Дифторгексагідроциклопентаоксазиніли і дифторгексагідробензооксазиніли як інгібітори бета-секретази 1
Формула / Реферат
1. Сполука формули І
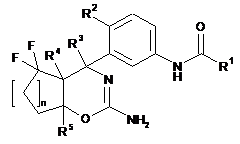 , I
, I
де
R1 вибраний з групи, що складається з
і) арилу,
іі) арилу, заміщеного 1-4 замісниками, незалежно вибраними з ціано, ціано-С1-6-алкілу, атома галогену, галоген-С1-6-алкокси, галоген-С1-6-алкілу, С1-6-алкокси, С1-6-алкоксі-С1-6-алкілу, С2-6-алкініл-С1-6-алкокси, С2-6-алкінілу і С1-6-алкілу,
ііі) гетероарилу, і
iv) гетероарилу, заміщеного 1-4 замісниками, незалежно вибраними з ціано, ціано-С1-6-алкілу, атома галогену, галоген-С1-6-алкокси, галоген-С1-6-алкілу, С1-6-алкокси, С1-6-алкоксі-С1-6-алкілу, С2-6-алкініл-С1-6-алкокси, С2-6-алкінілу і С1-6-алкілу;
R2 вибраний з групи, що складається з
і) атома водню,
іі) С1-6-алкілу, і
ііі) галогену;
R3 вибраний з групи, що складається з
і) С1-6-алкілу, і
іі) галоген-С1-6-алкілу;
R4 вибраний з групи, що складається з
і) атома водню, і
іі) С1-6-алкілу, і
R5 вибраний з групи, що складається з
і) атома водню, і
іі) С1-6-алкілу;
n дорівнює 1 або 2;
або її фармацевтично прийнятні солі.
2. Сполука формули І за п. 1, де R1 позначає гетероарил, заміщений 1-2 замісниками, незалежно вибраними з ціано, атома галогену, галоген-С1-6-алкілу і С2-6-алкініл-С1-6-алкокси.
3. Сполука формули І за будь-яким з пп. 1-2, де R1 вибраний з:
і) піридинілу, заміщеного 1-2 замісниками, незалежно вибраними з ціано і атома галогену,
іі) піразинілу, заміщеного 1-2 замісниками, незалежно вибраними з ціано, галоген-С1-6-алкілу і С2-6-алкініл-С1-6-алкокси, і
ііі) тіофенілу, заміщеного 1-2 атомами галогену.
4. Сполука формули І за будь-яким з пп. 1-3, де R1 позначає 5-бут-2-инілоксипіразин-2-іл, 5-ціанопіридин-2-іл, 5-хлорпіридин-2-іл, 5-фторметилпіразин-2-іл, 5-ціанопіразин-2-іл, 5-хлорпіридин-2-іл, 5-ціанопіридин-2-іл, 5-хлортіофен-2-іл або 5-(1,1-дифторетил)-піразин-2-іл.
5. Сполука формули І за будь-яким з пп. 1-4, де R2 позначає атом галогену.
6. Сполука формули І за будь-яким з пп. 1-5, де R2 позначає F.
7. Сполука формули І за будь-яким з пп. 1-6, де R3 позначає С1-6-алкіл.
8. Сполука формули І за будь-яким з пп. 1-7, де R3 позначає метил.
9. Сполука формули І за будь-яким з пп. 1-8, де R4 позначає атом водню.
10. Сполука формули І за будь-яким з пп. 1-9, де R5 позначає атом водню.
11. Сполука формули І за будь-яким з пп. 1-10, де n дорівнює 1.
12. Сполука формули І за будь-яким з пп. 1-10, де n дорівнює 2.
13. Сполука за будь-яким з пп. 1-12, вибрана з наступних:
5-бут-2-инілоксипіразин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aмiнo-5,5-дифтop-4-мeтил-4,4а,5,6,7,7а-гексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду,
5-фторметилпіразин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aмiнo-5,5-дифтop-4-мeтил-4,4а,5,6,7,7а-гексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду,
5-ціанопіридин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aміно-5,5-дифтop-4-метил-4,4a,5,6,7,7a-гексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду,
5-хлорпіридин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aмiнo-5,5-дифтop-4-мeтил-4,4a,5,6,7,7a-гексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду,
5-ціанопіразин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aмiнo-5,5-дифтop-4-мeтил-4,4a,5,6,7,7a-гексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду,
5-хлорпіридин-2-карбонової кислоти [3-((4S,4aR,8aR)-2-aмiнo-5,5-дифтop-4-мeтил-4a,5,6,7,8,8a-гексагідро-4Н-бензо[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду,
5-ціанопіридин-2-карбонової кислоти [3-((4S,4aR,8aR)-2-aмiнo-5,5-дифтop-4-мeтил-4a,5,6,7,8,8a-гексагідро-4Н-бензо[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду,
5-хлортіофен-2-карбонової кислоти [3-((4S,4aR,8aR)-2-aміно-5,5-дифтор-4-метил-4а,5,6,7,8,8а-гексагідро-4Н-бензо[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду і
5-(1,1-дифторетил)-піразин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aмiнo-5,5-дифтop-4-мeтил-4,4а,5,6,7,7а-гексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду
або їх фармацевтично прийнятних солей.
14. Спосіб одержання сполуки формули І за будь-яким з пп. 1-13, за яким в реакцію вводять сполуку формули I’ із сполукою формули XIV
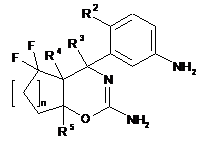 , I’
, I’ 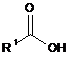 , XIV
, XIV
де n, R1, R2, R3, R4, R5 є такими, як визначено в будь-якому з пп. 1-12.
15. Сполука формули І за будь-яким з пп. 1-13, у будь-якому випадку одержана способом за п. 14.
16. Сполука формули І за будь-яким з пп. 1-13 для застосування як терапевтично активної речовини.
17. Сполука формули І за пп. 1-13 для застосування як терапевтично активної речовини для терапевтичного та/або профілактичного лікування захворювань і розладів, що характеризуються підвищеними рівнями b-амілоїду та/або олігомерів b-амілоїду, та/або b-амілоїдних бляшок та інших відкладень, зокрема хвороби Альцгеймера.
18. Фармацевтична композиція, що містить сполуку формули І за будь-яким з пп. 1-13 і фармацевтично прийнятний носій та/або фармацевтично прийнятну допоміжну речовину.
19. Застосування сполуки формули І за будь-яким з пп. 1-13 для одержання лікарського засобу для терапевтичного та/або профілактичного лікування захворювань і розладів, що характеризуються підвищеними рівнями b-амілоїду та/або олігомерів b-амілоїду, та/або b-амілоїдних бляшок та інших відкладень, зокрема хвороби Альцгеймера.
20. Спосіб застосування при інгібуванні активності бета-секретази 1 (ВАСЕ1), зокрема для терапевтичного та/або профілактичного лікування захворювань і розладів, що характеризуються підвищеними рівнями b-амілоїду та/або олігомерів b-амілоїду, та/або b-амілоїдних бляшок та інших відкладень, або хвороби Альцгеймера, за яким вводять сполуку формули І за будь-яким з пп. 1-13 людині або тварині.
Текст
Реферат: У даному винаході запропоновані дифторциклопентаоксазиніли і дифторбензооксазиніли формули І, що мають інгібіторну активність відносно бета-секретази 1 (ВАСЕ1 від англ. "betasecretase 1"), їх одержання, фармацевтичні композиції, що їх містять, та їх застосування як терапевтично активних речовин. Активні сполуки за даним винаходом корисні при терапевтичному та/або профілактичному лікуванні, наприклад, хвороби Альцгеймера. R F F R 4 R 2 O 3 N H N R 1 n R 5 O NH2 I UA 113309 C2 (12) UA 113309 C2 R F F R 4 R 2 O 3 N H N n R 5 O NH2 R 1 UA 113309 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ Хвороба Альцгеймера (AD; від англ. "Alzheimer's disease") є нейродегенеративним розладом центральної нервової системи і є провідною причиною прогресуючої деменції у немолодого населення. Її клінічними симптомами є наступні симптоми: погіршення пам'яті, пізнавальної здатності, тимчасової і просторової орієнтації, думки і мислення, а також важкі емоційні порушення. В даний час немає доступних способів лікування, які можуть попереджати це захворювання або його прогрес, або викликати стабільну реверсію його клінічних симптомів. AD стала значною проблемою охорони здоров'я у всіх суспільствах з високою середньою тривалістю життя, а також значним економічним вантажем для їх систем охорони здоров'я. AD характеризується двома наступними основними патологіями в центральній нервовій системі (ЦНС): виникненням амілоїдних бляшок і нейрофібрилярних клубків (Hardy et al. [1], Selkoe [2]). Обидві патології також зазвичай спостерігають у пацієнтів з синдромом Дауна (трисомією 21), у яких також розвиваються AD-подібні симптоми в ранньому віці. Нейрофібрилярні клубки є внутріклітинними агрегатами асоційованого з мікротрубочками білка tau (MAPT; від англ. "microtubule-associated protein tau"). Амілоїдні бляшки виникають в позаклітинному просторі, їх основними компонентами є Аβ-пептиди. Останні є групою протеолітичних фрагментів, утворених від білка-попередника β-амілоїду (APP; від англ. “βamyloid precursor protein") в результаті серії стадій протеолітичного розщеплювання. Ідентифіковано декілька форм APP, з яких найбільш поширеними є білки довжиною 695, 751 і 770 амінокислот. Всі вони мають походження від одного гена за допомогою диференціального сплайсингу. Аβ-пептиди утворені з одного і того ж домену APP, але відрізняються їх N- і Cкінцями, де основні види молекул мають довжину 40 і 42 амінокислоти. Існує декілька напрямків даних, які дозволяють з великою вірогідністю припустити, що агреговані Аβ-пептиди є істотними молекулами в патогенезі AD: 1) амілоїдні бляшки, утворені з Аβ-пептидів, складають незмінну частину патології AD; 2) Аβ-пептиди токсичні для нейронів; 3) при сімейній хворобі Альцгеймера (FAD; від англ. "Familial Alzheimer's Disease") мутації в генах цього захворювання APP, PSN1, PSN2 приводять до підвищених рівнів Аβ-пептидів і до раннього амілоїдозу головного мозку; 4) у трансгенних мишей, які експресують такі гени FAD, розвивається патологія, яка має багато схожості із захворюванням у людини. Аβ-пептиди продукуються з APP за допомогою послідовної дії двох протеолітичних ферментів, званих β- і γ-секретазою. β-Секретаза спочатку відщеплює приблизно 28 амінокислот в позаклітинному домені APP зовні від трансмембранного домену (ТМ; від англ. "transmembrane domain") з утворенням C-кінцевого фрагмента APP, що містить ТМ і цитоплазматичний домен (CTFβ). CTFβ є субстратом для γ-секретази, яка розщеплює в декількох сусідніх положеннях усередині ТМ з утворенням Aβ пептидів і фрагмента цитоплазми. γ-Секретаза є комплексом, що складається щонайменше з 4 різних білків, та її каталітичною субодиницею досить імовірно є білок пресенілін (PSEN1, PSEN2). βСекретаза (BACE1, Asp2; BACE позначає β-сайт APP-ферменту, що розщеплює) є аспартилпротеазою, закріпленою в мембрані за допомогою трансмембранного домену (Vassar et al. [3]). Вона експресується в багатьох тканинах організму людини, але її рівень особливо високий в ЦНС. Генетичне руйнування гена BACE1 у мишей чітко показало, що його активність істотна для процесингу APP, який приводить до утворення Аβ-пептидів, у відсутність BACE1 Аβпептиди не продукуються (Luo et al. [4], Roberds et al. [5]). Миші, у яких генно-інженерним шляхом одержана експресія гена APP людини, і у яких утворюються обширні амілоїдні бляшки і патології, подібні хворобі Альцгеймера, при старінні, цього не відбувається, коли активність βсекретази понижена в результаті генетичного руйнування одного з алелів BACE1 (McConlogue et al. [6]). Отже, припускають, що інгібітори активності BACE1 можуть бути корисними агентами для терапевтичного втручання в хворобу Альцгеймера (AD). У документі WO 2011071135 [7] розкриті оксазинові похідні, які підходять як інгібітори BACE1. Крім того, утворення або утворення і відкладення β-амілоїдних пептидів усередині, на поверхні або навколо нервової тканини (наприклад, головного мозку) інгібується даними сполуками, тобто відбувається інгібування продукування Аβ з APP або фрагмента APP. Об'єктами даного винаходу є нові сполуки формули I, їх одержання, лікарські засоби на основі сполуки відповідно до винаходу та їх одержання, а також застосування сполук формули I при контролі або попередженні захворювань, таких як хвороба Альцгеймера. Ці нові сполуки формули I мають покращені фармакологічні властивості, такі як низькі значення коефіцієнта ефлюкса (ER; від англ. "efflux ratio"). У даному винаході запропоновані нові сполуки формули I, що є дифторциклопентаоксазинілами, і дифтор-бензооксазинілами, що мають інгібіторні властивості відносно BACE1, їх одержання, фармацевтичні композиції, які їх містять, та їх застосування як терапевтично активних речовин. 1 UA 113309 C2 ОБЛАСТЬ ВИНАХОДУ У даному винаході запропоновані сполуки формули I 2 R 4 F F R O 3 R N H N 1 R n 5 R O NH2 I 5 10 15 20 25 30 35 40 45 50 в якій заступники і змінні є такими, як описано нижче і у формулі винаходу, або їх фармацевтично прийнятна сіль. Дані сполуки мають активність інгібування Asp2 (β-секретази, BACE1 або мемапсину-2) і, отже, їх можна застосовувати при терапевтичному та/або профілактичному лікуванні захворювань і розладів, що характеризуються підвищеними рівнями β-амілоїду та/або олігомерів β-амілоїду та/або β-амілоїдних бляшок і додаткових відкладень, зокрема, хвороби Альцгеймера. ВІДОМОСТІ, ПІДТВЕРДЖУЮЧІ МОЖЛИВІСТЬ ЗДІЙСНЕННЯ ВИНАХОДУ Об'єктом даного винаходу є сполука формули I та її фармацевтично прийнятні солі, одержання зазначених вище сполук, лікарські засоби, що їх містять, та їх одержання, а також застосування зазначених вище сполук при терапевтичному та/або профілактичному лікуванні захворювань і розладів, пов'язаних з інгібуванням активності BACE1, наприклад, хвороби Альцгеймера. Крім того, дані сполуки інгібують утворення або утворення і відкладення βамілоїдних бляшок усередині, на поверхні або навколо нервової тканини (наприклад, головного мозку) за допомогою інгібування продукування Аβ з APP або фрагмента APP. Наведені нижче визначення загальних термінів, використовуваних в даному описі, застосовують незалежно від того, чи зустрічаються обговорювані терміни окремо або у поєднанні з іншими групами. Термін " C1-6-алкіл", окремо або в комбінації з іншими групами, означає вуглеводневий радикал, який може бути нормальним або розгалуженим, з одиночним або множинним розгалуженням, де алкільна група, як правило, включає від 1 до 6 атомів вуглецю, наприклад, метил (Me), етил (Et), пропіл, ізопропіл (i-пропіл), н-бутил, i-бутил (ізобутил), 2-бутил (вторбутил), t-бутил (трет-бутил), ізопентил, 2-етил-пропіл, 1,2-диметил-пропіл і тому подібне. Конкретний "C1-6-алкіл" позначає групи, що мають від 1 до 5 атомів вуглецю. Конкретними групами є метил, етил і трет-бутил. Найбільш конкретна група є метилом. Термін "ціано-C1-6-алкіл", окремо або в комбінації з іншими групами, відноситься до C1-6алкілу, як визначено в даному описі, заміщеному одним або множинними ціано, зокрема, 1-5 ціано, конкретніше одним ціано. Прикладами є ціано-метил і тому подібне. Термін "галоген-C1-6-алкіл", окремо або в комбінації з іншими групами, відноситься до C1-6алкілу, як визначено в даному описі, заміщеному одним або множинними атомами галогену, зокрема, 1-5 атомами галогену, конкретніше 1-3 атомами галогену, найконкретніше одним атомом галогену або 3 атомами галогену. Конкретним атомом галогену є атом фтору. Прикладами є наступні групи: дифторметил, хлорметил, фторметил і тому подібне. Конкретна група є –CH2F. Термін "C1-6-алкокси-C1-6-алкіл", окремо або в комбінації з іншими групами, відноситься до C1-6-алкілу, заміщеному одним або множинними C1-6-алкокси, як визначено в даному описі. Прикладами є наступні групи: MeO-Me, 1MeO-Et, 2MeO-Et, 1MeO-2EtO-пропіл і тому подібне. Термін "ціано", окремо або в комбінації з іншими групами, відноситься до групи N≡C-(NC-). Термін "атом галогену", окремо або в комбінації з іншими групами, означає атом хлору (Cl), йоду (I), фтору (F) і брому (Br). Конкретний "атом галогену" є Cl і F. Термін "арил", окремо або в комбінації з іншими групами, відноситься до ароматичної карбоциклічної групи, що містить від 6 до 14, зокрема, від 6 до 10, атомів вуглецю, і що має щонайменше одне ароматичне кільце або множинні конденсовані кільця, з яких щонайменше одне кільце є ароматичним. Приклади "арилу" включають бензил, дифеніл, інданіл, нафтил, феніл (Ph) і тому подібне. Конкретна "арильна" група є фенілом. Термін "гетероарил", окремо або в комбінації з іншими групами, відноситься до ароматичної карбоциклічної групи, що має єдине 4-8-членне кільце або множинні конденсовані кільця, що 2 UA 113309 C2 5 10 15 20 25 30 35 40 45 50 55 60 містять від 6 до 14, зокрема, від 6 до 10 кільцевих атомів, і що містять 1, 2 або 3 гетероатоми, індивідуально вибрані з N, O і S, зокрема, N і O, де в даній групі щонайменше одне гетероциклічне кільце є ароматичним. Конкретні гетероарильні групи мають єдине 5- або єдине 6-членне кільце. Приклади "гетероарилу" включають бензофурил, бензоімідазоліл, 1Hбензоімідазоліл, бензооксазиніл, бензоксазоліл, бензотіазиніл, бензотіазоліл, бензотієніл, бензотриазоліл, фурил, імідазоліл, індазоліл, 1H-індазоліл, індоліл, ізохінолініл, ізотіазоліл, ізоксазоліл, оксазоліл, піразиніл, піразоліл (піразил), 1H-піразоліл, піразоло[1,5-a]піридиніл, піридазиніл, піридиніл, піримідиніл, піроліл, хінолініл, тетразоліл, тіазоліл, тієніл, триазоліл, 6,7дигідро-5H-[1]піридиніл і тому подібне. Конкретні "гетероарильні" групи є піридинілом, піразинілом і тіофенілом. Конкретними групами є піридин-2-іл, піразин-2-іл і тіофен-2-іл. Термін "C1-6-алкокси", окремо або в комбінації з іншими групами, означає -O-C1-6-алкільний радикал, який може бути нормальним або розгалуженим, з одним або множинним розгалуженням, де алкільна група, як правило, містить від 1 до 6 атомів вуглецю, наприклад, метокси (OMe, MeO), етокси (OEt), пропокси, ізопропокси (i-пропокси), н-бутокси, i-бутокси (ізобутокси), 2-бутокси (втор-бутокси), t-бутокси (трет-бутокси), ізопентилокси (i-пентилокси) і тому подібне. Конкретні групи “ C1-6-алкокси" мають від 1 до 4 атомів вуглецю. Конкретні групи є метокси і етокси. Термін "галоген-C1-6-алкокси", окремо або в комбінації з іншими групами, відноситься до C1-6алкокси, як визначено в даному описі, заміщеному одним або множинними атомами галогену, зокрема, атомом фтору. Конкретні "галоген-C1-6-алкокси" групи є фтор-C1-6-алкокси. Термін "C2-6-алкініл-C1-6-алкокси", окремо або в комбінації з іншими групами, відноситься до C1-6-алкокси, як визначено в даному описі, заміщеному одним або множинними C2-6-алкінілами, як визначено в даному описі. Конкретна група "C2-6-алкініл- C1-6-алкокси" є 5-бут-2-інілокси. Термін "C2-6-алкініл", окремо або в комбінації з іншими групами, означає одновалентну нормальну або розгалужену насичену вуглеводневу групу з атомів вуглецю в кількості від 2 до 6, зокрема, від 2 до 4 атомів вуглецю, що містить один, два або три потрійні зв'язки. Приклади “ C2-6-алкінілу" включають етиніл і пропініл. Термін "фармацевтично прийнятні солі" відноситься до солей, придатних для застосування у контакті з тканинами людей і тварин. Прикладами придатних солей з неорганічними і органічними кислотами є, але не обмежені ними, солі з наступними кислотами: оцтовою кислотою, лимонною кислотою, мурашиною кислотою, фумаровою кислотою, соляною кислотою, молочною кислотою, малеїновою кислотою, яблучною кислотою, метансульфоновою кислотою, азотною кислотою, фосфорною кислотою, пара-толуолсульфоновою кислотою, янтарною кислотою, сірчаною кислотою, сірчистою кислотою, винною кислотою, трифтороцтовою кислотою і тому подібне. Конкретні кислоти є мурашиною кислотою, трифтороцтовою кислотою і соляною кислотою. Терміни "фармацевтично прийнятний носій" і "фармацевтично прийнятна допоміжна речовина" відносяться до носіїв і допоміжних речовин, таких як розчинники або ексципієнти, сумісні з іншими інгредієнтами препарату. Термін "фармацевтична композиція" включає препарат, що містить зазначені інгредієнти в зумовлених кількостях або долях, а також будь-який препарат, який є результатом, прямо або побічно, об'єднання зазначених інгредієнтів у вказаних кількостях. Зокрема, цей термін включає препарат, що містить один або більше активних інгредієнтів, і необов'язковий носій, що включає інертні інгредієнти, а також будь-який препарат, який є результатом, прямо або побічно, об'єднання, комплексоутворення або агрегації будь-яких двох або більше інгредієнтів, або дисоціації одного або більше інгредієнтів, або інших типів реакцій або взаємодій одного або більше інгредієнтів. Термін "інгібітор" означає сполуку, конкуруючу за з'єднання, що зменшує або запобігає зв'язування конкретного ліганда з конкретним рецептором, або зменшуючи чи запобігаючи інгібування функції конкретного білка. Термін "половинна максимальна інгібіторна концентрація" (IC50) означає концентрацію конкретної сполуки, необхідну для одержання 50 % інгібувань біологічного процесу in vitro. Значення IC50 можна логарифмічно перетворити в значення pIC50 (-log IC50), в яких вищі значення вказують на експоненціально вищу ефективність. Значення IC50 не є абсолютною величиною, а залежить від експериментальних умов, наприклад, від використовуваних концентрацій. Значення IC50 можна перетворити в абсолютну константу інгібування (Ki), [8] використовуючи рівняння Ченга-Прусоффа . Термін "константа інгібування" (Ki) означає абсолютну спорідненість зв'язування конкретного інгібітора з рецептором. Її вимірюють, використовуючи аналізи конкурентного зв'язування, і вона рівна концентрації, при якій конкретний інгібітор займав би 50 % рецепторів у відсутності якого-небудь конкуруючого ліганда 3 UA 113309 C2 5 10 15 20 25 30 35 (наприклад, радіоліганда). Значення Ki можна логарифмічно перетворити в значення pKi (-log Ki), в яких вищі значення указують на експоненціально вищу ефективність. "Терапевтична ефективна кількість" означає кількість сполуки, яка при введенні суб'єктові для лікування хворобливого стану, є достатньою, щоб здійснити таке лікування хворобливого стану. "Терапевтично ефективна кількість" варіює залежно від сполуки, хворобливого стану, що підлягає лікуванню, тяжкості захворювання, що підлягає лікуванню, віку і відносного стану здоров'я суб'єкта, шляху і форми введення, думки лікаря-куратора, або ветеринара та від інших факторів. Термін "як визначено в даному описі" і "як розкрито в даному описі" при віднесенні до змінної включає за допомогою посилання, як широке визначення цієї змінної, так і конкретні, конкретніші і найбільш конкретніші визначення, якщо вони є. Терміни "обробка", "приведення в контакт" і "взаємодія" при віднесенні до хімічної реакції означають додавання або змішування двох або більше реагентів у відповідних умовах з одержанням зазначеного та/або бажаного продукту. Зрозуміло, що реакція, яка дає зазначений та/або бажаний продукт, може необов'язково бути прямим результатом об'єднання двох реагентів, які були спочатку додані, тобто може існувати одна або більше проміжних сполук, які утворюються в суміші, що нарешті приводить до утворення зазначеного та/або бажаного продукту. Гематоенцефалічний бар'єр є перешкодою для надходження терапевтичних речовин в головний мозок. P-глікопротеїн (P-gp) є ефлюксним переносником в багатьох тканинах, включаючи кишечник, головний мозок і нирки. Оскільки P-глікопротеїн може активно переносити терапевтичні речовини з клітини, його розглядають як відповідальний за перенесення певних терапевтичних речовин в головний мозок. Коефіцієнт ефлюкса (ER) є високо чутливим параметром, який можна використовувати для ступеня інгібування P-gp. Термін "ароматичний" означає традиційну ідею ароматичності, визначену в літературі, зокрема, в номенклатурі ІЮПАК [9]. Термін "фармацевтично прийнятний ексципієнт" означає будь-який інгредієнт, що не має терапевтичну активність, і що є нетоксичним, таким як розпушувачі, зв'язуючі речовини, наповнювачі, розчинники, буфери, тонічні агенти, стабілізатори, антиоксиданти, поверхневоактивні речовини або змащувальні речовини, використовувані при одержанні фармацевтичних препаратів. У будь-якому випадку, коли в хімічній структурі присутній хіральний атом вуглецю, мають на увазі, що всі стереоізомери, пов'язані з цим хіральним атомом вуглецю, включені в дану структуру. У винаході також запропоновані фармацевтичні композиції, способи застосування і способи одержання згаданих вище сполук. Всі окремі втілення винаходу можна об'єднувати. Одним втіленням винаходу є сполука формули I 2 R 4 F F R O 3 R N H N 1 R n 5 40 45 50 R O NH2 I де 1 R вибраний з групи, що складається з i) арилу, ii) арилу, заміщеного 1-4 заступниками, незалежно вибраними з ціано, ціано-C1-6-алкілу, атома галогену, галоген-C1-6-алкокси, галоген-C1-6-алкілу, C1-6-алкокси, C1-6-алкокси-C1-6-алкілу, C2-6-алкініл- C1-6-алкокси, C2-6-алкінілу і C1-6-алкілу, iii) гетероарилу, і iv) гетероарилу, заміщеного 1-4 заступниками, незалежно вибраними з ціано, ціано-C1-6алкілу, атома галогену, галоген-C1-6-алкокси, галоген-C1-6-алкілу, C1-6-алкокси, C1-6-алкокси-C1-6алкілу, C2-6-алкініл-C1-6-алкокси, C2-6-алкінілу і C1-6-алкілу; 2 R вибраний з групи, що складається з i) атома водню, 4 UA 113309 C2 5 10 ii) C1-6-алкілу, і iii) атома галогену; 3 R вибраний з групи, що складається з i) C1-6-алкілу, і ii) галоген-C1-6-алкілу; 4 R вибраний з групи, що складається з i) атома водню, і ii) C1-6-алкілу, і 5 R вибраний з групи, що складається з i) атома водню, і ii) C1-6-алкілу; n дорівнює 1 або 2; або її фармацевтично прийнятні солі. У певному втіленні винаходу запропоновано сполуку формули I, що є формулою Ia. 15 F F H F CH3 O N H N 1 R n H O NH2 Ia, 1 20 25 30 35 40 45 50 де n і R є такими, як розкрито в даному описі. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає гетероарил, заміщений 1-2 заступниками, незалежно вибраними з ціано, атома галогену, галоген-C1-6-алкілу і C2-6-алкініл-C1-6-алкокси. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R вибраний з i) піридинілу, заміщеного 1-2 заступниками, незалежно вибраними з ціано і атома галогену, ii) піразинілу, заміщеного 1-2 заступниками, незалежно вибраними з ціано, галоген-C1-6алкілу і C2-6-алкініл- C1-6-алкокси, і iii) тіофенілу, заміщеного 1-2 атомами галогену. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає піридиніл, заміщений 1-2 заступниками, незалежно вибраними з ціано і атома галогену. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає піразиніл, заміщений 1-2 заступниками, незалежно вибраними з ціано, галогенC1-6-алкілу і C2-6-алкініл-C1-6-алкокси. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає тіофеніл, заміщений 1-2 атомами галогену. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає 5-бут-2-інілокси-піразин-2-іл, 5-ціано-піридин-2-іл, 5-хлор-піридин-2-іл, 5фторметил-піразин-2-іл, 5-ціано-піразин-2-іл, 5-хлор-піридин-2-іл, 5-ціано-піридин-2-іл, 5-хлортіофен-2-іл або 5-(1,1-дифтор-етил)-піразин-2-іл. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає 5-бут-2-інілокси-піразин-2-іл. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає 5-ціано-піридин-2-іл. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає 5-хлор-піридин-2-іл. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає 5-фторметил-піразин-2-іл. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає 5-ціано-піразин-2-іл. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає 5-хлор-піридин-2-іл. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 5 UA 113309 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 де R позначає 5-ціано-піридин-2-іл. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає 5-хлор-тіофен-2-іл. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 1 де R позначає 5-(1,1-дифтор-етил)-піразин-2-іл. У певному втіленні винаходу запропоновано сполуки формули I, як розкрито в даному описі, 2 де R позначає атом галогену. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 2 де R позначає F. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 3 де R позначає C1-6-алкіл. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 3 де R позначає метил. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 4 де R позначає атом водню. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, 5 де R позначає атом водню. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, де n дорівнює 1. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, де n дорівнює 2. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, вибрану з групи, що складається з наступних сполук: 5-Бут-2-інілокси-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-аміду, 5-Фторметил-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4-метил4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-аміду, 5-Ціано-піридин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-аміду, 5-Хлор-піридин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-аміду, 5-Ціано-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл-аміду, 5-Хлор-піридин-2-карбонової кислоти [3-((-((4S, 4aR, 8aR)-2-аміно-5,5-дифтор-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-4-іл)-4-фтор-феніл]-аміду, 5-Ціано-піридин-2-карбонової кислоти [3-((-((4S, 4aR, 8aR)-2-аміно-5,5-дифтор-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-4-іл)-4-фтор-феніл]-аміду, 5-Хлор-тіофен-2-карбонової кислоти [3-((-((-((4S, 4aR, 8aR))-2-аміно-5,5-дифтор-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-4-іл)-4-фтор-феніл]-аміду, і 5-(1,1-Дифтор-етил)-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-аміду або їх фармацевтично прийнятних солей. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, що позначає 5-бут-2-інілокси-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, що позначає 5-фторметил-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, що позначає 5-ціано-піридин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, що позначає 5-хлор-піридин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, що позначає 5-ціано-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл-амід. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, що позначає 5-хлор-піридин-2-карбонової кислоти [3-((4S, 4aR, 8aR)-2-аміно-5,5-дифтор-4метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід. 6 UA 113309 C2 5 10 У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, що позначає 5-ціано-піридин-2-карбонової кислоти [3-((4S, 4aR, 8aR)-2-аміно-5,5-дифтор-4метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, що позначає 5-хлор-тіофен-2-карбонової кислоти [3-((4S, 4aR, 8aR)-2-аміно-5,5-дифтор-4метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, що позначає 5-(1,1-дифтор-етил)піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід. У певному втіленні винаходу запропонований спосіб синтезу сполуки формули I, як розкрито в даному описі, що включає взаємодію сполуки формули I" із сполукою формули XIV. 2 R 3 F F R4 R NH2 N O n 5 R O 1 R NH2 XIV I' 15 20 25 30 35 40 45 50 1 2 3 4 OH 5 , де n, R , R , R , R , R є такими, як розкрито в даному описі. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, у будь-якому випадку одержану способом, як визначено вище. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, вживану як терапевтично активна речовина. У певному втіленні винаходу запропоновано сполуку формули I. як розкрито в даному описі, вживану як інгібітор активності BACE1. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, вживану як терапевтично активна речовина для терапевтичного та/або профілактичного лікування захворювань і розладів, що характеризуються підвищеними рівнями β-амілоїду та/або олігомерів β-амілоїду та/або β-амілоїдних бляшок та інших відкладень, зокрема, хвороби Альцгеймера. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, вживану як терапевтично активна речовина для терапевтичного та/або профілактичного лікування хвороби Альцгеймера. У певному втіленні винаходу запропонована фармацевтична композиція, що містить сполуку формули I, як розкрито в даному описі, і фармацевтично прийнятний носій та/або фармацевтично прийнятна допоміжна речовина. У певному втіленні винаходу запропоновано застосування сполуки формули I, як розкрито в даному описі, для одержання лікарського засобу, вживаного при інгібуванні активності BACE1. У певному втіленні винаходу запропоновано застосування сполуки формули I, як розкрито в даному описі, для одержання лікарського засобу для терапевтичного та/або профілактичного лікування захворювань і розладів, що характеризуються підвищеними рівнями β-амілоїду та/або олігомерів β-амілоїду та/або β-амілоїдних бляшок та інших відкладень, зокрема, хвороби Альцгеймера. У певному втіленні винаходу запропоновано застосування сполуки формули I, як розкрито в даному описі, для одержання лікарського засобу для терапевтичного та/або профілактичного лікування хвороби Альцгеймера. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, вживану при інгібуванні активності BACE1. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, вживану при терапевтичному та/або профілактичному лікуванні захворювань і розладів, що характеризуються підвищеними рівнями β-амілоїду та/або олігомерів β-амілоїду та/або βамілоїдних бляшок та інших відкладень, зокрема, хвороби Альцгеймера. У певному втіленні винаходу запропоновано сполуку формули I, як розкрито в даному описі, вживану при терапевтичному та/або профілактичному лікуванні хвороби Альцгеймера. 7 UA 113309 C2 5 У певному втіленні винаходу запропонований спосіб застосування при інгібуванні активності BACE1, зокрема, для терапевтичного та/або профілактичного лікування захворювань і розладів, що характеризуються підвищеними рівнями β-амілоїду та/або олігомерів β-амілоїду та/або βамілоїдних бляшок та інших відкладень, або хвороби Альцгеймера, де даний спосіб включає введення сполуки формули I, як розкрито в даному описі, людині або тварині. Крім того, винахід включає всі оптичні ізомери, тобто діастереоізомери, діастереомерні суміші, рацемічні суміші, всі їх відповідні енантіомери та/або таутомери, а також їх сольвати. Фахівцям в даній області техніки зрозуміло, що сполука формули I може існувати в таутомерних формах, наприклад, в наступній таутомерній формі: 10 2 R 4 F F R O 3 R NH 1 R N H n O 5 R 15 20 25 30 NH Id Всі таутомерні форми включені в даний винахід. Сполуки формули I можуть містити один або більше асиметричних центрів, і, отже, можуть зустрічатися у вигляді рацематів, рацемічних сумішей, окремих енантіомерів, діастереомерних сумішей та індивідуальних діастереомерів. Додаткові асиметричні центри можуть бути присутніми залежно від природи різних заступників на молекулі. Кожен такий асиметричний центр незалежно утворює два оптичні ізомери, і мають на увазі, що всі можливі оптичні ізомери і діастереомери у вигляді сумішей і у вигляді чистих або частково очищених сполук включені в даний винахід. Мають на увазі, що даний винахід включає всі такі ізомерні форми цих сполук. Незалежні синтези цих діастереомерів або їх хроматографічні розділення можуть бути досягнуті, як відомо в даній області техніки, шляхом відповідної модифікації методології, розкритої в даному винаході. Їх абсолютна стереохімія може бути визначена за допомогою рентгенокристалографії кристалічних продуктів або кристалічних проміжних сполук, які є дериватизованими при необхідності реагентом, що містить асиметричний центр, що має відому абсолютну конфігурацію. За бажання рацемічні суміші сполук можуть бути розділені так, щоб виділити індивідуальні енантіомери. Це розділення можна здійснити способами, добре відомими в даній області техніки, такими як поєднання рацемічної суміші сполук з енантіомерно чистою сполукою з утворенням діастереомерної суміші з подальшим розділенням індивідуальних діастереомерів стандартними способами, такими як фракційна кристалізація або хроматографія. Певними прикладами ізомерів сполуки формули I є наступні сполуки: сполука формули Ib або сполука формули Ic, де залишки мають значення, як розкрито в будь-якому з втілень винаходу, зокрема, сполука формули Ic. 2 R 3 F 2 R O F R4 R N H N 4 1 R F 5 35 40 O N H N n R F R O 3 R 1 R n NH2 5 R Ib O NH2 Ic У втіленнях винаходу, в яких запропоновані оптично чисті енантіомери, оптично чистий енантіомер означає, що сполука містить більше 90 % бажаного ізомеру за масою, зокрема, більше 95 % бажаного ізомеру за масою, або конкретніший більше 99 % бажаного ізомеру за масою, причому, даний відсоток за масою заснований на сумарній масі ізомеру (ізомерів) сполуки. Хірально чисті або хірально збагачені сполуки можуть бути одержані шляхом стереоселективного синтезу або шляхом розділення енантіомерів. Розділення енантіомерів 8 UA 113309 C2 5 10 15 20 25 30 35 40 45 може бути виконане на кінцевому продукті або альтернативно на відповідній проміжній сполуці. Сполуки формули I можуть бути одержані відповідно до наведених нижче схем. Початкова речовина є у продажу або може бути одержана відповідно до відомих способів. Будь-які визначені вище залишки і змінні продовжують мати визначене вище значення, якщо не вказане інше. Сполуки загальної формули IV одержують шляхом взаємодії нітро-сполуки формули II з α,β ненасиченими кетонами загальної формули III у присутності активуючого реагенту, такого як, наприклад, ізоціанат, зокрема, фенілізоціанат, і каталітичної кількості основи, зокрема, алкіламіну, конкретніше триетиламіну, в розчиннику, такому як бензол або толуол, зокрема, бензол, або алкіловий ефір, зокрема, діетиловий ефір, з одержанням дигідроізоксазолу загальної формули IV. Фторування дигідрооксазолів загальної формули IV з одержанням дифтор-дигідрооксазолів загальної формули VI проводять у присутності фторуючого агента, зокрема, трифториду морфоліносери (V), в інертному розчиннику, зокрема, в дихлорметані. Ізоксазолідини загальної формули VIII одержують шляхом взаємодії арилгалогеніду, зокрема, арилброміду, такого як, наприклад, арилбромід VII, з алкіллітієвим реагентом, зокрема, з н-бутиллітієм, з одержанням ариллітієвої сполуки, яку можна піддавати взаємодії з дигідрооксазолами загальної формули VI у присутності кислоти Льюіса, зокрема, ефірату трифториду бору, в суміші розчинників, що складається з ефіру, зокрема, тетрагідрофурану, і толуолу, при температурі від -100 °C до -20 °C, зокрема, при -78 °C. Розділення рацемічних ізоксазолідинів загальної формули VIII з одержанням хіральних ізоксазолідинів загальної формули IXa і IXb може бути досягнуто за допомогою високоефективної рідинної хроматографії (ВЕРХ) на хіральній фазі, такої як, наприклад, в колонці Chiralpak AD, використовуючи суміш н-гептану і етанолу як елюент. Гідрогеноліз хіральних ізоксазолідинів загальної формули IX до аміноспиртів загальної формули X може бути краще всього виконаний шляхом трансферного гідрогенолізу, використовуючи паладій як каталізатор, зокрема, паладій на вуглеці, і джерело водню, наприклад, сіль мурашиної кислоти, зокрема, форміат амонію, в протонному розчиннику, такому як спирт, зокрема, етанол. Оксазини загальної формули XI можуть бути одержані шляхом взаємодії аміноспиртів загальної формули X з ціаногенбромідом в розчиннику, такому як спирт, зокрема, етанол, при підвищеній температурі. Альтернативно цю реакцію можна проводити в дві послідовні стадії, використовуючи ціаногенбромід і буфер, такий як, наприклад, ацетат натрію, у присутності розчинника, такого як, наприклад, ацетонітрил, з подальшим замиканням циклу проміжної сполуки у присутності мінеральної кислоти, зокрема, соляної кислоти, в розчиннику, такому як ефір, зокрема, 1,4-діоксан. При нітруванні оксазинів загальної формули XI з одержанням нітро-оксазинів загальної формули XII слідують стандартному методу, що включає чисту сірчану кислоту і димлячу азотну кислоту без використання розчинника. Відновлення нітрогрупи в проміжних сполуках загальної формули XII може бути виконано шляхом гідрогенізації з використанням каталізатора, такого як паладій на вуглеці, в протонних розчинниках, таких як спирти, зокрема, етанол або метанол, з одержанням анілінів загальної формули XIII. Селективне амідне поєднання анілінів загальної формули XIII і карбонових кислот загальної формули XIV з одержанням амідів загальної формули Ia" може бути виконано з гідратом 4-(4,6диметокси[1.3.5]триазин-2-іл)-4-метилморфолінію хлориду (DMTMM) в розчиннику, такому як спирт, зокрема, метанол. 9 UA 113309 C2 рац III II рац V VII IV VI VIII хіральна хіральна XIa хіральна рац Xa хіральна IXa хіральна хіральна XIV XIIa XIIIa Схема 1: Синтез сполук формули Ia' 5 10 15 20 25 30 Ia' Відповідні фармацевтично прийнятні солі з кислотами можуть бути одержані стандартними способами, відомими фахівцям в даній області техніки, наприклад, шляхом розчинення сполуки формули I у відповідному розчиннику, такому як, наприклад, діоксан або ТГФ, і додавання відповідної кількості відповідної кислоти. Продукти можуть бути зазвичай виділені шляхом фільтрування або шляхом хроматографії. Перетворення сполуки формули I у фармацевтично прийнятну сіль з основою може бути виконано шляхом обробки такої сполуки такою основою. Одним з можливих способів утворення такої солі є, наприклад, додавання 1/n еквівалентів основної солі, такий як, наприклад, M(OH) n, в якій M = катіон металу або амонію і n = число аніонів гідроксиду, до розчину сполуки у відповідному розчиннику (наприклад, в етанолі, в суміші етанол-вода, в суміші тетрагідрофуран-вода) і видалення розчинника шляхом випаровування або ліофілізації. В тому випадку, якщо їх одержання не описане в прикладах, сполуки формули I, а також всі проміжні продукти можуть бути одержані аналогічними способами або способами, розкритими в даному описі. Початкові речовини є у продажу, відомі в даній області техніки або можуть бути одержані способами, відомими в даній області техніки, або за аналогією з ними. Зрозуміло, що сполуки, які мають загальну формулу I, за даним винаходом можуть бути дериватизовані за функціональними групами з одержанням похідних, здібних до зворотного перетворення в початкову сполуку in vivo. Фармакологічні тести Сполуки формули I та їх фармацевтично прийнятні солі мають цінні фармакологічні властивості. Виявлено, що сполуки за даним винаходом пов'язані з інгібуванням активності BACE1. Ці сполуки були досліджені відповідно до тесту, приведеного нижче. Клітинний аналіз зниження Аβ: Клітини HEK293 людини, стабільно трансфіковані вектором, експресуючим кДНК гена APP wt (дикого типу) (APP695), використовували для оцінки ефективності сполук в клітинному аналізі. Клітини висівали в 96-лункові мікротитраційні планшети в середовищі для клітинних культур (Iscove, з додаванням 10 % (об/об) фетальної бичачої сироватки (ФБС), глутаміну, пеніциліну/стрептоміцину) приблизно до 80 % конфлюентності, і сполуки додавали в 10x концентрації в 1/10 об'єму середовища без ФБС, що містить 8 % диметилсульфоксиду (ДМСО) 10 UA 113309 C2 5 10 15 (кінцеву концентрацію ДМСО підтримували при 0,8 % об/об). Після 18-20 г інкубації при 37 °C і 5 % CO2 в зволоженому термостаті супернатант культури збирали для визначення концентрацій Aβ40. 96-лункові планшети для твердофазного імуноферментного аналізу (ELISA; від англ. "enzyme linked immunosorbent analysis") (наприклад, Nunc Maxisorb) покривали моноклональним антитілом, що специфічно розпізнає C-кінець Aβ40 [10]. Після блокування сайтів неспецифічного зв'язування, наприклад, 1 % бичачим сироватковим Альбуміном (БСА), і відмивання супернатанти культури додавали у відповідних розведеннях разом з ідентифікуючим антитілом Аβ, зшитим з пероксидазою хріну (наприклад, антитілом 4G8, Senetek, Maryand Heights, MO), та інкубували протягом 5-7 г. Потім лунки мікротитраційного планшета інтенсивно промивали фізіологічним розчином, забуференим Трисом, що містить 0,05 % Твін 20, і аналіз проявляли тетраметилбензидином/H2O2 в лимонно-кислотному буфері. Після зупинки реакції одним об'ємом 1 н. H2SO4 реакцію вимірювали в зчитуючому пристрої для планшетів ELISA при довжині хвилі 450 нм. Концентрації Аβ в супернатантах культури обчислювали на основі стандартної кривої, одержаної з відомими кількостями чистого пептиду Аβ. Таблиця 1 Значення IC50 вибраних прикладів Приклад Клітинна активність BACE1 Aβ40 IC50 [мкМ] Структура H O H2N N 1 O H N N O 0,0004 H F F H N O H2N N H N 2 H N 3 H F 0,0015 F H O H2N N F N O Cl F N F N O H F F 11 0,0019 UA 113309 C2 Таблиця 1 Значення IC50 вибраних прикладів Приклад Клітинна активність BACE1 Aβ40 IC50 [мкМ] Структура F F H N O H2N H N 4 N F N H F O F F H N O H2N H N 5 N F N H F O N O H2N H N N H N 7 O 0,0049 H F F F H2N N N 0,0055 H N O H N 8 H F F H2N N F N O Cl 0,0051 F H N 6 0,0089 O H N 0,0022 H O F 12 F F UA 113309 C2 Таблиця 1 Значення IC50 вибраних прикладів Приклад Клітинна активність BACE1 Aβ40 IC50 [мкМ] Структура H2N 9 H N Cl S 10 15 20 25 30 35 H N 0,350 H O 5 O F F F Аналіз P-gp (P-глікопротеїну) Лінії клітин, використовувані для експериментів по транспорту: Лінія клітин LLC-PK1 (ATCC #CL-101) є лінією епітеліальних клітин нирки свині. Лінії клітин, трансфіковані геном білка множинної лікарської резистентності 1 (MDR1; від англ. "multidrug resistance protein 1") людини, були одержані від Dr. A. Schinkel, Інститут раку Нідерландів (Амстердам, Нідерланди). Всі лінії клітин культивували на культуральній вставці з 2 напівпроникною мембраною (96-лункові планшети Miillipore, площа 0,11 см , розмір пор 0,4 мкм) при щільності 0,73*106 клітин/мл. Вимірювання транспорту проводили на добу 4 після посіву. Щільність клітинного моношару контролювали на основі проникності для позаклітинного маркера Lucifer yellow (10 мкМ). Експерименти, що показують проникність Lucifer yellow вище 25 нм/с, відхиляли. Експерименти по транспорту in vitro (Двонаправлений трансцелюлярний транспорт з використанням клітин LLC-PK1 і L-MDR1 LLC-PK1, екзогенно експресуючих MDR1 людини) Експерименти проводили на автоматизованій системі транспорту рідин фірми TECAN. Стисло, середовище витягували зі всіх компартментів, і середовище приймальної сторони замінювали культуральним середовищем. Вимірювання трансцелюлярного транспорту ініціювали додаванням субстрату разом з позаклітинним маркером Lucifer yellow на донорній стороні. Інгібітори додавали з обох боків (1 мкМ elacridar). Експерименти по транспорту проводили як в базолатеральному-апікальному, так і в апікальному-базолатеральному напрямку, по 3 лунки на кожне. Планшети інкубували при 37 °C і 5 % CO2 в термостаті Liconic. Зразки відбирали з донорного і з протилежного (акцепторного) боку після 2 годин інкубації. Концентрації субстрату в обох компартментах визначали за допомогою сцинтиляційного рахунку (дигоксин) або за допомогою рідинної хроматографії з тандемної мас-спектрометрії (РХ-МС/МС). Позаклітинний маркер (Lucifer yellow) кількісно визначали, використовуючи зчитуючий пристрій Spectrafluor plus при 430/535 нм (Ex/Em). У кожному експерименті використовували 3 різних вставки для кожної умови і обчислювали середнє значення. Аналіз даних Двонаправлений трансцелюлярний транспорт з використанням клітин LLC-PK1 і L-MDR1 Для оцінки даних по трансцелюлярному транспорту використовували наступне рівняння : 1 dQ Papp * A * C0 dt де Papp, A, C0 і dQ/dt є уявною проникністю, площею поверхні фільтру, початковою концентрацією і кількістю, що транспортується за період часу, відповідно. Значення P app обчислювали на основі єдиної тимчасової точки (2 г). Значення відношення транспорту до ефлюксу (ER) обчислювали таким чином: PappBA ER Papp AB де PAPPBA є значенням проникності в базолатеральному-апікальному напрямку, і PAPPAB є значенням проникності в апікальному-базолатеральному напрямку. Papp не коректували на 13 UA 113309 C2 5 10 15 20 25 30 35 40 45 50 55 60 струм позаклітинного матриксу Lucifer yellow, використовуваного для оцінки якості моношарів клітин. Аналіз інгібування CYP Інгібування цитохромів P450 (CYP) 2C9, 2D6 і 3A4 оцінювали, використовуючи мікросоми печінки людини і реакції метаболізму CYP-селективного субстрату. Складали суміші для інкубації об'ємом 50 мкл, що містять (кінцеві концентрації) 0,2 мг/мл об'єднаних мікросом печінки людини, 5 мкм субстрату (диклофенак для CYP2C9 [4'гідролази], декстрометорфан для CYP2D6 [O-деметилази] або мідазолам для CYP3A4 [1'гідролази]), 0,25 мкл диметилсульфоксиду (ДМСО), що містить тестований інгібітор і регенеруючу систему нікотинаміддифосфату-H (НАДФ-H). Концентрації тестованого інгібітору 50, 16,7, 5,6, 1,9, 0,6 і 0,2 мкМ оцінювали одноразово. Суміші для інкубації підігрівали до 37 °C протягом 10 хвилин, після чого ініціювали додаванням регенеруючої системи НАДФ-H. Інкубаційні суміші гасили через 5 хвилин (20 хвилин для декстрометорфану) додаванням 50 мкл холодного ацетонітрилу, 13 що містить 20 нг/мл 4-OH-диклофенак- C6, 20 нг/мл дектрорфану-D3 і 20 нг/мл 1-OHмідазоламу-D4. Погашені проінкубовані суміші зберігали при -20 °C потягом щонайменше 1 години перед центрифугуванням (20000xg, 20 хвилин). Супернатанти відбирали і розводили 1:1 водою, після чого аналізували, використовуючи систему для введення зразка RapidFire і масспектрометр API4000. Площі піку для субстрату, метаболіту і стабільно міченого стандарту метаболіту визначали, використовуючи тандемну мас-спектрометрію (МС/МС). Відносини площі піку між метаболітом, утвореним в результаті ферментативної реакції, і внутрішнім стандартом використовували в подальших обчисленнях. Відсоток (ДМСО) контрольної активності обчислювали для кожної проінкубованої суміші, і значення IC50 оцінювали за допомогою нелінійної регресії. Сульфафеназол, хінідин або кетоконазол тестували в кожному експерименті по інгібуванню CYP2C9, CYP2D6 або CYP3A4, відповідно, для гарантії чутливості і відтворюваності аналізу. (Validated assays for human cytochrome P450 activities [11]) Аналіз інгібування гена альфа-субодиниці калієвого каналу людини (hERG) PatchXpress Докладний спосіб кількісної оцінки інгібування каналу hERG за допомогою автоматизованої ® системи петч-кламп (фіксації потенціалу) PatchXpress 7000A (Molecular Devices, Sunnyvale, CA) описаний авторами Guo et al. [12] Стисло, клітини яєчника китайського хом'яка (CHO; від англ. "Chinese hamster ovary"), трансфіковані геном альфа-субодиниці калієвого каналу людини (hERG; від англ. "human ether-a-go-go-related gene") культивували в середовищі Ex-cell 302 з додаванням 10 % фетальної бичачої сироватки, 2 мМ глутаміну і 0,25 мг/мл генетицину і підтримували в CO2 інкубаторі при 37 °C. Для електрофізіології петч-кламп зовнішній буфер містив наступні компоненти (у мМ): 150 NaCl, 10 N-2-гідроксиетилпіперазин-N-2етансульфонової кислоти (ГЕПЕС), 4 KCl, 1,2 CaCl2, 1 MgCl2, pH 7,4, доведений HCl, і внутрішній реєструючий розчин містив наступні компоненти (у мМ): 140 KCl, 6 етиленглікольтетраоцтової кислоти (ЕГТА), 5 ГЕПЕС, MgCl2, 5 аденозинтрифосфату (АТФ)-Na2, pH 7,2, доведений KOH. Як тільки клітину вносили до реєстраційної камери і утворювали гіга-Ом ізоляцію з плоскими TM скляними електродами (Sealchip ), цілісно-клітинна конфігурація досягалася шляхом порушення клітинної мембрани. Потім мембранний потенціал фіксували при -80 мВ, і канал hERG активували 1-секундним деполяризуючим імпульсом, що подається при частоті 0,1 Гц, струм hERG вимірювали протягом фази реполяризації 500 мілісекунд (мс) до -40 мВ. Після одержання прийнятної реєстрації струму hERG клітини спочатку піддавали дії 0,3 % ДМСО як контроль носія, а потім тестованої сполуки в трьох ступінчасто зростаючих концентраціях з повністю логарифмічним інтервалом і, нарешті, E-4031 в концентрації 1 мкМ (як позитивний контроль) для повного блокування струму hERG. Кожну тестовану сполуку було протестовано на трьох або більше клітинах при концентраціях, що складають аж до 30 мкМ, або при граничній TM розчинності, визначеній за допомогою сканера розчинності BD Gentest . Інгібування струму hERG при кожній концентрації нормалізували за інгібуванням, зареєстрованим в контролі носія, і приводили у відповідність з рівнянням Хілла для обчислення IC20 та/або IC50. Кінетичні аналізи флуоресцентних субстратів катепсину D і катепсину E Загальний принцип аналізу Флуоресцентні аналізи MR121, описані нижче, засновані на тому факті, що MR121 утворює комплекс з триптофаном в не флуоресцентному основному стані. У розчині утворення цього комплексу відбувається при мілімолярних концентраціях триптофану. Цей механізм можна використовувати для розробки загального біохімічного аналізу протеаз. Пептидний субстрат мітять по N-кінцю триптофаном і по C-кінцю флуорофором MR121 (для катепсину D використовували 10-амінокислотний пептид WTSVLMAAPC-MR121; для катепсину E використовували MR121-CKLVFFAEDW). У відсутність протеазної активності субстрати залишаються інтактними, і флуоресценція MR121 знижується високою локальною 14 UA 113309 C2 5 10 15 20 25 концентрацією Trp. Якщо субстрати розщеплюються ферментами, флуоресценція MR121 відновлюється. Метод аналізу Кінетичні аналізи флуоресцентних субстратів катепсину D і катепсину E проводили при кімнатній температурі в 384-лункових мікротитраційних планшетах (чорних планшетах з прозорим плоским дном і з незв'язуючою поверхнею від фірми Corning) в кінцевому об'ємі 51 мкл. Тестовані сполуки серійно розводили в ДМСО (15 концентрацій, стадії розведення 1/3), і 1 мкл розведених сполук змішували протягом 10 хв з 40 мкл катепсину D (з печінки людини, Calbiochem), розведеного в аналітичному буфері (100 мМ ацетат натрію, 0,05 % БСА, pH 5,5; кінцева концентрація: 200 нМ) або з 40 мкл рекомбінантного катепсину E людини (R&D Systems), розведеного в аналітичному буфері (100 мМ ацетат натрію, 0,05 % БСА, pH 4,5; кінцева концентрація: 0,01 нМ). Після додавання 10 мкл субстрату катепсину D WTSVLMAAPCMR121, розведеного в аналітичному буфері катепсину D (кінцева концентрація: 300 нМ) або 1 з 10 субстрату катепсину E MR121-CKLVFFAEDW, розведеного в аналітичному буфері катепсину E (кінцева концентрація: 300 нМ), планшети сильно струшували протягом 2 хвилин. Ферментативну реакцію спостерігали в планшеті: зчитуючий пристрій видимого світла (Perkin Elmer) (довжина хвилі збудження: 630 нм; довжина хвилі випускання: 695 нм) протягом щонайменше 30 хвилин при кінетичному вимірюванні виявляє підвищення флуоресценції MR121 протягом періоду реакції. Обчислювали нахил лінійного діапазону кінетики, та IC50 тестованих сполук визначали, використовуючи чотирьохпараметричне рівняння для приведення у відповідність з кривою. Виявлення кон'югатів глутатіону Умови аналізу для виявлення кон'югатів глутатіону слідували методу, описаному авторами C.M.Dieckhaus et al. [13] Результати Таблиця 2 Біологічні дані вибраних прикладів P-gp Приклад людина 1) 1 2 4 8 9 B B 5) GSH 3) 2) hERG людина NF NF A A A Ефект in 4) vivo A A A CYP IC50 [мкМ] Катепсин E Катепсин D IC50 [мкМ] IC50 [мкМ] 3A4 2D6 2C9 97 90 >200 >200 >200 135 >200 183 >200 105 A A A A B A A B A A A B 1) Коефіцієнт ефлюкса: категорія субстрату: A = субстрату немає або слабкий (ER менше 3); B = хороший субстрат (ER більше 3, менше 10); 2) NF = in vitro відсутнє значне утворення адукту відносно контролю; 3) A = менше 50 % інгібування при 1 мкМ; 4) A = менше 50 % контролю при 30 мг/кг перорально (p.o.); 5) A=IC50 більше 10 мкМ; B=IC50 більше 1 мкМ, менше 10 мкМ. 30 35 40 Фармацевтичні композиції Сполуки формули I та їх фармацевтично прийнятні солі можна застосовувати як терапевтично активні речовини, наприклад, у формі фармацевтичних препаратів. Фармацевтичні препарати можна вводити перорально, наприклад, у формі таблеток, таблеток з покриттям, драже, твердих і м'яких желатинових капсул, розчинів, емульсій або суспензій. Введення можна, проте, також здійснювати ректально, наприклад, у формі супозиторіїв, або парентерально, наприклад, у формі ін'єкційних розчинів. Сполуки формули I та їх фармацевтично прийнятні солі можна обробляти фармацевтично інертними, неорганічними або органічними носіями, призначеними для одержання фармацевтичних препаратів. Лактозу, кукурудзяний крохмаль або його похідні, тальк, стеаринові кислоти або їх солі і тому подібне можна використовувати, наприклад, як такі носії для таблеток, таблеток з покриттям, драже і твердих желатинових капсул. Відповідними носіями для м'яких желатинових капсул є, наприклад, рослинні олії, віск, жири, напівтверді і рідкі поліоли і тому подібне. Проте, залежно від природи активної речовини у разі м'яких желатинових капсул 15 UA 113309 C2 5 10 15 20 25 носії зазвичай не потрібні. Відповідними носіями для одержання розчинів і сиропів є, наприклад, вода, поліоли, гліцерин, рослинна олія і тому подібне. Відповідними носіями для супозиторіїв є, наприклад, натуральні або отверджені масла, віск, жири, напіврідкі або рідкі поліоли і тому подібне. Фармацевтичні препарати можуть, крім того, містити фармацевтично прийнятні допоміжні речовини, такі як консерванти, солюбілізатори, стабілізатори, зволожуючі агенти, емульгатори, підсолоджувачі, барвники, коригенти, солі для варіювання осмотичного тиску, буфери, маскуючі агенти або антиоксиданти. Ці препарати можуть також містити інші терапевтично цінні речовини. Лікарські засоби, що містять сполуку формули I або її фармацевтично прийнятну сіль і терапевтично інертний носій, також є об'єктом даного винаходу, а також спосіб їх одержання, що включає приведення одної або більше сполук формули I та/або їх фармацевтично прийнятних солей і, якщо бажано, одної або більше інших терапевтично цінних речовин у форму галенова препарату для введення разом з одним або великим числом терапевтично інертних носіїв. Дозування може варіювати в широких межах і, звичайно, його слід регулювати за індивідуальними потребами у кожному конкретному випадку. У разі перорального введення доза для дорослих може варіювати від приблизно 0,01 мг до приблизно 1000 мг на добу сполуки загальної формули I або відповідної кількості її фармацевтично прийнятної солі. Добову дозу можна вводити у вигляді одноразової дози або в розділених дозах і, крім того, верхня межа може бути також перевищена, якщо виявлені показання до цього. Наведені нижче приклади ілюструють даній винахід без його обмеження, але служать виключно як репрезентативні. Фармацевтичні препарати зазвичай містять приблизно 1-500 мг, зокрема, 1-100 мг сполуки формули I. Прикладами композицій відповідно до винаходу є наступні композиції: Приклад A Таблетки, що мають наведену нижче композицію, готують звичайним способом: Таблиця 3 Можлива композиція таблетки Інгредієнт Сполука, що має формулу I Лактоза безводна DTG Sta-Rx 1500 Мікрокристалічна целюлоза Стеарат магнію Всього 30 35 5 5 125 6 30 1 167 мг/таблетка 25 100 25 100 105 30 6 6 30 30 1 1 167 167 500 500 150 60 450 1 831 Метод одержання 1. Змішують інгредієнти 1, 2, 3 і 4 і гранулюють з дистильованою водою. 2. Висушують гранули при 50 °C. 3. Пропускають гранули через відповідне устаткування для подрібнення. 4. Додають інгредієнт 5 і змішують протягом трьох хвилин; пресують на відповідному пресі. Приклад B-1 Готують капсули, що мають наведену нижче композицію: 16 UA 113309 C2 Таблиця 4 Можлива композиція інгредієнтів капсули мг/капсула Інгредієнт 5 5 159 25 10 1 200 Сполука, що має формулу I Водна лактоза Кукурудзяний крохмаль Тальк Стеарат магнію Всього 5 10 25 25 123 35 15 2 200 100 100 148 40 10 2 300 500 500 70 25 5 600 Метод одержання 1. Змішують інгредієнти 1, 2 і 3 у відповідному змішувачі протягом 30 хвилин. 2. Додають інгредієнти 4 і 5 і змішують протягом 3 хвилин. 3. Заповнюють у відповідну капсулу. Сполуку, що має формулу I, лактозу і кукурудзяний крохмаль спочатку змішують в змішувачі, а потім в подрібнюючому апараті. Суміш повертають в змішувач; додають до неї тальк і ретельно змішують. Суміш заповнюють за допомогою апарату у відповідні капсули, наприклад, в тверді желатинові капсули. Приклад B-2 Готують м'які желатинові капсули, що мають наведену нижче композицію: Таблиця 5 Можлива композиція інгредієнтів м'якої желатинової капсули Інгредієнт Сполука, що має формулу I Жовтий віск Гідрогенізоване соєве масло Частково гідрогенізовані рослинні олії Соєве масло Всього мг/капсула 5 8 8 34 110 165 Таблиця 6 Можлива композиція інгредієнтів м'якої желатинової капсули Інгредієнт Желатин Гліцерин 85 % Karion 83 Діоксид титану Оксид заліза жовтий Всього мг/капсула 75 32 8 (суха речовина) 0,4 1,1 116,5 15 20 Метод одержання Сполуку, що має формулу I, розчиняють в теплому розплаві інших інгредієнтів, і суміш заповнюють в м'які желатинові капсули відповідного розміру. Заповнені м'які желатинові капсули обробляють відповідно до звичайних методів. Приклад C Готують супозиторії, що мають наведену нижче композицію: 17 UA 113309 C2 Таблиця 7 Можлива композиція супозиторія Інгредієнт Сполука, що має формулу I Супозиторна маса Всього 5 мг/супозиторій 151285 1300 Метод одержання Супозиторну масу плавлять в скляній або сталевій судині, ретельно змішують і охолоджують до 45 °C. Після цього до неї додають тонкоподрібнену сполуку, що має формулу I, і перемішують до тих пір, поки вона повністю не диспергує. Суміш заливають у форми для супозиторіїв відповідного розміру, залишають до охолоджування; потім супозиторії витягують з форм і упаковують індивідуально у вощений папір або металеву фольгу. Приклад D Готують ін'єкційні розчини, що мають наведену нижче композицію: 10 Таблиця 8 Можлива композиція ін'єкційного розчину Інгредієнт Сполука, що має формулу I Поліетиленгліколь 400 Оцтова кислота Вода для ін'єкційних розчинів 15 мг/ ін'єкційний розчин 3 150 q.s. до pH 5,0 до 1,0 мл Метод одержання Сполуку, що має формулу I, розчиняють в суміші поліетиленгліколю 400 і води для ін'єкцій (частини). Доводять pH до 5,0 оцтовою кислотою. Об'єм доводять до 1,0 мл додаванням решти кількості води. Розчин фільтрують, заповнюють у флакони, використовуючи відповідний допустимий надлишок, і стерилізують. Приклад E Готують пакети-саше, що мають наведену нижче композицію: Таблиця 9 Можлива композиція пакета-саше Інгредієнт Сполука, що має формулу I Лактоза, дрібний порошок Мікрокристалічна целюлоза (AVICEL PH 102) Натрієва сіль карбоксиметилцелюлози Полівінілпіролідон K 30 Стеарат магнію Добавки коригентів Всього мг/саше 50 1015 1400 14 10 10 1 2500 20 Метод одержання Сполуку, що має формулу I, змішують з лактозою, мікрокристалічною целюлозою і натрієвою сіллю карбоксиметилцелюлози і гранулюють з сумішшю полівінілпіролідону у воді. 18 UA 113309 C2 5 Гранулят змішують із стеаратом магнію, додають добавки коригентів і заповнюють в пакетисаше. Експериментальний розділ Наведені нижче приклади приведені для ілюстрації винаходу. Їх не слід розглядати як винаходи, що обмежують об'єм, але виключно як репрезентативні. Синтез проміжних дигідроізоксазолів IV Проміжна сполука IV-1: рац-(3aR, 6aR)-3-Метил-3a, 5,6,6a-тетрагідроциклопента[d]ізоксазол-4-он рац 10 15 20 25 В інертній атмосфері розчин нітроетану (4,66 г, 4,44 мл, 62,1 ммоль) в ефірі (15 мл) обробляли при кімнатній температурі розчином циклопент-2-енону (5 г, 5,1 мл, 60,9 ммоль) в ефірі (90 мл) з подальшим додаванням триетиламіну (70,8 мг, 97,6 мкл, 700 мкмоль) і додаванням по краплях фенілізоціанату (14,8 г, 13,6 мл, 124 ммоль). Світло-жовтий розчин перемішували при 25 °C протягом вихідних днів. Для обробки білувату суспензію фільтрували і промивали три рази ефіром. Фільтрат випаровували, потім неочищений продукт розтирали в дихлорметані (15 мл), тверду речовину фільтрували і промивали дихлорметаном. Після випаровування фільтрату оранжевого кольору неочищений продукт очищали флешхроматографією на силікагелі, використовуючи градієнт гептану і етилацетату = 2:1-1:2 як елюент. рац-(3aR, 6aR)-3-Метил-3a, 5,6,6a-тетрагідро-циклопента[d]ізоксазол-4-он (5,95 г, 70 % + вихід) був одержаний у вигляді жовтої рідини. Мас-спектр (МС): m/z=139 [M] . Додатково був одержаний рац-(3aR, 6aS)-3-метил-3a, 4,5,6a-тетрагідро-циклопента[d]ізоксазол-6-он (0,37 г, + 4,3 % вихід) у вигляді жовтого масла. МС: m/z=139 [M] . Проміжна сполука IV-2: рац-(3aR, 7aR)-3-Метил-5,6,7,7a-тетрагідро-3aH-бензо[d]ізоксазол-4он рац 30 35 40 45 В інертній атмосфері розчин нітроетану (5,36 г, 5,1 мл, 71,4 ммоль) в ефірі (20 мл) обробляли при кімнатній температурі розчином циклогекс-2-енону (6,73 г, 6,78 мл, 70 ммоль) в ефірі (120 мл) з подальшим додаванням триетиламіну (70,8 мг, 97,6 мкл, 700 мкмоль) і додаванням по краплях (приблизно протягом 1 хвилини) фенілізоціанату (17,0 г, 15,6 мл, 143 ммоль). Прозорий розчин перемішували при 25 °C протягом 48 годин, причому, тверда речовина починала випадати в осад через 2 години. Для обробки тверду речовину фільтрували і промивали три рази ефіром. Жовтий фільтрат випаровували, потім жовтий неочищений продукт суспендували в дихлорметані (30 мл), тверду речовину фільтрували і промивали три рази дихлорметаном. Після випаровування фільтрату неочищений продукт очищали флешхроматографією на силікагелі, використовуючи градієнт гептану і етилацетату = 5:1-4:1-1:1 як елюент. рац-(3aR, 7aR)-3-Метил-5,6,7,7a-тетрагідробензо[d]ізоксазол-4(3aH)-он (7,27 г, 68 % + вихід) був одержаний у вигляді оранжевої рідини. МС: m/z=154,1 [M+H] . Додатково був одержаний рац-(3aR, 7aR)-3-метил-3a, 5,6,7a-тетрагідро-4H-бензо[d]ізоксазол-7-он (0,52 г, 4,9 % + вихід) був одержаний у вигляді світло-коричневої твердої речовини. МС: m/z=154,1 [M+H] . Загальний метод B: Синтез проміжних дигідроізоксазолів VI В інертній атмосфері розчин дигідроізоксазолу формули IV (12,2 ммоль) в дихлорметані (17 мл) обробляли по краплях при 0 °C трифторид морфоліносірки V (26,9 ммоль). Розчину давали підігрітися до кімнатної температури і перемішували протягом 15 годин. Для обробки суміш охолоджували до 0 °C і гасили насиченим розчином бікарбонату натрію, при цьому підтримуючи температуру нижче 20 °C. Після перемішування протягом 30 хвилин водний шар екстрагували 19 UA 113309 C2 три рази дихлорметаном. Об'єднані органічні шари промивали соляним розчином, висушували над сульфатом натрію і випаровували. Неочищений продукт очищали за допомогою молекулярної перегонки і флеш-хроматографії на силікагелі, використовуючи суміші гептану і етилацетату як елюенту, з одержанням чистих дигідроізоксазолів VI. 5 рац 10 Проміжна сполука VI-1: Починаючи з рац-(3aR, 6aR)-3-метил-3a, 5,6,6a-тетрагідроциклопента[d]ізоксазол-4-ону (проміжної сполуки IV-1), продукт рац-(3aR, 6aR)-4,4-дифтор-3метил-4,5,6,6a-тетрагідро-3aH-циклопента[d]ізоксазол був одержаний у вигляді світло-жовтої + рідини (73 % вихід). МС: m/z=162,2 [M+H] . рац 15 20 25 30 Проміжна сполука VI-2: Починаючи з рац-(3aR, 7aR)-3-метил-5,6,7,7a-тетрагідро-3aHбензо[d]ізоксазол-4-ону (проміжна сполука IV-2), продукт рац-(3aR, 7aR)-4,4-дифтор-3-метил-3a, 4,5,6,7,7a-гексагідро-бензо[d]ізоксазол був одержаний у вигляді суміші 1:1 з рац-(3aR, 7aR)-4фтор-3-метил-3a, 6,7,7a-тетрагідро-бензо[d]ізоксазолом у вигляді безбарвної рідини, яку + + включали в стадію без додаткового очищення. МС: m/z=176,2 [M+H] і МС: m/z=156,2 [M+H] . Загальний метод C: Синтез проміжних ізоксазолідинів VIII і IX В інертній атмосфері розчин арилброміду формули VII (13 ммоль) в суміші тетрагідрофурану (10 мл) і толуолу (30 мл) обробляли при -78 °C н-бутиллітієм (1,6 M в гексані, 7,8 мл) протягом 10 хв, підтримуючи при цьому температуру нижче -70 °C. Перемішування продовжували при -78 °C протягом 1 години. Розчин дигідроізоксазолу формули VI (6,21 ммоль) в толуолі (70 мл) обробляли при -78 °C ефіратом трифториду бору (12,4 ммоль) з подальшим додаванням протягом 10 хвилин одержаного вище арилітієвого реагента, використовуючи канюлю із захисним покриттям, підтримуючи температуру нижче -70 °C. Потім суміш перемішували при -78 °C протягом 30 хвилин. Після сумарного часу 2 години реакційну суміш гасили насиченим водним розчином хлориду амонію і екстрагували три рази етилацетатом. Об'єднані органічні шари промивали соляним розчином, висушували над сульфатом натрію і випаровували при зниженому тиску. Неочищений продукт очищали флеш-хроматографією на силікагелі, використовуючи суміші гептану або циклогексану і етилацетату як елюенту, з одержанням чистих ізоксазолідинів формули VIII. 35 рац 40 Проміжна сполука VIII-1: Починаючи з рац-(3aR, 6aR)-4,4-дифтор-3-метил-4,5,6,6aтетрагідро-3aH-циклопента[d]ізоксазолу, продукт рац-(3S, 3aR, 6aR)-4,4-дифтор-3-(2-фторфеніл)-3-метил-гексагідро-циклопента[d]ізоксазол був одержаний у вигляді світло-жовтого + масла (73 % вихід). МС: m/z=258,1 [M+H] . 20 UA 113309 C2 рац 5 Проміжна сполука VIII-2: Починаючи з суміші 1:1 рац-(3aR, 7aR)-4,4-дифтор-3-метил-3a, 4,5,6,7,7a-гексагідро-бензо[d]ізоксазолу і рац-(3aR, 7aR)-4-фтор-3-метил-3a, 6,7,7a-тетрагідробензо[d]ізоксазолу, продукт рац-(3S, 3aR, 6aR)-4,4-дифтор-3-(2-фтор-феніл)-3-метил-гексагідроциклопента[d]ізоксазол був одержаний у вигляді світло-жовтого масла (29 % вихід). МС: +. m/z=272,1 [M+H] хіральна 10 15 Проміжні сполуки IX-1: рац-(3S, 3aR, 6aR)-4,4-Дифтор-3-(2-фтор-феніл)-3-метил-гексагідроциклопента[d]ізоксазол розділяли за допомогою високоефективної рідинної хроматографії (ВЕРХ) на хіральній фазі (Chiralpak AD), використовуючи суміш 90:10 н-гептану і етанолу як елюент, з одержанням (3R, 3aS, 6aS)-4,4-дифтор-3-(2-фтор-феніл)-3-метил-гексагідроциклопента[d]ізоксазолу (проміжної сполуки IXb-1) у вигляді енантіомера, що елююється швидше (30 % вихід), і бажаного (3S, 3aR, 6aR)-4,4-дифтор-3-(2-фтор-феніл)-3-метилгексагідро-циклопента[d]ізоксазолу (проміжної сполуки IXa-1) у вигляді енантіомера, що елююється повільніше (27 % вихід), і той, і інший у вигляді жовтого масла. хіральна 20 25 30 35 Проміжні сполуки IX-2: рац-(3S, 3aR, 6aR)-4,4-дифтор-3-(2-фтор-феніл)-3-метил-гексагідроциклопента[d]ізоксазол розділяли за допомогою високоефективної рідинної хроматографії (ВЕРХ) на хіральній фазі (Chiralpak AD), використовуючи суміш 95:5 н-гептану і етанолу як елюент, з одержанням (3R, 3aS, 6aS)-4,4-дифтор-3-(2-фтор-феніл)-3-метил-гексагідроциклопента[d]ізоксазолу (проміжної сполуки IXb-2) у вигляді енантіомера, що елююється швидше (11 % вихід), і бажаного (3S, 3aR, 6aR)-4,4-дифтор-3-(2-фтор-феніл)-3-метилгексагідро-циклопента[d]ізоксазолу (проміжної сполуки Ixa-2) у вигляді енантіомера, що елююється повільніше (22 % вихід). Загальний метод D: Синтез проміжних аміноспиртів X До розчину ізоксазолідину формули IX (1,52 ммоль) в етанолі (8 мл) додавали паладій (10 % на вуглеці, 81 мгі) і форміат амонію (767 мг), і перемішування суміші продовжували при 22 °C протягом 2,5 годин. Потім суспензію фільтрували, фільтрат випаровували, і залишок розподіляли між етилацетатом і насиченим водним розчином бікарбонату натрію. Органічний шар висушували над сульфатом натрію, випаровували при зниженому тиску з одержанням чистого аміноспирту формули X. 21 UA 113309 C2 хіральна 5 Проміжна сполука Xa-1: Починаючи з (3S, 3aR, 6aR)-4,4-дифтор-3-(2-фтор-феніл)-3-метилгексагідро-циклопента[d]ізоксазолу (проміжної сполуки IXa-1), продукт (1R, 2R)-2-[(S)-1-аміно-1(2-фтор-феніл)-етил]-3,3-дифтор-циклопентанол був одержаний у вигляді білої кристалічної + твердої речовини (98 % вихід). МС: m/z=260,1 [M+H] . хіральна 10 15 20 Проміжна сполука Xa-2: Починаючи з (3S, 3aR, 6aR)-4,4-дифтор-3-(2-фтор-феніл)-3-метилгексагідро-циклопента[d]ізоксазолу (проміжної сполуки IXa-2), продукт (1R, 2R)-2-[(S)-1-аміно-1(2-фтор-феніл)-етил]-3,3-дифтор-циклогексанол був одержаний у вигляді білої твердої + речовини (98 % вихід). МС: m/z=274,1 [M+H] . Загальний метод E: Синтез проміжних оксазинів XI Розчин аміноспирту формули X (1,4 ммоль) в етанолі (7,5 мл) обробляли при кімнатній температурі розчином ціаногенброміду (5 M в ацетонітрилі; 2,85 ммоль). Реакційну суміш нагрівали при 85 °C в запаяній трубці протягом 3-6 годин. З метою завершення реакції додавали 1,4 ммоль ціаногенброміду. Після сумарного часу 22 години розчинник видаляли при зниженому тиску, і залишок розподіляли між етилацетатом і насиченим водним розчином карбонату натрію. Органічний шар відокремлювали, висушували над сульфатом натрію і випаровували при зниженому тиску. Неочищений продукт очищали флеш-хроматографією на силікагелі-NH2, використовуючи суміші гептану або циклогексану і етилацетату як елюенту, з одержанням чистих ізоксазолідинів формули XI. хіральна 25 30 Проміжна сполука XIa-1: Починаючи з ((1R, 2R)-2-[(S)-1-аміно-1-(2-фтор-феніл)-етил]-3,3дифтор-циклопентанолу, продукт (4S, 4aR, 7aR)-5,5-дифтор-4-(2-фтор-феніл)-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-2-іламін був одержаний у вигляді білої піни (80 % + вихід). МС: m/z=285,1 [M+H] . 22 UA 113309 C2 хіральна 5 10 15 Проміжна сполука XIa-2: Починаючи з (1R, 2R)-2-[(S)-1-аміно-1-(2-фтор-феніл)-етил]-3,3дифтор-циклогексанолу, продукт (4S, 4aR, 8aR)-5,5-дифтор-4-(2-фтор-феніл)-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-2-іламін був одержаний у вигляді аморфної білої + речовини (67 % вихід). МС: m/z=299,1 [M+H] . Загальний метод F: Синтез проміжних нітрооксазинів XII Оксазин формули XI (0,1 ммоль) додавали порціями до концентрованої сірчаної кислоти (2 мл) при 22 °C. Одержаний розчин охолоджували до 0 °C і обробляли червоною димлячою азотною кислотою (0,058 мл), і перемішування продовжували при 0 °C протягом 2 годин. Для обробки реакційну суміш поволі додавали до коленого льоду, і pH доводили до 10, використовуючи насичений розчин карбонату натрію. Водний шар екстрагували етилацетатом, органічний шар висушували над сульфатом натрію і випаровували з одержанням чистого нітрооксазину формули XII. Альтернативно неочищений продукт очищали флешхроматографією на силікагелі-NH2, використовуючи суміші гептану або циклогексану і етилацетату як елюент, з одержанням чистих нітро-оксазинів формули XII. хіральна 20 Проміжна сполука XIIa-1: Починаючи з (4S, 4aR, 7aR)-5,5-дифтор-4-(2-фтор-феніл)-4-метил4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-2-іламіну, продукт (4S, 4aR, 7aR)-5,5-дифтор4-(2-фтор-5-нітро-феніл)-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-2-іламін + був одержаний у вигляді білої піни (87 % вихід). МС: m/z=330,1 [M+H] . хіральна 25 30 35 Проміжна сполука XIIa-2: Починаючи з (4S, 4aR, 8aR)-5,5-дифтор-4-(2-фтор-феніл)-4-метил4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-2-іламіну, продукт (4S, 4aR, 8aR)-5,5-дифтор-4(2-фтор-5-нітро-феніл)-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-2-іламін був + одержаний у вигляді білої твердої речовини (88 % вихід). МС: m/z=344,1 [M+H] . Загальний метод G: Синтез проміжних анілінів XIII Суспензію нітро-оксазину формули XII (0,68 ммоль) в етанолі (4 мл) і триетиламін (0,095 мл) піддавали гідрогенізації при атмосферному тиску при 22 °C протягом 1,5 годин, використовуючи паладій (10 % на вуглеці; 72 мг) як каталізатор. Для обробки реакційну суміш фільтрували, і фільтрат випаровували з одержанням чистих анілінів формули XIII. 23 UA 113309 C2 хіральна 5 Проміжна сполука XIIIa-1: Починаючи з (4S, 4aR, 7aR)-5,5-дифтор-4-(2-фтор-5-нітро-феніл)4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-2-іламіну, продукт (4S, 4aR, 7aR)-4(5-аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин+ 2-іламін був одержаний у вигляді білої піни (97 % вихід). МС: m/z=300,1 [M+H] . хіральна 10 15 20 25 30 35 40 45 Проміжна сполука XIIIa-2: Починаючи з (4S, 4aR, 8aR)-5,5-дифтор-4-(2-фтор-5-нітро-феніл)4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-2-іламіну, продукт (4S, 4aR, 8aR)-4-(5аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-2+ іламін був одержаний у вигляді білої твердої речовини (75 % вихід). МС: m/z=314,0 [M+H] . Загальний метод Q синтезу кінцевих амідів I Розчин кислоти XIV (95,8 мкмоль) в метанолі (720 мкл) охолоджували до 0 °C. Додавали 4(4,6-диметокси-1,3,5-триазин-2-іл)-4-метилморфолінію хлорид (125 мкмоль). Через 5 хвилин додавали по краплях розчин аніліну формули XIII (95,8 мкмоль) в метанолі (240 мкл). Суміш перемішували при 0 °C протягом 1 години, потім при кімнатній температурі протягом ночі. Для обробки розчинник видаляли при зниженому тиску, потім залишок обробляли насиченим розчином бікарбонату натрію. Залишкову тверду речовину фільтрували, промивали водою і висушували при зниженому тиску. Неочищений продукт очищали на силікагелі-NH2, використовуючи суміші гептану і етилацетату як елюент, з одержанням чистих кінцевих амідів формули I. Альтернативно неочищений продукт очищали на ВЕРХ, використовуючи градієнт води і ацетонітрилу (+ 0,1 % триетиламіну) як елюент. Наведені нижче приклади були одержані відповідно до загального методу Q. Приклад 1 5-Бут-2-інілокси-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід В результаті поєднання (4S, 4aR, 7aR)-4-(5-аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-2-іламіну (проміжної сполуки XIIIa-1) і 5-бут-2інілокси-піразин-2-карбонової кислоти (CAS 1221447-98-8 [1]), слідуючи методу Q, одержали сполуку, зазначену в заголовку, у вигляді аморфної безбарвної речовини (34 % вихід). МС: + m/z=474,2 [M+H] . Приклад 2 5-Ціано-піридин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід В результаті поєднання (4S, 4aR, 7aR)-4-(5-аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-2-іламіну (проміжної сполуки XIIIa-1) і 5-ціанопіридин-2-карбонової кислоти, слідуючи методу Q, одержали сполуку, зазначену в заголовку, у + вигляді білого порошку (82 % вихід). МС: m/z=430,4 [M+H] . Приклад 3 5-Хлор-піридин-2-карбонової кислоти [(S)-3-((1R, 2R)-2-аміно-6,6-дифтор-4-фторметил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід В результаті поєднання (4S, 4aR, 7aR)-4-(5-аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-2-іламіну (проміжної сполуки XIIIa-1) і 5-хлорпіридин-2-карбонової кислоти, слідуючи методу Q, одержали сполуку, зазначену в заголовку, у 24 UA 113309 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 вигляді аморфної безбарвної речовини (69 % вихід). МС: m/z=439,2 [M+H] . Приклад 4 5-(1,1-Дифтор-етил)-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід В результаті поєднання (4S, 4aR, 7aR)-4-(5-аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-2-іламіну (проміжної сполуки XIIIa-1) і 5-(1,1дифтор-етил)-піразин-2-карбонової кислоти (CAS 1262803-63-3 [15]), слідуючи методу Q, одержали сполуку, зазначену в заголовку, у вигляді білої твердої речовини (52 % вихід). МС: + m/z=470,3 [M+H] . Приклад 5 5-Фторметил-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4-метил4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід В результаті поєднання (4S, 4aR, 7aR)-4-(5-аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-2-іламіну (проміжної сполуки XIIIa-1) і 5фторметил-піразин-2-карбонової кислоти (CAS 1262803-66-6), слідуючи методу Q, одержали сполуку, зазначену в заголовку, у вигляді білої твердої речовини (75 % вихід). МС: m/z=438,2 + [M+H] . Приклад 6 5-Ціано-піразин-2-карбонової кислоти [3-((4S, 4aR, 7aR)-2-аміно-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід В результаті поєднання (4S, 4aR, 7aR)-4-(5-аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4,4a, 5,6,7,7a-гексагідро-циклопента[e][1,3]оксазин-2-іламіну (проміжної сполуки XIIIa-1) і 5-ціанопіразин-2-карбонової кислоти (CAS 1211533-09-3), слідуючи методу Q, одержали сполуку, зазначену в заголовку, у вигляді світло-жовтої твердої речовини (28 % вихід). МС: m/z=431,3 + [M+H] . Приклад 7 5-Хлор-піридин-2-карбонової кислоти [3-((4S, 4aR, 8aR)-2-аміно-5,5-дифтор-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід В результаті поєднання (4S, 4aR, 8aR)-4-(5-аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-2-іламіну (проміжної сполуки XIIIa-2) і 5-хлорпіридин-2-карбонової кислоти, слідуючи методу Q, одержали сполуку, зазначену в заголовку, у + вигляді білої твердої речовини (85 % вихід). МС: m/z=453,1 [M+H] . Приклад 8 5-Ціано-піридин-2-карбонової кислоти [3-((4S, 4aR, 8aR)-2-аміно-5,5-дифтор-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід В результаті поєднання (4S, 4aR, 8aR)-4-(5-аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-2-іламіну (проміжної сполуки XIIIa-2) і 5-ціанопіридин-2-карбонової кислоти, слідуючи методу Q, одержали сполуку, зазначену в заголовку, у + вигляді білої твердої речовини (72 % вихід). МС: m/z=444,3 [M+H] . Приклад 9 5-Хлор-тіофен-2-карбонової кислоти [3-((4S, 4aR, 8aR)-2-аміно-5,5-дифтор-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-4-іл)-4-фтор-феніл]-амід В результаті поєднання (4S, 4aR, 8aR)-4-(5-аміно-2-фтор-феніл)-5,5-дифтор-4-метил-4a, 5,6,7,8,8a-гексагідро-4H-бензо[e][1,3]оксазин-2-іламіну (проміжної сполуки XIIIa-2) і 5-хлортіофен-2-карбонової кислоти (CAS 24065-33-6), слідуючи методу Q. одержали сполуку, + зазначену в заголовку, у вигляді білої твердої речовини (72 % вихід). МС: m/z=458,3 [M+H] . Джерела інформації: 1.Hardy et al., The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics, Science. 2002 Jul 19;297(5580):353-6 2. Selkoe, Cell biology of the amyloid beta-protein precursor and the mechanism of Alzheimer's disease, Annu Rev Cell Biol. 1994;10:373-403 3. Vassar et al., Beta-secretase cleavage of Alzheimer's amyloid precursor protein by the transmembrane aspartic protease BACE, Science. 1999 Oct 22;286(5440):735 4. Luo et al., Mice deficient in BACE1, the Alzheimer's beta-secretase, have normal phenotype and abolished beta-amyloid generation, Nat Neurosci. 2001 Mar;4(3):231-2 5. Roberds et al., BACE knockout mice are healthy despite lacking the primary beta-secretase activity in brain: implications for Alzheimer's disease therapeutics, Hum Mol Genet. 2001 Jun 1;10(12):1317-24 6. McConlogue et al., Partial reduction of BACE1 has dramatic effects on Alzheimer plaque and synaptic pathology in APP Transgenic Mice. J Biol Chem. 2007 Sep 7;282(36):26326 25 UA 113309 C2 5 10 7. WO 2011071135 8. Biochem. Pharmacol. (1973) 22:3099 9. Compendium of Chemical Terminology, 2nd, A. D. McNaught & A. Wilkinson (Eds). Blackwell Scientific Publications, Oxford (1997) 10. Brockhaus et al., NeuroReport 9, 1481-1486; 1998 11. R.L.Walsky and R.S.Obach, Drug Metabolism and Disposition 32: 647-660, 2004. and S.Fowler and H.Zhang, The AAPS Journal, Vol.10, No. 2, 410-424, 2008 12. Guo L, Guthrie H, Automated electrophysiology in the preclinical evaluation of drugs for potential QT prolongation. Journal of Pharmacological & Toxicological Methods, (2005) 52(1):123-35 13. C.M.Dieckhaus et al. in Chem.Res.Toxicol. 2005, 18, 630-638 14. WO2010047372 15. WO2011009898 ФОРМУЛА ВИНАХОДУ 15 1. Сполука формули І R F F R 4 R 2 O 3 N H N R 1 n R 20 25 30 35 40 45 50 5 O NH2 ,I де 1 R вибраний з групи, що складається з і) арилу, іі) арилу, заміщеного 1-4 замісниками, незалежно вибраними з ціано, ціано-С1-6-алкілу, атома галогену, галоген-С1-6-алкокси, галоген-С1-6-алкілу, С1-6-алкокси, С1-6-алкоксі-С1-6-алкілу, С2-6алкініл-С1-6-алкокси, С2-6-алкінілу і С1-6-алкілу, ііі) гетероарилу, і iv) гетероарилу, заміщеного 1-4 замісниками, незалежно вибраними з ціано, ціано-С1-6-алкілу, атома галогену, галоген-С1-6-алкокси, галоген-С1-6-алкілу, С1-6-алкокси, С1-6-алкоксі-С1-6-алкілу, С2-6-алкініл-С1-6-алкокси, С2-6-алкінілу і С1-6-алкілу; 2 R вибраний з групи, що складається з і) атома водню, іі) С1-6-алкілу, і ііі) галогену; 3 R вибраний з групи, що складається з і) С1-6-алкілу, і іі) галоген-С1-6-алкілу; 4 R вибраний з групи, що складається з і) атома водню, і іі) С1-6-алкілу, і 5 R вибраний з групи, що складається з і) атома водню, і іі) С1-6-алкілу; n дорівнює 1 або 2; або її фармацевтично прийнятні солі. 1 2. Сполука формули І за п. 1, де R позначає гетероарил, заміщений 1-2 замісниками, незалежно вибраними з ціано, атома галогену, галоген-С1-6-алкілу і С2-6-алкініл-С1-6-алкокси. 1 3. Сполука формули І за будь-яким з пп. 1-2, де R вибраний з: і) піридинілу, заміщеного 1-2 замісниками, незалежно вибраними з ціано і атома галогену, іі) піразинілу, заміщеного 1-2 замісниками, незалежно вибраними з ціано, галоген-С1-6-алкілу і С2-6-алкініл-С1-6-алкокси, і ііі) тіофенілу, заміщеного 1-2 атомами галогену. 26 UA 113309 C2 1 5 10 15 20 25 30 4. Сполука формули І за будь-яким з пп. 1-3, де R позначає 5-бут-2-инілоксипіразин-2-іл, 5ціанопіридин-2-іл, 5-хлорпіридин-2-іл, 5-фторметилпіразин-2-іл, 5-ціанопіразин-2-іл, 5хлорпіридин-2-іл, 5-ціанопіридин-2-іл, 5-хлортіофен-2-іл або 5-(1,1-дифторетил)-піразин-2-іл. 2 5. Сполука формули І за будь-яким з пп. 1-4, де R позначає атом галогену. 2 6. Сполука формули І за будь-яким з пп. 1-5, де R позначає F. 3 7. Сполука формули І за будь-яким з пп. 1-6, де R позначає С1-6-алкіл. 3 8. Сполука формули І за будь-яким з пп. 1-7, де R позначає метил. 4 9. Сполука формули І за будь-яким з пп. 1-8, де R позначає атом водню. 5 10. Сполука формули І за будь-яким з пп. 1-9, де R позначає атом водню. 11. Сполука формули І за будь-яким з пп. 1-10, де n дорівнює 1. 12. Сполука формули І за будь-яким з пп. 1-10, де n дорівнює 2. 13. Сполука за будь-яким з пп. 1-12, вибрана з наступних: 5-бут-2-инілоксипіразин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aмiнo-5,5-дифтop-4-мeтил4,4а,5,6,7,7а-гексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду, 5-фторметилпіразин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aмiнo-5,5-дифтop-4-мeтил4,4а,5,6,7,7а-гексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду, 5-ціанопіридин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aміно-5,5-дифтop-4-метил-4,4a,5,6,7,7aгексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду, 5-хлорпіридин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aмiнo-5,5-дифтop-4-мeтил-4,4a,5,6,7,7aгексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду, 5-ціанопіразин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aмiнo-5,5-дифтop-4-мeтил-4,4a,5,6,7,7aгексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду, 5-хлорпіридин-2-карбонової кислоти [3-((4S,4aR,8aR)-2-aмiнo-5,5-дифтop-4-мeтил-4a,5,6,7,8,8aгексагідро-4Н-бензо[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду, 5-ціанопіридин-2-карбонової кислоти [3-((4S,4aR,8aR)-2-aмiнo-5,5-дифтop-4-мeтил-4a,5,6,7,8,8aгексагідро-4Н-бензо[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду, 5-хлортіофен-2-карбонової кислоти [3-((4S,4aR,8aR)-2-aміно-5,5-дифтор-4-метил-4а,5,6,7,8,8агексагідро-4Н-бензо[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду і 5-(1,1-дифторетил)-піразин-2-карбонової кислоти [3-((4S,4aR,7aR)-2-aмiнo-5,5-дифтop-4-мeтил4,4а,5,6,7,7а-гексагідроциклопента[е][1,3]оксазин-4-іл)-4-фторфеніл]-аміду або їх фармацевтично прийнятних солей. 14. Спосіб одержання сполуки формули І за будь-яким з пп. 1-13, за яким в реакцію вводять сполуку формули I’ із сполукою формули XIV R F F R R 4 2 3 NH2 N O n R 35 1 40 45 50 5 2 O 3 NH2 4 , I’ R 1 OH , XIV 5 де n, R , R , R , R , R є такими, як визначено в будь-якому з пп. 1-12. 15. Сполука формули І за будь-яким з пп. 1-13, у будь-якому випадку одержана способом за п. 14. 16. Сполука формули І за будь-яким з пп. 1-13 для застосування як терапевтично активної речовини. 17. Сполука формули І за пп. 1-13 для застосування як терапевтично активної речовини для терапевтичного та/або профілактичного лікування захворювань і розладів, що характеризуються підвищеними рівнями -амілоїду та/або олігомерів -амілоїду, та/або амілоїдних бляшок та інших відкладень, зокрема хвороби Альцгеймера. 18. Фармацевтична композиція, що містить сполуку формули І за будь-яким з пп. 1-13 і фармацевтично прийнятний носій та/або фармацевтично прийнятну допоміжну речовину. 19. Застосування сполуки формули І за будь-яким з пп. 1-13 для одержання лікарського засобу для терапевтичного та/або профілактичного лікування захворювань і розладів, що характеризуються підвищеними рівнями -амілоїду та/або олігомерів -амілоїду, та/або амілоїдних бляшок та інших відкладень, зокрема хвороби Альцгеймера. 27 UA 113309 C2 5 20. Спосіб застосування при інгібуванні активності бета-секретази 1 (ВАСЕ1), зокрема для терапевтичного та/або профілактичного лікування захворювань і розладів, що характеризуються підвищеними рівнями -амілоїду та/або олігомерів -амілоїду, та/або амілоїдних бляшок та інших відкладень, або хвороби Альцгеймера, за яким вводять сполуку формули І за будь-яким з пп. 1-13 людині або тварині. Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDifluoro-hexahydro-cyclopentaoxazinyls and difluoro-hexahydro-benzooxazinyls as bace1 inhibitors
Автори англійськоюHilpert, Hans
Автори російськоюХильперт Ханс
МПК / Мітки
МПК: A61K 31/536, C07D 265/12, C07D 413/12
Мітки: бета-секретази, дифторгексагідробензооксазиніли, інгібітори, дифторгексагідроциклопентаоксазиніли
Код посилання
<a href="https://ua.patents.su/30-113309-diftorgeksagidrociklopentaoksazinili-i-diftorgeksagidrobenzooksazinili-yak-ingibitori-beta-sekretazi-1.html" target="_blank" rel="follow" title="База патентів України">Дифторгексагідроциклопентаоксазиніли і дифторгексагідробензооксазиніли як інгібітори бета-секретази 1</a>
Попередній патент: St2-антигензв’язувальний білок
Наступний патент: Спосіб визначення нормальних висот
Випадковий патент: Спосіб отримання гідрооксидів заліза












