Похідні піроніндолу та спосіб їх отримання
Формула / Реферат
1. Сполука, що має формулу:
Аr-В-Аr', (І)
де:
-В-:
-X-Y-Z-, де
X - -(СН2)n (де n дорівнює 0-6), де алкіл лінійний або розгалужений;
Y - оксиген, сульфур, >NH або є відсутньою;
Z - >С=О, >О, >СОО або є відсутньою;
де принаймні одна з X, Y та Z повинна бути присутньою;
Аr - система центрального кільця індолу:
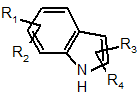 ,
,
Аr' - цикл альфа-, бета- або гамма-пірону кільця системи:

або
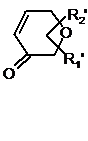 ,
,
або
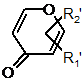 ,
,
де кожний із замісників R1-4 кільця Аr на будь-якій доступній позиції (охоплюючи N-позицію) та кожний із замісників R1'-2' кільця Аr' на будь-якій доступній позиції, та де кожний з R1-4 та R1'-2' незалежно - гідроген, оксиген, галоген, галоген-С1-5алкіл, арил, ацил, С5-7гетероцикл, що містить 1-3 гетероатоми, незалежно вибрані з наступного: нітроген, оксиген та сульфур; С6-8гетероарил, що містить 1-3 гетероатоми, незалежно вибрані з наступного: нітроген, оксиген або сульфур; C1-5алкіл, С2-5алкеніл, С2-5алкініл, арил-C1-5алкіл, арил-С2-5алкеніл, арил-С1-5алкініл, гідроксі-С1-5алкіл, нітро, аміно, ціано, ціанамідо, гуанідино, амідино, ациламідо, С1-5алкіламін, С1-5алкіламідо, гідроксил, тіол, ацилоксил, азидо, С1-5алкоксил, карбоксил, карбоніламідо або стирил; де названі арилалкіл, арилалкеніл, арилалкініл або стирил необов'язково можуть бути заміщеними в кільці одним або чотирма замісниками, незалежно вибраними з наступного: гідроген, галоген, галоген-С1-5алкіл, арил, С5-7гетероциклічна група, що містить 1-3 гетероатоми, незалежно вибрані з наступного: нітроген, оксиген або сульфур; гетероарил, що містить 1-3 гетероатоми, незалежно вибрані з наступного: нітроген, оксиген та сульфур; С1-5алкіл, С2-5алкеніл, С2-5алкініл, арил-С1-5алкіл, арил-С2-5алкеніл, арил-С2-5алкініл, гідроксі-С1-5алкіл, нітро, аміно, ціано, ціанамідо, гуанідино, амідино, ациламідо, гідроксил, тіол, ацилоксил, азидо, алкоксил, карбоксил, карбоніламідо, S-алкіл або алкілтіол; та R3 або R4 далі можуть охоплювати або представляти зв'язок із В; де Аr може бути зв'язаним із В на будь-якій позиції кільця Аr, незаміщеного R1 та R2, охоплюючи N-позицію, та Аr' може бути зв'язаним із В на будь-якому карбоні кільця Аr', незаміщеного R1' або R2'; або її фармацевтично прийнятна сіль або стереоізомер, за виключенням сполук, коли X - -(СН2)2, Y - -NH2, Z відсутній та Аr' - заміщений гамма-пірон.
2. Сполука за п. 1, де X - -(СН2)n, де n дорівнює 0-6, Y - >NH або >О та Z - >СО.
3. Сполука за п. 2, де Аr' - система кільця альфа-пірону.
4. Сполука за п. 2, де Аr' - система кільця бета-пірону.
5. Сполука за п. 2, де Аr' - система кільця гамма-пірону.
6. Сполука за п. 1, де
X - -(СН2)2-, Y - >NH або >О та Z - >СО,
Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний із R2 та R4 - гідроген;
Аr' - кільце гамма-пірону, зв'язане з Z на позиції 2 кільця пірону; R1' - гідроген або гідроксил на позиції 5 кільця пірону; та R2' - гідроген або карбоксил на позиції 6 кільця гамма-пірону;
або її фармацевтично прийнятна сіль або стереоізомер.
7. Сполука за п. 1, де
X - -(СН2)2-, Y - >NH або >О та Z - >СО;
Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний з R2 та R4 - гідроген;
Аr' - кільце альфа-пірону, заміщене Z на позиції 5 кільця пірону; та кожний R1' та R2' - гідроген;
або її фармацевтично прийнятна сіль або стереоізомер.
8. Сполука за п. 1, де
X - -(CH2)2, Y - >NH та Z - >СО;
Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний із R2 та R4 - Н;
Аr' - кільце гамма-пірону, заміщене Z на позиції 2 кільця пірону; R1'- гідроксил на позиції 5 кільця пірону; та R2' - гідроген;
або її фармацевтично прийнятна сіль або стереоізомер.
9. Сполука за п. 1, де X - -(СН2)2-, Y - >О та Z - >СО;
Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний із R2 та R4 - Н;
Аr' - кільце гамма-пірону, заміщене Z на позиції 2 кільця пірону; R1' - гідроксил на позиції 5 кільця пірону; та R2' - гідроген;
або її фармацевтично прийнятна сіль або стереоізомер.
10. Сполука за п. 1, де X - -(СН2)2-, Y - >NH та Z - >СО;
Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний із R2 та R4 - гідроген;
Аr' - кільце гамма-пірону, заміщене Z на позиції 2 кільця пірону; кожний R1' тa R2' - гідроген;
або її фармацевтично прийнятна сіль або стереоізомер.
11. Сполука за п. 1, де X - -(СН2)2-, Y - >NH та Z - >СО;
Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний із R2 та R4 - Н;
Аr' - кільце альфа-пірону, заміщене Z на позиції 5 кільця пірону; та R1' та R2' - гідроген;
або її фармацевтично прийнятна сіль або стереоізомер.
12. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки, солі або стереоізомера за п. 1 але без виключення у комбінації з одним або більше фармацевтично прийнятними розріджувачами, консервантами, солюбілізаторами, емульгаторами, ад'ювантами, наповнювачами або носіями.
13. Фармацевтична композиція за п. 12, котра характеризується принаймні одною з наступних ознак:
(і) її пристосовано для перорального, ректального, парентерального, інтраназального, вагінального, сублінгвального або місцевого призначення;
(іі) вона є в одиничній формі дозування, кожне одиничне дозування, яке містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1, яка є в діапазоні приблизно 2,5 мкг/кг - 25 мг/кг;
(ііі) вона є композицією подовженого вивільнення, де принаймні одна сполука за п. 1 вивільнюється із призначеною контрольованою швидкістю.
14. Фармацевтична композиція за п. 13, котру пристосовано для перорального призначення та в одиничній формі дозування, де кожна одинична форма дозування містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1 приблизно у діапазоні 0,2 мг - 500 мг.
15. Фармацевтична композиція за п. 14, де кожна одинична форма дозування містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1 приблизно у діапазоні 0,5 мг - 50 мг.
16. Фармацевтична композиція за п. 14, де кожна одинична форма дозування містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1 приблизно у діапазоні 2,5 мг - 20 мг.
17. Фармацевтична композиція за п. 13, котру пристосовано для парентерального або місцевого призначення в одиничній формі дозування, де кожна одинична форма дозування містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1 приблизно у діапазоні 2,5 мкг/кг - 5 мг/кг.
18. Фармацевтична композиція за п. 13, котру пристосовано для парентерального або місцевого призначення в одиничній формі дозування, де кожна одинична форма дозування містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1 приблизно у діапазоні 100 мкг - 100 мг.
19. Фармацевтична композиція за п. 12, де названа композиція є в одиничній формі дозування, та де названа одинична форма дозування надає кількість принаймні одної сполуки, солі або стереоізомера за п. 1, ефективну для лікування або попередження наступного: резистентність до інсуліну, діабет II типу, асоційована з інсультом втрата нейронів, ішемія, травма центральної нервової системи, розлад центральної нервової системи, шкідливі наслідки надстимулювання збуджувальних амінокислот, психіатричні розлади, епілепсія або інший конвульсивний розлад, занепокоєння, розлади сну, хронічний біль, глаукома, ретиніт CMV, енурез або толерантність до опіату або симптомів відміни; індукувальна анестезія; або для підсилення пізнання або індукувальної анестезії.
20. Фармацевтична композиція за п. 12, де названа композиція є в одиничній формі дозування, де названа одинична форма дозування надає кількість сполуки, солі або стереоізомера за п. 1, ефективну для лікування або попередження наступного: імпотенція, серцево-судинний розлад, розлад коагуляції крові, невропатія, базований на хронобіології розлад, запальний розлад, циркадний розлад сну, ендокринний розлад, неопластична хвороба, розлад імунної системи, стан, асоційований зі старінням, офтальмологічна хвороба, приступи головного болю, мігрень, розлад стабілізації діабету або приросту маси; або з метою розмноження тварин.
21. Фармацевтична композиція за п. 12, де названа композиція є в одиничній формі дозування, котра надає кількість сполуки за п. 1 або її солі або стереоізомера, ефективну для лікування або попередження розладу сну, порушення сну або для підвищення якості сну, або для зміни циркадного ритму.
22. Фармацевтична композиція за п. 21, котра, крім того, містить гіпнотичний, анксіолітичний, нейролептичний, седативний засіб, транквілізатор, агоніст або антагоніст мелатоніну, мелатонін, бензодіазепін, барбітурат або антагоніст 5НТ-2.
23. Фармацевтична композиція за п. 12, де названа композиція є в одиничній формі дозування, котра надає кількість сполуки за п. 1 або її солі або стереоізомера, ефективну для лікування або попередження діабету.
24. Фармацевтична композиція за п. 23, котра, окрім того, містить антидіабетичний засіб.
25. Спосіб лікування або попередження наступного: резистентність до інсуліну, діабет II типу, асоційована з інсультом втрата нейронів, ішемія, травма центральної нервової системи, розлад центральної нервової системи, нейродегенеративна хвороба, шкідливі наслідки надстимулювання збуджувальних амінокислот, психіатрична хвороба, епілепсія або інший конвульсивний розлад, занепокоєння, розлад сну, хронічний біль, глаукома, ретиніт CMV, енурез, толерантність до опіату або симптомів відміни; або для індукувальної анестезії; або для підсилення пізнання, який полягає у призначенні тварині або людині при потребі ефективної кількості фармацевтичної композиції, яка містить ефективну кількість сполуки, солі або стереоізомера за п. 1 але без виключення.
26. Спосіб лікування або попередження наступного: імпотенція, серцево-судинний розлад; невропатія, запальний розлад, невропатія, базований на хронобіології розлад, циркадний розлад сну, ендокринний розлад, неопластична хвороба, розлад імунної системи, стан, асоційований зі старінням, офтальмологічна хвороба, приступи головного болю, мігрень, розлад приросту маси; або для регулювання фертильності, статевої зрілості або кольору волосяного покриву як засіб у тваринництві, або для захисту шкіри, який полягає у призначенні тварині або людині при потребі такого лікування композиції, що містить ефективну кількість сполуки, солі або стереоізомера за п. 1 але без виключення.
27. Спосіб для зміни циркадного ритму, для покращення якості сну або для лікування або попередження розладу сну або порушення сну в людини або тварини при їхній потребі, який полягає в призначенні названій людині або тварині композиції, що містить ефективну кількість сполуки, солі або стереоізомера за п. 1 але без виключення.
28. Спосіб за п. 27, де названу композицію призначено в комбінації з відомим засобом, корисним для покращення якості сну, попередження або лікування розладу сну або порушення сну.
29. Спосіб за п. 28, де названий засіб охоплює гіпнотичний, анксіолітичний, антипсихотичний, седативний засіб, транквілізатор, агоніст або антагоніст мелатоніну, мелатонін, бензодіазепін, барбітурат або антагоніст 5НТ-2.
30. Спосіб за п. 27, котрий призначено в комбінації з лікуванням світлом.
31. Спосіб лікування або попередження діабету людини при потребі лікування, котрий полягає в призначенні названій людині композиції, що містить ефективну кількість сполуки, солі або стереоізомера за п. 1, але без виключення.
32. Спосіб за п. 31, де названу композицію призначено в комбінації з відомим антидіабетичним засобом.
33. Спосіб за п. 25, де названа композиція є у формі, придатній для перорального, парентерального, інтраназального, вагінального, ректального, сублінгвального або місцевого призначення.
34. Спосіб за п. 26, де названа композиція є у формі, придатній для перорального, парентерального, інтраназального, вагінального, ректального, сублінгвального або місцевого призначення.
35. Спосіб за п. 25, де названа композиція є в пероральній формі дозування подовженого вивільнення.
36. Спосіб за п. 26, де названа композиція є в пероральній формі дозування подовженого вивільнення.
Текст
Реферат: Заявлений винахід стосується нових похідних піроніндолу, фармацевтичних композицій, що їх містять, застосування сполук у виробництві медикаментів для лікування або попередження різних хвороб. UA 104988 C2 (12) UA 104988 C2 UA 104988 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0001] Ця пріоритетна формула винаходу із заявки на патент США 60/773,322 зареєстрована 15 лютого, 2006. Цю заявку охоплено тут посиланням. [0002] Показано, що альфа та гама-пірони є класами сполук, які пов'язані з кількома біхевіористичними та фармакологічними характеристиками, охоплюючи седативну, анксіолітичну, нейропротективну та антиоксидантну дії. Конкретно показано, що похідне гамапірону, назване малтолом, виділене із пасифлори, спричиняло седацію центральної нервової системи (ЦНС) та зниження індукованої кофеїном ажитації та спонтанної моторики у тварин; ці ефекти опосередковано через активацію рецепторів гама-аміномасляної кислоти (GABA) (Soulimani et al., J. Ethnopharmacology 57:11, 1997; Dhawan et al., J. Ethnopharmacology 78: 16570, 2001). Показано, що інші члени цього сімейства, гама-піронів коменової, меконової та хелідонової кислот впливають на седативні дії через взаємодію з опіоїдними рецепторами (U.S. Patent Application No. 2003/0181516). [0003] Надсімейство рецептору GABAa − один із класів рецепторів, через які діє головний інгібітор нейротрансмітеру GABA. У більшому ступені, хоч і нерівнозначно, ці рецептори, розподілені через мозок ссавця, та, зокрема, комплекс білків, названий рецептором GABA a, спричиняє зміни в провідності хлориду та поляризації мембрани (Mehta та Ticku, Brain Res. Brain Rev. 29:196-217, 1999). [0004] Бензодіазепінові ліки пускають у хід їх гіпнотичні, аналгетичні та анксіолітичні дії взаємодією із сайтами зв'язування бензодіазепіну на рецепторі GABA a. Крім сайту зв'язування бензодіазепіну рецептор GABAa містить кілька відмінних сайтів взаємодії з іншими класами ліків, що модулюють активності GAB Aergic, охоплюючи небензодіазепінові снодійні засоби (наприклад, золпідем, залеплон, індиплон, золпіклон) (Sanger, CNS Drugs 18 (Suppl. 1):9-15, 2004), стероїди, пітротоксин та барбітурати. Бензодіазепін та несайти зв'язування бензодіазепіну у комплексі рецептору GABAa не перекриваються з GABA або будь-якими іншими сайтами зв'язування ліків (дивись, наприклад, Cooper, et al., The Biochemial Basis of Neuropharmacology, 6th ed., pp. 145-148, Oxford University Press, New York, 1991). Електрофізіологічні дослідження показують, що головною дією бензодіазепінів та небензодіазепінів є підсилення GAB Aergic-інгібування нейронального збудження. Це є наслідком потенціювання притоку в клітини індукованого GABA хлориду та потім − гіперполяризації мембрани. Клінічно важливою алостеричною модуляцією рецепторів GABA бензодіазепінами та небензодіазепінами була простором інтенсивного фармакологічного відкриття в останні роки. Відомо, що агоністи, що діють на сайт бензодіазепіну, проявляють анксіолітичну, седативну та гіпнотичну дії, тоді як сполуки, що діють як інверсні агоністи при цьому сайті, виявляють анксіогенну дію, виявляють підсилення пізнавальної та проконвульсивної дії (Dawson et al., CNS Spectr. 10:21-7,2005). [0005] Головними розладами, при котрих рецептори GABAa є важливою терапевтичною метою, охоплюють розлади занепокоєння, пізнавальні розлади, епілепсія, розлади настрою, шизофренія, розлади болю та сну. Відомо, що модулятори рецептору GAB а грають важливу роль для сну, та позитивні алостеричні модулятори рецепторів GABA a широко застосовуються для стимулювання та підтримування сну при різноманітних первинних та вторинних розладах сну (Sanger, ЦНС Drugs, 18 (Suppl. 1):9-15, 2004). [0006] Тоді як бензодіазепіни мають довгу історію фармацевтичного застосування як анксіолітики, ці сполуки часто проявляють кілька небажаних побічних дій. Це може охоплювати погіршення пізнання, седацію, атаксію, потенціювання дій етанолу, збільшення ризику падіння та тенденцію до толерантності та залежності від ліків. Важливим аспектом цих активностей є залишкова дія в денний час, яка виражається в порушенні бадьорості в денний час. Отже, нові модулятори рецептора GABА мають менші несприятливі побічні дії. [0007] Сполуки індолу, конкретно це стосується серотоніну (5-гідрокситриптаміну; 5-HT) та мелатоніну (N-ацетил-5-метокси-триптаміну), мають глибокі дії на ЦНС та, таким чином, вторгаються в сон, безсоння, апетит та настрій. Існує велика кількість клінічно важливих сфер діяльності, де продемонстровано залучення системи мелатоніну (Bubenik et al., Biol. Signals Recept. 7:195-219, 1998). Вони охоплюють регулювання середньої температури тіла (Strassman et al., J. Appl. Physiol. 71:2178-2182, 1991; Krauchi et al., J. Appl. Physiol. 83:134-9, 1997), імунні відгуки, (Maestroni та Conti, J. Neuroimmun. 28:167-176 1990; Fraschini et al., Acta Oncol. 29:775776, 1990; Guerrero and Reiter, Endocr. Res. 18:91-113, 1992), пубертатний розвиток, овуляцію, сезонну репродукцію, заочеревинний та епідидимальний жир, а також інсулін плазми, лептин, гормон росту та рівні греліну (Rasmussen et al., Endocrinology 140: 1009-12, 1999; Cramer et al., Arzeneim-Forsch 26:1076-1078,1976; Wright et al, Clin. Endocrinol. 24:375-382, 1986, Paccotti et al, Chronobiologia 15:279-288, 1988; Valcavi et al, Clin. Endocrinol. 39:139-199, 1993; Mustonen et al., Endocrine 16:43-6, 2001), ритми кортизолу, очний тиск (Sampes et al. Curr. Eye Res. 7:649-653, 1 UA 104988 C2 5 10 15 20 25 30 35 40 45 50 55 60 1988; Rhode et al., Ophthalmic Res. 25:10-15, 1993), тиск крові (Scheer et al., Hypertension 43-1927, 2004), метаболізм глюкози, греліну, лептину та маси жиру тіла, вазопресин та екскрецію сечі (Song et al., FASEB J. 11:93-100, 1997; Yasin et al., Мозок Res. Bull. 39:1-5, 1997). У деяких випадках психіатричні розлади можуть мати в основі хронобіологічні етіології (наприклад, сезонний ефективний розлад), та є певними кандидатами для мелатонінової терапії (Miller, Altern. Med. Rev. 10:5-13, 2005). Мелатонін також діє як поглинач вільного радикалу та антиоксидант (Pooggeler et al., J. Pineal Res. 14:151-168, 1993). [0008] Є дуже потужні дані, при яких мелатонін конкретно регулює сон та безсоння в людей. Мелатонін призначали для ресинхронізації циркадних ритмів, які є поза фазою локальних фотоперіодичних циклів. Наприклад, розлади сну/пробудження, спричинені швидким схрещуванням зон часу (порушенням добового ритму організму), синдромом затриманої фази сну (DSPS) у пацієнтів, роботою за змінами та повною сліпотою, можна лікувати мелатоніном або аналогами мелатоніну (дивись U.S. Patents Nos. 4,600,723 та 4,666,086 °F Short et al. та 5,242,941 °F Lewy et al.). Крім того, мелатонін орієнтує седативні/гіпнотичні властивості у звичайних людей та у тих, які потерпають від безсоння (наприклад, Luboshizsky et al., Sleep Med. Rev. 2:191-202, 1998; U.S. Patent No. 5,403,851, D'Orlando et al). Показано, що розлади сну у літніх реагують на лікування мелатоніном (Garfinkel et al., Lancet 346:541-543, 1995; PandiPerumal et al., Exp. Gerontol. 40:911-25, 2005; U.S. Patent No. 5,498,423 °F Zisapel). Мелатонін та його аналоги зменшують появу латентності до сну у тих пацієнтів, що потерпають від безсоння (Roth et al., Сну, 28:303-7, 2005, Zhdanova et al., Clin. Pharmacol. Ther. 57:552-8, 1995) або депресії (Papp et al, Neuropsychopharmacology 28:694-703, 2003), та дуже підсилюють відновлення сну в тих пацієнтів, що потерпають від безсоння, що призводить до покращення добового безсоння (Zisapel, PCT Patent application No. WO 03/015690). [0009] Існує широкий спектр симптоматичних відгуків на лікування мелатоніном при різних розладах. Вони охоплюють занепокоєння (Loiseu et al., Eur. Neuropsychopharmcol. 2005), пароксизми (Munoz-Hoyos et al., J. Child. Neurol. 13:501-9, 1998), біль (Ray et al., Indian J. Med. Sci. 58:122-30, 2004), приступи головного болю та мігрень (Peres, Cephalalgia 25:403-11, 2005), депресію, манію та шизофренію (дивись Dobocovich "Antidepressant Agents", U.S. Patent No. 5,093,352; Shamir et al., J. Clin. Psychophannacol. 20:691-4, 2000), глаукому, старіння, стрес (Armstrong та Redman, Med. Hypotheses 34:300-309, 1991; Reiter, Bioassays 14: 169-175, 1992), гіпертензію (Scheer et al, Hypertension 43:192-7, 2004, Zisapel, U.S. Patent Application No. 10/169,467), синдроми скасування ліків (Zisapel, U.S. Patent No. 6,469,044), остеопороз (Cardinali et al, J. Pineal Res. 34:81-7, 2003), різні раки (Gonzalez et al., Melanoma Res. 1:237-243, 1991; Lissom et al., Eur. J. Рак 29A:185-189, 1993; Blask et al, Endocrine 27:179-88, 2005; U.S. Patents Nos. 5,196,435 °F Clemens et al. та 5,272,141 °F Fraschini et al), доброякісні пухлини та проліферативні хвороби, як-то доброякісна гіперплазія простати (BPH) (U.S. Patent No. 5,750,557 та European Patent No. EP 0565296B of Zisapel), псоріаз, контрацепцію та фертильність, передчасну статева зрілість, передменструальний синдром та гіперпролактинемію (Pevre et al., J. Clin. Endocrinol. Metab. 47:1383-1388, 1978; Puny et al, Am. J. Psychiatry 144:762-766,1987; Waldhauser et al., Clin. Endocrinol. Metab. 73:793-796,1991; Bispink et al., J. Pineal Res. 8:97-106, 1990; Ca'gnacci et al., J. Clin. Endocrinol. Metab. 73:210-220, 1991; Voordouw et al, J. Clin. Endocrinol. Metab. 74:10-108, 1992; дивись U.S. Patents Nos. 4,855,305 та 4,945,103 °F Cohen et al. та 5,272,141 °F Fraschini et al.). [0010] Мелатонін є корисним для лікування та запобігання нейродегенеративних розладів (Skene et al., Brain Rev. 528:170-174,1990; Feng et al, J. Pineal Res. 37:129-36, 2004), ішемічного інсульту (Cho et al, Brain Research 755:335-338,1997; Reiter et al, Exp. Biol. Med. 230:104-17, 2005), хвороби Альцгеймера (Pappola et al., J.Neurosci. 17:1683-90, 1997; Feng та Zhang, Free Radio. Biol. Med. 37:1790-801, 2004) та синдрому раптової смерті дитини (SIDS) (U.S. Patent No. 5,500,225 °F Laudon et al.). [0011] Поки ідентифіковано три підтипи рецептору мелатоніну: MT-1, MT-2 та дигідронікотинамід рибозид-хінонредуктазу 2, яку інколи відносять до рецепторів мелатоніну MT-3 або ML2 (Dubocovich et al., IUPHAR media, London, UK, 187-93, 1998; Maillet et al, FEBS Lett. 3:578-116-20, 2004). MT-1 локалізовано в ЦНС та в периферійних органах, як-то нирки та сечостатевий тракт, тоді як MT-2 локалізовано, переважно, у центральній нервовій системі. Відсутня фізіологічна активність, яку приписують сайтам MT-3 (ML2). Крім того, мелатонін взаємодіє з внутрішньоклітинними білками, як-то кальмодулін (Anton-Tay et al., J. Pineal Res. 24:35-42, 1998) та тубулін-асоційовані білки (Cardinali et al., J. Pineal Res. 23:32-9, 1997). Особливості затримки радіоактивного мелатоніну, інжектованого щурам, показують акумуляцію мелатоніну в мозку, гіпофізі, легенях, серці, гонадах та придаткових статевих органах (Withyachumnarnkul et al, Life Sci. 12:1575-65,1986). 2 UA 104988 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0012] Ясно, що існує широкий діапазон терапевтичних застосувань мелатоніну та його аналогів. Таким чином, триває зацікавленість у ідентифікації нових сполук, що взаємодіють із мелатонінергічними системами як потенційними терапевтичними засобами (Zlotos, Arch. Pharm. Chem. Life Sci. 338:229-247, 2005). Ці сполуки можуть надавати довший термін дії, селективну локалізацію та більшу ефективність щодо цього мелатоніну. [0013] Тепер відомо, що серотонін (5-HT) модулює численні фізіологічні та поведінкові системи, що пояснюють застосуванням багатьох базованих на 5-HT ліків для лікування дуже відмінних клінічних станів. Це − екстенсивне терапевтичне лікування, спрямоване на збільшення або зменшення функції 5-HT на вибраних сайтах у широко відмінних клінічних станах. Дослідження круговороту речовини 5-HT у ЦНС та периферійній тканині мають демонструвати зміни в метаболізмі 5-HT, асоційовані із широким розмаїттям клінічних станів, і показано, що багато ліків, як-то антидепресанти, протипсихотичні засоби та анксіолітики, змінюють функцію 5-HT у кількох розладах. Розвиток та широке розповсюдження клінічного застосування селективних інгібіторів перепоглинання 5-HT (SSRI) та передклінічного визначення численних підтипів рецептору 5-HT та їх поєднання із внутрішньоклітинними посередниками систем, та розвиток ліків, що селективно діють на ці системи, мають каталізувати бурхливий розвиток нової дослідницької інформації в цій галуззі. Тепер ясно, що системи 5-HT є дуже різноманітними, і вони охоплюють множину фізіологічних та поведінкових способів. Навпаки, розвиток конкретних агоністів та антагоністів рецептору 5-HT ведуть до більш конкретних цільових терапевтичних втручань, як-то застосування агоністу 5-HT суматриптину при мігрені та приступах головного болю, та антагоністу 5-HT3 ондансетрону для контролю нудоти та блювання. [0014] Існує велика кількість клінічно придатних зон, де показано залучення системи 5-HT. Вони охоплюють регулювання наступного: настрій, страх та занепокоєння, навчання та пам'ять, контроль пізнання, апетит та регулювання прийняття їжі, сон, статева функція, контроль імпульсу, регулювання поведінки розвитку, старіння та нейродегенерація, мотивація та заохочення, чутливість до болю, блювання, міоклонус, нейроендокринне регулювання, регулювання циркадного ритму, відгук на стрес та карциноїдний синдром. [0015] Існує широкий спектр симптоматичних відгуків на лікування селективним інгібітором перепоглинання серотоніну (SSRI) у різних розладах. Підвищена придатність кількості SSRI для клінічного застосування надає досвід лікування різноманітних відмінних клінічних станів. Дослідження регульованого плацебо показали позитивні результати лікування SSRI при наступному: депресія, обсесивно-компульсивний розлад (OCD), панічний розлад, передменструальний синдром, нейрогенна булімія, розлад при аутизмі, діабетична невропатія та ожиріння при діабеті. Повідомлено, що широкий спектр різних клінічних станів показують симптоматичний відгук на лікування SSRI, що охоплює найбільш важливе наступне: депресія, депресія, яка є вторинною до медичного стану, депресія після інсульту, психічна депресія, сезонний афективний розлад, OCD, панічний розлад, соціальна фобія, пограничний розлад особистості, синдром деперсоналізації, дисморфічний синдром організму, передменструальний синдром, розлади після пологів, нейрогенна булімія, стресовий розлад після травми, розлад при аутизмі, дефіцит уваги, розлад з гіперактивністю, синдром Туретта, трихотиломанія, оніхофагія, синдром Прадера-ВІллі, парафілія та статеві пристрасті, проспермія, профілактика мігрені, діабетична невропатія, больові синдроми, ожиріння, зростання маси у курців, алкоголізм, емоційна лабільність після травми головного мозку, параліч сну, патологічна підозрілість, хронічна шизофренія, поведінка з членоушкодженням, артрит, феномен Рейнауда, фіброміалгія, синдром хронічної утоми, синдром подразненого кишечнику, непритомність при відхиленні від вертикального стану, інтенційна міоклонія та нейроендокринне регулювання. [0016] Передклінічні дані 5-HT показують, що системи 5-HT переважно є модулювальними та, що найбільші ефекти 5-HT взаємодіють з існуючим станом інших залучених нейротрансмітерних систем. Нейроанатомія системи 5-HT свідчить, що при синапсах відсутня секреція 5-HT до 60 % або більше. Таким чином, не очікується, що дії 5-HT анатомічно ретельно локалізовані або, що вони демонструють властивості, асоційовані із системами, що більш безпосередньо опосередковують нейротрансмісію. Модулювальну природу систем 5-HT на клінічному рівні можна бачити через взаємодії з іншими системами нейротрансмітеру. У поведінці тварин активність серотонінергічних нейронів мозку щільно пов'язана з періодом пробудження, як-то найвища швидкість збудження протягом активного неспання або пробудження, проміжний рівень розвантаження протягом станів покою та повільно-хвильового сну, та віртуальна пауза протягом швидкого руху очей уві сні. Деякі сполуки SSRI асоційовано з несприятливою втратою маси або надмірним приростом маси в тих, які потерпають від безсоння, та статевою дисфункцією. 3 UA 104988 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0017] Широке розповсюдження залучення систем 5-HT у модулювання фізіологічних функцій великої кількості різних важливих біологічних систем, сполучних зі швидким прогресом досягнення молекулярної біології у відкритті нових підтипів рецептору 5-HT повинне сприяти зростанню дослідницької активності, спрямованої на розвиток клінічно придатних модуляторів 5-HT, що може забезпечувати іншими фармакологічними властивостями для того, щоб оптимізувати параметри застосування ліків для клінічної дії. [0018] Нові сполуки стосовно мелатоніну або серотоніну та піронів, але з фармакологічними або фармакокінетичними профілями, відмінними від цих молекул, можливо є важливими новими фармацевтичними препаратами. Наприклад, дивись U.S. Patent No. 5,403,851, котрий розкриває застосування заміщених триптамінів, фенілалкіламінів та стосується сполук для лікування ряду фармацевтичних показань, охоплюючи розлади сну, ендокринні показання, розлади імунної системи т.д. PCT Patent Application No. WO 87/00432 розкриває композиції для лікування або попередження псоріазу, що містять мелатонін або споріднені сполуки. U.S. Patent No. 5,122,535 розкриває продукування мелатоніну та його аналогів для різних терапевтичних призначень, охоплюючи призначення мелатоніну в комбінації з азидотимідином для лікування СНІД. Аналоги мелатоніну, базовані на біоізостеричних властивостях кільця нафталіну та кільця індолу, розкрито в J. Med. Chem. 1992, 35: 1484-1485, EP 662471 A2 950712 °F Depreux et al., WO 9529173 Al 951102 °F Ladlow et al, U.S. Patents Nos. 5,151,446 °F Horn et al., 5,194,614 °F Adrieux et al. та 5,276, 051 °F Lesieur et al. Мелатонін та його аналоги можуть потенціювати дії модуляторів рецептору GAB (Zisapel, U.S. Patent application No. US20055175692, Zisapel, U.S. Patent No. 6,469,044). [0019] Резистентність до інсуліну та незалежний від інсуліну діабет є поширеними в 35 % населення залежно від віку та природи субпопуляції. У Сполучених Штатах Америки 16 мільйонів людей мають діабет 2 типу та 13 мільйон мають послаблену толерантність до глюкози. Фактично, діабет 2 типу досягає епідемічних відсотків розповсюдження у світі. Установлено, що до 2025 року 300 мільйонів людей повинні мати діабет, найбільшу складову буде мати населення Китаю, Індії та Сполучених Штатів Америки. Внаслідок старіння та збільшення міри сидячого способу життя, ожиріння населення, небезпечних дієт резистентність до інсуліну також небезпечно збільшується (це вже є у два − три рази більш поширеним ніж діабет 2 типу). [0020] Резистентність до інсуліну, звичайно, виникає на початку розвитку діабету 2 типу. Змінений баланс в автономній нервовій системі та в певних ендокринних та запальних шляхах могли сприяти розвитку резистентності до інсуліну. Гіперглікемія при діабетах далі погіршує резистентність до інсуліну, а також дисфункцію бета-клітин, але механізми, що спричиняють це явище, тобто глюкотоксичність, не є повністю зрозумілими. Резистентність до інсуліну можна виявити при першому ступені спорідненості до діабету 2 типу в здорових пацієнтів, які також мають високий ризик розвитку діабету 2 типу. [0021] Гіперглікемія натощак при діабеті 2 типу виникає в присутності гіперінсулінемії; це відображує наявність резистентності до інсуліну в печінці з утворенням у результаті гликогенозу та гликонеогенезу. Крім послаблення супресії інсуліну на продукування печінкової глюкози, зменшене поглинання опосередкованої інсуліном глюкози клітинами м'язу вносить до гіперглікемії внесок у результаті, приблизно, 50 %. [0022] Толерантність до глюкози зменшується з віком внаслідок наступного: 1) збільшена резистентність до інсуліну рецептору клітини; 2) внутрішньоклітинні пострецепторні порушення та 3) зменшена чутливість панкреатичних острівців β-клітин до інсуліну та глюкози. Резистентність до інсуліну зі вторинною гіперінсулінемією та/або гіперглікемією сприяє багатьом розладам, асоційованим зі старінням, тобто, гіпертензії, ожирінню, атеросклерозу, ліпідним аномаліям, коагулопатіям та хронічним метаболічним порушенням, охоплюючи діабет 2 типу. Інсулін є одним із найбільш важливих анаболічних гормонів в організмі, і це є критичним для контролю метаболізму вуглеводу, ліпіду та білку. Інсулін секретується з бета клітин у ендокринну підшлункову залозу. Він діє зв'язуванням до трансмембранного інсулінового рецептору в клітинах-мішенях, і це активує домен тирозинкінази у внутрішньоклітинній частині рецептору, що призводить до фосфорилування субстратів інсулінового рецептору (IRS). Це запускає каскад сигнальних реакцій у клітині, що призводить до метаболічних дій. Головними цільовими тканинами метаболічної дії інсуліну є тканин м'язів, печінки та жиру. Інсулін стимулює поглинання глюкози в чутливих до інсуліну тканинах, переважно кістякового м'язу, і це інгібує продукування глюкози в печінці й стимулює накопичення глікогену в печінці та кістяковому м'язі. Це стимулює постачання неетерифікованих жирних кислот (NEFA) до жирової тканини, де вони зберігаються як тригліцериди, і ліполіз у жирових клітинах інгібується. Взагалі, синтез повного білку збільшується. 4 UA 104988 C2 5 10 15 20 25 30 35 40 45 [0023] Згідно з останніми дослідженнями вважається, що існує висока експресія фактору-α (TNF-α) цитокіну некрозу пухлин в адипоцитах гладких осіб, та, що TNF-α є головним діючим фактором щодо резистентності до інсуліну та ожиріння при діабеті 2 типу. TNF-α є важливим регулятором процесів апоптозу, і, таким чином, модулює об'єм пухлини, жирових та м'язових тканин. Його продукують не тільки імунокомпетентні клітини, але також адипоцити та клітини м'язів. Цей цитокін активується серед інших станів при пухлинах та ожирінні. TNF-α стимулює резистентність до інсуліну та анорексію дією на фосфорилування IRS-1 та фосфатидилінозитол 3-кінази (PI-3) модифікуванням резистентності через регулювання синтезу транспортеру залежної від інсуліну глюкози GLUT4 та через інтерференцію зі сигналізацією інсуліну (можливо через лептин). [0024] Незалежно від причини резистентність до інсуліну асоційовано із широким розповсюдженням та шкідливими діями на здоров'я. Це є правдивим, навіть, якщо толерантність до глюкози є тільки помірно послабленою й не знаходиться в явному діабетичному діапазоні. Значною серед шкідливих дій є схильність до васкулярної хвороби, що вражає великі кровоносні судини та пов'язана з гіпертензією та дисліпідемією (підвищення тригліцеридів та зниження HDL). Фактично комбінації наступного: 1) нетерпимість до глюкози, 2) резистентність до інсуліну, 3) гіпертензія та 4) дисліпілемія, у цілому, є достатніми для отримання назви синдрому X, синдрому резистентності до інсуліну або синдрому Reaven's. Клінічно це визначає межи розповсюдження в сотень мільйонів людей. [0025] Приймаючи до уваги вищезгадане обговорення, похідні пірон-індолу були б придатними для терапевтичного застосування при різних хворобах та станах, конкретно асоційованих із мелатоніном, 5-HT, інсуліном та розрегулюванням GABA. Заявлений винахід стосується терапевтично покращених сполук більше ніж для модулювання тільки одного із цих класів. Такий засіб, що діє як рецептор агоністів/антагоністів MT-1 та MT-2 або серотоніну з додатковими властивостями модуляції рецептору GABА, може надати нові ліки, але без обмеження, із седативною дією з додатковими клінічними перевагами, як-то покращення сну з корисними діями на добове безсоння. Внаслідок цього унікального способу дії ці засоби не повинні проявляти типових побічних дій стосовно бензодіазепінів, як-то симптоми толерантності до ліків та припинення дії ліків. [0026] Крім того, заявлений винахід спрямовує потреби в нових мелатонінергічних похідних, що впливають на резистентність до інсуліну та діабет ІІ типу. [0027] Повний уміст вищезгаданих патентів, патентних посилань та статей із літератури охоплено тут посиланням. [0028] Винахід стосується сполук, що мають формулу (I): Ar-B-Ar' (I) де: B −: -X-Y-Z-, де X − -(CH2)n- (де n дорівнює 0-6), де алкіл − лінійний або розгалужений, Y − оксисен, сульфур, >NH або є відсутнім, Z − >C=О, >О, >COO або є відсутньою, де принаймні, одна з X, Y та Z повинна бути присутньою; Ar − система центрального кільця індолу Ar' − система центрального кільця альфа-, бета- або гама-пірону: 5 UA 104988 C2 5 10 15 20 25 30 35 40 45 де кожний із замісників R1-4 кільця Ar на будь-якій доступній позиції (охоплюючи N-позицію) та кожний із замісників R1’-2" кільця Ar' на будь-якій доступній позиції, та де кожний з R 1-4 та R1’-2" незалежно − гідроген, оксиген, галоген, галоген-C1-5 алкіл, арил, ацил, C5-7 гетероцикл, що містить 1-3 гетероатоми, незалежно вибрані з наступного: нітроген, оксиген та сульфур; C 6-8 гетероарил, що містить 1-3 гетероатоми, незалежно вибрані з наступного: нітроген, оксиген або сульфур; C1-5 алкіл, C2-5 алкеніл, C2-5 алкініл, арил-С1-5 алкіл, арил-C2-5 алкеніл, арил-C2-5 алкініл, гідрокси-C1-5 алкіл, нітро, аміно, ціано, ціанамідо, гуанідино, амідино, ациламідо, C 1-5 алкіламін, C1-5 алкіламідо, гідроксил, тіол, ацилоксил, азидо, C 1-5 алкоксил, карбоксил, карбоніламідо або стирил; де названі арилалкіл, арилалкеніл, арилалкініл або стирил необов'язково можуть бути заміщеними в кільці 1− 4 замісниками, незалежно вибраними з наступного: гідроген, галоген, галоген-С1-5 алкіл, арил, C5-7 гетероциклічна група, що містить 1-3 гетероатоми, незалежно вибрані з наступного: нітроген, оксиген або сульфур; гетероарил, що містить 1-3 гетероатоми, незалежно вибрані з наступного: нітроген, оксиген та сульфур; C 1-5 алкіл, C2-5 алкеніл, C2-5 алкініл, арил-C1-5 алкіл, арил-C1-5 алкеніл, арил-C2-5 алкініл, гідрокси-C1-5 алкіл, нітро, аміно, ціано, ціанамідо, гуанідино, амідино, ациламідо, гідроксил, тіол, ацилоксил, азидо, алкоксил, карбоксил, карбоніламідо, S-алкіл або алкілтіол; та R3 або R4 далі можуть охоплювати або представляти зв'язок із B; де Ar може бути зв'язаним із B на будь-якій позиції кільця Ar, незаміщеного R1 та R2, охоплюючи N-позицію, та Ar' може бути зв'язаним із B на будь-якому карбоні кільця Ar', незаміщеного R1" або R2"; або їх фармацевтично прийнятну сіль або стереоізомер. [0029] Як тут застосовано, "арил" − феніл або нафтил. [0030] Без упередження щодо більшості сполук заявленого винаходу, підгрупу переважних тепер сполук визначено таким чином, що у формулі (I), X − -(CH2)2-, Y − >NH або >О, Z − >C=О, Ar − індол, що містить зв'язок R3 із X на позиції 3 кільця індолу, R1 − метоксил на позиції 5 кільця індолу, кожний з R2 та R4 − гідроген, та (a) Ar' − гама-пірон, зв'язаний із Z на позиції 2 кільця пірону, R1" − гідроген або гідроксил на позиції 5 кільця пірону, та R 2" − гідроген або карбоксил на позиції 6 кільця гама-пірону, або (b) Ar' − кільце альфа-пірону, зв'язане із Z на позиції 5 кільця пірону, кожний R1" та R2" − гідроген на позиціях 3, 4 або 6 кільця пірону; або їх фармацевтично прийнятна сіль або стереоізомер. [0031] У межах заявленого винаходу також охоплено фармацевтичні композиції, що містять як активну речовину терапевтично ефективну кількість сполуки формули (I), або її фармацевтично прийнятної солі, а також будь-який стереоізомер за формулою (I) у асоціації з одним або більше фармацевтично прийнятними розріджувачами, консервантами, солюбілізаторами, емульгаторами, ад'ювантами, наповнювачами або носіями, звичайно застосованими у фармацевтичних та ветеринарних композиціях. Представлену фармацевтичну композицію можна застосовувати для призначення людям та/або тваринам. [0032] Сполуки формули (I) є корисними для лікування та/або попередження, та/або мінімізації резистентності до інсуліну, та наступного: діабет типу II, втрата нейронів, асоційована з інсультом, ішемія, травма центральної нервової системи (ЦНС), розлади ЦНС, охоплюючи нейродегенеративні хвороби (як-то хвороба Альцгеймера, бічний аміотрофічний склероз (ALS), хвороба Хантингтона, хвороба Паркінсона та синдром Дауна); лікування або попередження шкідливих наслідків зверхподразнення збуджувальних амінокислот; лікування або попередження психіатричних розладів, епілепсія та інші конвульсивні розлади, занепокоєння, розлади сну, охоплюючи тих, що потерпають від безсоння, психіатричні хвороби (наприклад, депресія, психоз), хронічний біль (аналгезія), глаукома, цитомегаловірусний (CMV) ретиніт та 6 UA 104988 C2 5 10 15 20 25 енурез, та індукувальна анестезія, а також підсилення пізнання, та попередження і лікування толерантності до опіату та симптомів скасування. [0033] Шляхом подальшої розробки або пояснення станів, котрі тепер розглядаються, їх можна робити доступними для лікування призначенням представлених сполук, такі стани охоплюють наступне: імпотенція; серцево-судинні розлади (охоплюючи гіпертензію); розлади коагуляції крові; запальні розлади; невропатія; розлади, базовані на хронобіології (наприклад, порушення добового ритму організму); циркадні розлади сну (як-то синдром затриманого сну, проблеми при роботі за змінами та сезонні розлади, наприклад, сезонний афективний розлад (SAD)); ендокринні показання (наприклад, контрацепція та безплідність, передчасна статева зрілість, передменструальний синдром, гіперпролактинемія та недостатність гормону росту); неопластичні хвороби (охоплюючи рак та інші проліферативні хвороби (зростання доброякісної та злоякісної пухлини простати)); розлади імунної системи, охоплюючи СНІД; стани, пов'язані зі старінням; офтальмологічні хвороби; приступи головного болю; мігрень; захист шкіри; стабілізація діабету та розлади приросту маси (лептин, ожиріння); для захисту шкіри та як засіб у тваринництві (наприклад, регулювання фертильності, статевої зрілості та кольору волосяного покриття). [0034] Цей винахід стосується сполук, що мають формулу (I): Ar-B-Ar' (I) де: -B- є: X-Y-Zде X − -(CH2)n- (де n дорівнює 0-6), де алкіл − лінійний або розгалужений, Y − оксиген, сульфур, >NH або є відсутньою; Z − >C = О, або >О, або >COO або є відсутньою; де принаймні, одна з X, Y та Z повинна бути присутньою;: кільцева система Ar − цикл індолу: 30 кільцева система Ar' − цикл альфа-, бета- або гама-пірону 35 40 де кожний із замісників R1-4 кільцевої системи Ar на будь-якій доступній позиції (охоплюючи N-позицію), кожний з R1’-2" замісників кільцевої системи Ar' на будь-якій доступній позиції та, де кожний з R1-4 та R1’-2" незалежно представляють гідроген, оксиген, галоген, галоген-C1-5 алкіл, арил, ацил, C5-7 гетероцикл, що містить 1-3 гетероатоми, незалежно вибрані з наступного: 7 UA 104988 C2 5 10 15 20 25 30 35 40 45 50 55 60 нітроген, оксиген та сульфур; C6.8 гетероарил, що містить 1-3 гетероатоми, незалежно вибрані з наступного: нітроген, оксиген та сульфур; C1-5 алкіл, C2-5 алкеніл, C2-5 алкініл, арил- C1-5 алкіл, арил-C2-5 алкеніл, арил-C2-5 алкініл, гідрокси-C1-5 алкіл, нітро, аміно, ціано, ціанамідо, гуанідино, амідино, ациламідо, C1-5 алкіламін, C1-5 алкіламідо, гідроксил, тіол, ацилоксил, азидо, C1-5 алкоксил, карбоксил, карбоніламідо або стирил; де названі арилалкіл, арилалкеніл, арилалкініл, або стирил необов'язково може бути кільцем, заміщеним 1 − 4 замісниками, незалежно вибраними з наступного: гідроген, галоген, галоген-C1-5 алкіл, арил, C5-7 гетероцикл, що містить 1-3 гетероатоми, незалежно вибрані з наступного: нітроген, оксиген та сульфур; гетероарил, що містить 1-3 гетероатоми, незалежно вибрані, незалежно вибрані з наступного: нітроген, оксиген та сульфур; C1-5 алкіл, C2-5 алкеніл, C2-5 алкініл, арил-C2-5 алкеніл, арил-C2-5 алкініл, гідрокси-C1-5 алкіл, нітро, аміно, ціано, ціанамідо, гуанідино, амідино, ациламідо, гідроксил, тіол, ацилоксил, азидо, алкоксил, карбоксил, карбоніламідо, S-алкіл або алкілтіол; та R3 або R4 далі можуть охоплювати або представляти зв'язок із B; де Ar може бути зв'язаним із B на будь-якій позиції на кільці Ar, не заміщеному R1 та R2, охоплюючи N-позицію, та Ar' може бути зв'язаним із B на будь-якому карбоні кільця Ar', не заміщеному R1" або R2"; або їх фармацевтично прийнятної солі або стереоізомеру. [0035] Як тут застосовано, "арил" − феніл або нафтил. [0036] Також як тут застосовано, посилання на "a"-сполуку, сіль або стереоізомер формули (I) призначено охоплювати "одну або більше" таких сполук, солей або стереоізомерів. Крім того, посилання на a-"сполуку" формули (I), як у розглянутих нижче фармацевтичних композиціях, також призначено охоплювати сіль або стереоізомер сполуки. [0037] У переважному втіленні X − -(CH2)n-, де n дорівнює будь-якій з 0-6, та краще − будьякій з 1-6, Y − >NH або >О та Z − >CO. [0038] Без упередження до більшості сполук заявленого винаходу у переважному втіленні сполуку визначено формулою (I), X − -(CH2)2., Y − >NH або >О, Z − >C=О, Ar − індол, що містить зв'язок R3 із X на позиції 3 кільця індолу, R1 − метоксил на позиції 5 кільця індолу, кожний із R2 та R4 − гідроген, Ar' − гама-пірон, зв'язаний із Z на позиції 2 кільця пірону, R1" − гідроген або гідроксил на позиції 5 кільця пірону та R2" − гідроген або карбоксил на позиції 6 кільця гамапірону; або її фармацевтично прийнятну сіль або стереоізомер. У другому переважному втіленні Ar − як визначено вище, та Ar' − кільце альфа-пірону, зв'язане з Z на позиції 5 кільця альфа, пірону, R1" та R2" − гідрогени; або її фармацевтично прийнятні сіль або стереоізомер. [0039] Заявлений винахід також охоплює у своїх межах отримання композицій, що містять сполуку формули (1), де композиції є корисними як медикаменти. Фармацевтичні композиції містять як активну речовину терапевтично ефективну кількість сполуки формули (I) або її фармацевтично прийнятної солі, а також будь-який стереоізомер, охоплений формулою (I); у асоціації з одним або більше фармацевтично прийнятними розріджувачами, консервантами, солюбілізаторами, емульгаторами, ад'ювантами, наповнювачами та носіями, які звичайно застосовують у фармацевтичних та ветеринарних композиціях. Заявлені фармацевтичні композиції можна застосовувати для призначення людям та/або тваринам. [0040] Фармацевтичні композиції згідно з винаходом краще характеризувати принаймні, одною з наступних ознак: (i) їх пристосовано до наступних шляхів призначення: пероральний, парентеральний (наприклад, внутрішньом'язовий, інтраперитонеальний, внутрішньовенна або підшкірна ін'єкція або уведення), інтраназальний, вагінальний, ректальний, сублінгвальний або місцевий, та їх можна формувати у формах дозування, придатних для кожного призначеного шляху; (ii) вони є в одиничній формі дозування, кожне одиничне дозування, що містить кількість, принаймні, одної сполуки формули (I), що є в діапазоні, приблизно, 2,5 мкг − 25 мг/кг маси тіла; (iii) вони є композицією подовженого вивільнення, де принаймні одна сполука формули (I) вивільнюється із призначеною контрольованою швидкістю. [0041] Далі композиції характеризуються тим, що їх можна призначати окремо або в комбінації з або в поєднання з іншими сполуками, котрі відомі в рівні техніки як корисні для запобігання та лікування розладів центральної нервової системи (ЦНС) та метаболічних розладів, охоплюючи, але без обмеження, нейродегенеративні хвороби, розлади сну, резистентність до інсуліну та діабет типу II. [0042] Придатні фармацевтично прийнятні солі сполук формули (I), які можна застосовувати згідно із заявленим винаходом, охоплюють солі котрі, наприклад, можна формувати змішуванням розчину сполуки з розчином фармацевтично прийнятної нетоксичної кислоти, якто хлоридна кислота, фумарова кислота, малеїнова кислота, бурштинова кислота, оцтова кислота, лимонна кислота, винна кислота, карбонатна кислота, фосфатна кислота або 8 UA 104988 C2 5 10 15 20 25 30 35 40 45 50 55 60 сульфатна кислота. Солі аміногрупи також можуть містити четвертинні солі амонію, де атом нітрогену аміну несе алкіл, алкеніл, алкініл або arалкіл. Де сполука має кислоту групу, наприклад, групу карбонатної кислоти, заявлений винахід також передбачає її солі, краще − її нетоксичні фармацевтично прийнятні солі, як-то солі натрію, калію та кальцію. [0043] Сполуки формули (I) можна призначати ссавцям для лікування та/або попередження наступного: резистентність до інсуліну та діабет типу II; втрата нейронів, асоційована з інсультом; ішемія; травма центральної нервової системи (ЦНС); розлади ЦНС, охоплюючи нейродегенеративні хвороби (як-то хвороба Альцгеймера, бічний аміотрофічний склероз (ALS), хвороба Хантингтона, хвороба Паркінсона та синдром Дауна); шкідливих наслідків зверхподразнення збуджувальних амінокислот; психіатричні хвороби; епілепсія та інші конвульсивні розлади; занепокоєння; розлади сну, охоплюючи тих, що потерпають від безсоння; психіатричні хвороби (наприклад, депресія, психоз); хронічний біль (аналгезія); глаукома; цитомегаловірусний (CMV) ретиніт; енурез; та толерантність до опіату та симптомів скасування. Сполуки також можна призначати для індукування анестезії, а також для покращення здатності до пізнання. [0044] Крім того, сполуки винаходу можна призначати ссавцеві для лікування та/або попередження наступного: імпотенція; серцево-судинні розлади (охоплюючи гіпертензію, розлади коагуляції крові); запальні розлади; невропатія; розлади, базовані на хронобіології (наприклад, порушення добового ритму організму); циркадні розлади сну (як-то синдром затриманого сну, проблеми при роботі за змінами, та сезонні розлади (наприклад, сезонний афективний розлад (SAD)); ендокринні показання (наприклад, контрацепція, безплідність, передчасна статева зрілість, передменструальний синдром, гіперпролактинемія та зростання гормональної недостатності); неопластичні хвороби (охоплюючи рак та інші проліферативні хвороби (зростання доброякісної та злоякісної пухлини простати)); розлади імунної системи, охоплюючи СНІД; стани, пов'язані зі старінням; офтальмологічні хвороби; приступи головного болю; мігрень; розлади приросту маси (лептин, ожиріння); для захисту шкіри та як засіб у тваринництві (наприклад, регулювання фертильності, статевої зрілості та кольору волосяного покриття). [0045] Як тут застосовано "для лікування" означає полегшувати або лікувати хворобу, розлад, стан або полегшувати, принаймні, один симптом хвороби, розладу або стану. [0046] У переважних втіленнях сполуки винаходу призначаються людям, що потерпають від хвороби або розладу. [0047] Сполуки винаходу можна призначати самі або в комбінації із іншими відомими засобами, що є корисними в лікуванні хвороби, розладу або стану, який лікують. Як тут застосовано, "у комбінації" означає, що сполуку формули (I) та інший засіб можна співпризначати в супутній терапії або у фіксованій фізичній комбінації, або їх можна призначати роздільно, але як доповнення одного до іншого. [0048] У переважному втіленні сполуки формули (I) можна призначати для зміни циркадних ритмів або для покращення якості сну, або для лікування або попередження розладів сну або порушення сну в ссавця, особливо в людини. Крім того, сполуки формули (I) можна призначати для збільшення ефективності сну та для підтримання подовження сну. Розлади сну та порушення сну, котрі можна лікувати або попереджувати призначенням сполуки формули (I) охоплюють наступне: проблеми сну, асоційовані з тими, що потерпають від безсоння, гіперсомнія, апное вві сні, нарколепсія, нічний міоклонус, порушення сну REM, порушення добового ритму організму, порушення сну внаслідок роботи за змінами, безсоння, нічний страх, безсоння, асоційоване з депресією або з розладами емоційного настрою та нетримання сечі та ходіння вві сні, а також розлади сну, котрі супроводжують старіння, стан, асоційовані з циркадною періодичністю, психічні та фізичні розлади, асоційовані з подорожами через часові зони та із режимами циклічного зсуву роботи за змінами, або синдроми як фіброміалгія, котра характеризується сном, що не відновлює, та м'язовим болем, або апнеа уві сні, що асоційована з дихальними порушеннями протягом сну. [0049] У лікуванні або запобігання вищезгаданих станів, широко визначених як розлади циркадного ритму або розлади сну, сполуку формули (I) можна призначати саму або в комбінації з іншими сполуками, що відомі в рівні техніки як корисні для покращення якості сну та попередження й лікування розладів сну та порушень сну, охоплюючи наприклад, наступне: седативні засоби, снодійні засоби, анксіолітики, антипсихотчні засоби, заспокійливі засоби, малі транквілізатори, агоністи та антагоністи мелатоніну, мелатонін, бензодіазепіни, барбітурати, антагоністи 5HT-2, та подібне, як-то: адиназолам, алобарбітал, алонімід, алпразолам, амітриптилін, амобарбітал, амоксапин, бентазепам, бензоктамін, бротизолам, бупропіон, буспріон, бутабарбітал, буталбітал, капурид, карбоклорал, клорал бетаїн, клорал гідрат, 9 UA 104988 C2 5 10 15 20 25 30 35 40 45 50 55 60 хлордіазепоксид, кломіпрамін, клоперидон, клоразепат, клоретат, клозапін, ципразепам, десипрамін, декскламол, діазепам, диклоралфеназон, дивалпроекс, дифенгідрамін, доксепін, естазолам, есзопіклон, етхлорвінол, етомідат, фенобам, флунітразепам, флуразепам, флувоксамін, флуоксетин, фосазепам, габоксадол, глутефімід, галазепам, гідроксизин, іміпрамін, індиплон, літій, лоразепам, лорметазепам, мапротилін, меклокуалон, мелатонін, мефобарбітал, мепробамат, метакуалон, мідафлур, мідазолам, нефазодон, нізобамат, нітразепам, нортриптилін, оксазепам, паральдегід, пароксетин, пентобарбітал, перлапін, перфеназин, фенелзин, фенобарбітал, празепам, прометазин, пропофол, протриптилін, куазепам, рамелтеон, реклазепам, ролетамід, секобарбітал, сетралін, супроклон, темазепам, тіоридазин, траказолат, транілципромеін, тразодон, триазолам, трепіпам, трицетамід, триклофос, трифлуоперазин, триметозин, триміпрамін, улдазепам, ваопроат, венлафаксин, залеплон, золазепам, золпідем, золпіклон та їх солі, та їх комбінації, та подібне. [0050] Комбінації одного або більше цих відомих терапевтичних засобів зі сполукою формули (I) повинні давати додаткові, компліментарні та часто синергічні ефекти для покращення бажаних властивостей відомого терапевтичного засобу. [0051] Сполуку формули (I), саму або в комбінації з одним із вищезгаданих відомих терапевтичних засобів, далі можна призначати в комбінації з фізичними способами лікування, як-то світлова терапія (як-то описано в U.S. Patents 5,447,527 та 5,562,719, охоплених тут посиланням). [0052] Згідно із ще одним утіленням сполуки формули (I) можна призначати в комбінації з наступним: антидіабетичний засіб, як-то інсулін, сульфонілсечовини, бігуаніди (як-то метформін), інгібітори альфа-глюкозидази (як-то аскабоза), гама-агоністи активованого профілератором пероксисоми рецептору (PPARгама), як-то тіазолідиндіони, охоплюючи pioглітазон та росиглітазон, засоби, що знижують холестерин, як-то інгібітори редуктази HMGCoA (ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, ривастатин, ітавастатин та інші статини), секвестранти (холестирамін, колестипол та похідні даалкіламіноалкілу поперечнозшитого декстрану), нікотиніловий спирт, нікотинова кислота або її сіль, агоністи PPARальфа (геміброзил, клофібрат, фенофібрат та безафібрат), пробукол, PPARальфа/гама агоністи, як-то KRP-297, засоби проти ожиріння, як-то фенфлурамін, дексфенфлурамін, фентирамін, субітрамін, орлістат, інгібітор нейропептиду Y5, бета агоністи адренергічного рецептору, інгібітори дипептидилпептидази-4 та інгібітори PTP-1B. [0053] Якщо сполуку формули (I) призначено в комбінації з іншим терапевтичним засобом, як-то антидіабетичний засіб або засіб для лікування розладу сну або розладу циркадного ритму, сполуку формули (I) та відомий терапевтичний засіб можна призначати незалежно в добовому дозуванні, яке простирається від одного й одної сотої до одного рівнів дозування, котрі є ефективними, якщо сполуки призначаються самі. [0054] Сполуки формули (I) можна формувати у фармацевтичні композиції, придатній для наступних шляхів призначення: пероральний, парентеральний (наприклад, внутрішньом'язовова, інтраперитонеальна, внутрішньовенна або підшкірна ін'єкція або уведення) інтраназальний, вагінальний, ректальний, сублінгвальний або місцевий. Композиції можуть містити один або більше фармацевтично прийнятних розріджувачів, консервантів, солюбілізаторів, емульгаторів, ад'ювантів, наповнювачів та/або носіїв. [0055] Тверді форми дозування для перорального призначення охоплюють капсули, таблетки, пілюлі, порошки та гинули, У таких твердих формах дозування активну сполуку змішано, принаймні, з одним інертним фармацевтично прийнятним носієм, як-то цукроза, лактоза, або крохмаль. Такі форми дозування також можуть містити, що є звичайною практикою, додаткові речовини, відмінні від інертних розріджувачів, наприклад, змащувальні засоби, як-то магній стеарат. Ілюстративні ад'юванти, котрі можна вводити в таблетки, капсули та подібне є наступними: зв'язувач, як-то смола трагаканту, гуміарабік, кукурудзяний крохмаль або желатин; наповнювач, як-то мікрокристалічна целюлоза; дезінтегрувальний засіб, як-то кукурудзяний крохмаль, пептизований крохмаль, альгінова кислота та подібне; змащувач, як-то магній стеарат; підсолоджувальний засіб, як-то цукроза, лактоза або сахарин; ароматизатор, якто перцева м'ята, олія гаультерії або вишні. Форми дозування в капсулах, таблетках та пілюлях також можуть містити буферувальні засоби. Якщо одиничною формою дозування є капсула, вона може містити крім вищезгаданих матеріалів рідинний носій, як-то жирні масла. Різні інші матеріали можуть бути присутніми як покриття або інакше модифіковані фізичні форми одиниці дозування. Крім того, таблетки та пілюлі можна отримувати з ентеросолюбільним покриттям, та таблетки можна покривати шелаком, цукром або обома. [0056] Рідкі форми дозування для перорального призначення охоплюють фармацевтично прийнятні емульсії, розчини, суспензії, сиропи та еліксири, що містять інертні розріджувачі, 10 UA 104988 C2 5 10 15 20 25 30 35 40 45 50 55 60 звичайно, застосовані в рівні техніки, як-то вода. Окрім таких інертних розріджувачів композиції також можуть охоплювати ад'юванти, як-то зволожувальні засоби, емульсувальні та суспендувальні засоби, підсолоджувачі, смакові та ароматизаувальні засоби. Сироп або еліксир можуть містити активну сполуку, цукрозу як підсолоджувач, метил- та пропілпарабени як консерванти, фарбник та ароматизатор, як-то вишневий та апельсиновий ароматизатор. [0057] Згідно із цим винаходом препарати для парентерального призначення охоплюють стерильні водні або неводні розчини, суспензії або емульсії. Стерильні композиції для ін'єкції можна формувати згідно із звичайною фармацевтичною практикою розчиненням або суспендуванням активної речовини в наповнювачі, як-то вода для ін'єкції, природного походження рослинна олія, подібна до кунжутної олії, кокосової олії, арахісової олії, бавовняної олії, т.д., або синтетичний жировий наповнювач, подібний до етилолєату або подібне. Якщо потрібно, можна вводити буфер, консерванти, антиоксиданти та подібне. Прикладами неводних розчинників або наповнювачів є пропіленгліколь, поліетиленгліколь, рослинні олії, як-то оливкова олія та кукурудзяна олія, желатин, та придатні для інжектування органічні естери, якто етилолєат. Такі форми дозування також можуть містити ад'юванти, як-то консерванти, зволожувальні, емульсувальні та диспергувальні засоби. Їх можна стерилізувати, наприклад, фільтруванням через фільтр, що втримує бактерії, уведенням стерилізувальних засобів у композиції, опроміненням композицій або нагріванням композицій. Їх також можна виготовляти у формі стерильних твердих композицій, що безпосередньо перед застосуванням можна розчиняти в стерильній воді або деякому іншому стерильному придатному для інжектування середовищі. [0058] Кращими композиціями для ректального або вагінального призначення є супозиторії, що можуть містити додатково до активної речовини наповнювачі, як-то масло какао або віск для супозиторіїв. Композиції для інтраназального або сублінгвального призначення також отримують зі стандартними хорошими наповнювачами, що відомі в рівні техніки. [0059] Дозування активного засобу в композиціях цього винаходу можна змінювати за умови, що призначено терапевтичну кількість. Бажано, щоб активний засіб призначали пацієнту (людині або тварині) при потребі лікування в такому дозуванні, щоб він надавав оптимальну фармацевтичну ефективність. Вибране дозування залежить від природи та суворості хвороби або розладу, що лікують, бажаного терапевтичного ефекту, шляху призначення та терміну лікування. Кількість дозування також може змінюватися залежно від маси пацієнта та інших факторів. Наприклад, дія сполуки формули (I), що індукує зміну фази в центральному циркадному водієві ритму, може залежати від зовнішнього середовища та циркадного часу призначення. Та сама сполука може індукувати випередження по фазі, затримку по фазі або мати незначну дію на окремий циркадний ритм залежно від циркадного часу призначення. Доза повинна змінюватися від пацієнта до пацієнта залежно від природи та суворості хвороби, маси пацієнта, особливості дієти пацієнта, супутнього лікування, біонакопичення сполуки після застосування та інших факторів, котрі слід знати спеціалісту в рівні техніки. [0060] При лікуванні стану у відповідності із заявленим винаходом рівням придатного добового дозування, звичайно, слід бути приблизно 2,5 мкг − 25 мг на кг маси тіла пацієнта. Кількість добового дозування можна призначати в одиничній або кількох дозах на добу. Кращим рівням дозування слід, приблизно, дорівнювати 2,5 мкг − 20 мг/кг маси тіла пацієнта; ще краще, приблизно, 2,5 мкг − 10 мг/кг маси тіла пацієнта. Наприклад, для досягнення дії циркадного ритму зміни фази, відновлення внутрішнього циркадного часу, скорочення часу циркадних ритмів, зменшення розладу циркадного ритму або покращення якості сну придатні рівні дозування, приблизно, дорівнюють 2,5 мкг − 25 мг/кг маси тіла пацієнта, краще − приблизно, 2,5 мкг − 20 мг/кг маси тіла пацієнта, та головним чином − приблизно, 2,5 мкг − 10 мг/кг маси тіла пацієнта. У великих ссавців, наприклад, людей, типова вказана добова доза для перорального призначення є, приблизно, 0,2 − 1000 мг. Краще добове пероральне дозування є, приблизно, у діапазоні 0,5 − 50 мг. та ще краще − приблизно, у діапазоні 2,5 − 20 мг. Якщо застосовувати придатну для інжектування або місцевого застосування композицію, переважне дозування дорівнює, приблизно 2,5 мкг − 5 мг/кг маси тіла пацієнта, та головним чином − приблизно, 2,5 мкг − 1 мг/кг маси тіла пацієнта. У великих ссавців, наприклад, людей, типова вказана доза, приблизно, є 100 мкг − 100 мг внутрішньовенно. Сполуку можна призначати в режимі одного або кількох разів на добу, наприклад, 1 − 4 рази на добу, краще − один раз або двічі на добу. [0061] Композиції цього винаходу можуть бути у формі негайного вивільнення або, де це є придатним, як-то тверді композиції для перорального призначення, можуть бути у формах подовженого вивільнення. Композиції подовженого вивільнення охоплюють композиції затриманого, подовженого, імпульсного або регульованого вивільнення. Придатні композиції подовженого вивільнення, корисні для цілей заявленого винаходу, охоплюють типи композицій, 11 UA 104988 C2 5 10 15 описаних у U.S. Patents 6,106,864; 7,053,122; та 7,118,762, охоплених тут посиланням. Подробиці інших типів технологій придатного вивільнення, як-то дисперсії високої енергії та осмотичні й покриті частинки можна знайти, наприклад, у Verma, R. та S. Garg, Pharmaceutical Technology On-Line, 25(2), 1-14 (2001), також охоплених тут посиланням. [0062] Зміни періоду часу, за який вивільнюються сполука композиції подовженого вивільнення, базовано на показанні та терапевтичних рівнях мішені. Тим, хто потерпає від безсоння, наприклад, бажано обмежувати, наприклад, час фармакологічні дії призначеної до нічного часу сполуки, приблизно, 8 годинами. Для антидіабетичного лікування бажано призначати композиції, що мають подовжену дію, наприклад, 12 годинну дієвість, двічі на добу, уранці та ввечері. [0063] Винахід слід ілюструвати наступними прикладами. Зрозуміло, що наступні приклади призначено тільки для ілюстрації, та вони не призначені для обмеження заявленого винаходу будь-яким способом. Приклад 1 N-[2-(5-метокси-індол-3-іл)-етил]-комменамід Схема реакції синтезу N-[2-(5-метокси-індол-3-іл)-етил]-комменаміду 20 25 30 35 Загальна процедура синтезу N-[2-(5-метокси-індол-3-іл)-етил]-комменаміду [0064] Під атмосферою аргону 100 мл тригорлу круглодонну колбу наповнювали коменовою кислотою (560 мг, 1 екв.) та 5-метокситриптаміном (750 мг, 1,1 екв.), розчиненим у ДМФ (20 мл), та доводили до 0 °C у льодяній бані. Тоді при магнітному перемішуванні додавали HOBt (1гідроксибензотриазол моногідрат, 535 мг, 1,1 екв.), EDC (1-(3-диметиламінопропіл)-3етилкарбодіімід гідрохлорид, 760 мг, 1,1 екв.) та триетиламін (1,25 мл, 2,5 екв.). Суміш перемішували протягом додаткових 15 хвилин при 0 °C, та потім дозволяли реагувати протягом 48 год. при кімнатній температурі. Тоді додавали воду (25 мл) і суміш повністю екстрагували дихлорметаном (6 × 30 мл). Комбіновані органічні фази сушили над Na 2SО4 та розчинник видаляли роторним випаровуванням. Сиру речовину хроматографували через колонку з гелем оксиду силіцію, елюючи дихлорметаном / метанолом 95/5. Продукт отримували як в'язку олію, котру очищали три рази діетилетером для отримання коричневої твердої речовини (180 мг, вихід 15 %). Експериментальні дані для N-[2-(5-метокси-індол-3-іл)-етил]-комменаміду МС (ESI POS): 329 (M+H), 351 (M+Na), 392 (M+Na+CH3CN) аналіз ВЕРХ: 97 % 1 H ЯМР (CDCl3 400 MГц) δ 3,06 (t, j=6,7 Гц, 2H, CH2CH2NH), 3,76-3,79 (m, 2H, CH2СН2NH), 3,84 (s, 3H OCH3), 6,32 (br s, 1H, OH), 6,76 (br s, 1H, CH2CH2NН), 6,9 (dd, J, = 2,3 Гц, J2=8,8 Гц, 1H ароматичний H), 7,04 (d, J=2,3 Гц, 1H, ароматичний H), 7,06 (d, J=2,3 Гц, 1H, ароматичний H), 7,27 (s, 1H, CH), 7,29(d, J=8,8 Гц, 1H, ароматичний H), 7,73 (s, 1H, CH), 7,96 (br s, 1H, NН). Приклад 2 О-[2-(5-метокси-індол-3-іл)-етил]-коменовий естер 12 UA 104988 C2 Схема реакції синтезу O-[2-(5-метокси-індол-3-іл)-етил]-коменового естеру 5 10 15 20 [0065] Під атмосферою аргону 100 мл тригролу круглодонну колбу наповнювали коменовою кислотою (300 мг, 1 екв.) та 5-метокситриптофолом (365 мг, 1 екв.) розчиненому в CH 2Cl2/ ДМФ (10 / 5 мл, відповідно). Тоді додавали DDC (дициклогексилкарбодіімід, 435 мг. 1,1 екв.) та DMAP (4-диметиламінопіридин, 45 мг, 0,2 екв.) з магнітним перемішуванням. Після перемішування суміші протягом 16 годин при кімнатній температурі сформований білий осад видаляли фільтруванням через воронку Бюхнера. Із чистого фільтрату розчинник видаляли роторним випаровуванням. Тоді сирий продукт хроматографували через колонку з гелем оксиду силіцію, елюючи 250 мл CH2Cl2, а потім − дихлорметаном / метанолом 97/3. Фракції, що містять продукт комбінували та концентрували, та отримане тверде перекристалізовували циклогексану / етилацетату. Отримували чистий О-[2-(5-метокси-індол-3-іл)-етил]-коменовий естер світложовту тверду речовину (250 мг, вихід 40 %). Експериментальні дані для О-[2-(5-метокси-індол-3-іл)-етил]-коменового естеру МС (ESI POS): 330 (M+H), 352 (M+Na), 393 (M+Na+CH3CN) аналіз ВЕРХ: 97 % 1 H ЯМР (CDCl3 400 MГц) δ 3,18-3,22 (m, 2H, CН2CH2О), 3,87 (s, 3H, OСН3), 4,60-4,64 (m, 2H, CH2CH2О), 6,40 (br s, 1H, OH), 6,88 (dd, J1=2,2 Гц, J2=8,8 Гц, 1H, ароматичний H), 7,06-7,08 (m, 2H, ароматичний H+CH), 7,22 (s, 1H, ароматичний H), 7,25-7,28 (m, 1H, ароматичний H), 7,96-8,0 (s+br s, 2 H, NН+ CH). Приклад 3 N- [2-5 -метокси-індол-3-іл)-етил]-хелідонамід Схема реакції синтезу N-[2-(5-метокси-індол-3-іл)-3-етил]-хелідонамід 13 UA 104988 C2 5 10 15 20 25 i) ДМФ, HOBt 1,1 екв., EDC 1,1 екв., NEt3 2,5 екв., к.т., 24 год. Загальна процедура синтезу N-[2-(5-метокси-індол-3-іл)-етил]-хелідонаміду [0066] В 100 мл чотиригорлій круглодонній колбі під атмосферою аргону розчиняли 5метокситриптамін (350 мг, 1,1 екв.) у 10 мл ДМФ. При магнітному перемішуванні додавали хелідонову кислоту (310 мг, 1,1 екв.). Отриманий розчин доводили до 0° C у льодяній бані, і тоді додавали при магнітному перемішуванні HOBt (1-гідроксибензотриазол моногідрат, 250 мг, 1,1 екв.), EDC (1-(3-диметиламінопропіл)-3-етилкарбодіімід гідрохлорид, 350 мг, 1,1 екв.) та триетиламін (0,6 мл, 2,5 екв.). Суміш залишали перемішуватися протягом додаткових 15 хвилин при 0 °C та потім дозволяли реагувати протягом 48 год. при кімнатній температурі. Після курсу реакції − ВЕРХ-МС. Осаджені матеріали видаляли фільтруванням. До фільтрату додавали воду (100 мл) і суміш екстрагували дихлорметаном (3 × 50 мл). Комбіновані органічні фази сушили над Na2SО4 та розчинник видаляли роторним випаровуванням. Тоді сирий продукт хроматографували через колонку з гелем оксиду силіцію вихідним елююванням дихлорметаном / етанолом 8/2. Після елюювання побічного продукту полярність елюенту збільшували (дихлорметан / етанол 1/1) та продукт отримували як блідо-жовту тверду речовину (70 мг, вихід 11 %). Експериментальні дані для N-[2-(5-метокси-індол-3-іл)-етил]-хелідонаміду МС (ESI POS): 357 (M+H), 374 (M+Na), 398 (M+H + CH3CN) аналіз ВЕРХ: 97 % 1 H ЯМР (ДМСО-d6 400 МГц) δ 2,91(t, J=7,5 Гц, 2H, CH2CH2NН), 3,50-3,55 (m, 2H, CH2СН2NH), 3,76 (s, 3H, OCH3), 6,64-6,71 (m, 3H), 7,07 (d, J=2,6 Гц, 1H), 7,13 (d, J=2,1 Гц, 1H), 7,20 (d, J=8,8 Гц, 1H), 8,29 (s, 1H, NН), 8,92 (br t, J=5,8 Гц, 1H, CH2CH2NН), 10,62 (br s, 1H, COOH). Приклад 4 N-[2-(5-метокси-індол-3-іл)-етил]-оксипіранкарбоніламід Загальна процедура синтезу N-[2-(5-метокси-індол-3-іл)-етил]-оксипіранкарбоніламіду 30 35 [0067] Під атмосферою аргону 100 мл тригролу круглодонну колбу наповнювали оксипіранкарбоновою кислотою (600 мг, 1 екв.) та 5-метокситриптаміном (900 мг. 1,1 екв.), розчиненим у ДМФ (25 мл), та доводили до 0 °C у льодяній бані. Тоді додавали при магнітному перемішуванні HOBt (1-гідроксибензотриазол моногідрат, 640 мг, 1,1 екв.), EDC (1-(3диметиламінопропіл)-3-етилкарбодіімід гідрохлорид, 900 мг, 1,1 екв.) та триетиламін (1,5 мл, 2,5 екв.). Суміш перемішували протягом додаткових 15 хвилин при 0 °C та потім дозволяли реагувати протягом 48 год. при кімнатній температурі. Після курсу реакції − ВЕРХ-МС. Тоді додавали воду (40 мл) і суміш повністю екстрагували дихлорметаном (6 × 30 мл). Комбіновані 14 UA 104988 C2 5 10 15 20 25 30 органічні фази сушили над Nа2SО4 та розчинник видаляли роторним випаровуванням. Тоді сирий продукт хроматографували через колонку з гелем оксиду силіцію, елюючи дихлорметаном/метанолом 95/5, та отримували продукт (130 мг, 9,5 % вихід). Експериментальні дані для N-[2-(5-метокси-індол-3-іл)-етил]-оксипіранкабоніламіду МС (ESI POS): 313 (M+H), 335 (M+Na), 376 (M+Na+CH3CN) аналіз ВЕРХ: 95 % 1 H ЯМР (CDCl3, 400 МГц) δ 3,09 (t, J=6,1 Гц, 2H, СН2CH7NH), 3,70-3,74 (m, 2H, CH2CH2NH), 3,87 (s, 3H, OCH3, 5,58 (d, J=8,8 Гц, 1H, CH), 6,88-7,04 (m, 5H, 4 ароматичний H+1 CH), 7,29 (d, J=8,8 Гц, 1H, CH), 8,03 (br s, 1H, NH), 9,65 (br s, 1H, CH2CH2NН). Приклад 5 N-[2-(2-бромо-5-метокси-індол-3-іл)-етил]-оксипіранкарбоніламід Схема реакції синтезу N-[2-(5-метокси-індол-3-іл)-етил]-оксипіранкарбоніламіду a) Фталевий ангідрид, TEA, толуол, дефлегмація, протягом ночі b) піридиніум трибромід, ТГФ/хлороформ, -10 °C, 30 хвил. c) метиламін, EtOH, к.т., 3 год. d) оксипіранкарбонова кислота, NMM, TBTU, ДМФ, к.т., 5 год. a. 5-Метокситриптамін та фталевий ангідрид нагрівали під дефлегматором у толуолі протягом 16 годин Концентрування реакції під зниженим тиском дало сирий продукт, який застосовували в наступному етапі без подальшого очищення. b.Сирий фталоїлтриптамін розчиняли в ТГФ:CHCl3 (1:1) та отриманий розчин охолоджували до -10 °C і тоді обробляли піридиніум бромід пербромідом. Реакцію контролювали ТШХ та дозволяли нагрітися до кімнатної температури; додавали CH 2Cl2. Розчин промивали насиченим водним Na2S2O3, та водні шари екстрагували CH2Cl2. Комбіновані органічні шари сушили (MgSО4), фільтрували, концентрували під зниженим тиском, та сирий продукт застосовували в наступному етапі без подальшого очищення. c.Фталімідо-групу видаляли обробкою водним метиламіном в етанолі при кімнатній температурі. d.N-метилморфолін додавали до розчину оксипіранкарбонової кислоти в диметилформаміді, а потім − 2-(1H-бензотриазол-1-іл)-1,1,3,3-тетраметилуроніум тетрафлуорборат (TBTU) під атмосферою азоту. Після реакційну суміш перемішували протягом 20 хвил. при кімнатній температурі, повільно додавали 5-метокситриптамін і суміш перемішували протягом 5 год. Зі реакційної суміші видаляли ДМФ під високим вакуумом. Твердий продукт розчиняли в CH2Cl2 та отриману органічну фракцію промивали 0,2N HCl, 0,2N 15 UA 104988 C2 5 10 15 20 25 30 NaHCО3 та водою й тоді сушили (MgSО4), фільтрували та концентрували під зниженим тиском. Отриманий продукт очищали хроматографією на колонці. Експериментальні дані для N-[2-(2-бромо-5-метокси-індол-3-іл)-етил]оксипіранкарбоніламіду 1 H ЯМР (CDCl3, 300 MГц) δ 10,00 (s, 1H, NH), 8,00 (s, 1H, ароматичний COOCH), 7,06 (t, 1H, J=9 Гц, CONH), 6,78-6,67 (m, 4H, ароматичний H), 5,41 (d, 1H, J=9,6 Гц, ароматичний COCH), 3,67 (s, 3H, OCH3), 3,52 (q, 2H, J=6,24 Гц), 2,87 (t, 2H, J=6,3 Гц) Приклад 6 N- [2-(5 -метокси-індол-3-іл)-етил] -команіламід Схема реакції синтезу N-[2-(5-метокси -індол-3-іл)-етил]-команіламіду i. ДМФ, HOBt 1,1 екв., EDC 1,1 екв., NEt3 2,5 екв., к.т., 6 год. Загальна процедура синтезу N-[2-(5-метокси-індол-3-іл)-етил]-команіламіду [0068] Під атмосферою аргону 100 мл тригорлу круглодонну колбу наповнювали комановою кислотою (500 мг, 1 екв.) та 5-метокситриптаміном (760 мг, 1,1 екв.), розчиненим у ДМФ (25 мл), та доводили до 0 °C у льодяній бані. Тоді додавали при магнітному перемішуванні HOBt (1гідроксибензотриазол моногідрат, 530 мг, 1,1 екв.), EDC (1-(3-диметиламінопропіл)-3етилкарбодіімід гідрохлорид, 750 мг, 1,1 екв.) та триетиламін (1,25 мл, 2,5 екв.). Суміш перемішували протягом додаткових 15 хвилин при 0 °C і потім дозволяли реагувати протягом 6 год. при кімнатній температурі. Після курсу реакції − ВЕРХ-МС. Тоді додавали воду (50 мл) і суміш екстрагували дихлорметаном (3 × 50 мл). Комбіновані органічні фази сушили над Na 2SО4 та розчинник видаляли роторним випаровуванням. Тоді сирий продукт хроматографували через колонку з гелем оксиду силіцію, елюючи дихлорметаном / метанолом 95/5. Продукт отримували як яскраво-жовту тверду речовину (235 мг, вихід 21 %). Експериментальні дані для N-[2-(5-метокси-індол-3-іл)-етил]-команіламіду МС (ESI POS): 313 (M+H), 330 (M+H2О), 335 (M+Na), 376 (M+Na+CH3CN) аналіз ВЕРХ: 98 % 1 H ЯМР (ДМСО-d6, 400 МГц) δ 2,88-2,92 (m, 2H, CH2CH2NH), 3,48-3,53 (m, 2H, CH2CH2NH), 3,75 (s, 3H, OCH3, 6,42 (dd, J1=2,3 Гц, J2=5,9 Гц, 1H, CH=CH), 6,71 (dd, J, = 2,1 Гц, J 2=8,8 Гц, 1H, ароматичний H), 6,78 (d, J=2,3 Гц, 1H, ароматичний H), 7,04 (d, J=2,3 Гц, 1H, CH), 7,13 (d, J=2,1 Гц, 1H, ароматичний H), 7,22 (d, J=8,8 Гц, 1H, ароматичний H), 8,21 (d, J=5,9Гц, 1H, CH=CHCO), 9,04 (br t, J=5,8 Гц, 1H, CH2CH2NH), 10,65 (brs, 1H, NH). Приклад 7 N-[2-(5-метокси-індол-3-іл)-етил]-2-метокси-комменамід 16 UA 104988 C2 Схема реакції синтезу N-[2-(5-метокси-індол-3-іл)-етил]-2-метоксикомменаміду 5 10 15 20 25 30 35 40 i) CH3 12,2 екв., CH3ONa 1,1 екв., CH3OH, к.т., 72 год. ii) MnО2 16 екв., CH3OH, дефлегмація, 1,5 год.; Ag2О 1 екв., H2О, NaOH 1 N, к.т., 1 год. iii) HOBt 1,1 екв., EDC 1,1 екв., NEt3,5 екв., к.т., 16 год. Загальна процедура синтезу N-[2-(5-метокси-індол-3-іл)-етил]-2-метоксикомменаміду i. У 250 мл чотиригорлій круглодонній колбі під атмосферою аргону розчиняли 3,2 г коджевої кислоти (1 екв.) у 80 мл метанолу. Тоді додавали при магнітному перемішуванні в одній порції натрій метоксид у метаноловому розчині (4,6 мл, 1,1 екв.;, 5,4 M). Через 15 хвилин краплями додавали 2,95 мл (1,1 екв.) розчину метил йодиду в 10 мл CH 3OH, та отриманому розчину дозволяли реагувати при кімнатній температурі. Після курсу реакції − ТШХ (дихлорметан / метанол 9 /1 як елюент). Після 7 годин конверсія була, приблизно, 50 %, отже, ще додавали 1,1 еквівалент CH3I (2,95 мл у 10 мл CH3OH). Реакційна суміш реагувала при перемішуванні при кімнатній температурі протягом додаткових 65 годин, після чого додавали воду (400 мл). Розчин концентрували до залишкового об'єму, приблизно, 25-30 мл та залишали при 4° C протягом 14 год. Отриманий осад збирали фільтруванням, промивали діетилетером та сушили під вакуумом при 50 °C. 2- Гідроксиметил-5-метокси-4-пропанон отримували як жовту кристалічну тверду речовину (2,2 г, вихід 63 %). ii. У 250 мл круглодонній колбі розчиняли 2-гідроксиметил-5-метокси-4-пропанон (2,2 г, 1 екв.) у 85 мл метанолу та додавали 19,6 г активного манган діоксиду (16 екв.). Реакційну суміш нагрівали під дефлегматором протягом 1,5 год., тоді охолоджували до кімнатної температури. Нерозчинну частину відфільтровували та фільтрат концентрували, приблизно, до третини вихідного об'єму. До цього додавали 30 мл води, 10 мл NaOH 1 N та 3,3 г аргентум оксиду (1 екв.). Отримана суміш реагувала протягом 1 год. при кімнатній температурі, та тоді її фільтрували через прокладку целіту для видалення солі. Фільтрат концентрували під зниженим тиском для видалення метанолу й тоді промивали дихлорметаном. Потім до водорозчинної фази додавали HCl 2 N (12 мл) для утворення осаду, котрий збирали фільтруванням, промивали діетилетером та сушили під вакуумом при 50 °C. 5-Метокси-4-оксо-4H-піран-2карбонатну кислоту отримували як білу тверду речовину (1,2 г, 50 % вихід). ii. Під атмосферою аргону 100 мл тригорлу круглодонну колбу наповнювали 5-метокси-4оксо-4H-піран-2-карбонатною кислотою (340 мг, 1 екв.) та 5-метокситриптамін гідрохлоридом (500 мг, 1,1 екв.), розчиненим у ДМФ (15 мл), та доводили до 0 °C у льодяній бані. Тоді додавали при магнітному перемішуванні HOBt (1-гідроксибензотриазол моногідрат, 300 мг, 1,1 екв.), EDC (1-(3-диметиламінопропіл)-3-етилкарбодіімід гідрохлорид, 425 мг, 1,1 екв.) та триетиламін (0,98 мл, 3,5 екв.). Суміш перемішували протягом додаткових 15 хвилин при 0 °C і потім дозволяли реагувати протягом 16 год. при кімнатній температурі. Після курсу реакції − ВЕРХ-МС. Тоді додавали воду (25 мл) і суміш екстрагували дихлорметаном (2 × 30 мл). Тоді суспензія опинялася в комбінованих органічних фазах. Сформоване тверде тоді збирали фільтруванням, промивали дихлорметаном та сушили при 50 °C. Продукт отримували як білу 17 UA 104988 C2 5 10 15 20 25 30 35 тверду речовину (210 мг). Розчинник із фільтрату видаляли роторним випарюванням. Отриманий твердий залишок обробляли дихлорметаном / петролейним етером та дозволяли стояти при кімнатній температурі протягом 24 год. Суміш тоді фільтрували для отримання додаткового N-[2-(5-метокси-індол-3-іл)-етил]-2-метокси-комменаміду (70 мг, 42 % вихід). Експериментальні дані для N-[2-(5-метокси-індол-3-іл)-етил]-2-метокси-комменаміду МС (ESI POS): 343 (M+H), 365 (M+Na), 406 (M+Na+CH3CN) аналіз ВЕРХ: 98 % 1 H ЯМР (ДМСО-d6, 400 МГц) δ 2,87-2,91 (m, 2H, СН2CH2NH), 3,47-3,52 (m, 2H, CH2СН2NH), 3,70 (s, 3H, OCH3, 3,74 (s, 3H, OCH3, 6,70 (dd, J1=2,2 Гц, J2=8,8 Гц, 1H, ароматичний H), 6,83 (s, 1H, CH), 7,03 (d, J=2,8 Гц, 1H, ароматичний H), 7,12 (d, J=2,2 Гц, 1H, ароматичний H), 7,21 (d, J=8,8 Гц, 1H, ароматичний H), 8,12 (s, 1H, CH), 9,02 (br t, J=5,7 Гц, 1H, CH 7CH2NH), 10,64 (br s, 1H, NH). Приклад 8 N-[2-(5-метокси-індол-3-іл)-етил]-2-пірон-6-карбоксамід Схема реакції синтезу N-[2-(5-метокси-індол-3-іл)-етил]-2-пірон-6-карбоксаміду i KOEt 0,998 екв., толуол, к.т., 18 год.; H20/HCl 37 %, к.т… 30 хвил. ii HCl 37 %, 100 °C, 6 год. iii DME, HOBt 1,1 екв., EDC 1,1 екв., Py 2,2 екв., NEt3 1,4 екв., к.т., 3 Загальна процедура синтезу N-[2-(5-метокси-індол-3-іл)-етил]-2-пірон-6~карбоксаміду [0069] Етап 1 & 2 - У 100 мл чотиригорлій круглодонній колбі під атмосферою аргону 5,0 г діетилоксалату (1 екв.) розчиняли в 35 мл сухого толуолу. Тоді додавали при магнітному перемішуванні малими порціями калій етоксид (2,9 г, 0,998 екв.). Внутрішня температура досягала 40 °C, та вихідна суспензія повільно перетворювалась в оранжевий розчин. Через 2 годин розчин доводили до 0 °C у льодяній бані, та додавали краплями протягом 10 хвилин етилкротонат (4,3 мл, 1 екв.). Після 15 хвилин завершення додавання спостерігали утворення жовтого осаду солі калію 2,4-гексадієн-5-гідрокси-1,6-діоату. Суспензії дозволяли реагувати при кімнатній температурі протягом ночі. Потім реакційну суміш фільтрували та отриманий жовтий осад промивали циклогексаном та діетилетером і сушили під вакуумом при 50 °C до виходу 4,9 г жовтого твердого продукту. Тоді його розчиняли в 70 мл води, до чого додавали 5 мл 37 % HCl. Через 5 хвилин формувався жовтий осад. Суспензію перемішували при кімнатній температурі протягом додаткових 30 хвилин і тоді зберігали при 4 °C протягом ночі. Інтермедіат діетил 2,4-гексадієн-5-гідрокси-1,6-діоат збирали фільтруванням та промивали водою. [0070] Отриманий у такий спосіб сирий естер нагрівали при 100 °C з 6 мл концентрованої хлоридної кислоти. Вихідна суспензія переходила до розчину, якщо температура досягала 60 °C. Через одну години починав формуватися жовтий твердий продукт. Через 6 годин суспензію охолоджували та фільтрували піронову кислоту. Об'єм фільтрату зменшували 18 UA 104988 C2 5 10 15 20 25 30 35 40 випарюванням; залишкову маточну рідину охолоджували та додавали діетилетер для того, щоб осаджувати додаткову кількість кислоти, котру тоді витягали фільтруванням. [0071] 2-Пірон-6-карбонатну кислоту отримували як блідо-жовту тверду речовину (1,5 г, вихід 31 %). [0072] Етап 3 - У 100 мл тригролій круглодонній колбі під атмосферою аргону 5метокситриптамін гідрохлорид (430 мг, 1,1 екв.) суспендували в 1,2-диметоксиетані (DME, 15 мл). Додавали піридин (0,34 мл, 2,2 екв.) та суспензію перемішували при кімнатній температурі протягом 30 хвилин. Тоді додавали 2-пірон-6-карбонатну кислоту (250 мг, 1 екв.) та внутрішню температуру доводили до 0 °C у льодяній бані. Тоді додавали при магнітному перемішуванні HOBt (1-гідроксибензотриазол моногідрат, 260 мг, 1,1 екв.), EDC (1-(3-диметиламінопропіл)-3етилкарбодіімід гідрохлорид, 370 мг, 1,1 екв.) та триетиламін (0,34 мл, 1,4 екв.). Суміш перемішували протягом додаткових 15 хвилин при 0 °C і потім дозволяли реагувати протягом 3 год. при кімнатній температурі. Після курсу реакції − ВЕРХ-МС. Отриманий розчин концентрували під вакуумом та сирий залишок очищали хроматографією на колонці, елюючи дихлорметаном / метанолом 98 / 2. Отримували N-[2-(5-метокси-індол-3-іл)-етил]-2-пірон-6карбоксамід як жовту тверду речовину (400 мг, 72 % вихід). Експериментальні дані для N-[2-(5-метокси-індол-3-іл)-етил]-2-пірон-6-карбоксаміду МС (ESI POS): 313 (M+H), 330 (M+H2О), 376 (M+Na+CH3CN) аналіз ВЕРХ: 97 % 1 H ЯМР (ДМСО-d6, 400 МГц) δ 2,87-2,91 (m, 2H, CH2CH7NH), 3,47-3,52 (m, 2H, CH2CH2NH), 3,75 (s, 3H, OCH3, 6,55 (d, J=9,4 Гц, 1 H, CH), 6,70 (dd, J~ 2,9 Гц, J2=8,8 Гц, 1H, ароматичний H), 7,02 (br d, J=6,6 Гц, 1H, CH), 7,06 (d, J=2,1 Гц, 1H, ароматичний H), 7,13 (d, J=2,2 Гц, 1H, ароматичний H), 7,22 (d, J=8,8 Гц, 1H, ароматичний H), 7,67 (dd, J, = 6,6 Гц, J2=9,4 Гц, 1H, CH), 8,87 (br t, J=5,8 Гц, 1H, CR2CR2NH), 10,65 (br s, 1H, NH). Біологічне тестування сполуки винаходу Експеримент 1 Потенціювання часу сну в мишей гексобарбіталом-Na [0073] Мишей CD1 розподіляли довільно на групи по семеро мишей у кожній. Мишам у кожній групі призначали інтраперитонеально 100 мг/кг одної з наступних речовин тесту: О-[2-(5метокси-індол-3-іл)-етил]-коменовий естер, N-[2-(5-метоксиіндол-3-іл)-етил]-комменамід, N-[2-(5метокси-індол-3-іл)-етил]-оксипіранкарбоніламід, N-[2-(5-метокси-індол-3-іл)-етил]-хелідонамід, N-[2-(5-метокси-індол-3-іл)-етил]-команіламід або N-[2-(5-метокси-індол-3-іл)-етил]-2-метоксикомменамід у фізіологічному розчині (0,1 мл/10 г маси тіла), або сам фізіологічний розчин. Через п'ятнадцять хвилин миші отримували дозу 50 мг/кг гексобарбітал-Na внутрішньовенно. Час сну вимірювали в кожної тварини як час від втрати до відновлення настановного рефлексу. [0074] Як показано в таблиці 1 нижче, 100 мг/кг інтраперитонеально О-[2-(5-метокси-індол-3іл)-етил]-коменового естеру, N-[2-(5-метокси-індол-3-іл)-етил]-оксипіранкарбоніламіду та N-[2-(5метокси-індол-3-іл)-етил]-комменаміду значно збільшують період наркозу гексобарбіталу-Na, та N-[2-(5-метокси-індол-3-іл)-етил]-хелідонамід і N-[2-(5-метокси-індол-3-іл)-етил]-команіламід помірно збільшують період наркозу гексобарбіталу-Na. Результати показують гіпнотичну дієвість сполуки через позитивний механізм алостеричного зв'язування GABAa. 19 UA 104988 C2 5 10 15 20 Експеримент 2 125 Зв'язування I-мелатоніну в мембранах клітин CHO-K1 [0075] Аліквоти суспендованих мембран рекомбінантних клітин CHO-K1 (яєчник китайського хом'яка), що стабільно експресують рецептори мелатоніну-1 або мелатоніну-2 (MT-1 або MT-2) 125 людини або мозку хом'яку (MT-3) інкубували при 25 °C 0,05 нМ I-мелатоніну в буфері (25 мМ HEPES, pH 7,4, 5 мМ MgCl2, 1 мМ CaCl2, 0,5 % BSA) або 0,1 нM самого MT-3 або у присутності 1 нМ, 10 нМ, 0,1 мкM, 1 мкM та 10 мкM наступних речовин тесту: N-[2-(5-метокси-індол-3-іл)-етил]комменамід, N-[2-(5-метокси-індол-3-іл)-етил]-команіламід, N-[2-(5-метокси-індол-3-іл)-етил]оксипіранкарбоніламід, N-[2-(5-метокси-індол-3-іл)-етил]-2-метокси-комменамід, N-[2-(5-метоксиіндол-3-іл)-етил]-хелідонамід, О-[2-(5-метокси-індол-3-іл)-етил]-коменовий естер, N-[2-(5метокси-індол-3-іл)-етил]-2-пірон-6-карбоксамід та N-[2-(2-бромо-5-метокси-індол-3-іл)-етил]оксипіранкарбоніламід протягом 3 годин для MT-1, 4 годин для MT-2 та 30 хвил. для MT-3. Реакцію зв'язування завершували та мембрани промивали 4 мл охолодженого льодом буфером HEPES із вакуумним фільтруванням. Тоді мембрани збирали та фільтри, що містять зв'язаний 125 I-мелатонін, аналізували для визначення кількості радіоактивності в β-лічильнику. Неспецифічне зв'язування визначали, застосовуючи реакцію з 1 мкM 6-хлоромелатоніну (MT-1 та MT-2) або 30 мкМ мелатоніну (MT-3). [0076] Результати, приведені в таблицях 2 та 3, показують конкуренцію сполуки зі 125 специфічним зв'язуванням I-мелатоніну з рецепторами MT-1, MT-2 та MT-3. Показано, що N[2-(5-метокси-індол-3-іл)-етил]-комменамід та N-[2-(5-метокси-індол-3-іл)-етил]-команіламід зв'язуються з високою спорідненістю з 3 підтипами рецептору мелатоніну, тоді як інші сполуки зв'язуються, принаймні, з помірною спорідненістю до рецепторів мелатоніну. 25 20 UA 104988 C2 21 UA 104988 C2 5 10 15 20 25 Експеримент 3: Зв'язування підтипів рецептору серотоніну в мембранах клітин CHO-K1 [0077] Аліквоти суспендованих мембран рекомбінантних клітин людини CHO-K1, що стабільно експресують рецептори 5-HT1A, 5-HT2A, 5-HT1B, 5-HT2B, 5-HT2C, 5-HT4, 5-HT6 або 5-HT7 3 3 преінкубували при 25 °C з 1,5 нМ [ H] 8-OH-DPAT (5-HT1A), 1,5 нМ [ H] кетасерину (5-HT2A), 0,01 125 3 3 нМ [ I] ціанопіндолoлу (5-HT1B), 1 нМ [ H] месулегрину (5-HT2C), 0,7 нМ [ H] GR-113808 (5-HT4) 3 або при 37 °C 1,2 нМ [ H]LSD (5-HT2B, 5-HT6 та 5-HT7) у самому буфері (50 мМ трис-HCl, pH 7,7) або у присутності 1 нМ, 10 нМ, 0,1 мкM, 1 мкM та 10 мкM наступного: N-[2-(5-метокси-індол-3-іл)етил]-комменамід, N-[2-(5-метокси-індол-3-іл)-етил]-оксипіранкарбоніламід, N-[2-(5-метоксиіндол-3-іл)-етил]-команіламід, N-[2-(5-метокси-індол-3-іл)-етил]-2-метокси-комменамід або N-[2(5-метокси-індол-3-іл)-етил]-хелідонамід протягом 60 хвилин. Реакцію зв'язування зупиняли та мембрани промивали 4 мл охолодженого льодом буфером 50 мМ трис-HCl із вакуумним фільтруванням. Тоді мембрани збирали та фільтри, що містять зв'язані ліганди, аналізували для визначення кількості радіоактивності в β-лічильнику. Неспецифічне зв'язування визначали, застосовуючи реакцію з 10 мкM метеголіном (5-HT1A), 1 мкM міансерином (5-HT2А та 5-HT2C) або 10 мкM серотоніну (5-HT1B, 5-HT2B, 5-HT4, 5-HT6 та 5-HT7). [0078] Результати нижче в таблиці 4 показують конкуренцію сполуки зі специфічним зв'язування рецепторів 5-HT. Показано, що N-[2-(5-метокси-індол-3-іл)-етил]-комменамід зв'язується з помірною спорідненістю до рецепторів 5-HT1A, 5-HT2B та 5-HT7, показано, що N-[2(5-метокси-індол-3-іл)-етил]-оксипіранкарбоніламід зв'язується з помірною спорідненістю до рецепторів 5-HT1B та 5-HT7, показано, що N-[2-(5-метокси-індол-3-іл)-етил]-команіламід зв'язується з помірною спорідненістю до рецептору 5-HTIB, показано, що N-[2-(5-метокси-індол3-іл)-етил]-2-метокси-комменамід зв'язується з помірною спорідненістю до рецепторів 5-HT2B та 5-HT7 та показано, що N-[2-(5-метокси-індол-3-іл)-етил]-хелідонамід зв'язується з помірною спорідненістю до рецепторів 5-HT1A, та 5-HT1B. 22 UA 104988 C2 5 10 15 20 25 30 35 Експеримент 4: [0079] Гіпнотичні сполуки, що спричиняють депресію рухової активності, знижений підйом на задні лапи, гіпотермію та атаксію, аналізували обертанням мишей (Crabbe et al, Psychopharmacology, 161; 408-416, 2002). Аналіз рухливості [0080] Миші голодували протягом 16 годин перед лікуванням. Самців мишей CD1 вагою 2530 г обробляли інтраперитонеально мелатоніном, N-[2-(5-метокси-індол-3-іл)-етил]команіламідом або N-[2-(5-метокси-індол-3-іл)-етил]-комменамідом із дозою 100 мг/кг. Горизонтальні (тобто локомоцію) та вертикальні (тобто підйом на задні лапи) рухи визначали протягом 5 хвилин два рази, 30 та 60 хвил. після обробки. Застосовували групи по вісім мишей. 4-Канальний лічильних активності має каркас квадратної форми, що містить прозорі для інфрачервоного випромінювання акрилові порожнини. Порожнини мають дві пари світлопроменевих смуг для вимірювання горизонтальних рухів та дві пари для вимірювання підйому на задні лапи. Кожна смуга оснащена 16 інфрачервоними датчиками. [0081] Згідно з аналізом вимірювання руху мелатонін, N-[2-(5-метокси-індол-3-іл)-етил]команіламід та N-[2-(5-метокси-індол-3-іл)-етил]-комменамід у інтраперитонеальній дозі 100 мг/кг значно не змінив моторику та підйом на задні лапи, виміряні між 30-35 хвил. та 60-65 хвил. після обробки (Таблиця 5). [0082] N-[2-(5-метокси-індол-3-іл)-етил]-оксипіранкарбоніламід у інтраперитонеальній дозі 100 мг/кг значно зменшив обидві моторики та підйом на задні лапи за два інтервали часу, указані вище. Ці результати показують гіпнотичну та седативну дії N-[2-(5-метокси-індол-3-іл)етил]-оксипіранкарбоніламіду. Обертальний аналіз [0083] Відмічали падіння тварин, що пробігали більше 120 хвил. на брусі, який повертався, 2 та значимість розраховували за непараметричним тестом x . Застосовували по 8 мишей у групі. [0084] Обертальну апаратуру розподілено на п'ять зон тесту, що дозволяло тестувати до п'яти мишей одночасно. Брус спеціально механічно обробляли, що дало можливість тварині його обхоплювати. Діаметр брусу − 3,5 см. Швидкість обертання − 15 обертів за хвилину. Якщо тварина обривається з обертального брусу, вона тисне на кнопку для автоматичного запису часу перебування на брусі. За добу перед експериментом мишей тренували на обертальному брусі при 15 обертах за хвилину. Діазепам призначали перорально за 60 хвил. перед обертальним аналізом, речовини тесту призначали інтраперитонеально за 15 хвилин перед тестуванням. 23 UA 104988 C2 5 [0085] При обертальному тесті залежно від дози N-[2-(5-метокси-індол-3-іл)-етил]команіламіду та N-[2-(5-метокси-індол-3-іл)-етил]-комменаміду послаблялися показники мишей при швидкості 15 обертів за хвилину (Таблиця 6). [0086] Діазепам у пероральній дозі 1,5 мг/кг значно підсилював дії послаблення обертального показника обох сполук в усіх трьох застосованих дозах. Ці результати показують синергічні гіпнотичні дії N-[2-(5-метокси-індол-3-іл)-етил]-команіламіду та N-[2-(5-метокси-індол3-іл)-етил]-комменаміду, призначених із бензодіазепіновим гіпнотичним засобом діазепамом. 10 15 20 • p < 0,05; ** p < 0,01 ***; p < 0,005; ****р О та Z - >СО. 3. Сполука за п. 2, де Аr' - система кільця альфа-пірону. 4. Сполука за п. 2, де Аr' - система кільця бета-пірону. 5. Сполука за п. 2, де Аr' - система кільця гамма-пірону. 6. Сполука за п. 1, де X - -(СН2)2-, Y - >NH або >О та Z - >СО, Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний із R2 та R4 - гідроген; Аr' - кільце гамма-пірону, зв'язане з Z на позиції 2 кільця пірону; R1' - гідроген або гідроксил на позиції 5 кільця пірону; та R2' - гідроген або карбоксил на позиції 6 кільця гамма-пірону; або її фармацевтично прийнятна сіль або стереоізомер. 7. Сполука за п. 1, де X - -(СН2)2-, Y - >NH або >О та Z - >СО; Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний з R2 та R4 - гідроген; Аr' - кільце альфа-пірону, заміщене Z на позиції 5 кільця пірону; та кожний R1' та R2' - гідроген; або її фармацевтично прийнятна сіль або стереоізомер. 8. Сполука за п. 1, де 26 UA 104988 C2 5 10 15 20 25 30 35 40 45 50 55 X - -(CH2)2, Y - >NH та Z - >СО; Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний із R2 та R4 - Н; Аr' - кільце гамма-пірону, заміщене Z на позиції 2 кільця пірону; R1'- гідроксил на позиції 5 кільця пірону; та R2' - гідроген; або її фармацевтично прийнятна сіль або стереоізомер. 9. Сполука за п. 1, де X - -(СН2)2-, Y - >О та Z - >СО; Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний із R2 та R4 - Н; Аr' - кільце гамма-пірону, заміщене Z на позиції 2 кільця пірону; R1' - гідроксил на позиції 5 кільця пірону; та R2' - гідроген; або її фармацевтично прийнятна сіль або стереоізомер. 10. Сполука за п. 1, де X - -(СН2)2-, Y - >NH та Z - >СО; Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний із R2 та R4 - гідроген; Аr' - кільце гамма-пірону, заміщене Z на позиції 2 кільця пірону; кожний R1' тa R2' - гідроген; або її фармацевтично прийнятна сіль або стереоізомер. 11. Сполука за п. 1, де X - -(СН2)2-, Y - >NH та Z - >СО; Аr - кільце індолу; R3 - зв'язок із X на позиції 3 кільця індолу; R1 - метоксигрупа на позиції 5 кільця індолу, та кожний із R2 та R4 - Н; Аr' - кільце альфа-пірону, заміщене Z на позиції 5 кільця пірону; та R1' та R2' - гідроген; або її фармацевтично прийнятна сіль або стереоізомер. 12. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки, солі або стереоізомера за п. 1 але без виключення у комбінації з одним або більше фармацевтично прийнятними розріджувачами, консервантами, солюбілізаторами, емульгаторами, ад'ювантами, наповнювачами або носіями. 13. Фармацевтична композиція за п. 12, котра характеризується принаймні одною з наступних ознак: (і) її пристосовано для перорального, ректального, парентерального, інтраназального, вагінального, сублінгвального або місцевого призначення; (іі) вона є в одиничній формі дозування, кожне одиничне дозування, яке містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1, яка є в діапазоні приблизно 2,5 мкг/кг 25 мг/кг; (ііі) вона є композицією подовженого вивільнення, де принаймні одна сполука за п. 1 вивільнюється із призначеною контрольованою швидкістю. 14. Фармацевтична композиція за п. 13, котру пристосовано для перорального призначення та в одиничній формі дозування, де кожна одинична форма дозування містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1 приблизно у діапазоні 0,2 мг - 500 мг. 15. Фармацевтична композиція за п. 14, де кожна одинична форма дозування містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1 приблизно у діапазоні 0,5 мг - 50 мг. 16. Фармацевтична композиція за п. 14, де кожна одинична форма дозування містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1 приблизно у діапазоні 2,5 мг - 20 мг. 17. Фармацевтична композиція за п. 13, котру пристосовано для парентерального або місцевого призначення в одиничній формі дозування, де кожна одинична форма дозування містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1 приблизно у діапазоні 2,5 мкг/кг - 5 мг/кг. 18. Фармацевтична композиція за п. 13, котру пристосовано для парентерального або місцевого призначення в одиничній формі дозування, де кожна одинична форма дозування містить кількість принаймні одної сполуки, солі або стереоізомера за п. 1 приблизно у діапазоні 100 мкг - 100 мг. 19. Фармацевтична композиція за п. 12, де названа композиція є в одиничній формі дозування, та де названа одинична форма дозування надає кількість принаймні одної сполуки, солі або стереоізомера за п. 1, ефективну для лікування або попередження наступного: резистентність до інсуліну, діабет II типу, асоційована з інсультом втрата нейронів, ішемія, травма центральної нервової системи, розлад центральної нервової системи, шкідливі наслідки надстимулювання збуджувальних амінокислот, психіатричні розлади, епілепсія або інший конвульсивний розлад, занепокоєння, розлади сну, хронічний біль, глаукома, ретиніт CMV, енурез або толерантність до опіату або симптомів відміни; індукувальна анестезія; або для підсилення пізнання або індукувальної анестезії. 27 UA 104988 C2 5 10 15 20 25 30 35 40 45 50 55 20. Фармацевтична композиція за п. 12, де названа композиція є в одиничній формі дозування, де названа одинична форма дозування надає кількість сполуки, солі або стереоізомера за п. 1, ефективну для лікування або попередження наступного: імпотенція, серцево-судинний розлад, розлад коагуляції крові, невропатія, базований на хронобіології розлад, запальний розлад, циркадний розлад сну, ендокринний розлад, неопластична хвороба, розлад імунної системи, стан, асоційований зі старінням, офтальмологічна хвороба, приступи головного болю, мігрень, розлад стабілізації діабету або приросту маси; або з метою розмноження тварин. 21. Фармацевтична композиція за п. 12, де названа композиція є в одиничній формі дозування, котра надає кількість сполуки за п. 1 або її солі або стереоізомера, ефективну для лікування або попередження розладу сну, порушення сну або для підвищення якості сну, або для зміни циркадного ритму. 22. Фармацевтична композиція за п. 21, котра, крім того, містить гіпнотичний, анксіолітичний, нейролептичний, седативний засіб, транквілізатор, агоніст або антагоніст мелатоніну, мелатонін, бензодіазепін, барбітурат або антагоніст 5НТ-2. 23. Фармацевтична композиція за п. 12, де названа композиція є в одиничній формі дозування, котра надає кількість сполуки за п. 1 або її солі або стереоізомера, ефективну для лікування або попередження діабету. 24. Фармацевтична композиція за п. 23, котра, окрім того, містить антидіабетичний засіб. 25. Спосіб лікування або попередження наступного: резистентність до інсуліну, діабет II типу, асоційована з інсультом втрата нейронів, ішемія, травма центральної нервової системи, розлад центральної нервової системи, нейродегенеративна хвороба, шкідливі наслідки надстимулювання збуджувальних амінокислот, психіатрична хвороба, епілепсія або інший конвульсивний розлад, занепокоєння, розлад сну, хронічний біль, глаукома, ретиніт CMV, енурез, толерантність до опіату або симптомів відміни; або для індукувальної анестезії; або для підсилення пізнання, який полягає у призначенні тварині або людині при потребі ефективної кількості фармацевтичної композиції, яка містить ефективну кількість сполуки, солі або стереоізомера за п. 1 але без виключення. 26. Спосіб лікування або попередження наступного: імпотенція, серцево-судинний розлад; невропатія, запальний розлад, невропатія, базований на хронобіології розлад, циркадний розлад сну, ендокринний розлад, неопластична хвороба, розлад імунної системи, стан, асоційований зі старінням, офтальмологічна хвороба, приступи головного болю, мігрень, розлад приросту маси; або для регулювання фертильності, статевої зрілості або кольору волосяного покриву як засіб у тваринництві, або для захисту шкіри, який полягає у призначенні тварині або людині при потребі такого лікування композиції, що містить ефективну кількість сполуки, солі або стереоізомера за п. 1 але без виключення. 27. Спосіб для зміни циркадного ритму, для покращення якості сну або для лікування або попередження розладу сну або порушення сну в людини або тварини при їхній потребі, який полягає в призначенні названій людині або тварині композиції, що містить ефективну кількість сполуки, солі або стереоізомера за п. 1 але без виключення. 28. Спосіб за п. 27, де названу композицію призначено в комбінації з відомим засобом, корисним для покращення якості сну, попередження або лікування розладу сну або порушення сну. 29. Спосіб за п. 28, де названий засіб охоплює гіпнотичний, анксіолітичний, антипсихотичний, седативний засіб, транквілізатор, агоніст або антагоніст мелатоніну, мелатонін, бензодіазепін, барбітурат або антагоніст 5НТ-2. 30. Спосіб за п. 27, котрий призначено в комбінації з лікуванням світлом. 31. Спосіб лікування або попередження діабету людини при потребі лікування, котрий полягає в призначенні названій людині композиції, що містить ефективну кількість сполуки, солі або стереоізомера за п. 1, але без виключення. 32. Спосіб за п. 31, де названу композицію призначено в комбінації з відомим антидіабетичним засобом. 33. Спосіб за п. 25, де названа композиція є у формі, придатній для перорального, парентерального, інтраназального, вагінального, ректального, сублінгвального або місцевого призначення. 34. Спосіб за п. 26, де названа композиція є у формі, придатній для перорального, парентерального, інтраназального, вагінального, ректального, сублінгвального або місцевого призначення. 35. Спосіб за п. 25, де названа композиція є в пероральній формі дозування подовженого вивільнення. 28
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 405/12, A61K 31/351, A61K 31/4045, A61P 3/10, A61P 25/20
Мітки: спосіб, отримання, похідні, піроніндолу
Код посилання
<a href="https://ua.patents.su/31-104988-pokhidni-pironindolu-ta-sposib-kh-otrimannya.html" target="_blank" rel="follow" title="База патентів України">Похідні піроніндолу та спосіб їх отримання</a>
Попередній патент: Похідні 3-(2,6-диметилбензилокси)фенілоцтової кислоти
Наступний патент: Каністра і контейнер для транспортування, зберігання та/або утримання відходів ядерного палива
Випадковий патент: Машина для здрібнення матеріалів різної твердості












