Циклоалкільні похідні 3-гідрокси-4-піридинонів
Номер патенту: 84178
Опубліковано: 25.09.2008
Автори: Там Тім Фет, Лі Ванрен, Спіно Майкл, Ванг Їнгшенг, Зао Янкінг, Ша Біренкумар Хасмукхбхал
Формула / Реферат
1. Сполука 3-гідроксипіридин-4-он формули І:
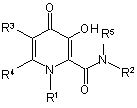 ,
,
де:
R1 є Х, за умови, що R2 є Y;
або
R1 - це Т, за умови, що R2 - це W;
або
R1 є Х, за умови, що R2R5N, взяті разом, утворюють гетероциклічне кільце, вибране з піперидинілу, морфолінілу, піролідинілу або піперазинілу, де піперидинільна, морфолінільна, піролідинільна або піперазинільна група є або незаміщеною, або заміщеною однією з трьох С1-С6 алкільних груп;
Х є С3-С6 циклоалкілом;
Y вибраний з групи, що складається з С3-С6 циклоалкілу, С1-С6 алкілу та С1-С6 алкілу, монозаміщеного С3-С6 циклоалкілом;
Т є С1-С6 алкілом;
W є С3-С6 циклоалкілом;
R3 вибраний з групи, що складається з водню та С1-С6 алкілу;
R4 вибраний з групи, що складається з водню та С1-С6 алкілу;
R5 вибраний з групи, що складається з водню та С1-С6 алкілу;
та/або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, де R1 - це Т, за умови, що R2 є W.
3. Сполука за п. 2, де Т є С1-С6 алкілом та W є С3-С6 циклоалкілом.
4. Сполука за п. 3, де Т є метилом, W є циклопропілом, R3 є воднем, R4 є метилом і R5 є воднем, вказана сполука є циклопропіламідом 3-гідрокси-1,6-диметил-4-оксо-1,4-дигідропіридин-2-карбонової кислоти.
5. Сполука за п. 1, де R1 є Х, за умови, що R2 є Y.
6. Сполука за п. 5, де Х є С3-С6 циклоалкілом, Y є С3-С6 циклоалкілом і R5 є воднем.
7. Сполука за п. 6, де X є циклопропілом та Y є циклопропілом, R3 є воднем, R4 є метилом, вказана сполука є N,1-дициклопропіл-3-гідрокси-6-метил-4-оксо-1,4-дигідропіридин-2-карбоксамідом.
8. Сполука за п. 5, де Х є С3-С6 циклоалкілом; Y є С1-С6 алкілом та R5 є воднем або метилом.
9. Сполука за п. 8, де Х є циклопропілом та Y є метилом, R3 є воднем, R4 є метилом і R5 є метилом, вказана сполука є 1-циклопропіл-3-гідрокси-N,N,6-триметил-4-оксо-1,4-дигідропіридин-2-карбоксамідом.
10. Сполука за п. 8, де Х є циклопропілом та Y є метилом, R3 є воднем; R4 є метилом, R5 є воднем, вказана сполука є метиламідом 1-циклопропіл-3-гідрокси-6-метил-4-оксо-1,4-дигідропіридин-2-карбонової кислоти.
11. Фармацевтична композиція, що містить метиламід 1-циклопропіл-3-гідрокси-6-метил-4-оксо-1,4-дигідропіридин-2-карбонової кислоти та фармацевтично придатний носій.
12. Фармацевтична композиція за п. 11, адаптована для орального застосування.
13. Сполука 3-гідроксипіридин-4-он формули ІА:
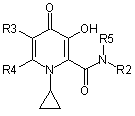 ,
,
де:
R2 вибраний з групи, що складається з С3-С6 циклоалкілу; С1-С6 алкілу; С1-С6 алкілу, монозаміщеного С3-С6 циклоалкілом;
R5 вибраний з групи, що складається з водню та від С1 до С6 алкілу;
R2R5N узяті разом утворюють гетероциклічне кільце, вибране з піперидинілу, морфолінілу, піролідинілу або піперазинілу, де піперидинільна, морфолінільна, піролідинільна або піперазинільна група є або незаміщеною, або заміщеною однією з трьох С1-С6 алкільних груп;
R3 вибраний з групи, що складається з водню та С1-С6 алкілу;
та
R4 вибраний з групи, що складається з водню та С1-С6 алкілу.
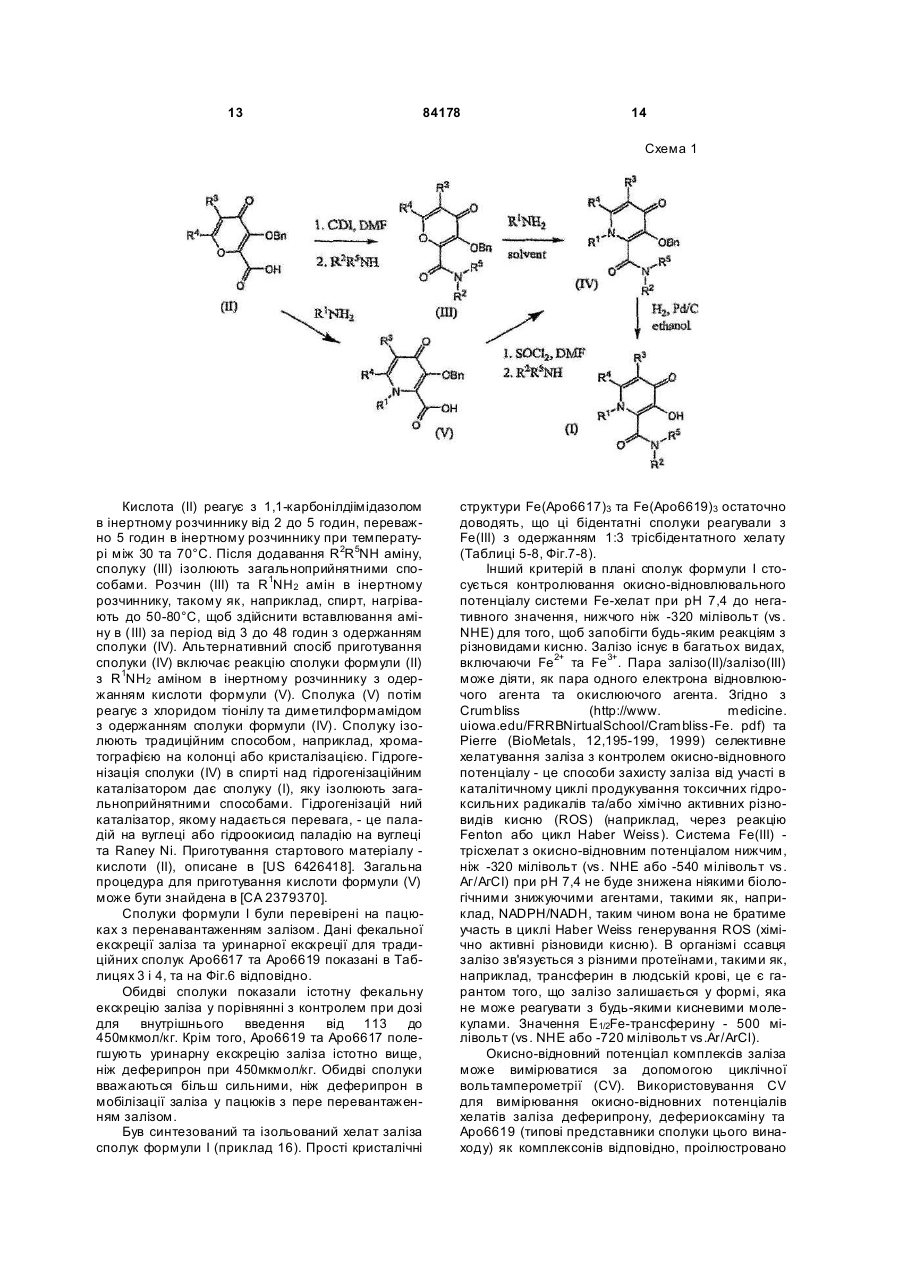
14. Спосіб одержання сполуки формули ІА
 ,
,
де:
R2 вибраний з групи, що складається з С3-С6 циклоалкілу; С1-С6 алкілу; С1-С6 алкілу, монозаміщеного С3-С6 циклоалкілом;
R5 вибраний з групи, що складається з водню та С1-С6 алкілу;
R2R5N узяті разом утворюють гетероциклічне кільце, вибране з піперидинілу, морфолінілу, піролідинілу або піперазинілу, де піперидинільна, морфолінільна, піролідинільна або піперазинільна група є або незаміщеною, або заміщеною однією з трьох С1-С6 алкільних груп;
R3 вибраний з групи, що складається з водню та С1-С6 алкілу;
та
R4 вибраний з групи, що складається з водню та С1-С6 алкілу,
при якому проводять етап депротектування бензольної групи в реакції гідрогенізації сполуки загальної формули 3-бензилоксипіридин-4-он або її гідрохлориду
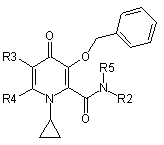 ,
,
де R2, R5, R2R5N, R3, R4 є такими, як визначено в п. 1.
15. Спосіб за п. 14, де реакцію гідрогенізації проводять з паладієм на деревному вугіллі або з гідрохлоридом паладію на деревному вугіллі та з воднем в інертному розчиннику, вибраному з групи, що складається з метанолу, етанолу або ізопропанолу.
16. Фармацевтична композиція, що містить сполуку, вказану в п. 1, та фізіологічно прийнятний носій.
17. Фармацевтична композиція за п. 16, яка адаптована для орального застосування.
18. Застосування сполуки, вказаної в п. 1, для приготування медикаменту для лікування медичних станів, пов'язаних з токсичною концентрацією заліза.
Текст
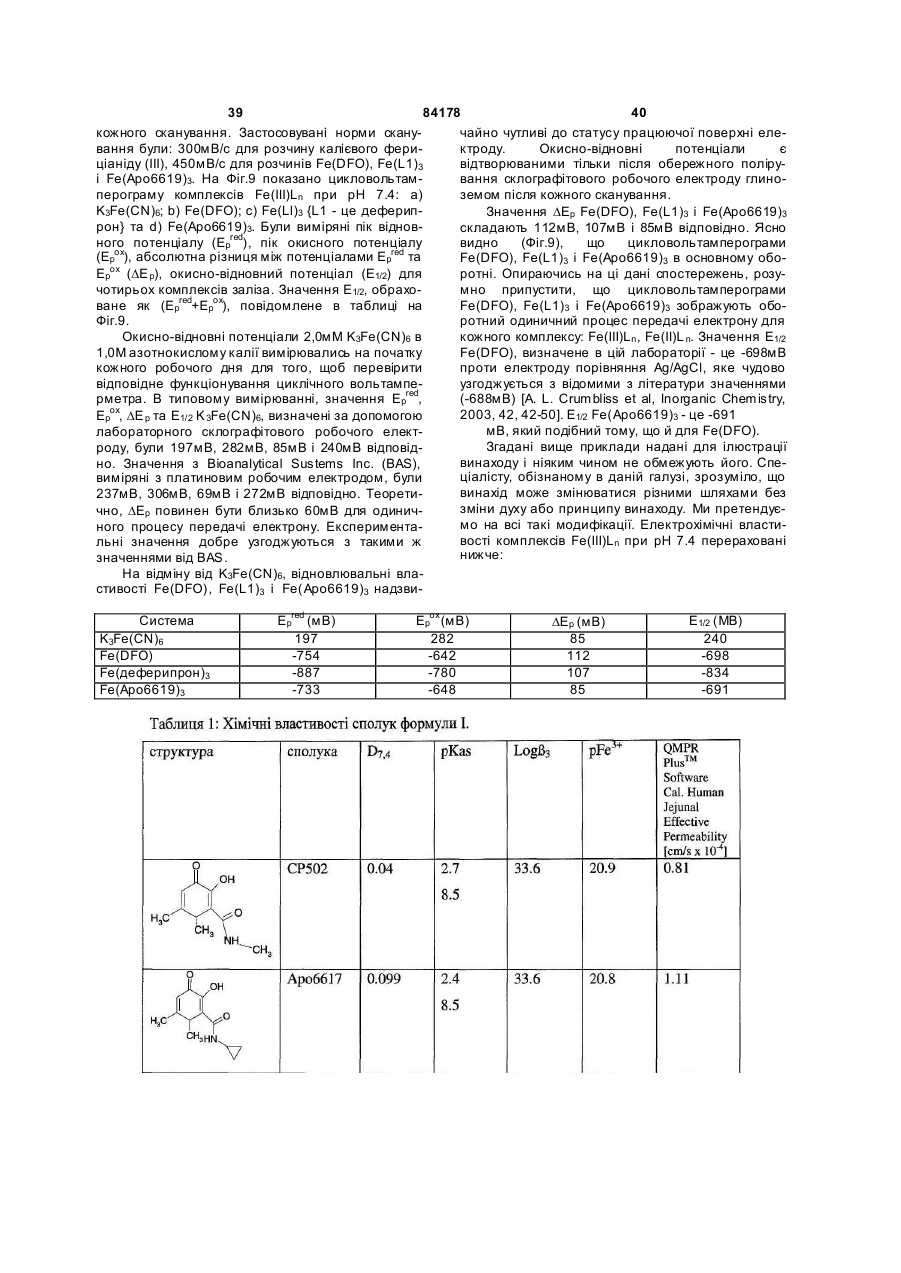
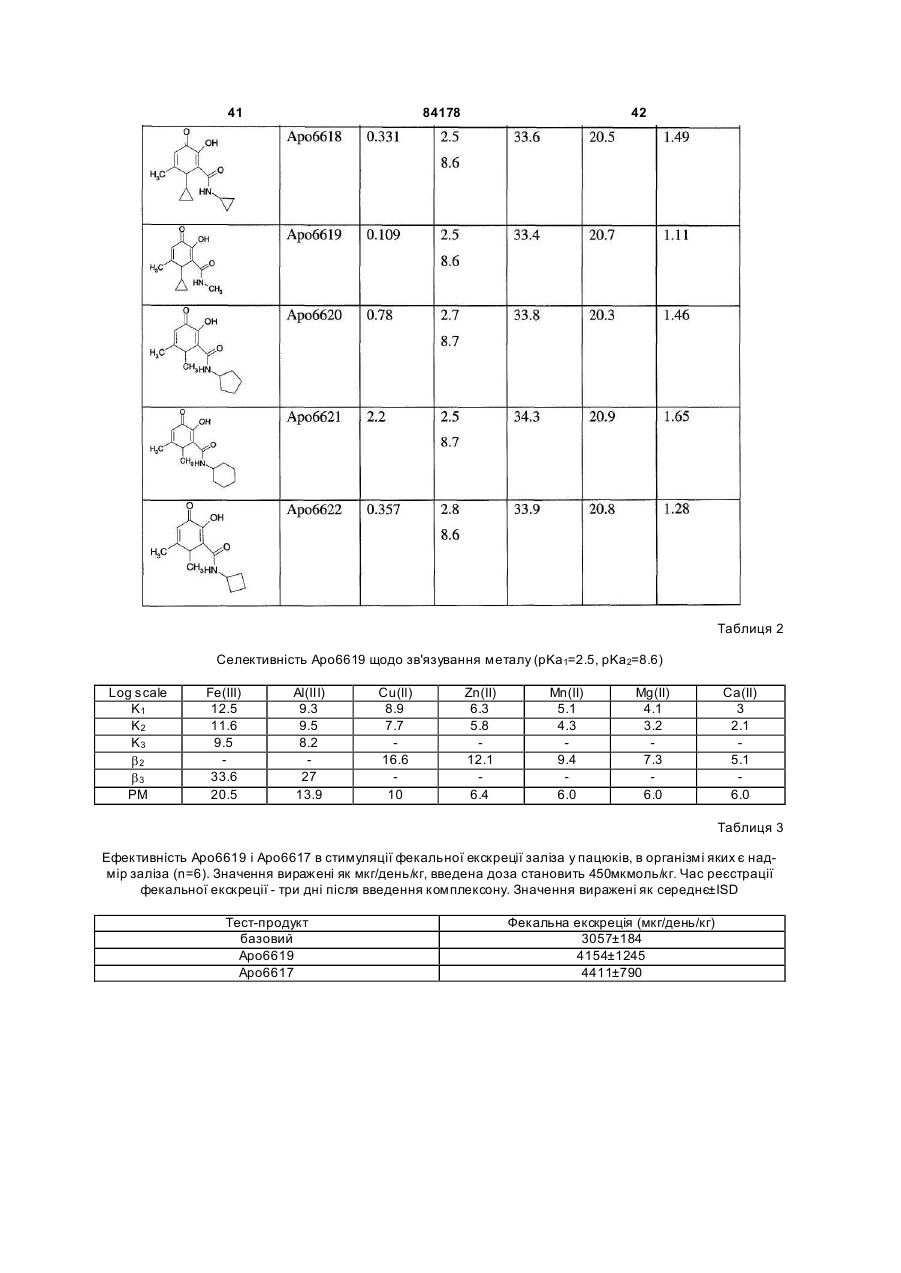
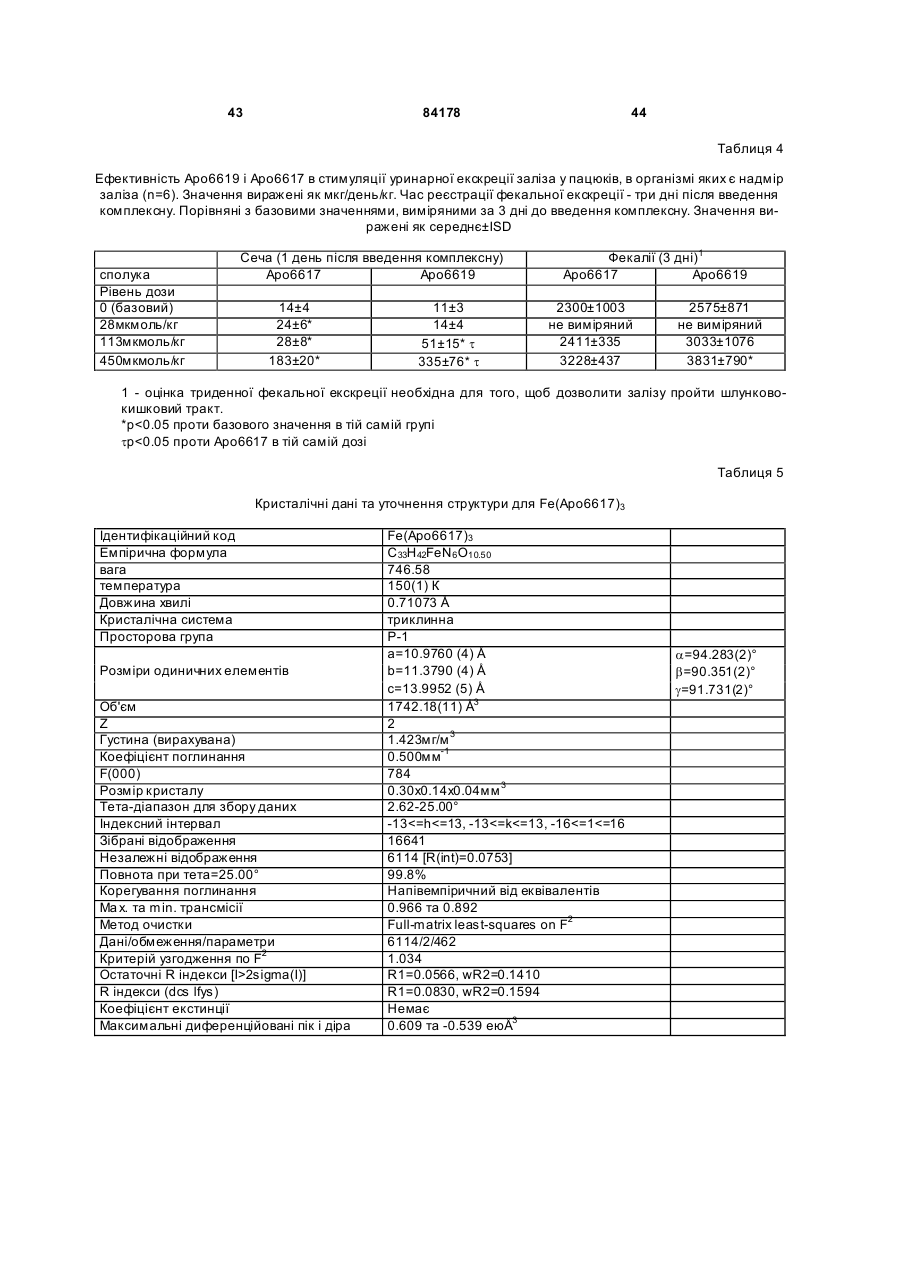
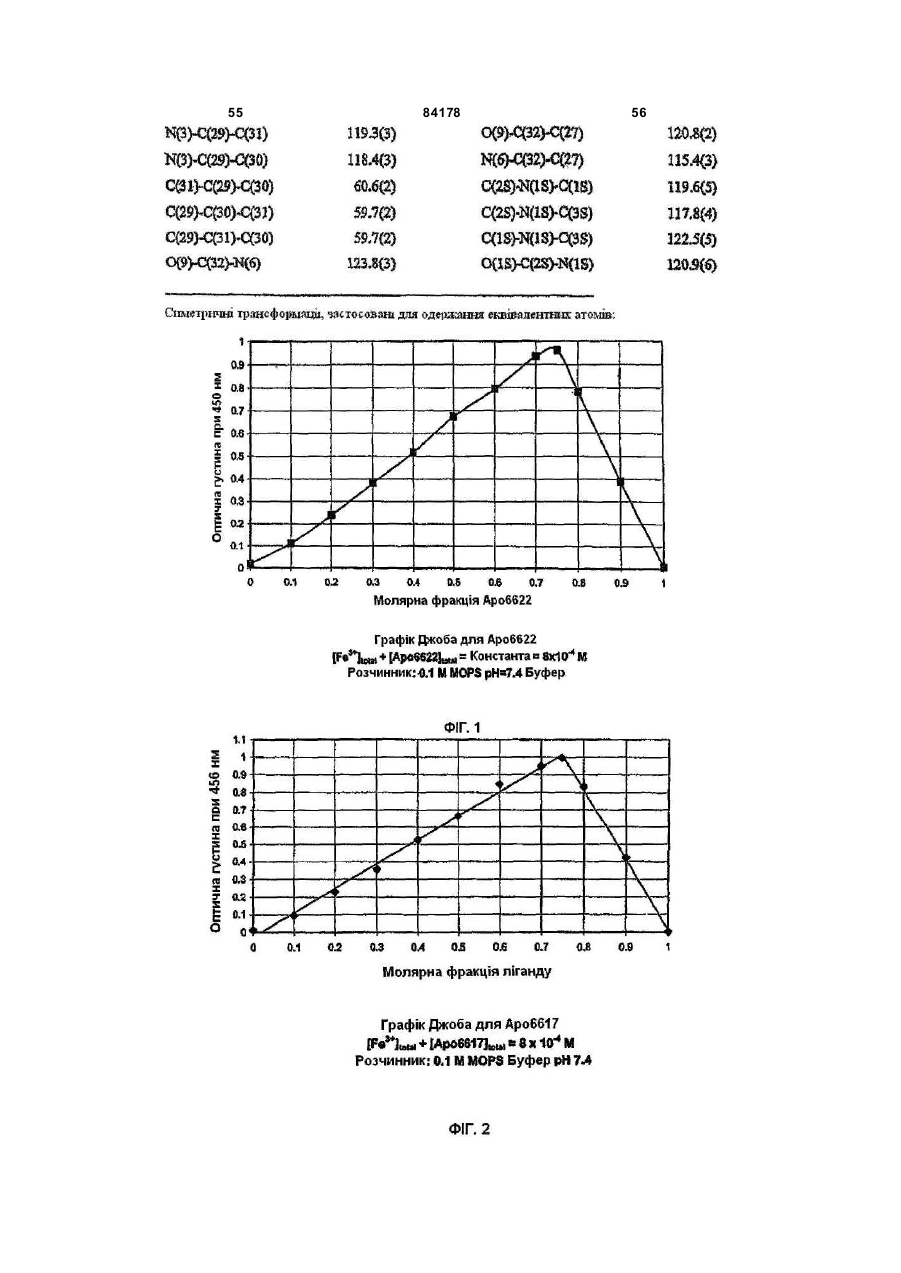
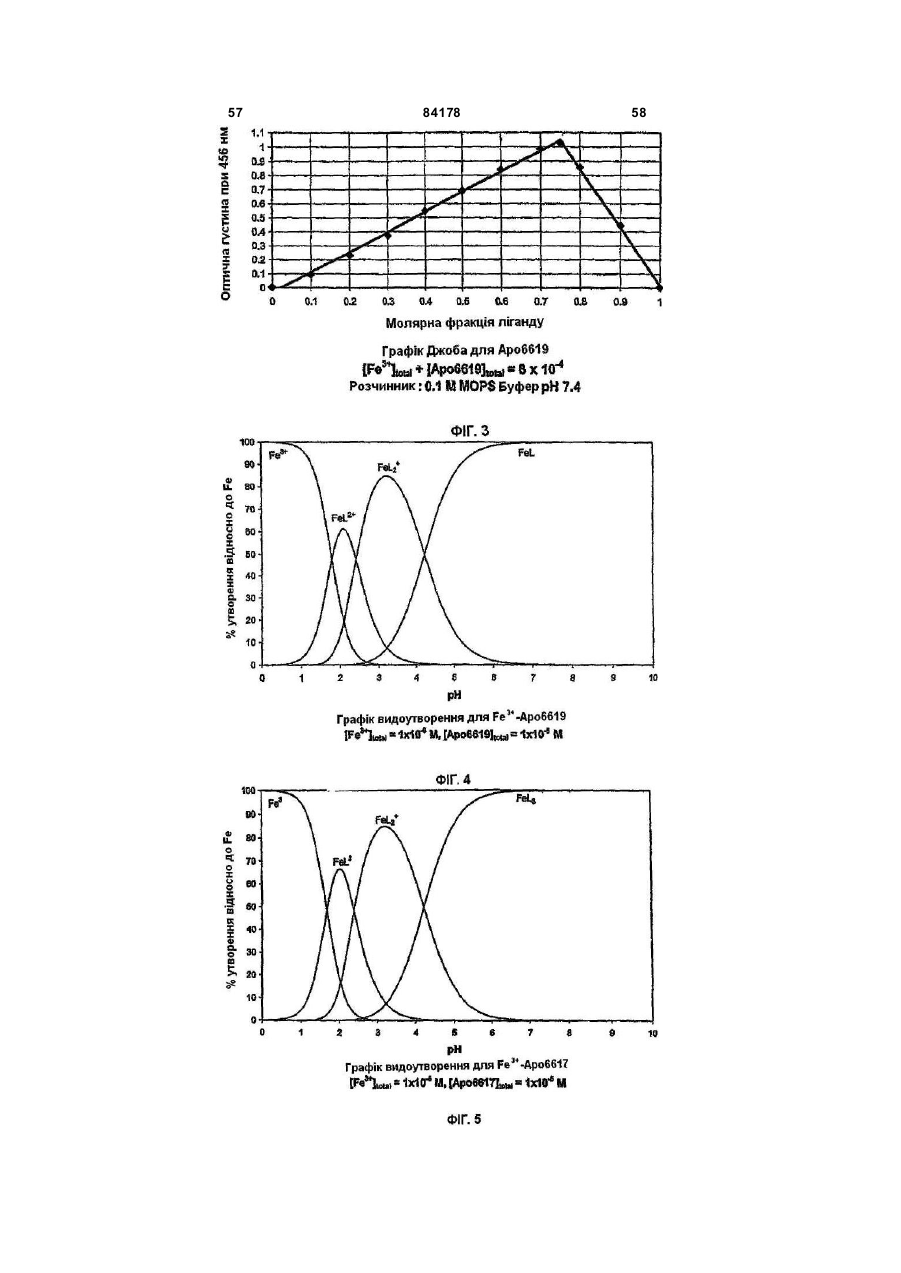
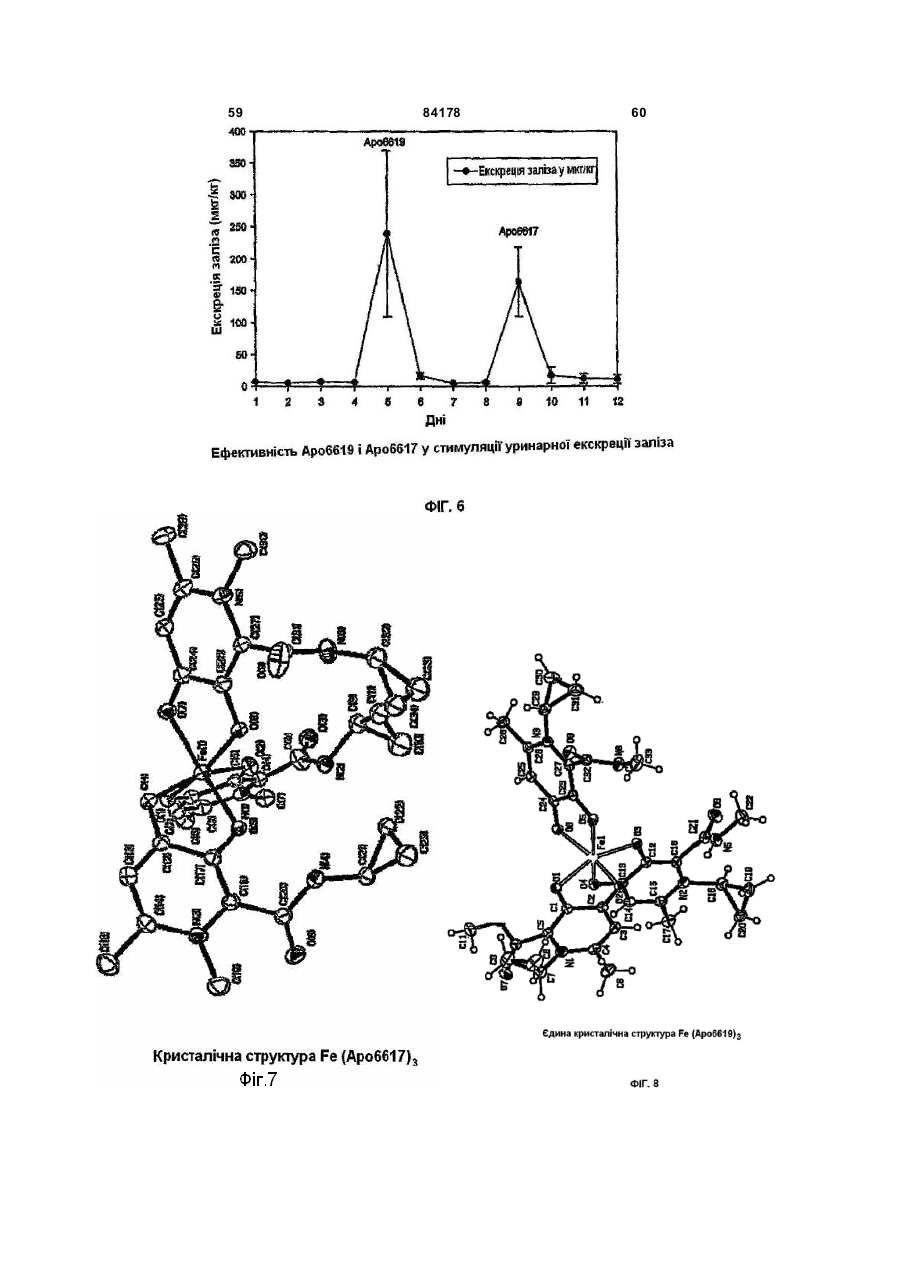
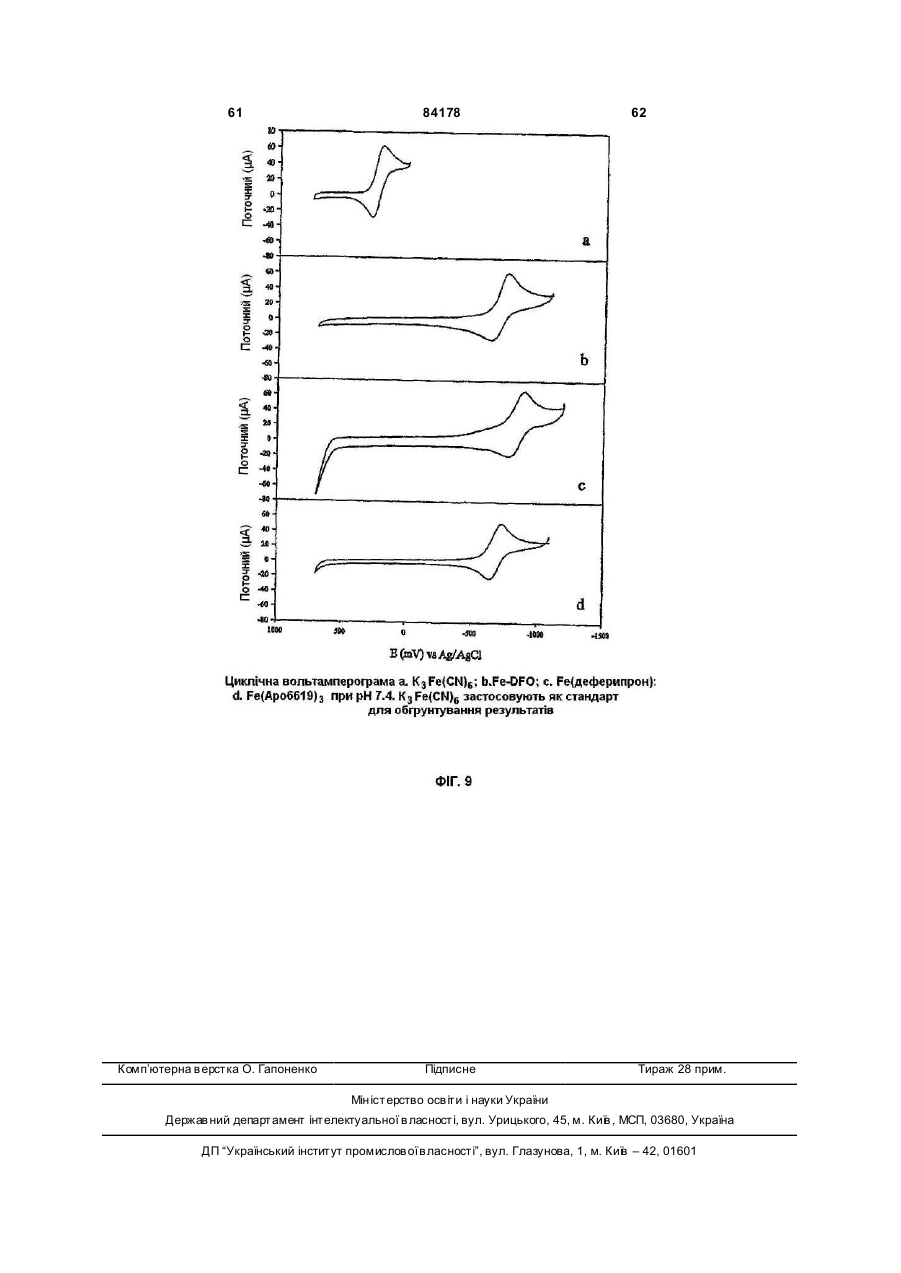
1. Сполука 3-гідроксипіридин-4-он формули І: O 2 (19) 1 3 84178 4 11. Фармацевтична композиція, що містить метилR5 вибраний з групи, що складається з водню та амід 1-циклопропіл-3-гідрокси-6-метил-4-оксо-1,4С1-С6 алкілу; дигідропіридин-2-карбонової кислоти та фармацеR2R5N узяті разом утворюють гетероциклічне кільвтично придатний носій. це, вибране з піперидинілу, морфолінілу, піроліди12. Фармацевтична композиція за п. 11, адаптованілу або піперазинілу, де піперидинільна, морфона для орального застосування. лінільна, піролідинільна або піперазинільна група 13. Сполука 3-гідроксипіридин-4-он формули ІА: є або незаміщеною, або заміщеною однією з трьох O С1-С6 алкільних груп; R3 вибраний з групи, що складається з водню та R3 OH С1-С6 алкілу; R5 та N R4 вибраний з групи, що складається з водню та R4 N R2 С1-С6 алкілу, O при якому проводять етап депротектування бен, зольної групи в реакції гідрогенізації сполуки загаде: льної формули 3-бензилоксипіридин-4-он або її R2 вибраний з групи, що складається з С 3-С6 цикгідрохлориду лоалкілу; С1-С6 алкілу; С1-С 6 алкілу, монозаміщеного С3-С6 циклоалкілом; R5 вибраний з групи, що складається з водню та O від С 1 до С 6 алкілу; R3 O R2R5N узяті разом утворюють гетероциклічне кільR5 це, вибране з піперидинілу, морфолінілу, піролідиN нілу або піперазинілу, де піперидинільна, морфоR4 N R2 лінільна, піролідинільна або піперазинільна група O є або незаміщеною, або заміщеною однією з трьох С1-С6 алкільних груп; , R3 вибраний з групи, що складається з водню та де R2, R5 , R2R5N, R 3, R4 є такими, як визначено в п. 1. С1-С6 алкілу; 15. Спосіб за п. 14, де реакцію гідрогенізації прота R4 вибраний з групи, що складається з водню та водять з паладієм на деревному вугіллі або з гідС1-С6 алкілу. рохлоридом паладію на деревному вугіллі та з 14. Спосіб одержання сполуки формули ІА воднем в інертному розчиннику, вибраному з групи, що складається з метанолу, етанолу або ізоO пропанолу. R3 OH 16. Фармацевтична композиція, що містить сполуR5 ку, вказану в п. 1, та фізіологічно прийнятний ноN сій. R4 N R2 17. Фармацевтична композиція за п. 16, яка адапO тована для орального застосування. , 18. Застосування сполуки, вказаної в п. 1, для приде: готування медикаменту для лікування медичних R2 вибраний з групи, що складається з С 3-С6 цикстанів, пов'язаних з токсичною концентрацією залоалкілу; С1-С6 алкілу; С1-С 6 алкілу, монозаміщеліза. ного С3-С6 циклоалкілом; Винахід стосується нових похідних 3-гідрокси4-піридинону та їх використовування в хелатуванні іонів заліза (III). Більш особливо, винахід стосується циклоалкільних похідних 3-гідрокси-4піридинону. 3-Гідрокси-4-піридинони - це бідентатні ліганди, які є комплексонами до іона Fe (III) в співвідношенні 3:1 і корисні при виведенні надмірного заліза з організму людей. Перевантаження залізом може бути від надмірного дієтичного споживання заліза, успадкованих генетичних умов, як наприклад гемохрбматозів, і регулярного переливання крові. Такі переливання використовуються для лікування медичних станів таких, як наприклад, талассемія, анемія серпоподібного еритроциту, ідіоматичні гемохроматози і пластична анемія. Збільшена внаслідок переливання абсорбція заліза приводить до перевантаження залізом. При насиченні організму феритином та трансферином іони депонуються в багатьох тканинах, таких, як наприклад, міокард, печінка та ендокринні органи, наслідком чого є токсичні ефекти. Обсяг дослідження комплексонів заліза та запропонована утилізація комплексонів були розглянуті в [Current Medicinal Chemistry (2003, 10, 983985, Tim F. Tam, et al)]. Комплексони заліза можуть бути корисними для запобігання утворення гідроксирадикалів, для лікування раку, малярії, постішемічної реперфузії та нейродегенеративних захворювань. Комплексони заліза, такі як DesferalÔ (мезилат десферіоксаміну) та FerriproxÔ (деферіпрон), використовуються для видалення надміру 5 84178 6 заліза з організму більшості пацієнтів, що стражгідрокси-4(1Н)-піридинон-2-карбокси-(N,Nдають на талассемію, оскільки людський організм диметил)-аміду гідрохлорид), аналог диметилкарне має ефективних засобів для видалення заліза, бамоїлу. СР502, СР506 і СР508 - це прототипи і закумульованого внаслідок переливання крові. вони не були оцінені для людей. Десфериоксамін вводиться щодня підшкірним Перший аспект даного винаходу забезпечує 3вливанням за період від 8 до 12 годин. На даний гідроксипіридин-4-он сполуку формули І, включаючас деферипрон (1,2-диметил-3-гідрокси-4чи фармацевтично прийнятну сіль сполуки форпіридинон) є доступним лише у формі ліків для мули І, прийому всередину. Він піддається екстенсивному метаболізму в печінці і більше ніж 85 % введеного дозування виводиться разом із сечею як нехелатований O-глюкуронід [Drur Metab. Dispo. 1992,20 (2), 256-261, S. Sinrh, et al.]. Для лікування станів, пов'язаних з перевантаженням залізом, потрібна відносно висока доза для орального введення 75мг/кг (3,5-4г на день). Таким чином, є необхідність ідентифікувати нові орально активні гідроде: ксипіридинони з поліпшеними ніж у деферипрону R1 є X за умови, що R2 є Y; фармакологічними властивостями. або [Voest et. al. (Annals of Internal Medicine R1 - це T за умови, що R 2 - це W; 1994,120, 490-499)] розглянув клінічний досвід або комплексонів заліза в умовах не залізного переваR1 є X за умови, що R2R5N взяті разом, утвонтаження. Комплексони заліза використовувалися рюють гетероциклічне кільце, вибране з піперидидля створення антиоксидантних ефектів, антипронілу, морфолінилу, піролідинілу або піперазинілу, ліферативних ефектів, антипротозойних ефектів де піперидинільна, морфолінильна, піролідинільна та для хелатування алюмінію і можуть використоабо піперазинільна група є або незаміщеною, або вуватися для лікування різноманітних хворобливих заміщеною однією з трьох С1-С6 алкільних груп; станів, таких як, наприклад, ревматоїдний артрит, X є С3-С6 циклоалкілом; для захисту серця від інтоксикації антрацикліном, Y вибраний з групи, що складається з С 3-С6 для обмеження ушкодження міокарду внаслідок циклоалкілу, з від C1 до С6 алкілу та з від C1 до С6 ішемічної реперфузії, як протипухлинні агенти та алкілу, монозаміщеного С3-С6 циклоалкілом; для лікування малярії. Крім того, [van Asbeck B. S. T є від C1 до С 6 алкілом; et.al. (J Clin Virol. 2001 Feb; 20 (3): 141-7)] повідW є С3-С6 циклоалкілом; омив, що комплексони заліза мають анти-HIV акR3 вибраний з групи, що складається з водню тивність. Таким чином утилітарність комплексонів та С1-С6 алкілу; заліза не обмежується тільки лікуванням станів, R4 вибраний з групи, що складається з водню пов'язаних з перевантаженням залізом. та С1-С6 алкілу Представники класу 3-гідрокси-4-піридинонів та відомі за їх здатністю до хелатування заліза. ПроR5 вибраний з групи, що складається з водню тотипи включають [RE 35948, US 6448273, US С1-С6 алкілу. 6335353 та US 5480894]. В [US 6335353] ефірні Другий аспект даного винаходу забезпечує запроліки похідних 3-гідрокси-4-піридинонів викорисстосування сполуки формули І для лікування затовуються для того, щоб полегшити ефективну хворювань, пов'язаних з перевантаженням заліекстракцію заліза з печінки, проте жодна з відповізом. дних сполук не була оцінена для людей. Третій аспект винаходу забезпечує фармацевВ інших підходах, відібрані нові сполуки розтичну композицію, що містить сполуку формули І. роблялися для того, щоб блокувати фазу II метаОдним класом сполук цього винаходу, якому болізму О-глюкуронідації при С3 кисні скелету девіддається перевага, є сполука формули І, в якій ферипрону. [US 5688815] розкриває 1-алкіл-3R1 є X за умови, що R2 є Y. X є С3-С6 циклоалкілом гідрокси-4-піридинони з С2 метильною групою, ; Y є від C1 до С6 алкілом; R3 є воднем; R4 є С3-С6 заміщеною фенільним або гетероїльним кільцем алкілом та R5 є воднем. та гідроксигрупою, та N1 замісник є нижчим алкілом. В [КАРБОНІЛДllМІДАЗОЛ 6335353] описаний 1-алкіл-3-гідрокси-4-піридинон з С2 алкілкарбамоїльною, арилкарбамоїльною або аралкілкарбамоїльною групою та Nl-замісник - це аліфатична вуглеводнева група. Використовування С2метилкарбамоїльної функціональності в сполуках, таких як, наприклад, СР502 (1,6-диметил-3гідрокси-4(1Н)-піридинон-2-карбокси-(N-метил)Сполукою цього підкласу, якій віддається ще аміду гідрохлорид; [US 6335353]) ефективно блобільша перевага, є сполука формули І, в якій R4 є кувало О-глюкуронідацію при СЗ3кисні. Інші анаметилом, X є циклопропілом та Y є метилом і спологи в [US 6335353] включають СР506 (1,6лука є метиламідом 1-циклопропіл-3-гідрокси-6диметил-3-гідрокси-4(1Н)-піридинон-2-карбоксиметил-4-оксо-1,4-дигідропіридин-2-карбонової кис(N-iзопропіл)-аміду гідрохлорид), аналог С2лоти. ізопропілкарбамоїлу та СР508 (1,6-диметил-3 7 84178 Другим класом сполук цього винаходу, якому віддається перевага, є сполука формули І, в якій R1 є X за умови, що R2 - це Y, X є С3-С6 циклоалкілом, Y є С3-С6 циклоалкілом, R3 - це водень, R4 є С1-С6 алкілом та R5 є воднем. В цьому підкласі сполукою, якій віддається перевага, є сполука, в якій R4 є метилом, X=Y=циклопропілу та сполука є циклопропіламідом 1-циклопропіл-3-гідрокси-6-метил-4-оксо-1,4дигідропіридин-2-карбонової кислоти. 8 Сполукою цього підкласу, якій віддається найбільша перевага, є сполука формули І, в якій R є метилом, X - це циклопропіл та Y - це метил, і сполука це 1-циклопропіл-3-гідрокси-N,N,6триметил-4-оксо-1,4-дигідропіридин-2-карбоксамід. Сполукою цього винаходу, якій віддається найбільша перевага, є сполука IA, сполука формули І, в якій R3=H, R4=метилу, за умови, що R1=X=циклопропілу, R2=Y та Y вибраний з групи, що складається з C3-C6 циклоалкілу; з від C1 до C6 алкілу; з від C1 до C6 алкілу, монозаміщеного C3-C6 циклоалкілом; або R1=X=циклопропілу, R2R5N узяті разом утворюють гетероциклічне кільце, вибране з піперидинілу, морфолінилу, піролідинілу або піперазинілу, де піперидинільна, морфолінильна, піролідинільна або піперазинільна група є або не заміщеною, або заміщеною однією з трьох С 1-С6 алкільних гр уп. Третім класом сполук формули І, якому віддається перевага, є сполука, в якій R1 - це T за умови, що R2 є W; T є від C1 до C6 алкілом ; W є С3С6б циклоалкілом, R3 є воденем, R4 є С1-С6 алкілом та R5 є воднем. Сполукою цього підкласу, якій віддається більша перевага, є сполука, в якій R4 є метилом, T є метилом та W - це циклопропіл, сполука - це циклопропіламід 3-гідрокси-1,6-диметил-4-оксо-і ,4дигідропіридин-2-карбонової кислоти. Четвертим класом сполук цього винаходу, якому віддається перевага, є сполука формули І, в якій R1 є X за умови, що R2 - це Y, X є С3-С6 циклоалкілом; Y є від C1 до C 6 алкілом; R3 є воднем; R4 є С1-С6 алкілом та R5 є метилом. В аспекті вищесказаного даний винахід забезпечує циклоалкільні похідні 3-гідрокси-4піридинону, що мають поліпшені властивості в порівнянні зі сполуками, розглянутими в попередньому рівні техніки. Циклоалкільна група приєднана до N1 та/або С2 амідного N атома. До цього опису, сполуки з N1-циклоалкільним замісником або С2 амідо-N-циклоалкільним замісником були невідомі з літератури. Ці сполуки не є проліками, але мають дуже хорошу селективність щодо іона металу. Вони не демонструють комплексоутворення з основними металами, такими як, наприклад, кальцій та магній, при pH 7,4 в хімічних дослідженнях. Значення D7,4 знаходиться в межах ряду, встановленого для ліків деферипрон, і сполука є активною при прийомі всередину в моделі на пацюках, в організмі яких є надмір заліза. Ці сполуки розроблялися з придатним фенольним С3 OH pKas в межах від 8.3 до 8.8, значення Fe3+ вище ніж 20, співвідношення хелатних утворень заліза 1:3, що є очевидним з графіка Джоба, та значення D7,4>0.1. Проста кристалічна структура хелату Fe(III) підтверджує, що сполука формули І це бідентатний ліганд. Фіг.1 - це схематичне уявлення графіка Джоба для Аро6622(циклопропіламід 1-циклопропіл-3гідрокси-6-метил-4-оксо-1,4-дигідропіридин-2карбонової кислоти), сполука формули І. Фіг.2 - це схематичне уявлення графіка Джоба для Аро6617 (циклопропіламід 1,6-етан-3-гідрокси4-оксо-1,4-дигідропіридин-2-карбонової кислоти), сполука формули І. 9 84178 10 Фіг.3 - це схематичне уявлення графіка Джоба Фармацевтично прийнятні солі, отримані з недля Аро6619 (метиламід 1-циклопропіл-3-гідроксиорганічних основ, являють собою солі натрію, ка6-метил-4-оксо-1,4-дигідропіридин-2-карбонової лію, літію, амонію, кальцію та магнію. Особлива кислоти), сполука формули І. перевага віддається солям натрію, кальцію і магФіг.4 - це графік видоутворення для Fe3+нію. Фармацевтично прийнятні, не токсичні солі, Apo6619. отримані з органічних основ, являють собою солі Фіг.5 - це графік видоутворення для Fe3+первинних, вторинних і третинних амінів, заміщеApo6617. них амінів, включаючи заміщені аміни природного Фіг.6: Ефективність Аро6619 і Аро6617 в стипоходження, циклічні аміни та основні іонообмінні муляції уринарної екскреції заліза у пацюків, в орсмоли. Прикладами таких солей є, наприклад, 2ганізмі яких є надмір заліза (n=6). amino-2-гідроксиметилпропан-1,3-діол, ізопропілаФіг.7: Єдина кристалічна структура Fe мін, трометамін, глюкозамін, метилглюкамін, пури(Аро6617)з хелату. ни, піперазини, піперидин, N-етилпіперидин, поліФіг.8: Єдина кристалічна структура Fe амінові смоли та подібне. (Аро6619)з хелату. Фармацевтично прийнятні адитивні кислі солі Фіг.9: Циклічна вольтамперограма системи Feодержують з неорганічних та органічних кислот, Apo6619 при рН 7.4. таких як, наприклад, галокислоти, сірчана кислота, Таблиця 1: Хімічні властивості сполуки форазотна кислота, фосфорна кислота, метансульфомули І. нова кислота та етансульфонова кислота. Таблиця 2: Селективність Аро6619 щодо зв'яСполуки цього винаходу - це 2-амідо похідні 4зування металу. оксо-1,4-дигідропіридин-2-карбоксаміду похідних, Таблиця 3: Ефективність Аро6619 і Аро6617 в що мають загальну стр уктур у: стимуляції фекальної екскреції заліза у пацюків, в організмі яких є надмір заліза (n=6). Значення виражені як мкг/день/кг. Таблиця 4: Ефективність Аро6619 і Аро6617 в стимуляції уринарної та фекальної екскреції заліза у пацюків, в організмі яких є надмір заліза (n=6/група). Значення виражені як мкг/день/кг. Фекальна екскреція, оцінена за 3 дні після введення хелату, порівняна з базовими значеннями, визнаБільшість сполук названі як похідні 4-оксо-1,4ченими за 3 дні до введення хелату. Значення дигідропіридин-2-карбоксаміду, наприклад: виражені як середнє ± ISD. 1-циклопропіл-N-гексил-3-гідрокси-6-метил-4Таблиця 5: Кристалічні дані та уточнення струоксо-1,4-дигідропіридин-2-карбоксамід: ктури для Fe (Аро6617)3. Таблиця 6: Довжина зв'язку [А] та кут [°] для Fe (Аро6617)3. Таблиця 7: Кристалічні дані та уточнення структури для Fe (Аро6619)3. Таблиця 8. Довжина зв'язку [А] та кут [°] для Fe (Аро6619)3. Як тут використано: Алкіл означає розгалужений або нерозгалужений насичений вуглеводневий ланцюг, що має, якщо інше не згадується, від одного до шести вугN-циклогексил-1-циклопропіл-3-гідрокси-6лецевих атомів, включаючи, але не обмежуючись, метил-4-оксо-1,4-дигідропіридин-2-карбоксамід: метил, етил, пропіл, ізопропіл, н-пропіл, бутил, сек-бутил, ізобутил, н-пентил, гексил. Термін "циклоалкіл", що тільки тут використовується або як частина іншої групи, включає насичені циклічні вуглеводневі групи, які містять одне кільце, включаючи моноциклічний алкіл, що в сумі містить від 3 до 6 вуглеців, утворюючи кільце, що включає циклопропіл, циклобутил, циклопентил і циклогексил. N-(циклогексилметил)-1-циклопропіл-3Фармацевтично прийнятні, нетоксичні солі відгідрокси-6-метил-4-оксо-1,4-дигідропіридин-2носяться до фармацевтично прийнятних солей карбоксамід: сполук винаходу, які зберігають біологічну активність сполук-попередників і не є біологічно або іншим чином небажаними (наприклад стійкі солі). Солі двох типів можуть бути утворені зі сполук цього винаходу: (1) Солі неорганічних і органічних основ зі сполуками формули І, які мають фенольну функціональну груп у, і (2) Адитивні кислі солі можуть бути утворені з функціональної аміно групи сполук формули І цього винаходу. 11 84178 12 pFe3+ 19,7. pKas деферипрону складає 3,56 та 9,64. Більшість сполук цього винаходу мають подібні константи комплексоутворення (Іог (b 3) в межах від 34 до 36, pFe3+>20 і придатні значення рKа фенолу від 8,3 до 8,8. Відповідно, сполуки цього винаходу - це чудові комплексони Fe(III). Теоретично вирахувана ефективна проникність [Peff] людської порожньої кишки сполук цього винаходу передбачена обчислювальним програмним забезпеченням із застосуванням QMPRP1Ô (від В деяких випадках, сполуки винаходу називаSimulationpl inc.). Більшість сполук цього винаходу ють, використовуючи за основу корінь "піридинмає вирахуван у Peff в межах від 1±0,3 (см/с´10-4), 4(1H)-oн". Прикладами є: передбачаючи, що сполуки мають хорошу проник1-циклопропіл-3-гідрокси-6-метил-2ність людської порожньої кишки. Хімічні властиво(морфолін-4-ілкарбоніл)піридин-4(1Н)-он: сті типових представників сполук формули І наведені в Таблиці 1. В основному, сполуки формули І з циклоалкільними групами при R1 та/або R2 - це комплексони металу із високими значеннями pFe3+. Значення D74 сполук формули І є подібним до деферипрону та подальше вивчення перевантаження залізом у пацюків показало, що сполуки формули І ефектив1-циклопропіл-3-гідрокси-6-метил-2-[(4ні у видаленні заліза in vivo. Деталі вивчення ефеметилпіперазин-1-ілкарбоніл]піридин-4(1Н)-он: ктивності на тваринах показані в прикладах нижче. Сполуки формули І не зв'язують основні метали, такі як, наприклад, марганець, кальцій і магній. Значення рМ та констант комплексоутворення сполуки формули І показані в Таблиці 2 (та більш детально обговорюються в прикладі 11). Сполука має перевагу щодо зв'язування Fe3+ над іншими двовалентними і тривалентними металами, такими як, наприклад, Cu, Zn та Al. Термін "тварини" відноситься до людей, так Сполуки формули І - це нові циклоалкільні посамо як і до всіх інших тваринних різновидів, особхідні 3-гідрокси-4-піридинони. Вони мають значенливо ссавців (наприклад, собаки, коти, коні, велика ня pFe3+ вище ніж 20, придатне значення D74 порогата худоба, свині і т.п.), плазунів, риб, комах та рівнянне з деферипроном, перевагу у напрямку до глистів. хелатування Fe та С2-алкілкарбамоїл або С2Сполуки цього винаходу розроблялися для тоциклоалкілкарбамоїл частину, яка розроблена для го, щоб поліпшити властивості відомих аналогів того, щоб блокувати фаз у II метаболізму 3-ОН деферипрону. Одним критерієм, застосованим в групи. плані логічного обґрунтування оральної активності На додаток до згаданого вище, сполуки форхелатів з ряду 3-гідрокси-4-піридинонів, є сполуки, мули І зв'язують Fe3+ в співвідношення 1:3 у фізіо3+ що мають значення pFe вище, ніж деферипрон логічних умовах при рН 7,4. Аналіз графіка Джоба (pFe3+=19.7). Використовуване тут визначення підтверджує пропорцію комплексону до заліза у 3+ pFe - це концентрація іона заліза в розчині, коли співвідношенні 1:3 (Фіг.(1-3) та приклад 9). -6 загальна кількість всього заліза складає 10 M та Графіки видоутворення варіантів Fe-5 концентрація ліганда складає 10 M i рН=7,4. Це комплексу різних pHs можуть обчислюватися за обраховано, використовуючи експериментально допомогою використовування програмного забезвизначені рKа та константи комплексування метапечення Hyperquad Stimulation and Speciation лу за допомогою Hyperquad software (Version 2.1, (HYSS2Ó2000 Protonic Sofware) з вхідним експеPeter Fans, University of Leeds). Зниження значенриментальним pKas (приклад 10 і 11) та констання рKа С3 фенольного ОН нижче, ніж 8,8 гарантує, 3+ тами комплексоутворення K1, K2 та K3 (приклад що значення pFe буде вищим при комбінуванні із 14). Фігури 4 і 5 ілюстр ують графік видо утворення сприятливою константою комплексоутворення b 3. сполук формули І при різному pHs. B обох вивченПоняття комплексоутворення детально описано нях, типові представники сполуки формули І винижче. ключно утворюють FeL3 хелати при рН вищим, ніж Ступінчаті та загальні константи комплексо7,0 (де L - це бідентатний ліганд), тому не гарантуутворення бідентатного ліганда, такого як 3ється присутність ніяких різновидів FeL2+ або FeL2+ гідрокси-4-піридинон, такі: при фізіологічному рН. Відсутність цих різновидів K1 Fe(III)+ліганд®Fе[ліганд]1 гарантує, що там не має доступного in vivo заліза K2 Fе[ліганд]1+ліганд®Fе[ліганд]2 при фізіологічному рН 7,4. K3 Fе[ліганд]2+ліганд®Fе[ліганд]3 Сполуки формули І, в яких R1 є X за умови, що Константа комплексоутворення b 3=K1·K2·K3 R2 - це Y; або R1 - це T за умови, що R2 - це W, Комплексон заліза - ліки деферипрон (1,2приготовані згідно з методом, представленим на диметил-3-гідрокси-4-піридинон) хелатують залізо Схемі 1. з константою комплексоутворення (Іог b 3) 36,3 та 13 84178 14 Схема 1 Кислота (II) реагує з 1,1-карбонілдіімідазолом в інертному розчиннику від 2 до 5 годин, переважно 5 годин в інертному розчиннику при температурі між 30 та 70°C. Після додавання R2R5NH аміну, сполуку (III) ізолюють загальноприйнятними способами. Розчин (III) та R1NH2 амін в інертному розчиннику, такому як, наприклад, спирт, нагрівають до 50-80°C, щоб здійснити вставлювання аміну в (III) за період від 3 до 48 годин з одержанням сполуки (IV). Альтернативний спосіб приготування сполуки (IV) включає реакцію сполуки формули (II) з R1NH2 аміном в інертному розчиннику з одержанням кислоти формули (V). Сполука (V) потім реагує з хлоридом тіонілу та диметилформамідом з одержанням сполуки формули (IV). Сполуку ізолюють традиційним способом, наприклад, хроматографією на колонці або кристалізацією. Гідрогенізація сполуки (IV) в спирті над гідрогенізаційним каталізатором дає сполуку (І), яку ізолюють загальноприйнятними способами. Гідрогенізацій ний каталізатор, якому надається перевага, - це паладій на вуглеці або гідроокисид паладію на вуглеці та Raney Ni. Приготування стартового матеріалу кислоти (II), описане в [US 6426418]. Загальна процедура для приготування кислоти формули (V) може бути знайдена в [CA 2379370]. Сполуки формули І були перевірені на пацюках з перенавантаженням залізом. Дані фекальної екскреції заліза та уринарної екскреції для традиційних сполук Аро6617 та Аро6619 показані в Таблицях 3 і 4, та на Фіг.6 відповідно. Обидві сполуки показали істотну фекальну екскрецію заліза у порівнянні з контролем при дозі для внутрішнього введення від 113 до 450мкмол/кг. Крім того, Аро6619 та Аро6617 полегшують уринарну екскрецію заліза істотно вище, ніж деферипрон при 450мкмол/кг. Обидві сполуки вважаються більш сильними, ніж деферипрон в мобілізації заліза у пацюків з пере перевантаженням залізом. Був синтезований та ізольований хелат заліза сполук формули І (приклад 16). Прості кристалічні структури Fe(Apo6617)3 та Fe(Apo6619)3 остаточно доводять, що ці бідентатні сполуки реагували з Fe(III) з одержанням 1:3 трісбідентатного хелату (Таблиці 5-8, Фіг.7-8). Інший критерій в плані сполук формули І стосується контролювання окисно-відновлювального потенціалу системи Fe-хелат при рН 7,4 до негативного значення, нижчого ніж -320 мілівольт (vs. NHE) для того, щоб запобігти будь-яким реакціям з різновидами кисню. Залізо існує в багатьох видах, включаючи Fe2+ та Fe3+. Пара залізо(II)/залізо(III) може діяти, як пара одного електрона відновлюючого агента та окислюючого агента. Згідно з Crumbliss (http://www. medicine. uiowa.edu/FRRBNirtualSchool/Crambliss-Fe. pdf) та Pierre (BioMetals, 12,195-199, 1999) селективне хелатування заліза з контролем окисно-відновного потенціалу - це способи захисту заліза від участі в каталітичному циклі продукування токсичних гідроксильних радикалів та/або хімічно активних різновидів кисню (ROS) (наприклад, через реакцію Fenton або цикл Haber Weiss). Система Fe(III) трісхелат з окисно-відновним потенціалом нижчим, ніж -320 мілівольт (vs. NHE або -540 мілівольт vs. Аг/АгСI) при рН 7,4 не буде знижена ніякими біологічними знижуючими агентами, такими як, наприклад, NADPH/NADH, таким чином вона не братиме участь в циклі Haber Weiss генерування ROS (хімічно активні різновиди кисню). В організмі ссавця залізо зв'язується з різними протеїнами, такими як, наприклад, трансферин в людській крові, це є гарантом того, що залізо залишається у формі, яка не може реагувати з будь-якими кисневими молекулами. Значення Е1/2Fе-трансферину - 500 мілівольт (vs. NHE або -720 мілівольт vs.Ar/ArCl). Окисно-відновний потенціал комплексів заліза може вимірюватися за допомогою циклічної вольтамперометрії (CV). Використовування CV для вимірювання окисно-відновних потенціалів хелатів заліза деферипрону, дефериоксаміну та Аро6619 (типові представники сполуки цього винаходу) як комплексонів відповідно, проілюстровано 15 84178 16 в прикладі 17 нижче. Хелати заліза, як наприклад, галузі з цього рівня техніки: наприклад, [див. Fe-десфериоксамін (DFO) та Fe-(деферипрон)3 Reminrton's Pharmaceutical Sciences, Mack мають значення окисно-відновного потенціалу Е1/2 Publishinr Company, Easton, Pa., 15th Edition, 1975, при -698 мілівольт (vs. Аг/АгСІ) та -834 мілівольт ch. 83 p.1436-1460, and ch. 89 p.1576-1607]. Фар(vs. Аг/АгСІ) при рН 7,4 відповідно. Сполуки формацевтична композиція для введення в будьмули І такі як Fe(Apo6619)3 мають значення Е1/2 якому випадку буде містити таку кількість активної 691 мілівольт (vs. Аг/АгСІ), подібне до десфериоксполуки, яка буде ефективною для полегшення саміну. Циклічна вольтамперометрія Fe-DFO, симптомів того захворювання, що підлягає лікуFе(деферипрон)3 тa Fe(Apo6619)3 може бути ванню. знайдена на Фіг.9. Одна з переваг комплексонів Фармацевтичні композиції, що містять активцього винаходу - це те, що окисно-відновні потенний інгредієнт, можуть знаходитися у формі, приціали їхніх хелатів заліза лежать в екстремально датній для орального застосування, наприклад, як негативній ділянці при фізіологічному рН 7,4, татаблетки, пігулки, водні або маслянисті суспензії, ким чином їхні хелати заліза не братимуть участь здатні до диспергування порошки або гранули, в окисно-відновлювальному циклі генерування емульсії, жорсткі та м'які капсули, сиропи або елікхімічно активних різновидів кисню при фізіологічсири. Композиції, призначені для орального застоному рН. У поєднанні з іншими новими властивоссування, можуть бути приготовані згідно з будь-яки тями, як описано у винаході, сполуки формули І є відомим з рівня техніки методом приготування ефективними агентами для видалення заліза за фармацевтичних композицій і такі композиції місдопомогою механізму комплексоутворення. тять один або більше агентів з групи, що складаДля лікування захворювань, пов'язаних з пеється з підсолоджуючих агентів, смакових агентів, ревантаженням залізом, таких як талассемії, забарвників та консервантів для забезпечення фархворювання серпоподібного еритроциту, гемохромацевтично привабливих та приємних на смак матозів та лікування пацієнтів з токсичною препаратів. Таблетки містять активний агент в концентрацією заліза, сполуки винаходу можуть суміші з не токсичними фармацевтично прийнятвводитися орально, місцево або парентерально в ними ексципієнтами, які є придатними для виробдозованих одиничних формах, що містять традиництва таблеток. Ексципієнти можуть бути, наприційні не токсичні фармацевтично прийнятні носії, клад, інертними розріджувачами, такими як ад’юванти та розчинники. фосфа т кальцію або фосфат натрію; грануляційДля лікування захворювань, не пов'язаних з ними або дезінтегруючими агентами, наприклад, перевантаженням залізом, таких як HIV, рак, макукурудзяним крохмалем або альгіновою кислолярія та для захисту серця від інтоксикації антратою; зв'язуючими агентами, наприклад, крохмацикліном, сполуки цього винаходу можуть також лем, желатиною або гуміарабіком; мастильними вводитись орально, місцево або парентерально в агентами, наприклад, стеаратом магнію, стеаридозованих одиничних формах, що містять традиновою кислотою або тальком. Для запобігання ційні не токсичні фармацевтично прийнятні носії, дезінтегрування та абсорбування в кишковоад’юванти та розчинники. шлунковому тракті, та для забезпечення таким Термін парентерально, що тут застосовується, чином безперервної дії впродовж тривалого часу включає методи підшкірної ін'єкції або вливання. таблетки можуть покриватися згідно з будь-яким На додачу до лікування теплокровних тварин, тавідомим способом. Для пом'якшувального ефекту ких як миші, пацюки, коні, велика рогата худоба, можуть використовуватися емульсифікатор або вівці, собаки, коти і т.п., сполуки винаходу ефектизволожувач, моностеарат або гліцерилдистеарат. вні для лікування людей. Композиції для орального застосування також Для застосування у фармацевтичних композиможуть бути присутні в жорстких желатинових капціях можуть бути використані традиційні не токсисула х, в яких активні інгредієнти змішані з інертчні тверді носії, що включають, наприклад, фарним твердим розріджувачем, наприклад, фосфамацевтично прийнятні манітол, лактозу, крохмаль, том кальцію або каоліном, або можуть бути стеарат магнію, натрієвий сахарин, тальк, целюлоприсутні в м'яких желатинових капсулах, в яких зу, глюкозу, са харозу, карбонат магнію та подібне. активний інгредієнт змішаний з водою або масляАктивна сполука, яку визначено вище, може занистим середовищем, наприклад, арахісовим масстосовуватися як рідина. Фармацевтичні композилом, рідким парафіном або оливковим маслом. ції для введення можуть, наприклад, бути пригоВодні суспензії можуть містити активні матерітованими розчинюванням, диспергуванням і т.п., али в суміші з ексципієнтом, придатним для водактивна сполука, яку визначено вище, та традиних суспензій. Такі ексципієнти є суспендуючими ційні фармацевтичні допоміжні речовини і носії, агентами, наприклад, карбоксиметилцелюлозою такі як, наприклад, вода, фізіологічний розчин, натрію, метилцелюлозою, гідроксипропілметилцеводорозчинна глюкоза, гліцерол, етанол та подіблюлозою, альгінатом натрію, полівінілпіролідоном, не, утворюють розчин або суспензію. За необхідкамедю або гуміарабіком; диспергувальні або змоності, фармацевтична композиція для введення чувальні агенти можуть бути фосфатами природможе також містити незначну кількість не токсичного походження, наприклад, лецетином або проних допоміжних субстанцій, таких як змочувальні дуктами конденсації простого циклічного ефіру з або емульгуючі агенти та подібне, наприклад, ацежирними кислотами, наприклад, стеаратом поліотат натрію, монолаурат сорбіту, ацетат триетаноксіетилену, або продуктами конденсації етиленокламіну натрію, олеат триетаноламіну і т.п. Сучасні сиду з довголанцюговими аліфатичними спиртами, методи приготування таких дозованих форм відонаприклад, гептадекатиленоксицетанол, або промі, або будуть відомими для спеціалістів в даній дуктами конденсації етиленоксиду з неповними 17 84178 18 складними ефірами жирних кислот та ангідридів Сполуки формули (І) або придатна фармацевгекситу, наприклад, сорбітмоноолеат поліетилену. тично прийнятна їх сіль та/або фармацевтично Водні суспензії можуть також містити один або прийнятний їх сольват також можуть бути викорисбільше консервантів, наприклад, етил, абонтані як композиція для місцевого застосування в пропіл, р-гідроксибензол, один або більше барвникомбінації з традиційними ексципієнтами для місків, таких як сахароза або сахарин. цевого застосування. Прикладами композицій для Маслянисті суспензії можуть бути утворені за місцевого застосування є мазі, креми або примочдопомогою суспендування активного інгредієнта в ки, просочений перев'язувальний матеріал, гелі, рослинній олії, наприклад, рициновій олії, оливкогелеподібний клей, спреї та аерозолі. Композиції вій олії, в маслі сезаму або в кокосовому маслі, можуть містити відповідні традиційні добавки, такі або в мінеральному маслі, такому як рідкий параяк консерванти, розчинники для сприяння проникфін. Маслянисті суспензії можуть містити загущунення ліків та агенти для пом'якшення мазей та ючий агент, наприклад, віск, твердий парафін або кремів. Вони можуть також містити сумісні традицетиловий спирт. Підсолоджуючі агенти, такі як ційні носії, такі як основи для кремів або мазей та розкриті вище, та ароматизуючі агенти можуть етанол або олеїновий спирт для примочок. Переддодаватися для забезпечення привабливого на бачається, що призначені для місцевого застосусмак орального препарату. Ці композиції можуть вання композиції містять достатню для полегшенбути законсервовані додаванням антиоксидантів, ня симптомів захворювання, що підлягає таких як аскорбінова кислота. лікуванню, кількість активних агентів. Таким чином, Здатні до диспергування порошки і гранули, сполука формули І або відповідна фармацевтично придатні для приготування водних суспензій шляприйнятна її сіль буде складати від приблизно 0,5 хом додавання води, забезпечують активний інгдо 10% ваги композиції. Придатний крем, примочредієнт в суміші з диспергуючим та змочуючим ка, гель, клей, мазь, спрей або аерозольні компоагентами, суспендуючим агентом та одним або зиції, що можуть бути використані для сполук фобільше консервантами. Придатні диспергувальні рмули І або для відповідної фармацевтично або змочувальні агенти та суспендувальні агенти придатної її солі, є традиційними композиціями, уже згадані вище. Додаткові реципієнти, напривідомими з рівня техніки, наприклад такими, що клад, підсолоджувачі, ароматизатори та барвники описані в стандартних посібниках та книжках можуть також бути присутніми. [Reminrton's Pharmaceutical Sciences, Mack Фармацевтична композиція винаходу може таPublishinr Company, Easton, Pa. , 15th Edition, 1975, кож знаходитися у формі емульсій масло-у-воді. ch. 83 p.1436-1460, and ch. 89 p.1576-1607]. Масляна фаза може бути олією, наприклад, оливПарентеральне застосування загалом харакковою олією або арахісовим маслом, або мінератеризується ін'єкцією - і підшкірною, і внутрішньольним маслом, наприклад, рідким парафіном, або м'язовою, і внутрішньовенною. Композиції для ін'єїхньою сумішшю. Придатні емульгуючі агенти мокцій можуть бути приготовані у вигляді жуть бути фосфатами природного походження, традиційних форм - або як рідкі розчини, або суестерами, одержаними з жирних кислот та ангідспензії в рідині перед ін'єкцією, або як емульсії. ридів гекситолу, наприклад, сорбітмоноолеатом, Придатними ексціпієнтами, наприклад, є вода, та продуктами конденсації вказаних неповних ефіфізіологічний розчин, глюкоза, гліцерол, етанол рів з етиленоксидом, наприклад, сорбітмоноолеаабо подібне. Крім того, при необхідності, фарматом поліоксіетилену. Емульсія може також містити цевтичні композиції для введення можуть також підсолоджувачі та ароматизатори. містити незначні кількості не токсичної допоміжної Сиропи і еліксири можуть готуватися з підсосубстанції, такої як змочувальний або емульгуюлоджуючими агентами, наприклад, гліцеролом, чий агенти, рН буферні агенти і подібне, як наприпропіленгліколем, орбіталем та сахарозою. Такі клад ацетат натрію, сорбітмонолаурат, триетанокомпозиції можуть також містити заспокійливий ламіну олеат і т.п. засіб, консервант та ароматизатор і барвник. ФарКількість активного інгредієнта, який може об'мацевтичні композиції можуть готуватися згідно з єднуватися з носіями для приготування одиничної відомими способами із застосуванням придатних дозованої форми, буде в значній мірі залежати від диспергуючих та змочувальних агентів та суспенхазяїна, який підлягатиме лікуванню, та від певнодуючи х агентів, які уже були згадані вище. Стериго методу введення пацієнту, композиція може льні препарати для ін'єкцій можуть також бути стемістити від 0,5мг до 5мг активного агента, змішарильними розчинами для ін'єкцій або суспензіями ного з придатною кількістю носіїв, яка може змінюв парентерально прийнятному не токсичному розватися від близько 5 до близько 95. Одиничні доріджувачі або розчиннику, наприклад, розчином в зовані форми загалом можуть містити від близько 1,3-бутандіолі. Серед прийнятних носіїв та роз1мг до близько 500мг активного інгредієнта. чинників, які можуть використовуватися, є вода, Крім того, зрозумілим є те, що для будь-якого розчини Рінгера та ізотонічний розчин хлориду окремо взятого пацієнта специфічний рівень дози натрію. Крім того, нелеткі масла традиційно викозалежатиме від різноманітних факторів, включаюристовуються як розчинники або суспендувальні чи активність призначених специфічних сполук, середовища. Для цієї мети може використовувативік, вагу тіла, загальний стан здоров'я, стать, дієту, ся будь-яке м'яке нелетке масло, включаючи синчас введення, комбінацію ліків та складність затетичні моно- або дигліцериди. Крім того, жирні хворювання, що підлягає лікуванню. кислоти, такі як олеїнова кислота, знайшли застоСполуки даного винаходу відрізняються від сування в препаратах та в композиціях для ін'єктих сполук, що розкриті в Суміші справжнього вицій. находу відрізняються від тих сумішей, повідомле 19 84178 20 них в [US 6448273, US 6335353, RE 35948 і US В подібний спосіб, який описано вище, шля хом 5688815]. Перші три патенти описують 3-гідроксизаміни циклогексиламіну іншим аміном, були при4-піридинони, що мають N1 аліфатичну вуглеводготовані наступні сполуки: 3-Бензилокси-6-метилневу груп у. [US 5,688,815] також описує 3-гідрокси4-оксо-4Н-піран-2-карбонової кислоти циклопропі4-піридинони з N1 заміщеною або незаміщеною ламід. нижчою алкільною групою. Згідно зі стандартними M. р. 79-80 C; 1H-NMR (CDCI3, 400MHz) d 0.21 посібниками та підручниками з хімії - [Orranic (m, 2Н, циклопропіл-Н), 0.70 (m, 2H, циклопропілChemistry by James B. Hendrickson, Donald J. Cram, Н), 2.35 (s, 3H, CH3), 2.71 (m, 1H, CH), 5.35 (s, 2Н, Геоrrе S. Hammond, third edition, 1970, McГraw Hill, CH2), 6.27 (s, 1H, CH), 7.39 (m, 5Н, ArH), 7.70 (s, p.72] - аліфатичні вуглеводні складені з ланцюгів 1H, NH); 13C(CDCl3) d 6.35, 7.21, 19.87, 22.61, вуглецевих атомів, не організованих в кільця. Ре22.70, 75.56, 115.37, 128.94 (2C), 129.17 (2C), човини, що належать до цієї групи, інколи розгля129.25, 135.49, 146.14, 146.39, 160.22, 165.74, даються як сполуки з незамкненим ланцюгом. 176.17 ; MS(m/z) 300 (M++1). Прикладами аліфатичних вуглеводневих гр уп, є 3-бензилокси-6-метил-4-оксо-4Н-піран-2лінійні або розгалужені алкіли, такі як метил, етил, карбонової кислоти метиламід. пропіл, ізопропіл, ізобутил, бутил та трет-бутил. M. р. 137-140 C, 1H-NMR (CDCl3, 400MH z)b Сполуки цього винаходу складаються з 3-гідрокси2.38 (s, 3H,СН3), 2.78 (d, 3H, NCH3), 5.39 (s, 2H, 4-піридинонів з: (а) N1-циклоалкільним замісником CH2), 6.30 (S, 1H, CH), 7.40 (m, 5Н, ArH), 7.62 (br, та С2 алкілкарбамоїльним замісником або (b) N11H, NH); MS (m/z) 300(M++1). циклоалкільним замісником і С2 циклоалкілкарбаПриклад 2: Приготування 3-бензилокси-1,6моїльним замісником; або (с) N1-алкільним замісдиметил-4-оксо-1,4-дигідропіридин-2-карбонової ником з С2 циклоалкілкарбамоїльним замісником. кислоти циклогексиламід Вони є сполуками з циклічними вуглеводневими До розчину 3-бензилокси-6-метил-4-оксо-4Нзамісниками. В циклічних вуглеводнях вуглецеві піран-2-карбонової кислоти циклогексиламіду ланцюги формують кільця. Прикладами циклічних (1,40г, 4,1ммол) в 5мл метанолу був доданий розвуглеводневих гр уп є циклоалкільні похідні, такі як чин метиламіну (9мл 2М розчину в метанол, циклопропіл, циклобутил, циклопентил та циклоге16сммол). Одержаний розчин перемішували при ксил. Чотири патенти - [US 6448273, US 6335353, від 70 до 75°C протягом ночі під тиском в запаяній RE 35948 і US 5688815] - не розкривають циклоалпробірці. Розчинник видаляли при зниженому тискільні похідні 3-гідрокси-4-піридинонів. Винахід кові до одержання світло-жовтої твердої речовини розкриває 3-гідрокси-4-піридинони з N1як неочищеного продукту. Речовину очищували за циклоалкільною групою з алкілкарбамоїльною грудопомогою хроматографії на колонці (градієнт пою при С2 або циклоалкілкарбамоїльною групою елюювання: 100% етилацетату до 25% метанолу в при С2. Він також розкриває 3-гідрокси-4етилацетаті), результатом чого було одержання піридинони з циклоалкілкарбамоїльною групою зазначеної сполуки у вигляді твердої білої речовипри С2 з N1-алкільною групою. ни (1,20г, вихід 83,0%). Винахід, крім того, описується і ілюструється в 258-260 C; 1H-NMR (CDCl3, 400MHz) d 1.26-1. наступних конкретних прикладах. 45 (m, 6Н, циклогексил-Н), 1.79 (m, 2Н, циклогекЧастковий опис втілень винаходу, яким надасил-Н), 1.95 (m, 2Н, циклогексил-Н), 2.41 (s, 3H, ється найбільша перевага CH3), 3.82 (s, 3H, NCH3), 3.95 (m, 1H, CH), 5.13 (s, Приклад 1: Приготування 3-Бензилокси-62Н, CH2), 7.19 (s, 1H, CH), 7.36 (m, 3H, ArH), 7.43 метил-4-оксо-4Н-піран-2-карбонової кислоти цик(m, 2Н, ArH), 8.50 (br, 1 H, NH); MS (m/z) 355 логексиламіду. (M++1). 1,1'-карбонілдіімідазол (1,99г, 12,30ммол) був В подібний спосіб, замінюючи 3-бензилокси-6доданий до розчину 3-(бензилокси)-6-метил-4метил-4-оксо-4Н-піран-2-карбонової кислоти цикоксо-4Н-піран-2-карбонової кислотни (2,0г, логексиламід іншими амідними похідними 37,69ммол) в диметилформаміді (DMF, 18мл) при бензилокси-6-метил-4-амід-оксо-4Н-піран-2кімнатній температурі. Утворений розчин нагрівали карбонової кислоти були приготовані наступні сподо 40-50°C протягом 3 годин. Спостерігався світлуки: ло-жовтий розчин. Потім був доданий циклогекси3-бензилокси-1,6-диметил-4-оксо-1,4ламін (1,23мл, 10,76ммол). Одержану суміш передигідропіридин-2-карбонової кислоти циклопропімішували при кімнатній температурі протягом ночі. ламід. DMF видаляли при зниженому тискові до одерM. р. 187-189 C; 'H-NMR (CDCl3, 400MHz) d жання світло-жовтої маслянистої речовини як не0.52 (m, 2Н, циклопропіл-Н), 0.74 (m, очищеного продукту, який очищували за допомо2Н,циклопропіл-Н), 2. 18 (s, 3H, CH3), 2.78 (m,1Н, гою хроматографії на колонці (градієнт CH), 3.50 (s, 3H, NCH3), 5.08 (s, 2H, CH2), 6.12 (s, елюювання: від 1:1 етилацетат/гексану до 10% 1H, CH), 7.33 (m, 3H, ArH), 7.39 (т, 2Н, ArH), 7.91 метанолу в етилацетаті), результатом чого було (br, 1H, NH); MS (m/z) 313(M++1). одержання зазначеної сполуки (1,60г, вихід 61 %) 3-бензилокси-1 -циклопропіл-6-метил-4-оксоу вигляді білої твердої речовини. 1,4-дигідропіридин-2-карбонової кислоти метилM. р. 118-120 C; 1H-NMR (CDCI3, 400MHz) d амід. 0.91 (m, 2Н, циклогексил-Н), 1.29 (m, 2Н, циклогекM. р. 132-135 C; 1H-NMR (CDCl3, 400MHz) d сил-Н), 1.58 (m, 3H, циклогексил-Н), 1.79 (m, 2Н, 1.05 (ш, 4Н, циклопропіл-Н), 2.38 (s, 3H, CH3), 2.70 циклогексил-Н), 2.37 (s, 3H,СН3), 3.79 (m, 1 H, CH), (d, J=1.8Hz, 3H, NСН3), 3.35 (m, 1 H, CH), 5.07 (s, 2Н, 5.40 (s, 2Н, CH2), 6.28 (s,l H, CH), 7.41 (m, 5Н, ArH), CH2), 6.14 (s, 1H, CH), 7.15 (br. , 1H), 7.35 (m, 5Н, + 7.67 (br, I H, NH); MS (m/z) 342(M +1). ArH); 13С (CDCl3) 8 9.48, 20.30, 25.86, 34.15, 74.01, 21 84178 22 118.16, 127.79, 128.06 (2C), 128.22 (2C), 137.35, 12,48ммол, 1,3екв) були додані і суміш перемішу142.05, 143.98, 149.91, 162.01, 173.89 ; MS (m/z) вали протягом ночі при кімнатній температурі. 313 (M++1). Розчинник був видалений під зниженим тиском. 3-бензилокси-1-циклопропіл-6-метил-4-оксоОчищення хроматографією (1:1 гексан/EtOAc, по1,4-дигідропіридин-2-карбонової кислоти циклоптім EtOAc) забезпечило зазначену сполуку (2,76г, ропіламід. вихід 91,56%) у вигляді твердої жовтої речовини. M. р. 164-167 C; 1H-NMR (CDCl3, 400MHz) d M. р. 69.3-71.0 C; 1H-NMR (CDCl3, 400MHz) d 0.54 (m, 2Н, циклопропіл-Н), 0.76 (m, 2H, циклоп1.51-1.72 (m, 4H, циклобутил H), 2.19-2.28 (m, 2Н, ропіл-Н), 1.08-1. 11 (m, 4Н,циклопропіл-Н), 2. 35 (s, циклобутил H), 2.37 (s, 3H,СН3), 4.39-4.41 (m,1Н, 3H, CH3), 2.75 (m, 1Н, CH), 3.37 (m, 1H, CH), 5.05 CH), 5.41 (s, 2H, OCH 2Ph), 6.30 (s, 1H, CH), 7.39(s, 2H, CH2), 6.13 (s, 1H, CH), 7.33 (m, 5Н, ArH), 7.49 (m, 5Н, ArH), 7.86 (br, 1H, NH), and MS (m/z) 7.89 (br, s, 1H, NH); MS (m/z) 339 (M++1). 314(M++1), 217,91. Приклад 3: 3-Гідрокси-1,6-диметил-4-оксо-1,4Діючи в подібний спосіб, була приготована надигідропіридин-2-карбонової кислоти циклогексиступна: ламід [Аро6621] 3-(бензилокси)-N-циклопентил-6-метил-4-оксоPd (OH)2 на деревному вугіллі (0,18г, 10% су4Н-піран-2-карбоксамід хої основи) був доданий до розчину 3-бензилоксиM. р. 108.0-108.5 C; 1H-NMR (CDCl3, 400MHz) d 1,6-диметил-4-оксо-1,4-дигідропіридин-211-1.16 (m, 2H, циклопентил H), 1.50-1.55 (m, 4Н, карбонової кислоти циклогексиламіду (1,0г, циклопентил H), 1.87-1.92 (m, 2Н, циклопентил H), 2,82ммол) в етанолі (50мл) в атмосфері азоту. 2.38 (s, 3H, CH 3), 4.17-4.22 (m,1Н, CH), 5.41 (S, 2H, Суміш гідрогенізували при 50psi протягом 4 годин. CH2), 6.30 (s, 1H, CH), 7.38-7.43 (m, 5Н, ArH), 7.72 Pd (OH)2 був вилучений фільтруванням через шар (br, 1Н, NH), MS (m/z) 328 (M++1), 217,91. целіту, осад на целітовому шарі був промитий Приклад 5: Приготування 3-(бензилокси)-Nетанолом (3x10мл). Фільтрат етанолу був випаруциклобутил-1,6-етан-4-оксо-1,4-дигідропіридин-2ваний з одержанням не зовсім білої твердої речокарбоксаміду вини (,.57г, вихід 77 %). Подальше очищення рекДо розчину сполуки з Прикладу 4 (2,616г, ристалізацією з метанолу (15мл) мало 8,35ммол, 1,0екв) в метанолі (10мл) був швидко результатом зазначену сполуку у вигляді білої доданий метиламін (2М в метанолі, 20мл, 40ммол, твердої речовини (0,18г). 4,9екв). Запаяну пробірку перемішували протягом M. р. 280-285 C (dec);1H-NMR (CDCl3, 400MHz) ночі при 70-75°C. Одержаний коричневий розчин d 1.30-1.43 (m, 5H, циклогексил-Н), 1.70 (m, 1Н, було випарувано до суха і очищено хроматографіциклогексил-Н), 1.80 (m, 2Н, циклогексил-Н), 2.00 єю (EtOAc, потім 1:4 МеОН/EtOAc), результатом (m, 2Н, циклогексил-Н), 2.41 (S, 3H, СН3), 3.63 (S, чого було одержання зазначеної сполуки у вигляді 3H, CH3), 3.90 (m, 1H, CH), 6.38 (s, 1H, CH); MS білої твердої речовини (1,70г, вихід 62,24%). (m/z) 265 (M++1). M. p. 221.3-222.4 C; 1H-NMR (DMSO-d6, В подібний спосіб, замінюючи 3-бензилокси400MHz) d 1.65-1.69 (m, 2H, циклобутил H), 1.901,6-диметил-4-оксо-1,4-дигідропіридин-21.95 (m, 2H, циклобутил H), 2.14-2.21 (m, 2H, циккарбонової кислоти циклогексиламід іншими амілобутил H), 2.31 (s, 3H, CH3), 3.42 (s, 3H, NCH3), дами 3-бензилокси-4-оксо-1,4-дигідропіридин-24.34-4.30 (m, 1Н, CH), 5.05 (s, 2H, OCH2Ph), 6.22 карбонової кислоти циклоалкілу, були приготовані (s, 1H, CH), 7.39-7.30 (m, 5Н, ArH), 9.08-9.06 (d, 1H, наступні сполуки: J=7.08Hz, NH); MS (m/z) 327(M++1), 230, 166, 91. 3-гідрокси-1,6-диметил-4-оксо-1,4Діючи подібним чином, була приготована надигідропіридин-2-карбонової кислоти циклопропіступна сполука: 3-(бензилокси)-N-циклопентил-1,6ламід [Аро6617]. диметил-4-оксо-1,4-дигідропіридин-2-карбоксамід M. р.260-262 C; 1H-NMR (MeOD-d4, 400MHz) d M. р. 233.6-234.4 C; 1H-NMR (DMSO-d6, 0.66 (m, 2Н,циклопропіл-Н), 0.85 (m, 2H, циклопро400MHz) d 1.43-1.52 (m, 4H, циклопентил H), 1.54піл-Н), 2.41 (s, 3H, CH 3), 2.95 (m, 1H, CH), 3.63(m, 1 1.60 (m, 2Н, циклопентил H), 1.78-1.83 (m, 2Н, цикH, NCH3), 6.38 (s, 1H, CH); MS (m/z) 223(M++1). лопентил H), 2.30 (s, 3H, CH 3), 3.43 (s, 3H, NCH 3), 1-циклопропіл-3-гідрокси-6-метил-4-оксо-1,44.13-4.18 (m, 1Н, CH), 5.04 (s, 2Н, OCH2Ph), 6.22 (s, дигідропіридин-2-карбонової кислоти метиламід 1H, CH), 7.30-7.41 (m, 5Н, ArH), 8.80-8.82 (d, [Аро6619]. J=6.95Hz, 1H, NH); MS (m/z) 341 (M++1), 230, 166, 1 M. р. 258-260 C (dec); H-NMR (MeOD-d4, 91. 400MHz) d 05 (m, 2Н, циклопропіл-Н), 1.19 (m, 2Н, Приклад 6: Приготування N-циклобутил-3циклопропіл-Н), 2.54 (s, 3H, CH3), 2.97 (s, 1H, гідрокси-1,6-диметил-4-оксо-1,4-дигідропіридин-2NCH3), 3.46 (m, 1 H, CH), 6.33 (s, 1H, CH); MS (m/z) карбоксаміду [Аро6622]. 223 (M++1). Суміш N-циклобутил-3-бензилокси-1,6Приклад 4: Приготування 3-(бензилокси)-Nдиметил-4-оксо-1,4-дигідропіридин-2-карбоксаміду циклобутил-6-метил-4-оксо-4Н-піран-2(1,528г, 4,68ммол, 1.0екв), 10% Pd на активізовакарбоксаміду. ному вугіллі (200мг, вологий) та етанолу (200мл) Суміш 3-(бензилокси)-6-метил-4-оксо-4Нперемішували під 50psi H2 при кімнатній темперапіран-2-карбонової кислоти (2,5г, 9,6 ммол, 1,0екв) турі протягом 2,5 годин. Каталізатор відфільтровута 1,1'-карбонілдіімідазолу (2,49г, 15,37ммол, вали через целіт, а фільтрат випаровували, ре1,6екв) в DMF (20мл) перемішували при 50°C прозультатом чого була тверда речовина, яку тягом 5 годин. Суміш була охолоджена до кімнатрекристалізовували з MeOH, одержуючи вказану ної температури. Циклобутиламіну гідрохлорид речовину у вигляді твердого білого осаду (0,57г, (1,24г, 11,52ммол, 1,2екв) та Et3N (1,74мл, вихід 51,5%). 23 84178 24 M. р. 277.3 C (dec) ; 1H-NMR (DMSO-d6, 0,13мол) протягом 5 хвилин. Після додавання хлористого тіонілу, реакційна суміш все ще залиша400MHz) d 1.68-1.70 (m, 2H, циклобутил H), 1.952.01 (m, 2Н, циклобутил H), 2.20-2.26 (m, 2Н, циклась у вигляді суспензії. Видаляли льодо-сольову баню. Реакційну суміш нагріли до кімнатної темпелобутил H), 2.29 (s, 3H, CH3), 3.41 (s, 3H, NCH3), ратури. Були взяті аліквотні проби і їх погасили 2М 4.31-4.35 (m, 1Н, CH), 6.13 (s, 1H, CH), 8.98 (br, 1Н, розчином метиламіну в THF. Одержана суміш буNH); MS (m/z) 237 (M+ +1), 185, 166, 123. ла проаналізована за допомогою HPLC. Таким Діючи в подібний спосіб, були приготовані наступні сполуки: чином, HPLC моніторинг показав, що приблизно 96% стартового матеріалу було витрачено після N-циклопентил-3-гідрокси-1,6-диметил-4-оксотого, як реакційну суміш перемішували протягом 3 1,4-дигідропіридин-2-карбоксамід [Аро6620]. годин при кімнатній температурі (HPLC, мобільна M. р. 289.3 C(dec); 'H-NMR (DMSO-d6, 400MH z) фаза: 0,035% HCIO4/CH3CN, 80/20, колонка: симеd 1.49-1.55 (m, 4H, циклопентил H), 1.61-1.68 (m, трія С18 WAT046980, швидкість потоку: 1мл/хв., 2Н, циклопентил H), 1.83-1.87 (m, 2Н, циклопентил контролююча довжина хвилі: 260нм., час утримуH), 2.29 (s, 3H, CH3), 3.42 (s, 3H, NCH3), 4.14-4.18 вання 3-бензилокси-1-циклопропіл-6-метил-оксо(m, 1H, CH), 6.12 (s, 1H), 8.71-8.73 (d, J=7.05Hz, 1,4-дигідропіридин-2-карбонової кислоти=2,46хв., 1H, NH); MS (m/z) 251 (M++1), 166. час утримування 3-бензилокси-1-циклопропіл-61-Циклопропіл-3-гідрокси-6-метил-4-оксо-1,4метил-4-оксо-1,4-дигідр-піридин-2-карбонової кисдигідропіридин-2-карбонової кислоти циклопропілоти метиламіду=5,40хв.). ламід [Аро6618]. В іншу 1-L 3-шию RBF, обладнану механічною M. р.241-143 C; 1H-NMR (DMSOd6, 400MHz) d мішалкою, помістили дихлорметан (240мл) та три0.53 (m, 2Н, циклопропіл-Н), 0.71 (m, 2H, циклопетиламін (36мл, 0,26мол) (льодо-сольова баня, ропіл-Н), 0.94-1.00 (m, 4Н, циклопропіл-Н), 2.42 (s, внутрішня температура складає -10°C). 2М метил3H, CH3), 2.79 (m, 1Н, CH), 3.30 (m, 1Н, CH), 6.08 амін в тетрагідрофурані (73мл, 0,146мол) був до(s, 1H, CH), 8.54 (br, s, 1H, NH); MS (m/z) 249 даний до охолодженого розчину. Кислий хлорид, (M++1). утворений in situ вище, перенесли у воронку, через Приклад 7: 3-бензилокси-1-циклопропіл-6яку вносять реактиви, та повільно додавали до метил-оксо-1 підготовки, 4-кислоти дигідропіридинрозчину аміну впродовж 30 хвилин. Спостеріга2-карбонова кислота. лась екзотермічна реакція, але внутрішня темпеДо суспензії 3-(бензилокси)-6-метил-4-оксоратура залишалась нижчою ніж -5°C. Реакція за4Н-піран-2-карбонової кислоти (70г, 0,27мол) в вершилась через 10 хвилин, що було встановлено MeOH (350мл) в 3-шийнІй RBF (круглодонна колза допомогою TLC (CH2Cl2/MeOH, співвідношення ба), обладнаній механічною мішалкою, додавали 9/1, об./об.). Реакційний розчин гасили водою циклопропіламін (120мл, 1,72мол). Утворився про(100мл) та перемішували протягом 5 хвилин. Орзорий світло-жовтий розчин. Реакційну суміш пеганічна фракція була зібрана та більше ніж двічі реплавлю вали приблизно 19 годин. Леткі продуквідмита водою, після промивання ненасиченим ти видаляли у вакуумі, а залишок розчиняли у воді розчином NaOH (0,05M, 3x100мл), висушена над (700мл) при помішуванні. Водний розчин фільтрусульфатом натрію, відфільтрована та сконцентровали через подушечки CeltetÒ. Фільтрат поміщали вана під вакуумом до одержання коричневого в 3-шийну RBF, обладнану механічною мішалкою, твердого осаду. Осад суспендували в 150 мл розта охолоджували у льодяній бані. Додавали кончину етанолу і етилацетату (співвідношення 2/8, центровану HCI доти, доки рН не мало значення об./об.) та пульпу перемішували протягом 2 годин. приблизно 1-2, випадав преципітат у вигляді об'Твердий осад зібрали вакуум-фільтрацією, відмиємистого твердого помаранчу. До суспензії додали етилацетатом (50мл) та висушили на повітрі. вали ацетон (200мл). Тверду речовину потім збиЗазначена сполука була одержана у вигляді світрали вакуум-фільтрацією, повністю відмивали ло-рожевого з коричневим відтінком осаду (14г, ацетоном та висушували на повітрі. Зазначена вихід 45%). Речовину потім очищували за допомосполука була одержана у вигляді не зовсім білої гою хроматографії на колонці (5 % MeOH:CH2Cl2). твердої речовини (71,0г, вихід 88%). M. р. 132-135 C; 1H-NMR (CDCl3, 400MHz) d M. p: 139.0-139.5 C; H-NMR(300MHz, DMSO1.05 (m, 4Н, циклопропіл-Н), 2.38 (s, 3H, CH3), 2.70 D6) 6(ppm): 0.98-1.15 (m, 4H, 2 c-CH2), [2.37 (s) + (d, J=1.8Hz, 3H, NCH3), 3.35 (m, 1H, CH), 5.07 (s, 2.40 (s), обертання, 3/2 коефіцієнт, 3H, CH3)], 3.302Н, CH2), 6.14 (s, 1H, CH), 7.15 (br, 1H), 7.35 (m, 3.50 (m, 1H, с-СН), 5.00-5.05 (m, 2Н, CH2Ph), 6.205Н, ArH); 13C(CDCl3) d (9.48, 20.30, 25.86, 34.15, 6.25 (m, 1H, C=CH), 7.28-7.50 (m, 5Н, Ph); MS (m/z): 74.01, 118.16, 127.79, 128.06(2C), 128.22(2C), 300.2 (M++1), 256.2, 192.2, 164.4, 91.0 (100%); 137.35, 142.05, 143.98, 149.91, 162.01, 173.89; MS Anal. Calcd. For C17H17NO4 : С, 68. 21; H, 5.72 ; N, (m/z): 313 (М++1). 4.68%. Found: С, 67.76; H, 5.76; N, 4.61%. В подібний спосіб були приготовані наступні Приклад 8: Синтезування 3-бензилокси-1сполуки: циклопропіл-6-метил-4-оксо-1,4-дигідропіридин-23-(бензилокси)-N-(циклогексилметил)-1карбонової кислоти метиламіду. циклопропіл-6-метил-4-оксо-1,4-дигідропіридин-2До охолодженої суспензії (льодо-сольова бакарбоксамід ня, внутрішня температура=-5°C) 3-бензилокси-11 циклопропіл-6-метил-оксо-1,4-дигідропіридин-2H-NMR (CD3OD, 400MHz) d 0.90-0.96 (m, 3H), 1.13-1.23 (m, 3H), 1.45-1.54 (m, 1H), 1.64 (br. m, карбонової кислоти (30г, 0,10мол), CH2Cl2 (150мл) 4H), 1.73-1.76 (br. m, 4Н), 2.56 (s, 3H,СН3), 3.12та DMF (7,8мл, 0,10мол) в 3-шийній RBF (кругло3.13 (d, J=6.8Hz, 2Н), 3.36-3.40 (m, 1H, CH), 5.09 (s, донній колбі), обладнаній механічною мішалкою, по краплі додавали хлористий тіоніл (9,5мл, 25 84178 26 2H), 6.43 (s, 1H), 7.31-7.37 (m, 3H), 7.43-7.45 (m, тягом приблизно 5 хвилин, потім крізь розчин про2Н); MS (m/z): 395 (M++1). пускали газоподібний азот впродовж приблизно 5 3-(бензилокси)-1-циклопропіл-6-метил-2хвилин. Додавали Pd-C (10% вологи, 5% мас/мас, (морфолін-4-ілкарбоніл)піридин-4(1Н)-он: 0,5г) та реакційну посудину двічі продували вод1 нем. Суміш гідрогенізували в реакторі Парра при H-NMR (CDCl3, 400MHz) d 0.87-0. 94 (br. m, водневому тискові 50psi в RT, проходження реакції 1Н), 1.09-1.13 (m,1Н), 1.25-1.30 (m, 2Н), 2.56 (s, контролювали за допомогою HPLC протягом біль3H,СН3), 3.30-3.42 (m, 2Н), 3.45-3.69 (m, 6Н), 3.843.90 (m, 1Н, CH), 4.74-4.77 (d, J=10.4Hz, 1H), 5.54ше ніж 3 годин. Через 3 години реакція завершилася. 5.56 (d, J=10.6Hz, 1H), 6.80 (br. s, 1H, NH), 7.36Надмір водню вилучили та газоподібний азот 7.41 (m, 5Н, ArH); MS (m/z): 369 (M++1). пропускали крізь розчин барботуванням протягом 3-(бензилокси)-1-циклопропіл-6-метил-N-(3близько 5 хвилин. Реакційну суміш фільтр ували метилбутил)-4-оксо-1,4-дигідропіридин-2карбоксамід; через попередньо оброблений целіт (попередньо 1 промитий 0,1N стандартним розчином 1H-NMR (CDCl3, 400MHz) d 0.86-0.88 (d, циклопропіл-3-гідрокси-6-метил-4-оксо-1,4J=6.4Hz, 6Н, 2CH3), 1.04-1.09 (m, 4H), 1.27-1.37 (m, дигідропіридин-2-карбонової кислоти метиламіду в 2Н), 1.55-1.60 (m, 1H, CH), 2.37 (s, 3H, CH3), 3.20метанолі), фільтраційну подушечку промивали (6 3.25 (m, 2Н, CH2), 3.34-3.37 (m, 1H, CH), 5.09 (s, разів по 10мл) метанолом. Об'єм фільтрату був 2Н, CH2), 6.10 (s, 1H), 7.30-7.38 (m, 5Н, ArH), 7.23зменшений до близько 30мл під зниженим тиском. 2.28 (br. t, 1H, NH). Залишок був о холоджений на льоду і випало неба3-(бензилокси)-N-циклогексил-1-циклопропілгато осаду. Додавали 2N розчин NaOH (25мл) до6-метил-4-оксо-1,4-дигідропіридин-2-карбоксамід: 1 ти, доки рН не встановилося близько 5, розчин H-NMR(CDCl3, 400MHz) d 1.15-1.30 (m,3H), перемішували протягом приблизно 10 хвилин. До1.31 (br.m, 1H), 1.34 (br.m, 5H), 1.66-1.70 (m, 1H), дали метиловий ефір трет-бутилу (MTBE, 30мл) і 2.78 (S, 3H, CH3), 3.30-3.34 (m, 1H), 3.42-3.51 (m, одержану суміш перемішували при температурі 2Н), 3.67-3.69 (m, 1H), 3.80-3.83 (m, 1H), 4.82-4.85 льодо-сольової бані протягом 30 хвилин. Осад (d, J=10.3Hz, 1H); 5.37-5.40 (d, J=10.5Hz, 1H), 7.34 збирали вакуум-фільтрацією, двічі повністю відми(br.m, 5Н, ArH), 7.86 (s, 1H). вали 5мл суміші EtOH/MTBE (співвідношення 1/2). 3-(бензилокси)-1-циклопропіл-N-гексил-6Умови HPLC для контролю за ходом реакції із заметил-4-оксо-1,4-дигідропіридин-2-карбоксамід: 1 стосуванням Hewlett Packard серії 1100 HPLC: сиH-NMR (CDCl3, 400MHz) d 0.89-0.92 (t, метрія C18, колонка (WAT046980), градієнт 0,035 J=6.6Hz, 3H, CH3), 1.25-1.32 (m, 6H), 1.40-1.47 (m, % HCIO4/CH3CN, min-% CH3CN: 0-10; 6-10; 7-20 і 4H), 1.64-1.70 (m, 2H,CH 2), 2.54 (s, 3H, CH3), 3.4315-20, X -210, 260 і 285нм; час утримування 13.48 (m, 2H, CH2), 3.91-3.93 (m, 1Н, CH), 5.10 (s, циклопропіл-3-гідрокси-6-метил-4-оксо-1,42H, CH2), 7,37-7,46 (m, 6Н, ArH та C=CH), 9.24 (br. дигідропіридин-2-карбонової кислоти метиламіду t, 1H, NH); MS (m/z): 383 (M++1). складає 2,099 хвилини. 3-(бензилокси)-1-циклопропіл-6-метил-2-[(4Крок b. Очищування 1-циклопропіл-3-гідроксиметилпіпепазин-1-іл)карбоніл]піридин-4(1H)-он: 1 6-метил-4-оксо-1,4-дигідропіридин-2-карбонової H-NMR (CDCl3, 400MHz) d 0.85-0.88 (m, 1H), кислоти метиламіду. 1.06-1.29 (m, 4H), 1.40-1.45 (br. m, 2H), 1.50-1.58 Суспензію неочищеного продукту, що була (br. ш, 4H), 2.51 (s, 3H, CH 3), 3.12-3.17 (m, 1H), одержана, як описано в Кроці а, перемішували з 3.35-3.48 (m, 3H), 3.75-3.78 (m, 1 H, CH), 4.76-4.78 сумішшю EtOH/дистильована вода (співвідношен(d, J=10.6Hz, 1H), 5.53-5.56 (d, J=10.7Hz, 1H), 6.68 ня 1/1, всього 14мл) при температурі льодо(br. s, 1H, NH), 7.30-7.43 (m, 5Н, ArH); MS (m/z): сольової бані протягом однієї години. Осад збира382 (M++1). ли вакуум-фільтрацією та двічі відмивали (5мл) 3-(бензилокси)-1-циклопропіл-N,N,6-триметилпопередньо охолодженою сумішшю 4-оксо-1,4-дигідропіридин-2-карбоксамід: EtOH/дистильована вода (співвідношення 1/1). 'H-NMR (CDCl3, 400MHz) d 1.16-1.20 (m, 2H), Зазначену сполуку - блідо-рожевий осад - висушу1.27-1.33 (m, 1H), 1.87-1.95 (m, 1H), 2.78 (s, 3H, вали до постійної ваги при 40°C під вакуумом проCH3), 3.05 (s, 3H, CH3), 3.08 (s, 3H, CH3), 3.62-3.68 тягом 16 годин. Цей продукт давав негативний (m, 1H, CH), 4.86-4.90 (d, J=10.8Hz, 1H), 5.33-5.38 результат в тесті нітрату срібла, важив 5,3г (зага(d, J=10.8Hz, 1H), 7.29-7.33 (m, 5Н, ArH), 7.77 (s, льний вихід 74%, кроки а та b). 1H, NH); MS (m/z): 327 (M++1). 1 H-NMR (300MHz, D MSO-D 6) d (ppm): 0.94-0.99 Приклад 9: А. Приготування 1-циклопропіл-3(m, 4Н, 2с-СН2), 2.39 (s, 3H, CCH3), 2.76 (d, гідрокси-6-метил-4-оксо-1,4-дигідропіридин-2J=4.4Hz, 3H, NHCH3), 3.28-3.31 (m, 1H, с-СН), 6.08 карбонової кислоти метиламіду. (s, 1H, C=CH), 8.44 (br. q., 1H, NHCH 3); 13C-NMR Процедура І: (75MHz, DMSO-D 6) d (ppm): 9.1, 19.9, 25.8, 33.7, Крок а. Синтезування 1-циклопропіл-3112.3, 130.1, 143.3, 148.7, 161.8, 170.6; MS/MS (+ve гідрокси-6-метил-4-оксо-1,4-дигідропіридин-2ES): MS (m/z) 223(M++1), 192.1, 164.2 (M+карбонової кислоти метиламіду. CONHCH3, 100%), 150.1, 136.3; Elemental Analysis: До суспензії 3-бензилокси-1-циклопропіл-6Anal. Calcd. для C11H14N2 O3: C, 59.45 ; H, 6.35 ; N, метил-4-оксо-1,4-дигідропіридин-2-карбонової кис12.60 %. Found: C, 59.19; H, 6.07; N, 12.53%; IR лоти метиламіду (10,0г, 0,032 мол) в метанолі (KBr)cm~1: 3300 (NH), 1670, 1653, 1495 (C=C). (40мл) і воді (2,6мл) при температурі льодоB. N-(циклогексилметил)-1-циклопропіл-3сольової бані по краплині додавали концентровану гідрокси-6-метил-4-оксо-1,4-дигідропіридин-2HCl (3,9мл). Одержаний прозорий коричневий розкарбоксамід: чин перемішували при кімнатній температурі про 27 84178 Суміш 3-(бензилокси)-N-(циклогексилметил)-1циклопропіл-6-метил-4-оксо-1,4-дигідропіридин-2карбоксаміду (2,0г, 4,8ммол), Pd/C (10% вогкості, 0,45г) в етанолі (150мл) гідрогенізували в апараті Парра при водневому тискові в 50psi протягом 16 годин. Реакційну суміш фільтрували через шар целіту і целіт повністю промивали EtOH (25мл). В результаті випаровування розчинника була одержана блідо-рожева тверда речовина. Цей осад розчинили в гарячому метанолі, потім охолоджували до кімнатної температури доки не випав твердий продукт. Цей осад було зібрано вакуумфільтруванням. Маточний розчин концентрували під вакуумом, а твердий залишок знову розчиняли в гарячому метанолі та охолоджували до кімнатної температури до випадання твердого продукту, який потім знову збирали. Цей процес повторювали ще раз. Три об'єднані тверді фракції білого кольору важили 0,95г (вихід 63%). 1 H-NMR (CDCl3, 400MHz) d 0.84-0.88 (m, 2Н, CH2 C-Pr), 1.03-1.09 (m, 2Н, CH2 с-Рr)), 1.06-1.31 (m, 5Н), 1.65-1.87 (m, 6Н), 2.50 (s, 3H, CH3), 3.333.36 (m, 2Н, CH2N), 3.51 (s, 1H), 3.58-3.61 (m, 1Н, CH с-Рr), 6.27 (s, 1H, C=CH), 6.80 (br. t, 1H, NH); MS (m/z): 305 (M++1). C. Наступні сполуки були приготовані в подібний спосіб: 1-циклопропіл-3-гідрокси-6-метил-N-(3метилбутил)-4-оксо-1,4-дигідропіридин-2карбоксамід: Вихід: 88%; 1H-NMR (CDCl3, 400MHz) d 0.850.89 (m, 1H), 0.98-1.00 (d, J=6.4Hz, 6Н, 2CH3), 1.151.19 (m, 2Н), 1.54-1.60 (m, 2Н), 1.72-1.77 (m, 1Н, CH), 2.50 (s, 3H, CH3), 3.49-3.53 (m, 2H, CH2), 3.573.60 (m,1Н, CH), 3.72 (br. s, 1H), 6.27 (s, 1H), 7.23 (br. t, 1H, NH); MS (m/z): 279 (M++1). 1-циклопропіл-N-гексил-3-гідрокси-6-метил-4оксо-1,4-дигідропіридин-2-карбоксамід: 28 Вихід: 87%; 1H-NMR (CDCl3, 400MHz) d 0.900.94 (t, J=6.8Hz, 3H, CH 3), 1.27-1.47 (m, 10Н), 1.681.73 (m, 2Н), 2.70 (s, 3H, CH3), 3.47-3.52 (m, 2Н, CH2), 3.85-3.88 (m, 1H, CH), 7.05 (s, 1H, C=CH), 8.30 (br. t, 1H, NH); MS (m/z): 293 (M++1). N-циклогексил-1-циклопропіл-3-гідрокси-6метил-4-оксо-1,4-дигідропіридин-2-карбоксамід: Вихід. 91%; 1H-NMR (CDCl3, 400MHz) d 0.981.05 (m,1Н), 1.21-1.38 (m, 3H), 1.60-1.80 (br. m, 7Н), 2.71 (s, 3H, CH3), 3.32-3.37 (m, 1H), 3.46-3.50 (m, 1H), 3.55-3.64 (m, 2Н), 3.92-3.99 (m, 1H), 6.88 (s, 1H, C=CH); MS (m/z): 277 (M++1). 1-Циклопропіл-3-гідрокси-N,N,6-триметил-4оксо-1,4-дигідропіридин-2-карбоксамід: Вихід: 97%; 1H-NMR (CD3OD, 300MHz) d 0.981.10 (m, 1H), 1.15-1.43 (m, 3H), 2.76 (s, 3H, CH3), 3.07 (s, 3H, CH3), 3.16 (S, 3H, CH3), 3.70-3.76 (m, 1H, CH), 7.10 (s, 1H, C=CH); 13C-NMR (CD3OD, 75MHz) d 9.5, 10.9, 21.3, 35.0, 38.1, 38.8, 114.4, 138.8, 142.9, 154.7, 162.5, 162.8 ; MS (m/z): 237 MS (m/z): 237 (M++1). 1-циклопропіл-3-гідрокси-6-метил-2-[(4метилпіперазин-1-іл)карбоніл]піридин-4(1H)-он: Вихід: 96%; 1H-NMR (CD3OD, 300MHz) d 0.891.00 (m, 1H), 1.06-1.29 (m, 3H), 1.52-1.85 (br. m, 8H), 2.56 (s, 3H, CH3), 3.40-3.60 (m, 3H), 3.88,3-89 (m, 1H, CH), 6.48 (s, 1H, C=C); 13C-NMR (CDCD3OD, 75MHz) d 10.0, 11.0, 21.0, 25.4, 26.4, 27.0, 36.5, 43.8, 49.2, 114.7, 132.9, 144.5, 152.8, 162.4, 170.2. N,1-дициклопропіл-3-гідрокси-бметил-4-оксо1,4-дигідропіридин-2-карбоксамід: 29 84178 30 314нм і незначно зростали при 281нм в кожному H-NMR (CD3OD, 300MHz) d 1.00-1.10 (m, 1Н), спектрі, тоді як в межах рН
ДивитисяДодаткова інформація
Назва патенту англійськоюCycloalkyl derivatives of 3-hydroxy-4-pyridinones
Автори англійськоюTam Tim Fat, Spino Michael, Li Wanren, Wang Yingsheng, Zhao Yanqing, Shah Birenkumar Hasmukhbhai
Назва патенту російськоюЦиклоалкильные производные 3-гидрокси-4-пиридинонов
Автори російськоюТам Тим Фет, Спино Майкл, Ли Ванрен, Ванг Йингшенг, Зао Янкинг, Ша Биренкумар Хасмукхбхал
МПК / Мітки
МПК: C07D 413/06, C07D 213/81, C07D 401/06, A61K 31/4412, A61K 31/537, A61K 31/496, A61P 39/00
Мітки: похідні, циклоалкільні, 3-гідрокси-4-піридинонів
Код посилання
<a href="https://ua.patents.su/31-84178-cikloalkilni-pokhidni-3-gidroksi-4-piridinoniv.html" target="_blank" rel="follow" title="База патентів України">Циклоалкільні похідні 3-гідрокси-4-піридинонів</a>
Попередній патент: Газгідратний спосіб концентрування рідких біопрепаратів
Наступний патент: Стінова панель
Випадковий патент: Спосіб виготовлення світлочутливого матеріалу для запису інформації на основі твердого електроліту