Пептид cdh3 та лікарський засіб, що містить його
Номер патенту: 100127
Опубліковано: 26.11.2012
Автори: Нішимура Ясухару, Імаі Кацунорі, Накамура Юсуке, Цунода Такуя
Формула / Реферат
1. Пептид за наступним (А) або (В):
(A) пептид, що складається з амінокислотної послідовності SEQ ID NO: 1 або 2,
(B) пептид, що складається з амінокислотної послідовності SEQ ID NO: 1 або 2, де одна або дві амінокислоти заміщені та де пептид має активність індукувати цитотоксичну Т-клітину (кілера).
2. Пептид за п. 1, де друга амінокислота від N-закінчення - це лейцин або метіонін.
3. Пептид за п. 1 або 2, де С-кінцева амінокислота - це валін або лейцин.
4. Засіб для індукування імунітету проти раку, який включає один або більше пептидів за будь-яким з пп. 1-3 як активний інгредієнт.
5. Засіб для лікування та/або профілактики раку, який включає один або більше пептидів за будь-яким з пп. 1-3 як активний інгредієнт.
6. Засіб для індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину (кілера), який включає один або більше пептидів за будь-яким з пп. 1-3 як активний інгредієнт.
7. Засіб для індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину (кілера), який включає один або більше полінуклеотидів, що кодують пептид за будь-яким з пп. 1-3, як активний інгредієнт.
8. Засіб для індукування цитотоксичної Т-клітини (кілера), який включає один або більше пептидів за будь-яким з пп. 1-3, як активний інгредієнт.
9. Антитіло проти пептиду за будь-яким з пп. 1-3.
10. Т-клітина-хелпер, цитотоксична Т-клітина (кілер) або група імуноцитів, що включає ці клітини, що індукується внаслідок застосування пептиду за будь-яким з пп. 1-3.
11. Антигенпрезентуюча клітина, яка презентує комплекс, який включає пептид за будь-яким з пп. 1-3 та HLA-антиген.
12. Антигенпрезентуюча клітина за п. 11, що індукується засобом за п. 6 або п. 7.
13. Екзосома, що презентує комплекс, який включає пептид за будь-яким з пп. 1-3 та HLA-антиген.
14. Екзосома за п. 13, де HLA-антиген - це HLA-A2 (HLA-A*0201).
15. Спосіб індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину (кілера), який включає етап контактування антигенпрезентуючої клітини з пептидом за будь-яким з пп. 1-3.
16. Спосіб індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину (кілера), який включає етап трансфекції полінуклеотиду, що кодує пептид за будь-яким з пп. 1-3, в антигенпрезентуючу клітину.
17. Спосіб індукування цитотоксичної Т-клітини (кілера), який включає етап контактування Т-клітини з пептидом за будь-яким з пп. 1-3.
18. Спосіб індукування імунітету проти раку, який включає етап введення пептиду за будь-яким з пп. 1-3 суб'єктові.
19. Спосіб лікування та/або профілактики раку, який включає етап введення пептиду за будь-яким з пп. 1-3 суб'єктові.
20. Застосування пептиду за будь-яким з пп. 1-3 для виробництва засобу для індукування імунітету проти раку.
21. Застосування пептиду за будь-яким з пп. 1-3 для виробництва лікарського засобу для лікування та/або профілактики раку.
22. Спосіб індукування цитотоксичної Т-клітини (кілера), який включає етап спільного культивування антигенпрезентуючої клітини, яку піддали контактуванню з пептидом за будь-яким з пп. 1-3, з Т клітинами CD8+.
Текст
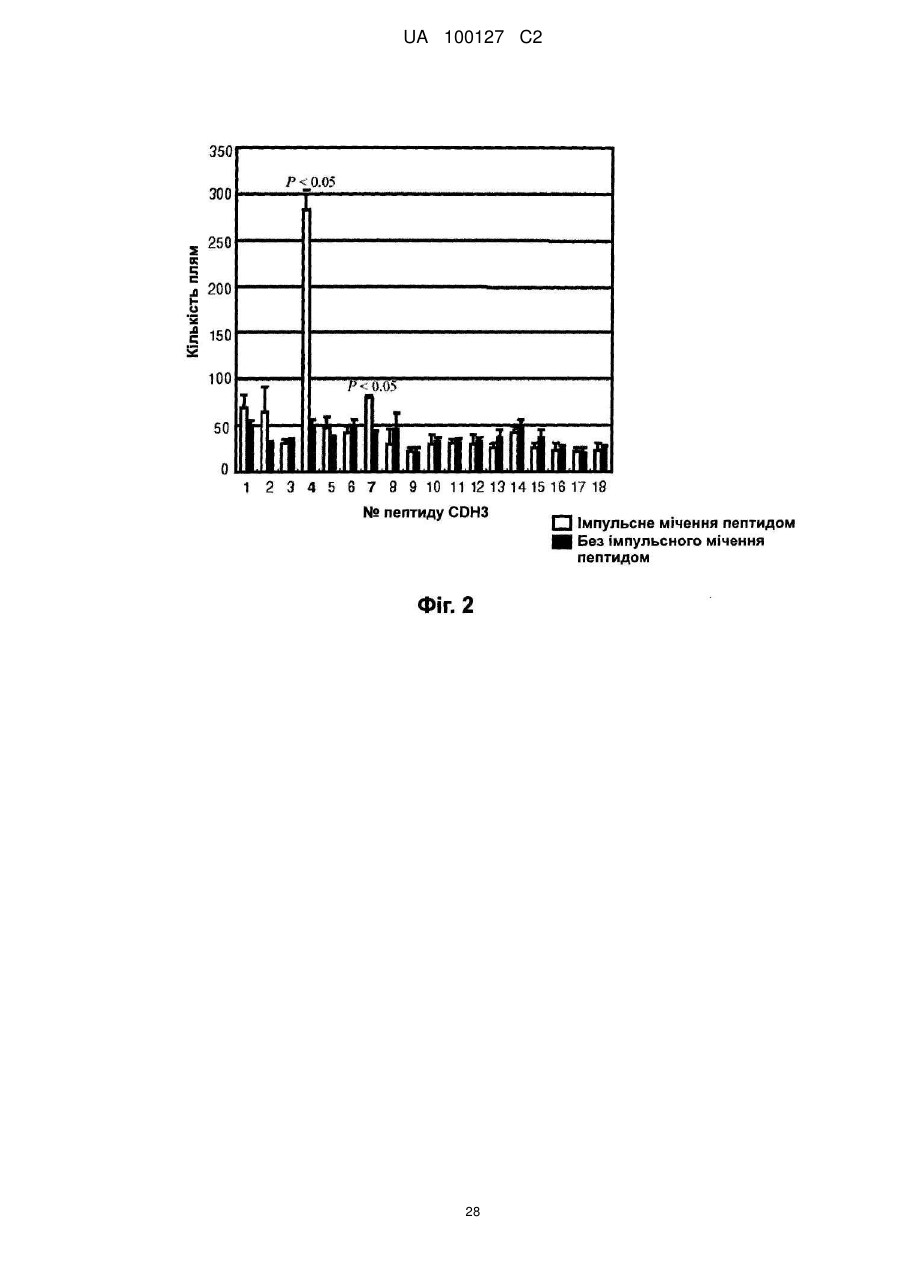
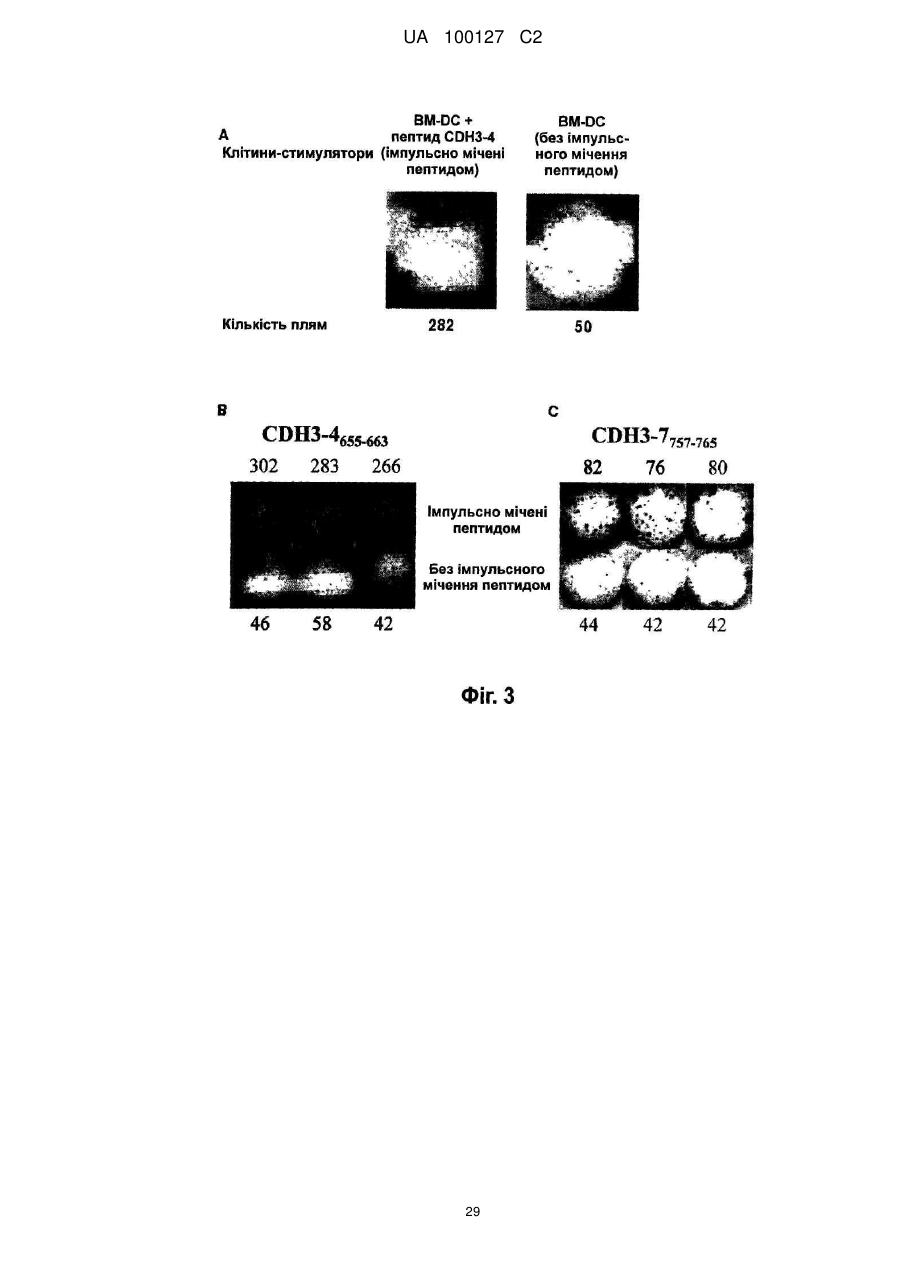
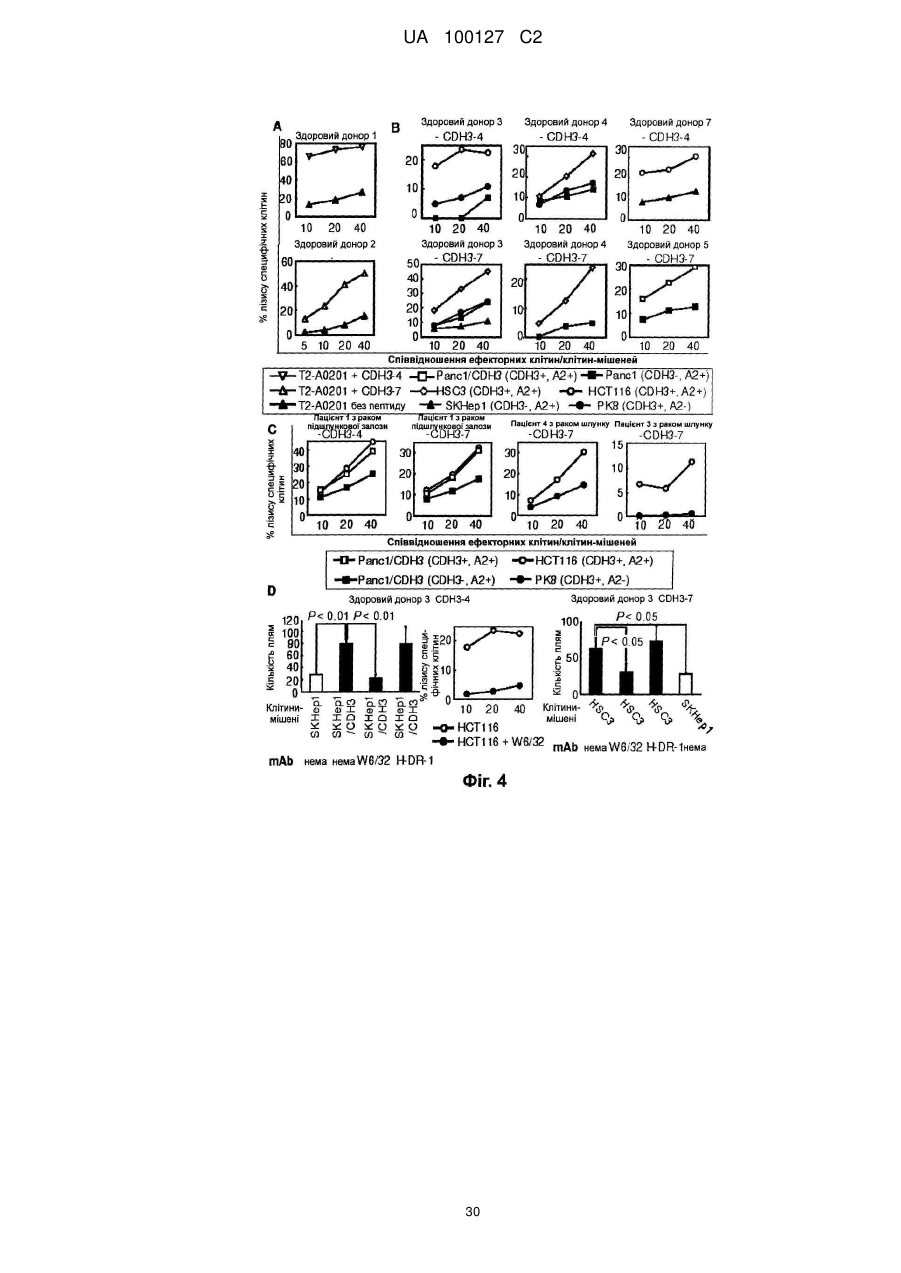
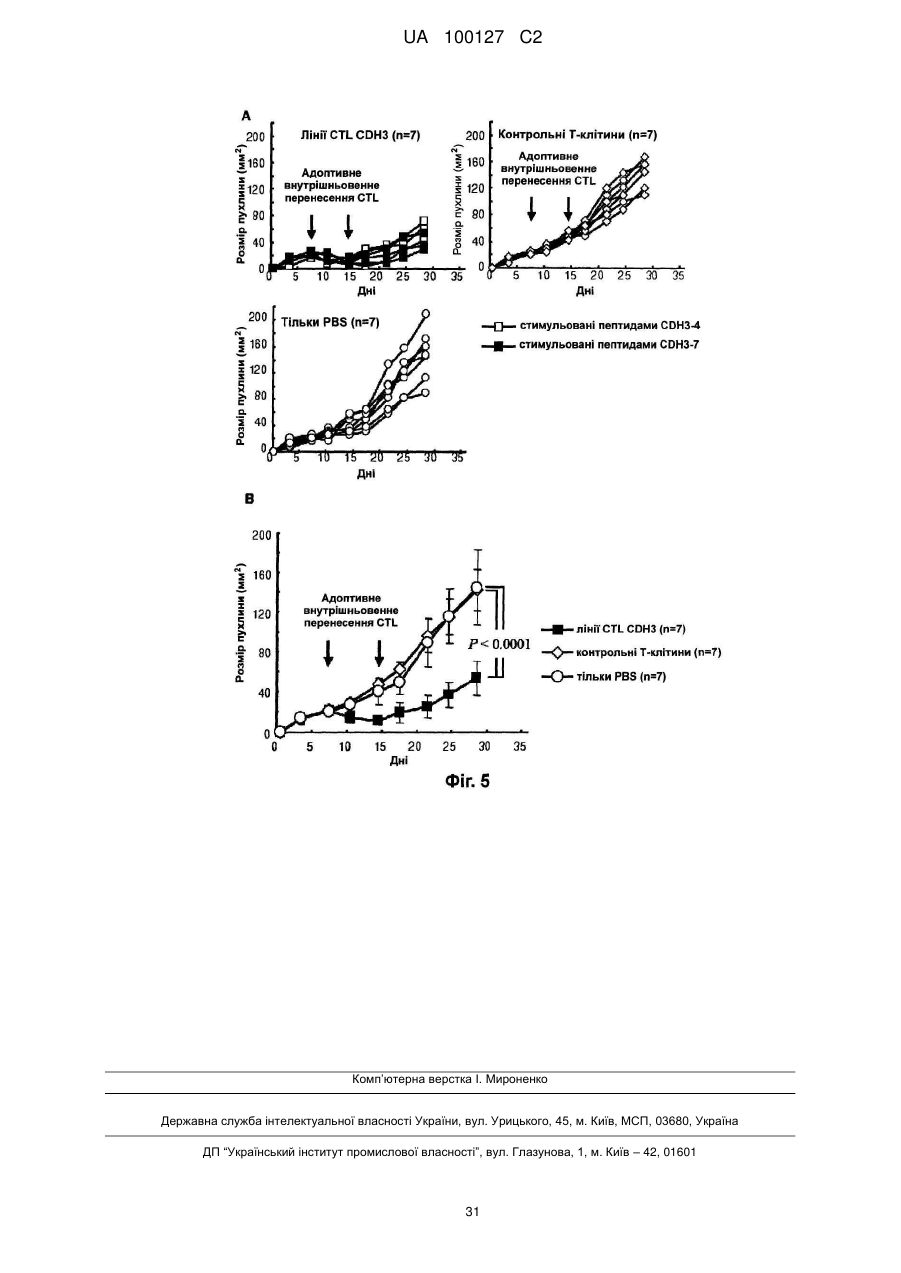
Реферат: Винахід належить до пептиду, що складається з амінокислотної послідовності SEQ ID NO: 1 або 2; або пептиду, що включає амінокислотну послідовність SEQ ID NO: 1 або 2, де одна, дві амінокислоти заміщені та де пептид має активність індукувати цитотоксичні Т-клітини-кілери. UA 100127 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Цей винахід стосується новітніх пептидів, що є корисними як вакцини проти тих видів раку, що надзвичайно високо експресують Р-кадгерин (CDH3), таких як рак підшлункової залози, холангіокарцинома, рак шлунку, рак товстої кишки та рак легенів, та фармацевтичних засобів, що включають цей пептид для лікування та профілактики раку. Попередній рівень техніки Рак підшлункової залози складає приблизно 2-3 % від усіх злоякісних пухлин. Кожного року приблизно 200000 людей в усьому світі вмирають від раку підшлункової залози, та перелік померлих від цього виду раку посідає 5 місце серед померлих від злоякісних пухлин. В Японії щорічно вмирає приблизно 20000 людей. Фактори ризику, що спричиняють розвиток раку підшлункової залози, включають діабет, хронічний панкреатит, паління та їм подібне, а також повідомлялося, що випадки хвороби у родині є також одним з факторів ризику. Робилися різні спроби ранньої діагностики, які включають удосконалену діагностичну томографію; проте, у більшості пацієнтів діагностували цей вид раку на розвинутих стадіях, коли вони демонструють стійкість до хіміотерапії. Отже, їх коефіцієнт виживаності протягом 5 років становить приблизно 9,7 % та лише 13 % навіть у випадках хірургічного видалення пухлини. Рак підшлункової залози має найбільш несприятливий прогноз серед видів раку травної системи. Внаслідок складності його діагностування спостерігається поступове зростання відсотку раку підшлункової залози як причини смерті від раку, особливо у розвинутих країнах. Незважаючи на здійснення багатопрофільних способів лікування, перш за все, хірургічної резекції, та інших способів лікування, таких як радіотерапія та хіміотерапія, вони суттєво не підвищили терапевтичний ефект, та терміново потрібні новітні терапевтичні стратегії. Холангіокарцинома складає приблизно 10 % від випадків первинного раку печінки, та вона є другим найпоширенішим видом раку після печінково-клітинного раку (гепатоцелюлярного раку). Цей вид раку демонструє непомітні клінічні симптоми, та у багатьох випадках рак виявляють на розвинутих стадіях, що супроводжуються метастазом в лімфатичні вузли, внутрішньопечінковим метастазом та їм подібним. Коефіцієнт виживаності протягом 5 років становить приблизно 20 % та 35 % у випадках хірургічної резекції, проте він є дуже низьким лише 7,4 % у випадках без хірургічного видалення. Незважаючи на те, що хірургічна резекція це єдиний спосіб терапії, від якого очікують довготривалої виживаності, багато пацієнтів є вже неоперабельними у час виявлення (показник хірургії: 66 %, показник резекції, що не приводить до виліковування: 20 %). Сприйнятливість пацієнтів як до протиракових ліків, так і до радіотерапії є низькою, та бажаним є запровадження терапії для неоперабельних випадків, включаючи випадки резекції, що не приводить до виліковування. Порівняно із західними країнами, коефіцієнт смертності від раку шлунку є високим серед азійських країн, таких як Японія та Китай. Раннє виявлення раку шлунку стало можливим внаслідок розповсюдження медичних тестів та прогресу в галузі приладів для ендоскопії травної системи та в способах огляду, що, у свою чергу, зумовлює зменшення кількості пацієнтів. Проте, рак шлунку все ще є другою головною причиною смерті від злоякісних пухлин серед японців, та його показник серед причин смерті все ще залишається високим. Рак товстої кишки є другим найпоширенішим видом раку у західних країнах, та він є третьою найпоширенішою причиною смерті внаслідок злоякісних пухлин у Японії. Рак шлунку та рак товстої кишки лікуються здебільшого шляхом хірургічної резекції, а також шляхом хіміотерапії, радіотерапії та їм подібного. Імунотерапія, яка пригнічує ріст раку шляхом покращення імунітету ракового пацієнта проти раку, у наш час привертає увагу як новітній спосіб терапії метастатичного раку та тяжкого раку, проти яких застосування вищезгаданих способів терапії є неможливим. Кількість випадків раку легенів неухильно зростає за останні роки в усьому світі, та зараз приблизно один мільйон людей на рік вмирають від раку легенів. Смертність від раку легенів безперервно зростає також і у Японії, та вважають, що у 2015 році вона сягатиме 123000. Це головна причина смертності від злоякісних пухлин у Японії. Вважають, що зростання у кількості зумовлюється підвищенням віку населення. Раннє виявлення та раннє лікування є важливими при лікуванні раку легенів. Проте, нещодавно було вказано, що звичайні рентгенівські дослідження грудної клітини та аналізи мокроти, які здійснюються під час медичних оглядів, несуттєво впливають на раннє виявлення раку легенів та не приводять до зниження показників смертності від раку. Оскільки, як вважають, кількість смертей від раку легенів безперервно зростає, розробка новітньої терапевтичної стратегії є терміновим викликом. З іншого боку, нещодавні розробки у галузі молекулярної біології та пухлинної імунології пояснюють, що цитотоксичні Т-клітини (клітини-кілери) та Т-клітини-хелпери розпізнають пептиди, що генеруються внаслідок руйнування білків, які специфічно та надзвичайно високо експресуються у ракових клітинах та які презентуються на поверхні ракових клітин або 1 UA 100127 C2 5 10 15 20 25 30 35 40 45 50 55 60 антигенпрезентуючих клітин молекулами HLA (загального антигену лейкоцитів) та стають причиною імунної реакції, яка руйнує ракові клітини. Далі, було визначено багато білків пухлинних антигенів та пептидів, що походять від них, які стимулюють такі імунні реакції, що атакують ці види раку, та зараз набуває розвитку клінічне застосування антиген-специфічної протипухлинної імунотерапії. HLA-молекула класу I експресується на поверхні усіх клітин тіла, які містять ядра. Вона експресується на клітинній поверхні шляхом зв'язування з пептидами, що генеруються внаслідок внутрішньоклітинного руйнування білків, що виробляються у цитоплазмі або у ядрі. На поверхні здорової клітини пептиди, що походять від нормальних білків, зв'язуються з HLAмолекулами класу І, та Т-клітини імунної системи не будуть ідентифікувати їх, щоб зруйнувати клітину. З іншого боку, у процесі розвитку ракової пухлини ракові клітини іноді експресують велику кількість білків, які ледь або дуже несуттєво експресуються у здорових клітинах. Коли HLA-молекули класу І зв'язуються з пептидами, згенерованими внаслідок внутрішньоклітинного руйнування білків, що специфічно та надзвичайно експресуються у ракових клітинах, а потім експресуються на поверхні ракових клітин, Т-клітини-кілери будуть розпізнавати їх та руйнувати тільки ракові клітини. Крім того, внаслідок введення таких специфічних до раку антигенів або пептидів окремому пацієнту можна індукувати імунну реакцію, яка руйнує ракові клітини та пригнічує зростання раку, при цьому вони не шкодять здоровим клітинам. Це називається протираковою імунотерапією, що застосовує специфічні для раку антигени. HLA-молекули класу ІІ здебільшого експресуються на поверхні антигенпрезентуючих клітин. HLA-молекули класу ІІ зв'язуються з пептидами, які походять від специфічних для раку антигенів, які генеруються внаслідок внутрішньоклітинного руйнування специфічних для раку антигенів, інкорпорованих в антигенпрезентуючі клітини ззовні клітин, та потім експресуються на клітинній поверхні. Тклітини-хелпери після їх розпізнавання активуються та індукують або підсилюють імунну реакцію проти пухлин шляхом виробництва різних цитокінів, які активують інші імунокомпетентні клітини. Отже, якщо буде розроблено імунотерапію, яка націлена на антигени, що специфічно та суттєво експресуються у цих ракових пухлинах, така терапія може ефективно усувати тільки рак, при цьому не здійснюючи жодного шкідливого впливу на здорові органи пацієнта. Також очікується, що цю терапію можна застосовувати для будь-яких пацієнтів з кінцевою стадією розвитку раку, до яких неможна застосовувати інші способи лікування. Крім того, внаслідок попереднього введення специфічного для раку антигену та пептиду як вакцини особам з високим ступенем ризику розвитку у них таких видів раку, можна запобігти розвитку раку. Незважаючи на те, що існує багато способів лікування раку підшлункової залози, прогноз для розвитку цього виду раку є дуже несприятливим порівняно з іншими видами раку. Причини цього полягають у тому, що рак підшлункової залози важко виявляти на ранній стадії, він швидко прогресує, та, внаслідок цього, його часто виявляють лише на пізніх розвинутих стадіях. Незважаючи на те, що хірургічне видалення у наш час є найбільш перспективним радикальним способом лікування, випадки, коли можна виконувати резекцію, складають лише приблизно 20 % від загальної кількості. Хірургічне лікування підшлункової залози є також надзвичайно інвазивним, та випадки розвинутих стадій демонструють поганий прогноз навіть після хірургічної резекції. Випадки, коли видалення є неможливим, лікуються за допомогою хіміотерапії, де здебільшого застосовується гемцитабін, та за допомогою радіотерапії. Проте, багато випадків демонструють стійкість до лікування та мають несуттєві цито-відновлювальні ефекти, що є однією з причин, чому рак підшлункової залози важко лікувати. Отже, якщо буде розроблено імунотерапію, яка націлена на антиген, який специфічно та суттєво експресується у раковій пухлині підшлункової залози, така терапія може ефективно усунути лише рак, при цьому не спричиняючи жодного шкідливого впливу на здорові органи пацієнта. Також очікується, що вона стане терапією, яку можна застосовувати для будь-якого пацієнта з кінцевою стадією розвитку раку. Крім того, оскільки рак підшлункової залози часто має рецидив невдовзі після резекції, також очікують, що ця терапія буде корисною як додаткова терапія після хірургічного втручання. Автори цього винаходу попередньо виконали аналіз широкогеномної генної експресії 27648 генів людини за допомогою аналізу з використанням кДНК-біочипа, щоб дослідити їх профілі експресії у 16 випадках раку підшлункової залози, у зародкових органах та різних здорових органах дорослої людини. Внаслідок цього автори цього винаходу визначили, що Р-кадгерин (CDH3) експресувався на високому рівні у багатьох випадках раку підшлункової залози, проте він ледь експресувався у здорових органах дорослої людини. Далі, спостерігали, що CDH3 також експресувався на високому рівні у більшості випадків холангіокарциноми, раку шлунку, раку товстої кишки, недрібноклітинного раку легенів, раку яєчок, раку шийки матки, остеогенної саркоми, саркоми м'яких тканин та їм подібних. Цей факт дозволяє припустити, що CDH3 може 2 UA 100127 C2 5 10 15 20 25 30 35 40 45 50 55 60 бути специфічним для раку антигеном при багатьох видах раку. HLA-A2 часто спостерігається у популяціях людей незалежно від раси, та приблизно 30 % японців є носіями HLA-A2. Отже, якщо за допомогою HLA-A2 можна ідентифікувати пептид, презентований Т-клітинам-кілерам, то його можна широко застосовувати не тільки до японців, але також і до населення європеоїдної раси та їм подібного. Отже, важливою задачею є ідентифікація ракових антигенних пептидів, презентованих Т-клітинам-кілерам за допомогою HLA-A2. Може бути надзвичайно переважним застосовувати такі ракові антигенні пептиди для імунотерапії раку легенів, показники захворюваності та смертності якого є надзвичайно високими в усьому світі. Інформацію стосовно документів попереднього рівня техніки, які є релевантними стосовно цього винаходу, наведено нижче. [Непатентний документ 1] Nakamura, T., et al., Oncogene 23: 2385-2400 (2004). [Непатентний документ 2] Obama, K., et al., Hepatology 41: 1339-1348 (2005). [Непатентний документ 3] Taniuchi, K., et al., Cancer Res 65: 3092-3099 (2005). [Непатентний документ 4] Soler, A. P., et al., Cancer 86: 1263-1272 (1999). [Непатентний документ 5] Paredes, J., et al., Clin Cancer Res 11: 5869-5877 (2005). [Непатентний документ 6] Ingunn, M., et al., J Clin Oncol 22: 1242-1252 (2004). [Непатентний документ 7] Glenn, L., et al., J Cell Biol 139: 1025-1032 (1997). [Непатентний документ 8] Bauer, R., et al., Exp. Mol. Pathol. 81: 224-230 (2006). [Непатентний документ 9] Muzon-Guerra, M.F., et al. Cancer 103: 960-969 (2005). [Непатентний документ 10] Marck, V.V., et al., Cancer Res. 65: 8774-8783 (2005). Суть винаходу Задачі, які слід розв'язати завдяки винаходу Мета, якої слід досягти за допомогою цього винаходу, - це розробка засобу для реалізації імунотерапії, яка пригнічує зростання раку шляхом підвищення імунітету ракових пацієнтів проти раку, як новітньої терапії для лікування метастатичних та важких форм раку, які складно лікувати хірургічними способами, шляхом хіміотерапії та радіотерапії, які застосовуються для лікування раку підшлункової залози, холангіокарциноми, раку шлунку, раку товстої кишки, недрібноклітинного раку легенів та їм подібного. Цим винаходом пропонуються ідентифіковані пептиди, що походять від білків, які специфічно та на високому рівні експресуються у ракових пухлинах та які презентуються Т-клітинам-кілерам за допомогою HLA-A2. Це дозволяє здійснювати імунотерапію, яку можна застосовувати до приблизно 30 % пацієнтів-японців з різними видами раку, які експресують CDH3 на високому рівні. Засіб для розв'язання задач За допомогою аналізу із застосуванням біочипа до кДНК тканин раку підшлункової залози автори цього винаходу ідентифікували CDH3 (GenBank, номер доступу No. NM_001793) як ген, що експресується на високому рівні у раковій пухлині підшлункової залози. З метою дослідження, чи індукується, чи не індукується протипухлинний імунітет за допомогою специфічних до CDH3 Т-клітин-кілерів, використали HLA-A2-трансгенних мишей, які експресують HLA-A2, носієм якого є 30 % представників японської нації. Докладніше, HLA-A2трансгенних мишей імунізували похідними від мишачого кісткового мозку дендритними клітинами, імпульсно міченими пептидом CDH3 людини, який має зв'язувальний з HLA-A2 мотив, щоб визначити, чи будуть індукуватися обмежені HLA-A2 специфічні до цього пептиду Тклітини-кілери. Спосіб імуноферментного спот-аналізу (ELISPOT) застосовували для виявлення γ-інтерферону (IFN-γ), що виробляється Т-клітинами-кілерами, які були активовані внаслідок розпізнавання пептиду, презентованого HLA-A2, та, тим самим, для визначення, чи індукуються, чи не індукуються Т-клітини-кілери, специфічні до пептиду CDH3, у клітинах селезінки імунізованих мишей. Внаслідок цього автори цього винаходу ідентифікували два новітні пептиди CDH3, які можна використовувати для імунотерапії HLA-A2-позитивних ракових пацієнтів. Крім того, було виявлено, що чутливі до CDH3 CTL, які індукуються внаслідок застосування цих пептидів, мають цитотоксичність, специфічну до ракових клітин, які експресують ендогенний CDH3 та молекули HLA-A2, та що CTL розпізнають клітини-мішені у такий спосіб, що зумовлюється обмеженням HLA класу І. Крім того, було також визначено, що зростання пухлин, трансплантованих до мишей NOD/SCID, суттєво пригнічувалося внаслідок внутрівенної ін'єкції CD8-позитивних клітин, індукованих цими пептидами (спосіб перенесеного імунітету CTL). Більш специфічно, цим винаходом пропонується: (1) Пептид з наступного (А) або (B): (А) пептид, що включає амінокислотну послідовність SEQ ID NO: 1 або 2, (B) пептид, що включає амінокислотну послідовність SEQ ID NO: 1 або 2, де одна, дві або декілька амінокислот заміщені, стерті, вставлені та/або додані та де пептид має активність 3 UA 100127 C2 5 10 15 20 25 30 35 40 45 50 55 60 індукувати цитотоксичну Т-клітину-(кілера); (2) пептид за (1), де друга амінокислота від N-закінчення - це лейцин або метіонін; (3) пептид за (1), де С-кінцева амінокислота - це валін або лейцин; (4) засіб для індукування імунітету проти раку, який включає один або більше пептидів за (1) як активний інгредієнт; (5) засіб для лікування та/або профілактики раку, який включає один або більше пептидів за (1) як активний інгредієнт; (6) засіб для індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину-(кілера), який включає один або більше пептидів за (1) як активний інгредієнт; (7) засіб для індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину-(кілера), який включає один або більше полінуклеотидів, що кодують пептид за (1), як активний інгредієнт; (8) засіб для індукування цитотоксичної Т-клітини-(кілера), який включає один або більше пептидів за (1) як активний інгредієнт; (9) антитіло проти пептиду за (1); (10) Т-клітина-хелпер, цитотоксична Т-клітина-(кілер) або група імуноцитів, що включає ці клітини, що індукується внаслідок застосування пептиду за (1); (11) антигенпрезентуюча клітина, яка презентує комплекс, який включає пептид за (1) та HLA-антиген; (12) антигенпрезентуюча клітина за (11), що індукується засобом за (6) або (7); (13) екзосома, що презентує комплекс, який включає пептид за (1) та HLA-антиген; * (14) екзосома за (13), де HLA-антиген - це HLA-A2 (HLA-A2 0201); (15) спосіб індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину-(кілера), який включає етап контактування антигенпрезентуючої клітини з пептидом за (1); (16) спосіб індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину-(кілера), який включає етап трансфекції полінуклеотиду, що кодує пептид за (1), в антигенпрезентуючу клітину; (17) спосіб індукування цитотоксичної Т-клітини-(кілера), який включає етап контактування Тклітини з пептидом за (1); (18) спосіб індукування імунітету проти раку, який включає етап введення пептиду за (1) суб'єктові; (19) спосіб лікування та/або профілактики раку, який включає етап введення пептиду за (1) суб'єктові; (20) застосування пептиду за (1) для виробництва засобу для індукування імунітету проти раку; та (21) застосування пептиду за (1) для виробництва лікарського засобу для лікування та/або профілактики раку. Стислий опис ілюстративного матеріалу Фіг. 1 демонструє протокол ідентифікації пептидів CDH3, що розпізнаються HLA-A2обмеженими Т-клітинами-кілерами. (День, коли клітини селезінки виділили з імунізованих мишей, позначено як "День 0"). Фіг. 2 демонструє графік, на якому зображено результат ELISPOT-аналізу для 18 пептидів CDH3. ELISPOT-аналіз використовували для визначення, чи можуть Т-клітини-кілери, отримані від імунізованих мишей, специфічно реагувати з клітинами, імпульсно міченими пептидами CDH3, та виробляти IFN-γ. Т-клітини-кілери, індуковані пептидом CDH3-4 або CDH3-7, специфічно розпізнавали BM-DC, імпульсно мічені пептидами CDH3, та виробляли IFN-γ; проте, Т-клітини-кілери, індуковані іншими пептидами, не демонстрували CDH3-специфічну імунну реакцію CTL. Отже, було підтверджено, що пептиди CDH3-4 та CDH3-7 є епітопними пептидами, спроможними індукувати CDH3-специфічні HLA-A2-обмежені Т-клітини-кілери. Номери пептидів CDH3, показані на Фіг. 2, відповідають номерам пептидів, наведеним у колонці "Положення пептидів" у Таблиці 2, а не номерам послідовностей (SEQ ID NO), описаних у цьому описі. Фіг. 3 демонструє фотографії, на яких зображено результати імуноферментного спотаналізу (ELISPOT), який виявляє IFN-γ, що виробляється Т-клітинами-кілерами, активованими внаслідок специфічного розпізнавання пептидів CDH3. CD4-негативні клітини селезінки демонстрували 283,7±40,0 плям/комірку у відповідь на BM-DC, імпульсно мічені пептидом CDH3-4655-663 (ліворуч на А та зверху на В), проте вони демонстрували 48,7±11,9 плям/комірку у відповідь на BM-DC, які не були імпульсно мічені (праворуч на А та нижній ряд на В) (P < 0,05). 4 UA 100127 C2 5 10 15 20 25 30 35 40 45 50 55 60 Подібно до цього CD4-негативні клітини селезінки демонстрували 79,3±3,2 плям/комірку у відповідь на BM-DC, імпульсно мічені пептидом CDH3-7757-765 (верхній ряд на С), проте вони демонстрували 42,7±2,5 плям/комірку у відповідь на BM-DC, які не були імпульсно мічені (нижній ряд на С) (P 5. 30 Приклад 2 Селекція складу пептиду CDH3, що має афінітет зв'язування з HLA-A2 Пошук амінокислотної послідовності CDH3 людини здійснювали, використовуючи систему BIMAS, та вибрали 18 пептидів у порядку зменшення очікуваного афінітету зв'язування з HLAA2 (Таблиця 2) 35 16 UA 100127 C2 Таблиця 2 Положення CDH3-1 CDH3-2 CDH3-3 CDH3-4 CDH3-5 CDH3-6 CDH3-7 CDH3-8 CDH3-9 CDH3-10 CDH3-11 CDH3-12 CDH3-13 CDH3-14 CDH3-15 CDH3-16 CDH3-17 CDH3-18 5 10 15 20 25 30 35 пептидів 659-667 629-637 602-610 655-663 419-427 564-572 757-765 187-195 152-160 228-237 500-509 419-428 440-449 66-75 2-11 101-110 223-232 655-664 Амінокислотні послідовності пептидів VLGAVLALL QLTVIRATV VVLSLKKFL FILPVLGAV KLPTSTATI VLNITDKDL FIIENLKAA AVSENGASV SPPEGVFAV VLPGTSVMQV TLDREDEQFV KLPTSTATIV FVPPSKVVEV FSTDNDDFTV GLPRGPLASL ILRRHKRDWV SVLEGVLPGT FILPVLGAVL (SEQ ID NO: 3) (SEQ ID NO: 4) (SEQ ID NO: 5) (SEQ ID NO: 1) (SEQ ID NO: 6) (SEQ ID NO: 7) (SEQ ID NO: 2) (SEQ ID NO: 8) (SEQ ID NO: 9) (SEQ ID NO: 10) (SEQ ID NO: 11) (SEQ ID NO: 12) (SEQ ID NO: 13) (SEQ ID NO: 14) (SEQ ID NO: 15) (SEQ ID NO: 16) (SEQ ID NO: 17) (SEQ ID NO: 18) Показники афінітету зв'язування 84 70 65 49 37 36 30 25 25 272 153 100 64 50 49 24 23 20 Епітопи HLA-A2-обмежених Т-клітин-кілерів, ідентифіковані у цьому винаході, показано підкресленням. Приклад 3 По-перше, дендритні клітини (DC) індукували з клітин кісткового мозку HLA-A2-трансгенних мишей, застосовуючи спосіб, описаний раніше (Komori H et al. Clinical Cancer Research 12: 26892697, 2006). Після цього отримані таким чином ВМ-DC імпульсно помітили пептидами CDH3 (10 5 мкM), а потім ввели інтраперитонеально HLA-A2-трансгенним мишам при 5 × 10 клітин/мишу. Після імунізації шляхом введення двічі з тижневим інтервалом, клітини селезінки миші зібрали та використали для виявлення Т-клітин-кілерів. Для того, щоб точно виявити індукцію Т-клітин+ кілерів, що походять з Т-клітин CD8 , використовували клітини селезінки, які отримали + внаслідок усунення Т-клітин CD4 за допомогою гранул MACS після видалення селезінки. Фігура 1 демонструє протокол визначення пептидів CDH3, що розпізнаються HLA-A2обмеженими Т-клітинами-кілерами у HLA-A2-трансгенних мишах. День, коли клітини селезінки зібрали від імунізованих мишей, позначено як "День 0". День -21: (1) Індукцію похідних від кісткового мозку дендритних клітин (далі у цьому описі позначаються "BM-DC") було ініційовано шляхом додавання GM-CSF до клітин кісткового мозку від HLA-A2-трансгенних мишей. День -14: (2) Суміш трьох типів пептидів CDH3 додали до індукованих BM-DC. Через дві 5 години після цього BM-DC ввели інтраперитонеально при 5 × 10 клітин/мишу. (1) та (2) повторювали двічі з тижневими інтервалами. День 0: Клітини селезінки узяли від імунізованих HLA-A2-трансгенних мишей та культивували разом з BM-DC, які знов інкубували з пептидом CDH3 протягом 2 годин, та культивували протягом 6 днів. День 6: Щоб виявити Т-клітини-кілери, які специфічно розпізнають пептиди CDH3, Т-клітини, що виробляють гама-інтерферон (IFN-γ), кількісно оцінили за допомогою імуноферментного спот-аналізу (ELISPOT) після антигенної стимуляції. Як клітини-мішені використовували імпульсно мічені пептидом CDH3 BM-DC та не мічені BM-DC. Дослідження активності CDH3-специфічних Т-клітин-кілерів шляхом імуноферментного спотаналізу Для того, щоб підтвердити, що Т-клітини-кілери, які специфічно реагують з CDH3, внаслідок чого виробляється IFN-γ, дійсно існують серед цих клітин, здійснювали дослідження шляхом імуноферментного спот-аналізу. IFN-γ виявили, використовуючи набір ELISPOT мишачого IFN-γ Mouse IFN-γ ELISPOT Set (BD Biosciences). Коли Т-клітини-кілери (ефекторні) реагують на клітини-стимулятори (мішені) та виробляють IFN-γ, тоді IFN-γ буде виявлятися у вигляді червоних плям. Як клітини-мішені використовували або BM-DC, або імпульсно мічені пептидом 17 UA 100127 C2 5 10 15 20 25 30 35 40 45 50 55 60 CDH3 BM-DC. По-перше, на планшет для імуноферментного спот-аналізу (BD Biosciences) нанесли антитіла анти-мишачого IFN-γ на 18 годин, а потім блокували, використовуючи 10 % FCS/RPMI (телячу сироватку крові/RPMI) протягом 2 годин. Ефекторні клітини (100 мкл/комірку) та клітини-мішені (100 мкл/комірку) змішали та культивували протягом 22 годин при 37 °C. Експеримент виконували при співвідношенні ефекторних клітин/клітин-мішеней (співвідношення E/T) 10:1. Планшет потім промили стерильною водою, піддали реакції з біотинілованим антитілом анти-мишачого IFN-γ протягом 2 годин, а потім піддали реакції зі стрептавідин-HRP протягом 1 години. IFN-γ-позитивні плями виявили у розчині субстрату. Для рахування плям використовували програмне забезпечення для автоматичного аналізу MINERVA TECH. Внаслідок цього імунну реакцію CDH3-специфічних Т-клітин-кілерів спостерігали для Т-клітинкілерів, індукованих пептидом CDH3-4 або CDH3-7, у той час коли жодної CDH3-специфічної імунної реакції не спостерігали для Т-клітин-кілерів, індукованих іншими пептидами (Фігури 2 та 3). Результати імуноферментного спот-аналізу на Т-клітинах-кілерах, індукованих пептидом CDH3-4 (SEQ ID NO: 1) та пептидом CDH3-7 (SEQ ID NO: 2), наведено на Фігурі 3. Т-клітини-кілери демонстрували 283,7±40,0 плям/комірку у відповідь на ВМ-DC, імпульсно мічені пептидом CDH3-4 (SEQ ID NO: 1), тоді як вони демонстрували 48,7±11,9 плям/комірку у присутності BM-DC, які не мітили імпульсно пептидом (P < 0,05). Подібно до цього, Т-клітиникілери демонстрували 79,3±3,2 плям/комірку у відповідь на BM-DC, імпульсно мічені пептидом CDH3-7 (SEQ ID NO: 2), тоді як вони демонстрували 42,7 плям/комірку у присутності BM-DC, імпульсно не мічених пептидом (P < 0,05). Статистичний аналіз Перевірку за двостороннім критерієм Ст'юдента застосовували для оцінки статистичної значущості даних, отриманих за допомогою імуноферментного спот-аналізу, та розміру пухлин між терапевтичними групами. Значущим вважали значення P < 0,05. Статистичний аналіз виконували, застосовуючи комерційно доступний пакет статистичного програмного забезпечення (SPSS for Windows (TM), version 11.0, Chicago, IL, USA). Приклад 4 Клітинні лінії та експресія HLA Клітинну лінію раку підшлункової залози PANC1, клітинну лінію раку ротової порожнини HSC3 та клітинну лінію Т2, позитивну на HLA-A2 (A*0201) та TAP-дефіцієнтну, що використовуються для визначення цитотоксичної активності, купили у Riken Cell Bank (Tsukuba, Японія). Клітинну лінію РК8 раку підшлункової залози людини було люб'язно надано Cell Resource Center for Biomedical Research, Institute of Development, Aging and Cancer, Tohoku University. Клітинну лінію HCT116 раку товстої кишки людини було люб'язно надано Dr. B. Vogelstein, Johns Hopkins University (Baltimore, MD). Клітинну лінію SKHep1 раку печінки людини було люб'язно надано професором Kyogo Ito, Kurume University (Kurume, Японія). Експресію HLA-A2 досліджували шляхом проточної цитометрії із застосуванням моноклонального антитіла анти-HLA-A2 (mAb) BB7.2 (One Lambda, Inc., Canoga Park, CA, США), з метою вибрати HLA-A2позитивних донорів крові та лінії клітин-мішеней для аналізів цитотоксичності. Ці клітини зберігали у середовищі RPMI 1640 або DMEM з доданою 10 % FCS в атмосфері 5 % CO2 при температурі 37 °C. Лентивірусний генний перенос Опосередкований лентивірусним вектором генний перенос здійснювали, як описано раніше (Tahara-Hanaoka S, et al. Exp Hematol 2002; 30: 11-17). Стисло кажучи, 17 мкг самоінактивуючих векторів CSII-CMV-RfA та CSIIEF-RfA (Miyoshi H, et al. J Virol 1998; 72: 8150-8157), що несуть кДНК CDH3, та 10 мкг pCMV-VSV-G-RSV-Rev та pCAG-HIVgp трансфектували у клітини 293Т, вирощені у 10 см-чашці для культивування, використовуючи Lipofectamine 2000 (Invitrogen Corporation, CA, США). Через 60 годин після цього культуральне середовище відновили та вірусні частинки осадили шляхом ультрацентрифугування (50000 х g, протягом 2 годин). Осад суспендували у 50 мкл середовища RPMI 1640 та 10 мкл вірусної суспензії додали до клітин PANC1 або клітин SKHep1, які посіяли на планшеті з пласким дном з 96 комірками з щільністю 5 4 × 10 клітин на комірку. Експресію трансфектованого CDH3 підтвердили шляхом вестерн-блот аналізу. Індукція CTL людини, які реагують на CDH3 РВМС (мононуклеари периферійної крові), що походять з гепаринізованої крові HLA-A2позитивних пацієнтів з раком підшлункової залози, раком шлунку, колоректальним раком або здорових донорів, виділили шляхом центрифугування з градієнтом щільності Ficoll-Conray. Дендритні клітини (DC), що походять з мононуклеарів периферійної крові (моноцитів), отримали згідно зі способом, про який повідомлялося раніше (Yoshitake Y, et al. Clin Cancer Res 2004; 10: 18 UA 100127 C2 5 10 15 20 25 30 35 40 45 50 55 60 6437-6448, Komori H, et al. Clin Cancer Res 2006; 12: 2689-2697). DC імпульсно мітили 20 мкг/мл пептиду-кандидата у присутності 4 мкг/мл β2-мікроглобуліну (Sigma-Aldrich, St. Louis, MO, США) протягом 2 годин при 37 °C у AIM-V (Invitrogen), що містило 2 % інактивовану теплотою автогенну плазму. DC потім опромінили (40 грей) та інкубували з CD8-позитивними клітинами. Інкубацію здійснювали у планшетах з 24 комірками, які підготували так, що вони містили у 5 кожній комірці 2 мл AIM-V з додаванням 2 % автогенної плазми, 1 × 10 імпульсно мічених 6 + пептидом DC, 2 × 10 T-клітин CD8 та 5 нг/мл рекомбінантного IL-7 людини (Wako, Osaka, Японія). Через два дні після цього до цих культур додали рекомбінантний IL-2 людини (PeproTec Inc.), внаслідок чого кінцева концентрація становила 20 МО/мл. На 7 та 14 день здійснювали дві щотижневі додаткові стимуляції тими самими імпульсно міченими пептидами автогенними DC із застосуванням такої ж самої процедури. Через 6 днів після останньої стимуляції антиген-специфічні реакції індукованих CTL визначили за допомогою аналізу 51 вивільнення Cr та імуноферментного спот-аналізу IFN-γ. Різні ракові клітини або імпульсно 3 мічені пептидом клітини Т2 (5 × 10 клітин/комірку), що використовувалися як клітини-мішені, культивували разом з CTL з відповідним співвідношенням ефектор/мішень, щоб здійснити 51 аналіз вивільнення Cr згідно з відомим способом (Komori H, et al., Clin Cancer Res 2006; 12: 2689-2697). Намагалися здійснити індукцію CDH3-специфічних CTL з РВМС HLA-A2-позитивних здорових донорів та різних ракових пацієнтів шляхом стимуляції пептидами CDH3-4655-663 та CDH3-7757-765. Т-клітини CD8, відібрані з РВМС, інкубували з похідними від аутогенних мононуклеарів (моноцитів) DC, імпульсно мічених кожним пептидом. Після трьох стимуляцій визначили руйнуючий клітини ефект проти імпульсно мічених пептидом клітин Т2 за допомогою 51 аналізу вивільнення Cr (Фігура 4A) та імуноферментного спот-аналізу IFN-γ. CTL, індуковані РВМС здорових донорів, демонстрували руйнуючий клітини ефект проти клітин Т2, імпульсно мічених пептидом CDH3-4655-663 або пептидом CDH3-7757-765, проте не проти клітин Т2 без імпульсного мічення пептидом. Подібні реакції спостерігали стосовно інших донорів. Ці результати вказують на те, що CTL мають пептид-специфічну цитотоксичність. Далі, тестували цитотоксичну активність цих CTL проти ракових клітинних ліній людини, які експресують CDH3 та HLA-A2. Як показано на Фіг. 4В, CDH3-реактивні CTL, стимульовані пептидом CDH3-4655-663 демонстрували у здорових донорів цитотоксичність до HCT116 (CDH3+, HLA-A2+), HSC3 (CDH3+, HLA-A2+) та PANC1/CDH3 (CDH3+, HLA-A2+), у яких ген CDH3 трансфектувався у клітини PANC1; проте вони не демонстрували такий самий ефект стосовно PANC1 (CDH3–, HLA-A2+), SKHep1 (CDH3–, HLA-A2+) та PK8 (CDH3+, HLA-A2–). Подібно до цього, CTL, стимульовані пептидом CDH3-7757-765, демонстрували цитотоксичність стосовно HSC3, але не стосовно PANC1, PK8 та SKHep1. Цю цитотоксичну активність спостерігали для CTL, що походять від пацієнтів з різними видами раку (Фігура 4С). Для того, щоб підтвердити, чи можуть ці пептиди вироблятися з білка CDH3у природних умовах, PANC1/CDH3 та SKHep1/CDH3 (CDH3+, HLA-A2+), у яких ген CDH3 трансфектувався у клітини SKHep1, використовували як клітини-мішені. Як показано на Фіг. 4С, CTL, індуковані шляхом стимуляції пептидом CDH3-4655-663 або CDH3-7757-765, демонстрували цитотоксичність проти HCT116, PANC1/CDH3 та SKHep1/CDH3, проте не проти PANC1, SKHep1 та PK8. Вищезазначені результати дозволяють припустити, що ці пептиди виробляються та презентуються на поверхні ракових клітин молекулами HLA-A2 у природних умовах. CDH3реактивні CTL мали цитотоксичність, специфічну щодо ракових клітин, що експресують молекули як CDH3, так і HLA-A2. Підтвердження рестрикції HLA класу І Щоб підтвердити, чи можуть індуковані CTL розпізнавати клітини-мішені у спосіб, зумовлений обмеженням HLA класу І, ракові клітини-мішені інкубували з 10 мкг/мл анти-HLAклас I mAb (W6/32) або 10 мкг/мл анти-HLA-DR mAb (H-DR-1) протягом 1 години перед початком 51 спільного інкубування CTL та ракової клітинної лінії для виконання аналізу вивільнення Cr або імуноферментного спот-аналізу, та вплив mAb на цитотоксичну активність CTL або виробництво IFN-γ досліджували за відомим способом (Gomi S, et al., J Immunol 1999; 163: 4994-5004). Внаслідок цього антитіло анти-HLA-клас І могло інгібувати виробництво IFN-γ зі статистичною значущістю в імуноферментному спот-аналізі для CTL, генерованих шляхом стимуляції пептидом CDH3-4655-663 проти SKHep1/CDH3 (Фігура 4D, ліворуч, P < 0,01). Воно також могло 51 інгібувати цитотоксичну активність проти НСТ116 в аналізі вивільнення Cr (Фігура 4D, посередині). Подібно до цього, антитіло анти-клас І могло інгібувати виробництво IFN-γ зі статистичною значущістю в імуноферментному спот-аналізі для CTL, генерованих шляхом стимуляції пептидом CDH3-7757-765, проти клітин HSC3 (Фігура 4 D, праворуч P < 0,01). Ці результати вказують на те, що індуковані CTL розпізнають CDH3-експресуючі клітини-мішені у 19 UA 100127 C2 5 10 15 20 25 30 35 40 45 50 55 60 спосіб, зумовлений обмеженням HLA-класу І. Приклад 5 Адоптивна імунотерапія In vivo протиракова активність індукованих CDH3 CTL людини, що застосовуються для адоптивної імунізації мишей NOD/SCID Для того, щоб оцінити терапевтичний ефект введення CDH3-реактивних CTL мишам, яким трансплантували CDH3-позитивні ракові клітини людини, здійснювали експериментальну адоптивну імунотерапію так, як описано раніше (Komori H, et al. Clin Cancer Res 2006; 12: 26896 2697). Стисло кажучи, клітини НСТ116 (4 × 10 клітин), позитивні як для HLA-A2, так і для ендогенного CDH3, інокулювали мишам NOD/SCID шляхом підшкірної ін'єкції у правий бік. Коли 2 розмір пухлини становив 25 мм на 7 день після інокуляції пухлин, мишам шляхом 6 внутрішньовенної ін'єкції ввели лінію CTL (4 × 10 ), специфічну до пептиду CDH3-4655-663 або + пептиду CDH3-7757-765, або, як негативну контрольну, Т-клітинну лінію CD8 , стимульовану HLAA2-обмеженим пептидом HIV (SLYNTYATL, SEQ ID NO: 19), що походить від 5 здорових донорів, та суспендовану у 100 мкл РВС (сольового розчину з фосфатним буфером). Т-клітини ввели шляхом внутрішньовенної ін'єкції знов на 14 день. Розміри пухлин вимірювали двічі на тиждень та оцінювали шляхом вимірювання двох діаметрів, перпендикулярних один одному, застосовуючи штангенциркулі. Перевірку за двостороннім критерієм Ст'юдента застосовували для оцінки статистичної значущості розмірів пухлин. Значення P < 0,05 вважали значущим. Статистичний аналіз здійснювали, застосовуючи комерційно доступний пакет статистичного програмного забезпечення (SPSS for Windows (TM), version 11.0). Контрольні T-клітини CD8+, стимульовані пептидом HIV, не демонстрували цитотоксичності проти клітин НСТ116 in vitro. Оцінювали розміри пухлин 7 окремих мишей у кожній групі (Фігура 5А) та середнє значення ± стандартне відхилення розмірів пухлин у кожній групі (Фігура 5В). Контрольна Т-клітинна лінія та тільки PBS не демонстрували інгібіторного впливу на зростання пухлин. Розмір пухлин у мишей, інокульованих CDH3-стимульованими CTL, був суттєво меншим порівняно з розміром пухлин у мишей, інокульованих контрольними T-клітинами CD8+, індукованими пептидом HIV, або тільки PBS (P < 0,001). Ці результати вказують на ефективність адоптивної терапії переносу CDH3-реактивних CTL людини проти пухлини людини CDH3+ у мишей NOD/SCID. Обговорення У цьому дослідженні винахідники цього винаходу ідентифікував кадгерин 3 (Cadherin 3) (CDH3)/Р-кадгерин як новітній ТАА за допомогою аналізу із застосуванням біочипа до кДНК раку підшлункової залози. Згідно з аналізом з використанням кДНК-біочипа, CDH3 сильно експресувався у клітинах раку підшлункової залози та слабо експресувався у яєчнику та молочній залозі. Експресія CDH3 була ледь помітною в інших життєво важливих органах. Крім того, дані біочипа та полімеразно-ланцюгової реакції з ревертазою (RT-PCR) продемонстрували, що CDH3 експресувався у ракових пухлинах при раку шлунку та колоректальному раку, а також при раку підшлункової залози, проте ледь експресувався у тканинах відповідних здорових органів. Вже повідомлялося, що CDH3 надмірно експресувався у більшій частині тканини раку підшлункової залози, у той час коли здорові протокові та ацинарні клітини у підшлунковій залозі майже не демонстрували експресію CDH3, що визначили шляхом імуногістохімічного забарвлення (Taniuchi K, et al. Cancer Res 2005; 65: 3092-3099). Ці результати дозволяють припустити, що CDH3 може бути новітньою мішенню імунотерапії для вищезазначених видів раку, при цьому ця мішень має низький ризик індукувати автоімунну реакцію. Родину кадгеринів розподіляють на різні підродини, включаючи кадгерин 1 (CDH1)/Екадгерин, кадгерин 2 (CDH2)/N-кадгерин та кадгерин 3 (CDH3)/Р-кадгерин, згідно з їх розподіленням у тканинах. CDH1 - це превалюючий член родини кадгерину, який експресується в усіх епітеліальних тканинах. Передбачають, що CDH1 діє як фактор супресії пухлини, який негативно регулює інвазію та метастаз ракових клітин (Frixen U H, et al. J Cell Biol 1991; 113: 173-185, Berx G, et al. Genomics 1995; 26: 281-289, Oka H, et al. Cancer Res 1993; 53: 1696-1701). Експресія CDH2 підвищується у інвазивних видах раку, та CDH2 вносить внесок у явище інвазії внаслідок взаємодії з рецептором фактору росту фібробласту (FGF) та через передачу сигналу далі (Suyama K, et al. Cancer Cell 2002; 2: 301-314). Експресія та роль CDH3 у раку є погано зрозумілою. У попередньому дослідженні Taniuchi et al. припустили, що підвищена експресія CDH3 ймовірно є фактором, що підсилює інвазивність раку підшлункової залози шляхом взаємодії з p120ctn та Rho-родиною GTPази, Rac1 та Cdc42 (Taniuchi K, et al. Cancer Res 2005; 65: 3092-3099). В інших попередніх дослідженнях припускається, що CDH3 є також фактором підвищеної інвазивності та поганого прогнозу для раку грудей (Palacios J, et al. Am J Pathol 1995; 20 UA 100127 C2 5 10 15 20 25 30 35 40 45 146: 605-612, Paredes J, et al. Clin Cancer Res 2005; 11: 5869-5877, Peralta Soler A, et al. Cancer 1999; 86: 1263-1272) та раку матки (Stefansson I M, et al. J Clin Oncol 2004; 22: 1242-1252). Якщо попередні дослідженні розглянути разом, об'єктивний показник реакції протиракових вакцин у клінічних випробуваннях було низьким - 2,6 % (Rosenberg S A, et al. Nat Med 2004; 10: 909-915). Одна можливість - це те, що ракові клітини уникають імунітету внаслідок делеції, мутації або даун-регулювання ТАА, що є наслідком терапії, яка індукує імунітет. Спираючись на точку зору про те, що пухлинні клітини не можуть втрачати антигени, які є необхідними для онкогенезу, можна припустити, що CDH3 буде корисним кандидатом ТАА для протиракової імунотерапії. У цьому винаході автори цього винаходу ідентифікували серед 18 пептидів-кандидатів, вибраних за алгоритмом BIMAS, 2 епітопні пептиди CDH3, обмежені HLA-A2, стосовно яких підтвердили, що вони індукують HLA-A2-обмежені CTL миші у HLA-A2.1-трансгенних мишей (HHD). Крім того, автори цього винаходу, застосовуючи ці пептиди, підтвердили, що CDH3реактивні CTL генерувалися РВМС, що походять від здорових донорів та ракових пацієнтів (Фігура 4). Ці CTL демонстрували руйнувальний ефект не тільки стосовно клітин Т2, імпульсно мічених відповідним пептидом, а також стосовно ракових клітинних ліній, що експресують CDH3 та HLA-A2. Спираючись на вищезазначене, припустили, що ці пептиди CDH3 (CDH3-4655-663 та CDH3-7757-765) природним чином виробляються внаслідок метаболізму з білка CDH3 у ракових клітинах, презентуються на клітинній поверхні разом з молекулами HLA-A2, а потім розпізнаються CTL. Цитотоксичність CDH3-реактивних CTL цього винаходу підтвердили не тільки in vitro шляхом 51 аналізу вивільнення Cr, але також in vivo шляхом CTL-адоптивної імунотерапії. Як показано на Фігурі 5, внаслідок внутрішньовенної ін'єкції клітин CD8+, індукованих пептидами цього винаходу, суттєво інгібувалося зростання пухлин, прищеплених мишам NOD/SCID, у порівнянні з контрольними клітинами CD8+ та їм подібними. HLA-A2 (A*0201) - це одна з найпоширеніших HLA-алелей у різних етнічних групах, включаючи азіатів, африканців, афроамериканців та європеоїдну расу (Browning M. et al. Immunol Today 1996; 17: 165-170). Отже, пептиди, ідентифіковані у цьому винаході, які презентуються Т-клітинам-кілерам через HLA-A2, мають потенціал клінічного застосування в усьому світі, якщо їх безпечність та ефективність при протираковій імунотерапії буде продемонстрована у дослідницькій медицині. Крім того, ідентифікація пептидів, що презентуються Т-клітинам-кілерам за допомогою HLA-A2, носіями яких часто є не тільки представники японської нації, але також й люди в усьому світі, ймовірно зумовить розробку фармацевтичних препаратів для протиракової імунотерапії, які можна застосовувати до приблизно 30 % пацієнтів з раком підшлункової залози в усьому світі. Промислова придатність HLA-A2 - це алель HLA класу І, носіями якої є приблизно 30 % населення Японії. Коли трансгенних мишей, що експресують HLA-A2 людини, імунізують пептидами CDH3 цього винаходу, ці пептиди можуть індукувати цитотоксичні Т-клітини, що розпізнають пептиди, зв'язані з молекулами HLA-A2, внаслідок чого індукуються імунні реакції. Надзвичайно ймовірно, що, також у людей, ці пептиди можуть індукувати цитотоксичні Т-клітини людини, які руйнують ракові клітини, що експресують комплекси з цих пептидів та молекул HLA-A2. Отже, пептиди цього винаходу можна застосовувати для імунотерапії раку підшлункової залози, холангіокарциноми, раку шлунку, раку товстої кишки та недрібноклітинного раку легенів у HLAA2-позитивних пацієнтів. Отже, очікується, що пептиди будуть покращувати показник якості життя (QOL) пацієнтів внаслідок пригнічування проліферації та/або розвитку таких видів раку. 21 UA 100127 C2 22 UA 100127 C2 23 UA 100127 C2 24 UA 100127 C2 25 UA 100127 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 1. Пептид за наступним (А) або (В): (A) пептид, що складається з амінокислотної послідовності SEQ ID NO: 1 або 2, (B) пептид, що складається з амінокислотної послідовності SEQ ID NO: 1 або 2, де одна або дві амінокислоти заміщені та де пептид має активність індукувати цитотоксичну Т-клітину (кілера). 2. Пептид за п. 1, де друга амінокислота від N-закінчення - це лейцин або метіонін. 3. Пептид за п. 1 або 2, де С-кінцева амінокислота - це валін або лейцин. 4. Засіб для індукування імунітету проти раку, який включає один або більше пептидів за будьяким з пп. 1-3 як активний інгредієнт. 5. Засіб для лікування та/або профілактики раку, який включає один або більше пептидів за будь-яким з пп. 1-3 як активний інгредієнт. 6. Засіб для індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину (кілера), який включає один або більше пептидів за будь-яким з пп. 1-3 як активний інгредієнт. 7. Засіб для індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину (кілера), який включає один або більше полінуклеотидів, що кодують пептид за будь-яким з пп. 1-3, як активний інгредієнт. 8. Засіб для індукування цитотоксичної Т-клітини (кілера), який включає один або більше пептидів за будь-яким з пп. 1-3, як активний інгредієнт. 9. Антитіло проти пептиду за будь-яким з пп. 1-3. 10. Т-клітина-хелпер, цитотоксична Т-клітина (кілер) або група імуноцитів, що включає ці клітини, що індукується внаслідок застосування пептиду за будь-яким з пп. 1-3. 11. Антигенпрезентуюча клітина, яка презентує комплекс, який включає пептид за будь-яким з пп. 1-3 та HLA-антиген. 12. Антигенпрезентуюча клітина за п. 11, що індукується засобом за п. 6 або п. 7. 13. Екзосома, що презентує комплекс, який включає пептид за будь-яким з пп. 1-3 та HLAантиген. * 14. Екзосома за п. 13, де HLA-антиген - це HLA-A2 (HLA-A 0201). 15. Спосіб індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину (кілера), який включає етап контактування антигенпрезентуючої клітини з пептидом за будь-яким з пп. 1-3. 26 UA 100127 C2 5 10 15 16. Спосіб індукування антигенпрезентуючої клітини, яка має активність індукувати цитотоксичну Т-клітину (кілера), який включає етап трансфекції полінуклеотиду, що кодує пептид за будь-яким з пп. 1-3, в антигенпрезентуючу клітину. 17. Спосіб індукування цитотоксичної Т-клітини (кілера), який включає етап контактування Тклітини з пептидом за будь-яким з пп. 1-3. 18. Спосіб індукування імунітету проти раку, який включає етап введення пептиду за будь-яким з пп. 1-3 суб'єктові. 19. Спосіб лікування та/або профілактики раку, який включає етап введення пептиду за будьяким з пп. 1-3 суб'єктові. 20. Застосування пептиду за будь-яким з пп. 1-3 для виробництва засобу для індукування імунітету проти раку. 21. Застосування пептиду за будь-яким з пп. 1-3 для виробництва лікарського засобу для лікування та/або профілактики раку. 22. Спосіб індукування цитотоксичної Т-клітини (кілера), який включає етап спільного культивування антигенпрезентуючої клітини, яку піддали контактуванню з пептидом за будь+ яким з пп. 1-3, з Т клітинами CD8 . 27 UA 100127 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPeptide cdh3 and drug containing it
Автори англійськоюNishimura, Yasuharu, Imai, Katsunori, Tsunoda, Takuya, Nakamura, Yusuke
Назва патенту російськоюПептид cdh3 и лекарственное средство, содержащее его
Автори російськоюНишимура Ясухару, Имаи Кацунори, Цунода Такуя, Накамура Юсуке
МПК / Мітки
МПК: A61P 35/04, C12N 5/10, C07K 14/705, C12N 15/09, C07K 16/30, A61P 37/04, C07K 7/06, A61K 38/16, A61P 43/00
Мітки: містить, пептид, засіб, лікарський
Код посилання
<a href="https://ua.patents.su/33-100127-peptid-cdh3-ta-likarskijj-zasib-shho-mistit-jjogo.html" target="_blank" rel="follow" title="База патентів України">Пептид cdh3 та лікарський засіб, що містить його</a>
Попередній патент: 1′,3′-дизаміщені 4-феніл-3,4,5,6-тетрагідро-2н,1’н-[1,4′]біпіридиніл-2′-они
Наступний патент: Спосіб одержання гарячого брикетованого частково відновленого заліза і спосіб одержання розплавленого переробного чавуну
Випадковий патент: Спосіб одержання наночастинок срібла у рідкокристалічній каприлатній матриці