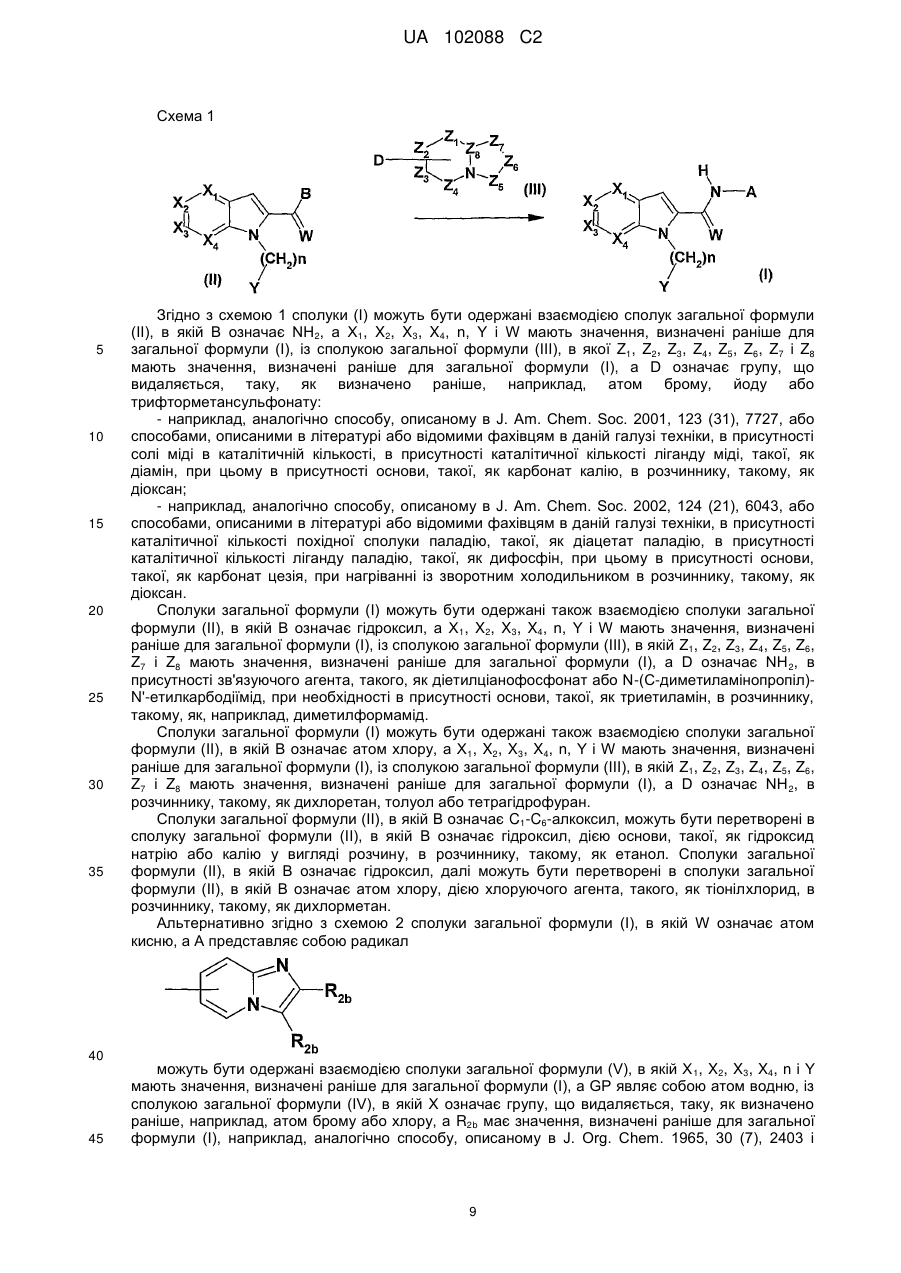
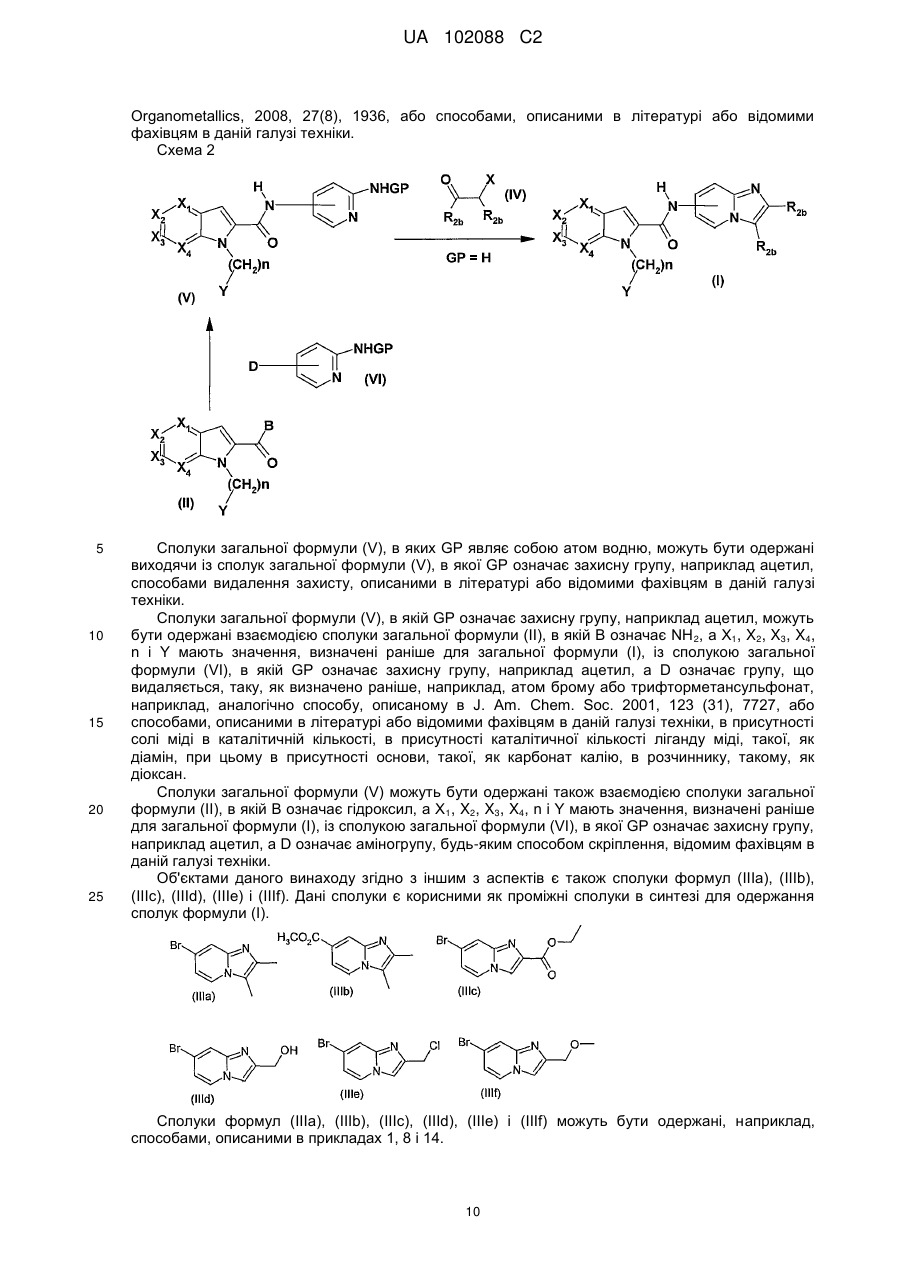
Похідні n-азабіциклічних карбоксамідів, їх одержання і застосування в терапії
Номер патенту: 102088
Опубліковано: 10.06.2013
Автори: Дюбуа Лоран, Леклерк Оділь, Еванно Яннік, Маланда Андре
Формула / Реферат
1. Сполука, відповідна загальній формулі (І):
 , (І)
, (І)
де:
Х1, Х2, Х3 і Х4 незалежно один від одного являють собою атоми азоту або C-R1;
при умові, що, коли один з членів Х1, Х2, Х3 і Х4 являє собою атом азоту, інші члени означають групи C-R1;
W являє собою атом кисню або сірки;
n дорівнює 0, 1, 2 або 3;
Y означає арил або гетероарил, що містить при необхідності один або декілька замісників, вибраних з таких замісників, як атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, гідрокси-, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С6-алкілен-О-, С1-С6-фторалкокси-, ціаногрупа, C(O)NR3R4, нітрогрупа, NR3R4, С1-С6-тіоалкіл, меркаптогрупа, -S(О)-С1-С6-алкіл, -S(О)2-С1-С6-алкіл, SO2NR3R4, NR5C(O)R6, NR5SO2R7, C(O)NR3R4, OC(O)NR3R4, -Sі-(С1-С6-алкіл)3, -SF5, арил-С1-С5-алкілен або арил, гетероарил-С1-С5-алкілен або гетероарил; причому групи С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С6-алкілен-О- можуть містити як замісники гідрокси-, С1-С6-алкоксигрупу або NR3R4; причому арил і гетероарил при необхідності містять один або декілька однакових або різних замісників R8;
А являє собою біциклічний гетероарил формули:
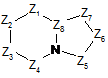 ,
,
де:
Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю, атоми азоту або C-R2a;
Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або С-R2b;
Z8 означає атом вуглецю;
причому не більше трьох членів з Z1, Z2, Z3, Z4, Z5, Z6 і Z7 являють собою атоми азоту;
причому один з членів Z1, Z2, Z3, Z4 являє собою атом вуглецю, зв'язаний з атомом азоту аміду або тіоаміду формули (І);
R1 вибраний з таких груп, як атом водню, атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, арилоксі-С1-С6-алкіл, гетероарилоксі-С1-С6-алкіл, арил-С1-С3-алкіленоксі-С1-С6-алкіл, гетероарил-С1-С3-алкіленоксі-С1-С6-алкіл, арилтіо-С1-С6-алкіл, гетероарилтіо-С1-С6-алкіл, арил-С1-С3-алкілентіо-С1-С6-алкіл, гетероарил-С1-С3-алкілентіо-С1-С6-алкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3-алкіленокси-, С1-С6-фторалкокси-, ціаногрупа, C(O)NR3R4, нітрогрупа, NR3R4, С1-С6-тіоалкіл, С3-С7-циклоалкілтіо-, С3-С7-циклоалкіл-С1-С3-алкілентіогрупа, -S(O)С1-С6-алкіл, -S(О)-С3-С7-циклоалкіл, -S(О)-С1-С3-алкілен-С3-С7-циклоалкіл, С1-С6-алкіл-S(О)2-, С1-С6-фторалкіл-S(О)2-, С3-С7-циклоалкіл-S(О)2-, С3-С7-циклоалкіл-С1-С3-алкілен-S(О)2-, SO2NR3R4, (С1-С6-алкіл)3-Sі-, -SF5, NR5C(O)R6, NR5SO2R7, C(O)NR3R4, OC(O)NR3R4, арил, гетероарил, арил-С1-С5-алкілен, гетероарил-С1-С5-алкілен, арилокси-, арилтіо-, гетероарилокси- або гетероарилтіогрупа; причому гетероарил або арил при необхідності містять один або декілька однакових або різних замісників R8;
R2a являє собою атом водню, атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С4-С7-циклоалкіл-С1-С3-алкілен-О-, гідрокси-, меркапто-, С1-С6-фторалкоксигрупу;
R2b являє собою атом водню,атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, гідрокси-, меркапто-, оксо-, тіо-, С3-С7-циклоалкілокси-, С1-С6-фторалкокси-, С3-С7-циклоалкіл-С1-С3-алкіленоксигрупу, С1-С6-алкоксі-С1-С3-алкілен, С3-С7-циклоалкілоксі-С1-С3-алкілен, С3-С7-циклоалкіл-С1-С3-алкіленоксі-С1-С3-алкілен, С1-С6-алкіл-С(О)-О-С1-С3-алкілен, С1-С6-алкіл-С(О)-О-, С3-С7-циклоалкіл-С(О)-О-С1-С3-алкілен, С3-С7-циклоалкіл-С(О)-О-, С1-С6-фторалкіл-С(О)-О-С1-С3-алкілен, С1-С6-фторалкіл-С(О)-О-, C(O)NR3R4, С(О)-О-С1-С6-алкіл, ціаногрупу, СНО, СО2Н, -С(О)-С1-С6-алкіл, -С(О)-С3-С7-циклоалкіл, феніл або тієніл; причому групи С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С1-С6-фторалкокси-, С3-С7-циклоалкіл-С1-С3-алкіленокси-, С1-С6-алкоксі-С1-С3-алкілен, С3-С7-циклоалкілоксі-С1-С3-алкілен, С3-С7-циклоалкіл-С1-С3-алкіленоксі-С1-С3-алкілен можуть містити як замісники гідрокси-, С1-С6-алкоксигрупу або NR3R4;
R3 і R4 незалежно один від одного являють собою атом водню або С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С5-алкілен або арил, або R3 і R4 спільно з атомом азоту, з яким вони зв'язані, утворюють азетидин, піролідин, піперидин, азепін, морфолін, тіоморфолін, піперазин, гомопіперазин; причому NR3R4 містить при необхідності як замісник С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С6-алкілен, арил, гетероарил, арил-S(О)2-, С1-С6-алкіл-S(О)2-, С1-С6-фторалкіл-S(О)2-, С3-С7-циклоалкіл-S(О)2-, С3-С7-циклоалкіл-С1-С3-алкілен-S(О)2-, арил-С(О)-, С1-С6-алкіл-С(О)-, С3-С7-циклоалкіл-С(О)-, С3-С7-циклоалкіл-С1-С3-алкілен-С(О)-, С1-С6-фторалкіл-С(О)-, гідрокси-, С1-С6-алкілокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3-алкіленоксигрупу, С1-С6-фторалкіл, арилоксі-С1-С6-алкілен, арилоксигрупу, гетероарилоксі-С1-С6-алкілен, гетероарилоксигрупу;
R5 і R6 незалежно один від одного являють собою атом водню, С1-С6-алкіл, -С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С6-алкілен або арил; причому арил при необхідності має один або декілька замісників, вибраних з атома галогену, С1-С6-алкілу, С3-С7-циклоалкілу, С3-С7-циклоалкіл-С1-С3-алкілену, С1-С6-фторалкілу, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3-алкіленокси-, С1-С6-фторалкокси-, нітро- або ціаногрупи;
або R5 і R6 спільно утворюють лактам, що складається з 4-7 членів і містить атом азоту і групу С(О), з якими вони зв'язані;
R7 являє собою С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С6-алкілен або арил; причому арил при необхідності має один або декілька замісників, вибраних з атома галогену, С1-С6-алкілу, С3-С7-циклоалкілу, С3-С7-циклоалкіл-С1-С3-алкілену, С1-С6-фторалкілу, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3-алкіленокси-, С1-С6-фторалкокси-, нітро- або ціаногрупи;
або R5 і R7 спільно утворюють сультам, що складається з 4-7 членів і містить атом азоту і групу S(O)2, з якими вони зв'язані;
R8 являє собою атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3-алкіленокси-, С1-С6-фторалкокси-, нітро-, ціаногрупу, NR3R4, -С(О)-С1-С6-алкіл, -С(О)-С3-С7-циклоалкіл; причому групи С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3-алкіленокси- можуть містити як замісники ОН, С1-С6-алкоксигрупу або NR3R4;
причому один або декілька атомів сірки сполуки загальної формули (І) можуть знаходитися в окисленій формі;
причому один або декілька атомів азоту сполуки загальної формули (І) можуть знаходитися в окисленій формі;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що Х1, Х2, Х3 і Х4, незалежно один від одного, являють собою C-R1; причому R1 має значення, визначені для загальної формули (І) за п. 1;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
3. Сполука формули (І) за п. 1, яка відрізняється тим, що Х1, Х2, Х3 являють собою C-R1, а Х4 означає атом азоту; причому R1 має значення, визначені для загальної формули (І) за п. 1;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
4. Сполука формули (І) за будь-яким з пп. 1-3, яка відрізняється тим, що R1 вибраний з атома водню, атомів галогенів або С1-С6-фторалкілу;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
5. Сполука формули (І) за будь-яким з пп. 1-4, яка відрізняється тим, що n дорівнює 1;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
6. Сполука формули (І) за будь-яким з пп. 1-5, яка відрізняється тим, що Y означає арил, що має при необхідності як замісники один або декілька атомів галогенів;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
7. Сполука формули (І) за будь-яким з пп. 1-6, яка відрізняється тим, що W являє собою атом кисню;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
8. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що А являє собою біциклічний гетероарил формули:
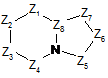 ,
,
де:
Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю і атоми азоту;
Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або С-R2b;
Z8 означає атом вуглецю;
причому не більше двох членів з Z1, Z2, Z3, Z4, Z5, Z6 i Z7 являють собою атоми азоту;
причому один з членів Z1, Z2, Z3 і Z4 являє собою атом вуглецю, зв'язаний з атомом азоту аміду або тіоаміду формули (І);
R2b означає атом водню, C1-С6-алкіл, С(О)-О-С1-С6-алкіл, феніл або тієніл; причому C1-С6-алкіл може містити як замісники гідрокси- або C1-С6-алкоксигрупи;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
9. Сполука формули (І) за будь-яким з пп. 1-8, яка відрізняється тим, що А являє собою радикали:
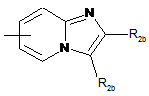 ,
, 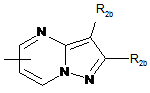 ,
,
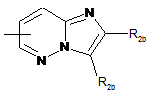 ,
, 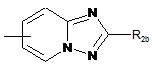 ,
,
R2b означає атом водню, С1-С6-алкіл, С(О)-О-С1-С6-алкіл, феніл або тієніл; причому С1-С6-алкіл може містити як замісники гідрокси- або С1-С6-алкоксигрупи;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
10. Сполука формули (І) за будь-яким з пп. 1-9, яка відрізняється тим, що
А являє собою радикали:
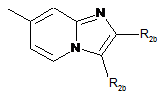 ,
,  ,
,
R2b означає атом водню, С1-С6-алкіл, феніл або тієніл; причому С1-С6-алкіли можуть містити як замісники гідрокси- або С1-С6-алкоксигрупи;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
11. Сполука формули (І) за будь-яким з пп. 1-8, яка відрізняється тим, що
Х1, Х2, Х3 і Х4 незалежно один від одного являють собою C-R1 або Х1, Х2, Х3 являють собою C-R1, а Х4 означає атом азоту;
R1 вибраний з атома водню, атомів галогенів або С1-С6-фторалкілу;
n дорівнює 1;
Y означає арил, що має при необхідності як замісники один або декілька атомів галогенів;
W являє собою атом кисню;
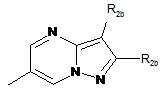
А являє собою біциклічний гетероарил формули:
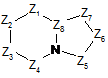 ,
,
де:
Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю і атоми азоту;
Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або С-R2b;
Z8 означає атом вуглецю;
причому не більше двох членів з Z1, Z2, Z3, Z4, Z5, Z6 і Z7 являють собою атоми азоту;
причому один з членів Z1, Z2, Z3 і Z4 являє собою атом вуглецю, зв'язаний з атомом азоту аміду або тіоаміду формули (І);
R2b означає атом водню, С1-С6-алкіл, С(O)-О-С1-С6-алкіл, феніл або тієніл; причому С1-С6-алкіл може містити як замісники гідрокси- або С1-С6-алкоксигрупи;
або її основа або кислотно-адитивна сіль, а також гідрат або сольват.
12. Сполука формули (І) за п. 1, вибрана з наступних сполук:
N-(2,3-диметилімідазо[1,2-а]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2,3-диметилімідазо[1,2-а]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-[2-(гідроксиметил)імідазо[1,2-а]піридин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(3-метил-2-фенілімідазо[1,2-а]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2-етилімідазо[1,2-а]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-[2-(тієн-2-іл)імідазо[1,2-а]піридин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2-трет-бутилімідазо[1,2-а]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2-метоксиметилімідазо[1,2-а]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-[2-(гідроксиметил)імідазо[1,2-а]піридин-7-іл]-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2-метил-3-фенілімідазо[1,2-а]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-[2-(тієн-2-іл)імідазо[1,2-а]піридин-7-іл]-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2-етилімідазо[1,2-а]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2-трет-бутилімідазо[1,2-а]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2,3-диметилімідазо[1,2-а]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2-етилімідазо[1,2-а]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2-карбоксамід;
N-(2,3-диметилімідазо[1,2-а]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2-карбоксамід;
N-[2-(гідроксиметил)імідазо[1,2-а]піридин-7-іл]-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-[2-(гідроксиметил)імідазо[1,2-а]піридин-7-іл]-5-трифторметил-1-[(3-фторфеніл)метил]-1Н-піроло[2,3-b]піридин-2-карбоксамід;
N-(2-метилімідазо[1,2-а]піридин-1-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2-метилпіразоло[1,5-а]піримідин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксамід;
N-[2-(етилоксикарбоніл)імідазо[1,2-b]піридазин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-[(2-(етилоксикарбоніл)імідазо[1,2-а]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-(2-метилімідазо[1,2-а]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід;
N-([1,2,4]триазоло[1,5-а]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Н-індол-2-карбоксамід.
13. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-12, який відрізняється тим, що вводять в реакцію сполуку загальної формули (II):
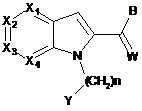 , (ІІ)
, (ІІ)
де Х1, Х2, Х3, Х4, n, Y і W мають значення, визначені раніше для загальної формули (І) за п. 1,
із сполукою загальної формули (III):
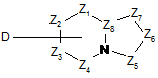 , (III)
, (III)
де Z1, Z2, Z3, Z4, Z5, Z6, Z7 і Z8 мають значення, визначені раніше для загальної формули (І) за п. 1:
- у випадку, коли В являє собою NH2-, a D являє собою групу, що видаляється, в присутності солі міді в каталітичній кількості, ліганду міді в каталітичній кількості і основи в розчиннику або в присутності каталітичної кількості похідного сполуки паладію, каталітичної кількості ліганду паладію і основи при нагріванні в розчиннику із зворотним холодильником;
- у випадку, коли В являє собою гідроксил, a D являє собою NH2, в присутності конденсуючого агента в розчиннику;
- у випадку, коли В являє собою атом хлору, a D являє собою NH2, в розчиннику.
14. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-12, в якій W означає атом кисню, а А являє собою
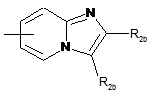 ,
,
який відрізняється тим, що вводять в реакцію сполуку загальної формули (V):
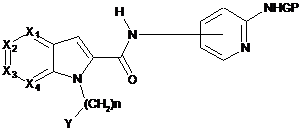 , (V)
, (V)
де Х1, Х2, Х3, Х4, n і Y мають значення, визначені раніше для загальної формули (І) за п. 1, a GP являє собою атом водню, із сполукою загальної формули (IV):
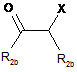 , (IV)
, (IV)
де X означає групу, що видаляється, a R2b має значення, визначені раніше для загальної формули (І) за п. 1.
15. Сполука вибрана з наступних сполук формули (IIIа), (IIIb), (IIIс), (IIId), (IIIе) або (IIIf):
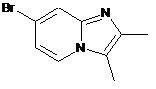 , (IIIа)
, (IIIа) 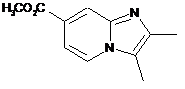 , (IIIb)
, (IIIb)
 , (IIIс)
, (IIIс) 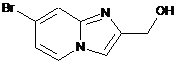 , (IIId)
, (IIId)
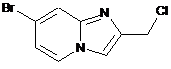 (IIIе) або
(IIIе) або 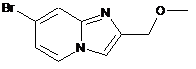 (IIIf).
(IIIf).
16. Лікарський засіб, який відрізняється тим, що він містить сполуку формули (І) за будь-яким з пп. 1-12 або адитивну сіль цієї сполуки з фармацевтично прийнятною кислотою, або також гідрати або сольват сполуки формули (І).
17. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку формули (І) за будь-яким з пп. 1-12 або фармацевтично прийнятну сіль, гідрати або сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт.
18. Застосування сполуки формули (І) за будь-яким з пп. 1-12 для одержання лікарського засобу, призначеного для профілактики і лікування патологій, в яких беруть участь рецептори типу TRPV1.
19. Застосування сполуки формули (І) за будь-яким з пп. 1-12 для одержання лікарського засобу, призначеного для профілактики або лікування болю, запалення, метаболічних порушень, урологічних порушень, гінекологічних порушень, шлунково-кишкових порушень, респіраторних порушень, псоріазу, свербежу, подразнень шкіри, очей або слизових оболонок, герпесу, оперізуючого лишаю, розсіяного склерозу, депресії і ракових захворювань.
Текст
Реферат: Винахід стосується сполуки загальної формули (І), в якій: Х 1, Х2, Х3 і Х4 незалежно один від одного являють собою атоми азоту або C-R1; W являє собою атом кисню або сірки; n дорівнює 0, 1, 2 або 3; Y означає арил або гетероарил, що при необхідності має замісники; А являє собою біциклічний гетероарил формули (II), де Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю, атоми азоту або C-R2a; Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або C-R2b; Z8 означає атом вуглецю; у вигляді основи або кислотноадитивної солі, а також у вигляді гідрату або сольвату. Спосіб одержання і застосування в терапії. UA 102088 C2 (12) UA 102088 C2 UA 102088 C2 5 10 15 20 25 30 35 40 45 У WO 2006/024776, WO 2006/072736, WO 2007/010144 і WO 2007/010138 описані похідні біциклічних карбоксамідів, що мають активність антагоністів або агоністів in vitro і in vivo до рецепторів типу TRPV1 (або VR1). Як і раніше зберігається потреба в нових лігандах до рецепторів типу TRPV1, що мають поліпшені властивості відносно функціональної активності, метаболічного профілю і/або профілю безпеки. Даний винахід відповідає цій потребі, надаючи похідні азабіциклічних карбоксамідів, що мають активність антагоністів або агоністів in vitro і in vivo до рецепторів типу TRPV1 (або VR1). Першим об'єктом даного винаходу є сполуки, відповідні наведеній далі загальній формулі (I). Іншим об'єктом даного винаходу є способи одержання сполук загальної формули (I). Іншим об'єктом даного винаходу є застосування сполук загальної формули (I) в лікарських засобах або в фармацевтичних композиціях. Сполуки за даним винаходом відповідають загальній формулі (I): , де: X1, X2, X3 і X4 незалежно один від одного являють собою атоми азоту або C-R1; при умові, що коли один з членів X1, X2, X3 і X4 являє собою атом азоту, інші члени означають групи C-R1; W являє собою атом кисню або сірки; n дорівнює 0, 1, 2 або 3; Y означає арил або гетероарил, що містить при необхідності один або декілька замісників, вибраних з таких замісників, як атом галогену, C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7-циклоалкілC1-C3-алкілен, C1-C6-фторалкіл, гідрокси-, C1-C6-алкокси-, C3-C7-циклоалкілокси-, C3-C7циклоалкіл-C1-C6-алкілен-O-, C1-C6-фторалкокси-, ціаногрупа, C(O)NR3R4, нітрогрупа, NR3R4, C1C6-тіоалкіл, меркаптогрупа, -S(О)-C1-C6-алкіл, -S(O)2-C1-C6-алкіл, SO2NR3R4, NR5C(О)R6, NR5SO2R7, C(O)NR3R4, °C(О)NR3R4, -Si-(C1-C6-алкіл)3, -SF5, арил-C1-C5-алкілен або арил, гетероарил-C1-C5-алкілен або гетероарил; причому групи C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7циклоалкіл-C1-C3-алкілен, C1-C6-фторалкіл, C1-C6-алкокси-, C3-C7-циклоалкілокси-, C3-C7циклоалкіл-C1-C6-алкілен-O- можуть містити як замісники гідрокси-, C1-C6-алкоксигрупу або NR3R4; причому арили і гетероарили при необхідності містять один або декілька однакових або різних замісників R8; А являє собою біциклічний гетероарил формули: де: Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю, атоми азоту або CR2a; Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або C-R2b; Z8 означає атом вуглецю; причому не більш трьох членів з Z1, Z2, Z3, Z4, Z5, Z6 і Z7 являють собою атоми азоту; причому один з членів Z1, Z2, Z3 і Z4 являє собою атом вуглецю, пов'язаний з атомом азоту аміду або тіоаміду формули (I); R1 вибраний з таких груп, як атом водню, атом галогену, C1-C6-алкіл, C3-C7-циклоалкіл, C3C7-циклоалкіл-C1-C3-алкілен, C1-C6-фторалкіл, арилоксі-C1-C6-алкіл, гетероарилоксі-C1-C6-алкіл, арил-C1-C3-алкіленоксі-C1-C6-алкіл, гетероарил-C1-C3-алкіленоксі-C1-C6-алкіл, арилтіо-C1-C6алкіл, гетероарилтіо-C1-C6-алкіл, арил-C1-C3-алкілентіо-C1-C6-алкіл, гетероарил-C1-C3алкілентіо-C1-C6-алкіл, C1-C6-алкокси-, C3-C7-циклоалкілокси-, C3-C7-циклоалкіл-C1-C3алкіленокси-, C1-C6-фторалкокси-, ціаногрупа, C(O)NR3R4, нітрогрупа, NR3R4, C1-C6-тіоалкіл, C3 1 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 C7-циклоалкілтіо-, C3-C7-циклоалкіл-C1-C3-алкілентіогрупа, -S(О)-C1-C6-алкіл, -S(О)-C3-C7циклоалкіл, -S(О)-C1-C3-алкілен-C3-C7-циклоалкіл, C1-C6-алкіл-S(O)2-, C1-C6-фторалкіл-S(O)2-, C3C7-циклоалкіл-S(O)2-, C3-C7-циклоалкіл-C1-C3-алкілен-S(O)2-, SO2NR3R4, (C1-C6-алкіл)3-Si-, -SF5, NR5C(О)R6, NR5SO2R7, C(O)NR3R4, °C(О)NR3R4, арил, гетероарил, арил-C1-C5-алкілен, гетероарил-C1-C5-алкілен, арилокси-, арилтіо-, гетероарилокси- або гетероарилтіогрупа; причому гетероарили або арили при необхідності містять один або декілька однакових або різних замісників R8; R2a являє собою атом водню, атом галогену, C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7циклоалкіл-C1-C3-алкілен, C1-C6-фторалкіл, C1-C6-алкокси-, C3-C7-циклоалкілокси-, C3-C7циклоалкіл-C1-C3-алкілен-O-, гідрокси-, меркапто-, С1-С6-фторалкоксигрупу; R2b являє собою атом водню, атом галогену, C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7циклоалкіл-C1-C3-алкілен, C1-C6-фторалкіл, C1-C6-алкокси-, гідрокси-, меркапто-, оксо-, тіо-, C3C7-циклоалкілокси-, C1-C6-фторалкокси-, C3-C7-циклоалкіл-C1-C3-алкіленоксигрупу, C1-C6алкоксі-C1-C3-алкілен, C3-C7-циклоалкілоксі-C1-C3-алкілен, C3-C7-циклоалкіл-C1-C3-алкіленокси(О)-O-C1-C3-алкілен, C1-C6-алкіл-C(О)-O-, C3-C7-циклоалкіл-C(О)-O-C1-C3-алкілен, C3-C7циклоалкіл-C(О)-O-, C1-C6-фторалкіл-C(О)-O-C1-C3-алкілен, C1-C6-фторалкіл-C(О)-O-, C(O)NR3R4, С(О)-O-C1-C6-алкіл, ціаногрупу, CHO, CO2H, -C(О)-C1-C6-алкіл, -C(О)-C3-C7циклоалкіл, феніл або тієніл; причому групи C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7-циклоалкіл-C1C3-алкілен, C1-C6-фторалкіл, C1-C6-алкокси-, C3-C7-циклоалкілокси-, C1-C6-фторалкокси-, C3-C7циклоалкіл-C1-C3-алкіленокси-, C1-C6-алкоксі-C1-C3-алкілен, C3-C7-циклоалкілоксі-C1-C3-алкілен, C3-C7-циклоалкіл-C1-C3-алкіленокси-; R3 і R4 незалежно один від одного являють собою атом водню або C1-C6-алкіл, C3-C7циклоалкіл, C3-C7-циклоалкіл-C1-C3-алкілен, арил-C1-C5-алкілен або арил, або R3 і R4 спільно з атомом азоту, з яким вони пов'язані, утворюють азетидин, піролідин, піперидин, азепін, морфолін, тіоморфолін, піперазин, гомопіперазин; причому NR3R4 містить при необхідності як замісник C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7-циклоалкіл-C1-C3-алкілен, арил-C1-C6-алкілен, арил, гетероарил, арил-S(O)2-, C1-C6-алкіл-S(O)2-, C1-C6-фторалкіл-S(O)2-, C3-C7-циклоалкілS(O)2-, C3-C7-циклоалкіл-C1-C3-алкілен-S(O)2-, арил-С(О)-, C1-C6-алкіл-C(О)-, C3-C7-циклоалкілC(О)-, C3-C7-циклоалкіл-C1-C3-алкілен-C(О)-, C1-C6-фторалкіл-C(О)-, гідрокси-, C1-C6-алкілокси-, C3-C7-циклоалкілокси-, C3-C7-циклоалкіл-C1-C3-алкіленоксигрупу, C1-C6-фторалкіл, арилоксі-C1C6-алкілен, арилоксигрупу, гетероарилоксі-C1-C6-алкілен, гетероарилоксигрупу; R5 і R6 незалежно один від одного являють собою атом водню, C1-C6-алкіл, C3-C7циклоалкіл, C3-C7-циклоалкіл-C1-C3-алкілен, арил-C1-C6-алкілен або арил; причому арил при необхідності має один або декілька замісників, вибраних з атома галогену, C1-C6-алкілу, C3-C7циклоалкілу, C3-C7-циклоалкіл-C1-C3-алкілену, C1-C6-фторалкілу, C1-C6-алкокси-, C3-C7циклоалкілокси-, C3-C7-циклоалкіл-C1-C3-алкіленокси-, C1-C6-фторалкокси-, нітроабо ціаногрупи; або R5 і R6 спільно утворюють лактам, що складається з 4-7 членів і містить атом азоту і групу С(О), з якими вони пов'язані; R7 являє собою C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7-циклоалкіл-C1-C3-алкілен, арил-C1-C6алкілен або арил; причому арил при необхідності має один або декілька замісників, вибраних з атома галогену, C1-C6-алкілу, C3-C7-циклоалкілу, C3-C7-циклоалкіл-C1-C3-алкілену, C1-C6фторалкілу, C1-C6-алкокси-, C3-C7-циклоалкілокси-, C3-C7-циклоалкіл-C1-C3-алкіленокси-, C1-C6фторалкокси-, нітро- або ціаногрупи; або R5 і R7 спільно утворюють сультам, що складається з 4-7 членів і містить атом азоту і групу S(O)2, з якими вони пов'язані; R8 являє собою атом галогену, C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7-циклоалкіл-C1-C3алкілен, C1-C6-фторалкіл, C1-C6-алкокси-, C3-C7-циклоалкілокси-, C3-C7-циклоалкіл-C1-C3алкіленокси-, C1-C6-фторалкокси-, нітро-, ціаногрупу, NR3R4, -C(О)-C1-C6-алкіл, -C(О)-C3-C7циклоалкіл; причому групи C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7-циклоалкіл-C1-C3-алкілен, C1-C6фторалкіл, C1-C6-алкокси-, C3-C7-циклоалкілокси-, C3-C7-циклоалкіл-C1-C3-алкіленокси- можуть містити як замісники OH, C1-C6-алкоксигрупу або NR3R4. У сполуках загальної формули (I): - один або декілька атомів сірки можуть знаходитися в окисленій формі (у вигляді S(О) або S(O)2); - один або декілька атомів азоту при необхідності можуть знаходитися в окисленій формі (у вигляді N-оксиду). Сполуки формули (I) можуть містити один або декілька асиметричних атомів вуглецю. Таким чином, вони можуть існувати в формі енантіомерів або діастереоізомерів. Такі енантіомери, 2 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 діастереоізомери, а також їх суміші, включаючи рацемічні суміші, становлять частину даного винаходу. Сполуки формули (I) можуть існувати в формі основ або кислотно-адитивних солей. Такі адитивні солі становлять частину даного винаходу. Ці солі можуть бути одержані з фармацевтично прийнятними кислотами, однак і солі інших кислот, наприклад, які можуть бути використані для очищення або виділення сполук формули (I), також становлять частину даного винаходу. Сполуки формули (I) можуть існувати також у вигляді гідратів або сольватів, а саме, у вигляді асоціатів або комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати і сольвати також становлять частину даного винаходу. У описі даного винаходу: - атом галогену означає фтор, хлор, бром або йод; - Ct-Cz означає вуглецевий ланцюжок, який може містити від t до z атомів вуглецю, причому t і z можуть приймати значення від 1 до 7; наприклад, С1-C3 являє собою вуглецевий ланцюжок, який може містити від 1 до 3 атомів вуглецю; - алкіл означає лінійну або розгалужену насичену аліфатичну групу. Як приклади можна згадати метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, пентил і т.д.; - алкілен означає лінійний або розгалужений насичений двовалентний радикала, наприклад, С1-3-алкілен являє собою лінійний або розгалужений двовалентний вуглецевий ланцюжок, що містить від 1 до 3 атомів вуглецю, зокрема, метилен, етилен, 1-метилетилен, пропілен; - циклоалкіл означає циклічний насичений або часткове ненасичений алкіл. Як приклади можна згадати циклопропіл, циклобутил, циклопентил, циклогексил і т.д.; - циклоалкілоксигрупа означає -O-циклоалкіл, в якому алкіл є таким, як визначено раніше; - фторалкіл означає алкіл, в якому один або декілька атомів водню заміщені атомами фтору; - алкоксигрупа означає -О-алкіл, в якому алкіл є таким, як визначено раніше; - фторалкоксигрупа означає алкілоксигрупу, в якій один або декілька атомів водню заміщені атомами фтору; - тіоалкіл або алкілтіогрупа означає -S-алкіл, в якому алкіл є таким, як визначено раніше; - арил означає ароматичний моно- або біцикл, що містить від 6 до 10 атомів вуглецю. Як приклади арилів можна згадати феніл або нафтил; - гетероарил означає ароматичний моно- або біцикл, що складається з 5-12 членів і що містить від 1 до 5 гетероатомів, вибраних з О, S або N. Як приклади моноциклічних гетероарилів можна згадати імідазоліл, піразоліл, тіазоліл, оксазоліл, ізотіазоліл, ізоксазоліл, фурил, тіофеніл, оксадіазоліл, тіадіазоліл, триазоліл, тетразоліл, піридил, піразиніл, піримідиніл, піридазиніл, триазиніл. Як приклади біциклічних гетероарилів можна згадати індоліл, ізоіндоліл, бензофурил, бензотіофеніл, бензоксазоліл, бензимідазоліл, індазоліл, бензотіазоліл, ізобензофурил, ізобензотіазоліл, піроло[2,3-c]піридил, піроло[2,3-b]піридил, піроло[3,2-b]піридил, піроло[3,2c]піридил, піроло[1,2-a]піридил, хіноліл, ізохіноліл, цинолініл, хіназолініл, хіноксалініл, піроло[1,2-a]імідазоліл, імідазо[1,2-a]піридил, імідазо[1,5-a]піридил, імідазо[1,2-b]піридазиніл, імідазо[1,2-c]піримідиніл, імідазо[1,2-a]піримідиніл, імідазо[1,5-a]піримідиніл, імідазо[1,5c]піримідиніл, імідазо[1,2-a]піразиніл, імідазо[1,5-a]піразиніл, імідазо[1,5-b]піридазиніл, імідазо[4,5-b]піразиніл, імідазо[4,5-b]піридил, імідазо[4,5-c]піридил, піразоло[1,5-a]піридил, піразоло[1,5-a]піримідиніл, піразоло[1,5-c]піримідиніл, піразоло[1,5-a]піразиніл, піразоло[1,5b]піридазиніл, індолізиніл, піроло[1,2-b]піридазиніл, піроло[1,2-c]піримідиніл, піроло[1,2a]піразиніл, піроло[1,2-a]піримідиніл, [1,2,4]триазоло[4,3-a]піридил, [1,2,4]триазоло[2,3-a]піридил, [1,2,4]триазоло[1,5-a]піридил, [1,2,3]триазоло[1,5-a]піридил, [1,2,4]триазоло[1,5-b]піридазиніл, триазоло[1,2-a]піримідиніл, триазоло[1,2-c]піримідиніл, триазоло[1,2-a]піразиніл, триазоло[1,2b]піридазиніл, [1,2,4]триазоло[1,5-b]піридазиніл, [1,2,4]триазоло[1,5-c]піримідиніл, [1,2,4]триазоло[1,2-a]піразиніл, [1,2,4]триазоло[1,5-a]піримідиніл, [1,2,3]триазоло[1,5b]піридазиніл, [1,2,3]триазоло[1,5-c]піримідиніл, [1,2,3]триазоло[1,2-a]піразиніл, [1,2,3]триазоло[1,5-a]піримідиніл, імідазо[1,2-d][1,2,4]триазиніл, імідазо[2,1-f][1,2,4]триазиніл, імідазо[1,2-b][1,2,4]триазиніл, імідазо[1,2-a][1,3,5]триазиніл, імідазо[2,1-c][1,2,4]триазиніл, імідазо[5,1-c][1,2,4]триазиніл, імідазо[1,5-a][1,3,5]триазиніл, імідазо[1,5-b][1,2,4]триазиніл, імідазо[5,1-f][1,2,4]триазиніл, імідазо[1,5-d][1,2,4]триазиніл, імідазо[1,5-c][1,2,3]триазиніл, піразоло[5,1-c][1,2,4]триазиніл, піразоло[1,5-a][1,3,5]триазиніл, піразоло[1,5-b][1,2,4]триазиніл, піразоло[5,1-f][1,2,4]триазиніл, піразоло[1,5-d][1,2,4]триазиніл, піразоло[1,5-c][1,2,3]триазиніл; - "оксо" означає "=О"; - "тіо" означає "=S". 3 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 Серед сполук загальної формули (I), що є об'єктами даного винаходу, першу підгрупу сполук складають сполуки, в яких: X1, X2, X3 і X4 незалежно один від одного являють собою C-R1; причому R1 має значення, визначені для загальної формули (I). Серед сполук загальної формули (I), що є об'єктами даного винаходу, другу підгрупу сполук складають сполуки, в яких: X1, X2, X3 і X4 незалежно один від одного являють собою атоми азоту або C-R1; при умові, що коли один з членів X1, X2, X3 і X4 являє собою атом азоту, інші члени означають групи C-R1; причому R1 має значення, визначені для загальної формули (I). Серед сполук загальної формули (I), що є об'єктами даного винаходу, третю підгрупу сполук складають сполуки, в яких: X1, X2, X3 являють собою C-R1; X4 означає атом азоту; причому R1 має значення, визначені для загальної формули (I). Серед сполук загальної формули (I), що є об'єктами даного винаходу, четверту підгрупу сполук складають сполуки, в яких R1 вибраний з атома водню, атома галогену, більш переважно з атома фтору або C1-C6-фторалкілу і найбільш переважно з трифторметилу. Серед сполук загальної формули (I), що є об'єктами даного винаходу, п'яту підгрупу сполук складають сполуки, в яких n дорівнює 1. Серед сполук загальної формули (I), що є об'єктами даного винаходу, в шостій підгрупі Y означає арил і більш переважно феніл, що має при необхідності як замісники один або декілька атомів галогенів і більш переважно атомів фтору. Серед сполук загальної формули (I), що є об'єктами даного винаходу, сьому підгрупу сполук складають сполуки, в яких W являє собою атом кисню. Серед сполук загальної формули (I), що є об'єктами даного винаходу, восьму підгрупу сполук складають сполуки, в яких: А являє собою біциклічний гетероарил формули: де: Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю і атоми азоту; Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або C-R2b; Z8 означає атом вуглецю; причому не більш двох членів з Z1, Z2, Z3, Z4, Z5, Z6 і Z7 являють собою атоми азоту; причому один з членів Z1, Z2, Z3 і Z4 являє собою атом вуглецю, пов'язаний з атомом азоту аміду або тіоаміду формули (I); причому R2b має значення, визначені для загальної формули (I). Серед сполук загальної формули (I), що є об'єктами даного винаходу, дев'яту підгрупу сполук складають сполуки, в яких: А являє собою біциклічний гетероарил формули: де: Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю і атоми азоту; Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або C-R2b; Z8 означає атом вуглецю; причому не більш двох членів з Z1, Z2, Z3, Z4, Z5, Z6 і Z7 являють собою атоми азоту; причому один з членів Z1, Z2, Z3 і Z4 являє собою атом вуглецю, пов'язаний з атомом азоту аміду або тіоаміду формули (I); R2b означає атом водню, C1-C6-алкіл, С(О)-O-C1-C6-алкіл, феніл або тієніл; причому C1-C6алкіли можуть містити як замісники гідрокси- або C1-C6-алкоксигрупи. Серед сполук загальної формули (I), що є об'єктами даного винаходу, десяту підгрупу сполук складають сполуки, в яких: А являє собою біциклічний гетероарил формули: 4 UA 102088 C2 5 10 де: Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю і атоми азоту; Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або C-R2b; Z8 означає атом вуглецю; причому не більш двох членів з Z1, Z2, Z3, Z4, Z5, Z6 і Z7 являють собою атоми азоту; причому один з членів Z1, Z2, Z3 і Z4 являє собою атом вуглецю, пов'язаний з атомом азоту аміду або тіоаміду формули (I); R2b означає атом водню, метил, етил, трет-бутил, С(О)-О-етил, феніл або тієніл; причому метильні групи можуть мати як замісники гідрокси- або метоксигрупи. Серед сполук загальної формули (I), що є об'єктами даного винаходу, одинадцяту підгрупу сполук складають сполуки, в яких: А представляє собою радикали: 15 причому R2b має значення, визначені для загальної формули (I). Серед сполук загальної формули (I), що є об'єктами даного винаходу, дванадцяту підгрупу сполук складають сполуки, в яких: А представляє собою радикали: 20 R2b означає атом водню, C1-C6-алкіл, С(О)-O-C1-C6-алкіл, феніл або тієніл; причому C1-C6алкіли можуть містити як замісники гідрокси- або C1-C6-алкоксигрупи. Серед сполук загальної формули (I), що є об'єктами даного винаходу, тринадцяту підгрупу сполук складають сполуки, в яких: А представляє собою радикали: 25 R2b означає атом водню, метил, етил, трет-бутил, С(О)-О-етил, феніл або тієніл; причому метильні групи можуть мати як замісники гідрокси- або метоксигрупи. Серед сполук загальної формули (I), що є об'єктами даного винаходу, чотирнадцяту підгрупу сполук складають сполуки, в яких: 5 UA 102088 C2 А представляє собою радикали: 5 10 15 20 25 30 35 причому R2b має значення, визначені для загальної формули (I). Серед сполук загальної формули (I), що є об'єктами даного винаходу, п'ятнадцяту підгрупу сполук складають сполуки, в яких: А представляє собою радикали: R2b означає атом водню, C1-C6-алкіл, феніл або тієніл; причому C1-C6-алкіли можуть містити як замісники гідрокси- або C1-C6-алкоксигрупи. Серед сполук загальної формули (I), що є об'єктами даного винаходу, шістнадцяту підгрупу сполук складають сполуки, в яких: А представляє собою радикали: R2b означає атом водню, метил, етил, трет-бутил, феніл або тієніл; причому метильні групи можуть мати як замісники гідрокси- або метоксигрупи. Серед сполук загальної формули (I), що є об'єктами даного винаходу, сімнадцяту підгрупу сполук складають сполуки, в яких значення X 1, X2, X3 і X4, n, Y, W і А являють собою комбінації наведених раніше значень. Серед сполук загальної формули (I), що є об'єктами даного винаходу, вісімнадцяту підгрупу сполук складають сполуки, в яких: X1, X2, X3 і X4 незалежно один від одного являють собою C-R1 або X1, X2, X3 являють собою C-R1, а X4 означає атом азоту; R1 вибраний з атома водню, атома галогену, більш переважно з атома фтору або C1-C6фторалкілу і найбільш переважно з трифторметилу; n дорівнює 1; Y означає арил і більш переважно феніл, що має при необхідності як замісники один або декілька атомів галогенів і більш переважно атомів фтору; W являє собою атом кисню; А являє собою біциклічний гетероарил формули: де: Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю і атоми азоту; Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або C-R2b; Z8 означає атом вуглецю; причому не більш двох членів з Z1, Z2, Z3, Z4, Z5, Z6 і Z7 являють собою атоми азоту; 6 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 60 причому один з членів Z1, Z2, Z3 і Z4 являє собою атом вуглецю, пов'язаний з атомом азоту аміду або тіоаміду формули (I); R2b означає атом водню, C1-C6-алкіл, С(О)-O-C1-C6-алкіл, феніл або тієніл; причому C1-C6алкіли можуть містити як замісники гідрокси- або C1-C6-алкоксигрупи. Серед сполук формули (I), що є об'єктами даного винаходу, можна, зокрема, згадати наступні сполуки: 1• N-(2,3-диметилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 2• N-(2,3-диметилімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 3• N-[2-(гідроксиметил)імідазо[1,2-a]піридин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 4• N-(3-метил-2-фенілімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 5• N-(2-етилімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил-1H -індол-2карбоксамід; 6• N-[2-(тієн-2-іл)імідазо[1,2-a]піридин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 7• N-(2-трет-бутилімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 8• N-(2-метоксиметилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 9• N-[2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 10• N-(2-метил-3-фенілімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 11• N-[2-(тієн-2-іл)імідазо[1,2-a]піридин-7-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 12• N-(2-етилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил-1H -індол-2карбоксамід; 13• N-(2-трет-бутилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 14• N-(2,3-диметилімідазо[1,2-a]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Hіндол-2-карбоксамід; 15• N-(2-етилімідазо[1,2-a]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-b]піридин-2-карбоксамід; 16• N-(2,3-диметилімідазо[1,2-a]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-b]піридин-2-карбоксамід; 17• N-[2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл]-5-трифторметил-1-[(3-фторфеніл)метил]1H-індол-2-карбоксамід; 18• N-[2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл]-5-трифторметил-1-[(3-фторфеніл)метил]1H-піроло[2,3-b]піридин-2-карбоксамід; 19• N-(2-метилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 20• N-(2-метилпіразоло[1,5-a]піримідин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 21• N-[2-(етилоксикарбоніл)імідазо[1,2-b]піридазин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1Hіндол-2-карбоксамід; 22• N-[(2-(етилоксикарбоніл)імідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1Hіндол-2-карбоксамід; 23• N-(2-метилімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід; 24• N-([1,2,4]триазоло[1,5-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід. Серед сполук загальної формули (I), що є об'єктами даного винаходу, окрему підгрупу сполук складають сполуки загальної формули (I'), в яких: R2b являє собою атом водню, атом галогену, C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7циклоалкіл-C1-C3-алкілен, C1-C6-фторалкіл, C1-C6-алкокси-, гідрокси-, меркапто-, оксо-, тіо-, C3C7-циклоалкілокси-, C1-C6-фторалкокси-, C3-C7-циклоалкіл-C1-C3-алкіленоксигрупу, C1-C6алкоксі-C1-C3-алкілен, C3-C7-циклоалкілоксі-C1-C3-алкілен, C3-C7-циклоалкіл-C1-C3-алкіленокси 7 UA 102088 C2 5 10 15 20 25 30 35 40 45 (О)-O-C1-C3-алкілен, C1-C6-алкіл-C(О)-O-, C3-C7-циклоалкіл-C(О)-O-C1-C3-алкілен, C3-C7циклоалкіл-C(О)-O-, C1-C6-фторалкіл-C(О)-O-C1-C3-алкілен, C1-C6-фторалкіл-C(О)-O-, C(O)NR3R4, С(О)-O-C1-C6-алкіл, ціаногрупу, CHO, CO2H, -C(О)-C1-C6-алкіл, -C(О)-C3-C7циклоалкіл; причому групи C1-C6-алкіл, C3-C7-циклоалкіл, C3-C7-циклоалкіл-C1-C3-алкілен, C1-C6фторалкіл, C1-C6-алкокси-, C3-C7-циклоалкілокси-, C1-C6-фторалкокси-, C3-C7-циклоалкіл-C1-C3алкіленокси-, C1-C6-алкоксі-C1-C3-алкілен, C3-C7-циклоалкілоксі-C1-C3-алкілен, C3-C7-циклоалкілC1-C3-алкіленокси-; причому R3 і R4 мають значення, визначені для загальної формули (I). Серед сполук загальної формули (I') що є об'єктами даного винаходу, першу підгрупу сполук складають сполуки, в яких X1, X2, X3 і X4 незалежно один від одного являють собою C-R1, а R1 вибраний з атома водню, атома галогену, більш переважно з атома фтору або C1-C6-фторалкілу і найбільш переважно з трифторметилу. Серед сполук загальної формули (I'), що є об'єктами даного винаходу, другу підгрупу сполук складають сполуки, в яких n дорівнює 1, а Y означає арил і більш переважно феніл, що має при необхідності як замісники один або декілька атомів галогенів і більш переважно атомів фтору. Серед сполук загальної формули (I), що є об'єктами даного винаходу, третю підгрупу сполук складають сполуки, в яких W являє собою атом кисню. Серед сполук загальної формули (I), що є об'єктами даного винаходу, четверту підгрупу сполук складають сполуки, в яких А представляє собою радикал , причому даний радикал при необхідності містить замісники, визначені раніше для загальної формули (I). Серед сполук загальної формули (I), що є об'єктами даного винаходу, п'яту підгрупу сполук складають сполуки, в яких: X1, X2, X3 і X4 незалежно один від одного являють собою C-R1, а R1 вибраний з атома водню, атома галогену, більш переважно з атома фтору або C1-C6-фторалкілу і найбільш переважно з трифторметилу; n дорівнює 1; Y означає арил і більш переважно феніл, що має при необхідності як замісники один або декілька атомів галогенів і більш переважно атомів фтору; W являє собою атом кисню; А представляє собою радикал , причому даний радикал при необхідності містить замісники, визначені раніше для загальної формули (I). Під групою, що видаляється в подальшому описі розуміють групу, яка може бути легко відщеплена від молекули внаслідок розриву гетеролітичного зв'язку з видаленням електронної пари. Така група також може бути легко заміщена іншою групою, наприклад, по реакції заміщення. Такими групами, що видаляються є, наприклад, галогени або активна гідроксигрупа, така, як метансульфонат, бензолсульфонат, п-толуолсульфонат, трифторметансульфонат, ацетат і т.д. Приклади груп, що видаляються, а також інформація по їх одержанню наведені в "Advances in Organic Chemistry", J. March, 5th Edition, Wiley Interscience, 2001. Під захисною групою в подальшому описі розуміють групу, яка може бути тимчасово включена в хімічну структуру з метою тимчасово інактивувати частину молекули на стадії проведення реакції і яка може бути легко видалена на подальшій стадії синтезу. Приклади захисних груп, а також інформація по їх властивостях наведені в T.W. Greene, P.G.M. Wutz, 3rd Edition, Wiley Interscience, 1999. За даним винаходом сполуку загальної формули (I) можна одержати способом, який пояснений наведеними далі загальними схемами 1 або 2. 8 UA 102088 C2 Схема 1 5 10 15 20 25 30 35 40 45 Згідно з схемою 1 сполуки (I) можуть бути одержані взаємодією сполук загальної формули (II), в якій В означає NH2, а X1, X2, X3, X4, n, Y і W мають значення, визначені раніше для загальної формули (I), із сполукою загальної формули (III), в якої Z1, Z2, Z3, Z4, Z5, Z6, Z7 і Z8 мають значення, визначені раніше для загальної формули (I), а D означає групу, що видаляється, таку, як визначено раніше, наприклад, атом брому, йоду або трифторметансульфонату: - наприклад, аналогічно способу, описаному в J. Am. Chem. Soc. 2001, 123 (31), 7727, або способами, описаними в літературі або відомими фахівцям в даній галузі техніки, в присутності солі міді в каталітичній кількості, в присутності каталітичної кількості ліганду міді, такої, як діамін, при цьому в присутності основи, такої, як карбонат калію, в розчиннику, такому, як діоксан; - наприклад, аналогічно способу, описаному в J. Am. Chem. Soc. 2002, 124 (21), 6043, або способами, описаними в літературі або відомими фахівцям в даній галузі техніки, в присутності каталітичної кількості похідної сполуки паладію, такої, як діацетат паладію, в присутності каталітичної кількості ліганду паладію, такої, як дифосфін, при цьому в присутності основи, такої, як карбонат цезія, при нагріванні із зворотним холодильником в розчиннику, такому, як діоксан. Сполуки загальної формули (I) можуть бути одержані також взаємодією сполуки загальної формули (II), в якій В означає гідроксил, а X 1, X2, X3, X4, n, Y і W мають значення, визначені раніше для загальної формули (I), із сполукою загальної формули (III), в якій Z1, Z2, Z3, Z4, Z5, Z6, Z7 і Z8 мають значення, визначені раніше для загальної формули (I), а D означає NH 2, в присутності зв'язуючого агента, такого, як діетилціанофосфонат або N-(С-диметиламінопропіл)N'-етилкарбодіїмід, при необхідності в присутності основи, такої, як триетиламін, в розчиннику, такому, як, наприклад, диметилформамід. Сполуки загальної формули (I) можуть бути одержані також взаємодією сполуки загальної формули (II), в якій В означає атом хлору, а X1, X2, X3, X4, n, Y і W мають значення, визначені раніше для загальної формули (I), із сполукою загальної формули (III), в якій Z1, Z2, Z3, Z4, Z5, Z6, Z7 і Z8 мають значення, визначені раніше для загальної формули (I), а D означає NH 2, в розчиннику, такому, як дихлоретан, толуол або тетрагідрофуран. Сполуки загальної формули (II), в якій В означає C1-C6-алкоксил, можуть бути перетворені в сполуку загальної формули (II), в якій В означає гідроксил, дією основи, такої, як гідроксид натрію або калію у вигляді розчину, в розчиннику, такому, як етанол. Сполуки загальної формули (II), в якій В означає гідроксил, далі можуть бути перетворені в сполуки загальної формули (II), в якій В означає атом хлору, дією хлоруючого агента, такого, як тіонілхлорид, в розчиннику, такому, як дихлорметан. Альтернативно згідно з схемою 2 сполуки загальної формули (I), в якій W означає атом кисню, а А представляє собою радикал можуть бути одержані взаємодією сполуки загальної формули (V), в якій X 1, X2, X3, X4, n і Y мають значення, визначені раніше для загальної формули (I), а GP являє собою атом водню, із сполукою загальної формули (IV), в якій X означає групу, що видаляється, таку, як визначено раніше, наприклад, атом брому або хлору, а R2b має значення, визначені раніше для загальної формули (I), наприклад, аналогічно способу, описаному в J. Org. Chem. 1965, 30 (7), 2403 і 9 UA 102088 C2 Organometallics, 2008, 27(8), 1936, або способами, описаними в літературі або відомими фахівцям в даній галузі техніки. Схема 2 5 10 15 20 25 Сполуки загальної формули (V), в яких GP являє собою атом водню, можуть бути одержані виходячи із сполук загальної формули (V), в якої GP означає захисну групу, наприклад ацетил, способами видалення захисту, описаними в літературі або відомими фахівцям в даній галузі техніки. Сполуки загальної формули (V), в якій GP означає захисну групу, наприклад ацетил, можуть бути одержані взаємодією сполуки загальної формули (II), в якій В означає NH 2, а X1, X2, X3, X4, n і Y мають значення, визначені раніше для загальної формули (I), із сполукою загальної формули (VI), в якій GP означає захисну групу, наприклад ацетил, а D означає групу, що видаляється, таку, як визначено раніше, наприклад, атом брому або трифторметансульфонат, наприклад, аналогічно способу, описаному в J. Am. Chem. Soc. 2001, 123 (31), 7727, або способами, описаними в літературі або відомими фахівцям в даній галузі техніки, в присутності солі міді в каталітичній кількості, в присутності каталітичної кількості ліганду міді, такої, як діамін, при цьому в присутності основи, такої, як карбонат калію, в розчиннику, такому, як діоксан. Сполуки загальної формули (V) можуть бути одержані також взаємодією сполуки загальної формули (II), в якій В означає гідроксил, а X 1, X2, X3, X4, n і Y мають значення, визначені раніше для загальної формули (I), із сполукою загальної формули (VI), в якої GP означає захисну групу, наприклад ацетил, а D означає аміногрупу, будь-яким способом скріплення, відомим фахівцям в даній галузі техніки. Об'єктами даного винаходу згідно з іншим з аспектів є також сполуки формул (IIIa), (IIIb), (IIIc), (IIId), (IIIe) і (IIIf). Дані сполуки є корисними як проміжні сполуки в синтезі для одержання сполук формули (I). Сполуки формул (IIIa), (IIIb), (IIIc), (IIId), (IIIe) і (IIIf) можуть бути одержані, наприклад, способами, описаними в прикладах 1, 8 і 14. 10 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 Показані на схемах 1 і 2 сполуки загальних формул (II), (III), (IV), (VI) і інші реагенти, опис способів одержання яких не наведений, є в торговій мережі, описані в літературі або можуть бути одержані аналогічно способам, описаним в літературі (наприклад, в US 6 737 435; US 6 673 797; WO 2006/101455; Synthesis, 1985, 2, 186; J.G. Lombardino. J. Org. Chem. 1965, 30 (7), 2403; T.M. Williams. J. Med. Chem. 1993, 36 (9), 1291; J. Med. Chem. 2008, 51 (19), 6044; JP 2001151771A2; WO 2006/024776; WO 2006/072736; WO 2007/010144; WO 2007/010138). Сполуки загальної формули (I), в яких один з членів X 1, X2, X3 або X4 являє собою атом вуглецю, що має як замісник алкіл, можуть бути одержані поєднанням, що каталізується металом, таким, як паладій або залізо, здійснюваним з відповідними сполуками загальної формули (I), що мають як замісник атома галогену, такий, як хлор, в присутності, наприклад, алкілмагнійгалогеніду або алкілцинкгалогеніду способами, описаними в літературі (наприклад, в A. Furstner et al. J. Am. Chem. Soc. 2002, 124(46), 13856; G. Queguiner et al. J. Org. Chem. 1998, 63(9), 2892) або відомими фахівцям в даній галузі техніки. Сполуки загальної формули (I), в яких один з членів X 1, X2, X3 або X4 являє собою атом вуглецю, що має як замісник ціаногрупу, арил або гетероарил, можуть бути одержані поєднанням, що каталізується металом, таким, як паладій, здійснюваним з відповідними сполуками загальної формули (I), що мають як замісник, наприклад, атом брому, в присутності триметилсилілціаніду, арилборонової або гетероарилборонової кислоти або будь-яким іншим способом, описаним в літературі або відомим фахівцям в даній галузі техніки. Сполуки загальної формули (I), що містять замісник типу C(O)NR3R4, можуть бути одержані виходячи з відповідних сполук загальної формули (I), що мають як замісник ціаногрупу, способами, описаними в літературі або відомими фахівцям в даній галузі техніки. Сполуки загальної формули (I), що містять замісник типу -S(О)-алкілу або -S(O)2-алкілу, можуть бути одержані окисленням відповідних сполук загальної формули (I), що мають як замісник тіоалкіл, способами, описаними в літературі або відомими фахівцям в даній галузі техніки. Сполуки загальної формули (I), що містять замісник типу NR3R4, NR5COR6 або NR5SO2R7, можуть бути одержані виходячи з відповідних сполук загальної формули (I), що мають як замісник нітрогрупу, наприклад, відновленням з подальшим ацилуванням або сульфонілуванням способами, описаними в літературі або відомими фахівцям в даній галузі техніки. Сполуки загальної формули (I), в якій W являє собою атом сірки, можуть бути одержані, наприклад, взаємодією відповідних сполук загальної формули (I), в яких W являє собою атом кисню, з реагентом, таким, як реактив Лоуссона. Сполуки загальної формули (I), в яких R2b являє собою гідроксіалкіл, можуть бути одержані виходячи із сполук загальної формули (I), в яких R2b являє собою, наприклад, ацетоксіалкіл або півалоїлоксіалкіл, способами, відомими фахівцям в даній галузі техніки, такими, як реакція з основою, такою, як водний розчин гідроксиду натрію, або реакція з алкоголятом, таким, як метилат, сіллю, такий, як сіль літію або натрію, в спиртовому розчиннику, такому, як метанол або етанол. Сполуки загальної формули (I), в яких R2b являє собою гідроксиметил, можуть бути одержані також виходячи із сполук загальної формули (I), в яких R2b являє собою, наприклад, етилкарбоксилат, реакцією з відновником, таким, як борогідрид натрію, в розчиннику, такому, як тетрагідрофуран. Сполуки загальної формули (II), в яких один з членів X1, X2, X3 або X4 являє собою атом вуглецю, що має як замісник NR3R4, NR5COR6 або NR5SO2R7, а В означає C1-C6-алкокси-, C3-C7циклоалкілокси-, C3-C7-циклоалкіл-C1-C3-алкіленокси- або арил-C1-C3-алкіленоксигрупу, можуть бути одержані виходячи з відповідних сполук загальної формули (II), що мають як замісник, наприклад, атом брому, реакцією поєднання з аміном, амідом або сульфонамідом відповідно в присутності основи, фосфіну і каталізатора на основі паладію способами, описаними в літературі або відомими фахівцям в даній галузі техніки. Сполуки загальної формули (II), в яких один з членів X 1, X2, X3 або X4 являє собою атом вуглецю, що має як замісник SO2NR3R4, а В означає C1-C6-алкокси-, C3-C7-циклоалкілокси-, C3C7-циклоалкіл-C1-C3-алкіленокси- або арил-C1-C3-алкіленоксигрупу, можуть бути одержані аналогічно способу, описаному в Pharmazie, 1990, 45, 346, або способами, описаними в літературі або відомими фахівцям в даній галузі техніки. У наведених далі прикладах описане одержання деяких сполук за даним винаходом. Ці приклади не є обмежувальними і наведені тільки для пояснення даного винаходу. Номери сполук, наведених в прикладах, відповідають номерам таблиці 1. Результати елементного 11 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 мікроаналізу, аналізів РХ-МС (рідинна хроматографія в поєднанні з мас-спектометрією), спектри іК або ЯМР підтверджують структури одержаних сполук. Приклад 1 (сполука № 1) N-(2,3-диметилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід 1.1 5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбонова кислота Водний розчин гідроксиду натрію, приготований виходячи з 1,15 г (28,92 ммоль) таблетованого гідроксиду натрію в 50 мл води, додають до розчину 7,6 г (24,10 ммоль) етил-5фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксилату (WO 2006/024776) в 241 мл етанолу. Суміш нагрівають протягом двох годин і потім згущують при зниженому тиску. Тверду речовину, 3 що утворилася, розчиняють в 200 см води. Розчин промивають етиловим ефіром два рази по 100 мл, підкисляють подальшим додаванням невеликої кількості концентрованої соляної кислоти і потім екстрагують 200 мл етилацетату. У завершення органічний шар промивають водою два рази по 100 мл і один раз 50 мл насичених розчини хлориду натрію, сушать над сульфатом магнію і згущують при зниженому тиску. Після висушування при 50 °C при зниженому тиску одержують 6,4 г необхідної сполуки у вигляді твердої речовини, які використовують в такому вигляді на наступній стадії синтезу. 1.2 5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксамід До тієї, що перемішується при 20 °C суспензії 2 г (6,96 ммоль) 5-фтор-1-[(3фторфеніл)метил]-1H-індол-2-карбоновой кислоти, одержаної на стадії 1.1, в 80 мл безводного толуолу додають 5,08 мл (69,62 ммоль) тіонілхлориду. Реакційну суміш перемішують протягом 2 годин при нагріванні із зворотним холодильником і потім згущують при зниженому тиску. Одержану речовину розчиняють в 10 мл дихлорметану і даний розчин по краплях додають до 9,12 мл 30 %-го водних розчини аміаку (69,62 ммоль). Реакційну суміш перемішують протягом 14 годин при 20 °C. Після цього тверду речовину відділяють фільтруванням і розтирають з 50 мл диизопропілового ефіру. Після фільтрування і висушування при зниженому тиску одержують 0,58 г необхідної сполуки. 1 ЯМР H (ДМСО-D6), δ, м.ч.: 8,11 (ушир. пік, 1H); 7,5 (м, 3H); 7,32 (м, 1H); 7,25 (с, 1H); 7,09 (м, 2H); 6,89 (м, 2H); 5,91 (с, 2H). 1.3 7-бром-2,3-диметилімідазо[1,2-a]піридин (сполука № IIIa) 3 мл (19,86 ммоль) 3-бромбутан-2-ону додають до 1,5 г суміші, що перемішується при 20 °C (8,67 ммоль) 2-аміно-4-бромпіридину і 1,45 г (17,34 ммоль) гідрокарбонату натрію в 50 мл етанолу. Реакційну суміш перемішують при нагріванні із зворотним холодильником протягом 12 годин і потім згущують при зниженому тиску. Одержану суміш обробляють 20 мл води. Розчин підлуговують подальшим додаванням карбонату калію. Осад відділяють фільтруванням, промивають водою і потім сушать при зниженому тиску. Таким чином, одержують 0,79 г необхідної сполуки, які використовують в такому вигляді на наступній стадії синтезу. 1 ЯМР H (ДМСО-D6), δ, м.ч.: 8,15 (д, 1H); 7,71 (с, 1H); 7,01 (д, 1H); 2,39 (с, 3H); 2,31 (с, 3H). 1.4 N-(2,3-диметилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід (сполука № 1) У пробірці, що витримує тиск, в інертній атмосфері при 20 °C змішують 0,0134 г (0,07 ммоль) йодиду міді, 0,2 г (0,7 ммоль) 5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного на стадії 1.2, 132 мг (0,56 ммоль) 7-бром-2,3-диметилімідазо[1,2-a]піридин, одержаний на стадії 1.3, 193 мг (1,4 ммоль) карбонату калію і 5 мл діоксану. Суспензію дегазують протягом декількох хвилин, потім додають 0,01 мл (0,08 ммоль) транс-1,2циклогександіаміну і закривають пробірку. Реакційну суміш перемішують протягом 20 годин при 110 °C. Після цього охолоджену суспензію фільтрують через шар діоксиду кремнію, елююючи сумішшю дихлорметану і метанолу. Фільтрат згущують при зниженому тиску. Одержану речовину розтирають в суміші 90 мл ізопропанолу і 10 мл ізопропілового ефіру. Фільтруванням відділяють тверду речовину, яку очищають хроматографуванням на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 27 мг необхідної сполуки. tпл: 251-253 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,82 (с, 1H); 8,41 (ушир. пік, 1H); 8,19 (ушир. пік, 1H); 7,62 (дд, 1H); 7,58 (дд, 1H); 7,51 (с, 1H); 7,45 (д, 1H); 7,32 (м, 1H); 7,19 (тд, 1H); 7,4 (тд, 1H); 6,5 (м, 2H); 5,89 (с, 2H); 2,5 (с, 6H). 12 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 2 (сполука № 2) N-(2,3-диметилімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід 2.1 6-бром-2,3-диметилімідазо[1,2-a]піридин 13,53 мл (130,06 ммоль) 3-бромбутан-2-ону додають до 5 г суміші, що перемішується при 20 °C (28,90 ммоль) 2-аміно-5-бромп іридину і 4,85 г (57,80 ммоль) гідрокарбонату натрію в 100 мл етанолу. Реакційну суміш перемішують при нагріванні із зворотним холодильником протягом 12 годин і потім згущують при зниженому тиску. Одержану суміш обробляють 100 мл води. Розчин підлуговують подальшим додаванням карбонату калію. Потім суміш екстрагують етилацетатом 3 рази по 50 мл. Об'єднані органічні фракції промивають водою (50 мл), сушать над сульфатом натрію і потім згущують при зниженому тиску. Одержують маслоподібну речовину, яку очищають хроматографуванням на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 1,1 г необхідної сполуки. 1 ЯМР H (ДМСО-D6), δ, м.ч.: 8,5 (с, 1H); 7,4 (д, 1H); 7,25 (д, 1H); 2,4 (с, 3H); 2,31 (с, 3H). + РХ-МС: 225 ([M+Н] , Rt=0,52 хв). 2.2 N-(2,3-диметилімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід (сполука № 2) У пробірці, що витримує тиск, в інертній атмосфері при 20 °C змішують 0,054 г (0,28 ммоль) йодиду міді, 0,8 г (2,79 ммоль) 5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного на стадії 1.2, 0,5 г (2,24 ммоль) 6-бром-2,3-диметилімідазо[1,2-a]піридин, одержаний на стадії 2.1, 0,77 г (5,59 ммоль) карбонату калію і 25 мл діоксану. Суспензію дегазують протягом декількох хвилин, потім додають 0,04 мл (0,31 ммоль) транс-1,2-циклогександіаміну і закривають пробірку. Реакційну суміш перемішують протягом 20 годин при 110 °C. Після цього реакційну суміш розбавляють 50 мл води і 50 мл етилацетату. Водний шар екстрагують етилацетатом 2 рази по 50 мл. Об'єднані органічні фракції промивають водою (50 мл), сушать над сульфатом натрію і потім згущують при зниженому тиску. Одержану речовину розтирають в киплячій суміші 30 мл ізопропілового ефіру і 10 мл води. Фільтруванням в гарячому стані відділяють 0,63 г необхідної сполуки у вигляді твердої речовини білого кольору. tпл: 220-242 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 11,0 (с, 1H); 9,2 (с, 1H); 8,1 (м, 1H); 7,95 (м, 1H); 7,6 (м, 2H); 7,55 (с, 1H); 7,35 (м, 1H); 7,2 (м, 1H); 7,15 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 2,5 (с, 3H); 2,45 (с, 3H). Приклад 3 (сполука № 3) N-[2-(гідроксиметилімідазо[1,2-a]піридин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід У пробірці, що витримує тиск, в інертній атмосфері при 20 °C змішують 20 мг (0,1 ммоль) йодиду міді, 0,3 г (1,05 ммоль) 5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного на стадії 1.2, 0,23 г (0,84 ммоль) 6-иодімідазо[1,2-a]піридин-2-ілметанолу, 0,29 г (2,1 ммоль) карбонату калію і 10 мл діоксану. Суспензію дегазують протягом декількох хвилин, потім додають 0,01 мл (0,12 ммоль) транс-1,2-циклогександіаміну і закривають пробірку. Реакційну суміш перемішують протягом 15 годин при 110 °C. Після цього суспензію, охолоджену до кімнатної температури, виливають в 20 мл води і 20 мл етилацетату. Водний шар екстрагують етилацетатом 2 рази по 10 мл. Об'єднані органічні фракції сушать над сульфатом магнію і згущують при зниженому тиску. Одержану речовину розтирають в киплячій суміші 10 мл дихлорметану і 30 мл ізопропілового ефіру і потім відділяють фільтруванням в гарячому стані. Після висушування одержують 0,31 г необхідної сполуки у вигляді твердої речовини бежового кольору. tпл: 247-249 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,6 (с, 1H); 9,3 (с, 1H); 7,9 (с, 1H); 7,6 (м, 2H); 7,5 (м, 2H); 7,35 (м, 2H); 7,2 (м, 1H); 7,1 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 5,1 (т, 1H); 4,6 (д, 2H). + РХ-МС: 433 ([M+Н] , Rt=4,12 хв). Приклад 4 (сполука № 4) N-(3-метил-2-фенілімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід 4.1 N-[6-(ацетиламіно)піридин-3-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксамід До розчину, що перемішується при 20 °C в інертній атмосфері 2 г (6,96 ммоль) 5-фтор-1-[(3фторфеніл)метил]-1H-індол-2-карбонової кислоти, одержаної згідно з методикою, описаною на стадії 1.1, в 40 мл ДМФА додають 1,72 г (8,35 ммоль) дициклогексилкарбодіїміду (DCC) і 1,13 г (8,35 ммоль) гідрату 1-гідроксибензотриазола (HOBT). Реакційну суміш перемішують при кімнатній температурі протягом 30 хвилин. Потім до реакційної суміші додають 2,1 г (13,92 ммоль) 2-ацетамідо-5-амінопіридину і 20 мг диметиламінопіридину (DMAP). Після 13 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 перемішування протягом 24 годин при 20 °C реакційну суміш згущують досуха. Одержаний залишок обробляють сумішшю 200 мл насиченого водного розчину NaHCO 3 і 200 мл етилацетату. Шари розділяють і водний шар екстрагують 200 мл етилацетату. Об'єднані органічні фракції сушать над сульфатом натрію і потім згущують при зниженому тиску. Одержану тверду речовину очищають хроматографуванням на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 2,6 г необхідної сполуки. 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,6 (с, 1H); 10,5 (с, 1H); 8,7 (с, 1H); 8,1 (с, 2H); 7,6 (м, 2H); 7,45 (с, 1H); 7,35 (м, 1H); 7,2 (м, 1H); 7,1 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 2,1 (с, 3H). + РХ-МС: 421 ([M+Н] , Rt=1,10 хв). 4.2 N-[6-амінопіридин-3-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксамід До суспензії 0,6 г (1,43 ммоль) N-[6-(ацетиламіно)піридин-3-іл]-5-фтор-1-[(3фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 4.1, в 9 мл безводного метанолу при перемішуванні при 0 °C в інертній атмосфері по краплях додають 2,03 мл (28,54 ммоль) ацетилхлориду. Реакційну суміш перемішують при 0 °C протягом 30 хвилин, потім поступово нагрівають до 70 °C і перемішують протягом 48 годин. Реакційну суміш згущують досуха. Одержаний залишок обробляють сумішшю 200 мл насиченого водного розчину NaHCO3 і 200 мл етилацетату. Шари розділяють і водний шар екстрагують 200 мл етилацетату. Об'єднані органічні фракції сушать над сульфатом натрію і потім згущують при зниженому тиску. Таким чином, одержують 0,46 г необхідної сполуки. 1 ЯМР H (ДМСО-D6), δ, м.ч.: 8,2 (с, 1H); 7,7 (м, 1H); 7,6 (м, 2H); 7,35 (м, 2H); 7,2 (м, 1H); 7,1 (м, 1H); 6,9 (м, 2H); 6,5 (д, 1H); 5,9 (с, 2H); 5,8 (с, 2H). 4.3 N-(3-метил-2-фенілімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід (сполука № 4) У пробірку з кришкою, що загвинчується місткістю 10 мл, забезпечену магнітним перемішуючим якором, вносять 0,05 г (0,13 ммоль) N-[6-амінопіридин-3-іла]-5-фтор-1-[(3фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 4.2, 0,056 г (0,26 ммоль) 2-бром-1-фенілпропан-1-ону і 4 мл ацетонітрилу. Потім пробірку загвинчують і нагрівають при 80 °C при перемішуванні протягом 24 годин. Далі, після доведення до кімнатної температури, одержаний осад відділяють фільтруванням, промивають послідовно 2 мл ацетонітрилу і 2 мл ізопропілового ефіру. Одержану тверду речовину сушать при зниженому тиску. Таким чином, одержують 0,024 г необхідної сполуки. tпл: 258-259 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,65 (с, 1H); 9,0 (с, 1H); 7,85 (д, 2H); 7,6 (м, 3H); 7,5 (м, 4H); 7,35 (м, 2H); 7,2 (м, 1H); 7,1 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 2,65 (с, 3H). Приклад 5 (сполука № 5) N-(2-етилімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксамід Сполуку № 5 одержували аналогічно способу, описаному на стадії 4.3, взаємодією 0,1 г (0,26 ммоль) N-[6-амінопіридин-3-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 4.2, з 0,08 г (0,53 ммоль) 1-бромбутан-2-ону в 4 мл ацетонітрилу. Одержано 0,112 г необхідного продукту. tпл=278-279 °C 1 ЯМР H (ДМСО-D6), δ, (м.ч.): 9,65 (с, 1H); 8,25 (с, 1H); 8,05 (д, 1H); 7,95 (д, 1H); 7,65 (м, 2H); 7,55 (с, 1H); 7,35 (м, 1H); 7,25 (м, 1H); 7,1 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 2,9 (кв, 2H); 1,3(т, 3H). + РХ-МС: 431 ([M+Н] , Rt=1,09 хв). Приклад 6 (сполука № 6) N-[2-(тієн-2-іл)імідазо[1,2-a]піридин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід Сполуку № 6 одержували аналогічно способу, описаному на стадії 4.3, взаємодією 0,1 г (0,26 ммоль) N-[6-амінопіридин-3-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 4.2, з 0,11 г (0,53 ммоль) 2-бром-1-(тієн-2іл)етанону в 4 мл ацетонітрилу. Одержано 0,126 г необхідної сполуки у вигляді твердої речовини білого кольору. tпл=316-318 °C 1 ЯМР H (ДМСО-D6), δ, (м.ч.): 10,8 (с, 1H); 9,5 (с, 1H); 8,6 (с, 1H); 7,8 (с, 2H); 7,7 (д, 1H); 7,6 (м, 3H); 7,55 (с, 1H); 7,35 (м, 1H); 7,2 (м, 2H); 7,1 (м, 1H); 6,95 (м, 2H); 5,9 (с, 2H). + РХ-МС: 485 ([M+Н] , Rt=1,16 хв). 14 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 7 (сполука № 7) N-(2-трет-бутилімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід Сполуку № 7 одержували аналогічно способу, описаному на стадії 4.3, взаємодією 0,1 г (0,26 ммоль) N-[6-амінопіридин-3-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 4.2, з 0,096 г (0,53 ммоль) 1-бром-3,3диметилбутан-2-ону в 4 мл ацетонітрилу. Одержано 0,119 г необхідної сполуки у вигляді твердої речовини білого кольору. tпл=190-192 °C 1 ЯМР H (ДМСО-D6), δ, (м.ч.): 10,9 (с, 1H); 9,6 (с, 1H); 8,3 (с, 1H); 8,0 (м, 2H); 7,65 (м, 2H); 7,55 (с, 1H); 7,35 (м, 1H); 7,25 (м, 1H); 7,1 (м, 1H); 6,95 (м, 2H); 5,9 (с, 2H); 1,4 (с, 9H). + РХ-МС: 459 ([M+Н] , Rt=1,17 хв). Приклад 8 (сполука № 8) N-(2-метоксиметилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід 8.1 7-бромімідазо[1,2-a]піридин-2-етилкарбоксилат (сполука № IIc) У пробірку з кришкою, що загвинчується, місткістю 20 мл, забезпечену магнітним перемішуючим якором, вносять 0,6 г (3,47 ммоль) 2-аміно-4-бромпіридина, 1,55 г (7,15 ммоль) етилбромпірувату і 4 мл ацетонітрилу. Потім пробірку загвинчують, перемішують при кімнатній температурі протягом 1 години і далі нагрівають при 150 °C при перемішуванні протягом 30 хвилин. Далі, після доведення до кімнатної температури, одержаний осад відділяють фільтруванням, промивають ацетонітрилом і сушать. Фільтрат згущують досуха і потім очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Одержану тверду речовину після випаровування розчинника сушать при зниженому тиску. Одержують 530 мг необхідного продукту. 1 ЯМР H (ДМСО-D6), δ, м.ч.: 8,65 (с, 1H); 8,6 (д, 1H); 8,05 (с, 1H); 7,3 (м, 1H); 4,3 (кв, 2H); 1,3 (т, 3H). 8.2 (7-бромімідазо[1,2-a]піридин-2-іл)метанол (сполука № IIId) До суспензії 0,25 г (0,93 ммоль) етил-7-бромімідазо[1,2-a]піридин-2-карбоксилата, одержаного згідно з методикою, описаною на стадії 8.1, в 4 мл безводного дихлорметану при перемішуванні при -19 °C в інертній атмосфері по краплях додають 2,09 мл (2,09 ммоль) одномолярного розчини DIBAL-H в толуоле. Реакційну суміш перемішують при -19 °C протягом 3 годин і потім гідролизуют при -40 °C подальшим додаванням 0,1 мл метанолу, 0,1 мл води і 10 мл 5 н. розчину HCl. Далі реакційну суміш підлуговують водним розчином гідроксиду натрію (24 %) і потім екстрагують дихлорметаном три рази по 100 мл. Об'єднані органічні фракції сушать над сульфатом натрію і потім згущують при зниженому тиску. Потім неочищений продукт реакції очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 110 мг необхідної сполуки. 1 ЯМР H (ДМСО-D6), δ, м.ч.: 8,0 (д, 1H); 7,8 (с, 1H); 7,6 (с, 1H); 6,9 (м, 1H); 4,9 (с, 2H). 8.3 7-бром-2-хлорметилімідазо[1,2-a]піридин (сполука № IIIe) До розчину 110 мг (0,48 ммоль) (7-бромімідазо[1,2-a]піридин-2-іл)метанолу, одержаного згідно з методикою, описаною на стадії 8.2, в 8 мл безводного дихлорметану при перемішуванні при кімнатній температурі в інертній атмосфері додають 0,03 мл (0,53 ммоль) тіонілхлориду. Реакційну суміш перемішують при кімнатній температурі протягом 4 годин, гідролізують при 0 °C подальшим додаванням 3 мл холодної води і 5 мл насичених водних розчини NaHCO3 і потім екстрагують дихлорметаном три рази по 10 мл. Об'єднані органічні фракції сушать над сульфатом натрію і потім згущують при зниженому тиску. Одержують 80 мг необхідного продукту. 1 ЯМР H (CDCl3), δ, м.ч.: 7,9 (д, 1H); 7,7 (с, 1H); 7,6 (с, 1H); 6,85 (м, 1H); 4,7 (с, 2H). 8.4 7-бром-2-метоксиметилімідазо[1,2-a]піридин (сполука № IIIf) До розчину 81 мг (0,33 ммоль) 7-бром-2-хлорметилімідазо[1,2-a]піридину, одержаного згідно з методикою, описаною на стадії 8.3, в 3 мл безводного метанолу при перемішуванні при кімнатній температурі в інертній атмосфері додають 35 мг (0,99 ммоль) метилату натрію. Реакційну суміш перемішують при 100 °C протягом 4 годин. Після цього реакційну суміш, охолоджену до кімнатної температури, згущують при зниженому тиску, розбавляють 10 мл хлороформу і промивають 10 мл насиченого водного розчину NaCl. Неочищений продукт реакції, одержаний після випаровування розчинника при зниженому тиску, очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 27 мг необхідної сполуки. 15 UA 102088 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 ЯМР H (CDCl3), δ, м.ч.: 7,9 (д, 1H); 7,75 (с, 1H); 7,5 (с, 1H); 6,85 (м, 1H); 4,6 (с, 2H); 3,4 (с, 3H). 8.5 N-(2-метоксиметилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід (сполука № 8) У пробірку місткістю 10 мл, що витримує тиск і призначену для мікрохвильового нагрівання, вносять 20 мг (0,09 ммоль) йодиду міді, 40 мг (0,14 ммоль) 5-фтор-1-[(3-фторфеніл)метил]-1Hіндол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 1.2, 27 мг (0,11 ммоль) 7-бром-2-метоксиметилімідазо[1,2-a]піридин, одержаний згідно з методикою, описаною на стадії 8.3, 50 мг (0,36 ммоль) карбонату калію і 3 мл безводного діоксану. Суспензію дегазують протягом декількох хвилин і потім додають 0,01 мл (0,04 ммоль) транс-1,2циклогександіаміна. Потім пробірку герметизують і нагрівають мікрохвилями при 150 °C протягом двох циклів по 1 год. Після цього суспензію, охолоджену до кімнатної температури, виливають в 20 мл води і потім екстрагують дихлорметаном 2 рази по 30 мл. Об'єднані органічні фракції сушать над сульфатом магнію і згущують при зниженому тиску. Потім неочищений продукт реакції очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 45 мг необхідної сполуки. tпл: 215-216 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,7 (с, 1H); 8,5 (д, 1H); 8,0 (с, 1H); 7,8 (с, 1H); 7,6 (м, 2H); 7,5 (с, 1H); 7,3 (м, 1H); 7,2 (м, 2H); 7,05 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 4,5 (с, 2H); 3,3 (с, 3H). РХ-МС: 445 ([M - Н]-, Rt=4,3 хв). Приклад 9 (сполука № 9) N-[2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід 9.1 N-[2-(етилоксикарбоніл)імідазо[1,2-a]піридин-7-іл]-5-фтор-1-[(3-фторфеніл)метил]-1Hіндол-2-карбоксамід Сполуку одержують аналогічно способу, описаному на стадії 4.3, взаємодією 0,2 г (0,53 ммоль) N-[2-амінопіридин-4-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 10.1, з 0,21 г (1,06 ммоль) етил-3-бром-2оксопропіоната в 8 мл ацетонітрилу. Одержують 70 мг необхідного продукту. + РХ-МС: 475 ([M+Н] , Rt=1,09 хв). 1 ЯМР H (ДМСО-D6), δ, (м.ч.): 10,75 (с, 1H); 8,5 (м, 2H); 7,9 (с, 1H); 7,65 (м, 2H); 7,5 (с, 1H); 7,35 (м, 2H); 7,2 (м, 1H); 7,1 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 4,3 (кв, 2H); 1,3 (т, 3H). 9.2 N-[2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол2-карбоксамід (сполука № 9) Сполуку № 9 одержували аналогічно способу, описаному на стадії 8.2, взаємодією 0,465 г (0,98 ммоль) N-[2-(етилоксикарбоніл)імідазо[1,2-a]піридин-7-іл]-5-фтор-1-[(3-фторфеніл)метил]1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 9.1, з 2,21 мл (2,21 ммоль) одномолярного толуольного розчину DIBAL-H в 4 мл дихлорметану. Одержано 80 мг необхідного продукту. tпл=244-245 °C 1 ЯМР H (ДМСО-D6), δ, (м.ч.): 10,6 (с, 1H); 8,48 (д, 1H); 8,0 (с, 1H); 7,7 (с, 1H); 7,6 (м, 2H); 7,5 (с, 1H); 7,35 (м, 1H); 7,2 (м, 2H); 7,05 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 5,1 (т, 1H); 4,6 (д, 2H). + РХ-МС: 433 ([M+Н] , Rt=1,06 хв). Приклад 10 (сполука № 10) N-(2-метил-3-фенілімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід 10.1 N-[2-амінопіридин-4-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксамід У пробірку місткістю 10 мл, що витримує тиск і призначену для мікрохвильового нагрівання, вносять 0,2 г (1,05 ммоль) йодиду міді, 0,6 г (2,10 ммоль) 5-фтор-1-[(3-фторфеніл)метил]-1Hіндол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 1.2, 0,4 г (2,31 ммоль) 2-аміно-4-бромпіридина, 1,16 г (8,40 ммоль) карбонату калію і 15 мл безводного діоксану. Суспензію дегазують протягом декількох хвилин і потім додають 0,14 мл (1,15 ммоль) транс-1,2циклогександіаміна. Потім пробірку герметизують і нагрівають мікрохвилями при 170 °C протягом двох циклів по 1 год. Після цього суспензію, охолоджену до кімнатної температури, виливають в 50 мл води і потім екстрагують дихлорметаном 2 рази по 75 мл. Об'єднані органічні фракції сушать над сульфатом магнію і згущують при зниженому тиску. Потім неочищений продукт реакції очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 0,425 г необхідної сполуки у вигляді твердої речовини бежового кольору. tпл: 217-218 °C 16 UA 102088 C2 1 5 10 15 20 25 30 35 40 45 50 55 ЯМР H (ДМСО-D6), δ, м.ч.: 10,4 (с, 1H); 7,8 (д, 1H); 7,6 (м, 2H); 7,45 (с, 1H); 7,35 (м, 1H); 7,2 (м, 1H); 7,1 (м, 2H); 6,9 (м, 2H); 6,8 (д, 1H); 5,9 (м, 4H). + РХ-МС: 379 ([M+Н] , Rt=1,03 хв). 10.2 N-(2-метил-3-фенілімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол2-карбоксамід (сполука № 10) У пробірку місткістю 10 мл, що витримує тиск і призначену для мікрохвильового нагрівання, вносять 0,1 г (0,26 ммоль) N-[2-амінопіридин-4-іла]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксаміду, одержаного згідно з методикою, описаною на стадії 10.1, 0,11 г (0,53ммоль) 2бром-1-фенілпропан-1-ону і 4 мл ацетонітрилу. Потім пробірку герметизують і нагрівають мікрохвилями при 150 °C протягом двох циклів по 1 год. Після цього реакційну суміш згущують при зниженому тиску. Потім неочищений продукт реакції очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 0,03 г необхідної сполуки у вигляді твердої речовини бежового кольору. tпл: 305-307 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,7 (с, 1H); 8,35 (д, 1H); 8,1 (с, 1H); 7,85 (д, 2H); 7,6 (м, 2H); 7,5 (м, 3H); 7,35 (м, 3H); 7,2 (м, 1H); 7,1 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 2,7 (с, 3H). + РХ-МС: 493 ([M+Н] , Rt=1,17 хв). Приклад 11 (сполука № 11) N-[2-(тієн-2-іл)імідазо[1,2-a]піридин-7-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід Сполуку № 11 одержували аналогічно способу, описаному на стадії 10.2, взаємодією 0,1 г (0,26 ммоль) N-[2-амінопіридин-4-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 10.1, з 0,11 г (0,53 ммоль) 2-бром-1-(тієн-2іл)етанона в 4 мл ацетонітрилу. Таким чином, одержано 0,026 г необхідної сполуки у вигляді твердої речовини бежового кольору. tпл: 259-260 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,7 (с, 1H); 8,5 (д, 1H); 8,2 (с, 1H); 8,0 (с, 1H); 7,6 (м, 2H); 7,5 (м, 3H); 7,3 (м, 2H); 7,2 (м, 1H); 7,15 (м, 1H); 7,05 (м, 1H); 6,95 (м, 2H); 5,9 (с, 2H). + РХ-МС: 485 ([M+Н] , Rt=1,13 хв). Приклад 12 (сполука № 12) N-(2-етилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил-1H -індол-2-карбоксамід Сполуку № 12 одержували аналогічно способу, описаному на стадії 10.2, взаємодією 0,1 г (0,26 ммоль) N-[2-амінопіридин-4-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 10.1, з 0,08 г (0,53 ммоль) 1-бромбутан-2ону в 4 мл ацетонітрилу. Таким чином, одержано 66 мг необхідної сполуки. tпл: 158-159 °C 1 ЯМР H (ДМСО-D6), δ, (м.ч.): 11,2 (с, 1H); 8,65 (д, 1H); 8,4 (с, 1H); 7,9 (с, 1H); 7,55 (м, 4H); 7,35 (м, 1H); 7,2 (м, 1H); 7,05 (м, 1H); 6,9 (д, 1H); 6,8 (д, 1H); 5,9 (с, 2H); 2,8 (кв, 2H); 1,25 (т, 3H). + РХ-МС: 431 ([M+Н] , Rt=1,08 хв). Приклад 13 (сполука № 13) N-(2-трет-бутилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил-1H -індол-2карбоксамід Сполуку № 13 одержували аналогічно способу, описаному на стадії 10.2, взаємодією 0,1 г (0,26 ммоль) N-[2-амінопіридин-4-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 10.1, з 0,096 г (0,53 ммоль) 1-бром-3,3диметилбутан-2-ону в 4 мл ацетонітрилу. Таким чином, одержано 0,116 г необхідної сполуки. tпл: 327-328 °C 1 ЯМР H (ДМСО-D6), δ, (м.ч.): 11,2 (с, 1H); 8,7 (д, 1H); 8,45 (с, 1H); 8,0 (с, 1H); 7,7 (м, 4H); 7,35 (м, 1H); 7,25 (м, 1H); 7,1 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 1,4 (с, 9H). + РХ-МС: 459 ([M+Н] , Rt=1,14 хв). Приклад 14 (сполука № 14) N-(2,3-диметилімідазо[1,2-a]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1H-індол2-карбоксамід 14.1 Мітив-2,3-диметилімідазо[1,2-a]піридин-7-карбоксилат (сполука № IIIb) До суспензії 5 г (32,86 ммоль) метил-2-амінопіридин-4-карбоксилату і 5,52 г (65,72 ммоль) гідрокарбонату натрію в 250 мл етанолу додають 12,4 г (82,15 ммоль) 3-бром-2-бутанону. Реакційну суміш перемішують при нагріванні із зворотним холодильником протягом 2 годин. Потім до реакційної суміші додають додатково 12,4 г (82,15 ммоль) 3-бром-2-бутанону і продовжують перемішувати при нагріванні із зворотним холодильником протягом 15 годин. 17 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 Після доведення до кімнатної температури розчинник випаровують. Залишок розбавляють 50 мл води і потім підлуговують додаванням насиченого розчину NaHCO 3 до pH=8-9. Осад, що утворився, відділяють фільтруванням, промивають декілька разів водою і потім сушать. Таким чином, одержують 4 г необхідної сполуки у вигляді твердої речовини бежового кольору. ЯМР (ДМСО-D6), δ, м.ч.: 8,3 (д, 1H); 8,05 (с, 1H); 7,3 (дд, 1H); 3,9(с, 3H); 2,5 (с, 3H); 2,35 (с, 3H). 14.2 2,3-диметилімідазо[1,2-a]піридин-7-карбонова кислота До розчину 1,85 г (9,06 ммоль) метил-2,3-диметилімідазо[1,2-a]піридин-7-карбоксилату, одержаного згідно з методикою, описаною на стадії 14.1, в 50 мл метанолу додають розчин 0,77 г (13,59 ммоль) гідроксиду калію в 1,5 мл води. Реакційну суміш витримують при 50 °C протягом 18 годин. Після доведення до кімнатної температури розчин охолоджують до 0 °C і значення pH реакційної суміші доводять до 5 додаванням по краплях 6 н. розчину HCl. Осад, що Утворився відділяють фільтруванням, промивають спочатку водою і потім ефіром з кількісним одержанням необхідної кислоти. + РХ-МС: 191 ([M+Н] , Rt=0,44 хв). 14.3 трет-Бутил-N-[2,3-диметилімідазо[1,2-a]піридин-7-іл]карбамат До суспензії 1,7 г (8,94 ммоль) 2,3-диметилімідазо[1,2-a]піридин-7-карбонової кислоти, одержаної згідно з методикою, описаною на стадії 14.2, в 29 мл трет-бутанолу додають 3,19 г (11,62 ммоль) дифенілфосфорилазиду і 3,11 мл (22,34 ммоль) триетиламіну. Після нагрівання протягом 4 годин при 90 °C і далі протягом 12 годин при 40 °C реакційну суміш згущують досуха і потім розбавляють 20 мл води. Одержаний осад відділяють фільтруванням, промивають декілька разів водою і потім сушать. Після очищення флеш-хроматографуванням на силікагелі при елююванні розчином метанолу в дихлорметані з градієнтом від 1 до 5 % одержують 1,15 г необхідної сполуки у вигляді твердої речовини жовтого кольору. ЯМР (ДМСО-D6), δ, м.ч.: 7,8 (д, 1H); 7,5-7,2 (м, 2H); 2,4 (2 с, 6H); 1,6 (с, 9H). 14.4 Гідрохлорид 2,3-диметилімідазо[1,2-a]піридин-7-іл-аміну До розчину 1,15 г (4,40 ммоль) трет-бутил-2,3-диметилімідазо[1,2-a]піридин-7-іл)карбамату, одержаного згідно з методикою, описаною на стадії 14.3, в 15 мл діоксану додають 15,4 мл (61,61 ммоль) 4 н. розчину HCl в діоксане. Реакційну суміш витримують при 55 °C протягом 4 годин. Після доведення до кімнатної температури реакційну суміш при перемішуванні розбавляють діетиловим ефіром. Осад, що утворився, відділяють фільтруванням, промивають ефіром і потім сушать при зниженому тиску. Одержують 0,9 г необхідного гідрохлориду 2,3диметилімідазо[1,2-a]піридин-7-іл-аміну. ЯМР (ДМСО-D6)?, м.ч.: 13,2 (с, 1H); 8,2 (д, 1H); 6,8 (д, 1H); 6,55 (с, 1H); 2,3 (с, 3H); 2,25 (с, 3H). 14.5 N-(2,3-диметилімідазо[1,2-a]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Hіндол-2-карбоксамід (сполука № 14) До розчину, що перемішується при 20 °C в інертній атмосфері 1 г (2,96 ммоль) 5трифторметил-1-[(3-фторфеніл)метил]-1H-індол-2-карбонової кислоти (WO 2006072736) в 70 мл ДМФА додають 0,74 г (3,56 ммоль) дициклогексилкарбодіїміду (DCC) і 0,48 г (3,56 ммоль) гідрату 1-гідроксибензотриазолу (HOBT). Реакційну суміш перемішують при кімнатній температурі протягом 30 хвилин. Потім до реакційної суміші додають 0,7 г (4,45 ммоль) 2,3диметилімідазо[1,2-a]піридин-7-іламіна, одержаного згідно з методикою, описаною на стадії 14.4, і 100 мг диметиламінопіридину (DMAP). Після перемішування протягом 12 годин при 50 °C реакційну суміш згущують досуха. Одержаний залишок обробляють сумішшю 50 мл води і 50 мл етилацетату. Шари розділяють і водний шар екстрагують 200 мл етилацетату. Об'єднані органічні фракції сушать над сульфатом натрію і потім згущують при зниженому тиску. Необхідну сполуку виділяють після очищення хроматографуванням на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 50 мг необхідної сполуки. tпл=280-281 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,75 (с, 1H); 8,25 (с, 1H); 8,15 (д, 1H); 7,95 (с, 1H); 7,8 (д, 1H); 7,6 (м, 2H); 7,3 (м, 2H); 7,1 (м, 1H); 6,9 (м, 2H); 5,95 (с, 2H); 2,4 (с, 3H); 2,3 (с, 3H). + РХ-МС: 481 ([M+Н] , Rt=1,18 хв). 18 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 15 (сполука № 15) N-(2-етилімідазо[1,2-a]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1H-піроло[2,3b]піридин-2-карбоксамід 15.1 5-трифторметил-1-[(3-фторфеніл)метил]-1H-піроло[2,3-b]піридин-2-карбоксамід До тієї суспензії, що перемішується, при 20 °C 1,5 г (4,43 ммоль) 5-трифторметил-1-[(3фторфеніл)метил]-1H-піроло[2,3-b]піридин-2-карбонової кислоти (WO 2008/093024) в 40 мл безводного толуолу додають 3,2 мл (44,34 ммоль) тіонілхлориду. Реакційну суміш перемішують протягом 2 годин при нагріванні із зворотним холодильником і потім згущують при зниженому тиску. Одержану речовину розчиняють в 20 мл дихлорметану і даний розчин по краплях додають до 5,81 мл 30 %-го водних розчини аміаку (44,34 ммоль). Реакційну суміш перемішують протягом 14 годин при 20 °C. Після цього тверду речовину відділяють фільтруванням і розтирають з 50 мл диизопропілового ефіру. Після фільтрування і висушування при зниженому тиску одержують 1,5 г необхідної сполуки. tпл: 203-204 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 8,78 (д, 1H); 8,65 (д, 1H); 8,29 (ушир. пік, 1H); 7,62 (ушир. пік, 1H); 7,4 (с, 1H); 7,32 (м, 1H); 7,05 (м, 1H); 6,92 (м, 2H); 6,0 (с, 2H). + РХ-МС: 338 ([M+Н] , Rt=1,20 хв). 15.2 N-[2-амінопіридин-4-іл]-5-трифторметил-1-[(3-фторфеніл)метил]-1H-піроло[2,3b]піридин-2-карбоксамід У пробірку місткістю 10 мл, що витримує тиск і призначену для мікрохвильового нагрівання, вносять 0,056 г (0,30 ммоль) йодиду міді, 0,2 г (0,59 ммоль) 5-трифторметил-1-[(3фторфеніл)метил]-1H-піроло[2,3-b]піридин-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 15.1, 0,11 г (0,65 ммоль) 2-аміно-4-бромпіридину, 0,33 г (2,37 ммоль) карбонату калію і 5 мл безводного діоксану. Суспензію дегазують протягом декількох хвилин і потім додають 0,04 мл (0,33 ммоль) транс-1,2-циклогександіаміну. Потім пробірку герметизують і нагрівають мікрохвилями при 170 °C протягом 45 хвилин. Після цього суспензію, охолоджену до кімнатної температури, виливають в 30 мл води і потім екстрагують дихлорметаном 2 рази по 40 мл. Об'єднані органічні фракції сушать над сульфатом магнію і згущують при зниженому тиску. Потім неочищений продукт реакції очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 0,22 г необхідної сполуки у вигляді твердої речовини білого кольору. tпл: 197-198 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,6 (с, 1H); 8,85 (с, 1H); 8,75 (с, 1H); 7,85 (д, 1H); 7,65 (с, 1H); 7,35 (м, 1H); 7,1 (м, 2H); 6,9 (м, 2H); 6,8 (м, 1H); 5,95 (с, 2H); 5,85 (с, 2H). + РХ-МС: 430 ([M+Н] , Rt=1,08 хв). 15.3 N-(2-етилімідазо[1,2-a]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-b]піридин-2-карбоксамід (сполука № 15) У пробірку місткістю 10 мл, що витримує тиск і призначену для мікрохвильового нагрівання, вносять 0,125 г (0,29 ммоль) N-[2-амінопіридин-4-іл]-5-трифторметил-1-[(3-фторфеніл)метил]1H-піроло[2,3-b]піридин-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 15.2, 0,088 г (0,58 ммоль) 1-бромбутан-2-ону і 4 мл ацетонітрилу. Потім пробірку герметизують і нагрівають мікрохвилями при 150 °C протягом двох циклів по 1 год. Після цього реакційну суміш згущують при зниженому тиску. Потім неочищений продукт реакції очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 0,076 г необхідної сполуки у вигляді твердої речовини жовтого кольору. tпл: 264-265 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,8 (с, 1H); 8,85 (с, 1H); 8,8 (с, 1H); 8,45 (д, 1H); 7,95 (с, 1H); 7,65 (м, 2H); 7,35 (м, 1H); 7, 2 (д, 1H); 7,1 (м, 1H); 6,95 (м, 2H); 6,0 (с, 2H); 2,7 (кв, 2H); 1,3 (т, 3H). + РХ-МС: 482 ([M+Н] , Rt=4,75 хв). Приклад 16 (сполука № 16) N-(2,3-диметилімідазо[1,2-a]піридин-7-іл)-5-трифторметил-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-b]піридин-2-карбоксамід Сполуку № 16 одержували аналогічно способу, описаному на стадії 15.3, взаємодією 0,12 г (0,28 ммоль) N-[2-амінопіридин-4-іл]-5-трифторметил-1-[(3-фторфеніл)метил]-1H-піроло[2,3b]піридин-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 15.2, з 0,084 г (0,56 ммоль) 3-бромбутан-2-ону в 5 мл ацетонітрилу. Одержано 45 мг необхідного продукту. tпл=287-288 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,8 (с, 1H); 8,85 (с, 1H); 8,8 (с, 1H); 8,2 (д, 1H); 8,0 (с, 1H); 7,65 (м, 1H); 7,35 (м, 1H); 7, 28 (м, 1H); 7,1 (м, 1H); 6,95 (м, 2H); 6,0 (с, 2H); 2,4 (с, 3H); 2,3 (с, 3H). 19 UA 102088 C2 + 5 10 15 20 25 30 35 40 45 50 55 РХ-МС: 482 ([M+Н] , Rt=1,13 хв). Приклад 17 (сполука № 17) N-[2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл]-5-трифторметил-1-[(3-фторфеніл)метил]-1Hіндол-2-карбоксамід 17.1 5-трифторметил-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксамід До суспензії, що перемішується при 20 °C 8 г (23,72 ммоль) 5-трифторметил-1-(3фторбензил)-1H-індол-2-карбонової кислоти (WO 2006072736) в 150 мл безводного толуолу додають 17,3 мл (237,2 ммоль) тіонілхлориду. Реакційну суміш перемішують протягом 2 годин при нагріванні із зворотним холодильником і потім згущують при зниженому тиску. Одержану речовину розчиняють в 25 мл дихлорметану і даний розчин по краплях додають до розчину 9,32 мл 30 %-го водного розчину аміаку. Реакційну суміш перемішують протягом 14 годин при 20 °C. Після цього тверду речовину відділяють фільтруванням і розтирають з 50 мл пентану. Після фільтрування і висушування при зниженому тиску одержують 5,87 г необхідної сполуки. 1 ЯМР H (ДМСО-D6), δ, м.ч.: 8,28 (ушир. пік, 1H); 8,13 (с, 1H); 7,77 (д, 1H); 7,6 (м, 2H); 7,41 (с, 1H); 7,32 (м, 1H); 7,05 (м, 1H); 6,9 (м, 2H); 6 (с, 2H). 17.2 N-[2-амінопіридин-4-іл]-5-трифторметил-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід У пробірку місткістю 10 мл, що витримує тиск і призначену для мікрохвильового нагрівання, вносять 0,056 г (0,30 ммоль) йодиду міді, 0,2 г (0,59 ммоль) 5-трифторметил-1-[(3фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 17.1, 0,12 г (0,71 ммоль) 2-аміно-4-бромпіридина, 0,33 г (2,38 ммоль) карбонату калію і 4 мл безводного діоксану. Суспензію дегазують протягом декількох хвилин і потім додають 0,04 мл (0,3 ммоль) транс-1,2-циклогександіаміна. Потім пробірку герметизують і нагрівають мікрохвилями при 170 °C протягом 45 хвилин. Після цього суспензію, охолоджену до кімнатної температури, виливають в 30 мл води і потім екстрагують дихлорметаном 2 рази по 40 мл. Об'єднані органічні фракції сушать над сульфатом магнію і згущують при зниженому тиску. Потім неочищений продукт реакції очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 0,186 г необхідної сполуки. tпл: 225-226 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,6 (с, 1H); 8,25 (с, 1H); 7,8 (м, 2H); 7,6 (м, 2H); 7,35 (м, 1H); 7,1 (м, 2H); 6,9 (м, 2H); 6,8 (д, 1H); 5,9 (с, 2H); 5,85 (с, 2H). + РХ-МС: 429 ([M+Н] , Rt=4,55 хв). 17.3 N-[2-(етилоксикарбоніл)імідазо[1,2-a]піридин-7-іл]-5-трифторметил-1-[(3фторфеніл)метил]-1H-індол-2-карбоксамід Сполуку одержують аналогічно способу, описаному на стадії 15.3, взаємодією 0,23 г (0,54 ммоль) N-[2-амінопіридин-4-іл]-5-трифторметил-1-[(3-фторфеніл)метил]-1H-індол-2карбоксаміду, одержаного згідно з методикою, описаною на стадії 17.2, з 0,21 г (1,07 ммоль) етил-3-бром-2-оксопропіонату в 4 мл ацетонітрилу. Одержують 192 мг необхідного продукту. tпл=282-283 °C 1 ЯМР H (ДМСО-D6), δ, (м.ч.): 10,9 (с, 1H); 8,55 (д, 1H); 8,45 (с, 1H); 8,25 (с, 1H); 8,1 (с, 1H); 7,85 (д, 1H); 7,65 (с, 1H); 7,6 (д, 1H); 7,35 (м, 2H); 7,1 (м, 1H); 6,95 (д, 2H); 6,0 (с, 2H); 4,3 (кв, 2H); 1,3 (т, 3H). + РХ-МС: 525 ([M+Н] , Rt=4,83 хв). 17.4 N-[2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл]-5-трифторметил-1-[(3-фторфеніл)метил]1H-індол-2-карбоксамід (сполука № 17) До 0,47 мл (0,47 ммоль) одномолярного розчини LiAlH4, розчиненого в 1 мл безводного ТГФ, охолодженого до -5 °C, додають по краплях за допомогою шприца суспензію 190 мг (0,36 ммоль) N-[2-(етилоксикарбоніл)імідазо[1,2-a]піридин-7-іл]-5-трифторметил-1-[(3фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 17.3, в 4 мл безводного ТГФ. Після перемішування протягом 3 годин при кімнатній температурі реакційну суміш повільно виливають в суміш (об./об.) води і концентрованого розчину гідроксиду натрію і потім екстрагують дихлорметаном 3 рази по 100 мл. Об'єднані органічні фракції сушать над сульфатом магнію і потім згущують при зниженому тиску. Одержаний неочищений продукт реакції очищають хроматографуванням на колонці з діоксидом кремнію, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 30 мг необхідної сполуки. tпл=254-255 °C 20 UA 102088 C2 1 5 10 15 20 25 30 35 40 45 50 55 ЯМР H (ДМСО-D6), δ, м.ч.: 10,8 (с, 1H); 8,49 (д, 1H); 8,25 (с, 1H); 8,0 (с, 1H); 7,8 (д, 1H); 7,7 (с, 2H); 7,6 (м, 2H); 7,3 (м, 1H); 7,2 (м, 1H); 7,05 (м, 1H); 6,95 (д, 2H); 5,95 (с, 2H); 5,1 (м, 1H); 4,55 (д, 2H). + РХ-МС: 483 ([M+Н] , Rt=1,29 хв). Приклад 18 (сполука № 18) N-[2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл]-5-трифторметил-1-[(3-фторфеніл)метил]-1Hпіроло[2,3-b]піридин-2-карбоксамід (сполука 18) 18.1 N-[2-(етилоксикарбоніл)імідазо[1,2-a]піридин-7-іл]-5-трифторметил-1-[(3фторфеніл)метил]-1H-піроло[2,3-b]піридин-2-карбоксамід Сполуку одержують аналогічно способу, описаному на стадії 15.3, взаємодією 0,197 г (0,46 ммоль) N-[2-амінопіридин-4-іл]-5-трифторметил-1-[(3-фторфеніл)метил]-1H-піроло[2,3b]піридин-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 15.2, з 0,179 г (0,92 ммоль) етил-3-бром-2-оксопропіоната в 5 мл ацетонітрилу. Одержують 130 мг необхідного продукту. 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,9 (с, 1H); 8,9 (с, 1H); 8,8 (с, 1H); 8,5 (м, 2H); 8,1 (с, 1H); 7,7 (с, 1H); 7,35 (м, 2H); 7,1 (м, 1H); 6,95 (м, 2H); 6,0 (с, 2H); 4,3 (кв, 2H); 1,3 (т, 3H). 18.2 N-[2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл]-5-трифторметил-1-[(3-фторфеніл)метил]1H-піроло[2,3-b]піридин-2-карбоксамід (сполука № 18) Сполуку № 18 одержували аналогічно способу, описаному на стадії 17.4, взаємодією 0,13 г (0,25 ммоль) N-[2-(етилоксикарбоніл)імідазо[1,2-a]піридин-7-іл]-5-трифторметил-1-[(3фторфеніл)метил]-1H-піроло[2,3-b]піридин-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 18.1, з 0,32 мл одномолярного розчину LiAlH4 в 4 мл тетрагідрофурану. Одержано 13 г необхідного продукту. tпл=238-240 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,8 (с, 1H); 8,85 (с, 1H); 8,8 (с, 1H); 8,45 (д, 1H); 8,0 (с, 1H); 7,7 (с, 1H); 7,65 (с, 1H); 7,35 (м, 1H); 7,2 (м, 1H); 7,05 (м, 1H); 6,95 (м, 2H); 6,0 (с, 2H); 5,15 (т, 1H); 4,55 (д, 2H). + РХ-МС: 484 ([M+Н] , Rt=1,13 хв). Приклад 19 (сполука № 19) N-(2-метилімідазо[1,2-a]піридин-7-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксамід Сполуку № 19 одержували аналогічно способу, описаному на стадії 10.2, взаємодією 0,12 г (0,32 ммоль) N-[2-амінопіридин-4-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 10.1, з 0,059 г (0,63 ммоль) 1-хлорпропан-2ону в 4 мл ацетонітрилу. Таким чином, одержано 50 мг необхідної сполуки. tпл: 267-268 °C 1 ЯМР H (ДМСО-D6), δ, (м.ч.): 10,6 (с, 1H); 8,4 (д, 1H); 7,95 (с, 1H); 7,6 (м, 3H); 7,45 (с, 1H); 7,35 (м, 1H); 7,2 (м, 2H); 7,05 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 2,3 (с, 3H). + РХ-МС: 417 ([M+Н] , Rt=1,2 хв). Приклад 20 (сполука № 20) N-(2-метилпіразоло[1,5-a]піримідин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2карбоксамід У пробірці, що витримує тиск, в інертній атмосфері при 20 °C змішують 80 мг (0,42 ммоль) йодиду міді, 0,4 г (1,40 ммоль) 5-фтор-1-[(3-фторфеніл)метил] 1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 1.2, 0,32 г (1,54 ммоль) 6-бром-2метилпіразоло[1,5-a]піримідину (WO 2006128693), 0,38 г (2,79 ммоль) карбонату калію і 10 мл діоксану. Суспензію дегазують протягом декількох хвилин, потім додають 0,053 мл (0,46 ммоль) транс-1,2-циклогександіаміну і закривають пробірку. Реакційну суміш перемішують протягом 15 годин при 110 °C. Після цього суспензію, охолоджену до кімнатної температури, виливають в 50 мл води і 50 мл етилацетату. Водний шар екстрагують етилацетатом 2 рази по 30 мл. Об'єднані органічні фракції сушать над сульфатом магнію і згущують при зниженому тиску. Одержану речовину розтирають в киплячій суміші 5 мл дихлорметану і 20 мл ізопропілового ефіру і потім відділяють фільтруванням в гарячому стані. Одержану тверду речовину очищають хроматографуванням на колонці з діоксидом кремнію, елююючи сумішшю н-гептану і етилацетату. Після висушування одержують 0,23 г необхідної сполуки у вигляді твердої речовини білого кольору. tпл: 267-268 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,8 (с, 1H); 9,4 (с, 1H); 8,7 (с, 1H); 7,65 (м, 2H); 7,5 (с, 1H); 7,35 (м, 1H); 7,2 (м, 1H); 7,05 (м, 1H); 6,95 (м, 2H);6,55 (с, 1H); 5,9 (с, 2H); 2,4 (с, 3H). + РХ-МС: 418 ([M+Н] , Rt=1,26 хв). 21 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 21 (сполука № 21) N-[2-(етилоксикарбоніл)імідазо[1,2-a]піридазин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1Hіндол-2-карбоксамід 21.1 Етил-6-бромімідазо[1,2-b]піридазин-2-карбоксилат До розчину 2,0 г (11,49 ммоль) 3-аміно-5-бромпіридазина в 200 мл абсолютного етанолу повільно додають 2,73 г (1,77 ммоль) етил-3-бром-2-оксопропіонату. Реакційну суміш нагрівають із зворотним холодильником протягом 18 годин. Після цього реакційну суміш охолоджують до кімнатної температури, осад, що утворився відділяють фільтруванням, промивають мінімальною кількістю етанолу і потім сушать в сушильному шафі при зниженому тиску. Одержують 1,33 г необхідного продукту. 1 ЯМР H (ДМСО-D6), δ, м.ч.: 8,9 (с, 1H); 8,2 (д, 1H); 7,55 (д, 1H); 4,3 (кв, 2H); 1,3 (т, 3H). + РХ-МС: 270 ([M+Н] , Rt=0,88 хв). 21.2 N-[2-(етилоксикарбоніл)імідазо[1,2-6]піридазин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1Hіндол-2-карбоксамід (сполука № 21) Сполуку № 21 одержували аналогічно способу, описаному в прикладі 20, взаємодією 0,4 г (1,40 ммоль) 5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 1.2, з 0,41 г (1,54 ммоль) етил-6-бромімідазо[1,2-b]піридазин-2карбоксилата, одержаного згідно з методикою, описаною на стадії 21.1, в присутності 80 мг (0,42 ммоль) йодиду міді, 0,38 г (2,79 ммоль) карбонату калію і 53 мг (0,46 ммоль) транс-1,2циклогександіаміну в 10 мл діоксану. Таким чином, одержано 20 мг необхідної сполуки. tпл: 267-268 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 11,6 (с, 1H); 8,7 (с, 1H); 8,2 (д, 1H); 7,9 (д, 1H); 7,65 (м, 3H); 7,35 (м, 1H); 7,25 (м, 1H); 7,05 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 4,35 (кв, 2H); 1,3 (т, 3H). + РХ-МС: 476 ([M+Н] , Rt=1,26 хв). Приклад 22 (сполука № 22) N-[2-(етилоксикарбоніл)імідазо[1,2-a]піридин-6-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол2-карбоксамід Сполуку № 22 одержували аналогічно способу, описаному на стадії 4.3, взаємодією 0,1 г (0,26 ммоль) N-[6-амінопіридин-3-іл]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 4.2, з 0,105 г (0,53 ммоль) етил-3-бром-2оксопропіоната в 4 мл ацетонітрилу. Одержано 0,05 г необхідної сполуки у вигляді твердої речовини білого кольору. tпл=242-245 °C 1 ЯМР H (ДМСО-D6), δ, (м.ч.): 10,8 (с, 1H); 10,55 (с, 1H); 8,8 (с, 1H); 7,8 (м, 2H); 7,65 (м, 2H); 7,55 (с, 1H); 7,35 (м, 1H); 7,2 (м, 1H); 7,05 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H); 4,4 (кв, 2H); 1,35 (т, 3H). + РХ-МС: 475 ([M+Н] , Rt=1,15 хв). Приклад 23 (сполука № 23) N-(2-метилімідазо[1,2-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксамід У пробірку місткістю 10 мл, що витримує тиск і призначену для мікрохвильового нагрівання, вносять 0,085 г (0,22 ммоль) N-[6-амінопіридин-3-іла]-5-фтор-1-[(3-фторфеніл)метил]-1H-індол2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 4.2, з 0,043 г (0,45 ммоль) 1хлорпропан-2-ону в 6 мл ацетонітрилу. Потім пробірку герметизують і нагрівають мікрохвилями при 150 °C протягом двох циклів по 1 год. Після цього реакційну суміш згущують досуха. Потім неочищений продукт реакції очищають хроматографуванням на колонці з силікагелем, елююючи сумішшю дихлорметану і метанолу. Таким чином, одержують 0,058 г необхідної сполуки у вигляді твердої речовини білого кольору. tпл: 200-203 °C 1 ЯМР H (ДМСО-D6), δ, м.ч.: 10,5 (с, 1H); 9,2 (с, 1H); 7,8 (с, 1H); 7,6 (м, 2H); 7,45 (м, 2H); 7,35 (м, 2H); 7,2 (м, 1H); 7,1 (м, 1H); 6, 9 (м, 2H); 5,9 (с, 2H); 2,3 (с, 3H). + РХ-МС: 417 ([M+Н] , Rt=1,05 хв). Приклад 24 (сполука № 24) N-([1,2,4]триазоло[1,5-a]піридин-6-іл)-5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксамід Сполуку № 24 одержували аналогічно способу, описаному в прикладі 20, взаємодією 0,5 г (1,75 ммоль) 5-фтор-1-[(3-фторфеніл)метил]-1H-індол-2-карбоксаміду, одержаного згідно з методикою, описаною на стадії 1.2, з 0,35 г (1,75 ммоль) 6-бром-[1,2,4]триазоло[1,5-a]піридин в присутності 99 мг (0,52 ммоль) йодиду міді, 0,48 г (3,49 ммоль) карбонату калію і 66 мг (0,58 ммоль) транс-1,2-циклогександіаміну в 15 мл діоксану. Таким чином, одержано 393 мг необхідної сполуки. tпл: 227-229 °C 22 UA 102088 C2 1 5 ЯМР H (ДМСО-D6), δ, м.ч.: 10,8 (с, 1H); 9,55 (с, 1H); 8,5 (с, 1H); 7,9 (с, 2H); 7,60 (м, 2H); 7,5 (с, 1H); 7,35 (м, 1H); 7,20 (м, 1H); 7,05 (м, 1H); 6,9 (м, 2H); 5,9 (с, 2H) + РХ-МС: 404 ([M+Н] , Rt=1,16 хв). Наведена далі табл. 1 наведена для пояснення хімічної структури і фізичних властивостей деяких сполук загальної формули (I) за даним винаходом. У даній таблиці: - в сполуках загальної формули (I) n дорівнює 1, а W=О; - в колонці "tпл, °C" наведені температури плавлення сполук в градусах Цельсію (°С); - сполуки являють собою сполуки у вигляді вільних основ. 10 Таблиця 1 № 1 2 3 4 5 6 7 X1, X2, X3, X4 CH, C-F, CH, CH CH, C-F, CH, CH CH, C-F, CH, CH CH, C-F, CH, CH CH, C-F, CH, CH CH, C-F, CH, CH CH, C-F, CH, CH Y 3-фторфеніл 3-фторфеніл 3-фторфеніл 3-фторфеніл 3-фторфеніл 3-фторфеніл 3-фторфеніл 8 CH, C-F, CH, CH 3-фторфеніл 9 10 11 12 13 CH, C-F, CH, CH CH, C-F, CH, CH CH, C-F, CH, CH CH, C-F, CH, CH CH, C-F, CH, CH CH, C-CF3, CH, CH CH, C-CF3, CH, N CH, C-CF3, CH, N CH, C-CF3, CH, CH CH, C-CF3, CH, N CH, C-F, CH, CH CH, C-F, CH, CH 14 15 16 17 18 19 20 tпл, °C 251-253 220-242 247-249 258-259 278-279 316-318 190-192 3-фторфеніл 3-фторфеніл 3-фторфеніл 3-фторфеніл 3-фторфеніл А 2,3-диметилімідазо[1,2-a]піридин-7-іл 2,3-диметилімідазо[1,2-a]піридин-6-іл 2- гідроксиметилімідазо[1,2-a]піридин-6-іл 3-метил-2-фенілімідазо[1,2-a]піридин-6-іл 2-етилімідазо[1,2-a]піридин-6-іл 2- тієн-2-илімідазо[1,2-a]піридин-6-іл 2- трет-бутилімідазо[1,2-a]піридин-6-іл 2-(метилоксиметил)імідазо[1,2-a]піридин7-іл 2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл 2-метил-3-фенілімідазо[1,2-a]піридин-7-іл 2- тієн-2-илімідазо[1,2-a]піридин-7-іл 2-етилімідазо[1,2-a]піридин-7-іл 2- трет-бутилімідазо[1,2-a]піридин-7-іл 3-фторфеніл 2,3-диметилімідазо[1,2-a]піридин-7-іл 280-281 3-фторфеніл 3-фторфеніл 2-етилімідазо[1,2-a]піридин-7-іл 2,3-диметилімідазо[1,2-a]піридин-7-іл 264-265 287-288 3-фторфеніл 2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл 254-255 3-фторфеніл 3-фторфеніл 3-фторфеніл 2-(гідроксиметил)імідазо[1,2-a]піридин-7-іл 2-метилімідазо[1,2-a]піридин-7-іл 2-метилпіразоло[1,5-a]піримідин-6-іл 2-етилоксикарбонілімідазо[1,2b]піридазин-6-іл 2-(етилоксикарбоніл)імідазо[1,2-a]піридин6-іл 2-метилімідазо[1,2-a]піридин-6-іл [1,2,4]триазоло[1,5-a]піридин-6-іл 238-240 267-268 267-268 21 CH, C-F, CH, CH 22 CH, C-F, CH, CH 20 25 3-фторфеніл 23 CH, C-F, CH, CH 24 CH, C-F, CH, CH 15 3-фторфеніл 3-фторфеніл 3-фторфеніл 215-216 244-245 305-307 259-260 158-159 327-328 267-268 242-245 200-203 227-229 Сполуки за даним винаходом були об'єктом фармакологічних випробувань in vitro і in vivo, які виявили їх перспективність як речовини з терапевтичною дією. Ці сполуки мають активність антагоністів або агоністів відносно рецепторів типу TRPV1 (або VR1). Випробування на інгібування струму, що викликається капсаїцином в DRG щура - Первинна культура клітин гангліїв дорсальних корінців (DRG) щура Нейрони DRG експресують рецептор TRPV1 природним шляхом. Первинні культури DRG новонароджених щурів одержували від щуренят у віці 1 день. Після розкриття ганглії обробляли трипсином і клітини механічно роз'єднували обережним розтиранням. Клітини ресуспендували в основному поживному середовищі Ігла, що містить 10 % ембріональної телячої сироватки, 25 мM KCl, 2 мM глутаміну, 100 мкг/мл гентаміцину і 50 нг/мл NGF, потім вміщували на скляні пластини, покриті ламініном (0,25·106 клітин на пластину), які потім вміщували в планшети Corning на 12 ямку. Клітини інкубували при 37 °C у вологій атмосфері, що містила 5 % CO2 і 95 % повітря. Цитозин- β -D-арабінозид (1 мкM) додавали через 48 год. після початку культивування для попередження розвитку клітин, що не були нейронними. Через 7-10 днів культивування пластини переміщували в експериментальні камери для досліджень по методу локальної фіксації потенціалу. 23 UA 102088 C2 5 10 15 20 25 - Електрофізіологічні дослідження Вимірювальні камери (об'єм 800 мкл), що містили клітинний препарат, вміщували на предметний столик інверсного мікроскопа (Olympus IMT2), оснащеного оптикою Hoffman (Modulation Contrast, Нью-Йорк), і здійснювали спостереження при 400-кратному збільшенні. У камерах безперервно здійснювали перфузію самопливом (2,5 мл/хв) за допомогою розподільника розчинів з 8 входами і одним виходом, що являв собою поліетиленову трубку (діаметр вільного перетину 500 мкм) і розміщеним на відстані менше за 3 мм від випробуваної клітини. Був використаний метод локальної фіксації потенціалу в конфігурації "ціла клітина". Піпетки з боросилікатного скла (опір 5-10 МОм) підводили до клітини за допомогою п'єзоелектричного 3-мірного мікроманіпулятора (Burleigh, PC1000). Значення загальних струмів (при постійному потенціалі на мембрані -60 мВ) записували з використанням підсилювача Axopatch 1D (Axon Instruments, Фостер-сіті, Каліфорнія), приєднаного до ПК, оснащеного програмою Pclamp8 (Axon Instrument). Зміни значень струму реєстрували на папері і одночасно переводили в цифрову форму (з частотою дискретизації від 15 до 25 Гц) і записували на жорсткий диск ПК. Введення розчину капсаїцину з концентрацією 300 нM викликає в клітинах DRG (при постійному напруженні -70 мВ) вхідний катіонний струм. Для мінімізації втрати чутливості рецепторів між двома введениями капсаїцину витримували інтервал не менше за одну хвилину. Після закінчення контрольного періоду (стабілізація відгуку тільки на капсаїцин) вводили тільки випробувані сполуки за даним винаходом із заданими концентраціями (концентрація 10 або 1 нM) протягом від 4 до 5 хвилин, протягом яких здійснювали декілька випробувань "капсаїцин + сполука" (досягнення максимального інгібування). Результати виражали як міра інгібування в процентах від контрольного відгуку на капсаїцин. Для випадку сполук-антагоністів VR1 міра інгібування відгуку на капсаїцин (1 мкM) для найбільш активних сполук за даним винаходом, перевірених при концентраціях від 0,1 до 100 нM, знаходиться в інтервалі від 20 до 100 %. Таким чином, вони є ефективними антагоністами рецепторов типу TRPV1. У табл. 2 наведено декілька прикладів міри інгібування, досягнутої із сполуками за даним винаходом. Таблиця 2 № сполуки 1 20 Міра інгібування в клітинах DRG, % 81,5 % (1 нM) 80 % (100 нM) 30 35 40 45 50 Таким чином, сполуки за даним винаходом можуть бути використані для одержання лікарських засобів, зокрема, для одержання лікарських засобів, призначених для профілактики або лікування патологій, в які залучені рецептори типу TRPV1. Сполуки за даним винаходом можуть володіти корисною дією для профілактики або лікування патологій, в які залучені рецептори типу TRPV1. Таким чином, об'єктами даного винаходу є лікарські засоби, що містять щонайменше одну сполуку формули (I) або фармацевтично прийнятну сіль або також гідрати або сольват згаданої сполуки. Такі лікарські засоби можуть знаходити застосування в терапії, зокрема, при профілактиці і/або лікуванні болю і запалення, хронічний болі, нейропатичного болю (травматичного, діабетичного, метаболічного, інфекційного, токсичного, викликаного протираковим лікуванням або ятрогенного), (остео)артритичного, ревматичного болю, фіброміалгії, болю в спині, болю, пов'язаного з раком, лицьової невралгії, головних болів, мігрені, зубного болю, болю при опіках, сонячних опіках, укусах або уколах, постгерпетичної невралгії, м'язвого болю, болю при стисканні нервів (центральної і/або периферичної нервової системи), травмах кісткового і/або головного мозку, ішемії (кісткового і/або головного мозку), нейродегенерації, судинних геморагічних пошкодженнях (кісткового і/або головного мозку), болю після інсульту. Сполуки за даним винаходом також можуть бути використані для профілактики і/або лікування метаболічних порушень, таких, як діабет. Сполуки за даним винаходом також можуть бути використані для профілактики і/або лікування урологічних порушень, таких, як гіперактивність сечового міхура, гіперрефлексія сечового міхура, нестабільність сечового міхура, нетримання сечі, ургентне нетримання сечі, везикальне нетримання сечі, цистит, ниркоподібна коліка, тазова гіперчутливість і тазовий біль. 24 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 Сполуки за даним винаходом можуть володіти корисною дією при профілактиці і/або лікуванні гінекологічних порушень, такій, як вульводинія, болі, пов'язані з сальпінгітом, дисменореєю. Такі сполуки можна також застосовувати для профілактики і/або лікування шлунковокишкових порушень, таких, як порушення шлунково-езофагеального рефлексу, виразка шлунка, виразка дванадцятипалої кишки, функціональна диспепсія, коліт, синдром подразнення товстої кишки (IBS), хвороба Крона, панкреатит, езофагіт, печінкова коліка. Також сполуки за даним винаходом можуть володіти корисною дією при профілактиці і/або лікуванні респіраторних порушень, таких, як астма, кашель, хронічне обструктивне захворювання легенів (COPD), спазм бронхів і запальні порушення дихальної системи. Такі сполуки також можуть бути використані для профілактики і/або лікування псоріазу, зуду, подразнень шкіри, очей або слизових оболонок, герпесу, оперізуючого лишаю. Сполуки за даним винаходом також можуть бути використані для лікування депресії. Сполуки за даним винаходом також можуть бути використані для лікування хвороб центральної нервової системи, таких, як розсіяний склероз. Сполуки за даним винаходом також можуть бути використані для лікування ракових захворювань. Даний винахід в одному з інших аспектів відноситься до фармацевтичних композицій, що містять як активну речовину щонайменше одну сполуку за даним винаходом. Такі фармацевтичні композиції містять ефективну дозу щонайменше однієї сполуки за даним винаходом або фармацевтично прийнятної солі, гідрату або сольвату згаданої сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт. Вказані ексципієнти вибирають відповідно до необхідних фармацевтичною формою і способом введення з традиційних ексципієнтів, відомих фахівцям в даній галузі техніки. Фармацевтичні композиції за даним винаходом можуть вводитися перорально, сублінгвально, підшкірно, внутрішньом'язово, внутрішньовенно, топічно, місцево, інтратрахеально, інтраназально, чрезшкірно або ректально. Такі композиції можуть вводитися в стандартній лікарській формі в суміші із звичайними фармацевтичними ексципієнтами. Вони призначені для введення тварині і людині для профілактики або лікування вказаних вище порушень або захворювань. Відповідні стандартні лікарські форми включають в себе форми для перорального введення, такі як таблетки, капсули з м'якою або твердою желатиновою оболонкою, порошки, гранули і розчини або суспензії для прийому всередину, форми для сублінгвального, трансбукального, інтратрахеального, інтраокулярного, інтраназального введення, шляхом інгаляції, форми для топічного, черезшкірного, підшкірного, внутрішньом'язового або внутрішньовенного введення, форми для ректального введення і імплантати. Для топічного нанесення сполуки за даним винаходом можна використати у вигляді кремів, гелей, мазей або лосьонів. Як приклад стандартна лікарська форма сполуки за даним винаходом в формі таблеток може містити наступні компоненти: сполука за даним винаходом 50,0 мг; 223,75 маніт мг; кроскармелоза натрію 6,0 мг; кукурудзяний крохмаль 15,0 мг; гідроксипропілметилцелюлоза 2,25 мг; стеарат магнію 3,0 мг. Вказані стандартні лікарські форми вводять для забезпечення введення добової дози в інтервалі від 0,001 до 30 мг активної речовини на один кг масу тіла відповідно до галенової форми. Можуть мати місце особливі випадки, в яких дози встановлюють збільшеними або зменшеними; такі дози також охоплює даний винахід. По прийнятій практиці відповідні дози для кожного хворого визначаються лікарем в залежності від способу введення, маси тіла і реакцій пацієнта. Даний винахід в одному з інших аспектів відноситься також до способу лікування вказаних вище патологій, який включає в себе введення пацієнту ефективної дози щонайменше однієї сполуки за даним винаходом або однієї з його фармацевтично прийнятних солей або гідратів, або сольватів. 25 UA 102088 C2 ФОРМУЛА ВИНАХОДУ 1. Сполука, відповідна загальній формулі (І): H X2 X3 X1 N N X4 A W (CH2)n Y 5 10 15 20 , (І) де: Х1, Х2, Х3 і Х4 незалежно один від одного являють собою атоми азоту або C-R1; при умові, що, коли один з членів Х1, Х2, Х3 і Х4 являє собою атом азоту, інші члени означають групи C-R1; W являє собою атом кисню або сірки; n дорівнює 0, 1, 2 або 3; Y означає арил або гетероарил, що містить при необхідності один або декілька замісників, вибраних з таких замісників, як атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкілС1-С3-алкілен, С1-С6-фторалкіл, гідрокси-, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкілС1-С6-алкілен-О-, С1-С6-фторалкокси-, ціаногрупа, C(O)NR3R4, нітрогрупа, NR3R4, С1-С6-тіоалкіл, меркаптогрупа, -S(О)-С1-С6-алкіл, -S(О)2-С1-С6-алкіл, SO2NR3R4, NR5C(O)R6, NR5SO2R7, C(O)NR3R4, OC(O)NR3R4, -Sі-(С1-С6-алкіл)3, -SF5, арил-С1-С5-алкілен або арил, гетероарил-С1С5-алкілен або гетероарил; причому групи С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С6алкілен-О- можуть містити як замісники гідрокси-, С1-С6-алкоксигрупу або NR3R4; причому арил і гетероарил при необхідності містять один або декілька однакових або різних замісників R8; А являє собою біциклічний гетероарил формули: Z2 Z3 25 30 35 40 45 Z1 Z8 N Z4 Z7 Z6 Z5 , де: Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю, атоми азоту або C-R2a; Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або С-R2b; Z8 означає атом вуглецю; причому не більше трьох членів з Z1, Z2, Z3, Z4, Z5, Z6 і Z7 являють собою атоми азоту; причому один з членів Z1, Z2, Z3, Z4 являє собою атом вуглецю, зв'язаний з атомом азоту аміду або тіоаміду формули (І); R1 вибраний з таких груп, як атом водню, атом галогену, С 1-С6-алкіл, С3-С7-циклоалкіл, С3-С7циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, арилоксі-С1-С6-алкіл, гетероарилоксі-С1-С6-алкіл, арил-С1-С3-алкіленоксі-С1-С6-алкіл, гетероарил-С1-С3-алкіленоксі-С1-С6-алкіл, арилтіо-С1-С6алкіл, гетероарилтіо-С1-С6-алкіл, арил-С1-С3-алкілентіо-С1-С6-алкіл, гетероарил-С1-С3алкілентіо-С1-С6-алкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3алкіленокси-, С1-С6-фторалкокси-, ціаногрупа, C(O)NR3R4, нітрогрупа, NR3R4, С1-С6-тіоалкіл, С3С7-циклоалкілтіо-, С3-С7-циклоалкіл-С1-С3-алкілентіогрупа, -S(O)С1-С6-алкіл, -S(О)-С3-С7циклоалкіл, -S(О)-С1-С3-алкілен-С3-С7-циклоалкіл, С1-С6-алкіл-S(О)2-, С1-С6-фторалкіл-S(О)2-, С3С7-циклоалкіл-S(О)2-, С3-С7-циклоалкіл-С1-С3-алкілен-S(О)2-, SO2NR3R4, (С1-С6-алкіл)3-Sі-, -SF5, NR5C(O)R6, NR5SO2R7, C(O)NR3R4, OC(O)NR3R4, арил, гетероарил, арил-С1-С5-алкілен, гетероарил-С1-С5-алкілен, арилокси-, арилтіо-, гетероарилокси- або гетероарилтіогрупа; причому гетероарил або арил при необхідності містять один або декілька однакових або різних замісників R8; R2a являє собою атом водню, атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С4-С7-циклоалкіл-С1-С3алкілен-О-, гідрокси-, меркапто-, С1-С6-фторалкоксигрупу; R2b являє собою атом водню, атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, гідрокси-, меркапто-, оксо-, тіо-, С3-С7циклоалкілокси-, С1-С6-фторалкокси-, С3-С7-циклоалкіл-С1-С3-алкіленоксигрупу, С1-С6-алкоксі 26 UA 102088 C2 5 10 15 20 25 30 35 40 45 50 55 С1-С3-алкілен, С3-С7-циклоалкілоксі-С1-С3-алкілен, С3-С7-циклоалкіл-С1-С3-алкіленоксі-С1-С3алкілен, С1-С6-алкіл-С(О)-О-С1-С3-алкілен, С1-С6-алкіл-С(О)-О-, С3-С7-циклоалкіл-С(О)-О-С1-С3алкілен, С3-С7-циклоалкіл-С(О)-О-, С1-С6-фторалкіл-С(О)-О-С1-С3-алкілен, С1-С6-фторалкілС(О)-О-, C(O)NR3R4, С(О)-О-С1-С6-алкіл, ціаногрупу, СНО, СО2Н, -С(О)-С1-С6-алкіл, -С(О)-С3-С7циклоалкіл, феніл або тієніл; причому групи С 1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С1-С6-фторалкокси-, С3-С7циклоалкіл-С1-С3-алкіленокси-, С1-С6-алкоксі-С1-С3-алкілен, С3-С7-циклоалкілоксі-С1-С3-алкілен, С3-С7-циклоалкіл-С1-С3-алкіленоксі-С1-С3-алкілен можуть містити як замісники гідрокси-, С1-С6алкоксигрупу або NR3R4; R3 і R4 незалежно один від одного являють собою атом водню або С 1-С6-алкіл, С3-С7циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С5-алкілен або арил, або R3 і R4 спільно з атомом азоту, з яким вони зв'язані, утворюють азетидин, піролідин, піперидин, азепін, морфолін, тіоморфолін, піперазин, гомопіперазин; причому NR3R4 містить при необхідності як замісник С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С6-алкілен, арил, гетероарил, арил-S(О)2-, С1-С6-алкіл-S(О)2-, С1-С6-фторалкіл-S(О)2-, С3-С7-циклоалкілS(О)2-, С3-С7-циклоалкіл-С1-С3-алкілен-S(О)2-, арил-С(О)-, С1-С6-алкіл-С(О)-, С3-С7-циклоалкілС(О)-, С3-С7-циклоалкіл-С1-С3-алкілен-С(О)-, С1-С6-фторалкіл-С(О)-, гідрокси-, С1-С6-алкілокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3-алкіленоксигрупу, С1-С6-фторалкіл, арилоксі-С1С6-алкілен, арилоксигрупу, гетероарилоксі-С1-С6-алкілен, гетероарилоксигрупу; R5 і R6 незалежно один від одного являють собою атом водню, С1-С6-алкіл, -С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С6-алкілен або арил; причому арил при необхідності має один або декілька замісників, вибраних з атома галогену, С1-С6-алкілу, С3-С7-циклоалкілу, С3-С7-циклоалкіл-С1-С3-алкілену, С1-С6-фторалкілу, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3С7-циклоалкіл-С1-С3-алкіленокси-, С1-С6-фторалкокси-, нітро- або ціаногрупи; або R5 і R6 спільно утворюють лактам, що складається з 4-7 членів і містить атом азоту і групу С(О), з якими вони зв'язані; R7 являє собою С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, арил-С1-С6алкілен або арил; причому арил при необхідності має один або декілька замісників, вибраних з атома галогену, С1-С6-алкілу, С3-С7-циклоалкілу, С3-С7-циклоалкіл-С1-С3-алкілену, С1-С6фторалкілу, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3-алкіленокси-, С1-С6фторалкокси-, нітро- або ціаногрупи; або R5 і R7 спільно утворюють сультам, що складається з 4-7 членів і містить атом азоту і групу S(O)2, з якими вони зв'язані; R8 являє собою атом галогену, С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3-алкіленокси-, С1-С6-фторалкокси-, нітро-, ціаногрупу, NR3R4, -С(О)-С1-С6-алкіл, -С(О)-С3-С7-циклоалкіл; причому групи С1-С6-алкіл, С3-С7-циклоалкіл, С3-С7-циклоалкіл-С1-С3-алкілен, С1-С6-фторалкіл, С1-С6-алкокси-, С3-С7-циклоалкілокси-, С3-С7-циклоалкіл-С1-С3-алкіленокси- можуть містити як замісники ОН, С1-С6-алкоксигрупу або NR3R4; причому один або декілька атомів сірки сполуки загальної формули (І) можуть знаходитися в окисленій формі; причому один або декілька атомів азоту сполуки загальної формули (І) можуть знаходитися в окисленій формі; або її основа або кислотно-адитивна сіль, а також гідрат або сольват. 2. Сполука формули (І) за п. 1, яка відрізняється тим, що Х1, Х2, Х3 і Х4, незалежно один від одного, являють собою C-R1; причому R1 має значення, визначені для загальної формули (І) за п. 1; або її основа або кислотно-адитивна сіль, а також гідрат або сольват. 3. Сполука формули (І) за п. 1, яка відрізняється тим, що Х1, Х2, Х3 являють собою C-R1, а Х4 означає атом азоту; причому R1 має значення, визначені для загальної формули (І) за п. 1; або її основа або кислотно-адитивна сіль, а також гідрат або сольват. 4. Сполука формули (І) за будь-яким з пп. 1-3, яка відрізняється тим, що R1 вибраний з атома водню, атомів галогенів або С1-С6-фторалкілу; або її основа або кислотно-адитивна сіль, а також гідрат або сольват. 5. Сполука формули (І) за будь-яким з пп. 1-4, яка відрізняється тим, що n дорівнює 1; або її основа або кислотно-адитивна сіль, а також гідрат або сольват. 6. Сполука формули (І) за будь-яким з пп. 1-5, яка відрізняється тим, що Y означає арил, що має при необхідності як замісники один або декілька атомів галогенів; або її основа або кислотно-адитивна сіль, а також гідрат або сольват. 27 UA 102088 C2 5 7. Сполука формули (І) за будь-яким з пп. 1-6, яка відрізняється тим, що W являє собою атом кисню; або її основа або кислотно-адитивна сіль, а також гідрат або сольват. 8. Сполука формули (І) за будь-яким з пп. 1-7, яка відрізняється тим, що А являє собою біциклічний гетероарил формули: Z2 Z3 10 15 Z1 Z8 N Z7 Z6 Z5 Z4 , де: Z1, Z2, Z3 і Z4 незалежно один від одного являють собою атоми вуглецю і атоми азоту; Z5, Z6 і Z7 незалежно один від одного являють собою атоми азоту або С-R2b; Z8 означає атом вуглецю; причому не більше двох членів з Z1, Z2, Z3, Z4, Z5, Z6 i Z7 являють собою атоми азоту; причому один з членів Z1, Z2, Z3 і Z4 являє собою атом вуглецю, зв'язаний з атомом азоту аміду або тіоаміду формули (І); R2b означає атом водню, C1-С6-алкіл, С(О)-О-С1-С6-алкіл, феніл або тієніл; причому C1-С6-алкіл може містити як замісники гідрокси- або C1-С6-алкоксигрупи; або її основа або кислотно-адитивна сіль, а також гідрат або сольват. 9. Сполука формули (І) за будь-яким з пп. 1-8, яка відрізняється тим, що А являє собою радикали: R2b N R2b N N N R2b , R2b N , N N 20 25 R2b N N N R2b R2b N , , R2b означає атом водню, С1-С6-алкіл, С(О)-О-С1-С6-алкіл, феніл або тієніл; причому С1-С6-алкіл може містити як замісники гідрокси- або С1-С6-алкоксигрупи; або її основа або кислотно-адитивна сіль, а також гідрат або сольват. 10. Сполука формули (І) за будь-яким з пп. 1-9, яка відрізняється тим, що А являє собою радикали: R2b N R2b N R2b 30 35 N N R2b N , , R2b означає атом водню, С1-С6-алкіл, феніл або тієніл; причому С1-С6-алкіли можуть містити як замісники гідрокси- або С1-С6-алкоксигрупи; або її основа або кислотно-адитивна сіль, а також гідрат або сольват. 11. Сполука формули (І) за будь-яким з пп. 1-8, яка відрізняється тим, що Х1, Х2, Х3 і Х4 незалежно один від одного являють собою C-R1 або Х1, Х2, Х3 являють собою CR1, а Х4 означає атом азоту; R1 вибраний з атома водню, атомів галогенів або С1-С6-фторалкілу; n дорівнює 1; Y означає арил, що має при необхідності як замісники один або декілька атомів галогенів; W являє собою атом кисню; А являє собою біциклічний гетероарил формули: 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAzabicyclic carboxamide derivatives, preparation thereof and therapeutic use thereof
Автори англійськоюDubois, Laurent, Evanno, Yannick, Leclerc, Odile, Malanda, Andre
Назва патенту російськоюПроизводные n-азабициклических карбоксамидов, их получение и применение в терапии
Автори російськоюДюбуа Лоран, Эванно Янник, Леклерк Одиль, Маланда Андрэ
МПК / Мітки
МПК: A61P 29/00, A61K 31/437, C07D 471/04, A61P 11/00, A61P 3/00
Мітки: карбоксамідів, похідні, терапії, n-азабіциклічних, застосування, одержання
Код посилання
<a href="https://ua.patents.su/33-102088-pokhidni-n-azabiciklichnikh-karboksamidiv-kh-oderzhannya-i-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні n-азабіциклічних карбоксамідів, їх одержання і застосування в терапії</a>