Похідні 4-арилморфолін-3-ону, спосіб їх одержання і їх застосування в терапії
Формула / Реферат
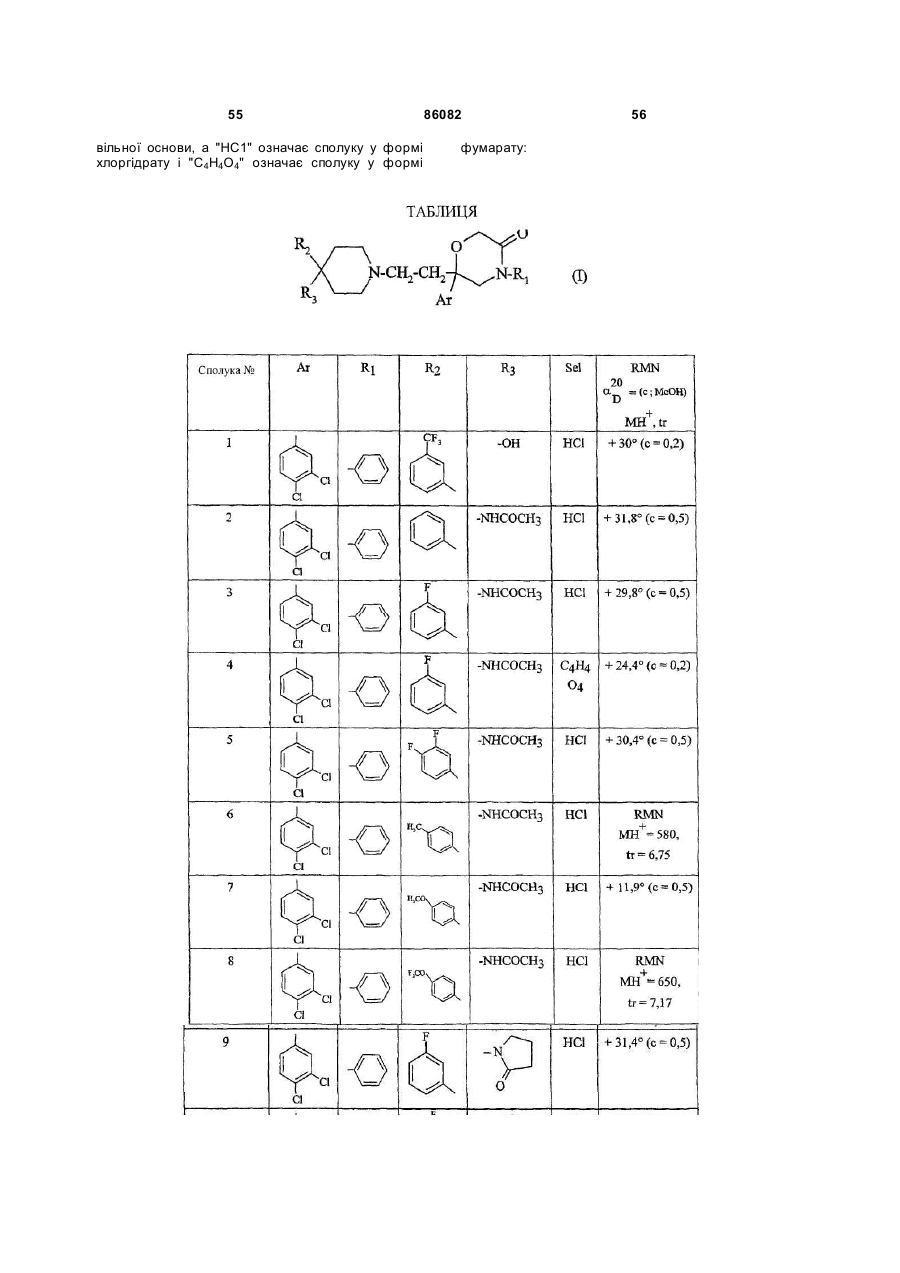
1. Сполука формули (І):
, (І)
в якій
Аr означає феніл, моно- або двозаміщений атомом галогену;
R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу або (С1-С4)алкокси;
R2 означає:
піридил;
феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси, трифторметильної групи, трифторметоксигрупи;
бензил, незаміщений або заміщений по фенілу один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси, трифторметильної групи, трифторметоксигрупи;
крім того, R2 може означати:
гетероциклічний радикал, вибраний з азетидину, піролідину, піперидину, морфоліну, тіоморфоліну або пергідроазепіну, якщо R3 означає ціано або групу CONR11R12;
R3 означає групу, вибрану з:
(1) атома водню;
(2) -(С1-С4)алкілу;
(3) -(С1-С4)алкілкарбонілу;
(4) ціано;
(5) -(CH2)q-OH;
(6) -(СН2)q-О-(С1-С4)алкілу;
(7) -(CH2)q-O-CO-R4;
(8) -(СН2)q-О-СО-NH-(С1-С4)алкілу;
(9) -NR5R6;
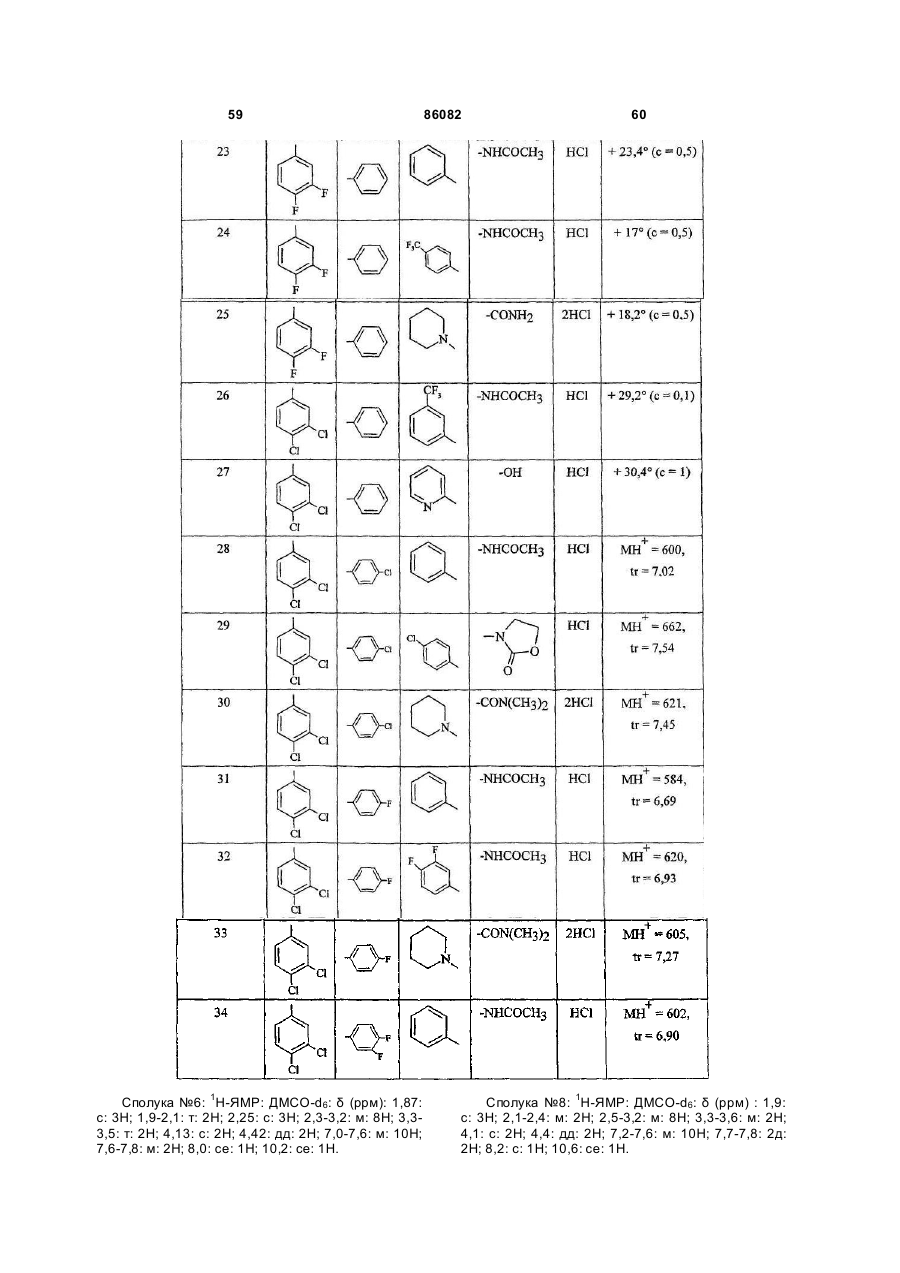
(10) -(CH2)q-NR7COR8;
(11) -(CH2)q-NR7COOR9;
(12) -(CH2)q-NR7SO2R10;
(13) -(CH2)q-NR7CONR11R12;
(14) -CH2NR13R14;
(15) -CH2-CH2NR13R14;
(16) -СООН-;
(17) -СОО-(С1-С4)алкілу;
(18) -CONR11R12;
(19) -CH2-COOH;
(20) -СН2-СОО-(С1-С4)алкілу;
(21) -CH2-CONR11R12;
(22) -O-CH2CH2OR15;
(23) -NR7COCOR16;
(24) -CONR7NR17R18;
(25) 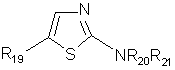 ;
;
(26) 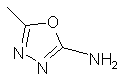 ;
;
q дорівнює 0, 1 або 2;
R4 означає (С1-С4)алкіл, (С3-С7)циклоалкіл, незаміщений або заміщений одним або декількома метилами; феніл; піридил;
кожний R5 і R6 незалежно означають атом водню або (С1-С4)алкіл; R6 може також означати (С3-С7)циклоалкілметил, бензил або феніл;
або R5 і R6 разом з атомом азоту, з яким вони зв'язані, утворюють гетероцикл, вибраний з азетидину, піролідину, піперидину, морфоліну, тіоморфоліну, пергідроазепіну або піперазину, незаміщеного або заміщеного в положенні 4 (С1-С4)алкілом;
R7 означає атом водню або (С1-С4)алкіл;
R8 означає атом водню; (С1-С4)алкіл; вініл; феніл: бензил; піридил; (С3-С7)циклоалкіл, незаміщений або заміщений одним або двома метилами; фурил; тієніл; піроліл; імідазоліл;
або R7 і R8 разом означають групу -(СН2)p-;
р дорівнює 3 або 4;
R9 означає (С1-С4)алкіл або феніл;
або R7 і R8 разом означають групу -(CH2)n-;
n дорівнює 2 або 3;
R10 означає (С1-С4)алкіл; аміно, вільний або заміщений одним або двома (С1-С4)алкілами; феніл, незаміщений або заміщений один або декілька разів замісником, вибраним з: атома галогену, (С1-С4)алкілу, трифторметилу, гідрокси, (С1-С4)алкокси, карбокси, (С1-С4)алкоксикарбонілу, (С1-С4)алкілкарбонілокси, ціано, нітро, аміно, незаміщеного або заміщеного від одного або двох (С1-С4)алкілами; причому вказані замісники є однаковими або різними;
кожний R11 і R12 незалежно означає водень або (С1-С4)алкіл; крім того, R12 може означати (С3-С7)циклоалкіл, (С3-С7)циклоалкілметил, гідрокси, (С1-С4)алкокси, бензил або феніл; або R11 і R12 разом з атомом азоту, з яким вони зв'язані, утворюють гетероцикл, вибраний з азетидину, піролідину, піперидину, морфоліну, тіоморфоліну або пергідроазепіну;
або R7 і RI2 означають разом групу -(СН2)m-;
m дорівнює 2 або 3;
кожний R13 і R14 незалежно означає атом водню або (С1-С4)алкіл;
крім того, R14 може означати (С3-С7)циклоалкілметил або бензил;
R15 означає атом водню; (С1-С4)алкіл; форміл; (С1-С4)алкілкарбоніл;
R16 означає (С1-С4)алкокси;
кожний R17 і R18 незалежно означає атом водню або (С1-С4)алкіл;
або R17 і R18 разом з атомом азоту, з яким вони зв'язані, утворюють гетероцикл, вибраний з піролідину, піперидину або морфоліну;
R19 означає атом водню або (С1-С4)алкіл;
кожний R20 і R21 незалежно означає атом водню або (С1-С4)алкіл;
крім того, R21 може означати форміл або (С3-С7)алкілкарбоніл;
у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що:
Аr означає феніл, двічі заміщений атомом галогену;
R1 означає феніл, незаміщений або заміщений один або два рази атомом галогену;
R2 означає:
піридил;
феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси, трифторметильної групи, трифторметоксигрупи;
крім того, R2 може означати гетероциклічний радикал, вибраний з азетидину, піролiдину, піперидину, морфоліну, тіоморфоліну або пергідроазетидину, якщо R3 означає групу -CONR11R12;
R3 означає групу, вибрану з:
(5) -(CH2)q-OH, в якій q дорівнює 0;
(10) -(CH2)q-NR7COR8, в якій q дорівнює 0;
(11) -(CH2)q-NR7COOR9, в якій q дорівнює 0;
(18) -CONR11R12;
причому R7, R8, R9, R11 і R12 такі, як визначені відносно сполуки формули (І) в пункті 1;
у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату.
3. Сполука формули (І) за п. 1, яка відрізняється тим, що:
Аr означає 3,4-дихлорфеніл або 3,4-дифторфеніл;
R1 означає феніл, 4-хлорфеніл, 4-фторфеніл, 3,4-дифторфеніл;
R2 означає:
піридин-2-іл;
феніл, 4-хлорфеніл, 3-фторфеніл, 4-фторфеніл, 3,4-дифторфеніл, 3-метилфеніл, 3,4-диметилфеніл, 4-метоксифеніл, 3-(трифторметил)феніл, 4-(трифторметил)феніл, 4-(трифторметокси)феніл;
крім того, R2 може означати піперидин-1-іл, якщо R3 означає групу -CONH2 або групу -CON(CH3)2;
R3 означає групу, вибрану з:
гідрокси;
![]() ;
;
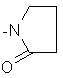 ;
;
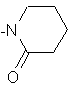 ;
;
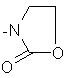 ;
;
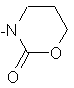 ;
;
![]() ;
;
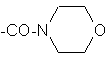 ;
;
![]() ;
;
у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату.
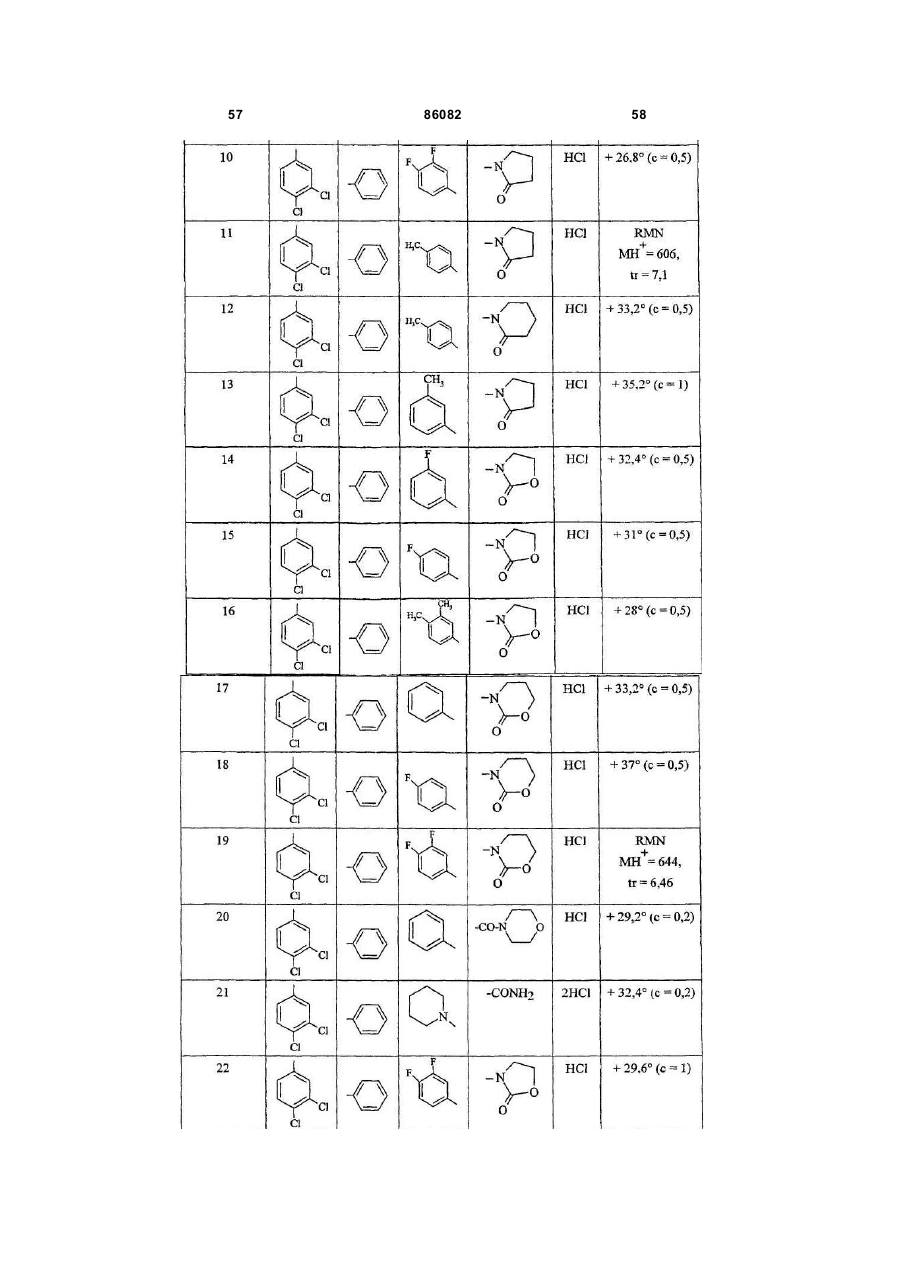
4. Сполука за п. 1 формули (І), вибрана з:
6-(3,4-дихлорфеніл)-6-[2-[4-гідрокси-4-[3-(трифторметил)феніл]піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-фенілпіперидин-4-іл]ацетамід, правообертаючий ізомер;
N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-(3-фторфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер;
N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-(3,4-дифторфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер;
N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-(4-метилфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер;
N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-(4-метоксифеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер;
N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-[4-(трифторметокси)феніл)]піперидин-4-іл]ацетамід, правообертаючий ізомер;
6-(3,4-дихлорфеніл)-6-[2-[4-(3-фторфеніл)-4-(2-оксопіролідин-1-іл)піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
6-(3,4-дихлорфеніл)-6-[2-[4-(3,4-дифторфеніл)-4-(2-оксопіролідин-1-іл)піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
6-(3,4-дихлорфеніл)-6-[2-[4-(4-метилфеніл)-4-(2-оксопіролідин-1-іл)піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
1'-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4'-(4-метилфеніл)-1-4'-біпіперидин-2-он, правообертаючий ізомер;
6-(3,4-дихлорфеніл)-6-[2-[4-(3-метилфеніл)-4-(2-оксопіролідин-1-іл)піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
6-(3,4-дихлорфеніл)-6-[2-[4-(3-фторфеніл)-4-(2-оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
6-(3,4-дихлорфеніл)-6-[2-[4-(4-фторфеніл)-4-(2-оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
6-(3,4-дихлорфеніл)-6-[2-[-4-(3,4-диметилфеніл)-4-(2-оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
3-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-фенілпіперидин-4-іл]-1,3-оксазинан-2-он, правообертаючий ізомер;
3-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-(4-фторфеніл)піперидин-4-іл]-1,3-оксазинан-2-он, правообертаючий ізомер;
3-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-(3,4-дифторфеніл)піперидин-4-іл]-1,3-оксазинан-2-он, правообертаючий ізомер;
6-(3,4-дихлорфеніл)-6-[2-[4-(морфолін-4-ілкарбоніл)-4-фенілпіперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
1'-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-1,4'-біпіперидин-4'-карбоксамід, правообертаючий ізомер;
6-(3,4-дихлорфеніл)-6-[2-[4-(3,4-дифторфеніл)-4-(2-оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
N-[1-[2-[2-(3,4-дифторфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-фенілпіперидин-4-іл]ацетамід, правообертаючий ізомер;
N-[1-[2-[2-(3,4-дифторфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-[4-(трифторметил)феніл]піперидин-4-іл]ацетамід, правообертаючий ізомер;
1'-[2-[2-(3,4-дифторфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-1,4'-біпіперидин-4'-карбоксамід, правообертаючий ізомер;
N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін-2-іл]етил]-4-[3-(трифторметил)феніл]піперидин-4-іл]ацетамід, правообертаючий ізомер;
6-(3,4-дихлорфеніл)-6-[2-(4-гідрокси-4-піридин-2-ілпіперидин-1-іл)етил]-4-фенілморфолін-3-он, правообертаючий ізомер;
N-[1-[2-[4-(4-хлорфеніл)-2-(3,4-дихлорфеніл)-5-оксоморфолін-2-іл]етил]-4-фенілпіперидин-4-іл]ацетамід;
4-(4-хлорфеніл)-6-[2-[4-(4-хлорфеніл)-4-(2-оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-6-(3,4-дихлорфеніл)морфолін-3-он;
1'-[2-[4-(4-хлорфеніл)-2-(3,4-дихлорфеніл)-5-оксоморфолін-2-іл]етил]-N,N-диметил-1,4'-біпіперидин-4'-карбоксамід;
N-[1-[2-[2-(3,4-дихлорфеніл)-4-(4-фторфеніл)-5-оксоморфолін-2-іл]етил]-4-фенілпіперидин-4-іл]ацетамід;
N-[1-[2-[2-(3,4-дихлорфеніл)-4-(4-фторфеніл)-5-оксоморфолін-2-іл]етил]-4-(3,4-дифторфеніл)піперидин-4-іл]ацетамід;
1'-[2-[2-(3,4-дихлорфеніл)-4-(4-фторфеніл)-5-оксоморфолін-2-іл]етил]-N,N-диметил-1,4'-біпіперидин-4'-карбоксамід;
N-[-[1-[2-[2-(3,4-дихлорфеніл)-4-(3,4-дифторфеніл)-5-оксоморфолін-2-іл]етил]-4-фенілпіперидин-4-іл]ацетамід;
у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату.
5. Сполука за п. 1 формули (І), яка являє собою N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксофенілморфолін-2-іл]етил]-4-(3-фторфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер;
у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату.
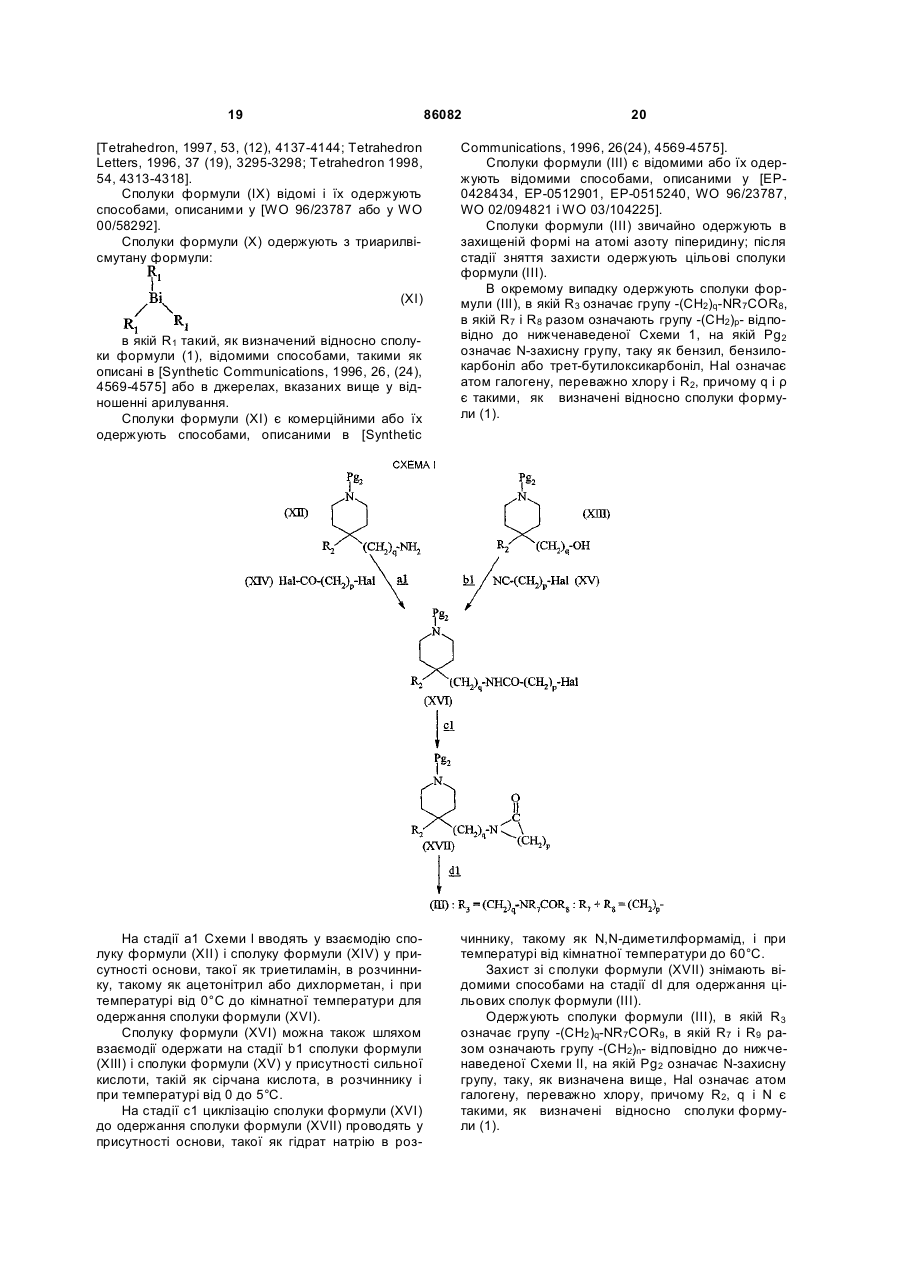
6. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-5, який відрізняється тим, що:
вводять у взаємодію сполуку формули:
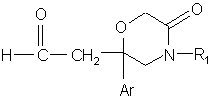 , (II)
, (II)
в якій Аr і R1 такі, як визначені відносно сполуки формули (І) в п. 1,
і сполуку формули
 , (III)
, (III)
в якій R2 і R3 такі, як визначені відносно сполуки формули (І) в п. 1, у присутності кислоти в розчиннику, потім відновлюють сіль імінію, що є проміжним продуктом, за допомогою відновника.
7. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-5, який відрізняється тим, що:
вводять у взаємодію сполуку формули:
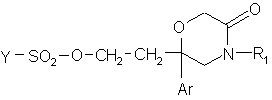 , (IV)
, (IV)
в якій Аr і R1 такі, як визначені відносно сполуки формули (І) в п. 1, і Y означає метильну, фенільну, толуольну або трифторметильну групу,
і сполуку формули
 , (III)
, (III)
в якій R2 і R3 такі, як визначені відносно сполуки формули (І).
8. Сполука формули:
 , (II)
, (II)
в якій:
Аr означає феніл, моно- або двозаміщений атомом галогену;
R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси.
9. Сполука формули:
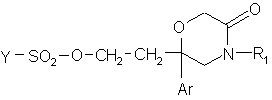 , (IV)
, (IV)
в якій:
Y означає метильну, фенільну, толуольну, трифторметильну групу;
Аr означає феніл, моно- або двозаміщений атомом галогену;
R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси.
10. Сполука формули:
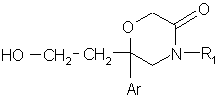 , (V)
, (V)
в якій:
Аr означає феніл, моно- або двозаміщений атомом галогену;
R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси.
11. Сполука формули:
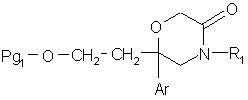 , (VI)
, (VI)
в якій:
Pg1 означає радикал тетрагідропіран-2-іл, бензоїл або (С1-С4)алкілкарбоніл; Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси.
12. Сполука формули:
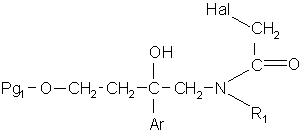 , (VII)
, (VII)
в якій:
Hal означає атом хлору або брому;
Pg1 означає радикал тетрагідропіран-2-іл, бензоїл або (С1-С4)алкілкарбоніл;
Аr означає феніл, моно- або двозаміщений атомом галогену;
R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси.
13. Сполука формули:
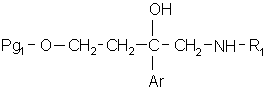 , (VIII)
, (VIII)
в якій:
Pg1 означає радикал тетрагідропіран-2-іл, бензоїл або (С1-С4)алкілкарбоніл;
Аr означає феніл, моно- або двозаміщений атомом галогену;
R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси.
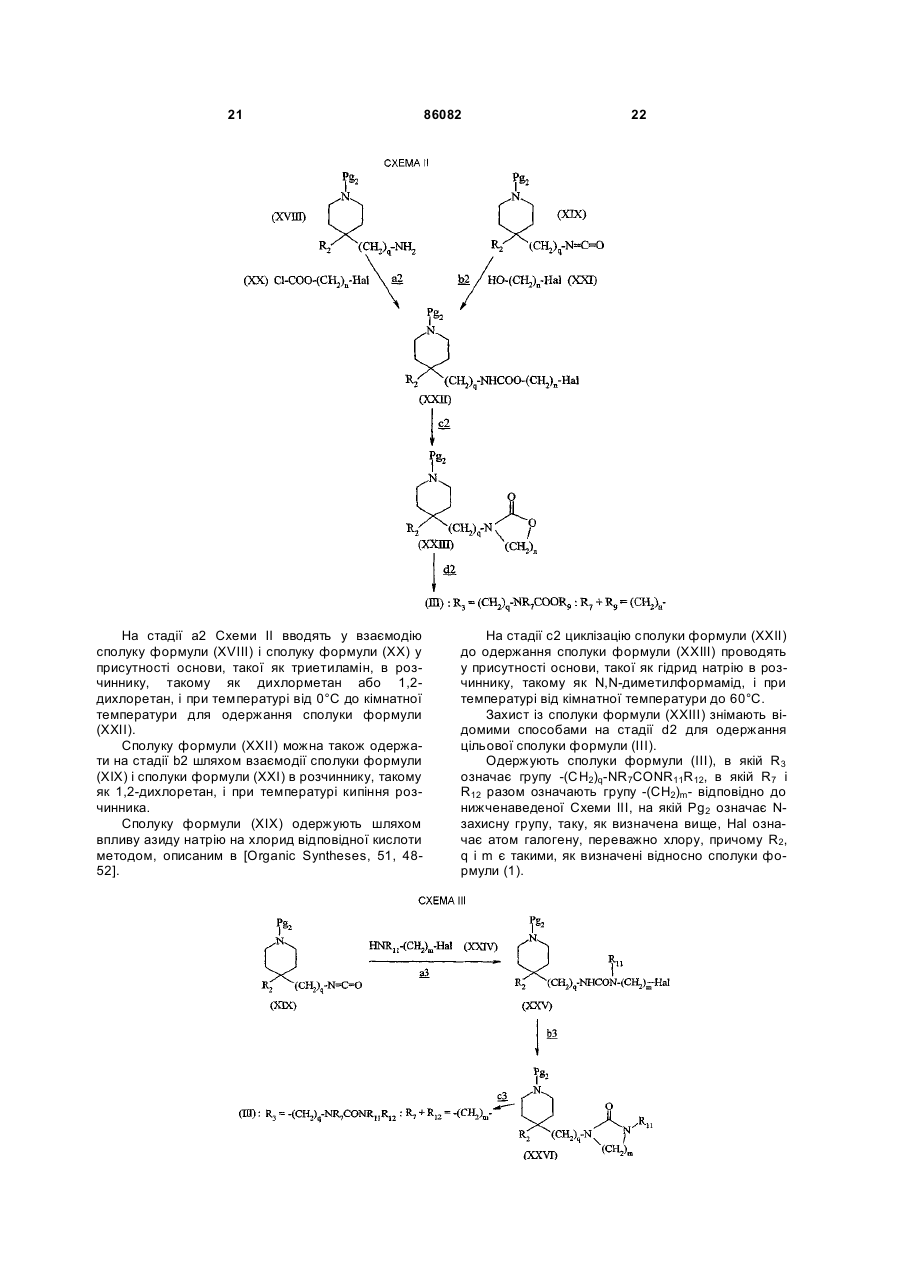
14. Сполука формули:
 , (III)
, (III)
в якій:
R2 означає:
піридил;
феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси, трифторметильної групи, групи трифторметокси;
бензил, незаміщений або заміщений на фенілі один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1-С4)алкокси, трифторметильної групи, трифторметоксигрупи;
R3 означає групу:
(11) -(CH2)q-NR7COOR9;
q дорівнює 0, 1 або 2;
R7 і R8 разом означають групу -(СН2)n-;
n дорівнює 2 або 3;
у формі основи або солі приєднання кислоти.
15. Лікарський засіб, який відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1-5 або сіль приєднання цієї сполуки і фармацевтично прийнятної кислоти, або гідрат, або сольват сполуки формули (І).
16. Фармацевтична композиція, яка відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1-5 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт.
17. Застосування сполуки формули (І) за будь-яким з пп. 1-5 для одержання лікарського засобу, призначеного для лікування або профілактики синдрому подразнення товстої кишки (IBS); фіброміалгії; невропатичних болів; синдрому хронічної втоми; мігрені; атипічних болів обличчя; хвороби Крона; виразкового коліту; запорів; діареї; шлунково-стравохідного рефлюксу, гастриту; панкреатиту; депресії; страху, такого як страх взагалі, страх, викликаний соціальними причинами, фобія і паніка; компульсивних нав'язливих станів; тиків; манії; біполярних порушень; шизофренія; шизоафективних порушень; порушень особистості; психотичних порушень, пов'язаних з дефіцитом уваги або гіперактивністю; порушень, пов'язаних із застосуванням препаратів, що спричиняють звикання; гіпертрофії простати.
Текст
1. Сполука формули (І): C2 2 (19) 1 3 незаміщеного або заміщеного в положенні 4 (С1С4)алкілом; R7 означає атом водню або (С1-С4)алкіл; R8 означає атом водню; (С1-С4)алкіл; вініл; феніл: бензил; піридил; (С3-С7)циклоалкіл, незаміщений або заміщений одним або двома метилами; фурил; тієніл; піроліл; імідазоліл; або R7 і R8 разом означають групу -(СН2)p -; р дорівнює 3 або 4; R9 означає (С1-С4)алкіл або феніл; або R7 і R8 разом означають групу -(CH2)n -; n дорівнює 2 або 3; R10 означає (С1-С4)алкіл; аміно, вільний або заміщений одним або двома (С1-С4)алкілами; феніл, незаміщений або заміщений один або декілька разів замісником, вибраним з: атома галогену, (С1С4)алкілу, трифторметилу, гідрокси, (С1С4)алкокси, карбокси, (С1-С4)алкоксикарбонілу, (С1-С4)алкілкарбонілокси, ціано, нітро, аміно, незаміщеного або заміщеного від одного або двох (С1-С4)алкілами; причому вказані замісники є однаковими або різними; кожний R11 і R12 незалежно означає водень або (С1-С4)алкіл; крім того, R12 може означати (С3С7)циклоалкіл, (С3-С7)циклоалкілметил, гідрокси, (С1-С4)алкокси, бензил або феніл; або R11 і R12 разом з атомом азоту, з яким вони зв'язані, утворюють гетероцикл, вибраний з азетидину, піролідину, піперидину, морфоліну, тіоморфоліну або пергідроазепіну; або R7 і RI2 означають разом групу -(СН2)m-; m дорівнює 2 або 3; кожний R13 і R14 незалежно означає атом водню або (С1-С4)алкіл; крім того, R14 може означати (С3С7)циклоалкілметил або бензил; R15 означає атом водню; (С1-С4)алкіл; форміл; (С1С4)алкілкарбоніл; R16 означає (С1-С4)алкокси; кожний R17 і R18 незалежно означає атом водню або (С1-С4)алкіл; або R17 і R18 разом з атомом азоту, з яким вони зв'язані, утворюють гетероцикл, вибраний з піролідину, піперидину або морфоліну; R19 означає атом водню або (С1-С4)алкіл; кожний R20 і R21 незалежно означає атом водню або (С1-С4)алкіл; крім того, R21 може означати форміл або (С3С7)алкілкарбоніл; у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату. 2. Сполука формули (І) за п.1, яка відрізняється тим, що: Аr означає феніл, двічі заміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази атомом галогену; R2 означає: піридил; феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1С4)алкокси, трифторметильної групи, трифторметоксигрупи; крім того, R2 може означати гетероциклічний ради 86082 4 кал, вибраний з азетидину, піролiдину, піперидину, морфоліну, тіоморфоліну або пергідроазетидину, якщо R3 означає групу -CONR11R12; R3 означає групу, вибрану з: (5) -(CH2)q-OH, в якій q дорівнює 0; (10) -(CH2)q-NR7COR8, в якій q дорівнює 0; (11) -(CH2)q-NR7COOR9, в якій q дорівнює 0; (18) -CONR11R12; причому R7, R8, R9, R11 і R12 такі, як визначені відносно сполуки формули (І) в пункті 1; у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату. 3. Сполука формули (І) за п.1, яка відрізняється тим, що: Аr означає 3,4-дихлорфеніл або 3,4-дифторфеніл; R1 означає феніл, 4-хлорфеніл, 4-фторфеніл, 3,4дифторфеніл; R2 означає: піридин-2-іл; феніл, 4-хлорфеніл, 3-фторфеніл, 4-фторфеніл, 3,4-дифторфеніл, 3-метилфеніл, 3,4диметилфеніл, 4-метоксифеніл, 3(трифторметил)феніл, 4-(трифторметил)феніл, 4(трифторметокси)феніл; крім того, R2 може означати піперидин-1-іл, якщо R3 означає групу -CONH2 або групу -CON(CH3)2 ; R3 означає групу, вибрану з: гідрокси; -NHCOCH3 -N -N O ; O ; -N -N O ; O O ; -CONH2 O -CO -N ; O -CON(CH ) 3 2; ; у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату. 4. Сполука за п.1 формули (І), вибрана з: 6-(3,4-дихлорфеніл)-6-[2-[4-гідрокси-4-[3(трифторметил)феніл]піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-фенілпіперидин-4іл]ацетамід, правообертаючий ізомер; N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(3фторфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер; N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(3,4дифторфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер; N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(4метилфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер; N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(4метоксифеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер; N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4 ; 5 фенілморфолін-2-іл]етил]-4-[4(трифторметокси)феніл)]піперидин-4-іл]ацетамід, правообертаючий ізомер; 6-(3,4-дихлорфеніл)-6-[2-[4-(3-фторфеніл)-4-(2оксопіролідин-1-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; 6-(3,4-дихлорфеніл)-6-[2-[4-(3,4-дифторфеніл)-4(2-оксопіролідин-1-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; 6-(3,4-дихлорфеніл)-6-[2-[4-(4-метилфеніл)-4-(2оксопіролідин-1-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; 1'-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4'-(4-метилфеніл)-1-4'біпіперидин-2-он, правообертаючий ізомер; 6-(3,4-дихлорфеніл)-6-[2-[4-(3-метилфеніл)-4-(2оксопіролідин-1-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; 6-(3,4-дихлорфеніл)-6-[2-[4-(3-фторфеніл)-4-(2оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; 6-(3,4-дихлорфеніл)-6-[2-[4-(4-фторфеніл)-4-(2оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; 6-(3,4-дихлорфеніл)-6-[2-[-4-(3,4-диметилфеніл)-4(2-оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; 3-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-фенілпіперидин-4-іл]1,3-оксазинан-2-он, правообертаючий ізомер; 3-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(4фторфеніл)піперидин-4-іл]-1,3-оксазинан-2-он, правообертаючий ізомер; 3-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(3,4дифторфеніл)піперидин-4-іл]-1,3-оксазинан-2-он, правообертаючий ізомер; 6-(3,4-дихлорфеніл)-6-[2-[4-(морфолін-4ілкарбоніл)-4-фенілпіперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; 1'-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-1,4'-біпіперидин-4'карбоксамід, правообертаючий ізомер; 6-(3,4-дихлорфеніл)-6-[2-[4-(3,4-дифторфеніл)-4(2-оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; N-[1-[2-[2-(3,4-дифторфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-фенілпіперидин-4іл]ацетамід, правообертаючий ізомер; N-[1-[2-[2-(3,4-дифторфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-[4(трифторметил)феніл]піперидин-4-іл]ацетамід, правообертаючий ізомер; 1'-[2-[2-(3,4-дифторфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-1,4'-біпіперидин-4'карбоксамід, правообертаючий ізомер; N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-[3(трифторметил)феніл]піперидин-4-іл]ацетамід, правообертаючий ізомер; 6-(3,4-дихлорфеніл)-6-[2-(4-гідрокси-4-піридин-2ілпіперидин-1-іл)етил]-4-фенілморфолін-3-он, правообертаючий ізомер; N-[1-[2-[4-(4-хлорфеніл)-2-(3,4-дихлорфеніл)-5 86082 6 оксоморфолін-2-іл]етил]-4-фенілпіперидин-4іл]ацетамід; 4-(4-хлорфеніл)-6-[2-[4-(4-хлорфеніл)-4-(2-оксо1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-6-(3,4дихлорфеніл)морфолін-3-он; 1'-[2-[4-(4-хлорфеніл)-2-(3,4-дихлорфеніл)-5оксоморфолін-2-іл]етил]-N,N-диметил-1,4'біпіперидин-4'-карбоксамід; N-[1-[2-[2-(3,4-дихлорфеніл)-4-(4-фторфеніл)-5оксоморфолін-2-іл]етил]-4-фенілпіперидин-4іл]ацетамід; N-[1-[2-[2-(3,4-дихлорфеніл)-4-(4-фторфеніл)-5оксоморфолін-2-іл]етил]-4-(3,4дифторфеніл)піперидин-4-іл]ацетамід; 1'-[2-[2-(3,4-дихлорфеніл)-4-(4-фторфеніл)-5оксоморфолін-2-іл]етил]-N,N-диметил-1,4'біпіперидин-4'-карбоксамід; N-[-[1-[2-[2-(3,4-дихлорфеніл)-4-(3,4-дифторфеніл)5-оксоморфолін-2-іл]етил]-4-фенілпіперидин-4іл]ацетамід; у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату. 5. Сполука за п.1 формули (І), яка являє собою N[1-[2-[2-(3,4-дихлорфеніл)-5-оксофенілморфолін-2іл]етил]-4-(3-фторфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер; у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату. 6. Спосіб одержання сполуки формули (І) за будьяким з пп.1-5, який відрізняється тим, що: вводять у взаємодію сполуку формули: O H C O O CH2 N R1 Ar , (II) в якій Аr і R1 такі, як визначені відносно сполуки формули (І) в п.1, і сполуку формули R2 NH R3 , (III) в якій R2 і R3 такі, як визначені відносно сполуки формули (І) в п.1, у присутності кислоти в розчиннику, потім відновлюють сіль імінію, що є проміжним продуктом, за допомогою відновника. 7. Спосіб одержання сполуки формули (І) за будьяким з пп.1-5, який відрізняється тим, що: вводять у взаємодію сполуку формули: O O Y SO2 O CH2 CH2 N R1 , (IV) в якій Аr і R1 такі, як визначені відносно сполуки формули (І) в п.1, і Y означає метильну, фенільну, толуольну або трифторметильну групу, і сполуку формули R2 NH R3 , (III) в якій R2 і R3 такі, як визначені відносно сполуки формули (І). 8. Сполука формули: Ar 7 O H C 86082 O O CH2 R1 N Ar , (II) в якій: Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси. 9. Сполука формули: O O Y SO2 O CH2 CH2 N R1 Ar , (IV) в якій: Y означає метильну, фенільну, толуольну, трифторметильну групу; Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси. 10. Сполука формули: O O HO N CH2 CH2 R1 Ar , (V) в якій: Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси. 11. Сполука формули: O O Pg1 O CH2 CH2 N R1 Ar , (VI) в якій: Pg1 означає радикал тетрагідропіран-2-іл, бензоїл або (С1-С4)алкілкарбоніл; Аr означає феніл, моноабо двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1С4)алкокси. 12. Сполука формули: Hal CH2 OH C O Pg 1 O CH2 CH2 C CH2 N Ar R1 , (VII) в якій: Hal означає атом хлору або брому; Pg1 означає радикал тетрагідропіран-2-іл, бензоїл або (С1-С4)алкілкарбоніл; Аr означає феніл, моно- або двозаміщений атомом 8 галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси. 13. Сполука формули: OH Pg1 O CH2 CH2 C CH2 NH R1 Ar , (VIII) в якій: Pg1 означає радикал тетрагідропіран-2-іл, бензоїл або (С1-С4)алкілкарбоніл; Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси. 14. Сполука формули: R2 R3 NH , (III) в якій: R2 означає: піридил; феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1С4)алкокси, трифторметильної групи, групи трифторметокси; бензил, незаміщений або заміщений на фенілі один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси, трифторметильної групи, трифторметоксигрупи; R3 означає групу: (11) -(CH2)q-NR7COOR9; q дорівнює 0, 1 або 2; R7 і R8 разом означають групу -(СН2 )n-; n дорівнює 2 або 3; у формі основи або солі приєднання кислоти. 15. Лікарський засіб, який відрізняється тим, що містить сполуку формули (І) за будь-яким з пп.1-5 або сіль приєднання цієї сполуки і фармацевтично прийнятної кислоти, або гідрат, або сольват сполуки формули (І). 16. Фармацевтична композиція, яка відрізняється тим, що містить сполуку формули (І) за будь-яким з пп.1-5 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт. 17. Застосування сполуки формули (І) за будьяким з пп.1-5 для одержання лікарського засобу, призначеного для лікування або профілактики синдрому подразнення товстої кишки (IBS); фіброміалгії; невропатичних болів; синдрому хронічної втоми; мігрені; атипічних болів обличчя; хвороби Крона; виразкового коліту; запорів; діареї; шлунково-стравохідного рефлюксу, гастриту; панкреатиту; депресії; страху, такого як страх взагалі, страх, викликаний соціальними причинами, фобія і паніка; компульсивних нав'язливих станів; тиків; манії; біполярних порушень; шизофренія; шизоа 9 86082 10 фективних порушень; порушень особистості; психотичних порушень, пов'язаних з дефіцитом уваги або гіперактивністю; порушень, пов'язаних із за стосуванням препаратів, що спричиняють звикання; гіпертрофії простати. Даний винахід стосується нових похідних 4арилморфолін-3-ону, їх одержання і їх застосування в терапії. Сполуки згідно з даним винаходом володіють дуже великою спорідненістю з людськими рецепторами NK2 нейрокініну А. Нейрокінін A (NRA) стосується групи нейропептидів, названих тахікінінами або нейрокінінами, яка включає в себе речовину Ρ (SP) і нейрокінін В (ΝΚΒ). Біологічна дія нейрокініну А, так само, як інших тахікінінів, опосередковано специфічними рецепторами сімейства рецепторів, що містять сім трансмембранних доменів, пов'язаних з білками G, які називають NK1, NK2 і NK3. Рецептор NK2 тахікінінів зв'язує нейрокінін А, тоді як рецептори ΝΚ1 і NK3 зв'язують відповідно речовину Ρ і нейрокінін В [Pennefather J.N. et al., Life Sci., 2004, 74, 14451463]. Рецептори NK2 тахікінінів широко представлені в периферичній нервовій системі, де вони опосередковують різноманітну дію нейрокініну А, специфічно і без обмеження в дихальній системі (бронхостеноз, кашель, запалення, гіперактивність бронхів...) [Joos G.F., Handb.Exp.Pharm., 2004, 164, 491-510, Advenier С. Et al., Eur.Respir.J., 1997, 10, 1892-1906], в шлунково-кишковому тракті (запалення, інфекція, рухова функція, біль) [Holzer Ρ, Handb Exp.Pharm., 2004, 164, 511-558] і в сечостатевій системі (гіперактивність сечового міхура, запалення, інфекція....) [Kiss S., et al. Neurosci Lett., 2001, 313, 57-60; Warner FJ. et al., Eur. J.Pharmacol., 2002, 438, 171-177]. Рецептор NK2 тахікінінів також представлений в головному мозку [Hagan R.M. et al., Regul. Pept., 1993, 46, 9-19; Steinberg R. Et al., Eur. J. Neurosci., 1998, 10, 23372345; Bensaid Μ et al., Neurosci. Lett., 2001, 303, 25-28; Saffroy M. et al., J.Neurochem., 2001, 79., 985-996; Saffroy M. et al., Neuroscience, 2003, 116, 761-773] і в спинному мозку [Yashpal K. Et al., Brain Res., 1990, 506, 59-266], де він опосередковує центральну (централізовану) дію нейрокініну А. Як приклади численні експериментальні дані показують, що блокування рецептора NK2 тахікінінів антагоністом може лікувати депресію [EmondsAlt, Handb Exp. Pharm., 2004, 219-244], а також функціональні порушення і болі в шлунковокишковому тракті, такі як синдром подразнення товстої кишки (IBS) [Emonds-Alt, Handb Exp. Pharm., 2004, 219-244; Lecci A. et al., Br.j.Pharmacol.. 2004, 141, 1249-1263]. У багатьох патентах і патентних заявках описані сполуки, що володіють активністю відносно рецепторів тахікінінів. Так, [міжнародна заявка WO 96/23787] стосується сполук формули А може означати двовалентний радикал -ОСН2-СО-; Am, m, AR1 і Τ мають різні значення. Сполуки (А) володіють спорідненістю, головним чином, з рецепторами NK1,NK2 або NK3 тахікінінів. [Заявка на патент ЕР-А-0776893] стосується сполук формули: (А) в якій, зокрема, (В) в якій, зокрема, D-E може означати двовалентний радикал -ОСН2-СН2-; L, G, Е, А, В, Ra і Rb мають різні значення. Сполуки (В) є антагоністами одночасно відносно рецепторів NK1 і рецепторів NK2 тахікінінів. [Заявка WO 00/34274] стосується похідних циклогексилпіперидину, які одночасно є антагоністами відносно рецепторів NK1 речовини Ρ і рецепторів ΝΚ2 нейрокініну А. [Заявка WO 02/094821] стосується похідних морфоліну, які одночасно є антагоністами відносно людських рецепторів ΝΚ1 і людських рецепторів ΝΚ3 тахікінінів. У цей час виявили нові сполуки, які володіють дуже високою спорідненістю з людськими рецепторами ΝΚ2 нейрокініну А і які є антагоністами цих рецепторів. Крім того, сполуки згідно з даним винаходом володіють високою біодоступністю при пероральному введенні і проходять через гематоенцефалічний бар'єр. Об'єктом даного винаходу є сполуки формули (I): (I) в якій Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу або (С1-С4)алкокси; R2 означає: піридил; феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1С4)алкокси, трифторметильної групи, трифторметокси групи; бензил, незаміщений або заміщений по фенілу один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1 11 86082 С4)алкілу, (С1-С4)алкокси, трифторметильної групи, трифторметокси групи; крім того, R2 може означати: гетероциклічний радикал, вибраний з азетидину, піролідину, піперидину, морфоліну, тіоморфоліну або пергідроазепіну, якщо R3 означає ціано або групу CONR11R12; R3 означає групу, вибрану з: (1) атома водню; (2) (С1-С4)алкілу; (3) (С1-С4)алкілкарбонілу; (4) ціано; (5) -(CH2)q-OH; (6) -(СН2)q-О-(С1-С4)алкілу; (7) -(CH2)q-O-CO-R4; (8) -(СН2)q-О-СО-NH-(С1-С4)алкілу; (9) -NR5R6; (10) -(CH2)q-NR7COR8; (11) -(CH2)q-NR7COOR9; (12) -(CH2)q-NR7SO2R10; (13) -(CH2)q-NR7CONR11R12; (14) -CH2NR13R14; (15) -CH2-CH2NR13R14; (16) -СООН-; (17) -СОО-(С1-С4)алкілу; (18) –CONR11R12; (19) -CH2-COOH; (20) -СН2-СОО-(С1-С4)алкілу; (21) -CH2-CONR11R12; (22) -O-CH2CH2OR15; (23) -NR7COCOR16; (24) -CONR7NR17R18; (25) ; (26) ; q дорівнює 0, 1 або 2; R4 означає (С1-С4)алкіл, (С3-С7)циклоалкіл, незаміщений або заміщений одним або декількома метилами; феніл; піридил; кожний R5 і R6 незалежно означають атом водню або (С1-С4)алкіл; R6 може також означати (С3С7)циклоалкілметил, бензил або феніл; або R5 і R6 разом з атомом азоту, з яким вони пов'язані, утворюють гетероцикл, вибраний з азетидину, піролідину, піперидину, морфоліну, тіоморфоліну, пергідроазепіну або піперазину, незаміщеного або заміщеного в положенні 4 (С1-С4)алкілом; R7 означає атом водню або (С1-С4)алкіл: R8 означає атом водню; (С1-С4)алкіл; вініл; феніл; бензил; піридил; (С3-С7)циклоалкіл, незаміщений або заміщений одним або двома метилами; фурил: тієніл; піроліл; імідазоліл; або R7 і R8 разом означають групу -(СН2)p -; p дорівнює 3 або 4; R9 означає (С1-С4)алкіл або феніл; або R7 і R8 разом означають групу -(СН2)n -; n дорівнює 2 або 3; R10 означає (С1-С4)алкіл; аміно, вільний або заміщений одним або двома (С1-С4)алкілами; феніл, незаміщений або заміщений один або декілька разів замісником, вибраним с: атома галогену, (С1С4)алкілу, трифторметила, гідрокси, (С1 12 С4)алкокси, карбокси, (С1-С4)алкоксикарбонілу, (С1-С4)алкіл карбоніл окси, ціано, нітро, аміно, вільного або заміщеного одного або двох (С1С4)алкілами; причому вказані замісники є однаковими або різними; кожний R11 і R12 незалежно означає водень або (С1-С4)алкіл; крім того R12 може означати (С3С7)циклоалкіл, (С3-С7)циклоалкілметил, гідрокси. (С1-С4)алкокси, бензил або феніл; або R11 і R12 разом з атомом азоту, з яким вони пов'язані, утворюють гетероцикл, вибраний з азетидину, піролідину, піперидину, морфоліну, тіоморфоліну або пергідроазепіну; або R7 і R12 означають разом групу -(СН2)m-, m дорівнює 2 або 3; кожний R13 і R14 незалежно означає атом водню або або (С1-С4)алкіл; крім того, R14 може означати (С3-С7)циклоалкілметил або бензил; R15 означає атом водню; (С1-С4)алкіл; форміл; (С1-С4)алкілкарбоніл; R16 означає (С1-С4)алкокси; кожний R17 і R18 незалежно означає атом водню або (С1-С4)алкіл; або R17 і R18 разом з атомом азоту, з яким вони пов'язані, утворюють гетероцикл, вибраний з піролідину, піперидину або морфоліну; R19 означає атом водню або (С1-С4)алкіл; кожний R20 і R21 незалежно означає атом водню або (С1-С4)алкіл; крім того, R21 може означати форміл або (С3-С7)алкілкарбоніл. Сполуки формули (1) можуть містити один або декілька асиметричних атомів вуглецю. Таким чином, вони можуть мати форму енантіомерів або діастеріоізомерів. Ці енантіомери, діастеріоізомери, а також їх суміші, включаючи рацемічні суміші, стосуються винаходу. Сполуки формули (1) можуть бути у вигляді основ або солей приєднання кислот. Такі солі приєднання стосуються винаходу. Ці солі переважно одержують з використанням фармацевтично прийнятних кислот, але солі інших кислот, придатних для очищення або виділення сполук формули (1), також стосуються винаходу. Сполуки формули (1) можуть також бути у формі гідратів або сольватів, а саме у вигляді асоціацій або комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати або сольвати також стосуються винаходу. Під атомом галогену розуміють атом брому, хлору, фтору або йоду. Під (С1-С4)алкілом розуміють лінійний або розгалужений алкільний радикал, що містить від одного до чотирьох атомів вуглецю, такий як радикал метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил. Під (С1-С4)алкокси розуміють лінійний або розгалужений алкокси радикал, що містить від одного до чотирьох атомів вуглецю, такий як радикал метокси, етокси, пропокси, ізопропокси, бутокси, ізобутокси, втор-бутокси, трет-бутокси. Під (С3-С7)циклоалкілом розуміють циклічну алкільну групу, що містить від трьох до семи атомів вуглецю, таку як циклопропільна, циклобутильна, циклопентильна, циклогексильна або циклогептильна. 13 Зі сполук формули (1), що є об'єктами винаходу, перша група сполук складається зі сполук, в яких: Аr означає феніл, двічі заміщений атомом галогену; і/або R1 означає феніл, незаміщений або заміщений один або два рази атомом галогену. і/або R2 означає: піридил; феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1С4)алкокси, трифторметильної групи, трифторметокси групи; крім того, R2 може означати гетероциклічний радикал, вибраний з азетидину, піролідину, піперидину, морфоліну, тіоморфоліну або пергідроазетидину, якщо R3 означає групу -CONR11R12; і/або R3 означає групу, вибрану з: (5) -(СН2)q-ОН, в якій q дорівнює 0; (10) -(CH2)q-NR7COR8, в якій q дорівнює 0; (11) -(CH2)q-NR7COOR9, в якій q дорівнює 0; (18) -CONR11R12; причому R7, R8, R9, R11 і R12 такі, як визначені відносно сполуки формули (1); у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату. Зі сполук цієї останньої групи можна назвати сполуки формули (1), в яких: Аr означає феніл, двічі заміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази атомом галогену; R2 означає: піридил; феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1С4)алкокси, трифторметильної групи, трифторметокси групи; крім того, R2 може означати гетероциклічний радикал, вибраний з азетидину, піролідину, піперидину, морфоліну. тіоморфоліну або пергідроазетидину, якщо R3 означає групу -CONR11R12; R3 означає групу, вибрану з: (5) -(CH2)q-OH, в якій q дорівнює 0: (10) -(CH2)q-NR7COR8, в якій q дорівнює 0; (11) -(CH2)q-NR7COOR9, в якій q дорівнює 0; (18) -CONR11R12; причому R7, R8, R9, R11 і R12 такі, як визначені відносно сполуки формули (1); у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату. З цих останніх сполук можна назвати сполуки формули (1), в яких: Аr означає 3,4-дихлорфеніл або 3,4дифторфеніл; R1 означає феніл, 4-хлорфеніл, 4-фторфеніл, 3,4-дифторфеніл: R2 означає: піридин-2-іл; феніл, 4-хлорфеніл, 3-фторфеніл, 4фторфеніл, 3,4-дифторфеніл, 3-метилфеніл, 3,4диметилфеніл, 4-метоксифеніл, 3(трифторметил)феніл, 4-(трифторметил)феніл, 4 86082 14 (трифторметокси)феніл; крім того, R2 може означати піперидин-1-іл, якщо R3 означає групу -CONH2 або групу – CONR11R12; R3 означає групу, вибрану з: гідрокси; у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату. Зі сполук формули (1), що є об'єктами винаходу, можна, зокрема, назвати наступні сполуки: -6-(3,4-дихлорфеніл)-6-[2-[4-гідрокси-4-[3(трифторметил)феніл]піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; -N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-фенілпіперидин-4іл]ацетамід, правообертаючий ізомер; -N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(3фторфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер; -N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(3,4дифторфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер; -N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(4метилфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер; -N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(4метоксифеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер; -N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-[4(трифторметокси)феніл)]піперидин-4-іл]ацетамід, правообертаючий ізомер; -6-(3,4-дихлорфеніл)-6-[2-[4-(3-фторфеніл)-4(2-оксопіролідин-1-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; -6-(3,4-дихлорфеніл)-6-[2-[4-(3,4дифторфеніл)-4-(2-оксопіролідин-1-іл)піперидин-1іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер; -6-(3,4-дихлорфеніл)-6-[2-[4-(4-метилфеніл)-4(2-оксопіролідин-1-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; -1'-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4'-(4-метилфеніл)-1-4'біпіперидин-2-он, правообертаючий ізомер; -6-(3,4-дихлорфеніл)-6-[2-[4-(3-метилфеніл)-4(2-оксопіролідин-1-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; -6-(3,4-дихлорфеніл)-6-[2-[4-(3-фторфеніл)-4 15 (2-оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; -6-(3,4-дихлорфеніл)-6-[2-[4-(4-фторфеніл)-4(2-оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; -6-(3,4-дихлорфеніл)-6-[2-[-4-(3,4диметилфеніл)-4-(2-оксо-1,3-оксазолідин-3іл)піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер; -3-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-фенілпіперидин-4-іл]1,3-оксазинан-2-он правообертаючий ізомер; -3-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(4фторфеніл)піперидин-4-іл]-1,3-оксазинан-2-он правообертаючий ізомер; -3-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(3,4дифторфеніл)піперидин-4-іл]-1,3-оксазинан-2-он, правообертаючий ізомер; -6-(3,4-дихлорфеніл)-6-[2-[4-(морфолін-4ілкарбоніл)-4-фенілпіперидин-1-іл]етил]-4фенілморфолін-3-он, правообертаючий ізомер; -1'-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-1,4'-біпіперидин-4'карбоксамід, правообертаючий ізомер; -6-(3,4-дихлорфеніл)-6-[2-[4-(3,4дифторфеніл)-4-(2-оксо-1,3-оксазолідин-3іл)піперидин-1-іл]етил]-4-фенілморфолін-3-он, правообертаючий ізомер; -N-[1-[2-[2-(3,4-дифторфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-фенілпіперидин-4іл]ацетамід, правообертаючий ізомер; -N-[1-[2-[2-(3,4-дифторфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-[4(трифторметил)феніл]піперидин-4-іл]ацетамід, правообертаючий ізомер; -1’-[2-[2-(3,4-дифторфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-1,4'-біпіперидин-4'карбоксамід, правообертаючий ізомер; -6-[1-[2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-[3(трифторметил)феніл]піперидин-4-іл]ацетамід, правообертаючий ізомер; -6-(3,4-дихлорфеніл)-6-[2-(4-гідрокси-4піридин-2-ілпіперидин-1-іл)етил]-4-фенілморфолін3-он, правообертаючий ізомер: -N-[1-[2-[4-(4-хлорфеніл)-2-(3,4-дихлорфеніл)5-оксо-морфолін-2-іл]етил]-4-фенілпіперидин-4іл]ацетамід; -4-(4-хлорфеніл)-6-[2-[4-(4-хлорфеніл)-4-(2оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]-6(3,4-дихлорфеніл)морфолін-3-он; -1’-[2-[4-(4-хлорфеніл)-2-(3,4-дихлорфеніл)-5оксо-морфолін-2-іл]етил]-N,N-диметил-1,4'біпіперидин-4'-карбоксамід; -N-[1-[2-[2-(3,4-дихлорфеніл)-4-(4-фторфеніл)5-оксо-морфолін-2-іл]етил]-4-фенілпіперидин-4-іл] ацетамід; -N-[1-[2-[2-(3,4-дихлорфеніл)-4-(4-фторфеніл)5-оксо-морфолін-2-іл]етил]-4-(3,4дифторфеніл)піперидин-4-іл]ацетамід; -1’-[2-[2-(3,4-дихлорфеніл)-4-(4-фторфеніл)-5оксо-морфолін-2-іл]етил]-N,N-диметил-1,4'біпіперидин-4'-карбоксамід; 86082 16 -N-[1-[2-[2-(3,4-дихлорфеніл)-4-(3,4дифторфеніл)-5-оксо-морфолін-2-іл]етил]-4фенілпіперидин-4-іл]ацетамід; у формі основи або солі приєднання кислоти, а також у формі гідрату або сольвату. Наступна сполука: -N-[1-[2-[2-(3,4-дихлорфеніл)-5-оксофенілморфолін-2-іл]етил]-4-(3фторфеніл)піперидин-4-іл]ацетамід, правообертаючий ізомер; у вигляді основи або солі приєднання кислоти, а також у формі гідрату або сольвату є переважним. Далі в тексті під захисною групою Pg мають на увазі групу, яка, з одного боку, забезпечує захист реакційноздатної функціональної групи, такої як гідроксигрупа або аміногрупа, в процесі синтезу, а з іншого боку, дозволяє регенерувати реакційноздатну функціональну групу в кінці синтезу. Приклади захисних груп, а також методи захисту і зняття захисту наведені у ["Protective Group in Organic Synthesis", Green et al., 2 nd Edition (John Wiley & Sons, Inc., New York), 1991]. Під групою, що видаляється, далі в тексті розуміють групу, яку можна легко відділити від молекули шляхом гетеролітичного розриву зв'язку з відділенням електронної пари. Цю групу можна також легко замінити іншою групою, наприклад, в процесі реакції заміщення. Такими групами, що видаляються, є, наприклад, галогени або активована гідрокси група, така як метансульфонат, бензолсульфонат, р-толуолсульфонат, трифталат, ацетат і т.д. Приклади груп, що видаляються, а також інформація про їх одержання наведені у ["Advanced in organic chemistry" J.MaRch, 3 nd Edition, Wiley Interscience, 1985, p.310-316]. Відповідно до винаходу можна одержувати сполуку формули (1) способом, який відрізняється наступним: вводять у взаємодію сполуку формули: (II) в якій Аr і R1 такі, як визначені відносно сполуки формули (1), і сполуку формули (III) в якій R2 і R3 такі, як визначені відносно сполуки формули (1), у присутності кислоти в розчиннику, потім відновлюють сіль імінію, що є проміжним продуктом, за допомогою відновника. Можливо, перетворюють сполуку формули (1) в одну з її солей приєднання кислоти. Реакцію проводять у присутності кислоти, такої як оцтова кислота, в розчиннику, такому як метанол або дихлорметан, при температурі від кімнатної температури до температури кипіння розчинника і одержують in situ проміжний імін, який відновлюють хімічним шляхом, використовуючи, наприклад, ціаноборгідрат натрію або триацетоксиборгідрат натрію, або каталітичним способом, використовуючи водень і каталізатор, такий як паладій на вугіллі або нікель Ренея. 17 86082 Відповідно до варіанту способу: вводять у взаємодію сполуку формули: (IV) в якій Аr і R1 такі, як визначені відносно сполуки формули (1), і Υ означає метильну, фенільну, толуольну або трифторметильну групу, і сполуку формули (III) в якій R2 і R3 такі, як визначені відносно сполуки формули (1). Можливо, перетворюють сполуку формули (1) в одну з її солей приєднання кислоти. Реакцію проводять у присутності розчинника, такого як Ν,Ν-диметилформамід, ацетонітрил, дихлорметан, толуол або пропан-2-ол і у присутності або за відсутності основи. Якщо використовують основу, її вибирають з органічних основ, таких як триетиламін, Ν,Ν-діізопропілетиламін або Νметилморфалін, або з карбонатів або бікарбонатів лужного металу, таких як карбонат калію, карбонат натрію або бікарбонат натрію. Якщо основу не використовують, реакцію проводять з використанням надмірної кількості сполуки формули (III) і у присутності йодиду лужного металу, такого як йодид калію або йодид натрію. Реакцію проводять при температурі від кімнатної температури до 100°С. Одержані сполуки формули (1) можна згодом відділити від реакційного середовища і очистити відомими способами, наприклад, кристалізацією або хроматографією. Сполуки формули (II) одержують шляхом окислення сполук формули: (V) в якій Аr і R1 такі, як визначені відносно сполуки формули (1). Реакцію окислення проводять з використанням, наприклад, оксалілхлориду, диметилсульфоксиду і триетиламіну в розчиннику, такому як дихлорметан і при температурі від -78°С до кімнатної температури. Сполуки формули (V) одержують шляхом зняття захисту зі сполук формули (VI) в якій Аr і R1 такі, як визначені відносно сполуки формули (1), і Pg1 означає відому О-захисну групу, таку, наприклад, як тетрагідропіран-2-іл, бензоїл або (С1-С4)алкіл карбоніл. Зняття захисту проводять традиційними способами, добре відомими фахівцеві. Наприклад, якщо Pg1 означає тетрагідропіран-2-ільну групу, зняття захисту здійснюють шляхом кислотного гідролізу з використанням соляної кислоти в розчиннику, такому як простий ефір, метанол або су 18 міш цих розчинників, або з використанням птолуолсульфонату піридинію в розчиннику, такому як метанол, або з використанням смоли Amberlyst® в розчиннику, такому як метанол. Реакцію проводять при температурі від кімнатної температури до температури кипіння розчинника. Якщо Pg1 означає бензоїльну групу або (С1С4)алкілкарбонільну групу, зняття захисту здійснюють шляхом гідролізу в лужному середовищі з використанням, наприклад, гідроксиду лужного металу, такого як гідроксид натрію, гідроксид калію або гідроксид літію, в розчиннику, такому як вода, метанол, етанол, діоксан або суміш цих розчинників при температурі від 0°С до температури кипіння розчинника. Сполуки формули (VI) одержують шляхом циклізації сполук формули (VII) в якій Аr і R1 такі, як визначені відносно сполуки формули (1), Pg1 такий, як визначений відносно сполуки формули (VI), і Hal означає атом галогену, переважно хлору або брому. Реакцію циклізації проводять у присутності основи, такої як третбутил калію, в розчиннику, такому як тетрагідрофуран, і при температурі від -60°С до температури навколишнього середовища. Сполуки формули (VII) одержують шляхом взаємодії сполуки формули (VIII) в якій Аr і R1 такі, як визначені відносно сполуки формули (1), і Pg1 такий, як визначений відносно сполуки формули (VI), зі сполукою формули НаІ'-СО-СН2-НаІ, в якій Hal і НаІ' означають атом галогену, переважно, хлору або брому, у присутності основи, такої як триетиламін, Nметилморфолін або піридин. Реакцію проводять в розчиннику, такому як дихлорметан, 1,2дихлоретан, тетрагідрофуран, діоксан або Ν,Νдиметилформамід при температурі від -70°С до температури навколишнього середовища. Сполуки формули (VIII) одержують шляхом взаємодії сполук формули (IX) в якій Аr і R1 такі, як визначені відносно сполуки формули (1), і Pg1 такий, як визначений відносно сполуки формули (VI), зі сполукою формули: (X) в якій R1 такий, як визначений відносно сполуки формули (1), у присутності дипівалоату міді (II) відповідно до способів арилування, описаних в 19 86082 [Tetrahedron, 1997, 53, (12), 4137-4144; Tetrahedron Letters, 1996, 37 (19), 3295-3298; Tetrahedron 1998, 54, 4313-4318]. Сполуки формули (IХ) відомі і їх одержують способами, описаними у [WO 96/23787 або у WO 00/58292]. Сполуки формули (X) одержують з триарилвісмутану формули: (XI) в якій R1 такий, як визначений відносно сполуки формули (1), відомими способами, такими як описані в [Synthetic Communications, 1996, 26, (24), 4569-4575] або в джерелах, вказаних вище у відношенні арилування. Сполуки формули (XI) є комерційними або їх одержують способами, описаними в [Synthetic На стадії а1 Схеми l вводять у взаємодію сполуку формули (XII) і сполуку формули (XIV) у присутності основи, такої як триетиламін, в розчиннику, такому як ацетонітрил або дихлорметан, і при температурі від 0°С до кімнатної температури для одержання сполуки формули (XVI). Сполуку формули (XVI) можна також шляхом взаємодії одержати на стадії b1 сполуки формули (XIII) і сполуки формули (XV) у присутності сильної кислоти, такій як сірчана кислота, в розчиннику і при температурі від 0 до 5°С. На стадії с1 циклізацію сполуки формули (XVI) до одержання сполуки формули (XVII) проводять у присутності основи, такої як гідрат натрію в роз 20 Communications, 1996, 26(24), 4569-4575]. Сполуки формули (III) є відомими або їх одержують відомими способами, описаними у [ЕР0428434, ЕР-0512901, ЕР-0515240, WO 96/23787, WO 02/094821 і WO 03/104225]. Сполуки формули (III) звичайно одержують в захищеній формі на атомі азоту піперидину; після стадії зняття захисти одержують цільові сполуки формули (III). В окремому випадку одержують сполуки формули (III), в якій R3 означає групу -(CH2)q-NR7COR8, в якій R7 і R8 разом означають групу -(СН2)p- відповідно до нижченаведеної Схеми 1, на якій Pg2 означає N-захисну групу, таку як бензил, бензилокарбоніл або трет-бутилоксикарбоніл, Hal означає атом галогену, переважно хлору і R2, причому q і ρ є такими, як визначені відносно сполуки формули (1). чиннику, такому як Ν,Ν-диметилформамід, і при температурі від кімнатної температури до 60°С. Захист зі сполуки формули (XVII) знімають відомими способами на стадії dl для одержання цільових сполук формули (III). Одержують сполуки формули (III), в якій R3 означає групу -(CH2 )q-NR7COR9, в якій R7 і R9 разом означають групу -(СН2)n- відповідно до нижченаведеної Схеми II, на якій Pg2 означає N-захисну групу, таку, як визначена вище, Hal означає атом галогену, переважно хлору, причому R2, q і N є такими, як визначені відносно сполуки формули (1). 21 На стадії а2 Схеми II вводять у взаємодію сполуку формули (XVIII) і сполуку формули (XX) у присутності основи, такої як триетиламін, в розчиннику, такому як дихлорметан або 1,2дихлоретан, і при температурі від 0°С до кімнатної температури для одержання сполуки формули (XXII). Сполуку формули (XXII) можна також одержати на стадії b2 шляхом взаємодії сполуки формули (XIX) і сполуки формули (XXI) в розчиннику, такому як 1,2-дихлоретан, і при температурі кипіння розчинника. Сполуку формули (XIX) одержують шляхом впливу азиду натрію на хлорид відповідної кислоти методом, описаним в [Organic Syntheses, 51, 4852]. 86082 22 На стадії с2 циклізацію сполуки формули (XXII) до одержання сполуки формули (XXIII) проводять у присутності основи, такої як гідрид натрію в розчиннику, такому як Ν,Ν-диметилформамід, і при температурі від кімнатної температури до 60°С. Захист із сполуки формули (XXIII) знімають відомими способами на стадії d2 для одержання цільової сполуки формули (III). Одержують сполуки формули (III), в якій R3 означає групу -(СН2)q-NR7CONR11R12, в якій R7 і R12 разом означають групу -(СН2)m- відповідно до нижченаведеної Схеми III, на якій Pg2 означає Nзахисну групу, таку, як визначена вище, Hal означає атом галогену, переважно хлору, причому R2, q і m є такими, як визначені відносно сполуки формули (1). 23 86082 На стадії а3 Схеми III вводять у взаємодію сполуку формули (XIX) і сполуку формули (XXIV) в розчиннику, такому як 1,2-дихлоретан, і при температурі від кімнатної температури до температури кипіння розчинника. На стадії b3 циклізацію сполуки формули (XXV) до одержання сполуки формули (XXVI) проводять у присутності основи, такої як гідрид натрію в розчиннику, такому як Ν,Ν-диметилформамід, і при температурі від кімнатної температури до 60°С. Захист зі сполуки формули (XXVI) знімають на стадії с3 відомими способами на стадії с3 для одержання цільових сполук формули (III). Сполуки формули (IV) одержують шляхом взаємодії сполуки формули (V) і сполуки формули: Y-SO2-Cl (XXVII) в якій Υ означає метильну, фенільну, толуольну або трифторметильну групу у присутності основи, такої як триетиламін, Ν,Ν-діізопропілетиламін або піридин в розчиннику, такому як дихлорметан або толуол, і при температурі від -20°С до температури кипіння розчинника. Відповідно до іншого аспекту, об'єктом винаходу також є сполуки формул (II), (IV), (V), (VI), (VII), (VIII) і деякі сполуки формули (III). Ці сполуки використовують як проміжні продукти при синтезі сполук формули (1). Таким чином об'єктом винаходу є сполуки формули: (II) в якій: Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену. (С1С4)алкілу, (С1-С4)алкокси. Об'єктом винаходу є сполуки формули: (IV) в якій: Υ означає метильну, фенільну, толуольну, трифторметильну групу; Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси. Об'єктом винаходу також є сполуки формули: (V) в якій: Аr означає феніл, моно- або двозаміщений атомом галогену; Ri означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1 24 С4)алкілу або (С1-С4)алкокси. Об'єктом винаходу також є сполуки формули: (VI) в якій: Pg1 означає радикал тетрагідропіран-2-іл, бензоїл або (С1-С4)алкілкарбоніл; Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси. Об'єктом винаходу також є сполуки формули: (VII) в якій: Hal означає атом хлору або брому; Pg1 означає радикал тетрагідропіран-2-іл, бензоїл або (С1-С4)алкілкарбоніл; Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси. Об'єктом винаходу також є сполуки формули: (VIII) в якій: Pg1 означає радикал тетрагідропіран-2-іл, бензоїл або (С1-С4)алкілкарбоніл; Аr означає феніл, моно- або двозаміщений атомом галогену; R1 означає феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси. Об'єктом винаходу також є сполуки формули: (III) в якій: R2 означає: піридил; феніл, незаміщений або заміщений один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1-С4)алкілу, (С1С4)алкокси, трифторметильної групи, групи трифторметокси; бензил, незаміщений або заміщений на фенілі один або два рази одним або двома замісниками, незалежно вибраними з атома галогену, (С1С4)алкілу, (С1-С4)алкокси, трифторметильної групи, трифторметокси групи; R3 означає групу: (11) -(CH2)q-NR7COOR9; q дорівнює 0, 1 або 2; 25 86082 R7 і R9 разом означають групу -(CH2 )n-; n дорівнює 2 або 3; у формі основи або солі приєднання кислоти. Розкладання рацемічних сумішей сполук формули (1) дозволяє виділяти енантіомери. Проте переважно провести розділення рацемічних сумішей сполук формули (IX) методами, описаними у [WO 96/23787 і у WO 00/58292]. Наступні приклади описують одержання ряду сполук згідно з винаходом. Ці приклади не мають обмежувального характеру і просто ілюструють винахід. Номери сполук, наведених у прикладах, відповідають номерам в нижченаведеній Таблиці (1), яка ілюструє хімічні структури і фізичні властивості ряду сполук згідно з винаходом. У приготуваннях і прикладах використовують наступні скорочення: Простий ефір: простий діетиловий ефір Простий ізо-ефір: простий діізопропіловий ефір DMSO: диметилсульфоксид DMF: Ν,Ν-диметилформамід THF: тетрагідрофуран DCM: дихлорметан ACOEt: етилацетат DIPEA: діізопропілетиламін TFA: трифтороцтова кислота ВОР: бензотриазол-1iлокситрис(диметиламіно)фосфонію гексафторфосфат Простий хлористоводневий ефір 2N: розчин 2N-соляної кислоти в простому діетиловому ефірі F: температура плавлення ТА: кімнатна температура (КТ) Еb: температура кипіння ВЕРХ: високоефективна рідинна хроматографія Двооксид кремнію Н: гель двооксиду кремнію 60 Н, що випускається фірмою Merck (DARMSTAD). Буферний розчин рН=2: розчин 16,66г KHSO4 і 32,32г K2SO4 в 1 літрі води. Спектри ядерного магнітного резонансу протону (ЯМР 1Н) зареєстровані при 200МГц в DMSOd6. Хімічні зсуви δ виражені в мільйонних частках (м.ч.). Для інтерпретації спектрів використовують наступні абревіатури: с-синглет, д-дублет, ттриплет, к-квадриплет, м-масив, мт-мультиплет, с.уш-уширений синглет, ддр-розв'язаний дублет. Сполуки згідно з винаходом аналізують комбінованим методом РХ/УФ/МС (рідинна хроматографія/УФ-детекція/мас-спектрометрія). Вимірюють молекулярний пік (МН+) і час втримування (tr) у хвилинах. Використовують колонку Symmetry С18, 2,1´50мм, 3,5мкм, при 30°С, витрата 0,4мл/хв. Елюент має наступний склад: Розчинник А: 0,005% трифтороцтової кислоти (TFA) у воді, рН 3,15; Розчинник В: 0,005% TFA в ацетонітрилі. Градієнт: Час (хв.) 0 10 %А 100 10 %в 0 90 26 15 16 20 10 100 100 90 0 0 УФ-детекцію проводять при l=210нМ і масдетекцію в режимі позитивної хімічної іонізації ESI. Приготування 1. Приготування сполук формули (X) Приготування 1.1 Біс(ацетато)трифенілвісмут У розчин 100г трифенілвісмутану в 720мл суміші DCM/THF (70/30об./об.) вводять краплями при КТ 56,6мл 32%-ного розчину пероцтової кислоти в оцтовій кислоті і перемішують протягом 2 годин при ТА. У реакційне середовище вводять 200мл простого ефіру, осад, що утворився, віджимають і промивають простим ефіром. Одержують 72,2г цільового продукту. Приготування 1.2 Біс(ацетато)три(4-хлорфеніл)вісмут А) Три(4-хлорфеніл)вісмутан У суміш 2,54г магнезію, покритого THF, вводять краплями і при ТА розчин 20г 1-бром-4хлорбензолу в 150мл THF і нагрівають зі зворотним холодильником протягом 1 години. Реакційну суміш охолоджують до 0°С, вводять краплями розчин 9,9г ВіСl3 в 50мл THF, нагрівають зі зворотним холодильником протягом 1 години і перемішують протягом ночі при КТ. Реакційну суміш виливають в 10%-ний водний розчин NH4Cl, насичений NaCl, фільтрують через Celite®, екстрагують за допомогою DCM, сушать органічну фазу над MgSO4 і випаровують розчинник у вакуумі. Одержують 15,5г цільового продукту. В) Біс(ацетато)три(4-хлорфеніл)вісмут У суміш 13г сполуки, одержаної на попередній стадії, в 250мл оцтової кислоти вводять при ТА 7,1г перборату натрію моногідрату і перемішують протягом 1 години при ТА. Реакційну суміш виливають в 500мл води, екстрагують DCM, промивають органічну фазу водою, сушать органічну фазу над MgSO4 і випаровують розчинник у вакуумі. Одержують 15,5г цільового продукту. Приготування 1.3 Біс(ацето)три(4-фторфеніл)вісмут А) Три(4-фторфеніл)вісмутан У суміш 5,6г магнезію, покритого THF, вводять краплями і при ТА розчин 40г 1-бром-4фторбензолу в 250мл THF і нагрівають зі зворотним холодильником протягом 1 години. Реакційну суміш охолоджують до 0°С, вводять краплями розчин 21,6г ВіСl3 в 100мл THF, нагрівають зі зворотним холодильником протягом 1 години і перемішують протягом ночі при ТА. Реакційну суміш виливають в 10%-ний водний розчин NH4Cl, насичений NaCl, фільтрують через Celite®, екстрагують за допомогою DCM, сушать органічну фазу над 27 MgSO4 і випаровують розчинник у вакуумі. Одержують 29,75г цільового продукту. В) Біс(ацетато)три(4-фторфеніл)вісмут У суміш 25г сполуки, одержаної на попередній стадії, в 100мл оцтової кислоти вводять 2,3г перборату натрію тетрагідрату і перемішують протягом 1 години при ТА. Реакційну суміш виливають на 1л води, екстрагують DCM, промивають органічну фазу водою, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 27,34г цільового продукту. Приготування 1.4 Біс(ацето)три(3,4-дифторфеніл)вісмут В) Три(3,4-дифторфеніл)вісмутан У суміш 2,5г магнію, покритого THF, вводять краплями і при ТА розчин 20г 1-бром-3,4дифторбензолу в 150мл THF і нагрівають зі зворотним холодильником протягом 1 години. Реакційну суміш охолоджують до 0°С, вводять краплями розчин 9,8г ВіСl3 в 50мл THF, нагрівають зі зворотним холодильником протягом 1 години і перемішують протягом ночі при КТ. Реакційну суміш виливають в 10%-ний водний розчин NH4CI, насичений NaCl, фільтрують через Celite®, екстрагують за допомогою DCM, сушать органічну фазу над MgSO4 і випаровують розчинник у вакуумі. Одержують 15,75г цільового продукту. В) Біс(ацетато)три(3,4-дифторфеніл)вісмут У суміш 13,5г сполуки, одержаної на попередній стадії, в 250мл оцтової кислоти вводять 7,4г перборату натрію моногідрату і перемішують протягом 1 години при КТ. Реакційну суміш виливають в 500мл води, екстрагують DCM, промивають органічну фазу водою, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 15,5г цільового продукту. 2. Приготування сполук формули (IX) Приготування 2.1 4-аміно-3-(3,4-дихлорфеніл)-3гідроксибутилбензоат, лівообертаючий ізомер. Цю сполуку одержують відповідно до методики, описаної на стадіях А, В, С, D, Ε і F Приготування 1.1 у [WO 00/58292]. Приготування 2.2 4-аміно-3-(3,4-дифторфеніл)-3гідроксибутилбензоат, лівообертаючий ізомер. Цю сполуку одержують відповідно до методики, описаної на стадії А Приготування 1.1 у [WO 96/23787]. Приготування 2.3 4-аміно-3-(3,4-дихлорфеніл)-3гідроксибутилбензоат. 86082 28 Цю сполуку одержують відповідно до методики, описаної на стадіях А, В, С, D і Ε Приготування 1.1 у [WO 00/58292]. 3. Приготування сполук формули (VIII) Приготування 3.1 4-аніліно-3-(3,4-дихлорфеніл)-3гідроксибутилбензоат, індивідуальний ізомер. A) Дипівалоат міді II. У суспензію 13,6г СuСО3×Сu(ОН)2 в 50мл води вводять краплями розчин 18,6г півалевої кислоти в 100мл гарячої води і перемішують до закінчення виділення газу. Реакційну суміш віджимають і осад промивають чотири рази водою. Осад обробляють 300мл THF, речовину, яка не розчинилась, відфільтровують і концентрують фільтрат у вакуумі. Після висушування у вакуумі одержують 7,2г цільового продукту. B) 4-аніліно-3-(3,4-дихлорфеніл)-3гідроксибутилбензоат, індивідуальний ізомер. Суміш 17,7г сполуки, одержаної при приготуванні 2.1, 30,7г сполуки, одержаної при приготуванні 1.1, і 1,25г сполуки, одержаної на попередній стадії, в 960мл DCM, перемішують протягом однієї ночі при КТ. Реакційну суміш концентрують досуха, залишок обробляють простим ефіром, речовину, яка не розчинилась, відфільтровують і фільтрат концентрують у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи DCM. Одержують 18,6г цільового продукту. Приготування 3.2 4-аніліно-3-(3,4-дифторфеніл)-3гідроксибутилбензоат, індивідуальний ізомер. У суміш 0,5г сполуки, одержаної при приготуванні 2.2, і 0,04г сполуки, одержаної на стадії А приготування 3.1, в 40мл DCM вводять при КТ 0,95г сполуки, одержаної при приготуванні 1.1, і перемішують при КТ протягом 1 години. Реакційну суміш підкисляють додаванням буфера, що має рН=2, нейтралізують до рН=7 10%-ним розчином Nа2СО3, речовину, яка не розчинилась, відфільтровують, декантують фільтрат, промивають органічну фазу водою. Сушать над Na2CO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі, елююючи DCM. Одержують 0,3г цільового продукту. Приготування 3.3 4-[(4-хлорфеніл)аміно]-3-(3,4-дихлорфеніл)-3гідроксибутилбензоат. 29 Суміш 15,5г сполуки, одержаної при приготуванні 1.2, 8,3г сполуки, одержаної при приготуванні 2.3, і 0,62г сполуки, одержаної на стадії А приготування 3.1, в 750мл DCM, перемішують протягом 18 годин при КТ. Реакційну суміш концентрують у вакуумі, залишок обробляють DCM, речовину, яка не розчинилась, відфільтровують і фільтрат піддають хроматографії на силікагелі, елююючи DCM. Одержують 4,62г цільового продукту. Приготування 3.4 3-(3,4-дихлорфеніл)-4-[(4-фторфеніл)аміно]-3гідроксибутилбензоат. Суміш 10г сполуки, одержаної при приготуванні 1.3, 5,78г сполуки, одержаної при приготуванні 2.3, і 0,43г сполуки, одержаної на стадії А приготування 3.1, в 500мл DCM, перемішують протягом 18 годин при КТ. Реакційну суміш концентрують у вакуумі, залишок обробляють DCM речовину, яка не розчинилась, відфільтровують і фільтрат піддають хроматографії на силікагелі, елююючи DCM. Одержують 5,84г цільового продукту. Приготування 3.5 3-(3,4-дихлорфеніл)-4-[(3,4дифторфеніл)аміно]-3-гідроксибутилбензоат. Суміш 15,5г сполуки, одержаної при приготуванні 1.4, 8,2г сполуки, одержаної при приготуванні 2.3, і 0,62г сполуки, одержаної на стадії А приготування 3.1, в 750мл DCM, перемішують протягом 18 годин при КТ. Концентрують у вакуумі, залишок обробляють DCM, речовину, яка не розчинилась, відфільтровують і фільтрат піддають хроматографії на силікагелі, елююючи DCM. Одержують 5,42г цільового продукту. 4. Приготування сполук формули (VII) Приготування 4.1 4-[(хлорацетил)(феніл)аміно]-3-(3,4дихлорфеніл)-3-гідроксибутилбензоат, лівообертаючий ізомер. У розчин 7,2г сполуки, одержаної при приготуванні 3.1, і 1,7г триетиламіну в 100мл DCM вводять при КТ 1,9г хлорацетилхлориду і перемішують при КТ протягом 1 години. Додають 0,19г хлорацетилхлориду і перемішують при КТ протягом 1 години. Реакційну суміш концентрують у вакуумі, залишок екстрагують за допомогою ACOEt, промивають органічну фазу буферним розчином, що має рН=2, водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 6,42г цільового продукту. α20D=-119,9°(c=1; MeOH). Приготування 4.2 4-[(хлорацетил)(феніл)аміно]-3-(3,4дифторфеніл)-3-гідроксибутилбензоат, індивідуа 86082 30 льний ізомер. Охолоджують до 0°С суміш 3,1г сполуки, одержаної при приготуванні 3.2, і 0,79г триетиламіну в 60мл DCM, вводять краплями розчин 0,88г хлорацетилхлориду в 10мл DCM і перемішують протягом 2 годин. Реакційну суміш концентрують у вакуумі, залишок екстрагують за допомогою ACOEt, промивають органічну фазу буферним розчином, що має рН=2, водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 3,5г цільового продукту. Приготування 4.3 4-[(хлорацетил)(4-хлорфеніл)аміно]-3-(3,4дихлорфеніл)-3-гідроксибутил-бензоат. У розчин 4,6г сполуки, одержаної при приготуванні 3.3, і 1г триетиламіну в 150мл DCM вводять 1,34г хлорацетилхлориду і перемішують при КТ протягом ночі. Реакційну суміш концентрують у вакуумі, залишок екстрагують за допомогою ACOEt, промивають органічну фазу буферним розчином, що має рН=2, водою, насиченим розчином NaCl, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 5,25г цільового продукту. Приготування 4.4 4-[(хлорацетил)(4-хлорфеніл)(4фторфеніл)аміно]-3-(3,4-дихлорфеніл)-3гідроксибутилбензоат. У суміш 8,5г сполуки, одержаної при приготуванні 3.4, і 2,64мл триетиламіну в 150мл DCM вводять 2,6г хлорацетилхлориду і перемішують при КТ протягом ночі. Реакційну суміш концентрують у вакуумі, залишок екстрагують за допомогою ACOEt, промивають органічну фазу буферним розчином, що має рН=2, водою, насиченим розчином NaCl, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 9,5г цільового продукту. Приготування 4.5 4-[(хлорацетил)(3,4-хлдифторфеніл)аміно]-3(3,4-дихлорфеніл)-3-гідроксибутилбензоат У суміш 5,4г сполуки, одержаної при приготуванні 3.5, і 1,17мл триетиламіну в 150мл DCM вводять 1,57г хлорацетилхлориду і перемішують при КТ протягом ночі. Концентрують у вакуумі, залишок екстрагують за допомогою ACOEt, промивають органічну фазу буферним розчином, що має рН=2, водою, насиченим розчином NaCl, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 6,23г цільового продукту. 31 5. Приготування сполук формули (VI) Приготування 5.1 2-[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етилбензоат, індивідуальний ізомер. Охолоджують до -60°С розчин 16г сполуки, одержаної при приготуванні 4.1 в 750мл THF, вводять 3,54г трет-бутилату калію, перемішують при поверненні температури до -30°С, потім перемішують протягом 30 хвилин при -30°С. Реакційну суміш виливають в заздалегідь охолоджений буферний розчин з рН=2, екстрагують за допомогою ACOEt, промивають органічну фазу водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 14,85г цільового продукту. Приготування 5.2 2-[2-(3,4-дифторфеніл)-5-оксо-4фенілморфолін-2-іл]етилбензоат, індивідуальний ізомер Охолоджують до -60°С розчин 3,5г сполуки, одержаної при приготуванні 4.2, в 120мл THF, вводять 1,75г трет-бутилату калію і перемішують протягом 1 години. Реакційну суміш виливають в буферний розчин з рН=2, екстрагують за допомогою ACOEt, промивають органічну фазу водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують цільовий продукт, який використовують як такий при Приготуванні 6.2. Приготування 5.3 2-[4-(4-хлорфеніл)-2-(3,4-дихлорфеніл)-5оксоморфолін-2-іл]етилбензоат. Охолоджують до -60°С розчин 1,28г третбутилату калію в 250мл THF. потім вводять краплями розчин 6,2г сполуки, одержаної при приготуванні 4.3, в 40мл THF, перемішують при поверненні температури до -30°С, потім перемішують протягом 1 години при -30(С. Реакційну суміш виливають в заздалегідь охолоджений буферний розчин з рН=2, екстрагують за допомогою ACOEt, промивають органічну фазу водою, потім насиченим розчином NaCl, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 5,8г цільового продукту. Приготування 5.4 2-[2-(3,4-дихлорфеніл)-4-(4-фторфеніл)-5оксоморфолін-2-іл]етилбензоат. Охолоджують до -60°С розчин 2г третбутилату калію в 450мл THF, потім вводять краплями розчин 9,5г сполуки, одержаної при приготуванні 4.4 в 40мл THF, перемішують, залишаючи 86082 32 температуру підійматись до -30°С, потім перемішують протягом 1 години при -30°С. Реакційну суміш виливають в заздалегідь охолоджений буферний розчин з рН=2, екстрагують за допомогою ACOEt, промивають органічну фазу водою, потім насиченим розчином NaCl, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 8,4г цільового продукту. Приготування 5.5 2-[2-(3,4-дихлорфеніл)-4-(3,4-дифторфеніл)-5оксоморфолін-2-іл]етил. Охолоджують до -60°С розчин 1,08г третбутилату в 250мл THF, потім вводять краплями розчин сполуки, одержаної при приготуванні 4.5 в 40мл THF, перемішують, дозволяючи температурі підійматись до -30°С, потім перемішують протягом 1 години при -30°С. Реакційну суміш виливають в заздалегідь охолоджений буферний розчин з рН=2, екстрагують за допомогою ACOEt, промивають органічну фазу водою, потім насиченим розчином NaCl, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 4,78г цільового продукту. 6. Приготування сполук формули (V) Приготування 6.1 6-(3,4-дихлорфеніл)-6-(2-гідроксіетил)-4фенілморфолін-3-он, правообертаючий ізомер. У розчин 14,5г сполуки, одержаної при приготуванні 5.1, в 100мл МеОН вводять при КТ 0,74г гідроксиду літію моногідрату і перемішують при КТ протягом 1 години. Реакційне середовище концентрують у вакуумі, залишок обробляють водою, екстрагують простим ефіром, промивають органічну фазу водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи DCM, потім градієнтом суміші DCM/MeOH до (98,5/1,5; об./об.). Одержують 9г цільового продукту. α20D=+96,6°(c=1; MeOH). Приготування 6.2 6-(3,4-дифторфеніл)-6-(2-гідроксіетил)-4фенілморфолін-3-он, індивідуальний ізомер. У розчин сполуки, одержаної при приготування 5.2, в 30мл МеОН вводять при КТ 3мл концентрованого розчину NaOH і перемішують при КТ протягом 1 години. Концентрують у вакуумі, залишок обробляють водою, екстрагують ACOEt, промивають органічну фазу водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи сумішшю DCM/MeOH (100/1; об./об.). Одержують 1,3г цільового продукту. 33 Приготування 6.3 6-(4-хлорфеніл)-6-(3,4-дихлорфеніл)-6-(2гідроксіетил)морфолін-3-он. У розчин 5,8г сполуки, одержаної при приготуванні 5.3, в 75мл МеОН вводять при КТ 0,48г гідроксиду літію моногідрату і 2мл води, потім перемішують при КТ протягом 3 годин. Реакційну суміш концентрують у вакуумі, залишок обробляють водою, екстрагують ефіром, промивають органічну фазу водою, потім насиченим розчином NaCl, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 4,7г цільового продукту. Приготування 6.4 6-(3,4-дихлорфеніл)-4-(4-фторфеніл)-6-(2гідроксіетил)морфолін-3-он. У розчин 8,4г сполуки, одержаної при приготуванні 5.4, в 75мл МеОН вводять 0,72г гідроксиду літію моногідрату і 2мл води і перемішують при КТ протягом 3 годин. Реакційну суміш концентрують у вакуумі, залишок обробляють водою, екстрагують ефіром, промивають органічну фазу водою, потім насиченим розчином NaCl, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 6,06г цільового продукту. Приготування 6.5 6-(3,4-дихлорфеніл)-4-(3,4-дифторфеніл)-6-(2гідроксіетил)морфолін-3-он. У розчин 4,75г сполуки, одержаної при приготуванні 5.5, в 75мл МеОН вводять 0,4г гідроксиду літію моногідрату і 2мл води, потім перемішують при КТ протягом 3 годин. Концентрують у вакуумі, залишок обробляють водою, екстрагують ефіром, промивають органічну фазу водою, потім насиченим розчином NaCl, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 3,8г цільового продукту. 7. Приготування сполук формули (II) Приготування 7.1 [2-(3,4-дихлорфеніл)-5-оксо-4-фенілморфолін2-іл]ацетальдегід, індивідуальний ізомер. Охолоджують до -60°С розчин 1,6г сполуки, одержаної при приготуванні 6.1 і 1,86мл DMSO в 40мл DCM, вводять краплями розчин 1,1г оксалілхлориду в 20мл DCM і перемішують протягом 2 годин при -60°С. Потім вводять 1,4г триетиламіну і перемішують при підйомі температури до КТ. Реакційну суміш промивають розчином НСI IN, водою, 86082 34 сушать органічну фазу над Na2SO4 і випаровують розчинник у вакуумі. Одержують 1,6г цільового продукту. Приготування 7.2 [2-(3,4-дифторфеніл)-5-оксо-4-фенілморфолін2-іл]ацетальдегід, індивідуальний ізомер. Охолоджують до -70°С розчин 1,14г оксалілхлориду в 20мл DCM, додають краплями розчин 1,5г сполуки, одержаної при Приготуванні 6.1, і 2,1мл DMSO в 40мл DCM, і перемішують протягом 3 годин при -70°С. Потім вводять 6,5г триетиламіну і перемішують при підйомі температури до КТ. Реакційну суміш промивають розчином НСI 2N, водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 1,4г цільового продукту. Приготування 7.3 [4-(4-[хлорфеніл)-2-(3,4-дихлорфеніл)-5оксоморфолін-2-іл]ацетальдегід. Охолоджують до -60°С розчин 2,05г оксалілхлориду в 80мл DCM, додають краплями розчин 2,5мл DMSO в 20мл DCM, потім краплями вводять розчин 4,7г сполуки, одержаної при Приготуванні 6.3, і 3,5мл DMSO в 40мл DCM, і перемішують протягом 1 години при -60°С. Потім вводять 10,1мл триетиламіну і перемішують при підйомі температури до КТ. Реакційну суміш промивають розчином НСI 1N, 10%-ним розчином Nа2СО3, насиченим розчином НСl, сушать над MgSO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі, елююючи DCM, потім градієнтом суміші DCM/MeOH від (99/1; об./об.) до (95/5; об./об.). Одержують 2,58г цільового продукту. Приготування 7.4 [2-(3,4-дихлорфеніл)-4-(4-фторфеніл)-5оксоморфолін-2-іл]ацетальдегід. Охолоджують до -60°С суміш 2,72мл оксалілхлориду в 80мл DCM, додають краплями розчин 3,32мл DMSO в 20мл DCM, потім краплями вводять розчин 6г сполуки, одержаної при Приготуванні 6.4 і 4,65мл DMSO в 40мл DCM, і перемішують протягом 1 години на холоді. Потім вводять 13,5мл триетиламіну і перемішують при підйомі температури до КТ. Реакційну суміш промивають розчином НСI IN, 10%-ним розчином Na2СО3, насиченим розчином НСl, сушать над MgSO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі, елююючи DCM, потім градієнтом суміші DCM/MeOH від (99/1; об./об.) до (95/5; об./об.). Одержують 3,68г цільового продукту. 35 Приготування 7.5 [2-(3,4-дихлорфеніл)-4-(3,4-дифторфеніл)-5оксоморфолін-2-іл]ацетальдегід. Охолоджують до -60°С розчин 1,65мл оксалілхлориду в 80мл DCM, додають краплями розчин 2мл DMSO в 20мл DCM, потім краплями вводять розчин 3,8г сполуки, одержаної при приготуванні 6.5, і 2,8мл DMSO в 40мл DCM, і перемішують протягом 1 години на холоді. Потім вводять 8,15мл триетиламіну і перемішують при підйомі температури до КТ. Реакційну суміш промивають розчином НСI 1N, 10%-ним розчином Na2CO3, насиченим розчином НСl, сушать над MgSO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі, елююючи градієнтом суміші DCM/МеОН від (99/1; об./об.) до (95/5; об./об.). Одержують 3г цільового продукту. 8. Приготування сполук формули (III) Приготування 8.1 N-(4-фенілпіперидин-4-іл)ацетамід. Цю сполуку одержують методом, описаним в [ЕР 474561]. Приготування 8.2 N-[4-(3-фторфеніл)піперидин-4-іл]ацетаміду форміат. А) 1-бензил-4-(3-фторфеніл)піперидин-4-ол. У суспензію 5,86г магнезію в 25мл THF повільно вводять розчин 42,16г 1-бром-3-фторбензолу в 100мл THF до досягнення, потім до підтримання кипіння THF і залишають на 1 годину при кипінні і при перемішуванні. Після охолоджування до КТ вводять краплями розчин 38г 1-бензол-4піперидинону в 175мл THF і нагрівають зі зворотним холодильником протягом 1 години. Після охолоджування до КТ реакційну суміш виливають на лід, екстрагують AcOEt, промивають органічну фазу водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 38г цільового продукту після кристалізації в циклогексані. В) N-[1-бензил-4-(3-фторфеніл)піперидин-4іл]ацетамід. У розчин 38г сполуки, одержаної на попередній стадії, в 152мл ацетонітрилу вводять краплями і при температурі нижче 30°С 133мл 95%-ного розчину H2SO4, потім перемішують протягом 3 годин при температурі від 25 до 30°С. Реакційну суміш виливають на лід, підлуговують додаванням концентрованого розчину NaOH, осад, який утворився, віджимають і промивають водою. Після висушування одержують 42,8г цільового продукту. С) N-[4-(3-фторфеніл)піперидин-4-іл]ацетаміду форміат. Залишають на 30 хвилин при 40°С, потім 1год. 30хв. при КТ суміш 14г сполуки, одержаної на по 86082 36 передній стадії, 16,32г форміату амонію і 2,3г 10%ного паладію на вугіллі в 100мл етанолу. Каталізатор фільтрують і фільтрат концентрують у вакуумі. Одержують 12г цільового продукту. Приготування 8.3 N-[4-(3,4-дифторфеніл)піперидин-4іл]ацетаміду форміат ол. А) 1-бензил-4-(3,4-дифторфеніл)піперидин-4 У суспензію 7,55г магнезію в 50мл THF вводять краплями розчин 50г 1-бром-3,4дифторбензолу в 100мл THF до досягнення, потім до підтримання кипіння THF і залишають на 2 години при кипінні зі зворотним холодильником і при перемішуванні. Після охолоджування до КТ вводять краплями розчин 49г 1-бензол-4піперидинону в 100мл THF і перемішують протягом ночі при КТ. Реакційну суміш виливають в насичений розчин NH4Cl, екстрагують ефіром, органічну фазу сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 38,3г цільового продукту після кристалізації в циклогексані. В) N-[1-бензил-4-(3,4-дифторфеніл)піперидин4-іл]ацетамід. У розчин 37г сполуки, одержаної на попередній стадії, в 140мл ацетонітрилу вводять краплями і при температурі нижче 30°С 120мл 95%-ного розчину H2SO4, потім перемішують протягом ночі при КТ. Реакційну суміш виливають на лід, підлуговують додаванням концентрованого розчину NaOH, екстрагують DCM, органічну фазу промивають водою, потім концентрованим розчином NaCl, сушать над Na2SO4 і випаровують розчинник у вакуумі. Після висушування одержують 42,8г цільового продукту. С) N-[4-(3,4-дифторфеніл)піперидин-4іл]ацетаміду форміат. Перемішують протягом 4 годин при КТ суміш 5г сполуки, одержаної на попередній стадії, 4,65г форміату амонію і 0,93г 10%-ного паладію на вугіллі в 100мл EtOH. Каталізатор фільтрують і фільтрат концентрують у вакуумі. Одержують 4,3г цільового продукту. Підготовка 8.4 N-[4-(4-метилфеніл)піперидин-4-іл]ацетаміду форміат. A) 1-бензил-4-(4-метилфеніл)піперидин-4-ол Цю сполуку одержують методом, описаним на стадії А) при підготовці 8.3 з 2,6г магнію в 15мл THF, 15г 1-бром-4-метилбензолу в 100мл THF і 16,6г 1-бензил-піперидинону в 100мл THF. Одержують 22,9 цільового продукту. B) N-[1-бензил-4-(4-метилфеніл)піперидин-4іл]ацетамід. У розчин 5,4г сполуки, одержаної на попередній стадії, в 30мл ацетонітрилу вводять краплями і при температурі нижче 30°С 19мл 95%-ного розчину H2SO4 і перемішують протягом ночі при КТ. Реакційну суміш виливають на лід, підлуговують 37 додаванням концентрованого розчину NaOH, осад, який утворився, віджимають. Одержують 4,51г цільового продукту. C) N-[4-(4-метилфеніл)піперидин-4іл]ацетаміду форміат. Охолоджують на крижаній бані суміш 3,5г сполуки, одержаної на попередній стадії і 2г форміату амонію в 80мл МеОН, вводять 0,06г 10%-ного паладію на вугіллі і перемішують протягом ночі при підйомі температури до КТ. Каталізатор фільтрують і фільтрат концентрують у вакуумі. Після висушування одержують 1,63г цільового продукту. Підготовка 8.5 N-[4-(4-метоксифеніл)піперидин-4-іл]ацетаміду форміат А) 1-бензил-4-(4-метоксифеніл)піперидин-4-ол Охолоджують до -78°С розчин 44,8г і-бром-4метоксибензолу в 700мл THF, вводять краплями 168мл розчину 1,6 Μ N-бутиллітію в гексані, потім перемішують протягом 30 хвилин при -78°С. Потім вводять краплями розчин 45,3г 1-бензол-4піперидинону в 100мл THF і перемішують протягом 2 годин при -78°С. Реакційну суміш виливають в 400мл насиченого розчину NH4CI, екстрагують ефіром, промивають органічну фазу водою, насиченим розчином NaCl, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 48,6г цільового продукту після кристалізації в гексані. B) N-[1-бензил-4-(4-метоксифеніл)піперидин-4іл]ацетамід. У розчин 48,6г сполуки, одержаної на попередній стадії, в 189мл ацетонітрилу вводять краплями і при температурі нижче 27°С 160мл 95%-ного розчину H2SO4, потім перемішують протягом 2 годин і залишають на ніч на холоді. Реакційну суміш виливають на лід, підлуговують 30%-ним розчином NaOH, осад, який утворився, віджимають і промивають водою. Одержують 49,4г цільового продукту, який використовують як такий. C) N-[4-(4-метоксифеніл)піперидин-4іл]ацетаміду форміат. Перемішують протягом ночі при КТ суміш 2,58г сполуки, одержаної на попередній стадії, 2,88г форміату амонію і 1,7г 10%-ного паладію на вугіллі в 60мл EtOH. Каталізатор фільтрують і фільтрат концентрують у вакуумі. Одержують 0,7г цільового продукту. Підготовка 8.6 N-[4-[4-(трифторметокси)феніл]піперидин-4іл]ацетаміду форміат. А) 1-бензил-4-[4(трифторметокси)феніл]піперидин-4-ол Цю сполуку одержують методом, описаним на стадії А) при підготовці 8.5, з 20г 1-бром-4(трифторметокси)бензолу в 300мл THF, 89,3мл розчину 1,6 Μ Ν-бутиллітію в гексані і 24,1мл 1бензил-4-піперидинону в 500мл THF. Одержують 18,5г цільового продукту. В) N-[1-бензил-4-[4(трифторметокси)феніл]піперидин-4-іл]ацетамід. 86082 38 У розчин 18,43г сполуки, одержаної на попередній стадії, в 61мл ацетонітрилу вводять краплями і при 25°С 120мл 95%-ного розчину H2SO4, потім перемішують протягом 3 годин. Реакційну суміш виливають на лід, підлуговують додаванням концентрованого розчину NaOH, екстрагують за допомогою ACOEt, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок обробляють ефіром і осад, що утворився, віджимають. Одержують 9,5г цільового продукту. С) N-[4-[4-(трифторметокси)феніл]піперидин-4іл]ацетаміду форміат. Перемішують протягом ночі при КТ суміш 2,75г сполуки, одержаної на попередній стадії, 1,97г форміату амонію 1,2г 10%-ного паладію на вугіллі в 50мл EtOH. Каталізатор фільтрують і фільтрат концентрують у вакуумі. Одержують 2г цільового продукту. Приготування 8.7 1-[4-(3-фторфеніл)піперидин-4-іл]піролідин 2он А) 1-бензил-4-(3-фторфеніл)піперидин-4-амін Нагрівають зі зворотним холодильником протягом 48 годин суміш 42,5г сполуки, одержаної на стадії В підготовки 8.2. і 250мл розчину НСI 2N. Вводять ще 100мл розчину НСI 4N і продовжують кип'ятіння зі зворотним холодильником протягом 72 годин. Після охолоджування до КТ реакційну суміш нейтралізують шляхом введення концентрованого розчину NaOH, екстрагують за допомогою ACOEt, промивають органічну фазу водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 37г цільового продукту. В) N-[1-бензил-4-(3-фторфеніл)піперидин-4-іл]4-хлорбутанамід Перемішують протягом 30 хвилин при КТ суміш 2,7г сполуки, одержаної на попередній стадії, і 1,32г триетиламіну в 100мл ацетонітрилу, потім вводять краплями 1,34г 4-хлорбутурилхлориду і перемішують 2 години при КТ. Концентрують у вакуумі, залишок обробляють водою, екстрагують AcOEt, сушать органічну фазу над MgSO4 і випаровують розчинник у вакуумі. Одержують 3г цільового продукту. С) 1-[1-бензил-4-(3-фторфеніл)піперидин-4іл]піролідин-2-он. Перемішують протягом 2 годин при КТ суміш 3г сполуки, одержаної на попередній стадії, і 0,617г 60%-ного гідриду натрію в олії в 60мл DMF. У реакційну суміш вводять воду, екстрагують AcOEt, сушать органічну фазу над Na2SO4 і випаровують розчинник у вакуумі. Одержують 2,65г цільового продукту. D) 1-[4-(3-фторфеніл)піперидин-4-іл]піролідин 2-он Перемішують протягом ночі при КТ суміш 2,65г сполуки, одержаної на попередній стадії, 1,43г форміату амонію і 1,2г 10%-ного паладію на вугіллі в 50мл EtOH. Каталізатор фільтрують і фільтрат 39 концентрують у вакуумі. Залишок обробляють 10%-ним розчином Na2СО3, екстрагують AcOEt, сушать органічну фазу над Na2SO4 і випаровують розчинник у вакуумі. Одержують 1,6г цільового продукту після кристалізації з ефіру. Підготовка 8.8 1-[4-(3,4-дифторфеніл)піперидин-4іл]піролідин 2-он А) 1-бензил-4-(3,4-дифторфеніл)піперидин-4амін Кип'ятять зі зворотним холодильником протягом 48 годин суміш 14,55г сполуки, одержаної на стадії В підготовки 8.3, і 100мл 8%-ного розчину НСl. Реакційну суміш концентрують у вакуумі, залишок обробляють простим ефіром і осад, що утворився, віджимають. Залишок обробляють 10%-ним розчином Nа2СО3, екстрагують DCM, сушать органічну фазу над Na2SO4 і випаровують розчинник у вакуумі. Одержують 10,75г цільового продукту. В) N-[1-бензил-4-(3,4-дифторфеніл)піперидин4-іл]-4-хлорбутанамід Перемішують протягом 30 хвилин при КТ суміш 3,11г сполуки, одержаної на попередній стадії, і 1,43г триетиламіну в 50мл ацетонітрилу, потім вводять краплями 1,16г 4-хлорбутирилхлориду і перемішують 5 годин при КТ. Концентрують у вакуумі, залишок екстрагують AcOEt, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 3,73г цільового продукту. С) 1-[1-бензил-4-(3,4-дифторфеніл)піперидин4-іл]піролідин-2-он. Перемішують протягом 30 хвилин при КТ суміш 3,73г сполуки, одержаної на попередній стадії, і 0,73г 60%-ного гідриду натрію в олії в 60мл DMF. У реакційну суміш вводять воду, екстрагують AcOEt, сушать органічну фазу над Na2SO4 і випаровують розчинник у вакуумі. Одержують 3,7г цільового продукту у вигляді олії оранжевого кольору. D) 1-[4-(3,4-дифторфеніл)піперидин-4іл]піролідин 2-он Перемішують протягом 4 годин при КТ суміш 3,7г сполуки, одержаної на попередній стадії, 1,9г форміату амонію і 1,4г 10%-ного паладію на вугіллі в 60мл МеОН. Каталізатор фільтрують, фільтрат концентрують у вакуумі, залишок обробляють простим ефіром. Одержують 2,5г цільового продукту. Приготування 8.9 1-[4-(4-метилфеніл)піперидин-4-іл]піролідин-2он А) N-[1-бензил-4-(4-метилфеніл)піперидин-4іл]-4-хлорбутанамідхлоргідрат Охолоджують до 0°С суміш 20г сполуки, одержаної на стадії А при підготовці 8.4, і 120,7мл 4хлорбутиронітрилу, вводять краплями 50,5мл 86082 40 95%-ного розчину H2SO4 і перемішують протягом 2 годин при температурі від 0 до -5(С. Реакційну суміш виливають у воду, підлуговують до рН=14 додаванням концентрованого розчину NaOH, екстрагують за допомогою DCM, органічну фазу промивають водою, сушать над MgSO4 і частково концентрують розчинник. Речовину, яка не розчинилась, відфільтровують, підкисляють фільтрат до рН=1 додаванням розчину 2N-соляної кислоти, перемішують і віджимають осад, що утворився. Одержують 9,8г цільового продукту після висушування у вакуумі. В) 1-[1-бензил-4-(4-метилфеніл)піперидин-4іл]піролідин-2-он У розчин 1,9г сполуки, одержаної на попередній стадії (вільна основа), в 60мл DMF вводять при КТ 60%-ного 0,396г гідриду натрію в олії і перемішують протягом ночі при КТ. У реакційну суміш вводять воду, екстрагують ACOEt, сушать органічну фазу над Na2SO4 і випаровують розчинник у вакуумі. Одержують 1,7г цільового продукту. С) 1-[4-(4-метилфеніл)піперидин-4іл]піролідин-2-он Перемішують протягом 3 годин при КТ суміш 1,7г сполуки, одержаної на попередній стадії, 0,934г форміату амонію і 0,026г 10%-ного паладію на вугіллі в 100мл МеОН. Каталізатор фільтрують і фільтрат концентрують у вакуумі. Залишок обробляють ацетоном, осад, який утворився, віджимають і промивають його ацетоном. Одержують 1,232г цільового продукту. Приготування 8.10 1-[4-(4-метилфеніл)піперидин-4-іл]піперидин2-он А) N-[1-бензил-4-(4-метилфеніл)піперидин-4іл]-5-хлорпентанамід-хлоргідрат. Охолоджують до 0°Сг 6,8г сполуки, одержаної на стадії А при приготуванні 8.4, і 50,3г 5-хлор-Nвалеронітрилу, швидко вводять 17,16мл 95%-ного розчину H2SO4 і перемішують протягом 4 годин при температурі від 0 до -5°С. Реакційну суміш виливають у воду, підлуговують до рН=14 додаванням концентрованого розчину NaOH, екстрагують за допомогою DCM, органічну фазу промивають водою, сушать над MgSO4 і випаровують розчинник у вакуумі. Залишок обробляють розчином хлористого водню в ефірі 2N, перемішують і віджимають осад, що утворився. Одержують 2г цільового продукту. B) 1-[1-бензил-4-(4-метилфеніл)піперидин-4іл]піперидин-2-он У розчин 1г сполуки, одержаної на попередній стадії (вільна основа), в 30мл DMF вводять при КТ 0,2г 60%-ного гідриду натрію в олії і перемішують протягом ночі при КТ. У реакційну суміш вводять воду, екстрагують за допомогою DCM, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок обробляють простим ізо-ефіром і осад, що утворився, віджимають. Одержують 0,15г цільового продукту. C) 1-[4-(4-метилфеніл)піперидин-4іл]піперидин-2-он 41 Перемішують протягом ночі при КТ суміш 2г сполуки, одержаної на попередній стадії, 1,04г форміату амонію і 0,29г 10%-ного паладію на вугіллі в 50мл МеОН. Каталізатор фільтрують і фільтрат концентрують у вакуумі. Одержують 0,7г цільового продукту. Приготування 8.11 1-[4-(3-метилфеніл)піперидин-4-іл]піролідин-2он. А) 1-бензил-4-(3-метил феніл )піперидин-4-ол. Цю сполуку одержують методом, описаним на стадії А при приготуванні 8.3, з 3,4г магнію в 15мл THF, розчину 20г 1-бром-3,4-метилбензолу в 100мл THF і розчину 22,13г 1-бензол-4-піперидону в 100мл THF. Одержують 26,54г цільового продукту. В) N-[1-бензил-4-(3-метилфеніл)піперидин-4іл]-4-хлорбутанамідхлоргідрат. Цю сполуку одержують методом, описаним на стадії А при приготуванні 8.9, з 24г сполуки, одержаної на попередній стадії, 14,5мл 4хлорбутиронітрилу і 60,6мл 95%-ного розчину H2SO4. Одержують 8,3г цільового продукту. С) 1-[1-бензил-4-(3-метилфеніл)піперидин-4іл]піролідин-2-он У розчин 7г сполуки, одержаної на попередній стадії (вільна основа), в 150мл DMF вводять при КТ 1,56г 60%-ного гідриду натрію в олії і перемішують протягом ночі при КТ. Реакційну суміш екстрагують за допомогою DCM, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 6,7г цільового продукту. С) 1-[4-(3-метилфеніл)пшеридин-4іл]піролідин-2-он Перемішують протягом ночі при КТ суміш 6,5г сполуки, одержаної на попередній стадії, 3,53г форміату амонію і 0,1г 10%-ного паладію на вугіллі в 150мл МеОН. Каталізатор фільтрують і фільтрат концентрують у вакуумі, залишок обробляють ацетоном і віджимають осад, що утворився. Одержують 3,5г цільового продукту. Приготування 8.12 3-(4-фенілпіперидин-4-іл)-1,3-оксазолідин-2-он A) 1-[(бензилокси)карбоніл]-4-фенілпіперидин4-карбонова кислота Охолоджують до 5°С суміш 151г ртолуолсульфонату 4-фенілпіперидин-4-карбонової кислоти і 213г 30%-ного водного розчину NaOH в 500мл води. Вводять краплями розчин 68,2г бензилхлорформіату в 150мл ацетону і перемішують протягом 6 днів при підйомі температури до КТ. Вводять 150мл ацетону і виливають реакційну суміш в суміш 200г концентрованого розчину НСl, 300мл води і 300мл ацетону, заздалегідь охолодженого на крижаній бані. Віджимають осад, що 86082 42 утворився, промивають його водою, потім простим ефіром. Одержують 89,7г цільового продукту. B) Бензил-4-(хлоркарбоніл)-4-фенілпіперидин1-карбоксилат Нагрівають зі зворотним холодильником до закінчення виділення газу суміш 50,89г сполуки, одержаної на попередній стадії, і 71,4г тіонілхлориду в 400мл 1,2-дихлоретану. Реакційну суміш концентрують у вакуумі, залишок обробляють ацетоном і випаровують розчинник у вакуумі. Одержують 55,3г цільового продукту у вигляді олії зеленого кольору. C) Бензол-4-ізоціанат-4-фенілпіперидин-1карбоксилат Охолоджують до 5°С суміш 55,3 сполуки, одержаної на попередній стадії, в 200мл ацетону, вводять краплями розчин 19,5г азиду натрію в 60мл і перемішують протягом 2 годин при підйомі температури до КТ. Концентрують у вакуумі, залишок обробляють 5%-ним розчином NаНСО3, екстрагують толуолом, промивають органічну фазу водою, насиченим розчином NaCl, сушать над Na2SO4 і концентрують дві третини розчинника у вакуумі. Нагрівають зі зворотним холодильником протягом 1 години залишок толуолового розчину, потім концентрують у вакуумі. Одержують 54г цільового продукту у вигляді олії оранжевого кольору, яка кристалізується. D) Бензил-4-[[(2-хлоретокси)карбоніл]аміно]-4фенілпіперидин-1-карбоксилат Нагрівають зі зворотним холодильником протягом 5 годин суміш 3,36г сполуки, одержаної на попередній стадії, і 8,04г хлоретанолу в 50мл 1,2дихлоретану і перемішують протягом ночі при КТ. Концентрують у вакуумі, залишок обробляють пентаном, подрібнюють, віджимають осад, що утворився, і промивають пентаном. Одержують 3,7г цільового продукту. Е) Бензол-4-(2-оксо-1,3-оксазолідин-3-іл)-4фенілпіперидин-1-карбоксилат Перемішують протягом ночі при КТ суміш 3,7г сполуки, одержаної на попередній стадії, і 0,7г 60%-ного гідриду натрію в олії в 50мл DMF. Концентрують у вакуумі, залишок обробляють буферним розчином з рН=2, екстрагують AcOEt, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок обробляють сумішшю простого ізо-ефіру і пентану, подрібнюють, віджимають осад, що утворився, і промивають його простим ізо-ефіром. Одержують 2,7г цільового продукту. F) 3-(4-фенілпіперидин-4-іл)-1,3-оксазолідин-2он Нагрівають до 50°С протягом 1 години суміш 2,7г сполуки, одержаної на попередній стадії, 1,34г форміату амонію і 0,45г 10%-ного паладію на вугіллі в 50мл EtOH. Каталізатор фільтрують і фільтрат концентрують у вакуумі. Одержують 1,7г цільового продукту. Приготування 8.13 3-[4-(3-фторфеніл)піперидин-4-іл]-1,3оксазолідин-2-он 43 А) 2-хлоретил[1-бензил-4-(3фторфеніл)піперидин-4-іл]карбам ат У розчин 9г сполуки, одержаної на стадії А при приготуванні 8.7, і 3,84г триетиламіну в 100мл 1,2дихлоретану вводять при КТ 4,52г 2хлоретилхлорформіату i перемішують протягом 1 години при КТ. Концентрують у вакуумі, залишок екстрагують AcOEt, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи сумішшю DCM/MeOH (100/1; об./об.). Одержують 3,2г цільового продукту. B) 3-[1-бензил-4-(3-фторфеніл)піперидин-4-іл]1,3-оксазолідин-2-он У розчин 3,2г сполуки, одержаної на попередній стадії, в 30мл DMF вводять при КТ 0,65г 60%ного гідриду натрію в олії, перемішують протягом 1 години при КТ, потім нагрівають протягом 1 години до 30°С. Концентрують у вакуумі, обробляють залишок водою, віджимають осад, що утворився, і промивають його водою. Після висушування у вакуумі одержують 2,4г цільового продукту. C) 3-[4-(3-фторфеніл)піперидин-4-іл]-1,3оксазолідин-2-он Нагрівають до 50-60°С протягом 3 годин суміш 2,4г сполуки, одержаної на попередній стадії, 1,28г форміату амонію і 0,43г 10%-ного паладію на вугіллі в 150мл ЕtOН. Після охолоджування до ТА каталізатор фільтрують і фільтрат концентрують у вакуумі. Одержують 1,2г цільового продукту. Приготування 18.14 3-[4-(4-фторфеніл)піперидин-4-іл]-1,3оксазолідин-2-он A) Трет-бутил-біс-(2-хлоретил)карбамат У суміш 75г біс-(2-хлоретил)амінхлоргідрату і 9,17г ди-трет-бутилдикарбонату в 1000мл DCM вводять при КТ і краплями 61,2мл триетиламіну і перемішують протягом ночі при КТ. Концентрують реакційну суміш у вакуумі, залишок екстрагують ефіром, промивають органічну фазу водою, буферним розчином з рН=2, 5%-ним розчином NaHCO3, насиченим розчином NaCl, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 101г цільового продукту у вигляді олії, який використовують як такий. B) Трет-бутил-4-ціано-4-(4фторфеніл)піперидин-1-карбоксилат. У суміш 33,3г 60%-ного гідриду натрію в олії в 200мл DMSO і 100мл THF вводять краплями і при КТ розчин 50мл 4-фторфенілацетонітрилу і 101г сполуки, одержаної на попередній стадії, в 200мл THF, перемішують протягом 2 годин при КТ, потім нагрівають зі зворотним холодильником протягом 1 години і перемішують протягом ночі при КТ. Реакційне середовище виливають в насичений розчин NH4Cl, концентрують THF у вакуумі, розбавляють 86082 44 водну фазу водою, екстрагують ефіром, сушать органічну фазу над Na2SO4 і випаровують розчинник у вакуумі. Одержану олію оранжевого кольору вміщують в мінімальну кількість простого ефіру і віджимають кристалічний продукт, що утворився. Одержують 87,6г цільового продукту. C) 4-(4-фторфеніл)піперидин-1карбонітрилхлоргідрат Нагрівають зі зворотним холодильником протягом 4 годин суміш 87,6г сполуки, одержаної на попередній стадії, і 33мл концентрованого розчину НСI в 330мл МеОН. Концентрують органічну фазу у вакуумі, залишок обробляють ацетоном і віджимають кристалічний продукт, що утворився. Одержують 54,71г цільового продукту. D) 4-(4-фторфеніл)піперидин-4-карбонова кислота Нагрівають зі зворотним холодильником протягом 7 годин суміш 54,71г сполуки, одержаної на попередній стадії, і 57г поташі в 360мл діетиленгліколю, потім перемішують протягом ночі при КТ. Об'єм реакційної суміші доводять до 900мл додаванням льоду, нейтралізують до рH=7 додаванням концентрованого розчину НСI і перемішують протягом 2 годин. Залишок віджимають і промивають ацетоном. Одержують 31,56г цільового продукту. E) 1-[(бензолокси)карбоніл]-4-(4фторфеніл)піперидин-4-карбонова кислота У суміш 31,56г сполуки, одержаної на попередній стадії, і 56,4г 30%-ного розчину NaOH в 320мл води вводять 50мл ацетону, охолоджують на крижаній бані, вводять краплями 20,12мл бензилхлорформіату і перемішують протягом ночі при КТ. Реакційну суміш промивають ефіром, підкисляють водну фазу до рН=1 додаванням концентрованого розчину НСI, екстрагують AcOEt, органічну фазу промивають водою, насиченим розчином НСI, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи DCM, потім сумішшю DCM/MeOH (100/2;об./об.). Одержують 30,39г цільового продукту. F) Бензил-4-(хлоркарбоніл)-4-(4фторфеніл)піперидин-1-карбоксилат У розчин 30,39г сполуки, одержаної на попередній стадії, в 200мл 1,2-дихлоретану вводять 25мл тіонілхлориду, потім нагрівають зі зворотним холодильником протягом 4 годин. Концентрують у вакуумі, залишок обробляють DCM і випаровують розчинник у вакуумі. Одержують 31,8г цільового продукту. G) Бензил-4-(4-фторфеніл)-4ізоціанатопіперидин-1-карбоксилат Охолоджують на крижаній бані розчин 31,8г сполуки, одержаної на попередній стадії, в 200мл ацетону, вводять краплями розчин 11,1г азиду натрію в 15мл води і перемішують протягом 1 години при КТ. Концентрують у вакуумі, залишок екстрагують толуолом, промивають органічну фазу 5%-ним розчином NaHCO3, насиченим розчином NaCl, сушать над Na2SO4. Нагрівають зі зворотним холодильником протягом 1 години толуольний розчин, що залишився, потім концентрують у вакуумі. Залишок обробляють пентаном і віджимають осад, що утворився. Одержують 26г 45 цільового продукту. Н) Бензил-4-[[(2-хлоретокси)карбоніл]аміно]-4(4-фторфеніл)піперидин-1-карбоксилат Нагрівають зі зворотним холодильником протягом 4 годин суміш 1,77г сполуки, одержаної на попередній стадії, і 0,4г 2-хлоретанолу в 50мл 1,2 дихлоретану, потім перемішують протягом ночі при КТ і концентрують у вакуумі. Одержують 2,1г цільового продукту. І) Бензил-4-(4-фторфеніл)-4-(2-оксооксазолідин-3-іл)піперидин-1-карбоксилат. Перемішують протягом 2 годин при КТ суміш 2,1г сполуки, одержаної на попередній стадії, і 0,386г 60%-ного гідриду натрію в олії в 20мл DMF. Концентрують у вакуумі, залишок обробляють буферним розчином з рН=2, екстрагують AcOEt, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок обробляють пентаном, подрібнюють і віджимають осад, що утворився. Одержують 1,5г цільового продукту. J) 3-[4-(4-фторфеніл)піперидин-4-іл]-1,3оксазолідин-2-он Перемішують протягом 1 години при 40°С суміш 1,5г сполуки, одержаної на попередній стадії, 0,7г амонію форміату і 0,2г 10%-ного паладію на вугіллі в 20мл ЕЮН. Каталізатор фільтрують і концентрують фільтрат у вакуумі Одержують 0,9г цільового продукту. Приготування 18.15 3-[4-(3,4-диметилфеніл)піперидин-4-іл]-1,3оксазолідин-2-он A) Бензил [біс(2-хлоретил)]амін На крижаній бані охолоджують суміш 150г біс(2-хлоретил)амінхлоргідрату і 144г броміди бензилу в 1000мл DMF, вводять краплями 120мл триетиламіну, потім перемішують протягом 5 годин при КТ. Концентрують у вакуумі, залишок обробляють водою, екстрагують простим ефіром, сушать органічну фазу над Na2SO4 і випаровують розчинник у вакуумі. Одержують 110г цільового продукту. B) 1-бензил-4-(3,4-диметилфеніл)піперидин-4карбонітрил У суспензію 5,78г 60%-ного гідриду натрію в олії в 20мл THF і 10мл DMSO вводять краплями розчин 10г 3,4-диметилфенілацетонітрилу в 50мл DMSO, потім перемішують протягом 30 хвилин при КТ. Потім вводять краплями розчин 14г сполуки, одержаної на попередній стадії, в 50мл DMSO, перемішують протягом ночі при КТ. Реакційне середовище концентрують у вакуумі, залишок обробляють водою, екстрагують ефіром, сушать органічну фазу над Na2SO4 і випаровують розчинник у вакуумі. Залишок обробляють розчином хлористого водню в ефірі (2N), віджимають осад, що утворився, і промивають його пентаном. Одержують 18г цільового продукту, F=265-267°. C) 1-бензил-4-(3,4-диметилфеніл)піперидин-4карбонова кислота 86082 46 Нагрівають зі зворотним холодильником протягом 24 годин суміш 15г сполуки, одержаної на попередній стадії, і 11,06г КОН в таблетках в 100мл етиленгліколю. Після охолоджування до КТ в реакційну суміш вводять воду, промивають водну фазу простим ефіром, нейтралізують водну фазу до рН=7 додаванням концентрованого розчину НСI і осад, що утворився, віджимають. Одержують 10,6г цільового продукту. D) 1-бензил-4-(3,4-диметилфеніл)піперидин-4карбонілхлорид, хлоргідрат. Нагрівають зі зворотним холодильником протягом 6 годин суміш 10,6г сполуки, одержаної на попередній стадії, і 8,76мл тіонілхлориду в 100мл 1,2-дихлоретану, потім перемішують протягом ночі при КТ. Концентрують у вакуумі, залишок обробляють простим ефіром, осад, що утворився, віджимають, промивають ефіром і пентаном. Одержують 9г цільового продукту. Е) 1-Бензил-4-(3,4-диметилфеніл)-4ізоціанатопіперидин Охолоджують до 0°С розчин 9г сполуки, одержаної на попередній стадії, і 5,16мл триетиламіну в 200мл ацетону, вводять краплями розчин 3,1г азиду натрію в 15мл води і перемішують при підйомі температури до КТ. Концентрують у вакуумі, залишок екстрагують толуолом, промивають органічну фазу водою, сушать над Na2SO4 і нагрівають зі зворотним холодильником протягом 3 годин толуольну фазу, що залишилась. Концентрують у вакуумі і одержують 4г цільового продукту, які використовують як такий. F) 2-хлоретил[1-Бензил-4-(3,4диметилфеніл)піперидин-4-іл]карбамат Нагрівають зі зворотним холодильником протягом 4 годин суміш 4г сполуки, одержаної на попередній стадії, і 10,05г 2-хлоретанолу в 50мл 1,2 дихлоретану. Концентрують у вакуумі і залишок піддають хроматографії на силікагелі, елююючи сумішшю DCM/MeOH (100/5; об./об.). Одержують 2г цільового продукту, які використовують як такий. G) 3-[1-Бензил-4-(3,4диметилфеніл)піперидин-4-іл]-1,3-оксазолідин-2он. Перемішують протягом 2 годин при ТА суміш 2г сполуки, одержаної на попередній стадії, і 0,4г 60%-ного гідриду натрію в олії в 20мл DMF. Концентрують у вакуумі, залишок обробляють водою, екстрагують AcOEt, органічну фазу промивають водою, сушать над MgSO4 і випаровують розчинник у вакуумі. Одержують 1,4г цільового продукту. Н) 3-[4-(3,4-диметилфеніл)піперидин-4-іл]-1,3оксазолідин-2-он Перемішують при 30°С протягом 2 годин суміш 1,4г сполуки, одержаної на попередній стадії, 0,73г амонію форміату і 0,41г 10%-ного паладію на вугіллі в 30мл EtOH. Каталізатор фільтрують і концентрують фільтрат у вакуумі. Одержують 1г цільового продукту. Приготування 18.16 3-(4-фенілпіперидин-4-іл)-1,3-оксазинан-2-онформіат 47 А) Бензил-4-[[(3-хлорпропокси)карбоніл]аміно]4-фенілпіперидин-1-карбоксилат Нагрівають зі зворотним холодильником протягом 4 годин суміш 4г сполуки, одержаної на стадії С при приготуванні 8.12, і 5мл 3-хлор-1пропанолу в 100мл 1,2-дихлоретану. Додають 5мл 3-хлор-1-пропанолу, потім продовжують кип'ятіння зі зворотним холодильником протягом 1 години. Додають ще 5мл 3-хлор-1-пропанолу і перемішують протягом ночі при КТ. Концентрують у вакуумі і одержують 4,14г цільового продукту. В) Бензил-4-(2-оксо-1,3-оксазинан-3-іл)-4фенілпіперидин-1-карбоксилат Перемішують протягом 2 годин при КТ суміш 4,14г сполуки, одержаної на попередній стадії, і 0,769г 60%-ного гідриду натрію в олії в 50мл DMF. Концентрують у вакуумі, залишок обробляють простим ізо-ефіром, віджимають осад, що утворився. Після висушування у вакуумі одержують 3,19г цільового продукту. С) 3-(4-фенілпіперидин-4-іл)-1,3-оксазинан-2он-форміат Перемішують протягом 3 годин при КТ суміш 3,19г сполуки, одержаної на попередній стадії, 1.53г амонію форміату і 0,43г 10%-ного паладію на вугіллі в 60мл ЕtOН. Каталізатор фільтрують і концентрують фільтрат у вакуумі. Одержують 1г цільового продукту. Приготування 8.17 3-[4-(4-фторфеніл)піперидин-4-іл]-1,3оксазинан-2-он-форміат А) Бензил-4-[[(3-хлорпропокси)карбоніл]аміно]4-(4-фторфеніл)піперидин-1-карбоксилат Нагрівають зі зворотним холодильником протягом 1 години суміш 2г сполуки, одержаної на стадії G при приготуванні 8.14, і 8мл 3-хлор-1пропанолу в 20мл 1,2-дихлоретану. Реакційну суміш концентрують у вакуумі, залишок обробляють пентаном, перемішують протягом 1 години і віджимають осад, що утворився. Одержують 2,5г цільового продукту після висушування у вакуумі. B) Бензил-(4-фторфеніл)-4-(2-оксо-1,3оксазинан-3-іл)-піперидин-1-карбоксилат Перемішують протягом 1 години при КТ суміш 2,5г сполуки, одержаної на попередній стадії, і 0,445г 60%-ного гідриду натрію в олії в 20мл DMF. Концентрують реакційну суміш у вакуумі, залишок обробляють буферним розчином з рН=2, екстрагують ACOEt, органічну фазу промивають водою, сушать над Na2SO4 і розчинник випаровують у вакуумі. Залишок обробляють сумішшю ефіру та ізо/пентану, подрібнюють і віджимають осад, що утворився. Одержують 1,1г цільового продукту. C) 3-[4-(4-фторфеніл)піперидин-4-іл]-1,3оксазинан-2-он-форміат Перемішують протягом 1 години при КТ суміш 1,1г сполуки, одержаної на попередній стадії, 0,5г амонію форміату і 0,14г 10%-ного паладію на вугіллі в 20мл ЕtOН. Каталізатор фільтрують і кон 86082 48 центрують фільтрат у вакуумі. Одержують 0,7г цільового продукту. Приготування 8.18 3-[4-(3,4-дифторфеніл)піперидин-4-іл]-1,3оксазинан-2-он A) 4-(3,4-дифторфеніл)піперидин-4-амін Охолоджують на крижаній бані розчин 33г сполуки, одержаної на стадії А при приготуванні 8.8, і 18,42г форміату амонію в 500мл МеОН, вводять 0,5г 10%-ного паладію на вугіллі, перемішують протягом 3 годин при підйомі температури до КТ, потім нагрівають до 40°С протягом 1 години. Каталізатор фільтрують і концентрують фільтрат у вакуумі. Одержують 28г цільового продукту. B) Бензил-4-аміно-4-(3,4дифторфеніл)піперидин-1-карбоксилат. У суміш 27,5г сполуки, одержаної на попередній стадії, і 57,7мл триетиламіну в 500мл DCM вводять краплями і при КТ 22,1г бензилхлорформіату і перемішують протягом 1 години при КТ. Концентрують реакційну суміш у вакуумі, залишок екстрагують DCM, промивають органічну фазу водою, насиченим розчином NaCl, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі, елююючи DCM/MeOH (95/5; об ./об.). Одержують 11,51г цільового продукту. С) Бензил-4-[[(3-хлорпропокси)карбоніл]аміно]4-(3,4-дифторфеніл)-піперидин-1-карбоксилат У суміш 5г сполуки, одержаної на попередній стадії, і 4,42мл триетиламіну в 100мл DCM вводять краплями і при КТ 2,27г 3хлорпропілхлорформіату і перемішують протягом ночі при КТ. Концентрують реакційну суміш у вакуумі, залишок екстрагують DCM, промивають органічну фазу водою, насиченим розчином NaCl, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи DCM, потім сумішшю DCM/MeOH (100/2; об./об.). Одержують 1,9г цільового продукту. D) Бензил-(3,4-дифторфеніл)-4-(2-оксо-1,3оксазинан-3-іл)піперидин-1-карбоксилат Перемішують протягом 2 годин при КТ суміш 1,9г сполуки, одержаної на попередній стадії, і 0,33г 60%-ного гідриду натрію в олії в 30мл DMF. Концентрують реакційну суміш у вакуумі, залишок обробляють ефіром і віджимають осад, що утворився. Сушать у вакуумі і одержують 1,5г цільового продукту. Е) 3-[4-(3,4-дифторфеніл)піперидин-4-іл]-1,3оксазинан-2-он Перемішують протягом ночі при КТ суміш 1,5г сполуки, одержаної на попередній стадії, 0,66г амонію форміату і 0,18г 10%-ного паладію на вугіллі в 50мл EtOH. Каталізатор фільтрують і концентрують фільтрат у вакуумі. Одержують 0,87г цільового продукту. Приготування 8.19 4-[(4-фенілпіперидин-4-іл)карбоніл]морфолін 49 Цю сполуку одержують методами, описаними у приготуванні 1.29 в [WO 97/10211]. Приготування 8.20 1,4'-біпіридин 4'-карбоксаміду форміат. A) 1'-бензил-1,4'-біпіридин 4'-карбоксамід Цю сполуку одержують методом, описаним на стадії В у приготуванні 3.1 в [WO 02/094821]. B) 1,4'-біпіридин 4'-карбоксаміду форміат Витримують протягом 4 годин 30 хвилин суміш 50г сполуки, одержаної на попередній стадії, 31,4г форміату амонію і 12,5г 50%-ного паладію на вугіллі в 200мл МеОН. Каталізатор фільтрують і концентрують фільтрат у вакуумі. Одержують 22,5г цільового продукту. Приготування 8.21 3-[4-(3,4-дифторфеніл)піперидин-4-іл]-1,3оксазолідин-2-он А) Бензил-4-[[(2-хлоретокси)карбоніл]аміно]-4(3,4-дифторфеніл)піперидин-1-карбоксилат У розчин 5г сполуки, одержаної на стадії В приготування 8.18, і 4,42мл триетиламіну в 100мл DCM вводять краплями і при КТ 2,06г 2хлоретилхлорформіату і перемішують протягом ночі при КТ. Концентрують реакційну суміш у вакуумі, залишок екстрагують DCM, промивають органічну фазу водою, насиченим розчином NaCl, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи DCM, потім сумішшю DCM/MeOH (97/3; об./об.). Одержують 1,55г цільового продукту. В) Бензил-4-(3,4-дифторфеніл)-4-(2-оксо-1,3оксазолідин-3-іл)піперидин-1-карбоксилат У суміш 1,5г сполуки, одержаної на попередній стадії, в 50мл DCM вводять 0,16г 60%-ного гідриду натрію в олії і перемішують протягом 2 годин при КТ. Концентрують реакційну суміш у вакуумі, залишок обробляють ефіром, віджимають осад, що утворився, і сушать у вакуумі. Одержують 1,16г цільового продукту. С) 3-[4-(3,4-дифторфеніл)піперидин-4-іл]-1,3оксазолідин-2-он Перемішують протягом ночі суміш 1,15г сполуки, одержаної на попередній стадії, 0,52г форміату амонію і 0,15г 10%-ного паладію на вугіллі в 60мл ЕtOН. Фільтрують каталізатор і фільтрат концентрують у вакуумі. Одержують 0,73г цільового продукту. Приготування 8.22 N-[4-[3-(трифторметил)феніл]піперидин-4іл]ацетаміду форміат. 86082 50 А) 1-бензил-4-[3(трифторметил)феніл]піперидин-4-ол. У суміш 24,5г 4-гідрокси-4-[3(трифторметил)феніл]піперидину (комерційного) і 27,6г K2СО3 в 20мл DMF вводять краплями і при КТ 17,1г броміду бензилу, потім нагрівають до 40°С протягом 2 годин і перемішують протягом ночі при КТ. Концентрують реакційну суміш у вакуумі, залишок обробляють водою, екстрагують ACOEt, промивають органічну фазу водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Одержують 31г цільового продукту В) Ν-[1-бензил-4-[3(трифторметил)феніл]піперидин-4-іл]ацетаміду. У розчин 31г сполуки, одержаної на попередній стадії, в 170мл анетонітрилу вводять краплями і при температурі нижче 20°С 88,65мл 95%ного H2SO4 і перемішують 6 годин при КТ. Реакційну суміш виливають на лід, нейтралізують додаванням концентрованого розчину NaOH, віджимають осад, що утворився, промивають його водою і сушать його. Одержують 17,7 цільового продукту після кристалізації в пропан-2-олі. С) N-[4-[3-(трифторметил)феніл]піперидин-4іл]ацетаміду форміат. Перемішують протягом ночі при КТ суміш 3г сполуки, одержаної на попередній стадії, 1,5г форміату амонію і 0,4г 10%-ного паладію на вугіллі в 60мл МеОН. Фільтрують каталізатор і фільтрат концентрують у вакуумі. Одержують 3г цільового продукту. Приготування 8.23 4-(піридин-2-іл)піперидин-4-олу форміат. A) 1-бензил-4-(піридин-2-іл)піперидин-4-ол. Охолоджують до -70°С розчин 22,2г 2бромпіридину в 100мл THF, вводять краплями 87,8мл N-бутиллітію і перемішують 30 хвилин. Потім вводять краплями і при -60°С розчин 25,6г 1бензил-4-піперидинону в 100мл THF і перемішують протягом ночі при підйомі температури до КТ. Реакційну суміш виливають у воду, екстрагують ефіром, промивають органічну фазу водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи DCM, потім сумішшю DCM/MeOH від (99/1; об./об.) до (90/10; об./об.). Одержують 21,5г цільового продукту. B) 4-(піридин-2-іл)піперидин-4-олу форміат. Перемішують протягом ночі при КТ суміш 5г сполуки, одержаної на попередній стадії, 3,5г форміату амонію і 0,1г 10%-ного паладію на вугіллі в 50мл МеОН. Фільтрують каталізатор і фільтрат концентрують у вакуумі. Одержують 3,4г цільового продукту. Приготування 8.24 3-[4-(4-хлорфеніл)піперидин-4-іл]-1,3оксазолідин-2-он-хлоргідрат A) Бензил-4-(4-хлорфеніл)піперидин-1 карбонітрил 51 У суспензію 9,8г 60%-ного гідриду натрію в олії в 140мл THF і 60мл DMSO вводять краплями і при КТ розчин 11,3г 4-хлорфенілацетонітрилу і 20г бензил[біс(2-хлоретил)]амінобензилу в 140мл THF і 60мл DMSO, потім нагрівають до 70-80°С протягом 2 годин. Після охолоджування реакційну суміш виливають на лід, екстрагують простим ефіром, промивають органічну фазу водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі, елююючи сумішшю гептану і AcOEt (90/10; об./об.). Одержують 19,6г цільового продукту. B) 1-бензил-4-(4-хлорфеніл)піперидин-4карбонова кислота Нагрівають до 200°С протягом 18 годин суміш 19,6г сполуки, одержаної на попередній стадії, і 14,15г КОН в таблетках в 150мл етиленгліколю. Після охолоджування до КТ реакційну суміш виливають на лід, промивають водну фазу простим ефіром, підкисляють водну фазу до рН=6,5 додаванням концентрованого розчину НСI і осад, що утворився, віджимають, промивають водою, потім ацетоном і сушать його. Одержують 19г цільового продукту. C) 1 -бензил-4-(4-хлорфеніл)піперидин-4карбонілхлорид, хлоргідрат. Нагрівають зі зворотним холодильником протягом 4 годин суміш 19г сполуки, одержаної на попередній стадії, і 40,5мл тюнілхлориду, потім перемішують протягом ночі при КТ. Концентрують реакційну суміш у вакуумі, залишок обробляють толуолом і випаровують розчинник у вакуумі. Одержують 21г цільового продукту, який використовують як такий. D) 1-Бензил-4-(4-хлорфеніл)-4ізоціанатопіперидин Охолоджують до 0°С суспензію 20,5г сполуки, одержаної на попередній стадії, і 13мл триетиламшу в 200мл ацетону, вводять краплями розчин 9,6г азиду натрію в 50мл води і перемішують протягом 30 хвилин, потім 1 годину при КТ. Концентрують у вакуумі, залишок екстрагують толуолом, промивають органічну фазу водою, сушать над Na2SO4 і нагрівають зі зворотним холодильником протягом 4 годин толуольну фазу. Перемішують протягом ночі при КТ, випаровують розчинник у вакуумі і одержують 10,5г цільового продукту, який використовують як такий. E) 2-хлоретил[1-Бензил-4-(4хлорфеніл)піперидин-4-іл]карбамат Нагрівають до 80°С протягом 1 години суміш 10,5г сполуки, одержаної на попередній стадії, і 20мл 2-хлоретанолу, потім перемішують протягом ночі при КТ. Концентрують у вакуумі, екстрагують залишок AcOEt, промивають органічну фазу водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі, елююючи DCM, потім градієнтом суміші DCM/MeOH від (99/1; об./об.) до (90/10; об./об.). Одержують 8,3г цільового продукту. F) 3-[1-Бензил-4-(4-хлорфеніл)піперидин-4-іл]1,3-оксазолідин-2-он. У розчин 8г сполуки, одержаної на попередній стадії, в 45мл DMF вводять порціями і при КТ 1,73г 60%-ного гідриду натрію в олії і нагрівають до 50°С 86082 52 протягом 1 години. Концентрують у вакуумі, залишок обробляють водою, екстрагують AcOEt, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок обробляють пентаном, подрібнюють, віджимають осад, що утворився, і промивають пентаном. Одержують 6,2г цільового продукту. G) 3-[4-(4-[хлорфеніл)піперидин-4-іл]-1,3оксазолідин-2-ону хлор гідрат Охолоджують до 0°С суміш 6,2г сполуки, одержаної на попередній стадії, і 2,3г K2СО3 в 60мл DCM, вводять краплями 2,87г 1хлоретилхлорформіату, перемішують протягом 1 години на холоді, потім 1 годину при КТ. Фільтрують речовину, яка не розчинилась, і концентрують фільтрат у вакуумі. Залишок обробляють 50мл МеОН і перемішують протягом ночі при КТ. Концентрують у вакуумі, залишок розчиняють в суміші DCM/MeOH, вводять в суміш простого ефіру/пентану, осад, що утворився, фільтрують і промивають простим ефіром. Одержують 4,2г цільового продукту. Приготування 8.25 Ν,Ν-диметил-1,4'-біпіперидин-4'-карбоксамід. Цю сполуку одержують методами, описаними у Приготуванні 3.1 в [WO 02/094821]. Приклад 1: Сполука 1 6-(3,4-дихлорфеніл)-6-[2-[4-гідрокси-4[3(трифторметил)феніл]піперидин-4-іл]етил]-4фенілморфолін-3-он-хлоргідрат, правообертаючий ізомер. У розчин 0,5г сполуки, одержаної при Приготуванні 7.1, в 20мл DCM вводять 0,337г 4-гідрокси4[3-(трифторметил)феніл]піперидину (комерційного), потім 0,61г триацетоксиборогідриду натрію і 0,0085г оцтової кислоти і перемішують протягом ночі при КТ. Реакційну суміш підлуговують 10%ним розчином Na2CO3, екстрагують DCM, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи DCM, потім градієнтом суміші DCM/EtOH до (98/2; об./об.). Одержаний продукт обробляють хлористим воднем в ефірі (2N), концентрують у вакуумі, розчиняють залишок в DCM, вводять простий ефір і віджимають осад, що утворився. Одержують 0,42г цільового продукту. α20D=+30° (с=0,25; МеОН). Приклад 2: Сполука 3 N-[1-[2[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(3фторфеніл)піперидин-4-іл]ацетаміду хлоргідрат, 53 86082 54 правообертаючий ізомер. У розчин 0,5г сполуки, одержаної при Приготуванні 7.1, в 20мл DCM вводять 0,387г сполуки, одержаної при Приготуванні 8.2, потім 0,61г триацетоксиборогідриду натрію і 0,0085г оцтової кислоти і перемішують протягом ночі при КТ. Реакційну суміш підлуговують 10%-ним розчином Na2CO4, екстрагують DCM, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи DCM, потім градієнтом суміші DCM/MeOH до (97/3; об./об.). Одержаний продукт обробляють хлористим воднем в ефірі (2N), концентрують у вакуумі, розчиняють залишок в DCM, вводять простий ефір і віджимають осад, що утворився. Одержують 0,57г цільового продукту. α20D=+29,8° (с=0,5; МеОН). 1 H-ЯМР: ДМСО-d6: δ (ppm): 1,9: с: 3Н; 2,3: мт: 2Н; 2,4-3,7: м: 10Н; 4,0-4,75: м: 4Н; 7,0-7,9: м: 12Н; 8,2: с: 1H; 11: се: 1Н. Приклад 3: Сполука 4 N-[1-[2[2-(3,4-дихлорфеніл)-5-оксо-4фенілморфолін-2-іл]етил]-4-(3фторфеніл)піперидин-4-іл]ацетаміду фумарат, правообертаючий ізомер. Нагрівають зі зворотним холодильником розчин 4,5г сполуки 3 у формі вільної основи в 72мл ацетонітрилу, вводять 0,896г фумарової кислоти і продовжують нагрівати зі зворотним холодильником протягом 30 хвилин. Реакційну суміш охолоджують до КТ і перемішують протягом 1 години при КТ. Віджимають кристалічний продукт, що утворився і сушать у вакуумі. Одержують 2,3г цільового продукту у вигляді фумарату, F=244245°C. α20D=+24,4° (с=0,25; МеОН). Приклад 4: Сполука 14 6-(3,4-дихлорфеніл)-6-[2-[4-(3-фторфеніл)-4-(2оксо-1,3-оксазолідин-3-іл)пшеридин-1-іл]етил]-4фенілморфолін-3-он-хлоргідрат, правообертаючий ізомер. Перемішують протягом ночі при КТ суміш 0,5г сполуки, одержаної при Приготуванні 7.1, 0,36г сполуки, одержаної при Приготуванні 8.13, 0,58г триацетоксиборогідриду натрію і 0,0085г оцтової кислоти в 50мл DCM. Реакційну суміш промивають 10%-ним розчином Na2CO3, органічну фазу промивають водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи DCM, потім градієнтом суміші DCM/MeOH (99/1; об./об.). Одержаний продукт розчиняють в DCM, додають хлористий водень в ефірі (2N), віджимають осад, що утворився, і обробляють його ефіром. Одержують 0,4г цільового продукту. α20D=+32,4°(c=0,5; MeOH). 1 H-ЯМР: ДМСО-d6: δ (ppm): 2,3 мт: 2Н; 2,4-3,7: м: 12Н; 4,0-4,75: м: 6Н; 7,0-7,9: м: 12Н; 11: се: 1Н. Приклад 5: Сполука 15 6-(3,4-дихлорфеніл)-6-[2-[4-(4-фторфеніл)-452-оксо-1,3-оксазолідин-3-іл)піперидин-1-іл]етил]4-фенілморфолін-3-он-хлоргідрат, правообертаючий ізомер. Перемішують протягом ночі при КТ суміш 0,5г сполуки, одержаної при Приготуванні 7.1, 0,36г сполуки, одержаної при Приготуванні 8.14, 0,61г триацетоксиборогідриду натрію і 0,0085г оцтової кислоти в 50мл DCM. Реакційну суміш промивають 10%-ним розчином Na2CO3, водою, сушать над Na2SO4 і випаровують розчинник у вакуумі. Залишок піддають хроматографії на силікагелі Н, елююючи DCM, потім сумішшю DCM/MeOH до (100/3;об./об.). Одержаний продукт розчиняють в DCM, додають хлористий водень в ефірі (2N), віджимають осад, що утворився, і обробляють його простим ефіром. Одержують 0,56г цільового продукту. α20D=+31°(c=0,5; MeOH). 1 H-ЯМР: ДМСО-d6: δ (ppm): 2,3: мт: 2Н; 2,4-3,7: м: 12Н; 4,0-4,75: м: 6Н; 7,0-7,9: м: 12Н; 11: се: 1Н. Нижченаведена таблиця ілюструє хімічні структури і фізичні властивості декількох прикладів сполук згідно з винаходом. На цій таблиці: У колонці «Сіль» "-" означає сполуку у формі 55 вільної основи, а "НС1" означає сполуку у формі хлоргідрату і "С4Н4О4" означає сполуку у формі 86082 фумарату: 56 57 86082 58 59 Сполука №6: 1Н-ЯМР: ДМСО-d6: δ (ррм): 1,87: с: 3Н; 1,9-2,1: т: 2Η; 2,25: с: 3Н; 2,3-3,2: м: 8Н; 3,33,5: т: 2Н; 4,13: с: 2Н; 4,42: дд: 2Н; 7,0-7,6: м: 10Н; 7,6-7,8: м: 2Н; 8,0: се: 1H; 10,2: се: 1Н. 86082 60 Сполука №8: 1Н-ЯМР: ДМСО-d6: δ (ррм) : 1,9: с: 3Н; 2,1-2,4: м: 2Н; 2,5-3,2: м: 8Н; 3,3-3,6: м: 2Н; 4,1: с: 2Н; 4,4: дд: 2Н; 7,2-7,6: м: 10Н; 7,7-7,8: 2д: 2Н; 8,2: с: 1Н; 10,6: се: 1Н.
ДивитисяДодаткова інформація
Назва патенту англійською4-arylmorpholin-3-one derivatives, their preparation and therapeutic use thereof
Автори англійськоюEmon-Alt Ksave, Proietto Vincenzo
Назва патенту російськоюПроизводные 4-арилморфолин-3-она, способ их получения и их применение в терапии
Автори російськоюЭМОН-АЛЬТ Ксавье, Проиетто Винченцо
МПК / Мітки
МПК: C07D 413/14, C07D 265/10, A61K 31/537, C07D 413/06
Мітки: 4-арилморфолін-3-ону, спосіб, одержання, терапії, застосування, похідні
Код посилання
<a href="https://ua.patents.su/33-86082-pokhidni-4-arilmorfolin-3-onu-sposib-kh-oderzhannya-i-kh-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-арилморфолін-3-ону, спосіб їх одержання і їх застосування в терапії</a>
Попередній патент: Засіб, його застосування, спосіб боротьби з артроподами, спосіб захисту насіння та оброблене насіння
Наступний патент: Піразолзаміщені аміногетероарильні сполуки як інгібітори протеїнкінази
Випадковий патент: Пристрій для одержання махрових тканин