Гомологи з фактором росту фібробласта
Номер патенту: 75316
Опубліковано: 17.04.2006
Автори: Реймонд Фенелла К., Гансен Бріджіт, Конклін Деррел К., Голдерман Сьюзен Д., Дейшер Тереза А., Буковскі Томас Р., Шеппард Пол О.
Формула / Реферат
1. Ізольована полінуклеотидна молекула, що кодує поліпептид, який є гомологом ростових факторів фібробластів, вибрана з групи:
і. полінуклеотидні молекули, що містять послідовність нуклеотидів, показану в послідовності SEQ ID NO: 1 як фрагмент від нуклеотиду 82 до нуклеотиду 621;
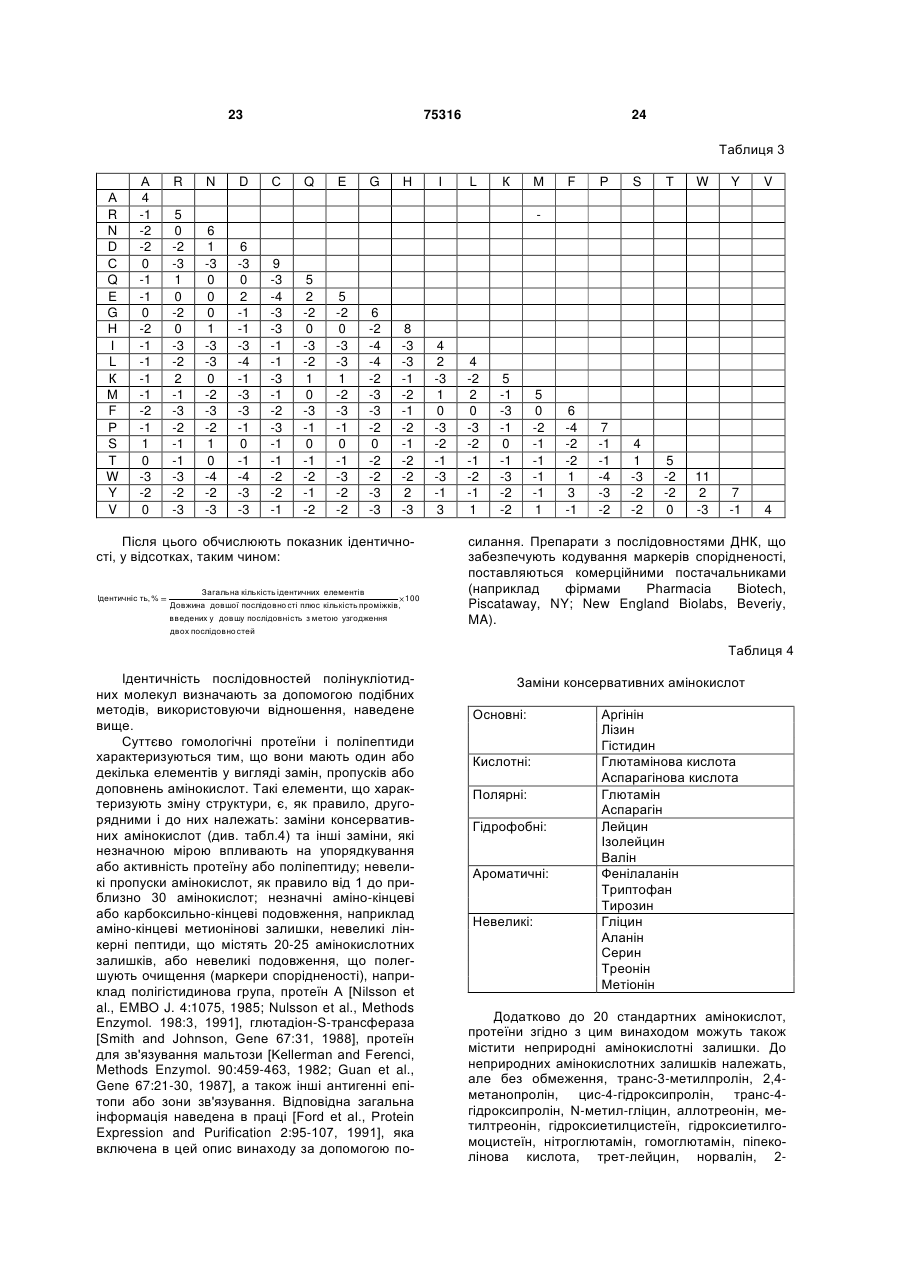
іі. природні варіанти, які принаймні на 80 % ідентичні молекулам (i);
ііі. полінуклеотидні молекули, що кодують поліпептид, який принаймні на 80 % ідентичний амінокислотній послідовності, показаній в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 207 (Ala),
причому поліпептид, кодований полінуклеотидом, є таким, що стимулює проліферацію клітин, які походять з мезенхимних початкових клітин і їх попередників.
2. Ізольована полінуклеотидна молекула за п. 1, яка відрізняється тим, що відповідає послідовності нуклеотидів, показаній в послідовності SEQ ID NO: 1 як фрагмент від нуклеотиду 82 до нуклеотиду 621.
3. Ізольована полінуклеотидна молекула за п. 1, яка відрізняється тим, що полінуклеотидом є ДНК.
4. Ізольована полінуклеотидна молекула, що кодує поліпептид, який є гомологом ростових факторів фібробластів, вибрана з групи:
і. полінуклеотидні молекули, що містять послідовність нуклеотидів, показану в послідовності SEQ ID NO: 6 як фрагмент від нуклеотиду 82 до нуклеотиду 621;
іі. природні варіанти, які принаймні на 80 % ідентичні молекулам (i);
ііі. полінуклеотидні молекули, що кодують поліпептид, який принаймні на 80 % ідентичний амінокислотній послідовності, показаній в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 207 (Ala),
причому поліпептид, кодований полінуклеотидом, є таким, що стимулює проліферацію клітин, які походять з мезенхимних початкових клітин і їх попередників.
5. Вектор експресії, що містить такі елементи, сполучені між собою для можливості виконання заданих функцій:
промотор транскрипції;
фрагмент ДНК, вибраний з групи:
і. полінуклеотидні молекули, що містять послідовність нуклеотидів, показану в послідовності SEQ ID NO: 1 як фрагмент від нуклеотиду 82 до нуклеотиду 621;
іі. природні варіанти, які принаймні на 80 % ідентичні молекулам (i);
ііі. полінуклеотидні молекули, що кодують поліпептид, який принаймні на 80 % ідентичний амінокислотній послідовності, показаній в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 207 (Ala);
термінатор транскрипції.
6. Вектор експресії, що містить такі елементи, сполучені між собою для можливості виконання заданих функцій:
промотор транскрипції;
сегмент ДНК, вибраний з групи:
і. полінуклеотидні молекули, що містять послідовність нуклеотидів, показану в послідовності SEQ ID NO: 6 як фрагмент від нуклеотиду 82 до нуклеотиду 621;
іі. природні варіанти, які принаймні на 80 % ідентичні молекулам (i);
ііі. полінуклеотидні молекули, що кодують поліпептид, який принаймні на 80 % ідентичний амінокислотній послідовності, показаній в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 207 (Ala);
термінатор транскрипції,
причому поліпептид, кодований полінуклеотидом, є таким, що стимулює проліферацію клітин, які походять з мезенхимних початкових клітин і їх попередників.
7. Культивована клітина, в яку введений вектор експресії за будь-яким з пп. 5-6, причому згадана клітина забезпечує експресію поліпептиду, кодованого фрагментом ДНК.
8. Спосіб одержання поліпептиду, що є гомологом ростових факторів фібробластів, згідно з яким виконуються такі процедури:
культивування клітини, в яку введений вектор експресії згідно з будь-яким з пп. 5-6, внаслідок чого згадана клітина забезпечує експресію поліпептиду, що є гомологом ростових факторів фібробластів, кодованого фрагментом ДНК;
виділення поліпептиду, що є гомологом ростових факторів фібробластів.
9. Ізольований поліпептид, що є гомологом ростових факторів фібробластів, вибраний з групи:
і. поліпептидні молекули, що містять амінокислотну послідовність, показану в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 175 (Met);
іі. природні варіанти, які принаймні на 80 % ідентичні молекулам (i);
ііі. поліпептидні молекули, які принаймні на 80 % ідентичні послідовності, показаній в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 175 (Met),
причому поліпептид, кодований полінуклеотидом, є таким, що стимулює проліферацію клітин, які походять з мезенхимних початкових клітин і їх попередників.
10. Ізольований поліпептид, що є гомологом ростових факторів фібробластів, вибраний з групи:
і. поліпептидні молекули, що містять амінокислотну послідовність, показану в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 196 (Lys);
іі. природні варіанти, які принаймні на 80 % ідентичні молекулам (а);
ііі. поліпептидні молекули, які принаймні на 80 % ідентичні послідовності, показаній в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 196 (Lys),
причому поліпептид є таким, що стимулює проліферацію клітин, які походять з мезенхимних початкових клітин і їх попередників.
11. Ізольований поліпептид, що є гомологом ростових факторів фібробластів, вибраний з групи:
і. поліпептидні молекули, що містять амінокислотну послідовність, показану в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 207 (Ala);
іі. природні варіанти, які принаймні на 80 % ідентичні молекулам (i);
ііі. поліпептидні молекули, які принаймні на 80 % ідентичні амінокислотній послідовності, показаній в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 207 (Ala),
причому поліпептид є таким, що стимулює проліферацію клітин, які походять з мезенхимних початкових клітин і їх попередників.
12. Поліпептид, що є гомологом ростових факторів фібробластів, за п. 10, який відрізняється тим, що містить сигнальну послідовність.
13. Поліпептид, що є гомологом ростових факторів фібробластів, за п. 10, який відрізняється тим, що містить сигнальну послідовність, показану в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 1 (Met) до амінокислотного залишку 27 (Ala).
14. Фармацевтичний засіб для стимуляції проліферації клітин, які походять з мезенхимних початкових клітин і їх попередників, який містить очищений поліпептид, що є гомологом ростових факторів фібробластів, за п. 10, у поєднанні з фармацевтично прийнятною речовиною-носієм.
15. Антитіло, яке специфічно зв’язується з поліпептидною молекулою, що містить амінокислотну послідовність, показану в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 1 (Met) до амінокислотного залишку 207 (Ala).
16. Антитіло за п. 15, яке відрізняється тим, що специфічно зв’язується з поліпептидною молекулою, що містить амінокислотну послідовність, показану в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 196 (Lys).
17. Спосіб стимуляції росту міоцитів або клітин-попередників міоцитів у ссавців, яким необхідна така стимуляція, який включає:
і. введення ефективної кількості поліпептиду, що є гомологом ростових факторів фібробластів, за одним з пп. 9-13;
іі. вимірювання збільшення розмірів і кількості клітин-попередників міоцитів або міоцитів у ссавця порівняно з цими показниками у контрольних тварин.
18. Спосіб стимуляції за п. 17, який відрізняється тим, що міоцитами або клітинами-попередниками міоцитів є серцеві міоцити або клітини-попередники серцевих міоцитів.
19. Спосіб стимуляції, в умовах поза живими організмами, росту клітин-попередників міоцитів або міоцитів, який включає:
і. культивування клітин-попередників міоцитів або міоцитів разом з поліпептидом, що є гомологом ростових факторів фібробластів, за одним з пп. 9–13;
іі. вимірювання кількості клітин-попередників міоцитів або міоцитів у клітинах серцевої тканини, які культивують у культуральному середовищі із згаданим поліпептидом, і порівнювання її з кількістю клітин-попередників міоцитів або міоцитів у клітинах серцевої тканини, які культивують за відсутності згаданого поліпептиду, що є гомологом ростових факторів фібробластів.
20. Спосіб за п. 19, який відрізняється тим, що міоцити або клітини-попередники міоцитів є серцевими міоцитами або клітинами-попередниками серцевих міоцитів.
21. Спосіб одержання химернї сполуки, згідно з яким виконуються такі процедури:
сполучення першої молекули, яка містить поліпептид, що є гомологом ростових факторів фібробластів, вибраний з групи:
і. поліпептидні молекули, що містять амінокислотну послідовність, показану в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 175 (Met);
іі. природні варіанти, які принаймні на 80 % ідентичні молекулам (а);
ііі. поліпептидні молекули, які принаймні на 80 % ідентичні амінокислотній послідовності, показаній в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 196 (Lys),
з другою молекулою, що містить препарат або лікарський засіб, для формування химерної сполуки;
причому поліпептид є таким, що стимулює проліферацію клітин, які походять з мезенхимних початкових клітин і їх попередників.
Текст
1. Ізольована полінуклеотидна молекула, що кодує поліпептид, який є гомологом ростових факторів фібробластів, вибрана з групи: і. полінуклеотидні молекули, що містять послідовність нуклеотидів, показану в послідовності SEQ ID NO: 1 як фрагмент від нуклеотиду 82 до нуклеотиду 621; іі. природні варіанти, які принаймні на 80 % ідентичні молекулам (i); ііі. полінуклеотидні молекули, що кодують поліпептид, який принаймні на 80 % ідентичний амінокислотній послідовності, показаній в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 207 (Ala), причому поліпептид, кодований полінуклеотидом, є таким, що стимулює проліферацію клітин, які походять з мезенхимних початкових клітин і їх попередників. 2. Ізольована полінуклеотидна молекула за п. 1, яка відрізняється тим, що відповідає послідовно 2 (19) 1 3 75316 4 термінатор транскрипції. залишку 28 (Glu) до амінокислотного залишку 196 6. Вектор експресії, що містить такі елементи, спо(Lys), лучені між собою для можливості виконання задапричому поліпептид є таким, що стимулює проліних функцій: ферацію клітин, які походять з мезенхимних почапромотор транскрипції; ткових клітин і їх попередників. сегмент ДНК, вибраний з групи: 11. Ізольований поліпептид, що є гомологом росі. полінуклеотидні молекули, що містять послідовтових факторів фібробластів, вибраний з групи: ність нуклеотидів, показану в послідовності SEQ ID і. поліпептидні молекули, що містять амінокислотNO: 6 як фрагмент від нуклеотиду 82 до нуклеотину послідовність, показану в послідовності SEQ ID ду 621; NO: 2 як фрагмент від амінокислотного залишку 28 іі. природні варіанти, які принаймні на 80 % іденти(Glu) до амінокислотного залишку 207 (Ala); чні молекулам (i); іі. природні варіанти, які принаймні на 80 % ідентиііі. полінуклеотидні молекули, що кодують поліпепчні молекулам (i); тид, який принаймні на 80 % ідентичний амінокисііі. поліпептидні молекули, які принаймні на 80 % лотній послідовності, показаній в послідовності ідентичні амінокислотній послідовності, показаній SEQ ID NO: 2 як фрагмент від амінокислотного в послідовності SEQ ID NO: 2 як фрагмент від амізалишку 28 (Glu) до амінокислотного залишку 207 нокислотного залишку 28 (Glu) до амінокислотного (Ala); залишку 207 (Ala), термінатор транскрипції, причому поліпептид є таким, що стимулює проліпричому поліпептид, кодований полінуклеотидом, ферацію клітин, які походять з мезенхимних почає таким, що стимулює проліферацію клітин, які ткових клітин і їх попередників. походять з мезенхимних початкових клітин і їх по12. Поліпептид, що є гомологом ростових факторів фібробластів, за п. 10, який відрізняється тим, передників. 7. Культивована клітина, в яку введений вектор що містить сигнальну послідовність. експресії за будь-яким з пп. 5-6, причому згадана 13. Поліпептид, що є гомологом ростових факторів фібробластів, за п. 10, який відрізняється тим, клітина забезпечує експресію поліпептиду, кодованого фрагментом ДНК. що містить сигнальну послідовність, показану в 8. Спосіб одержання поліпептиду, що є гомологом послідовності SEQ ID NO: 2 як фрагмент від аміноростових факторів фібробластів, згідно з яким викислотного залишку 1 (Met) до амінокислотного конуються такі процедури: залишку 27 (Ala). культивування клітини, в яку введений вектор екс14. Фармацевтичний засіб для стимуляції проліпресії згідно з будь-яким з пп. 5-6, внаслідок чого ферації клітин, які походять з мезенхимних початзгадана клітина забезпечує експресію поліпептиду, кових клітин і їх попередників, який містить очищо є гомологом ростових факторів фібробластів, щений поліпептид, що є гомологом ростових кодованого фрагментом ДНК; факторів фібробластів, за п. 10, у поєднанні з фавиділення поліпептиду, що є гомологом ростових рмацевтично прийнятною речовиною-носієм. факторів фібробластів. 15. Антитіло, яке специфічно зв’язується з поліпе9. Ізольований поліпептид, що є гомологом ростоптидною молекулою, що містить амінокислотну вих факторів фібробластів, вибраний з групи: послідовність, показану в послідовності SEQ ID і. поліпептидні молекули, що містять амінокислотNO: 2 як фрагмент від амінокислотного залишку 1 ну послідовність, показану в послідовності SEQ ID (Met) до амінокислотного залишку 207 (Ala). 16. Антитіло за п. 15, яке відрізняється тим, що NO: 2 як фрагмент від амінокислотного залишку 28 (Glu) до амінокислотного залишку 175 (Met); специфічно зв’язується з поліпептидною молекуіі. природні варіанти, які принаймні на 80 % ідентилою, що містить амінокислотну послідовність, почні молекулам (i); казану в послідовності SEQ ID NO: 2 як фрагмент ііі. поліпептидні молекули, які принаймні на 80 % від амінокислотного залишку 28 (Glu) до амінокисідентичні послідовності, показаній в послідовності лотного залишку 196 (Lys). SEQ ID NO: 2 як фрагмент від амінокислотного 17. Спосіб стимуляції росту міоцитів або клітинзалишку 28 (Glu) до амінокислотного залишку 175 попередників міоцитів у ссавців, яким необхідна (Met), така стимуляція, який включає: причому поліпептид, кодований полінуклеотидом, і. введення ефективної кількості поліпептиду, що є є таким, що стимулює проліферацію клітин, які гомологом ростових факторів фібробластів, за походять з мезенхимних початкових клітин і їх поодним з пп. 9-13; передників. іі. вимірювання збільшення розмірів і кількості клі10. Ізольований поліпептид, що є гомологом ростин-попередників міоцитів або міоцитів у ссавця тових факторів фібробластів, вибраний з групи: порівняно з цими показниками у контрольних тваі. поліпептидні молекули, що містять амінокислотрин. 18. Спосіб стимуляції за п. 17, який відрізняється ну послідовність, показану в послідовності SEQ ID NO: 2 як фрагмент від амінокислотного залишку 28 тим, що міоцитами або клітинами-попередниками (Glu) до амінокислотного залишку 196 (Lys); міоцитів є серцеві міоцити або клітиниіі. природні варіанти, які принаймні на 80 % ідентипопередники серцевих міоцитів. чні молекулам (а); 19. Спосіб стимуляції, в умовах поза живими оргаііі. поліпептидні молекули, які принаймні на 80 % нізмами, росту клітин-попередників міоцитів або ідентичні послідовності, показаній в послідовності міоцитів, який включає: SEQ ID NO: 2 як фрагмент від амінокислотного і. культивування клітин-попередників міоцитів або міоцитів разом з поліпептидом, що є гомологом 5 75316 6 ростових факторів фібробластів, за одним з пп. 9– і. поліпептидні молекули, що містять амінокислот13; ну послідовність, показану в послідовності SEQ ID іі. вимірювання кількості клітин-попередників міоNO: 2 як фрагмент від амінокислотного залишку 28 цитів або міоцитів у клітинах серцевої тканини, які (Glu) до амінокислотного залишку 175 (Met); культивують у культуральному середовищі із згаіі. природні варіанти, які принаймні на 80 % ідентиданим поліпептидом, і порівнювання її з кількістю чні молекулам (а); клітин-попередників міоцитів або міоцитів у клітиііі. поліпептидні молекули, які принаймні на 80 % нах серцевої тканини, які культивують за відсутноідентичні амінокислотній послідовності, показаній сті згаданого поліпептиду, що є гомологом ростов послідовності SEQ ID NO: 2 як фрагмент від амівих факторів фібробластів. нокислотного залишку 28 (Glu) до амінокислотного 20. Спосіб за п. 19, який відрізняється тим, що залишку 196 (Lys), міоцити або клітини-попередники міоцитів є серз другою молекулою, що містить препарат або цевими міоцитами або клітинами-попередниками лікарський засіб, для формування химерної сполусерцевих міоцитів. ки; 21. Спосіб одержання химернї сполуки, згідно з причому поліпептид є таким, що стимулює проліяким виконуються такі процедури: ферацію клітин, які походять з мезенхимних почасполучення першої молекули, яка містить поліпепткових клітин і їх попередників. тид, що є гомологом ростових факторів фібробластів, вибраний з групи: Ця патентна заявка є спорідненою з попередньою патентною заявкою 60/028,646, поданою 16 жовтня 1996 року. Відповідно до розділу 35 Зводу законів США, пункт 119 (е) (1), заявка, що пропонується, є документом, згідно з яким заявляються права на переваги, що забезпечуються згаданою попередньою заявкою. До групи ростових факторів фібробластів (FGF) належать принаймні дев'ять різних ростових факторів [Basilico et al., Adv. Cancer Res. 59:115165, 1992; Ferning et al., Prog. Growth Factor Res. 5(4):353-377, 1994], які взагалі діють як мітогени щодо клітин різних типів, охоплюючи широкий діапазон таких клітин. Наприклад, основний ростовий фактор фібробластів (відомий також як ростовий фактор FGF-2) є мітогенним, в умовах поза живими організмами, щодо ендотеліальних клітин, клітин судинних гладеньких м'язів, фібробластів і, взагалі, щодо клітин мезодермального або нейроектодермального походження, включаючи серцеві і скелетні міоцити [Gospodarowicz et al., J. Cell. Biolog. 70:395-405, 1976; Gospodarowicz et al., J. Cell. Biolog. 89: 568-578,1981; Kardami, J. Mol. Cell. Biochem. 92:124-134, 1990]. Показано, що в живих організмах ростовий фактор bFGF має важливе значення для розвитку серця у птахів [Sugi et al., Dev. Biol. 168:567-574, 1995; Mima et al., Proc. Nat'l. Acad. Sci. 92:467-471, 1995], а також стимулює розвиток колатеральних коронарних судин у собак [Lazarous et al., Circulation 94:1074-1082, 1996]. Крім того, були продемонстровані немітогенні дії різних ростових факторів, що належать до групи ростових факторів фібробластів. До дій, що характерні для кислотного або основного ростового фактора фібробластів, але не зв'язані з ростом клітин, належать такі: підвищене виділяння, в ендотеліальних клітинах, активатора плазміногену в тканинах; стимуляція синтезу позаклітинного матеріалу; хемотаксис для ендотеліальних клітин; примусова експресія генів, що спричиняють ембріональні скорочення, у кардіоміоцитах [Parker et al., J. Clin. Invest. 85:507-514, 1990]; підвищення реак тивності гормонів гіпофізу [Baird et al., J. Cellular Physiol. 5:101-106, 1987]. У декількох членів групи ростових факторів фібробластів відсутня сигнальна послідовність (ростові фактори aFGF, bFGF і, можливо, FGF-9), внаслідок чого не можна очікувати секреції таких ростових факторів. Крім того, деякі ростові фактори з групи ростових факторів фібробластів можуть мігрувати в ядра клітин [Friesel et al., FASEB 9:919925, 1995]. Всі ростові фактори з групи ростових факторів фібробластів зв'язують гепарин на основі структурної подібності. Структурна гомологія об'єднує різні зразки таким чином, щоб зберегти характерні для них структурні і функціональні взаємозв'язки [Omitz et al., J. Biol. Chem. 271(25): 1529215297, 1996]. Існують чотири відомі позаклітинні рецептори ростових факторів фібробластів (рецептори FGFR) і всі ці рецептори являють собою тирозинкінази. Взагалі, ростові фактори, що належать до групи ростових факторів фібробластів, зв'язуються з усіма відомими рецепторами ростових факторів фібробластів, але специфічні ростові фактори фібробластів зв'язуються з специфічними рецепторами з більшою мірою спорідненості. Іншими засобами забезпечення специфічності ростових факторів, що належать до групи ростових факторів фібробластів, є просторова і часова експресія лігандів і їхніх рецепторів у процесі ембріогенезу. На підставі доказів можна стверджувати, що ростові фактори фібробластів діють, найбільш імовірно, тільки як ростові фактори з автокринною або паракринною дією, завдяки їх спорідненості при зв'язуванні гепарину, внаслідок чого обмежується дифузія ростових факторів фібробластів від місця їх виділяння [Flaumenhaft et al., J. Cell. Biol. 111(4): 1651-1659, 1990]. В основному ростовому факторі фібробластів відсутня сигнальна послідовність і тому дія цього ростового фактора обмежена і можлива тільки як автокринна або паракринна дія. Обгрунтовано доказано, що основний ростовий фактор фібробластів зберігається всередині клітин 7 75316 8 і виділяється після пошкодження тканини. ПоказаСерцеві хвороби є основною причиною смертно, що основний ростовий фактор фібробластів ності в США і кількість смертей внаслідок цих хвомає дві зони зв'язування з рецепторами, які відрізроб становить до 30% ycix смертей. У лікарнях няються від зони зв'язування гепарину [Abraham et США щороку лікуються понад 750 тисяч пацієнтів з al., EMBO J. 5(10):2523-2528, 1986]. інфарктом міокарда, при наявності більше 5 мільПоказано, що рецептор FGFR-3 має важливе йонів хворих з діагнозом коронарної хвороби серзначення для росту кісток. У мишей, яким гомозиця. До факторів риску у зв'язку з інфарктом міокаготно забезпечували відсутність рецептора FGFRрда належать цукровий діабет, гіпертензія, 3 (-/-), спостерігались післяродові аномалії скелета ожиріння, паління, високий рівень ліпопротеїду [CoІvin et al., Nature Genet. 12:309-397, 1996; Deng низької густини в плазмі крові, а також генетична et al., Cell 84:911-921, 1996]. На підставі мутантносхильність. го фенотипу можна зробити висновок, що в норСерцева гіперплазія являє собою підвищення мальних мишей рецептор FGFR-3 є необхідним інтенсивності росту серцевих міоцитів. Показано, для регуляції поділу хондроцитових клітин у зоні що в людей і пацюків серцева гіперплазія розвиростової оболонки кістки [Goldfarb, Cytokine and вається в процесі нормального старіння організму Growth Factor Rev. 7(4): 311-325, 1996]. Ліганд для [Olivetti et al., J. Am. Coll. Cardiol. 24(1): 140-149, рецептора FGFR-3 у ростовій оболонці кістки не 1994; Anversa et al., Сіrc. Rec. 67:871-885, 1990], а виявлений. в пацюків також у випадках кардіоміопатії, спричиНезважаючи на те, що були виявлені тільки неної катехоламіном [Deisher et al., Am. J. чотири рецептори ростових факторів фібробласCaediovasc. Pathol. 5(1):79-88, 1994]. Спірними тів, причому всі ці рецептори, як показано, мають залишаються погляди на те, що є причиною згадафункціональні варіанти, що утворюються в реного підвищення інтенсивності росту міоцитів зультаті сплайсингу, цілком імовірним є також ісвплив певної клітини-попередника чи результат нування нових рецепторів ростових факторів фібросту клітин, диференціація яких більшою мірою робластів. Наприклад, не виявлений рецептор для проявляється з часом. ізоформи FGF-8a [MacArthur et al., J. Virol. Однак, оскільки інфаркти та інші причини нек69(4):2501-2507, 1995]. розу міокарда проявляються як такі порушення, Ростовий фактор FGF-8 являє собою такий наслідки яких неможливо усунути, можна зробити ростовий фактор з групи ростових факторів фібвисновок, що нормальні процеси при серцевій гіробластів, який спочатку був виділений з ракових перплазії не можуть компенсувати значну втрату клітин молочної залози як мітоген, спричинений міоцитів і тому необхідні екзогенні фактори, які б андрогеном. Цей ростовий фактор був приєднаний стимулювали гіперплазію і забезпечували, як кіндо хромосоми людини 10q25-q26 [White et al., цевий результат, відновлення спроможності серця Genomics 30:109-111, 1995]. Ростовий фактор правильно функціонувати. FGF-8 бере участь у розвитку кінцівок ембріона Реконструкція кісток являє собою динамічний [Vogel et al., Development 122:1737-1750, 1996; процес, який забезпечує збереження маси кісткоTanaka et al., Current Biology 5(6):594-597, 1995]. вих тканин і форми скелета. Процес реконструкції Експресія ростового фактора FGF-8 у процесі емзабезпечує рівновагу між процесом резорбції і бріогенезу в серцевих, сечостатевих і невральних процесом формування кістки, причому вважаєтьтканинах показує, що цей ростовий фактор може ся, що в процесі реконструкції основне значення бути необхідним для росту згаданих тканин мають клітини двох типів. Такими клітинами є [Crossley et al., Development 121:439-451, 1995]. остеобласти і остеокласти. Остеобласти забезпеІснують докази того, що акроцефалосиндактилія, чують синтез і відкладення кісткового матеріалу тобто природжена аномалія, що характеризується для формування нової кістки. Дія остеобластів і баштоподібним черепом і перетинчастими пальостеокластів регулюється багатьма системними і цями рук та ніг, зв'язана з точковими мутаціями локальними факторами, до яких належать і росторостового фактора FGF-8 [White et al., Genomics ві фактори. 30:109-111, 1995]. Незважаючи на те, що взаємодія між локальРостовий фактор FGF-8 має п'ять екзонів, на ними і системними ростовими факторами повністю відміну від інших відомих ростових факторів фібне визначена, існує однозначна думка щодо того, робластів, які мають тільки по три екзони. Перші що ростові фактори мають основне значення для три екзони ростового фактора FGF-8 відповідають процесів регуляції при нормальній реконструкції першому екзону інших ростових факторів фібробкісток скелета і при заживанні переломів кісток. До ластів [MacArthur et al., Development 121:3603деяких ростових факторів, виявлених у кістках, 3613, 1995]. Ген людини, що відповідає ростовому належать ростові фактори IGF-I, IGF-II, TOF- 1, фактору FGF-8, кодує чотири ізоформи, які відрізTGF- 2, bFGF, aFGF, PDGF, а також група кістконяються своїми N-кінцевими зонами, тобто ізофових морфогенних протеїнів [Baylink et al., J. Bone рми а, b, e, f згаданого ростового фактора, на відMineral Res. 8 (Supp.2):S565-S572, 1993]. міну від гена миші або пацюка, який породжує вісім Якщо інтенсивність процесу резорбції кістки ізоформ ростового фактора FGF-8 [Crossley et al., перевищує інтенсивність процесу формування Development 121:439-451, 1995]. Протеїни FGF-8a і кістки, то виникає чиста втрата маси кістки і підFGF-80 людини на 100% відповідають протеїнам вищується можливість переломів кістки. Зменшенмишей і пацюків, а протеїни FGF-8е і FGF-8f заня інтенсивності формування кісток пов'язане з безпечують гомологію між протеїнами людини і старінням організму і певними патологічними стамиші на 98% [Gemel et al., Genomics 35:253-257, нами. Тільки в США щороку реєструється прибли1996]. зно 1,5 мільйонів переломів кісток, зумовлених 9 75316 10 остеопорозом. Вплив таких переломів на якість послідовності SEQ ID NO: 1 як фрагмент від нукжиття пацієнтів дуже значний. Відповідні кошти, які лютида 82 до нукліотида 621; б) алель ні варіанти витрачаються в системі охорони здоров'я в США, молекул (а), в) полінукліотидні молекули, що кощороку оцінюються сумою 5-10 мільярдів доларів дують поліпептид, який принаймні на 60% ідентичСША, без врахування коштів на лікування хронічний амінокислотній послідовності, показаній в посних хворих. лідовності SEQ ID NO: 2 як фрагмент від До інших випадків терапевтичного викорисамінокислотного залишку 28 (Glu) до амінокислоттання ростових факторів, які впливають на процес ного залишку 207 (Ala), і г) полінукліотидні молекуреконструкції кісток, належить, наприклад, викорили, що містять послідовність нукліотидів, показану стання ростових факторів при лікуванні пошков послідовності SEQ ID NO: 6 як фрагмент від нукджень кісток, для якого необхідний ріст остеобласліотида 82 до нукліотида 621; тів, наприклад пошкоджень при переломах кісток, термінатор транскрипції. а також для стимуляції процесів росту мезенхимВідповідно до ще однієї характерної особлиних клітин і синтезу внутрішньої покривної кістки, вості винаходу, цей винахід забезпечує створення які визнані необхідними для заживання переломів культивованої клітини, в яку введений вектор екскісток [Joyce et al., 36th Annual Meeting, пресії, що містить нижчезазначені елементи, споOrthopaedic Research Society, February 5-8, 1990, лучені між собою для можливості виконання задаNew Orleans, LA]. них функцій: промотор транскрипції; сегмент Винахід, що пропонується, забезпечує ствомолекули ДНК, вибраний з групи молекул, до якої рення необхідних поліпептидів для вищезгаданих належать а) полінукліотидні молекули, що містять та інших випадків використання ростових фактопослідовність нукліотидів, показану в послідовносрів, а інформація про такі поліпептиди, зрозуміла ті SEQ ID NO: 1 як фрагмент від нукліотида 82 до для спеціалістів у даній галузі, наведена нижче в нукліотида 621, б) алельні варіанти молекул (а), в) описі винаходу. полінукліотидні молекули, що кодують поліпептид, Відповідно до першої характерної особливості який принаймні на 60% ідентичний амінокислотній винаходу, цей винахід забезпечує створення ізопослідовності, показаній в послідовності SEQ ID льованої полінукліотидної молекули, що кодує NO: 2 як фрагмент від амінокислотного залишку 28 поліпептид, який є гомологом ростових факторів (Glu) до амінокислотного залишку 207 (Ala), і г) фібробластів (FGF), вибраної з групи полінукліополінукліотидш молекули, що містять послідовтидних молекул, до якої належать: ність нукліотидів, показану в послідовності SEQ ID а) полінукліотидні молекули, що містять посліNO: 6 як фрагмент від нукліотида 82 до нукліотида довність нукліотидів, показану в послідовності 621; термінатор транскрипції, SEQ ID NO: 1 як фрагмент від нукліотида 82 до внаслідок чого згадана культивована клітина нукліотида 621; забезпечує експресію поліпептиду, кодованого б) алельні варіанти молекул (а); сегментом послідовності ДНК. в) полінукліотидні молекули, що кодують поліВідповідно до ще однієї характерної особлипептид, який принаймні на 60 % ідентичний аміновості винаходу, цей винахід забезпечує метод фокислотній послідовності, показаній в послідовності рмування поліпептиду, що є гомологом ростових SEQ ID NO: 2 як фрагмент від амінокислотного факторів фібробластів, згідно з яким виконуються залишку 28 (Glu) до амінокислотного залишку 207 такі процедури: (Ala); створення культивованої клітини, в яку введег) полінукліотидні молекули, що містять посліний вектор експресії, який містить такі елементи, довність нукліотидів, показану в послідовності сполучені між собою для можливості виконання SEQ ID NO: 6 як фрагмент від нукліотида 82 до заданих функцій: промотор транскрипції; сегмент нукліотида 621. молекули ДНК, вибраний з групи молекул, до якої Згідно з одним варіантом реалізації винаходу, належать а) полінукліотидні молекули, що містять ізольована полінукліотидна молекула містить поспослідовність нукліотидів, показану в послідовнослідовність нукліотидів, показану в послідовності ті SEQ ID NO: 1 як фрагмент від нукліотида 82 до SEQ ID NO: I як фрагмент від нукліотида 1 до нукнукліотида 621, б) алельні варіанти молекул (а), в) ліотида 621, або послідовність нукліотидів, покаполінукліотидні молекули, що кодують поліпептид, зану в послідовності SEQ ID NO: 6 як фрагмент від який принаймні на 60% ідентичний амінокислотній нукліотида 1 до нукліотида 621. послідовності, показаній в послідовності SEQ ID Згідно з іншим варіантом реалізації винаходу, NO: 2 як фрагмент від амінокислотного залишку 28 ізольована полінукліотидна молекула містить пос(Glu) до амінокислотного залишку 207 (Ala), і г) лідовність нукліотидів, показану в послідовності полінукліотидні молекули, що містять послідовSEQ ID NO: I як фрагмент від нукліотида 82 до ність нукліотидів, показану в послідовності SEQ ID нукліотида 621. NO: 6 як фрагмент від нукліотида 82 до нукліотида Відповідно до другої характерної особливості 621; термінатор транскрипції, внаслідок чого згавинаходу, цей винахід забезпечує створення векдана культивована клітина забезпечує експресію тора експресії, який містить нижчезазначені елеполіпептиду, що є гомологом ростових факторів менти, сполучені між собою для можливості викофібробластів, кодованого сегментом послідовності нання заданих функцій: ДНК; промотор транскрипції; виділяння поліпептиду, що є гомологом ростосегмент молекули ДНК, вибраної з групи молевих факторів фібробластів. кул, до якої належать а) полінукліотидні молекули, Відповідно до ще однієї характерної особлищо містять послідовність нукліотидів, показану в вості винаходу, цей винахід забезпечує створення 11 75316 12 ізольованого поліпептиду, щоє гомологом ростомолекули, яка містить амінокислотну послідоввих факторів фібробластів, вибраного з групи моність, показану в послідовності SEQ ID NO: 2 як лекул, до якої належать: фрагмент від амінокислотного залишку 1 (Met) до а) поліпептидні молекули, що містять амінокиамінокислотного залишку 207 (Ala). слотну послідовність, показану в послідовності Згідно з іншим варіантом реалізації винаходу, SEQ ID NO: 2 як фрагмент від амінокислотного цей винахід забезпечує створення антитіла, що залишку 28 (Glu) до амінокислотного залишку 175 зв'язується з поліпептидною молекулою, яка міс(Met); тить амінокислотну послідовність, показану в посб) алельні варіанти молекул (а); лідовності SEQ ID NO: 2 як фрагмент від амінокив) поліпептидні молекули, що принаймні на слотного залишку 28 (Glu) до амінокислотного 60% ідентичні амінокислотній послідовності, показалишку 196 (Lys). заній в послідовності SEQ ID NO: 2 як фрагмент Відповідно до ще однієї характерної особливід амінокислотного залишку 28 (Glu) до амінокисвості винаходу, цей винахід забезпечує метод лотного залишку 175 (Met). стимуляції росту міоцитів або клітин-попередників Відповідно до ще однієї характерної особлиміоцитів за допомогою введення ссавцям, яким вості винаходу, цей винахід забезпечує створення необхідна згадана стимуляція, такої кількості поліізольованого поліпептиду, що є гомологом ростопептиду, що є гомологом ростових факторів фібвих факторів фібробластів, вибраного з групи моробластів, яка достатня для клінічно значущого лекул, до якої належать: підвищення кількості міоцитів або клітина) поліпептидні молекули, що містять амінокипопередників міоцитів у таких ссавців. слотну послідовність, показану в послідовності Згідно з іншим варіантом реалізації винаходу, SEQ ID NO: 2 як фрагмент від амінокислотного цей винахід забезпечує метод стимуляції росту залишку 28 (Glu) до амінокислотного залишку 196 міоцитів або клітин-попередників міоцитів у випад(Lys); ку, коли міоцити або клітини-попередники міоцитів б) алельні варіанти молекул (а); являють собою, відповідно, серцеві міоцити або в) поліпептидні молекули, що принаймні на клітини-попередники серцевих міоцитів. 60% ідентичні амінокислотній послідовності, покаВідповідно до ще однієї характерної особлизаній в послідовності SEQ ID NO: 2 як фрагмент вості винаходу, цей винахід забезпечує метод від амінокислотного залишку 28 (Glu) до амінокисстимуляції, в умовах поза живими організмами, лотного залишку 196 (Lys). клітин-попередників міоцитів або міоцитів, згідно з Згідно з іншим варіантом реалізації винаходу, яким культивують клітини серцевої тканини разом цей винахід забезпечує створення ізольованого з такою кількістю поліпептиду, що є гомологом поліпептиду, що є гомологом ростових факторів ростових факторів фібробластів, яка достатня для фібробластів, вибраного з групи молекул, до якої збільшення кількості клітин-попередників міоцитів належать: або міоцитів у клітинах серцевої тканини, культиа) поліпептидні молекули, що містять амінокивованих у присутності поліпептиду, що є гомолослотну послідовність, показану в послідовності гом ростових факторів фібробластів, порівняно з SEQ ID NO: 2 як фрагмент від амінокислотного кількістю клітин-попередників міоцитів або міоцитів залишку 28 (Glu) до амінокислотного залишку 207 у серцевій тканині, культивованих при відсутності (Ala); поліпептиду, що є гомологом ростових факторів б) алельні варіанти молекул (а); фібробластів. в) поліпептидні молекули, що принаймні на Згідно з іншим варіантом реалізації винаходу, 60% ідентичні амінокислотній послідовності, покацей винахід забезпечує метод стимуляції, в умозаній в послідовності SEQ ID NO: 2 як фрагмент вах поза живими організмами, росту клітинвід амінокислотного залишку 28 (Glu) до амінокиспопередників міоцитів або міоцитів у випадку, коли лотного залишку 207 (АІа). міоцити або клітини-попередники міоцитів являють Згідно з додатковим варіантом реалізації висобою, відповідно, серцеві міоцити або клітининаходу, цей винахід забезпечує створення поліпепопередники серцевих міоцитів. птиду, що є гомологом ростових факторів фібробВідповідно до ще однієї характерної особлиластів, який додатково містить сигнальну вості винаходу, цей винахід забезпечує метод випослідовність. бірного введення препарату або лікарського засоЗгідно з іншим варіантом реалізації винаходу, бу в серцеву тканину, згідно з яким виконуються цей винахід забезпечує створення поліпептиду, що такі процедури: є гомологом ростових факторів фібробластів, який сполучення першої молекули, яка містить помістить також сигнальну послідовність, показану в ліпептид, що є гомологом ростових факторів фібпослідовності SEQ ID NO: 2 як фрагмент від аміноробластів, з другою молекулою, що являє собою кислотного залишку 1 (Met) до амінокислотного препарат або лікарський засіб, з метою створення залишку 27 (Ala). химерної сполуки; Цей винахід забезпечує також створення фавведення химерної сполуки в серцеву тканину. рмацевтичного засобу, який містить очищений Фіг.1 і 2 ілюструють результати взаємного пополіпептид, що є гомологом ростових факторів рівняння структур фактора 1 (FHF-1), що є гомолофібробластів, у поєднанні з фармацевтично пригом ростових факторів фібробластів людини, росйнятною речовиною-носієм. тового фактора FGF-10, що активізує міоцити Відповідно до ще однієї характерної особлилюдини, ростового фактора 4 (FHF-4), що є гомовості винаходу, цей винахід забезпечує створення логом ростових факторів фібробластів людини, антитіла, що зв'язується з епітопом поліпептидної ростового фактора 2 (FHF-2), що є гомологом рос 13 75316 14 тових факторів фібробластів людини, ростового генного середовища, так що в цій полінукліотидній фактора 3 (FHF-3), що є гомологом ростових факмолекулі відсутні інші зовнішні або небажані кодуторів фібробластів людини, ростового фактора вальні послідовності, і має форму, яка забезпечує FGF-4 людини, ростового фактора FGF-6 людини, можливість використання такої полінукліотидної ростового фактора FGF-2 людини (основного), молекули в системах виробництва протеїнів меторостового фактора FGF-1 людини (кислотного), дами генної інженерії. Такими ізольованими молеростового фактора 2 (KGF-2) кератиноцитів людикулами є молекули, які відокремлені від свого прини, попередника KGF-7 ростового фактора керародного генного середовища, і до цих молекул тиноцитів людини, ростового фактора zFGF-5 люналежать комплементарні ДНК і геномні клони. В дини, ростового фактора FGF-8 людини, ростового ізольованих молекулах ДНК, які розглядаються в фактора FGF-5 людини, ростового фактора FGF-9 цьому винаході, відсутні інші гени, які характерні людини і ростового фактора FGF-3 людини. Знак для цих молекул у природному стані, але можуть бути присутні природні 5'-кінцеві і 3'-кінцеві нетра" " використовується для позначення консерватинсльовані зони, наприклад зони промотора і тервних амінокислот, знак ":" використовується для мінатора. Ідентифікація зон, зв'язаних з ізольовапозначення замін консервативних амінокислот, а ною молекулою, є очевидною для звичайних знак "." використовується для позначення замін спеціалістів у даній галузі (див., наприклад, працю амінокислот з менш вираженою консервативністю. [Dynan and Tijan, Nature 316:774-778, 1985]). ТерНа Фіг.3 показана таблиця подібності ростових мін "ізольований" щодо протеїну означає, що профакторів у межах групи ростових факторів, в якій теїн виявлений в середовищі, відмінному від серенаведені дані, виражені у відсотках, які показують, довища, природного для цього протеїну, наскільки ідентичними, при взаємному порівнянні, наприклад не в крові або тканині тваринного похоє ростові фактори людини FGF-5, FGF-6, FGF-7, дження. У переважній формі ізольований протеїн FGF-8, FGF-9, zFGF-5, FGF-10, FGF-1, FHF-1, значною мірою вільний від домішок інших протеїFGF-2, FHF-2, FHF-4, FGF-3, KGF-2, FHF-3 і нів, зокрема від домішок інших протеїнів тваринноFGF-4. го походження. Переважно, необхідно використоТермін "ортолог" (або термін "гомолог щодо рівувати дуже чистий протеїн, тобто з чистотою зних зразків") означає поліпептид або протеїн, більше 95%, а більш переважно - з чистотою біодержаний з одного зразка, який є гомологом анальше 99%. логічного поліпептиду або протеїну, одержаного з Термін "сполучені для можливості виконання іншого зразка. заданих функцій", якщо він стосується сегментів Термін "паралог" означає поліпептид або проДНК, означає, що сегменти сполучені таким чином, теїн, одержаний з певного зразка, який є гомолощо в стані після сполучення стає можливим здійсгом іншого поліпептиду або протеїну, одержаного з нення реакцій відповідно до заданих цілей, наприцього ж зразка. клад, реакція транскрипції починається в зоні проТермін "алельний варіант" означає будь-яку з мотора і продовжуються вздовж послідовності двох або більшої кількості альтернативних форм кодувального сегмента до досягнення термінатогена, розташованого в одному і тому ж локусі хрора. мосоми. Алельні варіанти утворюються природно, Термін "полінукліотид" означає однонитковий завдяки мутаціям, і можуть бути причиною феноабо двонитковий полімер, що складається з гететипного поліморфізму в межах популяцій. Мутації роциклічних основ дезоксирибонуклеїнової або генів можуть бути невираженими (зміни в кодоварибонуклеїнової кислоти, послідовність яких зчиних поліпептидах відсутні) або можуть спричиняти тується в напрямі від 5-кінця до 3-кінця. Полінуклікодування таких поліпептидів, які мають зміни в отидами є ДНК і РНК; полінукліотиди можуть бути амінокислотній послідовності. Термін "алельний ізольовані від свого природного середовища, синваріант" використовується в цьому описі винаходу тезовані в умовах поза живими організмами або також для позначення протезну, кодованого алесформовані в результаті об'єднання природних і льним варіантом гена. синтетичних молекул. Термін "вектор експресії" означає молекулу Термін "комплементи полінукліотидних молеДНК, лінійну або кільцеву, яка містить сегмент, що кул" означає полінукліотидні молекули у вигляді кодує необхідний поліпептид, який сполучений, послідовності комплементарних гетероциклічних для можливості виконання заданих функцій, з дооснов, яка має зворотну орієнтацію порівняно з датковими сегментами, які забезпечують транскорієнтацією, характерною для первинної послідоврипцію, тобто зчитування генетичного коду, заданості. Наприклад, послідовність 5' ATGCACGGG 3' ного згаданим кодувальним сегментом. Згадані є комплементарною щодо послідовності 5' додаткові сегменти можуть містити послідовності CCCGTGCAT 3'. промотора і термінатора, а також можуть містити, Термін "дегенеративна нукліотидна послідовдодатково, одну або декілька зон початку репліканість" означає послідовність нукліотидів, яка місції, один або декілька вибіркових маркерів, послітить один або декілька дегенеративних кодонів довність, що підсилює реплікацію, сигналізатор (порівняно з первинною полінукліотидною молекуполіаденілування і тому подібні елементи. Як пралою, що кодує поліпептид). Дегенеративні кодони вило, вектори експресії формують з плазмідних містять різні триплети нукліотидів, але кодують або вірусних ДНК, а іноді вектор експресії містить один і той же амінокислотний залишок (наприклад, елементи як плазмідної, так і вірусної ДНК. кожний з триплетів GAU і GAC кодує амінокислотТермін "ізольована", якщо він стосується поліний залишок Asp). нукліотидної молекули, означає, що полінукліотиТермін "промотор" означає секцію гена, що мідна молекула переміщена із свого природного 15 75316 16 стить послідовності ДНК, які забезпечують зв'язутового фактора FGF-8. Аналіз поширення матричвання РНК-полімерази та ініціацію процесу трансної РHК, яка відповідає цій новій послідовності крипції. Як правило, але не завжди, послідовності ДНК, у тканинах показав, що найбільша експресія промотора розташовані в 5'-кінцевих, некодувальспостерігається в серцевих тканинах ембріонів і них зонах генів. серцевих тканинах дорослих організмів, а потім Термін "секреторна сигнальна послідовність" рівень експреси поступово зменшується, залишаозначає послідовність ДНК, що кодує поліпептид ючись помітним, у такому порядку: легеневі ткани("секреторний пептид"), який, як компонент більни ембріонів, тканини скелетних м'язів і тканини шого поліпептиду, спрямовує більший поліпептид гладеньких м'язів, наприклад м'язів тонкої кишки, на здійснення секреторних реакцій обміну в клітитовстої кишки і трахеї. Поліпептид, що є гомологом ні, в якій він синтезується. Як правило, більший ростових факторів фібробластів, був позначений поліпептид розщеплюється для того, щоб видаляяк zFGF-5. ти секреторний пептид у процесі здійснення секреНові поліпептиди zFGF-5, що розглядаються в торних реакцій обміну. цьому винаході, спочатку були виявлені в резульТермін "рецептор" означає протеїн, присутній таті аналізу бази даних EST (набір послідовносв клітині, який зв'язується з біологічно активною тей, що являють собою продукти експресії генів), молекулою (тобто лігандом) і передає дію ліганду здійснюваного з метою пошуку ростових факторів. на клітину. Для рецепторів, зв'язаних з клітинною У наборі EST була виявлена одна послідовність, оболонкою, характерна багатозонна структура з яка, за результатами прогнозування, є споріднедвома зонами, якими є позаклітинна зона, що заною з послідовностями, що належать до групи безпечує зв'язування з лігандом, і внутрішньокліростових факторів фібробластів. Новий поліпептинна зона ефектора, яка, як правило, забезпечує тид, що є гомологом ростових факторів фіброблапередачу сигналу. Зв'язування ліганду з рецептостів, кодований первинною, непроцесованою комром спричиняє зміну структури рецептора, внасліплементарною ДНК, має символічну формулу док чого зона ефектора починає взаємодіяти з CXFXEX{6}Y, де X - амінокислота, а Х{ } - кількість другими молекулами клітини. У свою чергу, внаамінокислот, що перевищує одиницю. Ця символіслідок такої взаємодії виникають зміни метаболізчна формула характерна для всіх відомих ростому в клітині. До метаболічних реакцій, які виникавих факторів, що належать до групи ростових фають у зв'язку з процесами взаємодії між кторів фібробластів, і є єдиною для цих протонів. рецептором і лігандом, належать такі: транскрипНукліотидна послідовність комплементарної ція гена, фосфорилування, дефосфорилування, ДНК поліпептиду zFGF-5 показана в послідовності збільшення кількості аденозинионофосфату при SEQ ID NO: 1, а відповідна похідна амінокислотна його циклічному синтезі, мобілізація клітинного послідовність показана в послідовності SEQ ID кальцію, мобілізація ліпідів клітинної оболонки, NO: 2. Якщо в послідовності SEQ ID NO: 2 порівз'єднання клітин, гідроліз ліпідів інозиту і гідроліз няти фрагмент від амінокислотного залишку 28 фосфоліпідів. У більшості випадків ядерні рецеп(Glu) до амінокислотного залишку 181 (GIn) з відтори також мають багатозонну структуру і містять повідним фрагментом ростового фактора FGF-8 аміно-кінцеву зону, зону трансактивації, зону зв'я(див. Фіг.1 і 2), то видно, що вихідна і похідна амізування з ДНК і зону зв'язування з лігандом. Взанокислотні послідовності ідентичні приблизно на галі, можливі такі рецептори: рецептори, зв'язані з 56%. клітинною оболонкою, цитозольні або ядерні; моНовий поліпептид, що кодується полінукліотиномерні рецептори (наприклад рецептор гормону, дом, який розглядається в цьому описі винаходу, що стимулює щитовидну залозу, бетамає фрагмент з символічною формулою адренорецептор) або полімерні рецептори (наприCXFXE{6}Y, який присутній у всіх ростових фактоклад рецептор PDGF, рецептор гормону росту, рах, що належать до групи ростових факторів фібрецептор IL-3, рецептор GM-CSF, рецептор Gробластів. Фрагменти з символічною формулою CSF, рецептор еригропоетину, рецептор IL-6). CXFXE{6}Y є дуже консервативними. УзагальнююТермін "пара комплемент-антикомплемент" чу типову амінокислотну послідовність, що відпоозначає неідентичні елементи, які у відповідних відає фрагменту з символічною формулою умовах утворюють стабільну пару з нековалентCXFXEX{6}Y, мають ростовий фактор 1 (FHF-1), ними зв'язками. Наприклад, біотин і авідин (або що є гомологом ростових факторів фібробластів стрептавідин) є елементами-прототипами пари людини [Smallwood et al., Proc. Natl. Acad. Sci. USA "комплемент-антикомплемент". Як приклади інших 93:9850-9857, 1996], ростовий фактор FGF-10, що пар "комплемент-антикомплемент", можна назвати активізує міоцити людини [HSU76381, ідентифікапари "рецептор-ліганд", пари "антитіло-антиген тор у системі банку даних GENBANK (гаптен або епітоп)", пари, що складаються із знаhttp://www.ncbi.nlm.nih.gov/], ростовий фактор 4 чущого і незначущого полінукліотидів і тому подіб(FHF-4), що є гомологом ростових факторів фіброні пари. Якщо бажаною є подальша дисоціація бластів людини [Smallwood et al., Proc. Natl. Acad. пари "комплемент-антикомплемент", то показник Sci. USA 93:9850-9857, 1996], ростовий фактор 2 спорідненості пари "комплемент-антикомплемент" (FHF-2), що є гомологом ростових факторів фібропри утворенні сполук повинен, переважно, не пебластів людини [Smallwood et al., Proc. Natl. Acad. ревищувати значення 109М-1. Sci. USA 93:9850-9857, 1996], ростовий фактор 3 Винахід, що пропонується, частково зробле(FHF-3), що є гомологом ростових факторів фіброний на основі відкриття нової послідовності ДНК, бластів людини [Smallwood et al., Proc. Natl. Acad. що кодує поліпептид, який є гомологом ростових Sci. USA 93:9850-9857, 1996], ростовий фактор факторів фібробластів і являє собою гомолог рослюдини FGF-4 [Basilico et al., Adv. Cancer Res. 17 75316 18 59:115-165, 1992], ростовий фактор FGF-6 людини жний з ростових факторів aFGF і bFGF містить три [Basilico et al., Adv. Cancer Res. 59:115-165, 1992], екзони, розділені двома інтронами змінної довжиростовий фактор FGF-2 людини (основний) ни. Ростовий фактор FGF-8 містить п'ять екзонів, з [Basilico et al., Adv. Cancer Res. 59:115-165, 1992], яких три відповідають першому екзону ростових ростовий фактор FGF-1 (кислотний) [Basilico et al., факторів aFGF і bFGF. Всі відомі ростові фактори Adv. Cancer Res. 59:115-165, 1992], ростовий факз групи ростових факторів фібробластів модифікотор 2 (KGF-2) кератиноцитів людини [HSU67918, вані, згідно з процедурою сплайсингу, для того, ідентифікатор у системі банку даних GENBANK щоб забезпечити можливість формування однакоhttp://www.ncbi.nlm.nih.gov/], попередник KGF-7 вих поліпептидів. ростового фактора кератиноцитів людини [Basilico Послідовність SEQ ID NO: 6 являє собою деet al., Adv. Cancer Res. 59:115-165, 1992], ростовий генеративну полінукліотидну послідовність, що фактор zFGF-5 людини, ростовий фактор FGF-8 охоплює всі полінукліотиди, які можуть кодувати людини [Gemel et al., Genomics 35:253-257, 1996], поліпептид 2FGF-5 відповідно до послідовності ростовий фактор FGF-5 людини [Basilico et al., SEQ ED NO: 2 (амінокислотні залишки від 1 або 28 Adv. Cancer Res. 59:115-165, 1992], ростовий факдо 207). Таким чином, у цьому винаході розглядатор FGF-9 людини [Miyamoto et al., Mol. Cell. Biol. ються полінукліотиди, що кодують поліпептид 13:4251-4259, 1993] і ростовий фактор FGF-3 люzFGF-5, які розташовані в діапазоні, показаному в дини [Basilico et al., Adv. Cancer Res. 59:115-165, послідовності SEQ ID NO: 6 як фрагмент від нуклі1992]. отида 1 або 82 до нукліотида 621. Крім того, у Аналіз комплементарної ДНК, що кодує поліцьому винаході розглядаються фрагменти і злиті пептид zFGF-5, (послідовність SEQ ID NO: 1) випротеїни, описані вище стосовно послідовності явив наявність відкритої рамки зчитування нукліоSEQ ID NO: 1, які формуються з аналогічних секцій тидної послідовності, яка забезпечує кодування послідовності SEQ ID NO: 6, причому нукліотиди 207 амінокислот (послідовність SEQ ID NO: 2) і яка від 82 до 621 послідовності SEQ ID NO: 6 відповімістить остаточно сформований поліпептид, що дають нукліотидам від 82 до 621 послідовності складається з 180 амінокислот (послідовність SEQ SEQ ID NO: 1, і які призначені для кодування остаID NO: 2; фрагмент від амінокислотного залишку точної молекули поліпептиду zFOF-5. 28 до амінокислотного залишку 207). Результати Позначення елементів послідовності SEQ ID взаємного порівняння поліпептиду zFGF-5 з іншиNO: 6 показані нижче в таблиці 1. ми відомими ростовими факторами фібробластів показали наявність фрагмента послідовності, який Таблиця 1 має високу ідентичність, у відсотках, з фрагментом послідовності SEQ ID NO: 2 від амінокислотного Нукліотид Елементи Комплемент Елементи залишку 127 (Cys) до амінокислотного залишку А А T Т 138 (Туr), як показано на рисунку. У декількох росС С G G тових факторів з групи ростових факторів фібробG G С С ластів відсутні сигнальні послідовності. Т Т А А R A|G Y С|Т Для ростових факторів з групи ростових факY С|Т R A|G торів фібробластів характерна наявність зон зв'яМ А|С К G|T зування з гепарином. Передбачувана зона зв'язуК G|T М А|С вання з гепарином для поліпептиду zFOF-5 S C|G S C|G виявлена у фрагменті послідовності SEQ ID NO: 2 C|G А|Т W А|Т від амінокислотного залишку 148 (Оіу) до амінокиН А|С|Т D A|G|T слотного залишку 169 (Gln). Вважається, що переВ C|G|T V A|C|G дача сигналів через рецептори починається після V A|C|G В C|G|T зв'язування з лігандом ростового фактора фібробD A|G|T Н A|C|T ластів у комплексі з сульфатними глікопротеїдами N A|C|G|T N A|C|G|T гепарину в поверхневій частині клітини. Багато ростових факторів з групи ростових факторів фібДегенеративні кодони, що використовуються в робластів можна об'єднати в одну або дві групи послідовності SEQ ID NO: 6, і всі можливі кодони споріднених ростових факторів на основі подібнодля заданих амінокислот показані нижче в табл. 2. сті структури і функцій цих ростових факторів. Ко 19 75316 20 Таблиця 2 Амінокислота Cys Ser Thr Pro Ala Gly Asn Asp Glu GІn His Arg Lys Met ІІe Leu Val Phe Туг Trp Тег Asn|Asp Glu|Gln Any Gap Позначення С S T P A G N D E Q H R К M I L V F Y W . В Z X Кодони TGC TGT AGC AGT TCA TCC TCG TCT АСА АСС ACG ACT CCA CCC CCG CCT GCA GCC GCG GCT GGA GGC GGG GGT AAC AAT GAC GAT GAA GAG CAA CAG CAC CAT AGA AGG CGA CGC CGG CGT AAA AAG ATG ATA АТС ATT СТА CTC CTG CTT TTA TTG GTA GTC GTG GTT TTC TTT TAC TAT TGG TAA TAG TGA Дегенеративний кодон TGY WSN ACN CCN GCN GGN AAY GAY GAR CAR CAY MGN AAR ATG ATH YTN GTN TTY TAY TGG TRR RAY SAR NNN -- Навіть для звичайного спеціаліста в даній галузі очевидною є деяка неоднозначність при визначенні дегенеративного кодона, який відповідає всім можливим колонам, що кодують кожну амінокислоту. Наприклад, дегенеративний кодон WSN для серину може, при певних умовах, кодувати аргінін ARG, а дегенеративний кодон MQN для аргініну може, при певних умовах, кодувати серин AGY. Подібний взаємозв'язок існує і між колонами, що кодують фенілаланін і лейцин. Таким чином, деяким полінукліотидам, що охоплюються дегенеративною послідовністю, можуть відповідати неправильні амінокислоти, але навіть звичайний спеціаліст у даній галузі може достатньо просто виявити неправильні послідовності, порівнюючи конкретні послідовності з амінокислотною послідовністю SEQ ID NO: 2. Дуже консервативні амінокислоти, що входять до складу поліпептиду zFGF-5, можна використовувати як засіб для ідентифікації нових продуктів, що належать до однієї групи. Для ідентифікації нових продуктів, що належать до однієї групи, у базах даних EST можна використовувати символічну формулу CXFXEX{6}Y для консервативної послідовності. Згідно з іншим методом, який передбачає використання полінукліотидних проб і процедур гібридизації, послідовність РНК, одержану з різних зразкових тканин, можна використовувати для формування бібліотек комплементарних ДНК, а потім аналізувати ці бібліотеки для виявлення нових продуктів, що належать до однієї групи. Зокрема, ланцюгову полімеразну реакцію із зворотною транскрипцією (RT-PCR) можна використовувати для розмноження послідовностей, що кодують дуже дегенеративні ДНК праймери, які формуються з послідовностей, що відповідають фрагменту послідовності SEQ ID NO: 2 від амінокислотного залишку 127 (Cys) до амінокислотного залишку 138 (Туr). У діапазоні переважних варіантів реалізації винаходу, що пропонується, ізольовані полінукліотиди виконують функції проби і забезпечують гібридизацію з подібними за розмірами секціями послідовності SEQ ID NO: 1 або послідовності, комплементарної щодо послідовності SEQ ID NO: 1, при оптимальних умовах експерименту. Взагалі, оптимальні умови експерименту вибирають таким чином, щоб температура при реакції була на 5°С нижче температури плавлення (Тm), визначеної для конкретної послідовності при відомих значеннях концентрації іонів і показника pH. Температура Тm являє собою температуру (при визначених значеннях концентрації іонів і показника pH), при якій забезпечується гібридизація 50% матричної послідовності з абсолютно узгодженою пробою. Типовими оптимальними умовами є умови, в яких концентрація солі становить принаймні приблизно 0,02М при pH=7, а температура становить приблизно принаймні 60°С. Як зазначено вище, до ізольованих полінукліотидів згідно з винаходом, що пропонується, належать послідовності ДНК і РНК. Методи ізоляції послідовностей ДНК і РНК добре відомі спеціалістам у даній галузі. Як правило, послідовності РНК переважно ізолюють із серцевих тканин, хоч послідовності ДНК можна також створювати, використовуючи послідовності РНК, одержані з інших тканин, або ізолювати як геномні послідовності ДНК. Всю послідовність РИК можна сформувати, використовуючи метод екстракції гуані 21 75316 22 дину соляною кислотою (НСІ) з подальшою Ізокції клітин-хазяїнів, а експресію необхідної комляцією за допомогою центрифугування в умовах плементарної послідовності ДНК можна виявити градієнту CsCl [Chirgwin et al., Biochemistry 18:52за допомогою антитіла до поліпептиду zFGF-5. 94, 1979]. Послідовність РНК poly(A)+ формують з Подібні методи можна використовувати і для ізоповної послідовності РНК за допомогою методу, ляції геномних клонів. описаного в праці [Aviv and Leder, Proc. Natl. Для спеціалістів у даній галузі очевидно, що Acad. Sсi. USA 69:1408-1412, 1972]. Послідовпослідовностям, які охоплюються послідовностяність комплементарної ДНК (кДНК) формують з ми SEQ ID NO: 1 і SEQ ID NO: 2, відповідає тільки послідовності РНК poly(A)+, використовуючи віоднин алель гена і поліпептиду zFGF-5 людини і домі методи. Потім полінукліотиди, що кодують що можна очікувати появи алельних варіантів і поліпептиди zFGF-5, ідентифікують і ізолюють, альтернативних, варіантів внаслідок сплайсингу. використовуючи для цього, наприклад, гібридиАлельні варіанти можна клонувати, збуджуючи зацію або ланцюгову полімеразну реакцію. реакції з комплементарними ДНК або геномними Винахід, що пропонується, забезпечує також послідовностями, що містяться в бібліотеках, створення дублікатів поліпептидів і полінукліотиодержаними з різних живих організмів, викорисдів (ортологів або паралогів), одержаних з інших товуючи для цього стандартні процедури. Алельзразків. Об'єктом особливого інтересу є поліпепні варіанти послідовності ДНК, що відповідає потиди zFGF-5 з протеїнів, одержаних з тканин інслідовності SEQ ID NO: 1, включаючи алельні ших ссавців, включаючи протеїни мишей, пацюваріанти з невираженими мутаціями і алельні ків, свиней, овець, биків, собак, кішок, коней та варіанти, в яких мутації спричиняють зміни в аміінших приматів. Особливий інтерес викликає іденокислотній послідовності, охоплюються винахонтифікація паралогів послідовності, характерної дом, що пропонується, як і протеїни, які являють для людини, тому що для пацюків і мишей виявсобою алельні варіанти відповідно до послідовлено 8 паралогів ростового фактора FGF-8, тоді ності SEQ ID NO. 2. як для людини відомі тільки 4 паралоги. Паралоги Винахід, що пропонується, забезпечує також людського походження або гомологи щодо різних можливість одержання ізольованих поліпептидів зразків протеїнів людини можна клонувати, викоzFGF-5, які є суттєво гомологічними щодо поліристовуючи інформацію і сполуки, одержані згідпептидів послідовності SEQ ID NO: 2 і їхніх гомоно з цим винаходом, у поєднанні із звичайними логів щодо різних зразків або ортологів. Термін методами клонування. Наприклад, комплемента"суттєво гомологічний" використовується в цьому рну ДНК можна клонувати, використовуючи матописі винаходу для визначення поліпептидів, поричну РНК, одержану з таких тканин або клітин, слідовності яких на 50%, переважно на 60%, а які забезпечують експресію протеїну. Придатні найбільш переважно принаймні на 80%, ідентичні джерела одержання матричної РНК можна випослідовностям поліпептидів, що відповідають значити за допомогою нозерн-блоттингу, викорипослідовності SEQ ID NO: 2, або ортологам чи стовуючи проби, створені з послідовностей, що паралогам цих поліпептидів. Найбільш переважрозглядаються в цьому описі винаходу. Потім но, необхідно використовувати такі поліпептиди, можна сформувати бібліотеку матричних РНК які принаймні на 90%, а краще всього на 95% і для групи тканин або клітин з позитивною реакцібільше, ідентичні поліпетидам, що відповідають єю. Після цього комплементарну ДНК, що кодує послідовності SEQ ID NO: 2, або ортологам чи поліпептид zFGF-5, можна ізолювати, використопаралогам цих поліпептидів. Ідентичність послівуючи для цього різні методи, наприклад, збудовностей, у відсотках, визначають за допомогою джуючи реакцію за допомогою повної або часткозвичайних методів. Див., наприклад, праці вої комплементарної послідовності ДНК людини [Altschul et al., Bull. Math. Bio. 48:603-616, 1986; або за допомогою одного або декількох наборів Henikoff and Henikoff, Proc. Natl. Acad. Sci. USA дегенеративних проб, одержаних на основі пос89:10915-10919, 1992]. Суть цих методів полягає лідовностей, що розглядаються в цьому описі в тому, що дві амінокислотні послідовності поріввинаходу. Клонування комплементарної ДНК монюють для того, щоб оптимізувати їхні показники жливе також за допомогою ланцюгової полімерапорівняння, використовуючи штрафні коефіцієнти зної реакції (PCR) [MuІІis, US Patent 4,683,202], (поява проміжку - 10 балів, розширення проміжку при використанні праймерів, одержаних з послі- 1 бал) і матрицю оцінки "blosum 62" [Henikoff and довностей, що розглядаються в цьому описі виHenikoff, Proc. Natl. Acad. Sci. USA 89:10915находу. Згідно з додатковим методом, бібліотеку 10919, 1992], як показано в таблиці 3 (для амінокомплементарних послідовностей ДНК можна кислот використовуються стандартні однолітерні використовувати для перетворення або трансфепозначення). 23 75316 24 Таблиця 3 А R N D С Q Е G Н І L К М F Р S Т W Y V А 4 -1 -2 -2 0 -1 -1 0 -2 -1 -1 -1 -1 -2 -1 1 0 -3 -2 0 R N 5 0 -2 -3 1 0 -2 0 -3 -2 2 -1 -3 -2 -1 -1 -3 -2 -3 6 1 -3 0 0 0 1 -3 -3 0 -2 -3 -2 1 0 -4 -2 -3 D С Q Е G Н L К М F Р S Т W Y V 6 -4 -2 -2 1 3 -1 7 -1 -1 -4 -3 -2 4 1 -3 -2 -2 5 -2 -2 0 11 2 -3 7 -1 4 6 -3 0 2 -1 -1 -3 -4 -1 -3 -3 -1 0 -1 -4 -3 -3 9 -3 -4 -3 -3 -1 -1 -3 -1 -2 -3 -1 -1 -2 -2 -1 5 2 -2 0 -3 -2 1 0 -3 -1 0 -1 -2 -1 -2 5 -2 0 -3 -3 1 -2 -3 -1 0 -1 -3 -2 -2 6 -2 -4 -4 -2 -3 -3 -2 0 -2 -2 -3 -3 8 -3 -3 -1 -2 -1 -2 -1 -2 -2 2 -3 Після цього обчислюють показник ідентичності, у відсотках, таким чином: Ідентичніс ть, % І Загальна кількість ідентичних елементів 100 Довжина довшої послідовно сті плюс кількість проміжків, введених у довшу послідовні сть з метою узгодження двох послідовно стей 4 2 -3 1 0 -3 -2 -1 -3 -1 3 4 -2 2 0 -3 -2 -1 -2 -1 1 5 -1 -3 -1 0 -1 -3 -2 -2 5 0 -2 -1 -1 -1 -1 1 силання. Препарати з послідовностями ДНК, що забезпечують кодування маркерів спорідненості, поставляються комерційними постачальниками (наприклад фірмами Pharmacia Biotech, Piscataway, NY; New England Biolabs, Beveriy, MA). Таблиця 4 Ідентичність послідовностей полінукліотидних молекул визначають за допомогою подібних методів, використовуючи відношення, наведене вище. Суттєво гомологічні протеїни і поліпептиди характеризуються тим, що вони мають один або декілька елементів у вигляді замін, пропусків або доповнень амінокислот. Такі елементи, що характеризують зміну структури, є, як правило, другорядними і до них належать: заміни консервативних амінокислот (див. табл.4) та інші заміни, які незначною мірою впливають на упорядкування або активність протеїну або поліпептиду; невеликі пропуски амінокислот, як правило від 1 до приблизно 30 амінокислот; незначні аміно-кінцеві або карбоксильно-кінцеві подовження, наприклад аміно-кінцеві метионінові залишки, невеликі лінкерні пептиди, що містять 20-25 амінокислотних залишків, або невеликі подовження, що полегшують очищення (маркери спорідненості), наприклад полігістидинова група, протеїн А [Nilsson et al., EMBO J. 4:1075, 1985; Nulsson et al., Methods Enzymol. 198:3, 1991], глютадіон-S-трансфераза [Smith and Johnson, Gene 67:31, 1988], протеїн для зв'язування мальтози [Kellerman and Ferenci, Methods Enzymol. 90:459-463, 1982; Guan et al., Gene 67:21-30, 1987], а також інші антигенні епітопи або зони зв'язування. Відповідна загальна інформація наведена в праці [Ford et al., Protein Expression and Purification 2:95-107, 1991], яка включена в цей опис винаходу за допомогою по Заміни консервативних амінокислот Основні: Кислотні: Полярні: Гідрофобні: Ароматичні: Невеликі: Аргінін Лізин Гістидин Глютамінова кислота Аспарагінова кислота Глютамін Аспарагін Лейцин Ізолейцин Валін Фенілаланін Триптофан Тирозин Гліцин Аланін Серин Треонін Метіонін Додатково до 20 стандартних амінокислот, протеїни згідно з цим винаходом можуть також містити неприродні амінокислотні залишки. До неприродних амінокислотних залишків належать, але без обмеження, транс-3-метилпролін, 2,4метанопролін, цис-4-гідроксипролін, транс-4гідроксипролін, N-метил-гліцин, аллотреонін, метилтреонін, гідроксиетилцистеїн, гідроксиетилгомоцистеїн, нітроглютамін, гомоглютамін, піпеколінова кислота, трет-лейцин, норвалін, 2 25 75316 26 азафенілаланін, 3-азафенілаланін, 4графії, дифракції електронів або ковалентної фіказафенілаланін, 4-фторфенілаланін, 4сації мічених субстратів під дією світла, поєднуюгідпроксипролін, 6-N-метил-лізин, 2чи ці методи з мутацією амінокислот у місцях очікуваного контакту. Див., наприклад, праці [de аміноізомасляна кислота, ізовалін і -метилVos et al., Science 255:306-312, 1992; Smith et al., серин. Спеціалістам у даній галузі відомі декілька J. Mol. Biol. 224:899-904, 1992; Wlodaver et al., методів введення неприродних амінокислотних FEBS Lett. 309:59-64, 1992]. Показники ідентичзалишків у протеїни. Наприклад, можна викорисності суттєвих амінокислот можна також визначитовувати систему, в умовах поза живими організти за результатами аналізу гомології щодо спорімами, в якій незначущі мутації заглушуються за днених ростових факторів фібробластів, як допомогою аміноацилованих супресорних транспоказано на Фіг.1 і 2. портних РНК. Відомі також методи синтезу аміноРезультати аналізу амінокислотних послідовкислот і аміноацилування транспортних РНК. Реностей поліпептиду zFGF-5 показали наявність акції транскрипції і трансляції плазмід, в яких двохосновної секції в С-кінцевій частині поліпепприсутні незначущі мутації, здійснюються в безтиду (амінокислотні залишки 196-197 (Lys-Arg)). клітинній системі, яка містить екстракт S30 кишПоказано, що поліпептид, укорочений в Скової палички Е.соІі і ферменти та інші реагенти, кінцевій частиш, який містить амінокислотну посщо комерційно поставляються. Протеїни очищалідовність, показану в послідовності SEQ ID NO: ють за допомогою хроматографії. Див., напри2 як фрагмент від амінокислотного залишку 28 клад, праці [Robertson et al., J. Am. Chem. Soc. (Glu) до амінокислотного залишку 196 (Lys), є 113:2722, 1991; EІІman et al., Meth. Enzymol. біологічно активним. Двохосновні амінокислоти, 202:301, 1991; Chung et al., Science 259:806-809, наприклад Arg-X-X-Arg (де X - будь-який аміноки1993; Chung et aL, Proc. Natl. Acad. Sсi. USA слотний залишок), Arg-Arg або Lys-Arg, можуть 90:10145-49, 1993]. Згідно з другим методом, розщеплюватися під дією декількох ферментів, трансляцію здійснюють в овоцитах Xenopus за до яких належать, але без обмеження, тромбін і допомогою мікроін'єкції мутованої матричної РИК карбоксипептидази. Тому в пунктах формули виі хімічно аміноацилованих супресорних транспорнаходу врахована можливість консервативних тних РНК [Turcatti et al., J. Biol. Chem. 271:19991змін у двохосновних амінокислотних залишках, 98, 1996]. Згідно з третім методом, клітини кишзокрема в двохосновних амінокислотних залишкової палички Е.соІі культивують при відсутності ках 196 (Lys) і 197 (Arg) послідовності SEQ ID NO: природної амінокислоти, яка повинна бути замі2. нена, (наприклад при відсутності фенілаланіну) На підставі результатів аналізу групи ростоале в присутності бажаних неприродних амінокивих факторів встановлено, що укорочена в Сслот (наприклад 2-азафенілаланіну, 3кінцевіЙ частині молекула, яка містить фрагмент азафенілаланіну, 4-азафенілаланіну або 4послідовності SEQ ID NO: 2 від амінокислотного фторфенілаланіну). Неприродну амінокислоту залишку 28 (Glu) до амінокислотного залишку 175 вводять у протеїн замість її природного двійника. (Met), може бути біологічно активною. ПередбаДив. працю [Koide et al., Biochem. 23:7470-76, чається, що внутршшьомолекулярний дисульфі1994]. Природні амінокислотні залишки можна дний зв'язок створюватиметься в секції між аміперетворювати в неприродні зразки за допомонокислотними залишками 109 (Cys) і 129 (Cys) гою хімічної модифікації в умовах поза живими послідовності SEQ ID NO: 2. організмами. Хімічну модифікацію можна поєднуОдержані на основі гомологічних порівнянь з вати з сайт-специфічним мутагенезом для того, кристалічними структурами ростових факторів щоб додатково розширити діапазон замін аміноFGF-1 і FGF-2, прогнозовані дані вторинної струккислот [Wynn and Richards, Protein Sсi. 2:395-403, тури, тобто ниткової бета-структури поліпептиду 1993]. zFGF-5, відповідають амінокислотним залишкам Суттєві амінокислоти в поліпептидах zFGF-5, 56-59, 64-69, 73-76, 85-92. 96-102, 106-111, 115що охоплюються цим винаходом, можна іденти119, 128-134, 138-144, І49-155 і 173-177 послідофікувати за допомогою процедур, відомих спецівності SEQ ID NO: 2. Амінокислоти, які мають алістам у даній галузі, наприклад за допомогою важливе значення для зв'язування поліпептиду сайт-специфічного мутагенезу або мутагенезу з zFGF-5 з рецепторами, можна ідентифікувати за спрямованим аналізом аланіну [Cunningham and допомогою сайт-специфічного мутагенезу всієї Wells, Science 244:1081-1085, 1989]. Згідно з молекули поліпептиду zFGF-5. Більш конкретно, останнім методом, у кожному амінокислотному ці амінокислоти можна ідентифікувати за допомозалишку молекули формують окремі мутації алагою сайт-специфічного мутагенезу тих амінокисніну, після чого одержані мутантні молекули пелот у поліпептиді zFGF-5, які відповідають аміноревіряють на біологічну активність (наприклад, кислотним залишкам у кислотному ростовому перевіряють активність щодо росту серцевих факторі FGF-1 і основному ростовому факторі міоцитів або фібробластів, або щодо стимуляції FGF-2, визначеним як такі, що мають важливе формування кісток) для визначення таких амінозначення для зв'язування цих ростових факторів кислотних залишків, які мають важливе значення з їхніми рецепторами [Blaber et al., Biochem для активності молекули. Див. також працю 35:2086-2094, 1996]. До цих амінокислот нале[Hilton et al., J. Biol. Chem. 271:4699-4708, 1996]. жать амінокислоти Туr33, Arg53, Asn110, Туr112, Місця взаємодії лігандів з рецепторами можна Lys119, Trp123, Leu149 і Met151 у ростовому фавизначати також за допомогою методів фізичного кторі людини FGF-2, а також амінокислоти Туr30, аналізу структури, використовуючи, наприклад, Arg50, Asn107, Туr109, Lys116, Тrр122, Leu148 і методи ядерного магнітного резонансу, кристало 27 75316 28 Leu150 у ростовому факторі людини FGF-1, як менти цих протеїнів і злиті протеїни, можна форпоказано на Фіг.1 і 2. Відповідними амінокисломувати в клітинах-хазяїнах за допомогою процетами в поліпептиді zFGF-5 є амінокислоти Tyr58, сів генетичної інженерії, використовуючи відомі Gly77, Аsn136, Туr138, Lys145, Trp149, Met175 і методи. До придатних клітин-хазяїнів належать Arg177, як показано на Фіг.1 і 2. Для спеціалістів у такі клітини, які можна трансформувати або транданій галузі очевидно, що інші ростові фактори з сфектувати за допомогою екзогенної ДНК і вирогрупи ростових факторів фібробластів можуть щувати у відповідній культурі, наприклад клітини бути, повністю або частково, структурно або біобактерій, грибкові клітини і культивовані клітини хімічно подібними до поліпептиду zFGF-5 і що вищих евкаріотів. Переважно, необхідно викорисожлива заміна цих ростових факторів за допомотовувати клітини евкаріотів, зокрема культивовані гою згаданого аналізу. Описані фрагменти мають клітини багатоклітинних організмів. Методи оброважливе значення для біологічних функцій молебки клонованих молекул ДНК і введення екзогенкули. ної ДНК у різноманітні югітини-хазяїни описані в Різноманітні заміни амінокислот можна здійспрацях [Sambrook et al., Molecular Cloning: A нювати і перевіряти, використовуючи відомі меLaboratory Manual, 2nd ed., Cold Spring Harbor тоди мутагенезу і аналізу з відбором, наприклад Laboratory Press, Cold Spring Harbor, NY, 1989; методи, описані в праці [Reidhaar-Olson and Ausubel et al. (eds.), Current Protocols in Molecular Sauer, Science 241:53-57, 1988] або [Вомwіе and Biology, John Willey and Sons, Inc., NY, 1987], які Sauer, Proc. Natl. Acad. Sci. USA 86:2152-2156, включені в цей опис винаходу за допомогою по1989]. Суть методів, запропонованих авторами силання. цих праць, полягає в тому, що здійснюють одноВзагалі, послідовність ДНК, що кодує поліпечасну рандомізацію двох або більшої кількості птид zFGF-5 згідно з цим винаходом, сполучена, позицій елементів у поліпептиді, вибирають фундля можливості виконання заданих функцій, з кціональний поліпептид, а потім розшифровують іншими генетичними елементами, необхідними послідовності мутагенізованих поліпептидів для для експресії цієї послідовності, до яких, взагалі, того, щоб визначити діапазон допустимих замін належать промотор і термінатор транскрипції у на кожній позиції. До інших методів, які можна складі вектора експресії. Як правило, вектор мовикористовувати, належать метод проявлення же містити також один або декілька вибіркових фатів, наприклад метод, розкритий в джерелах маркерів і одну або декілька зон початку репліка[Lowman et al., Biochem 30:10832-10837, 1991; ції, хоч для спеціалістів у даній галузі очевидно, Ladner et al., US Patent No. 5,223,409; Huse, WIPO що в певних системах вибіркові маркери можуть Publication WO 92/06204], і метод фрагментбути розташовані в окремих векторах, а реплікаспецифічного мутагенезу, описаний в працях цію екзогенної ДНК можна забезпечити, вставля[Derbyshire et al., Gene 46:145, 1986; Ner et al., ючи її в геном клітини-хазяїна. Вибір промоторів, DNA 7:127, 1988]. термінаторів, вибіркових маркерів, векторів та Методи мутагенезу, розглянуті вище, можна інших елементів здійснюється за допомогою віпоєднувати з високопродуктивними, автоматизодомих процедур генетичної інженерії, які доступні ваними процедурами аналізу, призначеними для звичайним спеціалістам у даній галузі. Такі різвиявлення активності клонованих, мутагенізованоманітні елементи описані в літературі і доступні них поліпептидів у клітинах-хазяїнах. Мутагенізочерез комерційних постачальників. вані молекули ДНК, які кодують активні поліпепДля спрямування поліпептиду zFGF-5 на тиди (наприклад поліпептиди, що забезпечують процес здійснення секреторних реакцій в клітиніріст клітин), можна виділяти з клітин-хазяїнів і хязяїні, вектор експресії містить секреторну сигшвидко розшифровувати, використовуючи сучаснальну послідовність (відому також як лідерна не обладнання. Згадані методи дозволяють швипослідовність, вихідна послідовність або початдко оцінювати важливість окремих амінокислоткова послідовність). Секреторна сигнальна посліних залишків у певному поліпептиді і їх можна довність може бути природною послідовністю або використовувати для аналізу поліпептидів з невіхимерною послідовністю, яка містить сигнальну домою структурою. послідовність, одержану з іншого секретованого За допомогою методів, розглянутих вище, протеїну (наприклад лідерну послідовність -ргезвичайний спеціаліст у даній галузі може ідентирго з протеїну t-PA), або може бути синтезована фікувати або формувати різноманітні поліпептияк нова послідовність. Секреторна сигнальна ди, які є суттєво гомологічними щодо послідовнопослідовність сполучається з послідовністю ДНК сті, показаної в послідовності SEQ ID NO: 2 як поліпептиду zFGF-5 у правильно заданій рамці фрагмент між амінокислотними залишками 28 зчитування. Як правило, секреторні сигнальні (Glu) і 196 (Lys) або фрагмент між амінокислотпослідовності розташовуються в 5'-кінцевій часними залишками 28 (Glu) і 207 (Ala), а також алетині послідовності ДНК, яка кодує заданий полільні варіанти або біологічно активні фрагменти пептид, хоч окремі сигнальні послідовності мозгаданих поліпептидів, і забезпечувати збережуть бути розташовані в будь-якій частиш даної ження таких властивостей природного протеїну, послідовності ДНК (див., наприклад, описи до які важливі для росту клітин. Згадані поліпептиди патентів [Welch et al., US Patent No. 5,037,743; можуть також містити додаткові поліпептидні сеHolland et al., US Patent No. 5,143,830]). гменти, загальна інформація про які наведена Далі розглядається універсальна акцепторна вище. плазміда, яка може бути використана для клонуПоліпептиди згідно з цим винаходом, вклювання ДНК, що кодує будь-який заданий поліпепчаючи первинні, непроцесовані протеїни, фрагтид, включаючи злиті поліпептиди. Акцепторна 29 75316 30 плазміда корисна при використанні методу форркерну групу, розташовану ближче до другого мування двониткової кільцевої молекули ДНК. кінця акцепторної плазміди. Згідно з цим методом виконуються такі процедуРозглядається метод формування двониткори: вої кільцевої молекули ДНК, згідно з яким викоа) створення фрагмента двониткової донорнуються такі процедури: ної ДНК, що кодує заданий поліпептид; а) створення декількох: фрагментів двонитб) створення двониткової лінійної акцепторкової донорної ДНК, що перекриваються, які раної плазміди, що має перший і другий тупі кінці і зом кодують заданий поліпептид; містить вибірковий маркер і послідовність репліб) створення двониткової лінійної акцепторкації, які виконують свої функції в середовищі ної плазміди, що має перший і другий тупі кінці і Saccharomyces cerevisiae, причому акцепторна містить вибірковий маркер і послідовність репліплазміда суттєво вільна від ДНК, що кодує задакації, які виконують свої функції в середовищі ний поліпептид; Saccharomyces cerevisiae, причому акцепторна в) створення першого лінкера двониткової плазміда суттєво вільна від ДНК, що кодує задаДНК, який містить перший сегмент, послідовність ний поліпептид; якого ідентична послідовності в першій зоні акцев) створення першого лінкера двониткової пторної плазміди, і другий сегмент, послідовність ДНК, який містить перший сегмент, послідовність якого ідентична послідовності в першій зоні фраякого ідентична послідовності в першій зоні акцегмента донорної ДНК, причому кожний сегмент, пторної плазміди, і другий сегмент, послідовність як перший, так і другий, першого лінкера має доякого ідентична послідовності в першій зоні одновжину принаймні 10 пар комплементарних, пар го з фрагментів донорної ДНК, причому кожний гетероциклічних, основ; сегмент, як перший, так і другий, першого лінкера г) створення другого лінкера двониткової має довжину принаймні 10 пар комплементарних ДНК, який містить перший сегмент, послідовність пар гетероциклічних основ; якого ідентична послідовності в другій зоні акцепг) створення другого лінкера двониткової торної плазміди, і другий сегмент, послідовність ДНК, який містить перший сегмент, послідовність якого ідентична послідовності в другій зоні фрагякого ідентична послідовності в другій зоні акцепмента донорної ДНК, причому кожний сегмент, як торної плазміди, і другий сегмент, послідовність перший, так і другий, другого лінкера має довжиякого ідентична послідовності в зоні іншого франу принаймні 10 пар комплементарних пар гетегмента донорної ДНК, причому кожний сегмент, роциклічних основ; як перший, так і другий, другого лінкера має довд) об'єднання фрагмента донорної ДНК, акжину принаймні 10 пар комплементарних пар цепторної плазміди, першого лінкера ДНК і другогетероциклічних основ; го лінкера ДНК у клітині-хазяїні Saccharomyces д) об'єднання фрагментів донорної ДНК, акcerevisiae, внаслідок чого фрагмент донорної цепторної плазміди, першого лінкера ДНК і другоДНК з'єднується з акцепторною плазмідою за го лінкера ДНК у клітині-хазяїні Saccharomyces рахунок гомологічної рекомбінації донорної ДНК, cerevisiae, внаслідок чого фрагменти донорної акцепторної плазміди і лінкерів, утворюючи заДНК з'єднуються з акцепторною плазмідою за мкнуту кільцеву плазміду. рахунок гомологічної рекомбінації, утворюючи Акцепторна плазміда містить також промотор замкнуту кільцеву плазміду, яка містить зону, що транскрипції, розташований ближче до першого кодує заданий поліпептид. кінця, а фрагмент донорної ДНК сполучений, для Акцепторна плазміда містить також один або можливості виконання заданих функцій, з промодекілька промоторів транскрипції, фрагмент дотором транскрипції в замкнутій кільцевій плазміді. норної ДНК, що кодує лідерний пептид, і один або Крім того, акцепторна плазміда містить сегмент декілька сегментів ДНК, що кодують пептидну ДНК, що кодує лідерний пептид, і один або декімаркерну групу, як описано вище. лька сегментів ДНК, що кодують пептидну маркеГрибкові клітини, включаючи дріжджові клітирну групу, розташовані таким чином, що ці сегмени, зокрема клітини виду Saccharomyces або Ріснти ДНК сполучені, для можливості виконання кіа, є переважними для використання їх як клітинзаданих функцій, з фрагментом донорної ДНК у хаїнів при формуванні фрагментів поліпептиду замкнутій кільцевій плазміді. zFOF-S або продуктів злиття поліпептидів. Згідно з переважним варіантом реалізації Інші методи трансформації дріжджових клітин цього винаходу, акцепторна плазміда містить за допомогою екзогенної ДНК і формування ретакож: комбінантних поліпептидів з таких клітин розгляа) промотор, сегмент ДНК, що кодує перший даються, наприклад, в описах до патентів лідерний пептид, і сегмент ДНК, що кодує першу [Kawasaki, US Patent No. 4,599,311; Kawasaki et пептидну маркерну групу, причому сегмент ДНК, al., US Patent No. 4,931,373; Brake, US Patent No. що кодує лідерний пептид, розташований між 4,870,008; Welch et al., US Patent No. 5,037,743; промотором і сегментом ДНК, що кодує першу Murray et al., US Patent No. 4,845,075], які вклюпептидну маркерну групу, розташовану ближче чені в цей опис винаходу за допомогою посиландо першого кінця акцепторної плазміди, а промоня. Трансформовані клітини вибирають за фенотор, сегмент ДНК, що кодує лідерний пептид, і типом, визначеним за допомогою вибіркового сегмент ДНК, що кодує першу пептидну маркерну маркера, як правило за стійкістю до лікарських групу, сполучені для можливості виконання задазасобів або за спроможністю росту при відсутноних функцій; сті певного живильного елемента (наприклад б) сегмент ДНК, що кодує другу пептидну малейцину). Альтернативною переважною вектор 31 75316 32 ною системою для використання в дріжджових допомогою посилання. До переважно використоклітинах є векторна система РОТ 1, що розглядавуваних культивованих клітин з тканин ссавців ється в описі до патенту [Kawasaki et al., US належать клітини COS-1 [АТСС No. CRL 1650], Patent No. 4,931,373], яка дозволяє вибирати COS-7 [АТСС No. CRL 1651], ВНК 570 [АТСС No. трансформовані клітини за показниками росту в CRL 10314], 293 [АТСС No. CRL 1573; Graham et середовищі, що містить глюкозу. До промоторів і al., J. Gen. Virol. 36:59-72, 1977] і група клітин з термінаторів, придатних для використання в дріяєчників китайського хом'ячка (наприклад клітини жджових клітинах, належать промотори і термінаСНО-К1 [АТСС No. CCL 61]). Спеціалістам у даній тори, одержані з гонів гліколітичного ферменту галузі відомі додаткові придатні клітини, які пос(див., наприклад, описи до патентів [Kawasaki et тавляються такими комерційними постачальниal., US Patent No. 4,599,311; Kingsmann et al, US ками, як АТСС (Американська колекція типів куPatent No. 4,615,974; Bitter, US Patent No. льтур), Роквіл, штат Меріленд. Взагалі, 4,977,092], які включені в цей опис винаходу за переважно необхідно використовувати сильні допомогою посилання) і генів алкогольдегідрогепромотори транскрипції, наприклад промотори, нази. Див. також описи до патентів США №№ одержані з вірусу SV-40 або цитомегаловірусу. 4990446, 5063154, 5139936 і 4661454, які вклюДив., наприклад, опис до патенту США чені в цей опис винаходу за допомогою посилан№4956288. До інших придатних промоторів наня. Системи трансформації, призначені для інших лежать промотори, одержані з генів металотіодріжджових клітин, включаючи клітини Hansenida нешу (див. описи до патентів США №№ 4579821 і polymorpha, Schizosaccharomyces pombe, 4601978, які включені в цей опис винаходу за Kluyveromyces lactis, Kluyveromyces fragilis, допомогою посилання), і промотор, одержаний з Ustilago maydis, Pichia pastoris, Pichia guillermondii аденовірусу. і клітини Candia maltosa, також відомі спеціалісВідбір за стійкістю до лікарських засобів витам у даній галузі. В особливо переважній систекористовується, як правило, для селекції культимі використовуються клітини Pichia methanolica вованих клітин з тканин ссавців, в які введена (див. опис до патентної заявки WO 9717450). чужорідна ДНК. Такі клітини відомі під загальною Альтернативні системи трансформації описані, назвою "трансфектанти". Клітини, які культивунаприклад, у працях [Gleeson et al., J. Gen. ються в присутності агента для селекції і які заMicrobiol. 132:3459-3465, 1986; Cregg, US Patent безпечують передачу заданого гена потомству No. 4,882,279]. Можна використовувати клітини цих клітин, відомі як "стабільні трансфектанти". Aspergillus, згідно з методами, що розглядаються Переважним вибірковим маркером є ген, що ков описі до патенту [McKnight et al., US Patent No. дує стійкість до антибіотичного неоміціну. Селек4,935,349], який включений в цей опис винаходу цію здійснюють у присутності лікарського засобу за допомогою посилання. Методи трансформації типу "неоміцин", наприклад G-418, або іншого клітин Асrеmоnіum chrysogenum розглядаються в подібного лікарського засобу. Системи селекції описі до патенту [Sumino et al., US Patent No. можна також використовувати для підвищення 5,162,228], який включений в цей опис винаходу рівня експресії заданого гена (відповідний процес за допомогою посилання. Методи трансформації відомий як "підсилення"). Підсилення здійснюєтьклітин Neurospora розглядаються в описі до пася при культивуванні трансфектантів у присутнотенту [Lambowitz., US Patent No. 4,486,533], який сті, на невеликому рівні, агента дня селекції, з включений в цей опис винаходу за допомогою наступним підвищенням кількості агента для сепосилання. лекції таким чином, щоб вибрати клітини, які заКультивовані клітини, одержані з тканин ссабезпечують інтенсивне формування продуктів, вців, є також переважними для використання, як синтезованих введеними генами. Переважно виклітини-хазяїни, згідно з цим винаходом. До мекористовуваним вибірковим маркером, що може тодів введення екзогенної ДНК у клітини-хазяїни з бути підсилений, є диіідрофолатредуктаза, яка тканин ссавців належать методи трансфекції чезабезпечує стійкість до метотрексату. Можна вирез посередництво фосфату кальцію [Wigler et користовувати також інші гени, що забезпечують al., Cell 14:725, 1987; Coisaro and Pearson, стійкість до лікарських засобів (наприклад стійSomatic Cell Genetics 7:603, 1981; Graham and кість до гідроміцину, стійкість до декількох лікарVan der Eb, Virology 52:456, 1973], електропорації ських засобів, стійкість до пуроміцин[Neumann et al., EMBO J. 1:841-845, 1982], транацетилтгрансферази). сфекції через посередництво DEAE-декстрану До інших клітин вищих евкаріотів, які також [Ausubel et al., eds., Current Protocols in Molecular можна використовувати як клітини-хазяїни, налеBiology, John Willey and Sons, Inc., NY, 1987] і жать клітини з організмів комах, рослин і птахів. трансфекції через посередництво ліпосоми Трансформація клітин з організмів комах і фор[Hawley-Nelson et al., Focus 15:73, 1993; Ciccarone мування чужорідних поліпептидних протеїнів у et al., Focus 15:80, 1993], причому згадані праці цих клітинах розглядаються в описах до патентів включені в цей опис винаходу за допомогою по[Guarino et al., US Patent No. 5,162,222; Bang et силання. Формування рекомбінантних поліпептиal., US Patent No. 4,775,624] і описі до патентної дів у культивованих клітинах тканин ссавців розгзаявки, публікація WIPO WO 94/06463, які вклюлядається, наприклад, в описах до патентів чені в цей опис винаходу за допомогою посилан[Levinson et al., US Patent No. 4,713,339; Hagen et ня. Використання культури Agrobacteriwn al., US Patent No. 4,784,950; Palmiter et al., US rhizogenes як вектора для експресії генів у росPatent No. 4,579,821; Ringold, US Patent No. линних клітинах описано в праці [Sinkar et al., J. 4,656,134], які включені в цей опис винаходу за Biosci. (Bangalore) 11:47-58, 1987]. 33 75316 34 Трансформовані або трансфектовані клітининих процесів для зчеплення з підкладками, в яких хазяїни культивують відповідно до звичайних використовується ціанамід. Згадані та інші тверді процедур, у середовищі для культивації, яке міспідкладки відомі спеціалістам у даній галузі, шитить поживні речовини та інші компоненти, необроко використовуються і поставляються комерхідні для росту вибраних клітин-хазяїв. Спеціалісційними постачальниками. Методи, що забезпетам у даній галузі відомі різні середовища для чують зчеплення рецепторних поліпептидів з культивації клітин, придатні для використання, твердими підкладками, також відомі спеціалістам включаючи спеціальні і комплексні середовища, і у даній галузі. Вибір конкретного методу здійснюкожне таке середовище містить, як правило, ється відповідно до звичайних процедур і часткоджерело вуглецю, джерело азоту, суттєво необво залежить від характеристик вибраної підкладхідні амінокислоти, вітаміни і мінерали. Середоки. Див., наприклад, працю [Affinity вище для культивації клітин може також містити Chromatography: Principles and Methods, такі елементи, як ростові фактори або сироватку, Pharmacia LKB Biotechnology, Uppsala, Sweden, залежно від необхідності. Як правило, вибирають 1988]. таке середовище для вирощування клітин, яке Поліпептиди, що охоплюються цим винахопридатне для клітин з екзогенно введеною ДНК, дом, можна також ізолювати, використовуючи їхні використовуючи, наприклад, відбір за стійкістю властивості щодо зв'язування з гепарином. Необдо лікарських засобів або відбір за можливістю хідна інформація наведена в праці [Burgess et el., росту при відсутності суттєво необхідної живильAnn. Rev. of Biochem. 58:575-606, 1989]. Ростові ної речовини, у поєднанні з вибірковим маркефактори, що належать до групи ростових фактором, який присутній у векторі експресії або транрів фібробластів, можна очищати, для досягненсфектований в клітині-хазяїні. ня очевидної гомогенності, використовуючи афінРекомбінантні поліпептиди zFGF-5 (або хину хроматографію за спорідненістю до гепарину і мерні поліпептиди zFGF-5), одержані в результаті сефарози [Gospodarowicz et al., Proc. Natl. Acad. експресії, можна очищати, використовуючи метод Sci. 81:6963-6967, 1984], і елюювати в умовах фракціонування або звичайні методи очищення і лінійних: ступінчастих градієнтів NaCl [Ron et al., звичайні середовища. Для фракціонування зразJ. Biol. Chem. 268(4):2984-2988, 1993; ків можна використовувати осаджування сульфаChromatography: Principles and Methods, pp.77-80, том амонію, а також екстрагування кислотою або Pharmacia LKJB Biotechnology, Uppsala, Sweden, лугом. Як приклади, можна назвати такі процеду1993; "Immobilized Affinity Ligand Techniques", ри, які можна використовувати в процесі очищенHermanson et al., eds., 16S5-167, Academic Press, ня: обробка гідроксиапатитом, сортування за роSan Diego, 1992; Kjellen et al., Ann. Rev. Biochem. змірами, рідинна експрес-хроматографія 60:443-474, 1991; Ke et al., Protein Expr. Puriff. протеїнів і обернено-фазова рідинна хроматог3(6):497-507, 1992]. рафія з високою вирізняльною спроможністю. До інших методів очищення належить метод Придатними середовищами для аніонного обміну хроматографії з адсорбцією імобілізованих іонів є похідні декстрану, агароза, целюлоза, поліакметалів (IMAC), призначений для очищення прориламід, спеціальні зразки кремнезему і тому теїнів, збагачених гістидином. Суть цього методу подібні речовини. Переважно, необхідно викорисполягає в тому, що гель спочатку заряджають товувати похідні РЕІ, DEAE, QAE і Q, а особливо іонами двовалентного металу для утворення хепереважно - сефарозу малої густини DBAE латної сполуки [Е. Sulkowski, Trends in Biochem. (Pharmacia, Piscatawwy, NJ). Прикладами сере3:1-7, 1985]. Протеїни, збагачені гістидином, аддовищ для хроматографії є середовища, що міссорбуються цим матеріалом з різними мірами тять фенілові, бутилові або октилові групи, наспорідненості, залежно від використовуваних приклад феніл-сефароза FF (Pharmacia), бутил іонів металу, і можуть бути елюйовані за допомоToyopearl 650 (Toso Haas, Montgomeryville, PA), гою процесу протилежно спрямованого елююоктил-сефароза (Pharmacia) і тому подібні, або вання, внаслідок якого зменшується показник pH, поліакрилати, наприклад Amberchrom CG 71 або за допомогою сильних агентів для форму(Toso Haas) і тому подібні. Як придатні тверді вання хелатних сполук. До інших методів очипідкладки, використовують скляні гранули, силіщення належать метод очищення глікозилованих конові смоли, целюлозні смоли, агарозні гранули, протеїнів за допомогою афінної хроматографії за гранули агарози з перехресними зв'язками, полісспорідненістю до лектину і хроматографії з обмітирольні гранули, поліакриламідні смоли з перехном іонів [Methods in Enzymol., Vol. 182, "Guide to ресними зв'язками і тому подібні матеріали, які є Protein Purification", M. Deutscher, (ed.), Acad. нерозчинними в умовах використання. Згадані Press, San Diego, 1990, pp.529-539]. Як альтернапідкладки можна модифікувати за допомогою тивний метод, для полегшення очищення можна реактивних груп, які забезпечують можливість використовувати продукт злиття заданого поліпезчеплення протеїнів з підкладками за допомогою птиду і маркера спорідненості (наприклад групи амінових груп, карбоксильних груп, сульфогідриполігистидину, протеїну, що зв'язує мальтозу, або льних груп, гідроксильних груп або вуглеводних імуноглобіну). сполук. Прикладами хімічних процесів, що забезпечують зчеплення з підкладками, є активація Певні переваги забезпечуються при викорисбромідом, активація N-гідроксисукцинімідом, актанні процедур повторного упорядкування протетивація епоксидом, активація сульфогідрилом, їну (а також процедур додаткового повторного активація гідразидом, а також активація карбококислення). Переважно, необхідно використовусильними і аміловими похідними у випадку хімічвати протеїн з чистотою більше 80%, більш пере 35 75316 36 важно - з чистотою більше 90%, а найбільш пе(ВrdU) в ДНК клітин, що розростаються (див. прареважно - з чистотою більше 95%; краще всього цю [Porstmann et al., J. Immunol. Methods 82:169використовувати фармацевтично чистий протеїн, 179, 1985], включену в цей опис винаходу за дотобто протеїн з чистотою більше 99,9% щодо помогою посилання) і метод аналізу з викорисзабруднювальних макромолекул, домішок інших танням: тетразольних солей (див. праці протеїнів і нуклеїнових кислот, вільний від інфек[Mosmann, J. Immunol. Methods 65:55-63, 1983; ційних та пірогенних компонентів. Переважно, в Alley et al., Cancer Res. 48:589-601, 1988; Marshall очищеному протеїні суттєво відсутні інші протеїet al., Growth Reg. 5:69-84, 1995; Scudiero et al., ни, зокрема інші протеїни тваринного походженCancer Res. 48:4827-4833, 1988], які всі включені ня. в цей опис винаходу за допомогою посилання). Поліпептиди zFGF-5 або фрагменти цих поДиференціювання клітин являє собою диналіпептидів можна також формувати за допомогою мічний процес, що розвивається, і починається з хімічного синтезу. Поліпептиди zFGF-5 можуть плюрипотентних початкових клітин, а закінчуєтьбути мономерами або полімерами, глікозиловася формуванням повністю диференційованих ними або неглікозилованими, пегілованими або клітин. Плюрипотентні початкові клітини, повна непегілованими і можуть або не можуть містити регенерація яких можлива без підтримання поспочатковий метіониновий амінокислотний залилідовності клітинних поколінь, виділяють набір шок. маркерів диференціації, які втрачаються у випадАктивність молекул, що охоплюються цим ку, коли підтримується послідовність клітинних винаходом, можна оцінювати за допомогою різпоколінь. Недиференційовані клітининих методів аналізу, наприклад, оцінюючи регепопередники виділяють набір маркерів диференнерацію або гіперплазію (тобто ріст) серцевих ціації, експресія яких може продовжуватися або клітин на основі специфічності серцевих тканин не продовжуватися в процесі розвитку клітин, дорослих організмів. До додаткових показників згідно з послідовністю клітинних поколінь, до доактивності, використання яких є імовірним щодо зрівання. Маркери диференціації, експресія яких поліпептидів згідно з цим винаходом, належать: здійснюється виключно зрілими клітинами, харакріст ендотеліальних клітин, кардіоміцитів, фібротеризують, як правило, функціональні властивосбластів, скелетних міоцитів, посередньо або безті клітини, наприклад клітинні продукти, ферменпосередньо під дією інших ростових факторів; дія ти для утворення цих клітинних продуктів і як фактора хемотаксису щодо ендотеліальних рецептори. Етап диференціації популяції клітин клітин, фібробластів або фагоцитів; дія як остеоконтролюють за допомогою ідентифікації маркегенного фактора; дія як фактора розширення мерів, присутніх у популяції клітин. Вважається, що зенхимних початкових клітин і популяційміоцити, остеобласти, адіпоцити, хондроцити, попереднків. фібробласти і клітини сітківки ока походять з спіПоказники росту можна оцінювати, викорисльної мезенхимної початкової клітини [Owen et товуючи культивовані клітини серцевих тканин, al., Ciba Fdn. Symp. 136:42-46, 1988]. Маркери або, у живих організмах, за допомогою введення для мезенхимних початкових клітин не ідентифімолекул, одержаних згідно з винаходом, що проковані достатньою мірою [Owen et al., J. of Cell понується, в організм відповідної піддослідної Sci. 87:731-738, 1987], тому ідентифікацію здійстварини. Взагалі, вплив на ріст клітин оцінюється нюють на етапах, що відповідають клітиніза збільшенням кількості клітин і тому така оцінка попереднику і зрілій клітині. Наявність на ранможе враховувати гальмування процесу втрати ньому етапі початкових клітин, що є клітинамиклітин, а також мітогенез. До культивованих кліпопередниками серцевих міоцитів (на які часто тин належать серцеві фібробласти, серцеві міопосилаються як на початкові клітини для серцецити, скелетні міоцити і ендотеліальні клітини вих міоцитів), передбачається, але не продемонпупкової вени людини, одержані з первинних кустрована, у серцевих тканинах дорослих організльтур. До ряду визначених клітин належать фібмів. Нові поліпептиди згідно з цим винаходом робласт NIH ЗТЗ [АТСС No. CRL-1658], серцеві можуть виявитися корисними при дослідженнях з клітини СНН-1 кети [АТСС No. CRL-1680], серцеві метою відокремлення мезенхимних початкових міобласти H9c2 пацюка [АТСС No. CRL-1446], клітин і клітин, що є клітинами-попередниками ракові клітини Shionogi молочної залози [Tanaka серцевих міоцитів, як у живих організмах, так і et al., Ргос. Natl. Acad. Sci. 89:8928-8932, 1991] і умовах поза живими організмами. клітини LNCap.FGG аденокарциноми [АТСС No. Існують докази, які дозволяють стверджуваCRL-1740]. Методи аналізу для оцінки росту кліти, що фактори, які стимулюють розвиток процетин достатньо відомі спеціалістам у даній галузі. сів у специфічних клітинах для досягнення повної Наприклад, до цих методів аналізу належать такі диференціації або дедиференціації, впливають методи, як метод аналізу чутливості до хімічних на всю популяцію клітин, яка походить від спільподразників, зокрема до нейтрального червоного ної клітини-попередника або початкової клітини. барвника, (див. працю [Cavanaugh et al., Таким чином, цей винахід охоплює стимуляцію Investigational New Drugs 8:347-354, 1990], вклюпроцесів гальмування росту або процесів росту чену в цей опис винаходу за допомогою посиланміоцитів, клітин гладеньких м'язів, остеобластів, ня), метод аналізу з введенням нукліотидів з раадіпоцитів, хондроцитів і ендотеліальних клітин. діоактивними мітками (див. працю [Cook et al., Молекули, створені згідно з цим винаходом, моAnalytical Biochem. 179:1-7, 1989], включену в цей жуть, стимулюючи ріст або диференціацію серопис винаходу за допомогою посилання), метод цевих міоцитів, одночасно гальмувати ріст або аналізу з введенням 5-бром-2'-дезокюиурідину диференціацію адіпоцитів завдяки впливу на по 37 75316 38 чаткові клітини або клітини-попередники, що є даній галузі і які докладніше будуть розглянуті спільними для адіпоцитів. Таким чином, молекули нижче. Наприклад, дія інсуліну як регулятора вмізгідно з цим винаходом, можна використовувати сту глюкози в крові виявляється, переважно, у для припинення розвитку хондросаркоми, атеропечінці, скелетних м'язах і жирових тканинах. У склерозу, рестенозу і ожиріння. скелетних м'язах і жирових тканинах інсулін стиДо методів аналізу диференціації належать, мулює споживання, зберігання і використання наприклад, методи оцінки тих маркерів у поверхглюкози. невих частинах клітин, які пов'язані з експресією Існують методи, визнані в даній галузі, які тканин, специфічною щодо етапу диференціації, призначені для контролю всіх метаболічних фунактивністю ферментів, функціональною активніскцій, розглянутих вище. Таким чином, звичайний тю або морфологічними змінами (див. праці спеціаліст у даній галузі зможе оцінювати поліпе[Watt, FASEB 5:281-284, 1991; Franste, птиди zFGF-5, фрагменти цих поліпептидів, злиті Differentiation 57:63-75, 1994; Raes, Adv. Anim. протеїни, антитіла, агоністи і антагоністи стосовCell Biol. Technol. Bioprocesses, 161-171, 1989], які но функцій, що модулюють метаболізм. Приклавсі включені в цей опис винаходу за допомогою ди, що ілюструють методи модуляції, наведені посилання). нижче. Згідно з процедурами аналізу в живих органіЛіпогенез, стимульований інсуліном, можна змах, призначеними для оцінки відновлення серконтролювати, наприклад, вимірюючи включення 14 цевих клітин або гіперплазії, молекули, одержані С-ацетату в тригліцерид [Mackall et al., J. Biol. за цим винаходом, вводять новонародженим або Chem. 251:6462-6464, 1976] або накопичення дорослим пацюкам. Серцеву діяльність у тварин тригліцериду [Kletzien et al., Mol. Pharmacol. оцінюють, вимірюючи частоту серцевих скоро41:393-398, 1992]. чень, кров'яний тиск і хвилинний об'єм серця для Споживання глюкози, стимульоване поліпептого, щоб оцінити роботу лівого шлуночка серця. тидом zFGF-5, можна оцінювати, наприклад, виПроцедури аналізу, призначені для оцінки поліпкористовуючи метод аналізу процесу перенесеншення серцевої діяльності, які використовуються ня глюкози, стимульованого інсуліном. Первинні після смерті тварини, передбачають оцінку збіадіпоцити або клітини NIH ЗТЗ L1 [ATCC No. льшення маси серця, об'єму ядер і цитоплазми, а CCL-92.1], поміщають у середовище DMEM (сетакож контрастне фарбування серцевих гістолоредовище Ігла, модифіковане за способом Дульгічних зон для виявлення ядерного антигену в беко), яке містить 1г/л глюкози, 0,5% або 1,0% клітинах, що розростаються, залежно від рівня альбуміну BSA (альбумін бичачої сироватки), актину в цитоплазмі [Quaini et al., Circulation Res. 20мМ кислоти HEPES (N-275:1050-1063, 1994; Reiss et al., Proc. Natl. Acad. гідроксиетилпеперазин-N'-2-етаносульфонова Sci. 93:8630-8635, 1996]. кислота) і 2мМ глютаміну. Після культивування, Процедури аналізу, у живих організмах, припротягом 2-5 годин, середовище заміняють свізначені для оцінки змін інтенсивності формуванжим, вільним від глюкози середовищем DMEM, ня кісток, передбачають аналіз гістології кісток що містить 0,5% або 1,0% альбуміну BSA, 20мМ (див., наприклад, працю [Recker, R.., eds., Bone кислоти HEPES, 1мМ пiрувату і 2мМ глютаміну. Histomorphometry: Techniques and Interpretation, Потім додають поліпептид zFGF-5, інсулін або Boca Raton: CRC Press, Inc., 1983]) і комп'ютерну інсуліноподібний ростовий фактор IGF-5, або томографію з оцінкою кількісних показників [QCT; розчин досліджуваної речовини і забезпечують Ferretti, J. Bone 17:353S-364S, 1995; інкубацію клітин протягом 20-30 хвилин. Після Orphanoludakis et al., Investig. Radiol. 14:122-130, цього додають дезоксиглюкозу, мічену ізотопом 3 1979; Durand et al., Medical Physics 19:569-573, Н або 14С, до досягнення остаточної концентра1992]. Як метод аналізу, в умовах поза живими ції приблизно 50М, і забезпечують інкубацію кліорганізмами, для оцінки змін у формуванні кісток тин протягом 10-30 хвилин. Потім клітини швидко може бути використаний, наприклад, метод калапромивають холодним буферним розчином, наваріального аналізу [Goven et al., J. ImmimoI приклад розчином PBS (фізіологічний розчин з 136:2478-2482, 1986]. фосфатним буфером), а потім лізують, викорисЩодо балансу енергії модуляції, зокрема з товуючи придатний агент для лізування, наприточки зору зв'язку енергії модуляції з метаболізклад розчин DDS (додецилсульфат натрію) з мом, ростом і диференціацією адипоцитів, то концентрацією 1% або розчин 1N NaOH. Після поліпептиди zFGF-5 модулюють вплив на метацього оцінюють вміст клітинного лізату, викорисболічні реакції. До таких метаболічних реакцій товуючи сцинтиляційний лічильник. Радіоактивналежать реакції адіпогенезу, глюконеогенезу, ність, пов'язану з клітинами, вимірюють як показглікогенолізу, ліпогенезу, споживання глюкози, ник, що характеризує перенесення глюкози, після синтезу протеїну, термогенезу, використання усунення неспецифічного зв'язування, визначекисню і тому подібні реакції. Поряд з іншими меного при інкубації клітин у присутності цитохапатодами, які відомі спеціалістам у даній галузі або зину b, який є інгібітором перенесення глюкози. розглядаються в цьому описі винаходу, для оцінДо інших методів належать методи, описані, наки енергетичного балансу у ссавців можна контприклад, у працях [Manchester et al., Am. J. ролювати одну або декілька вищезгаданих метаPhisiol. 266 (Endocrinol. Metab. 29): E326-E333, болічних функцій. Ці метаболічні функції 1994] (перенесення глюкози, стимульоване інсуконтролюють за допомогою методів (методів лаліном). бораторного аналізу або аналізу на піддослідних Синтез протеїнів можна оцінювати, напритваринах), які відомі звичайним спеціалістам у клад, порівнюючи осадження протеїнів, мічених 39 75316 40 S-метіонином, після інкубації досліджуваних наприклад протеолітичні фрагменти F(ab')2 і Fab. клітин у присутності 35S-метіонину, а потім у приЦей термін поширюються також на непошкоджені сутності 358-метіонину і передбачуваного модуляантитіла або фрагменти, створені за допомогою тора синтезу протеїнів. методів генетичної інженерії, наприклад химерні Термогенез можна оцінювати за допомогою антитіла, фрагменти Fv, окремі ланцюгові антитіметоду, описаного в працях [В. Stanley, Biology of ла та інші подібні антитіла, а також на синтетичні Neuropeptide Y and Related Peptides, W. Colmere пептиди і поліпептиди, що зв'язують антигени. and C. Wahlestedt (eds.), Humana Press, Ottawa, Антитіла, що не відповідають людському похо1993, pp.457-569; C. BiIIington et al., Am. J. дженню, можна перетворювати в антитіла людсьPhysiol. 260:R321, 1991; N. Zarjevski et al., кого походження, пересаджуючи тільки комплеEndocrinology 133:1753, 1993; C. Billington et al., ментзалежні залишки в каркасні і константні зони Am. J. Physiol. 266:R1765, 1994; HeIIer et al., Am. людського походження або вставляючи повні J. Physiol. 254(4 Pt 2):R661-7, 1987; Heller et al., варіабельні секції, що не відповідають людському Am. J. Physiol. 245(3):R321-8, 1983]. Крім того, походженню (покриваючи їх, за вибором, поверхнепрямим показником термогенезу є рівень менею, що відповідає молекулі людського похотаболізму, який можна вимірювати за допомогою дження, за допомогою заміни відкритих залишків, різних методів. внаслідок чого формується так зване антитіло з Використання кисню можна оцінювати за доповерхневим покриттям). У деяких випадках анпомогою методу, описаного в праці [Heller et. aL, титіла, перетворені в антитіла людського похоPflugers Arch 369(1):55-59, 1977]. Цей метод педження, можуть зберігати у варіабельних секціях редбачає також аналіз температури гіпоталамуса каркасних зон людського походження залишки, і виділяння тепла в метаболічних процесах. Вищо не відповідають людському походженню, які користання кисню і терморегуляція були оцінені необхідні для поліпшення відповідних характеритакож в організмі людини, як описано в праці стик зв'язування. Завдяки перетворенню антитіл [HaskeIl et. al., J. Appl. Physiol. 51(4):948-954, в антитіла людського походження, можна збіль1981]. шити період біологічного нашвжиття антитіл і Поліпептиди zFGF-5 можна також використозменшити потенціальну можливість виникнення вувати для створення антитіл, які специфічно несприятливих імунних реакцій після введення зв'язуються з епітопами поліпептиду zFGF-5, пепантитіл в організм людини. До альтернативних тидами або поліпептидами. Методи створення методів формування або вибору антитіл, придатполіклональних і моноклональних антитіл достаних для використання в цьому винаході, налетньо відомі спеціалістам у даній галузі (див., нажать метод експозиції, в умовах поза живими приклад, праці [Sambrook et al., Molecular Cloning: організмами, лімфоцитів до протеїну або пептиду A Laboratory Manual, Second Edition, Cold Spring zFGF-5 і метод вибору для створення бібліотек Harbor, NY, 1989; Hurrell, J. G. R., Ed., Monoclonal виражених антитіл у фагах та в інших подібних Hybridoma Antibodies: Techniques and векторах (використовуючи, наприклад, імобілізоApplications, CRC Press, Inc., Boca Raton, FL, ваний або мічений протеїн або пептид zFGF-5). 1982], які включені в цей опис винаходу за допоАнтитіла визначаються як такі, що специфічмогою посилання). Як очевидно для звичайного но зв'язуються, якщо вони зв'язуються з поліпепспеціаліста в даній галузі, поліклональні антитіла тидом zFGF-5 із спорідненістю при зв'язуванні можна формувати з клітин, одержаних з різних (Ка), що становить 106М-1 або більше, переважно теплокровних тварин, наприклад коней, корів, кіз, 107М-1 або більше, а найбільш переважно -109М-1 овець, собак, курчат, кроликів, мишей і пацюків. або більше. Спорідненість антитіла при зв'язуванні може легко визначити звичайний спеціаліст Імуногенність поліпептиду zFGF-5 можна піду даній галузі, використовуючи, наприклад, метод вищити, використовуючи ад'ювант (стимулятор), аналізу, запропонований Скетчардом (Scatchard). наприклад галун (гідроксид алюмінію), а також повний або неповний ад'ювант Фройнда (Freund). Для виявлення антитіл, що специфічно зв'яДо поліпептидів, придатних для імунізації, налезуються з протеїнами або пептидами zFGF-5, жать також злиті поліпептиди, наприклад продукможна використовувати різні процедури аналізу, ти злиття поліпептиду zFGF-5 або частини полівідомі спеціалістам у даній галузі. Приклада тапептиду zFGF-5 з поліпептидом імуноглобуліну ких методів докладно описані в праці [Antibodies: або протеїном, що зв'язує мальтозу. ПоліпептидA Laboratory Manual, Hariow and Lane (Eds.), Cold ним імуногеном може бути первинна, непроцесоSpring Harbor Laboratory Press, 1988]. До типових вана молекула або частка цієї молекули. Якщо прикладів таких процедур аналізу належать: узчастка поліпептиду є гаптеноподібною, то таку годжений імуноелектрофорез, радіоімуноаналіз, частку можна приєднати до макромолекуяярного радіоімунопреципітація, твердофазний імунофеносія або сполучити з макромолекулярним носієм рментннй аналіз (ELISA), аналіз з використанням (наприклад з молекулою блюдечкового гемоціадот-блоттингу або вестфн-блоттингу, аналіз з ніну (KLN), альбуміну бичачої сироватки (BSA) гальмуванням зв'язування або конкурентним або токсоїду тетанусу) для імунізації. зв'язуванням, а також аналіз з використанням Термін "антитіло", що використовується в імуносендвічів. Крім того, антитіла можна поділяцьому описі винаходу, поширюється на поліклоти за спроможністю зв'язуватися з природними нальні антитіла, поліклональні антитіла, очищені або мутантними протеїнами або пептидами за допомогою афінного очищення, моноклональні zFGF-5. антитіла і фрагменти, що зв'язують антигени, Антитіла до поліпептиду zFGF-5 можна вико35 41 75316 42 ристовувати для мічення клітин, які забезпечують лення поліпептидів, які взаємодіють з відомою експресію поліпептиду zFGF-5, для спрямування мішенню, якою може бути протеїн або поліпепіншого протеїну, невеликої молекули або хімічної тид, наприклад ліганд або рецептор, біологічна сполуки в серцеву тканину, для ізоляції поліпепабо синтетична макромолекула, органічна або тиду zFGF-5 за допомогою афінного очищення, у неорганічна речовина. Методи, призначені для процедурах, діагностичного аналізу для визнастворення і аналізу таких бібліотек виражених чення рівнів циркуляції поліпептидів zFGF-5, для невпорядкованих пептидів, відомі спеціалістам у виявлення або визначення кількості розчинного даній галузі [Ladner et al., US Patent No. поліпептиду zFGF-5 як індикатора основного па5,223,409; Ladner et al., US Patent No. 4,946,778; тологічного відхилення або захворювання, у проLadner et al., US Patent No. 5,403,484; Ladner et цедурах аналізу, в яких використовується клітинal., US Patent No. 5,571,698], а бібліотеки вираний фільтр із збудженням флуоресценції (FACS), жених невпорядкованих пептидів і комплекти для для перевірки бібліотек експресії, для формувананалізу таких бібліотек поставляються комерційня антитіл проти ідіотизму, а також як нейтраліними постачальниками, наприклад фірмами зуючі антитіла або як антагоністи для гальмуванClontech (Palo Alto, CA), Invitrogen, Inc. (San ня росту клітин, здійснюваного через Diego, CA), New England Biolabs, lnc. (Beverly, посередництво поліпептиду zFGF-5, у живих орMA), Pharmacia LKB Biotechnology, Inc. ганізмах і поза живими організмами. До придат(Piscataway, NJ). Бібліотеки виражених невпорядних безпосередніх міток або маркерів належать кованих пептидів можна аналізувати, використорадіонукліди, ферменти, субстрати, кофактори, вуючи послідовності поліпептиду zFGF-5, що розінгібітори, флуоресцентні маркери, хемілюмінесглядаються в цьому описі винаходу, для центні маркери, магнітні частки і тому подібні заідентифікації протеїнів, які зв'язуються з поліпепсоби. У випадку непрямих маркерів або міток тидом zFGF-5. Ці протеїни, що зв'язуються, які можуть використовуватися, як посередники, пари взаємодіють з поліпептидами zFGF-5, можна ви"біотин-авідин" або інші пари "комппементкористовувати для мічення клітин, для ізоляції антикомгоіемент". Антитіла, що використовуютьгомологічних поліпептидів за допомогою афінного ся в цьому винаході, можна безпосередньо або очищення, а також безпосередньо або посередпосередньо сполучати з лікарськими засобами, ньо сполучати з лікарськими засобами, токсинатоксинами, радіонуклідами і тому подібними реми, радіонуклідами і тому подібними речовинами. човинами і використовувати одержані сполуки Згадані протеїни, що зв'язуються, можна викоридля діагностичного аналізу в живих організмах стовувати в процедурах аналізу, призначених для або як терапевтичні засоби. аналізу бібліотек експресії і оцінки нейтралізуючої Молекули згідно з цим винаходом можна виактивності. Протеїни, що зв'язуються, можна такористовувати для ідентифікації та ізоляції рецекож використовувати в процедурах діагностичнопторів, які справляють вплив на розвиток інфаркго аналізу для визначення рівнів циркуляції політу міокарда. Наприклад, можливі імобігпзація пептидів, для виявлення або кількісного аналізу протеїнів і пептидів, що пропонуються згідно з розчинних поліпептидів як індикаторів основного цим винаходом, на колонці і пропускання препапатологічного відхилення або захворювання. ратів, приготованих на мембранах, через колонку Згадані протеїни, що зв'язуються, можуть діяти як [Immobilized Affinity Ligand Techniques, Hermanson антагоністи поліпептиду zFGF-5, блокуючи зв'яet al., eds., Academic Press, San Diego, CA, 1992, зування з поліпептидом zFGF-5 і передачу сигнаpp.195-202]. Протеїни і пептиди можна також мілів в умовах поза живими організмами і в живих тити, використовуючи мічення радіоізотопами організмах. Такі протеїни, що зв'язуються, які [Methods in Enzymol., vol. 182, "Ouide to Protein діють як антагоністи поліпептиду zFGF-5, виявPurification", M. Deutscher, ed., Acad. Press, San ляються корисними для гальмування експресії Diego, CA, 1990, 721-737] або фотоафінне міченгенів, яка спричиняє ріст або диференціювання ня [Brunner et. al., Ann. Rev. Biochem. 62:483-514, клітин. Протеїни, що зв'язуються, які діють як ан1993; Fedan et al., Biochem. Pharmacol. 33:1167тагоністи поліпептиду zFGF-5, можна використо1180, 1984], і ідентифікувати специфічні протеїни вувати для лікування, наприклад для лікування на поверхневих частинах клітин. рабдоміосаркоми, міксоми серця, раку кістки, Антагоністи можуть бути корисними для гаякий пов'язаний з остеобластами, а також карлильмування активності молекул zFGF-5, пов'язаної ковості, артриту, для заживання зв'язок і хрящів, з ростом, у таких клітинах, як серцеві клітини, як окремо, так і в поєднанні з іншими терапевтичвключаючи міоцити, фібробласти і ендотеліальні ними засобами. клітини, а також в остеобластах і хондроцитах. Молекули згідно з цим винаходом можуть буГени, що кодують зони зв'язування в поліпептиді ти корисними для росту клітин серцевих тканин, zFGF-5, можна одержати, аналізуючи бібліотеки наприклад міоцитів або міобластів, скелетних невпорядкованих пептидів, які проявляються у міоцитів або міобластів і клітин гладеньких м'язів, фатах (фагове вираження) або в бактеріях, нахондроцитів, ендотеліальних клітин, адіпоцитів і приклад у кишковій паличці Е. соlі. Нукліотидні остеобластів, в умовах поза живими організмами. послідовності, що кодують поліпептиди, можна Наприклад, молекули згідно з цим винаходом, створювати за допомогою різних методів, наприкорисні як компоненти певних середовищ для клад за допомогою методів невпорядкованого вирощування клітин і їх можна використовувати мутагенезу і синтезу невпорядкованих полінукліокремо або в поєднанні з іншими цитокінами і отидів. Такі бібліотеки виражених невпорядковагормонами для заміни сироватки, яка широко них пептидів можна використовувати для вияввикористовується при культивуванні клітин. Мо 43 75316 44 лекули згідно з цим винаходом особливо корисні паратів або лікарських засобів до серця, сполудня специфічної стимуляції росту і розвитку міочаючи поліпептиди zFGF-5 з іншим протеїном цитів у клітинних культурах і можуть також вияви[Franz et al., Сіrc Res. 73:629-638, 1993] таким тися корисними при дослідженнях гіперплазії і чином, що перша молекула, яка містить поліпепрегенерації серцевих міоцитів. тид, що є гомологом поліпептиду zFGF-5, сполуПоліпептиди, нуклеїнові кислоти і антитіла, чається з другою молекулою препарату або ліщо пропонуються згідно з цим винаходом, можна карського засобу, внаслідок чого утворюється використовувати при лікуванні порушень, пов'яхимерна сполука. Протеїни, наприклад антитіла, заних з інфарктом міокарда, застійною серцевою можна використовувати для формування химернедостатністю, гіпертрофічною кардіоміопатією і них сполук з молекулами поліпептиду zFGF-5, розширеною кардіоміопатією. Молекули згідно з створеними згідно з цим винаходом [Manila et al., цим винаходом можуть також виявитися корисJ. Nucl. Cardiol. 2:26-34, 1995]. Як приклади комними для обмеження розмірів інфаркту після сепонентів препаратів або лікарських засобів, можрцевого приступу, для стимуляції розвитку кровона назвати, без будь-якого обмеження, біологічно носних судин і заживання ран після пластичних активні поліпептиди, гени, токсини, радіонукліди, операцій на судинах або після ендартеректомії, фармацевтичні засоби з невеликими молекулами для поліпшення коронарного колатерального І тому подібні компоненти. Сполучення може бути кровообігу, для реваскуляризації в очних тканипрямим або непрямим (наприклад у випадку лінах, для лікування ускладнень, пов'язаних з непосом) і може здійснюватися за допомогою засодостатньою циркуляцією крові, наприклад при бів рекомбінації, хімічних зв'язків, сильної некодіабетичних виразках на ногах, для усунення навалентної взаємодії і тому подібних засобів. слідків приступу після коронарної реперфузії з Згідно з одним із варіантів реалізації цього використанням фармакологічних засобів, а також винаходу, препарат, що містить протеїн zFGF-5, в інших випадках, в яких розвиток кровоносних використовується як терапевтичний засіб для судин забезпечує певні переваги. Молекули згідпідвищення інтенсивності процесу формування но з цим винаходом можуть виявитися корисними кісток через посередництво остеобластів. Препадля поліпшення серцевої діяльності, збуджуючи рати і методи використання препаратів згідно з регенерацію або гіперплазію міоцитів, колатерацим винаходом можна використовувати як засоби льне формування коронарних судин або реконсдля стимуляції заживання кісток після пошкотрукцію некротичних ділянок міокарда. Іншими джень і усунення дефектів кісток, наприклад пошприкладами терапевтичного використання цього коджень при закритих, відкритих і несуглобних винаходу є стимуляція регенерації або гіперплазії переломах кісток, для стимуляції заживання кісскелетних м'язів, регенерація нирок і лікування ток після операцій пластичної хірургії, для стимусистемної і легеневої гіпертензій. ляції вростання кісток у нецементні протезні з'єдРозвиток колатеральних серцевих судин, нання і зубні імплантати, для лікування стимульований поліпептидом zFGF-5, оцінюють у періодонтальних захворювань і усунення періокроликів, собак або свиней, використовуючи для донтальних дефектів, для поліпшення процесу цього моделі хронічної оклюзії коронарної артерії формування кісток при дистракційному остеоге[Landau et al., Amer. Heart J. 29:924-931, 1995; незі, а також для лікування інших захворювань, Sellke et al., Surgery 120(2): 182-188, 1996; пов'язаних з скелетною системою, лікування яких Lazarous et al., Circulation 94:1074-1082, 1996]. можливе за допомогою стимуляції активності Переваги поліпептиду zFGF-5 при лікуванні присостеобластів, наприклад для лікування остеопотупів у пацюків оцінюють, у живих організмах, розу і артриту. Процес формування нового кіствикористовуючи білатеральну оклюзію сонної кового матеріалу, який забезпечують методи, що артерії і оцінюючи гістологічні зміни, а також фунпропонуються згідно з цим винаходом, може бути кціонування лабіринту [Gage et al., Neurobiol. використаний для усунення наслідків природжеAging 9:645-655, 1988]. Ефективність поліпептиду них, травматичних або онкологічних резекцій кісzFGF-5 при лікуванні гіпертензії оцінюють, у житок, або для лікування кісток після остеонекрозу, вих організмах, використовуючи, у випадку аналіспричиненого дією радіації [Hart et al., Cancer зу системної гіпертензії, пацюків із спонтанною 37:2580-2585, 1976]. Методи згідно з цим винахогіпертензією (SHR) [Marche et al., СІin. Exp. дом можна також використовувати в пластичній Pharmacol. Physiol. Suppl. LSI 14-116, 1995]. хірургії. Якщо протеїни згідно з цим винаходом Молекули згідно з цим винаходом можна випризначені для фармацевтичного використання, користовувати для контролю проходження ввето фармацевтичні засоби мають склад, який задених препаратів або лікарських засобів до сербезпечує парентеральне, зокрема внутрішньоця. Наприклад, молекули згідно з цим винаходом венне або підшкірне, введення протеїнів за доможуть виявитися корисними для обмеження дії помогою звичайних методів. Внутрішньовенне лікарських засобів на серце завдяки експресії, введення можна здійснювати за допомогою ін'єкспецифічної для тканин, яку спрямовує промотор ції або вливання ударної дози фармацевтичного поліпептиду zFGF-5. Наприклад, специфічну для засобу на період часу від однієї до кількох годин. серцевих тканин експресію можна забезпечити, Взагалі, фармацевтичні засоби містять протеїн використовуючи дисцистронний комплекс, що zFGF-5 разом з фармацевтично прийнятним носкладається з аденовірусу і поліпептиду zFGF-5 сієм, наприклад саліном, буферованим саліном, [Rothmann et al., Gene Therapy 3:919-926, 1996]. розчином 5% декстрози у воді або іншим подібКрім того, поліпептиди zFGF-5 можна використоним носієм. Фармацевтичні засоби можуть також вувати для обмеження проходження інших премістити один або декілька наповнювачів, консер 45 75316 46 вантів, розчинників, буферних агентів, альбумін одержаної з тканини дорослого організму, яка для відвернення втрати протеїну на стінках амвикористовувалась як матриця в процесі ланцюпул і тому подібні засоби. Методи технології пригової полімеразної реакції. готування фармацевтичних засобів достатньо Умови для ланцюгової полімеразної реакції відомі спеціалістам у даній галузі і описані, набули такими: 1 цикл при температурі 94°С протяприклад, у праці [Remington's Pharmaceutical гом 90 секунд, 35 циклів при 94°С протягом 15 Sciences, Gennaro, ed., Mack Publishing Co., секунд і при 68°С протягом 1 хвилини, потім 1 Easton, PA, 1990], яка включена в цей опис винацикл протягом 10 хвилин при 72°С і період інкуходу за допомогою посилання. Як правило, викобації при 4°С. Ланцюгова полімеразна реакція ристовують терапевтичні дози в діапазоні від забезпечила рекреацію 160 пар гетероциклічних 0,1мкг до 100мкг на 1кг маси пацієнта на добу, а основ послідовності з набору EST і підтвердила, переважно - від 0,5мкг/кг до 20мкг/кг на добу, що послідовність з набору EST вибрана правильпричому точну дозу визначає лікар відповідно до но. прийнятих стандартних процедур лікування, враДо інших бібліотек послідовностей, розмноховуючи стан пацієнта, історію хвороби та іншу ження яких можливе за допомогою олігонуклюїиподібну інформацію. Кваліфікація звичайного дних праймерів, належать бібліотеки послідовноспеціаліста в даній галузі цілком достатня для стей для скелетних м'язів, легень, шлунку, тонкої визначення дози. Протеїни можна призначати кишки і щитовидної залози. для невідкладного лікування, часто протягом пеПриклад 2. Поширення в тканинах ріоду від одного до трьох днів, або використовуАналіз за допомогою нозерн-блотгангу був вати для лікування хронічних захворювань протяпроведений при використанні набору багатоелегом декількох місяців або років. Взагалі, ментних відбитків тканин людини (Human Multiple терапевтично ефективна кількість поліпептиду Tissue Blots), що поставляється фірмою Clontech zFGF-5 являє собою таку кількість, яка достатня (Palo Alto, CA). Фрагмент ДНК довжиною 160 пар для досягнення клінічно значущих змін щодо росгетероциклічних основ, описаний в прикладі 1, ту міоцитів, серцевої діяльності, формування піддавали електрофорезу в гелі з 1% агарози, кісток або для збільшення кількості специфічних потім фрагмент електроелюювали і мітили радіоклітин, зв'язаних з мезенхимними початковими активним ізотопом, використовуючи систему клітинами і клітинами-попередниками для міоциMEOAPRIME DNA (Ameraham, Arlington Heights, тів, остеобластів і хондроцитів. Зокрема, клінічно IL), призначену для мічення при невпорядкованій значуще збільшення кількості міоцитів або клітинініціації біосинтезу нуклеїнових кислот на прайпопередників міоцитів можна визначати, вимірюмері, відповідно до технічних умов виготовлюваючи об'єм фракції у викиді крові з лівого шлуночча. Пробу очищали, використовуючи всувну кока серця до введення і після введення молекул лонку NUCTRAP (Stratagene Cloning Systems, La поліпептиду zFGF-5, і, таким чином, оцінювати, Jolla, CA). Розчин EXPRESSHYB (Clontech, Palo що рівень такого збільшення становить принаймAlto, CA) використовували як розчин для поперені 5%, а переважно 10% або більше, від загальдньої гібридизації і як розчин для гідризації в ного об'єму фракції. Методи аналізу, призначені процесі нозерн-блоттингу. Гібридизацію здійснюдля визначення об'єму фракції при викиді крові за вали ввечері, при температурі 68°С, потім відбитодне скорочення серця, достатньо відомі навіть ки промивали спочатку в розчині 2Х хлориду і звичайним спеціалістам у даній галузі цитрату натрію (SSC) і 0,05% додецилсульфату Нижче наведені приклади, не пов'язані з натрію (SDS) при температурі реакції, а потім у будь-якими обмеженнями, які докладніше ілюстрозчині 0,1Х SSC і 0,1% SDS при температурі рують винахід, що пропонується. 50°С. Одну смугу спектра можна було спостерігаПриклади ти приблизно при довжині 2,0 тисяч пар нуклгіоПриклад 1. Розширення послідовності з натидів. Інтенсивність сигналу була найбільшою бору EST для серця дорослого організму, а сигнали з відЗа результатами аналізу бази даних для траносно меншою інтенсивністю характерні дам скенсльованих ДНК, здійснюваного з метою пошуку летних м'язів і шлунку. ростових факторів, була виявлена послідовність Приклад 3. Аналіз поліпептиду zFGF-5 в умоз набору послідовностей, що являють собою вах поза живими організмами продукти експресії генів (EST), яка, за результаА. тами прогнозування, являє собою нову послідовМітогенну активність поліпептиду zFGF-5 ність, що належить до групи ростових факторів аналізують, використовуючи групи клітин і клітифібробластів, і цю послідовність позначили як ни, одержані з первинної культури. КондиційоваzFGF-5. не середовище, що складається з клітин, які заОлігонукліотидні праймери ZC11,676 (послібезпечують експресію рекомбінантного і довність SEQ ID NO: 3) і ZC11,677 (послідовність очищеного протеїну, додають до культур, яким SEQ ID NO: 4) були сформовані з послідовності, відповідають такі клітини: фібробласт NIH ЗТЗ яка належить до набору послідовностей, що яв[АТСС No. CRL-1658], серцеві клітини СНН-1 кети ляють собою продукти експресії генів (EST). Ці [АТСС No. CRL-1680], серцеві міобласти Н9с2 праймери були використані для ініціації біосинтепацюка [АТСС No. CRL-1446], ракові клітини зу нуклеїнових кислот, у межах набору EST, після Shionogi молочних залоз ссавців [Tanaka et аl., здійснення ланцюгової полімеразної реакції Ргос. Natl. Acad. Sci. 89:8928-8932, 1992] і клітини (PCR), з використанням комплементарної ДНК LNCap.FGG аденокарциноми. До свіжих: ізольоMARATHON READY (Clontech, Palo Alto, CA), ваних клітин, придатних для аналізу активності 47 75316 48 поліпептиду zFGF-5 як стимулятора росту, налеполіпептидом zFGF-5, а другу половину ямок, без жать: серцеві фібробласти, серцеві міоцити, скеполіпептиду zFGF-5, використовують для негатилетні міоцити і ендотеліальні клітини пупкової вного контролю. Потім забезпечують інкубацію вени людини. клітин протягом 3 діб, при температурі 37°С, у Мітогенну активність оцінюють, вимірюючи присутності 5% СО2, і середовище видаляють. На 3 рівень включення Н-тимідину за допомогою мекожну ямку додають по 100мкл суміші DFC (див. тоду, запропонованого авторами праці [Rainess табл. 5), яка містить 0,1% сироватки ембріона and Ross, Meth. Enzymology 109:749-773, 1985]. теляти (FCS) і 3Н-тимідин з радіоактивністю 2 Суть цього методу полягає в тому, що використомікрокюрі на 1мл, після чого забезпечують додатвують клітини в стані спокою, які являють собою кову інкубацію планшетів протягом 1-24 годин клітини, висіяні на планшети для клітинних кульпри температурі 37°С, середовище відсмоктують і на кожну ямку додають по 150мкл трипсину. тур, з густиною 3 104 клітин на 1мл, у відповідПотім забезпечують інкубацію планшетів, при ному середовищі. Як типове середовище для температурі 37°С, до відокремлення клітин (провирощування клітин використовують середовище тягом принаймні 10 хвилин). Відокремлені клітини Ігла, модифіковане за способом Дульбеко збирають і переносять на фільтри, використову(GIBCO-BRL, Gaithersburg, MD), яке містить 10% ючи засіб для збирання клітин LKB Wallac 1295сироватки ембріона теляти (FCS). Клітини куль001 (LKB Wallac, Pharmacia, Gaithersburg, MD). тивують на планшетах, що містять по 96 ямок, і Фільтри висушують у мікрохвильовій печі, протядозволяють клітинам рости протягом 3-4 діб. Погом 10 хвилин, потім вимірюють інтенсивність тім середовище для вирощування видаляють і сигналів за допомогою сцинтиляційного лічильдодають на кожну ямку по 180мкл суміші DFC ника Betaplate 1250 (LKB Wallac), згідно з інструк(див. табл. 5), яка містить 0,1% сироватки ембріцією постачальника лічильника. она теляти (FCS). Половину ямок заповнюють Таблиця 5 Середовище Ігла, модифіковане за способом Дульбеко (DMEM, Gibco-BRL) Живильне середовище Ham F12 (Gibco-BRL) L-глютамін (Sigma, St. Louis, MO) Піруват натрію (Sigma, St. Louis, MO) Кислота HEPES (Sigma, St. Louis, MO) Фетуїн (Aldrich, Milwaukee, WI) Інсулін (Sigma, St. Louis, MO) Селен (Aldrich, Milwaukee, WI) Трансферті (JRH, Lenexa, KS) Б. Серця були ізольовані в новонароджених мишей віком від одного дня, а потім оброблені за допомогою декількох циклів реакції з колагеназою згідно з процедурою, описаною в праці [Brandt et al, J. Biol. Chem. 268:11500-11503, 1993]. Окремі міоцити були ізольовані за показником перевищення градієнта Перколя (Percoll), після чого 2мл клітин висівали на чашки для тканинних культур, по 6 ямок, з густиною 0,5 106 клітин на 1мл. Через 3 доби ямки промивали три рази, використовуючи фізіологічний розчин з фосфатним буфером (PBS) без домішки кальцію або магнію, і знову заповнювали середовищем, вільним від сироватки, об'ємом 1мл (табл.6). Потім ямки засівали частками протеїну AdCMVzFGF-5, по 1011 часток на кожну ямку, або частками протеїну AdCMV-CFP (зелений флуоресцентний протеїн) в контрольних ямках, і забезпечу 250мл 250мл 0,29мг/мл 1мМ 25мМ 10мкг/мл 50мкг/мл 3нг/мл 20мкг/мл вали інкубацію при температурі 37°С протягом 8 годин. Після цього ямки знову промивали три рази, використовуючи фізіологічний розчин з фосфатним буфером (PBS) без домішки кальцію або магнію, і знову заповнювали середовищем, вільним від сироватки, об'ємом 2мл. Протягом 48 годин після засівання протеїном AdCMV-zFGF-5 пульсації культивованих міоцитів припинились і були виявлені морфологічні зміни цих міоцитів, тоді як в ямках, заповнених протеїном AdCMV-CFP, довільні пульсації продовжувалися, а морфологічні зміни після засівання протеїном AdCMV-CFP були відсутніми. В ямках з вневнесеним протеїном AdCMV-zFGF-5 через 48 годин був також виявлений суцільний шар життєздатних, неклейких клітин, при збереженні злиття шарів клейких міоцитів, що свідчить про активність протеїну AdCMV-zFGF-5 щодо росту культивованих міоцитів мишей і пацюків. 49 75316 50 Таблиця 6 Середовище Ігла, модифіковане за способом Дульбеко (DMEM) Живильна суміш Ham F12 (Gibco-BRL); відношення об'єму суміші до об'єму середовища DMEM -1:1 NaHCO3 (Sigma) L-глютамін (Sigma) PSN (Sigma) Інсулін (Sigma) Трансферин LiCl (Sigma) Селен Аскорбінова кислота (Sigma) Тироксин (Sigma) В. Поліпептид zFGF-5, злигай з протеїном МВР (протеїн, що зв'язує мальтозу), як описано в прикладі 9А, і очищений так, як описано в прикладі 10, додавали до міоцитів (приклад 3Б) при концентрації 0,1нг/мл. Як було показано, злитий протеїн MBP-zFGF-5 також стимулює ріст міоцитів. Приклад 4. Аналіз активності поліпептиду zFGF-5 в умовах поза живими організмами Серцевий мітогенез оцінюють у живих організмах, видаляючи повністю серця в новонароджених або 8-тижневих мишей або пацюків. Видалене серце поміщають у середовище Joklik (Sigma, St. Louis, MO) або середовище Dulbecco при температурі 37°С, 5% СО2, на період 4-24 години. Протягом періоду інкубації додають поліпептид zFGF-5 при концентрації в діапазоні від 1пг/мл до 100мкг/мл. Для негативного контролю використовують тільки буферний розчин. Потім додають 3 Н-тимідин і забезпечують інкубацію зразків протягом 1-4 годин, після чого роблять зрізи серця і оцінюють мітогенез за допомогою авторадіографії. Зрізи серця використовують для гістоморфометрії з метою визначення об'ємів ядер і цитоплазми [McLaughІіln, Am. J. Physiol. 271:R122R129, 1996]. Згідно з альтернативним методом, забезпечували ліофілізацію серця, після чого повторно створювали суспензію в 1мл 0,1N NaOH. Для осаджування ДНК використовували трихлороцтову кислоту (ТСА) з концентрацією 10%, при температурі 0°С. Для оцінки включення неспецифічного 3Н-тимідину додавали надосадову рідину до 9мл сцинтиляційної рідини. Для того, щоб оцінити включення 3Н-тимідину, специфічне до ДНК, повторно створювали суспензію одержаного осаду в 1мл стабілізатора тканин BTS-450 (Beckman, FuІlerton, CA), потім додавали суспензію до 9мл сцинтиляційної рідини. Лівий і правий шлуночки серця ізолювали з серця, видаленого в одноденної миші CD-1 (Jackson Labs, Bar Harbor, ME), і забезпечували інкубацію протягом 4 годин, у присутності 3нг/мл матеріалу zFGF5-Hep2 (n=13; див. приклад 10) або контрольного матеріалу (n=10). Потім додавали 3Н-тимідин протягом однієї години. Шлуночки промивали декілька разів, потім гомогенізували в 1мл середовища Joklik. Одержаний гомогенат додавали до 9мл сцинтиляційної суміші і аналізували для визначення сумарного спо 17мМ 2мМ 1% 1мкг/мл 5мкг/мл 1нМ 1нМ 25мкг/мл 1нМ живання 3Н-тимідину і рівня включення в ДНК. Матеріал zFGF5-Hep2 підвищував споживання 3Н-тимідину і рівень включення в ДНК у 2,068±0,489 разів порівняно з контрольним матеріалом, що свідчить про мітогенність поліпептиду zFGF-5 щодо серцевих клітин. Приклад 5. Аналіз активності поліпептиду zFGF-5 у живих організмах Вплив поліпептиду zFGF-5 на ріст клітин оцінюють, у живих організмах, використовуючи двотижневих новонароджених мишей або двохмісячних дорослих пацюків. Пацюкам роблять одноразові ін'єкції в серце або ін'єкції протягом тривалого часу. А. Новонародженим пацюкам вводять поліпептид zFGF-5 протягом 1-14 днів, дозами в діапазоні від 50нг до 100мкг на добу. Після введення поліпептиду zFGF-5 оцінюють вплив цього поліпептиду, використовуючи для порівняння тварин, яким тільки імітували введення, для чого оцінюють збільшення маси серця, поліпшення діяльності лівого шлуночка серця в живих організмах і в умовах поза живими організмами, а також збільшення відношення об'ємів ядерної і цитозольної серцевих фракцій, яке визначають за допомогою гістоморфометрії. Б. Пацюки з кардіоміопатією, спричиненою довгостроковим введенням катехоламіну або перев'язуванням серцевих судин, або з кардюміопатією, характерною для сирійського хом'ячка [Sole et al., Amer. J. Cardiol. 62(ll):20G-24G, 1988], також використовуються для оцінки впливу поліпептиду zFGF-5 на діяльність серця і серцеві тканини. Для збудження кардіоміопатІЇ за допомогою катехоламіну, пацюкам віком 7-8 тижнів постійно вводять епінефрин протягом двох тижнів, використовуючи для цього осмотичні мініатюрні шприці, підшкірно імплантовані між плечовими пластинками тварин. Введення епінефрину спричиняє збільшення показника фібротичного ураження лівого шлуночка серця в межах від 0,005±0,005 до 2,11±0,18 (шкала 0-3), збільшення ширини клітин міоцитів лівого шлуночка в межах від 17,36±0,46мкм до 23,05±0,62мкм, а також незначну скорочувальну реакцію папілярного м'яза лівого шлуночка на дію ізопроторенолу (зусилля натягу 0,2г порівняно з зусиллям 1,1г у пацюків, яким вводили салін). Через двотижневий період 51 75316 52 введення епінефрину пацюкам щоденно вводять, 4 хвилин при температурі 94°С, потім відпал провнутрішньоперикардіально, кожний з препаратів тягом 1,5 хвилини при 66°С, розширення реакції zFGF-5, bFGF, IGF-I або IGF-II протягом періоду протягом 1,5 хвилини при 72°С і остаточно - цикл до 14 днів. Потім пацюків умертвляють і виконурозширення реакції протягом 7 хвилин при 72°С. ють процедури гістоморфометрії і гістоцитохімічДля розділення продуктів реакції використовуваного аналізу. ли електрофорез в агарозному гелі 3% NuSieve Стан пацюків, яким робили вищезгадані проGТG (FMC Bioproducts, Rockland, ME). цедури, оцінюють також наприкінці періоду ввеРезультати показали, що поліпептид zFGF-5 дення катехоламіну, а потім знову після введення приєднується до хромосоми 541,12 cR у верхній ростових факторів, причому відновлення серцечастині зв'язувальної групи хромосоми 5 людини вої діяльності визначають за показниками, що відповідно до карти радіаційних гібридів WІCGR. характеризують зменшення фібротичного ураЩодо центромери, то її найближчим до місця ження лівого шлуночка серця, збільшення шириприєднання маркером був маркер WI-16922, а ни клітин міоцитів лівого шлуночка серця і посинайдальшим від місця приєднання маркером лення скорочувальної реакції папілярного м'яза маркер WI-14692. Використання оточуючих марлівого шлуночка на дію ізопроторенолу. керів згідно з картою CHLC допомагає також розПриклад 6. Приєднання поліпептиду zFGF-5 ташовувати поліпептид zFGF-5 у секції 5q34-q35 до хромосоми варіанта v8c7 хромосоми 5 людини згідно з карПоліпептид zFGF-S був приєднаний до хротою CHLC включених маркерів (Об'єднаний мосоми 5 за допомогою набору GcneBridge 4 центр дослідження геномних зв'язків людини; Radiation Hybrid Panel, який розроблений Інституобслуговуюча програма WWW: том Уайтхеда (Whitehead) і Центром досліджень (http://www.chlc.org/ChlcIntegratedMaps.html). геному при Масачусетському технологічному інПриклад 7. Вплив поліпептиду zFGF-5 на кісституті і комерційно поставляється (Research тки А. Genetics, Inc., Huntsvffle, AL). Набір GeneBridge 4 Аденовірусний вектор, що містить комплемеRadiation Hybrid Panel містить ДНК, придатні для нтарну ДНК для поліпептиду zFGF-5, був створевикористання при ланцюгових полімеразних реаний за допомогою методів, описаних у праці кціях, вибрані з кожного з 93 радіоактивних гібри[Becker et al., Methods in Cell Biology 43:161-189, дних клонів, а також дві контрольні ДНК (донорна 1994]. Суть цих методів полягає в тому, що комДНК HFL і реципієнт А23). Доступна для широкоплементарну ДНК для поліпептиду zFGF-5 (як го використання обслуговуюча програма WWW показано в послідовності SEQ ID NO: І) клонують (http://www-genome.wi.mit.edu/cgiяк фрагмент Xba I-Sal І вектора pACCMV bin/contig/rhmapper.pl) забезпечує можливість [Gluzman et al., In Eucaryotic Viral Vectors, приєднання до хромосом при використанні карти Gluzman (eds.), pp.187-192, Cold Spring Harbor радіаційних гібридів для геному людини, розробPress, Cold Spring Harbor NY, 1982]. Вектор леної Інститутом Уайтхеда і Центром досліджень pACCMV містить частину геному аденовірусу 5, геному при Масачусетському технологічному інпромотор CMV і послідовність термінатора SV40. ституті (карта радіаційних гібридів WICGR), яка Потім забезпечували сумісну трансфекцію плазбула створена за допомогою набору GeneBridge міди, що містить вектор і ДНК-вставку, з плазмі4 Radiation Hybrid Panel. дою, що містить геном аденовірусу 5, позначеною Для приєднання поліпептиду zFGF-5 за дояк pJM17 [McGrory et al., Virology 163:614-617, помогою набору GeneBridge 4 Radiation Hybrid 1988], у 293 клітинах [АТСС No. CRL-1573; АмеPanel, реагенти, по 25мкл, наносили на титраційриканська колекція типових культур, Rockville, ний мікроплашпет з 96 ямками (Stratagene, La MD], завдяки чому створювалися умови для реJolla, СА) і використовували для ланцюгової покомбінації і формування рекомбінантного аденолімеразної реакції в апараті для циклічних тервірусу, що містить поліпептид zFGF-5, позначеномальних реакцій RoboCycler Gradient 96 го як AdCMV-zFGF5. Присутність (Stratagene). Кожний з 96 реагентів для ланцюгокомплементарної ДНК для поліпептиду zFGF-5 вої полімеразної реакції містить 2,5мкл суміші була підтверджена ланцюговою полімеразною 50Х Advantage KlenTag Polymerase Mix реакцією. (Clontech), 2мкл суміші дезоксинукліозидтрифосАденовірусний вектор AdCMV-zFGF5 був вифатів (dNTP) (з концентрацією 2,5мМ кожного користаний для передачі гена, в живому організкомпонента суміші; Perkin-Elmer, Foster City, СА), мі, при введенні мишам, за допомогою внутріш1,25мкл праймера ZC11,677 для сприйнятливості ньовенної ін'єкції, доз у діапазоні від 1 1011 до (послідовність SEQ ID NO. 4), 1,25мкп праймера 5 1011 часток на одну мишу. Було показано, що ZC12,053 проти сприйнятливості (послідовність після внутрішньовенної ін'єкції більша частина SEQ ID NO: 5), 2,5мкл суміші RediLoad (research вірусу досягає печінки і забезпечує дуже ефектиGenetics, Inc.), 0,5мкл суміші Advantage KlenTag вну трансдукцію печінкових клітин [Herz et al., Polymerase Mix (Clontech laboratories, Inc.), 25нг Proc. Natl. Acad. Sci. USA 90:2812-2816, 1993]. ДНК з окремого гібридного клону або контрольної Було продемонстровано, що клітини виробляють ДНК, а також розчин ddH20 в об'ємі, необхідному протеїн, кодований комплементарною ДНК, і у для досягнення сумарного об'єму 25мкл. Реагенвипадку секретованих протеїнів виділяють ці проти були покриті однаковою кількістю мінеральнотеїни в контур циркуляції. Були продемонстровані го масла і герметизовані. Умови для ланцюгової високі рівні експресії і фізіологічної дії [Ohwadaet полімеразної реакції а апараті для циклічних реаal., Blood 88:768-774, 1996; Stevenson et al., кцій були такими: один початковий цикл протягом Arteriosclerosis, Thrombosis and Vascular Biology 53 75316 54 15:479-484, 1995; Setoguchi et al., Blood 84:2946стегнової кістки після внутрішньовенного або 2953, 1994; Sakamoto et al., Proc. Natl. Acad. Sci. внутрішньоперикардіального введення аденовіUSA 91:12368-12372, 1994]. русу AdCMV-zFGF5 у кількості, яка становить, Шеститижневим мишам CD-1 (Jackson Labs, відповідно 530% (при внутрішньовенному ввеBar Harbor, ME) вводили аденовірус без ДНКденні) і 263% (при внутрішньоперикардіальному вставки (AdCMV-null) або аденовірус AdCMVвведенні) від кількості контрольного вектора, поzFGF5 внутрішньовенно, через хвостову вену, рівняно з кістками при введенні тільки відповідноабо внутрішньоперикардіально. Сумарна кільго контрольного вектора; б) помітне збільшення об'єму остеогенних кість вірусних часток становила 5 1011 або тканин на поверхнях кісток, яке дозволяє зробити 100мкл на одну мишу. Через 14 днів після ін'єкції висновок про підвищення рівня диференціації мишей умертвляли, видаляли великогомілкові і стромальних клітин кліткового мозку в напрямі стегнові кістки для того, щоб визначити можливу формування остеобластів. запальну реакцію. Кістки поміщали в 103. Відсутній суттєвий вплив аденовірусного відсотковий нейтральний розчин формаліну і підвектора AdCMV-zFGF5, при внутрішньовенному давали обробці. З кісток видаляли кальцій за доабо внутрішньоперикардіальному введенні, на помогою суміші 5-відсоткової мурашиної кислоти і кількість ендостеальних остеобластів порівняно з 10-відсоткового цитрату натрію, потім кістки провпливом, який справляють тільки відповідні контмивали водою, збезводнювали у середовищі 70рольні вектори при внутрішньовенному або внут100-відсоткового етанолу, очищали в ксилолі і рішньоперикардіальному введенні. покривали парафіном. Зразки розрізали, у поздо4. Ширина ростової оболонки кістки значно вжньому напрямі, у місцях метафізів великогомізменшується при внутрішньовенному, але не при лкової і стегнової кісток і мітили гемотоксиліном і внутрішньоперикардіальному, введенні аденовіеозином для ідентифікації кісткових клітин. Остерусного вектора AdCMV-zFGF5, що дозволяє области виявляли за показниками центральної зробити висновок про зниження активності росзони негативного контролю Golgi і показниками тової оболонки кістки після внутрішньовенного ексцентричності ядер, а остеокласт - за показнивведення. Вплив способу введення аденовірусками багатоядерності, неоднорідної форми і за ного вектора AdCMV-zFGF5 на диференціацію наявністю лакун Howchip, зв'язаних, із згаданими клітин не оцінювали. клітинами, що забезпечують поглинання. Вгаценаведені результати показують, що поДля цілей гістоморфометрії кісток були вибліпептид zFGF-5 є ефективним иітогеном для рані зразки стегнової кістки. Об'єм губчастої рестимуляції росту остеобластів і що поліпептид човини кістки не визначали у зв'язку з тим, що zFGF-5 може збуджувати формування нових кісмісця взяття проб були різними (наприклад, зразток. ки стегнової кістки не були розрізані точно в одній Б. площині). Щодо гістоморфометричних змін оціВикористовуючи по суті такі ж процедури, як і нювали три параметри кістки. описані в прикладі 7 А, був проведений кількісний 1. Кількість ендостеальних остеобластів. Цей аналіз мишей-самок CD-1 (Jackson Labs), яким параметр визначали вздовж ендостеальної поверхні губчастої речовини кістки, при збільшенні в вводили 1 1011 часток аденовірусу AdCMV180 разів, у зоні розміром 1,22мм, розташованій zFGF5 на одну мишу. Мишей умертвляли через ближче до ростової оболонки кістки. 30 днів після ін'єкцій і було визначено, що відно2. Кількість ендостеальних остеокластів. Цей шення довжини серця до довжини великогомілпараметр визначали вздовж ендостеальної повекової кості в мишей збільшилось порівняно з конрхні губчастої речовини кістки, при збільшенні в трольними тваринами, яким вводили аденовірус 180 разів, у зоні розміром 1,22мм, розташованій без ДНК або салін. Відсутні відмінності між груближче до ростової оболонки кістки. пами залежно від довжини великогомілкової кос3. Ширина ростової оболонки кістки. Цей паті, а також відмінності серед груп залежно від раметр визначали через кожні 72мкм, при збільмаси будь-яких інших органів. Таким чином, одешенні в 90 разів, по всій ростовій оболонці, за ржані результати кількісного аналізу показують, винятком периферійних кінцевих частин, для оціщо поліпептид zFGF-S вибірно збільшує сумарну нки активності ростової оболонки кістки. густину, густину губчастої речовини і товщину Аналіз даних (середнє значення ± середньоростової оболонки стегнової кістки. квадратичне відхилення, n=4-7 на 1 групу) покаПриклад 8. Вплив поліпептиду zFGF-5 на сезав такі результати. рце 1. Як видно, відсутні помітні ознаки запалюЯк описано в прикладі 7Б, мишам CD-1 ввовальної реакції в суглобі між великогомілковою і дили, внутрішньовенно, по одній дозі аденовірусу стегновою кістками. AdCMV-zFGF5, потім мишей умертвляли через 2. Як показали результати перевірки через 2 чотири тижні. Було визначено, що відношення тижні, у мишей аденовірусний вектор AdCMVдовжини серця до довжини великогомілкової косzFGFS, введений внутрішньовенно або внутрішті в мишей збільшилось порівняно з мишами, ньоперикардіяльно, значно підвищує остеогенну яким вводили аденовірус без ДНК або салін. Реактивність у зоні віддаленого метафізу стегнової зультати показали відсутність відмінностей між кістки. Стимуляцію остеогенної активності підтвегрупами залежно від довжини великогомілкової рджують такі показники: кості, які б могли бути пов'язані із згаданою зміа) значне збільшення кількості ендостеальною, а також відмінностей серед груп залежно від них остеобластів у губчастій речовині віддаленої маси будь-яких інших органів. Таким чином, оде 55 75316 56 ржані результати якісного аналізу показують, що пресії. Комплекс для тромбіну (позначений як поліпептид zFGF-5, при внутрішньовенному ввеpSDH90) був трансфектований в клітини DH10B денні у вигляді аденовірусного комплексу, вибір(GIBCO-BTL), а комплекс для фактора Ха (познано стимулює ріст серця. чений як pSDH117,3) і комплекс для ентеропепПриклад 9. Експресія поліпептиду zFGF-5 тидази (позначений як pSDH116,3) були трансА. Формування плазмід, що кодують поліпепфектовані в клітини ТОР10 (Invitrogen, San Diego, тид zFGF-5 СА). Всі три продукти злиття з протеїном МВР Експресія поліпептиду zFGF-5, який є гомомають чистоту приблизно 63кДа (43кДа в зоні логом ростових факторів фібробластів, була протеїну МВР і приблизно 20кДа в зоні поліпепздійснена в кишковій паличці Е. соІі за допомогою тиду zFGF-5). сполучної системи, створеної на основі протеїну Б. Гомологічна рекомбінація при експресії МВР (протеїн що зв'язує мальтозу), яка поставполіпептиду zFGF-5 ляється фірмою New England Biolabs (NEB, Для експресії вектора zFGF-5 у клітинах Beverly, MA). У цій системі комплементарна ДНК Pichia methanolica використовується система для для поліпептиду zFGF-5 приєднується до 3’-кінця експресії, що розглядається в описі до одночасно гена maІЕ, створюючи злитий протеїн MBPподаної патентної заявки РСТ WO 9717450, який zFGF5. Експресія злитого протеїну починається з включений в цей опис винаходу за допомогою кінцевого промотора і тільки після ініціації промопосилання. Плазміду для експресії, яка містить, тора за допомогою додавання 1мМ ізопропіл-bповністю або частково, полінукліотид, що кодує тіогалактозилпіранозиду (IPTG). Були створені поліпептид zFGF-5, формують за допомогою готри варіанти комплексу згаданого злитого протеїмологічної рекомбінації. Вектор експресії формуну, які відрізняються між собою тільки зоною роють з послідовності pCZR204, яка містить промозщеплення для виділення поліпептиду zFGF-5 з тор AUG1, після якого розташована лідерна протеїну МВР. Перший комплекс містить зону послідовність Fpp, а потім розташовані амінорозщеплення тромбіном, розташовану між зонакінцевий пептидннй маркер, зона рестрикції Smal ми протеїну МВР і поліпептиду zFGF-5. Другий з тупим кінцем, карбоксильно-кінцевий пептидний комплекс містить зону розщеплення фактором маркер, кодон припинення трансляції, після якого Ха, замість зони розщеплення тромбіном. Третій розташований термінатор AUG1, вибірковий маркомплекс містить зону розщеплення ентеропепкер ADE2, і остаточно - 3'-кінцева зона AUG1, що тидазою, замість зони розщеплення тромбіном. не транслюється. Крім того, цей вектор містить Комплекси були сформовані як продукти внупослідовності URA3 і GEN-ARS, необхідні для трішньорамочного злиття з протеїном МВР (провибору і реплікації в середовищі S. cerevisisiae, а R теїн, що зв'язує мальтозу), відповідно до зони також послідовності початку реплікації Amp і багатократного клонування (MCS) вектора pMALсоІЕІ, необхідні для селекції і реплікації в клітинах c2 (NEB) і згідно з технічними вимогами виготовЕ. соІі. Послідовність zFGF-5, вставлена в цей лювача. Розмноження поліпептиду zFGF-5 завектор, починається з амінокислотного залишку безпечувалось завдяки ланцюговій полімеразній 27 (Ala) амінокислотної послідовності zFGF-5. реакції, при використанні праймерів, які ініціюваДля формування комплексу pSDHH4, що явли необхідні зони клонування, а також необхідні ляє собою плазміду для експресії поліпептиду зони розщеплення, причому використовувалися zFGF-5 у клітинах P.methanolica, нижчеперелічені такі олігонуклютидні праймери: 1) у комплексі для фрагменти ДНК були трансформовані в середотромбіну -zc12,652 (послідовність SEQ ID NO: 7) і вище S.cerevisisiae: 100нг акцепторного вектора zc12,631 (послідовність SEQ ID NO: 8); 2) у комpCZR204, який був засвоєний за допомогою зони плексі для фактора Ха - zc15,290 (послідовність Smal; 1мкг фрагмента рестрикції Xbal-Sall, який SEQ ID NO: 9) і zc12,631 (послідовність SEQ ID виділений з комплексу pSDH90.5 і містить посліNO: 8), 3) у комплексі дай ентеропептидази довність, що кодує поліпептид zFGF-5; 1мкг синzc15,270 (послідовність SEQ ID NO: 10) і zc12,631 тетичного, двониткового лінкерного сегмента, (послідовність SEQ ID NO: 8). У кожному випадку одержаного в результаті ланцюгової полімеразрозмноження природної сигнальної послідовності ної реакції, який перекриває 70 пар гетероциклічполіпептиду zFGF-5 відсутнє; поліпептид zFGF-5, них основ кодувальної послідовності aFpp з одноодержаний в результаті експресії, починається з го кінця і приєднує їх до 70 пар гетероциклічних амінокислотного залишку 26 послідовності SEQ основ аміно-кінцевої кодувальної послідовності, ID NO: 2 (амінокислотний залишок Val замінений що міститься в закінченій послідовності поліпепна амінокислотний залишок Ala). Комплекс для тиду zFGF-5, з другого кінця, і який сформований тромбіну був сформований за допомогою ввез чотирьох олігояукліотидів, а саме олігонукліодення фрагмента Xba I-Sal І поліпептиду zFGF-5 тидів zc13,497 (послідовність SEQ ID NO:11), у зони Xba I-Sal І вектора pMAL-c2. Комплекс для zc15,131 (послідовність SEQ ID NO: 12), zc15,132 фактора Ха був сформований за допомогою вве(послідовність SEQ ID NO: 18), zc15,134 (послідення фрагмента blunt-Sal І у секції Xmn I-Sal І довність SEQ ID NO: 13), а відповідна значуща зони багатократного клонування MCS. Комплекс нитка двониткової послідовності якого показана в для ентеропептидази був сформований за допопослідовності SEQ ID NO: 19 (5'-кінцева лінкерна могою введення фрагмента Xba I-Sal І у зони послідовність (aFpp N-кінець поліпептиду Xba-Sal І вектора pMAL-c2. Після формування zFGF-5)); 1мкг синтетичного, одержаного в рекомплексів вони були трансформовані в різномазультаті ланцюгової полімеразної реакції, двонинітні штами-хазяїни кишкової палички Е.соІі і проткового лінкерного сегмента, який перекриває 70 аналізовані для виявлення високого рівня експар гетероциклічних основ карбоксильно-кінцевої 57 75316 58 кодувальної послідовності, що міститься в посліні експерименти можна здійснювати, використодовності поліпептиду zFGF-5, з одного кінця і вуючи культури, вирощувані в колбах з переміприєднує їх до 70 пар гетероциклічних основ посшуванням. Згідно з типовою процедурою, клітини лідовності термінатора AUG1, і який сформовакультивують протягом двох діб на планшетах з ний з чотирьох олігонукліотидів, а саме zc13,529 мінімальною кількістю метанолу, як описано ви(послідовність SEQ ID NO:14), zc13,525 (послідоще, при температурі 30°С, потім колонії викорисвність SEQ ID NO: 15), zc13,526 (послідовність товують для висівання на невелику кількість жиSEQ ID NO: 16), zc13,528 (послідовність SEQ ID вильного середовища з мінімальним вмістом NO: 17), а відповідна значуща нитка двониткової метанолу (6,7г/л азотовмісної дріжджової основи послідовності якого показана в послідовності без амінокислот, 10г/л метанолу, 0,4мг/п біотину), SEQ ID NO: 20 (3'-кінцева лінкерна послідовність при густині клітин приблизно 1 106 клітин на 1мл. (С-кінець поліпептиду zFGF-5 термінатор Клітини вирощують при температурі 30°С. КлітиAUG1)). Були вибрані колонії Ura+, а ДНК з остани, що вирощуються в середовищі з метанолом, точно сформованих дріязджових колоній була споживають більше кисню, тому при культивації екстрагована і трансформована в клітини Е.соІі. клітин необхідно забезпечити інтенсивне переміОкремі клони, що перешкоджали створенню шування. Метанол поповнюють щодоби (типова структури для правильної експресії, були ідентинорма - 1/100 об'єму 50-відсоткового метанолу на фіковані за допомогою аналізу, з використанням добу). ланцюгової полімеразної реакції з олігунукліотиУ випадку культивування на виробничому рідами zc13,497 (послідовність SEQ ID NO: 11) і вні, свіжі культури високопродуктивних клонів zc13,528 (послідовність SEQ ID NO: 12), з подаформують у колбах, з перемішуванням. Одержані льшим засвоєнням через рестрикцію, необхідним культури використовують для висівання на живидля перевірки наявності вставки поліпептиду льне середовище у ферментері. У типових умоzFGF-5, і розшифровуванням послідовності ДНК вах, 500мл культури в середовищі YEPD, виродля того, щоб підтвердити сполучення необхідщеної при температурі 30°С протягом 1-2 діб, при них послідовностей ДНК одна з одною. Плазмідінтенсивному перемішуванні, використовуються на ДНК, одержана в більшому обсязі, була видідля внесення в ферментер місткістю 5л. Клітини лена для одного з правильних клонів, після чого вирощують у придатному середовищі, що містить була забезпечена реакція засвоєння ДНК, за досолі, глюкозу, біотин і елементи для мічення, при помогою зони Sfi І, для виділення комплексу температурі 28°С, pH=5,0 і вмісті розчиненого Pichia-zFGF5, що є результатом експресії, з струкисню більше 30%. Після закінчення споживання ктури вектора. Потім послідовність ДНК, розрізапочаткового заряду глюкози (показником такого на за допомогою зони Sfi І, була трансформована закінчення є зменшення споживання кисню) у в клітину-хазяїна Рісchiа methanolica для експрепосудину вносять живильну суміш із глюкози і сії, позначену як PMAD16, і висіяна на планшети метанолу для того, щоб забезпечити виробництADE D для селекції. Виявлення і вибір різноманіво необхідного протеїну. Оскільки широкомасштних клонів здійснювали за допомогою процедури табна ферментація здійснюється в умовах обмевестерн-блоттингу, що забезпечує високий рівень ження кількості вуглецю, то присутність глюкози в експресії поліпептиду zFGF-5. живильній суміші не спричиняє гальмування проБільш детально, у випадку невеликого обсягу мотора, збуджуваного метанолом. виробництва протеїну (наприклад на планшетах Приклад 10. Очищення поліпептиду zFGF-5 або в колбах з перемішуванням) трансформация Середовище для ферментації клітин Е.соlі P.methanolica, які несуть комплекс для експресії, було одержане з штаму, що забезпечує експрещо містить промотор, регульований метанолом, сію поліпептиду zFGF-5 у вигляді продукту злиття (наприклад промотор AUG1) вирощуються в приз протеїном МВР (протеїн, що зв'язує мальтозу), сутності метанолу і при відсутності інших шкідли(описаного вище як продукт з позначенням вих домішок, що є джерелами вуглецю (наприpSDH90.5). Злитий протеїн MBP-zFGF5 був переклад при відсутності глюкози). Для експериментів творений в розчин, за допомогою обробки ульту невеликому обсязі, включаючи експерименти развуком або обробки згідно з процедурою для попередньої оцінки рівнів експресії, трансFrench для роздрібнення під тиском, при викорисформанти можна вирощувати, при температурі танні буферного розчину, що містить 20мМ кис30°С, на твердих носіях, які містять, наприклад, лоти HEPES (N-2-гідроксиетилпеперазин-N'-220г/л агару Bacto-agar (Difco), 6,7г/л азотовмісної етаносульфонова кислота), 0,4М NaCl, 0,01мМ дріжджової основи без амінокислот (Difco), 10г/л етилендіамінтетраоцтової кислоти (EDTA) і 10мМ метанолу, 0,4мг/л біотину і 0,56г/л порошкоподібдифенілтрихлоретану (DDT), при pH=7,4. Буферної суміші аденіну, треоніну і триптофану (Adeний розчин для екстрагування містить також по Thr-Trp). Оскільки метанол є джерелом леткого 5мг/мл пепстатину (Pepstatin), лейпептину вуглецю, то він легко втрачається при довгостро(Leupeptin), апротиніну (Aprotinin) і бістатину ковій інкубації. Для безперервного поповнення (Bestaun). Для досягнення остаточної концентраметанолу можна помістити водний 50ції 0,5мМ був також доданий фенілметилсульфовідсотковий розчин метанолу в кришки перевернілфторид (PMSF). нених планшетів, завдяки чому метанол надхоЕкстракт був оброблений на центрифузі, з дить до вирощуваних клітин внаслідок перенеприскоренням 18000g, протягом 30 хвилин, при сення при випаровуванні. Взагалі, температурі 4°С. Одержана надосадова рідина використовують не більше 1мл метанолу на один була оброблена амілозою (Pharmacia LKB планшет розміром 100мм. Трохи більш масштабBiotechnology, Piscataway, NJ), яка зв'язує зону 59 75316 60 протеїну МВР у злитому протеїні. Після промидному гелі, призначеного для визначення зменвання колонки, зв'язаний злитий протеїн MBPшення вмісту додецилсульфату натрію. zFGF5 елюювали в тому ж буферному розчині, Розшифровування N-кінцевої амінокислотної який використовувався для екстракції, без етшіепослідовності показало наявність природної Nндіамінтетраоцтової кислоти та інгібіторів протеїкінцевої послідовності, але дані маснази, але при наявності 10мМ мальтози. спектрофотометрії виявили наявність молекуляНакопичений після елюювання протеїн MBPрних сполук, які показують, що С-кінець необхідzFOFS обробляли за допомогою тромбіну Bovine но укорочувати на позиції, що відповідає аміноки(відношення мас - 1:100), активного щодо злитого слотному залишкові 196 (Lys) у послідовності протеїну MBP-zFGFS. Реакція розщеплення проSEQ ID NO: 2, для якої характерна двохосновна ходила протягом 6-8 годин при кімнатній темпегрупа. ратурі і після її закінчення реакції суміш продуктів Протеїн zFGF-5 має високу стабільність у сереакції пропускали над шаром сефарози редовищі 1,3М NaCl. Після діалізу в фізіологічноBenzamidine (Pharmacia LKB Biotechnology, му розчині з фосфатним буфером протеїн zFGFPiscataway, NJ), щоб видалити тромбін, викорис5 густіє і залишає рідку фазу. Таким чином, спотовуючи буферний розчин для елюювання, опилуки, що містять гепарин та інші поліаніони, можсаний вище у зв'язку з афінною хроматографією на використовувати для запобігання згущенню за спорідненістю до амілози. чистого протеїну zFGF-5. Готову фракцію, що містить розщеплений Приклад 11. Формування антитіл продукт zFGF-5 і зону вільного протеїну МВР, Антитіла для поліпептиду zFGF-5 були сфонаносили на матрицю Toso Haas Heparin, призрмовані за допомогою стандартних методів, віначену для оцінки спорідненості до гепарину домих спеціалістам у даній галузі і описаних ра(Toso Haas, MontgomeryvіІle, PA), відкалібровану ніше, імунізуючи морських свинок, кроликів і в розчині, що містить 0,5М NaCl, 20мМ кислоти мишей пептидами QTRARDDVSRKQLRLYC (посHEPES, 0,01М етилендаамінтетраоцтової кислолідовність SEQ ID NO: 2, фрагмент від амінокисти (EDTA), при pH=7,4. У таких умовах протеїни лотного залишку 40 до амінокислотного залишку МВР і zFGF-5 зв'язуються з гепарином. Зв'язані 56, з додатковим амінокислотним залишком Cys протеїни елюювали в умовах об'ємного градієнту, на С-кінці), позначеними як zFGF-1, пептидами що забезпечується в 2-3 колонках, який утворюVTTVTKRSRRIRPTHRAC (послідовність SEQ ID ється між 0,5М NaCl і 2,0М NaCl у буферному NO: 2, фрагмент від амінокислотного залишку розчині колонок. 191 до амінокислотного залишку 207, з додаткоПротеїн МБР вимивається на ранньому етапі, вим амінокислотним залишком Cys на С-кінці), при концентрації NaCl приблизно 0,7М, а розщепозначеними як zFGF-5, або первинними, непроплений продукт zFGF-5 вимивається при конценцесованими поліпептидами zFGF5, як показано в трації NaCІ приблизно 1,3М. Накопичені фракції послідовності SEQ ID NO: 2, злитими з протеїном продукту zFGF-5 знову пропускали через етап МВР (протеїн, що зв'язує мальтозу), позначеними обробки амілозою для того, щоб видалити будьяк МВР-FGF5. Пептиди були об'єднані, через які залишки злитого протеїну МВР-zFGFS, які амінокислотні залишки Cys, за допомогою продуспричиняють другорядну забрудненість. Очищекту KLH, активованого малеімідом (Maleimide) ний матеріал був позначений як zFGF5-Hep2 і (Pierce Chemical Co., Rockford, IL). окремі зразки цього матеріалу мають високу чисУ таблиці 7 наведені дані про піддослідних тоту, на рівні приблизно 20кДа, за результатами тварин, рівні імунізації і способи відділення антианалізу на основі електрофорезу в поліакриламітіл. Таблиця 7 Пептид або протеїн zFGFS-1 Тварини Морські свинки Кролики ZFGF5-2 Морські свинки Кролики Миші MBP-FGF5 Кролики Рівень імунізації Початковий - 50мкг на одну тварину Повторний - 25мкг на одну тварину Початковий -100мкг на одну тварину Повторний - 50мкг на одну тварину Початковий - 50мкг на одну тварину Повторний - 25мкг на одну тварину Початковий - 100мкг на одну тварину Повторний - 50мкг на одну тварину Початковий - 20мкг на одну тварину Повторний - 10мкг на 1 тварину Початковий - 200мкг на 1 тварину Повторний - 100мкг на 1 тварину Приклад 12. Вплив поліпептиду zFGF-5 на мишей з ожирінням Вплив поліпептиду zFGF-5 на адиюцити і жировий обмін досліджували, використовуючи мишей-самок з ожирінням (C57B1/6J, Jackson Labs, Ваг Harbor, ME). Миші відзначались ожирінням, Спосіб відділення антитіл Афінне очищення фракціонування імуноглобуліну G Афінне очищення фракціонування імуноглобуліну G Афінне очищення фракціонування імуноглобуліну G Афінне очищення фракціонування імуноглобуліну G Афінне очищення фракціонування імуноглобуліну G Афінне очищення стійкістю до інсуліну і мали так звані "жирові кістки". Після зважування, причому при зважуванні всі миші мали однакову вагу, мишам вводили, внутрішньовенно, препарат AdCMVzFGF-5, по 1011 часток на 1 мишу, а контрольним мишам вводили салін або препарат Ad5CMV-GFP, як
ДивитисяДодаткова інформація
Назва патенту англійськоюHomologues with fidroblast growth factor
Автори англійськоюConklin Darrell C.
Назва патенту російськоюГомологи з фактором роста фибробласта
Автори російськоюКонклин Деррел К.
МПК / Мітки
МПК: A61P 9/10, C07K 19/00, C12N 15/18, C12P 21/02, C07K 14/50, A61P 21/00, C12N 1/19, C07K 16/22, A61P 19/08, A61K 38/00, C12P 21/08, C12N 1/15, C12N 1/21, C12N 15/09, C12N 5/10
Мітки: фактором, росту, фібробласта, гомологи
Код посилання
<a href="https://ua.patents.su/34-75316-gomologi-z-faktorom-rostu-fibroblasta.html" target="_blank" rel="follow" title="База патентів України">Гомологи з фактором росту фібробласта</a>
Випадковий патент: Способи і композиції для зменшення злипання насіння