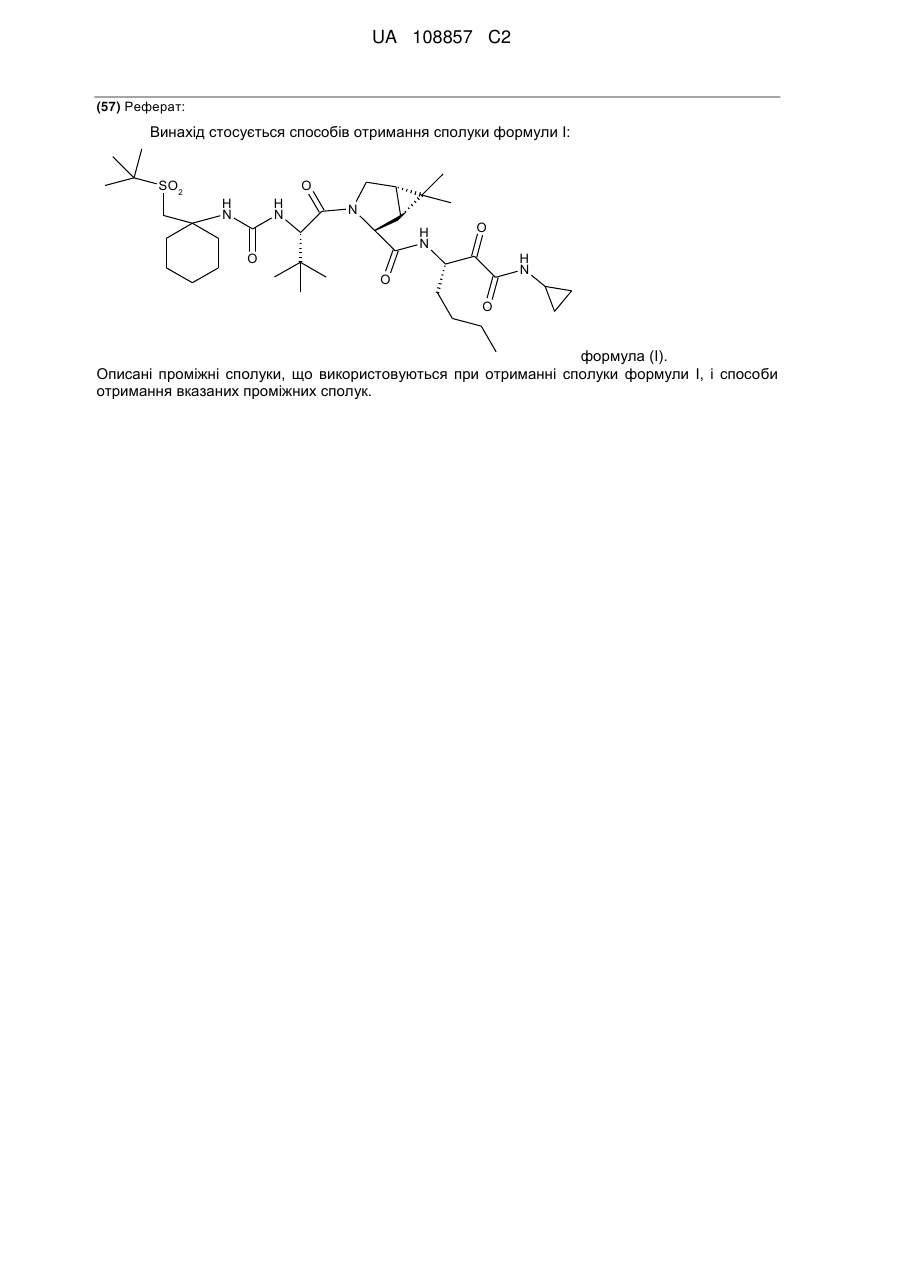
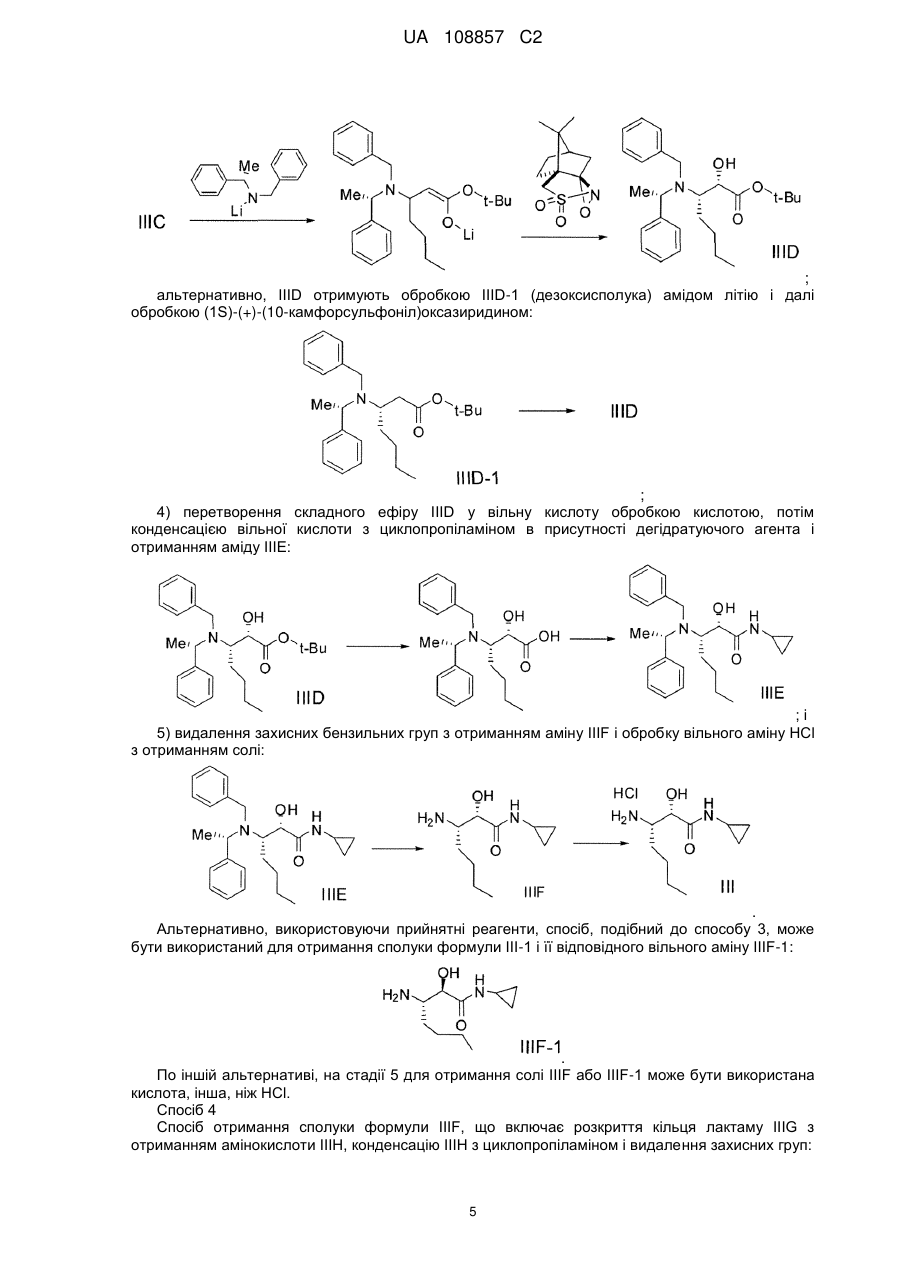
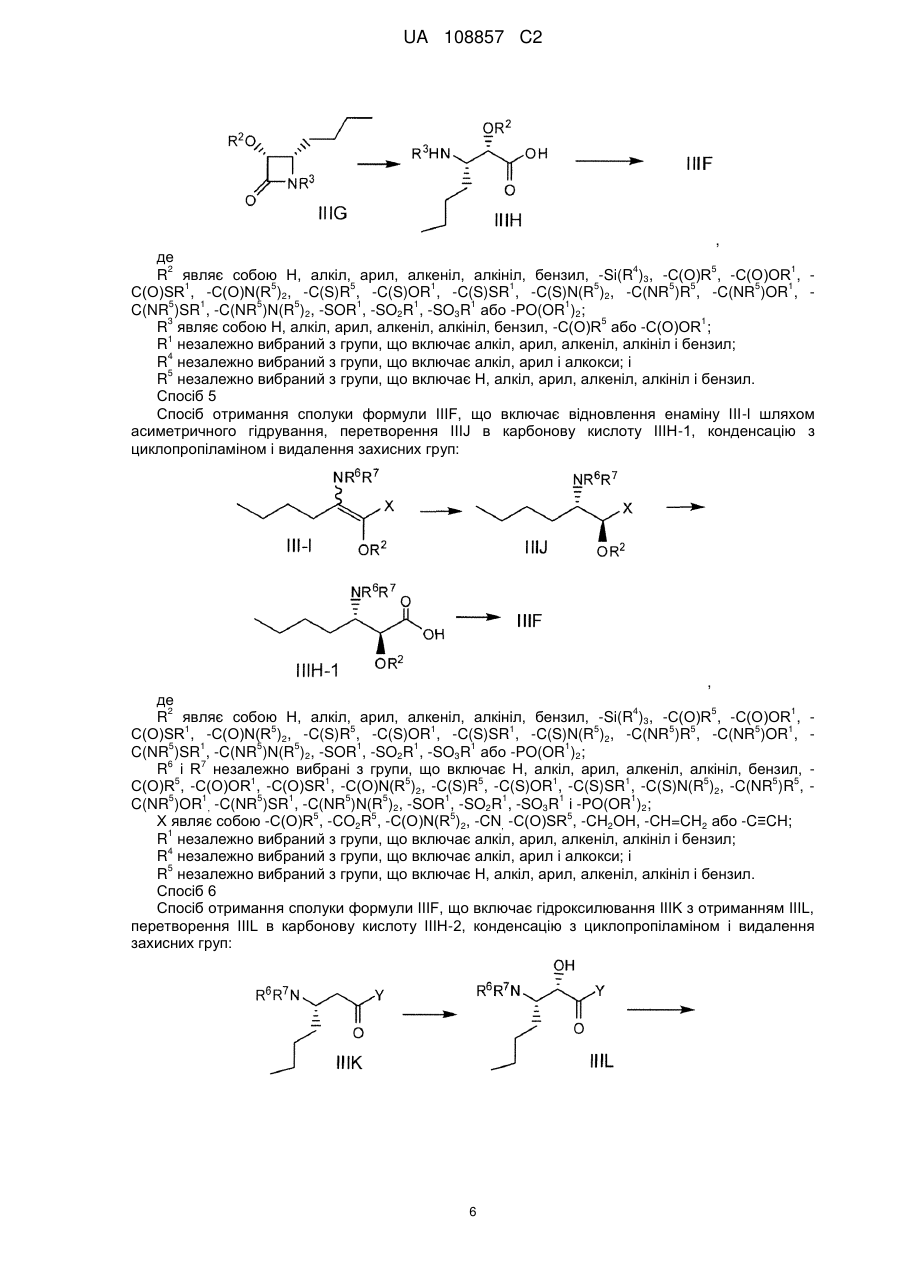
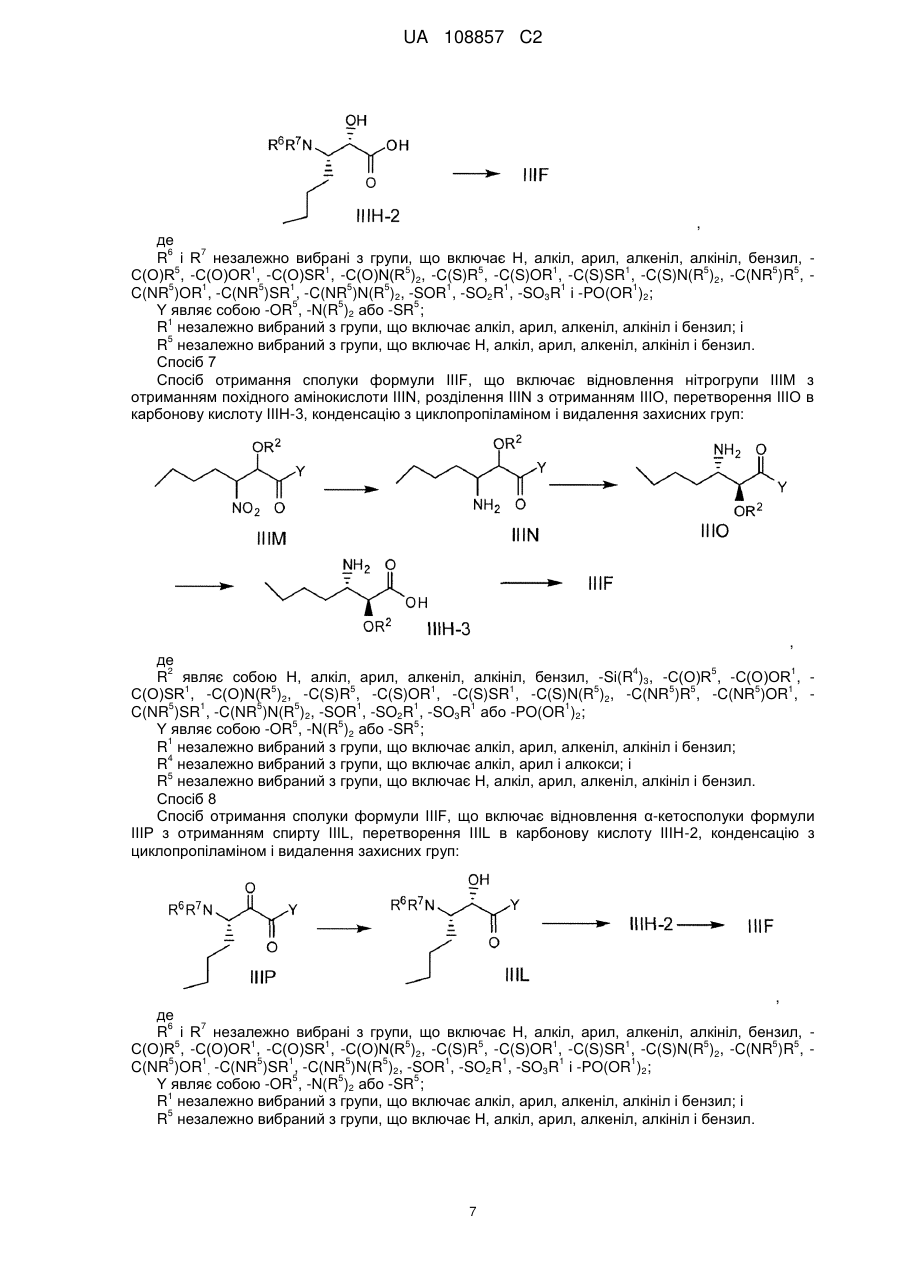
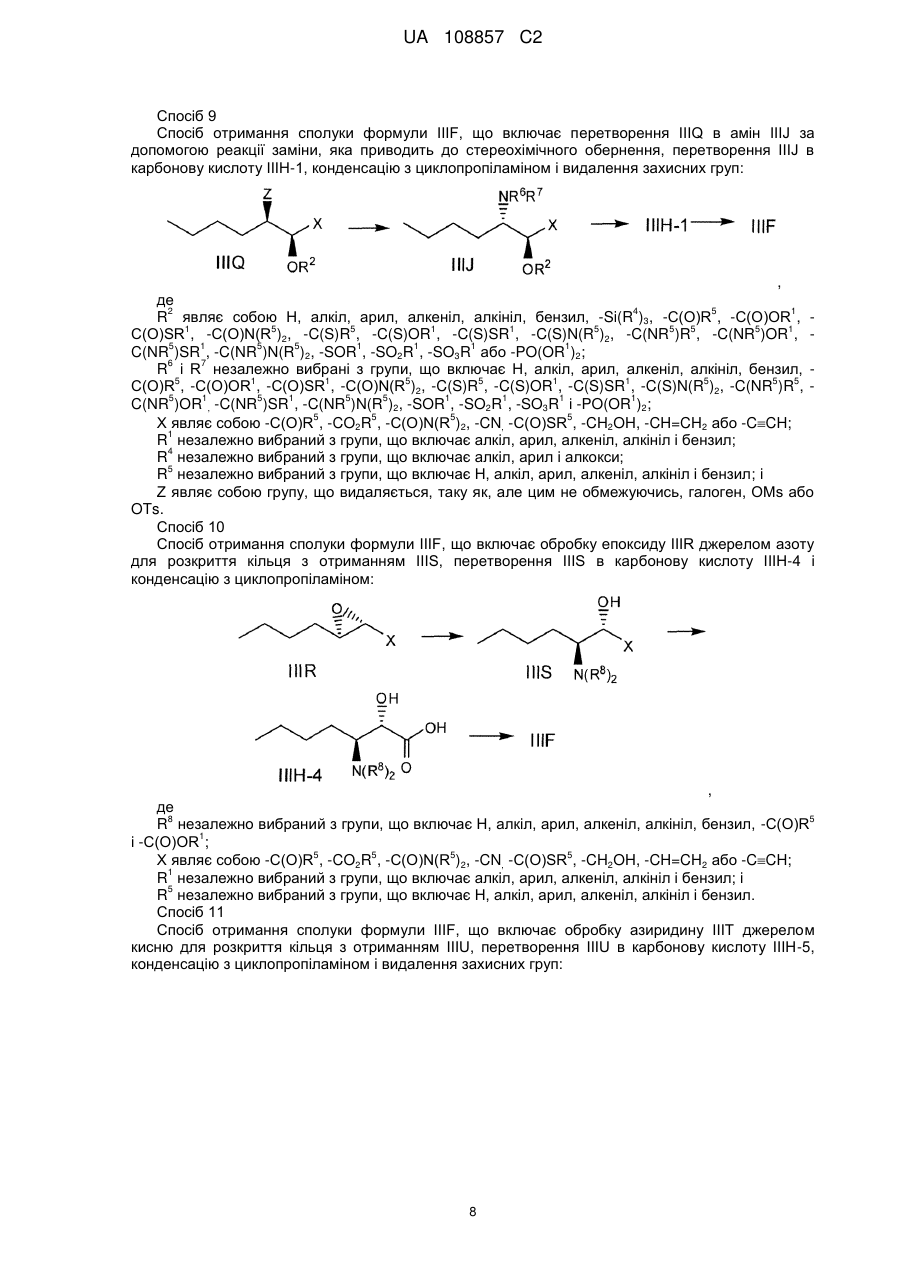
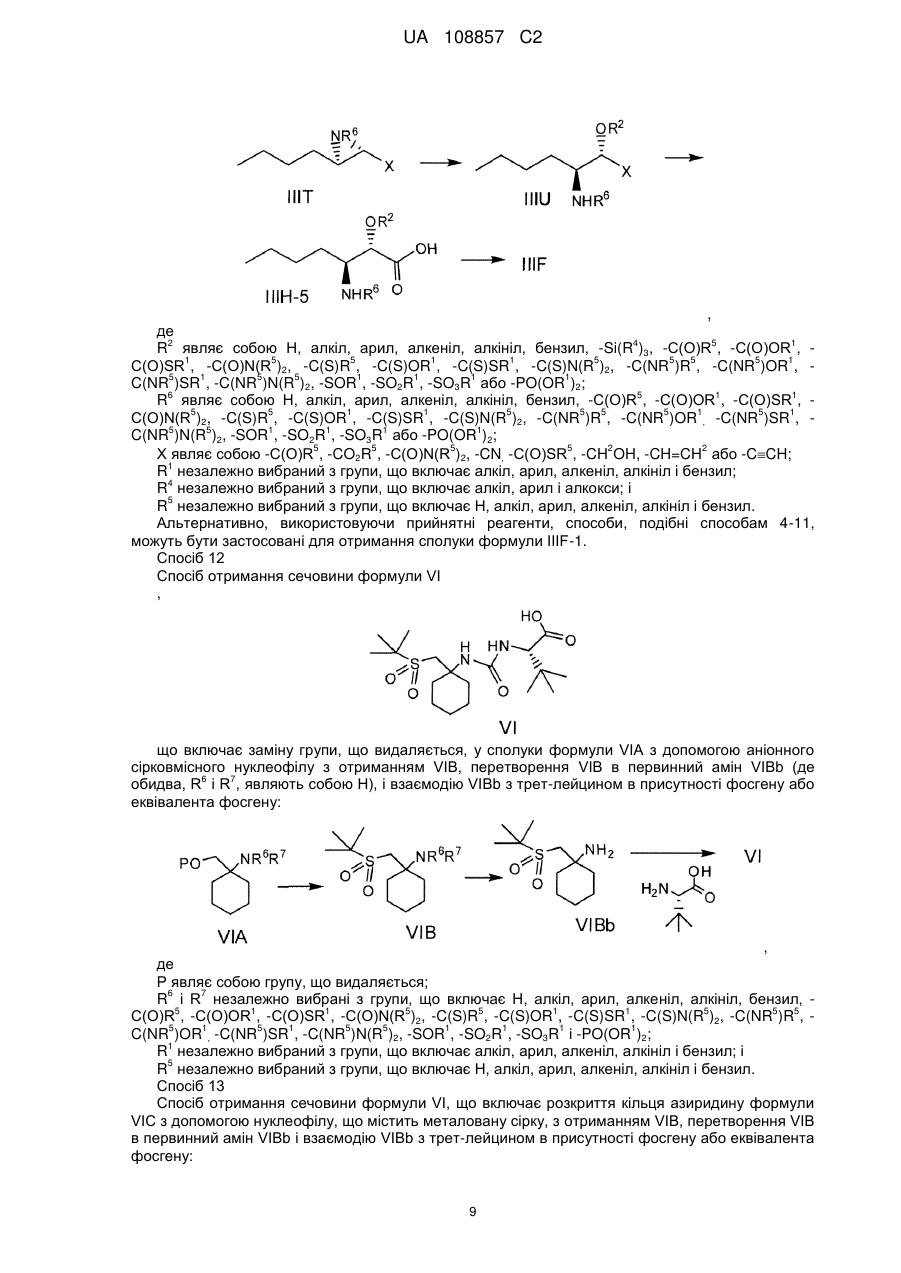
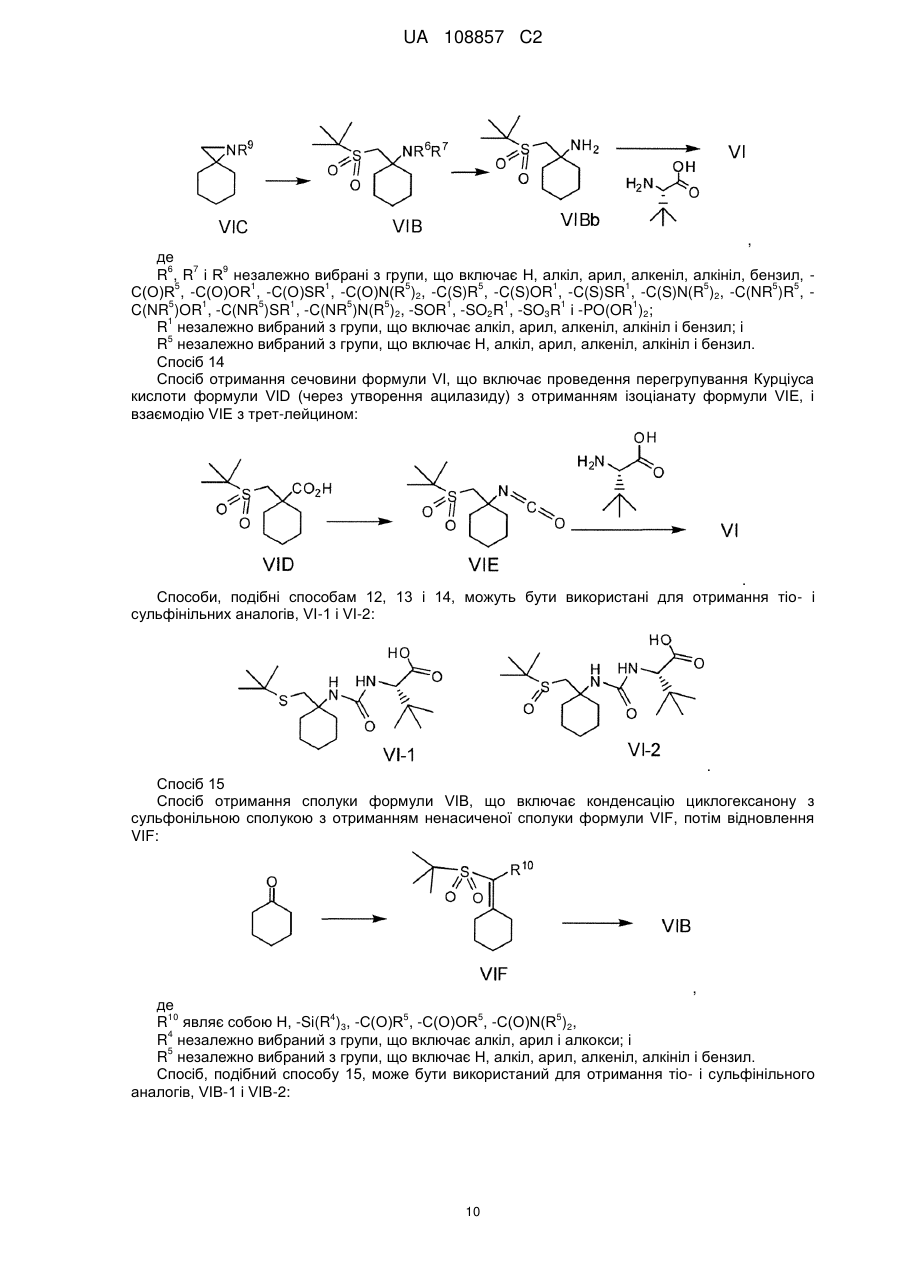
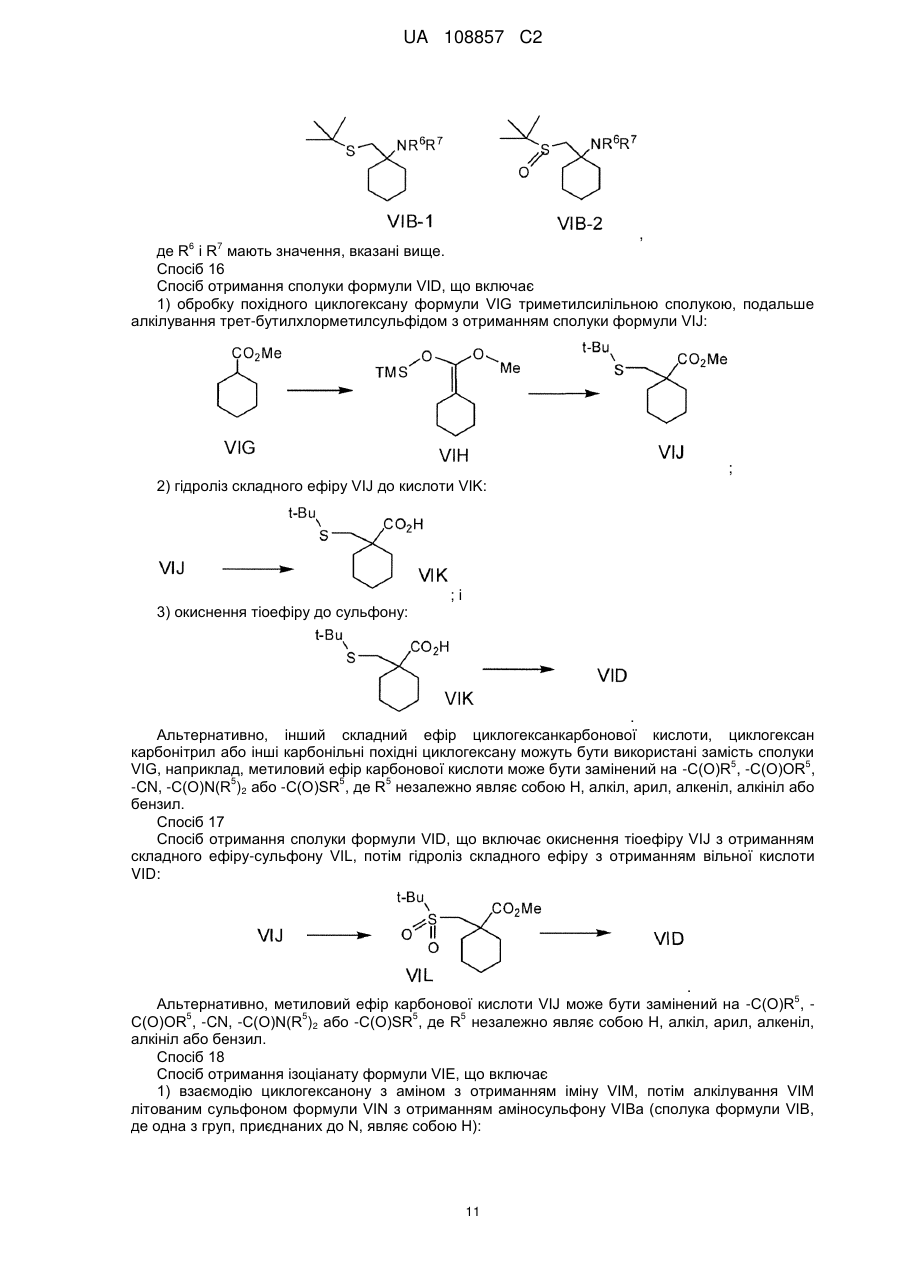
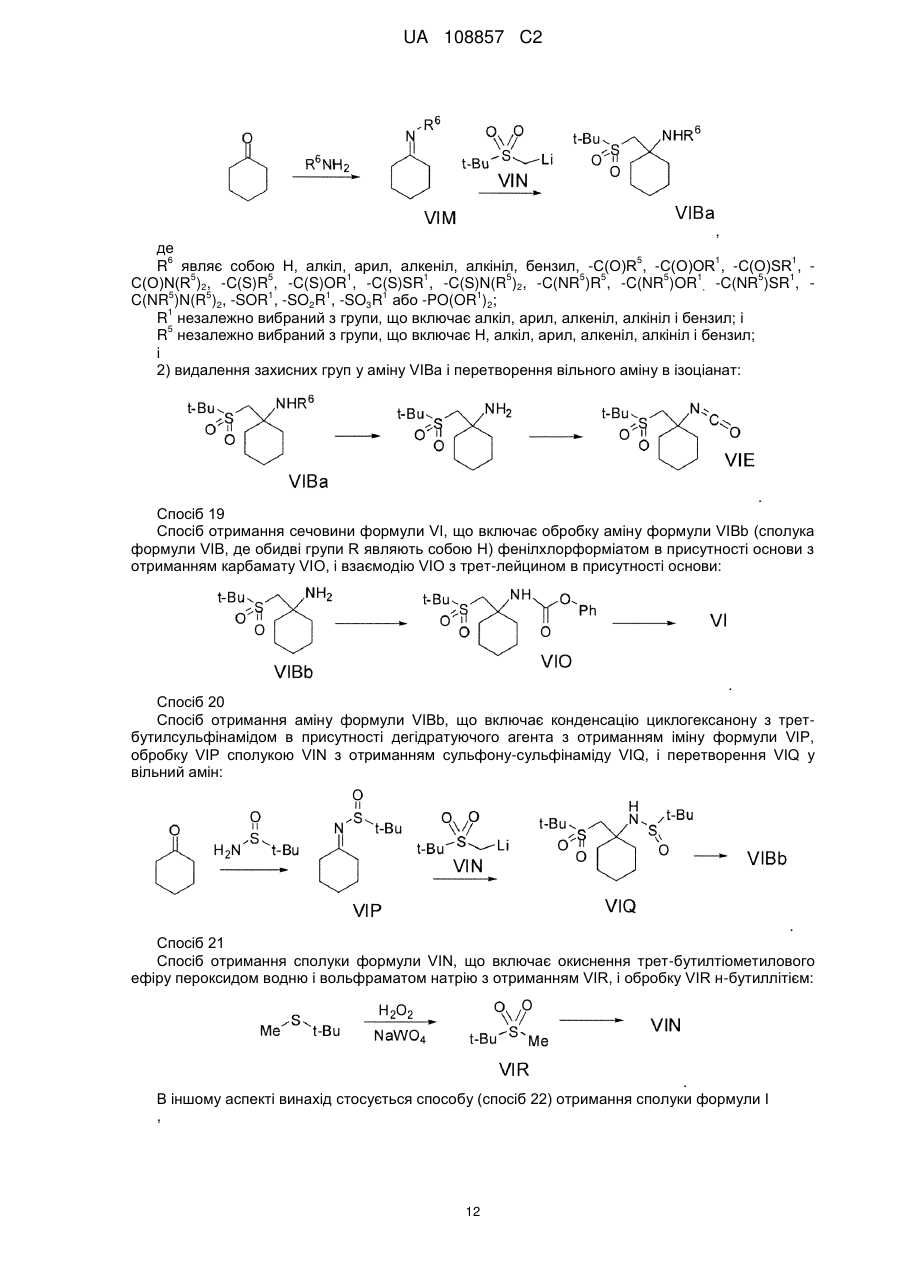
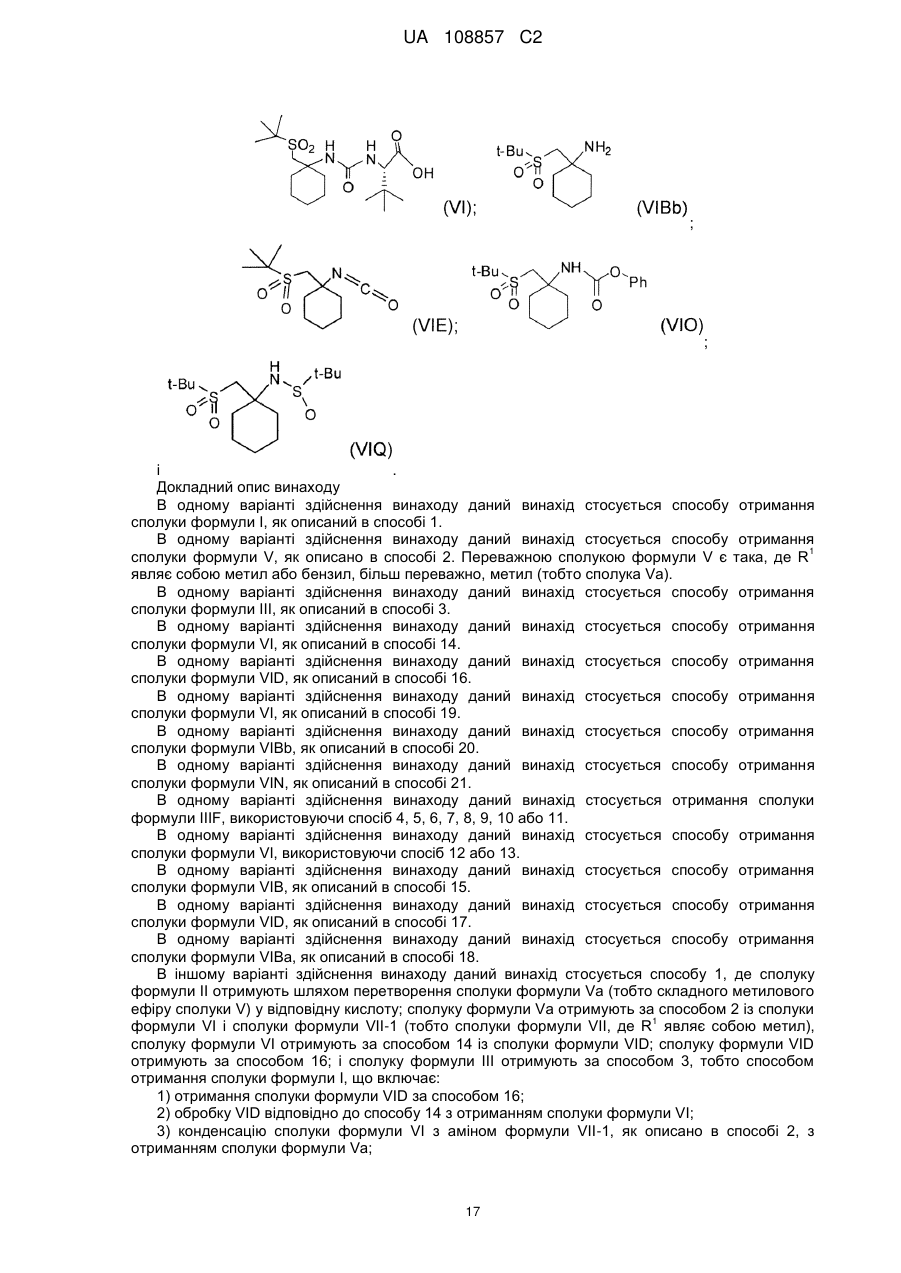
Енантіо- і стереоспецифічні синтези b-аміно-a-гідроксіамідів
Номер патенту: 108857
Опубліковано: 25.06.2015
Автори: Траверз Джон, Міллер Стівен П., Феррейра Амадео, Кун Цзяньше, Хантер Томас Дж., Нджороге Ф. Джордж, Лекхал Аззеддіне, Сміт Ренді М., Арасаппан Ашок, Ко Шень-Чунь, Чень Юнган, Альбанесе-Уолкер Дженніфер, Леонг Уілльям У., Ляо Хунбяо, Меттьюз Кеннет С., Пуар'є Марк, Беннет Френк, Божен Стефан Л., Трзаска Скотт Т., Демоншо Патріс, Ван Ліцзюнь
Формула / Реферат
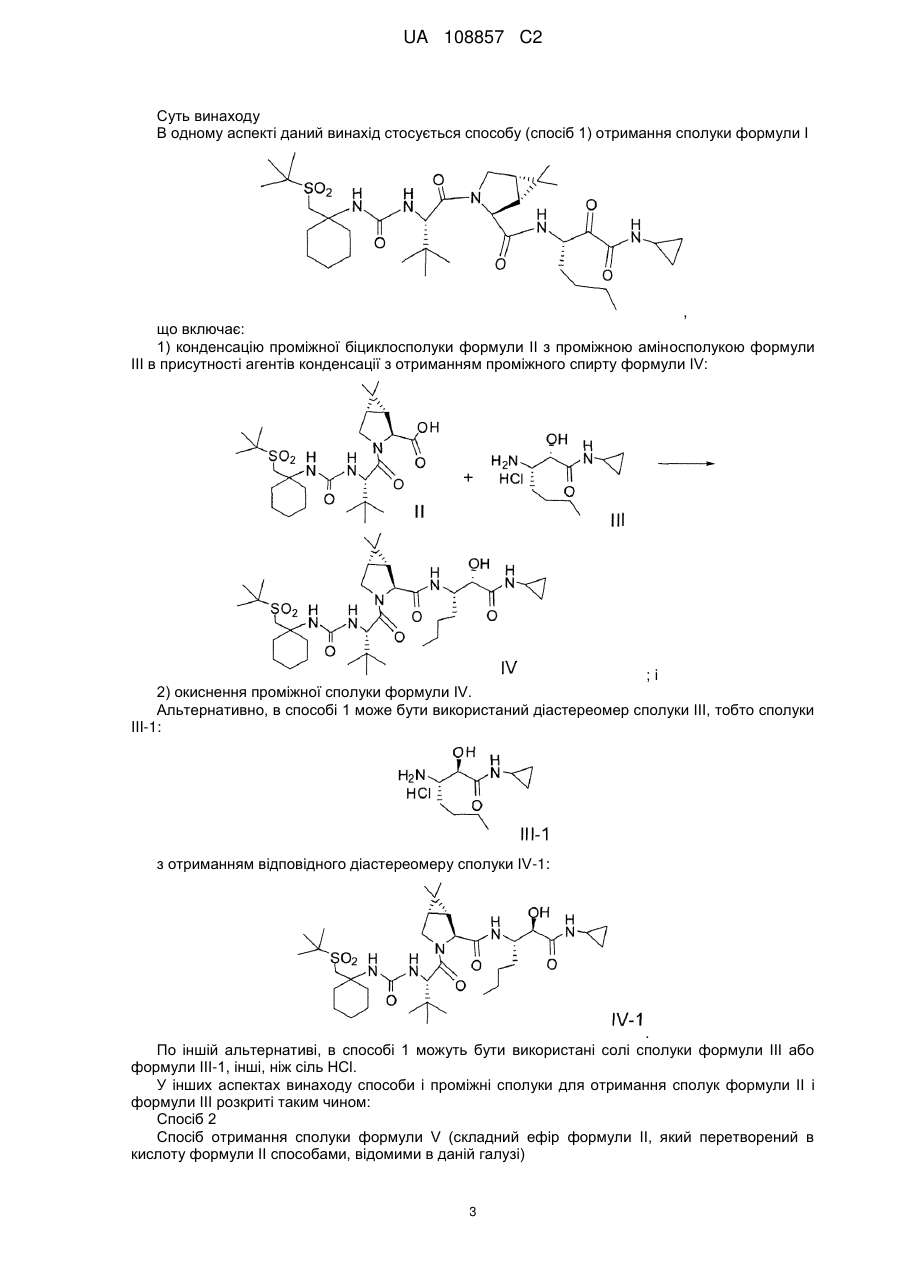
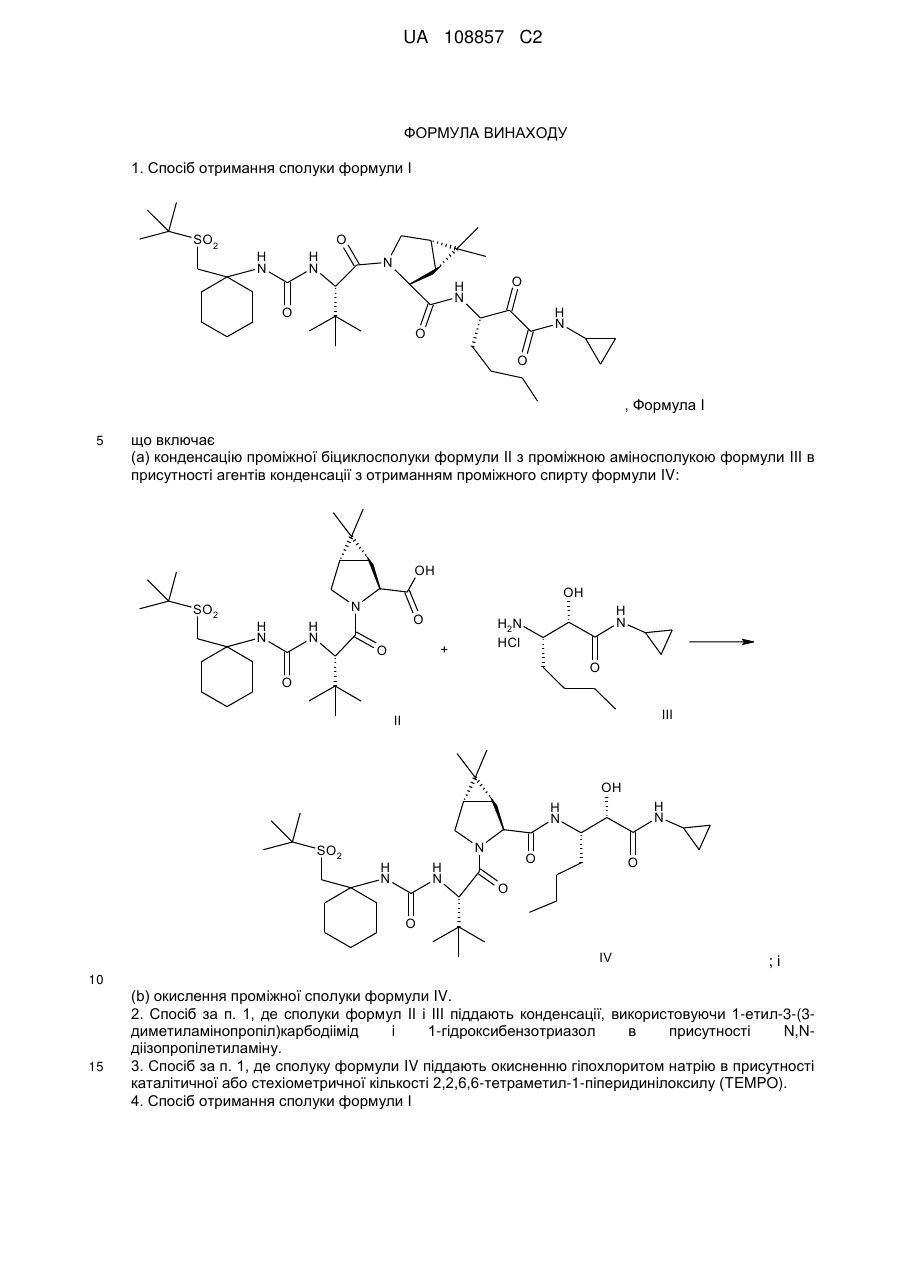
1. Спосіб отримання сполуки формули І
 , Формула І
, Формула І
що включає
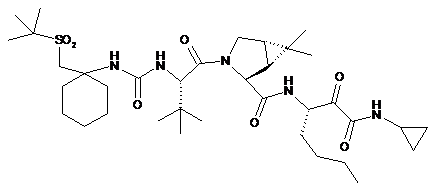
(a) конденсацію проміжної біциклосполуки формули II з проміжною аміносполукою формули III в присутності агентів конденсації з отриманням проміжного спирту формули IV:
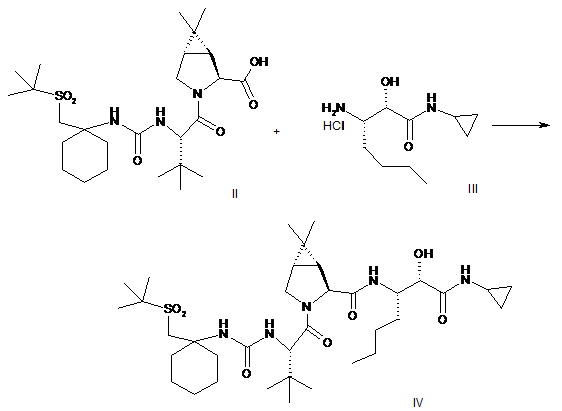 ; і
; і
(b) окислення проміжної сполуки формули IV.
2. Спосіб за п. 1, де сполуки формул II і III піддають конденсації, використовуючи 1-етил-3-(3-диметиламінопропіл)карбодіімід і 1-гідроксибензотриазол в присутності N,N-діізопропілетиламіну.
3. Спосіб за п. 1, де сполуку формули IV піддають окисненню гіпохлоритом натрію в присутності каталітичної або стехіометричної кількості 2,2,6,6-тетраметил-1-піперидинілоксилу (TEMPO).
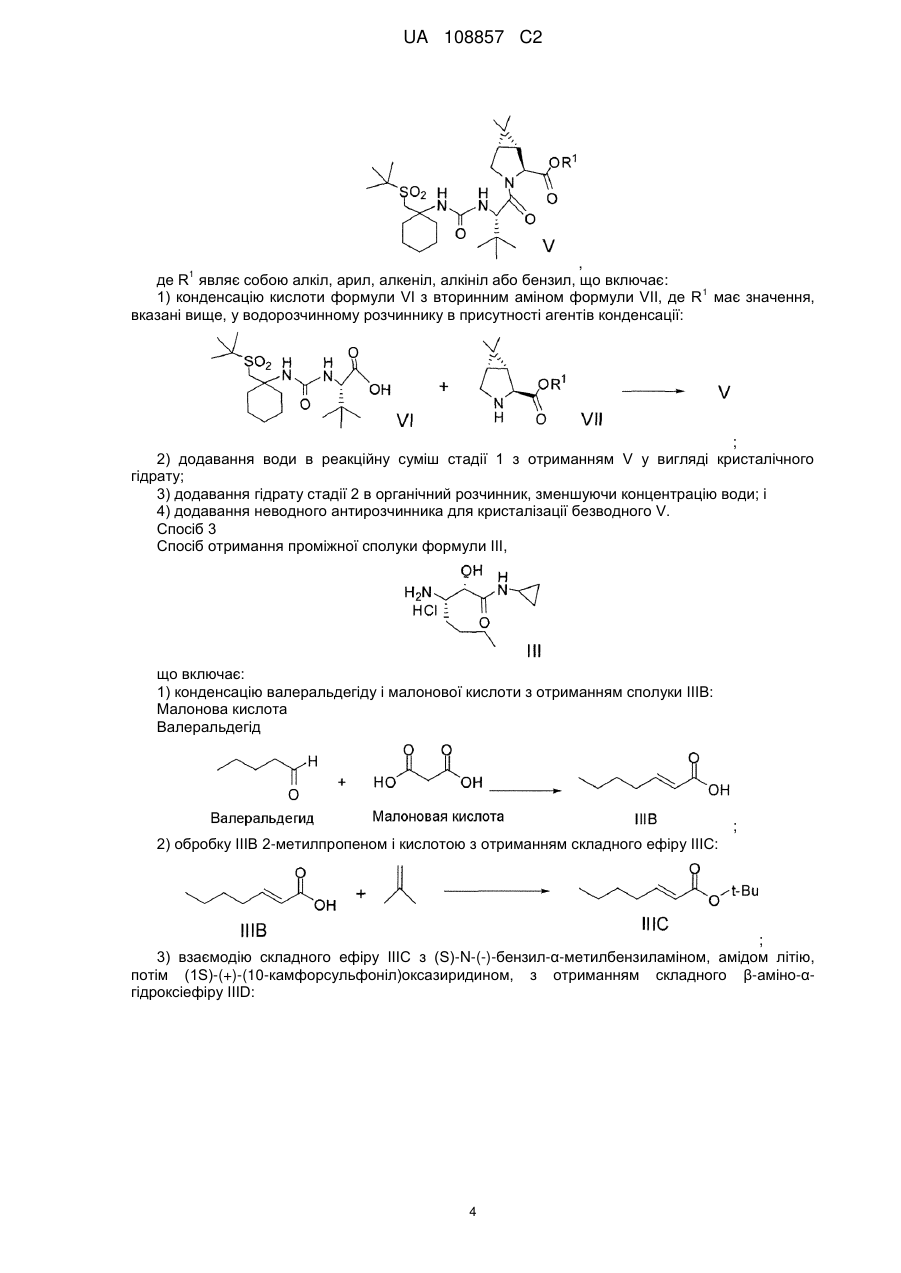
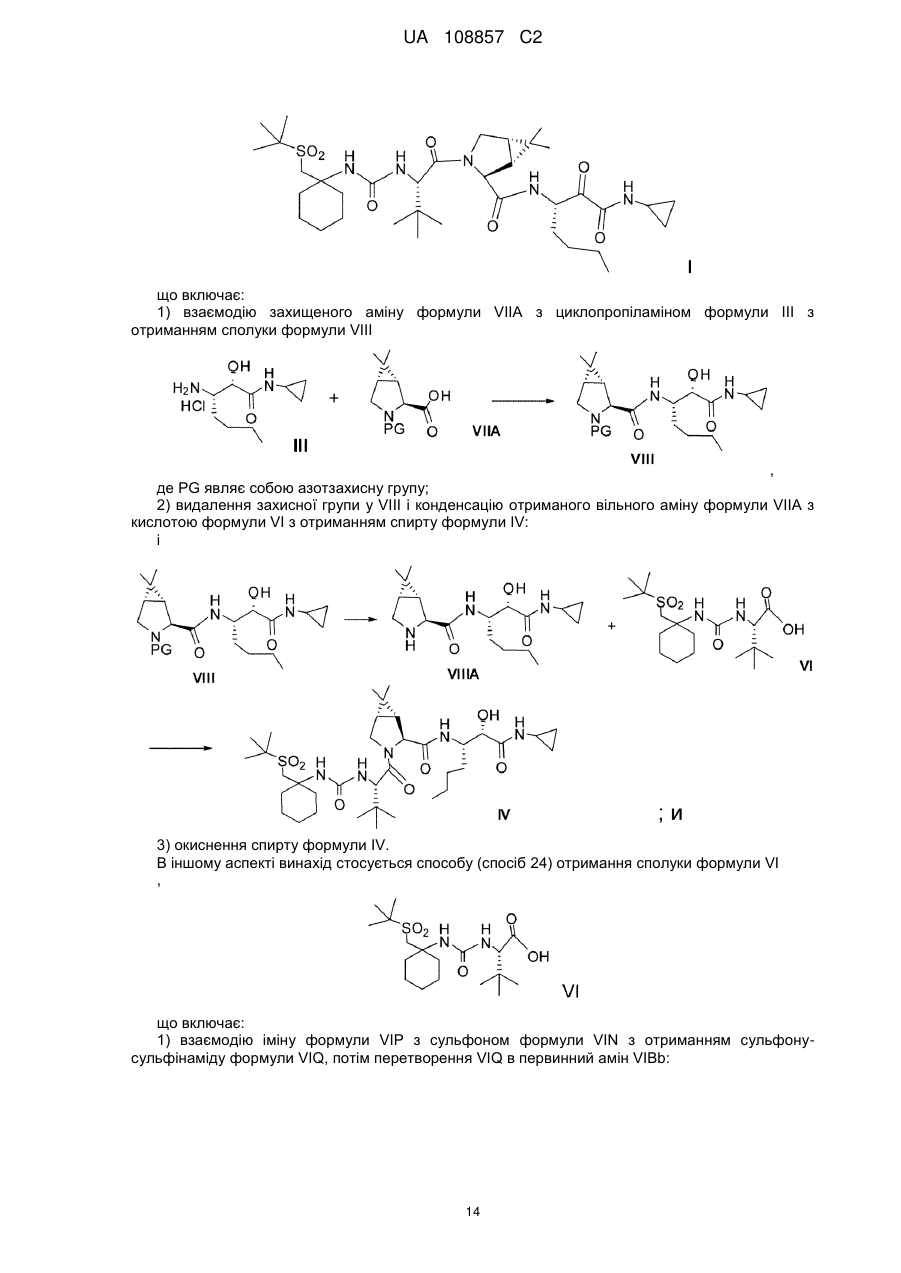
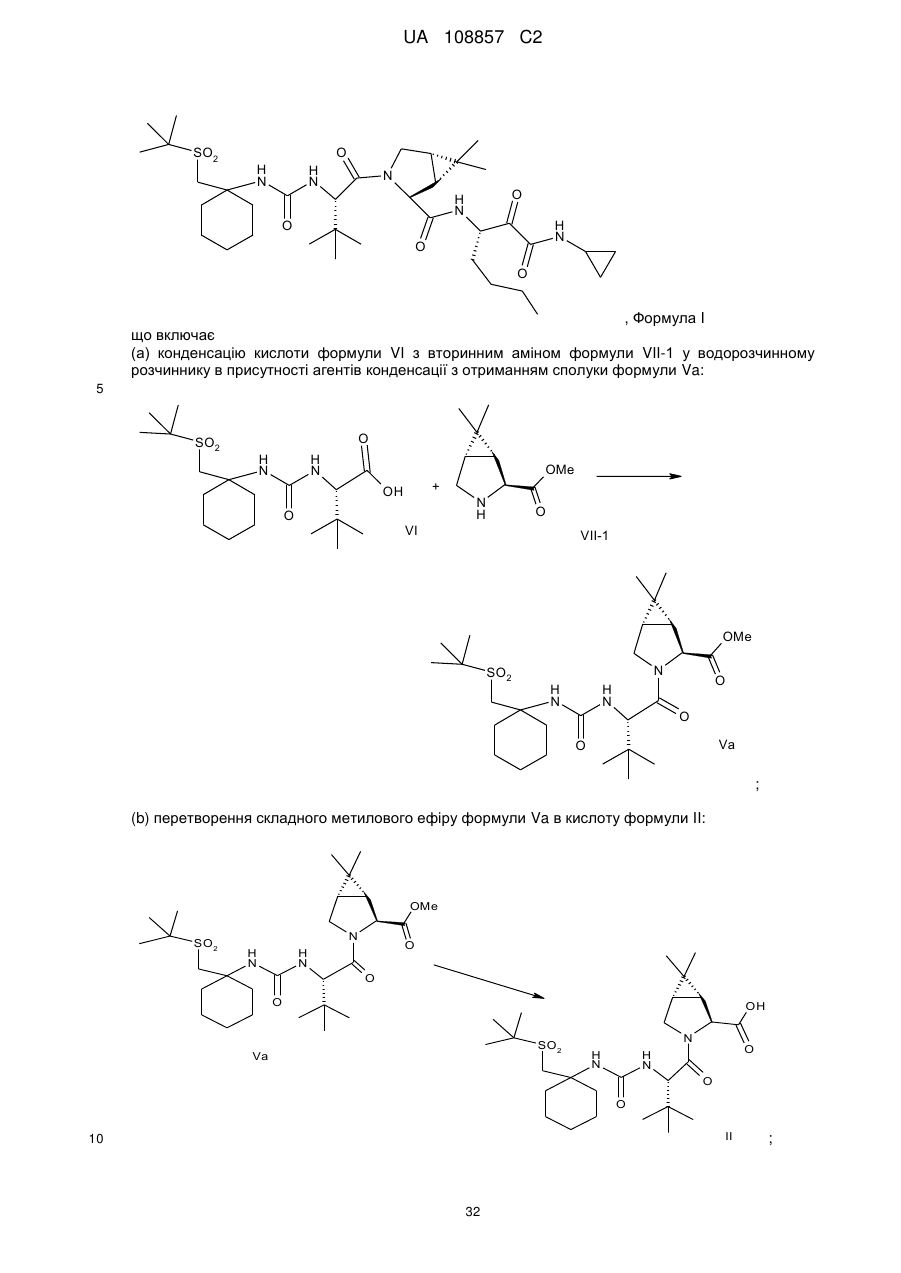
4. Спосіб отримання сполуки формули І
 , Формула I
, Формула I
що включає
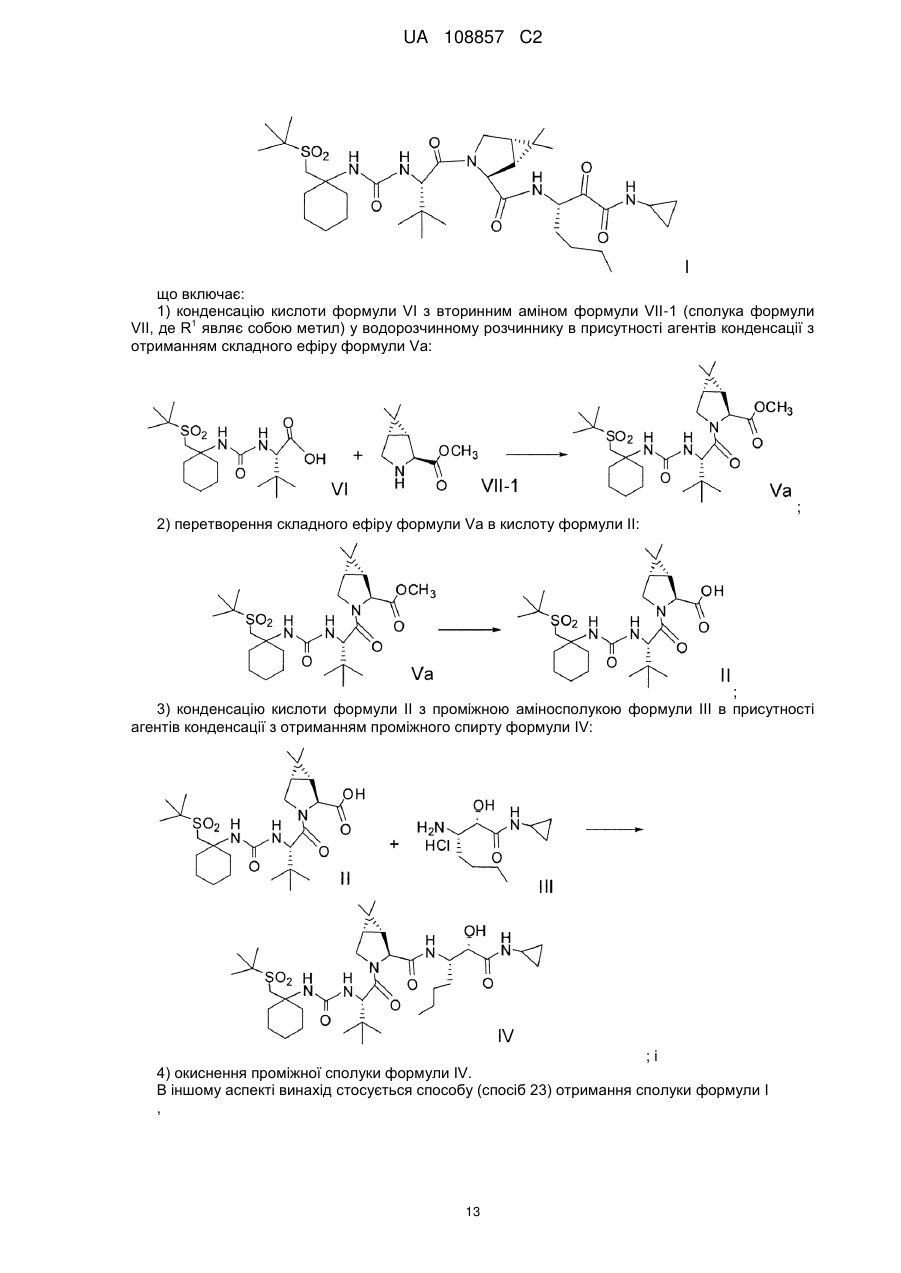
(a) конденсацію кислоти формули VI з вторинним аміном формули VII-1 у водорозчинному розчиннику в присутності агентів конденсації з отриманням сполуки формули Va:
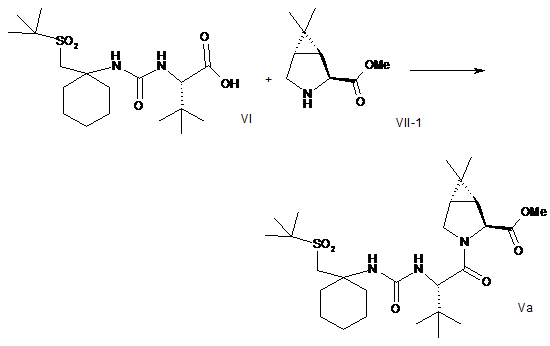 ;
;
(b) перетворення складного метилового ефіру формули Va в кислоту формули II:
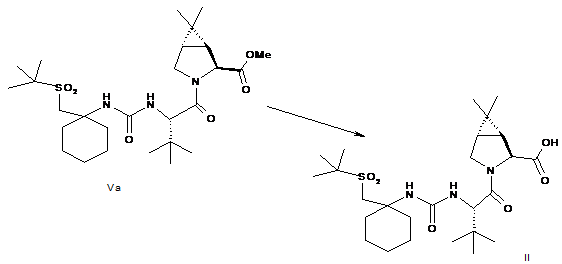 ;
;
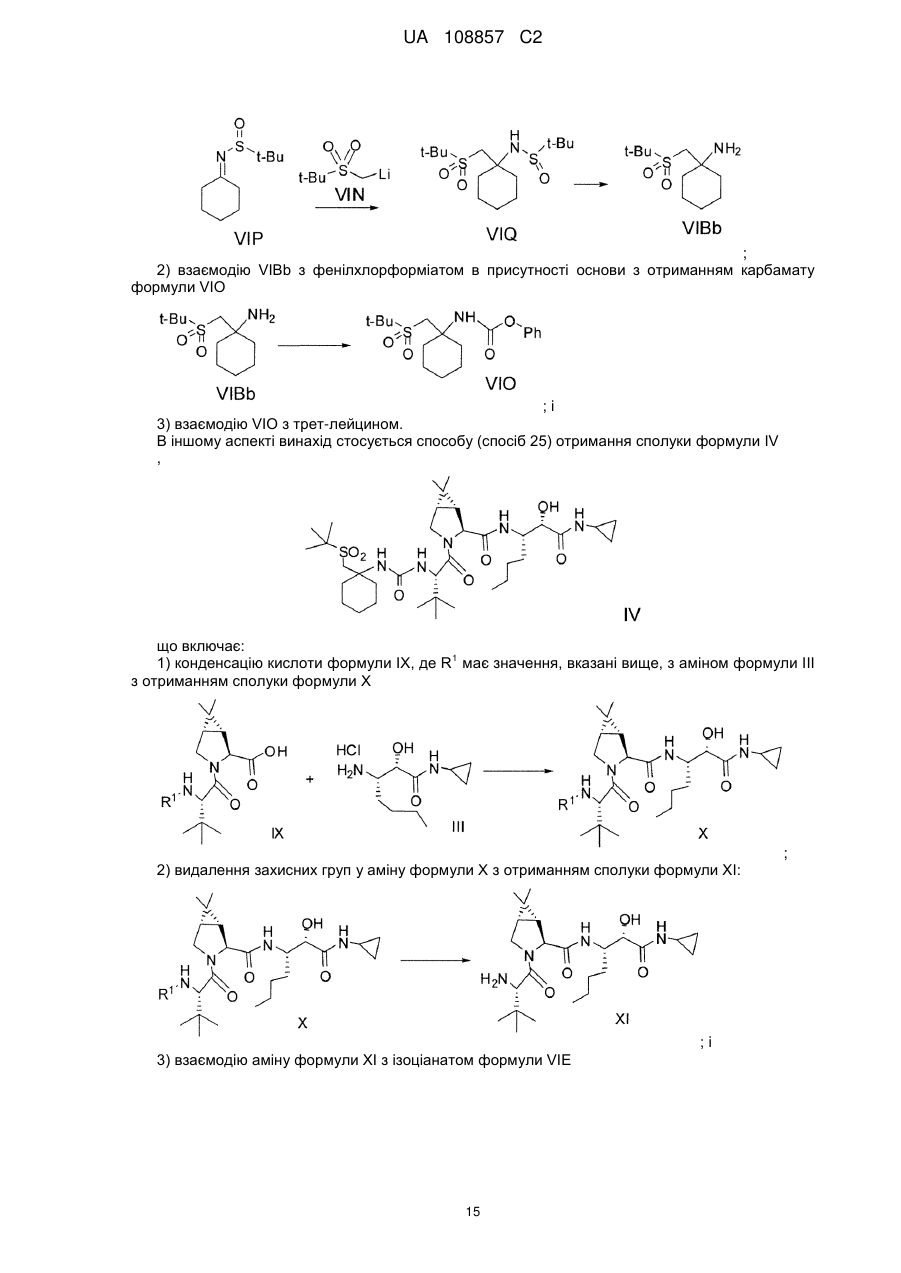
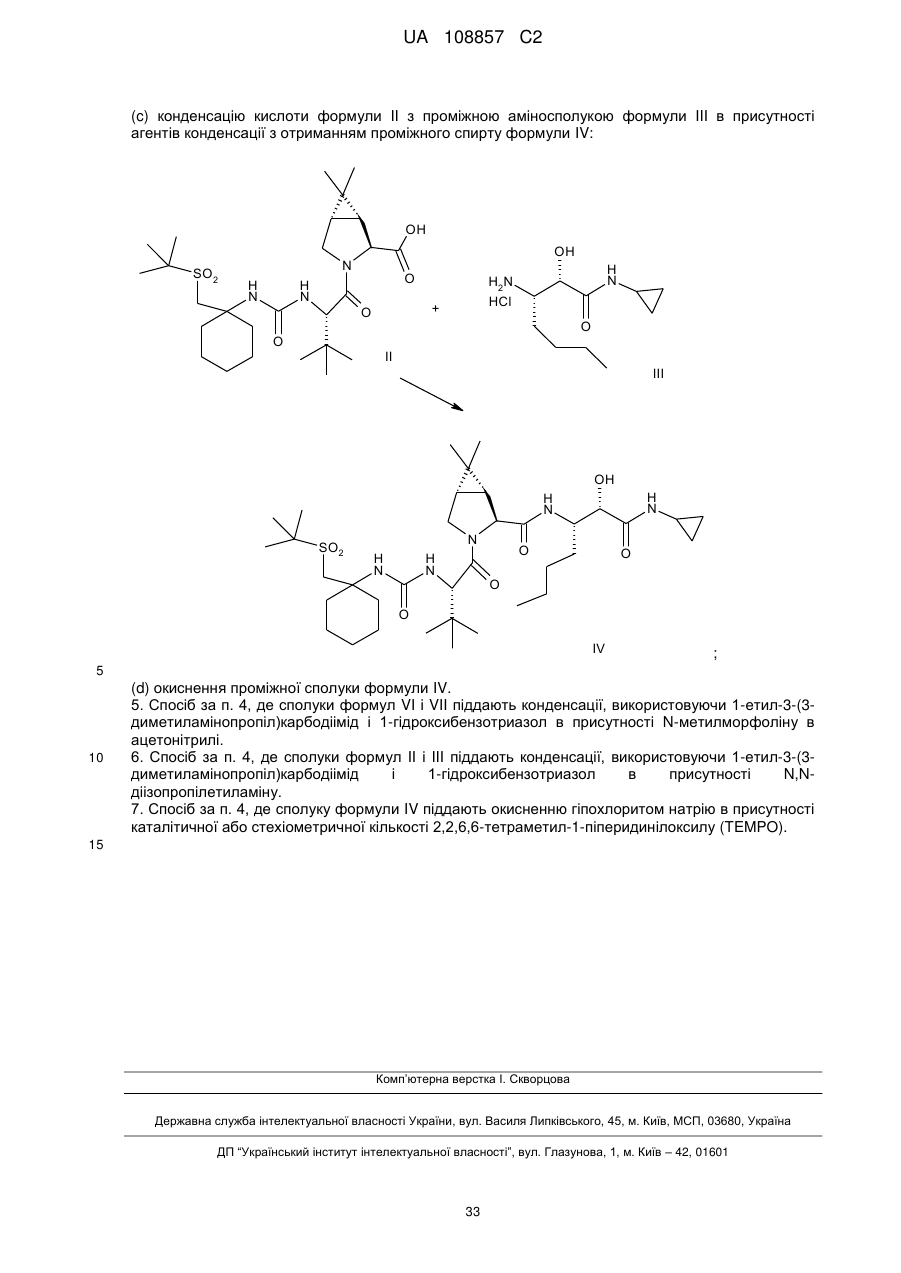
(c) конденсацію кислоти формули II з проміжною аміносполукою формули III в присутності агентів конденсації з отриманням проміжного спирту формули IV:
 ;
;
(d) окиснення проміжної сполуки формули IV.
5. Спосіб за п. 4, де сполуки формул VI і VII піддають конденсації, використовуючи 1-етил-3-(3-диметиламінопропіл)карбодіімід і 1-гідроксибензотриазол в присутності N-метилморфоліну в ацетонітрилі.
6. Спосіб за п. 4, де сполуки формул II і III піддають конденсації, використовуючи 1-етил-3-(3-диметиламінопропіл)карбодіімід і 1-гідроксибензотриазол в присутності N,N-діізопропілетиламіну.
7. Спосіб за п. 4, де сполуку формули IV піддають окисненню гіпохлоритом натрію в присутності каталітичної або стехіометричної кількості 2,2,6,6-тетраметил-1-піперидинілоксилу (TEMPO).
Текст
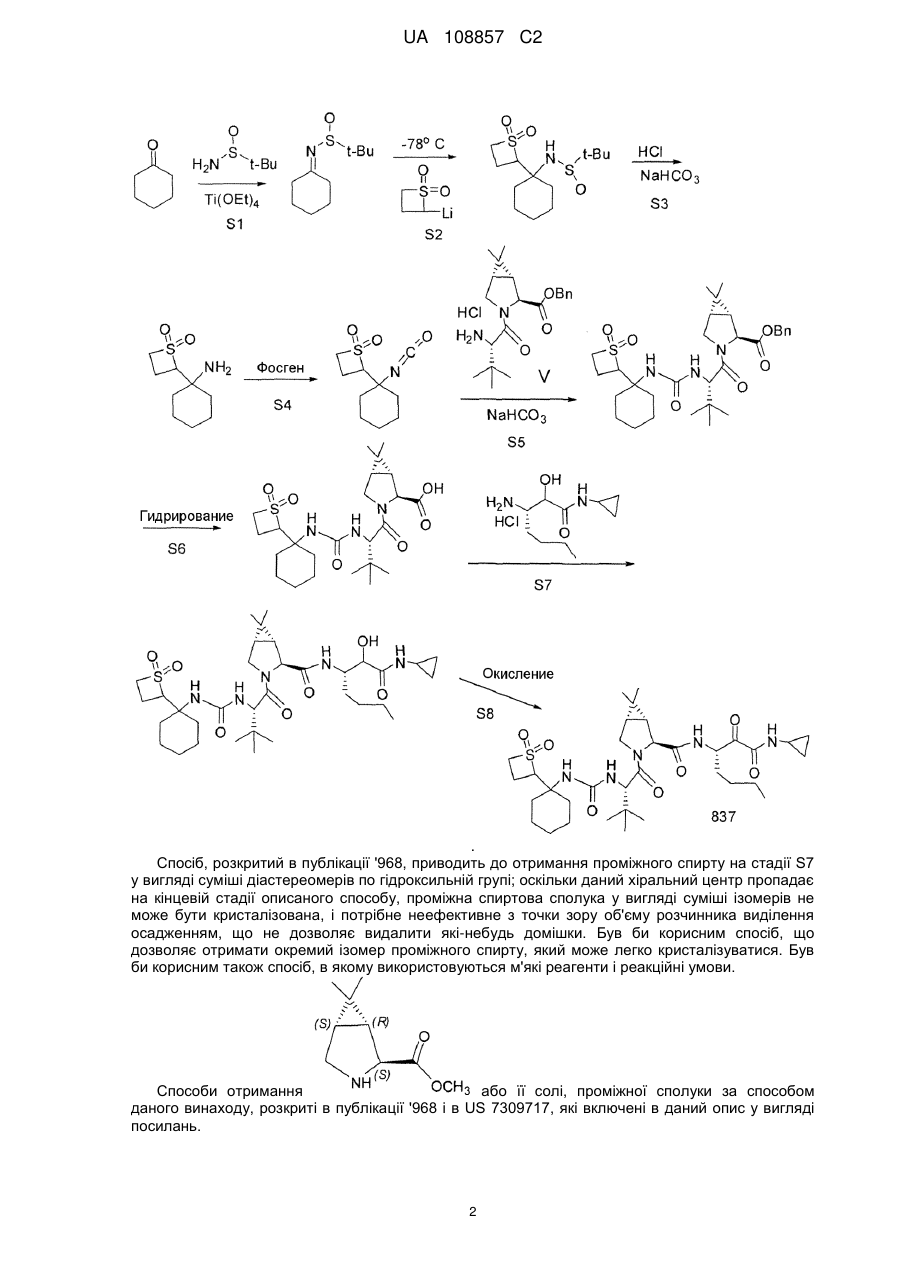
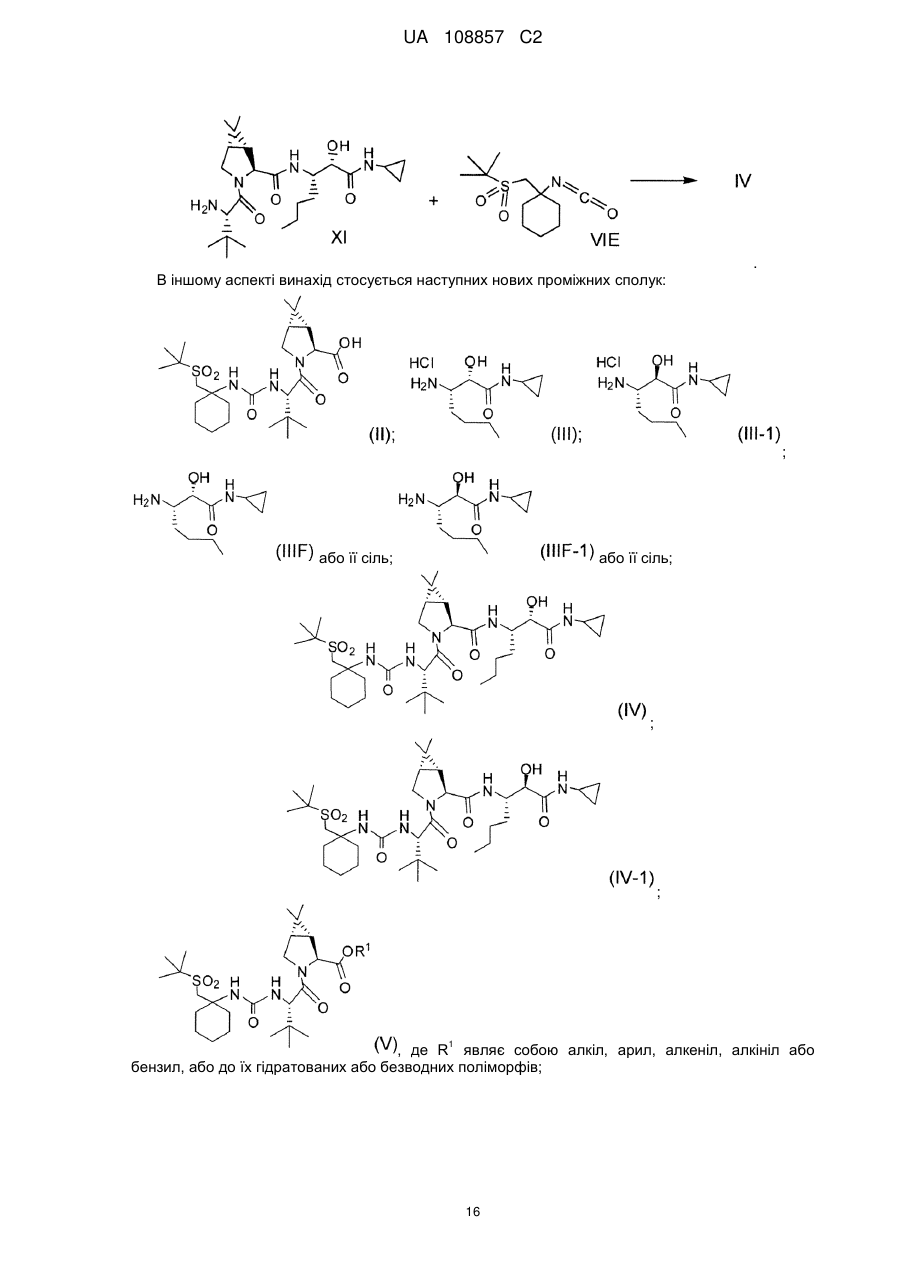
Реферат: Винахід стосується способів отримання сполуки формули І: SO2 O H N H N N H N O H N O O O формула (І). Описані проміжні сполуки, що використовуються при отриманні сполуки формули І, і способи отримання вказаних проміжних сполук. UA 108857 C2 Перехресні посилання до споріднених заявок Дана заявка основана і за нею вимагається пріоритет згідно з попередніми заявками США №№ 61/229613, 61/229636, 61/229648, 61/229652 і 61/229618, кожна з яких була подана 29 липня 2009 року, і кожна з вказаних заявок включена в даний опис як посилання в повному своєму об'ємі. Галузь винаходу Даний винахід стосується способу отримання сполуки формули I, яка показала наявність активності як інгібітору протеази HCV. Даний винахід стосується також способу отримання проміжних сполук, що використовуються при отриманні сполуки формули I, що указується тут також як (1R, 5S)-N-[1(S)-[2-(циклопропіламіно)-1,2-діоксоетил]пентил]-3-[2(S)-[[[[1-[[1,1диметилетил)сульфоніл]метил]циклогексил]аміно]карбоніл]аміно]-3,3-диметил-1-оксобутил]-6,6диметил-3-азабіцикло[3.1.0]гексан-2(S)-карбоксамід. 5 . Передумови винаходу Вказування якої-небудь публікації в даному розділі або в будь-якому розділі даної заявки не є визнанням того, що така публікація є прототипом даного винаходу. Сполука формули I загалом і конкретно розкрита в опублікованому патенті США № 2007/0042968, опублікованому 22 лютого 2007 року (публікація '968), включеному в даний опис як посилання. Способи, що підходять для отримання сполуки формули I, загалом описані в публікації '968. Зокрема, в публікації '968 обговорене отримання сульфонкарбаматної сполуки, наприклад, сполуки формули 837, що містить як замісник циклічний сульфон (абзаци [0395]-[0403]). Спосіб представлений на наступній реакційній схемі: Гідрування Окиснення 1 UA 108857 C2 . Спосіб, розкритий в публікації '968, приводить до отримання проміжного спирту на стадії S7 у вигляді суміші діастереомерів по гідроксильній групі; оскільки даний хіральний центр пропадає на кінцевій стадії описаного способу, проміжна спиртова сполука у вигляді суміші ізомерів не може бути кристалізована, і потрібне неефективне з точки зору об'єму розчинника виділення осадженням, що не дозволяє видалити які-небудь домішки. Був би корисним спосіб, що дозволяє отримати окремий ізомер проміжного спирту, який може легко кристалізуватися. Був би корисним також спосіб, в якому використовуються м'які реагенти і реакційні умови. Способи отримання або її солі, проміжної сполуки за способом даного винаходу, розкриті в публікації '968 і в US 7309717, які включені в даний опис у вигляді посилань. 2 UA 108857 C2 Суть винаходу В одному аспекті даний винахід стосується способу (спосіб 1) отримання сполуки формули I , що включає: 1) конденсацію проміжної біциклосполуки формули II з проміжною аміносполукою формули III в присутності агентів конденсації з отриманням проміжного спирту формули IV: ;і 2) окиснення проміжної сполуки формули IV. Альтернативно, в способі 1 може бути використаний діастереомер сполуки III, тобто сполуки III-1: з отриманням відповідного діастереомеру сполуки IV-1: . По іншій альтернативі, в способі 1 можуть бути використані солі сполуки формули III або формули III-1, інші, ніж сіль HCl. У інших аспектах винаходу способи і проміжні сполуки для отримання сполук формули II і формули III розкриті таким чином: Спосіб 2 Спосіб отримання сполуки формули V (складний ефір формули II, який перетворений в кислоту формули II способами, відомими в даній галузі) 3 UA 108857 C2 , 1 де R являє собою алкіл, арил, алкеніл, алкініл або бензил, що включає: 1 1) конденсацію кислоти формули VI з вторинним аміном формули VII, де R має значення, вказані вище, у водорозчинному розчиннику в присутності агентів конденсації: ; 2) додавання води в реакційну суміш стадії 1 з отриманням V у вигляді кристалічного гідрату; 3) додавання гідрату стадії 2 в органічний розчинник, зменшуючи концентрацію води; і 4) додавання неводного антирозчинника для кристалізації безводного V. Спосіб 3 Спосіб отримання проміжної сполуки формули III, що включає: 1) конденсацію валеральдегіду і малонової кислоти з отриманням сполуки IIIB: Малонова кислота Валеральдегід ; 2) обробку IIIB 2-метилпропеном і кислотою з отриманням складного ефіру IIIC: ; 3) взаємодію складного ефіру IIIC з (S)-N-(-)-бензил-α-метилбензиламіном, амідом літію, потім (1S)-(+)-(10-камфорсульфоніл)оксазиридином, з отриманням складного β-аміно-αгідроксіефіру IIID: 4 UA 108857 C2 ; альтернативно, IIID отримують обробкою IIID-1 (дезоксисполука) амідом літію і далі обробкою (1S)-(+)-(10-камфорсульфоніл)оксазиридином: ; 4) перетворення складного ефіру IIID у вільну кислоту обробкою кислотою, потім конденсацією вільної кислоти з циклопропіламіном в присутності дегідратуючого агента і отриманням аміду IIIE: ;і 5) видалення захисних бензильних груп з отриманням аміну IIIF і обробку вільного аміну HCl з отриманням солі: . Альтернативно, використовуючи прийнятні реагенти, спосіб, подібний до способу 3, може бути використаний для отримання сполуки формули III-1 і її відповідного вільного аміну IIIF-1: . По іншій альтернативі, на стадії 5 для отримання солі IIIF або IIIF-1 може бути використана кислота, інша, ніж HCl. Спосіб 4 Спосіб отримання сполуки формули IIIF, що включає розкриття кільця лактаму IIIG з отриманням амінокислоти IIIH, конденсацію IIIH з циклопропіламіном і видалення захисних груп: 5 UA 108857 C2 , де 2 4 5 1 R являє собою Н, алкіл, арил, алкеніл, алкініл, бензил, -Si(R )3, -C(О)R , -C(О)OR , 1 5 5 1 1 5 5 5 5 1 C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , -C(NR )OR , 5 1 5 5 1 1 1 1 C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R або -PO(OR )2; 3 5 1 R являє собою Н, алкіл, арил, алкеніл, алкініл, бензил, -C(О)R або -C(О)OR ; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; 4 R незалежно вибраний з групи, що включає алкіл, арил і алкокси; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил. Спосіб 5 Спосіб отримання сполуки формули IIIF, що включає відновлення енаміну III-l шляхом асиметричного гідрування, перетворення IIIJ в карбонову кислоту IIIH-1, конденсацію з циклопропіламіном і видалення захисних груп: , де 2 4 5 1 R являє собою Н, алкіл, арил, алкеніл, алкініл, бензил, -Si(R )3, -C(О)R , -C(О)OR , 1 5 5 1 1 5 5 5 5 1 C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , -C(NR )OR , 5 1 5 5 1 1 1 1 C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R або -PO(OR )2; 6 7 R і R незалежно вибрані з групи, що включає Н, алкіл, арил, алкеніл, алкініл, бензил, 5 1 1 5 5 1 1 5 5 5 C(О)R , -C(О)OR , -C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , 5 1 5 1 5 5 1 1 1 1 C(NR )OR , -C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R і -PO(OR )2; 5 5 5 5 X являє собою -C(О)R , -CO2R , -C(О)N(R )2, -CN, -C(О)SR , -CH2OH, -CH=CH2 або -C≡CH; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; 4 R незалежно вибраний з групи, що включає алкіл, арил і алкокси; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил. Спосіб 6 Спосіб отримання сполуки формули IIIF, що включає гідроксилювання IIIK з отриманням IIIL, перетворення IIIL в карбонову кислоту IIIH-2, конденсацію з циклопропіламіном і видалення захисних груп: 6 UA 108857 C2 , де 6 7 R і R незалежно вибрані з групи, що включає Н, алкіл, арил, алкеніл, алкініл, бензил, 5 1 1 5 5 1 1 5 5 5 C(О)R , -C(О)OR , -C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , 5 1 5 1 5 5 1 1 1 1 C(NR )OR , -C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R і -PO(OR )2; 5 5 5 Y являє собою -OR , -N(R )2 або -SR ; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил. Спосіб 7 Спосіб отримання сполуки формули IIIF, що включає відновлення нітрогрупи IIIM з отриманням похідного амінокислоти IIIN, розділення IIIN з отриманням IIIO, перетворення IIIO в карбонову кислоту IIIH-3, конденсацію з циклопропіламіном і видалення захисних груп: , де 2 4 5 1 R являє собою Н, алкіл, арил, алкеніл, алкініл, бензил, -Si(R )3, -C(О)R , -C(О)OR , 1 5 5 1 1 5 5 5 5 1 C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , -C(NR )OR , 5 1 5 5 1 1 1 1 C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R або -PO(OR )2; 5 5 5 Y являє собою -OR , -N(R )2 або -SR ; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; 4 R незалежно вибраний з групи, що включає алкіл, арил і алкокси; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил. Спосіб 8 Спосіб отримання сполуки формули IIIF, що включає відновлення α-кетосполуки формули IIIP з отриманням спирту IIIL, перетворення IIIL в карбонову кислоту IIIH-2, конденсацію з циклопропіламіном і видалення захисних груп: , де 6 7 R і R незалежно вибрані з групи, що включає Н, алкіл, арил, алкеніл, алкініл, бензил, 5 1 1 5 5 1 1 5 5 5 C(О)R , -C(О)OR , -C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , 5 1 5 1 5 5 1 1 1 1 C(NR )OR , -C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R і -PO(OR )2; 5 5 5 Y являє собою -OR , -N(R )2 або -SR ; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил. 7 UA 108857 C2 Спосіб 9 Спосіб отримання сполуки формули IIIF, що включає перетворення IIIQ в амін IIIJ за допомогою реакції заміни, яка приводить до стереохімічного обернення, перетворення IIIJ в карбонову кислоту IIIH-1, конденсацію з циклопропіламіном і видалення захисних груп: , де 2 4 5 1 R являє собою Н, алкіл, арил, алкеніл, алкініл, бензил, -Si(R )3, -C(О)R , -C(О)OR , 1 5 5 1 1 5 5 5 5 1 C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , -C(NR )OR , 5 1 5 5 1 1 1 1 C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R або -PO(OR )2; 6 7 R і R незалежно вибрані з групи, що включає Н, алкіл, арил, алкеніл, алкініл, бензил, 5 1 1 5 5 1 1 5 5 5 C(О)R , -C(О)OR , -C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , 5 1 5 1 5 5 1 1 1 1 C(NR )OR , -C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R і -PO(OR )2; 5 5 5 5 X являє собою -C(О)R , -CO2R , -C(О)N(R )2, -CN, -C(О)SR , -CH2OH, -CH=CH2 або -CCH; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; 4 R незалежно вибраний з групи, що включає алкіл, арил і алкокси; 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил; і Z являє собою групу, що видаляється, таку як, але цим не обмежуючись, галоген, OMs або OTs. Спосіб 10 Спосіб отримання сполуки формули IIIF, що включає обробку епоксиду IIIR джерелом азоту для розкриття кільця з отриманням IIIS, перетворення IIIS в карбонову кислоту IIIH-4 і конденсацію з циклопропіламіном: , де 8 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл, бензил, -C(О)R 1 і -C(О)OR ; 5 5 5 5 X являє собою -C(О)R , -CO2R , -C(О)N(R )2, -CN, -C(О)SR , -CH2OH, -CH=CH2 або -CCH; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил. Спосіб 11 Спосіб отримання сполуки формули IIIF, що включає обробку азиридину IIIT джерелом кисню для розкриття кільця з отриманням IIIU, перетворення IIIU в карбонову кислоту IIIH-5, конденсацію з циклопропіламіном і видалення захисних груп: 8 UA 108857 C2 , де 2 4 5 1 R являє собою Н, алкіл, арил, алкеніл, алкініл, бензил, -Si(R )3, -C(О)R , -C(О)OR , 1 5 5 1 1 5 5 5 5 1 C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , -C(NR )OR , 5 1 5 5 1 1 1 1 C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R або -PO(OR )2; 6 5 1 1 R являє собою Н, алкіл, арил, алкеніл, алкініл, бензил, -C(О)R , -C(О)OR , -C(О)SR , 5 5 1 1 5 5 5 5 1 5 1 C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , -C(NR )OR , -C(NR )SR , 5 5 1 1 1 1 C(NR )N(R )2, -SOR , -SO2R , -SO3R або -PO(OR )2; 5 5 5 5 2 2 X являє собою -C(О)R , -CO2R , -C(О)N(R )2, -CN, -C(О)SR , -CH OH, -CH=CH або -CCH; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; 4 R незалежно вибраний з групи, що включає алкіл, арил і алкокси; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил. Альтернативно, використовуючи прийнятні реагенти, способи, подібні способам 4-11, можуть бути застосовані для отримання сполуки формули IIIF-1. Спосіб 12 Спосіб отримання сечовини формули VI , що включає заміну групи, що видаляється, у сполуки формули VIA з допомогою аніонного сірковмісного нуклеофілу з отриманням VIB, перетворення VIB в первинний амін VIBb (де 6 7 обидва, R і R , являють собою Н), і взаємодію VIBb з трет-лейцином в присутності фосгену або еквівалента фосгену: , де Р являє собою групу, що видаляється; 6 7 R і R незалежно вибрані з групи, що включає Н, алкіл, арил, алкеніл, алкініл, бензил, 5 1 1 5 5 1 1 5 5 5 C(О)R , -C(О)OR , -C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , 5 1 5 1 5 5 1 1 1 1 C(NR )OR , -C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R і -PO(OR )2; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил. Спосіб 13 Спосіб отримання сечовини формули VI, що включає розкриття кільця азиридину формули VIC з допомогою нуклеофілу, що містить металовану сірку, з отриманням VIB, перетворення VIB в первинний амін VIBb і взаємодію VIBb з трет-лейцином в присутності фосгену або еквівалента фосгену: 9 UA 108857 C2 , де 6 7 9 R , R і R незалежно вибрані з групи, що включає Н, алкіл, арил, алкеніл, алкініл, бензил, 5 1 1 5 5 1 1 5 5 5 C(О)R , -C(О)OR , -C(О)SR , -C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , 5 1 5 1 5 5 1 1 1 1 C(NR )OR , -C(NR )SR , -C(NR )N(R )2, -SOR , -SO2R , -SO3R і -PO(OR )2; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил. Спосіб 14 Спосіб отримання сечовини формули VI, що включає проведення перегрупування Курціуса кислоти формули VID (через утворення ацилазиду) з отриманням ізоціанату формули VIE, і взаємодію VIE з трет-лейцином: . Способи, подібні способам 12, 13 і 14, можуть бути використані для отримання тіо- і сульфінільних аналогів, VI-1 і VI-2: . Спосіб 15 Спосіб отримання сполуки формули VIB, що включає конденсацію циклогексанону з сульфонільною сполукою з отриманням ненасиченої сполуки формули VIF, потім відновлення VIF: , де 10 4 5 5 5 R являє собою Н, -Si(R )3, -C(О)R , -C(О)OR , -C(О)N(R )2, 4 R незалежно вибраний з групи, що включає алкіл, арил і алкокси; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил. Спосіб, подібний способу 15, може бути використаний для отримання тіо- і сульфінільного аналогів, VIB-1 і VIB-2: 10 UA 108857 C2 , 6 7 де R і R мають значення, вказані вище. Спосіб 16 Спосіб отримання сполуки формули VID, що включає 1) обробку похідного циклогексану формули VIG триметилсилільною сполукою, подальше алкілування трет-бутилхлорметилсульфідомз отриманням сполуки формули VIJ: ; 2) гідроліз складного ефіру VIJ до кислоти VIK: ;і 3) окиснення тіоефіру до сульфону: . Альтернативно, інший складний ефір циклогексанкарбонової кислоти, циклогексан карбонітрил або інші карбонільні похідні циклогексану можуть бути використані замість сполуки 5 5 VIG, наприклад, метиловий ефір карбонової кислоти може бути замінений на -C(О)R , -C(О)OR , 5 5 5 -CN, -C(О)N(R )2 або -C(О)SR , де R незалежно являє собою Н, алкіл, арил, алкеніл, алкініл або бензил. Спосіб 17 Спосіб отримання сполуки формули VID, що включає окиснення тіоефіру VIJ з отриманням складного ефіру-сульфону VIL, потім гідроліз складного ефіру з отриманням вільної кислоти VID: . 5 Альтернативно, метиловий ефір карбонової кислоти VIJ може бути замінений на -C(О)R , 5 5 5 5 C(О)OR , -CN, -C(О)N(R )2 або -C(О)SR , де R незалежно являє собою Н, алкіл, арил, алкеніл, алкініл або бензил. Спосіб 18 Спосіб отримання ізоціанату формули VIE, що включає 1) взаємодію циклогексанону з аміном з отриманням іміну VIM, потім алкілування VIM літованим сульфоном формули VIN з отриманням аміносульфону VIBa (сполука формули VIB, де одна з груп, приєднаних до N, являє собою Н): 11 UA 108857 C2 , де 6 5 1 1 R являє собою Н, алкіл, арил, алкеніл, алкініл, бензил, -C(О)R , -C(О)OR , -C(О)SR , 5 5 1 1 5 5 5 5 1 5 1 C(О)N(R )2, -C(S)R , -C(S)OR , -C(S)SR , -C(S)N(R )2, -C(NR )R , -C(NR )OR , -C(NR )SR , 5 5 1 1 1 1 C(NR )N(R )2, -SOR , -SO2R , -SO3R або -PO(OR )2; 1 R незалежно вибраний з групи, що включає алкіл, арил, алкеніл, алкініл і бензил; і 5 R незалежно вибраний з групи, що включає Н, алкіл, арил, алкеніл, алкініл і бензил; і 2) видалення захисних груп у аміну VIBa і перетворення вільного аміну в ізоціанат: . Спосіб 19 Спосіб отримання сечовини формули VI, що включає обробку аміну формули VIBb (сполука формули VIB, де обидві групи R являють собою Н) фенілхлорформіатом в присутності основи з отриманням карбамату VIO, і взаємодію VIO з трет-лейцином в присутності основи: . Спосіб 20 Спосіб отримання аміну формули VIBb, що включає конденсацію циклогексанону з третбутилсульфінамідом в присутності дегідратуючого агента з отриманням іміну формули VIP, обробку VIP сполукою VIN з отриманням сульфону-сульфінаміду VIQ, і перетворення VIQ у вільний амін: . Спосіб 21 Спосіб отримання сполуки формули VIN, що включає окиснення трет-бутилтіометилового ефіру пероксидом водню і вольфраматом натрію з отриманням VIR, і обробку VIR н-бутиллітієм: . В іншому аспекті винахід стосується способу (спосіб 22) отримання сполуки формули I , 12 UA 108857 C2 що включає: 1) конденсацію кислоти формули VI з вторинним аміном формули VII-1 (сполука формули 1 VII, де R являє собою метил) у водорозчинному розчиннику в присутності агентів конденсації з отриманням складного ефіру формули Va: ; 2) перетворення складного ефіру формули Va в кислоту формули II: ; 3) конденсацію кислоти формули II з проміжною аміносполукою формули III в присутності агентів конденсації з отриманням проміжного спирту формули IV: ;і 4) окиснення проміжної сполуки формули IV. В іншому аспекті винахід стосується способу (спосіб 23) отримання сполуки формули I , 13 UA 108857 C2 що включає: 1) взаємодію захищеного аміну формули VIIA з циклопропіламіном формули III з отриманням сполуки формули VIII , де PG являє собою азотзахисну групу; 2) видалення захисної групи у VIII і конденсацію отриманого вільного аміну формули VIIA з кислотою формули VI з отриманням спирту формули IV: і 3) окиснення спирту формули IV. В іншому аспекті винахід стосується способу (спосіб 24) отримання сполуки формули VI , що включає: 1) взаємодію іміну формули VIP з сульфоном формули VIN з отриманням сульфонусульфінаміду формули VIQ, потім перетворення VIQ в первинний амін VIBb: 14 UA 108857 C2 ; 2) взаємодію VIBb з фенілхлорформіатом в присутності основи з отриманням карбамату формули VIO ;і 3) взаємодію VIO з трет-лейцином. В іншому аспекті винахід стосується способу (спосіб 25) отримання сполуки формули IV , що включає: 1 1) конденсацію кислоти формули IX, де R має значення, вказані вище, з аміном формули III з отриманням сполуки формули X ; 2) видалення захисних груп у аміну формули X з отриманням сполуки формули XI: ;і 3) взаємодію аміну формули XI з ізоціанатом формули VIE 15 UA 108857 C2 . В іншому аспекті винахід стосується наступних нових проміжних сполук: ; або її сіль; або її сіль; ; ; 1 , де R являє собою алкіл, арил, алкеніл, алкініл або бензил, або до їх гідратованих або безводних поліморфів; 16 UA 108857 C2 ; ; і . Докладний опис винаходу В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули I, як описаний в способі 1. В одному варіанті здійснення винаходу даний винахід стосується способу отримання 1 сполуки формули V, як описано в способі 2. Переважною сполукою формули V є така, де R являє собою метил або бензил, більш переважно, метил (тобто сполука Va). В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули III, як описаний в способі 3. В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули VI, як описаний в способі 14. В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули VID, як описаний в способі 16. В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули VI, як описаний в способі 19. В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули VIBb, як описаний в способі 20. В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули VIN, як описаний в способі 21. В одному варіанті здійснення винаходу даний винахід стосується отримання сполуки формули IIIF, використовуючи спосіб 4, 5, 6, 7, 8, 9, 10 або 11. В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули VI, використовуючи спосіб 12 або 13. В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули VIB, як описаний в способі 15. В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули VID, як описаний в способі 17. В одному варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули VIBa, як описаний в способі 18. В іншому варіанті здійснення винаходу даний винахід стосується способу 1, де сполуку формули II отримують шляхом перетворення сполуки формули Va (тобто складного метилового ефіру сполуки V) у відповідну кислоту; сполуку формули Va отримують за способом 2 із сполуки 1 формули VI і сполуки формули VII-1 (тобто сполуки формули VII, де R являє собою метил), сполуку формули VI отримують за способом 14 із сполуки формули VID; сполуку формули VID отримують за способом 16; і сполуку формули III отримують за способом 3, тобто способом отримання сполуки формули I, що включає: 1) отримання сполуки формули VID за способом 16; 2) обробку VID відповідно до способу 14 з отриманням сполуки формули VI; 3) конденсацію сполуки формули VI з аміном формули VII-1, як описано в способі 2, з отриманням сполуки формули Va; 17 UA 108857 C2 4) отримання аміну формули III відповідно до способу 3; 5) перетворення складного метилового ефіру формули Va у вільну кислоту формули II; 6) конденсацію кислоти формули II з аміном формули III з отриманням спирту формули IV і окиснення спирту відповідно до способу 1. В іншому варіанті здійснення винаходу даний винахід стосується способу отримання сполуки формули I, що включає: 1) отримання сполуки формули III за способом 3; 2) взаємодія сполуки формули III із захищеним аміном формули VIIA і отримання сполуки формули VIII; 3) отримання складного метилового ефіру Va за способом 2 і перетворення його у вільну кислоту II; 4) видалення захисної групи у сполуки VIII з отриманням VIIIA і конденсацію VIIIA з кислотою II і отримання спирту IV; 5) окиснення спирту. В іншому варіанті здійснення винаходу винахід стосується отримання сполуки формули VI, що включає: 1) отримання сульфону VIN відповідно до способу 21; 2) отримання іміну VIP і взаємодію його з сульфоном VIN з отриманням сульфонусульфінаміду формули VIQ, потім перетворення VIQ у вільний амін VIBb відповідно до способу 20; 3) взаємодію VIBb з фенілхлорформіатом в присутності основи з отриманням карбамату формули VIO, і взаємодію VIO з трет-лейцином відповідно до способу 19. За способом 1 отримання сполуки формули I, конденсацію проміжної кислоти формули II і аміну формули III здійснюють, використовуючи стандартні способи конденсації пептидів, відомі в даній галузі, наприклад, використовуючи 1-етил-3-(3-диметиламінопропіл)карбодіімід (EDCi) і 1-гідроксибензотриазол (HOBt) в присутності основи, такої як N, N-діізопропілетиламін (DIPEA). Використання окремого діастереомеру аміну III дає окремий діастереомер сполуки формули IV, яку кристалізують з високим ступенем чистоти з суміші етилацетат/вода. За способом, описаним в публікації '968, утворювалася суміш діастереомерів на стадії 7; суміш можна було не кристалізувати, і було з точки зору необхідного об'єму недоцільно виділяти осад, оскільки це не дозволяло видалити які-небудь домішки. Спосіб відповідно до даної формули винаходу дозволяє здійснити з точки зору необхідного об'єму більш ефективне виділення, зменшує використання розчинника, підвищує об'ємну здатність реактора і можливість ефективного видалення домішок на цій стадії. Окремий діастереомер аміну III може бути замінений в способі на діастереомер III-1. Більше того, хоч сіль HCl і є переважною для сполуки III або III-1, може бути використана будь-яка прийнятна кислотно-адитивна сіль. Вільну кислоту формули II отримують, виходячи зі складного ефіру формули V, способами, добре відомими в даній галузі, наприклад, шляхом обробки NaOH. Переважним складним 1 ефіром формули V є такий складний ефір, де R являє собою алкіл або бензил; більш 1 переважно, R являє собою метил. На стадії 2 способу 1, спирт формули IV піддають окисненню до кетону формули I одним з багатьох можливих способів окиснення, включаючи: i) основані на TEMPO (2,2,6,6-тетраметил-1-піперидинілокси, вільний радикал) способи окиснення, де TEMPO являє собою: стехіометричний реагент, де TEMPO не відповідає його повністю окисненій формі; стехіометричний або каталітичний реагент, де TEMPO використовують з додатковим агентом окиснення. Додаткові агенти окиснення включають хлорне вапно (гіпохлорит натрію); перманганат (будь-яка сіль); діоксид марганцю; оксон, перкислоту, таку як метаперхлорбензойну кислоту; пероксид, такий як пероксид водню або алкіл-пероксид водню, такий як трет-бутилпероксид водню; кисень, або чистий, або у вигляді компонента газової суміші (наприклад, повітря); лужноземельні метали ступеню окиснення +4, такі як солі церію; солі заліза ступеню окиснення +3; солі паладію ступеню окиснення +2, або окремо, або у вигляді кооксиданту з додатковим стехіометричним окислювальним агентом; галогени ступеню окиснення від 0 до +7; сполуки N-йод, N-бром або N-хлор сукцинідного типу; хінон, такий як бензохінон; ii) Електрохімічне окиснення; iii) Основане на сульфоксиді або селеноксиді окиснення, таке як окиснення по Шверну або по Моффатту; 18 UA 108857 C2 iv) Окиснення гіпервалентними галогенами, такими як перйодинат Десса-Мартину або IBX (йодоксибензойна кислота), або стехіометрично, або каталітично зі стехіометричним кооксидантом; v) Окиснення в присутності перехідних металів, таких як Ag, Ru, V, Mo, Cu, Co, Cr, Pb, Fe, Pd або Mn, або стехіометрично, або каталітично зі стехіометричним кооксидантом; vi) Окиснення за Оппенауером, де стехіометричним окислювачем є кетон і каталізатор, такий як Al(OR)3; vii) Окиснення в присутності ферменту, такого як алкогольдегідрогеназа; viii) Окиснення в присутності діоксиранів (наприклад, DMDO). За переважним способом окиснення як окислювач використовують хлорне вапно і як каталізатор - TEMPO. Сполука формули IV має погану розчинність в багатьох розчинниках: як один приклад прийнятного розчинника для окиснення можна вказати вологий метилацетат. За способом 2 отримання сполуки формули V, вільну кислоту VI піддають конденсації з 1 аміном VII, де R має значення, вказані вище, переважно, алкіл, більш переважно, метил, використовуючи стандартні способи конденсації пептидів, відомі в даній галузі, наприклад, використовуючи EDCi і HOBt і основу, таку як N-метилморфолін (NMM) у водорозчинному розчиннику, такому як ацетонітрил; також можуть бути використані інші агенти конденсації, такі як о-бензотриазол-1-іл-N, N,N',N'-тетраметилуроній гексафторфосфат (HATU), хлорангідрид біс(2-оксо-3-оксазолідиніл)фосфорної кислоти (BOP-Cl) і карбонілдіімідазол (CDI). По завершенні реакції конденсації замість звичайної обробки водою даний спосіб включає додавання води безпосередньо в отриманий розчин, що приводить до кристалізації сполуки V у вигляді гідрату. Фільтрація кристалічних твердих продуктів приводить до виділення гідратованої сполуки V, тоді як побічні продукти в основному залишаються в фільтраті. Вологий коржик гідрату на фільтрі потім вміщують в розчинник, такий як етилацетат або толуол, і розчин піддають азеотропній відгонці з видаленням більшої частини води. Коли кількість води знижується до низького рівня, додають неводний антирозчинник, такий як гептани, для кристалізації безводної форми сполуки V. 1 Спосіб 2 є більш зручним, оскільки переважна сполука Va (R являє собою метил) існує у вигляді двох поліморфів, гідратованої форми і безводної форми. Оскільки гідратована форма містить невизначену кількість води, важко отримати точне визначення її чистоти за допомогою аналізу мас./мас., однак спосіб, за яким утворюється гідратований поліморф (стадія 2 способу 2) дозволяє поліпшити контроль за домішками. Навпаки, безводну форму можна точно зважити, але спосіб її отримання не дозволяє видалити домішки так ефективно. Спосіб 2 дозволяє скористатися перевагою в досягненні бажаної чистоти обох способів, при цьому у високій мірі підвищуючи ефективність реакції; він усуває потребу в багаторазових промиваннях водою, що звичайно пов'язано з реакцією конденсації EDCi/HOBt амідних зв'язків. Спосіб 3 стосується отримання індивідуального діастереомеру солі аміну III, необхідної для отримання сполуки формули I. Стадія 1 способу 3 включає конденсацію валеральдегіду і малонової кислоти в розчиннику, такому як піридин, з отриманням α,β-ненасиченої кислоти IIIB, потім на стадії 2 взаємодію IIIB, під тиском, з 2-метилпропеном і кислотним каталізатором, таким як H2SO4, з отриманням складного ефіру IIIC. Складний ефір IIIC піддають взаємодії з (S)N-(-)-бензил-α-метилбензиламіном, переважно, в інтервалі температур від -65 до -55 °C і в розчиннику, такому як ТГФ, з отриманням проміжного еноляту. (S)-N-(-)-Бензил-αметилбензиламін утворюється in situ шляхом взаємодії (S)-бензил-1-фенілетиламіну і нгексиллітію перед додаванням IIIC в реакційну суміш. Потім в розчин еноляту додають (виділення не потрібне) (1S)-(+)-(10-камфорсульфоніл)оксазиридин з отриманням складного βаміно-α-гідроксіефіру IIID. Подібний спосіб описаний Beevers et al, Bioorg. Med. Chem. Lett., 2002, 12, 641-643, однак Beevers et al використовують температуру -78 °C, тоді як за даним способом використовують більш зручну температуру від -65 до -55 °C. На стадії 4 складний ефір IIID обробляють кислотою, такою як трифтороцтова кислота, з отриманням вільної кислоти, яку піддають конденсації (без виділення) з циклопропіламіном в присутності дегідратуючого агента, такого як EDCi/HOBt, з отриманням аміду IIIE. На стадії 5 захисні бензильні групи у IIIE видаляють, наприклад, за допомогою джерела водню в присутності каталізатора на основі металу, таких як газоподібний водень і паладій на вугіллі, з отриманням вільного аміну IIIF. Обробка IIIF з допомогою HCl дає сіль III. Альтернативно, на стадії 3 взаємодія IIIC з амідом літію може бути погашена водою або іншим джерелом протонів, енолят може бути перетворений з отриманням IIID-1, який може бути далі підданий обробці оксазиридином з отриманням IIID. Інші N-захищені аміди літію можуть бути використані на стадії 3, при умові, що на N є хіральний центр. 19 UA 108857 C2 Спосіб, аналогічний способу 3, використовуючи прийнятний реагент на стадії 3, може бути застосований для отримання сполуки формули IIIF-1 і її HCl солі, III-1. Використовуючи способи, відомі в даній галузі, на стадії 5 способу 3 HCl сіль може бути замінена іншими кислотно-адитивними солями для отримання інших солей IIIF і IIIF-1. Спосіб 4 отримання сполуки IIIF включає розкриття лактамового кільця IIIG з отриманням амінокислоти IIIH, наприклад, шляхом обробки кислотою, переважно HCl. Конденсацію IIIH з циклопропіламіном здійснюють методом, подібним описаному в способі 3, стадія 4, і подальше 2 3 видалення захисних груп у аміно- і гідроксильної груп (коли R і R не є Н) здійснюють 2 способами, відомими в даній галузі. Переважними групами R є алкіл і бензил; переважними 3 групами R є алкіл і бензил. Спосіб 5 отримання сполуки IIIF включає відновлення енаміну III-I шляхом асиметричного гідрування з отриманням IIIJ і перетворення IIIJ в карбонову кислоту IIIH-1. Конденсацію IIIH-1 з циклопропіламіном здійснюють методом, подібним описаному в способі 3, стадія 4, і подальше 2 6 7 видалення захисних груп у аміно- і гідроксильної груп (коли R , R і R не є Н) здійснюють 2 способами, відомими в даній галузі. Переважними групами R є алкіл і бензил; переважними 6 7 групами R і R є алкіл і бензил. Спосіб 6 отримання сполуки IIIF включає гідроксилювання IIIK з отриманням IIIL, наприклад, шляхом обробки з допомогою LiHMDS і оксазиридину, і перетворення IIIL в карбонову кислоту IIIH-2. Конденсацію IIIH-2 з циклопропіламіном здійснюють методом, подібним описаному в 6 7 способі 3, стадія 4, і подальше видалення захисних груп у аміногрупи (коли R і R не є Н) 6 7 здійснюють способами, відомими в даній галузі. Переважними групами R і R є алкіл і бензил. Спосіб 7 отримання сполуки IIIF включає відновлення нітрогрупи IIIM з отриманням амінокислоти IIIN, розділення IIIN способами, відомими в даній галузі, з отриманням IIIO, і перетворення IIIO в карбонову кислоту IIIH-3. Конденсацію IIIH-3 з циклопропіламіном здійснюють методом, подібним описаному в способі 3, стадія 4, і подальше видалення захисних 2 груп у гідроксильної групи (коли R не є Н) здійснюють способами, відомими в даній галузі. 2 Переважними групами R є алкіл і бензил. Спосіб 8 отримання сполуки IIIF включає відновлення α-кетосполуки IIIP з отриманням IIIL, яку потім обробляють методом, подібним описаному в способі 6, з отриманням IIIF. 6 7 Переважними групами R і R є алкіл і бензил. Спосіб 9 отримання сполуки IIIF включає перетворення сполуки IIIQ з отриманням аміну IIIJ, наприклад, по типу реакції Міцунобу. IIIJ потім обробляють методом, подібним описаному в способі 5, з отриманням IIIF. Спосіб 10 отримання сполуки IIIF включає розкриття епоксидного кільця IIIR джерелом азоту, таким як аміак або азид, з отриманням IIIS, і перетворення IIIS в карбонову кислоту IIIH-4. Конденсацію IIIH-4 з циклопропіламіном здійснюють методом, подібним описаному в способі 3, стадія 4. R8, переважно, являє собою Н, алкіл або бензил. Спосіб 11 отримання сполуки IIIF включає обробку азиридину IIIT джерелом кисню, таким як алкоксид, з отриманням IIIU, і перетворення IIIU в карбонову кислоту IIIH-5. Конденсацію IIIH-5 з циклопропіламіном здійснюють методом, подібним описаному в способі 3, стадія 4, і подальше 2 6 видалення захисних груп у аміно- і гідроксильної груп (коли R і R не є Н) здійснюють 2 6 способами, відомими в даній галузі. R , переважно, являє собою алкіл або бензил, і R , переважно, являє собою алкіл або бензил. По способах 12 і 13 отримують сечовину VI або заміною групи, що видаляється (наприклад, сполуки VIA, де Р являє собою, наприклад, Ms або Ts) (спосіб 12), або розкриттям азиридинового кільця (спосіб 13) за допомогою сірковмісного нуклеофілу формули (CH3)3C-SM+, де M являє собою Н або метал, такий як Na, Li або K, з подальшим окисненням і 6 отриманням VIB. Сполуку формули VIB потім перетворюють в первинний амін VIBb (тобто R і 7 R , обидва, являють собою Н) способами, відомими в даній галузі. Проміжну аміносполуку VIBb потім піддають конденсації з трет-лейцином в присутності реагенту, такого як фосген або 6 7 еквівалент фосгену, з отриманням VI. R і R незалежно являють собою, переважно, Н, алкіл або бензил. У способі 14 сечовину VI отримують, піддаючи сполуку VID перегрупуванню Курціуса, наприклад, обробкою реагентом, таким як дифенілфосфорил азид (DPPA), з отриманням ізоціанату VIE. Немає необхідності у виділенні ізоціанату перед взаємодією з S-трет-лейцином при отриманні сполуки VI. Спосіб 15 стосується альтернативного шляху отримання сполуки VIB, що включає 10 конденсацію циклогексанону з сульфонільним похідним формули (CH 3)3C-SO2-CH2-R (або 10 10 (CH3)3C-SO-CH2-R , або (CH3)3C-S-CH2-R з отриманням відповідного сульфініл- або 10 тіоаналога), де R має значення, вказані вище. Отриману ненасичену сполуку VIF потім 20 UA 108857 C2 10 відновлюють до сполуки VIB; наприклад, коли R являє собою -C(О)OH, VIF може бути 5 6 оброблений азотвмісним нуклеофілом, таким як HN(R )(R ), з подальшим декарбоксилюванням. У способі 16 отримання проміжної кислота/сульфонсполуки VID, стадія 1 включає обробку комерційно доступного метилового ефіру циклогексанкарбонової кислоти (VIG) сильною основою, такою як діізопропіламід літію, потім хлортриметилсиланом з отриманням триметилсиліленоляту VIH. Альтернативно, на стадії 1 замість VIG можуть бути використані інший складний ефір циклогексанкарбонової кислоти, циклогексанкарбонітрил і інші карбонілпохідні циклогексану. Реакційний розчин, що містить VIH, може бути підданий заміні розчинника і концентруванню, але немає необхідності у виділенні VIH перед продовженням способу. Енолят алкілують трет-бутилхлорметилсульфідом, використовуючи способи, відомі в даній галузі (дивіться Beight et al, Bioorg. Med. Chem. Lett, 1996, 6, 2053-2058) з отриманням складного ефіру/сульфону VIJ. На стадії 2 способу 16 складний ефір піддають гідролізу до вільної кислоти VIK, наприклад, шляхом обробки основою, такою як LiOH, NaOH, KOH або CsOH, в умовах гідролізу по Бростеду або з участю кислот Льюїса, або шляхом фермент-опосередкованого гідролізу. Переважним способом є обробка NaOH. На стадії 3 частину тіоефіру VIK піддають окисненню до кислоти/сульфону VID, наприклад, шляхом обробки пероксимоносульфатом калію (оксоно), м-хлорпероксибензойною кислотою або диметил діоксираном (DMDO). Спосіб 17 подібний способу 16, за винятком того, що стадії 2 і 3 переставлені місцями, тобто частину тіоефіру піддають окисненню до сульфону, потім складний ефір піддають гідролізу до кислоти. Спосіб 18 отримання ізоціанату VIE включає взаємодію комерційно доступного 6 6 циклогексанону з аміном R NH2 (де значення R визначені вище) з отриманням іміну VIM, потім алкілування VIM з допомогою (CH3)3C-SO2-CH2-Li (VIN) з отриманням VIBa. Амін піддають видаленню захисних груп до первинного аміну і перетворенню в бажаний ізоціанат. Спосіб 19 отримання сечовини формули VI включає обробку аміну формули VIBb фенілхлорформіатом в присутності основи, такої як DIPEA, з отриманням карбамату VIO, який, переважно, очищували шляхом кристалізації. VIO потім піддавали гідролізу з допомогою третлейцину в присутності основи, такої як 1,1,3,3-тетраметилгуанідин. Отриману сполуку VI очищали, переважно, шляхом кристалізації. Спосіб 20 отримання аміну VIBb включає конденсацію циклогексанону з третбутилсульфонамідом в присутності дегідратуючого агента, такого як Ti(OEt) 4, з отриманням іміну VIP. Імін потім обробляють (CH3)3C-SO2-CH2-Li в реакції по типу Манніха з отриманням сульфон-сульфінамідної сполуки VIQ; VIQ піддають гідролізу з допомогою HCl з отриманням HCl солі, потім обробляють основою, такою як NaOH, з отриманням VIBb. Спосіб 21 отримання VIN включає окиснення трет-бутилтіометилового ефіру пероксидом водню і вольфраматом натрію при температурі нижче приблизно 30 °C з отриманням VIR; підтримка температури нижче приблизно 30 °C дозволяє уникнути летучості і втрати третбутилтіометилового ефіру. VIR потім піддавали гідролізу з допомогою н-бутиллітію при температурі приблизно 0 °C. У порівнянні зі стадіями S1-S5 способу, описаного в публікації '968, і підсумовуючи розділ рівень техніки даного опису, способи 19, 20 і 21 мають ряд переваг. Продукт S1, нестабільну сполуку, виділяють способом, описаним в '968, а за даним способом 20 його піддають взаємодії напряму, з отриманням більш стабільної проміжної сполуки. Отримання літованого сульфону і подальше додавання іміну за способом 21 здійснюють при температурі приблизно 0 °C, тоді як за способом, описаним в публікації '968, подібну реакцію (S2) здійснюють при температурі 78 °C. За способом 19 реагентом, що використовується для отримання сечовини, є фенілхлорформіат, а не фосген, як використовується у випадку S4 за способом, описаним в публікації '968. За способом, описаним в публікації '968, виділені проміжні сполуки очищали з допомогою хроматографії на колонці, тоді як очищення в способах 19-21 здійснюють шляхом кристалізації. Спосіб 22 отримання сполуки формули I, переважно, включає отримання проміжної сполуки V методом, описаним в способі 2, з подальшим перетворенням складного метилового ефіру V у вільну кислоту II способами, відомими в даній галузі, наприклад, шляхом обробки основою, такою як NaOH, потім конденсацією кислоти II з аміном III і окиснення отриманого спирту, як описано в способі 1. У способі 23 отримання сполуки формули I використовуються проміжні сполуки, подібні тим, які описані в способі 22, але об'єднані в іншому порядку. Захищений по аміногрупі амін формули VIIA, де PG являє собою групу, таку як трет-бутилкарбоніл (BOC) або карбобензилокси (CBZ), вводять у взаємодію з аміноспиртом формули III з отриманням сполуки формули VIII, яку потім 21 UA 108857 C2 піддають видаленню захисних груп і взаємодії з кислотою формули VI з отриманням спирту формули IV. Спирт формули IV потім окисляють з отриманням сполуки формули I, як описано в способі 1. Спосіб 24 отримання сполуки формули VI включає взаємодію іміну формули VIP з сульфоном формули VIN, відповідно до способу 20, з отриманням аміну VIBb і подальшою взаємодією VIBb з фенілхлорформіатом, потім трет-лейцином, як описано в способі 19. Переважно, VIP отримують, як описано в способі 20, і сульфон VIN отримують, як описано в способі 21. Спосіб 25 отримання сполуки формули IV включає конденсацію кислоти формули IX (відомої в даній галузі) з аміном формули III, використовуючи методи звичайної пептидної конденсації, і видалення захисних груп у отриманого аміну X, використовуючи відомі способи, з отриманням сполуки аміну формули XI. Амін формули XI піддають взаємодії з ізоціанатом VIE з отриманням сполуки формули IV. У описі були використані наступні абревіатури, крім вказаних вище: Me = метил, Et = етил, Bu = бутил, Ms = мезил = метансульфоніл, Ts = тозил = толуолсульфоніл, Ph = феніл; ТГФ = тетрагідрофуран; LDA = діізопропіламід літію; TMSCl = хлортриметил силан; MTBE = метиловий трет-бутиловий ефір; RT = кімнатна температура; ТФО = трифтороцтова кислота; 2-MeТГФ = 2метилтетрагідрофуран. Як тут використовується, якщо не указано іншого, наступні терміни визначені далі: "Алкіл" означає аліфатичну вуглеводневу групу, яка може бути прямою або розгалуженою і що містить від приблизно 1 до приблизно 20 атомів вуглецю в ланцюгу. Переважні алкільні групи містять від приблизно 1 до приблизно 12 атомів вуглецю в ланцюгу. Більш переважні алкільні групи містять від приблизно 1 до приблизно 6 атомів вуглецю в ланцюгу. Розгалуження означає, що одна або декілька з нижчих алкільних груп, таких як метил, етил або пропіл, приєднані до лінійного алкільного ланцюга. "Алкеніл" означає пряму або розгалужену аліфатичну вуглеводневу групу, що має, щонайменше, один вуглець-вуглецевий подвійний зв'язок і що містить від приблизно 2 до приблизно 15 атомів вуглецю в ланцюгу. Переважні алкенільні групи містять від приблизно 2 до приблизно 12 атомів вуглецю в ланцюгу; і, більш переважно, від приблизно 2 до приблизно 6 атомів вуглецю в ланцюгу. "Нижчий алкеніл" означає від приблизно 2 до приблизно 6 атомів вуглецю в ланцюгу, який може бути прямою або розгалуженою. Необмежувальні приклади відповідних алкенільних груп включають етеніл, пропеніл, н-бутеніл, 3-метилбут-2-еніл, нпентеніл, октеніл і деценіл. Переважною алкенільною групою є аліл. "Алкініл" означає аліфатичну вуглеводневу групу, що має, щонайменше, один вуглецьвуглецевий потрійний зв'язок, і яка може бути прямою або розгалуженою і що містить від приблизно 2 до приблизно 15 атомів вуглецю в ланцюгу. Переважні алкінільні групи містять від приблизно 2 до приблизно 12 атомів вуглецю в ланцюгу; і більш переважно, від приблизно 2 до приблизно 4 атомів вуглецю в ланцюгу. Розгалуження означає, що одна або декілька з нижчих алкільних груп, така як метил, етил або пропіл, приєднані до лінійного алкінільного ланцюга. "Нижчий алкініл" означає від приблизно 2 до приблизно 6 атомів вуглецю в ланцюгу, який може бути прямим або розгалуженим. Необмежувальні приклади прийнятних алкінільних групи включають етиніл, пропініл, 2-бутиніл і 3-метилбутиніл. "Арил" означає ароматичну моноциклічну або поліциклічну кільцеву систему, що містить від приблизно 6 до приблизно 14 атомів вуглецю, переважно, від приблизно 6 до приблизно 10 атомів вуглецю. Арильна група необов'язково може бути заміщена одним або декількома "замісниками кільцевої системи", які можуть бути однаковими або різними і мають значення, вказані вище. Необмежувальні приклади прийнятних арильних груп включають феніл і нафтил. Сполуки формул IIIF і IIIF-1 можуть утворювати солі, які також входять в об'єм даного винаходу. Термін "сіль(солі)", як тут використовується, означає солі кислот, утворені з неорганічними і/або органічними кислотами. Фармацевтично прийнятні (тобто нетоксичні фізіологічно прийнятні) солі є переважними, хоч інші солі також використовуються. Солі сполук формул IIIF і IIIF-1 можуть бути отримані відомими способами, наприклад, шляхом взаємодії сполуки формули IIIF або IIIF-1 з деякою кількістю кислоти, такою як еквівалентна кількість, в середовищі, такому як середовище, в якому сіль виділяється в осад, або у водному середовищі. Приклади солей додавання кислот включають ацетати, аскорбати, бензоати, бензолсульфонати, бісульфати, борати, бутирати, цитрати, камфорати, камфорсульфонати, фумарати, гідрохлориди, гідроброміди, гідройодиди, лактати, малеати, метансульфонати, нафталінсульфонати, нітрати, оксалати, фосфати, пропіонати, саліцилати, сукцинати, сульфати, тартрати, тіоціанати, толуолсульфонати (також відомі як тозилати) і тому подібне. Крім того, кислоти, які звичайно розглядаються як прийнятні для утворення фармацевтично 22 UA 108857 C2 прийнятних солей з основних фармацевтичних сполук, обговорені, наприклад, P. Stahl et al, Camille G. (eds.) Handbook of Pharmaceutical Salts. Properties, Selection and Use. (2002) Zurich: Wiley-VCH; S. Berge et al, Journal of Pharmaceutical Sciences (1977) 66(1) 1-19; Р. Gould, International J. of Pharmaceutics (1986) 33 201-217; Anderson et al, The Practice of Medicinal Chemistry (1996), Academic Press, New York; і в публікації The Orange Book (Food & Drug Administration, Washington, D. C. на їх веб-сайті). Вказані описи включені в даний опис у вигляді посилань. Отримання сполуки VIJ LDA отримували повільним додаванням н-бутиллітію (2,5 M, 159 кг) до діізопропіламіну (60 кг), розчиненого в ТГФ (252 кг), підтримуючи температуру приблизно -20 °C, з подальшим перемішуванням при цій температурі протягом приблизно 30 хвилин. До цього розчину додавали метиловий ефір циклогексанкарбонової кислоти (70 кг), підтримуючи температуру нижчу ніж -10 °C. Суміш перемішували при цій температурі протягом приблизно 2 годин. До отриманого еноляту додавали TMSCl (64,4 кг). Суміш перемішували при температурі від -10 до 20 °C протягом приблизно 30 хвилин, і потім нагрівали до приблизно 25 °C і витримували при цій температурі, щоб дати можливість перетворенню в силіленольний ефір сполуки VIH. Реакційну суміш піддавали заміні розчинника на н-гептан у вакуумі, підтримуючи температуру нижчу ніж 50 °C, що приводило до утворення осаду твердих продуктів. Тверді продукти фільтрували і промивали н-гептаном, і промивки об'єднували з н-гептановою реакційною сумішшю. н-Гептанову суміш сполуки VIH концентрували у вакуумі і розбавляли CH 2Cl2. В окремий реактор вміщували CH2Cl2 (461 кг) і безводний ZnBr2 (14,5 кг). Температуру цинкової зависі встановлювали приблизно 20 °C. До цинкової зависі одночасно додавали розчин сполуки VIH і 2-хлорметилсульфаніл-2-метилпропану (63,1 кг, посилання: Bioorg. Med. Chem. Lett, 1996, 6, 2053-2058), підтримуючи температуру нижчу ніж 45 °C. Після завершення додавання суміш перемішували протягом приблизно 1,5 години при температурі від 35 до 45 °C, після чого реакційну суміш охолоджували до температури від 10 до 15 °C. Потім додавали розбавлену водну HCl, підтримуючи температуру в інтервалі між 0 і 15 °C, далі розділяли водний і органічний шари (бажана сполука знаходиться в органічному шарі). Органічний шар промивали водним розчином NaHCO3 і водою. Органічний шар піддавали заміні розчинника на метанол шляхом вакуумної дистиляції, підтримуючи температуру нижчу ніж 35 °C, і зберігали у вигляді розчину в метанолі до подальшого перетворення в сполуку VIK. Практичний вихід сполуки VIJ=69,7 кг (мольний вихід = 57,9 %). Отримання сполуки VIK У чистий реактор вміщували сполуку VIJ (99,8 кг фактичного в метанольному розчині), воду (270 кг), NaOH (70 кг) і метанол (603 кг). Суміш нагрівали до приблизно 70 °C і перемішували при цій температурі протягом приблизно 16 годин. Після перетворення в натрієву сіль сполуки VIK, реакційну суміш концентрували у вакуумі, підтримуючи температуру нижчу ніж 55 °C, і потім охолоджували до приблизно 25 °C. Потім додавали воду і MTBE, перемішували, і шари розділяли (продукт знаходився у водному шарі). Водний шар, що містить продукт, потім промивали MTBE. CH2Cl2 вміщували у водний шар і температуру встановлювали при приблизно 10 °C. Отриману суміш підкисляли до pH приблизно 1,5 з допомогою HCl, перемішували, відстоювали і розділяли (сполука була в органічному шарі). Водний шар екстрагували CH2Cl2, і об'єднані органічні шари зберігали в розчині CH2Cl2 для подальшого отримання сполуки VID. Практичний вихід сполуки VIK=92,7 кг (мольний вихід = 98,5 кг). МС обчислено: 230,13; МС знайдено (ES-, M-H): 229,11. 23 UA 108857 C2 Отримання сполуки VID ® У реактор вміщували воду (952 кг), оксон (92,7 кг) і сполуку VIK (92,7 кг фактичного у вигляді розчину в CH2Cl2). Реакційну суміш перемішували протягом приблизно 24 годин при температурі приблизно 15 °C, протягом цього часу сполука VIK окислювалася до сульфону ® сполуки VID. Надлишок оксон гасили за допомогою водного розчину Na2S2O5, реакційну суміш відстоювали, і шари розділяли; водний шар повторно екстрагували CH 2Cl2, і об'єднані органічні шари, що містять продукт, промивали водою. Отриманий розчин потім упарювали у вакуумі. До сполуки VID, що випала в осад, додавали н-гептан, і отриману завись перемішували протягом приблизно 60 хвилин при температурі приблизно 30 °C. Реакційну суміш фільтрували, і вологий коржик на фільтрі промивали нгептаном. Вологий коржик на фільтрі знову розчиняли в CH 2Cl2, потім додавали н-гептан. Отриманий розчин потім упарювали у вакуумі, підтримуючи температуру нижчу ніж 35 °C, даючи продукту виділитися у вигляді осаду. Отриманий розчин охолоджували до температури приблизно 0С° і перемішували при цій температурі протягом приблизно 1 години. Розчин фільтрували, вологий коржик на фільтрі промивали н-гептаном і сушили у вакуумі при температурі приблизно 45 °C з отриманням 68,7 кг сполуки VID (мольний вихід = 65,7 %). МС обчислено: 262,37; МС знайдено (ES-, M-H): 261,09. Отримання сполуки VI У реактор вміщували сполуку VID (68,4 кг), толуол (531 кг) і Et 3N (31 кг). Реакційну суміш кип'ятили при атмосферному тиску з використанням апарату Старка для видалення води (мета - KF
ДивитисяДодаткова інформація
Назва патенту англійськоюEnantio- and stereo-specific syntheses of b-amino-a- hydroxy amides
Автори англійськоюTraverse, John, Leong, William, W., Miller, Steven, P., Albaneze-Walker, Jennifer, Hutner, Thomas, J., Wang, Lijun, Liao, Hongbiao, Arasappan, Ashok, Trzaska, Scott, T., Smith, Randi, M., Lekhal, Azzeddine, Bogen, Stephane, L., Kong, Jianshe, Bennett, Frank, Njoroge, F., George, Poirier, Marc, Kuo, Shen-Chun, Chen, Yonggang, Matthews, Kenneth S., Demonchaux, Patrice, Ferreira, Amadeo
Автори російськоюТраверз Джон, Леонг Уилльям У., Миллер Стивен П., Альбанесе-Уолкер Дженнифер, Хантер Томас Дж., Ван Лицзюнь, Ляо Хунбяо, Арасаппан Ашок, Трзаска Скотт Т., Смит Ренди М., Лекхал Аззедине, Божен Стефан Л., Кун Цзяньше, Беннет Френк, Нджороге Ф. Джордж, Пуарье Марк, Ко Шень-Чунь, Чень Юнган, Меттьюз Кеннет С., Демоншо Патрик, Феррейра Амадео
МПК / Мітки
МПК: C07C 315/00, C07D 209/52, C07K 5/06, C07C 237/02
Мітки: енантіо, стереоспецифічні, b-аміно-a-гідроксіамідів, синтезі
Код посилання
<a href="https://ua.patents.su/35-108857-enantio-i-stereospecifichni-sintezi-b-amino-a-gidroksiamidiv.html" target="_blank" rel="follow" title="База патентів України">Енантіо- і стереоспецифічні синтези b-аміно-a-гідроксіамідів</a>