Азетидинонові сполуки і медичне застосування зазначених сполук
Номер патенту: 105053
Опубліковано: 10.04.2014
Автори: Сюй Сяоцзе, Чжу Цюфен, Ло Хайрон, Бай Хуа, Лю Сяу, Чжан Юнкай, Чжен Сяохе, Чен Ін, Чжан Юн, Гу Маоцзян, Чжао Сюйян
Формула / Реферат
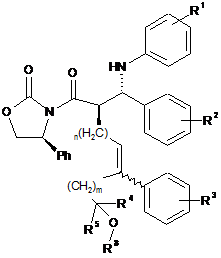
1. Сполука, представлена формулою (І):
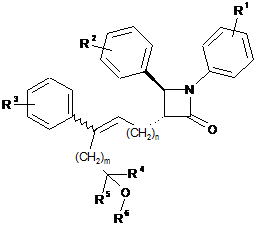 , Формула (І)
, Формула (І)
або її фармацевтично прийнятна сіль, де:
R1 означає 1-3 замісники, незалежно вибрані з групи, що складається з водню, галогену, трифторметилу, ціано, С1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, гідроксилу, С1-С6алкокси, бензилокси і -OCOR7;
R2 означає 1-3 замісники, незалежно вибрані з групи, що складається з водню, галогену, трифторметилу, ціано, С1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, гідроксилу, С1-С6алкокси, С6-С10арилокси, (С6-С10арил)метокси і -OCOR7;
R3 означає 1-3 замісники, незалежно вибрані з групи, що складається з водню, галогену, трифторметилу, ціано, С1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, С1-С6алкокси і бензилокси;
R4 вибирають із групи, що складається з водню, С1-С6алкілу, С2-С6алкенілу і С3-С6циклоалкілу;
R5 вибирають із групи, що складається з водню, С1-С6алкілу, С2-С6алкенілу і С3-С6циклоалкілу;
R6 означає водень або -COR7;
R7 означає С1-С10алкіл, феніл або феніл, заміщений принаймні одним замісником, вибраним із групи, що складається з галогену, трифторметилу, ціано, гідроксилу, С1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, С1-С6алкокси, фенокси і бензилокси;
m дорівнює 0, 1, 2 або 3;
n дорівнює 1, 2 або 3;
де вуглець-вуглецевий подвійний зв'язок має Z-конфігурацію або Е-конфігурацію.
2. Сполука за п. 1, де R1 означає 1-3 замісники, незалежно вибрані з групи, що складається з галогену.
3. Сполука за п. 2, де R1 означає 1-3 замісники, незалежно вибрані з групи, що складається з фтору і хлору, переважно фтору.
4. Сполука за будь-яким із попередніх пунктів, де R2 означає 1-3 замісники, незалежно вибрані з групи, що складається з гідроксилу, C1-С6алкокси і -OCOR7, де R7 вибирають із групи, що складається з C1-С6алкілу, фенілу або фенілу, заміщеного принаймні одним замісником, вибраним із групи, що складається з галогену, трифторметилу, ціано, гідроксилу, С1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, С1-С6алкокси і бензилокси.
5. Сполука за п. 4, де R2 означає 1-3 замісники, незалежно вибрані з групи, що складається з гідроксилу, метокси, фенілокси і -OCOR7.
6. Сполука за будь-яким із попередніх пунктів, де R3 означає 1-3 замісники, незалежно вибрані з групи, що складається з галогену.
7. Сполука за п. 6, де R3 означає 1-3 замісники, незалежно вибрані з групи, що складається з фтору і хлору, переважно фтору.
8. Сполука за будь-яким із попередніх пунктів, де R4 означає водень або С1-С6алкіл.
9. Сполука за п. 8, де R4 означає водень або метил.
10. Сполука за будь-яким із попередніх пунктів, де R5 означає водень або C1-С6алкіл.
11. Сполука за п. 10, де R5 означає водень або метил.
12. Сполука за будь-яким із попередніх пунктів, де R6 означає водень.
13. Сполука за будь-яким із пп. 1-11, де R6 означає -COR7, де R7 означає C1-С10алкіл, феніл або феніл, заміщений принаймні одним замісником, вибраним із групи, що складається з галогену, трифторметилу, ціано, гідроксилу, С1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, С1-С6алкокси, фенокси і бензилокси.
14. Сполука за будь-яким із попередніх пунктів, де R7 означає С1-С10алкіл, переважно метил.
15. Сполука за будь-яким із попередніх пунктів, де m дорівнює 0 або 1.
16. Сполука за будь-яким із попередніх пунктів, де n дорівнює 1.
17. Сполука за п. 1, вибрана з групи, що складається з:
(3R,4S)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]-4-(4-гідроксифеніл)азетидин-2-ону (I-1 Z-конфігурації);
(3R,4S)-1-(4-фторфеніл)-3-[(Е)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]-4-(4-гідроксифеніл)азетидин-2-ону (I-1 Е-конфігурації);
(3R,4S)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]-4-(4-метоксифеніл)азетидин-2-ону (I-2 Z-конфігурації);
(3R,4S)-1-(4-фторфеніл)-3-[(Е)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]-4-(4-метоксифеніл)азетидин-2-ону (I-2 Е-конфігурації);
(3R,4S)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]-4-(4-феноксифеніл)азетидин-2-ону (I-3 Z-конфігурації);
(3R,4S)-1-(4-фторфеніл)-3-[(Е)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]-4-(4-феноксифеніл)азетидин-2-ону (I-3 Е-конфігурації);
(3R,4S)-4-(4-бензилоксифеніл)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]азетидин-2-ону (I-4 Z-конфігурації);
(3R,4S)-4-(4-бензилоксифеніл)-1-(4-фторфеніл)-3-[(Е)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]азетидин-2-ону (I-4 Е-конфігурації);
(3R,4S)-4-(4-бензоїлоксифеніл)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]азетидин-2-ону (I-5 Z-конфігурації);
(3R,4S)-4-(4-ацетоксифеніл)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]азетидин-2-ону (I-6 Z-конфігурації);
(3R,4S)-4-(4-бензоїлоксифеніл)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідроксипент-2-еніл]азетидин-2-ону (I-7 Z-конфігурації);
(3R,4S)-l-(4-фтopфeнiл)-3-[(Z)-3-(4-фтopфeнiл)-4-гiдpoкcипeнт-2-eнiл]-4-(4-гідроксифеніл)азетидин-2-ону (I-8 Z-конфігурації);
(3R,4S)-1-(4-фторфеніл)-3-[(Е)-3-(4-фторфеніл)-4-гідроксипент-2-еніл]-4-(4-гідроксифеніл)азетидин-2-ону (I-8 Е-конфігурації);
(3R,4S)-4-(4-бензоїлоксифеніл)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідрокси-4-метилпент-2-еніл]азетидин-2-ону (I-9 Z-конфігурації);
(3R,4S)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідрокси-4-метилпент-2-еніл]-4-(4-гідроксифеніл)азетидин-2-ону (I-10 Z-конфігурації);
(3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфеніл)бут-2-еніл]-4-(4-ацетоксифеніл)-1-(4-фторфеніл)азетидин-2-ону (I-11 Z-конфігурації);
(3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфеніл)бут-2-еніл]-1-(4-фторфеніл)-4-(4-гідроксифеніл)азетидин-2-ону (I-12 Z-конфігурації);
(3R,4S)-3-[(Z)-4-бензоїлокси-3-(4-фторфеніл)бут-2-еніл]-1-(4-фторфеніл)-4-(4-гідроксифеніл)азетидин-2-ону (I-13 Z-конфігурації);
(3R,4S)-3-[(Z)-4-(4-фторбензоїлокси)-3-(4-фторфеніл)бут-2-еніл]-1-(4-фторфеніл)-4-(4-гідроксифеніл)азетидин-2-ону (I-14 Z-конфігурації);
(3R,4S)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-(4-метилбензоїлокси)бут-2-еніл]-4-(4-гідроксифеніл)азетидин-2-ону (I-15 Z-конфігурації);
(3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфеніл)бут-2-еніл]-4-(4-бензоїлоксифеніл)-1-(4-фторфеніл)азетидин-2-ону (I-16 Z-конфігурації);
(3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфеніл)бут-2-еніл]-1-(4-фторфеніл)-4-(4-метоксифеніл)азетидин-2-ону (I-17 Z-конфігурації);
(3R,4S)-3-[(Е)-4-ацетокси-3-(4-фторфеніл)бут-2-еніл]-1-(4-фторфеніл)-4-(4-метоксифеніл)азетидин-2-ону (I-17 Е-конфігурації).
18. Спосіб одержання сполуки, представленої формулою (І), за п. 1, в якому здійснюють зняття захисту сполуки, представленої формулою V, в лужних умовах:
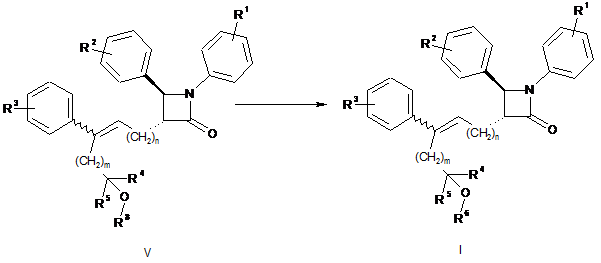 ,
,
де R1, R2, R3, R4, R5, R6, m і n є такими, як визначено в п. 1, R8 означає гідроксилзахисну групу, таку як ацетил, трет-бутилдиметилсиліл (TBDMS), триметилсиліл (TMS), трет-бутилдифенілсиліл (TBDPS) або таке інше.
19. Фармацевтична композиція, що містить ефективну кількість сполуки, представленої формулою (І), або її фармацевтично прийнятної солі за будь-яким із пп. 1-17.
20. Застосування сполуки за будь-яким із пп. 1-17 для одержання лікарського засобу для зниження рівнів сироваткового холестерину.
21. Спосіб одержання сполуки формули V, як визначено в п. 18, в якому здійснюють обробку сполуки, представленої формулою IV, N,О-біс(триметилсиліл)ацетамідом і подальшу циклізацію одержаного силілованого продукту:
 ,
,
де R1, R2, R3, R4, R5, R8, m і n є такими, як визначено в п. 18.
22. Сполука, представлена формулою V:
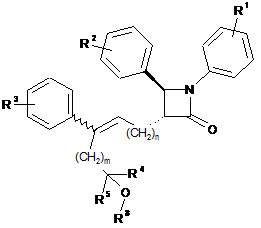 , V
, V
де R1, R2, R3, R4, R5, R8, m і n є такими, як визначено в п. 21.
23. Сполука, представлена формулою IV:
 , IV
, IV
де R1, R2, R3, R4, R5, R8, m і n є такими, як визначено в п. 21.
Текст
Реферат: Даним винаходом запропоноване одержання азетидинонових сполук і медичне застосування зазначених сполук. Конкретніше, в описі запропоновані азетидинонові сполуки, представлені 1 2 3 4 5 6 формулою (І), де R , R , R , R , R і R визначені в описі, і способи одержання таких сполук. Сполуки за даним винаходом можуть знижувати рівні загального холестерину (ТС) і холестерину ліпопротеїнів низької густини (LDL-C) у плазмі і можуть бути використані для лікування або профілактики атеросклерозу, какергазії кровоносних судин, серцевої UA 105053 C2 (12) UA 105053 C2 недостатності, хвороби коронарних артерій, ангіокардіопатії, інфаркту міокарда, стенокардії і гіперліпідемії і гіперхолестеринемії, і такого іншого. Даним винаходом також запропонований спосіб одержання сполук формули (І) і проміжних сполук. R R R 1 2 N 3 (CH2)n (CH2)m R R 5 O 4 O R 6 (I) UA 105053 C2 5 10 15 20 25 30 35 40 45 50 55 Опис Галузь техніки, до якої належить винахід Даний винахід стосується нових азетидинонових сполук, як засобу, що знижує сироватковий холестерин, і лікування захворювань шляхом введення азетидинонових сполук. Даний винахід також стосується способів одержання азетидинонових сполук. Рівень техніки винаходу Атеросклеротичне захворювання коронарних артерій є основною причиною смерті і захворюваності, а також значної витрати ресурсів охорони здоров’я в західному світі. Добре відомо, що холестеринові ефіри є основним фактором ризику атеросклеротичних уражень, а також основною формою відкладання холестерину в клітинах стінок артерій. Регуляції гомеостазу холестерину в організмах людей і тварин включають регуляції харчового холестерину і регуляції біосинтезу холестерину, біосинтезу жовчної кислоти і метаболізму ліпопротеїну плазми, що містить холестерин. Холестерин харчового і жовчного походження поглинається з кишечнику і надходить до кровотоку у вигляді компонента хіломікронів. В іншому аспекті, холестерин біосинтезується і метаболізується печінкою і, отже, є основним детермінантом рівнів холестерину плазми. Печінка є ділянкою синтезу і секреції ліпопротеїну дуже низької густини (VLDL), і потім VLDL метаболізує до ліпопротеїну низької густини (LDL) у кровотоці. LDL є основною формою холестерину з ліпопротеїном у плазмі, і підвищення концентрації LDL пов’язане зі зростанням атеросклерозу. Незалежно від того, що саме мають на увазі, якщо кишкова абсорбція холестерину знижується, менше холестерину буде надходити до печінки, що призводить до зниження продукування печінкового ліпопротеїну (VLDL), так само, як і до зростання печінкового кліренсу холестерину плазми. У цей час численні клінічні дослідження наочно продемонстрували, що зростання загального рівня сироваткового холестерину є одним з основних факторів ризику захворювання коронарних артерій. Чим вищим є рівень загального сироваткового холестерину, тим вищим є ризик і раніше наступає атеросклероз. При зниженні загального сироваткового холестерину на 1%, ризик настання захворювання коронарних артерій може бути знижений на 2%. Таким чином, інгібування утворення холестеринових ефірів і зниження сироваткового холестерину може пригнічувати розвиток формування атеросклеротичних уражень, знижувати акумуляцію холестеринових ефірів в артеріальних стінках і запобігати кишковій абсорбції харчового холестерину. Навіть при існуючому широкому діапазоні терапевтичних засобів, таких як статини, наприклад, симвастатин і флувастатин, речовина, що зв’язує жовчні кислоти, фібрати, аналоги нікотинової кислоти, значна частина гіперхолестеринемічних пацієнтів не здатна досягнути заданих рівнів холестерину, або взаємодії лікарських засобів між собою, або ненадійність препарату унеможливлюють тривале застосування, необхідне для досягнення заданих рівнів. Тому все ще зберігається потреба в розробці додаткових засобів, які є ефективнішими і краще переносяться. Були описані сполуки, що мають таку інгібуючу активність стосовно абсорбції холестерину, див., наприклад, сполуки, описані в WO 93/02048, WO 94/17038, WO 95/08532, WO 95/26334, WO 95/35277, WO 96/16037, WO 96/19450, WO 97/16455, WO 02/50027, WO 02/50060, WO 02/50068, WO 02/50090, WO 02/66464, WO 04/000803, WO 04/000804, WO04/000805, США 5756470, США 5767115 і США RE37721. Переважно представлені азетидинонові сполуки для зниження холестерину і/або інгібування формування уражень стінок артерій у ссавців. Даний винахід ґрунтується на наведеному вище відкритті несподіваного інгібування абсорбції холестерину похідними 2-азетидинону. Відповідно до даного винаходу синтезовані і структурно модифіковані такі азетидинонові сполуки, щоб знайти азетидинонові сполуки з ефективнішим інгібуючим ефектом стосовно холестерину. Сполуки даного винаходу не описані ні в одній із наведених вище заявок. Даний винахід додатково стосується застосування азетидинонових сполук даного винаходу для зниження рівнів сироваткового холестерину. Стислий опис винаходу Одним із завдань даного винаходу є розробка нових засобів, що знижують сироватковий холестерин, тобто азетидинонових сполук або їхніх фармацевтично прийнятних солей. Іншим завданням даного винаходу є розкриття способів одержання зазначених азетидинонових сполук. Сполуками даного винаходу є сполуки, представлені формулою: 1 UA 105053 C2 Формула (I) 5 10 15 20 25 30 35 або їхні фармацевтично прийнятні солі, де: 1 R означає 1-3 замісники, незалежно вибрані з групи, що складається з водню, галогену, трифторметилу, ціано, С1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, гідроксилу, С1-С6алкокси, 7 бензилокси і -OCOR ; 2 R означає 1-3 замісники, незалежно вибрані з групи, що складається з водню, галогену, трифторметилу, ціано, С1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, гідроксилу, С1-С6алкокси, 7 С6-С10арилокси, (С6-С10арил)метокси і -OCOR ; 3 R означає 1-3 замісники, незалежно вибрані з групи, що складається з водню, галогену, трифторметилу, ціано, С1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, С1-С6алкокси і бензилокси; 4 R вибирають із групи, що складається з водню, С1-С6алкілу, С2-С6алкенілу і С3С6циклоалкілу; 5 R вибирають із групи, що складається з водню, С1-С6алкілу, С2-С6алкенілу і С3С6циклоалкілу; 6 7 R означає водень або -COR ; 7 R означає С1-С10алкіл, феніл або феніл, заміщений, принаймні, одним замісником, вибраним із групи, що складається з галогену, трифторметилу, ціано, гідроксилу, С 1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, С1-С6алкокси, фенокси і бензилокси; m дорівнює 0, 1, 2 або 3; n дорівнює 1, 2 або 3; і вуглець-вуглецевий подвійний зв’язок має Z-конфігурацію або Е-конфігурацію. У зазначеному вище варіанті здійснення даного винаходу, “галоген” включає фтор, хлор, бром і йод; “С1-С6алкіл” включає метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, н-пентил, ізопентил, неопентил, н-гексил, ізогексил, неогексил; “С2-С6алкеніл” включає вініл, пропеніл, аліл, бутеніл, пентеніл, гексеніл; “С3-С6циклоалкіл” включає циклопропіл, циклобутил, циклопентил, циклогексил; “С1-С6алкокси” включає метокси, етокси, н-пропокси, ізопропокси, нбутокси, ізобутокси, трет-бутокси, н-пентокси, ізопентокси, неопентокси, н-гексокси, ізогексокси, неогексокси. Інший аспект даного винаходу стосується проміжних сполук для одержання сполуки формули (I), сполуки, представленої формулою (III): . де: 3 R означає 1-3 замісники, незалежно вибрані з групи, що складається з водню, галогену, трифторметилу, ціано, С1-С6алкілу, С2-С6алкенілу, С3-С6циклоалкілу, С1-С6алкокси і бензилокси; 4 R вибирають із групи, що складається з водню, С1-С6алкілу, С2-С6алкенілу і С3С6циклоалкілу; 5 R вибирають із групи, що складається з водню, С1-С6алкілу, С2-С6алкенілу і С3С6циклоалкілу; 2 UA 105053 C2 8 5 R означає захисну групу гідроксилу, таку як ацетил, трет-бутилдиметилсиліл (TBDMS), триметилсиліл (TMS), трет-бутилдифенілсиліл (TBDPS) або таке інше; m дорівнює 0, 1, 2 або 3; n дорівнює 1, 2 або 3; і вуглець-вуглецевий подвійний зв’язок має Z-конфігурацію або Е-конфігурацію. Сполуки, представленої формулою V: , 1 2 3 4 5 8 де R , R , R , R , R , R , m і n є такими, як визначено вище. Сполуки, представленої формулою IV: 10 15 , 1 2 3 4 5 8 де R , R , R , R , R , R , m і n є такими, як визначено вище. Сполуки, представленої формулою L: , 3 4 5 8 де R , R , R , R , m і n є такими, як визначено вище. Сполуки, представленої формулою K: , 3 4 5 8 9 де R , R , R , R , m і n є такими, як визначено вище і R означає метил або етил. Сполуки, представленої формулою J: 3 UA 105053 C2 , 3 4 5 8 9 де R , R , R , R , R , m і n є такими, як визначено вище. Сполуки, представленої формулою Н: 5 10 , 3 4 5 8 9 де R , R , R , R , R , m і n є такими, як визначено вище. Сполуки, представленої формулою G: , 3 4 5 8 де R , R , R , R , m і n є такими, як визначено вище, X означає галоген, тобто, фтор, хлор, бром або йод. Сполуки, представленої формулою F: , 3 4 5 8 де R , R , R , R , m і n є такими, як визначено вище. Сполуки, представленої формулою D: 15 20 25 , 3 4 5 8 де R , R , R , R , m і n є такими, як визначено вище. Крім того, у зазначених вище проміжних сполуках із вуглець-вуглецевим подвійним зв’язком, вуглець-вуглецевий подвійний зв’язок має Z-конфігурацію або Е-конфігурацію. У ще одному аспекті даний винахід стосується фармацевтичної композиції, що містить ефективну кількість сполуки, представленої формулою (I), та її фармацевтично прийнятної солі. Фармацевтична композиція даного винаходу додатково містить фармацевтично прийнятні носії, сумісні зі сполукою формули (I). Сполука формули (I) може бути введена у звичайних дозованих формах, переважно, пероральних дозованих формах, таких як капсули, таблетки, порошки, плоскі капсули, суспензії або розчини. Дозована форма і фармацевтична композиція можуть бути одержані з використанням традиційних фармацевтично прийнятних ексципієнтів і домішок і застосуванням традиційних технологій. Фармацевтично прийнятні ексципієнти і 4 UA 105053 C2 5 10 15 20 25 30 35 40 45 50 55 домішки включають нетоксичні сумісні наповнювачі, зв’язувальні речовини, дезінтегрувальні агенти, буфери, консерванти, антиоксиданти, лубриканти, коригенти, загусники, барвники, емульгатори і таке інше. В іншому аспекті даний винахід стосується застосування сполуки формули (I) в одержанні лікарського засобу для зниження рівнів сироваткового холестерину. Даний винахід також стосується способу зниження сироваткового холестерину, що включає введення ефективної кількості сполуки формули (I), тобто, застосування сполуки даного винаходу у ролі лікарського засобу для зниження рівнів сироваткового холестерину. Сполука даного винаходу може знижувати рівні загального холестерину (TC) і холестерину ліпопротеїнів низької густини (LDL-C) у плазмі, і може бути використана як лікарський засіб для зниження холестерину в крові. Таким чином, сполука даного винаходу може бути використана для лікування або профілактики атеросклерозу, судинного порушення, серцевої недостатності, хвороби коронарних артерій, серцево-судинного захворювання, інфаркту міокарда, стенокардії і гіперліпідемії, гіперхолестеринемії і такого іншого. Як використано в даному описі, ряд термінів визначається таким чином. “Галоген” означає фтор, хлор, бром і йод. “Алкіл”, коли використовується як замісник або частина замісника, означає лінійний або розгалужений аліфатичний вуглеводневий замісник. Найпереважнішим алкілом є C1-С6алкіл, якщо не зазначено інакше. Приклади лінійного або розгалуженого C 1-С6алкілу включають, але не як обмеження, метил, етил, н-пропіл, 2-пропіл, н-бутил, ізобутил, трет-бутил, гексил і таке інше. “Алкеніл”, коли використовується як замісник або частина замісника, означає аліфатичний вуглеводневий замісник із, принаймні, одним вуглець-вуглецевим подвійним зв’язком і може бути лінійним або розгалуженим. Найбільш переважним алкенілом є C 2-С6алкеніл. Зазначений замісник може містити множинні подвійні зв’язки в основному ланцюгу, які можуть незалежно мати Е-конфігурацію або Z-конфігурацію. Приклади зазначеного алкенілу включають, але не як обмеження, вініл, пропеніл, аліл і таке інше. “Циклоалкіл” означає насичене або частково насичене окреме, конденсоване або спіровуглецеве кільце. Переважно, циклоалкіл являє собою кільце з 3-6 атомами вуглецю. Приклади включають, але не як обмеження, циклопропіл, циклобутил, циклопентил, циклогексил і таке інше. “Алкокси” означає замісник (алкіл-О-), в якому алкіл відповідає зазначеному вище визначенню. Переважно, алкокси означає C1-С6алкокси. Приклади включають, але не як обмеження, метокси, етокси, н-пропокси, ізопропокси, н-бутокси, ізобутокси, трет-бутокси і таке інше. Термін “арил”, коли використовується окремо або в комбінації, означає ароматичну вуглецево-кільцеву систему з одним або двома кільцями, в якій зазначені кільця конденсаційнозв’язані. Термін “арил” включає ароматичні групи, такі як феніл, нафтил і тетрагідронафтил. Переважним арилом є С6-С10арил, переважнішим арилом є феніл. Зазначений “арил” може мати один або декілька замісників, таких як C1-С6алкіл, гідроксил, галоген, алкілгалогенід, нітро, ціано, C1-С6алкокси, C1-С6алкіламіно і таке інше. Даний винахід включає сполуку формули (I) та її різні можливі ізомери, які включають недзеркальні ізомери, дзеркальні ізомери і геометричні ізомери, такі як “Z-” або “Е-” конфігураційні ізомери. Крім того, термін “фармацевтично прийнятна сіль” означає сіль сполуки, що має початкову біологічну активність і придатну для медичного застосування. Фармацевтично прийнятна сіль сполуки формули (I) є сіллю, утвореною з лужним металом. Лужний метал, який може утворювати фармацевтично прийнятну сіль зі сполукою формули (I), включає літій, натрій, калій, магній, кальцій, алюміній, цинк і таке інше. Сполуку формули (I) переважно вводять перорально. Автори виявили, що сполука даного винаходу може знижувати рівні сироваткового холестерину. Одержання азетидинонових сполук Інший аспект даного винаходу додатково стосується способу одержання сполуки формули (I), що включає зняття захисту сполуки, представленої формулою V, у лужних умовах: 5 UA 105053 C2 , 1 5 10 2 3 4 5 8 8 де R , R , R , R , R , R , m і n є такими, як визначено вище, R означає гідроксил-захисну групу, таку як ацетил, трет-бутилдиметилсиліл (TBDMS), триметилсиліл (TMS), трет2 бутилдифенілсиліл (TBDPS) або таке інше; коли R означає гідроксил, зазначений замісник є 2 необов’язково заміщеним, і, після гідролізу сполуки формули V, видалення захисної групи на R , альтернативно, за необхідності, гідроксил додатково перетворюють в інший замісник, 2 зазначений вище для R . Сполука формули V може бути одержана наступним способом, що включає обробку сполуки, представленої формулою IV, N,О-біс(триметилсиліл)ацетамідом і подальшу циклізацію одержаного силілованого продукту: , 15 20 1 2 3 4 5 8 де R , R , R , R , R , R , m і n є такими, як визначено вище. Сполука формули IV, використана вище, може бути одержана наступним способом, за яким сполуку, представлену формулою III, розчиняють у придатному безводному розчиннику (такому як безводний метиленхлорид), потім конденсують з іміном, представленим формулою II, в умовах захисту в атмосфері сухого інертного газу (такого як азот), у присутності кислоти Льюїса TiCl4 у ролі каталізатора: . 25 Сполука формули III, використана вище, може бути одержана наступним способом, за яким у безводному інертному розчиннику (такому як CH2Cl2 або ТГФ) кислота, представлена формулою L, і ізобутилхлорформіат утворюють змішаний ангідрид, і потім здійснюють конденсацію з (S)-4-феніл-2-оксазолідиноном у присутності придатного каталізатора, такого як натрійбіс(триметилсиліл)амід або 4-диметиламінопіридин (DMAP), переважно, натрійбіс(триметилсиліл)амід), при температурі від -60С до -25С: 30 6 UA 105053 C2 . 5 Сполука формули L, використане вище, може бути одержана наступним способом, за яким сполуку, представлену формулою К, гідролізують у лужних умовах і потім підкисляють, з одержанням сполуки формули L: , 9 10 де R означає метил або етил. Сполука формули К, використана вище, може бути одержана наступним способом, за яким сполуку, представлену формулою J, декарбоксилують нагріванням, з одержанням сполуки з однією складноефірною групою, тобто сполуки формули К: . 15 Сполука формули J, використана вище, може бути одержана наступним способом, за яким сполуку, представлену формулою Н, гідролізують за однією складноефірною групою, регулюючи придатні реакційні умови, що надає сполуку формули J: . 20 Сполука формули Н, використана вище, може бути одержана наступним способом, за яким сполуку, представлену формулою G, піддають взаємодії з діефіром малонової кислоти, з одержанням складнодіефірної сполуки формули Н: 25 , 30 де X означає галоген, тобто фтор, хлор, бром або йод. Сполука формули G, використана вище, може бути одержана наступним способом, за яким гідроксил сполуки, представленої формулою F, галогенують, обробкою галогенуючим агентом, 7 UA 105053 C2 що дає сполуку формули G: . 5 Сполука формули F, використана вище, може бути одержана наступним способом, за яким складнодіефірну групу сполуки, представленої формулою D, відновлюють придатним відновлювальним агентом (таким як диізобутилалюмогідрид (DIBAH)), з одержанням сполуки формули F: . 10 Сполука формули D, використана вище, може бути одержана наступним способом, за яким сполуку, представлену формулою С, піддають реакції Віттіга-Хорнера, з одержанням сполуки формули D, яку додатково розділяють, з одержанням Z-конфігурації і Е-конфігурації: 15 . 20 Сполука формули С, використана вище, може бути одержана наступним способом, за яким, у придатному розчиннику, гідроксил сполуки, представленої формулою В, захищають у присутності придатних каталізаторів (таких як 4-диметиламінопіридин (DMAP)), з одержанням сполуки формули С: . 25 Сполука формули В, використана вище, може бути одержана наступним способом, за яким складнодіефірну групу сполуки, представлену формулою А, гідролізують у лужних умовах, з одержанням відповідного спирту, тобто сполуки формули В: . 30 8 UA 105053 C2 Сполука формули А, використана вище, може бути одержана наступним способом, за яким галогенід піддають взаємодії з ацетатом натрію, з одержанням сполуки формули А: . 5 10 15 20 25 30 Даний винахід додатково ілюструється наступними прикладами. Приклади охоплюють одержання конкретних сполук, представлених формулою (I), і відповідні дані зі структурної ідентифікації. Потрібно зазначити, що наступні приклади є виключно ілюстративними, і ніяким чином не можуть розглядатися, як такі, що обмежують даний винахід. У наступних прикладах, якщо не зазначено інакше, всі температури дані в градусах за Цельсієм і; якщо не зазначено особливо, всі вихідні речовини і реагенти є комерційно доступними. Комерційно доступні вихідні речовини і реагенти використовують безпосередньо, без додаткового очищення, якщо не зазначено інакше. Лабораторний скляний посуд сушать у сушильній шафі і/або при нагріванні. Реакції відстежують на пластинах із кварцового скла-60 F254 (0,25 мм) (ТШХ), які аналізують методом тонкошарової хроматографії і виявляють при відповідному співвідношенні (V/V) розчинників. Закінчення реакції визначають за зникненням вихідних речовини ТШХ. 1 Спектр H-ЯМР знімають, використовуючи прилад Bruker (400 МГц). Хімічний зсув 1 наведений у м. ч. Тетраметилсилан використовують як внутрішній стандарт (0,00 м. ч.). H-ЯМР представлений таким чином: с = синглет, д = дублет, т = триплет), м = мультиплет, розшир. = розширений, пд = подвійний дублет, пт = подвійний триплет. Коли наводиться константа зв’язку, одиницею є Гц. Мас-спектр визначають на приладі РХ/МС з іонізацією ESI або APCI. Температури плавлення були некоректованими. Наступні приклади є такими, що тільки ілюструють спосіб синтезу специфічних сполук даного винаходу. Однак не існує обмежень для способу синтезу. Сполуки, не перераховані в даному описі вище, також можуть бути одержані шляхом аналогічного синтезу при виборі відповідних вихідних речовин і за необхідного регулювання ряду реакційних умов, які можуть бути загальновідомі в даній галузі. Синтез 1 3 2 4 5 6 8 Як для сполуки формули (I), коли R =R означає F, R означає OH, R =R =R означає Н, R 9 означає TBDMS, R означає Me, X означає Cl, m дорівнює 0, n дорівнює 1, відповідна сполука може бути синтезована з використанням способу, представленого наступною схемою синтезу. 35 9 UA 105053 C2 Сполука II-1 може бути синтезована наступним способом: 5 10 15 20 25 30 Детальний опис варіантів здійснення Приклад 1 Одержання [2-(4-фторфеніл)-2-оксоетил]ацетату (сполука А-1) У 3-літрову колбу додають 400 грами (2,32 моль) 2-хлор-1-(4-фторфеніл)етанону, 1 літр N,Nдиметилформаміду і 265 грами (3,23 моль) безводного ацетату натрію. Суміш перемішують і нагрівають до 90С, і взаємодія продовжується 10 годин. Після завершення взаємодії, нагрівання припиняють. Реакційний розчин охолоджують до кімнатної температури та екстрагують етилацетатом (600 мл 6). Органічні фази об’єднують, промивають тричі насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха. Залишок кристалізують зі змішаного розчинника толуол/петролейний ефір і сушать, з одержанням 357 грамів (1,82 моль) сполуки А-1 із виходом 78,5%. 1 H ЯМР (400 МГц, CDCl3): 2,23 (с, 3H, -CH3), 5,30 (с, 2H, -CH2-), 7,14-7,19 (м, 2H, Cpr-H), 7,93-7,97 (м, 2H, Cpr-H); МС (m/z): 197 [M+Н]. Приклад 2 Одержання 1-(4-фторфеніл)-2-гідроксіетанону (сполука В-1) У 2-літрову колбу додають 321,3 грами (1,64 моль) сполуки А-1, 1 літр метанолу, 18 грами (0,13 моль) карбонату калію. Суміш перемішують при кімнатній температурі, і взаємодія продовжується 2 години. Суміш екстрагують 5 разів етилацетатом (800 мл 5). Органічні фази об’єднують, сушать над безводним сульфатом натрію і концентрують досуха, з одержанням 211,0 грамів (1,37 моль) сполуки В-1 із виходом 83,5%. 10 UA 105053 C2 H ЯМР (400 МГц, CDCl3): 3,46 (розшир. с, 1H, -OH), 4,85 (с, 2H, -CH2-), 7,17-7,21 (м, 2H, Cpr-H), 7,95-7,98 (м, 2H, Cpr-H), Приклад 3 Одержання 2-трет-бутилдиметилсилілокси-1-(4-фторфеніл)етанону (сполуки С-1) 1 5 10 15 20 25 30 35 40 45 У 5-літрову колбу додають 187,8 грами (1,22 моль) сполуки В-1, 1,2 літри ацетонітрилу, 1,8 літри дихлорметану, 17,6 грами (0,14 моль) 4-диметиламінопіридину (DMAP), 200 мл (1,44 моль) триетиламіну і 258,4 грами (1,72 моль) трет-бутилдиметилсиланхлориду (TBDMSCl). Суміш перемішують при кімнатній температурі, і взаємодія продовжується 10 годин. Потім 136 мл (1 моль/л) хлористоводневої кислоти додають по краплях у реакційний розчин. Після додавання, реакційний розчин додатково перемішують 20 хвилин і потім екстрагують 3 рази дихлорметаном (400 мл 3). Органічні фази об’єднують і промивають 5 разів насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха. Залишок очищають колонковою хроматографією (суміш петролейний ефір/дихлорметан=1,5/1), з одержанням 219,5 грамів (0,82 моль) сполуки С-1 з виходом 67,2%. 1 H ЯМР (400 МГц, CDCl3): 0,16 (с, 6H, 2-CH3), 0,93 (с, 9H, 3-CH3), 4,86 (с, 2H, -CH2-), 7,117,15 (м, 2H, Cpr-H), 7,96-8,00 (м, 2H, Cpr-H); МС (m/z): 269 [M+Н]. Приклад 4 Одержання етил-4-трет-бутилдиметилсилілокси-3-(4-фторфеніл)бут-2-еноату (сполука D-1) У 5-літрову колбу додають 27,0 грами (1,19 моль) триетилфосфоноацетату і 1,3 літри тетрагідрофурану. Суміш перемішують і додають по краплях 0,82 літри (2 моль/л) натрійбіс(триметилсиліл)аміду приблизно при -30C. Після додавання, суміш нагрівають до кімнатної температури, і взаємодія продовжується 1 годину. Потім додають по краплях 192,1 грами (0,72 моль) сполуки С-1 (розчиненої в 450 мл тетрагідрофурану) при температурі близько -60C. Після додавання, температуру підіймають до кімнатної температури, і взаємодія продовжується 1 годину. Одержану суміш екстрагують 3 рази етилацетатом (250 мл 3), сушать над безводним сульфатом натрію і концентрують досуха. Продукт очищають колонковою хроматографією (петролейний ефір), з одержанням 125 грамів (0,37 моль, вихід 51,4%) сполуки D-1 (Z-конфігурації) і 67,6 грамів (0,20 моль, вихід 27,8%) сполуки D-1 (Е-конфігурації). Сполука D-1 (Z-конфігурації): 1 H ЯМР (400 МГц, CDCl3): 0,10 (с, 6H, 2-CH3), 0,65 (с, 9H, 3-CH3), 1,21 (т, 3H, J=7,2 Гц, CH3), 4,11 (кв, 2H, J=7,2 Гц, -CH2-), 5,06 (с, 2H, -CH2-), 5,89 (с, 1H, -CH-), 6,90-6,95 (м, 2H, Cpr-H), 7,35-7,38 (м, 2H, Cpr-H); МС (m/z): 339 [M+Н]. Сполуки D-1 (Е-конфігурації): 1 H ЯМР (400 МГц, CDCl3): 0,10 (с, 6H, 2-CH3), 0,94 (с, 9H, 3-CH3), 1,10 (т, 3H, J=7,2 Гц, CH3), 4,02 (кв, 2H, J=7,2 Гц, -CH2-), 4,30 (с, 2H, -CH2-), 6,20 (с, 1H, -CH-), 7,02-7,06 (м, 2H, Cpr-H), 7,13-7,16 (м, 2H, Cpr-H); МС (m/z): 339 [M+Н]. Приклад 5 Одержання (Z)-4-трет-бутилдиметилсилілокси-3-(4-фторфеніл)бут-2-ен-1-олу (сполука F-1, Z-конфігурації) У 5-літрову колбу додають 120 грами (0,36 моль) сполуки D-1 (Z-конфігурації) і 1,0 літр 11 UA 105053 C2 5 10 дихлорметану. Потім додають по краплях 0,8 літри (1,125 моль/л) розчину диізобутилалюмогідриду (DIBAH) у н-гексані, приблизно при -60C. Температуру підіймають до кімнатної температури, і взаємодія продовжується 30 хвилин. До реакційного розчину додають 500 мл дихлорметану. Одержану суміш послідовно промивають насиченим розчином хлориду амонію, потім насиченим розчином солі 3 рази, сушать над безводним сульфатом натрію і концентрують досуха, з одержанням 103,6 грами (0,35 моль) сполуки F-1 (Z-конфігурації) із виходом 97,2%. 1 H ЯМР (400 МГц, CDCl3): 0,07 (с, 6H, 2-CH3), 0,86 (с, 9H, 3-CH3), 2,25 (т, 1H, J=5,8 Гц, OH), 4,36 (т, 2H, J=6,3 Гц, -CH2-), 4,54 (с, 2H, -CH2-), 5,99 (т, 1H, J-6,8 Гц, -CH-), 6,98-7,02 (м, 2H, Cpr-H), 7,32-7,36 (м, 2H, Cpr-H), Приклад 6 Одержання (Е)-4-трет-бутилдиметилсилілокси-3-(4-фторфеніл)бут-2-ен-1-олу (сполука F-1, Е-конфігурації) 15 20 Зазначену сполуку одержують з етил-(Е)-4-трет-бутилдиметилсилілокси-3-(4фторфеніл)бут-2-еноату (сполуки D-1, Е-конфігурації) способом, аналогічним до описаного в прикладі 5. 1 H ЯМР (400 МГЦ, CDCl3): 0,09 (с, 6H, 2-CH3), 0,94 (с, 9H, 3-CH3), 4,12-4,14 (м, 2H, -CH2-), 4,34 (с, 2H, -CH2-), 6,01 (т, 1H, J=6,8 Гц, -CH-), 7,05-7,09 (м, 2H, Cpr-H), 7,16-7,19 (м, 2H, Cpr-H). Приклад 7 Одержання трет-бутил[(Z)-4-хлор-2-(4-фторфеніл)бут-2-енокси]диметилсилан (сполуки G-1, Z-конфігурації) 25 30 35 40 У 5-літрову колбу додають 100,6 грами (0,34 моль) сполуки F-1 (Z-конфігурацію), 1,6 літри дихлорметану, 10,5 грами (0,085 моль) 4-диметиламінопіридину і 182 мл диізопропілетиламіну. Суміш перемішують у захисній атмосфері азоту, додають по краплях 74,3 грами (0,39 моль) 4толуолсульфонілхлориду (TsCl) (розчиненого в 800 мл дихлорметану), приблизно при -20C. Розчин нагрівають до кімнатної температури, і взаємодія продовжується 12 годин. Потім реакційний розчин підкисляють до pH=4 2 моль/л хлористоводневої кислоти. Реакційний розчин перемішують 30 хвилин, потім дають розшаруватися. Водну фазу екстрагують 2 рази дихлорметаном (100 мл 2). Одержані органічні фази об’єднують, промивають 3 рази насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха, з одержанням 77,5 грамів (0,25 моль) сполуки G-1 (Z-конфігурації) із виходом 73,5%. 1 H ЯМР (400 МГц, CDCl3): 0,06 (с, 6H, 2-CH3), 0,88 (с, 9H, 3-CH3), 4,34 (т, 2H, J=8,0 Гц, CH2-), 4,57 (с, 2H, -CH2-), 5,91 (т, 1H, J=8,0 Гц, -CH-), 6,99-7,03 (м, 2H, Cpr-H), 7,35-7,39 (м, 2H, Cpr-H). Приклад 8 Одержання трет-бутил[(E)-4-хлор-2-(4-фторфеніл)бут-2-енокси]диметилсилану (сполуку G-1, E-конфігурації) 45 12 UA 105053 C2 5 Зазначену в заголовку сполуку одержують з (E)-4-трет-бутилдиметилсилілокси-3-(4фторфеніл)бут-2-ен-1-олу (сполука F-1, E-конфігурації) способом, аналогічним до описаного в прикладі 7. 1 H ЯМР (400 МГц, CDCl3): 0,07 (с, 6H, 2-CH3), 0,91 (с, 9H, 3-CH3), 3,97-3,99 (м, 2H, -CH2-), 4,30 (с, 2H, -CH2-), 5,99 (т, 1H, J=8,0 Гц, -CH-), 7,04-7,09 (м, 2H, Cpr-H), 7,17-7,21 (м, 2H, Cpr-H). Приклад 9 Одержання диметил-2-[(Z)-4-трет-бутилдиметилсилілокси-3-(4-фторфеніл)бут-2еніл]пропандіоату (сполука H-1, Z-конфігурації) 10 15 20 25 У 3-літрову колбу додають 57,2 грами (0,43 моль) диметилмалонату і 1 літр N,Nдиметилформаміду. Суміш перемішують у захисній атмосфері азоту, додають 73,0 грами (0,55 моль) карбонату цезію при кімнатній температурі. Після взаємодії протягом 2 годин при кімнатній температурі додають по краплях 75,5 грами (0,24 моль) сполуки G-1 (Z-конфігурації) (розчиненої в 300 мл N,N-диметилформаміду). Після взаємодії протягом 1 години до реакційного розчину додають 400 мл етилацетату і 100 мл води. Розчину дають розшаруватися. Водний шар екстрагують 3 рази етилацетатом (100 мл 3). Органічні фази об’єднують, промивають 3 рази насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха, з одержанням 96,5 грамів (0,235 моль) сполуки H-1 (Z-конфігурації) із виходом 98%. 1 H ЯМР (400 МГц, ДМСО-d6): 0,01 (с, 6H, 2-CH3), 0,81 (с, 9H, 3-CH3), 2,84 (т, 2H, J=7,6 Гц, -CH2-), 3,50 (т, 1H, J=7,6 Гц, -CH-), 3,73 (с, 6H, 2-CH3), 4,50 (с, 2H, -CH2-), 5,62 (т, 1H, J=7,6 Гц, CH-), 6,93-6,97 (м, 2H, Cpr-H), 7,27-7,31 (м, 2H, Cpr-H); МС (m/z): 411 [M+H]. Приклад 10 Одержання диметил-2-[(E)-4-трет-бутилдиметилсилілокси-3-(4-фторфеніл)бут-2еніл]пропандіоату (сполука H-1, E-конфігурації) 30 40 Зазначену в заголовку сполуку одержують із трет-бутил[(E)-4-хлор-2-(4-фторфеніл)бут-2енокси]диметилсилану (сполука G-1 E-конфігурації) способом, аналогічним до описаного в прикладі 9. 1 H ЯМР (400 МГц, CDCl3): 0,03 (с, 6H, 2-CH3), 0,90 (с, 9H, 3-CH3), 2,54 (т, 2H, J=7,6 Гц, CH2-), 3,39 (т, 1H, J=7,6 Гц, -CH-), 3,71 (с, 6H, 2-CH3), 4,24 (с, 2H, -CH2-), 5,67 (т, 1H, J=7,6 Гц, CH-), 7,02-7,07 (м, 2H, Cpr-H), 7,10-7,14 (м, 2H, Cpr-H); МС (m/z): 411 [M+H]. Приклад 11 Одержання (Z)-6-трет-бутилдиметилсилілокси-5-(4-фторфеніл)-2-метоксикарбонілгекс-4енової кислоти (сполука J-1, Z-конфігурації) 45 У 2-літрову колбу додають 94,0 грами (зі вмістом 75%, 0,23 моль) сполуки H-1 (Zконфігурації) і 0,62 літри етанолу. Потім додають по краплях при кімнатній температурі 85 мл 3 35 13 UA 105053 C2 5 10 15 20 моль/л водного розчину гідроксиду калію. Після взаємодії протягом 1 години, реакційний розчин підкисляють до pН=4 2 моль/л хлористоводневою кислотою. Суміш перемішують 30 хвилин і екстрагують 3 рази етилацетатом (150 мл 3). Органічні фази об’єднують, промивають 3 рази насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха, з одержанням 76,1 грамів (0,19 моль) сполуки J-1 (Z-конфігурації) із виходом 83,8%. 1 H ЯМР (400 МГц, CDCl3): 0,01 (с, 6H, 2-CH3), 0,80 (с, 9H, 3-CH3), 2,84-2,87 (м, 2H, -CH2-), 3,53 (т, 1H, J=7,2 Гц, -CH-), 3,74 (с, 3H, -CH3), 4,49 (с, 2H, -CH2-), 5,62 (т, 1H, J=7,2 Гц, -CH-), 6,926,96 (м, 2H, Cpr-H), 7,23-7,30 (м, 2H, Cpr-H); МС (m/z): 397 [M+H]. Приклад 12 Одержання (E)-6-трет-бутилдиметилсилілокси-5-(4-фторфеніл)-2-метоксикарбонілгекс-4енової кислоти (сполука J-1, E-конфігурації) Зазначену в заголовку сполуку одержують із диметил-2-[(E)-4-трет-бутилдиметилсилілокси3-(4-фторфеніл)бут-2-еніл]пропандіоату (сполука H-1, E-конфігурації) способом, аналогічним до описаного в прикладі 11. 1 H ЯМР (400 МГц, CDCl3): 0,02 (с, 6H, 2-CH3), 0,86 (с, 9H, 3-CH3), 2,56-2,60 (м, 2H, -CH2-), 3,38 (т, 1H, J=7,2 Гц, -CH-), 3,70 (с, 3H, -CH3), 4,20 (с, 2H, -CH2-), 5,66 (т, 1H, J=7,2 Гц, -CH-), 6,997,03 (м, 2H, Cpr-H), 7,06-7,24 (м, 2H, Cpr-H); МС (m/z):419 [M+Na]. Приклад 13 Одержання метил-(Z)-6-трет-бутилдиметилсилілокси-5-(4-фторфеніл)гекс-4-еноату (сполука K-1, Z-конфігурації) 25 30 35 У 2-літрову колбу додають 73,66 грами (0,186 моль) сполуки J-1 (Z-конфігурації), 0,6 літра толуолу і 3,8 мл триетиламіну. Суміш нагрівають до температури кипіння зі зворотним холодильником, і взаємодію здійснюють протягом 5 годин. Одержану суміш екстрагують етилацетатом, промивають насиченим розчином солі, сушать над безводним натрію сульфатом і концентрують досуха, з одержанням 57,02 грами (0,162 моль) сполуки K-1 (Z-конфігурації) з виходом 87,1%. 1 H ЯМР (400 МГц, CDCl3): 0,03 (с, 6H, 2-CH3), 0,84 (с, 9H, 3-CH3), 2,45-2,47 (м, 2H, -CH2-), 2,56-2,61 (м, 2H, -CH2-), 3,69 (с, 3H, -CH3), 4,52 (с, 2H, -CH2-), 5,70 (т, 1H, J=7,2 Гц, -CH-), 6,957,00 (м, 2H, Cpr-H), 7,33-7,36 (м, 2H, Cpr-H); МС (m/z): 353 [M+H]. Приклад 14 Одержання метил-(E)-6-трет-бутилдиметилсилілокси-5-(4-фторфеніл)гекс-4-еноату (сполука K-1, E-конфігурації) 40 45 Зазначену в заголовку сполуку одержують із 6-трет-бутилдиметилсилілокси-5-(4фторфеніл)-2-метоксикарбоніл-4(E)-гексенової кислоти (сполука J-1, E-конфігурації) способом, аналогічним до описаного в прикладі 13. 1 H ЯМР (400 МГц, CDCl3): 0,02 (с, 6H, 2-CH3), 0,88 (с, 9H, 3-CH3), 2,27-2,33 (м, 4H, 2 14 UA 105053 C2 5 10 15 20 CH2-), 3,64 (с, 3H, -CH3), 4,24 (с, 2H, -CH2-), 5,70 (т, 1H, J=7,2 Гц, -CH-), 7,02-7,05 (м, 2H, Cpr-H), 7,10-7,12 (м, 2H, Cpr-H); МС (m/z): 353 [M+H]. Приклад 15 Одержання (Z)-6-трет-бутилдиметилсилілокси-5-(4-фторфеніл)гекс-4-енової кислоти (сполука L-1, Z-конфігурації) В 1-літрову колбу додають 56,07 грами (0,159 моль) сполуку K-1 (Z-конфігурації) і 180 мл етанолу. Потім додають по краплях при кімнатній температурі 54,28 мл (3 моль/л) водного розчину гідроксиду калію. Після взаємодії протягом 1 години, реакційний розчин підкисляють до pН=4 2 моль/л хлористоводневою кислотою. Продовжують перемішування розчину протягом 30 хвилин. Залишок екстрагують 3 рази етилацетатом (60 мл 3). Органічні фази об’єднують, промивають 3 рази насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха, з одержанням 39,88 грамів (0,118 моль) сполуки L-1 (Z-конфігурації) із виходом 74,1%. 1 H ЯМР (400 МГц, CDCl3): 0,03 (с, 6H, 2-CH3), 0,84 (с, 9H, 3-CH3), 2,50-2,54 (м, 2H, -CH2-), 2,60 (т, 2H, -CH2-), 4,52 (с, 2H, -CH2-), 5,74 (т, 1H, J-7,6 Гц, -CH-), 6,95-6,99 (м, 2H, Cpr-H), 7,327,36 (м, 2H, Cpr-H); МС (m/z): 361 [M+Na]. Приклад 16 Одержання (E)-6-трет-бутилдиметилсилілокси-5-(4-фторфеніл)гекс-4-енової кислоти (сполука L-1, E-конфігурації) 25 30 Зазначену в заголовку сполуку одержують з метил-(E)-6-трет-бутилдиметилсилілокси-5-(4фторфеніл)гекс-4-еноату (сполука K-1, E-конфігурації) способом, аналогічним до описаного в прикладі 15. 1 H ЯМР(400 МГц, CDCl3): 0,02 (с, 6H, 2-CH3), 0,88 (с, 9H, 3-CH3), 2,27-2,30 (м, 2H, -CH2-), 2,35-2,39 (м, 2H, -CH2-), 4,24 (с, 2H, -CH2-), 5,71 (т, 1H, J=7,2 Гц, -CH-), 6,95-6,99 (м, 2H, Cpr-H), 7,32-7,36 (м, 2H, Cpr-H); МС (m/z): 361 [M+Na]. Приклад 17 Одержання (4S)-3-[(Z)-6-трет-бутилдиметилсилілокси-5-(4-фторфеніл)гекс-4-еноїл]-4фенілоксазолідин-2-он (сполука III-1, Z-конфігурації) 35 40 45 Стадія 1: В 1-літрову колбу додають 39,21 грами (0,116 моль) сполуки L-1 (Z-конфігурації), 300 мл тетрагідрофурану і 19,0 мл (0,14 моль) ізобутилхлорформіату. Потім додають по краплях 19,3 мл (0,14 моль) триетиламіну при температурі близько -60C. Після додавання, суміш нагрівають до кімнатної температури, і взаємодія продовжується 30 хвилин. Залишок фільтрують, з одержанням змішаного ангідриду в розчині тетрагідрофурану для подальшого використання. Стадія 2: У 3-літрову колбу додають 22,69 грами (0,14 моль) (S)-4-феніл-2-оксазолідону і 0,6 літра тетрагідрофурану. Потім додають по краплях 69,6 мл (2 моль/л) 15 UA 105053 C2 5 10 натрійбіс(триметилсиліл)аміду приблизно при -25C. Взаємодія продовжується 30 хвилин. Потім додають по краплях тетрагідрофурановий розчин змішаного ангідриду, одержаний на стадії 1. Після додавання, суміш нагрівають до кімнатної температури, і взаємодія продовжується 1 годину. Залишок екстрагують 3 рази етилацетатом (150 мл 3). Органічні фази об’єднують, промивають 3 рази насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха, з одержанням 47,62 грамів (0,10 моль) сполуки III-1 (Z-конфігурації), із виходом 85%. 1 H ЯМР (400 МГц, CDCl3): 0,05 (с, 6H, 2-CH3), 0,86 (с, 9H, 3-CH3), 2,59-2,64 (м, 2H, -CH2-), 3,13-3,18 (м, 2H, -CH2-), 4,32-4,35 (м, 1H, -CH2-), 4,52 (с, 2H, -CH2-), 4,74 (т, 1H, J=8,8 Гц, -CH2-), 5,47-5,49 (м, 1H, -CH-), 5,74 (т, 1H, J=7,5 Гц, -CH-), 6,99-7,03 (м, 2H, Cpr-H), 7,31-7,41 (м, 7H, CprH); МС (m/z): 506 [M+Na]. Приклад 18 Одержання (4S)-3-[(E)-6-трет-бутилдиметилсилілокси-5-(4-фторфеніл)гекс-4-еноїл]-4фенілоксазолідин-2-ону (сполука III-1, E-конфігурації) 15 20 25 30 35 40 45 Зазначену в заголовку сполуку одержують із (E)-6-трет-бутилдиметилсилілокси-5-(4фторфеніл)гекс-4-енової кислоти (сполука L-1, E-конфігурації) способом, аналогічним до описаного в прикладі 17. 1 H ЯМР (400 МГц, CDC13): 0,01 (с, 6H, 2-CH3), 0,87 (с, 9H, 3-CH3), 2,23-2,28 (м, 2H, -CH2), 2,94-2,99 (м, 2H, -CH2-), 4,22 (с, 2H, -CH2-), 4,25-4,28 (м, 1H, -CH2-), 4,66 (т, 1H, J=8,8 Гц, -CH2-), 5,36-5,39 (м, 1H, -CH-), 5,69 (т, 1H, J=12 Гц, -CH-), 6,99-7,01 (м, 2H, Cpr-H), 7,06-7,08 (м, 2H, CprH), 7,27-7,37 (м, 5H, Cpr-H); МС (m/z): 506 [M+Na]. Приклад 19 Одержання [4-[(4-фторфеніл)імінометил]феніл]бензоату (сполука II-1) У колбу на 500 мл додають 45,6 грами (0,374 моль) 4-гідроксибензальдегід, 150 мл ацетону і 25,8 грами (0,187 моль) карбонату калію. Потім повільно додають по краплях, при температурі близько 0C, 52,1 мл (0,449 моль) бензоїлхлориду (BzCl). Після додавання, суміш нагрівають до кімнатної температури, і взаємодія продовжується 2 години. Залишок екстрагують 3 рази етилацетатом (150 мл 3). Органічні фази об’єднують, сушать над безводним сульфатом натрію і концентрують досуха, з одержанням 76,08 грамів (0,336 моль) 4-бензоїлоксибензальдегіду. Потім 35,7 мл (0,37 моль) 4-фтораніліну додають по краплях до розчину одержаного 4бензоїлоксибензальдегіду в 300 мл етилацетату. Взаємодія продовжується 1 годину. Реакційну суміш фільтрують. Твердий продукт, що утворився, перекристалізовують з безводного етанолу, з одержанням 60,3 грамів (0,189 моль) білої твердої речовини, а саме, сполуки II-1. 1 H ЯМР (400 МГц, CDCl3): 7,09-7,14 (м, 2H, Cpr-H), 7,23-7,28 (м, 2H, Cpr-H), 7,37-7,39 (м, 2H, Cpr-H), 7,54-7,59 (м, 2H, Cpr-H), 7,67-7,71 (м, 1H, Cpr-H), 7,99-8,02 (м, 2H, Cpr-H), 8,24-8,26 (м, 2H, Cpr-H), 8,49 (с, 1H, -CH-). Приклад 20 Одержання [4-[(Z,1S,2R)-6-трет-бутилдиметилсилілокси-1-(4-фтораніліно)-5-(4-фторфеніл)2-[(4S)-2-оксо-4-фенілоксазолідин-3-карбоніл]гекс-4-еніл]феніл]бензоату (сполука IV-1, Zконфігурації) 16 UA 105053 C2 5 10 15 20 В 1-літрову колбу додають 350 мл дихлорметану і 20 грами порошку молекулярних сит у захисній атмосфері азоту, і потім додають 10,6 мл (95,7 ммоль) тетрахлориду титану і 9,6 мл (0,032 моль) тетраізопропілату титану при температурі близько 0C. Після взаємодії протягом 15 хвилин, додають 47,62 грами (98,6 ммоль) сполуки III-1 (Z-конфігурації) (розчиненої в 60 мл дихлорметану). Після взаємодії протягом 5 хвилин, додають 37,8 мл (0,21 моль) диізопропілетиламіну (DIPEA), приблизно при 0C. Після взаємодії протягом 1 години, реакційний розчин охолоджують приблизно до -20C, додають 34,97 грами (98,6 ммоль) сполуки II-1 (розчиненої в 0,87 літрах дихлорметану). Після взаємодії протягом 4 годин, додають по краплях 29 мл оцтової кислоти і 58 мл (2 моль/л) сірчаної кислоти. Суміш перемішують при кімнатній температурі 30 хвилин і потім екстрагують 3 рази дихлорметаном (120 мл 3). Органічні фази об’єднують, сушать над безводним сульфатом натрію і концентрують досуха. Залишок очищають колонковою хроматографією, з одержанням 43,3 ммоль сполуки IV-1 (Zконфігурації) із виходом 43,9%. 1 H ЯМР (400 МГц, CDCl3): 0,05 (с, 6H, 2-CH3), 0,86 (с, 9H, 3-CH3), 2,60-2,62 (м, 2H, -CH2-), 3,15-3,16 (м, 1H, -CH-), 4,35-4,40 (м, 2H, -CH2-), 4,46-4,52 (м, 2H, -CH2-), 4,53-4,60 (м, 1H, -CH-), 4,72-4,76 (м, 1H, -NH-), 5,74 (т, 1H, J=7,2 Гц, -CH-), 6,80-6,85 (м, 1H, -CH-), 6,99-7,38 (м, 6H, CprH), 7,39-7,41 (м, 8H, Cpr-H), 7,59-7,55 (м, 2H, Cpr-H), 7,69-7,72 (м, 1H, Cpr-H), 8,23-8,25 (м, 2H, Cpr-H); МС (m/z): 803 [M+H]. Приклад 21 Одержання [4-[(E,1S,2R)-6-трет-бутилдиметилсилілокси-1-(4-фтораніліно)-5-(4-фторфеніл)2-[(4S)-2-оксо-4-фенілоксазолідин-3-карбоніл]гекс-4-еніл]феніл]бензоату (сполука IV-1, Eконфігурації) 25 30 35 Зазначену в заголовку сполуку одержують із (4S)-3-[(E)-6-трет-бутилдиметилсилілокси-5-(4фторфеніл)гекс-4-еноїл]-4-фенілоксазолідин-2-ону (сполука III-1, E-конфігурації) способом, аналогічним до описаного в прикладі 20. 1 H ЯМР (400 МГц, CDCl3): 0,01 (с, 6H, 2-CH3), 0,87 (с, 9H, 3-CH3), 2,24-2,26 (м, 2H, -CH2-), 2,96-2,97 (м, 1H, -CH-), 4,28-4,33 (м, 2H, -CH2-), 4,37-4,43 (м, 2H, -CH2-), 4,51-4,58 (м, 1H, -CH-), 4,66-4,70 (м, 1H, -NH-), 5,68 (т, 1H, J=7,2 Гц, -CH-), 6,78-6,83 (м, 1H, -CH-), 6,88-7,25 (м, 6H, CprH), 7,29-7,31 (м, 8H, Cpr-H), 7,52-7,54 (м, 2H, Cpr-H), 7,58-7,60 (м, 1H, Cpr-H), 8,15-8,17 (м, 2H, Cpr-H); МС (m/z): 803 [M+H]. Приклад 22 Одержання (3R,4S)-4-(4-бензоїлоксифеніл)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-третбутилдиметилсилілоксибут-2-еніл]азетидин-2-ону (сполука V-1, Z-конфігурації) (твердий), 50С 40 17 UA 105053 C2 5 10 15 В 1-літрову колбу додають 42,5 ммоль сполуки IV-1 (Z-конфігурації), 350 мл толуолу і 22,93 грами (112,7 ммоль) N,O-біс(триметилсиліл)ацетаміду. Взаємодія продовжується 1 годину приблизно при 50C. Потім додають 1,36 грами (4,3 ммоль) тетрабутиламонійфториду (TBAF). Взаємодія продовжується 3 години при тій же температурі. Після завершення взаємодії, нагрівання припиняють. Після охолодження реакційної системи до кімнатної температури, pН доводять приблизно до 7,0 2 моль/л хлористоводневою кислотою. Одержану суміш екстрагують 300 мл етилацетату, промивають 3 рази насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха. Залишок очищають колонковою хроматографією, з одержанням 33,1 ммоль сполуки V-1 (Z конфігурації) із виходом 77,9%. 1 H ЯМР (400 МГц, CDCl3): 0,10 (с, 6H, 2-CH3), 0,90 (с, 9H, 3-CH3), 2,92-2,96 (м, 2H, -CH2-), 3,31-3,32 (м, 1H, -CH-), 4,59 (д, 1H, J=12,0 Гц, -CH2-), 4,71 (д, 1H, J=12,0 Гц, -CH2-), 4,92 (с, 1H, CH-), 5,78 (т, 1H, J=8,0 Гц, -CH-), 7,00-7,07 (м, 5H, Cpr-H), 7,26-7,38 (м, 5H, Cpr-H), 7,44-7,46 (м, 2H, Cpr-H), 7,56-7,60 (м, 2H, Cpr-H), 7,69-7,71 (м, 1H, Cpr-H), 8,24-8,26 (м, 2H, Cpr-H); МС (m/z): 640 [M+H]. Приклад 23 Одержання (3R,4S)-4-(4-бензоїлоксифеніл)-1-(4-фторфеніл)-3-[(E)-3-(4-фторфеніл)-4-третбутилдиметилсилілоксибут-2-еніл]азетидин-2-ону (сполука V-1, E-конфігурації) (твердий), 50С 20 25 30 Зазначену в заголовку сполуку одержують із [4-[(E,1S,2R)-6-трет-бутилдиметилсилілокси-1(4-фтораніліно)-5-(4-фторфеніл)-2-[(4S)-2-оксо-4-фенілоксазолідин-3-карбоніл]гекс-4еніл]феніл]бензоату (сполука IV-1, E-конфігурації) способом, аналогічним до описаного в прикладі 22. 1 H ЯМР (400 МГц, CDCl3): 0,12 (с, 6H, 2-CH3), 0,93 (с, 9H, 3-CH3), 2,65-2,69 (м, 2H, -CH2-), 3,09-3,10 (м, 1H, -CH-), 4,42 (д, 1H, J=12,0 Гц, -CH2-), 4,54 (д, 1H, J=12,0 Гц, -CH2-), 4,48 (с, 1H, CH-), 5,71 (т, 1H, J=12,0 Гц, -CH-), 6,73-6,75 (м, 5H, Cpr-H), 6,92-6,98 (м, 5H, Cpr-H), 7,02-7,08 (м, 2H, Cpr-H), 7,22-7,25 (м, 5H, Cpr-H); МС (m/z): 640 [M+H]. Приклад 24 Одержання (3R,4S)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]-4-(4гідроксифеніл)азетидин-2-ону (сполука I-1, Z-конфігурації) 35 40 45 Стадія 1: У колбу на 500 мл додають 32,5 ммоль сполуки V-1 (Z-конфігурації), 250 мл метанолу і 4,89 грами (35,8 ммоль) карбонату калію. Суміш перемішують при кімнатній температурі, і взаємодія продовжується 30 хвилин. Після завершення взаємодії, залишок екстрагують 3 рази етилацетатом (300 мл 3). Органічні фази об’єднують, промивають насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха для подальшого використання. Стадія 2: Продукт стадії 1 розчиняють у 200 мл тетрагідрофурану. PН доводять приблизно до 1 6 моль/л хлористоводневою кислотою. Суміш перемішують при кімнатній температурі, і взаємодія продовжується 30 хвилин. Залишок екстрагують 3 рази етилацетатом (250 мл 3). Органічні фази об’єднують, промивають насиченим розчином солі, сушать над безводним 18 UA 105053 C2 5 10 15 20 сульфатом натрію, концентрують досуха та очищають колонковою хроматографією, з 24 одержанням 8,14 грамів (19,3 ммоль) сполуки I-1 (Z-конфігурації) із виходом 59,4%. [a] D=1,67(c=3 мг/мл MeOH), 1 H ЯМР (400 МГц, ДМСО-d6): 2,72-2,84 (м, 2H, -CH2-), 3,20-3,25 (м, 1H, -CH-), 4,39 (с, 2H, CH2-), 4,85 (т, 1H, J=5,2 Гц, -CH-), 4,93 (с, 1H, -OH), 5,80 (т, 1H, J=7,6 Гц, -CH-), 6,73-6,76 (м, 2H, Cpr-H), 7,10-7,20 (м, 4H, Cpr-H), 7,21-7,39 (м, 4H, Cpr-H), 8,40-7,42 (м, 2H, Cpr-H), 9,48 (с, 1H, OH); МС (m/z): 422 [M+H]. Приклад 25 Одержання (3R,4S)-1-(4-фторфеніл)-3-[(E)-3-(4-фторфеніл)-4-гідроксибут-2-еніл]-4-(4гідроксифеніл)азетидин-2-ону (сполука I-1, E-конфігурації) Зазначену в заголовку сполуку одержують із (3R,4S)-4-(4-бензоїлоксифеніл)-1-(4фторфеніл)-3-[(E)-3-(4-фторфеніл)-4-трет-бутилдиметилсилілоксибут-2-еніл]азетидин-2-ону (сполука V-1, E-конфігурації) способом, аналогічним до описаного в прикладі 24. 1 H ЯМР (400 МГц, CDCl3): 2,45-2,57 (м, 2H, -CH2-), 2,98-3,02 (м, 1H, -CH-), 4,22 (с, 2H, -CH2), 4,41 (д, 1H, J=2,3 Гц, -CH-), 5,73 (т, 1H, J=7,2 Гц, -CH-), 6,75-6,77 (м, 2H, Cpr-H), 6,82-6,86 (м, 2H, Cpr-H), 6,98-7,00 (м, 2H, Cpr-H), 7,04-7,07 (м, 2H, Cpr-H), 7,09-7,19 (м, 4H, Cpr-H); МС (m/z): 422 [M+H]. Пр. Сполуки 1 H ЯМР (400 МГц) МС (m/z): 26 (CDCl3): 2,83-2,88 (м, 2H, -CH2-), 3,24-3,28 (м, 1H, -CH-), 3,81 (с, 3H, -CH3), 4,55 (кв, 2H, -CH2-), 4,75 (с, 1H, -CH-), 5,84 (т, 1H, J=8,0 Гц, -CH-), 6,89-6,95 (м, 4H, Cpr-H), 6,97-7,02 (м, 2H, Cpr-H), 7,23-7,28 (м, 6H, Cpr-H); 436 [M+H] 27 (CDCl3): 2,52-2,62 (м, 2H, -CH2-), 3,07-3,11 (м, 1H, -CH-), 3,78 (с, 3H, -CH3), 4,27 (с, 2H, -CH2-), 4,51 (с, 1H, -CH-), 5,81 (т, 1H, J=7,2 Гц, -CH-), 6,87-6,92 (м, 4H, Cpr-H), 7,05-7,07 (м, 2H, Cpr-H), 7,18-7,21 (м, 6H, Cpr-H); 436 [M+H] 19 UA 105053 C2 28 498 [M+H] 29 (CDCl3): 2,54-2,66 (м, 2H, -CH2-), 3,10-3,14 (м, 1H, -CH-), 4,31 (с, 2H, -CH2-), 4,52 (с, 1H, -CH-), 5,83 (т, 1H, J=7,2 Гц, -CH-), 6,91-7,03 (м, 6H, Cpr-H), 7,04-7,10 (м, 2H, Cpr-H), 7,12-7,16 (м, 1H, Cpr-H), 7,18-7,24 (м, 6H, Cpr-H), 7,33-7,38 (м, 2H, Cpr-H); 498 [M+H] 30 (CDCl3): 2,83-2,87 (м, 2H, -CH2-), 3,24-3,28 (м, 1H, -CH-), 4,55 (кв, 2H, -CH2-), 4,74 (с, 1H, -CH-), 5,83 (т, 1H, J=8,0 Гц, -CH-), 6,90-7,01 (м, 6H, Cpr-H), 7,23-7,28 (м, 4H, Cpr-H) , 7,33-7,43 (м, 7H, Cpr-H); 512 [M+H] 31 5 (CDCl3): 2,85-2,89 (м, 2H, -CH2-), 3,26-3,30 (м, 1H, -CH-), 4,55 (кв, 2H, -CH2-), 4,78 (с, 1H, -CH-), 5,85 (т, 1H, J=8,0 Гц, -CH-), 6,93-7,04 (м, 8H, Cpr-H), 7,12-7,16 (м, 1H, Cpr-H), 7,24-7,31 (м, 4H, Cpr-H), 7,33-7,42 (м, 4H, Cpr-H); (CDCl3): 2,51-2,64 (м, 2H, -CH2-), 3,07-3,11 (м, 1H, -CH-), 4,29 (с, 2H, -CH2-), 4,49 (с, 1H, -CH-), 5,04 (с, 2H, -CH2-), 5,81 (т, 1H, J=7,2 Гц, -CH-), 6,88-7,00 (м, 4H, CprH), 7,03-7,09 (м, 2H, Cpr-H), 7,177,23 (м, 6H, Cpr-H), 7,31-7,43 (м, 5H, Cpr-H); 512 [M+H] Приклад 32 Одержання (3R,4S)-4-(4-бензоїлоксифеніл)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4гідроксибут-2-еніл]азетидин-2-ону (сполуки I-5, Z-конфігурації): 20 UA 105053 C2 5 10 У колбу на 250 мл додають 19,0 ммоль сполуки I-1 (Z-конфігурації), 100 мл дихлорметану, 4,72 грами (20,9 ммоль) бензойного ангідриду і 3,3 мл триетиламіну. Суміш перемішують при кімнатній температурі, і взаємодія продовжується 2 години. Після завершення взаємодії, залишок екстрагують 3 рази етилацетатом (300 мл 3). Органічні фази об’єднують, промивають насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха. Залишок очищають колонковою хроматографією, з одержанням 8,04 грамів (15,3 ммоль) сполуки I-5 (Z конфігурації) із виходом 80,6%. 1 H ЯМР (400 МГц, CDCl3): 2,87-2,91 (м, 2H, -CH2-), 3,29-3,34 (м, 1H, -CH-), 4,57 (кв, 2H, CH2-), 4,85 (с, 1H, -CH-), 5,86 (т, 1H, J=8,0 Гц, -CH-), 6,94-7,04 (м, 4H, Cpr-H), 7,24-7,29 (м, 4H, Cpr-H), 7,39-7,43 (м, 4H, Cpr-H), 7,50-7,54 (м, 2H, Cpr-H), 7,64-7,68 (м, 1H, Cpr-H), 8,18-8,20 (м, 2H, Cpr-H); МС (m/z): 526 [M+Н]. Приклад 33 Одержання (3R,4S)-4-(4-ацетоксифеніл)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4гідроксибут-2-еніл]азетидин-2-ону (сполуки I-6 Z-конфігурації) 15 20 25 30 35 40 Сполуку I-1 (Z-конфігурації) використовують як вихідну речовину і сполуку I-6 (Zконфігурації) одержують згідно зі способом прикладу 32. 1 H ЯМР (400 МГц, CDCl3): 2,30 (с, 3H, -CH3), 2,83-2,88 (м, 2H, -CH2-), 3,24-3,29 (м, 1H, -CH-), 4,54 (кв, 2H, -CH2-), 4,81 (с, 1H, -CH-), 5,82 (т, 1H, J=8,0 Гц, -CH-), 6,91-7,01 (м, 4H, Cpr-H), 7,097,12 (м, 2H, Cpr-H), 7,22-7,26 (м, 2H, Cpr-H), 7,34-7,38 (м, 2H, Cpr-H), 7,38-7,41 (м, 2H, Cpr-H); МС (m/z): 464 [M+Н]. Приклад 34 Одержання (3R,4S)-4-(4-бензоїлоксифеніл)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4гідроксипент-2-еніл]азетидин-2-ону (сполуки I-7, Z-конфігурації): Стадія 1: У колбу на 100 мл додають 15.0 ммоль сполуки I-5 (Z-конфігурації), 20 мл дихлорметану і 7,63 грами (18,0 ммоль) перйодинану Десс-Мартіна. Суміш перемішують при кімнатній температурі, і взаємодія продовжується 2 години. Після завершення взаємодії, одержану суміш промивають діетиловим ефіром. Фільтрат концентрують досуха і безпосередньо використовують на наступній стадії без додаткового очищення. Стадія 2: У колбу на 100 мл додають 18,0 ммоль метилмагнійхлориду і 30 мл безводного тетрагідрофурану. Суміш охолоджують до -10С, повільно по краплях додають тетрагідрофурановий розчин продукту стадії 1. Після додавання, суміш нагрівають до 0С, і взаємодія продовжується 2 години. Після завершення взаємодії, залишок нейтралізують насиченим розчином NH4Cl та екстрагують 3 рази дихлорметаном (80 мл 3). Органічні фази об’єднують, промивають насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха. Залишок очищають колонковою хроматографією, з одержанням 2,29 грамів (4,25 ммоль) сполуки I-7 (Z-конфігурації) із виходом 52,6%. 1 H ЯМР (400 МГц, CDCl3): 1,26 (д, 3H, -CH3), 2,80-2,98 (м, 2H, -CH2-), 3,32-3,35 (м, 1H, -CH 21 UA 105053 C2 5 10 15 ), 4,80 (д, 1H, -CH-), 5,03-5,08 (м, 2H, 2-CH-)5 5,56 (т, 1H, J=7,2 Гц, -CH-), 6,93-7,00 (м, 4H, CprH), 7,23-7,32 (м, 6H, Cpr-H), 7,38-7,47 (м, 2H, Cpr-H), 7,50-7,54 (м, 2H, Cpr-H), 7,64-7,67 (м, 1H, Cpr-H), 8,15-8,20 (м, 2H, Cpr-H); МС (m/z): 584 [M-H+HCOOH]. Приклад 35 Одержання (3R,4S)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідроксипент-2-еніл]-4-(4гідроксифеніл)азетидин-2-ону (сполука I-8, Z-конфігурації): Сполуку I-7 (Z-конфігурації) використовують як вихідну речовину, і, згідно зі стадією 1 прикладу 24, видаляють бензоїльну захисну групу, з одержанням сполуки I-8 (Z-конфігурації). 1 H ЯМР (400 МГц, ДМСО-d6): 1,11 (д, 3H, -CH3), 2,76-2,83 (м, 2H, -CH2-), 3,20-3,24 (м, 1H, CH-), 4,91-4,93 (м, 2H, 2-CH-), 4,93 (с, 1H, -OH), 5,45 (т, 1H, J=7,2 Гц, -CH-), 6,74-6,78 (м, 2H, Cpr-H), 7,07-7,19 (м, 4H, Cpr-H), 7,21-7,26 (м, 4H, Cpr-H), 7,33-7,39 (м, 2H, Cpr-H), 9,56 (с, 1H, OH); МС (m/z): 434 [M-H]. Приклад 36 Одержання (3R,4S)-1-(4-фторфеніл)-3-[(Е)-3-(4-фторфеніл)-4-гідроксипент-2-еніл]-4-(4гідроксифеніл)азетидин-2-ону (сполуки I-8, Е-конфігурації): 20 25 30 Сполуку I-1 (Е-конфігурації) використовують як вихідну речовину, і сполуку I-8 (Еконфігурації) одержують відповідно до способів прикладу 32, прикладу 34 і прикладу 35, послідовно. 1 H ЯМР(400 МГц, CDCl3): 1,18 (д, 3H,-CH3), 2,43-2,50 (м, 2H, -CH2-), 3,04-3,06 (м, 1H, -CH-), 4,48-4,50 (м, 2H, 2-CH-), 5,78 (т, 1H, J=7,2 Гц, -CH-), 6,82-6,85 (м, 2H, Cpr-H), 6,89-6,94 (м, 2H, Cpr-H), 7,02-7,07 (м, 2H, Cpr-H), 7,12-7,15 (м, 4H, Cpr-H), 7,18-7,22 (м, 2H, Cpr-H); МС (m/z): 434 [M-H]. Приклад 37 Одержання (3R,4S)-4-(4-бензоїлоксифеніл)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4гідрокси-4-метилпент-2-еніл]азетидин-2-ону (сполуки I-9, Z-конфігурації): 22 UA 105053 C2 5 Сполуку I-7 (Z-конфігурації) використовують як вихідну речовину, і сполуку I-9 (Zконфігурації) одержують згідно зі способами стадії 1 і стадією 2 прикладу 34. 1 H ЯМР (400 МГц, CDCl3): 1,35 (с, 3H, -CH3), 1,38 (с, 3H, -CH3), 3,01-3,09 (м, 1H, -CH-), 3,263,34 (м, 2H, -CH2-), 4,86 (д, 1H, -CH-), 5,34 (т, 1H, J=7,6 Гц, -CH-), 6,89-7,04 (м, 6H, Cpr-H), 7,237,30 (м, 4H, Cpr-H), 7,39-7,41 (м, 2H, Cpr-H), 7,50-7,54 (м, 2H, Cpr-H), 7,64-7,65 (м, 1H, Cpr-H), 8,18-8,20 (м, 2H, Cpr-H); МС (m/z): 598 [M-H+HCOOH]. Приклад 38 Одержання (3R,4S)-1-(4-фторфеніл)-3-[(Z)-3-(4-фторфеніл)-4-гідрокси-4-метилпент-2-еніл]-4(4-гідроксифеніл)азетидин-2-ону (сполука I-10, Z-конфігурації): 10 15 20 25 30 35 Сполуку I-9 (Z-конфігурації) використовують як вихідну речовину, і, згідно зі способом стадії 1 прикладу 24, видаляють бензоїльну захисну групу, з одержанням сполуки I-10 (Z-конфігурації). 1 H ЯМР (400 МГц, ДМСО-d6): 1,21 (с, 3H, -CH3), 1,23 (с, 3 Н, -CH3), 2,96-3,08 (м, 2H, -CH2-), 3,16-3,20 (м, 1H, -CH-), 4,88 (д, 1H, -CH-), 4,96 (с, 1H, -OH), 5,14 (т, 1H, J=7,6 Гц, -CH-), 6,74-6,76 (м, 2H, Cpr-H), 7,06-7,07 (м, 4H, Cpr-H), 7,12-7,16 (м, 4H, Cpr-H), 7,19-7,23 (м, 4H, Cpr-H), 9,51 (с, 1H, -OH); МС (m/z): 448 [M-H]. Приклад 39 Одержання (3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфеніл)бут-2-еніл]-4-(4-ацетоксифеніл)-1-(4фторфеніл)азетидин-2-ону (сполука I-11, Z-конфігурації) У колбу на 250 мл додають 19,0 ммоль сполуки I-1 (Z-конфігурації), 100 мл дихлорметану, 4,84 грами (47,5 ммоль) оцтового ангідриду і 7,5 мл триетиламіну. Суміш перемішують при кімнатній температурі, і взаємодія продовжується 2 години. Після завершення взаємодії, залишок екстрагують 3 рази етилацетатом (100 мл 3). Органічні фази об’єднують, промивають насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха. Залишок очищають колонковою хроматографією, з одержанням 8,16 грамів (16,2 ммоль) сполуки I-11 (Z-конфігурації) із виходом 85,0%. 1 H ЯМР (400 МГц, CDCl3): 2,00 (с, 3H, -CH3), 2,30 (с, 3H, -CH3), 2,88-2,92 (м, 2H, -CH2-), 3,23-3,27 (м, 1H, -CH-), 4,76 (с, 1H, -CH-), 5,04 (кв, 2H, -CH2-), 5,95 (т, 1H, J=7,6 Гц, -CH-), 6,936,98 (м, 2H, Cpr-H), 6,98-7,03 (м, 2H, Cpr-H), 7,09-7,11 (м, 2H, Cpr-H), 7,23-7,29 (м, 4H, Cpr-H), 7,30-7,34 (м, 2H, Cpr-H); МС (m/z): 506 [M+Н]. Приклад 40 Одержання (3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфеніл)бут-2-еніл]-1-(4-фторфеніл)-4-(4гідроксифеніл)азетидин-2-ону (сполуки I-12, Z-конфігурації) 23 UA 105053 C2 5 10 Сполуку I-11, (Z-конфігурації) використовують як вихідну речовину, і, згідно зі способом стадії 1 прикладу 24, ацетильну захисну групу видаляють із фенольного гідроксилу, з одержанням сполуки I-12 (Z-конфігурації). 1 H ЯМР (400 МГц, ДМСО-d6): 1,94 (с, 3H, -CH3), 2,76-2,88 (м, 2H, -CH2-), 3,23-3,27 (м, 1H, CH-), 4,90 (д, 1H, -CH-), 5,05 (кв, 2H, -CH2-), 6,01 (т, 1H, J=7,6 Гц, -CH-), 6,74-6,76 (м, 2H, Cpr-H), 7,12-7,21 (м, 6H, Cpr-H), 7,21-7,25 (м, 2H, Cpr-H), 7,36-7,40 (м, 2H, Cpr-H), 9,52 (с, 1H, -OH); МС (m/z): 464 [M+Н]. Наступні сполуки одержують, використовуючи відповідні вихідні речовини, згідно зі способами прикладу 39 і прикладу 40. Пр. 41 42 43 15 Сполуки 1 H ЯМР (400 МГц) (ДМСО-d6): 2,83-2,96 (м, 2H, CH2-), 3,26-3,33 (м, 1H, -CH-), 4,91 (д, 1H, -CH-), 5,34 (кв, 2H, CH2-), 6,09 (т, 1H, J=8,0 Гц, -CH-), 6,72-6,74 (м, 2H, Cpr-H), 7,11-7,21 (м, 8H, Cpr-H), 7,44-7,49 (м, 4H, Cpr-H), 7,60-7,64 (м, 1H, Cpr-H), 7,79-7,82 (м, 2H, Cpr-H), 9,52 (с, 1H, -OH); (ДМСО-d6): 2,83-2,96 (м, 2H, CH2-), 3,26-3,35 (м, 1H, -CH-), 4,91 (с, 1H, -CH-), 5,34 (кв, 2H, CH2-), 6,10 (т, 1H, J=7,6 Гц, -CH-), 6,72-6,74 (м, 2H, Cpr-H), 7,12-7,22 (м, 8H, Cpr-H), 7,28-7,33 (м, 2H, Cpr-H), 7,44-7,48 (м, 2H, Cpr-H), 7,84-7,88 (м, 2H, Cpr-H), 9,54 (с, 1H, -OH); Z: (ДМСО-d6): 2,29 (с, 3H, -CH3), 2,33-2,46 (м, 2H, -CH2-), 3,79-3,85 (м, 1H, -CH-), 4,82 (кв, 2H, -CH2-), 5,34 (д, 1H, -CH-), 5,77 (т, 1H, J=7,2 Гц, -CH-), 6,74-6,77 (м, 2H, Cpr-H), 7,11-7,19 (м, 6H, Cpr-H), 7,23-7,28 (м, 4H, Cpr-H), 7,36-7,39 (м, 2H, Cpr-H), 6,65-7,67 (м, 2H, Cpr-H), 9,54 (с, 1H, -OH); Мс (m/z): 526 [M+Н] 544 [M+Н] 540 [M+Н] Приклад 44 (3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфеніл)бут-2-еніл]-4-(4-бензоїлоксифеніл)-1-(4фторфеніл)азетидин-2-он (сполука I-16, Z-конфігурації) 24 UA 105053 C2 5 10 15 20 25 У колбу на 250 мл додають 16,0 ммоль сполуку I-5 (Z-конфігурації), 100 мл дихлорметану, 1,96 грами (19,2 ммоль) оцтового ангідриду і 2,8 мл триетиламіну. Суміш перемішують при кімнатній температурі, і взаємодія продовжується 2 години. Після завершення взаємодії, залишок екстрагують 3 рази етилацетатом (100 мл 3). Органічні фази об’єднують, промивають насиченим розчином солі, сушать над безводним сульфатом натрію і концентрують досуха. Залишок очищають колонковою хроматографією, з одержанням 7,94 грамів (14,0 ммоль) сполуки I-16 (Z-конфігурації) із виходом 87,5%. 1 H ЯМР (400 МГц, CDCl3): 2,90-2,94 (м, 2H, -CH2-), 3,27-3,31 (м, 1H, -CH-), 4,80 (с, 1H, -CH-), 5,06 (кв, 2H, -CH2-), 5,97 (т, 1H, J=8,0 Гц, -CH-), 6,95-7,03 (м, 4H, Cpr-H), 7,23-7,32 (м, 6H, Cpr-H), 7,38-7,40 (м, 2H, Cpr-H), 7,50-7,54 (м, 2H, Cpr-H), 7,63-7,67 (м, 1H, Cpr-H), 8,18-8,20 (м, 2H, CprH); МС (m/z): 568 [M+Н]. Приклад 45 (3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфеніл)бут-2-еніл]-1-(4-фторфеніл)-4-(4метоксифеніл)азетидин-2-он (сполука 1-17, Z конфігурацію) Сполуку I-17 (Z-конфігурації) одержують згідно зі способом прикладу 44, використовуючи сполуку I-2 (Z-конфігурації) як вихідну речовину. 1 H ЯМР (400 МГц, CDCl3): 1,96 (с, 3H, -CH3), 2,52-2,67 (м, 2H, -CH2-), 3,07-3,11 (м, 1H, -CH-), 3,80 (с, 3H, -CH3), 4,47 (с, 1H, -CH-), 4,74 (кв, 2H, -CH2-), 5,80 (т, 1H, J=7,6 Гц, -CH-), 6,87-6,94 (м, 4H, Cpr-H), 7,05-7,09 (м, 2H, Cpr-H), 7,16-7,23 (м, 6H, Cpr-H); МС (m/z): 500 [M+Na]. Приклад 46 (3R,4S)-3-[(Е)-4-ацетокси-3-(4-фторфеніл)бут-2-еніл]-1-(4-фторфеніл)-4-(4метоксифеніл)азетидин-2-он (сполука I-17, Е-конфігурації) 25 UA 105053 C2 5 10 15 20 25 30 35 40 Сполуку I-17 (Е-конфігурації) одержують згідно зі способом прикладу 44, використовуючи сполуку I-2 (Е-конфігурації) як вихідну речовину. 1 H ЯМР (400 МГц, CDCl3): 1,99 (с, 3H, -CH3), 2,87-2,91 (м, 2H, -CH2-), 3,21-3,25 (м, 1H, -CH-), 3,80 (с, 3H, -CH3), 4,47 (с, 1H, -CH-), 5,04 (с, 2H, -CH2-), 5,96 (т, 1H, J=7,6 Гц, -CH-), 6,88-6,96 (м, 4H, Cpr-H), 6,98-7,02 (м, 2H, Cpr-H), 7,23-7,31 (м, 6H, Cpr-H); МС (m/z): 500 [M+Na]. Фармакодинамічний скринінг in vivo Фармакодинамічний скринінг сполуки даного винаходу in vivo виконують наступним способом. 1. Створення моделі гіперхолестеринемії у золотистих хом’ячків Проводять акліматизацію тварин, забезпечуючи годування протягом 1 тижня з вільним доступом до корму і води, в умовах освітлення 10 г/14 г. На 8 день тварини одержують корм із високим вмістом жиру (що містить 0,5% холестерину, 20% пальмової олії, 79,5% основного корму) протягом 1 тижня. Потім кожну тварину анестезують ефіром. Після зважування, відбирають 0,5 мл крові з очноямкової вени, антикоагулюють гепарином і центрифугують при 5000 об/хв протягом 10 хв. Збирають плазму і рівні TC (загального холестерину) і LDL-C (холестерину ліпопротеїнів низької густини) у плазмі визначають за допомогою автоматичного біохімічного аналізатора. Тварин із TC плазми 9-15 ммоль/л відбирають у ролі модельних тварин (див. наступне посилання на метод моделювання на тваринах: Burrier, R.E., Smith, A.A., Mcgregor, D.G., Hoos, L.M., Zilli, D.L., Davis, H.R. The effect of acyl CoA: cholesterol acyltransferase inhibition on the uptake, esterification and secretion of cholesterol by the hamster small intestine. J. Pharm. Exp. Ther., 1995, 272, 156-163). 2. Скринінг сполуки Тварин групують за TC і LDL-C і зважують, по 6 тварин на групу. Езетиміб використовують як позитивний контроль. Тваринам вводять внутрішньошлуночково об’єм 5 мл/кг протягом 1 тижня. Кожну тварину анестезують ефіром. Після зважування, відбирають 0,5 мл крові з очноямкової вени, антикоагулюють гепарином і центрифугують при 5000 об/хв протягом 10 хв. Збирають плазму і рівні TC (загального холестерину) і LDL-C (холестерину ліпопротеїнів низької густини) у плазмі визначають за допомогою автоматичного біохімічного аналізатора, для оцінки ефективності даних сполук. 3. Результати скринінгу Згідно з фармакодинамічним скринінговим тестом, в якому як позитивний контроль використовують езетиміб, результати показують, що сполуки I-1 (Z), I-2 (Z), I-3 (Z), I-4 (Z), I-5 (Z), I-6 (Z), I-11 (Z), I-12 (Z), I-13 (Z), I-14 (Z), I-15 (Z), I-16 (Z) і I-17 (Z) мають дію зі зниження холестерину. Зокрема, ефективність сполук I-1 (Z), I-2 (Z), I-3 (Z), I-4 (Z), I-6 (Z), I-15 (Z) і I-17 (Z) більше схожа на позитивний контроль, і I-1 (Е) також має деяку холестерин-знижувальну дію. Результати скринінгу наведені в таблицях 1-12. Оскільки I-1 (Z) має значну ефективність, проводили додаткові експерименти з визначення знижувального холестерин ефекту зазначеної сполуки (див., таблицю 13). (1) Вплив сполук на рівень ліпідів крові на моделі гіперхолестеринемії у золотистих хом’ячків 26 UA 105053 C2 Таблиця 1 Вплив сполуки I-1 на рівень ліпідів крові на моделі гіперхолестеринемії золотистих хом’ячків (x±s) Групи Кількість тварин Доза (мг/кг) модель езетиміб I-1 (E) I-1 (E) I-1 (E) I-1 (Z) I-1 (Z) I-1 (Z) 6 6 6 6 6 6 6 6 2 10 2 0,4 10 2 0,4 Біохімічні показники (ммоль/л) До введення Після введення (ммоль/л) (ммоль/л) TC LDL-C TC LDL-C 9,93±1,33 2,43±0,67 12,86±2,49** 3,18±1,64 9,9±1,24 2,55±0,96 4,21±0,68*** 0,57±0,34*** 9,85±1,2 2,51±0,91 8,7±0,93* 1,74±0,62 9,84±1,14 2,21±0,47 11,19±0,69 2,21±0,37 9,85±1,1 2,44±0,46 12,42±1,4 2,84±0,59 9,76±1 2,48±0,67 4,3±0,85*** 0,42±0,2*** 9,74±0,98 2,57±0,47 4,9±0,62*** 0,71±0,49*** 9,74±0,99 2,26±0,65 6,46±0,58*** 1,52±0,31* Примітка: порівняння даних до введення з даними після введення, *P
ДивитисяДодаткова інформація
Назва патенту англійськоюAzetidinone compounds and medical use thereof
Автори англійськоюBai, Hua, Xu, Xiaojie, Zhai, Xuyang, Liu, Xiaoyu, Zhang, Yuncai, Chen, Ying, Zhing, Xiaohe, Gu, Maojian, Zhu, Qifeng, Zhang, Yong, Luo, Hairong
Автори російськоюБай Хуа, Сюй Сяоцзе, Чжао Сюйян, Лю Сяу, Чжан Юнкай, Чен Ин, Чжен Сяохе, Гу Маоцзян, Чжу Цюфен, Чжан Юн, Ло Хайрон
МПК / Мітки
МПК: A61P 9/00, C07D 263/26, A61P 3/06, A61P 9/04, A61P 9/10, A61K 31/397, C07D 205/08
Мітки: застосування, сполук, азетидинонові, сполуки, медичне, зазначених
Код посилання
<a href="https://ua.patents.su/36-105053-azetidinonovi-spoluki-i-medichne-zastosuvannya-zaznachenikh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Азетидинонові сполуки і медичне застосування зазначених сполук</a>