Спосіб одержання похідних 2-оксоінділ-1-карбоксаміда
Формула / Реферат
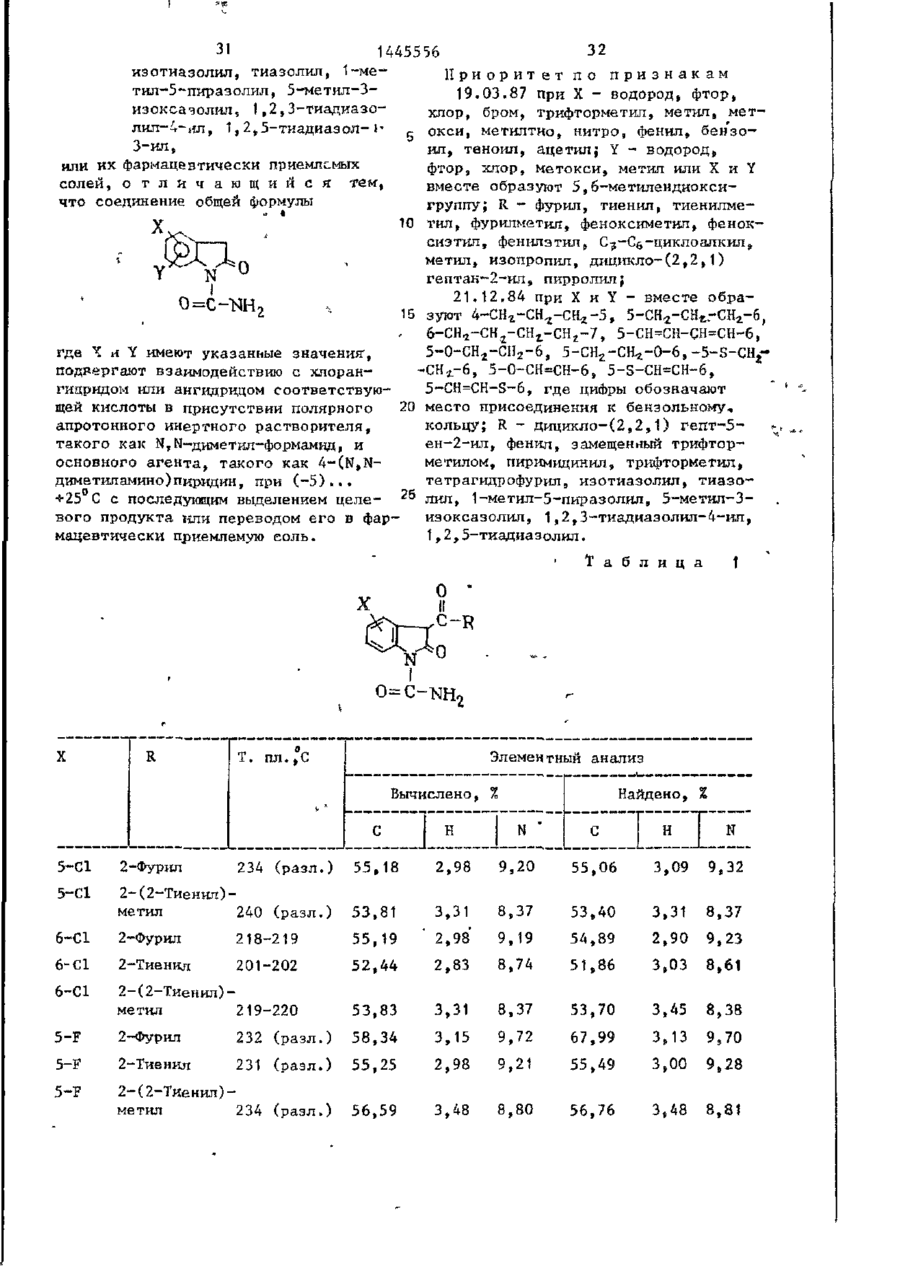
Способ получения производных 2-оксоиндол-1-карбоксамида общей формулы
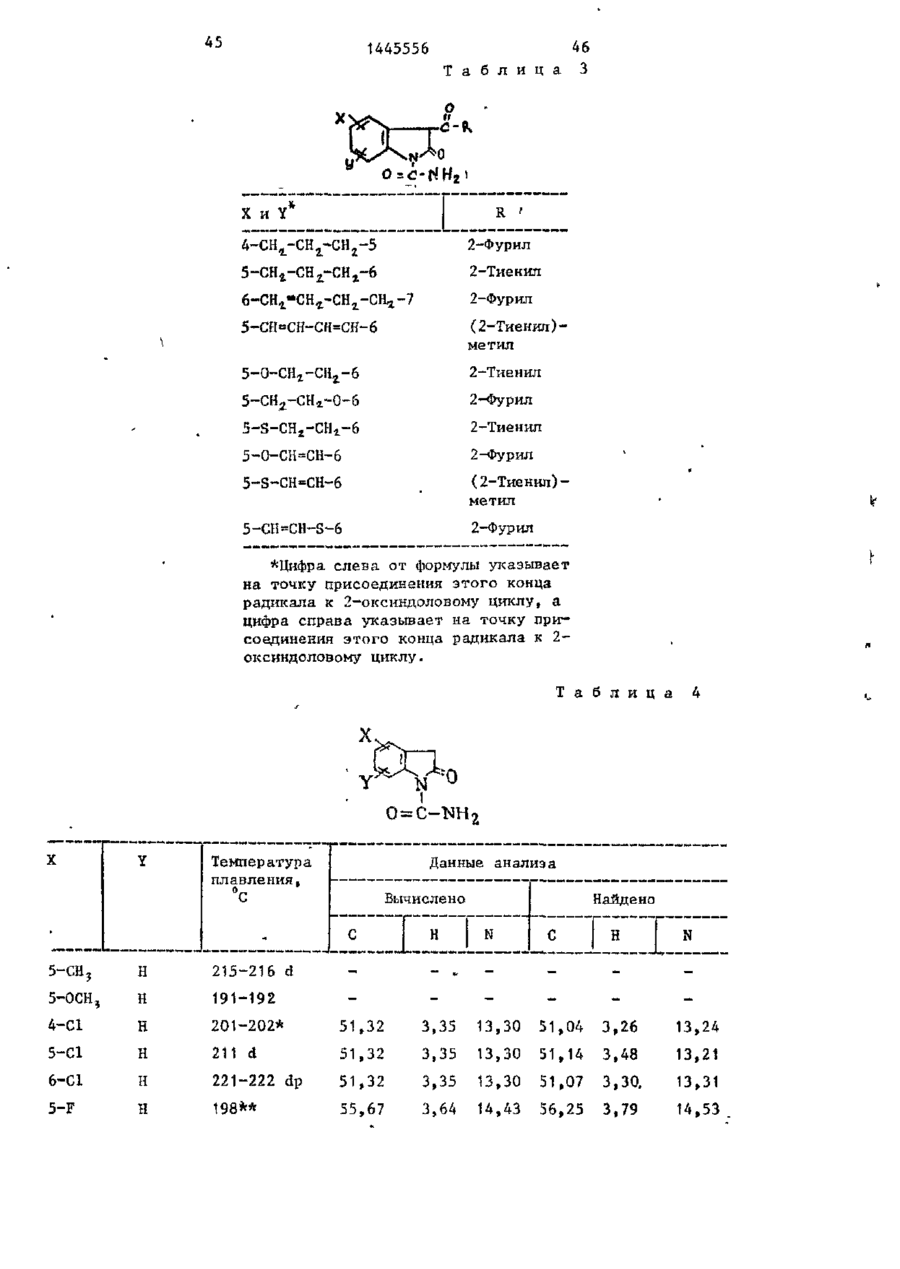
где Х - водород, фтор, хлор, бром, трифторметил, метил, метокси, метилтио, нитро, фенил, бензо-ил, теноил или ацетил; Y - водород, фтор, хлор, метокси, метил, или Х и Y вместе образуют 5, 6-метилендиоксигруппу, А-СН2- СН2- СН2-5,5- СН2- СН2-6, 6- СН2- СН2- СН2- СН2-7, 5-СН=СН-СН=СН-6,5-О-СН2- СН2-6, 5-СН2-СН2-O-6, 5-S-СН2-СН2-6, 5-0-СН=СН-6,5-5-СН=СН-6,5-СН-=СН-5-6, где цифры обозначают место присоединения к бензольному кольцу; К - фурил, тиенил, тиенилметил, фурилметил, феноксиметил, феноксиэтил, фенилэтил, С3-С6-циклоалкил, метил, изопропил, дицикло-(2,2,1) гептан-2-ил, дицикло-(2,2,1) гепт-5-ен-2-ил, фенил, фенил, замещенный одним или двумя атомами хлора или метилом, бензил, бензил, замещенный хлором или трифторметилом, пирролил, пиримидинил, трифторметил, тетрагидрофурил, изотиазолил, тиазолил, 1-метил-5-пиразолил, 5-метил-3-изоксазолил, 1,2,3-тиадиазолил-4-ил, 1,2,5-тиадиазол-1-3-ил, или их фармацевтически приемлемых солей, отличающийся тем, что соединение общей формулы
где X и Y имеют указанные значения, подвергают взаимодействию с хлорангадридом или ангидридом соответствующей кислоты в присутствии полярного апротонного инертного растворителя, такого как N,N-диметилформамид, и основного агента, такого как 4-(N,N-диметиламино)пиридин, при (-5) ...+25 °С с последующим выделением целевого продукта или переводом его в формацевтически приемлемую соль.
Приоритет по признакам
19.03.87 при Х - водород, фтор, хлор, бром, трифторметил, метил, метокси, метилтио, нитро, фенил, бензоил, теноил, ацетил; Y - водород, фтор, хлор, метокси, метил или Х и Y вместе образуют 5,6-метилендиоксигруппу; R - фурил, тиенил, тиенилметил, фурилметил, феноксиметил, фенокси-этил, фенилэтил, С3-С6-циклоалкил, метил, изопропил, дицикло-(2,2,1) гептан-2-ил, пирролил;
21.12.84 при Х и Y- вместе образуют 4-CH2-CH2-CH2-5,5- CH2- CH2- CH2-6, 6- CH2- CH2- CH2-7, 5-СН=СН-СН=СН-6, 5-O-CH2-CH2-6, 5-CH2-CH2-O-6, -5-S- CH2- CH2-6, 5-O-СН=СН-6, 5-S-СН=СН-6, 5-СН=СН-S-6, где цифры обозначают место присоединения к бензольному кольцу; R-дицикло-(2,2,1)гепт-5-ен-2-ил, фенил, замещенный трифторметилом, пиримидинил, трифторметил, тетрагидрофурил, изотиазодил, тиазолил, 1-метил-5-пиразолил, 5-метил-3-изоксазолил, 1,2,3-тиадиазолил-4-ил, 1,2,5-тиадиазолил.
Текст
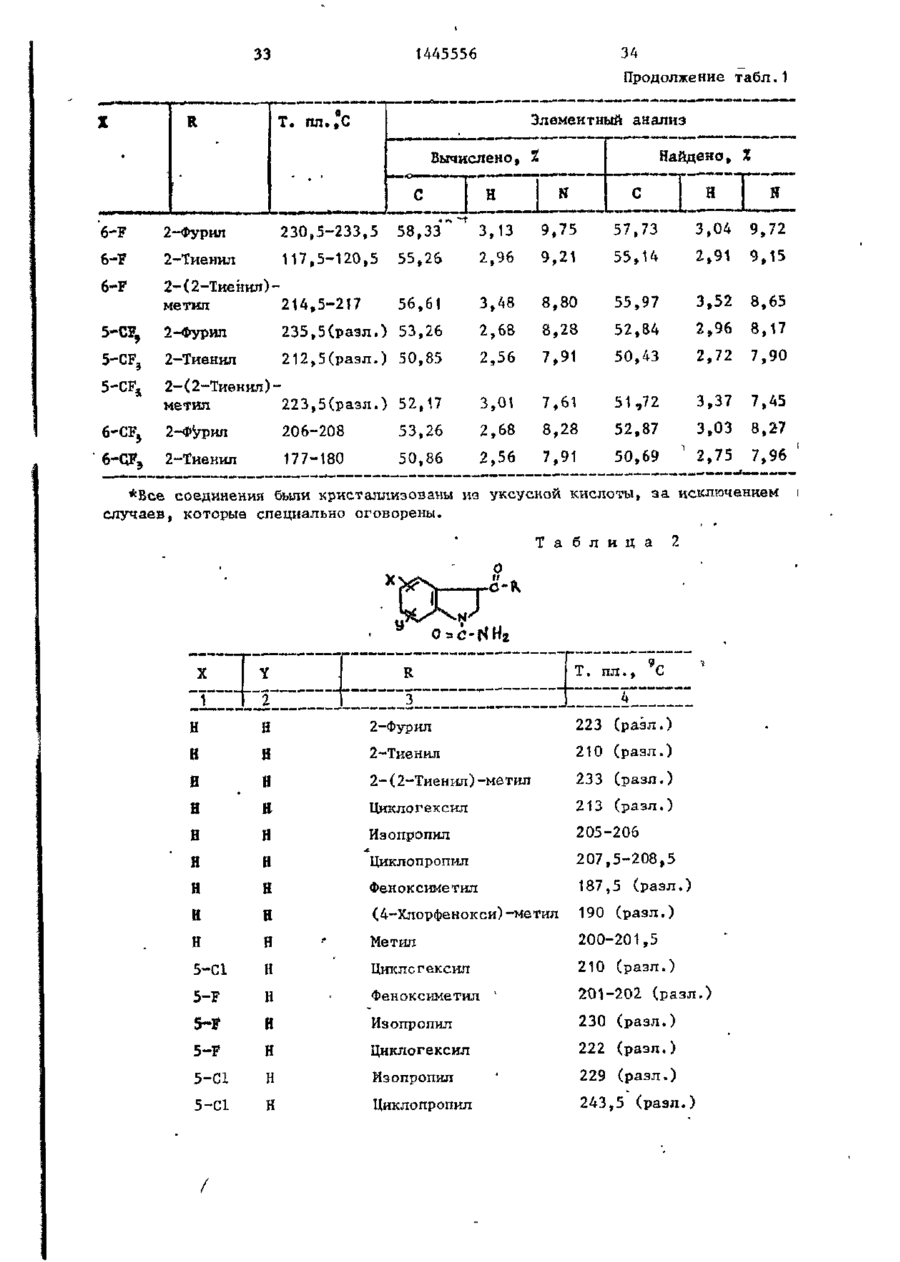
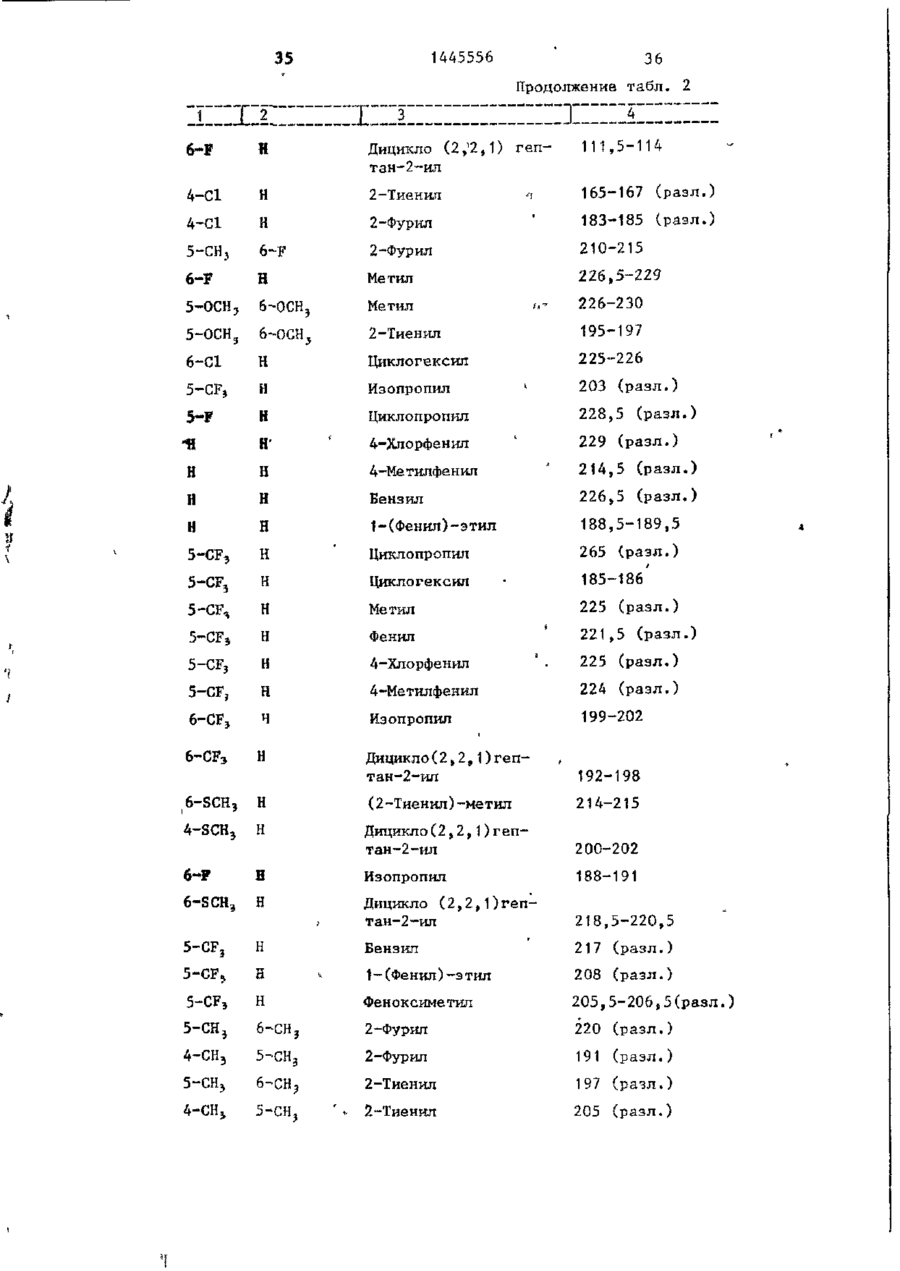
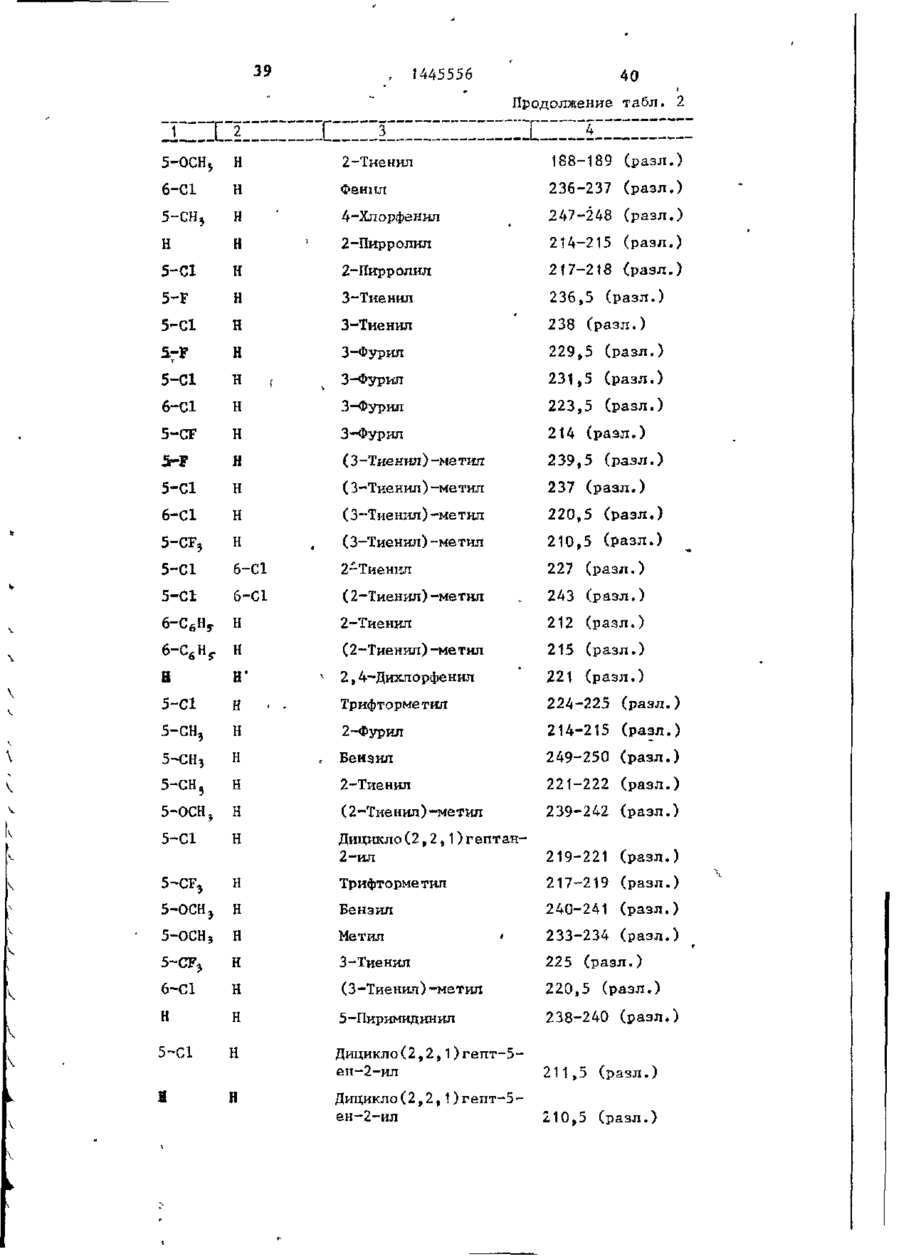
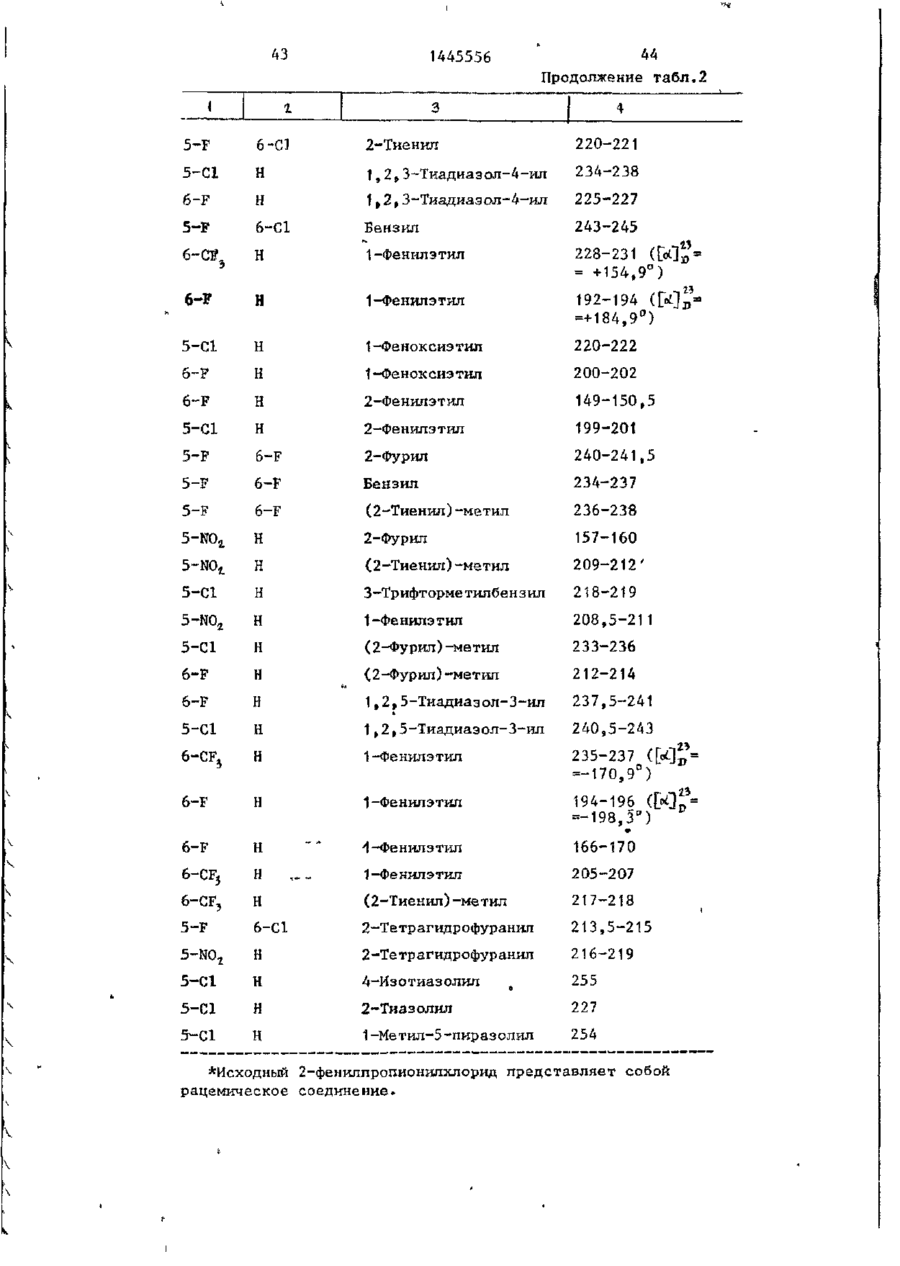
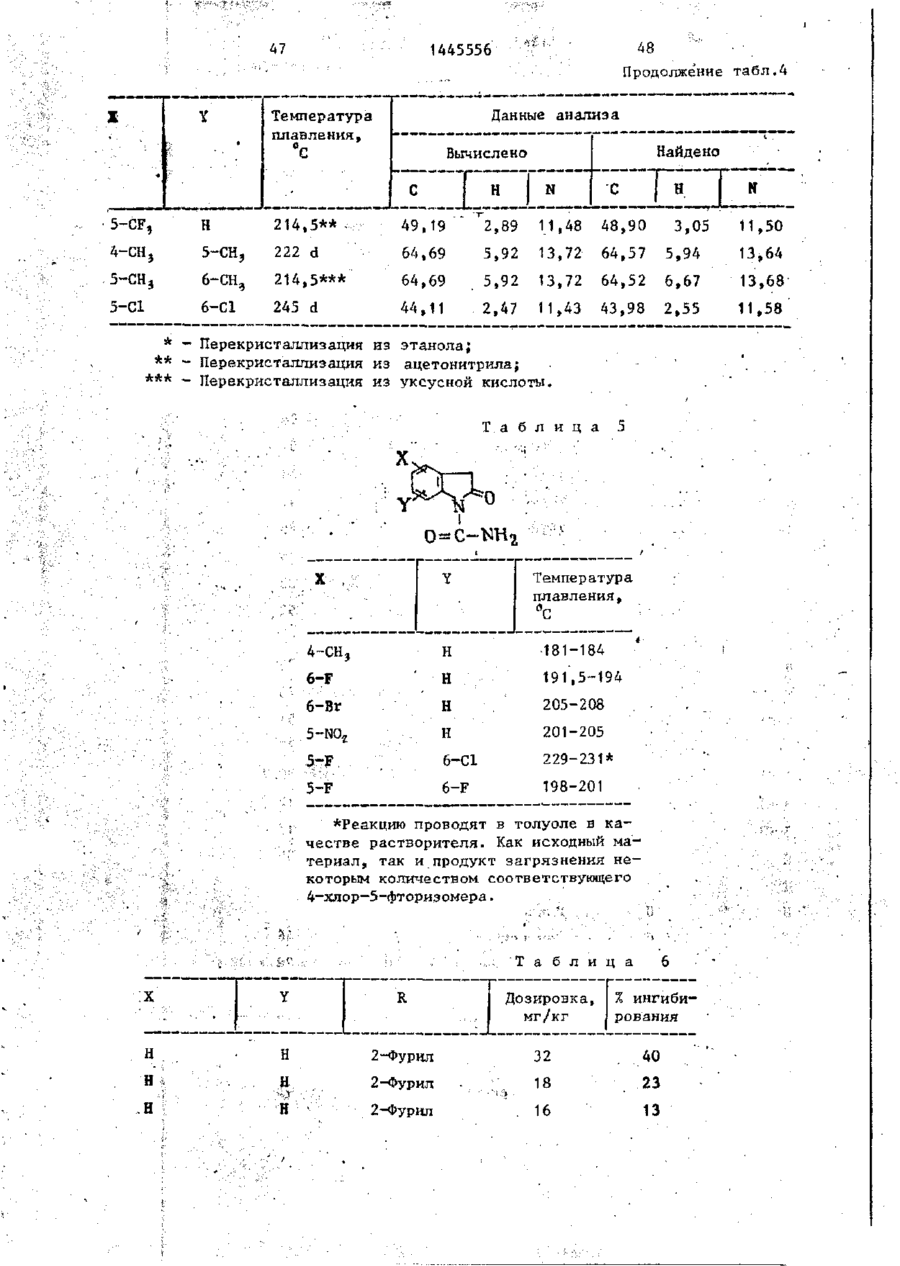
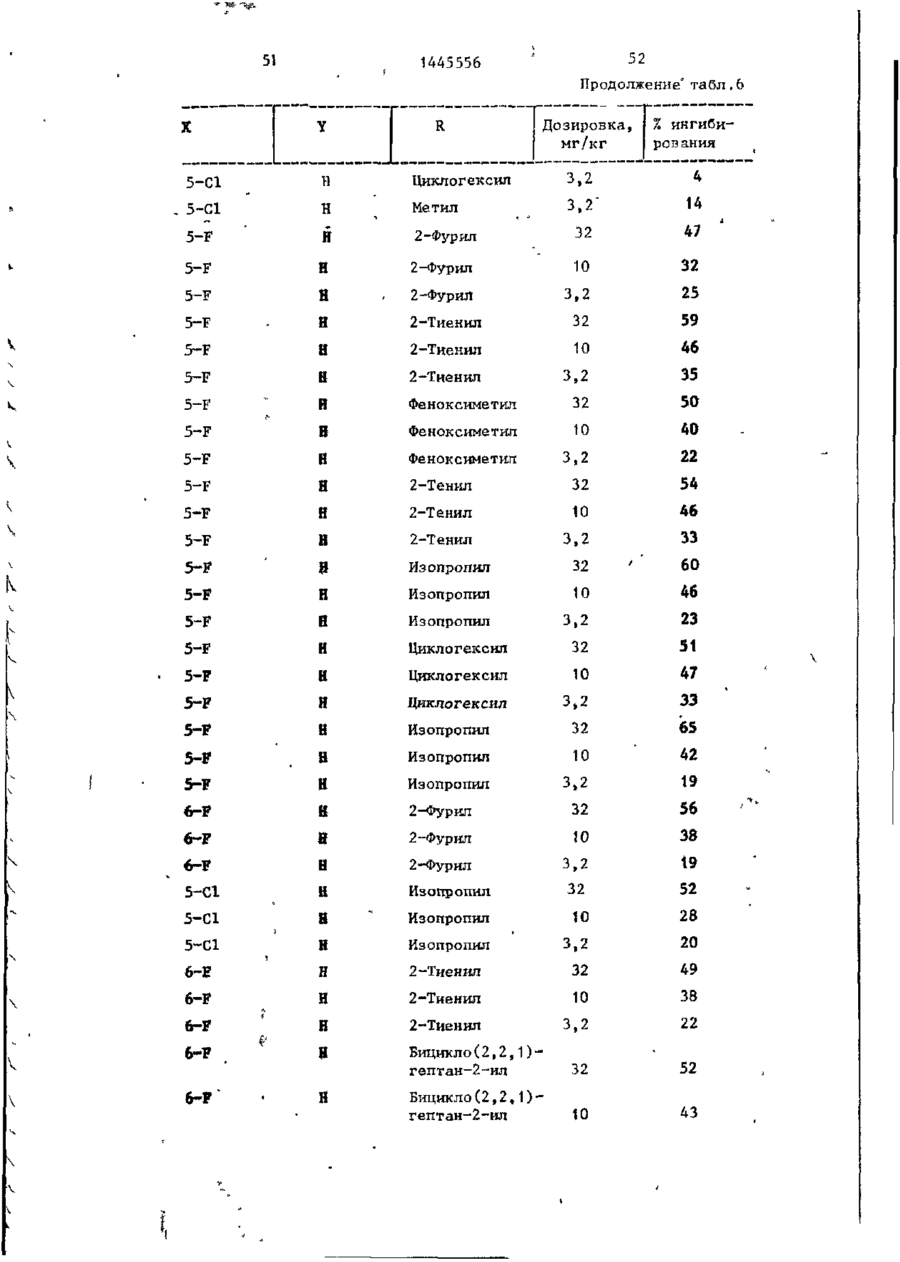
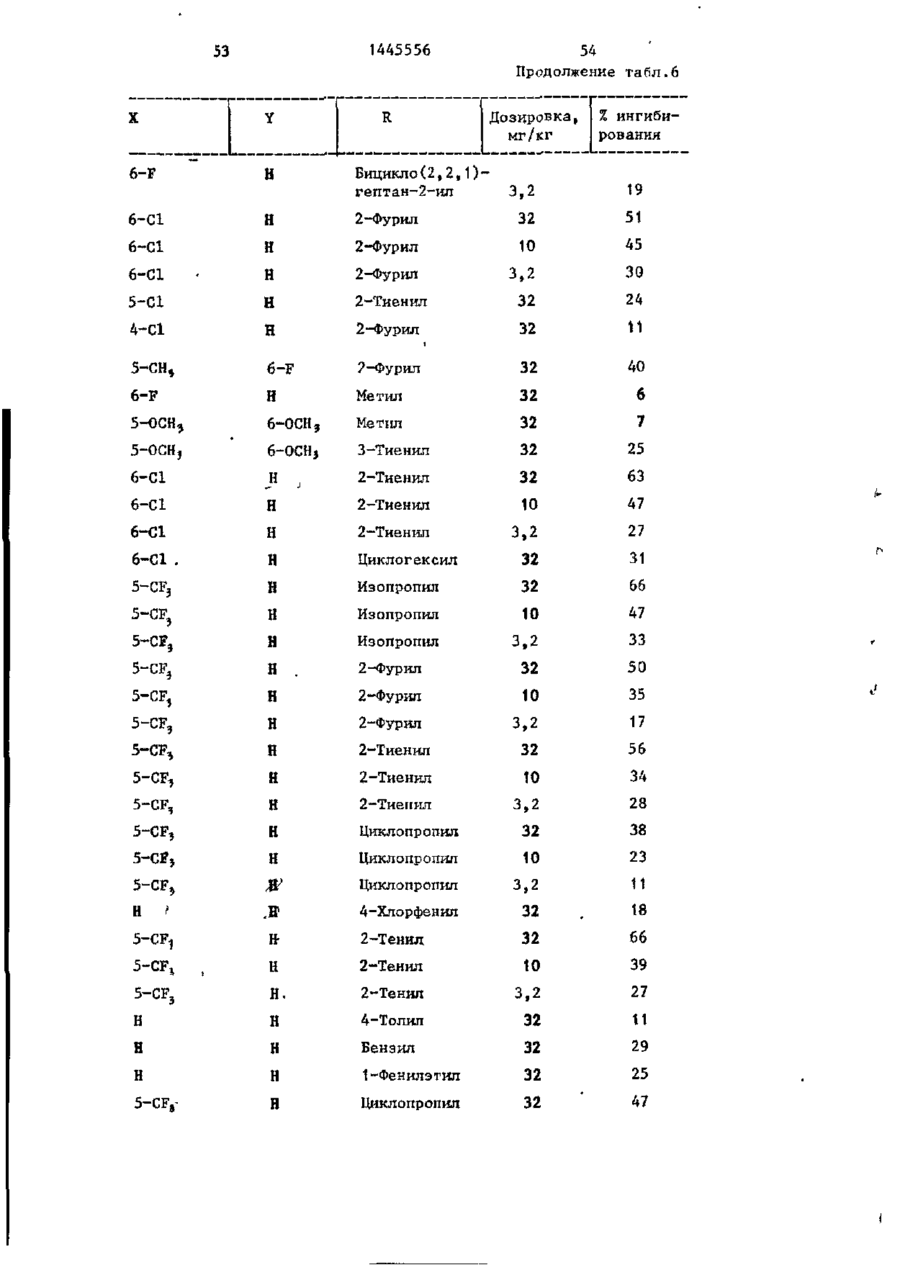
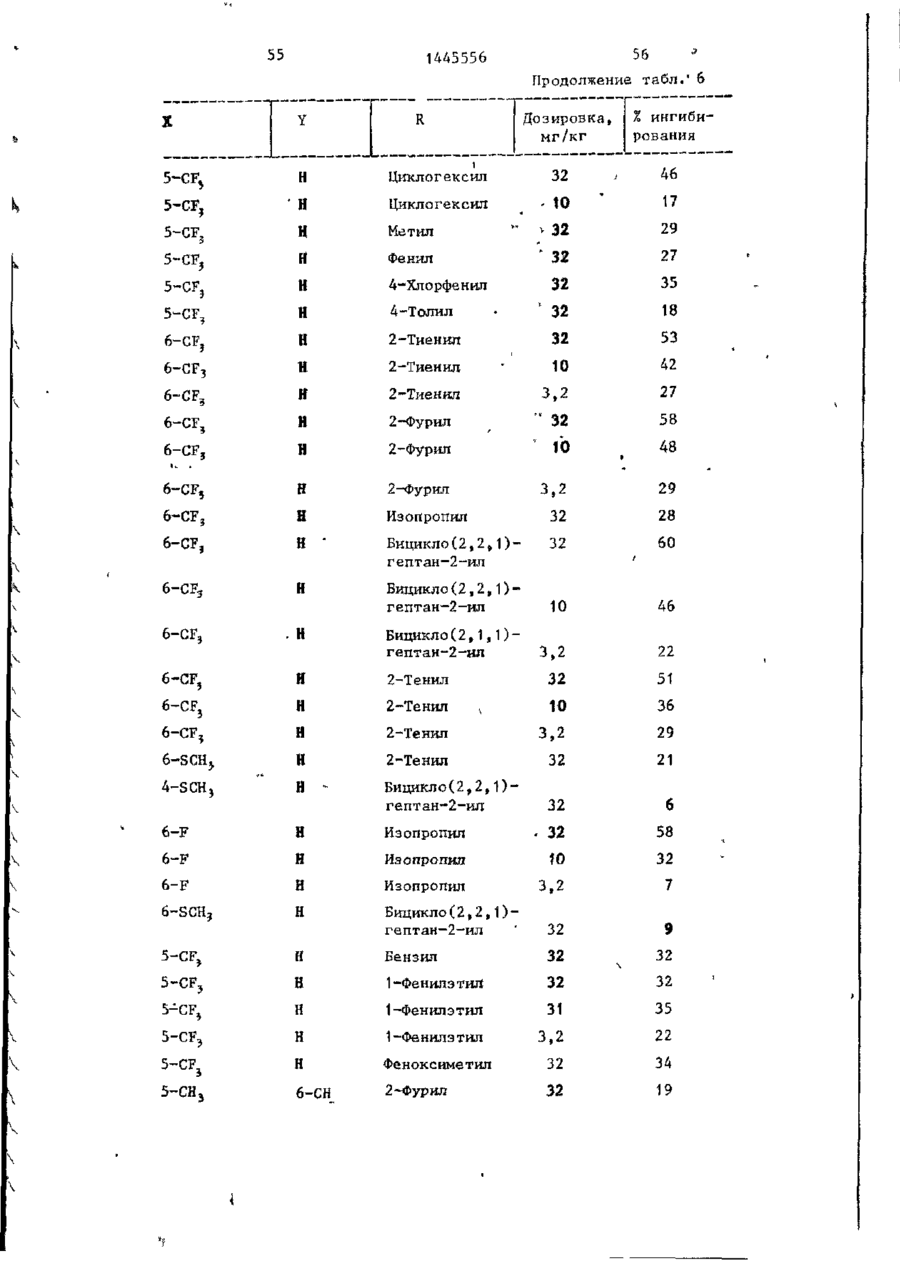
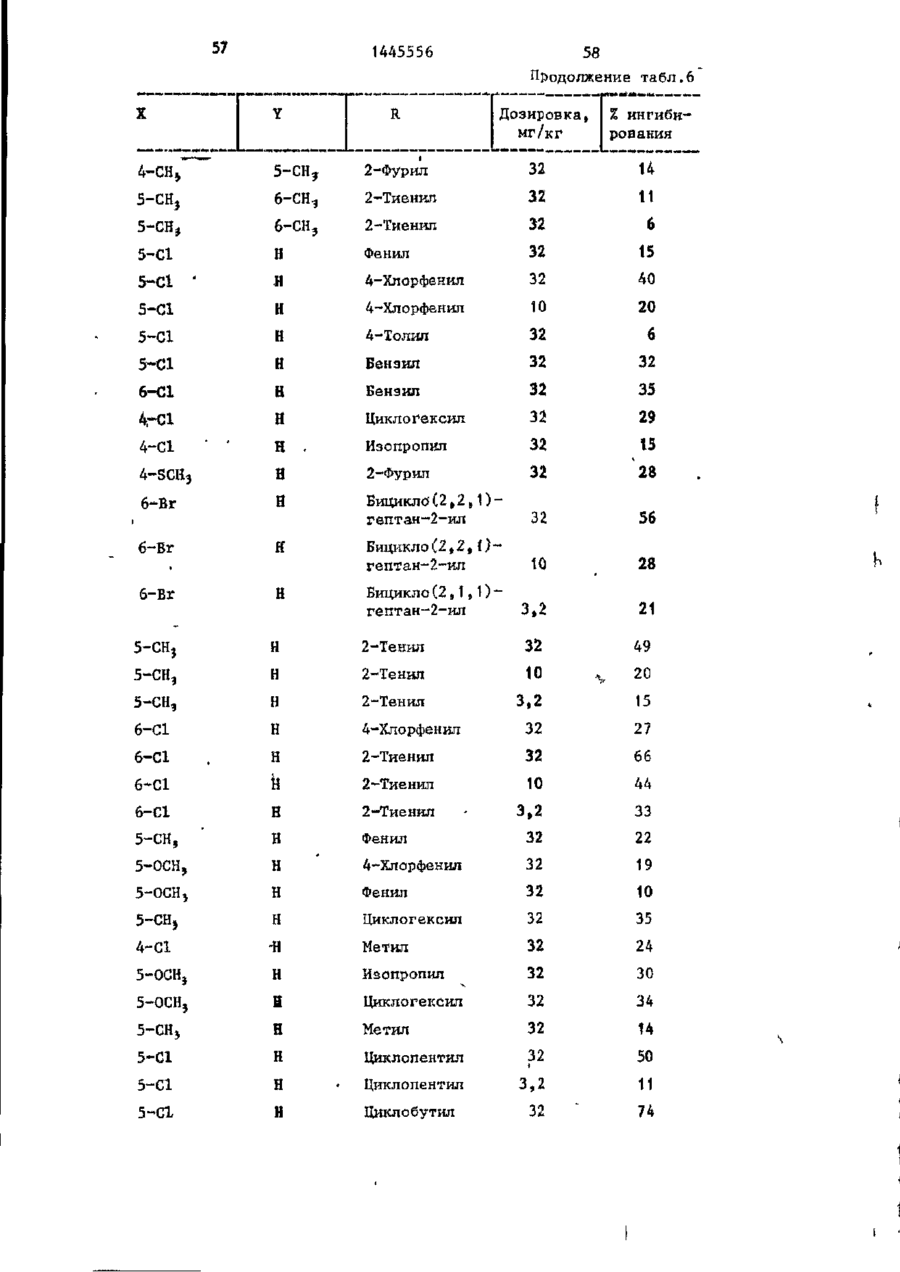
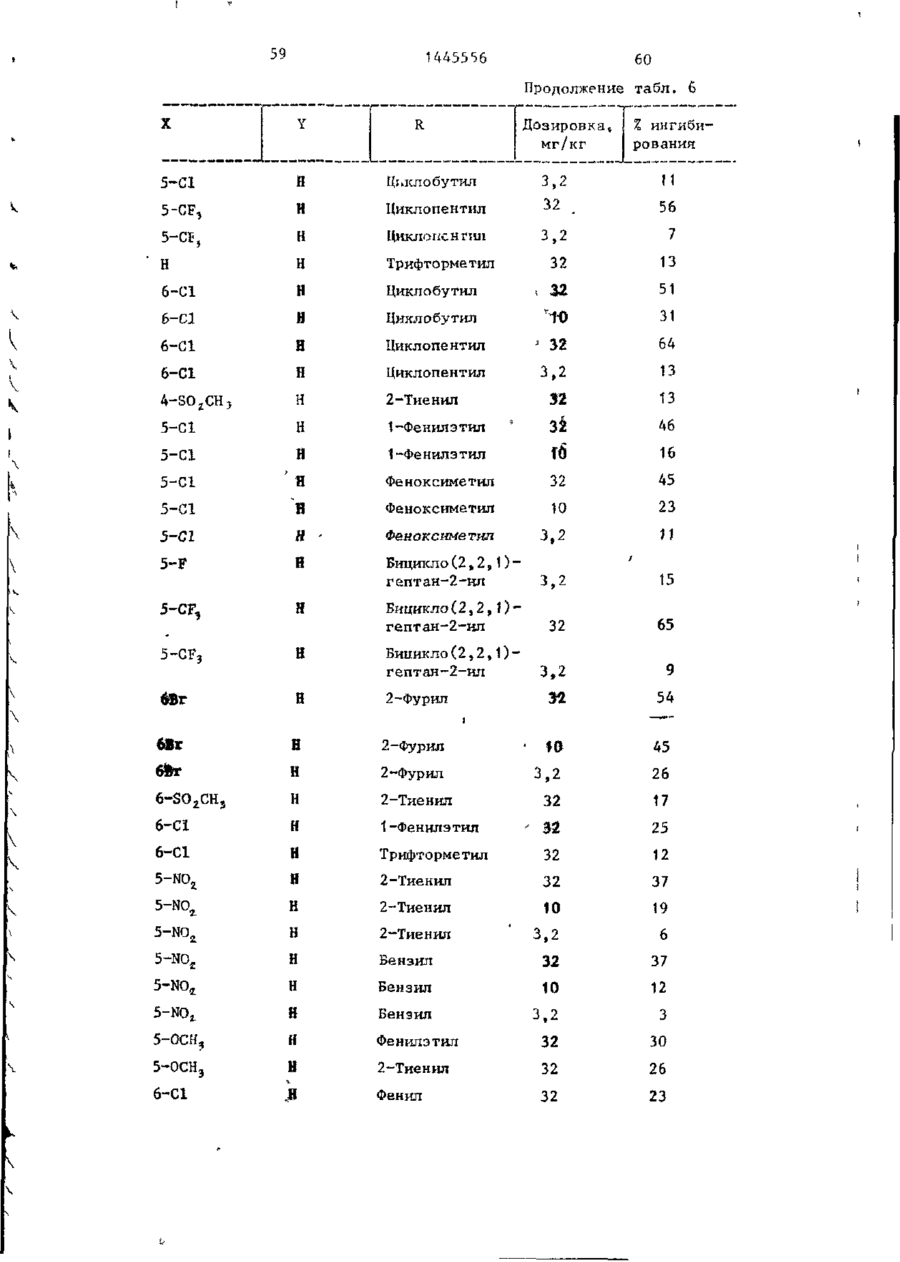
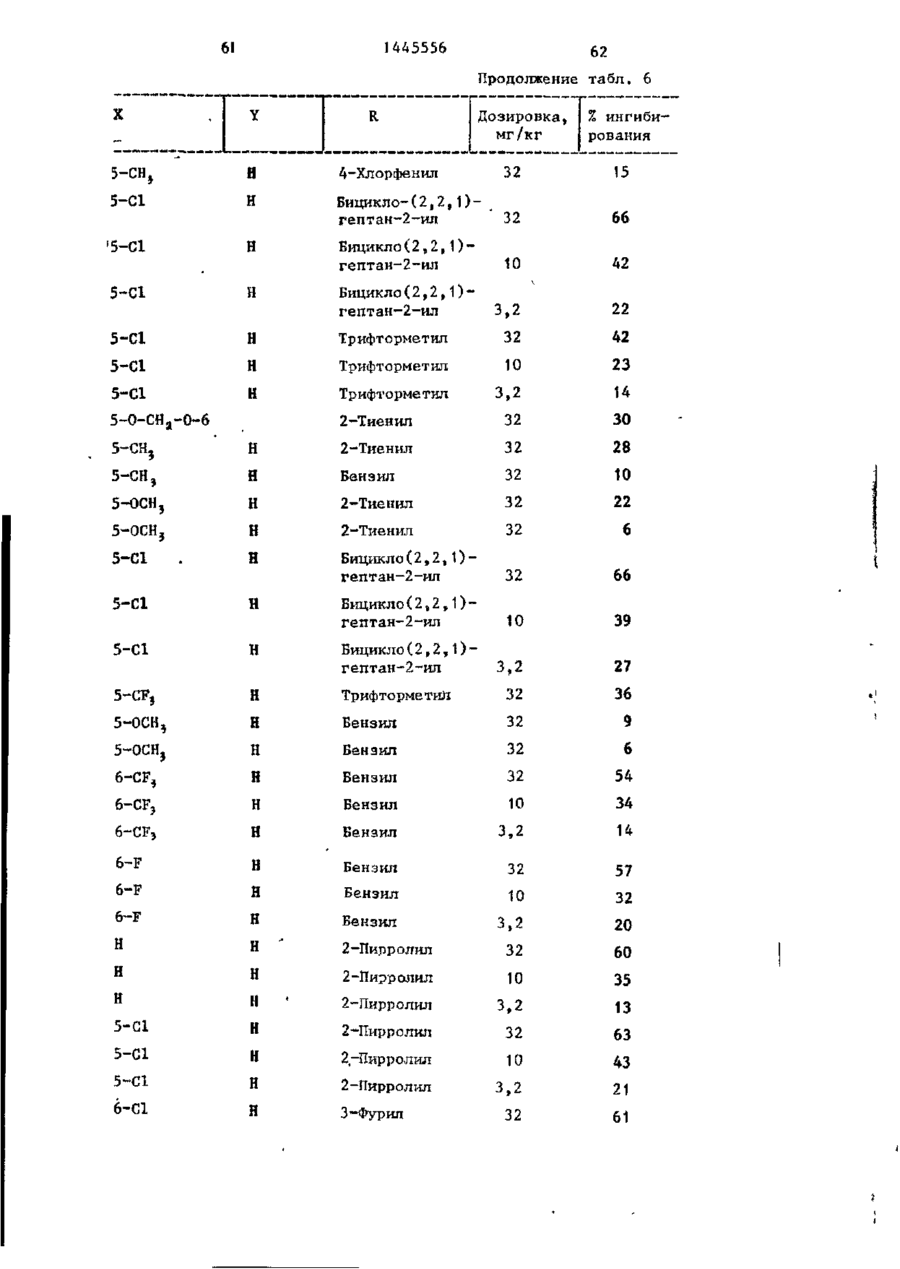
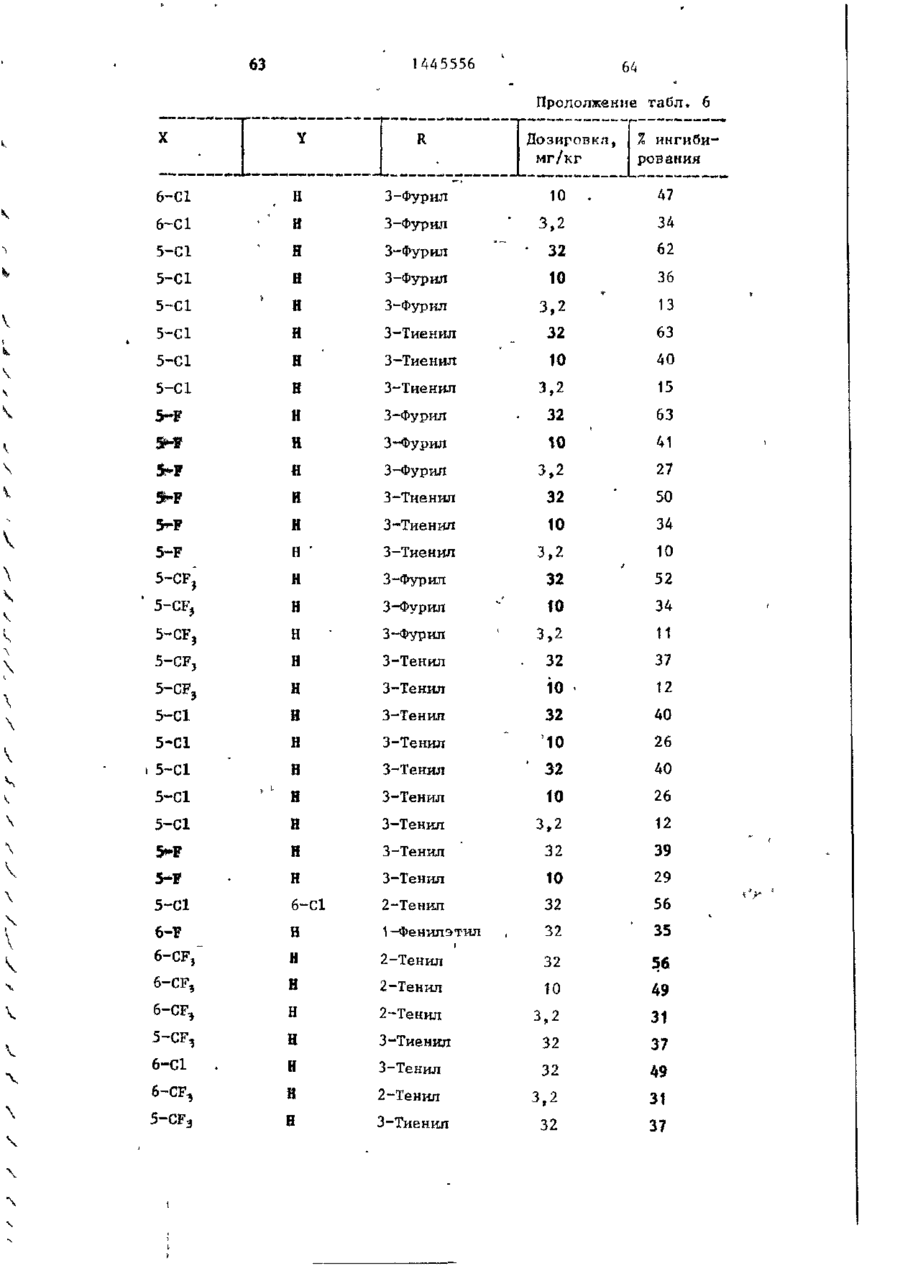
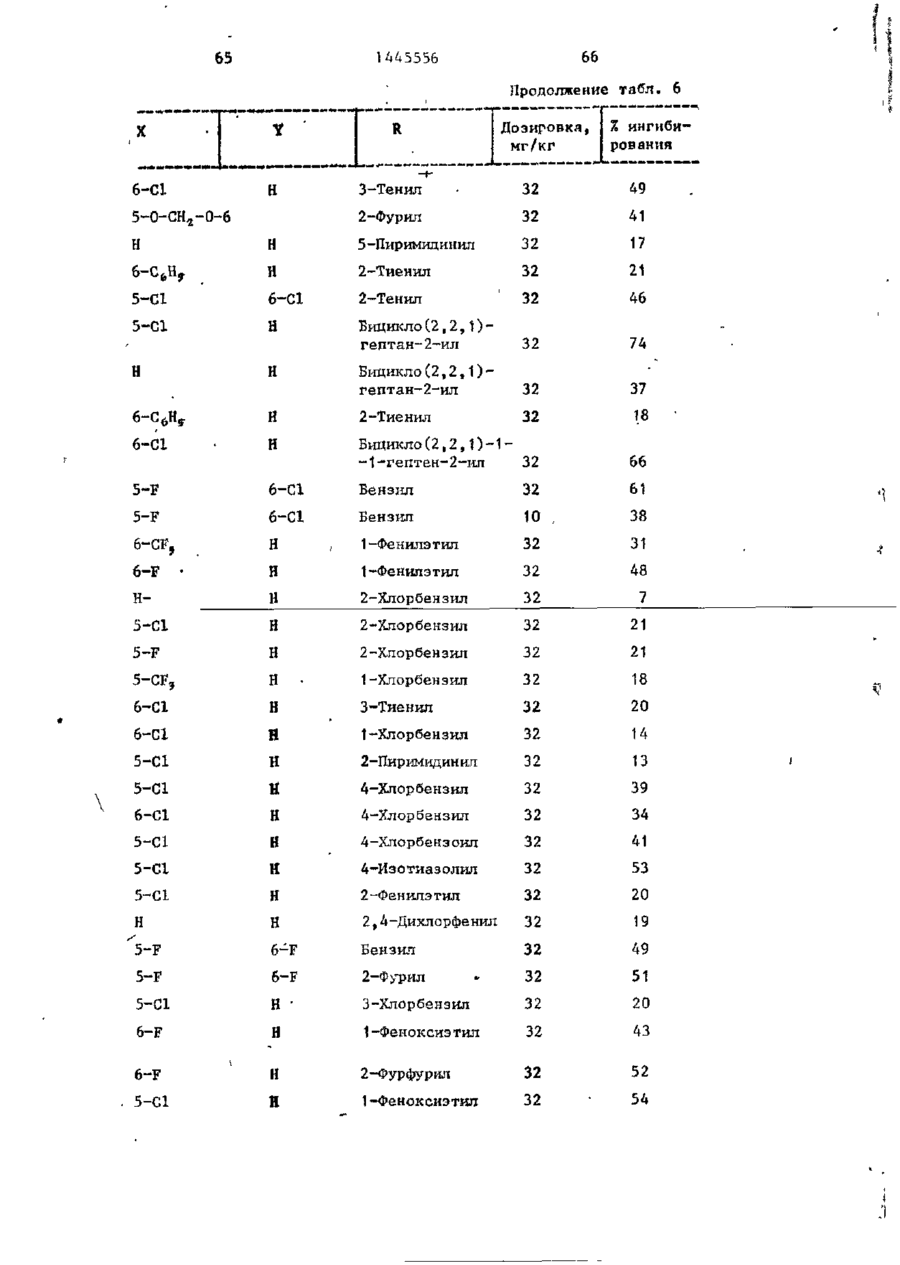
СОЮЗ СОВЕТСКИХ СОЦИАЛИСТИЧЕСКИХ РЕСПУБЛИК С51)4 С 07 D 209/34 ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТ КРЫТИЙ (21) 3869754/23-04 * (22) 18.03.85 (31) 590659; 684634 (32) 19.03.84; 21.12,84 І (33) US (46) 15.12.88. Вюп. № 46 (71) Пфайзер ИНК (US) (72) Сол Бернард Кодин (US) (53) 547.756.07(088.8) (56) Машковский М.Д. Лекарственные средства. 4.1. М,: Медицина, 1987, с. 194, (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ОКСОИНДОЛ-1-КАРБОКСАМИДА (57) Изобретение относится к гетеро циклическим соединениям, в частности к способу получения производных 2-оксоикдол-1-карбоксамида формулы 5-0-СН=СН-6, S-S-СІЬСН-б, 5-CH=CH-S-6, (цифры - место присоединения к бензольному кольцу); R - фурил, тиенил, тиенилмвтил, сЬурилметилу феноксиметил, феноксиэтил, фенштзтші, С 3 ~С 6 циклоалкил, метил, иэопропил, дицикло-(2,2,1) ґептан-2-ил, дицикло^2,2,1J гепт-5-ен-2~ші,фенил, фенил, замещенный одним или двумя атомами С1 или метилом, бензил, замещенный хлором или трифторметилом, пирролил, пиримидинияt трифторметил, тетрагидрофурил, изотпазолиЛр тиазолші, 1-метил-5-пиразолил, 5-метил-З-изоксалолил, 1,2,3-тиадиазолил-4-иЛ, 1,2,5тиадиаэол-3-ил, или их фармацевтически приемлемых солеи» которые могут быть использованы в медицине, так как обладают противовоспалительными и анальгетическими свойствами. Получе^ ние целевых продуктов ведут введени.0 • ем группы где X - Н, F, СІ, Вг, трифторметил, метил, метокси, метилтио, нитро, фенил, бензоил, тенонл или ацетил; Y - Н, F, СІ, метокси, метил или X и У вместе образуют 5,6-метилендиоксигруппу, 4-(сИ 2 ) 3 -5, 5-(СН 2 ) 3 -6, 6-(СН г ) 4 -7, 5-СН-СН-СН*СН-6, 5-О-СНгСНі-6, 5-СІІ2-СЯі-0-6, 5-S-CH1-C44-6, С# V взаимодействием с хлорангидрийом или ангидридом соответствующей кислоты в присутствии полярного апротонноґо инертного растворителя, такого как NtN-диметилформамид, и основного агента, такого как 4-(N,N-диметиламино)пиридин, при (—5) (+25)°С с последующим выделением це-1 левого продукта или переводом его в фармацевтически приемлемую соль. 6 табл. 1445556 Перемешиваемый шлам 21, f г (О,1 моль) 5-хлор-2-оксиндол-1-карбоксамида и 26,9 г (0,22 моль) 4(Н,И-диметиламино)пиридина в 200 мл N,N -диметилформамида охлаяодают до О (і) температуры бани со льдом, а затем в шлам по каплям добавляют раствор 16,1 г (0,11 моль) 2-теноилхлорида (О в 50 мл Н,Ы-диметилформамида. Перемешивание продолжают в течение приблизительно 30 мин, после чего реакционную смесь выливают в смесь 1. л где X - водород, фтор, хлор, бром, воды с 75 мл 3 н. соляной кислоты. трифторметил, метил, метокси, Образовавшуюся смесь охлаждают в бане метилтио, нитро, фенил, бен- ' со льдом, а затем фильтрованием собизоил, теноил или ацетил; рают твердый материал. Этот твердый Y - водород, фтор, хлор, метокси, материал промывают водой, после чего метил или X и Y вместе обраперекристаллиэовывают из 1800 мл укзуют 5,6-метилендиоксигруппу, сусной кислоты, в результате чего по4-CFTi-CH1-CILL-5, 5-СНг,-СИ2 = лучают 26,6 г указанного соединения в виде легких желтых кристаллов с 5-СН=СН-СН=СН-6, 5-0-СН г ~СН г т.пл. 230 С (с разложением). Изобретение относится к органической химии, а именно к способу получения новых производных 2-оксоиндол-1~карбоксамида общей формулы ,6, 5-СН2~СН^-0-6, 5-S-CH^-CHii 6, 5-0-СН=СН-6, 5-S-CH=CH-6, 2 s 5-CH=CH-S-6, где цифры обозначают место присоединения к бензольному кольцу; R - фурил; тиенил, тиенилметил, фурилме тил, фе но ксиме тил, эп феиоксиэтил, фенилэтил, Cj-Cg-циклоалкил, метил,изопрошел, дицикло-(2,2,1)гептан-2-ил, дицикло-(2,2,1) гепт* 5-ЄН-2-ИЛ, фенил, фенил, замещенный одним или двумя ато- 35 мами хлора или метилом, бензил, бензил, замещенный хлором или трифторметилом, пирролил,пиримидинил, трифторметил, тетрагидрофурил, изотиа- 40 Вычислено, %: С 52,42; Н 2,83; N 8,74. \ , 2 5 W Найдено,%: С 5 2 , 2 2 ; Н 2 , 8 1 ; N 8,53. П р и м е р 2 . В результате реакции СООТВеТСТВуЮЩеГО 2-ОКСИНДОЛ-1 карбоксамида с требуемым хлорангид- ^1 Ридом кислоты в основном согласно процедуре примера 1 получают "соединения, приведенные в табл., 1. П р и м е р 3. 5-Хлор-З-ацетнл2-оксиндол-1-карбоксамида. Перемешиваемый шлам 842 мг (4,0 ммоль) 5-хлор-2-оксиндол-1карбоксамида и 1,08 г (8,8 ммоль) 4-(М,М-диметиламино) пиридина в 15 мл NjN-диметилформамида охзолил, тиазолил, 1-метил-5лаждают до температуры бани со пиразолил, 5-метил-З-изоксальдом, а затем по каплям в шлач добавзолил, 1,2,3-тиадиазолил-4ил, 1,2,5-тиадиазол-3-'ил, .^ ляют раствор 449 мг (4,4 ммоль) уксусного ангидрида в 5 мл N,N-flHMemn_ йїіи их фармацевтически приемлемых соформамида. Перемешивание продолжают в лей, которые могут быть использованы течение приблизительно 30 мин, а з а - , в медицине, так как обладают противотем реакционную смесь выливают в ' воспалительными и анальгетическими смесь 75 мл воды с 3 мл. 3 н.соляной свойствами. кислоты. Образовавшуюся смесь охлажда'Целью изобретения является разрают в бане со льдом и твердый материал ботка доступного способа получения удаляют фильтрованием. Далее твердый соединений формулы (I), обладающих материал перекристаллизовывают из укрядом полезных фармакологических сусной кислоты, получив 600 мг легких свойств. бледно-розовых кристаллов с т . п л . Изобретение иллюстрируется сле~ " 237,5°С (с разложением)» дующими примерами. П р и м е р 1. 5-Хлор-3-(2-теноил)-2-оксиндол-1-карбоксамид. Вычислено, %\ С 52,29; Н 3,59; N 11,09. 4 1445556 амина. Готовый раствор охлаждают до M 50 С, добавляют в него 65 г обесцвеНайдено, Z: С 52,08; И 3,63; чивающего у г л я , после чего раствор N 11,04. повторно нагревают до температуры* П р и м е р 4. В результате реаккипения с обратным холодильником и ций соответствующих 2-оксиндол-1-карвыдерживают в этих условиях в т е ч е боксамидов с активированными произние 1 ч . Горячий раствор профильтроводными требуемой карбоновой кислоты вывают через продукт "сьюперсел" формулы R -СО-ОН в основном согласно 10 (диатомовая земля) и фильтрат охлажвышеизложенному в примере 1 или придают до 40 С. В фильтрат добавляют мере 3 получают соединения, приведенпостепенно в течение 30 мин 392 мл ные в табл. 2. концентрированной соляной кислоты. П р и м е р 5. В результате реакЭту смесь охлаждают до 20-23 С, пеции 2-теноилхлорида и 2-фуроилхлорида с 5,6-метилендиокси-2-оксиндол-1-кар- 15 ремешивают в течение 30 мин, после •чего твердый материал собирают фильтбоксамидом в соответствии с процедурованием и промывают метанолом. Тверрой примера 1 получают соединения: дый материал высушивают, в результа5» 6-метилендиокси-3-(2-теноил)-2— те чего получают 589 г указанного оксиндол-1-карбоксамид с т . п л . 21520 соединения с т.ил. 229-23195 С (с 217 С (с разложением); разложением). 5,6-метилендиокси-З-(2-фуроил)-2оксиндол-1-карбоксамида с т . п л . 234П р и м е р 8. Этаноламиновая 235°С (с разложением). соль 5-хлор-3-(2-теноил)-2-оксиндолП р и м е р 6. В результате 1-карбоксамида. реакции соответствующего хлорангид25 Шлам 321 мг (1,0 ммолк) 5-хлор-Зрида кислоты с требуемым 2-оксиндолС2-теношт)-2-оксиндол-1-карбоксамида 1-карбоксам/адом согласно процедуре в 25-30 мл диизопрогтилового спирта примера 1 могут быть получены соединагревают до температуры кипения, поснения, приведенные в табл. 3.' ле чего добавляют в него раствор 30 67 мг этаноламина в 1 мл диизопропиП р и м е р 7. 5~Хлор-3-(2-теко——лового спирта* в результате подучают ил)-2-окснндол-1~карбоксамид. в течение 2-3 мин желтый раствор. В перемешиваемый шлам 429,9 г Этот раствор упаривают до объема 12— (2,04 моль) 5-хлор-2~оксиндол-1-карЇЗ мл, после чего ему дают остыть. боксамида в 4 л М,Н-диметилфармамида 35 Полученный твердый материал выделяют добавляют 547,9 г (4,48 моль) 4-(N,Nфильтрованием, в результате чего в диметилакнно)пиридина, а затем смесь виде желтых кристаллов получают охлаждают до 8 С, В эту смесь при пе255 мг указанной соли с т.пл. 165,5ремешивании добавляют раствор 328 г 167°С (со слабым разложением). (2,23 моль) теноилхлорида в 800 мл 40 Вычислено, %: С 50,32; Н 4,22; Г^Ы-диметилформамида в течение 30 мин, 'N U,00. причем температуру поддерживают в C 1 6 H ( 6 C1N,O 4 S. интервале 8-15°С. Перемешивание проНайдено, %: С 50,52; Н 4,44; должают в течение 30 мин, а затем реN 10,88. акционную смесь выливают при переме45 П р и м е р 9. Натриевая соль шивании в смесь 510 мл концентриро5-хлор-3-(2—теноил)-2-оксиндап—1ванной соляной кислоты с 12 л воды. карбоксамида^. Перемешивание далее продолжают в теЧасть А. В перемешиваемый шлам чение 2 ч, после чего твердый матери20 г (62,4 ммоль) 5-хлор-3-(2-теноал собирают фильтрованием, промывают 50 ил)-2-ОКСИНДОЛ-1-карбоксамида в вначале водой, а затем метанолом. 400 мл метанола по каплям при комТвердый материал высушивают с полунатной температуре добавляют 4,14 мл чением 675,6 г указанного соединения. (68,6 ммоль) этаноламина. В приготовЧасть (673,5 г, 2,1 моль) указанленный таким образом раствор добавного соединения добавляют в 13 л ме55 ляют раствор (6,74 г, 124,7 ммоль) танола и смесь нагревают до темпераметоксида натрия в метаноле. Конечтуры кипения с обратным холодильниную смесь нагревают до температуры ком. В перемешиваемую сме~сь далее приблизительно 90 С, после чего ей добавляют 136 г (2,22 моль) этанолдают охладиться и перемешивают в те 1445556 6 что вместо порошкообразного метоксида чение ночи. Образовавшийся твердый натрия используют раствор 7,00 г гидматериал выделяют фильтрованием и рата окиси калия в метаноле. В р е высушивают при комнатной температуре зультате получают моногидрат калиевой в вакууме в течение ночи, в резульсоли 5-хлор-3-(2-теноил)-2-оксиндолтате чего получают 18,12 г сырого ) продукта. Этот сырой продукт пере1-карбоксамида с т.пл, 214-216 С. кристаллизовывагот из смеси метанола Вычислено, %: С 44,30; Н 2 , 9 3 ; с изопропанолом, в результате чего N 7,41. получают 1,73 г первой порции и 10 10,36 г второй порции моногидрата Найдено, %: С 44,29; Н 2,67; натриевой соли 5-хлор-3-(2~теноил)N 7,22. 2-оксиндол-1-карбоксамида. Обе порП р и м е р 11. Аммониевая соль ции продукта плавятся при 236-238°С. 5-хлор-З-(2-теноил)-2-окскндол-t-карВычислено, %: С 4 6 , 4 8 ; Н 3,06; 15 боксамида. Указанную соль получают в основном N 7,74, С HftClN.,OlSNa-HzO в соответствии с процедурой примера Найдено, %: 1-я порция; G 46,99 9 части В с использованием раствора аммиака в метаноле вместо порошкообН 2,68; N 7,98; 2-я порция: С 46,71; Н 2,70; 20 разного метоксида натрия. В результате получают безводную соль с т.пл. N 7,79. Остаток первой порции высушивают. 2ОЗ-2О4°С. В результате получают безводную натВычислено, %: С 49,64; Н 3,86; риевую соль 5-хлор-3-(2-теноил)-2N 12,41.' оксиндол-1-карбоксамида с т.пл. 237- 25 C 1 4 H 6 C1N 1 SO,-NH 4 238°С. Найдено, %: С 49,75; Н 3,53; Данные элементарного анализа для N 12,20. остатка первой порции продукта. П р и м е р 12. 2-0ксиндол-1-карВычислено,•%: С 48,92; Н 2,64; боксамид. N 8,15. 30 В раствор 194 мг (1,0 ммоль) 2-42уреидофенил)-уксусной кислоты в 4 мл Найдено, %: С 48,23; Н 2,81; трифторуксусной кислоты добавляют N 7,89. і 630 мг (3,0 ммоль) трифторуксусного Часть В,В перемешиваемый шлам 20 г ангидрида и затем смесь выдерживают (62,4 ммоль) 5-хлор-3-(2-теноил)-2при температуре кипения с обратным 35 оксиндол-1-карбоксамида в 400 мл метахолодильником в течение примерно 1 ч. нола добавляют 4,14 мл (68,6 ммоль) Далее реакционную смесь охлаждают и этаноламина (по каплям, при выпариванием в вакууме удаляют из нее комнатной температуре)» В приготовлен- растворитель. Остаток растворяют в ный таким образом прозрачный раствор 40 5-8 мл насыщенного раствор бикарбодобавляют 6,74 г порошкообразного мената натрия, а материал, который вытоксида натрия и смесь. Твердый матепадает из раствора в осадок, собирают риал, который при этом выпал в осафильтрованием. Полученный таким обрадок, собирают фильтрованием и высушизом твердый материал перекристаллизовают в глубоком вакууме в течение 45 вывагот из этанола с получением 61 мг іїЬчи. В результате получают полугидсоединения в виде бесцветных кристалрат 5-хлор-3-(2-теноил)-2-теноил)-2лов с т.пл. 179—180*С (со слабым разоксиндол—1-карбоксамида с т.пл. 238ложением) . 239°С. Вычислено, %: С 61,36; Н 4,58; Вычислено, %: С 4 7 , 6 7 ; Н 2,85; N 15,91. 50 N 7,94. С , H, B N Z O 2 Найдено, %: С 61,40; Н 4,80; Найдено, %: С 4 7 , 7 2 ; Н-2,73; N 15,77. N 7,70. П р и м е р 13. 5-Хлор-2-оксиндолП р и м е р _10. Калиевая соль 1-карбоксамид. 55 _5~зслор-3- (2-теноил)-2-оксиндол-і-карЦиклизация 4,78 г (0,021 моль) 2боксамида . (5-хлор-2-уреидофеиил)-уксусной кислоты совместно с 8-,0 г (0,063 моль) Процедуру примера 9 части В повтотрифторуксусного ангидрида в 75 мл ряют полностью, за исключением т о г о , 1445556 8 твердого материала. Объединенные портрифторуксуснои кислоты в соответствии ции твердого материала перекристаллис процедурой примера 12 и последующая зовывают растворением я 200 мл ацетоперекристаллизация сырого продукта из ацетонитрила позволяет получить 80 мг 5 нитрила с последующим концентрированием раствора под пониженным давленисоединения с т . п л . 2\ V С (с разложеем до остаточного объема примерно нием) . 75 мл. Небольшое количество аморфноВычислено, %: С 5 1 , 3 2 ; К 3,52; го материала, который отделяется, отN 13,30. Cq H 7 C l N 2 0 2 10 фильтровывают, фильтрат обесцвечивают Найдено, %: С 5 1 , 3 7 ; Н 3,37; и концентрируют под пониженным д а в л е N 13,53. нием до остаточного объема приблизи14. 2-Оксиндол-іП р и м е р тельно 50 мл, после чего в него карбоксамид. вносят затравочный материал. В р е f,20 г ( 8 , 4 ммоль) хлорсульфонил- 15 зультате получают 3,0 г (38%-ный выизоцианата добавляют в смесь 0,94 ход) соединения в виде темно-красных (7,1 ммоль) 2-оксиндола с 30 мл дикристаллов s которые отфильтровывают этилового эфира и смесь перемешивают и высушивают при комнатной температуре в течение П р и м е р 16. 6-Фтор-5-метил-220 ч . Затем диэтиловый эфир удаляют 20 оксиндол-1-карбоксамид. . • в вакууме и остаток обрабатывают В соответствии с процедурой при10 мл воды и 10 мл 1 н.раствора мера 15 указанное соединение полусоляной кислоты. Далее добавляют чают из 1,0 г (6,0 ммоль) 6-фтор-5125 мл этилацетата и смесь перемешиметил-2-оксиндола и 1,03 г (7,3 ммоль) вают в течение 1 ч. Отделяют этилаце- ^хлорсульфонилизоцианата в 30 мл татную фазу, промывают ее одной 50толуола. Н а стадии гидролиза миллилитровпй порцией 1 и. соляной используют 5 мл воды, в результате кислоты, 2 порциями по 100 мл рассочего получают 0,58-г (46%-ный выход) ла и высушивают над сульфатом магния. продукта с т.пл. 200-203°С. В результате концентрирования получа- 30 ют 0,97 г (7 7%-ный выход) сырого проВычислено, %: С 57,69; Н 4,36; дукта. Перекристаллизация из этанола N 13,46. позволяет получить 0,18 г продукта с т.пл. 177-179°С. Найдено, %: С 57,02; Н 4,41;' П р и м е р 15. 2-0ксиндол-1-кар~ 35 N 12,05. боксамид. Образец хлорсульфонилового промеВ перемешиваемую смесь 5,86 г жуточного продукта перед гидролизом (44,0 ммоль) 2-оксиндола с 160 мл суудаляют и подвергают масс-спектрометхого толуола добавляют 7,47 г рическому анализу с целью точного (52,8 ммоль) хлорсульфонилизоцианата. 40 определения массы, в результате чего Немедленно начинает выделяться хлоустановлено, что молекулярная масса ристый водород. Эту смесь перемешиC(0HSN204SC1 составляет 307,9848. вают при температуре кипения с обратП р и м е р 17. 2-0ксиндол-1-карным холодильником в течение 15 мин, боксамнд. после чего ее охлаждают до комнатной 45 В шлам 13,3 г ( 0 , 1 0 моль) 2-оксинтемпературы. В охлажденную смесь додола в 150 мл толуола добавляют J5,6 r бавляют 50 мл воды (вначале выделяет(0,11 моль) хлорсульфонилизоцианата и ся некоторое количество хлористого реакционную смесь выдерживают над паводорода), после чего эту смесь переровой 'баней в течение 10 мин, причем мешивают в течение 1,5 ч. Твердый 50 почти немедленно после образования и продукт, который при этом выпадает в выпадения осадка в течение приблизиосадок, собирают фильтрованием и высу- тельно 3 мин образуется прозрачный шивают (4,10 г ) . Фильтрат подвергают раствор. Реакционную смесь охлаждают экстракционной обработке 100 мл этилна ледяной бане в течение 30 мин, ацетата, а полученный экстракт промы- 55 после чего твердый материал отфильтвают 2 порциями по 100 мл рассола и ровывают и высушивают на воздухе, высушивают над сульфатом магния. В Полученный таким образом хлорсульрезультате выпаривания экстракта при фониловый промежуточный продукт добавпониженном давлении получают 4,16 г ляют в 240 мл смеси уксусной кислоты 9 1445556 Ю с водой в соотношении 2:1 н полученПри 5-10°С 5,66 г (0,04 молъ) хлорный шлам выдерживают на водяной бане п сульфонилизоцианата добавляют в шлам 6,0 г (0,033 моль) 6-метилтио-2-оксинв течение 10 мин. Далее его охлаждают допа в 60 мл ацетонитрила. Эту реакна бане со льдом, а не совсем белый ционнуга смесь перемешивают в течение твердый материал, который образовы1 ч. Затеи добавляют 100 мл воды и вается, отфильтровывают и высушивают на воздухе. В результате концентрации перемешивание продолжают в течение маточного раствора до вязкой массы и 10 мин. Водный раствор подвергают ее фильтрования получают дополнитель- ю экстракционной обработке 600 мл этилно 1,2 г продукта. Объединенный твер ацетата, после чего экстракт промыдый материал перекристаллизовывагат вают последовательно водой и рассолом, приблизительно из 250 мл этанола с высушивают над сульфатом магния и выполучением 11,48 г (65%-иый выход) паривают под пониженным давлением с продукта. 15 получением серого твердого материала, который перекристаллизовывагзт из П р и м е р 18. Замещенные 2-і. ацотонитрила с получением 3,0 г прооксиндол-1-карбоксамиды. дукта. Дополнительно 0,71 г продукта Реакцией соответствующих 2-оксиндолов с хлореульфонилиэоциаиатом с получают из маточного раствора, •вследпоследующим гидролизом в соответствии 20 ствие чего в общей сложности гютучают с процедурой примера 17 получают пи3,71 г (выход 50,6%) продукта с т.пл. жеследующие согдштпия, приведенные 176-179с'С. в табл. 4. остаток растиремешивание продолжают, в течение 1 ч, рают в воде и выделяют фильтрованием. а затем добавляют раствор 10 г После сушки получают 3,2 г соедине(0,036 моль) 4-бром-З-китродифенила ния с т.пл. 225-227 С. в 50 мл диметилсульфоксида. Эту реак30 В результате реакции 2-оксиндола ционную смесь выдерживают при 100 С с бензоилхлоридом и 2-теноилхлоридомв течение 1 ч, охлаждают и выливают в присутствии хлористого алюминия в в смесь воды со льдом, содержавшую основном согласно вышеизложенной про5 г хлористого аммония. Полученную цедуре получают соответственно нижетаким образом смесь подвергают экст35 следующие соединения: 5-бенэойл-2-окракционной обработке этилацетатом, синдол с т.пл. 203-205 С (ич метаноэкстракты промывают раствором хлорисла) и 5-(2-теноил)-2-оксиндола с того натрия и высушивают над сульфат.пл. 211-213°С (из CH ? CN). том магния. В результате выпаривания в вакууме получают маслоподобный проП р и м е р 50. 5-Ером-2-оксин-дукт, который подвергают хроматогра40 дол может быть получен бромированием фической обработке с использованием 2-оксиндола. силикагеля, а затем перекристаллизо5~н-бутил-2-оксиндол может быть вывают из метанола, получая 6 г диполучен реакцией 5-н-бутилизатина с гидразингидратом, а затем с метоксиметил-2-(3-ннтро-4-дифенил)-малоната 45 Дом натрия в этаноле в соответствии с т.пл, 82-83°С. с процедурой примера получения 5. 5-н-бутилизатин может быть полуЧасть (5 г) вышеуказанного нитрочен из 4-н-бутиланилина его обработ"соединения восстанавливают водородом кой хлоральгидратом и гидроксиламином над платиновым катализатором в смеси 50 мл тетрагидрофурана с 10 мл мета- 5о с последующей циклизацией с помощью серной кислоты в соответствии с часнола под давлением приблизительно тями А и В примера получения 7. 5 кг/кв,'см, получая соответствующий амин., Это последнее соединение кипя5-Этокси-2-оксиндол может быть тят с обратным холодильником в этанополучен конверсией З-окси-6-нитротоле в течение 16 ч, а затем продукт 55 луола в З-этокси-6-нитротолуол по выделяют выпариванием растворителя и стандартным методам (карбонат калия и перекристаллизовывают из метанола, йодистый этил s ацетоне) с последующей получая 1,1 г этил-6~фенил-2-оксинконверсией З-этокси-6-нитротолуола дол-1-карбоксилата с т.пл. 115-117 С. в 5-этокси-2-оксиндола по методу, 1445556 25 26 описанному Бекеттом и др.» для контечение 47 ч, охлаждают, а затем из версии З-метокси-6-нитротолуола в 5нее выпариванием в вакууме удаляют растметокси-2-оксиндол, 5-н-бутокси-2воритель. Остаток растирают в 200 мл оксиндол может быть получен аналогич- 5 диэтилового эфира, а твердый материным путем, но с использованием н-буал собирают фильтрованием и отбрасытилиодида вместо этилиодида. вают в отход. Фильтрат выпаривают в о вакууме, а остаток растирают в изоПример 5 1 . 3-(2-Фуроил)-2пропиловом спирте и удаляют фильтрооксиндол. В перемешиваемый раствор 5,5 г 10 ванием. Твердый материал суспендируют (0,24 моль) натрия в 150 мл этанола в 250 мл воды, которую затем подкиспри комнатной температуре добавляют ляют концентрированной соляной кис13,3 г (0,10 моль) 2-оксиндола. Прилотой. Эту смесь перемешивают с полуготовленный шлам охлаждают до темперачением твердого продукта, который туры бани со льдом, а затем по кап15 выделяют фильтрованием. Продукт перелям в течение 10-15 мин добавляют кристаллизовывают из уксусной кисло15,7 г (0,12 моль) 2-фуроилхлорида. ты, а затем из ацетонитрила, получив Баню со льдом удаляют и добавляют 705 мг соединения с т.пл. 185-186 С. дополнительно 100 мл этанола, поспе Вычислено, %: С 68,72; Н 3,99; чего реакционную смесь выдерживают 20 N 6,17. при температуре кипения с обратным C,*H 4 O,N холодильником в течение 7 ч. Далее Найдено, %: С 6 8 , 7 2 ; К 4 , 1 4 ; реакционной смеси дают постоять в теN 6,14. чение ночи, а затем из нее отфильт/ П р и м е р 5 4 . 5-Амино-2-6ксинровывают твердое вещество. Это твер25 дол-1- карбоксамид. дое вещество добавляют в 400 мл воды В раствор 5,0 г 5--нитро-2-оксини приготовленную смесь подкисляют с дол-1-карбоксамида в 110 мл Ы,Ы-дииспользованием концентрированной сометилформамида добавляют 0,5 г ляной кислоты. Смесь охлазвдают льдом 10%-иого палладия на угле и пригои твердый материал собирают фильтро30 товленную смесь подвергают встряхи-* ванием. Этот твердый остаток переванию в атмосфере водорода под накристаллиэовывают из 150 мл уксусной чальным давлением 5 кг/кв.см до преккислоты, в результате чего получают ращения процесса поглощения водорода. 8,3 г желтых кристаллов с т.пл. 209Катализатор удаляют фильтрованием, 210 С (с разложением). 35 фильтрат разбавляют рассолом и подВычислено, %: С 68,72; Н 3,99; вергают экстракционной обработке N 6,17. этилацетатом. Экстракты высушивают С„ H,O^N над сульфатом магния и выпаривают в Найдено, %: С 68,25; И 4,05; вакууме, получив маслоподобный проN 6,20. 40 дукт темной окраски, который после П р и м е р 52. В результате рерастирания в воде затвердевает. Б акции 2-оксиндола с соответствующим результате в виде желтого твердого хлорангидридом кислоты согласно метопродукта получают 3,0 г соединения ду примера получения 51 получают дос т.пл. 189-191*С. полнительные соединения: 3-(2-тено45 Соединения формулы I обладают йл)-2-оксиндол с т.пл. 189-190°С, анальгетическим действием. Это дей17%-нын выход; 3-[2-(2-тиенил)-ацествие продемонстрировано на мышах тил]-2-оксиндол с т.пл. 191-192,5^0, путем блокирования брюшинного стя38%-ный выход и 3-(2-феиоксиацетил)гивания, вызванного введением в ор 2-оксиндол с т.пл. 135-136 С, 42%-ный 50 ганизм 2-фенил-1,4-бензохинона (ФБХ). выход. Использованная при этом методика осПример 53. 3-(3-Фуроил)-2~ нована на методике Зигмунда и др., оксиндол. приспособленной для высокого расхода Б перемешиваемый раствор 2,8 г в единицу времени. В качает- v (0,12 моль) натрия в 200 мл этанола 55 ве подопытных животных в ходе продобавляют 13,3 г (0,10 моль) 2-оксинведения данных экспериментов испольдола» а затем 16,8 г этил-3-фуроата. зовали самцов мышей Каруорта^альбиЭту смесь выдерживают при температуре носов расы CF-1 весом 18-20 г.Перед кипения с обратным холодильником в введением лекарственных препаратов 27 28 1445556 стеклянном цилиндре, соединенном с и испытаниями всем животным в течепреобразователем давления Статхема. ние ночи не давали корма. Выход преобразователя через регулиСоецинения формулы I растворяли рующее устройство соединялся с микили суспендировали в основе для прировольтметром. Это позволяло отмеготовления лекарств, которая включачать объем ртути, вытесненный погрула 5% этанола, 5% продукта "змульженной в нее лапой. Лекарственные фор 260" (смесь эфиров полиокси-этилепрепараты давали животным насильстновой жирной кислоты) и 90% соли. Эта основа для приготовления лекарств Ю венным скармливанием. Спустя 1 ч после введения в их организм лекарел/жила также в качестве контрольноственного препарата у них вызывали го материала. Дозировки готовили в отек инъекцией 0,05 мл 1%-ного растсоответствии с логарифмической шкавора каррагепина в ткань подошвы нолой, т.е. . ..0,32; 1,0; 3,2; I5 меченной лапы. Немедленно после этого 10,32 ... мг/кг, т рассчитывали по і измеряли объем лапы с вздутием в ревесу соли, когда применяли или не зультате инъекции. Увеличения объема применяли кнепоту. Вводили в оргапапы спустя 3 ч после инъекции, карранизм лерорально в концентрациях, генина составляло индивидуальную которые изменяли с целью обеспечить 20 воспалительную реакцією. постоянную дозировку 10 мг/гсг веса животного. Вышеуказанная методика Полученные при этом результаты Милна и Туми была использована для приводятся как в % иигибирования обраопредепения эффективности и потензования отека, обусловленного каждым ции. Соединения вводили мышам пероиспытуемым соединением по сравнению рально спустя 1 ч после внутрибрю25 с контролем (т.е. только носителем^ шинного введения ФЕХ в количестве не содержащим никакого соединения) 2 мг/кг живого поса. Мышеи немедлен(табл, 6 ) . но после этого помещали в индивидуАнальгетическое, действие соединеальные теплые прозрачные камеры, и ний формулы I подтверждает их полез™ по истечении 5 мин поспе введения 30 ность для экстренного введения в оргаФБХ подсчитывали число перетяжек низм млекопитающих с целью утоления брюшины в течение последующих 5 мин. боли, например послеоперационной боСтепень анальгетической защиты ли и боли при травмах. Кроме того, (САЗ, %) рассчитывали с учетом эфсоединения формулы I могут быть исфективности подавления перетяжек пользованы для постоянного введения 3 5 брюшины в сравнении с их числом у в организм млекопитающих с целью параллельных животных контрольной смягчения симптомов хронических загруппы на тот же самый день. По меньболеваний, в частности воспаления шей мере четыре таких определения при ревматоидном артритеэ и боли І (N5: 5) позволяли получить данные ре- 40 связанной с остеоартритом и другими акции на дозировку и рассчитать САЗЭД, чышечно-скелетными расстройствами. т*е. лучшую расчетную дозировку(КоВ том случае, когда соединение торая снижает число перетяжек брюформулы I или его фармацевтически шины па 50% Б сравнении с числом у приемлемую соль необходимо использоживотных контрольной группы. 45 вать в качестве либо анальгетического агента, либо противовоспалительного Соединения формулы I обладают агента, его можно вводить в организм также противовоспалительным действимлекопитающих либо индивидуально* ем. Это действие продемонстриролибо,' что предпочтительнее, в сочетавано на крысах по методике, основан50 нии с фармацевтически приемлемыми: ноной на стандартном испытании на отесителями (наполнителями) или разбаке лапы крысы, вызываемом введением вителями в составе фармацевтической коррагенина. композиции согласно стандартной фарИеаиастезированных взрослых саммацевтической практике. Это соедицов белой крысы весом 150-190 г пересчитали, взвесили и на правые боко- 55 некие следует вводить пероральнымвые лодыжки животных нанесли чернильили парентеральным путем,Перенте— ные метки. Каждую папу погрузили в ральный путь включает внутривенный, ртуть точно до уровня чернильной, метвнутримышечный, внутрибрюшинный^подки. Ртуть при этом содержалась в кожный и местный методы введения» 30 29 1445556 При пероральном применении соедиБиологические данные. нений формулы I такое соединение Значение Е Л 5 О Д Л Я 5-хлор-З-(2-тено-, можно вводить в организм, в частносил)-2- оксиндол-1-карбоксамида (где ти, в форме таблеток или капсул * , X - хлор и находится в 5 положении или в виде водных растворов или сусмолекулы, Y - водород и R - 2-тиенил),
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing derivatives of 2-oxoindoyl-1-carboxamide
Автори англійськоюSol Bernard Cadin
Назва патенту російськоюСпособ получения производных 2-оксоиндол-1-карбоксамида
Автори російськоюСол Бернард Кадин
МПК / Мітки
МПК: C07D 409/06, C07D 491/056, C07D 403/06, A61P 29/00, A61K 31/40, C07D 407/06, C07D 413/06, A61P 25/04, C07D 209/34, C07D 209/42, C07D 417/06, C07D 513/04, A61K 31/404, A61K 31/403
Мітки: спосіб, 2-оксоінділ-1-карбоксаміда, одержання, похідних
Код посилання
<a href="https://ua.patents.su/36-6343-sposib-oderzhannya-pokhidnikh-2-oksoindil-1-karboksamida.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних 2-оксоінділ-1-карбоксаміда</a>
Попередній патент: Пристрій для тривалого визволення лікарської речовини у рубцево-сітковому відділі шлунку жуйних тварин
Наступний патент: Спосіб одержання бензолсульфонатної солі 3-етіл-5метілового ефіру 2-(2-аміноетоксіметіл)-4-(2-хлорфеніл)-6-метіл-1,4-дігідропірідін-3,5-дікарбонової кислоти
Випадковий патент: Антифрикційний порошковий матеріал на основі міді