Хіназолінові інгібітори активувальних мутантних форм рецептора епідермального фактора росту
Номер патенту: 115686
Опубліковано: 11.12.2017
Автори: Ван Цзябін, Цзен Цінбей, Лі Дейвід Юньчжі, Ян Чженьфан, Чжан Сяолінь
Формула / Реферат
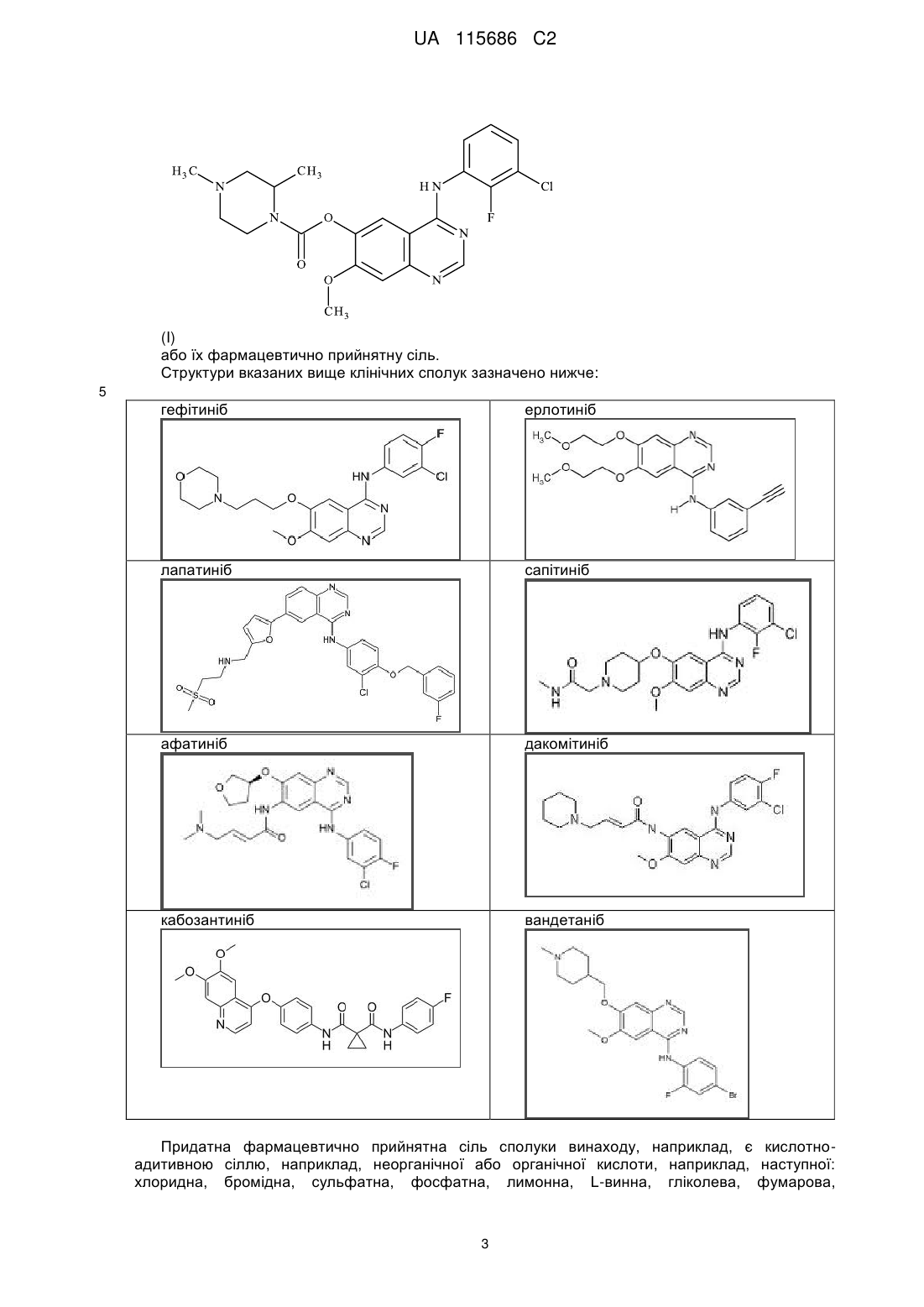
1. Сполука формули (І):
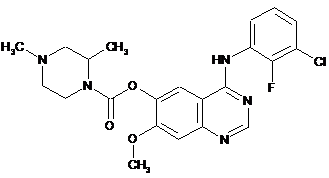 (І)
(І)
або її фармацевтично прийнятна сіль.
2. Сполука формули (І) за п. 1, яка є 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилатом.
3. Сполука формули (І) за п. 1, яка відрізняється тим, що фармацевтично прийнятна сіль сполуки формули (І) є 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилат гідрохлоридом.
4. Сполука формули (І) за п. 1, яка відрізняється тим, що фармацевтично прийнятна сіль сполуки формули (І) є 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилат сукцинатом.
5. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-4 у кристалічній формі.
6. Моно-НСl-сіль сполуки формули (І) за п. 3 у кристалічній формі, яка має рентгенівську дифракцію на порошку принаймні із двома конкретними піками приблизно при 2-тета = 12,3° та 13,9°.
7. Моно-НСl-сіль сполуки формули (І) за п 3 у кристалічній формі, яка має рентгенівську дифракцію на порошку з конкретними піками приблизно при 2-тета = 12,3, 13,9, 9,3, 23,3, 18,7, 16,0, 24,6, 26,8, 28,0°.
8. Сукцинатна сіль сполуки формули (І) за п. 4 у кристалічній формі, яка має рентгенівську дифракцію на порошку принаймні із трьома конкретними піками приблизно при 2-тета = 6,5°, 17,7° та 14,7°.
9. Сукцинатна сіль сполуки формули (І) за п. 4 у кристалічній формі, яка має рентгенівську дифракцію на порошку з конкретними піками приблизно при 2-тета = 6,5, 17,7, 14,7, 9,2, 26,5, 20,2, 13,1, 27,3, 24,0°.
10. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль за будь-яким з пп. 1-9, разом з фармацевтично прийнятним розріджувачем або носієм.
11. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-9 для застосування як медикаменту.
12. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-9 у виготовленні медикаменту для інгібування активувального мутантного EGFR у теплокровної тварини, як-то людина.
13. Спосіб отримання протиракової дії у теплокровної тварини, як-то людина, яка потребує такого лікування, який полягає в застосуванні до цієї тварини ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-9.
14. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-9 для застосування в лікуванні немалоклітинного раку легенів.
15. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-9 для застосування в лікуванні метастатичного немалоклітинного раку легенів.
16. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-9 у комбінації із протипухлинним засобом, вибраним з:
(і) анти-СТLА-4-антитіла;
(іі) 6-(4-бромо-2-хлоро-феніламіно)-7-флуоро-3-метил-3H-бензімідазол-5-карбонової кислоти (2-гідроксіетоксі)-аміду або його фармацевтично прийнятної солі;
(ііі) анти-PD-L1-антитіла;
(iv) 1-[(1S)-1-(імідазо[1,2-а]піридин-6-іл)етил]-6-(1-метил-1Н-піразол-4-іл)-1H-[1,2,3]триазоло[4,5-b]піразину або його фармацевтично прийнятної солі;
(v) анти-PD-1-антитіла; або
(vi) антитіла ОХ40-агоністу.
Текст
Реферат: Винахід стосується сполук формули (І) або їх фармацевтично прийнятної солі: H3 C CH3 N N HN Cl O N F O O CH3 N (I), РЕЦЕПТОРА UA 115686 C2 (12) UA 115686 C2 які мають інгібіторну активність проти активувальних мутантних форм EGFR, та, відповідно, є корисними щодо їх активності проти раку, та способів лікування людини або організму тварини. Винахід також стосується фармацевтичних композицій, які їх містять, та їх застосування у виготовленні медикаментів для застосування в отриманні дії проти раку в теплокровної тварини, як-то людина. UA 115686 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід стосується певних сполук 4-(заміщених-аніліно)-6-O-(заміщених-піперизинкарбоніл)хіназоліну та їх фармацевтичних солей, які можуть бути корисними в лікуванні або попередженні хвороби, або медичного стану, опосередкованих через активувальні мутантні форми рецептору епідермального фактору росту (EGFR), наприклад, як-то активувальний мутант L858R та/або активувальний мутант делеції Екзон 19. Такі сполуки та їх солі можуть бути корисними в лікуванні або попередженні чисельності різних видів раку. Винахід також стосується фармацевтичних композицій, які містять названі сполуки або їх фармацевтичну сіль, кристалічні форми цих сполук або їх фармацевтичної солі, проміжних сполук, корисних у виготовленні названих сполук або їх фармацевтичної солі, та способів лікування хвороб, опосередкованих активувальними мутантними формами EGFR, які застосовують названі сполуки або їх фармацевтичну сіль. EGFR (інакше відоме як ErbB1 або HER1) є членом трансмембранного білку тирозинкінази сімейства рецептору erbB. Після зв'язування ліганди фактору росту, як-то епідермальний фактор росту (EGF), рецептор може гомодимеризуватися із ще одною молекулою EGFR або гетеродимеризуватися із ще одним членом сімейства, як-то erbB2 (HER2), erbB3 (HER3) або erbB4 (HER4). Гомо- та/або гетеродимеризація рецепторів erbB призводить до фосфорилування ключових залишків тирозину у внутрішньоклітинному домені та призводить до стимулювання численних шляхів внутрішньоклітинної сигнальної трансдукції, залучених у клітинну проліферацію та виживання. Відміна регулювання сигналізації сімейства erbB стимулює проліферацію, інвазію, метастазування, ангіогенез та виживання пухлини клітини, та описано в багатьох раках людини, охоплюючи рак легенів, голови та шиї, та молочної залози. Тому сімейство erbB представляє доцільний об'єкт для розробки протипухлинного препарату, та ряд засобів, націлених на EGFR або erbB2, тепер є клінічно доступними, TM TM TM TM охоплюючи гефітиніб (IRESSA ), ерлотиніб (TARCEVA ) та лапатиніб (TYKERB , TYVERB ). Докладні огляди сигналізації рецептору erbB та його залучення до утворення пухлини передбачено в New England Journal of Medicine [2008] Vol. 358;1160–74 та Biochemical and Biophysical Research Communications [2004] Vol. 319: 1–11. У 2004 повідомлено (Science [2004] Vol, 304: 1497–500 та New England Journal of Medicine [2004] Vol. 350; 2129–39), що активування мутацій в EGFR корельовано з відгуком на лікування гефітинібом немалоклітинного раку легенів (NSCLC). Приблизно 90 % NSCLC-пов'язаних мутацій EGFR містять дві головних мутації EGFR (E746-A750del в Екзон 19 та мутацію заміщення L858R в Екзоні 21) (Pao et al. Proceedings of the National Academy of Sciences of the United States of America [2004], Vol, 13: 306-11 та Kosada et al. Рак Research [2004]Vol. 64: 891923). Ці активувальні мутації призводять до зростання спорідненості до інгібіторів малої молекули тирозинкінази, як-то гефітиніб та ерлотиніб, та зменшення спорідненості до аденозин трифосфату (АТФ) стосовно дикого тиру (WT) EGFR. Однак, повідомлено про шкідливі дії, як-то висип на шкірі та діарея, які вважають пов'язаними з інгібуванням сигнальних шляхів WT EGFR в нормальній шкірі та клітинах кишки, в >60 % пацієнтів NSCLC, яких лікували гефітинібом або ерлотинібом (Zhou CC et al. Journal of Clinical Oncology [2011], Vol. 12: 735-42; Mok TS et al. New England Journal of Medicine [2009], Vol. 361: 947-57). Крім того, гефітиніб та ерлотиніб показали обмежені результати при лікуванні пацієнтів NSCLC із метастазом мозку, оскільки ніякий із них не перетинав гематоенцефалічний бар'єр (BBB) (McKillop D et al. Xenobiotica [2004], Vol. 34: 983-1000; Jackman DM et al. Journal of Clinical Oncology [2006], Vol. 24: 4517-20 Grommes C et al. Neuro-Oncology [2011], Vol. 13: 13649), тоді як деякі повідомлення сповіщають, що виявлено метастаз мозку при раку легенів при незадоволеній медичній потребі (Gavrilovic et al., Journal of Neurooncology [2005], Vol. 75: 5-14; Barnholtz-Sloan JS et al. Journal of Clinical Oncology [2004], 22: 2865-72; Schouten LJ et al, Cancer [2002], Vol. 94: 2698-705). Лептоменінгеальні метастази виникають, коли рак розповсюджується до оболонок мозку, шару тканини, яка покриває мозок та спинний мозок. Метастази можуть розповсюджуватися до оболонок мозку через кров, або це може переноситися від метастазів мозку цереброспінальною рідиною (CSF), яка тече через оболонки мозку. Якщо клітини пухлини попадають до CSF та виживають, вони можуть мігрувати через центральну нервову систему, що спричиняє неврологічні проблеми (Le Rhun et al. Surg Neurol Int. [2013], Vol. 4: S265-88). Число інцидентів лептоменінгеальних метастазів зростає частково внаслідок довшого життя пацієнтів хворих на рак, але також внаслідок багатьох хіміотерапій, та молекулярні цільові лікування є нездатними досягти достатніх концентрацій у цереброспінальній рідині для знищення клітин пухлини. Лікування традиційно були неефективними, та виживання вимірювалися тижнями. AstraZeneca досліджував сапітиніб (AZD8931), інгібітор рівної сили рецепторів EGFR, HER2 та HER3, для 1 UA 115686 C2 5 10 15 20 25 30 35 40 45 50 55 застосування при раку грудної залози. До цього часу сапітиніб досліджено в трьохфазових II клінічних випробовуваннях; перше − в комбінації з паклітакселом у порівнянні тільки з паклітакселом у пацієнтів з розповсюдженим раком грудної залози при експресуванні низьких рівнів HER2; другий − в комбінації з анастрозолом у порівнянні тільки з анастрозолом при позитивному рецепторі гормону в розповсюдженому раку грудної залози; та третій − в комбінації з паклітакселом у порівнянні тільки з паклітакселом при метастатичному, шлунковому або об'єднаному шлунково-кишечному раці, який прогресує протягом першої лінії терапії та є непридатним для лікування трастузумабом статусом HER2. Сполука заявленого винаходу є структурно відмінною від сапітинібу та володіє підсиленими властивостями проникнення до мозку, які роблять її потенційно корисною в лікуванні видів раку, при яких є метастази центральної нервової системи [ЦНС], зокрема, при яких є метастази мозку та які призводять до лептоменінгеальних метастазів. У цей час деякі необоротні інгібітори EGFR хіназоліну, як-то афатиніб та дакомітиніб, є в клінічному розвитку. Хоч ці сполуки показали порівняльні з гефітинібом та ерлотинібом дії на активувальні мутації EGFR у пацієнтів NSCLC, вони продемонстрували більш важкі несприятливі дії, як-то висип на шкірі (>90 % висип на шкірі та діарея) (Zhou CC et al. Journal of Clinical Oncology [2011], Vol. 12: 735-42; Mok TS et al. New England Journal of Medicine [2009], Vol. 361: 947-57; Miller VA et al. Lancet Oncology [2012], Vol. 13: 528-38; Ramalingam SS et al.. Journal of Clinical Oncology [2012], Vol. 30: 3337-44). Сполуки заявленого винаходу є оборотними інгібіторами, та, отже, очікують, що вони мають пов'язані з EGFR менші несприятливі дії ніж афатиніб та дакомітиніб. Розкрито певні сполуки хіназоліну, наприклад, у "Preparation of quinazoline derivatives для treatment of tumors" (US 20080177068 A1), "Preparation of quinazoline derivatives для treatment of tumors" (US 20080167328 A1), "Preparation of saccharide derivatives of quinazolines as protein tyrosine kinase inhibitors " (CN 101857618 A), "Preparation of chlorofluoroanilinomethoxy-Nmethylcarbamoylmethylpiperidinyloxy quinazoline derivatives for use as antitumor agents" (WO 2010061208 A2), "Preparation of 4-aminoquinazoline derivatives as antineoplastic agents (CN 101367793 A)", "Preparation of proline quinazoline derivatives as antiproliferative agents (BR 2006002275 A)", "Preparation of quinazoline derivatives as protein kinase inhibitors" (WO 2005097137 A2), "Preparation of quinazoline derivatives as protein kinase inhibitors" (WO 2005097134 A2), "Preparation of quinazoline derivatives as EGFR tyrosine kinase inhibitors" (WO 2005028469 A1), "Preparation of phenylamino-substituted quinazolines as inhibitors of EGF and ErbB-2 kinases" (WO 2005028470 A1), "Preparation of quinazoline derivatives as EGFR tyrosine kinase inhibitors" (WO 2005026156 A1), "Preparation of piperidyl-quinazoline derivatives as tyrosine kinase inhibitors for the treatment of tumors" (WO 2005012290 A1), "Preparation of 4anilinoquinazolines as antiproliferative agents" (WO 2003082831 A1), "Preparation of aminoquinazolines as epidermal growth factor receptor signal transduction inhibitors ” (WO 2002018351 A1), "Preparation of quinazolines as aurora 2 kinase inhibitors" (WO 2001021594 A1), "Quinazolines and other bicyclic heterocycles, pharmaceutical compositions containing these compounds as tyrosine kinase inhibitors, та processes for preparing them" (WO 2000055141 A1), "Preparation of quinazoline derivatives and their receptor tyrosine kinase inhibitory properties" (WO 9738994 A1), "Quinazoline derivatives as antitumor agents" (WO 9730034 A1), "Preparation of haloanilinoquinazolines as Class I receptor tyrosine kinase inhibitors" (WO 9633980 A1) та "Quinazoline derivatives useful for treatment of neoplastic disease" (US 5457105). Сполуки винаходу або їх фармацевтично прийнятна сіль у порівнянні з іншими клінічно придатними інгібіторами EGFR виявляють певні покращені властивості, наприклад, вище проникнення BBB (отже, це робить їх потенційно корисними для лікування видів раку, при яких утворюються метастази ЦНС, зокрема, метастази мозку та лептоменінгеальні метастази); демонструють кращу селективність поміж WT EGFR та мутантним EGFR (що може призводити до менших побічних ефектів лікування − висипу на шкірі та діареї); при підтриманні рівнозначної або покращеної активності проти активувального мутантного EGFR (наприклад, L858Rактивувальний мутант EGFR та/або активувальні мутанти делеції Екзон 19). Отже, такі сполуки або їх фармацевтично прийнятна сіль можуть бути особливо корисними в лікуванні хворобливих станів, у яких залучено ці активувальні мутації EGFR, наприклад, у лікуванні раку. Відповідно, згідно із заявленим винаходом запропоновано сполуку формули (I): 2 UA 115686 C2 (I) або їх фармацевтично прийнятну сіль. Структури вказаних вище клінічних сполук зазначено нижче: 5 гефітиніб ерлотиніб лапатиніб сапітиніб афатиніб дакомітиніб кабозантиніб вандетаніб Придатна фармацевтично прийнятна сіль сполуки винаходу, наприклад, є кислотноадитивною сіллю, наприклад, неорганічної або органічної кислоти, наприклад, наступної: хлоридна, бромідна, сульфатна, фосфатна, лимонна, L-винна, гліколева, фумарова, 3 UA 115686 C2 5 10 15 20 25 30 35 40 45 50 55 60 бурштинова або малеінова кислота, головним чином, − хлоридна, бромідна, сульфатна, фосфатна, лимонна, L-винна, гліколева, фумарова або малеінова кислота. Конкретна фармацевтично прийнятна сіль сполуки винаходу − сіль хлоридної кислоти. Подальша конкретна фармацевтично прийнятна сіль сполуки винаходу − сіль бурштинової кислоти. Фахівцю слід розуміти, що додаткові кислотно-адитивні солі, наприклад, але без обмеження щодо показаних у прикладах, також можуть бути вірогідними. Солі сполук формули (I) можна отримувати, наприклад, реакцією сполуки формули (I) з кількістю кислоти в середовищі, в якому сіль осаджується, або у водному середовищі після ліофілізації. Сполуки формули (I) або їх фармацевтично прийнятна сіль мають хіральний центр. Зрозуміло, що згідно з винаходом охоплено всі стереомери (енантіомери та діастереомери) сполук формули (I) або їх фармацевтично прийнятної солі, які володіють активізацією інгібіторної активності активувального мутантного EGFR. Винахід далі стосується будь-якої та всіх таутомерних форм сполук формули (I) або їх фармацевтично прийнятної солі, які володіють активізацією інгібіторної активності мутантного EGFR. Згідно з наступним аспектом винаходу запропоновано енантіомер формули (I) або його фармацевтично прийнятну сіль, суттєво, вільні від будь-яких інших енантіомерів. Згідно з наступним аспектом винаходу запропоновано (R)енантіомер формули (I) або його фармацевтично прийнятну сіль, суттєво, вільні від будь-яких інших енантіомерів. Згідно з наступним аспектом винаходу запропоновано (S)-енантіомер формули (I) або його фармацевтично прийнятна сіль, суттєво, вільні від будь-яких інших енантіомерів. В одному втіленні винаходу, де суміш містить нерівні молярні пропорції енантіомерів, суміш може мати енантіомерний надлишок, вибраний з >50 %, >70 %, >90 % та >95 %. Конкретно, суміш може мати енантіомерний надлишок >98 %. Конкретніше, суміш може мати енантіомерний надлишок >99 %. Ще конкретніше, суміш може мати енантіомерний надлишок >99,5 %. Також зрозуміло, що певні сполуки формули (I) або їх фармацевтично прийнятна сіль можуть існувати в сольватованій, а також у несольватованій формах, як-то, наприклад, гідратовані форми. Слід розуміти, що згідно з винаходом охоплено всі такі сольватовані формі, які володіють активізацією інгібіторної активності мутанту EGFR. У подальшому слід розуміти, що згідно з винаходом охоплено всі ізотопічні форми описаних 12 13 тут сполук. Наприклад, гідроген включає дейтерій, та карбон включає C та C. Згідно із ще одним аспектом винаходу конкретні сполуки винаходу − будь-які з одного з прикладів або їх фармацевтично прийнятна сіль. Згідно із ще одним аспектом винаходу конкретні сполуки винаходу вибрано з наступного: 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2R)-2,4-диметилпіперазин-1карбоксилат; 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2S)-2,4-диметилпіперазин-1карбоксилат; та 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (±) 2,4-диметилпіперазин-1карбоксилат; або їх фармацевтично прийнятна сіль. Згідно із ще одним аспектом винаходу конкретні сполуки винаходу вибрано з наступного: 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2R)-2,4-диметилпіперазин-1карбоксилат; 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2S)-2,4-диметилпіперазин-1карбоксилат та 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (±) 2,4-диметилпіперазин-1карбоксилат. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з фармацевтично прийнятної солі 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)2,4-диметилпіперазин-1-карбоксилату. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з 4-[(3-хлоро-2флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2R)-2,4-диметилпіперазин-1-карбоксилату гідрогенхлориду. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з 4-[(3-хлоро-2флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилату сукцинату. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з 4-[(3-хлоро-2флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилату. 4 UA 115686 C2 5 10 15 20 25 30 35 Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з фармацевтично прийнятної солі 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2S)2,4-диметилпіперазин-1-карбоксилату. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з 4-[(3-хлоро-2флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2S)-2,4-диметилпіперазин-1-карбоксилату. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з фармацевтично прийнятної солі 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (-)2,4-диметилпіперазин-1-карбоксилату. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з 4-[(3-хлоро-2флуорофеніл)аміно]-7-метоксихіназолін-6-іл (-)-2,4-диметилпіперазин-1-карбо ксилату. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з фармацевтично прийнятної солі 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (+)2,4-диметилпіперазин-1-карбоксилату. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з 4-[(3-хлоро-2флуорофеніл)аміно]-7-метоксихіназолін-6-іл (+)-2,4-диметилпіперазин-1-карбо ксилату. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з фармацевтично прийнятної солі 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (±) 2,4-диметилпіперазин-1-карбоксилату. Згідно із ще одним аспектом винаходу конкретну сполуку винаходу вибрано з 4-[(3-хлоро-2флуорофеніл)аміно]-7-метоксихіназолін-6-іл (±) 2,4-диметилпіперазин-1-карбо ксилату. Якщо тут цитовано оптичні ротації (+) або (-), їх конкретно визначено при c10, де c − концентрація в г/мл, в ДМСО при 25ºC. Також зрозуміло, що певні сполуки винаходу або їх фармацевтично прийнятна сіль можуть існувати в певних кристалічних формах. Зокрема, 4-[(3хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2R)-2,4-диметил піперазин-1-карбоксилат ідентифіковано як такий, що має кілька кристалічних форм, як-то Форма A, Форма E, Форма I та Форма J. Крім того, хлоридна сіль 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилату також може існувати в кристалічній формі, конкретно − формі А1 моно-HCl солі, та сукцинатна сіль 4-[(3-хлоро-2-флуорофеніл)аміно]-7метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилату також може існувати в кристалічній формі, конкретно, формі А8 сукцинатної солі. Слід розуміти, що згідно із заявленим винаходом охоплено всі такі кристалічні форми сполук формули (I) або їх фармацевтично прийнятної солі, які володіють активізацією інгібіторної активності мутантного EGFR. 4-[(3-Хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2R)-2,4-диметил піперазин-1карбоксилат у кристалічній формі, формі А Форму А охарактеризовано, принаймні, одною з наступних 2θ величин, виміряних із застосуванням радіації CuKa: 23,3 та 14,3°. Форму А охарактеризовано при застосуванні рентгенівської дифракції на порошку, суттєво, як показано на фігурі 1. Десять піків рентгенівської дифракції на порошку показано в таблиці A: Таблиця A Кут 2-тета (2θ) 23,3 14,3 9,4 18,6 16,3 21,5 12,4 26,1 19,8 27,4 Інтенсивність % 100,00 83,70 78,08 61,70 60,41 39,61 38,89 38,18 35,71 31,12 40 45 Десять піків рентгенівської дифракції на порошку для форми А Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму А, яка має рентгенівську дифракцію на порошку, принаймні, із двома конкретними піками, приблизно, при o o 2-тета = 23,3 та 14,3 . Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму А, яка має рентгенівську дифракцію на порошку з конкретними піками, приблизно, при 2-тета = 23,3, 14,3, o 9,4, 18,6, 16,3, 21,5, 12,4, 26,1, 19,8, 27,4 . 5 UA 115686 C2 5 10 15 Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму А, яка має рентгенівську дифракцію на порошку, суттєво, таку саму, як рентгенівська дифракція на порошку, показна на фігурі 1. Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму А, яка має o рентгенівську дифракцію на порошку, принаймні, із двома конкретними піками при 2-тета = 23,3 o o та 14,3 , де названі величини можуть бути плюс або мінус 0,2 2-тета. Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму А, яка має рентгенівську дифракцію на порошку з конкретними піками при 2-тета = 23,3, 14,3, 9,4, 18,6, o o 16,3, 21,5, 12,4, 26,1, 19,8, 27,4 , де названі величини можуть бути плюс або мінус 0,2 2-тета. Згідно з аналізом DSC форми А показано ендотерму плавлення при досягненні 192,4 °C та пік при 195,8 °C (фігура 2). 4-[(3-Хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2R)-2,4-диметил піперазин-1карбоксилат у кристалічній формі, формі E Форму E охарактеризовано, принаймні, одною з наступних 2θ величин, виміряних при застосуванні радіації CuKa: 7,3 та 13,7°. Форму E охарактеризовано рентгенівською дифракцією на порошку, суттєво, як показано на фігурі 3. Дев'ять піків рентгенівської дифракції на порошку показано в таблиці B: Таблиця B Кут 2-тета (2θ) 7,3 13,7 13,4 17,6 5,6 10,8 21,7 26,5 28,4 20 25 30 35 40 Інтенсивність % 100,00 81,83 74,07 28,89 28,02 19,08 19,04 17,10 13,41 Дев'ять піків рентгенівської дифракції на порошку для форми E Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму E, яка має рентгенівську дифракцію на порошку, принаймні, із двома конкретними піками, приблизно, при o o 2-тета = 7,3 та 13,7 . Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму E, яка має рентгенівську дифракцію на порошку з конкретними піками, приблизно, при 2-тета = 7,3, 13,7, o 13,4, 17,6, 5,6, 10,8, 21,7, 26,5, 28,4 . Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму E, яка має рентгенівську дифракцію на порошку, суттєво, таку саму як рентгенівська дифракція на порошку, показна на фігурі 3. Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму E, яка має o рентгенівську дифракцію на порошку, принаймні, із двома конкретними піками при 2-тета = 7,3 o o та 13,7 , де названі величини можуть бути плюс або мінус 0,2 2-тета. Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму E, яка має рентгенівську дифракцію на порошку з конкретними піками при 2-тета = 7,3, 13,7, 13,4, 17,6, 5,6, o o 10,8, 21,7, 26,5, 28,4 , де названі величини можуть бути плюс або мінус 0,2 2-тета. Згідно з аналізом DSC форми E показано ендотерму плавлення при досягненні 194,2 °C та пік при 196,3 °C (фігура 4). 4-[(3-Хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2R)-2,4-диметил піперазин-1карбоксилат у кристалічній формі, формі I Форму I охарактеризовано, принаймні, одною з наступних величин 2θ, виміряних при застосуванні радіації CuKa: 3,5 та 7,0°. Форму I охарактеризовано рентгенівською дифракцією на порошку, суттєво, як показано на фігурі 5. Десять піків рентгенівської дифракції на порошку показано в таблиці C: 6 UA 115686 C2 Таблиця C Кут 2-тета (2θ) 3,5 7,0 9,5 6,4 14,3 18,0 16,4 15,3 4,7 21,3 5 10 15 20 25 Інтенсивність % 100,00 41,22 32,57 32,54 25,70 24,80 22,12 10,95 7,05 4,54 Десять піків рентгенівської дифракції на порошку для форми I Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму I, яка має рентгенівську дифракцію на порошку, принаймні, із трьома конкретними піками, приблизно, при 2-тета 3,5°, 7,0° та 9,5°. Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму I, яка має рентгенівську дифракцію на порошку з конкретними піками, приблизно, при 2-тета = 3,5, 7,0, 9,5, o 6,4, 14,3, 18,0, 16,4, 15,3, 4,7, 21,3 . Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму I яка має рентгенівську дифракцію на порошку, суттєво, таку саму як рентгенівська дифракція на порошку, показна на фігурі 5. Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму I, яка має рентгенівську дифракцію на порошку, принаймні, із трьома конкретними піками при 2-тета = o 3,5°, 7,0° та 9,5°, де названі величини можуть бути плюс або мінус 0,2 2-тета. Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму I, яка має рентгенівську дифракцію на порошку з конкретними піками при 2-тета = 3,5, 7,0, 9,5, 6,4, 14,3, o o 18,0, 16,4, 15,3, 4,7, 21,3 , де названі величини можуть бути плюс або мінус 0,2 2-тета. Згідно з аналізом DSC форми I показано ендотерму плавлення при досягненні 193,3 °C та пік при 195,9 °C (фігура 6). 4-[(3-Хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2R)-2,4-диметил піперазин-1карбоксилат у кристалічній формі, формі J Форму J охарактеризовано, принаймні, одною з наступних величин 2θ, виміряних при застосуванні радіації CuKa: 7,8 та 7,0°. Форму J охарактеризовано рентгенівською дифракцією на порошку, суттєво, як показано на фігурі 7. Десять піків рентгенівської дифракції на порошку показано в таблиці D: Таблиця D Кут 2-тета (2θ) 7,8 7,0 4,9 15,9 17,7 3,4 20,7 9,8 13,9 12,7 30 Інтенсивність % 100,00 49,36 45,57 27,11 20,89 17,30 16,71 14,59 14,11 10,83 Десять піків рентгенівської дифракції на порошку для форми J Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму J, яка має рентгенівську дифракцію на порошку, принаймні, із двома конкретними піками, приблизно, при o o 2-тета = 7,8 та 7,0 . 7 UA 115686 C2 5 10 15 20 Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму J, яка має рентгенівську дифракцію на порошку з конкретними піками, приблизно, при 2-тета = 7,8, 7,0, 4,9, o 15,9, 17,7, 3,4, 20,7, 9,8, 13,9, 12,7 . Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму J яка має рентгенівську дифракцію на порошку, суттєво, таку саму як рентгенівська дифракція на порошку, показна на фігурі 7. Згідноіз заявленим винаходом тут запропоновано кристалічну форму, форму J, яка має o рентгенівську дифракцію на порошку, принаймні, із двома конкретними піками при 2-тета = 7,8 o o та 7,0 , де названі величини можуть бути плюс або мінус 0,2 2-тета. Згідно із заявленим винаходом тут запропоновано кристалічну форму, форму J, яка має рентгенівську дифракцію на порошку з конкретними піками при 2-тета = 7,8, 7,0, 4,9, 15,9, 17,7, o o 3,4, 20,7, 9,8, 13,9, 12,7 , де названі величини можуть бути плюс або мінус 0,2 2-тета. Згідно з аналізом DSC форми J показано ендотерму плавлення при досягненні 193,3 °C та пік при 195,8 °C (фігура 8). 4-[(3-Хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)-2,4-диметил піперазин-1карбоксилат гідрогенхлорид сіль у кристалічній формі, моно-HCl сіль, форма А1 Моно-HCl-сіль форми А1 охарактеризовано, принаймні, одною з наступних величин 2θ, виміряних при застосуванні радіації CuKa: 12,3 та 13,9°. Моно-HCl сіль форми А1 охарактеризовано рентгенівською дифракцією на порошку, суттєво, як показано на фігурі 9. Дев'ять піків рентгенівської дифракції на порошку показано в таблиці E: Таблиця E Кут 2-тета (2θ) 12,3 13,9 9,3 23,3 18,7 16,0 24,6 26,8 28,0 25 30 35 40 45 Інтенсивність % 100,00 40,45 29,34 26,42 20,54 17,94 10,24 8,94 7,90 Дев'ять піків рентгенівської дифракції на порошку для солі моно-HCl Форми А1 Згідно із заявленим винаходом тут запропоновано кристалічну форму солі моно-HCl форми А1, яка має рентгенівську дифракцію на порошку, принаймні, із двома конкретними піками, o o приблизно, при 2-тета = 12,3 та 13,9 . Згідно із заявленим винаходом тут запропоновано кристалічну форму солі моно-HCl форми А1 яка має рентгенівську дифракцію на порошку з конкретними піками, приблизно, при 2-тета = o 12,3, 13,9, 9,3, 23,3, 18,7, 16,0, 24,6, 26,8, 28,0 . Згідно із заявленим винаходом тут запропоновано кристалічну форму солі моно-HCl форми А1, яка має рентгенівську дифракцію на порошку, суттєво, таку саму як рентгенівська дифракція на порошку, показна на фігурі 9. Згідно із заявленим винаходом тут запропоновано кристалічну форму солі моно-HCl форми А1, яка має рентгенівську дифракцію на порошку, принаймні, із двома конкретними піками при 2o o o тета = 12,3 та 13,9 , де названі величини можуть бути плюс або мінус 0,2 2-тета. Згідно із заявленим винаходом тут запропоновано кристалічну форму солі моно-HCl форми А1, яка має рентгенівську дифракцію на порошку з конкретними піками при 2-тета = 12,3, 13,9, o o 9,3, 23,3, 18,7, 16,0, 24,6, 26,8, 28,0 , де названі величини можуть бути плюс або мінус 0,2 2тета. Згідно з аналізом DSC солі моно-HCl форми А1 показано ендотерму плавлення при досягненні 259,6 °C та пік при 261,4 °C (фігура 10). 4-[(3-Хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)-2,4-диметил піперазин-1карбоксилат сукцинатна сіль у кристалічній формі, сукцинатна сіль форми А 8 Сукцинатна сіль форми А8 охарактеризовано, принаймні, одною з наступних 2θ величин, виміряних при застосуванні радіації CuKa: 6,5 та 17,7. Сукцинатна сіль форми А8 охарактеризовано рентгенівською 8 UA 115686 C2 дифракцією на порошку, суттєво, як показано на фігурі 11. Дев'ять піків рентгенівської дифракції на порошку показано в таблиці F: Таблиця F Кут 2-тета (2θ) 6,5 17,7 14,7 9,2 26,5 20,2 13,1 27,3 24,0 Інтенсивність % 100,00 31,30 24,91 21,73 14,13 12,03 11,74 9,72 5,56 5 10 15 20 25 30 35 40 45 Згідно із заявленим винаходом тут запропоновано кристалічну форму cукцинатної солі форми А8, яка має рентгенівську дифракцію на порошку, принаймні, із трьома конкретними піками, приблизно, при 2-тета = 6,5°, 17,7° та 14,7°. Згідно із заявленим винаходом тут запропоновано кристалічну форму cукцинатної солі форми А8, яка має рентгенівську дифракцію на порошку з конкретними піками, приблизно, при 2-тета = 6,5, 17,7, 14,7, 9,2, 26,5, 20,2, 13,1, 27,3, 24,0°. Згідно із заявленим винаходом тут запропоновано кристалічну форму cукцинатної солі форми А8, яка має рентгенівську дифракцію на порошку, суттєво, таку саму як рентгенівська дифракція на порошку, показна на фігурі 11. Згідно із заявленим винаходом тут запропоновано кристалічну форму cукцинатної солі форми А8, яка має рентгенівську дифракцію на порошку, принаймні, із трьома конкретними o піками при 2-тета = 6,5°, 17,7° та 14,7°, де названі величини можуть бути плюс або мінус 0,2 2тета. Згідно із заявленим винаходом тут запропоновано кристалічну форму cукцинатної солі форми А8, яка має рентгенівську дифракцію на порошку з конкретними піками при 2-тета = 6,5, o 17,7, 14,7, 9,2, 26,5, 20,2, 13,1, 27,3, 24,0°, де названі величини можуть бути плюс або мінус 0,2 2-тета. Згідно з аналізом DSC Форми А8 показано ендотерму плавлення при досягненні 191,8 °C та пік при 194,2 °C (фігура 12). Підписи під фігурами: Фігура 1: Рентгенівська порошкова дифрактограма форми А. Фігура 2: Термограма DSC (диференційної сканувальної калориметрії) форми А. Фігура 3: Рентгенівська порошкова дифрактограма форми E. Фігура 4: Термограма DSC (диференційної сканувальної калориметрії) форми E Фігура 5: Рентгенівська порошкова дифрактограма форми I. Фігура 6: Термограма DSC (диференційної сканувальної калориметрії) форми I. Фігура 7: Рентгенівська порошкова дифрактограма форми J. Фігура 8: Термограма DSC (диференційної сканувальної калориметрії) форми J Фігура 9: Рентгенівська порошкова дифрактограма солі моно-HCl форми А1. Фігура 10: Термограма DSC (диференційної сканувальної калориметрії) солі моно-HCl Форм А1. Фігура 11: Рентгенівська порошкова дифрактограма сукцинатної солі форми А8. Фігура 12: Термограма DSC (диференційної сканувальної калориметрії) cукцинатної солі форми А8. Коли встановлено, що заявлений винахід стосується кристалічної форми, то придатна ступінь кристалічності є більшою ніж, приблизно, 60 %, зручно − більше приблизно 80 %, придатна ступінь кристалічності є більшою ніж, приблизно, 90 %, та зручніше − більше приблизно 95 %. Найбільш придатна ступінь кристалічності є більшою ніж, приблизно, 98 %. Слід розуміти, що величини 2-тета рентгенівської дифракції на порошку можуть злегка змінюватися від одного апарату до іншого або від одного зразку до іншого, та, отже, цитовані величини не слід тлумачити як абсолютні. Відомо, що рентгенівська дифракція на порошку може мати одну або більше похибки виміру залежно від умов вимірювання (як-то оснащення або застосований апарат). Зокрема, взагалі відомо, що інтенсивність рентгенівської дифракції 9 UA 115686 C2 5 10 15 20 25 30 35 40 45 50 55 на порошку може коливатися залежно від умов вимірювання. Отже, слід розуміти, що поліморфні форми заявленого винаходу не обмежується кристалами, які піддають рентгенівській дифракції на порошку, ідентичними щодо рентгенівської дифракції на порошку, показаної на фігурах, та будь-які кристали, які піддають рентгенівській дифракції на порошку, суттєво, такі ж самі, як показані на фігурах, охоплено в межах заявленого винаходу. Фахівець в галузі техніки рентгенівської дифракції на порошку здатен оцінювати реальну ідентичність рентгенівської дифракції на порошку. Фахівцям у галузі техніки рентгенівської дифракції на порошку слід розуміти, що на відносну інтенсивність піків може впливати, наприклад, розмір гранули, приблизно, 30 мкм, та співвідношення не одиничних аспектів, які можуть впливати на аналіз зразків. Фахівцю також слід розуміти, що на позицію відбиття може впливати точна висота, при якій зразок знаходиться в дифрактометрі та калібрування нуля в дифрактометрі. Площинність поверхні зразку також може мати невеликий вплив. Отже, наведені дані дифракційної картини не слід сприймати як абсолютні величини. (Jenkins, R & Snyder, R.L. "Introduction to X-Ray Powder Diffractometry" John Wiley & Sons 1996; Bunn, C.W. (1948), Chemical Crystallography, Clarendon Press, London; Klug, H. P. & Alexander, L. E. (1974), X-Ray Diffraction Procedures). Загалом, похибка вимірювання кута в рентгенівській дифрактограмі на порошку дорівнює, o приблизно плюс або мінус 0,2 2-тета, та такий рівень похибки вимірювання слід брати до уваги при розгляданні рентгенівської дифракції на порошку, показної на фігурах та таблицях. Крім того, слід розуміти, що інтенсивності можуть коливатися залежно від умов експерименту та виготовлення зразку (кращої орієнтації). Отже, згідно з наступним аспектом винаходу запропоновано 4-[(3-хлоро-2флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилат у кристалічній формі. Згідно з наступним аспектом винаходу запропоновано фармацевтично прийнятну сіль 4-[(3хлоро-2-флуорофеніл)аміно]-7-метоксихіназолін-6-іл(2R)-2,4-диметил піперазин-1-карбоксилату в кристалічній формі. Згідно з наступним аспектом винаходу запропоновано хлоридну сіль 4-[(3-хлоро-2флуорофеніл)аміно]-7-метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилату в кристалічній формі. Згідно з одним аспектом винаходу 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метокси хіназолін-6іл (2R)-2,4-диметилпіперазин-1-карбоксилат у кристалічній формі є у вигляді форми А. Згідно з одним аспектом винаходу 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метокси хіназолін-6іл (2R)-2,4-диметилпіперазин-1-карбоксилат у кристалічній формі є у вигляді форми E. Згідно з одним аспектом винаходу 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метокси хіназолін-6іл (2R)-2,4-диметилпіперазин-1-карбоксилат у кристалічній формі є у вигляді форми I. Згідно з одним аспектом винаходу 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метокси хіназолін-6іл (2R)-2,4-диметилпіперазин-1-карбоксилат у кристалічній формі є у вигляді форми J. Згідно з одним аспектом винаходу хлоридна сіль 4-[(3-хлоро-2-флуорофеніл)аміно] -7метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилату в кристалічній формі є у вигляді солі моно-HCl форми А1. Згідно з одним аспектом винаходу сукцинатна сіль 4-[(3-хлоро-2-флуорофеніл) аміно]-7метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилату в кристалічній формі є у вигляді сукцинатної солі форми А8. Згідно з одним аспектом винаходу 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метокси хіназолін-6іл (2R)-2,4-диметилпіперазин-1-карбоксилат у кристалічній формі є у вигляді форми А та є, суттєво, вільним щодо будь-яких інших форм. Згідно з одним аспектом винаходу 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метокси хіназолін-6іл (2R)-2,4-диметилпіперазин-1-карбоксилат у кристалічній формі є у вигляді форми E та є, суттєво, вільним щодо будь-яких інших форм. Згідно з одним аспектом винаходу 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метокси хіназолін-6іл (2R)-2,4-диметилпіперазин-1-карбоксилат у кристалічній формі є у вигляді форми I та є, суттєво, вільним щодо будь-яких інших форм. Згідно з одним аспектом винаходу 4-[(3-хлоро-2-флуорофеніл)аміно]-7-метокси хіназолін-6іл (2R)-2,4-диметилпіперазин-1-карбоксилат у кристалічній формі є у вигляді форми J та є, суттєво, вільним щодо будь-яких інших форм. Згідно з одним аспектом винаходу хлоридна сіль 4-[(3-хлоро-2-флуорофеніл)аміно] -7метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилату в кристалічній формі є у вигляді солі моно-HCl форми А1 та є, суттєво, вільною щодо будь-яких інших форм. 10 UA 115686 C2 5 10 15 20 25 30 35 40 45 50 55 Згідно з одним аспектом винаходу сукцинатна сіль 4-[(3-хлоро-2-флуорофеніл) аміно]-7метоксихіназолін-6-іл (2R)-2,4-диметилпіперазин-1-карбоксилату в кристалічній формі є у вигляді сукцинатної солі форми А8 та є, суттєво, вільною щодо будь-яких інших форм. Термін "суттєво вільний" означає − менше 10 % іншої форми або форм енантіомеру або енантіомерів, конкретно − менше 5 %. В іншому аспекті "суттєво вільний" означає − менше 1 % іншої форми або форм, енантіомеру або енантіомерів. Тут вираз у формі також охоплює аморфну форму. Як установлено вище, сполуки або їх фармацевтично прийнятна сіль, визначені в заявленому винаході, володіють активністю проти раку, яка, як уважають, виникає внаслідок інгібіторної активності щодо активувального мутантного EGFR, та інших властивостей сполук або їх фармацевтично прийнятної солі. Ці властивості можна оцінювати, наприклад, застосовуючи викладені нижче процедури. Аналіз 1: Аналіз клітинного фосфорилування Лінія легеневих клітин людини NCI-H3255 (L858R) отримували з Американської колекції типових культур. Клітини NCI-H3255 утримували в середовищі BEBM (Lonza; CC-3171), яке містить 10 % ембріональної бичачої сироватки (FBS) (Gibco; 10099-141), доповненої комплектом BEGM (Lonza; CC-4175). Лінію легеневих клітин людини PC-9 (Екзон 19 делеція EGFR) отримували з Американської колекції типових культур. Клітини PC-9 утримували в RPMI 1640 (Gibco; 22400-089), яке містить 10 % ембріональної бичачої сироватки. Лінія легеневих клітин людини NCI-H838 (дикий тип EGFR) отримували з Американської колекції типових культур. Клітини NCI-H838 утримували в RPMI 1640 (Gibco; 22400-089), яке містить 10 % ембріональної бичачої сироватки. Усі клітини вирощували у вологому інкубаторі при 37 °C з 5 % CO2. Аналізи вимірювання клітинного фосфорилування ендогенного p-EGFR у клітинних лізатах робили згідно із протоколом, описаним у PathScan® Phospho-EGF Receptor (Tyr1068) Sandwich ELISA Kit (Каталог комплекту клітинної сигналізації, номер #7240). 100 мкл клітин засівали (32000 клітин/комірку) в RPMI 1640+1 % ембріональної бичачої сироватки в Corning Costar, 96-коміркових планшетах із клітинною культурою та інкубували при 37 °C з 5 % CO2 протягом ночі. Клітини акустично дозували, застосовуючи Tecan, сполуками послідовно розрідженими в 100 % ДМСО. Клітинні планшети інкубували протягом подальших 4 год., потім додавали сполуки, (NCI-H838: rhEGF (R&D, номер каталогу#236-EG) додавали до клітинного планшету з кінцевою концентрацією 100 нг/мл rhEGF щоб стимулювати протягом 5 хвилин), потім − аспірація середовища, до кожної комірки додавали 110 мкл буферу лізису IP (буфер лізису IP: добавка 1:100 коктейлю інгібітору протеази 2&3 (Sigma, номер каталогу P5726&P0044), до кожної комірки додавали 1:100 коктейль інгібітору протеази (Sigma, номер каталогу P8340) до буферу лізису Pierce IP (Thermo, номер каталогу #87788)). Планшети тримали при 4 °C при обертанні 300 обертів за хвилину протягом 0,5-1 години. Клітинний лізис 100 мкл/комірку переносили до покритих планшетів (Комплект клітинної сигналізації, номер каталогу#7240) та інкубували протягом ночі при 4 °C при обертанні 300 обертів за хвилину. Планшети тримали при температурі 4-37 °C при обертанні 300 обертів за хвилину протягом 1 години. Потім − аспірація та промивання планшетів 1 x промивним буфером, додавали до кожної комірки 100 мкл антитіла виявлення (Комплект клітинної сигналізації, номер каталогу#7240). Планшет герметизували тасьмою та інкубували протягом 2 годин при 37 °C при обертанні 300 обертів за хвилину, Потім − аспірація та промивання планшетів 1 x промивним буфером, та додавали до кожної комірки 100 мкл HRP-зв'язаного вторинного антитіла (Комплект клітинної сигналізації, номер каталогу#7240). Планшет герметизували тасьмою та інкубували протягом 1 години при 37 °C при обертанні 300 обертів за хвилину. Після аспірації та промивання планшетів 1 x промивним буфером, та до кожної комірки додавали 100 мкл субстрату TMB (Комплект клітинної сигналізації, номер каталогу#7240). Планшет герметизували тасьмою та інкубували протягом 30 хвилин при 37 °C при обертанні 300 обертів за хвилину. До планшетів додавали 100 мкл розчину зупинки (Комплект клітинної сигналізації, номер каталогу#7240) та зчитували оптичну щільність при 450 нм протягом 30 хвилин на планшетному зчитувачеві SpectraMax M5e. Дані, отримані для кожної сполуки експортували в придатний комплект системи програмного забезпечення (як-то H-BASE) аналізу апроксимації кривої. Із цих даних визначали величину КІ 50 обчисленням концентрації сполуки, яка потрібна для отримання 50 % дії. Дані аналізу (мкM) в аналізі 1 для прикладів цієї програми, а також отриманих для гефітинібу та ерлотинібу, показано нижче в таблиці (де n = число повторних експериментів): 11 UA 115686 C2 Приклад 1 КІ50 (NCI-H3255) 0,0072±0,0013 (n=12) КІ50 (PC-9) 0,0074±0,0013 (n=12) Приклад 3 0,005 (n=1) 0,008 (n=1) Приклад 4 0,001 (n=1) гефітиніб 0,0065±0,002 (n=42) 0,0081±0,0019 (n=10) 0,004 (n=1) 0,0062±0,0019 (n=42) 0,0061±0,0019 (n=10) Сполука ерлотиніб 5 10 15 20 25 30 35 40 45 КІ50 (NCI-H838) 0,065±0,009 (n=13) 0,04 (n=1) 0,04 (n=1) 0,03±0,01 (n=42) 0,033±0,007 (n=10) У прикладі 1, прикладі 2 та прикладі 3 показано порівняну при співставленні з ефективністю щодо гефітинібу та ерлотинібу. Аналіз 2: Аналіз проникнення через мозковий кров'яний бар'єр Kp, uu мозок та Kp, uu CSF − головні параметри, виміряні та оптимізовані у відкритті щодо ліків ЦНС (Di L et al., Journal of Medicinal Chemistry [2013], 56: 2-12). Kp, uu мозок, співвідношення між концентраціями незв'язаних ліків у мозку та в крові, прогнозує дію ліків на метастатичні пухлини при мозковому лептоменінгеальному метастазі (LM) до м'якої павутинної оболонки мозку внаслідок метастатичного раку, обумовлюючи підвищення дисфункції центральної нервової системи. Kp, uu CSF означає розповсюдження ліків у CSF у порівнянні із цим у крові, яке стимулює реакцію на вплив лікарського засобу протягом лікування лептоменінгеального метастазу. Аналіз крові мозкового зв'язування іn vitro проводили на планшеті HT-Dialysis plate (Gales Ferry, CT) з напівпроникненою мембраною. Розріджену кров (1:1 з DPBS pH 7,4) та гомогенатом мозку (1:3 з DPBS pH 7,4) наколювали з 5 мкМ сполуки тесту (у трьох екземплярах) та діалізували до рівного об'єму 150 мкл 100 мM буферу PBS (pH 7,4) при 37 °C протягом 4 годин у планшеті при повільному обертанні. При кінці інкубації брали аліквоту 50 мкл із резервуару та 5 мкл від донора. Потім зразок 5 мкл розбавляли 45 мкл контрольної крові або гомогенату мозку. Парні зразки були матричними-суміщеними з буфером або гомогенатом контрольної крові/мозку та їх змішували протягом 2 хвил., та потім осаджували 150 мкл холодного ацетонітрилу з 100 нг/мл бутамиду як внутрішнього стандарту. Після центрифугування при 4000 обертів за хвилину протягом 20 хвил. надосад розбавляли 0,1 % водним розчином мурашиної кислоти та аналізували з допомогою РХ/МС/МС (API 4000, Applied Biosystems, Foster City). Незв'язану фракцію (fu) сполуки тесту в гомогенаті мозку та розбавленій крові обчислювали співвідношенням відгуку буферу до відгуку гомогенату мозку/крові, та незв'язану фракцію (f u, bl та fu, br) сполуки тесту в нерозбавленій крові та тканині обчислювали з виміряної fu у гомогенаті та розбавленій крові згідно з наступним рівнянням: f u, bl (fu, br) = (1/D) / [(1/fu-1) + 1/D)]. D − коефіцієнт розбавлення. Модель короткої пероральної абсорбції (SOA) є моделлю перевірки in-vivo для ідентифікації проникнення сполуки в мозок. Шість самців щурів Han Wistar, придбаних у Beijing Vital River, перорально дозували сполукою при 2 мг/кг в 1 % метилцелюлозі. При 0,25, 0,5, 1, 2, 4 та 7 годині після дозування цереброспінальну рідину (CSF) збирали з "cisterna magna", та зразки крові (>60 мкл/момент часу/кожне місце) збирали через пункцію серця в окремі трубки з коагульованою ЕДТА, та потім негайно розбавляли 3-кратним об'ємом води. Тканину мозку збирали та гомогенізували в 3X об'ємах 100 мM буферованого фосфатом фізіологічного розчину (pH 7,4). Усі зразки до аналізу РХ/МС/МС зберігали приблизно, при 70 °C. Стандарти готували відбором контрольної крові, гомогенату мозку та покриттям штучної CSF 0,2 − 500 нг/мл. Гомогенізовану тканину мозку разом зі зразками крові осаджували додаванням 3-кратного об'єму холодного ацетонітрилу, який містить внутрішній стандарт (40 нг/мл дексаметазону та 40 нг/мл диклофенаку), та 10 мкл зразків CSF осаджували 100 мкл холодного ацетонітрилу, який містить внутрішній стандарт. Після 2 хвил. вихрювання та 5 хвил. центрифугування при 14,000 обертів за хвилину надосад аналізували РХ/МС/МС (API 4000, Applied Biosystems, Foster City). Два комплекту стандартних кривих отримували на початку та в кінці кожної партії від аналізу зразку крові. Для зразків мозку та CSF аналізували одну стандартну криву разом зі зразками тесту. Сукупні мозкові рівні, відображені як співвідношення мозок/кров (Kp, мозок) вимірювали AUCbrain/AUCblood у гризунів після перорального застосування. Вільну фракцію сполуки тесту в біологічному матриксі визначали аналізом зв'язування крові та мозку in vitro. K p, uu мозок та Kp, uu CSF обчислювали згідно з наступним рівнянням: Kp, uu мозок = AUCbrain/AUCblood x (fu, мозок/fu.кров) та Kp, uu CSF=AUCCSF/(AUCblood x fu.кров). 12 UA 115686 C2 Аналіз даних в аналізі 2 для прикладів цього застосування а також даних, отриманих для сапітинібу (форми вільної основи) показано в таблиці нижче: Приклад 1 0,8-1,3 (n=2) Kp, uu CSF 1,0-1,3 (n=2) Приклад 3 1,6 (n=1) 2,6 (n=1) сапітиніб 0,13 (n=1) Сполука 5 10 15 20 25 30 35 40 45 50 55 Kp, uu мозок Нижча межа кількісного аналізу що демонструє властивості сполук заявленого винаходу щодо більш високого проникнення мозкового бар'єру в порівняні із сапітинібом. Згідно з подальшим аспектом винаходу тут запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль, як визначено вище, у поєднання з фармацевтично прийнятним розріджувачем або носієм. Композиція може бути у формі, придатній для перорального застосування, наприклад, як таблетка або капсула, для парентеральної ін'єкції (охоплюючи внутрішньовенну, підшкірну, внутрішньом'язову, інтраваскулярну або вливання) як стерильний розчин, суспензію або емульсію для місцевого застосування як мазь або крем, або для ректального застосування як супозиторій. Конкретно композиція може бути у формі, придатній для перорального застосування. Взагалі, указані вище композиції можна отримувати стандартним способом, застосовуючи звичайні наповнювачі. Сполуку формули (I) або її фармацевтично прийнятні солі, щоб постачати терапевтично ефективну дозу, слід застосовувати до теплокровної тварини при одиничній дозі в діапазоні 0,01-2000 мг/кг, конкретно, 2,5-1000 мг/кг, конкретно, 5-500 мг/кг. Однак, добову дозу обов'язково слід змінювати залежно від особи, яку лікують, конкретного шляху застосування та тяжкості хвороби, яку лікують. Відповідно оптимальне дозування може визначати практикуючий лікар, який лікує будь-якого конкретного пацієнта. Згідно з подальшим аспектом винаходу заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятні солі, які визначено вище, для застосування в способі терапевтичного лікування людини або тварини. Як результат активуючої інгібіторної активності мутанту EGFR, уважають, що сполуки формули (I) або їх фармацевтично прийнятна сіль є корисними в лікуванні хвороб або медичних станів, опосередкованих тільки, або частково активацією мутантного EGFR, наприклад, раку. Типи видів раку, які можуть бути чутливими до лікування при застосуванні сполук формули (I) або їх фармацевтично прийнятної солі, охоплюють, але без обмеження, наступне: рак яєчників, цервікальний рак, рак товстої та прямої кишки, рак грудної залози, рак підшлункової залози, гліома, гліобластома, меланома, рак простати, лейкемія, лімфома, лімфома не-Ходжкіна, рак легенів, гепатоцелюлярний рак, рак шлунку, шлунково-тонкокишкова пухлина строми, рак щитовидної залози, рак жовчної протоки, ендометріальний рак, рак нирки, анаплазирована великоклітинна лімфома, гостра мієлоїдна лейкемія, множинна мієлома, меланома та мезотеліома. У конкретному втіленні винаходу типом раку, який піддається лікуванню при застосуванні сполуки формули (I) або її фармацевтично прийнятної солі, є немалоклітинний рак легенів (NSCLC). У подальшому конкретному втіленні клітини NCSLC у теплокровної тварини здатні або, як показано раніше, здатні до мутацій, активувані в гені EGFR. Сполука формули (I) або її фармацевтично прийнятна сіль є корисною в лікуванні хворобливих станів, у які залучено активувальний мутантний EGFR. Згідно з одним аспектом винаходу, який стосується активувального мутантного EGFR, це посилає одну або більше мутацій у місці зв'язування АТФ (домен кінази) гену EGFR, конкретно поблизу Ексонів 18-21, якто описано в WO 2005/094357. Згідно з одним аспектом винаходу, який стосується активувального мутантного EGFR, це стосується L858R активувального мутантного EGFR та/або активувального мутантного EGFR делеції Екзон 19. Згідно з одним аспектом винаходу, який стосується активувального мутантного EGFR, це стосується L858R активувального мутантного EGFR та активувального мутантного EGFR делеції Екзон 19. Згідно з одним аспектом винаходу, який стосується активувального мутантного EGFR, це стосується L858R активувального мутантного EGFR. Згідно із ще одним аспектом винаходу, де стосується активувального мутантного EGFR, це стосується активувального мутантного EGFR делеції Екзон 19. Передбачено, що для способів лікування згаданого тут раку сполуки формули (I), або їх фармацевтично прийнятну сіль слід застосовувати до ссавця, конкретніше до людини. 13 UA 115686 C2 5 10 15 20 25 30 35 40 45 50 55 60 Аналогічно, щодо застосувань сполук формули (I) або їх фармацевтично прийнятної солі, для лікування згаданого тут раку, передбачено, що сполуки формули (I) або їх фармацевтично прийнятну сіль слід застосовувати до ссавця, конкретніше до людини. Отже, згідно із ще одним аспектом винаходу запропоновано сполуки формули (I), або їх фармацевтично прийнятна сіль, які визначено вище, для застосування як медикаменту. Згідно з подальшим аспектом винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі, які визначено вище, у виготовленні медикаменту для інгібування активувального мутантного EGFR у теплокровної тварини, як-то людина. Згідно із цим аспектом винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі, які визначено вище, у виготовленні медикаменту для отримання дії проти раку в теплокровної тварини, як-то людина. Згідно з подальшою особливістю винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі, які визначено вище, у виготовленні медикаменту для застосування в лікуванні наступного: рак яєчників, цервікальний рак, рак кишечнику, рак грудної залози, рак підшлункової залози, гліома, гліобластома, меланома, рак простати, лейкемія, лімфома, лімфома не-Ходжкіна, рак легенів, гепатоцелюлярний рак, рак шлунку, шлунковотонкокишкова пухлина строми, рак щитовидної залози, рак жовчної протоки, ендометріальний рак, рак нирки, анаплазирована великоклітинна лімфома, гостра мієлоїдна лейкемія, множинна мієлома, меланома та мезотеліома. Згідно з подальшою особливістю винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі, які визначено вище, у виготовленні медикаменту для застосування в лікуванні NSCLC. Згідно з подальшою особливістю цього аспекту винаходу запропоновано спосіб інгібування активувального мутантного EGFR у теплокровної тварини, як-то людина, яка потребує такого лікування, який полягає в застосуванні до названої тварини ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, які визначено вище. Згідно з подальшою особливістю цього аспекту винаходу запропоновано спосіб отримання дії проти раку в теплокровної тварини, як-то людина, яка потребує такого лікування, який полягає в застосуванні до названої тварини ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, які визначено вище. Згідно з подальшою особливістю цього аспекту винаходу запропоновано спосіб отримання дії проти раку в теплокровної тварини, як-то людина, яка потребує такого лікування, який полягає (1) у визначенні наявності чи відсутності в теплокровної тварини мутації активувальної EGFR в клітині пухлини та (2) застосуванні до названої тварини ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, які визначено вище. Згідно з додатковою особливістю цього аспекту винаходу запропоновано спосіб лікування наступного: рак яєчників, цервікальний рак, рак кишечнику, рак грудної залози, рак підшлункової залози, гліома, гліобластома, меланома, рак простати, лейкемія, лімфома, лімфома неХоджкіна, рак легенів, гепатоцелюлярний рак, рак шлунку, шлунково-тонкокишкова пухлина строми, рак щитовидної залози, рак жовчної протоки, ендометріальний рак, рак нирки, анаплазирована великоклітинна лімфома, гостра мієлоїдна лейкемія, множинна мієлома, меланома та мезотеліома, у теплокровної тварини, як-то людина, яка потребує такого лікування, який полягає в застосуванні до названої тварини ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, які визначено вище. Згідно з додатковою особливістю цього аспекту винаходу запропоновано спосіб лікування NSCLC, у теплокровної тварини, як-то людина, яка потребує такого лікування, який полягає в застосуванні до названої тварини ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі, які визначено вище. Згідно з подальшим аспектом винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль, які визначено вище, для застосування в інгібуванні активувального мутантного EGFR у теплокровної тварини, як-то людина. Згідно із цим аспектом винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль, які визначено вище, для застосування в отриманні дії проти раку в теплокровної тварини, як-то людина. Згідно з подальшою особливістю винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль, які визначено вище, для застосування в лікуванні наступного: рак яєчників, цервікальний рак, рак кишечнику, рак грудної залози, рак підшлункової залози, гліома, гліобластома, меланома, рак простати, лейкемія, лімфома, лімфома не-Ходжкіна, рак легенів, гепатоцелюлярний рак, рак шлунку, шлунково-тонкокишкова пухлина строми, рак щитовидної залози, рак жовчної протоки, ендометріальний рак, рак нирки, анаплазирована 14 UA 115686 C2 5 10 15 20 25 30 35 40 45 50 55 60 великоклітинна лімфома, гостра мієлоїдна лейкемія, множинна мієлома, меланома та мезотеліома. Згідно з подальшою особливістю винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль, які визначено вище, для застосування в лікуванні NSCLC. Згідно з наступним аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль, які визначено вище, у поєднанні з фармацевтичним прийнятним розріджувачем або носієм для застосування в інгібуванні активувального мутантного EGFR у теплокровної тварини, як-то людина. Згідно з наступним аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль, які визначено вище, у поєднанні з фармацевтичним прийнятним розріджувачем або носієм для застосування отримання дії проти раку в теплокровної тварини, як-то людина. Згідно з наступним аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль, які визначено вище, у поєднанні з фармацевтичним прийнятним розріджувачем або носієм для застосування в лікуванні наступного: рак яєчників, цервікальний рак, рак кишечнику, рак грудної залози, рак підшлункової залози, гліома, гліобластома, меланома, рак простати, лейкемія, лімфома, лімфома не-Ходжкіна, рак легенів, гепатоцелюлярний рак, рак шлунку, шлунково-тонкокишкова пухлина строми, рак щитовидної залози, рак жовчної протоки, ендометріальний рак, рак нирки, анаплазирована великоклітинна лімфома, гостра мієлоїдна лейкемія, множинна мієлома, меланома та мезотеліома у теплокровної тварини, як-то людина. Згідно з наступним аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль, які визначено вище, у поєднанні з фармацевтичним прийнятним розріджувачем або носієм для застосування в лікуванні NSCLC у теплокровної тварини, як-то людина. Згідно з будь-якими згаданими тут аспектами або втіленнями, де вказано рак, названий рак можна вибирати з наступного: рак яєчників, цервікальний рак, рак кишечнику, рак грудної залози, рак підшлункової залози, гліома, гліобластома, меланома, рак простати, лейкемія, лімфома, лімфома не-Ходжкіна, рак легенів, гепатоцелюлярний рак, рак шлунку, шлунковотонкокишкова пухлина строми, рак щитовидної залози, рак жовчної протоки, ендометріальний рак, рак нирки, анаплазирована великоклітинна лімфома, гостра мієлоїдна лейкемія, множинна мієлома, меланома та мезотеліома. Згідно з будь-якими згаданими тут аспектами або втіленнями, де вказано рак, конкретно названий рак, можна вибирати з раку легенів. Згідно з подальшим аспектом конкретно названий рак можна вибирати з немалоклітинного раку легенів. Згідно з подальшим аспектом конкретно названий рак можна вибирати з неметастатичного немалоклітинного раку легенів. Згідно з подальшим аспектом конкретно названий рак можна вибирати з метастатичного немалоклітинного раку легенів. st nd Сполуку заявленого винаходу можна застосовувати в ад'юванті та/або лінії 1 та/або лінії 2 лікування параметрів пацієнтів з NSCLC, які несуть активувальний мутант EGFR із та без метастазу ЦНС, конкретно метастазу мозку та/або лептоменінгеальних метастазів. Згідно із ще одним аспектом рак є в неметастатичному стані. Згідно із ще одним аспектом рак є в метастатичному стані. Згідно із ще одним аспектом винаходу конкретно метастаз − метастази ЦНС. Згідно із ще одним аспектом конкретно метастази ЦНС − метастази мозку. Згідно із ще одним аспектом конкретно метастази ЦНС − лептоменінгеальні метастази. Певні пацієнти з NSCLC із метастазом ЦНС, конкретно метастазом мозку та/або лептоменінгеальними метастазами, виявляють симптоми ЦНС, як-то головний біль та блювота. Для цих пацієнтів, можна застосовувати системну мозкову радіаційну терапію (WBRT) для поліпшення таких симптомів. Сполука заявленого винаходу може посилювати протипухлинну дію WBRT а також далі поліпшувати симптоми ЦНС при застосуванні в комбінації з WBRT. Визначене вище лікування щодо активності активувального мутантного EGFR можна застосовувати як єдину терапію або, крім того, воно може охоплювати сполуку винаходу, звичайну хірургію або радіаційну терапію (наприклад, WBRT яку тут описано вище) або хіміотерапію. Така хіміотерапія може охоплювати один або більше з наступних протипухлинних засобів: (i) анти-CTLA-4-антитіло; (ii) 6-(4-бромо-2-хлоро-феніламіно)-7-флуоро-3-метил-3H-бензімідазол-5-карбонової кислоти (2-гідрокси-етокси)-амід (який розкрито в WO 2007/076245) або його фармацевтично прийнятна сіль; 15 UA 115686 C2 5 10 15 20 25 30 35 40 45 50 55 60 (iii) анти-PD-L1 антитіло; (iv) 1-[(1S)-1-(імідазо[1,2-a]піридин-6-іл)етил]-6-(1-метил-1H-піразол-4-іл)-1H[1,2,3]триазоло[4,5-b]піразин (Сполука 270 в WO 2011/079804) або його фармацевтично прийнятна сіль; (v) анти-PD-1-антитіло; або (vi) агоніст OX40-антитіла. Конкретно анти-CTLA-4-антитіло − тремелімумаб (який розкрито в US 6 682 736). Згідно із ще одним аспектом винаходу конкретно анти-CTLA-4-антитіло − іпілімумаб (який продають від Bristol Myers Squib як YERVOY®). Конкретно, "6-(4-бромо-2-хлоро-феніламіно)-7-флуоро-3-метил-3H-бензімідазол-5карбонової кислоти (2-гідрокси-етокси)-амід (який розкрито в WO 2007/076245) або його фармацевтично прийнятна сіль" − сіль гідрогенсульфату 6-(4-бромо-2-хлоро-феніламіно)-7флуоро-3-метил-3H-бензімідазол-5-карбонової кислоти (2-гідрокси-етокси)-аміду. Конкретніше, сіль гідрогенсульфату − 1:1 сполука:H2SO4. Конкретно, анти-PD-L1-антитіло − антитіло, яке розкрито в US 20130034559 (MedImmune). Згідно із ще одним аспектом винаходу конкретно анти-PD-L1-антитіло − антитіло, яке розкрито в US 2010/0203056 (Genentech/Roche). Згідно із ще одним аспектом винаходу, конкретно, антиPD-L1-антитіло − антитіло, яке розкрито в US 20090055944 (Medarex). Згідно із ще одним аспектом винаходу, конкретно, анти-PD-L1-антитіло − антитіло, яке розкрито в US 20130323249 (Sorrento Therapeutics). Конкретно, анти-PD-1-антитіло − MRK-3475, яке розкрито в WO 2009/114335 та US 8 168 757 (Merck). Згідно із ще одним аспектом винаходу, конкретно, ніволумаб − анти-PD-1-антитіло, яке розкрито в WO 2006/121168 або US 8 008 449 (Medarex). Згідно із ще одним аспектом винаходу, конкретно, анти-PD-1-антитіло − антитіло, яке розкрито в WO2009/101611 (CureTech). Згідно із ще одним аспектом винаходу, конкретно, анти-PD-1-антитіло − антитіло, яке розкрито в WO2012/145493 (Amplimmune). Згідно із ще одним аспектом винаходу конкретно, анти-PD-1антитіло − антитіло, яке розкрито в US 7 488 802 (Wyeth/MedImmune). Конкретно анти-OX40-антитіло − антитіло, яке розкрито в US20110123552 (Crucell). Згідно із ще одним аспектом винаходу, конкретно, анти-PD-1-антитіло − антитіло, яке розкрито в US 20130280275 (Board of Regents, Univ. of Texas). Згідно із ще одним аспектом винаходу конкретно, анти-PD-1-антитіло − антитіло, яке розкрито в WO 99/42585 (Agonox) та WO 95/12673 та WO 95/21915. Згідно із цим аспектом винаходу запропоновано комбінацію, придатну для застосування в лікуванні раку, яка містить сполуку формули (I), яку визначено вище, або її фармацевтично прийнятну сіль та будь-який один із протипухлинних засобів, указаних вище за (i) – (iv). Отже, згідно з наступним аспектом винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль у комбінації із протипухлинним засобом, вибраним з одного вказаного тут вище за (i) – (iv). Тут, де застосовано термін "комбінація", слід розуміти, що це стосується одночасного, роздільного або послідовного застосування. Згідно з одним аспектом винаходу "комбінація" стосується одночасного застосування. Згідно із ще одним аспектом винаходу "комбінація" стосується роздільного застосування. Згідно з наступним аспектом винаходу "комбінація" стосується послідовного застосування. Де застосування є послідовним або роздільним, зволікання в застосуванні другого компоненту не призводить до втрати корисної дії комбінації. Згідно з подальшим аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль у комбінації із протипухлинним засобом, вибраним з одного вказаного тут вище за (i) – (iv), в асоціації з фармацевтично прийнятним розріджувачем або носієм. Згідно з подальшим аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль у комбінації із протипухлинним засобом, вибраним з одного вказаного тут вище за (i) – (iv), в асоціації з фармацевтично прийнятним розріджувачем або носієм для застосування в продукування активності активувального мутантного EGFR. Згідно з подальшим аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль у комбінації із протипухлинним засобом, вибраним з одного вказаного тут вище за (i) – (iv), в асоціації з фармацевтично прийнятним розріджувачем або носієм для застосування в продукуванні протиракової дії. Згідно з подальшим аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль у комбінації із 16 UA 115686 C2 5 10 15 20 25 30 35 40 45 50 55 60 протипухлинним засобом, вибраним з одного вказаного тут вище за (i) – (iv), в асоціації з фармацевтично прийнятним розріджувачем або носієм для застосування в лікуванні наступного: рак яєчників, цервікальний рак, рак кишечнику, рак грудної залози, рак підшлункової залози, гліома, гліобластома, меланома, рак простати, лейкемія, лімфома, лімфома неХоджкіна, рак легенів, гепатоцелюлярний рак, рак шлунку, шлунково-тонкокишкова пухлина строми, рак щитовидної залози, рак жовчної протоки, ендометріальний рак, рак нирки, анаплазирована великоклітинна лімфома, гостра мієлоїдна лейкемія, множинна мієлома, меланома та мезотеліома. Згідно з подальшим аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль у комбінації із протипухлинним засобом, вибраним з одного вказаного тут вище за (i) – (iv), в асоціації з фармацевтично прийнятним розріджувачем або носієм для застосування в лікуванні NSCLC. Згідно з подальшим аспектом винаходу заявленого винаходу запропоновано комплект, який містить сполуку формули (I) або її фармацевтично прийнятну сіль у комбінації із протипухлинним засобом, вибраним з одного тут указаного вище за (i) – (iv) . Згідно з подальшим аспектом винаходу заявленого винаходу запропоновано комплект, який містить наступне: a) сполуку формули (I) або їх фармацевтично прийнятну сіль у вигляді першої лікарської форми; b) протипухлинний засіб, вибраний одного вказаного вище за (i) – (iv); у вигляді другої лікарської форми; та c) контейнер, який містить названі першу та другу лікарські форми. Крім того, сполуки формули (I) або їх фармацевтично прийнятна сіль також є корисними щодо їх застосування в терапевтичній медицині, як фармакологічний засіб у розвитку та стандартизації тестових систем in vitro для визначення дій інгібіторної активності активувального мутанту EGFR у лабораторних тварин, як-то коти, собаки, кролі, мавпи, щури та миші, як частини дослідження нових терапевтичних засобів. Описані тут альтернативні та переважні втілення сполук винаходу також застосовують у вказаній вище іншій фармацевтичній композиції, процесі, способі, застосуванні та особливостях виготовлення медикаменту. Приклади Винахід далі описано наступними прикладами, в яких, взагалі: (i) після реакцій провадили рідинну хроматографію мас-спектрометрією (РХМС) або тонкошарову хроматографію (ТШХ); причому згаданий час реакції необов'язково є мінімально досяжним; (ii) коли потрібно, органічні розчини сушили через безводний магній сульфат або безводний натрій сульфат, процедури завершення робили, застосовуючи традиційні техніки відокремлення шарів, випаровування робили ротаційним випаровуванням під зниженим тиском або в Genevac HT-4 / EZ-2. (iii) виходи, де це присутнє, необов'язково є максимально досяжними, та якщо потрібно, реакції повторювали, якщо потребувалась більша кількість продукту; (iv) взагалі, структури кінцевих продуктів підтверджували ядерним магнітним резонансом (ЯМР) та/або мас-спектрометричними способами; електророзпилювальні мас-спектроскопічні дані отримували, застосовуючи Waters ZMD або Waters ZQ LC/ мас-спектрометр, отримуючи дані позитивного та негативного іону, звичайно описано тільки іони, які стосуються вихідної структури; величини хімічного зсуву ЯМР протону вимірювали на дельта-шкалі при 400 МГц, застосовуючи ЯМР-спектрометр Bruker або ЯМР-спектрометр Varian. Застосовували наступні скорочення: s, синглет; d, дуплет; pd, частковий дуплет; t, триплет; q, квартет; m, мультиплет; br, широкий. Обмінні протони не завжди спостерігали або повідомляли в ЯМР кінцевих продуктів, внаслідок обміну з дейтерованим розчинником, або сприятливою дейтерованою водою в розчиннику, сигнал є або слабко розрішеним та/або дуже широким; (v) проміжні сполуки необов'язково були повністю очищеними, але їх структури та чистоту визначали ТШХ, аналітичною ВЕРХ та/або аналізом ЯМР; (vi) якщо не встановлено інакше, хроматографію на колонці (миттєвою процедурою) та рідинну хроматографію середнього тиску (СТРХ) виконували на Merck Kieselgel silica (Art. 9385) або застосовуючи патрони з діоксидом силіцію на напівавтоматизованій апаратурі флешхроматографії (SFC) (наприклад, CombiFlash Companion); та (vii) застосовували наступні скорочення: Boc трет-бутилоксикарбоніл; CD3OD дейтерометанол; 17 UA 115686 C2 5 10 15 20 25 30 35 40 45 50 ДМСО-d6 гексадейтеродиметилсульфоксид; CDCl3 дейтерохлороформ; PE петролейний етер; IPA ізопропанол; iPrOAc ізопропілацетат; MTBE метил трет-бутил-етер; ДХМ дихлорометан; ТГФ тетрагідрофуран; КТ кімнатна температура; MeOH метанол; EtOH етанол; та EtOAc етилацетат. Рентгенівська дифракція на порошку Аналітичний інструмент: Panalytical Empyrean. Рентгенівську дифрактограму на порошку визначали встановленням зразку кристалічного матеріалу на Si-утримувач монокристалу та розгортанням зразку до тонкого шару для створення мікроскопічного препарату. Позицію 2θ калібрували стосовно стандарту Panalytical 640 Si powder standard. Зразок опромінювали рентгенівським промінням, генерованим довго-тоноко-фокусною трубкою, яка діє при 45 кВ та 40 мA із довжиною хвилі Kα1=1,540598 ангстремів та Kα2=1,544426 ангстремів (інтенсивність співвідношення Kα2/Kα1 дорівнює 0,50). Коліміроване джерело рентгенівського променю проводили через програмований дивергентний щілинний агрегат при 10 мм, та відбите випромінювання спрямували через 5,5 мм антирозсіювальну щілину. Зразок піддавали впливу протягом 12,7 секунд 0,0167° 2-тета-інкремент (безперервний режим сканування) у діапазоні 3 − 40 градусів 2-тета в режимі тета-тета. Час випробування був 3 хвилини та 57 секунд. Прилад оснащували детектором RTMS (X'Celerator). Регулювання та отримання даних здійснювали з допомогою Dell Optiplex 780 XP, що діє за програмою збору даних. Фахівцям із рентгенівської дифракції на порошку в галузі техніки слід розуміти, що відносна інтенсивність піків може вражатися, наприклад, гранулами з розміром більшим 30 мкм, та співвідношенням не одиничних аспектів, які можуть вражати аналіз зразків. Фахівцю також слід розуміти, що позиція відбиття може бути враженою певною висотою, при якій зразок перебуває в дифрактометрі, та калібруванням нуля дифрактометру. Площинність поверхні зразка також може мати малу дію. Отже, представлені дані рентгенограми дифракційної картини не слід сприймати як абсолютні величини. Диференціальна скандувальна калориметрія Аналітичний інструмент: TA Instruments Q200 або Q2000 DSC. Типово менше 5 мг матеріалу, який містився в стандартній алюмінієвій оснащеній кришкою посудині, нагрівали при температурі 25 − 300C при постійній швидкості нагрівання 10C за хвилину. Для промивання застосовували газ азот зі швидкістю потоку 50 мл за хвилину. Проміжна сполука 1 5-гідрокси-4-метокси-2-нітробензойна кислота 4,5-диметокси-2-нітробензойну кислоту (145 г, 0,639 мол) розчиняли в розчині натрій гідроксиду (6N, 600 мл) та нагрівали при 100 °C протягом 3 год. Суміш охолоджували до кімнатної температури та заливали в суміш концентрованої хлоридної кислоти та подрібненого льоду (pH
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinazoline inhibitors of activating mutant forms of epidermal growth factor receptor
Автори англійськоюLi, David, Yunzhi, Wang, Jiabing, Yang, Zhenfan, Zeng, Qingbei, Zhang, Xiaolin
Автори російськоюЛи Дэйвид Юньчжи, Ван Цзябин, Ян Чженьфан, Цзэн Цинбэй, Чжан Сяолинь
МПК / Мітки
МПК: A61K 31/517, C07D 403/12, A61K 31/496
Мітки: форм, мутантних, інгібітори, рецептора, росту, хіназолінові, епідермального, фактора, активувальних
Код посилання
<a href="https://ua.patents.su/37-115686-khinazolinovi-ingibitori-aktivuvalnikh-mutantnikh-form-receptora-epidermalnogo-faktora-rostu.html" target="_blank" rel="follow" title="База патентів України">Хіназолінові інгібітори активувальних мутантних форм рецептора епідермального фактора росту</a>
Попередній патент: Спосіб виготовлення моделі абсолютно чорного тіла
Наступний патент: Спосіб термічної обробки сталевих листів та пристрій для його здійснення
Випадковий патент: Фармацевтична композиція "веногепар" для лікування хронічної венозної недостатності та її ускладнень