Похідні хіназоліну як інгібітори васкулярного ендотеліального фактора росту (vegf)
Номер патенту: 72946
Опубліковано: 16.05.2005
Автори: Стоукс Елайн Софі Елізабет, Еннекен Лоран Франсуа Андре, Томас Ендрю Пітер
Формула / Реферат
1. Похідне хіназоліну формули І:
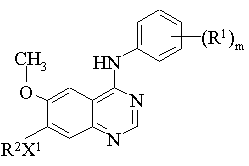 , (I)
, (I)
де:
m дорівнює цілому числу від 1 до 3;
R1 являє собою галоген або С1-3-алкіл;
X1 являє собою -О-;
R2 вибраний з однієї з наступних трьох груп:
1) С1-5-алкіл-R3 (де R3 являє собою піперидин-4-іл, який має один або два замісники, вибрані з гідрокси, галогену, С1-4-алкілу, С1-4-гідроксіалкілу і С1-4-алкокси);
2) С2-5-алкеніл-R3 (де R3 має вказані вище значення);
3) С2-5-алкініл-R3 (де R3 має вказані вище значення);
і де будь-яка алкільна, алкенільна або алкінільна група може мати один або декілька замісників, вибраних з гідрокси, галогену і аміно;
або його сіль.
2. Похідне хіназоліну за п. 1, де фенільна група, що має (R1)m, вибрана з 2-фтор-4-метилфенілу, 4-хлор-2,6-дифторфенілу, 4-бром-2,6-дифторфенілу, 4-хлор-2-фторфенілу і 4-бром-2-фторфенілу.
3. Похідне хіназоліну за п. 1 або п. 2, де R2 являє собою С1-5-алкіл-R3 (де R3 має значення, вказані в п. 1).
4. Похідне хіназоліну за будь-яким з попередніх пунктів, де R2 являє собою піперидин-4-ілметил, в якому кільце піперидину може мати один або два замісники, вибрані з С1-4алкілу.
5. Похідне хіназоліну за п. 1 формули II:
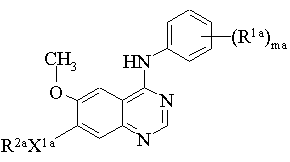 , (II)
, (II)
де:
mа дорівнює цілому числу від 1 до 3;
R1a являє собою галоген або С1-3-алкіл;
Х1a являє собою -О-;
R2a вибраний з однієї з наступних трьох груп:
1) С1-5-алкіл-R3 (де R3 має значення, вказані в п. 1);
2) С2-5-алкеніл-R3 (де R3 має значення, вказані в п. 1);
3) С2-5-алкініл-R3 (де R3 має значення, вказані в п. 1);
або його сіль.
6. Похідне хіназоліну за п. 1, вибране з:
4-(4-хлор-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-
ілметокси)хіназоліну,
4-(2-фтор-4-метиланіліно)-6-метокси-7-(1-метилпіперидин-4-
ілметокси)хіназоліну,
4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-
ілметокси)хіназоліну,
4-(4-хлор-2,6-дифтораніліно)-6-метокси-7-(1-метилпіперидин-4-
ілметокси)хіназоліну,
4-(4-бром-2,6-дифтораніліно)-6-метокси-7-(1-метилпіперидин-4-
ілметокси)хіназоліну,
4-(4-хлор-2-фтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназоліну,
4-(2-фтор-4-метиланіліно)-6-метокси-7-(піперидин-4-ілметокси)хіназоліну,
4-(4-бром-2-фтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназоліну,
4-(4-хлор-2,6-дифтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназоліну,
4-(4-бром-2,6-дифтораніліно)-6-метокси-7-(піперидин-4-
ілметокси)хіназоліну
і їх солей.
7. Похідне хіназоліну за п. 1, вибране з:
4-(4-хлор-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназоліну,
4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназоліну,
4-(4-хлор-2,6-дифтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназоліну,
4-(4-бром-2,6-дифтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназоліну
і їх солей.
8. Похідне хіназоліну за п. 1, вибране з:
4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-
ілметокси)хіназоліну і його солей.
9. Похідне хіназоліну за будь-яким з попередніх пунктів у вигляді фармацевтично прийнятної солі.
10. Сполука формули І за п.1 або її фармацевтично прийнятна сіль для отримання лікарського засобу для продукування антиангіогенної і/або знижуючої васкулярну проникність дії у теплокровної тварини, такої як людина.
11. Сполука за п. 10, де лікарський засіб додатково містить васкулярний мішеневий агент.
12. Сполука за п. 11, що являє собою 4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін або її фармацевтично прийнятну сіль, і васкулярним мішеневим агентом є N-ацетилколхінол-О-фосфат.
13. Сполука формули І за п. 1 або її фармацевтично прийнятна сіль для отримання лікарського засобу для продукування протиракової дії у теплокровної тварини, такої як людина.
14. Сполука за п. 13, де лікарський засіб додатково містить васкулярний мішеневий агент.
15. Сполука за п. 14, що являє собою 4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін або її фармацевтично прийнятну сіль, і васкулярним мішеневим агентом є N-ацетилколхінол-О-фосфат.
16. Сполука формули І за п. 1 або її фармацевтично прийнятна сіль для отримання лікарського засобу для інгібування ефектів фактора росту судинного ендотелію (VEGF) у теплокровної тварини, такої як людина.
17. Спосіб одержання похідного хіназоліну формули І, вказаного в п. 1, або його солі, при якому проводять:
(a) взаємодію сполуки формули III:
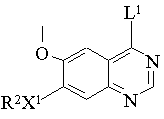 , (ІІІ)
, (ІІІ)
де R2 і X1 мають значення, вказані в п. 1, і L1 являє собою групу, що замінюється, із сполуками формули IV:
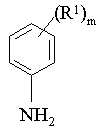 , (IV)
, (IV)
де R1 і m мають значення, вказані в п. 1;
(b) взаємодію сполуки формули V:
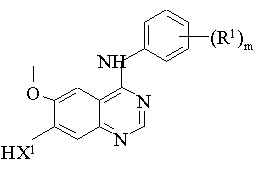 , (V)
, (V)
де m, X1 і R1 мають значення, вказані в п. 1, із сполуками формули VI:
R2-L1, (VI)
де R2 має значення, вказані в п. 1, і L1 має значення, вказане нижче;
(c) взаємодію сполуки формули VII:
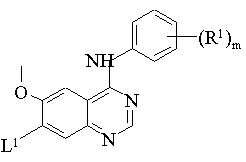 , (VII)
, (VII)
із сполукою формули VIII:
R2-X1-H , (VIII)
де R1, R2, m і X1 мають значення, вказані в п. 1, і L1 має значення, вказане нижче, або
(d) видалення захисту у сполуки формули IX:
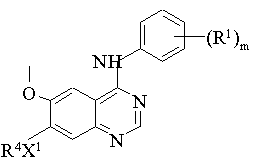 , (IX)
, (IX)
де R1, m і X1 мають значення, вказані в п. 1, і R4 являє собою захищену групу R2, де R2 має значення, вказані в п. 1, але додатково містить одну або декілька захисних груп Р2, і, якщо необхідно, фармацевтично прийнятну сіль похідного хіназоліну формули І, взаємодію отриманої сполуки з кислотою або основою з отриманням необхідної фармацевтично прийнятної солі.
18. Фармацевтична композиція, що містить як активний інгредієнт сполуку формули І, вказану в п. 1, або її фармацевтично прийнятну сіль в поєднанні з фармацевтично прийнятним ексципієнтом або носієм.
19. Спосіб продукування антиангіогенної і/або знижуючої васкулярну проникність дії у теплокровної тварини, потребуючої такого лікування, який включає введення вказаній тварині ефективної кількості сполуки формули І, вказаної в п. 1, або її фармацевтично прийнятної солі.
20. Спосіб за п. 19, де введення сполуки формули І здійснюють до, після або одночасно з введенням ефективної кількості мішеневого агента.
21. Спосіб за п. 20, де сполукою, що вводять, є 4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін або її фармацевтично прийнятна сіль і васкулярним мішеневим агентом є N-ацетилколхінол-O-фосфат.
22. Спосіб продукування протиракової дії у теплокровної тварини, потребуючої такого лікування, який включає введення вказаній тварині ефективної кількості сполуки формули І, вказаної в п. 1, або її фармацевтично прийнятної солі.
23. Спосіб за п. 22, де введення сполуки формули І здійснюють до, після або одночасно з введенням ефективної кількості мішеневого агента.
24. Спосіб за п. 23, де сполукою, що вводять, є 4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін або її фармацевтично прийнятна сіль і васкулярним мішеневим агентом є N-ацетилколхінол-O-фосфат.
25. Спосіб інгібування ефектів фактора росту судинного ендотелію (VEGF) у теплокровної тварини, потребуючої такого лікування, який включає введення вказаній тварині ефективної кількості сполуки формули І, вказаної в п. 1, або її фармацевтично прийнятної солі.
Текст
Даний винахід відноситься до похідних хіназоліну, способів їх одержання, фармацевтичних композицій, що містять їх як активний інгредієнт, способів лікування патологічних станів, асоційованих з розвитком кровоносних судин і/або підвищеною васкулярною проникністю, до їх застосування як лікарських засобів і до їх застосування при виготовленні лікарських препаратів для використання при продукуванні антиангіогенних і/або знижуючих васкулярну проникність дій у теплокровних тварин, таких як людина. Нормальний розвиток кровоносних судин грає важливу роль в різних процесах, що включають ембріональний розвиток, загоєння ран і декілька компонентів жіночої репродуктивної функції. Небажаний або патологічний розвиток кровоносних судин був пов'язаний з патологічними станами, що включають діабетичну ретинопатію, псоріаз, рак, ревматоїдний артрит, атерому, саркому Капоти і гемангіому [Fan et al, 1995, Trends Pharmacol Sci. 16: 5.7-66; Folkman, 1995, Nature Medicine 1: 27-31]. Вважають, що зміна васкулярної проникності грає роль як в нормальних, так і патологічних фізіологічних процесах [Cullinan-Bove et al, 1993, Endocrinology 133: 829-837; Senger et al, 1993, Cancer and Metastasis Reviews, 12: 303-324]. Були ідентифіковані декілька поліпептидів зі стимулюючою in vitro зростання ендотеліальних клітин активністю, включаючи кислотні і основні фактори росту фібробластів (aFGF і bFGF) і васкулярний ендотеліальний фактор росту (VEGF). Внаслідок обмеженої експресії його рецепторів, активність фактора росту VEGF, в протилежність активності FGFs, є відносно вибірковою по відношенню до ендотеліальних клітин. Останні дані вказують на те, що VEGF є важливим стимулятором як нормального, так і патологічного розвитку кровоносних судин [Jakeman et al, Endocrinology, 133: 848-859; Kolch et al, 1995, Breast Cancer Research and Treatment, 36: 139-155] і васкулярної проникності [Connolly et al, 1989, J. Biol. Chem. 264: 20017-20024]. Антагонізм дії VEGF секвестрацією VEGF антитілом може привести до інгібування росту пухлини [Kirn et al, 1993, Nature 362: 841-844]. Рецепторні тирозинкінази (RTKs) є важливими в передачі біохімічних сигналів через плазматичну мембрану клітин. Ці трансмембранні молекули характеристично складаються з позаклітинного, зв'язуючого ліганд домену, пов'язаного через сегмент в плазматичній мембрані з доменом внутрішньоклітинної тирозинкінази. Скріплення ліганду з рецептором приводить до стимуляції активності асоційованої з рецептором тирозинкінази, яка приводить до фосфорилювання залишків тирозину як на рецепторі, так і інших внутрішньоклітинних молекулах. Вказані зміни у фосфорилюванні тирозину ініціюють каскад передачі сигналу, що приводить до різних клітинних реакцій у відповідь. На сьогоднішній день ідентифіковано, щонайменше, дев'ятнадцять різних підродин RTK, що визначаються гомологією амінокислотної послідовності. Одна з цих підродин в цей час включає fms-подібний рецептор тирозинкінази, Fit або Fltl, рецептор, що містить домен вставки кінази, KDR (названий також Flk-Ι), і інший fms-подібний рецептор тирозинкінази, Flt4. Було показано, що два з цих споріднених RTKs, Fit і KDR, зв'язують VEGF з високою спорідненістю [De Vries at al, 1992, Science 255: 989-991; Terman et al, 1992, Biochem. Biophys. Res. Comm. 1992, 187: 1579-1586]. Скріплення VEGF з вказаними рецепторами, експресованими в гетерологічних клітинах, було асоційоване із змінами в статусі фосфорилювання тирозину клітинних білків і кальцієвих потоків. Похідні хіназоліну, які є інгібіторами рецепторної тирозинкінази VEGF, описані в публікації Міжнародних патентних заявок №№ WO97/30035 і WO98/13354. У WO97/30035 і WO98/13354 описуються сполуки, які володіють активністю проти рецепторної тирозинкінази VEGF, в той же час володіючи деякою активністю проти рецепторної тирозинкінази EGF. Сполуки за даним винаходом підпадають під об'єм широкого загального опису WO97/30035 і WO98/13354. Авторами виявлено, що сполуки за даним винаходом володіють дуже високою інгібуючою активністю у відношенні рецепторної тирозинкінази VEGF. Сполуки за даним винаходом, які були перевірені, виявляють in vitro активність відносно ряду ксенотрансплантатів пухлин у мишей. Сполуки за даним винаходом володіють вигідним токсикологічним профілем при випробуванні протягом 14 днів на пацюках. Сполуки за даним винаходом володіють дуже високою інгібуючою активністю у відношенні рецепторної тирозинкінази VEGF, виявляють in vi vo активність проти ряду ксенотрансплантатів пухлин у мишей і володіють вигідним токсикологічним профілем при випробуванні протягом 14 днів на пацюках. Сполуки за даним винаходом інгібують дію VEGF, що є пінною властивістю при лікуванні патологічних станів, асоційованих з розвитком кровоносних судин і/або підвищеною васкулярною проникністю, таких як рак, діабет, псоріаз, ревматоїдний артрит, саркома Капоши, гемангіома, гострі і хронічні нефропатії, атерома, артеріальний рестеноз, аутоімунні захворювання, гостре запалення, надмірні утворення шрамів і спайок, ендометріоз, дисфункціональна маточна кровотеча і очні хвороби з проліферацією ретинальних судин. Сполуки за даним винаходом володіють високою активністю у відношенні рецепторної тирозинкінази VEGF, в той же час володіючи деякою активністю у відношенні рецепторної тирозинкінази EGF. Крім того, деякі сполуки за даним винаходом володіють значно більш високою активністю у відношенні рецепторної тирозинкінази VEGF, в порівнянні з активністю у відношенні рецепторної тирозинкінази EGF або рецепторної тирозинкінази EGF R1. Без якої-небудь прив'язки до теорії, такі сполуки можуть, наприклад, представляти інтерес при лікуванні пухлин, які асоціюються з VEGF, особливо тих пухлин, зростання яких залежить від VEGF. Крім того, вважають, що вказані сполуки можуть представляти інтерес при лікуванні пухлинних станів, асоційованих як з VEGF, так і EGF, особливо, коли пацієнт страждає станом, при якому присутні пухлини, зростання яких залежить як від VEGF, так і EGF. Відповідно до одного аспекту даного винаходу, запропоноване похідне хіназоліну формули І: де: m дорівнює цілому числу від 1 до 3; R1 представляє галоген або С1-3-алкіл; X1 представляє -О-; R2 вибраний з однієї з наступних трьох гр уп: 1) С1-5-алкіл-R3 (де R3 представляє піперидин-4-іл, який має один або два замісники, вибраних з гідрокси, галогену, С1-4-алкілу5 С1. 4-гідроксіалкілу і С 1-4-алкокси); 2) С2-5-алкеніл-R3 (де R3 має вказані вище значення); 3) C 2-5-алкеніл-R3 (де R3 має вказані вище значення); і де будь-яка алкільна, алкенільна або алкінільна група може мати один або декілька замісників, вибраних з гідрокси, галогену і аміно; або його сіль або його проліки. Переважно, m дорівнює 2. Фенільна група, що містить (R1)m, переважно, вибрана з 2-фтор-4-метилфенілу, 4-хлор-2,6дифторфенілу, 4-бром-2,6-дифторфенілу, 4-хлор-2-фторфенільної групи і 4-бром-2-фторфенілу. Фенільна група, що містить (R1)m, більш переважно, вибрана з 4-хлор-2-фторфенілу і 4-бром-2фтор фенілу. Фенільна група, що має (R1)m, дуже переважно, вибрана з 4-бром-2-фторфенілу. R2, переважно, представляє С1-5-алкіл-R3 (де R3 має вказані вище значення). R2, більш переважно, представляє С1-3-алкіл-R (де R має вказані вище значення). Конкретно, R2 представляє піперидин-4-ілметил, в якому кільце піперидину може мати один або два замісники, як вказано тут ви ще. Більш конкретно, R2 представляє піперидин-4-ілметил, в якому кільце піперидину може мати один або два замісники, вибраних з С 1-4-алкілу. Зокрема, R2 представляє 1-метилпіперидин-4-ілметил. Відповідно до наступного аспекту даного винаходу, запропоноване похідне хіназоліну формули II: де: ma дорівнює цілому числі від 1 до 3; R1a представляє галоген або С1-3-алкіл; Х1а представляє -О-; R2a вибраний з однієї з наступних трьох гр уп: 1) С1-5-алкіл-R3 (де R3 має вказані вище значення); 2) С2-5-алкеніл-R3 (де R3 має вказані вище значення); 3) С2-5-алкініл-R3 (де R3 має вказані вище значення); або його сіль, або його проліки. Переважно, та дорівнює 2. Фенільна група, що має (R1a) ma, переважно, вибрана з 2-фтор-4-метилфенілу, 4-хлор-2, 6дифторфенілу, 4-бром-2,6-дифторфенілу, 4-хлор-2-фторфенільної групи і 4-бром-2-фторфенілу. Фенільна група, що має (R1a)ma , більш переважно, вибрана з 4-хлор-2-фторфенілу і 4-бром-2фтор фенілу. Фенільна група, що має (R1a)ma, дуже переважно, вибрана з 4-бром-2-фторфенілу. R2a, переважно, представляє С1-5-алкіл-R3 (де R3 має вказані вище значення). R2a, більш переважно, представляє С1-3-алкіл-R3 (де R3 має вказані вище значення). Конкретно, R2a представляє піперидин-4-ілметил, в якому кільце піперидину може мати один або два замісники, як указано тут вище. Більш конкретно, R2a представляє піперидин-4-ілметил, в якому кільце піперидину може мати один або два замісники, вибраних з С 1-4-алкілу. Зокрема, R2a представляє 1-метилпіперидин-4-ілметил. Переважні сполуки даного винаходу включають: 4-(4-хлор-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(2-фтор-4-метиланіліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(4-хлор-2,6-дифтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(4-бром-2,6-дифтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(4-хлор-2-фтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназолін, 4-(2-фтор-4-метиланіліно)-6-метокси-7-(піперидин-4-ілметокси)хіназолін, 4-(4-бром-2-фтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназолін, 4-(4-хлор-2,6-дифтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназолін, 4-(4-бром-2,6-дифтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназолін і їх солі, особливо їх гідрохлоридні солі. Більш переважні сполуки даного винаходу включають: 4-(4-хлор-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(4-хлор-2,6-дифтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(4-бром-2,6-дифтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(4-хлор-2-фтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназолін, 4-(4-бром-2-фтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназолін, 4-(4-хлор-2,6-дифтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназолін, 4-(4-бром-2,6-дифтораніліно)-6-метокси-7-(піперидин-4-ілметокси)хіназолін і їх солі, особливо їх гідрохлоридні солі. Особливо переважні сполуки даного винаходу включають: 4-(4-хлор-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-іліметокси)хіназолін, 4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(4-хлор-2,6-дифтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін, 4-(4-бром-2,6-дифтораніліно)-6-метокси-7-(1-метилпіперидин-і-ілметокси)хіназолін і їх солі, особливо їх гідрохлоридні солі. Більш конкретно, переважні сполуки даного винаходу включають: 4-(4-хлор-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін і 4-(4-бром-2-фтораніліно)-6-метокси-7-(1-метилпіперидин-4-ілметокси)хіназолін і їх солі, особливо їх гідрохлоридні солі. Особливо переважною сполукою даного винаходу є 4-(4-бром 2-фтораніліно)-6-метокси-7-{1-метилпіперидин-4-ілметокси)хіназолін і його солі, особливо гідрохлоридні солі. Щоб уникнути яких-небудь сумнівів, потрібно врахувати, що в тих випадках, коли в даному описі група визначається виразом «така, що раніше тут визначається» або «яка визначається тут раніше», вказана група включає перше і найширше визначення, що зустрічається, а також кожне і все з переважних визначень для цієї групи. Аналогічна умова застосовна для виразу «як указано далі» або «що визначається далі». У даному описі, якщо не вказане інше, термін «алкіл» включає алкільні групи як з нерозгалуженим, так і з розгалуженим ланцюгом, але посилання на індивідуальні алкільні групи, такі як «пропіл», є конкретними тільки для варіанту нерозгалуженого ланцюга. Аналогічна умова застосовна для інших родових термінів. Якщо не вказане інше, термін «алкіл» переважно відноситься до ланцюгів з 1-5 атомами вуглецю, переважно, 1-3 атомами вуглецю. Термін «алкокси», що використовується тут, якщо не указано інакше, включає «алкіл»-О-групи, в яких «алкіл» має значення, вказані тут вище. Термін «арил», що використовується тут, якщо не указано інакше, включає відношення до С 6-10-арильної групи, яка може, при необхідності, мати один або декілька замісників, вибраних з галогену, алкілу, алкокси, нітро, трифторметилу і ціано (де алкіл і алкокси мають значення, вказані тут вище). Термін «арилокси», що використовується тут, якщо не указано інакше, включає «арил»-О-групи, в яких «арил» має значення, вказані тут ви ще. Термін «сульфонілокси», що використовується тут, відноситься до алкілсульфонілокси- і арилсульфонілоксигруп, в яких «алкіл» і «арил» мають значення, вказані тут ви ще. Термін «алканоїл», що використовується тут, якщо не указано інакше, включає форміл і алкіл-С=О-групи , в яких «алкіл» має значення, вказані тут ви ще, наприклад С2-алканоїл є етаноїлом і відноситься до СН 3С=О , С1-алканоїл є формілом і відноситься до СНО. У даному описі, якщо не указано інакше, термін «алкеніл» включає алкенільні групи як з нерозгалуженим, так і розгалуженим ланцюгом, але посилання на індивідуальні алкенільні групи, такі як 2бутеніл, є специфічними тільки для варіанту нерозгалуженого ланцюга. Якщо не указано інакше, термін «алкеніл», переважно, відноситься до ланцюгів з 2-5 атомами, переважно, 3-5 атомами вуглецю. У даному описі, якщо не указано інакше, термін «алкініл» включає алкінільні групи як з нерозгалуженим, так і розгалуженим ланцюгом, але посилання на індивідуальні алкенільні групи, такі як 2-бутиніл, є специфічними тільки для варіанту нерозгалуженого ланцюга. Якщо не указано інакше, термін «алкініл», переважно, відноситься до ланцюгів з 2-5 атомами, переважно, 3-5 атомами вуглецю. У формулі І, як указано тут ви ще, водень може бути присутнім в положеннях 2, 5 і 8 хіназолінової групи. У даному винаході повинно бути ясно, що сполука формули І або її сіль може виявляти феномен таутомерії і що зображення формул в даному описі можуть представляти тільки одну з можливих таутомерних форм. Повинно бути зрозуміле, що винахід включає будь-яку таутомерпу форму, яка інгібує активність рецепторної тирозинкінази VEGF, і не повинен обмежуватися тільки будь-якою однією таутомерною формою, що використовується в зображеннях формул. Повинно бути зрозуміле також, що деякі сполуки формули І і їх солі можуть існувати в сольватованих, а також несольватованих формах, таких як, наприклад, гідратовані форми. Повинно бути зрозуміле, що винахід включає всі такі сольватовані форми, які інгібують активність рецепторної тирозинкінази VEGF. Щоб уникнути появи сумнівів, потрібно знати, що в сполуці формули І, коли R2 представляє, наприклад, груп у формули С 2-5-алкеніл-R3, він представляє С2-5-алкенільну частину, яка пов'язана з X1, і аналогічну умовність застосовують для інших груп. Коли R2 представляє групу 1-R3-проп-1-ен-3-іл, він є першим вуглецем, до якого приєднаний R3, і він є третім вуглецем, який пов'язаний з X1, аналогічно, коли R2 представляє групу 2-R3-пен-3-eh-5-iл, він є другим вуглецем, до якого приєднана група R 3, і він є п'ятим вуглецем, який пов'язаний з X1, і аналогічну умовність застосовують для інших груп. Сполуки формули І можна вводити у вигляді проліків, які розщеплюються в організмі людини або тварини з виділенням сполуки формули І. Приклади проліків включають гідролізовані in vivo складні ефіри сполуки формули І. Різні форми проліків відомі в даній області. Приклади таких пролікарських похідних див. в п ублікаціях: a) Design of Prodrugs, edited by Η. Bundgaard, (Elsevter, 1985) and Methods in Enzymofogy, Vol.42, p.309396, edited by K. Widder, et al. (Academic Press, 1985); b) A Textbook of Drag Design and Development, edited by Krogsgaard-Larsen and H. Bundgaard, "Chapter 5 Design and Application of Prodrags", by H. Bundgaard p.113-191 (1991); c) Н. Bundgaard, Ad vanced Drag Delivery Reviews, 8, 1-38 (1992); d) H. Bundgaard, et al., Journal of Pharmaceutical Sciences, 77, 285 (1988); and e) N. Kakeya, et al., Chem Pharm Bull, 32, 692 (1984). Гідролізований in vivo складний ефір сполуки формули І, що містить гідроксигрупу, включає неорганічний ефір, такий як фосфатний ефір (в тому числі фосфорамідні циклічні ефіри) і ацилоксіалкілові прості ефіри і аналогічні сполуки, які внаслідок гідролізу in vivo складного ефіру розщеплюються з утворенням вихідної гідроксигрупи(груп). Приклади ацилоксіалкілових простих ефірів включають ацетоксиметокси і 2,2-диметилпропіонілоксиметокси. Вибір груп, утворюючих гідролізовані in vivo складні ефіри для гідрокси, включає алканоїл, бензоїл, фенілацетил і заміщений бензоїл і фенілацетил, алкоксикарбоніл (для одержання алкілкарбонатних ефірів), діалкілкарбамоїл і N-(діалкіламіноетил)-Nалкілкарбамоїл (для одержання карбаматів), діалкіламіноацетил і карбоксіацетил. Приклади замісників бензоїлу включають морфоліно і піперазино, сполучені за атомом азоту кільця через метиленову групу з 3або 4-положенюш кільця бензоїлу. Даний винахід відноситься до сполук формули І, як вказано тут вище, а також їх солей. Солі для використання в фармацевтичних композиціях повинні бути фармацевтично прийнятними солями, але інші солі можуть бути придатними при одержанні сполук формули І і їх фармацевтично прийнятних солей. Фармацевтично прийнятні солі за винаходом можуть, наприклад, включати кислотно-адитивні солі сполук формули І, як указано тут вище, які є досить основними для утворення таких солей. Такі кислотно-адитивні солі включають, наприклад, солі з неорганічними або органічними кислотами, утворюючими фармацевтично прийнятні аніони, такі як галогенводневі (особливо, хлористоводнева або бромистоводнева кислота, з яких хлористоводнева кислота особливо переважна), або з сірчаною або фосфорною кислотою, або з трифтороцтовою кислотою, лимонною або малеїновою кислотою. Крім того, коли сполуки формули І є досить кислотними, можна одержати фармацевтично прийнятні солі з неорганічною або органічною основою, яка утворює фармацевтично прийнятний катіон. Такі солі з неорганічними або органічними основами включають, наприклад, сіль лужного металу, така як сіль натрію або калію, сіль лужноземельного металу, така як сіль кальцію або магнію, сіль амонію або, наприклад, сіль з метиламіном, диметиламіном, триметиламіном, піперидином, морфоліном або трис-(2-гідроксіетил)аміном. Сполука формули І або її сіль, або інші сполуки винаходу (як указано тут вище) можна одержати будьяким способом, який, як відомо, є придатним для одержання хімічно близьких сполук. Такі способи включають, наприклад, способи, ілюстровані в Європейських патентних заявках, публікації №№ 0520722, 0566226, 0602851 і 0635498, і в публікаціях Міжнародних патентних заявок №№ WO97/22596, WO97/30035, WO97/32856 і WO98/13354. Такі способи запропоновані як наступні ознаки винаходу і описані нижче. Необхідні вихідні матеріали можна одержати стандартними методиками органічної хімії. Одержання таких вихідних матеріалів описується в супроводжуючих не обмежуючих прикладах. У альтернативному випадку, необхідні вихідні матеріали можна одержати методиками, аналогічними ілюстрованим методикам, які знаходяться в межах знань хіміка-органіка середньої кваліфікації. Таким чином, наступні способи від (а) до (d) і від (і) до (iv) складають наступні ознаки даного винаходу. Синтез сполук формули І (а) Сполуки формули І і їх солі можна одержати взаємодією сполуки формули III (де R2 і X1 мають значення, вказані вище, і L1 представляє частину, що замінюється) із сполукою формули IV: (де R1 і m мають значення, вказані вище), при цьому одержують сполуки формули І і їх солі. Відповідна група L1, що замінюється, представляє, наприклад, галоген, алкокси (переважно, С1-4-алкокси), арилокси або сульфонілоксигрупу, наприклад, хлор, бром, метокси, фенокси, метансульфонілокси або толуол-4сульфонілоксигрупу. Взаємодію переважно проводять в присутності або кислоти, або основи. Такою кислотою є, наприклад, безводна неорганічна кислота, така як хлористий водень. Такою основою є, наприклад, органічний амін, такий як, наприклад, піридин, 2,6-лутидин, колідин, 4-диметиламінопіридин, триетиламін, морфолін, Nметилморфолін або діазабіцикло[5.4.0]ундец-7-ен, або, наприклад, карбонат або гідроксид лужного металу або лужноземельного металу, наприклад, карбонат натрію, карбонат калію, карбонат кальцію, гідроксид натрію або гідроксид калію. У альтернативному випадку такою основою є, наприклад, гідрид лужного металу, наприклад, гідрид натрію, або амід лужного металу або лужноземельного металу, наприклад, амід натрію або біс(триметилсиліл)амід натрію. Взаємодію, переважно, проводять в присутності інертного розчинника або розріджувача, наприклад, алканолу або складного ефіру, такого як метанол, етанол, 2пропанол або етилацетат, галогенованого розчинника, такого як метиленхлорид, трихлорметан або тетрахлорид вуглецю, простого ефіру, такого як тетрагідрофуран або 1,4-діоксан, ароматичного вуглеводневого розчинника, такого як толуол, або диполярного органічного розчинника, такого як N,Nдиметилформамід, Ν,N-диметилацетамід, N-метилпіролідин-2-он або диметилсульфоксид. Взаємодію відповідним чином проводять при температурі в діапазоні, наприклад, від 10 до 150°С, переважно, в діапазоні від 20 до 80°С. Сполуку за винаходом можна одержати вказаним способом у вигляді вільної основи або, в альтернативному випадку, її можна одержати у вигляді солі з кислотою формули H-L1, де L1 має значення, вказані вище. Коли необхідно одержати вільну основу з солі, сіль можна обробити основою, як указано вище, з використанням загальноприйнятої методики. b) Сполуки формули І і їх солі можна одержати взаємодією, відповідним чином, в присутності основи, як указано вище, сполуки формули V: (де m, X1 R 1 мають значення, вказані вище) зі сполукою формули VI: R -L1 (VI) (де R2 і L1 мають значення, вказані вище); L1 представляє групу, що замінюється, наприклад, галоген або сульфонілоксигрупу, таку як бром або метансульфонілоксигрупа. У відповідному випадку L1 представляє групу O-+P(Y)3 (де Υ представляє бутил або феніл), і в таких випадках сполуку формули VI можна зручно одержати in situ. Взаємодію, переважно, проводять в присутності основи (як указано вище в способі (а)) і, переважно, в присутності інертного розчинника (як указано вище в способі (а)), переважно, при температурі в діапазоні, наприклад, від 10 до 150°С, у відповідному випадку, приблизно при 50°С. (c) Сполуки формули І і їх солі можна одержати взаємодією сполуки формули VII: 2 із сполукою формули VIII: R2-X1-Η (VIII) (де L1, R1, R2, m і X1, всі, мають значення, вказані вище). Взаємодію відповідним чином можна проводити в присутності основи (як указано тут ви ще в способі (а)) і, переважно, в присутності інертного розчинника або розріджувача (як указано вище в способі (а)), переважно, при температурі в діапазоні, наприклад, від 10 до 150°С, у відповідному випадку приблизно при 100°С. (d) Сполуки формули І і їх солі можна одержати зняттям захисту у сполуки формули IX: де R1, m і X1, всі, мають вказані вище значення, і R4 представляє захищену гр уп у R2, де R2 має вказані вище значення, але додатково має одну або декілька захисних груп Р2. Вибір захисної групи знаходиться в межах стандартного знання хіміка-органіка, наприклад, знання, включеного в стандартні посібники, такі як «Protective Groups in Organic Synthesis» T.W. Greene and R.G.M. Wuts, 2nd Ed. Wiley 1991. Переважно, Ρ2 представляє таку захисну гр упу, як карбамат (алкоксикарбоніл) (такий як, наприклад, трет-бутоксикарбоніл, трет-амілоксикарбоніл, циклобутоксикарбоніл, пропоксикарбоніл, метоксикарбоніл, етоксикарбоніл, ізопропоксикарбоніл, алілоксикарбоніл або бензилоксикарбоніл). Більш переважно, Р2; представляє третбутоксикарбоніл. Взаємодію, переважно, проводять в присутності кислоти. Така кислота є, наприклад, неорганічною кислотою, такою як хлористий водень, бромистий водень, або органічною кислотою, такою як трифтороцтова кислота, трифторметансульфонова кислота. Взаємодію можна проводити в присутності інертного розчинника, такого як метиленхлорид, трихлорметан, і в присутності слідів води. Взаємодію у відповідному випадку проводять при температурі в діапазоні 10-100°С, переважно, в діапазоні 20-80°С. Синтез проміжних продуктів (1) Сполуки формули III і їх солі, в яких L1 представляє галоген, можна, наприклад, одержати галогенуванням сполуки формули X: (де R2 і X1 мають вказані вище значення). Відповідні галогенуючі агенти включають галогенангідриди неорганічних кислот, наприклад, тіонілхлорид, хлорид фосфору (III), оксихлорид фосфору(V) і хлорид фосфору (V). Реакцію галогенування у відповідному випадку проводять в присутності інертного розчинника або розріджувача, такого як, наприклад, галогенований розчинник, такий як метиленхлорид, трихлорметан або тетрахлорид вуглецю, або ароматичний вуглеводневий розчинник, такий як бензол або толуол. Взаємодію відповідним чином проводять при температурі в діапазоні в діапазоні, наприклад, від 10 до 150°С, переважно, в діапазоні від 40 до 100°С. Сполуки формули X і їх солі можна, наприклад, одержати взаємодією сполуки формули XI: (де L1 має вказані вище значення) із сполукою формули VIII, як указано вище. Взаємодію можна відповідним чином проводити в присутності основи (як указано вище в способі (а)) і, переважно, в присутності інертного розчинника або розріджувача (як указано вище в способі (а)), переважно, при температурі в діапазоні, наприклад, від 10 до 150°С, у відповідному випадку, приблизно при 100°С. Сполуки формули X і їх солі можна також одержати циклізацією сполуки формули XII: (де R2 і X1 мають значення, вказані вище, і А1 представляє гідрокси-, алкокси-(переважно, С1-4-алкокси) або аміногрупу), при цьому одержують сполуку формули X або її сіль. Циклізацію можна проводити взаємодією сполуки формули XII, де А1 представляє гідрокси- або алкоксигрупу, з формамідом або його еквівалентом, ефективним для того, щоб викликати циклізацію, при цьому одержують сполуку формули X або її сіль, таку як хлорид [3-(диметиламіно)-2-азапроп-2-еніліден]диметиламмонію. Циклізацію у відповідному випадку проводять в присутності формаміду як розчинника або в присутності інертного розчинника або розріджувача, такого як простий ефір, наприклад, 1,4-діоксан. Циклізацію у відповідному випадку проводять при підвищеній температурі, переважно, в діапазоні від 80 до 200°С. Сполуки формули X можна також одержати циклізацією сполуки формули XII, де А1 представляє аміногрупу, з мурашиною кислотою або її еквівалентом, ефективним для того, щоб викликати циклізацію, при цьому одержують сполуку формули X або її сіль. Еквіваленти мурашиної кислоти, ефективні для того, щоб викликати циклізацію, включають, наприклад, три-С 1-4-алкоксиметан, наприклад, триетоксиметан і триметоксиметан. Циклізацію у відповідному випадку проводять в присутності каталітичної кількості безводної кислоти, такої як сульфонова кислота, наприклад, п-толуолсульфонова кислота, і в присутності інертного розчинника або розріджувача, такого як, наприклад, галогенований розчинник, такий як метиленхлорид, трихлорметан або тетрахлорид вуглецю, простий ефір, такий як діетиловий ефір або тетра-гідрофуран, або ароматичний вуглеводневий розчинник, такий як толуол. Циклізацію у відповідному випадку проводять при температурі в діапазоні, наприклад, від 10 до 100°С, переважно, в діапазоні від 20 до 50°С. Сполуки формули XII і їх солі можна, наприклад, одержати відновленням нітрогрупи в сполуці формули XIII: (де R2, X1 і А1 мають вказані вище значення) з одержанням сполуки формули XII, як указано тут раніше. Відновлення нітрогрупи можна у відповідному випадку здійснити будь-якою з методик, відомих для такого перетворення. Відновлення можна проводити, наприклад, гідруванням розчину нітросполуки в присутності інертного розчинника або розріджувача, як указано тут вище, в присутності металу, ефективного для каталізу реакцій гідрування, такого як паладій або платина. Наступним відновлюючим агентом є, наприклад, активований метал, такий як активоване залізо (одержаний, наприклад, промиванням порошку заліза розбавленим розчином кислоти, такої як хлористоводнева кислота). Так, наприклад, відновлення можна проводити нагріванням нітросполуки і активованого металу в присутності розчинника або розріджувача, такого як суміш води і спирту, наприклад, метанолу або етанолу, до температури в діапазоні, наприклад, від 50 до 150°С, у відповідному випадку, приблизно при 70°С. Сполуки формули XIII і їх солі можна наприклад, одержати взаємодією сполуки формули XIV: (де L1 і А1 мають вказані вище значення) із сполукою формули VIII, як указано тут ви ще, при цьому одержують сполуку формули XIII. Взаємодію сполук формул XIV і VIII у відповідному випадку проводять в умовах, які описані для вказаного вище способу (с). Сполуки формули XIII і їх солі можна, наприклад, одержати також взаємодією сполуки формули XV: (де L1 і А1 мають вказані вище значення) із сполукою формули VI, як указано тут вище, при цьому одержують сполуку формули XIII, як указано тут вище. Взаємодію сполук формул XV і VI у відповідному випадку проводять в умовах, які описані тут ви ще для способу (b). Сполуки формули III і їх солі можна також одержати, наприклад, взаємодією сполуки формули XVI: (де X1 має значення, вказані тут вище, і L2 представляє захисну частину, що замінюється) із сполукою формули VI, як указано тут ви ще, при цьому одержують сполуку формули III, в якій L1 представлений L2. Відповідним чином використовують сполуки формули XVI, де L представляє феноксигрупу, яка може, якщо необхідно, містити аж до 5 замісників, переважно, аж до 2 замісників, вибраних з галогену, нітро і ціано. Взаємодію можна у відповідному випадку проводити в умовах, що описуються для вказаного вище способу (b). Сполуки формули XVI і їх солі, як указано тут ви ще, можна, наприклад, одержати видаленням захисної групи у сполуки формули XVII: (де X1 і L2 мають значення, вказані тут ви ще, і Ρ1 представляє захисну групу фенольного гідроксила). Вибір захисної групи фенольного гідроксилу Ρ1 знаходиться в межах стандартного знання хіміка-органіка, наприклад, знання, включеного в стандартні посібники, такі як «Protective Groups in Organic Synthesis» T.W. Greene and R.G.M. Wuts, 2nd Ed. Wiley 1991, і включає простий ефір (наприклад, метиловий, метоксиметиловий, аліловий і бензиловий, заміщений замісниками аж до двох, вибраних з С 1-4-алкокси і нітро), силілові прості ефіри (наприклад, трет-бутилдифенілсиліловий і трет-бутилдиметилсиліловий), складні ефіри (наприклад, ацетат і бензоат) і карбонати (наприклад, метил і бензил, заміщений замісниками аж до двох, вибраних з С1-4-алкокси і нітро). Зняття захисту можна здійснити методиками, добре відомими в літературі, наприклад, коли Р1 представляє бензильну груп у, зняття захисту можна здійснити гідрогенолізом або обробкою трифтороцтовою кислотою. Видалення такої захисної групи фенольного гідроксилу можна здійснити будь-якою з методик, відомих для такого перетворення, включаючи умови взаємодії методик, вказаних в стандартних посібниках, таких як посібник, вказаний тут раніше, або методикою, що відноситься до них. Умови взаємодії, переважно, є такими, що гідроксипохідне одержують без небажаних взаємодій у інших дільниць в межах вихідних сполук або сполук-продуктів. Наприклад, коли захисна група Р1 представляє ацетат, перетворення можна у відповідному випадку здійснити обробкою похідного хіназоліну основою, як указано тут ви ще, що включає аміак і його моно- і діалкіловані похідні, переважно, в присутності протонного розчинника або співрозчинника, такого як вода або спирт, наприклад, метанол або етанол. Таку взаємодію можна здійснити в присутності додаткового інертного розчинника або розріджувача, як указано тут вище, і при температурі в діапазоні від 0 до 50°С, у відповідному випадку, приблизно при 20°С. Одну сполук у формули III можна, якщо необхідно, перетворити в іншу сполуку формули III, в якій частина L1 є іншою. Так, наприклад, сполуку формули III, В якій L1 інший, ніж галоген, наприклад, необов'язково заміщений фенокси, можна перетворити в сполуки формули III, в якій L1 представляє галоген, гідролізом сполуки формули III (в якій L1 є іншим, ніж галоген) з одержанням сполуки формули X, як указано тут ви ще, з подальшим введенням галогеніду в сполук у формули X, таким чином одержаної, як указано тут ви ще, при цьому одержують сполуку формули III, в якій L1 представляє галоген. (іі) Сполуки формули V, як указано вище, і їх солі можна одержати зняттям захисту у сполуки формули XVIII: (де R1, Ρ1 , X1 і m мають значення, вказані тут ви ще) способом, наприклад, що описується вище в (і). Сполуки формули XVIII і їх солі можна одержати взаємодією сполук формул XVII і IV, як указано тут вище, в умовах, описаних тут вище в (а), при цьому одержують сполуку формули XVIII або її сіль. (ііі) Сполуки формули VII і їх солі, як указано тут ви ще, можна одержати взаємодією сполуки формули XIX: (де L1 має значення, вказані вище, і L1 в 4- і 7-положеннях можуть бути однаковими або різними) із сполукою формули IV, як указано тут вище, причому взаємодію проводять, наприклад, способом, що описується вище в (а). (iv) Сполуки формули IX можна одержати взаємодією сполуки формули V, як указано тут ви ще, із сполукою формули XX: R4-L1 (XX) де R4 і L1 мають значення, вказані вище, в умовах, описаних у вказаному вище способі (b), при цьому одержують сполуку формули IX або її сіль. Взаємодію, переважно, проводять в присутності основи (як указано тут вище в способі (а)) і переважно в присутності інертного розчинника або розріджувача (як указано вище в способі (а)), переважно, при температурі в діапазоні, наприклад, від 10 до 150°С, у відповідному випадку, в діапазоні 20-50°С. Коли необхідна фармацевтично прийнятна сіль сполуки формули І, її можна одержати, наприклад, взаємодією вказаної сполуки, наприклад, з кислотою з використанням загальноприйнятої методики, причому кислота має фармацевтично прийнятний аніон, або її можна одержати взаємодією вказаної сполуки з основою загальноприйнятою методикою. Ідентифікація сполук, які, можливо, інгібують активність тирозинкінази, асоційовану з рецепторами VEGF, такими як Flt і/або KDR, і які інгібують розвиток кровоносних судин і/або підвищують васкулярну проникність, є необхідною і представляє предмет даного винаходу. Вказані властивості можна оцінити, наприклад, з використанням однієї або декількох методик, вказаних нижче. (а) Випробування інгібування in vitro рецепторної тирозинкінази Даний аналіз визначає здатність випробуваної сполуки інгібувати активність тирозинкінази. ДНК, що кодує цитоплазматичні домени рецептора VEGF або епідермального фактора росту (EGF), можна одержати загальним синтезом гена [Edwards Μ, International Biotechnology Lab 5(3), 19-25, 1987] або клонуванням. її можна потім експресувати у відповідній системі експресії для одержання поліпептиду з активністю тирозинкінази. Було виявлено, що, наприклад, рецепторні цитоплазмічні домени VEGF або EGF, які були одержані експресією рекомбінантного білка в клітинах комах, демонструють властиву їм активність тирозинкінази. У разі рецептора VEGF Flt (Genbank accession number X51602) фрагмент ДНК з 1,7 т.п. н., що кодує велику частину цитоплазматичного домену, що починається з метіоніну 783 і включає кінцевий кодон, описаний Shibuya et al. [Oncogene, 1990, 5: 519-524], був виділений з кДНК і клонований в бакуловірусний вектор-переносник (наприклад, pAcYMl [див. Бакуловір усна система експресії: А Laboratory Guide, L.A. King and R.D. Possee, Chapman and Hall, 1992] або рАс360 або pBlueBacHis (доступний від Invitrogen Corporation). Дану рекомбінантну конструкцію котрансфекціювали в клітини комах (наприклад, Spodoptera frugiperda 21(Sf21)) з вірусної ДНК (наприклад, Pharmingen BaculoGold) для одержання рекомбінантного бакуловірусу. [Де талі способів збирання молекул рекомбінантної ДНК і одержання і використання рекомбінантного бакуловірусу можна знайти в стандартних монографіях, наприклад, в Sambrook et al, 1989, Molecular cloning - A Laboratory Manual, 2nd edition, Cold Spring Harbour Laboratory Press and O'Reilly et al. 1992, Baculovirus Expression Vectors - A Laboratory Manual, W.H. Freeman and Go, New York]. Для інших тирозинкіназ, що використовуються в аналізах, цитоплазматичні фрагменти, що починаються з метіоніну 806 (KDR, Genbank accession number L04947) і метіоніну 668 (EGF receptor, Genbank accession number X00588), можна клонувати і експресувати аналогічним способом. Для експресії активності тирозинкінази CFlt клітини Sf21 інфекціювали очищеним з бляшок рекомбінантним вірусом cFlt при множинності інфекції 3 і збирали через 48 годин. Зібрані клітини промивали охолодженим льодом забуференим фосфатом сольовим розчином (PBS) (10мМ фосфат натрію, рН 7,4, 138мМ хлорид натрію, 2,7мМ хлорид калію), потім знов суспендували в охолодженому льодом HNTG/PMSF (20мМ Hepes, рН 7,5, 150мМ хлорид натрію, 10%об./об. гліцерин, 1%об./об. тритон Х100, 1,5мМ хлорид магнію, 1мМ: етиленглікольбіс (b-аміноетиловий ефір)-N,N,N’,N’-тетраоцтова кислота (EGTA), 1мМ PMSF (фенілметилсульфонілфторид); PMSF додають безпосередньо перед використанням з свіжовиготовленого 100мМ розчину в метанолі), причому використовують 1мл HNTG/PMSF на 10 мільйонів клітин. Суспензію центрифугували протягом 10 хвилин при 13000об./хв. при 4°С, супернатант (початковий розчин ферменту) видаляли і зберігали в аліквотах при -70°С. Кожну нову серію вихідного розчину ферменту титр ували в аналізі розбавленням розріджувачем ферменту (100мМ Hepes, рН 7,4, 0,2мМ ортованадат натрію, 0,1%об./об. тритон X100, 0, мМ дитіотреїт). Для типової серії вихідний розчинферменту розбавляли 1 до 2000 розріджувачем ферменту і 50мкл розбавленого ферменту використали для кожної ямки аналізу. Вихідний розчин субстрату одержували з статистичного співполімеру, що містить тирозин, наприклад, полі(GIu, Ala, Туr), 6:3:1 (Sigma P3899), зберігали у вигляді вихідного розчину 1мг/мл в PBS при -20°С і розбавляли 1 до 500 PBS для покриття планшету. За день до аналізу 100мкл розбавленого розчину субстрату розподіляли на всіх ямках аналітичних планшетів (Nunc maxisorb 96-well immunoplates), які герметизували і залишали на ніч при 4°С. У день аналізу розчин субстрату вивантажували і ямки аналітичного планшета промивали один раз PBST (PBS, що містить 0,05%об./об. твіну 20) і один раз 50мМ Hepes з рН 7,4. Випробувані сполуки розбавляли 10% диметилсульфоксидом (ДМСО) і 25мкл розбавленої сполуки переносили в ямки промитих аналітичних планшетів. «Загальна» контрольна ямка містила 10% ДМСО замість сполуки. Двадцять п'ять мікролітрів 40мМ хлориду марганцю(П), що містить 8мкМ аденозин-5’трифосфат (АТФ), додавали у всі ямки для випробування, за винятком «сліпих» контрольних ямок, які містили хлорид марганцю (II) без АТФ. Для початку взаємодій 50мкл свіжорозбавленого ферменту додавали в кожну ямку і планшети інкубували при кімнатній температурі протягом 20 хвилин. Рідину потім вивантажували і ямки промивали два рази PBST. Сто мікролітрів мишачих IgG-антитіл проти фосфо тирозину (Upstate Biotechnology Ink. Product 05-321), розбавлених 1 до 6000 вміщуючим PBST 0,5%мас./об., бичачим сироватковим альбуміном (BSA), додавали до кожної ямки і планшети інкубували протягом 1 години при кімнатній температурі до вивантаження рідини і промивання ямок два рази PBST. Додавали сто мікролітрів пов'язаних з пероксидазою з хріну (HRP) овечих антитіл проти мишачого Ig (Amersham product NXA 931), розбавлених 1 до 500 PBST, що містить 0,5%мас./об. BSA, і планшети інкубували протягом 1 години при кімнатній температурі до вивантаження рідини і промивання ямок два рази PBST. У кожну ямку додавали сто мікролітрів розчину 2,2’-азинобіс-(3-етилбензтіазолін-6-сульфонової кислоти) (ABST), свіжовиготовленого з використанням однієї таблетки 50мг ABTS (Boehringer 1204 521) в 50мл свіжоодержаного розчину 50мМ фосфат-цитратного буфера, рН 5,0, + 0,03% перборату натрію (одержаний з 1 капсулою фосфатцитратного буфера з перборатом натрію (PCSB) (Sigma P4922) на 100мл дистильованої води). Планшети потім інкубували протягом 20-60 хвилин при кімнатній температурі доти, поки величина оптичної щільності «загальних» контрольних ямок, виміряна при 405нм з використанням зчитуючого планшету спектрофотометру, не стала приблизно 1,0. «Сліпі» (без АТФ) і «загальні» (без сполуки) контрольні величини використали для визначення діапазону розбавлення випробуваної сполуки, який дає 50% інгібування ферментативної активності. (b) Аналіз проліферації in vitro HUVEC Даний аналіз визначає здатність випробуваної сполуки інгібувати стимульовану фактором зростання проліферацію ендотеліальних клітин умбілікальної вени людини (HUVEC). Клітини HUVEC виділяли в MCDB 131 (Gibco BRL) + 7,5%об./об. фетальній телячій сироватці (FCS) і висівали (при пересівах від 2 до 8) в MCDB 131 + 2%об./об. FCS + 3мкг/мл гепарину + 1мкг/мл гідрокортизону при концентрації 1000 клітин/ямку в 96-ямкових планшетах. Після не менш, ніж 4 днів, до них додавали дози відповідного фактора росту (наприклад, 3нг/мл VEGF, 3нг/мл EGF або 0,3нг/мл b-FGF) і сполуки. Культури потім інкубували протягом 4 днів при 37°С з 7,5% діоксиду вуглецю. На че твертий день культури піддавали короткочасному міченню 1мкКі/ямку міченого літієм тимідину (Amersham product TRA 61) і інкубували протягом 4 годин. Клітини збирали з використанням харвестера 96-ямкового планшета (Tomtek) і потім аналізували для визначення включення тритію лічильником бета-випромінювання планшетів. Включення радіоактивності в клітини, виражене як число імпульсів за хвилину, використали для вимірювання інгібування сполуками стимульованої фактором росту проліферації клітин. (c) Модель твердого пухлинного захворювання Дане випробування вимірює здатність сполук інгібувати зростання твердих пухлин. Ксенотрансплантати пухлини CaLu-6 імплантували в бічн у частин у тіла самиць мишей athymic Swiss nu/nu підшкірною ін'єкцією 1x10б клітин CaLu-6/миша в 100мкл 50% (об./об.) розчину Matrigel в культуральному середовищі, що не містить сироватку. Через десять днів після клітинної імплантації мишей розподіляли на 8-10 груп, так щоб досягнути порівнянні середні об'єми груп. Пухлини вимірювали з використанням ноніусного штангенциркуля і об'єми обчислювали так: (1 x w) x (1 x w) x (p/6), де 1 представляє найбільший діаметр і w представляє діаметр, перпендикулярний найбільшому діаметру. Випробувані сполуки вводили перорально один раз на день протягом мінімум 21 днів, а контрольні тварини одержували розріджувач сполуки. Розмір пухлин вимірювали два рази на тиждень. Рівень інгібування зростання обчислювали порівнянням середнього об'єму пухлини контрольної групи в порівнянні з групою обробки, і статистичну значущість визначали з використанням t-критерію Ст'юдента і/або критерію суми рангів Уітні. Інгібуючу дію обробкою сполукою вважали значущою, коли р
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinasoline derivatives as inhibitors of vascular endothelial growth factor (vegf)
Назва патенту російськоюПроизводные хиназолина как ингибиторы васкулярного эндотелиального фактора роста (vegf)
Автори російськоюThomas, Andrew, Peter
МПК / Мітки
МПК: A61P 17/06, C07D 401/12, A61P 27/02, A61P 9/00, A61P 9/14, A61P 19/02, A61P 9/10, A61P 43/00, A61P 35/00, A61K 31/517, A61P 29/00
Мітки: росту, vegf, інгібітори, ендотеліального, фактора, похідні, васкулярного, хіназоліну
Код посилання
<a href="https://ua.patents.su/20-72946-pokhidni-khinazolinu-yak-ingibitori-vaskulyarnogo-endotelialnogo-faktora-rostu-vegf.html" target="_blank" rel="follow" title="База патентів України">Похідні хіназоліну як інгібітори васкулярного ендотеліального фактора росту (vegf)</a>
Попередній патент: Сполука (варіанти), фармацевтична композиція, спосіб лікування (варіанти)
Наступний патент: Грейфер для лісоматеріалів
Випадковий патент: Застосування алюмінію азотнокислого як підсилювача дії азоту і як системного активатора морфогенетичних процесів рослин та добриво на його основі












