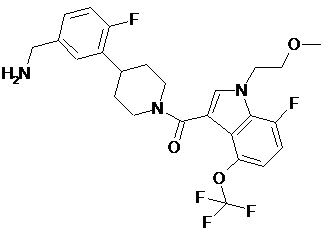
[4-(5-амінометил-2-фторфеніл)-піперидин-1-іл]-[7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1н-індол-3-іл]-метанон як інгібітор триптази тучних клітин
Номер патенту: 104148
Опубліковано: 10.01.2014
Автори: Следескі Адам В., Шей Джон Дж., мол., Полі Грегорі Бернард, Чой Накієн, Чоі-Следескі Йонг Мі, Шум Патрік Ваі-Квок
Формула / Реферат
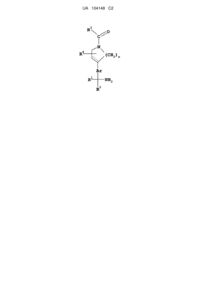
1. Сполука формули І:
 (I)
(I)
або її проліки, фармацевтично прийнятна сіль або сольват.
2. Сполука за п. 1 у вигляді фармацевтично прийнятної солі, вибраної з: гідрохлориду, фумарату, безилату, тозилату, сульфату, цитрату, метансульфонату, тартрату, фосфату, глютамату і бензоату.
3. Сполука за п. 2, де сіль являє собою бензоат.
4. Кристалічна форма А сполуки за п. 3.
5. Кристалічна форма за п. 4, яка відрізняється тим, що дана кристалічна форма має піки XRPD при щонайменше двох кутах з наступних кутів 2θ: 7,75, 10,13, 17,03, 17,16, 18,39, 21,33 і 21,88.
6. Кристалічна форма за п. 5, яка відрізняється тим, що дана кристалічна форма має піки XRPD при щонайменше трьох кутах з наступних кутів 2θ: 7,75, 10,13, 17,03, 17,16, 18,39, 21,33 і 21,88.
7. Кристалічна форма за п. 6, яка відрізняється тим, що дана кристалічна форма має піки XRPD при щонайменше чотирьох кутах з наступних кутів 2θ: 7,75, 10,13, 17,03, 17,16, 18,39, 21,33 і 21,88.
8. Кристалічна форма за п. 7, яка відрізняється тим, що дана кристалічна форма має піки XRPD при щонайменше п'яти кутах з наступних кутів 2θ: 7,75, 10,13, 17,03, 17,16, 18,39, 21,33 і 21,88.
9. Кристалічна форма сполуки за п. 3, яка відрізняється тим, що дана кристалічна форма плавиться при 162 градусах Цельсія.
10. Застосування сполуки за п. 1 для лікування пацієнта, що потребує поліпшення, який страждає на фізіологічний стан або підданий такому стану, шляхом інгібування триптази.
11. Спосіб лікування пацієнта, що потребує поліпшення, який страждає на фізіологічний стан або підданий такому стану, шляхом інгібування триптази, що включає в себе уведення пацієнту терапевтично ефективної кількості сполуки, заявленої в п. 1.
12. Спосіб за п. 11, у якому фізіологічний стан вибраний із групи, що складається з запального захворювання, хвороби, що виражається в руйнуванні суглобного хряща, очного кон'юнктивіту, весняного кон’юнктивіту, запальної хвороби кишечнику, астми, алергійного риніту, інтерстиціальної хвороби легенів, фіброзу, хронічної обструктивної хвороби легенів (ХОХЛ), склеродерми, легеневого фіброзу, цирозу печінки, фіброзу міокарда, нейрофіброми, гіпертрофічних рубців або шрамів, дерматологічного стану, стану, пов'язаного з руйнуванням атеросклеротичних бляшок, періодонтальної хвороби, діабетичної ретинопатії, росту пухлини, анафілаксії, розсіяного склерозу, виразки шлунка і синцитіальної вірусної інфекції.
13. Спосіб за п. 12, у якому фізіологічним станом є ХОХЛ.
14. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за п. 1 і фармацевтично прийнятний носій для неї.
15. Фармацевтична композиція за п. 14, яка додатково містить терапевтично ефективну кількість другої сполуки, вибраної з групи, що включає бета-адренегрічний агоніст, антихолінергік, протизапальний кортикостероїд, антагоніст рецептора лейкотриєну, інгібітор ліпоксигенази, інгібітор фосфодіестерази-4 і протизапальний засіб.
16. Фармацевтична композиція за п. 15, де інгібітор фосфодіестерази-4 вибирають з рофлуміласту і цифлумоласту.
17. Сполука, вибрана з групи сполук, які мають формулу:
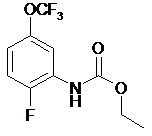 ,
, 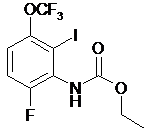 ,
, 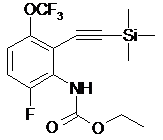 ,
, 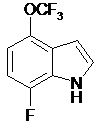 ,
, 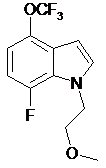 ,
, 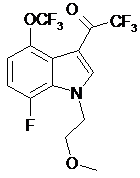 і
і 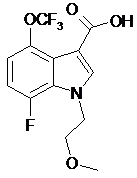 .
.
18. Сполука, яка має формулу:
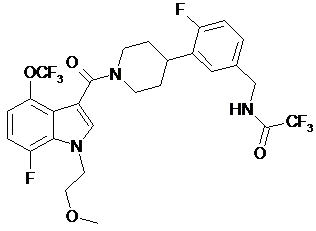 .
.
19. Спосіб одержання гідрохлориду 2,2,2-трифтор-N-(4-фтор-3-піридин-4-ілбензил)-ацетаміду, заявленого в п. 2, в якому здійснюють сполучення гідрохлориду 3-бром-4-фторбензиламіну і піридин-4-боронової кислоти в умовах сполучення Сузукі з одержанням гідрохлориду 2,2,2-трифтор-N-(4-фтор-3-піридин-4-ілбензил)-ацетаміду.
20. Спосіб за п. 19, у якому для умов сполучення Сузукі використовують розчинник сполучення Сузукі, вибраний зі спиртового розчинника з точкою кипіння, яка дорівнює щонайменше точці кипіння ізопропілового спирту, полярного апротонного розчинника або простого ефірного розчинника, або суміші будь-яких з названих вище розчинників з водою або толуолом.
21. Спосіб за п. 20, у якому розчинником сполучення Сузукі є спиртовий розчинник із точкою кипіння, яка дорівнює щонайменше точці кипіння ізопропілового спирту.
Текст
Реферат: Даний винахід стосується індолбензиламінової сполуки, що використовується як інгібітор триптази. Даний винахід також стосується застосування сполуки для лікування пацієнта, що знаходиться в такому фізіологічному стані або підданий такому фізіологічному стану, що має потребу в поліпшенні шляхом пригнічення триптази, і полягає у введенні пацієнту терапевтично ефективної кількості сполуки. Крім того, даний винахід стосується лікарського препарату, що містить фармацевтично ефективну кількість сполуки з формулою І і фармацевтично прийнятний носій. UA 104148 C2 (12) UA 104148 C2 UA 104148 C2 5 10 15 20 25 30 35 40 45 50 ГАЛУЗЬ ВИНАХОДУ Даний винахід присвячений заміщеній індолбензиламіновій сполуці, її одержанню, лікарському препарату, що включає таку сполуку, її застосуванню, а також її проміжним сполукам. РІВЕНЬ ТЕХНІКИ Опосередковані тучними клітинами запальні захворювання, зокрема астма, стають усе більш насущною проблемою охорони здоров'я. Астма часто характеризується прогресуючим розвитком підвищеної чутливості трахеї і бронхів як до імуноспецифічних алергенів, так і до звичайних хімічних і фізичних подразників, що приводить до розвитку хронічного запалення. Лейкоцити, що містять IgE-рецептори, а саме тучні клітини і базофіли, присутні в епітелії й у розташованих під ним тканинах гладких м'язів бронхів. Спочатку ці лейкоцити активуються за допомогою зв'язування специфічних, що попадають в організм при вдиханні антигенів з IgEрецепторами, а потім виділяють ряд хімічних медіаторів. Наприклад, дегрануляція тучних клітин приводить до виділення протеогліканів, пероксидази, арилсульфатази B, хімази і триптази, у результаті чого відбувається звужування бронхіоли. Триптаза зберігається в секреторних гранулах тучних клітин і є основною протеазою тучних клітин людини. Триптаза бере участь у різних біологічних процесах, у тому числі в розкладанні судинорозширювальних і бронхорелаксуючих нейропептидів (Caughey, et al., J. Pharmacol. Exp. Ther., 1988, 244, стор. 133-137; Franconi, et al., J. Pharmacol. Exp. Ther., 1988, 248, стор. 947-951; і Tam, et al., Am. J. Respir. Cell Mol. Biol., 1990, 3, стор. 27-32) і в модуляції бронхіальної реактивності на гістамін (Sekizawa, et al., J. Clin. Invest., 1989, 83, стор. 175-179). Таким чином, інгібітори триптази можуть використовуватися як протизапальні засоби (K Rice, P.A. Sprengler, Current Opinion in Drug Discovery and Development, 1999, 2(5), стор. 463474), зокрема при лікуванні хронічної астми (M.Q. Zhang, H. Timmerman, Mediators Inflamm., 1997, 112, стор. 311-317), а також при лікуванні і профілактиці алергійного риніту (S. J. Wilson et al, Clin. Exp. Allergy, 1998, 28, стор. 220-227), запальної хвороби кишечнику (S.C. Bischoff et al, Histopathology, 1996, 28, стор. 1-13), псоріазу (A. Naukkarinen et al, Arch. Dermatol. Res., 1993, 285, стор. 341-346), кон`юнктивіту (A.A. Irani et al, J. Allergy Clin. Immunol., 1990, 86, стор. 34-40), атопічного дерматиту (A. Jarvikallio et al, Br. J. Dermatol., 1997, 136, стор. 871-877), ревматоїдного артриту (L.C. Tetlow et al, Ann. Rheum. Dis., 1998, 54, стор. 549-555), остеоартриту (M.G. Buckley et al, J. Pathol., 1998, 186, стор. 67-74), подагричного артриту, ревматоїдного спондиліту і захворювань з руйнуванням хрящової тканини суглобів. Крім того, було показано, що триптаза є сильним мітогеном для фібробластів, що вказує на її можливу участь у пневмофіброзі при астмі і інтерстиціальних легеневих процесах (Ruoss et al., J. Clin. Invest., 1991, 88, стор. 493-499). Таким чином, інгібітори триптази можуть використовуватися при лікуванні або профілактиці фіброзних захворювань (J.A. Cairns and A.F. Walls, J. Clin. Invest., 1997, 99, стор. 1313-1321) наприклад, фіброзу, склеродермії, пневмофіброзу, цирозу печінки, міокардіального фіброзу, нейрофібром і гіпертрофічних рубців. Крім того, інгібітори триптази можуть використовуватися при лікуванні або профілактиці інфаркту міокарда, інсульту, стенокардії й інших наслідків розриву атеросклеротичних бляшок (M. Jeziorska et al, J. Pathol., 1997, 182, стор. 115-122). Також було виявлено, що триптаза активує простромелізин, що, у свою чергу, активує коллагеназу, таким чином, ініціюючи руйнування хрящової і періодонтальної сполучної тканини, відповідно. Таким чином, інгібітори триптази можуть використовуватися при лікуванні або профілактиці артриту, періодонтальних захворювань, діабетичної ретинопатії і росту пухлин (W.J. Beil et al, Exp. Hematol., (1998) 26, стор. 158-169). Крім того, інгібітори триптази можуть використовуватися при лікуванні анафілаксії (L.B. Schwarz et al, J. Clin. Invest., 1995, 96, стор. 2702-2710), розсіяного склерозу (M. Steinhoff et al, Nat. Med. (N. Y.), 2000, 6(2), стор. 151-158), виразки шлунку і вірусних захворювань синцитію. Про заміщені арилметиламіни, представлені сполукою з формулою (A), їх одержанні, 1 UA 104148 C2 (A), 5 10 15 лікарські препарати, що містять ці сполуки, і їх фармацевтичні застосування при лікуванні патологічних станів, що піддаються модулюванню шляхом придушення триптази, повідомляється в патенті США № 6977263. У патенті США № 6977263, зокрема, розкриті сполуки з наступними формулами: У патенті США № 6977263 при цьому не розкриваються жодні зі згаданих вище похідних [(амінометилфеніл)-піперидин-1-іл]-[індоліл]-метанону, у яких пара-положення стосовно амінометильної групи фенільної функціональної групи також заміщене фторвмісною групою. Крім того, у патенті США № 6977263 розкривається тільки одне похідне [(амінометилфеніл)піперидин-1-іл]-[індоліл]-метанону, у якому заміщений ароматичний вуглець у його індольній групі, що не зв'язаний з карбонілом; точніше, метокси-замісник є тільки в 5-положенні індолу. У Bioorg. Med. Chem. Lett. 15, 2734 (2005) розкриті три типи [(амінометилфеніл)-піперидин-1іл]-[1Н-індол-3-іл]-метанону як інгібітори триптази. Один тип інгібіторів стосується сполуки з формулою B, у якій жоден з ароматичних вуглеців у її індольній групі, 2 UA 104148 C2 (B) 5 крім зв'язаного з карбонілом вуглецю, не заміщується, тоді як індольний азот має як 1 замісник R водень, метил, етил, ізопропіл, пропіл, ізобутил, бутил, гексил, 2-метоксіетил, циклогексилметил, циклопропілметил, 3-піридил, 2-тіазол, ацетил, тіофен-2-карбоніл, бензолсульфоніл або метансульфоніл. Інший тип інгібіторів стосується сполуки з формулою C, у якій індольний азот має як замісник тільки водень і один ароматичний (C) 10 вуглець у її індольній групі, крім зв'язаного з карбонілом вуглецю, що має у вигляді замісника R метил у 4-, 5-, 6- або 7-положенні або фтор у 7-положенні. Третій тип інгібіторів стосується сполуки з формулою D, у якій один ароматичний вуглець у її індольній групі, (D) 15 20 25 30 крім зв'язаного з карбонілом вуглецю, має як замісник метил у 7-положенні, і індольний азот 1 має як замісник R метил, етил, пропіл, бутил або 2-метоксіетил. Bioorg. Med. Chem. Lett. 15, 2734 (2005) також розкриває, що заміщення ароматичного вуглецю в індольній групі в 5- або 7положенні було можливе, у той час як заміщення в 4- або 6-положенні дало менш активні сполуки. У патенті США № 6977263 або в Bioorg. Med. Chem. Lett. 15, 2734 (2005) не розкривається інформація про індолвмісні інгібітори триптази, у яких: (1) пара-положення стосовно амінометильної групи його фенільної функціональної групи також заміщене фтовмісною групою; (2) азот індолу заміщений 2-метоксіетилом; або (3) заміщені два або більше ароматичних вуглеці в його індольній групі, крім зв'язаного з карбонільною групою вуглецю, і вони мають цінні фармацевтичні властивості як інгібітор триптази. Така сполука повинна з легкістю знайти застосування в лікуванні пацієнта, що страждає на захворювання, яке можна полегшити введенням інгібітору триптази, наприклад, запальними захворюваннями, опосередкованими тучними клітинами, запаленням і захворюванням або розладом, зв'язаним з деградацією 3 UA 104148 C2 судинорозширювальних і бронхорелаксуючих нейропептидів, а також мати знижену схильність до метаболізму семікарбазид-чутливої аміноксидази (САО). КОРОТКИЙ ОПИС ВИНАХОДУ Даний винахід стосується сполуки з формулою I: 5 (I) 10 15 20 25 або проліків, фармацевтично прийнятної солі або сольвату названої сполуки. Крім того, даний винахід стосується лікарського препарату, що містить фармацевтично ефективну кількість сполуки з формулою 1 і фармацевтично прийнятний носій. Даний винахід також стосується застосування сполуки з формулою 1 як інгібітору триптази і полягає у введенні сполуки в препарат, що містить рецептор інгібітору триптази. Даний винахід також стосується застосування сполуки з формулою I для лікування пацієнта, що знаходиться в такому фізіологічному стані або підданого такому фізіологічному стану, що має потребу в поліпшенні за допомогою інгібітору триптази і полягає у введенні пацієнту терапевтично ефективної кількості сполуки за пунктом 1. Даний винахід також стосується одержання сполуки з формулою I і використовуваних у ньому проміжних сполук. Більш повне представлення про різні аспекти, особливості і переваги даного винаходу можна одержати з нижченаведеного докладного опису, що приводиться винятково як ілюстрація і не обмежує охоплення даного винаходу. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Список скорочень Використовувані вище і по всьому тексту опису винаходу скорочення, представлені нижче, якщо не зазначене інше, мають наступні значення: n-BuOAc н-бутилацетат n-BuLi н-бутиллітій sec-BuLi втор-бутиллітій t-Bu трет-бутил t-BuOH трет-бутанол CuІ йодид міді дихлорметан, CH2Cl2 або ДХМ метиленхлорид ДМФ диметилформамід ДМСО диметилсульфоксид 1,1'dppf біс(дифенілфосфіно)фероцен диференціальна скануюча ДСК калориметрія 1-етил-3-(3ЕДКІ диметиламінопропіл) карбодіімід гідрохлориду екв. еквівалент(и) Et етил Et2O діетиловий ефір TEA триетиламін EtOH етанол EtOAc етилацетат EtOC(O)Cl етилхлорформіат 4 UA 104148 C2 ВЕРХ MgSO4 Me MeOH МС МТБЕ NaHCO3 Na2SO3 Na2SO4 ЯМР Pd(PPh3)2Cl2 PdCl2dppf Pd(dtbpf)Cl2 Pd2(dba)3 Pd(OAc)2 P(Cy)3 t-Bu3P PPh3 PrOH iPrOH i-PrOAc t-BuOK PPSE 5 10 15 високоефективна рідинна хроматографія сульфат магнію метил метанол мас-спектроскопія метил-трет-бутиловий ефір бікарбонат натрію сульфіт натрію сульфат натрію ядерний магнітний резонанс двохлористий бістрифенілфосфін паладію (II) двохлористий 1,1'біс(дифенілфосфіно)фероцен паладію (II) двохлористий (1,1’біс(ди-третбутилфосфіно)фероцен паладію трис(дибензиліденацетон)дипа ладій(0) ацетат (II) паладію трициклогексилфосфін три-трет-бутилфосфін трифенілфосфін пропанол ізопропанол ізопропілацетат трет-бутоксид калію триметилсиліловий ефір поліфосфорної кислоти карбонат калію сульфат калію рідинна хроматографія сульфат натрію кімнатна температура час утримання трифтороцтова кислота трифтороцтовий ангідрид термогравіметричний аналіз тетрагідрофуран тонкошарова хроматографія K2CO3 K2SO4 РХ Na2SO4 кімн. темп. Rt ТФО ТФОА ТГА ТГФ ТШХ ТМСацетилен триметилсилілацетилен Визначення Використовувані вище і у всьому тексті даного опису і прикладеній формулі винаходу наступні терміни мають наступні значення, якщо не зазначене інше. Використовуваний у даному документі термін "сполуки даного винаходу" і аналогічні вирази включають описану вище в даному документі сполуку з формулою I, якийсь вираз включає проліки, фармацевтично прийнятну сіль і сольват, наприклад, гідрат. Аналогічним способом посилання на проміжні сполуки, не залежно від того, або включені вони самі у формулу винаходу, поширюється на солі і сольвати, де це допускається контекстом. Для внесення ясності конкретні випадки, якщо це допускається контекстом, іноді відзначені в тексті, однак ці випадки мають винятково ілюстративний характер і не виключають інші випадки, якщо це допускається контекстом. Використовуваний у даному документі термін "лікувати" або "лікування" охоплює профілактичну терапію, а також лікування діагностованого захворювання, наприклад, поліпшення стану пацієнта. Таке поліпшення включає уповільнення розвитку хвороби або позитивна зміна стану пацієнта. "Пацієнт" означає людину або іншого ссавця. 5 UA 104148 C2 5 10 15 20 25 30 35 40 45 50 55 "Ефективна кількість" означає кількість сполуки, що здатна дати бажаний терапевтичний ефект. "Проліки" означає сполуку, яка придатна для введення пацієнту без прояву надмірної токсичності, роздратування, алергійної реакції і тому подібного і яка перетвориться in vivo метаболічними засобами (наприклад, гідролізом) у сполуку даного винаходу. Докладні зведення про проліки представлені в роботах T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems, Vol. 14 °F the A. C. S. Symposium Series, і Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, що включені в даний документ за допомогою посилання. "Фармацевтично прийнятна сіль" означає будь-яку сіль цих активних інгредієнтів з кислотою, при якій не виникають небажані токсичні або побічні ефекти. Ці кислоти добре відомі фахівцям фармацевтам. До прикладів придатних солей належать наступні: хлорид; бромід; йодид; аспартат, зокрема, кислий аспартат; бензоат, зокрема, кислий бензоат; цитрат, зокрема, кислий цитрат; тартрат; фосфат, зокрема, кислий фосфат; фумарат, зокрема, кислий фумарат; гліцерофосфат; глюкозофосфат; лактат; малеат, зокрема, кислий малеат; оротат; оксалат, зокрема, кислий оксалат; сульфат, зокрема, кислий сульфат; трихлорацетат; трифторацетат; бесилат; тозилат і метансульфонат. Перелік затверджених агентством FDA США фармацевтично прийнятних солей наведений у Philip L. Gould, "Salt Selection for Basic Drugs" 33 Іnt'l J. Pharm. 201, 202, 214-216 (1986); з додатковою інформацією в Stephen M. Berge et al., "Pharmaceutical Salts", Journal of Pharmaceutical Sciences Vol. 66, No. 1, January 1977, стор. 1-19; і методи приготування таких солей відомі фахівцям з посібника Handbook of Pharmaceutical Salts, P. Heinrich Stahl, Camille G. Wermuth (Eds.), IUPAC Wiley-VCH, 2002; зазначені публікації включені в даний документ за допомогою посилання. "Сольват" означає сполуку, що складає предмет даного винаходу, фізично зв'язану з однією або декількома молекулами розчинника. До фізичного зв'язування належить, зокрема, утворення водневого зв'язку. У визначених випадках сольват може бути виділений, наприклад, коли одна або більше молекул розчинника включені в кристалічну решітку твердої кристалічної речовини. Термін "сольват" поширюється як на фазу розчину, так і на виділювані сольвати. Характерними прикладами сольватів є гідрати, етанолати, метанолати і їм подібні. "Умови реакції сполучення Судзукі" означає умови з використанням розчинника для сполучення Судзукі, каталізатора для сполучення Судзукі і температури для реакції сполучення Судзукі. "Розчинник для сполучення Судзукі" означає спиртовий розчинник з температурою кипіння ізопропілового спирту, наприклад, н-пропіловий спирт, н-бутиловий спирт і ін.; полярний апротонний розчинник, наприклад, диметилформамід, 1-метил-2-піролідон, диметилсульфоксид і ін.; ефірний розчинник, наприклад, ТГФ, 2-метил-ТГФ, диметоксіетан і ін.; або суміш кожного з перерахованих вище розчинників і води або толуолу. "Каталізатор для сполучення Судзукі" означає Pd-каталізатор, наприклад, Pd(PPh3)4, Pd(PPh3)2Cl2, Pd2(dba)3, Pd(dtbpf)Cl2 і ін.; або Pd-каталізатор, наприклад, Pd(OAc)2, Pd2(dba)3 і ін., у присутності фосфінового ліганду, наприклад, PPh 3, dppf, t-Bu3P, P(Cy)3 і ін. "Температура для реакції сполучення Судзукі" означає температуру від приблизно 60C до температури точки кипіння реакційної суміші для сполучення Судзукі. "Умови трифторацетилування" означають умови з використанням агента трифторацетилування, розчинника трифторацетилування і температури реакції трифторацетилування. "Агент трифторацетилування" означає трифтороцтовий ангідрид, 1,1,1-трихлор-3,3,3трифторацетон, трифтороцтову кислоту і триметилсиліловий ефір поліфосфорної кислоти (ТЕПК), трифторацетилхлорид, трифторацетилфторид, пентафторфенілтрифторацетат і ін. "Розчинник трифторацетилування" означає розчинник, наприклад, ефірний розчинник, такий як етилацетат, ізопропілацетат, н-бутилацетат і ін.; ароматичний вуглеводневий розчинник, такий як толуол і ін.; хлорований вуглеводневий розчинник, такий як хлористий метилен, 1,2дихлоретан і ін. "Температура реакції трифторацетилування" означає інтервал температур від приблизно 20 °C до приблизно 30 °C. "Умови гідрування" означають умови з використанням каталізатора гідрування, розчинника гідрування, температури реакції гідрування і тиску гідрування. "Розчинник гідрування" означає спиртовий розчинник, наприклад, метанол, етанол, ізопропіловий спирт і ін.; або оцтову кислоту; або суміш спиртового розчинника або оцтової кислоти і води. 6 UA 104148 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Каталізатор гідрування" означає PtО2, Pd/C, Pd(OH)2, Rh/C і ін., з додаванням або без додавання неорганічної кислоти, наприклад, HCl і ін., або органічної кислоти, наприклад, оцтової кислоти й ін. "Температура реакції гідрування" означає інтервал температур від приблизно 10 °C до приблизно 60 °C. "Тиск гідрування" означає інтервал тисків від приблизно 10 до приблизно 1000 фунт/кв. дюйм (верхня межа визначається можливостями обладнання). Конкретні або переважні здійснення Даний винахід також стосується застосування сполуки з формулою I для лікування пацієнта, що знаходиться в такому фізіологічному стані, що може бути поліпшене шляхом уведення пацієнту терапевтично ефективної кількості сполуки з формулою I. Конкретні здійснення фізіологічних станів, які можна лікувати за допомогою сполуки даного винаходу включають, зрозуміло, не обмежуючи ними, запальні захворювання, наприклад, запалення суглобів, артрит, ревматоїдний артрит, ревматоїдний спондиліт, подагричний артрит, травматичний артрит, краснушний артрит, псоріатичний артрит і інші хронічні запальні захворювання суглобів, астму та інші запальні респіраторні захворювання. Інші здійснення фізіологічних станів, які можна лікувати за допомогою даного винаходу включають такі фізіологічні стани, як хронічне обструктивне захворювання легенів (ХОЗЛ), загострення ХОЗЛ, руйнування хрящової тканини, кон`юнктивіт, весняний кон`юнктивіт, запальна хвороба кишечнику, астма, алергійний риніт, інтерстиціальні захворювання легенів, фіброз, склеродермія, пневмофіброз, цироз печінки, фіброз міокарда, нейрофіброми, гіпертрофічні фляки, різні дерматологічні захворювання, наприклад, атопічний дерматит і псоріаз, інфаркт міокарда, інсульт, стенокардія й інші наслідки розриву атеросклеротичних бляшок, а також періодонтальне захворювання, діабетична ретинопатія, ріст пухлини, анафілаксія, розсіяний склероз, виразкова хвороба і вірусні захворювання синцитію. У конкретному здійсненні даний винахід стосується застосування сполуки з формулою I для лікування пацієнта, що страждає на астму й інші запальні респіраторні захворювання, шляхом уведення пацієнту фізіологічно ефективної кількості сполуки. В іншім конкретному здійсненні даний винахід стосується застосування сполуки з формулою I для лікування пацієнта, що страждає на ХОЗЛ, шляхом уведення пацієнту фізіологічно ефективної кількості сполуки. В іншім конкретному здійсненні даний винахід стосується застосування сполуки з формулою I для лікування пацієнта, що страждає на загострення ХОЗЛ, шляхом уведення пацієнту фізіологічно ефективної кількості сполуки. В іншім конкретному здійсненні даний винахід стосується застосування сполуки з формулою I для лікування пацієнта, що страждає на алергійний риніт, шляхом уведення пацієнту фізіологічно ефективної кількості сполуки. В іншім конкретному здійсненні даний винахід стосується застосування сполуки з формулою I для лікування пацієнта, що страждає на запалення суглобів, шляхом уведення пацієнту фізіологічно ефективної кількості сполуки. В іншім конкретному здійсненні даний винахід стосується застосування сполуки з формулою I для лікування пацієнта, що страждає на запальну хворобу кишечнику, шляхом уведення пацієнту фізіологічно ефективної кількості сполуки. Крім того, даний винахід поширюється на лікарський препарат, що містить сполуку з формулою I, другу сполука, вибирану з групи, що включає бета-адренергічний агоніст, антихолінергік, протизапальний кортикостероїд, а також протизапальний засіб і його фармацевтично прийнятний носій. У такому препараті сполука з формулою I і друга сполука присутні в таких кількостях, що забезпечують терапевтично ефективну дія, тобто, адитивний або синергічний ефект. До конкретних запальних захворювань або порушень, що можуть лікуватися таким лікарським препаратом належить, серед іншого, астма. Даний винахід також стосується способу лікування пацієнта, що страждає на запальний розлад, шляхом уведення пацієнту сполуки з формулою I і другої сполуки, вибираної з групи, що включає бета-адренегрічний агоніст, антихолінергік, протизапальний кортикостероїд і протизапальний засіб. Відповідно до даного способу, сполука з формулою I і друга сполука присутні в таких кількостях, що забезпечують терапевтично ефективну дію, тобто, адитивний або синергічний ефект. Відповідно до такого способу даного винаходу, сполука даного винаходу може бути введена пацієнту до другої сполуки, друга сполука може бути введена пацієнту до сполуки даного винаходу, або сполука даного винаходу і друга сполука можуть бути введені одночасно. Конкретні приклади адренегрічних агоністів, антихолінергічних засобів, протизапальних кортикостероїдів і протизапальних засобів, що мають застосування відповідно 7 UA 104148 C2 5 10 15 20 до зазначеного способу, описані нижче. Антихолінергічні засоби, передбачені для застосування в рамках даного винаходу, включають бромід іпратропію і тіотропій. Протизапальні кортикостероїди, передбачені для застосування в рамках даного винаходу, включають беклометазону дипропіонат, триамцінолону ацетонід, флунізолід, флутиказону пропіонат, мометазону фуроат, метилпреднізон, преднізолон і дексаметазон. Даний винахід також стосується проміжних сполук з формулами 2-9 для одержання сполуки з формулою I. Лікарські препарати Як малося на увазі вище, сполука даного винаходу має корисну фармакологічну дію і, відповідно, може бути введена в лікарський препарат і використана при лікуванні пацієнтів, що страждають на визначені медичні розлади. Таким чином, даний винахід забезпечує, відповідно до подальшого аспекту, лікарські препарати, що містять сполуку даного винаходу, і її фармацевтично прийнятний носій. Використовуваний у даному документі термін "фармацевтично прийнятний" переважно означає затверджений органом регулювання уряду, зокрема федерального уряду або уряду штату, або внесений у Фармакопею США або іншу загальноприйняту фармакопею для використання на тваринах і, особливо, на людині. Придатні фармацевтичні носії описані у виданні "Rеміngtоn's Pharmaceutical Sciences", E.W. Martin. Відповідно до даного винаходу лікарські препарати можуть готуватися по загальноприйнятих методах з використанням одного або декількох фармацевтично прийнятних ад`ювантів або наповнювачів. До ад`ювантів, серед іншого, належать розріджувачі, наповнювачі, зв`язучі, дезінтегруючі речовини, гліданти, ковзаючі речовини, поверхнево-активні 8 UA 104148 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуки, стерильні водні середовища і різні нетоксичні органічні розчинники. Препарати можуть готуватися у вигляді таблеток, капсул, пігулок, лікарських форм із тривалим вивільненням речовини, гранул, порошків, водних розчинів або суспензій, ін'єкційних розчинів, еліксирів або сиропів, і можуть містити один або декілька агентів, вибираних із групи, що включає підсолоджувачі, віддушки, барвники або стабілізатори, для того щоб одержувати фармацевтично прийнятні препарати. Вибір носія і вміст активної речовини в носії звичайно визначається відповідно до розчинності і хімічних властивостей активної сполуки, конкретним способом введення і положеннями, що повинні додержуватися у фармацевтичній практиці. Наприклад, наповнювачі, такі як лактоза, мікрокристалічна целюлоза, пептизований крохмаль, немодифікований крохмаль, окварцована мікрокристалічна целюлоза, маніт, сорбіт, ксиліт, декстрати, фруктоза, цитрат натрію, карбонат кальцію, дикальційфосфат дигідрат, безводний дикальційфосфат, сульфат кальцію, поряд зі сполучними, такими як полівінілпіролідон, гідроксипропілметилцелюлоза, етилцелюлоза, гідроксіетилцелюлоза, метилцелюлоза, натрієва сіль карбоксиметилцелюлози, пептизований крохмаль, крохмаль, поліетиленгліколі, поліетиленоксид, полікарбофіли, желатин і камедь, а також розпушувачі, такі як кроскармелоза натрію, натрієва сіль гліколяту крохмалю, кросповідон, крохмаль, мікрокристалічна целюлоза, альгінові кислоти і деякі складні силікати в сполученні з ковзними речовинами, такими як стеарат магнію, стеарат кальцію, стеаринова кислота, гідрогенізована рослинна олія, мінеральна олія, поліетиленгліколі, ефіри гліцерину жирних кислот, лаурилсульфат натрію, і гліданти, такі як діоксид кремнію, тальк, крохмаль, а також придатний зволожуючий агент, такий як лаурилсульфат натрію, ефіри сорбіту, ефіри поліоксіетилену жирних кислот, полоксамер, ефір поліоксіетилену, докузат натрію, поліетоксилована рицинова олія і бензалконію хлорид, можуть бути використані для приготування таблеток. Для приготування капсул доцільно використовувати наповнювачі, такі як лактоза, мікрокристалічна целюлоза, пептизований крохмаль, немодифікований крохмаль, окварцована мікрокристалічна целюлоза, окремо або в суміші з двох або більше наповнювачів, зі сполучними або без них, як описано вище, поряд із придатним зволожуючим агентом (агентами), дезінтегруючими речовинами, глідантами, змащувальними речовинами і т. п., як зазначено вище. При використанні водних суспензій вони можуть містити емульгатори або речовини, що сприяють утворенню суспензій. Можуть також використовуватися розріджувачі, наприклад, сахароза, етанол, поліетиленгліколь, пропіленгліколь, гліцерин і хлороформ або їх суміші. Такими фармацевтично прийнятними носіями можуть також бути стерильна вода й олії, у тому числі нафтового, тваринного, рослинного або синтетичного походження, наприклад, арахісове масло, соєва олія, мінеральне масло, кунжутна олія і подібні їм олії. При внутрішньовенному введенні лікарського препарату переважним носієм є вода. Фізіологічні розчини і водні розчини декстрози і гліцерину також можуть використовуватися як рідких носіїв, особливо для ін'єкційних розчинів. До придатних фармацевтичних наповнювачів належать маніт, альбумін сироватки людини (HSA), крохмаль, глюкоза, лактоза, сахароза, желатин, солод, рис, борошно, крейда, силікагель, карбонат магнію, стеарат магнію, стеарат натрію, гліцеринмоностеарат, тальк, хлорид натрію, сухе зняте молоко, гліцерин, пропілен, гліколь, вода, етанол і подібні їм речовини. Такі препарати можуть мати форму розчинів, суспензій, таблеток, пігулок, капсул, порошків, лікарських форм із тривалим вивільненням речовини і їм подібних. Зрозуміло, лікарський препарат даного винаходу буде містити терапевтично ефективну кількість активної сполуки поряд з відповідною кількістю носія, для того, щоб забезпечити форму для належного введення пацієнту. Хоча внутрішньовенна ін'єкція є дуже ефективною формою введення, можуть бути використані й інші способи, наприклад, шляхом ін'єкції або шляхом перорального, назального або парентерального введення, що обговорюються нижче. Способи лікування Сполука з формулою I забезпечує діяльність по придушенню триптази, відповідно до досліджень, описаних в літературі, а також описаних далі, причому передбачається, що результати досліджень корелюють з фармакологічною активністю в організмі людини й інших ссавців. Таким чином, у ще одному здійсненні даний винахід стосується застосування формули I або препарату, що містить її для лікування пацієнта, що знаходиться в такому стані або підданого такому стану, що може бути поліпшено введенням інгібітору триптази. Так, сполука з формулою I корисна для лікування запального захворювання, наприклад, запалення суглобів, включаючи артрит, ревматоїдний артрит та інші артритичні стани, такі як ревматоїдний спондиліт, подагричний артрит, травматичний артрит, краснушний артрит, псоріатичний артрит, остеоартрит, або інші хронічні запальні захворювання суглобів, або захворювань з руйнуванням хрящової тканини суглобів, кон`юктивіту, весняного кон`юктивіту, запальної хвороби кишечнику, астми, алергійного риніту, інтерстиціальних захворювань легенів, фіброзу, склеродермії, 9 UA 104148 C2 5 10 15 20 25 30 35 40 45 50 55 60 пневмофіброзу, цирозу печінки, фіброзу міокарда, нейрофібром, гіпертрофічних рубців, різних дерматологічних захворювань, наприклад, атопічного дерматиту і псоріазу, інфаркту міокарда, інсульту, стенокардії або інших наслідків розриву атеросклеротичних бляшок, а також періодонтального захворювання, діабетичної ретинопатії, росту пухлини, анафілаксії, розсіяного склерозу, виразкової хвороби або вірусного захворювання синцитію. Відповідно до ще одного пункту даного винаходу пропонується спосіб лікування пацієнта (людини або тварини), що знаходиться в такому стані або підданого такому стану, що може бути поліпшено введенням інгібітору триптази, наприклад, станів, описаних вище, що включає введення пацієнту ефективної кількості сполуки або препарату, що містить сполуку даного винаходу. Комбінована терапія Як було продемонстровано вище, інші фармацевтично активні агенти можуть використовуватися в сполученні зі сполукою з формулою I, у залежності від захворювання, що є предметом лікування. Наприклад, при лікуванні астми бета-адренегрічні агоністи, такі як альбутерол, тербуталін, формотерол, фенотерол або преналін можуть бути включені, так само як і антихолінергічні засобу, такі як бромід іпратропію, протизапальні кортикостероїди, такі як беклометазону дипропіонат, триамцинолону ацетонід, флунізолід, флутиказону пропіонат, мометазона фуроат, метилпреднізолон, преднізолон або предіноз; і протизапальні засоби, такі як кромоглікат натрію і недокроміл натрію. Таким чином, даний винахід поширюється на лікарський препарат, що містить сполуку з формулою I і другу сполуку, вибирану з групи, що включає бета-адренегрічний агоніст, антихолінергік, протизапальний кортикостероїд, антагоніст рецептора лейкотриєну, інгібітор ліпоксигенази, інгібітор фосфодіестерази-4, а також протизапальний засіб; і його фармацевтично прийнятний носій. Зокрема, передбачений для застосування з даним винаходом як антагоніст лейкотриєну монтелукаст. І, зокрема, передбачені для застосування з даним винаходом як інгібітори фосфодіестерази-4 рофлуміласт і цифлумоласт. Конкретні фармацевтичні носії, що мають застосування в даному лікарському препараті, описані в даному документі. Більше того, даний винахід поширюється на спосіб лікування пацієнта, що страждає на астму, що полягає у введенні пацієнту сполуки даного винаходу і другої сполуки, вибираної з групи, що включає бета-адренегрічний агоніст, антихолінергік, протизапальний кортикостероїд, антагоніст рецептора лейкотриєну, інгібітор ліпоксигенази, інгібітор фосфодіестерази-4, а також протизапальний засіб. Відповідно до такого комбінованого методу, сполука даного винаходу може бути введена пацієнту до введення другої сполуки, сполука даного винаходу може бути введена після введення другої сполуки або сполука даного винаходу і друга сполука можуть бути введені одночасно. Методи доставки Відповідно до даного винаходу сполука з формулою I або лікарський препарат, що містить сполуку, може вводитися пацієнту парентерально, черезслизово, наприклад, перорально, назально, пульмонально, ректально або черезшкірно. Пероральна доставка У даному документі пропонуються для використання пероральні тверді лікарські форми, загальний опис яких приводиться в Rеміngtоn's Pharmaceutical Sciences, 18th Ed.1990 (Mack Publishing Co. Easton PA 18042) at Chapter 89, що у силу посилання на нього включається в даний документ. До твердих лікарських форм відносяться таблетки, капсули, пігулки, пастилки або коржі, облатки або гранули. Для складання таких препаратів може використовуватися ліпосомальне або протеіноїдне інкапсулювання (як, наприклад, протеіноїдні мікросфери, представлені в патенті США № 4,925,673). Може використовуватися ліпосомальне інкапсулювання, і можуть бути одержані похідні ліпосом і різних полімерів (наприклад, патент США № 5,013,556). Опис можливих твердих лікарських форм для терапевтичного застосування приводить Marshall, K. у: Modern Pharmaceutics Edited by G.S. Banker and C.T. Rhodes Chapter 10, 1979, що у силу посилання включається в даний документ. У загальному випадку, сполука буде включати сполуку даного винаходу й інертні інгредієнти, що забезпечують захист від середовища шлунка і вивільнення біологічно активного матеріалу, тобто, сполуки даного винаходу, у кишечнику. Крім того, конкретно пропонуються пероральні лікарські форми сполуки даного винаходу. Така сполука може бути хімічно модифікованою, для того щоб пероральна доставка була більш ефективною. У загальному випадку запропонована хімічна модифікація передбачає приєднання не менше одного функціонального фрагмента до самої молекули компонента, причому такий функціональний фрагмент забезпечує (а) інгібування протеолізу; і (b) засвоєння в кровотік з шлунка або кишечнику. Крім того, бажано підвищити загальну стабільність сполуки даного 10 UA 104148 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходу і збільшити час циркуляції в організмі. До прикладів таких функціональних фрагментів належать: поліетиленгліколь, співполімери етиленгліколю і пропіленгліколю, карбоксиметилцелюлоза, декстран, полівініловий спирт, полівінілпіролідон і поліпролін. Abuchowski and Davis, 1981, "Soluble Polymer-Enzyme Adducts" у: Enzymes as Drugs, Hocenberg and Roberts, eds., Wiley-Interscience, New York, NY, pp. 367-383; Newmark, et al., 1982, J. Appl. Biochem. 4:185-189. До інших полімерів, що можуть бути використані, належать полі-1,3діоксолан і полі-1,3,6-триоксокан. Як відзначалося вище, кращим для фармацевтичного використання є функціональні фрагменти, що містять поліетиленгліколь. Для сполуки даного винаходу місцем вивільнення може бути шлунок, тонкий кишечник (дванадцятипала кишка, худа кишка або клубова кишка) або товстий кишечник. Фахівцям в галузі відомі доступні сполуки, що не будуть розчинятися в шлунку, але будуть вивільняти речовину в дванадцятипалій кишці або в іншій зоні кишечнику. Переважно вивільнення дозволить уникнути негативних впливів середовища шлунка або за допомогою захисту сполуки даного винаходу, або за рахунок вивільнення речовини поза середовищем шлунка, наприклад, у кишечнику. Щоб забезпечити абсолютну стійкість у шлунку, необхідне покриття, непроникне до рН 5,0, як мінімум. Прикладами найбільш розповсюджених інертних інгредієнтів, що використовуються як ентеральні покриття, є ацетаттримелітат целюлози (АТЦ), гідроксипропілметилцелюлози фталат (ГПМЦФ), ГПМЦФ 50, ГПМЦФ 55, полівінілацетат фталат (ПВАФ), Eudragit L30D, Aquateric, ацетатфталат целюлози (ФАЦ), Eudragit L, Eudragit S і шелак. Такі покриття можуть використовуватися у вигляді змішаних плівок. Покриття або суміш покриттів можуть також використовуватися на таблетках, що не призначені для захисту від середовища шлунку. До них можуть належати цукрові покриття або покриття, що полегшують проковтування таблетки. Капсули можуть складатися з твердої оболонки (наприклад, желатину) для доставки твердого лікарського засобу, тобто, порошку; для рідких форм може використовуватися м'яка желатинова оболонка. Матеріалом оболонки для облаток може бути густий або крохмаль інший їстівний папір. Для приготування пігулок, коржів, формованих таблеток або таблетованих порошків можуть використовуватися методики концентрації вологи. Терапевтичний засіб може входити до складу препарату у вигляді агрегатів дрібних частинок у вигляді гранул або кульок з розміром часток близько 1 мм. Сполука матеріалу для введення у вигляді капсул може також являти собою порошок, злегка пресовані вкладки або навіть таблетки. Терапевтичний засіб може бути приготований за допомогою пресування. Можуть включатися барвники й віддушки. Наприклад, може готуватися лікарська форма сполуки даного винаходу (наприклад, інкапсулюванням у ліпосомах або мікросферах), а потім вноситися в харчовий продукт, наприклад, охолоджений напій, що містить барвники й віддушки. Можна розбавляти або збільшувати обсяг терапевтичного засобу за рахунок інертного матеріалу. До таких розріджувачів можуть належати вуглеводи, особливо маніт, альфа-лактоза, безводна лактоза, целюлоза, сахароза, модифіковані декстрани і крохмаль. Деякі неорганічні солі можуть також використовуватися як наповнювачі, у тому числі трифосфат кальцію, карбонат магнію і хлорид натрію. Ряд розріджувачів, що промислово випускаються, включає Fast-Flo, Emdex, STA-Rx 1500, Emcompress і Avicel. Дезінтегруючі речовини можуть включатися до складу терапевтичного засобу у вигляді твердої лікарської форми. До матеріалів, використовуваних як дезінтегруючі засоби, серед інших, належать випуск промислово дезінтегруючого засобу на основі крохмалю, наприклад, Explotab. Можуть застосовуватися натрієва сіль гліколяту крохмалю, амберліт, натрієва сіль карбоксиметилцелюлози, ультрамілопектин, альгінат натрію, желатин, апельсинова цедра, кисла карбоксиметилцелюлоза, природна губка і бентоніт. Іншою формою дезінтегруючих речовин є нерозчинні катіонобменні смоли. Камеді в порошку можуть використовуватися як дезінтегруючі речовини і сполучні, і до них можуть належати такі порошкові камеді як агар, карайя або трагакант. Як дезінтегруючі речовини також корисно застосовувати альгінову кислоту і її натрієву сіль. Сполучні можуть використовуватися для формування терапевтичного засобу у тверду таблетку, і до таких сполучних належать матеріали з природних продуктів, наприклад, камедь, трагакант, крохмаль і желатин. Серед інших сполучних метилцелюлоза (МЦ), етилцелюлоза (ЕЦ) і карбоксиметилцелюлоза (КМЦ). Для гранулювання терапевтичного засобу можуть використовуватися полівінілпіролідон (ПВП) і гідроксипропілметилцелюлоза (ГПМЦ) у спиртових розчинах. До складу терапевтичного засобу може включатися агент, що знижує тертя, для того, щоб запобігти злипанню в процесі приготування сполуки. Змащувальні речовини можуть 11 UA 104148 C2 5 10 15 20 25 30 35 40 45 50 55 використовуватися як прошарок між терапевтичним засобом і стінкою матриці, і до них, серед інших, можуть належати стеаринова кислота, у тому числі її магнієві і кальцієві солі, політетрафторетилен (ПТФЕ), рідкий парафін, рослинні олії і воски. Можуть також застосовуватися розчинні змащувальні речовини, наприклад, лаурилсульфат натрію, лаурилсульфат магнію, поліетиленгліколь різної молекулярної ваги, Carbowax 4000 і 6000. Можуть додаватися гліданти, що поліпшують текучість ліків при готуванні сполуки і сприяють реорганізації при формуванні. До глідантів належать крохмаль, тальк, пірогенний кремнезем і гідратований алюмосилікат. Щоб сприяти розчиненню терапевтичного засобу у водному середовищі, як зволожуючий агент може додаватися поверхнево-активна речовина. До поверхнево-активних речовин можуть належати аніонні детергенти, наприклад, лаурилсульфат натрію, діоктилсульфосукцинат натрію і діоктилсульфонат натрію. Можливе застосування катіонних детергентів, що можуть включати бензалконій хлорид і бензетомій хлорид. Перелік можливих неіоногенних детергентів, що можуть входити до складу препарату як поверхнево-активні речовини, включає лауромакрогол 400, поліоксилстеарат 40, поліоксіетиленове похідне гідрогенізованої рицинової олії 10, 50 і 60, гліцерилмоностеарат, полісорбат 40, 60, 65 і 80, цукровий ефір жирних кислот, метилцелюлозу і карбоксиметилцелюлозу. Такі поверхнево-активні речовини можуть бути присутнім у складі препарату сполуки даного винаходу як у чистому вигляді, так і в суміші в різних співвідношеннях. До добавок, що у стані підсилити засвоєння сполуки даного винаходу, належать, наприклад, жирні кислоти: олеїнова кислота, лінолева кислота і ліноленова кислота. Бажаним може бути препарат для перорального застосування з регульованим вивільненням діючої речовини. Лікарський препарат може включатися в інертну матрицю, що забезпечує вивільнення або за рахунок дифузії, або за допомогою механізмів вилуговування, наприклад, камеді. До складу препарату також можуть входити повільно розпадаються матриці. Ряд ентеральних покриттів також мають уповільнений ефект вивільнення. Іншою формою регульованого вивільнення даного терапевтичного препарату є метод, оснований на терапевтичній системі Oros (Alza Corp.), тобто, препарат полягає в напівпроникну мембрану, що дозволяє воді проникати усередину і за рахунок осмотичних ефектів виштовхувати препарат через єдиний тонкий просвіт. Для приготування препарату можуть використовуватися інші покриття. До них належать різноманітні цукри, що можуть наноситися в дражирувальний казані. Терапевтичний препарат може також вводитися в таблетці з плівковим покриттям, і застосовувані для цього матеріали підрозділяються на 2 групи. До першого належать неентеричні матеріали, і вона включає метилцелюлозу, етилцелюлозу, гідроксіетилцелюлозу, метилгідроксіетилцелюлозу, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, натрієву сіль карбоксиметилцелюлози, провідон і поліетиленгліколі. Другу групу утворюють ентеричні матеріали, що звичайно представлені ефірами фталевої кислоти. Для забезпечення оптимального плівкового покриття може використовуватися суміш матеріалів. Плівкове покриття може наноситися в дражирувальному казані або в псевдозрідженому шарі, або покриттям шляхом пресування. Пульмональна доставка У даному документі також пропонується пульмональна доставка сполуки даного винаходу як у чистому вигляді, так і у формі лікарського препарату. Сполука доставляється в легені ссавців при вдиханні і через легеневий епітелій, що вистилає, переноситься в кровотік. Інші повідомлення про це включають Adjei et al., 1990, Pharmaceutical Research, 7:565- 569; Adjei et al., 1990, International Journal of Pharmaceutics, 63:135- 144 (лейпролід ацетат); Braquet et al., 1989, Journal of Cardiovascular Pharmacology, 13(suppl. 5):143- 146 (ендотелін-1); Hubbard et al., 1989, Annals of Internal Medicine, Vol. III, pp. 206- 212 (a1-антитрипсин); Smith et al., 1989, J.Clin. Invest. 84:1145-1146 (a1-протеїназа); Oswein et al., 1990, "Aerosolization of Proteins", Proceedings of Symposium on Respiratory Drug Delivery II, Keystone, Colorado, March, (рекомбінантний гормон росту людини); Debs et al., 1988, J. Immunol. 140:3482- 3488 (інтерферон-гамма і фактор некрозу пухлини альфа) і Platz et al., патент США No. 5,284,656 (гранулоцитарний колонієстимулюючий фактор). Метод і сполука для пульмональної доставки препаратів системного впливу описані в патенті США № 5,451,569, виданому 19 вересня 1995 року Wong et al. Для практичного використання в даному винаході пропонується широке коло механічних пристроїв, призначених для пульмональної доставки терапевтичних препаратів, у тому числі, серед інших, аерозольні апарати, що дозують інгалятори і порошкові інгалятори, усі вони відомі фахівцям у даній галузі. 12 UA 104148 C2 5 10 15 20 25 30 35 40 45 50 55 Деякі конкретні приклади пристроїв, що промислово випускаються, придатних для практичного застосування в даному винаході, включають аерозольний апарат Ultravent, вироблений Mallinckrodt, Inc., St. Louis, Missouri; аерозольний апарат Acorn II, що випускається Marquest Medical Products, Englewood, Colorado; дозуючий інгалятор Ventolin, що виробляється Glaxo Inc., Research Triangle Park, North Carolina; а також порошковий інгалятор Spinhaler, що випускається Fisons Corp., Bedford, Massachusetts, і багато які інші. Усі подібні пристрої вимагають використання препаратів, придатних для дозування сполуки даного винаходу. Кожен препарат, як правило, придатний для використання з визначеним типом використовуваного пристрою, і може передбачати застосування відповідного пропелента на додаток до звичайних розріджувачів, допоміжних речовин і (або) носіїв, придатних для проведення лікування. Також пропонується використовувати ліпосоми, мікрокапсули або мікросфери, комплекси включення або інші види носіїв. Хімічно модифікована сполука даного винаходу може також входити до складу різних препаратів у залежності від типу хімічної модифікації або типу використовуваного пристрою. До складу препаратів, придатних для використання в аерозольному апараті, як у струминному, так і в ультразвуковому, буде звичайно входити сполука даного винаходу, розчинена у воді з концентрацією приблизно від 0,1 до 25 мг сполуки на мл розчину. Препарат може також включати буфер і простий цукор (наприклад, для стабілізації і регулювання осмотичного тиску). Сполука для аерозольного апарата може також містити поверхнево-активну речовину для зменшення або запобігання поверхнево-стимульованої агрегації сполуки, викликаної розпиленням розчину при утворенні аерозолю. Сполуки препарату для використання в дозуючому пристрої для інгаляції будуть звичайно містити дрібно подрібнений порошок, що містить сполуку винаходу, зважену в пропеленті за допомогою поверхнево-активної речовини. Як пропелент може використовуватися будь-який традиційний матеріал, що застосовується для цих цілей, наприклад, хлорфторвуглеводень, гідрохлорфторвуглеводень, гідрофторвуглеводень або вуглеводень, у тому числі трихлорфторметан, дихлордифторметан, дихлортетрафторетанол і 1,1,1,2- тетрафторетан або їх комбінації. До придатних поверхнево-активних речовин належать сорбітан триолеат і соєвий лецитин. Олеїнова кислота може також бути придатна для використання як поверхнево-активна речовина. Препарати для дозування за допомогою порошкового пристрою для інгаляції будуть містити подрібнений порошок, що містить сполуку даного винаходу, і можуть також включати наповнювач, наприклад, лактозу, сорбіт, сахарозу або маніт у кількостях, що сприяють розпиленню порошку з пристрою, наприклад, від 50 до 90 ваг. % препарату. Сполука даного винаходу повинна переважним способом готуватися в подрібненому вигляді із середнім розміром частинок менше 10 мм (або мікрон), переважніше усього від 0,5 до 5 мм, для найбільш ефективної доставки в дистальний відділ легенів. Назальна доставка Також пропонується назальна доставка сполуки даного винаходу. Назальна доставка забезпечує влучення сполуки в кровотік безпосередньо після введення терапевтичного препарату в ніс без необхідності депонування продукту в легенях. Препарати для назальної доставки включають сполуки з декстраном або циклодекстраном. Черезшкірна доставка У даному винаході знаходить застосування множина різноманітних методів черезшкірногозастосування того або іншого препарату, наприклад, через трансдермальний пластир. Трансдермальні пластири описані, наприклад, у патентах США №№ 5,407,713, 5,352,456, 5,332,213, 5,336,168, 5,290,561, 5,254,346, 5,164,189, 5,163,899, 5,088,977, 5,087,240, 5,008,110 і 4,921,475, розкриття інформації з кожного з яких у силу посилання на них цілком включається в даний документ. Можна з легкістю зрозуміти, що черезшкірний шлях введення можна зробити більш ефективним за рахунок використання агента, що підсилює проникнення через шкіру, наприклад, агентів, описаних у патентах США №№ 5,164,189, 5,008,110 і 4,879,119, розкриття інформації з кожного з яких у силу посилання на них цілком включається в даний документ. Місцеве застосування Для місцевого застосування можуть використовуватися гелі (на водній або спиртовій основі), креми або мазі, що містять сполуки винаходу. Сполуки винаходу можуть також входити до складу гелю або матричної основи для застосування в пластирі, що будуть забезпечувати регульоване вивільнення сполуки через трансдермальний бар'єр. Ректальне введення 13 UA 104148 C2 5 10 15 20 25 30 35 40 45 Тверді сполуки для ректального уведення включають супозиторії, які приготовлені відповідно до відомих методів і місять сполуку винаходу. Дозування Відсоток активного компонента в сполуках винаходу може відрізнятися, при цьому необхідно, щоб він містив таку частинку, що забезпечувала б відповідне дозування. Очевидно, що форми, що містять кілька одиниць дози, можуть уводитися приблизно одночасно. Застосовувана доза буде визначатися лікарем, і залежить від бажаного терапевтичного ефекту, способу введення і тривалості лікування, а також стану пацієнта. Для дорослі дози звичайно складають від приблизно 0,001 до приблизно 50, переважно, від приблизно 0,001 до приблизно 5 мг/кг маси тіла при введенні за допомогою інгаляцій, від приблизно 0,01 до приблизно 100, переважно від 0,1 до 70, більш точно від 0,5 до 10 мг/кг маси тіла в день при пероральному застосуванні, і від приблизно 0,001 до приблизно 10, переважно від 0,01 до 1 мг/кг маси тіла в день при внутрішньовенному введенні. У кожному конкретному випадку дози будуть визначатися відповідно до факторів, характерних для пацієнта, що пройшов лікування, наприклад, віку, ваги, загального стану здоров'я й інших особливостей, що можуть впливати на ефективність лікарського препарату. Крім того, відповідно до винаходу сполука може вводитися так часто, як це необхідно для досягнення бажаного терапевтичного ефекту. Деякі пацієнти можуть виявляти швидку відповідну реакцію на більш високу або більш низьку дозу, і для них можуть виявитися достатніми набагато більш слабкі дози. Для інших пацієнтів можуть знадобитися довгострокові курси лікування з частотою від 1 до 4 доз у день, відповідно до фізіологічних потреб кожного конкретного пацієнта. У цілому діюча речовина може застосовуватися перорально від 1 до 4 разів у день. Зрозуміло, для деяких пацієнтів буде потрібно установити не більше однієї або двох доз у день. Природно, пацієнт, для якого введення сполуки даного винаходу виявляється ефективною терапевтичною схемою, переважно, є людиною, але може бути і будь-якою твариною. Таким чином, як може з легкістю зрозуміти будь-який фахівець у даній галузі, способи і лікарські препарати даного винаходу особливо підходять для введення будь-якій тварині, зокрема ссавцю, і в тому числі, без будь-яких обмежень, домашній тварині, наприклад, що належить до сімейства котячих або псових, сільськогосподарських тварин, наприклад, серед інших, корів, коней, кіз, овець і свиней, диких тварин (в умовах дикої природи або в зоологічному саду), піддослідних тварин, наприклад, мишей, щурів, кроликів, кіз, вівці, свиней, собак, кішці і ін., птахів, наприклад, курей, індичок, співочих птахів, тобто, для застосування у ветеринарній медицині. Докладна інформація про приготування Сполука з формулою I може бути одержана за допомогою застосування або адаптації відомих методів, під якими маються на увазі методи, що використовувалися колись або описані в літературі, наприклад, викладені в роботі R.C. Larock in Comprehensive Organic Transformations, VCH publishers, 1989, або як це описано в даному документі. В описаних нижче реакціях може виникати необхідність захистити реакційні функціональні групи, наприклад, аміногрупи, щоб уникнути їх небажаної участі в реакціях. Можуть використовуватися традиційні захисні групи відповідно до прийнятої практики, приклади див. у T.W. Greene and P.G.M. Wuts у "Protective Groups in Organic Chemistry" John Wiley and Sons, 1991. Зокрема, сполука з формулою I може бути одержана як це показано на схемах 1-2. Наприклад, сполука даного винаходу являє собою ахіральну сполуку, одержання якої включає конвергентний синтез. Сполука винаходу, як і її сіль, бензоат, одержують, як показано на схемах нижче. 14 UA 104148 C2 5 10 15 20 25 (i) Етилхлорформіат, піридин, ТГФ, 0 °C, 100 %; (ii) a: втор-BuLi, ТГФ, -78 °C, b: I2, ТГФ, -78 °C, 52-68 %; (iii) ТМС-ацетилен, TEA, CuІ, Pd(PPh3)2Cl2, дегазований ТГФ, 60 °C, 93 %; (iv) KOH, t-BuOH, 70 °C, 91 %; (v) порошкова KOH, 2-метоксіетилбромід, ДМСО, кімн. темп., 95 %; (vi) ТФОА, ДМФ, 40 °C, 89 %; (vii) 5M NaOH, MeOH, 85 °C, 96 %; (viii) гідрохлорид 2,2,2-трифтор-N(фтор-3-піперидин-4-ілбензил)-ацтетаміду, ЕДКІ, TEA, CH2Cl2 (ДХМ), кімн. темп., 99 %; (ix) a: K2CO3, MeOH/H2O, b: 1M HCl у Et2O, 90 %. Сполуку 1 перетворюють у сполуку 2 за допомогою захисту аміногрупи агентом для захисту амінів, наприклад, етилхлорформіатом, у присутності придатної основи, наприклад, піридину, для того, щоб одержати захищену сполуку 2. Сполуку 2 перетворюють у сполуку 5 за допомогою процесу, що включає три стадії. Сполуку 2 йодують у положенні поруч з карбаміновим ефіром за допомогою реакції 2 із сильною основою, наприклад, втор-бутиллітієм, з утворенням аніона, що взаємодіє з джерелом йоду, наприклад, молекулярним йодом, щоб одержати сполуку 3. Сполуку 3 потім перетворюють в ацетиленову сполуку 4 в умовах каталізу, наприклад, під дією йодиду міді (I) і дихлориду бістрифенілфосфінпаладію (II) у присутності триметилсилілацетилену і основи, наприклад, триетиламіну. Сполуку 4 циклізують під дією сильної основи, наприклад, гідроокису калію, і при нагріванні, щоб одержати індольну сполуку 5. Сполуку 5 перетворюють у сполуку 6 за допомогою алкілування його індольного азоту алкіл галогенідом у присутності сильної основи, наприклад, гідроокису калію, у диполярному апротонному розчиннику, наприклад, диметилсульфоксиді, при кімнатній температурі, для того щоб одержати сполуку 6. Сполуку 6 перетворюють у сполуку 8 за допомогою процесу, що включає дві стадії. Спочатку, сполуку 6 перетворюють у сполуку 7 при обробці сполуки 6 трифтороцтовим ангідридом у присутності розчинника, наприклад, N, N-диметилформаміду, і при нагріванні. 15 UA 104148 C2 5 10 15 20 25 Сполуку 7 обробляють сильною основою, наприклад, гідроокисом натрію, щоб одержати сполуку 8, що несе кислотну функцію в 3-положенні. Сполуку 8 перетворюють в амід 9 по реакції кислоти 8 з 2,2,2-трифтор-N-(фтор-3-піперидин4-ілбензил)-ацетамід гідрохлоридом (сполука 14) у присутності реагенту кислої сполуки, наприклад, ЕДКІ, і органічної основи, наприклад, триетиламіну, в інертному розчиннику, наприклад, дихлорметані. Сполуку 9 перетворюють у сполуку 10 при знятті захисту N-бензилтрифторацетаміду під дією помірної основи, наприклад, карбонату калію, у суміші розчинників, наприклад, метанол/вода. Гідрохлоридна сіль може утворюватися в присутності полярного органічного розчинника, наприклад, ефіру, з утворенням сполуки 10, що являє собою гідрохлоридну сіль ([4(5-амінометил-2-фторфеніл)-піперидин-1-іл]-[7-фтор-1-(2-метоксіетил)-4-метил-1H-індол-3-іл]метанону) з формулою I. Реакції в даній схемі виглядають у такий спосіб. Стадія A: Одержання етилового ефіру (2-фтор-5-трифторметоксифеніл)-карбамінової кислоти (2) До розчину 1 (50,72 м, 0,26 моль) і піридину (27,3 мл, 0,34 моль) у ТГФ (500 мл) при 0 °C додають етилхлорформіат (32,2 мл, 0,39 моль) по краплях протягом 30 хв. Через 1 год. РХ/МС і ТШХ показують, що реакція завершена. Реакційну суміш фракціонують між Н 2О і EtOAc. Дві фази розділяють і органічну фазу промивають 1 M HCl, H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc (95/5 до 70/30) як елюент для одержання 69,23 г (99 %) продукту 2 у вигляді 1 прозорої безбарвної рідини. H ЯМР (CDCl3) δ 8,11 (ушир. с, 1H), 7,07 (дд, J=9,1, 9,3 Гц, 1H), 19 7,00-6,80 (м, 2H), 4,27 (кв., J=7,1 Гц, 2H), 1,33 (т, J=7,1 Гц, 3H); F ЯМР (CDCl3) δ -57,84 (с, 3F), 134,01 (ушир. с, 1F); МС 309 (M+CH3CN+1, 100 %), 268 (M+1). Стадія B: Одержання етилового ефіру (6-фтор-2-йод-3-трифторметоксифеніл)-карбамінової кислоти (3) 30 35 40 До розчину 2 (31,34 м, 117,2 ммоль) у ТГФ (180 мл) при -78 °C додають втор-BuLi (1,4 М в циклогексані, 200 мл, 280 ммоль) по краплях протягом 1 год. Через 20 хв розчин I 2 (44,6 г, 175,8 ммоль) у ТГФ (150 мл) додають по краплях протягом 30 хв. Дану суміш потім перемішують при 78 °C протягом 30 хв. Додають насичений NH4Cl, після чого охолодну баню видаляють. Реакційну суміш фракціонують між Н2О і EtOAc. Фази розділяють і органічну фазу промивають 10 % Na2SO3, H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Залишок суспендують у ДХМ (50 мл) і додають гептан (300 мл). Порошок білого кольору 3 (18,1 г, 39 %) з одержаної суспензії збирають вакуумним фільтруванням і сушать на 16 UA 104148 C2 5 повітрі. Фільтрат концентрують під вакуумом, і залишок суспендують у гептані (200 мл). Ще одну порцію 3 (3,8 г, 8 %) збирають вакуумним фільтруванням і сушать на повітрі. Додатковий продукт може бути одержаний шляхом очищення фільтрату за допомогою хроматографії на 1 силікагелі. H ЯМР (CDCl3) δ 7,30-17,10 (м, 2H), 6,16 (ушир. с, 1H), 4,26 (кв., J=7,1 Гц, 2H), 1,32 19 (т, J=7,1 Гц, 3H); F ЯМР (CDCl3) δ -56,90 (с, 3F), -114,35 (д, J=8,5 Гц, 1F); МС 394 (M+1, 100 %), 374, 364, 321, 267. Стадія C: Одержання етилового ефіру (6-фтор-3-трифторметокси-2триметилсиланілетинілфеніл)-карбамінової кислоти (4) 10 15 20 Суміш 3 (18,1 г, 45,9 ммоль), Et3N (12,8 мл, 91,9 ммоль), Pd(PPh)2Cl2 (1,6 г, 5 % моль), CuІ (0,7 г, 8 % моль) і ТМС-ацетилену (19,6 мл, 137,8 ммоль) у дегазованому ТГФ (180 мл) нагрівають при температурі 60 °C протягом ночі. Суміш охолоджують до кімнатної температури, а потім фракціонують між Н2О і EtOAc. Дану суміш фільтрують через циліт для видалення нерозчинного матеріалу. Дві фази фільтрату розділяють, і органічну фазу промивають H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc як елюент для одержання 15,6 г (93 %) 1 продукту 4 у вигляді твердої речовини бежевого кольору. H ЯМР (CDCl3) δ 7,15-7,00 (м, 2H), 19 6,41 (ушир. с, 1H), 4,26 (кв., J=7,1 Гц, 2H), 1,31 (т, J=7,1 Гц, 3H); 0,27 (с, 9H); F ЯМР (CDCl3) δ 57,59 (с, 3F), -118,15 (с, 1F); МС 364 (M+1, 100 %). Стадія D: Одержання 7-фтор-4-трифторметоксі-1H-індолу (5) 25 30 35 Суміш 4 (28,9 г, 79,6 ммоль) і КОН (35,7 г, 636,7 ммоль) у дегазованій трет-BuOH (300 мл) нагрівають при температурі 70 °C протягом ночі. РХ/МС показує, що реакція завершена. Суміш охолоджують до кімнатної температури, а потім фракціонують між Н 2О і Et2O. Дві фази розділяють і водну фазу екстрагують Et2O (2X). Об'єднані органічні фази промивають H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc (100/0 до 60/40) як елюент для одержання 16 1 г (91 %) продукту 5 у вигляді рідини жовтого кольору. H ЯМР (CDCl3) δ 8,47 (ушир. с, 1H), 7,3519 7,20 (м, 1H), 6,95-6,80 (м, 2H), 6,68 (д, J=2,5 Гц, 1H); F ЯМР (CDCl3) δ -57,63 (с, 3F), -136,10 (д, J=8,5 Гц, 1F); МС 220 (M+1, 100 %), 200. Стадія E: Одержання 7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1H-індолу (6) 17 UA 104148 C2 5 10 Суміш 5 (16 г, 72,8 ммоль) і порошку КОН (20,4 г, 364,2 ммоль) у ДМСО (150 мл) перемішують при кімнатній температурі протягом 10 хв. Додають 2-метоксіетилбромід (10,3 мл, 109,2 ммоль). Суміш перемішують при кімнатній температурі протягом ночі. РХ/МС показує, що реакція завершена. Суміш фракціонують між H2O і Et2O. Дві фази розділяють і водну фазу екстрагують Et2O (2X). Об'єднані органічні фази промивають H 2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc (100/0 до 50/50) як елюент для одержання 19,3 г (95 %) продукту 6 у вигляді 1 рідини жовтого кольору. Н ЯМР (CDCl3) δ 7,15 (д, J=2,1 Гц, 1H), 6,90-6,75 (м, 2H), 6,56 (т, J=2,5 19 Гц, 1H), 3,72 (т, J=5,2 Гц, 2H), 3,72 (т, J=5,2 Гц, 2H), 3,31 (с, 3H); F ЯМР (CDCl3) δ -57,54 (с, 3F), -137,00 (д, J=11,3 Гц, 1F), МС 278 (M+1, 100 %). Стадія F: Одержання 2,2,2-трифтор-1-[7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1H-індол3-іл]-етанону (7) 15 20 25 До суміші 6 (19,3 г, 69,7 ммоль) у ДМФ (135 мл) додають ТФОА (26,2 мл, 188,2 ммоль). Суміш нагрівають при 40 °C протягом ночі. ТШХ показує, що реакція завершена. Суміш охолоджують до кімнатної температури, а потім фракціонують між Н2О і Et2O. Фази розділяють і органічну фазу промивають насиченим NaHCO3 (2X), H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc (100/0 до 50/50) як елюент для одержання 23,4 г (89 %) продукту 7 у вигляді 1 твердої речовини зеленуватого кольору. Н ЯМР (CDCl3) δ 8,03 (д, J=1,4 Гц, 1H), 7,20-6,95 (м, 19 2H), 4,54 (т, J=4,9 Гц, 2H), 3,76 (т, J=4,8 Гц, 2H), 3,33 (с, 3H); F ЯМР (CDCl3) δ -57,74 (с, 3F), 71,10 (с, 3F), -134,95 (д, J=11,5 Гц, 1F); МС 374 (M+1, 100 %). Стадія G: Одержання 7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1H-індол-3-карбонової кислоти (8) 18 UA 104148 C2 5 10 15 20 25 30 Суміш 7 (23,4 г, 62,6 ммоль) у MeOH (100 мл) і 5 М NaOH (100 мл) нагрівають при 80 °C протягом ночі. РХ/МС показує, що реакція завершена. Реакційну суміш охолоджують до кімнатної температури, а потім концентрують під вакуумом для видалення більшої частини MeOH. Залишок розчиняють у H2O, а потім промивають Et2O один раз. Водну фазу повільно підкисляють до рН~2 концентрованої HCl. Підкислену суспензію екстрагують Et 2O, і органічний екстракт промивають H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Залишок суспендують у ДХМ/гептані (10/90). Порошок білого кольору 8 (19,4 г, 1 96 %) із суспензії збирають вакуумним фільтруванням і сушать на повітрі. H ЯМР (CDCl3) δ 8,02 (с, 1H), 7,15-7,05 (м, 1H), 7,00-6,90 (м, 1H), 4,49 (т, J=5,0 Гц, 2H), 3,75 (т, J=4,9 Гц, 2H), 3,33 (с, 19 3H); F ЯМР (CDCl3) δ -57,74 (с, 3F), -135,65 (д, J=11,3 Гц, 1F); МС 363 (M+CH3CN+1), 322 (M+1, 100 %). Стадія H: Одержання 2,2,2-трифтор-N-(4-фтор-3-{1-[7-фтор-1-(2-метоксіетил)-4трифторметоксі-1H-індол-3-карбоніл]-піперидин-4-іл}-бензил)-ацетаміду (9) Суміш 8 (19,1 г, 59,6 ммоль), Et3N (24,8 мл, 177,9 ммоль), гідрохлорид 2,2,2-трифтор-N-(4фтор-3-піперидин-4-ілбензил) ацетаміду (11, 26,4 г, 77,5 ммоль) (14) і ЕДКІ (17,1 г, 89,3 ммоль) у CH2Cl2 перемішують при кімнатній температурі протягом ночі. ТШХ і РХ/МС показують, що реакція завершена. Суміш фракціонують між H2O і CH2Cl2. Фази розділяють і органічну фазу промивають сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc (40/60 до 0/100) як елюент для 1 одержання продукту 9 (36 г, 99 %) у вигляді білої піни. H ЯМР (CDCl3) δ 7,37 (с, 1H), 7,20-7,10 (м, 2H), 7,10-6,85 (м, 4H), 4,95 (ушир. с, 1H), 4,60-4,35 (м, 4H), 3,90 (ушир. с, 1H), 3,73 (т, J=5,0 19 Гц, 2H), 3,32 (с, 3H), 3,25-2,70 (м, 3H), 2,05-1,50(м, 4H); F ЯМР (CDCl3) δ -57,54 (с, 3F), -75,39 (с, 3F), -119,31 (с, 1F), -134,96 (д, J=11,3 Гц, 1F); МС 608 (M+1, 100 %). Стадія I: Одержання гідрохлориду [4-(5-амінометил-2-фторфеніл)-піперидин-1-іл]-[7-фтор-1(2-метоксіетил)-4-трифторметоксі-1H-індол-3-іл]-метанону (10) 19 UA 104148 C2 5 10 15 20 25 30 35 40 45 До суміші 9 (36 г, 59,3 ммоль) у MeOH (400 мл) додають водний розчин K 2CO3 (65,5 г, 474 ммоль, розчиненої в 120 мл H2O). Суміш перемішують при кімнатній температурі протягом ночі. РХ/МС показує, що реакція завершена. Реакційну суміш концентрують у вакуумі для видалення більшої частини метанолу. Залишок фракціонують між H 2O і EtOAc. Дві фази розділяють, і органічну фазу промивають H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом для одержання 27,5 г (90 %) продукту 10 у вигляді прозорої безбарвної липкої смолистої речовини. 1 H ЯМР (CDCl3) δ 7,42 (с, 1H), 7,25-7,10 (м, 2H), 7,05-6,85 (м, 3H), 4,92 (ушир. с, 1H), 4,46 (т, J=5,2 Гц, 2H), 3,86 (ушир. с, 3 H), 3,74 (т, J=5,1 Гц, 2H), 3,32 (с, 3H), 3,30-2,75 (м, 3H), 2,24 (ушир. 19 с, 2H), 2,05-1,55 (м, 4H); F ЯМР (CDCl3) δ -57,52 (с, 3F), -121,64 (с, 1F), -136,03 (д, J=11,3 Гц, 1F); МС 512 (M+1, 100 %). До розчину вищевказаного матеріалу (2,856 г, 5,59 ммоль) у Et 2O (30 мл) додають по краплях 2 N HCl/Et2O (3 мл, 6 ммоль). Випадає твердий осад, і ефірний розчин зливають. Тверду речовину промивають додатковою кількістю Et2O і потім зливають. Тверду речовину блідо-жовтого кольору, що залишилася, розчиняють у теплому MeOH (10 мл), потім додають Et2O (50 мл) до деякого помутніння розчину. Приблизно через 2 години з'являється твердий осад. Додають додаткову кількість Et2O (5-10 мл), а потім суспензію поміщають у холодильник на ніч. Білий кристалічний продукт (2,475 г, 4,52 ммоль) збирають і сушать під високим вакуумом протягом 4 годин. 1 H ЯМР (DMSO-d6) δ 8,32 (ушир. с, 2H), 7,71 (с, 1H), 7,43 (д, 1H, J=7,2 Гц), 7,36 (м, 1H), 7,267,20 (м, 1H), 7,12-7,08 (м, 2H), 4,49 (т, J=5,1 Гц, 2H), 4,00 (с, 2H), 3,71 (т, J=5,1 Гц, 2H), 3,32 (с, 19 3H), 3,21-3,07 (м, 3H), 2,99 (ушир. с, 2H), 1,80-1,62 (м, 4H); F ЯМР (DMSO-d6) δ -56,79 (с, 3F), 119,34 (с, 1F), -134,53 (д, J=9,6 Гц, 1F); МС 512 (M+1, 100 %). CHN: Теоретичні частки: C 53,06 %, H 5,16 %, N 7,42 % (розраховано як 1,0 H2O). Одержано: C 53,03 %, H 4,82 %, N 7,22, Cl 6,64 %. Бензоат [4-(5-амінометил-2-фторфеніл)піперидин-1-іл][7-фтор-1-(2-метоксіетил)-4трифторметоксі-1H-індол-3-іл]метанону (10 сіль бензоату). 20-літровий реактор зі скляною сорочкою, що вже містить розчин толуолу, приблизно містить [4-(5-амінометил-2-фторфеніл)піперидин-1-іл][7-фтор-1-(2-метоксіетил)-4трифторметоксі-1H-індол-3-іл]метанон (1320 г, 2,58 моль), перемішують і нагрівають до 61 °C. Додають бензойну кислоту (316 г, 2,58 моль) і після повного розчинення бензойної кислоти додають циклогексан (6,04 л). Реакцію нагрівають до 77 °C, після чого в неї вносять запал бензоату [4-(5-амінометил-2-фторфеніл)піперидин-1-іл][7-фтор-1-(2-метоксіетил)-4трифторметоксі-1H-індол-3-іл]метанону (0,100 г) з попередньої партії. Кристалізація здійснюється при 77 °C, і після 15 хв. реакцію рівномірно охолоджують зі швидкістю 10 °C/год. Коли температура реакції досягає 61 °C, перемішування й охолодження припиняють і реакцію охолоджують до кімнатної температури. На ранок відновлюють перемішування і продукт збирають шляхом фільтрації. Фільтрувальний корж промивають сумішшю розчинника, приготовленою з толуолу (3 л) і циклогексану (1,5 л). Після часткового вакуумного сушіння продукт поміщають у сушильну піч, де його сушать при температурі 40 °C з одержанням бензоату [4-(5-амінометил-2-фторфеніл)піперидин-1-іл][7-фтор-1-(2-метоксіетил)-4трифторметоксі-1H-індол-3-іл]метанону у вигляді безбарвної твердої речовини: 1408,8 г (86 %), т. п.=156-159 °C. Елементний аналіз: Розрахунок для C25H26F5N3O3.C7H6O2: C, 60,66; H, 5,09; N, -1 6,63. Одержано: C, 60,44; H, 5,01; N, 6,87. Інфрачервоні спектральні характеристики (см ): 1612, 1526, 1511, 1501, 1394, 1362, 1256, 1232, 1211, 1158, 1117, 999, 826. Схема 2 20 UA 104148 C2 5 10 15 20 25 30 35 3-бром-4-фторбензиламін гідрохлорид (Wychem) реагує з піридин-4-бороновою кислотою (Clariant або Boron Molecular) у спиртовому розчиннику з температурою кипіння, яка щонайменше дорівнює температурі кипіння ізопропілового спирту, наприклад, у н-пропіловому спирті, н-бутиловому спирті й ін.; полярному апротонному розчиннику, наприклад, диметилформаміді, 1-метил-2-піролідоні, диметилсульфоксиді і подібному ефірному розчиннику, наприклад, 2-метилтетрагідрофурані, диметоксіетані й ін. Сполука 12 і сполука 13 у суміші з будь-якими перерахованими вище розчинниками і водою в присутності придатного каталізатора, наприклад, дихлоридного дихлорметанового комплексу 1,1’біс(дифенілфосфіно)фероценпаладію (II) (PdCl2dppf-CH2Cl2), Pd(PPh3)4, PdCl2(PPh3)2, Pd(dtbpf)Cl2 і ін., при достатньому нагріванні від приблизно 70C до температури кипіння реакційної суміші для сполучення Судзукі утворюють піридин. Такий піридин трансформують у трифторацетамідне похідне гідрохлориду 2,2,2-трифтор-N(4-фтор-3-піридин-4-ілбензил)-ацетаміду в умовах трифторацетилування під дією придатного агента трифторацетилування, наприклад, трифтороцтового ангідриду, трифторацетилфториду, пентафторфенілтрифторацетатау й ін., у розчиннику трифторацетилування, наприклад, в ефірному розчиннику, такому як етилацетат, ізопропілацетат і ін.; ароматичному вуглеводневому розчиннику, такому як толуол і ін.; хлорованому вуглеводневому розчиннику, такому як хлористий метилен, 1,2-дихлоретан і ін., при температурі реакції трифторацетилування від приблизно -20 до приблизно 30C з наступною обробкою соляною кислотою. Гідрохлорид 2,2,2-трифтор-N-(4-фтор-3-піридин-4-ілбензил)-ацетаміду відновлюється в умовах гідрування до сполуки 14 за допомогою обробки воднем у присутності каталізатора гідрування, тобто, PtO2, Pd/C, Pd(OH)2, Rh/C і ін., з додаванням неорганічної кислоти або без неї, наприклад, HCl і ін., або органічної кислоти, такої як оцтова кислота й ін., у розчиннику реакції гідрування, наприклад, спиртовому розчиннику, такому як етанол, ізопропіловий спирт і ін.; або в оцтовій кислоті; або в суміші спиртового розчинника або оцтової кислоти і води, при температурі реакції гідрування від приблизно 10 °C до приблизно 60 °C, а також тиску гідрування від приблизно 20 до приблизно 1000 фунт/кв. дюйм. Сполука даного винаходу є основою, і така сполука придатна для застосування у вигляді вільної основи або у вигляді його фармацевтично прийнятної солі приєднання кислоти. Солі приєднання кислоти можуть бути більш зручною формою для використання, і на практиці використання сольової форми по суті означає застосування форми вільної основи. 21 UA 104148 C2 5 10 15 20 25 30 35 40 45 50 Кислоти, що можуть бути використані для приготування солей приєднання кислоти, включають, переважно, ті, що дають при комбінації їх з вільною основою, фармацевтично прийнятні солі, тобто, солі, аніони яких не токсичні для пацієнта у фармацевтичних дозах солей, і позитивний інгібуючий ефект, вироблений вільною основою не руйнується побічними ефектами, приписуваними аніонам. Незважаючи на те що фармацевтично прийнятні солі зазначеної основної сполуки є переважними, усі солі приєднаних кислот корисні як джерела форм вільної основи, навіть якщо конкретна сіль як така необхідна тільки як проміжний продукт, як, наприклад, у випадку, коли сіль утворюється тільки з метою очищення і ідентифікації або коли вона використовується як проміжна сполука в готуванні фармацевтично прийнятної солі шляхом іонообмінних процесів. Фармацевтично прийнятні солі, що відносяться до сфери даного винаходу, включають солі, одержані з мінеральних і органічних кислот, і до них відносяться гідрогалогеніди, наприклад, гідрохлорид і гідробромід, сульфати, фосфати, нітрати, сульфамати, ацетати, цитрати, лактати, тартрати, малонати, оксалати, саліцилати, пропіонати, сукцинати, фумарати, малеати, метилен-біс-бета-гідроксинафтоати, бензоати, тозилати, гентизінати, ізетіонати, ди-п-толуілтартрати, метансульфонати, етансульфонати, бензолсульфонати, п-толуолсульфонати, циклогексилсульфонати і хінати. Більш конкретним прикладом солі сполуки з формулою I є гідрохлоридна сіль. Ще однією конкретною сіллю даного винаходу є фумарат сполуки з формулою I. Переважною фармацевтично прийнятною сіллю даного винаходу є бензоат сполуки з формулою I. Солі сполуки винаходу як такі не тільки використовуються як активні сполуки, але також придатні для цілей очищення сполуки, наприклад, за рахунок використання різниці в розчинності між солями і вихідною сполукою, побічними продуктами і/або вихідним матеріалом за допомогою методик, відомих фахівцям в галузі. Відповідно до ще однієї особливості винаходу солі приєднання кислот сполуки даного винаходу можуть бути одержані при реакції вільної основи з відповідною кислотою з застосуванням або адаптацією відомих методів. Наприклад, солі приєднання кислот сполуки даного винаходу можуть бути одержані розчиненням або вільної основи в воді або водному спиртовому розчині, або інших придатних розчинниках, що містять придатну кислоту, і виділенням солі за допомогою випарювання розчину, або ж реакцією вільної основи і кислоти в органічному розчиннику, у цьому випадку сіль відокремлюється безпосередньо або може бути одержана концентруванням розчину. Солі приєднання кислот сполуки даного винаходу можна відновити із солей з застосуванням або адаптацією відомих методів. Наприклад, вихідна сполука даного винаходу може бути одержана з її солей приєднання кислот обробкою лугами, наприклад, водним розчином бікарбонату натрію або водним розчином аміаку. Вихідні матеріали і проміжні сполуки можуть бути одержані з застосуванням або адаптацією відомих методів, наприклад, методів, описаних у довідкових прикладах, або в їх очевидних хімічних еквівалентів. Даний винахід також присвячений деяким проміжним сполукам із наведеної вище схеми 1, і описані в даному документі процеси їх одержання є як такі додатковими ознаками даного винаходу. Приклади Для більш глибокого розуміння даного винаходу можна послатися на наступні переважні, але не єдині приклади, що приводяться як ілюстрація винаходу. Наступні приклади приводяться з метою більш повної ілюстрації конкретних здійснень винаходу. Разом з тим його жодним способом не слід розглядати як обмеження широкого охоплення даного винаходу. У довідковому прикладі, що наводиться нижче, розкривається спосіб одержання проміжної сполуки, використовуваної для одержання сполуки з формулою I. У спектрах ядерного магнітного резонансу (ЯМР), наведених нижче, величини хімічного зсуву виражені в м. ч. відносно тетраметилсилану. Скорочення мають наступні значення: уш=уширений, дд=дублет дублетів, с=синглет; м=мультиплет. ДОВІДКОВИЙ ПРИКЛАД 1 Стадія A: Одержання гідрохлориду 2,2,2-трифтор-N-(4-фтор-3-піридин-4-ілбензил)ацетаміду (13) 55 22 UA 104148 C2 5 10 15 20 25 30 У колбу поміщають NaHCO3 (126 г, 1,5 моль), гідрохлорид 3-бром-4-фторбензиламіну (11, 120 г, 0,5 моль) і піридин-4-боронової кислоти (13, 67,6 г, 0,55 ммоль) і iPrOH (750 мл) і воду (375 мл) при кімнатній температурі. Суспензію дегазують N 2 протягом 1 год. при 10 °C. У суміш додають комплекс із дихлорметаном дихлориду 1,1'-біс(дифенілфосфіно)фероценпаладію (II) (PdCl2dppf-CH2Cl2, 16,4 г, 20 ммоль). Реакційну суміш нагрівають до 80 °C, одночасно відганяючи деяку частину, доки внутрішня температура не досягнете 80 °C, і перемішують протягом 10 год. Після завершення реакції (аналіз ВЕРХ) суміш охолоджують до кімнатної температури, додають водний розчин 2 N HCl (750 мл) і перемішують протягом 0,5 год. Розчин промивають ДХМ (750 мл і 500 мл). У водну фазу додають 50-процентний водний розчин NaOH (100 мл), щоб скорегувати до pН >13. Після додавання n-BuOAc (2 л) в органічну фазу додають активоване вугілля (50 г). Одержану суміш фільтрують через шар целіт (50 г). Проводять азеотропний відгін. Після додавання додаткової кількості n-BuOAc (1 л) реакцію охолоджують до 5 °C. У розчин повільно додають ТФОА (157 г, 0,6 моль) при 5 °C. Після завершення реакції (аналіз ВЕРХ) реакційну суміш промивають 10 % водним розчином Na2CO3 (1 л). Розчин 5-6 N HCl у iPrOH (120 мл) вводять у неочищену органічну фазу при 10 °C. Потім додають додаткову кількість n-BuOAc (1 л) і суспензію залишають на ніч при кімнатній температурі. Одержану тверду фазу фільтрують при в 10 °C і сушать у печі при 50 °C, одержуючи 124 г (75 %) сполуки 15 у вигляді твердої речовини білого кольору: т. п.=220 °C. Розрахунок сполуки C14H10F4N2O1 HCl: C, 50,24; H, 3,31; N, 8,37. Одержано: C, 50,16; H, 3,08; N, 8,38. МС (ESI) m/z 299 (M+H). H ЯМР (300 МГц, D2O) δ 8,70 (д, J=6,9 Гц, 2 H), 8,14 (д, J=6,9 Гц, 2H), 7,56-7,20 (м, 3H), 4,51 (с, 2H). Стадія B: Одержання гідрохлориду 2,2,2-трифтор-N-(4-фтор-3-піперидин-4-ілбензил)ацетаміду (14) У колбу Парра поміщають сполуку 13 (123 г, 0,37 моль) і MeOH (740 мл) при кімнатній температурі, потім додають 5 % Pt/C (36,9 г, 30 ваг. %). Реакційну колбу поміщають в апарат гідрування Парра і наповняють H2 під тиском 50-60 фунт/кв. дюйм. Суміш струшують протягом >48 год. одночасно з наповненням H2, поки тиск не стабілізується (H2 поповнюють до 50-60 фунт/кв. дюйм кожні 2-3 години протягом дня, а ранком спостерігається тиск 10-20 фунт/кв. дюйм без подальшого поповнення H2). Коли аналіз ВЕРХ показує завершення реакції, реакційну суміш фільтрують через шар целіту. Фільтрат відганяють при 40-50 °C, одночасно додаючи nBuOAc (1,25 л). Після завершення відгону MeOH, додають додаткову кількість n-BuOAc (1 л). 23 UA 104148 C2 5 Одержану суспензію охолоджують до кімнатної температури протягом ночі. Суспензію охолоджують до 10 °C, фільтрують і сушать у печі при 50 °C, одержуючи 112 г (89 %) сполуки 14 у вигляді твердої речовини білого кольору: т. п.=134 °C. Розрахунок сполуки C14H10F4N2O-HCl: C, 1 50,24; H, 3,31; N, 8,37. Одержано: C, 50,16; H, 3,08; N, 8,38. МС (ESI) m/z 305,4 (M+H). H ЯМР (300 MHz, D2O) δ 7,16-6,98 (м, 3 H), 4,34 (с, 2H), 3,42 (д, J=12,9 Гц, 2H), 3,14-2,99 (м, 3H), 1,981,81 (м, 4H). ДОВІДКОВИЙ ПРИКЛАД 2 Стадія A: Одержання етилового ефіру (2-фтор-5-трифторметоксифеніл)-карбамінової кислоти (2) 10 15 20 До розчину 1 (50,72 г, 0,26 моль) і піридину (27,3 мл, 0,34 моль) у ТГФ (500 мл) при 0 °C додають етилхлорформіат (32,2 мл, 0,39 моль) по краплях протягом 30 хв. Через 1 год. РХ/МС і ТШХ показують, що реакція завершена. Реакційну суміш фракціонують між H 2O і EtOAc. Дві фази розділяють і органічну фазу промивають 1 M HCl, H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc (95/5 до 70/30) як елюент для одержання 69,23 г (99 %) продукту 2 у вигляді 1 прозорої безбарвної рідини. H ЯМР (CDCl3) δ 8,11 (ушир. с, 1H), 7,07 (дд, J=9,1, 9,3 Гц, 1H), 19 7,00-6,80 (м, 2H), 4,27 (кв., J=7,1 Гц, 2H), 1,33 (т, J=7,1 Гц, 3H); F ЯМР (CDCl3) δ -57,84 (с, 3F), 134,01 (ушир. с, 1F); МС 309 (M+CH3CN+1, 100 %), 268 (M+1). Стадія B: Одержання етилового ефіру (6-фтор-2-йод-3-трифторметоксифеніл)-карбамінової кислоти (3) 25 30 35 40 До розчину 2 (31,34 м, 117,2 ммоль) у ТГФ (180 мл) при -78 °C додають втор-BuLi (1,4 М в циклогексані, 200 мл, 280 ммоль) по краплях протягом 1 год. Через 20 хв розчин I 2 (44,6 г, 175,8 ммоль) у ТГФ (150 мл) додають по краплях протягом 30 хв. Дану суміш потім перемішують при 78 °C протягом 30 хв. Додають насичену NH 4Cl, після чого прохолодну баню видаляють. Реакційну суміш фракціонують між H2O і EtOAc. Фази розділяють і органічну фазу промивають 10 % Na2SO3, H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Залишок суспендують у ДХМ (50 мл) і додають гептан (300 мл). Порошок білого кольору 3 (18,1 г, 39 %) з одержаної суспензії збирають вакуумним фільтруванням і сушать на повітрі. Фільтрат концентрують під вакуумом, і залишок суспендують у гептані (200 мл). Ще одну порцію 3 (3,8 г, 8 %) збирають вакуумним фільтруванням і сушать на повітрі. Додатковий продукт може бути одержаний шляхом очищення фільтрату за допомогою хроматографії на 1 силікагелі. H ЯМР (CDCl3) δ 7,30-17,10 (м, 2H), 6,16 (ушир. с, 1H), 4,26 (кв., J=7,1 Гц, 2H), 1,32 19 (т, J=7,1 Гц, 3H); F ЯМР (CDCl3) δ -56,90 (с, 3F), -114,35 (д, J=8,5 Hz, 1F); МС 394 (M+1, 100 %), 374, 364, 321, 267. 24 UA 104148 C2 Стадія C: Одержання етилового ефіру триметилсиланілетинілфеніл)-карбамінової кислоти (4) (6-фтор-3-трифторметокси-2 5 10 15 20 25 Суміш 3 (18,1 г, 45,9 ммоль), Et3N (12,8 мл, 91,9 ммоль), Pd(PPh)2Cl2 (1,6 г, 5 % моль), CuІ (0,7 г, 8 % моль) і ТМС-ацетилену (19,6 мл, 137,8 ммоль) у дегазованому ТГФ (180 мл) нагрівають при температурі 60 °C протягом ночі. Суміш охолоджують до кімнатної температури, а потім фракціонують між Н2О і EtOAc. Дану суміш фільтрують через целіт для видалення нерозчинного матеріалу. Дві фази фільтрату розділяють і органічну фазу промивають H 2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc як елюент для одержання 15,6 г (93 %) 1 продукту 4 у вигляді твердої речовини бежевого кольору. H ЯМР (CDCl3) δ 7,15-7,00 (м, 2H), 19 6,41 (ушир. с, 1H), 4,26 (кв., J=7,1 Гц, 2H), 1,31 (т, J=7,1 Гц, 3H); 0,27 (с, 9H); F ЯМР (CDCl3) δ 57,59 (с, 3F), -118,15 (с, 1F); МС 364 (M+1, 100 %). Стадія C: Одержання 7-фтор-4-трифторметоксі-1H-індолу (5) Суміш 4 (28,9 г, 79,6 ммоль) і КОН (35,7 м, 636,7 ммоль) у дегазованій трет-BuOH (300 мл) нагрівають при температурі 70 °C протягом ночі. РХ/МС показує, що реакція завершена. Суміш охолоджують до кімнатної температури, а потім фракціонують між Н 2О і Et2O. Дві фази розділяють і водну фазу екстрагують Et2O (2X). Об'єднані органічні фази промивають H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc (100/0 до 60/40) як елюент для одержання 16 1 г (91 %) продукту 5 у вигляді рідини жовтого кольору. H ЯМР (CDCl3) δ 8,47 (ушир. с, 1H), 7,3519 7,20 (м, 1H), 6,95-6,80 (м, 2H), 6,68 (д, J=2,5 Гц, 1H); F ЯМР (CDCl3) δ -57,63 (с, 3F), -136,10 (д, J=8,5 Гц, 1F); МС 220 (M+1, 100 %), 200. Стадія E: Одержання 7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1H-індолу (6) 30 25 UA 104148 C2 5 10 Суміш 5 (16 г, 72,8 ммоль) і порошку КОН (20,4 г, 364,2 ммоль) у ДМСО (150 мл) перемішують при кімнатній температурі протягом 10 хв. Додають 2-метоксіетилбромід (10,3 мл, 109,2 ммоль). Суміш перемішують при кімнатній температурі протягом ночі. РХ/МС показує, що реакція завершена. Суміш фракціонують між H2O і Et2O. Дві фази розділяють і водну фазу екстрагують Et2O (2X). Об'єднані органічні фази промивають H 2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc (100/0 до 50/50) як елюент для одержання 19,3 г (95 %) продукту 6 у вигляді 1 рідини жовтого кольору. Н ЯМР (CDCl3) δ 7,15 (д, J=2,1 Гц, 1H), 6,90-6,75 (м, 2H), 6,56 (т, J=2,5 19 Гц, 1H), 3,72 (т, J=5,2 Гц, 2H), 3,72 (т, J=5,2 Гц, 2H), 3,31 (с, 3H); F ЯМР (CDCl3) δ -57,54 (с, 3F), -137,00 (д, J=11,3 Гц, 1F), МС 278 (M+1, 100 %). Стадія F: Одержання 2,2,2-трифтор-1-[7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1H-індол3-іл]-етанону (7) 15 20 25 До суміші 6 (19,3 г, 69,7 ммоль) у ДМФ (135 мл) додають ТФОА (26,2 мл, 188,2 ммоль). Суміш нагрівають при 40 °C протягом ночі. ТШХ показує, що реакція завершена. Суміш охолоджують до кімнатної температури, а потім фракціонують між Н 2О і Et2O. Фази розділяють і органічну фазу промивають насиченим NaHCO3 (2X), H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc (100/0 до 50/50) як елюент для одержання 23,4 г (89 %) продукту 7 у вигляді 1 твердої речовини зеленуватого кольору. Н ЯМР (CDCl3) δ 8,03 (д, J=1,4 Гц, 1H), 7,20-6,95 (м, 19 2H), 4,54 (т, J=4,9 Гц, 2H), 3,76 (т, J=4,8 Гц, 2H), 3,33 (с, 3H); F ЯМР (CDCl3) δ -57,74 (с, 3F), 71,10 (с, 3F), -134,95 (д, J=11,5 Гц, 1F); МС 374 (M+1, 100 %). Стадія G: Одержання 7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1H-індол-3-карбонової кислоти (8) 26 UA 104148 C2 5 10 15 20 25 30 Суміш 7 (23,4 г, 62,6 ммоль) у MeOH (100 мл) і 5 М NaOH (100 мл) нагрівають при 80 °C протягом ночі. РХ/МС показує, що реакція завершена. Реакційну суміш охолоджують до кімнатної температури, а потім концентрують під вакуумом для видалення більшої частини MeOH. Залишок розчиняють у H2O, а потім промивають Et2O один раз. Водну фазу повільно підкисляють до рН~2 концентрованої HCl. Підкислену суспензію екстрагують Et 2O, і органічний екстракт промивають H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Залишок суспендують у ДХМ/гептані (10/90). Порошок білого кольору 8 (19,4 г, 1 96 %) із суспензії збирають вакуумним фільтруванням і сушать на повітрі. H ЯМР (CDCl3) δ 8,02 (с, 1H), 7,15-7,05 (м, 1H), 7,00-6,90 (м, 1H), 4,49 (т, J=5,0 Гц, 2H), 3,75 (т, J=4,9 Гц, 2H), 3,33 (с, 19 3H); F ЯМР (CDCl3) δ -57,74 (с, 3F), -135,65 (д, J=11,3 Гц, 1F); МС 363 (M+CH3CN+1), 322 (M+1, 100 %). Стадія H: Одержання 2,2,2-трифтор-N-(4-фтор-3-{1-[7-фтор-1-(2-метоксі-етил)-4трифторметоксі-1H-індол-3-карбоніл]-піперидин-4-іл}-бензил)-ацетаміду (9) Суміш 8 (19,1 г, 59,6 ммоль), Et3N (24,8 мл, 177,9 ммоль), гідрохлорид 2,2,2-трифтор-N-(4фтор-3-піперидин-4-ілбензил) ацетаміду (11, 26,4 г, 77,5 ммоль) (14) і ЕДКІ (17,1 г, 89,3 ммоль) у CH2Cl2 перемішують при кімнатній температурі протягом ночі. ТШХ і РХ/МС показують, що реакція завершена. Суміш фракціонують між H2O і CH2Cl2. Фази розділяють і органічну фазу промивають сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом. Сирий матеріал очищають на силікагелі гептаном/EtOAc (40/60 до 0/100) як елюент для 1 одержання продукту 9 (36 г, 99 %) у вигляді білої піни. H ЯМР (CDCl3) δ 7,37 (с, 1H), 7,20-7,10 (м, 2H), 7,10-6,85 (м, 4H), 4,95 (ушир. с, 1H), 4,60-4,35 (м, 4H), 3,90 (ушир. с, 1 H), 3,73 (т, J=5,0 19 Гц, 2H), 3,32 (с, 3H), 3,25-2,70 (м, 3H), 2,05-1,50(м, 4H); F ЯМР (CDCl3) δ -57,54 (с, 3F), -75,39 (с, 3F), -119,31 (с, 1F), -134,96 (д, J=11,3 Гц, 1F); МС 608 (M+1, 100 %). Стадія I: Одержання гідрохлориду [4-(5-амінометил-2-фторфеніл)-піперидин-1-іл]-[7-фтор-1(2-метоксіетил)-4-трифторметоксі-1H-індол-3-іл]-метанону (10) 27 UA 104148 C2 5 10 15 20 25 30 35 40 45 До суміші 9 (36 г, 59,3 ммоль) у MeOH (400 мл) додають водний розчин K2CO3 (65,5 г, 474 ммоль, розчиненої в 120 мл H2O). Суміш перемішують при кімнатній температурі протягом ночі. РХ/МС показує, що реакція завершена. Реакційну суміш концентрують у вакуумі для видалення більшої частини метанолу. Залишок фракціонують між H 2O і EtOAc. Дві фази розділяють, і органічну фазу промивають H2O і сольовим розчином, сушать над MgSO4, фільтрують і концентрують під вакуумом для одержання 27,5 г (90 %) продукту 10 у вигляді прозорої безбарвної липкої смолистої речовини. 1 H ЯМР (CDCl3) δ 7,42 (с, 1H), 7,25-7,10 (м, 2H), 7,05-6,85 (м, 3H), 4,92 (ушир. с, 1H), 4,46 (т, J=5,2 Гц, 2H), 3,86 (ушир. с, 3 H), 3,74 (т, J=5,1 Гц, 2H), 3,32 (с, 3H), 3,30-2,75 (м, 3H), 2,24 (ушир. 19 с, 2H), 2,05-1,55 (м, 4H); F ЯМР (CDCl3) δ -57,52 (с, 3F), -121,64 (с, 1F), -136,03 (д, J=11,3 Гц, 1F); МС 512 (M+1, 100 %). До розчину вищевказаного матеріалу (2,856 г, 5,59 ммоль) у Et 2O (30 мл) додають по краплях 2 N HCl/Et2O (3 мл, 6 ммоль). Випадає твердий осад, і ефірний розчин зливають. Тверду речовину промивають додатковою кількістю Et2O і потім зливають. Тверду речовину блідо-жовтого кольору, що залишилася, розчиняють у теплому MeOH (10 мл), потім додають Et2O (50 мл) до деякого помутніння розчину. Приблизно через 2 години з'являється твердий осад. Додають додаткову кількість Et2O (5-10 мл), а потім суспензію поміщають у холодильник на ніч. Білий кристалічний продукт (2,475 г, 4,52 ммоль) збирають і сушать під високим вакуумом протягом 4 годин. 1 H ЯМР (DMSO-d6) δ 8,32 (ушир. с, 2H), 7,71 (с, 1H), 7,43 (д, 1H, J=7,2 Гц), 7,36 (м, 1H), 7,267,20 (м, 1H), 7,12-7,08 (м, 2H), 4,49 (т, J=5,1 Гц, 2H), 4,00 (с, 2H), 3,71 (т, J=5,1 Гц, 2H), 3,32 (с, 19 3H), 3,21-3,07 (м, 3H), 2,99 (ушир. с, 2H), 1,80-1,62 (м, 4H); F ЯМР (DMSO-d6) δ -56,79 (с, 3F), 119,34 (с, 1F), -134,53 (д, J=9,6 Гц, 1F); МС 512 (M+1, 100 %). CHN: Теоретичні частки: C 53,06 %, H 5,16 %, N 7,42 % (розраховано як 1,0 H2O). Одержано: C 53,03 %, H 4,82 %, N 7,22, Cl 6,64 %. ДОВІДКОВИЙ ПРИКЛАД 3 Бензоат сполуки з формулою I 20-літровий реактор у скляній сорочці, що вже містить розчин толуолу, приблизно містить [4(5-амінометил-2-фторфеніл)піперидин-1-іл][7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1Hіндол-3-іл]метанон (1320 г, 2,58 моль), перемішують і нагрівають до 61 °C. Додають бензойну кислоту (316 г, 2,58 моль) і після повного розчинення бензойної кислоти додають циклогексан (6,04 л). Реакцію нагрівають до 77 °C, після чого в неї вносять запал бензоату [4-(5-амінометил2-фторфеніл)піперидин-1-іл][7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1H-індол-3-іл]метанону (0,100 г) з попередньої партії. Кристалізація здійснюється при 77 °C, і після 15 хв. реакцію рівномірно охолоджують зі швидкістю -10 °C/год. Коли температура реакції досягає 61 °C, перемішування й охолодження припиняють і реакцію охолоджують до кімнатної температури. На ранок відновляють перемішування і продукт збирають шляхом фільтрації. Фільтрувальний корж промивають сумішшю розчинника, приготовленої з толуолу (3 л) і циклогексани (1,5 л). Після часткового вакуумного сушіння продукт поміщають у сушильну піч, де його сушать при температурі 40 °C з одержанням бензоату [4-(5-амінометил-2-фторфеніл)піперидин-1-іл][7фтор-1-(2-метоксіетил)-4-трифторметоксі-1H-індол-3-іл]метанону у вигляді безбарвної твердої речовини: 1408,8 г (86 %), т. п.=156-159 °C. ДОВІДКОВИЙ ПРИКЛАД 4 Бесилат сполуки з формулою I Бензолсульфонат [4-(5-амінометил-2-фторфеніл)піперидин-1-іл][7-фтор-1-(2-метоксіетил)-4трифторметоксі-1H-індол-3-іл]метанону. 28
ДивитисяДодаткова інформація
Назва патенту англійською[4-(5-aminomethyl-2-fluoro-phenyl)-piperidin-1-yl]-[7-fluoro-1-(2-methoxy-ethyl)-4-trifluoromethoxy-1h-indol-3-yl]-methanone as an inhibitor of mast cell tryptase
Автори англійськоюChoi-Sledeski, Yong, Mi, Choy, Nakyen, Poli, Gregory, Bernard, Shay, John, J., Jr., Shum, Patrick, Wai-Kwok, Sledeski, Adam, W.
Автори російськоюСледески Адам В.
МПК / Мітки
МПК: A61K 31/404, A61P 29/00, C07D 401/06
Мітки: тучних, триптази, 4-(5-амінометил-2-фторфеніл)-піперидин-1-іл]-[7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1н-індол-3-іл]-метанон, інгібітор, клітин
Код посилання
<a href="https://ua.patents.su/38-104148-4-5-aminometil-2-ftorfenil-piperidin-1-il-7-ftor-1-2-metoksietil-4-triftormetoksi-1n-indol-3-il-metanon-yak-ingibitor-triptazi-tuchnikh-klitin.html" target="_blank" rel="follow" title="База патентів України">[4-(5-амінометил-2-фторфеніл)-піперидин-1-іл]-[7-фтор-1-(2-метоксіетил)-4-трифторметоксі-1н-індол-3-іл]-метанон як інгібітор триптази тучних клітин</a>
Попередній патент: Похідна піролідиндикарбонової кислоти та її застосування у лікуванні проліферативних захворювань
Наступний патент: Спосіб захисту рослин від хвороб
Випадковий патент: Спосіб одержання ін'єкційного засобу на основі речовини з р-вітамінною активністю