Композиція, що містить цефтаролін фозамілу, для лікування бактеріальної інфекції
Формула / Реферат
1. Фармацевтична композиція, яка містить цефтаролін фозамілу від приблизно 200 мг до приблизно 800 мг цефтароліну фозамілу та L-аргінін у співвідношенні 1:0,66 (мас./мас.) цефтароліну фозамілу (безводного й вільної оцтової кислоти) і L-аргініну, та менш ніж приблизно 2 % L-аргінінового аддукту, як показано у формулі (І) або (II) нижче:
 , (І)
, (І)
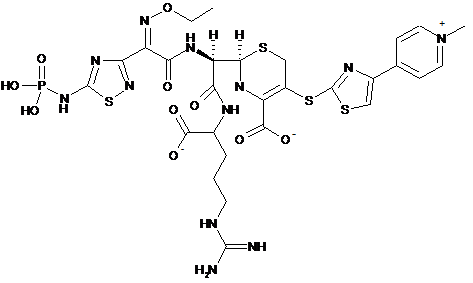 . (ІІ)
. (ІІ)
2. Композиція за п. 1, де цефтаролін фозамілу є у формі водної оцтової кислоти:
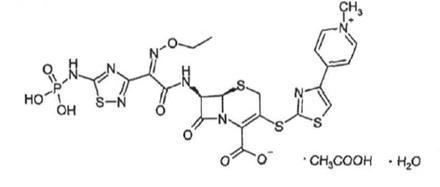 ,
,
або у формі безводного та вільної оцтової кислоти цефтароліну фозамілу.
3. Композиція за п. 1, для застосування при лікуванні бактеріальної інфекції, яку вибирають із групи, що включає ускладнену інфекцію шкіри й підшкірної клітковини й позалікарняну бактеріальну пневмонію.
4. Композиція для застосування за п. 3, де бактеріальна інфекція являє собою ускладнену інфекцію шкіри й підшкірної клітковини.
5. Композиція для застосування за п. 4, де ускладнена інфекція шкіри й підшкірної клітковини обумовлена мікроорганізмом, вибраним із групи, яка включає
Staphylococcus aureus, Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus anginosus, Slreptococcus intermedius, Streptococcus constellatus, Enterococcus faecalis, Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Morganella morganii.
6. Композиція для застосування за п. 3, де бактеріальна інфекція являє собою позалікарняну бактеріальну пневмонію.
7. Композиція для застосування за п. 6, де позалікарняна бактеріальна пневмонія обумовлена мікроорганізмом, вибраним із групи, яка включає Streptococcus pneumoniae, Staphylococcus aureus, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae і Escherichia coli.
Текст
Реферат: Винахід стосується фармацевтичної композиції, що містить цефтаролін фозамілу від приблизно 200 мг до приблизно 800 мг та L-аргінін у співвідношенні 1:0,66 (мас./мас.) цефтароліну фозамілу і L-аргініну, та менше ніж приблизно 2 % L-аргінінового аддукту, для лікування бактеріальної інфекції. UA 110098 C2 (12) UA 110098 C2 UA 110098 C2 5 10 15 У даній заявці заявляється пріоритет попередньої заявки на патент США серійний № 61/244,120, поданої 21 вересня 2009 р., і попередньої заявки на патент США серійний № 61/294,901, поданої 14 січня 2010 р., обидві ці заявки в такий спосіб включені повністю як посилання. Галузь техніки, до якої належить винахід Даний винахід стосується композицій, що містять цефтаролін або його проліки (наприклад, цефтаролін фозаміл) і способів лікування бактеріальних інфекцій, таких як ускладнені інфекції шкіри й підшкірної клітковини (cSSSI) і позалікарняна бактеріальна пневмонія (CABP) шляхом введення цефтароліну або його проліків (наприклад, цефтаролін фозамілу). Передумови створення винаходу Цефтаролін являє собою новий парентеральний цефалоспорін із широким спектром активності по відношенню до клінічно важливих позалікарняних і лікарняних грамнегативних і грампозитивних патогенів, включаючи резистентні до метициліну Staphylococcus aureus і резистентні до багатьох лікарських засобів Streptococcus pneumoniae. У патенті US № 6,417,175 описані сполуки, що мають надзвичайно хороші антибактеріальні активності по відношенню до широкого спектру грампозитивних і грамнегативних бактерій. Ці сполуки представлені загальною формулою: 1 20 25 30 35 4 де R -R , Q, X, Y і n мають значення, вказані в цьому документі. У патенті US № 6,417,175 описані способи приготування сполук, і в загальному описані препарати сполук, такі як водні й сольові розчини для ін'єкції. Однією з таких сполук є 7-[2(Z)етоксііміно-2-(5-фосфоноаміно-1,2,4-тіадіазол-3-іл)ацетамідо]-3-[4-(1-метил-4-піридиніо)-2тіазолілтіо]-3-цефем-4-карбоксилат. У патенті US № 6,906,055 описане хімічне сімейство, яке включає сполуки формули: Цефтаролін фозаміл являє собою стерильний, синтетичний, парентеральний пролікарський цефалоспорінівий антибіотик. N-фосфоноаміно водорозчинні проліки швидко перетворюються в біологічно активний цефтаролін, який, як було показано, проявляє антибактеріальну активність. Цефтаролін фозаміл відомий як (6R,7R)-7-{(2Z)-2-(етоксііміно)-2-[5-(фосфоноаміно)-1,2,4тіадіазол-3-іл]ацетамідо}-3-{[4-(1-метилпіридин-1-ій-4-іл)-1,3-тіазол-2-іл]сульфаніл}-8-оксо-5-тіа1-азабіцикло[4.2.0]окт-2-ен-2-карбоксилат. Цефтаролін фозаміл може бути представлений у формі водної оцтової кислоти. У патенті US № 7,419,973 описані композиції, що містять цефтаролін фозаміл і регулятор рН, такий як L-аргінін. 1 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 Патенти US №№ 6,417,175 і 6,906,055 і 7,419,973 включені в дану заявку як посилання, повністю. У даній галузі існує невирішена проблема розробки нових і поліпшених композицій, що містять цефтаролін або його проліки, і способів лікування бактеріальних інфекцій шляхом введення цефтароліну або його проліків. Даний винахід забезпечує композиції й способи лікування бактеріальних інфекцій з використанням цефтароліну або його проліків (наприклад, цефтаролін фозамілу). Ці композиції й методи несподівано й непередбачено ефективні для лікування бактеріальних інфекцій, таких як ускладнені інфекції шкіри й підшкірної клітковини (cSSSI) і позалікарняна бактеріальна пневмонія (CABP). Суть винаходу Відповідно до деяких варіантів здійснення, даний винахід забезпечує композиції для лікування бактеріальних інфекцій, які містять від приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків й менше, ніж 2% L-аргінінового адукту. Відповідно до деяких варіантів здійснення, даний винахід забезпечує композиції для лікування бактеріальних інфекцій, які містять від приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків, і забезпечує середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну від приблизно 50 до приблизно 80 мл/хв приблизно в 1,2 рази більше, ніж середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну більше, ніж приблизно 80 мл/хв. Відповідно до деяких варіантів здійснення, даний винахід забезпечує композиції для лікування бактеріальних інфекцій, які містять від приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків й забезпечує середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну від приблизно 30 до приблизно 50 мл/хв приблизно в 1,5 рази більше, ніж середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну більше, ніж приблизно 80 мл/хв. Відповідно до деяких варіантів здійснення, даний винахід забезпечує способи лікування бактеріальних інфекцій у пацієнтів, які цього потребують, шляхом забезпечення лікарської форми, яка містить приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків й додавання приблизно 20 мл стерильної води до лікарської форми з утворенням відновленого розчину, який має значення рН від приблизно 4,8 до приблизно 6,5 і введення відновленого розчину пацієнтам протягом періоду приблизно одна година. Відповідно до деяких варіантів здійснення, даний винахід забезпечує способи лікування бактеріальних інфекцій шляхом забезпечення лікарської форми, яка містить приблизно 400 мг цефтароліну або його проліків й введення відновленого розчину, що містить лікарську форму, протягом періоду приблизно одна година пацієнтам із кліренсом креатиніну від приблизно 10 до приблизно 50 мл/хв. Відповідно до деяких варіантів здійснення, даний винахід забезпечує способи лікування бактеріальних інфекцій у пацієнтів, які цього потребують, шляхом забезпечення лікарської форми, яка містить приблизно 600 мг цефтароліну або його проліків й введення відновленого розчину, що містить лікарську форму, протягом періоду приблизно одна година, де лікарська форма забезпечує профіль у плазмі in vivo для цефтароліну, що включає Cmax від приблизно 15 до приблизно 30 мкг/мл і AUC від приблизно 45 до приблизно 75 мкг год/мл. Відповідно до деяких варіантів здійснення, даний винахід забезпечує способи лікування бактеріальних інфекцій у пацієнтів, які цього потребують, шляхом забезпечення лікарської форми, яка містить приблизно 600 мг цефтароліну або його проліків й введення відновленого розчину, що містить лікарську форму, протягом періоду приблизно одна година й повторне введення кожні 12 годин протягом періоду від приблизно 5 до приблизно 14 днів. Відповідно до деяких варіантів здійснення, даний винахід забезпечує способи лікування бактеріальних інфекцій шляхом забезпечення лікарської форми, яка містить приблизно 400 мг цефтароліну або його проліків й введення відновленого розчину, що містить лікарську форму, протягом періоду приблизно одна година пацієнтам із кліренсом креатиніну від приблизно 10 до приблизно 50 мл/хв і повторне введення кожні 12 годин протягом періоду від приблизно 5 до приблизно 14 днів. Відповідно до деяких варіантів здійснення, даний винахід забезпечує способи лікування бактеріальних інфекцій у пацієнтів, які цього потребують, шляхом введення лікарської форми, яка містить від приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків й інформування пацієнтів про те, що композиція протипоказана пацієнтам з відомою важкою підвищеною чутливістю або пацієнтам, у яких була анафілактична реакція на бета-лактами. Докладний опис винаходу Даний винахід стосується композицій, що містять цефтаролін або його проліки, і способів 2 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 лікування бактеріальних інфекцій шляхом введення цефтароліну або його проліків. В одному аспекті, даний винахід забезпечує композиції, що містять цефтаролін або його проліки, які ефективні для лікування бактеріальних інфекцій, наприклад, ускладнені інфекції шкіри й підшкірної клітковини (cSSSI) і позалікарняна бактеріальна пневмонія (CABP). У деяких варіантах здійснення, композиції містять цефтаролін. В інших варіантах здійснення, композиції містять фосфоноцефемові проліки цефтароліну, наприклад, цефтаролін фозаміл. У типових варіантах здійснення, цефтаролін фозаміл є безводним. В інших варіантах здійснення, композиції містять цефтаролін фозаміл моногідрат сольват оцтової кислоти. У деяких варіантах здійснення, композиції можуть містити від приблизно 100 мг до приблизно 1200 мг цефтароліну або його проліків (наприклад, цефтаролін фозаміл або цефтаролін фозаміл моноацетат моногідрат). Наприклад, композиції можуть містити приблизно 100 мг, приблизно 200 мг, приблизно 300 мг, приблизно 400 мг, приблизно 500 мг, приблизно 600 мг, приблизно 800 мг, приблизно 1000 мг, або приблизно 1200 мг цефтароліну або його проліків. У деяких варіантах здійснення, композиції містять кількість цефтароліну або його проліків, яка ефективна для лікування бактеріальних інфекцій, таких як ускладнені інфекції шкіри й підшкірної клітковини (cSSSI) і позалікарняна бактеріальна пневмонія (CABP). Кількість може становити приблизно 100 мг, приблизно 200 мг, приблизно 300 мг, приблизно 400 мг, приблизно 500 мг, приблизно 600 мг, приблизно 700 мг, приблизно 800 мг, приблизно 900 мг, приблизно 1000 мг або приблизно 1200 мг. У деяких прикладах, кількість може знаходитися в інтервалі від приблизно 200 мг до приблизно 800 мг. У типових варіантах здійснення, кількість може становити приблизно 400 мг. В інших ілюстративних варіантах здійснення, кількість може становити приблизно 600 мг. Композиції додатково можуть містити один або декілька фармацевтично прийнятних носіїв. У подальших варіантах здійснення, композиції можуть містити L-аргінін. L-аргінін можна додавати як підлуговуючий агент для контролювання рН композиції, для підвищення іонної сили та/або для поліпшення розчинності цефтароліну або його проліків. Наприклад, L-аргінін можна додавати для контролю рН відновленого розчину, що містить цефтаролін або його проліки до рН в інтервалі, приблизно від 4 до 7, наприклад, до рН від приблизно 4,8 до 6,5. У деяких прикладах, значення рН може знаходитися в інтервалі від 4,5 до 6,5. Цефтаролін фозаміл має водну розчинність від приблизно 8 до 30 мг на мл, якої може бути досить для певного парентерального введення. L-аргінін може поліпшувати розчинність більше, ніж 200 мг на мл залежно від молярності розчину. Таким чином, високі дози, наприклад, приблизно 600 мг цефтаролін фозамілу можуть вводитися з невеликою кількістю ін'єкованої рідини, наприклад, приблизно 2 мл або приблизно 3 мл для внутрішньом'язового введення й використовуючи приблизно 50 мл для інфузійного розчину. Співвідношення цефтароліну або його проліків (наприклад, цефтаролін фозаміл або цефтаролін фозаміл моноацетат моногідрат) до L-аргініну може становити від приблизно 1 до приблизно 2, таке як, приблизно 1,4, приблизно 1,5, приблизно 1,6 або приблизно 1,7. Наприклад, співвідношення може становити приблизно 1,5. У типових варіантах здійснення, кількість L-аргініну, необхідне для досягнення цільового рН, у відновленому розчині, може становити приблизно 660 мг/г цефтаролін фозамілу (безводного й вільної оцтової кислоти), еквівалентне до цефтаролін фозаміл:L-аргініну (мас./мас.) співвідношенню 1,5. Наприклад, приблизно 395 мг L-аргініну може використовуватися для приблизно 600 мг цефтаролін фозамілу в безводній формі й у формі вільної оцтової кислоти. В інших прикладах, приблизно 263 мг L-аргініну може використовуватися для приблизно 400 мг цефтаролін фозамілу в безводній формі й у формі вільної оцтової кислоти. Співвідношення між цефтаролін фозаміл моногідрат сольватом оцтової кислоти й L-аргініном може знаходитися в інтервалі від приблизно 1,7 до приблизно 1,8. Аргінін може взаємодіяти із цефтаролін фозамілом і його активним метаболітом цефтароліном з утворенням аргінінового адукту. В аргініновому адукті відсутнє бета-лактамне кільце й, отже, він не має антимікробні властивості. Таким чином, ця реакція між цефтароліном і аргініном не є бажаною. Даний винахід забезпечує нові й поліпшені композиції, що містять цефтаролін або його проліки, (наприклад, цефтаролін фозаміл) і L-аргінін, які містять менше, ніж приблизно 2% аргінінового адукту. У деяких прикладах, композиції містять приблизно 100 мг до приблизно 1200 мг цефтароліну або його проліків (наприклад, цефтаролін фозамілу) і Lаргініну й менше, ніж приблизно 2% аргінінового адукту. Такі композиції ефективні для лікування бактеріальних інфекцій, наприклад, cSSSI і CABP. У деяких варіантах здійснення, композиції можуть містити аргініновий адукт формули (I): 3 UA 110098 C2 (I) В інших варіантах здійснення, композиції можуть містити аргініновий адукт формули (II): 5 10 15 (II) У деяких варіантах здійснення, композиції містять менше, ніж приблизно 2% аргінінового адукту. У типових варіантах здійснення, композиції містять від приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків, і менше, ніж приблизно 2% аргінінового адукту. В інших ілюстративних варіантах здійснення, композиції можуть містити менше, ніж приблизно 1,5% аргінінового адукту, наприклад, на рівні нижче приблизно 0,1%, приблизно 0,2 %, приблизно 0,3 %, приблизно 0,4%, приблизно 0,5%, приблизно 0,6 %, приблизно 0,7 %, приблизно 0,8%, приблизно 0,9%, приблизно 1%, приблизно 1,1%, приблизно 1,2 %, приблизно 1,3%, приблизно 1,4% або приблизно 1,5%. У типових варіантах здійснення, композиції можуть містити в інтервалі від приблизно 0,01 до приблизно 1,5 % аргінінового адукту. У деяких варіантах здійснення, композиції можуть містити менше, ніж приблизно 10% загального вмісту домішок. Домішки включають, але не обмежуючись тільки ними, технологічні домішки або продукти розкладання цефтароліну або його проліків. Деякі приклади таких домішок перераховані нижче. U1 стосується цефтароліну формули (III) з незамкнутим кільцем: 20 (III) U2 стосується цефтароліну формули (IV) пірофосфорного типу: (IV) 4 UA 110098 C2 U3 стосується цефтароліну (активному метаболіту) формули (V): (V) U4 стосується димеру цефтаролін ацетату формули (VI): 5 (VI) U5 стосується дельта цефтаролін ацетату 2-типу формули (VII): 10 (VII) U6 стосується цефтароліну формули (VIII) з незамкнутим кільцем: (VIII) U7 стосується U-1 амідного типу формули (IX): 15 (IX) U8 стосується цефтаролін ацетату дез-метильного типу формули X: (X) U9 стосується цефтаролін ацетату ацетильного типу формули XI: 20 25 (XI) У деяких варіантах здійснення, композиції містять цефтаролін або його проліки (наприклад, цефтаролін фозаміл) і приблизно від 1 до 10 % домішок. У специфічних варіантах здійснення, композиції можуть містити від приблизно 0,05 до приблизно 10 % домішок. У типових варіантах здійснення, композиції можуть містити менше, ніж приблизно 5 % 5 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 домішок. Наприклад, композиції можуть містити менше, ніж приблизно 0,6% U1; менше, ніж приблизно 0,6 % U2, менше, ніж приблизно 5 % U3, менше, ніж приблизно 0,2% U4, менше, ніж приблизно 0,2 % U5, менше, ніж приблизно 0,6% U6, менше, ніж приблизно 0,2 % U7, менше, ніж приблизно 0,2 % U8, менше, ніж приблизно 1 % U9, або менше, ніж приблизно 1,5 % адуктів. У деяких варіантах здійснення, композиції містять приблизно 0,05 до приблизно 0,2 % U4, U5, U7 або U8. В інших варіантах здійснення, композиції містять від приблизно 0,05 до приблизно 0,6 % U1, U2 або U6. В інших варіантах здійснення, композиції містять від приблизно 0,05 до приблизно 0,6 % U9. У певних варіантах здійснення, композиції містять від приблизно 0,05 до приблизно 5 % U3. В інших варіантах здійснення, композиції містять від приблизно 0,05 до приблизно 1,5 % адукту. Таким чином, у деяких варіантах здійснення даний винахід забезпечує композиції, що містять цефтаролін або його проліки, (наприклад, цефтаролін фозаміл), які є несподівано й непередбачено стабільні. Наприклад, композиції можуть включати препарати, що містять цефтаролін або його проліки (наприклад, цефтаролін фозаміл) і 0,9% хлорид натрію, 5% декстрозу, 2,5% декстрозу, 0,45% хлорид натрію або розчин Рінгера з лактатом. У деяких варіантах здійснення, композиції, що містять цефтаролін або його проліки (наприклад, цефтаролін фозаміл), можуть включати 0,9% хлорид натрію й будуть несподівано й непередбачено стабільними, як показано згідно з рівнем одного або більш домішок або адуктів. Композиції, що містять цефтаролін або його проліки, можуть забезпечувати in vivo профіль у плазмі для цефтароліну, що включає Cmax від приблизно 1 до приблизно 100 мкг/мл і AUC від приблизно 5 до приблизно 200 мкг год/мл. У специфічних варіантах здійснення, композиції можуть забезпечувати in vivo профіль у плазмі для цефтароліну, що включає Cmax від приблизно 2 до приблизно 50 мкг/мл і AUC від приблизно 5 до приблизно 150 мкг год/мл. Наприклад, композиції, що містять приблизно 600 мг цефтароліну або його проліків, можуть забезпечувати in vivo профіль у плазмі для цефтароліну, що включає Cmax від приблизно 15 до приблизно 30 мкг/мл і AUC від приблизно 45 до приблизно 75 мкг год/мл. В іншому прикладі, композиції, що містять приблизно 400 мг цефтароліну або його проліків, можуть забезпечувати in vivo профіль у плазмі для цефтароліну, що включає Cmax від приблизно 8 до приблизно 20 мкг/мл і AUC від приблизно 25 до приблизно 50 мкг год/мл. У деяких варіантах здійснення, композиції містять приблизно від 200 мг до 1200 мг цефтаролін фозамілу й забезпечує in vivo профіль у плазмі для цефтароліну, що включає середнє значення Cmax менше, ніж приблизно 100 мкг/мл. Наприклад, профіль у плазмі включає середнє значення Cmax менше, ніж приблизно 80 мкг/мл; приблизно 70 мкг/мл; приблизно 60 мкг/мл; приблизно 50 мкг/мл; приблизно 40 мкг/мл або приблизно 30 мкг/мл. У типових варіантах здійснення, профіль у плазмі включає середнє значення Cmax від приблизно 10 до приблизно 50 мкг/мл. В інших варіантах здійснення, профіль у плазмі включає середнє значення Cmax від приблизно 10 до приблизно 40 мкг/мл. В інших варіантах здійснення, композиції містять приблизно від 100 мг до 1200 мг цефтаролін фозамілу й забезпечує in vivo профіль у плазмі для цефтароліну, що включає середнє значення AUC0- від приблизно від 10 до 500 мкг год/мл; приблизно від 10 до 400 мкг год/мл мкг год/мл; приблизно від 10 до 300 мкг год/мл; приблизно від 10 до 200 мкг год/мл або приблизно від 10 до 100 мкг год/мл. У типових варіантах здійснення, профіль у плазмі включає середнє значення AUC0- від приблизно від 10 до 200 мкг год/мл. У типових варіантах здійснення, композиції містять від приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків й забезпечують середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну від приблизно 50 до приблизно 80 мл/хв,яке більше, ніж середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну більше, ніж приблизно 80 мл/хв. Наприклад, AUC може бути аж до приблизно в 2 рази більше, наприклад, приблизно в 1,2 рази більше, приблизно в 1,3 рази більше або приблизно в 1,5 рази більше. У специфічних варіантах здійснення, середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну від приблизно 50 до приблизно 80 мл/хв, приблизно в 1,2 рази більше, ніж середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну більше, ніж приблизно 80 мл/хв. Наприклад, композиції можуть містити приблизно від 200 мг до 800 мг ( як, наприклад, приблизно 600 мг) цефтароліну або його проліків ( як, наприклад, цефтаролін фозаміл) і забезпечують середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну від приблизно 50 до приблизно 80 мл/хв, яке від приблизно 10% до приблизно 50% більше, ніж середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну більше, ніж приблизно 80 мл/хв. У деяких прикладах, середнє значення AUC може підвищуватися на приблизно 15%, приблизно 16%, приблизно 17%, приблизно 18%, приблизно 19%, приблизно 20%, приблизно 21%, приблизно 22%, приблизно 23%, приблизно 24% або приблизно 25%. 6 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 В інших ілюстративних варіантах здійснення, композиції містять від приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків й забезпечують середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну від приблизно 30 до приблизно 50 мл/хв аж до приблизно 3 рази більше, як, наприклад, приблизно в 1,5 рази більше, ніж середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну більше, ніж приблизно 80 мл/хв. Наприклад, композиції можуть містити від приблизно 200 до приблизно 800 мг (як, наприклад, приблизно 600 мг) цефтароліну або його проліків (як, наприклад, цефтаролін фозаміл) і забезпечують середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну від приблизно 30 до приблизно 50 мл/хв, яке від приблизно 40% до приблизно 100% більше, ніж середнє значення AUC для цефтароліну в пацієнтів із кліренсом креатиніну більше, ніж приблизно 80 мл/хв. У деяких прикладах, середнє значення AUC може підвищуватися на приблизно 45%, приблизно 46%, приблизно 47%, приблизно 48%, приблизно 49%, приблизно 50%, приблизно 51%, приблизно 52%, приблизно 53%, приблизно 54% або приблизно 55%. У деяких варіантах здійснення, даний винахід забезпечує композиції, що містять приблизно від 200 мг до 1200 мг цефтаролін фозамілу, що забезпечує in vivo профіль у плазмі для цефтароліну, що включає середнє значення Tmax більше, ніж приблизно 10 хв. Наприклад, профіль у плазмі включає середнє значення Tmax більше, ніж приблизно 15 хвилин, 30 хвилин, 45 хвилин, 1 година, 1,5 години або приблизно 2 години. У типових варіантах здійснення, профіль у плазмі включає середнє значення Tmax від приблизно 30 хвилин до приблизно 4 години, як, наприклад, приблизно 1,6 години, приблизно 2 години, приблизно 2,5 години або приблизно 3 години. У деяких варіантах здійснення, даний винахід забезпечує композиції, що складаються по суті із цефтароліну або його проліків (наприклад, цефтаролін фозамілу). У таких композиціях, цефтаролін або його проліки (наприклад, цефтаролін фозаміл) є єдиним активним компонентом. Активний компонент, як визначено в даній заявці, являє собою компонент, який ефективний для лікування бактеріальних інфекцій, наприклад, антибактеріальний засіб або антимікробний засіб. Такі композиції можуть мати інші компоненти, які є неактивними та/або не являють собою антибактеріальні засоби, антимікробні засоби. Приклади таких компонентів включають, але не обмежуючись тільки ними, один або декілька фармацевтично прийнятних носіїв, наповнювачів, допоміжних речовин, або інших компонентів, придатних для приготування композицій. Доступні різні стандартні посилання, у яких описані процедури для приготування різних композицій, придатних для введення сполук відповідно до винаходу. Приклади потенційних композицій і препаратів представлені, наприклад, в Handbook of Pharmaceutical Excipients, American Pharmaceutical Association (поточне видання); Pharmaceutical Dosage Forms: Tablets (Lieberman, Lachman і Schwartz, редактори) поточне видання, опубліковане Marcel Dekker, Inc., а також Remington's Pharmaceutical Sciences (Arthur Osol, редактор), 1553-1593 (поточне видання). Композиції можуть бути твердими або рідкими й можуть бути представлені у фармацевтичних формах, таких як, наприклад, плоскі таблетки або таблетки, покриті цукровою оболонкою, желатинові капсули, гранули, супозиторії, препарати для ін'єкцій, мазі, креми, гелі, і приготовлені відповідно до загальноприйнятих методів. Активний компонент або компоненти можуть бути включені з наповнювачами, які звичайно використовуються в таких фармацевтичних композиціях, такими як тальк, гуміарабік, лактоза, крохмаль, стеарат магнію, олію какао, водні або неводні наповнювачі, жирні речовини тваринного або рослинного походження, похідні парафіну, гліколі, різні змочувальні речовини, диспергувальні або емульгувальні засоби й консерванти. Композиції можуть бути представлені у формі ліофілізату, призначеного для розчинення екстемпорально в підходящому носії, наприклад, апірогенній стерильній воді. Наприклад, композиція може бути приготовлена у вигляді твердої лікарської форми, такої як сухий порошок, який може бути відновлений з розчинником перед введенням. У типових варіантах здійснення, композиція може бути приготовлена у вигляді сухого порошку, що містить цефтаролін або його проліки (наприклад, цефтаролін фозаміл). Сухий порошок може бути відновлений за допомогою стерильного розріджувача, такого як вода, з утворенням відновленого розчину перед введенням. рН відновленого розчину може знаходитися в інтервалі від приблизно 4 до приблизно 7, наприклад, від приблизно 4,8 до приблизно 6,5 або від приблизно 4,5 до приблизно 6,5. В інших варіантах здійснення, рН відновленого розчину може знаходитися в інтервалі від приблизно 5,6 до приблизно 7. Відновлений розчин може бути додатково розведений перед введенням, використовуючи підходящий розчин, такий як інфузійний розчин. Прикладами таких інфузійних розчинів є 0,9% хлорид натрію (фізіологічний розчин), 5% 7 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 декстроза, 2,5% декстроза й 0,45% хлорид натрію й розчин Рінгера з лактатом. Композиції можуть бути приготовлені в різних твердих пероральних лікарських формах, включаючи такі тверді форми, як таблетки, желатинові капсули, капсули, каплети, гранули, коржі й нерозфасовані порошки. Композиції згідно із даним винаходом можуть вводитися окремо або в комбінації з різними фармацевтично прийнятними носіями, розріджувачами (такими як сахароза, маніт, лактоза, крохмалі) і наповнювачами, відомими в даній галузі, включаючи, але не обмежуючись тільки ними, суспендуючі засоби, солюбілізатори, буферні речовини, сполучні, дезінтегратори, консерванти, барвники, ароматизатори, змащувальні речовини та інші. Капсули, таблетки й гелі з уповільненим вивільненням також можуть використовуватися для введення композицій. Композиції також можуть бути приготовлені в різних рідких пероральних лікарських формах, включаючи водні й неводні розчини, емульсії, суспензії, сиропи, і еліксири. Такі лікарські форми також можуть містити підходящі інертні розріджувачі, відомі в даній галузі, такі як вода, й підходящі наповнювачі, відомі в даній галузі, такі як консерванти, зволожуючі речовини, підсолоджувачі, ароматизатори, а також агенти для емульгування та/або суспендування сполук відповідно до винаходу. Композиції згідно із даним винаходом можуть ін'єкуватися, наприклад, внутрішньовенно, у формі ізотонічного стерильного розчину. Інші препарати також можливі. Для місцевого введення, фармацевтична композиція може знаходитися у формі кремів, мазей, лініментів, лосьйонів, емульсій, суспензій, гелів, розчинів, пластирів, порошків, спреїв, і крапель, що підходять для введення на шкіру, очі, вуха або ніс. Місцеве введення також може включати трансдермальне введення за допомогою таких засобів, як трансдермальні пластирі. Також можуть бути приготовлені водні препарати, що підходять для введення шляхом інгаляції. Наприклад, сполуки відповідно до винаходу можуть вводитися шляхом інгаляції у формі порошку (наприклад, мікронізованого) або у формі атомізованих розчинів або суспензій. Водний препарат можна поміщати в підходящий пропелент під тиском. В іншому аспекті, даний винахід забезпечує способи лікування бактеріальних інфекцій шляхом введення цефтароліну або його проліків. Способи включають введення композицій або лікарських форм, що містять цефтаролін або його проліки, як описано вище. Способи включають лікування бактеріальних інфекцій, викликаних мікроорганізмами, включаючи грампозитивні й грамнегативні мікроорганізми, такі як Staphylococcus aureus (чутливі до метициліну й резистентні до метициліну ізоляти), Streptococcus pneumoniae (включаючи резистентні до багатьох лікарських засобів ізоляти [MDRSP]), Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus anginosus група (включаючи S. anginosus, S. intermedius, і S. constellatus), Enterococcus faecalis (ампіцилін-чутливі), Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Morganella morganii, Haemophilus influenzae (включаючи штами, які продукують бета-лактамазу) і Haemophilus parainfluenzae (включаючи штами, які продукують бета-лактамазу). Резистентні до багатьох лікарських засобів Streptococcus pneumoniae ізоляти являють собою штами, резистентні до двох або більше з наступних антибіотиків: пеніцилін (мінімальна інгібуюча концентрація (MIC) > 2 мкг/мл), друге покоління цефалоспорінів (наприклад, цефуроксим), макроліди, хлорамфенікол, фторхінолони, тетрацикліни й триметоприм/сульфаметоксазол. У деяких варіантах здійснення, способи включають лікування бактеріальних інфекцій, викликаних факультативними грампозитивними мікроорганізмами, наприклад, групою CFG стрептококів, групою Viridans стрептококів і Streptococcus pneumoniae (пеніцилін-проміжні, пеніцилін-резистентні або резистентні до багатьох лікарських засобів); факультативними грамнегативними мікроорганізмами, наприклад, Citrobacter koseri (цефтазидим-чутливі), Citrobacter freundii (цефтазидим-чутливі), Enterobacter cloacae (цефтазидим-чутливі), Enterobacter aerogenes (цефтазидим-чутливі), Haemophilus influenzae (бета-лактамазoнегативні, ампіцилін-резистентні), Moraxella catarrhalis, Neisseria gonorrhoeae, Neisseria meningitidis, Pasturella multocida, Providencia rettgeri (цефтазидим-чутливі), Proteus mirabilis (цефтазидимчутливі), види Salmonella (цефтазидим-чутливі) і види Shigella (цефтазидим-чутливі); і анаеробними мікроорганізмами, наприклад, види Clostridium, Finegoldia magna, Propionibacterium acnes, Fusobacterium nucleatum і Fusobacterium necrophorum. У типових варіантах здійснення, цефтаролін або його проліки можуть вводитися пацієнтам, які цього потребують, для лікування ускладненої інфекції шкіри й підшкірної клітковини (cSSSI). cSSSI може бути викликана грампозитивними й грамнегативними мікроорганізмами, такими як Staphylococcus, Streptococcus, Enterococcus, Escherichia, Klebsiella і Morganella. У типових варіантах здійснення, мікроорганізм може являти собою Staphylococcus aureus, включаючи чутливі до метициліну й резистентні до метициліну ізоляти. В інших варіантах здійснення, cSSSI може бути викликана групою Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus 8 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 dysgalactiae або Streptococcus anginosus (включаючи S. anginosus, S. intermedius, і S. constellatus). В інших варіантах здійснення, cSSSI може бути викликана Enterococcus faecalis, наприклад, ампіцилін-чутливим ізолятом Enterococcus faecalis. У деяких варіантах здійснення, cSSSI може бути викликане Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca або Morganella morganii. У деяких варіантах здійснення, цефтаролін або його проліки можуть вводитися пацієнтам, які цього потребують, для лікування позалікарняної бактеріальної пневмонії (CABP). CABP може бути викликана грампозитивними й грамнегативними мікроорганізмами, такими як Streptococcus, Staphylococcus, Haemophilus, Haemophilis, Klebsiella і Escherichia. У типових варіантах здійснення, інфекція може бути викликана чутливими ізолятами Streptococcus pneumoniae, Staphylococcus aureus, Haemophilus influenzae, Haemophilus parainfluenzae, Klebsiella pneumoniae або Escherichia coli. У типових варіантах здійснення, мікроорганізм може являти собою Streptococcus pneumoniae. Штам Streptococcus pneumoniae може бути пеніцилінчутливим, пеніцилін-резистентним або резистентним до багатьох лікарських засобів. У подальших варіантах здійснення, мікроорганізм може являти собою Streptococcus pneumoniae серотип 19A. У деяких варіантах здійснення, CABP може бути зв’язана із супутньою бактеріємією. В інших ілюстративних варіантах здійснення, мікроорганізм може являти собою Staphylococcus aureus. Штам або ізолят Staphylococcus aureus може бути чутливим до метициліну або резистентним до метициліну. У ще інших типових варіантах здійснення винаходу, мікроорганізм може являти собою Haemophilus influenzae, Klebsiella pneumoniae або Escherichia coli. У типових варіантах здійснення, мікроорганізм може являти собою непродукуючий -лактамазу ампіцилін-резистентний (BLNAR) штам Haemophilus influenzae. В інших варіантах здійснення, CABP може бути викликана Enterobacter, Proteus, Serratia або Moraxella. У подальших варіантах здійснення, CABP може бути викликана Enterobacter aerogenes, Proteus mirabilis, Serratia marcescens або Moraxella catarrhalis. У типових варіантах здійснення, способи включають лікування cSSSI або CABP шляхом введення пацієнтові, який цього потребує, терапевтично ефективної кількості цефтароліну або його проліків (наприклад, цефтаролін фозаміл). У деяких варіантах здійснення, способи включають введення цефтароліну або його фармацевтично прийнятної солі або сольвату. В інших варіантах здійснення, способи включають введення проліки цефтароліну або його фармацевтично прийнятної солі або сольвату. У типових варіантах здійснення, проліки можуть являти собою фосфоно проліки. У деяких прикладах, проліки цефтароліну може являти собою цефтаролін фозаміл. У деяких варіантах здійснення, цефтаролін фозаміл може знаходитися у водній формі, наприклад, моногідратній формі. В інших варіантах здійснення, цефтаролін фозаміл може знаходитися в безводній формі. У деяких варіантах здійснення, цефтаролін або його проліки можуть знаходитися у формі сольвату. Наприклад, цефтаролін або проліки цефтароліну може знаходитися у формі сольвату оцтової кислоти, такого як, цефтаролін фозаміл моногідрат, сольват оцтової кислоти. У деяких варіантах здійснення, забезпечуються способи лікування cSSSI або CABP шляхом введення пацієнтові, який цього потребує, терапевтично ефективної кількості (6R,7R)-7-{(2Z)-2(етоксііміно)-2-[5-(фосфоноаміно)-1,2,4-тіадіазол-3-іл]ацетамідо}-3-{[4-(1-метилпіридин-1-ій-4-іл)1,3-тіазол-2-іл]сульфаніл}-8-оксо-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-2-карбоксилату ( тобто, цефтаролін фозамілу). У деяких варіантах здійснення, способи лікування бактеріальної інфекції включають введення в інтервалі від приблизно 100 мг до приблизно 2400 мг цефтароліну або його проліків (наприклад, цефтаролін фозамілу). У подальших варіантах здійснення, цефтаролін або його проліки можуть вводитися в кількості в інтервалі від приблизно 100 мг до приблизно 1200 мг. У деяких варіантах здійснення, цефтаролін або його проліки можуть вводитися в кількості в інтервалі від приблизно 200 мг до приблизно 1000 мг. У типових варіантах здійснення, кількість може становити приблизно 100 мг, приблизно 200 мг, приблизно 300 мг, приблизно 400 мг, приблизно 500 мг, приблизно 600 мг, приблизно 700 мг, приблизно 800 мг, приблизно 900 мг, приблизно 1000 мг, приблизно 1100 мг або приблизно 1200 мг. У певних варіантах здійснення, кількість може становити приблизно 400 мг. В інших варіантах здійснення, кількість може становити приблизно 600 мг. В інших варіантах здійснення, кількість може становити приблизно 800 мг. У певних варіантах здійснення, кількість може становити приблизно 1200 мг. Способи включають введення лікарської форми, яка містить цефтаролін або його проліки (наприклад, цефтаролін фозаміл) у кількості, як описано вище. Наприклад, лікарські форми можуть містити в інтервалі від приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків (наприклад, цефтаролін фозамілу). Кількість може вводитися в єдиній дозі або в декількох розділених дозах на добу. 9 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 Наприклад, кількість може вводитися у вигляді єдиної добової дози. У типових варіантах здійснення, може вводитися приблизно 800 мг цефтароліну його проліків (наприклад, цефтаролін фозаміл) на добу. В інших ілюстративних варіантах здійснення, може вводитися приблизно 1200 мг цефтароліну його проліків (наприклад, цефтаролін фозамілу) на добу. У деяких варіантах здійснення, кількість може вводитися у вигляді двох - восьми доз на добу. Наприклад, може вводитися приблизно 400 мг цефтароліну його проліків (наприклад, цефтаролін фозамілу) кожні 12 годин ( тобто два рази в на добу). У деяких прикладах, може вводитися приблизно 600 мг цефтароліну його проліків (наприклад, цефтаролін фозамілу) кожні 12 годин ( тобто два рази в на добу). У деяких варіантах здійснення, цефтаролін або його проліки можуть вводитися парентерально. Підходящі методи для парентерального введення включають, але не обмежуючись тільки ними, введення стерильного водного препарату сполуки, який переважно є ізотонічним по відношенню до крові реципієнта (наприклад, фізіологічний сольовий розчин). Такі препарати можуть включати суспендуючі засоби й загусники й ліпосоми або інші системи мікрочастинок, які створені для націлювання сполуки на компоненти крові або один або декілька органів. Препарат може бути представлений у формі єдиної дози або багатодозової форми. Парентеральне введення може бути внутрішньовенним, внутрішньоартеріальним, внутрішьооболонковим, внутрішньом'язовим, підшкірним, внутрішньом'язовим, у черевну порожнину (наприклад, внутрішньоочеревинним), та ін. У деяких варіантах здійснення, парентеральне введення може здійснюватися за допомогою інфузійних насосів (зовнішніх або імплантованих) або інших підходящих засобів, придатних для бажаного способу введення. Цефтаролін або його проліки (наприклад, цефтаролін фозаміл) може вводитися у вигляді розчину або суспензії в розчиннику, такому як вода, фізіологічний сольовий розчин, від приблизно 5 % до приблизно 10 % цукрового (наприклад, глюкозного, декстрозного) розчину, або їх комбінації. У типових варіантах здійснення, цефтаролін або його проліки можуть вводитися внутрішньовенно, наприклад, шляхом інфузії. У деяких варіантах здійснення, цефтаролін або його проліки можуть вводитися шляхом внутрішньовенної інфузії протягом однієї години. В інших варіантах здійснення, цефтаролін або його проліки можуть вводитися шляхом безперервної або пролонгованої внутрішньовенної інфузії. В інших варіантах здійснення, цефтаролін або його проліки можуть вводитися внутрішньом'язово. Для внутрішньом'язового введення більш високих доз, ін'єкцію можна проводити у дві або більше внутрішньом'язові ділянки. У деяких варіантах здійснення, способи можуть включати введення цефтаролін або його проліки кожні 4 години, 6 годин, 8 годин, 12 годин, 18 годин або кожні 24 години. Наприклад, цефтаролін або його проліки можуть вводитися кожні 12 годин внутрішньовенно шляхом інфузії протягом однієї години. В інших варіантах здійснення, способи можуть включати введення цефтаролін або його проліки шляхом безперервної або пролонгованої інфузії. Наприклад, цефтаролін або його проліки можуть вводитися шляхом інфузії протягом 2 годин, 3 години, 4 години, 5 годин, 6 годин, 7 годин, 8 годин, 9 годин, 10 годин, 11 годин або 12 годин. В інших варіантах здійснення, тривалість інфузії може становити більше, ніж 12 годин, наприклад, 13 годин, 14 годин, 15 годин, 16 годин, 17 годин, 18 годин, 19 годин, 20 годин, 21 година або 22 години, 23 години або 24 години. Наприклад, приблизно 400 мг цефтароліну або його проліків може вводитися шляхом інфузії протягом 12 годин. В іншому прикладі, приблизно 600 мг цефтароліну або його проліків може вводитися шляхом інфузії протягом 12 годин. Тривалість лікування може залежати від тяжкості й ділянки інфекції й клінічного стану пацієнта й бактеріологічного процесу. У деяких варіантах здійснення, лікування може тривати принаймні в інтервалі від приблизно 5 до 14 днів. В інших варіантах здійснення, лікування може тривати принаймні в інтервалі від приблизно 5 до 7 днів. Наприклад, приблизно 400 мг цефтароліну або його проліків може вводитися кожні 24 години впродовж від приблизно п'яти до чотирнадцяти днів. У подальших варіантах здійснення, приблизно 400 мг цефтароліну або його проліків може вводитися кожні 24 години впродовж від приблизно п'яти до десяти днів. В інших варіантах здійснення, приблизно 400 мг цефтароліну або його проліків може вводитися кожні 24 години впродовж від приблизно п'яти до семи днів. В інших варіантах здійснення, приблизно 400 мг цефтароліну або його проліків може вводитися кожні 12 годин протягом від приблизно п'яти до чотирнадцяти днів. В інших варіантах здійснення, приблизно 400 мг цефтароліну або його проліків може вводитися кожні 12 годин протягом від приблизно п'яти до десяти днів. В інших варіантах здійснення, приблизно 400 мг цефтароліну або його проліків може вводитися кожні 12 годин протягом від приблизно п'яти до семи днів. В інших варіантах здійснення, приблизно 400 мг цефтароліну або його проліків може 10 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 вводитися кожні 8 годин протягом від приблизно п'яти до чотирнадцяти днів. Наприклад, приблизно 400 мг цефтароліну або його проліків може вводитися кожні 8 годин протягом від приблизно п'яти до десяти днів. У подальших варіантах здійснення, приблизно 400 мг цефтароліну або його проліків може вводитися кожні 8 годин протягом від приблизно п'яти до семи днів. У деяких варіантах здійснення, приблизно 600 мг цефтароліну або його проліків може вводитися кожні 24 години впродовж від приблизно п'яти до чотирнадцяти днів. Наприклад, приблизно 600 мг цефтароліну або його проліків може вводитися кожні 24 години впродовж від приблизно п'яти до десяти днів. У типових варіантах здійснення, приблизно 600 мг цефтароліну або його проліків може вводитися кожні 24 години впродовж від приблизно п'яти до семи днів. У типових варіантах здійснення, приблизно 600 мг цефтароліну або його проліків може вводитися кожні 12 годин протягом від приблизно п'яти до чотирнадцяти днів. В інших варіантах здійснення, приблизно 600 мг цефтароліну або його проліків може вводитися кожні 12 годин протягом від приблизно п'яти до десяти днів. В інших варіантах здійснення, приблизно 600 мг цефтароліну або його проліків може вводитися кожні 12 годин протягом від приблизно п'яти до семи днів. У певних варіантах здійснення, приблизно 600 мг цефтароліну або його проліків може вводитися кожні 8 годин протягом від приблизно п'яти до чотирнадцяти днів. У деяких варіантах здійснення, приблизно 600 мг цефтароліну або його проліків може вводитися кожні 8 годин протягом від приблизно п'яти до десяти днів. В інших варіантах здійснення, приблизно 600 мг цефтароліну або його проліків може вводитися кожні 8 годин протягом від приблизно п'яти до семи днів. У типових варіантах здійснення, способи включають лікування ускладнених інфекцій шкіри й підшкірної клітковини (cSSSI) шляхом введення пацієнтові, який цього потребує, приблизно 600 мг цефтароліну або його проліків (наприклад, цефтаролін фозаміл) кожні 12 годин внутрішньовенно шляхом інфузії протягом однієї години від п'яти до чотирнадцяти днів. В інших ілюстративних варіантах здійснення, способи включають лікування позалікарняної бактеріальної пневмонії (CABP) шляхом введення приблизно 600 мг цефтароліну або його проліків (наприклад, цефтаролін фозаміл) кожні 12 годин внутрішньовенно шляхом інфузії протягом однієї години від п'яти до семи днів. У деяких варіантах здійснення, у способах лікування може бути необхідним добір дози залежно від пацієнтів, що піддаються лікуванню. Наприклад, для пацієнтів із кліренсом креатиніну більше, ніж 50 мл/хв, можуть не потребувати добору дози. Таких пацієнтів можна лікувати шляхом введення приблизно 600 мг цефтароліну або його проліків (наприклад, цефтаролін фозаміл) внутрішньовенно кожні 12 годин, такого як, наприклад, шляхом інфузії протягом однієї години. У пацієнтів з ослабленою нирковою функцією із кліренсом креатиніну менше, ніж 50 мл/хв, може бути необхідним підбір режиму дозування для уникнення накопичення цефтароліну внаслідок зниженого кліренсу. Наприклад, пацієнтів із кліренсом креатиніну від приблизно 10 мл/хв до приблизно 50 мл/хв можна лікувати шляхом введення приблизно 400 мг цефтароліну або його проліків (наприклад, цефтаролін фозаміл) внутрішньовенно кожні 12 годин, а саме, наприклад, шляхом інфузії протягом однієї години. Кліренс креатиніну можна оцінювати за допомогою формули Кокрофта-Голта. Наприклад, кліренс креатиніну можна розраховувати, використовуючи наступну формулу, яка представляє стаціонарний стан ниркової функції. Самці: Кліренс креатиніну (мл/хв) = Вага (кг) x (140 – вік у роках)/72 x креатинін у сироватці (мг/дл) Самки: Кліренс креатиніну (мл/хв) = 0,85 x значення, розрахованого для самців У деяких варіантах здійснення, може бути рекомендована додаткова доза цефтароліну або його проліків, якщо цефтаролін або його проліки вводять перед гемодіалізом. Кількість додаткової дози, яку вводять, може залежати від кількості годин між введенням цефтароліну або його проліків й гемодіалізом. У деяких варіантах здійснення, способи включають забезпечення лікарської форми, яка містить від приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків й додавання приблизно 20 мл стерильної води до лікарської форми з утворенням відновленого розчину, який має значення рН в інтервалі від приблизно 4 до приблизно 7, і введення відновленого розчину протягом періоду приблизно одна година. У деяких прикладах, відновлений розчин має значення рН від приблизно 4,8 до приблизно 6,5. В інших прикладах, відновлений розчин має значення рН від приблизно 4,5 до приблизно 6,5. В інших варіантах здійснення, способи включають забезпечення лікарської форми, яка містить приблизно 400 мг цефтароліну або його проліків й введення відновленого розчину, що 11 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 містить лікарську форму, протягом періоду приблизно одна година пацієнтам із кліренсом креатиніну від приблизно 10 до приблизно 50 мл/хв. У подальших варіантах здійснення, введення повторюють кожні 12 годин протягом періоду від приблизно п'яти до чотирнадцяти днів. У деяких прикладах, введення повторюють кожні 12 годин протягом періоду від приблизно п'яти до семи днів. В інших варіантах здійснення, способи включають забезпечення лікарської форми, яка містить приблизно 600 мг цефтароліну або його проліків й введення відновленого розчину, що містить лікарську форму, протягом періоду приблизно одна година. У подальших варіантах здійснення, введення повторюють кожні 12 годин протягом періоду від приблизно п'яти до чотирнадцяти днів. У деяких прикладах, введення повторюють кожні 12 годин протягом періоду від приблизно п'яти до семи днів. У деяких прикладах, способи включають забезпечення лікарської форми, яка містить приблизно 600 мг цефтароліну або його проліків й введення відновленого розчину, що містить лікарську форму, протягом періоду приблизно одна година таким чином, що лікарські форми забезпечують in vivo профіль у плазмі для цефтароліну, що включає Cmax від приблизно 15 до приблизно 30 мкг/мл і AUC від приблизно 45 до приблизно 75 мкг год/мл. У деяких варіантах здійснення, способи включають забезпечення лікарських форм, які містять від приблизно 100 мг до приблизно 1200 мг цефтароліну або його проліків, що забезпечує in vivo профіль у плазмі для цефтароліну, що включає середнє значення Tmax більше, ніж приблизно 10 хв. Наприклад, профіль у плазмі включає середнє значення Tmax більше, ніж приблизно 15 хвилин, 30 хвилин, 45 хвилин, 1 година, 1,5 години або приблизно 2 години. У типових варіантах здійснення, профіль у плазмі включає середнє значення Tmax від приблизно 30 хвилин до приблизно 4 години, як, наприклад, приблизно 1,6 години, приблизно 2 години, приблизно 2,5 години або приблизно 3 години. У деяких варіантах здійснення, способи включають введення пацієнтові лікарської форми, яка містить від приблизно 200 мг до приблизно 800 мг цефтароліну або його проліків й інформування пацієнта про те, що лікарська форма протипоказана пацієнтам з відомою важкою підвищеною чутливістю або пацієнтам, у яких була анафілактична реакція на бета-лактами. У деяких варіантах здійснення, способи включають забезпечення лікарської форми, яка містить цефтаролін або його проліки (наприклад, цефтаролін фозаміл) і забезпечення інструкцій для введення лікарської форми. У деяких варіантах здійснення, способи включають забезпечення лікарської форми, яка містить від приблизно 200 мг до приблизно 1200 мг цефтароліну або його проліків (наприклад, цефтаролін фозаміл) і забезпечення інструкцій для приготування розчину, який містить лікарську форму для внутрішньовенного або внутрішньом'язового введення. У типових варіантах здійснення, способи включають забезпечення лікарської форми у вигляді стерильного безводного порошку у флаконі й забезпечення інструкцій для відновлення флакона за допомогою розріджувача для внутрішньовенного введення. Наприклад, інструкції можуть включати відновлення флакона із застосуванням певної кількості розріджувача, обережне струшування доти, поки порошок повністю не розчиниться, відбір певного об'єму відновленого розчину й додавання його в інфузійний мішок, що містять аж до приблизно 250 мл інфузійного розчину й обережне струшування для забезпечення повного змішування лікарського продукту. Інфузійні розчини включають, але не обмежуючись тільки ними, 0,9% хлорид натрію (фізіологічний розчин), 5% декстрозу, 2,5% декстрозу й 0,45% хлорид натрію й розчин Рінгера з лактатом. У типових варіантах здійснення, в інструкціях може міститися додаткове попередження про те, що відновлений розчин не призначений для безпосередньої ін'єкції. У типових варіантах здійснення, приблизно 400 мг цефтароліну або його проліків (наприклад, цефтаролін фозаміл) може бути відновлено за допомогою приблизно 20 мл розріджувача й вводитися шляхом інфузії протягом приблизно 1 години. В інших варіантах здійснення, приблизно 600 мг цефтароліну або його проліків (наприклад, цефтаролін фозаміл) може бути відновлено за допомогою приблизно 20 мл розріджувача й вводитися шляхом інфузії протягом приблизно 1 години. У деяких варіантах здійснення, відновлений розчин можна витримувати приблизно протягом однієї години перед переносом і розведенням в інфузійному мішку. В інших варіантах здійснення, цефтаролін або його проліки відновлюють у стерильній воді для ін'єкцій і вводять негайно. У кращих варіантах здійснення, цефтаролін або його проліки можуть бути відновлене, використовуючи в/в мішки, що містять фізіологічний розчин. В/в мішки можна зберігати при кімнатній температурі протягом аж до приблизно 6 годин або при 2-8°С протягом аж до приблизно 24 години перед введенням. У деяких варіантах здійснення, може не бути доцільним заморожування відновленого розчину. В інших варіантах здійснення, лікарська форма забезпечується в замороженому мішку або 12 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 попередньо заповненому шприці. У типових варіантах здійснення, заморожені мішки можуть містити від приблизно 1 мг/мл до 20 мг/мл цефтароліну або його проліків (наприклад, цефтаролін фозаміл). У деяких прикладах, заморожений мішок може містити приблизно 2 мг/мл, приблизно 3 мг/мл, приблизно 4 мг/мл, приблизно 5 мг/мл, приблизно 6 мг/мл, приблизно 7 мг/мл, приблизно 8 мг/мл, приблизно 9 мг/мл, приблизно 10 мг/мл, приблизно 11 мг/мл або приблизно 12 мг/мл цефтароліну або його проліків (наприклад, цефтаролін фозаміл). Додатково, заморожені мішки можуть містити від приблизно 0,5 мг/мл до приблизно 20 мг/мл Lаргініну. У типових варіантах здійснення, заморожені мішки можуть містити приблизно 0,5 мг/мл, приблизно 1 мг/мл, приблизно 2 мг/мл, приблизно 3 мг/мл, приблизно 4 мг/мл, приблизно 5 мг/мл, приблизно 6 мг/мл, приблизно 7 мг/мл, приблизно 8 мг/мл, приблизно 9 мг/мл або приблизно 10 мг/мл L-аргініну. У деяких варіантах здійснення, заморожені мішки можуть мати значення рн у діапазоні від приблизно 4,5 до приблизно 7. У типових варіантах здійснення, значення рН може знаходитися в інтервалі від приблизно 5,5 до приблизно 7. У типових варіантах здійснення, даний винахід забезпечує заморожені мішки, які містять композиції, що містять цефтаролін або його проліки, (наприклад, цефтаролін фозаміл), які несподівано й непередбачено стабільні. Наприклад, композиції можуть включати препарати, які містять цефтаролін або його проліки (наприклад, цефтаролін фозаміл) і 0,9% хлорид натрію, 5% декстрозу, 2,5% декстрозу, 0,45% хлорид натрію або розчин Рінгера з лактатом. У деяких варіантах здійснення, композиції, які містять цефтаролін або його проліки (наприклад, цефтаролін фозаміл), можуть включати 0,9% хлорид натрію й бути несподівано й непередбачено стабільними, як показано згідно з рівнем однієї або декількох домішок або адуктів. Наприклад, загальний вміст домішок може бути не більше, ніж приблизно 5%. В інших варіантах здійснення, композиції можуть містити не більше, ніж приблизно 5% U3, не більше, ніж приблизно 0,6% U1 і/або не більше, ніж приблизно 0,6% U6. У типових варіантах здійснення, загальний вміст домішок у заморожених мішках може становити менше, ніж 5%. У деяких прикладах, заморожені мішки можуть містити від приблизно 0,05% до приблизно 5% загального вмісту домішок. У специфічних варіантах здійснення, заморожені мішки можуть містити від приблизно 0,05% до приблизно 5% U3, від приблизно 0,05% до приблизно 0,6% U1 або від приблизно 0,05% до приблизно 0,6% U6. Наприклад, композиції можуть містити від приблизно 0,05 % до приблизно 5% U3 після зберігання при -20°C після закінчення 0 - 6 місяців. В інших варіантах здійснення, композиції можуть містити від приблизно 0,05 % до приблизно 0,6% U1 після зберігання при -20°C після закінчення 0 - 6 місяців. В інших варіантах здійснення, композиції можуть містити від приблизно 0,05 % до приблизно 0,6% U6 після зберігання при 20°C після закінчення 0-6 місяців. У подальших варіантах здійснення, забезпечуються інструкції для введення лікарської форми. Наприклад, суб'єкта інструктують відносно розморожування замороженого мішка або замороженого шприца перед введенням. Суб'єкта додатково можна інструктувати відносно розведення композиції за допомогою сумісного розріджувача перед введенням. У деяких варіантах здійснення, спосіб включає приготування розчину цефтароліну або його проліків для внутрішньом'язового введення. У типових варіантах здійснення, цефтаролін або його проліки відновлюють за допомогою певної кількості розріджувача й обережно струшують доти, поки порошок повністю не розчинитися. У специфічних варіантах здійснення, відновлений розчин вводять шляхом глибокої внутрішньом'язової ін'єкції у велику м'язову масу, таку як, сідничні м'язи або латеральну частину стегна. У типових варіантах здійснення, відновлений внутрішньом'язовий розчин використовую протягом приблизно однієї години після приготування. Наприклад, приблизно 400 мг цефтароліну або його проліків може бути відновлено з використанням приблизно 2 мл розріджувача й використовуватися для внутрішньом'язового введення. В інших ілюстративних варіантах здійснення, приблизно 600 мг цефтароліну або його проліків може бути відновлено з використанням приблизно 2 мл розріджувача й використовуватися для внутрішньом'язового введення. У типових варіантах здійснення, способи включають забезпечення інформації про те, що відновлений розчин, що містить цефтаролін або його проліки, слід візуально оглядати відносно наявності твердих частинок і/або знебарвлення перед введенням. Може забезпечуватися додаткова інформація відносно того, що відновлені розчини можуть бути жовтого кольору або інфузійні розчини можуть бути прозорими або від світло- до темно-жовтого кольору. Колір може залежати від концентрації й використовуваних розріджувачів. Колір композицій, що містять цефтаролін або його проліки, може ставати темним, залежно від умов зберігання. У таких варіантах здійснення, на ефективність продукту може не виявлятися несприятливого впливу. Розріджувачі, які можна використовувати для внутрішньовенного введення, включають, але не обмежуючись тільки ними, 0,9% хлорид натрію для ін'єкцій, USP (фізіологічний розчин); 5% 13 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 декстрозу для ін'єкцій, USP; 2,5% декстрозу й 0,45% хлорид натрію для ін'єкцій, USP і розчин Рінгера з лактатом для ін'єкцій, USP. У подальших варіантах здійснення, способи можуть забезпечувати інструкції відносно не змішування цефтароліну або його проліків з розчинами, що містять інші лікарські засоби. У деяких варіантах здійснення, може забезпечуватися інформація відносно того, що цефтаролін або його проліки протипоказані пацієнтам з відомою важкою підвищеною чутливістю або пацієнтам, у яких була анафілактична реакція на бета-лактами. У подальших варіантах здійснення, пацієнт може бути інформований відносно того, що були описані важкі й іноді смертельні алергічні (анафілактичні) реакції й важкі шкірні реакції в пацієнтів, що одержують бета-лактамні антибіотики, і що такі реакції більш імовірно можуть спостерігатися в особин із чутливістю на множинні алергени в анамнезі. У деяких варіантах здійснення, може бути необхідне ретельне опитування для визначення того, чи була в суб'єкта, що піддається лікуванню, попередня алергічна реакція на інші карбапанеми, цефалоспоріни, пеніциліни або інші алергени, перед початком лікування. У деяких варіантах здійснення, пацієнта інструктують відносно скасування лікарського засобу, якщо спостерігається алергічна реакція. У деяких варіантах здійснення, може забезпечуватися інформація відносно побічних дій. Наприклад, може забезпечуватися інформація відносно того, що найпоширенішими побічними реакціями, що зустрічаються в приблизно 4% або більше пацієнтів, є діарея, нудота й головний біль. У деяких варіантах здійснення, способи лікування бактеріальної інфекції, наприклад, cSSSI і CABP включають забезпечення фармацевтичного продукту, що містить лікарську форму, яка містить цефтаролін або його проліки (наприклад, цефтаролін фозаміл) і опублікований матеріал. Наприклад, фармацевтичний продукт може являти собою флакон, мішок або шприц, з пакувальним матеріалом або без нього. У типових варіантах здійснення, продукт може являти собою флакон, який містить приблизно 400 мг або приблизно 600 мг стерильного порошку, що містить цефтаролін або його проліки (наприклад, цефтаролін фозаміл). Флакон може містити будь-які композиції, описані вище. Опублікований матеріал може містити інформацію для введення лікарської форми. Опублікований матеріал може являти собою листок-вкладиш, флайєр, брошуру, або пакувальний матеріал для лікарської форми, такий як мішок, або інші. У типових варіантах здійснення, опублікований матеріал містить інструкції відносно відновлення флакона, що містить лікарську форму за допомогою вказаної кількості розріджувача (наприклад, 20 мл для внутрішньовенного й 2 мл для внутрішньом'язового введення) і обережного струшування доти, поки порошок повністю не відновиться. У подальших варіантах здійснення, матеріал містить інструкції відносно відбору певного об'єму відновленого розчину й додавання його в інфузійний мішок, що містить розріджувач, наприклад, 250 мл 0,9% хлориду натрію (фізіологічний розчин), 5% декстрози, 2,5% декстрози й 0,45% хлориду натрію або розчину Рінгера з лактатом і обережного струшування для забезпечення повного змішування лікарського продукту. Опублікований матеріал може містити додаткова вказівка відносно того, що відновлений розчин не призначений для безпосередньої ін'єкції. У типових варіантах здійснення, матеріал містить інструкції про те, що приблизно 400 мг цефтароліну або його проліків відновлюють за допомогою приблизно 20 мл розріджувача й вводять шляхом інфузії протягом приблизно 1 години. В інших ілюстративних варіантах здійснення, матеріал містить інструкції про те, що приблизно 600 мг цефтароліну або його проліків відновлюють за допомогою приблизно 20 мл розріджувача й вводять шляхом інфузії протягом приблизно 1 години. У деяких прикладах, матеріал містить інструкції про те, що приблизно 400 мг цефтароліну або його проліків може бути відновлено з використанням приблизно 2 мл розріджувача й використовуватися для внутрішньом'язового введення. В інших ілюстративних варіантах здійснення, матеріал містить інструкції про те, що приблизно 600 мг цефтароліну або його проліків може бути відновлено з використанням приблизно 2 мл розріджувача й використовуватися для внутрішньом'язового введення. Для продуктів, таких як заморожені мішки й попередньо заповнені шприци, матеріал може включати інструкції відносно розморожування замороженого мішка або замороженого шприца перед введенням. У подальших варіантах здійснення, матеріал може мати інструкції відносно розведення композиції за допомогою сумісного розріджувача перед введенням. У деяких варіантах здійснення, способи включають забезпечення лікарської форми, яка містить від приблизно 100 мг до приблизно 1200 мг цефтароліну або його проліків пацієнтові, який цього потребує, і інформування пацієнта про те, що лікарська форма протипоказана пацієнтам з відомою важкою підвищеною чутливістю або пацієнтам, у яких була анафілактична реакція на бета-лактами. У подальших варіантах здійснення, пацієнт може бути інформований відносно того, що були 14 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 описані важкі й іноді смертельні алергічні (анафілактичні) реакції й важкі шкірні реакції в пацієнтів, що одержували бета-лактамні антибіотики, і що такі реакції більш імовірно можуть спостерігатися в особин із чутливістю на множинні алергени в анамнезі. У деяких варіантах здійснення, може бути необхідне ретельне опитування для визначення того, чи була чи в суб'єкта, що піддається лікуванню, попередня алергічна реакція на інші карбапанеми, цефалоспоріни, пеніциліни або інші алергени, перед початком лікування. У деяких варіантах здійснення, пацієнта інструктують відносно скасування лікарського засобу, якщо спостерігається алергічна реакція. У деяких варіантах здійснення, способи включають забезпечення лікарської форми, яка містить від приблизно 100 мг до приблизно 1200 мг цефтароліну або його проліків, і забезпечення інформації відносно взаємодії цефтароліну або його проліків з іншими антимікробними засобами. Наприклад, способи можуть включати інформування про те, що відсутній антагонізм між цефтароліном або його проліками і іншими загальноприйнятими використовуваними антибактеріальними засобами. Приклади таких антибактеріальних засобів, включають, але не обмежуючись тільки ними, ванкоміцин, лінезолід, даптоміцин, левофлоксацин, азитроміцин, амікацин, азтреонам, тигециклін, і меропенем. У деяких варіантах здійснення, способи можуть включати забезпечення інформації про те, що існує синергізм між цефтароліном і іншими антимікробними засобами. Наприклад, може забезпечуватися інформація про те, що продемонстрований синергізм між цефтароліном або його проліками і антибактеріальним або антимікробним засобом, наприклад, амікацином. Приклади інших антибактеріальних засобів, включають, але не обмежуючись тільки ними, ванкоміцин, лінезолід, даптоміцин, левофлоксацин, азитроміцин, азтреонам, тигециклін, і меропенем. Якщо спеціально не вказане інакше, то всі технічні й наукові терміни, використовувані в даній заявці, звичайно мають такі ж значення, як і загальноприйняте розуміється кваліфікованим фахівцем в галузі техніки, до якої належить даний винахід. Термін “проліки” означає сполуку, яка являє собою попередник лікарського засобу, який при введенні суб'єктові піддається хімічного перетворення за допомогою метаболічного або хімічного процесу, з одержанням сполуки, яка являє собою активний компонент. Підходящі проліки цефтароліну включають, але не обмежуючись тільки ними похідні фосфоноцефему, такі як, наприклад, 7-[2(Z)-етоксііміно-2-(5-фосфоноаміно-1,2,4-тіадіазол-3-іл)ацетамідо]-3-[4-(1метил-4-піридиніо)-2-тіазолілтіо]-3-цефем-4-карбоксилат. Можуть утворюватися сольвати сполуки, якщо молекула (и) розчинника інкорпоруються в кристалічні ґрати структури молекули цефтароліну або його проліків, при здійсненні, наприклад, процесу кристалізації. Підходящі сольвати включають, наприклад, гідрати (моногідрат, півторагідрат, дигідрат), сольвати з органічними сполуками (наприклад, CH 3CO2H, CH3CH2CO2H, CH3CN), і їх комбінації. Термін “складається по суті з”, як використовується в даній заявці по відношенню до композицій або лікарських форм, означає, що цефтаролін або його проліки (наприклад, цефтаролін фозаміл) являє собою єдиний активний компонент у композиціях або лікарських формах. “Активний компонент”, як використовується в даній заявці, стосується антимікробного засобу або антибактеріального засобу або засобу, який ефективний для лікування бактеріальної інфекції. Термін “приблизно” або “близько” означає значення в межах припустимого інтервалу похибок для конкретного значення, як визначається фахівцем у даній галузі техніки, яке буде залежати, зокрема, від того, як значення вимірюється або визначається, тобто, обмеженнями системи вимірювання. Наприклад, “приблизно” може означати значення в межах 1 або більше, ніж 1 стандартне відхилення, згідно із практикою в даній галузі. Альтернативно, “приблизно” по відношенню до композицій може означати значення плюс або мінус діапазон аж до 20%, переважно аж до 10%, більш переважно аж до 5%. Альтернативно, особливо стосовно біологічних систем або процесів, термін може означати значення в межах порядку величини, переважно в межах 5-кратного, і більш переважно в межах 2-кратного, значення. Якщо кращі значення описані в заявці й пунктах формули винаходу, то, якщо спеціально не вказане інакше, термін “приблизно” означає середнє значення в межах припустимого інтервалу похибок для конкретного значення. Наприклад, якщо згадується період часу, наприклад, годинник, то представлені значення (± 20%) є більш застосовними. Таким чином, 6 годин може являти собою, наприклад, 4,8 годин, 5,5 годин, 6,5 годин, 7,2 години, а також звичайно 6 годин. Терміни “лікування,” “лікувати,” і “лікований” стосується одного або більше наступних понять: зменшення або полегшення принаймні одного симптому бактеріальної інфекції в суб'єкта; зменшення або полегшення інтенсивності та/або тривалості прояву бактеріальної інфекції, яка спостерігається в суб'єкта; і зупинка, уповільнення початку (тобто, періоду перед клінічним 15 UA 110098 C2 5 10 15 20 проявом інфекції) і/або зменшення ризику розвитку або погіршення бактеріальної інфекції. Термін “позалікарняна пневмонія”, як використовується в даній заявці є еквівалентним і може використовуватися взаємозамінно з терміном “позалікарняна бактеріальна пневмонія.” Термін "терапевтично ефективна" по відношенню до дози або кількості стосується такої кількості сполуки або фармацевтичної композиції, якої достатньо для забезпечення бажаної активності при введенні ссавцеві, який цього потребує. “Ефективна кількість” означає кількість сполуки відповідно до винаходу, якої, при введенні пацієнтові для лікування інфекції або захворювання, достатньо для здійснення такого лікування. “Ефективна кількість” буде змінюватися залежно від активного компонента, стану інфекції, захворювання або стану, що піддається лікуванню, і його тяжкості, і віку, ваги, фізичного стану й сприйнятливості ссавця, що піддається лікуванню. Приклади Наступні приклади бути тільки ілюстративними для даного винаходу й не повинні розглядатися як так чи інакше обмежуючі обсяг, а також різні варіанти й еквіваленти, які охоплюються даним винаходом, будуть очевидними для фахівців у даній галузі при прочитанні даного опису. Приклад 1 Проліки, цефтаролін фозаміл, швидко перетворюється в біологічно активний цефтаролін у плазмі. Середні значення фармакокінетичних параметрів цефтароліну в дорослих з нормальною функцією нирок після однократних і багаторазових 60-хвилинних в/в інфузій 600 мг цефтаролін фозамілу, що вводиться кожні 12 годин, узагальнено в таблиці 1. Стандартне відхилення представлене в дужках. Фармакокінетичні характеристики були подібними для введення однократної й багаторазової дози. Таблиця 1 Середні значення фармакокінетичних параметрів цефтароліну IV у дорослих Параметр Cmax (мкг/мл) AUC (мкггод/мл) * t 1/2 (ч) CL/Fm (л/год) Однократна доза 600 мг, яку вводили у вигляді 60 хвилинної інфузії 19,0 (0,71) 56,8 (8,94) 1,60 (0,38) 9,58 (1,85) Багаторазові дози 600 мг, які вводили кожні 12 годин у вигляді 60 хвилинних інфузій 21,3 (4,10) 56,2 (8,90) 2,66 (0,40) 9,60 (1,40) *AUC0-∞ для введення однократної дози, AUC0-tau для введення багаторазової дози 25 30 35 40 45 Cmax і AUC цефтароліну підвищувалися приблизно пропорційно до підвищення дози в межах інтервалу дозування 50-1000 мг. Не спостерігали помітного накопичення цефтаролін фозамілу або цефтароліну після багаторазових в/в інфузій 600 мг, які вводили кожні 8 або 12 годин аж до 14 днів у суб'єктів з нормальною функцією нирок. Зв'язування цефтароліну з білком плазми крові було низьким (приблизно 20%) і знижувалося тільки незначно при підвищенні концентрацій. Проліки, цефтаролін фозаміл, швидко перетворювалися в біологічно активний цефтаролін у плазмі, і вважаються, що перетворення опосередковується фосфатазним ферментом. Після цього відбувається гідроліз бета-лактамного кільця цефтароліну з утворенням мікробіологічно неактивного, метаболіту із цефтароліну відкритим кільцем M-1. Середнє співвідношення в плазмі цефтароліну M-1 до цефтароліну AUC після однократної 600 мг в/в інфузії цефтаролін фозамілу в здорових суб'єктів становило приблизно 20-30%. В об'єднаних мікросомах печінки людину, спостерігали низький (< 12%) метаболічний кругообіг для цефтаролін фозамілу й цефтароліну. Ці дослідження вказують на те, що малоймовірно, що ферменти печінки CYP450 суттєво метаболізують цефтаролін фозаміл або цефтаролін. Цефтаролін і його метаболіти головним чином елімінуються нирками. Середнє значення кінцевого елімінаційного періоду напіввиведення цефтароліну у здорових дорослих суб'єктів з нормальною функцією нирок склав приблизно 2,5 години. Після введення однократної 600 мг в/в дози радіоактивно міченого цефтаролін фозамілу в дорослих самців, приблизно 87% радіоактивності відновлювалося в сечі й 6% у фекаліях. Більша частина радіоактивності (~90%) відновлювалася протягом 48 годин. З радіоактивності, відновленої в сечі, приблизно 64% екскретувалось у вигляді цефтароліну й приблизно 2% у 16 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 вигляді цефтаролін-M-1. Специфічні популяції Після введення однократної 600 мг внутрішньовенної дози цефтаролін фозамілу, середнє значення AUC цефтароліну в суб'єктів зі слабкої (50 мл/хв < CrCl ≤ 80 мл/хв) або помірної (30 мл/хв 80 мл/хв). Після введення однократної 400 мг внутрішньовенної дози цефтаролін фозамілу, середнє значення AUC цефтароліну в суб'єктів з важкою (CrCl ≤30 мл/хв) нирковою недостатністю підвищувалося на 115% порівнянню із середніми значеннями в здорових суб'єктів з нормальною функцією нирок. Однократну 400 мг дозу цефтаролін фозамілу вводили суб'єктам з термінальною стадією ниркової недостатності (ESRD) або за 4 години до або 1 година після гемодіалізу (HD). Середнє значення AUC цефтароліну після перед- і пост-HD інфузії підвищувалося приблизно на 89% і 167%, відповідно, у порівнянні із середніми значеннями в здорових суб'єктів з нормальною функцією нирок. Середнє значення відновленого цефтароліну в діалізаті після 4-х годинної HD сесії становило 76,5 мг, або 21,6% дози, що вводиться. Після введення 600 мг внутрішньовенної дози цефтаролін фозамілу здоровим літнім суб'єктам (≥ 65 років), середнє значення AUC цефтароліну було незначне вище (~33%) у порівнянні зі значенням у більш молодих дорослих суб'єктів (18-45 років). Cmax суттєво не відрізнялося між літніми й більш молодими суб'єктами. Відмінність в AUC пов’язана зі зниженою нирковою функцією в літніх суб'єктів і, вважається, не є клінічно значимим. Фармакокінетику цефтароліну оцінювали в пацієнтів-підлітків (вік 12-17) з нормальною функцією нирок. Середні значення Cmax і AUC для цефтароліну, які спостерігалися в суб'єктівпідлітків, які одержували 8 мг/кг цефтаролін фозамілу (або 600 мг для суб'єктів з вагою > 75 кг) становили приблизно на 10% і 23% менше, ніж значення, які спостерігалися в дорослих суб'єктів після введення дози 600 мг цефтаролін фозамілу. Стать У фазі 1 досліджень у здорових суб'єктів, Cmax і AUC для цефтароліну були подібними між особинами чоловічої й жіночої статей, хоча спостерігалася тенденція для незначно більш високого AUC (6-15%) і Cmax (17-22%) у суб'єктів жіночої статі. При аналізі даних популяційної фармакокінетики для фази 1, 2 і 3 клінічних досліджень не було ідентифіковано клінічно значимих підвищень експозиції цефтароліну залежно від підлоги. Не був потрібний підбір дози залежно від підлоги. Взаємодії лікарських засобів In vitro дослідження на мікросомах печінки людини свідчили про те, що ні цефтаролін фозаміл, ні цефтаролін не інгібують основні цитохромні P450 ізоферменти CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 і CYP3A4. In vitro дослідження на гепатоцитах людину також вказували на те, що цефтаролін фозаміл, цефтаролін, і його неактивний метаболіт з відкритим кільцем не є індукторами CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, або CYP3A4/5. Таким чином, не очікують, що цефтаролін фозаміл буде інгібувати або знижувати кліренс лікарських засобів, які метаболізуються за допомогою цих метаболічних шляхів клінічно релевантним способом. У пробному популяційному PK аналізі не було ідентифіковано яких-небудь клінічно релевантних підвищень експозиції цефтароліну (Cmax і AUC) у пацієнтів з cSSSI або CABP, які приймали супутні лікарські засоби, які є відомими інгібіторами, індукторами, і субстратами системи цитохром P450. Таким чином, у даному прикладі встановлено, що цефтаролін і його проліки (наприклад, цефтаролін фозаміл) є несподівано й непередбачено безпечними й ефективними для лікування бактеріальних інфекцій, включаючи позалікарняну пневмонію й cSSSI. Приклад 2 У цілому 1396 дорослих із клінічно задокументованими ускладненими інфекціями шкіри й підшкірної клітковини (cSSSI) включали у два рандомізованих, багатоцентрових, багатонаціональних, подвійних сліпих, дослідження для порівняння 600 мг цефтаролін фозамілу, що вводиться внутрішньовенно протягом 1 години кожні 12 годин, з ванкоміцином плюс азтреонам [1 г ванкоміцину вводили внутрішньовенно протягом 1 години, після цього вводили 1 г азтреонаму внутрішньовенно протягом 1 години кожні 12 годин]. У дослідження включали пацієнтів з cSSSI (глибокий/поширений целюліт, великий абсцес, ранева інфекція [хірургічна або травматична], інфіковані укуси комах, опіки або виразки, інфекції нижніх кінцівок у пацієнтів із цукровим діабетом або захворюванням периферичних судин). Тривалість лікування становила від 5 до 14 днів. Перемикання на пероральну терапію не дозволялося. 17 UA 110098 C2 5 10 Модифікована популяція всіх включених у дослідження пацієнтів (MITT) включала всіх пацієнтів, які одержували будь-яку кількість досліджуваного лікарського засобу відповідно до їх рандомізованої лікованої групи. Клінічно оцінювана (CE) популяція включала пацієнтів в MITT популяції, які проявляли достатнє дотримання протоколу. Основним критерієм оцінки ефективності була клінічна відповідь при візиті для оцінки ефективності лікування (TOC) у складених первинних CE і MITT популяціях (таблиця 2). Цефтаролін не був нижче відносно ванкоміцину плюс азтреонам. При аналізі підгрупи (CE популяції), на порівняльні клінічні показники ефективності лікування між групою цефтароліну й групою ванкоміцин плюс азтреонам не впливали вік, стать, расова, етнічна приналежність, або вага. Клінічні показники ефективності лікування в TOC, викликаного патогеном, у мікробіологічно оцінюваній (ME) популяції представлено в таблиці 3. Таблиця 2 Клінічні показники ефективності лікування в TOC для двох фаз 3 дослідженні в cSSSI після терапії протягом 5-14 днів Цефтаролін фозаміл n/N (%) Інтегровані дослідження CE MITT cSSSI дослідження 1 CE MITT cSSSI дослідження 2 CE MITT Ванкоміцин/ Азтреонам n/N (%) Відмінність між лікуванням (2-стороннє 95% CI) 559/610 (91,6) 595/693 (85,9) 549/592 (92,7) 586/685 (85,5) -1,1 (-4,2, 2,0) 0,3 (-3,4, 4,0) 288/316 (91,1) 304/351 (86,6) 280/300 (93,3) 297/347 (85,6) -2,2 (-6,6, 2,1) 1,0 (-4,2, 6,2) 271/294 (92,2) 291/342 (85,1) 269/292 (92,1) 289/338 (85,5) 0,1 (-4,4., 4,5) -0,4 (-5,8, 5,0) Таблиця 3 Клінічні показники ефективності лікування інфікування патогеном для мікробіологічно оцінюваних пацієнтів з cSSSI (Дані для двох інтегрованих досліджень фази 3) Цефтаролін фозаміл n/N (%) Грампозитивні: Staphylococcus aureus MSSA (чутливі до метициліну) MRSA (резистентні до метициліну) Streptococcus pyogenes Streptococcus agalactiae Streptococcus dysgalactiae a Група Streptococcus anginosus Грамнегативні: Escherichia coli Klebsiella pneumoniae Klebsiella oxytoca Morganella morganii 15 20 a Ванкоміцин/Азтреонам n/N (%) 352/378 (93,1%) 212/228 (93,0%) 142/152 (93,4%) 56/56 (100%) 21/22 (95,5%) 13/13 (100%) 12/13 (92,3%) 336/356 (94,4%) 225/238 (94,5%) 115/122 (94,3%) 56/58 (96,6%) 18/18 (100%) 15/16 (93,8%) 15/16 (93,8%) 20/21 (95,2%) 17/18 (94,4%) 10/12 (83,3%) 11/12 (91,7%) 19/21 (90,5%) 13/14 (92,9%) 6/6 (100%) 5/6 (83,3%) включаючи S. anginosus, S. intermedius, і S. constellatus. Приклад 3 У цілому 1240 дорослих з діагнозом позалікарняна бактеріальна пневмонія (CABP) включали у два рандомізованих, багатоцентрових, багатонаціональних, подвійних сліпих, дослідження (дослідження 1 і 2) для порівняння цефтаролін фозамілу (600 мг, які вводили внутрішньовенно протягом 1 години кожні 12 годин) із цефтріаксоном (1 г цефтріаксону, який вводили внутрішньовенно протягом 0,5 години кожні 24 години). В обидвох лікованих групах 18 UA 110098 C2 5 10 15 CABP дослідження 1, дві дози перорально кларитроміцину (500 мг кожні 12 годин), вводили як додаткову терапію, починаючи в день дослідження 1. Не використовували додаткової терапії макролідами в CABP дослідженні 2. Пацієнтів з новим (і) або прогресуючим (і) легеневим (і) інфільтратом (ами) на рентгенографії органів грудної клітки й клінічні ознаки й симптоми, що вказують на CABP, з необхідністю госпіталізації й в/в терапії записували в дослідженнях. Тривалість лікування становила від 5 до 7 днів. Перемикання на пероральну терапію не дозволялося. Модифікована популяція всіх включених у дослідження пацієнтів (MITTE) включала всіх пацієнтів, які одержували будь-яку кількість досліджуваного лікарського засобу відповідно до їх рандомізованої лікованої групи й була в PORT (команда досліджень результатів пневмонії) класі ризику III або IV. Клінічно оцінювана (CE) популяція включала пацієнтів в MITTE популяції, які проявляли достатнє дотримання протоколу. Основним критерієм оцінки ефективності була клінічна відповідь при візиті для оцінки ефективності лікування (TOC) у складених первинних CE і MITTE популяціях (таблиця 4). При аналізі підгрупи (CE популяція), на порівняльні клінічні показники ефективності лікування між групою цефтароліну й групою цефтріаксону не впливали вік, стать, расова, етнічна приналежність, або вага. Клінічні показники ефективності лікування в TOC, викликаного патогеном, у мікробіологічно оцінюваній (ME) популяції представлено в таблиці 5. Таблиця 4 Клінічні показники ефективності лікування в TOC для двох фаз 3 дослідження в CABP після терапії протягом 5-7 днів Цефтаролін фозаміл n/N (%) Інтегровані дослідження CE MITTE CABP дослідження 1 CE MITTE CABP дослідження 2 CE MITTE Цефтріаксон n/N (%) Відмінність між лікуванням (2-стороннє 95% CI) 387/459 (84,3%) 479/580 (82,6%) 349/449 (77,7%) 439/573 (76,6%) 6,7 (1,6, 11,8) 6,0 (1,4, 10,7) 194/224 (86,6%) 244/291 (83,8%) 183/234 (78,2%) 233/300 (77,7%) 8,4 (1,4, 15,4) 6,2 (-0,2, 12,6) 193/235 (82,1%) 235/289 (81,3%) 166/215 (77,2%) 206/273 (75,5%) 4,9 (-2,5, 12,5) 5,9 (-1,0, 12,7) Таблиця 5 Клінічні показники ефективності лікування інфікування патогеном для мікробіологічно оцінюваних пацієнтів з CABP (Дані для двох інтегрованих клінічних досліджень фази 3) Цефтаролін фозаміл n/N (%) Грампозитивні: Streptococcus pneumoniae a MDRSP (резистентні до багатьох лікарських засобів ) Staphylococcus aureus MSSA (чутливі до метициліну) Грамнегативні: Haemophilus influenzae Haemophilus parainfluenzae Escherichia coli Klebsiella pneumoniae 20 a Цефтріаксон n/N (%) 54/63 (85,7%) 41/59 (69,5%) 4/4 (100%) 18/25 (72,0%) 18/25 (72,0%) 1/4 (25,0%) 15/27 (55,6%) 14/25 (56,0%) 15/18 (83,3%) 17/20 (85,0%) 16/16 (100%) 10/12 (83,3%) 13/13 (100%) 15/17 (88,2%) 9/12 (75,0%) 10/12 (83,3%) MDRSP ізоляти являють собою штами S. pneumoniae, резистентні принаймні до двох або більше з наступних антибактеріальних класів: пеніциліни, макроліди, тетрацикліни, фторхінолони, хлорамфенікол, триметоприм-сульфаметоксазол, і цефалоспоріни другої генерації. 25 Приклад 4 19 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 У фазі 3, багатоцентрове, рандомізоване, подвійне сліпе, порівняльне дослідження здійснювали для оцінки безпеки й ефективності цефтароліну відносно цефтріаксону для лікування дорослих суб'єктів із позалікарняної пневмонією (CAP). Основними завданнями дослідження було визначення не меншої ефективності в клінічних показниках ефективності лікування для цефтароліну в порівнянні з такими для цефтріаксону при оцінці ефективності лікування (TOC) у клінічно оцінюваній (CE) і модифікованій ефективності для всіх включених у дослідження пацієнтів (MITTE) популяцій у дорослих суб'єктів з CAP. Додатковими завданнями дослідження була оцінка наступних параметрів: клінічна відповідь наприкінці терапії (EOT); мікробіологічно сприятливий показник результату в TOC; сумарний (клінічний і рентгенографічний) показник ефективності в TOC; клінічна й мікробіологічна відповідь на патоген в TOC; клінічний рецидив для пізніх віддалених результатів (LFU); мікробіологічне повторне інфікування/ повторний прояв в LFU; і безпека. 317 суб'єкт рандомізували для цефтароліну й 310 суб'єктів рандомізували для цефтріаксону (популяція для всіх включених у дослідження пацієнтів [ITT]). 315 суб'єктів знаходилися в групі для цефтароліну й 307 суб'єктів знаходилися в групі для цефтріаксону, модифікованій популяції для всіх включених у дослідження пацієнтів (MITT) або популяції для визначення безпеки. Наступні популяції аналізували відносно ефективності: Модифікована популяція визначення ефективності для всіх включених у дослідження пацієнтів (MITTE): 289 (цефтаролін) і 273 (цефтріаксон); Клінічно оцінювана (CE) популяція: 235 (цефтаролін) і 215 (цефтріаксон); Мікробіологічно модифікована популяція для всіх включених у дослідження пацієнтів (mMITT): 99 (цефтаролін) і 102 (цефтріаксон); Мікробіологічно модифікована популяція визначення ефективності для всіх включених у дослідження пацієнтів (mMITTE): 90 (цефтаролін) і 88 (цефтріаксон); і Мікробіологічно оцінювана (ME) популяція: 85 (цефтаролін) і 76 (цефтріаксон). Критеріями для включення були: 1. Суб'єктами були особини чоловічої й жіночої статей у віці 18 років або старше. 2. Суб'єкти мали позалікарняну пневмонію, що відповідає наступним критеріям: I. Рентгенографічно підтверджена пневмонія (новий або прогресуючий інфільтрат (и) легенів) на рентгенограмі грудної клітки [CXR] або комп'ютерної томографії грудної клітки [CT], що вказує на бактеріальну пневмонію); і II. Гостре захворювання (тривалість ≤ 7 днів) принаймні із трьома наступними клінічними ознаками або симптомами, що вказують на інфекцію нижніх дихальних шляхів: новий кашель або кашель, що підсилюється; гнійне мокротиння або зміна характеру мокротиння; дані аускультації, що вказують на пневмонію (наприклад, хрипи, егофонія, виявлення ущільнень); задишка, часте дихання, або гіпоксемія (O2 насичення < 90% у кімнатнім повітрі або pО2 38,5°С ректально або в барабанній порожнині) або гіпотермія (< 35°C); кількість лейкоцитів (WBC) більше, ніж 10,000 3 3 клітин/мм або менше, ніж 4,500 клітин/мм ; і більше, ніж 15% незрілих нейтрофілів (смуги) незалежно від кількості WBC; і III. PORT оцінка більше, ніж 70 і менше, ніж або рівна 130 ( тобто, PORT клас ризику III або IV). 3. Суб'єкт потребував початкової госпіталізації, або лікування в пункті невідкладної медичної допомоги або термінового амбулаторного лікування, згідно зі стандартами лікування. 4. Інфекцію в суб'єкта необхідно первинно лікувати за допомогою в/в антибіотиків. 5. Пацієнти жіночої статі в репродуктивному віці, і ті, у яких пройшло менше двох років після настання менопаузи, погоджувалися й виконували запропоноване використання високоефективних методів контрацепції (тобто презерватив плюс сперміцид, комбіновані пероральні протизаплідні засоби, імплант, ін'єкований, постійний внутрішньоматковий протизаплідний засіб, утримання від полового життя, або вазектомінізований партнер) під час участі в даному дослідженні. 6. Суб'єкти підписували письмову інформовану згоду й демонстрували готовність і здатність виконувати всі процедури дослідження. Наступні критерії використовували для виключення: 1. PORT оцінка менше, ніж або рівна 70 (PORT клас ризику I або II), PORT оцінка більше, ніж 130 (PORT клас ризику V), або необхідність перекладу в реанімаційне відділення. 2. CAP придатність для амбулаторної терапії із застосуванням перорального антимікробного засобу. 3. Підтверджені або передбачувані інфекції дихальних шляхів, пов'язані з іншими джерелами, що відрізняються від позалікарняних бактеріальних патогенів (наприклад, 20 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 вентиляторно-асоційована пневмонія; внутрішньолікарняна пневмонія; видима/велика аспіраційна пневмонія; передбачувана вірусна, грибкова або мікобактеріальна інфекція легенів). 4. Неінфекційні причини інфільтратів легенів (наприклад, емболія легенів, хімічна пневмонія після аспірації, алергічний альвеоліт, застійна серцева недостатність). 5. Емпієма плеври (не включаючи негнійні парапневмонічні ефузії). 6. Мікробіологічно задокументована інфекція, викликана патогеном, для якого відома резистентність до цефтріаксону, або епідеміологічна або клінічна ситуація, яка припускає високу ймовірність резистентного до цефтріаксону “типового” бактеріального патогену (наприклад, Pseudomonas aeruginosa, резистентні до метициліну Staphylococcus aureus [MRSA]). Епідеміологічні повідомлення про потенційну MRSA інфекції, яка охоплює проживаючих в інтернаті для старих або інтернаті для проживання старих людей з особливими потребами, існування постійних локальних спалахів MRSA інфекції, відоме інфікування шкіри з MRSA, недавні шкірні інфекції або інфекції шкірних структур, обумовлені MRSA, внутрішньовенне застосування лікарських засобів, супутній грип. Суб'єктів з факторами ризику для MRSA інфекції, у яких переважали грампозитивні коки в скупченнях при фарбуванні мокротиння за Грамом, виключали. 7. Інфекції, викликані атиповим організмом (M. pneumoniae, C. pneumoniae, види Legionella) підтверджували або припускали на основі епідеміологічної ситуації, або інфекції, викликані Legionella pneumophila, підтверджували за допомогою тесту антигену в сечі на вихідному рівні. 8. Попереднє лікування за допомогою антимікробного засобу для CAP протягом 96 годин перед рандомізацією. Застосовували наступні виключення: Суб'єкти могли бути визнані придатними, незважаючи на попередню антимікробну терапію, якщо вони відповідали наступним критеріям: або однократна доза перорально або внутрішньовенно антибіотика короткочасної дії для CAP або обидва з наступних: однозначні терапевтичні дані неефективності лікування (наприклад, погіршення ознак і симптомів) протягом принаймні 48 годин попередньої системної антимікробної терапії й виділення організму, резистентного до попередньої системної антимікробної терапії. 9. Неефективність цефтріаксону (або іншого цефалоспоріну третього покоління) як терапія для цього епізоду CAP або попереднє виділення організму, пов'язаного із цим епізодом CAP і резистентного in vitro до цефтріаксону. 10. В анамнезі будь-яка гіперчутлива або алергічна реакція на будь-який β-лактамний антибіотик. 11. Раніше або зараз в історії хвороби епілепсія або епілептичне порушення. Виключення: переконливо підтверджені фебрильні судоми в дитячому віці. 12. Необхідність супутньої антимікробної або системної протигрибкової терапії за будьякими підставами. Виключення: Місцева протигрибкова або антимікробна терапія, одинична пероральна доза будь-якого протигрибкового засобу для лікування вагінального кандидозу. 13. Пухлинне захворювання легенів, кістозний фіброз, прогресуюче смертельне захворювання, хронічне неврологічне порушення, що запобігає очищення легеневої секреції, або тривалість життя менше, ніж або рівна 3 місяці. 14. Введення пробенециду протягом 3 днів перед початком дослідження терапії лікарським засобом або необхідність супутньої терапії із застосуванням пробенециду. 15. Інфекції або стани, при яких необхідно супутнє системне введення кортикостероїдів. Виключення: Еквівалент дози кортикостероїду становить менше, ніж 40 мг преднізону на добу. 16. Важке порушення функції нирок (CrCl ≤ 30 мл/хв), оцінюване згідно з формулою Кокрофта-Голта. 17. Ознаки істотного печінкового, гематологічного або імунологічного захворювання, визначеного згідно з наступними критеріями: відомий гострий вірусний гепатит; рівень аспартатамінотрансферази (AST) або аланінамінотрансферази (ALT) більше, ніж в 10 разів верхньої межі норми або загальний білірубін більше, ніж в 3 рази верхньої межі норми; прояву кінцевої стадії захворювання печінки, такого як асцит або гепатична енцефалопатія; 3 нейтропенія, обумовлена як менше, ніж 500 нейтрофілів/мм , яка є поточною або 3 прогнозованою; тромбоцитопенія з кількістю тромбоцитів менше, ніж 60 тис. клітин/мм ; відомі інфекції, викликані вірусом імунодефіциту людину, і або кількість CD4 менше, ніж або рівно 200 3 клітин/мм в останньому вимірюванні або діагноз іншого набутого імунодефіциту й синдромвизначальне захворювання, яке є поточним. 18. Ознаки захворювання, безпосередньо небезпечного для життя, яке є поточним або наближається, включаючи, але не обмежуючись тільки ними, дихальну недостатність, гостру 21 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 серцеву недостатність, шок, гострий коронарний синдром, нестабільні аритмії, гіпертонічний криз, гостру печіночну недостатність, активну шлунково-кишкову кровотечу, глибокі метаболічні аномалії (наприклад, діабетичний кетоацидоз), або гострі порушення мозкового кровообігу. 19. Перебування в інтернаті для старих або інтернаті для проживання старих людей з особливими потребами, який забезпечує 24-х годинне медичне спостереження (не включаючи поліпшених життєвих умов для амбулаторних літніх пацієнтів) або госпіталізація протягом 14 днів перед початком симптомів (тобто, пневмонія, пов'язана з наданням медичної допомоги). 20. Жінки в період вагітності або годування грудьми. 21. Участь у будь-якому дослідженні, що включає введення дослідницького засобу або обладнання протягом 30 днів перед рандомізацією у дане дослідження або попередня участь у даному дослідженні. 22. Попередня участь у дослідженні цефтароліну. 23. Нездатність або небажання дотримуватися процедур і обмежень, специфічних для дослідження 24. Будь-який стан, який, на думку дослідника, буде впливати на безпеку суб'єкта або якість даних. Досліджуваний лікарський засіб: Цефтаролін фозаміл вводили у дві послідовні 300 мг внутрішньовенні (в/в) інфузіях протягом 30 хвилин, кожні 12 годин (кожні 12 годин). 600 мг дозу цефтаролін фозамілу, яку інфузували протягом 60 хвилин, розділяли на дві інфузії для збереження «сліпоти» дослідження. Для суб'єктів з помірною нирковою недостатністю (30 мл/хв 50 мл/хв). Тривалість лікування становила від 5 до 7 днів. Порівняльний лікарський засіб: Цефтріаксон вводили у вигляді 1 г в/в інфузії протягом 30 хвилин з наступним в/в сольовим плацебо, інфузованим протягом 30 хвилин, кожні 24 години (к24год). Через двадцять чотири години після кожної дози цефтріаксону й сольового плацебо ( тобто, між дозами цефтріаксону), суб'єкти одержували дві послідовні інфузії сольового плацебо, кожну інфузували протягом 30 хвилин кожні 24 години для збереження «сліпоти» дослідження. Для оцінки використовували наступні критерії: Первинними показниками результатів ефективності були клінічний для суб'єкта показник ефективності лікування при оцінці ефективності лікування (TOC) в CE і MITTE популяціях. Суб'єктів розглядали клінічно вилікуваними в TOC, якщо в них спостерігався загальне вирішення усіх ознак і симптомів вихідної інфекції, або поліпшення інфекції таким чином, що не було необхідності в подальшій антимікробній терапії. Вторинними показниками результатів ефективності були: Клінічний для суб'єкта показник ефективності лікування в EOT в MITTE і CE популяціях; Для суб'єкта мікробіологічно сприятливий показник результату (знищення або передбачуване знищення) в TOC в mMITT, mMITTE, і ME популяціях; Сумарний (комбінований і рентгенографічний) показник ефективності в TOC в MITTE і CE популяціях; Для патогену клінічний показник ефективності лікування й мікробіологічно сприятливий показник результату в TOC в mMITTE і ME популяціях; Для суб'єкта частота рецидивів в LFU у піднаборі суб'єктів в CE і MITTE популяціях, які були клінічно вилікуваними в TOC; і Для суб'єкта рівень повторної інфекції або рецидивів в LFU у піднаборі суб'єктів в mMITTE і ME популяціях, які мали сприятливий клінічний або мікробіологічний результат (знищення або передбачуване знищення) в TOC. Усі суб'єкти, які одержували будь-яку кількість досліджуваного лікарського засобу, включали в аналіз безпеки. Оцінка безпеки включала моніторинг побічних явищ (AE) аж до TOC і важких побічних явищ (SAE) за допомогою LFU; запис основних показників стану організму, медичний огляд, електрокардіограма (ECG), і дані клінічних лабораторних аналізів (клінічна біохімія, гематологія, і аналіз сечі), у заздалегідь установлені періоди часу в процесі здійснення дослідження. Одержували фармакокінетичні (PK) зразки від приблизно 120 до 140 суб'єктів, лікованих за допомогою цефтароліну або цефтріаксону, у день дослідження 3. PK зразки збирали для обох груп цефтароліну й цефтріаксону для підтримки «сліпоти» дослідження, але тільки PK зразки від суб'єктів у групі цефтароліну аналізували (використовуючи валідований аналіз) за допомогою відкритої центральної біоаналітичної лабораторії. Основним завданням даного дослідження було визначення не меншої ефективності в 22 UA 110098 C2 5 10 15 20 25 30 35 клінічних показниках ефективності лікування для цефтароліну в порівнянні з такими для цефтріаксону в TOC в CE і MITTE популяціях у дорослих суб'єктів з CAP. Було сім досліджуваних популяцій, шість із яких статистично аналізували. 1. Популяція всіх включених у дослідження пацієнтів (ITT) включала всіх рандомізованих суб'єктів і не аналізувалася. 2. MITT популяція включала всіх рандомізованих суб'єктів, які одержували будь-яку кількість досліджуваного лікарського засобу. 3. MITTE популяція складалася із усіх суб'єктів в MITT популяції в PORT класі ризику III або IV. 4. MMITT популяція складалася із усіх суб'єктів в MITT популяції, які відповідали мінімальним критеріям захворювання для CAP і які мали принаймні один типовий бактеріальний організм, що відповідає CAP патогену, ідентифікованому з підходящого мікробіологічного зразка (наприклад, кров, мокротиння, плевральний випіт). Суб'єкти з Mycoplasma pneumoniae або Chlamydophila pneumoniae як єдиний збудник інфекції, і всі суб'єкти з L. pneumophila інфекцією виключалися з mMITT популяції. 5. MMITTE популяція складалася із суб'єктів в mMITT популяції, але крім суб'єктів в PORT класі ризику II. 6. CE популяція складалася із усіх суб'єктів в MITTE популяції, які відповідали всім оцінним критеріям і від яких була доступна достатня інформація відносно CAP для визначення результату для суб'єкта (тобто, суб'єкт не мав невизначеного результату). 7. ME популяція представляла піднабір CE і mMITTE популяцій і включала кожного суб'єкта в CE популяції, який мав принаймні один «типовий» бактеріальний патоген, виділений з підходящого мікробіологічного зразка. Двосторонній 95% довірчий інтервал (CI) для спостережуваного відмінності в основному критерії ефективності (клінічний показник ефективності лікування) між групою цефтароліну й групою цефтріаксону розраховували для тих суб'єктів з PORT класу ризику III або IV. Робили висновок про не меншу ефективність, якщо нижня межа 95% CI була вище - 10%. Враховуючи точкову оцінку для клінічного показника ефективності лікування в CE популяції 90% у групі цефтріаксону, і 90% у групі цефтароліну, межа не меншої ефективності 10%, потужність 90% і 25% неоцінюваний показник, і що приблизно 76 суб'єктів в PORT класі ризику II було зареєстровано, була потрібна загальна вибірка 626 суб'єктів (313 суб'єктів у кожній лікованій групі). Вторинні результати ефективності аналізували шляхом визначення двосторонніх 95% CI для спостережуваного відмінності в показниках результатів між групою цефтароліну й групою цефтріаксону для тих суб'єктів в PORT класі ризику III і IV. Таблиця 6 Розподіл популяції Диспропорція На популяцію Рандомізовано Одержували досліджуваний лікарський засіб PORT III або IV Мали оцінений клінічний результат Мали вихідний патоген Мали вихідний патоген і оцінений клінічний результат Для виключених Закінчили дослідження Виключені з дослідження Причина дострокового відсторонення Побічне явище Недотримання умов дослідницького лікування На вимогу спонсора/дослідника Відкликання інформованого згоди Пацієнт, з яким загублений контакт для спостереження Інші Популяція Цефтаролін Цефтріаксон ITT MITT MITTE CE mMITTE ME Усього 310 307 273 215 88 76 627 622 562 450 178 161 289 259 (89,6) 30 (10,4) MITTE 317 315 289 235 90 85 273 248 (90,8) 25 (9,2) 562 507 (90,2) 55 (9,8) 8 (2,8) 0 1 (0,3) 4 (1,4) 16 (5,5) 1 (0,3) 7 (2,6) 1 (0,4) 1 (0,4) 8 (2,9) 8 (2,9) 0 15 (2,7) 1 (0,2) 2 (0,4) 12 (2,1) 24 (4,3) 1 (0,2) Демографічні характеристики: В MITTE популяції переважаючими суб'єктами були особини 23 UA 110098 C2 5 10 чоловічої статі (62%), не-латиноамериканці (84%), білої раси (96%), і середній вік становив приблизно 61 рік. Більшість суб'єктів мали PORT оцінку III (59% у групі цефтароліну, 63% у групі цефтріаксону). Кількість суб’єктів з будь-якою релевантною історією хвороби становила 51% у групіцефтароліну й 44% у групі цефтріаксону. Найпоширенішою релевантною історією хвороби було структурне захворювання легенів (33% у групі цефтароліну й 32% у групі цефтріаксону). Ліковані групи були добре збалансованими відносно патогенних організмів, ідентифікованих з дихальних і гемокультур, або тестів антигенів у сечі. Найпоширенішими патогенами були Streptococcus pneumoniae і Staphylococcus aureus. Найпоширенішими грамнегативними патогенами були Haemophilus influenzae, H. parainfluenzae, і Klebsiella pneumoniae. Частота бактеріємії була подібною між двома лікованими групами (5,2% цефтаролін; 4,0% цефтріаксон). Демографічні й вихідні характеристики в CE популяції були подібними з такими в MITTE популяції. Таблиця 7 Результати ефективності Клінічний успіх при TOC візиті - Не менша ефективність (CE і MITTE популяції) Цефтаролін Цефтріаксон a b Популяція Відмінність 95% Ci n (%) n (%) CE, N 235 215 193 (82,1) 166 (77,2) 4,9 (-2,5, 12,5) MITTE, N 289 273 235 (81,3) 206 (75,5) 5,9 (-1,0, 12,7) d Сприятливий Мікробіологічний результат при TOC візиті (ME і mMITTE популяції) ME, N 85 76 72 (84,7) 63 (82,9) 1,8 (-9,7, 13,7) mMITTE, N 90 88 74 (82,2) 72 (81,8) 0,4 (-11,1, 11,9) Для суб'єкта Клінічні показники ефективності лікування при EOT візиті (CE і MITTE популяції) Цефтаролін Цефтріаксон a b Популяція Відмінність 95% Ci n (%) n (%) CE, N 235 215 202 (86,0) 172 (80,0) 6,0 (-1,0, 13,0) MITTE, N 289 273 249 (86,2) 215 (78,8) 7,4 (1,1, 13,8) 15 20 25 Скорочення: CE = клінічно оцінюваний; EOT = закінчення лікування; ME = мікробіологічно оцінюваний; CI = довірчий інтервал; MITT = модифікований для всіх включених у дослідження пацієнтів; mMITTE = модифікований мікробіологічний для всіх включених у дослідження пацієнтів з PORT оцінкою III або IV. a Відмінність = % вилікуваних у групі цефтароліну мінус % вилікуваних у групі цефтріаксону. b CI розраховували, використовуючи метод Miettinen і Nurminen без коректувань. c Сприятливі відповіді включали знищення й передбачуване знищення. Дані, представлені в таблиці 7, свідчать про те, що цефтаролін і його проліки (наприклад, цефтаролін фозаміл) несподівано й непередбачено ефективні для лікування позалікарняної пневмонії. 24 UA 110098 C2 Таблиця 8 Клінічні показники ефективності лікування й Сприятливий мікробіологічний результат для вихідного патогену Клінічні показники ефективності лікування при TOC візиті для вихідного патогену (ME Популяція) Патоген Цефтаролін (N=) Цефтріаксон (N=) S. pneumoniae 33/39 (84,6) 23/32 (71,9) MDRSP 2/2 (100,0) 1/4 (25,0) S. aureus 10/15 (66,7) 8/15 (53,3) H. influenzae 13/15 (86,7) 11/12 (91,7) H. parainfluenzae 9/9 (100,0) 6/7 (85,7) K. pneumoniae 6/6 (100,0) 7/8 (87,5) Сприятливий мікробіологічний результат в TOC для вихідного патогену (ME) Патоген Цефтаролін (N=) Цефтріаксон (N=) S. pneumoniae 35/39 (89,7) 25/32 (78,1) MDRSP 2/2 (100,0) 2/4 (50,0) S. aureus 11/15 (73,3) 11/15 (73,3) H. influenzae 13/15 (86,7) 11/12 (91,7) H. parainfluenzae 9/9 (100,0) 7/7 (100,0) K. pneumoniae 6/6 (100,0) 7/8 (87,5) 5 10 15 Дані, представлені в таблиці 8, свідчать про те, що цефтаролін і його проліки (наприклад, цефтаролін фозаміл) несподівано й непередбачено ефективні для лікування позалікарняної пневмонії. Більш високий відсоток суб'єктів, що має викликані лікуванням побічні явища (TEAE) був описаний у групі, лікованій цефтароліном, (53,7% цефтаролін; 47,2% цефтріаксон), але подібні відсотки будь-яких пов'язаних з досліджуваним лікарським засобом TEAE були описані у двох лікованих групах (12,4% цефтаролін; 13,7% цефтріаксон). Кількість суб'єктів з будь-якими SAE також було подібним у двох лікованих групах (13,0% цефтаролін; 12,7% цефтріаксон), також як і кількість суб'єктів з TEAE, що приводять до передчасного припинення введення досліджуваного лікарського засобу (0,6% цефтаролін; 1,3% цефтріаксон). Кількість смертельних випадків була порівняною для двох лікованих груп (2,9% цефтаролін; 2,0% цефтріаксон). Найпоширеніші TEAE (що зустрічаються в 2% або більше суб'єктів) у будь-якій з лікованих груп представлені нижче. Описана частота побічних явищ >= 2% суб'єктів у будь-якій лікованій групі: Безпека популяції Таблиця 9 Побічні явища Побічне явище (MedDRA Переважний термін) Будь-яке AE Діарея Нудота Пневмонія Гіпокаліємія Головний біль Безсоння ХОЗЛ Плевральний випіт Флебіт Гіпертонія Число (%) суб'єктів Цефтаролін (N=315) Цефтріаксон (N=307) 169 (53,7) 145 (47,2) 12 (3,8) 9 (2,9) 6 (1,9) 6 (2,0) 8 (2,5) 4 (1,3) 10 (3,2) 5 (1,6) 11 (3,5) 5 (1,6) 10 (3,2) 8 (2,6) 8 (2,5) 5 (1,6) 4 (1,3) 7 (2,3) 10 (3,2) 8 (2,6) 8 (2,5) 8 (2,6) a “Будь-яке AE” включало суб'єктів, у яких було описано принаймні одне побічне явище. 25 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 Не було TEAE із частотою випадків у двох лікованих групах, що відрізняються на 2% або більше. Пов'язані з досліджуваним лікарським засобом TEAE, що зустрічаються в 1,0% або більше суб'єктів у будь-якій з лікованих груп, являли собою діарею (1,9% цефтаролін; 2,0% цефтріаксон), нудоту (0,6% цефтаролін; 1,6% цефтріаксон), підвищення креатинін фосфокинази в крові (1,3% цефтаролін; 0,7% цефтріаксон), підвищення аланінамінотрансферази (0,3% цефтаролін; 1,0% цефтріаксон), головний біль (0,6% цефтаролін; 1,0% цефтріаксон) і флебіт (2,9% цефтаролін; 1,6% цефтріаксон) TEAE, які були не більш, ніж слабкими (28,9% цефтаролін; 19,9% цефтріаксон), більш часто зустрічалися в групі, лікованій цефтароліном. TEAE, не більш, ніж помірними (18,4% цефтаролін; 19,9% цефтріаксон) або важкі, зустрічалися в подібного відсотка суб'єктів в обидві лікованих групах (6,3% цефтаролін; 7,5% цефтріаксон). Два суб'єкти (1 у групі цефтароліну, 1 у групі цефтріаксону) мали SAE, розглянуті як можливо або ймовірно пов'язані з досліджуваним лікарським засобом (конвульсія для суб'єкта в групі цефтароліну; підвищення печіночних ферментів для суб'єкта в групі цефтріаксону). Більш високу частоту після вихідної сероконверсії Direct Coombs спостерігали в групі цефтароліну (8,1%) у порівнянні із групою цефтріаксону (3,8%). Не було ідентифіковано випадків гемолітичної анемії в кожній із груп. Зміни параметрів гематології й клінічної біохімії, які спостерігалися при терапії, були незначними й подібними у двох лікованих групах і не спостерігали тенденцій, зв'язаних лабораторними параметрами, або факторів небезпеки. Огляд потенційно клінічно значимих (PCS) значень лабораторних аналізів вказував на сумарну низьку частоту й відсутність значимих відмінностей між двома лікованими групами. Таким чином, даний приклад свідчить про те, що цефтаролін і його проліки (наприклад, цефтаролін фозаміл) несподівано й непередбачено ефективні для лікування бактеріальних інфекцій, включаючи позалікарняну пневмонію й cSSSI. Приклад 5 У фазі 3, багатоцентрове, рандомізоване, подвійне сліпе, порівняльне дослідження здійснювали для оцінки безпеки й ефективності цефтароліну відносно цефтріаксону, додатково із кларитроміцином, для лікування дорослих суб'єктів із позалікарняною пневмонією (CAP). Основним завданням дослідження було визначення не меншої ефективності в клінічних показниках ефективності лікування для цефтароліну в порівнянні з такими для цефтріаксону при оцінці ефективності лікування (TOC) у клінічно оцінюваній (CE) і модифікованій ефективності для всіх включених у дослідження пацієнтів (MITTE) популяцій у дорослих суб'єктів з CAP. Додатковими завданнями дослідження була оцінка наступних параметрів: клінічна відповідь наприкінці терапії (EOT); мікробіологічно сприятливий показник результату в TOC; сумарний (клінічний і рентгенографічний) показник ефективності в TOC; клінічна й мікробіологічна відповідь на патоген в TOC; клінічний рецидив для пізніх віддалених результатів (LFU); мікробіологічне повторне інфікування/ повторний прояв в LFU; і безпека. Популяція всіх включених у дослідження пацієнтів (ITT) включала 305 суб'єктів для цефтароліну й 309 суб'єктів для цефтріаксону, тоді як модифікована популяція включених у дослідження пацієнтів (MITT) або популяція для визначення безпеки включала 299 суб'єктів для цефтароліну й 307 суб'єктів для цефтріаксону. Наступні популяції аналізували відносно ефективності: 1. MITTE популяція; 291 (цефтаролін) і 300 (цефтріаксон) 2. CE популяція; 224 (цефтаролін) і 234 (цефтріаксон) 3. Мікробіологічно модифікована популяція для всіх включених у дослідження пацієнтів (mMITT); 75 (цефтаролін) і 82 (цефтріаксон) 4. Мікробіологічно модифікована популяція визначення ефективності для всіх включених у дослідження пацієнтів (mMITTE): 75 (цефтаролін) і 80 (цефтріаксон) 5. Мікробіологічно оцінювана (ME) популяція: 69 (цефтаролін) і 71 (цефтріаксон) Використовували наступні критерії для включення: 1. Суб'єктами були особини чоловічої й жіночої статей у віці 18 років або старше 2. Суб'єкти мали позалікарняну пневмонію, що відповідає наступним критеріям: I. Рентгенографічно підтверджена пневмонія (новий або прогресуючий інфільтрат (и) легенів) на рентгенограмі грудної клітки [CXR] або комп'ютерної томографії грудної клітки [CT], що вказує на бактеріальну пневмонію); і II. Гостре захворювання (тривалість ≤ 7 днів) принаймні із трьома наступними клінічними ознаками або симптомами, що вказують на інфекцію нижніх дихальних шляхів: новий кашель 26 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 або кашель, що підсилюється; гнійне мокротиння або зміна характеру мокротиння; дані аускультації, що вказують на пневмонію (наприклад, хрипи, егофонія, виявлення ущільнень); задишка, часте дихання, або гіпоксемія (O2 насичення < 90% у кімнатнім повітрі або pО2 38,5°С ректально або в барабанній порожнині) або гіпотермія (< 35°C); кількість лейкоцитів (WBC) більше, ніж 10,000 3 3 клітин/мм або менше, ніж 4,500 клітин/мм ; більше, ніж 15% незрілих нейтрофілів (смуги) незалежно від кількості WBC; і III. PORT оцінка більше, ніж 70 і менше, ніж або рівна 130 (тобто, PORT клас ризику III або IV). 3. Суб'єкт потребував початкової госпіталізації, або лікування в пункті невідкладної медичної допомоги або термінового амбулаторного лікування, згідно зі стандартами лікування. 4. Інфекцію в суб'єкта необхідно первинно лікувати за допомогою в/в антибіотиків. 5. Пацієнти жіночої статі в репродуктивному віці, і ті, у яких пройшло менше двох років після настання менопаузи, погоджувалися й виконували запропоноване використання високоефективних методів контрацепції (тобто, презерватив плюс сперміцид, комбіновані пероральні протизаплідні засоби, імплант, ін'єкований, постійний внутрішньоматковий протизаплідний засіб, утримання від полового життя, або вазектомінізований партнер) під час участі в даному дослідженні 6. Суб'єкти підписували письмову інформовану згоду й демонстрували готовність і здатність виконувати всі процедури дослідження. Критеріями виключення були: 1. PORT оцінка менше, ніж або рівна 70 (PORT клас ризику I або II), PORT оцінка більше, ніж 130 (PORT клас ризику V), або необхідність перекладу в реанімаційне відділення. 2. CAP придатність для амбулаторної терапії із застосуванням перорального антимікробного засобу. 3. Підтверджені або передбачувані інфекції дихальних шляхів, пов'язані з іншими джерелами, що відрізняються від позалікарняних бактеріальних патогенів (наприклад, вентиляторно-асоційована пневмонія; внутрішньолікарняна пневмонія; видима/велика аспіраційна пневмонія; передбачувана вірусна, грибкова або мікобактеріальна інфекція легенів). 4. Неінфекційні причини інфільтратів легенів (наприклад, емболія легенів, хімічна пневмонія після аспірації, алергічний альвеоліт, застійна серцева недостатність). 5. Емпієма плеври (не включаючи негнійні парапневмонічні ефузії). 6. Мікробіологічно задокументована інфекція, викликана патогеном, для якого відома резистентність до цефтріаксону, або епідеміологічна або клінічна ситуація, яка припускає високу ймовірність резистентного до цефтріаксону “типового” бактеріального патогену (наприклад, Pseudomonas aeruginosa, резистентні до метициліну Staphylococcus aureus [MRSA]). Епідеміологічні повідомлення про потенційну MRSA інфекції, яка охоплює проживаючих в інтернаті для старих або інтернаті для проживання старих людей з особливими потребами, існування постійних локальних спалахів MRSA інфекції, відоме інфікування шкіри з MRSA, недавні шкірні інфекції або інфекції шкірних структур, обумовлені MRSA, внутрішньовенне застосування лікарських засобів, супутній грип. Суб'єкти з факторами ризику для MRSA інфекції, у яких переважали грампозитивні коки в скупченнях при фарбуванні мокротиння за Грамом, виключали. 7. Інфекції, викликані атиповим організмом (M. pneumoniae, C. pneumoniae, види Legionella) підтверджували або припускали на основі епідеміологічної ситуації, або інфекції, викликані Legionella pneumophila, підтверджували за допомогою тесту антигену в сечі на вихідному рівні. 8. Попереднє лікування за допомогою антимікробного засобу для CAP протягом 96 годин перед рандомізацією. Виключення: Суб'єкти могли бути визнані придатними, незважаючи на попередню антимікробну терапію, якщо вони відповідали наступним критеріям: або однократна доза перорально або внутрішньовенно антибіотика короткочасної дії для CAP або обидва з наступних: однозначні терапевтичні дані неефективності лікування (наприклад, погіршення ознак і симптомів) протягом принаймні 48 годин попередньої системної антимікробної терапії й виділення організму, резистентного до попередньої системної антимікробної терапії. 9. Неефективність цефтріаксону (або іншого цефалоспоріну третього покоління) як терапія для цього епізоду CAP або попереднє виділення організму, пов'язаного із цим епізодом CAP і резистентного in vitro до цефтріаксону. 10. В анамнезі будь-яка гіперчутлива або алергічна реакція на будь-який β-лактамний антибіотик. 27 UA 110098 C2 5 10 15 20 25 30 35 40 45 50 55 60 11. Раніше або зараз в історії хвороби гіперчутливість або алергічна реакція на кларитроміцин або будь-який макролід /кетолід. 12. Нездатність приймати перорально кларитроміцин. 13. Необхідність супутньої терапії із застосуванням будь-якого лікарського засобу, для якого відомим протипоказанням є взаємодія лікарських засобів із кларитроміцином; або відзначене протипоказання застосування кларитроміцину. 14. Раніше або зараз в історії хвороби епілепсія або епілептичне порушення. Виключення: переконливо підтверджені фебрильні судоми в дитячому віці. 15. Необхідність супутньої антимікробної або системної протигрибкової терапії за будьякими підставами. Виключення: Місцева протигрибкова або антимікробна терапія, одинична пероральна доза будь-якого протигрибкового засобу для лікування вагінального кандидозу. 16. Пухлинне захворювання легенів, кістозний фіброз, прогресуюче смертельне захворювання, хронічне неврологічне порушення, що запобігає очищення легеневої секреції, або тривалість життя менше, ніж або рівна 3 місяці. 17. Введення пробенециду протягом 3 днів перед початком дослідження терапії лікарським засобом або необхідність супутньої терапії із застосуванням пробенециду. 18. Інфекції або стани, при яких необхідно супутнє системне введення кортикостероїдів. Виключення: Еквівалент дози кортикостероїду становить менше, ніж 40 мг преднізону на добу 19. Важке порушення функції нирок (CrCl ≤ 30 мл/хв), оцінюване згідно з формулою Кокрофта-Голта 20. Ознаки істотного печінкового, гематологічного або імунологічного захворювання, визначеного згідно з наступними критеріями: відомий гострий вірусний гепатит; рівень аспартатамінотрансферази (AST) або аланінамінотрансферази (ALT) більше, ніж в 10 разів верхньої межі норми або загальний білірубін більше, ніж в 3 рази верхньої межі норми; прояву кінцевої стадії захворювання печінки, такого як асцит або гепатична енцефалопатія; 3 нейтропенія, обумовлена як менше, ніж 500 нейтрофілів/мм , яка є поточною або 3 прогнозованою; тромбоцитопенія з кількістю тромбоцитів менше, ніж 60 тис. клітин/мм ; відомі інфекції, викликані вірусом імунодефіциту людину, і або кількість CD4 менше, ніж або рівно 200 3 клітин/мм в останньому вимірюванні або діагноз іншого набутого імунодефіциту синдромвизначальне захворювання, яке є поточним. 21. Ознаки захворювання, безпосередньо небезпечного для життя, яке є поточним або наближається, включаючи, але не обмежуючись тільки ними, дихальну недостатність, гостру серцеву недостатність, шок, гострий коронарний синдром, нестабільні аритмії, гіпертонічний криз, гостру печіночну недостатність, активну шлунково-кишкову кровотечу, глибокі метаболічні аномалії (наприклад, діабетичний кетоацидоз), або гострі порушення мозкового кровообігу. 22. Перебування в інтернаті для старих або інтернаті для проживання старих людей з особливими потребами, який забезпечує 24-х годинне медичне спостереження (не включаючи поліпшених життєвих умов для амбулаторних літніх пацієнтів) або госпіталізація протягом 14 днів перед початком симптомів (тобто, пневмонія, пов'язана з наданням медичної допомоги). 23. Жінки в період вагітності або годування грудьми. 24. Участь у будь-якому дослідженні, що включає введення дослідницького засобу або обладнання протягом 30 днів перед рандомізацією у дане дослідження або попередня участь у даному дослідженні. 25. Попередня участь у дослідженні цефтароліну. 26. Нездатність або небажання дотримуватися процедур і обмежень, специфічних для дослідження. 27. Будь-який стан, який, на думку дослідника, буде впливати на безпеку суб'єкта або якість даних. Досліджуваний лікарський засіб: Цефтаролін фозаміл вводили у дві послідовні 300 мг внутрішньовенні (в/в) інфузіях протягом 30 хвилин, кожні 12 годин (кожні 12 годин). 600 мг дозу цефтаролін фозамілу, яку інфузували протягом 60 хвилин, розділяли на дві інфузії для збереження «сліпоти» дослідження. Для суб'єктів з помірною нирковою недостатністю (30 мл/хв 50 мл/хв). Тривалість лікування становила від 5 до 7 днів. Порівняльний лікарський засіб: Цефтріаксон вводили у вигляді 1 г в/в інфузії протягом 30 хвилин з наступним в/в сольовим плацебо, інфузованим протягом 30 хвилин, кожні 24 години ( к24год). Через двадцять чотири години після кожної дози цефтріаксону й сольового плацебо (тобто, між дозами цефтріаксону), суб'єкти одержували дві послідовні інфузії сольового 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCompositions comprising ceftaroline for treating bacterial infections
Автори англійськоюThye, Dirk, Talbot, George
Назва патенту російськоюКомпозиции, содержащая цефтаролин фозамил, для лечения бактериальной инфекции
Автори російськоюТай Дирк, Талбот Джордж
МПК / Мітки
МПК: A61K 31/545, A61P 31/04
Мітки: цефтаролін, композиція, бактеріальної, фозамілу, інфекції, містить, лікування
Код посилання
<a href="https://ua.patents.su/38-110098-kompoziciya-shho-mistit-ceftarolin-fozamilu-dlya-likuvannya-bakterialno-infekci.html" target="_blank" rel="follow" title="База патентів України">Композиція, що містить цефтаролін фозамілу, для лікування бактеріальної інфекції</a>
Попередній патент: Терапевтичний агент для лікування розладів настрою
Наступний патент: Внутрішньоматкова система
Випадковий патент: Індуктивний датчик поверхневих нерівностей пиломатеріалів












