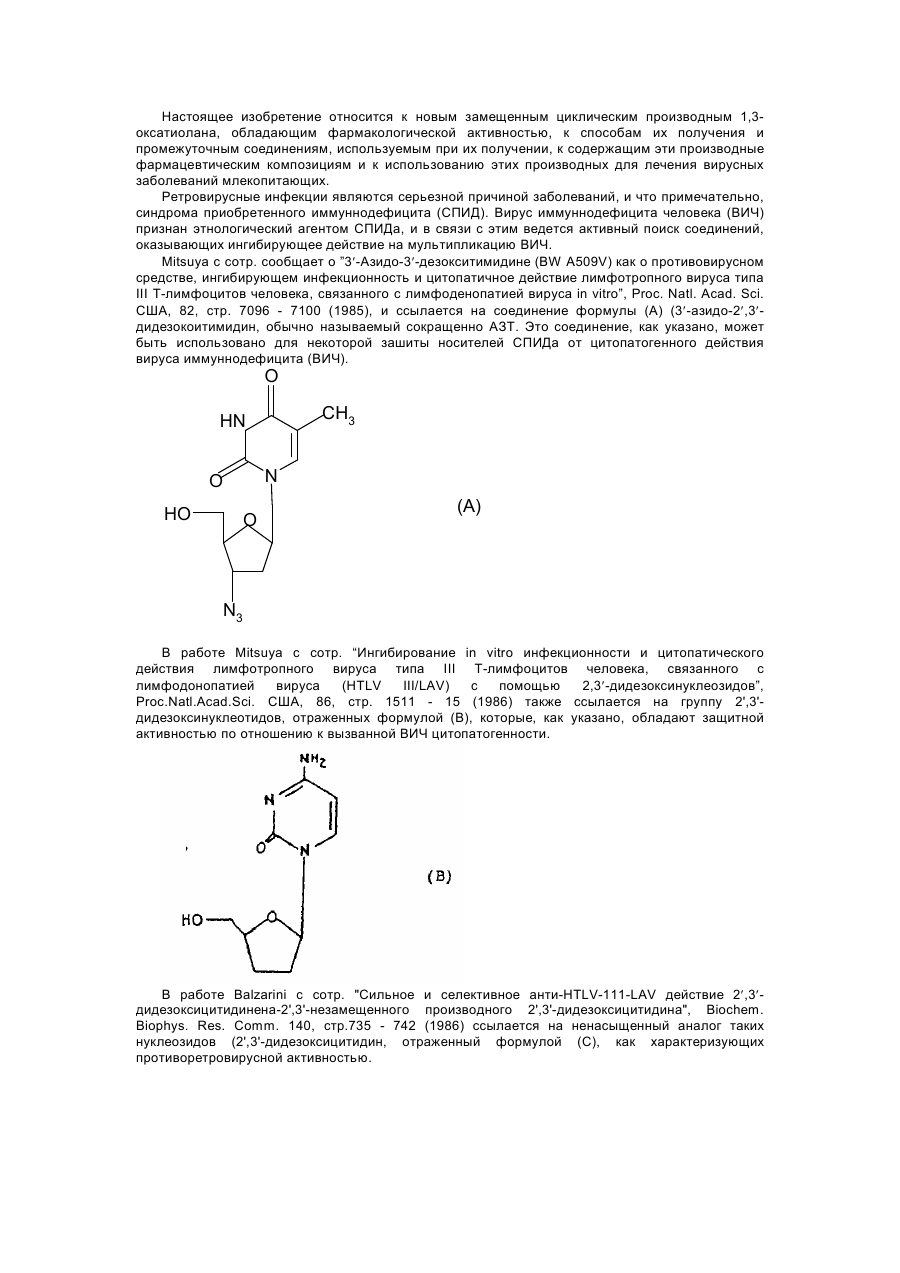
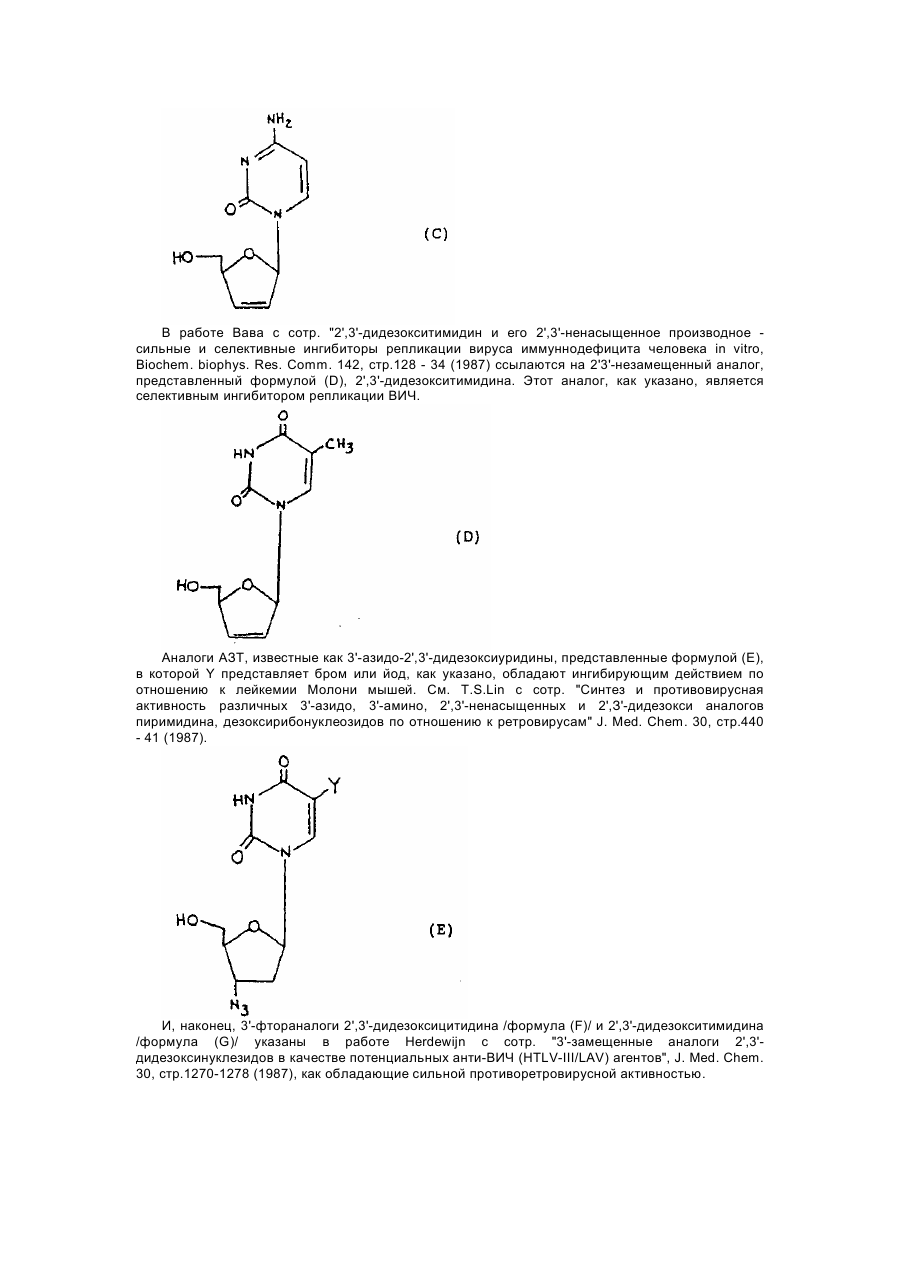
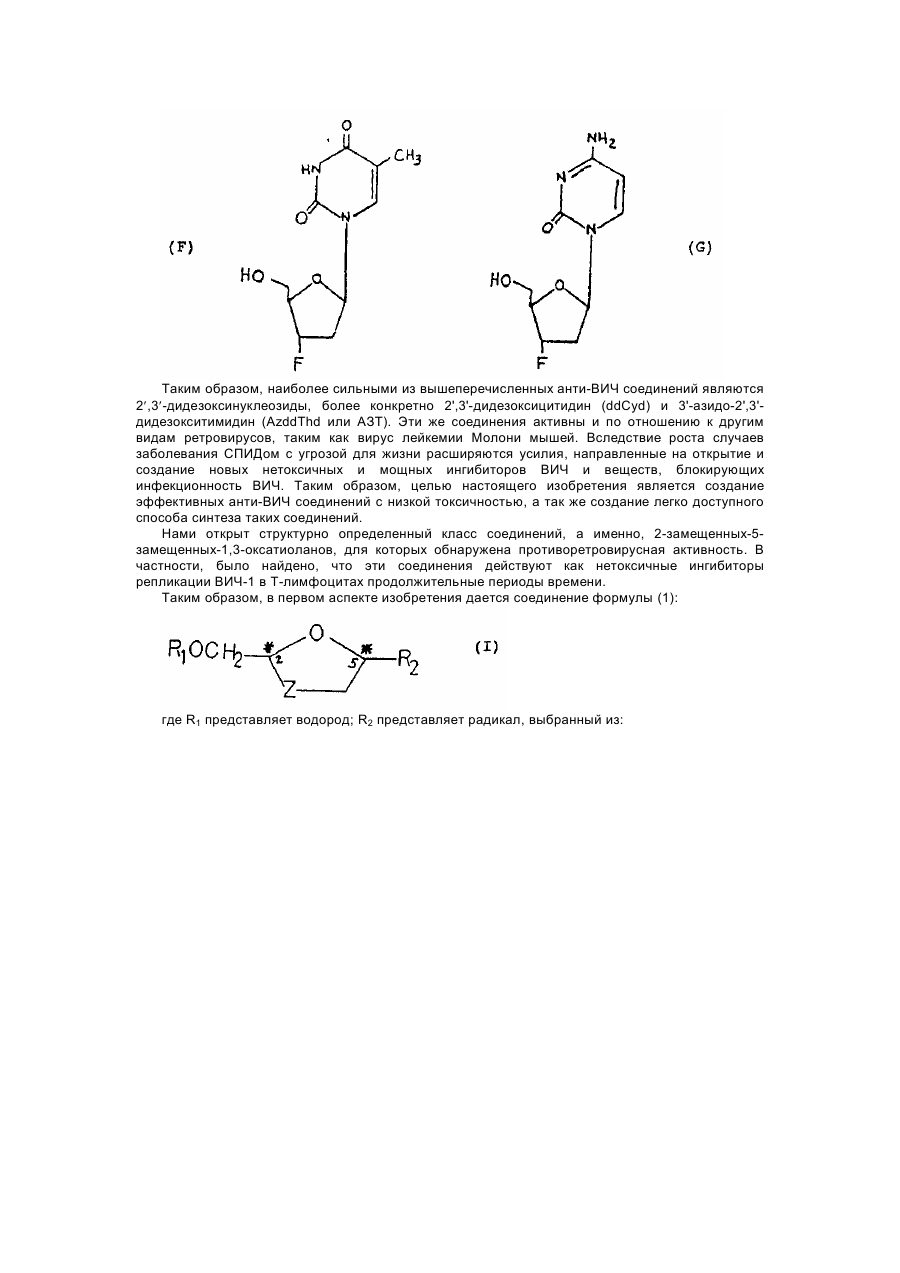
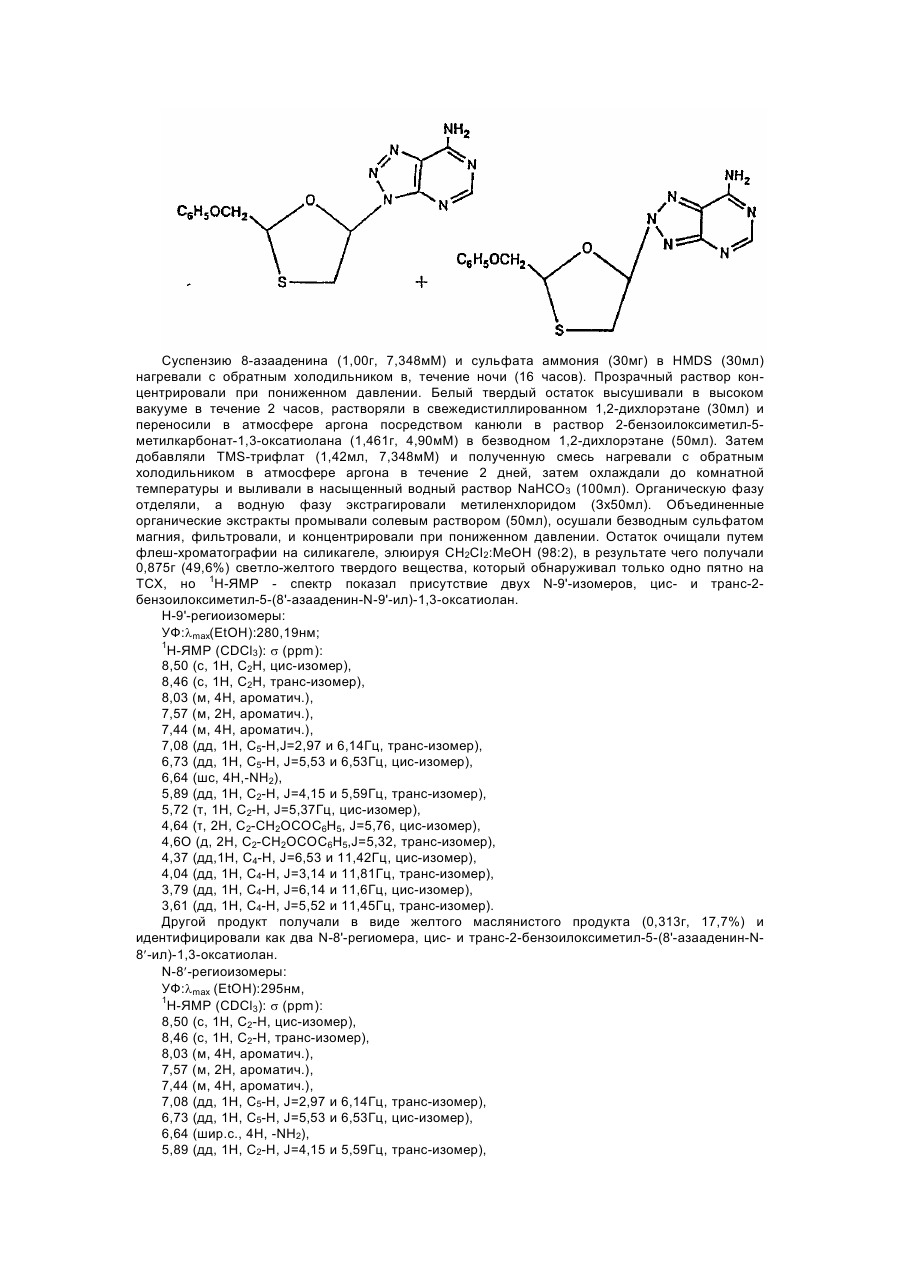
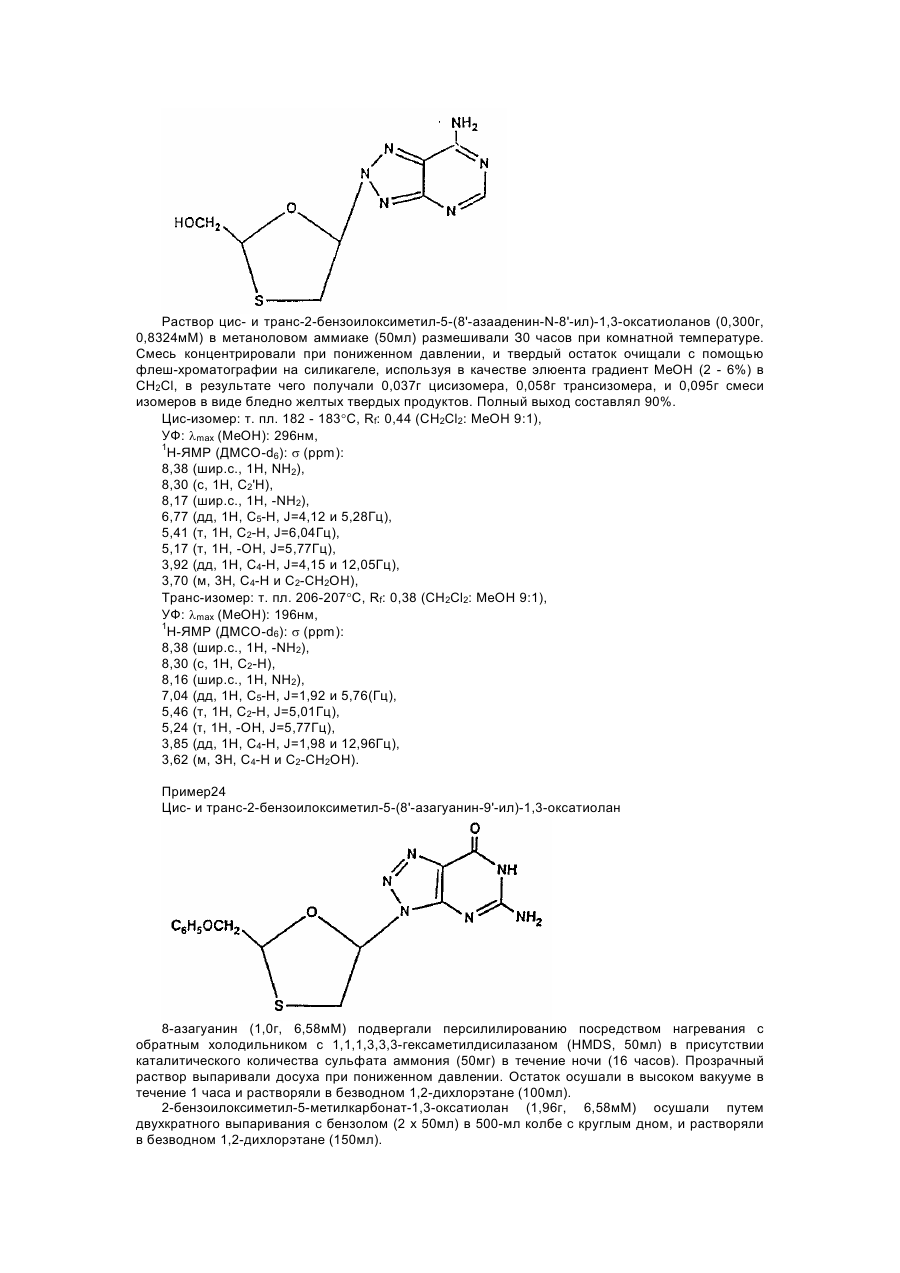
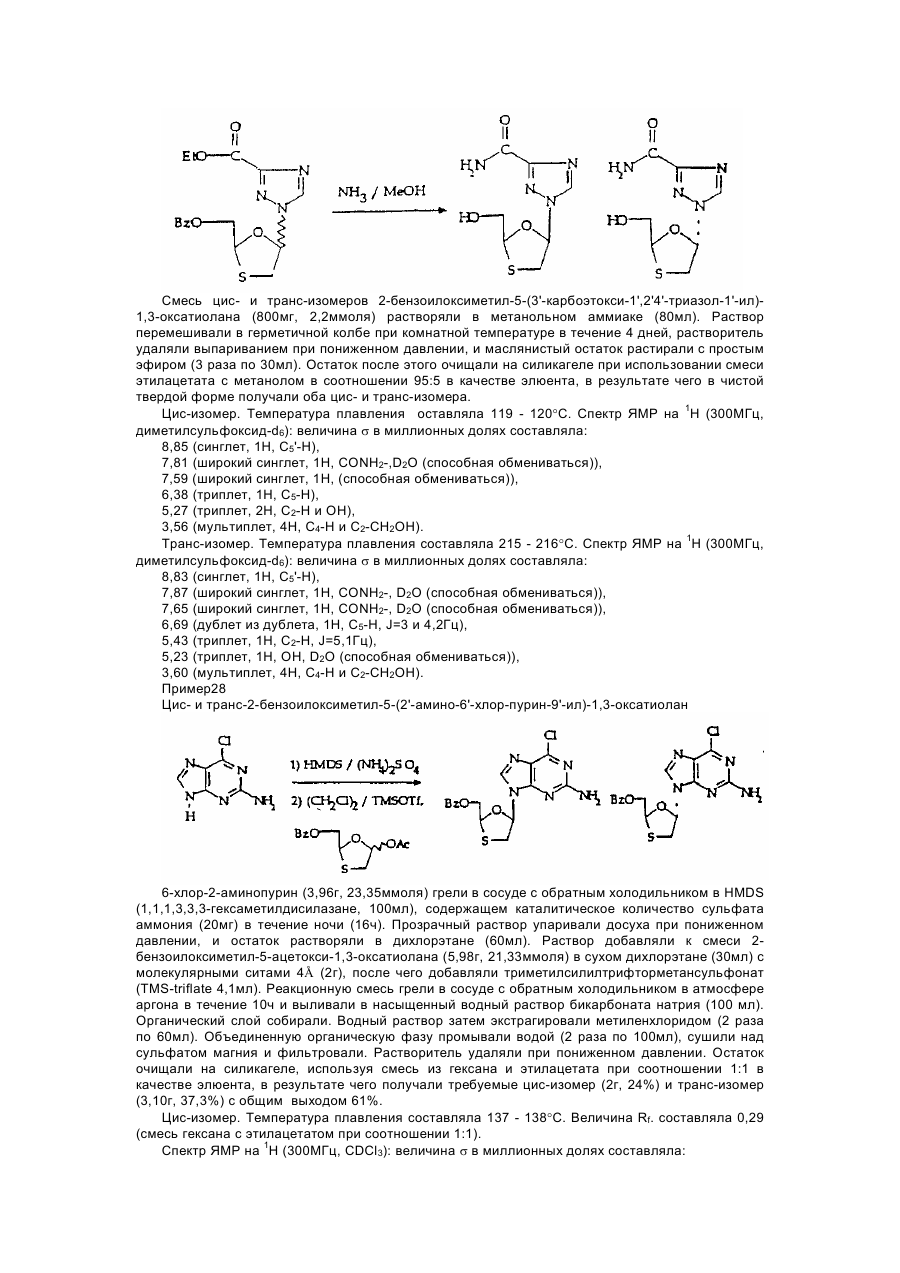
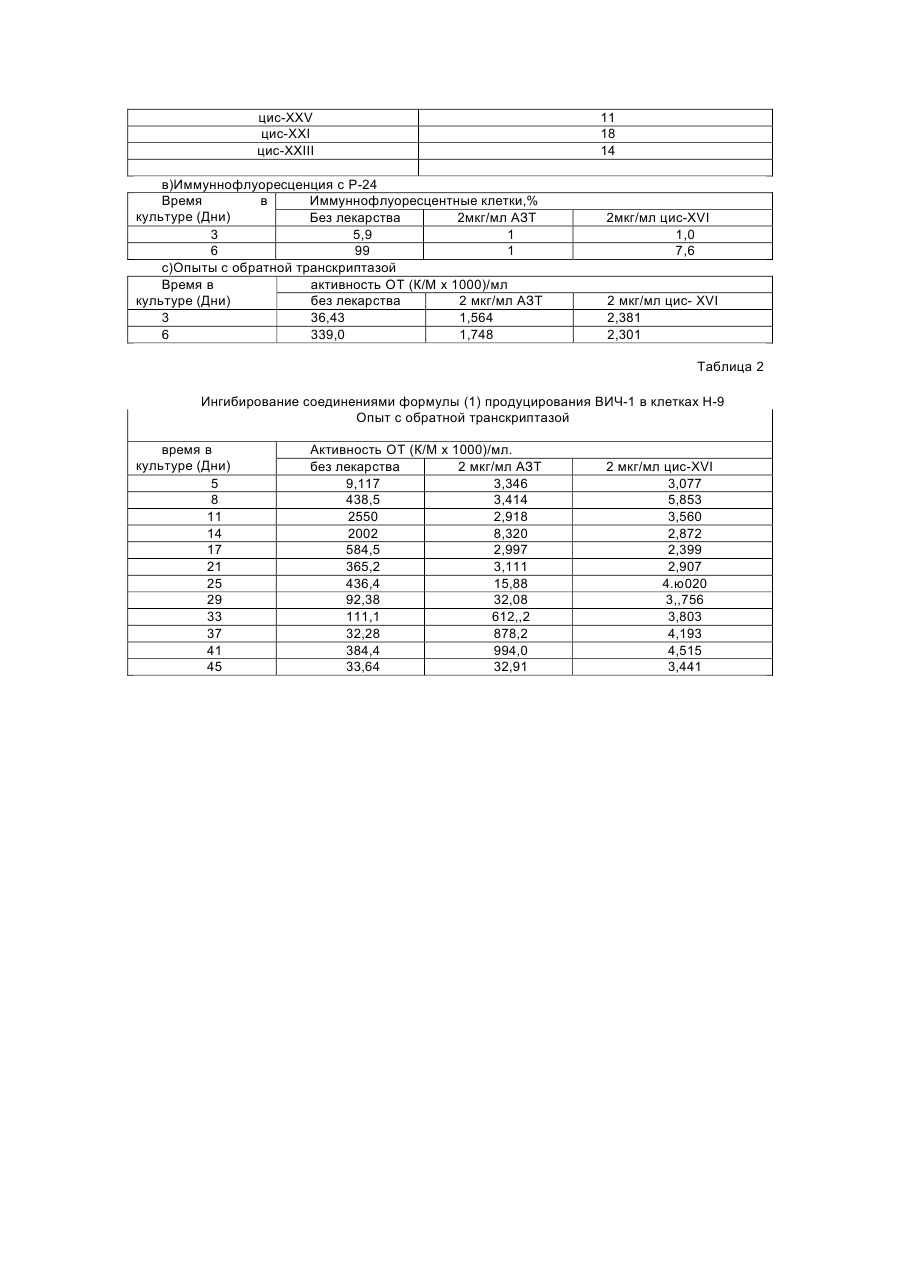
1,3-оксатіолан, його похідні, спосіб (варіанти) його одержання та фармацевтична композиція
Формула / Реферат
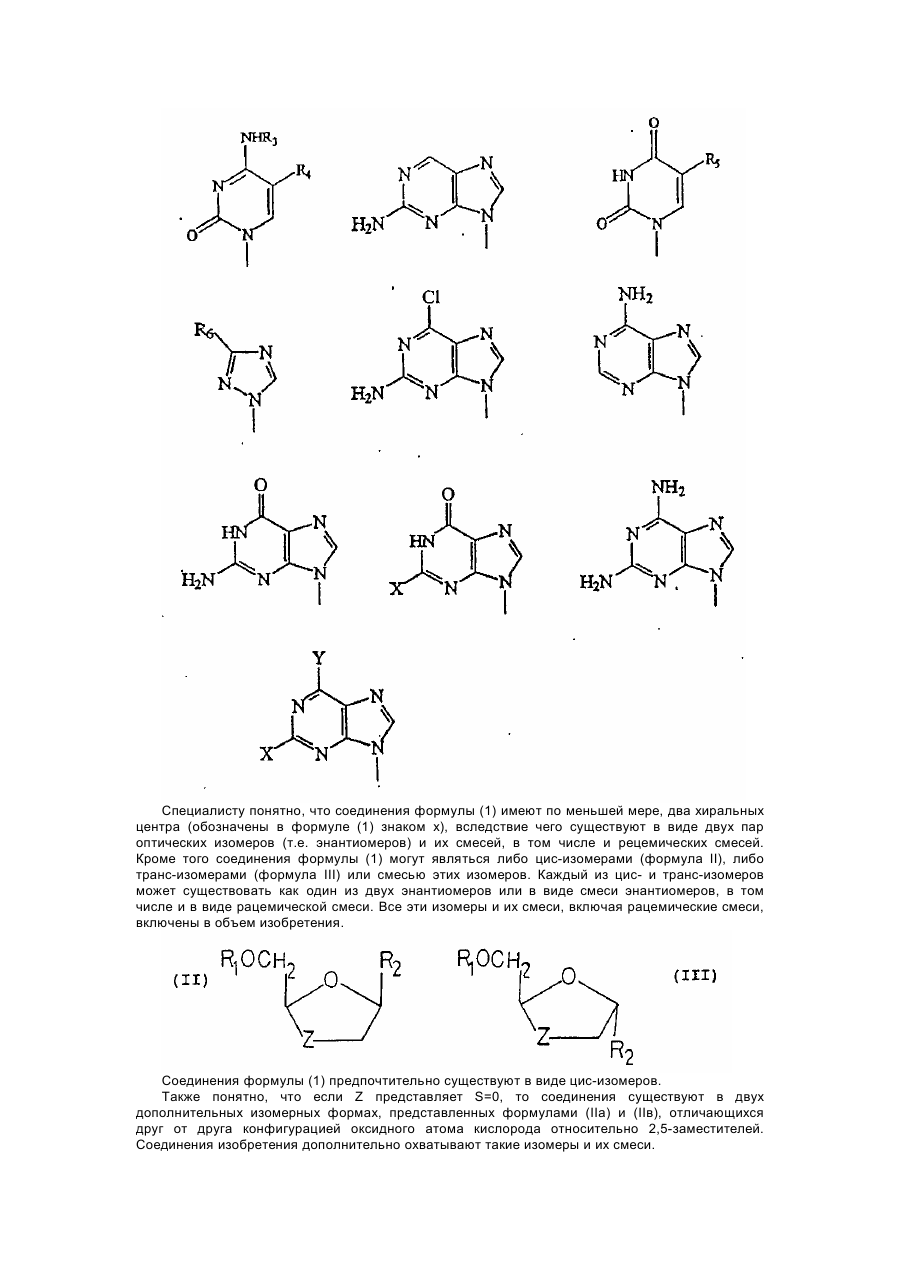
1. 1,3-Оксатиолан формулы (I), его геометрические и оптические изомеры и смеси этих изомеров:
в которой:
Z выбирается из S, SO или SO2;
R1 является водородом;
R2 является радикалом, выбираемым из:
в которых:
R3 является водородом;
R4 является водородом, С1-6алкилом или фтором;
R5 является водородом или С1-6алкилом;
R6 является карбамоилом или тиокарбамоилом и
Х и Y независимо водород, бром, хлор, фтор, йод, аминогруппа или гидроксильная группа;
и его фармацевтически приемлемые соли или эфиры, обладающие противовирусной активностью.
2. 1,3-Оксатиолан по п. 1, отличающийся тем, что он существует в виде цис-изомера.
3. 1,3-Оксатиолан по п. 1 или 2, отличающийся тем, что Z представляет собой S.
4. 1,3-Оксатиолан по любому из пп. 1 - 3, отличающийся тем, что R2 представляет собой радикал формулы:
в которой R3 является водородом, а R4 выбирается из водорода, насыщенного С1-6алкила или фтора.
5. 1,3-Оксатиолан по п. 1, отличающийся тем, что он выбирается из:
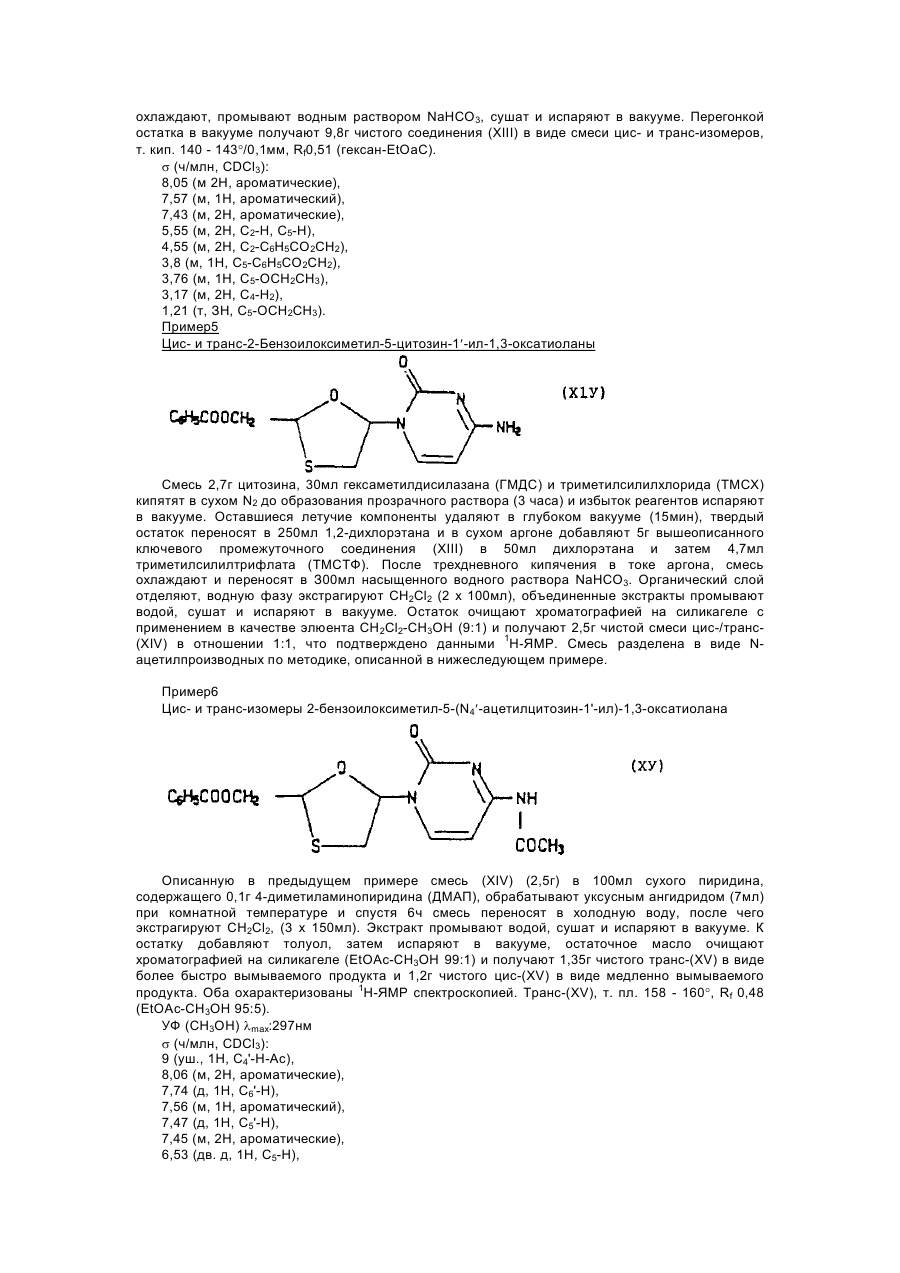
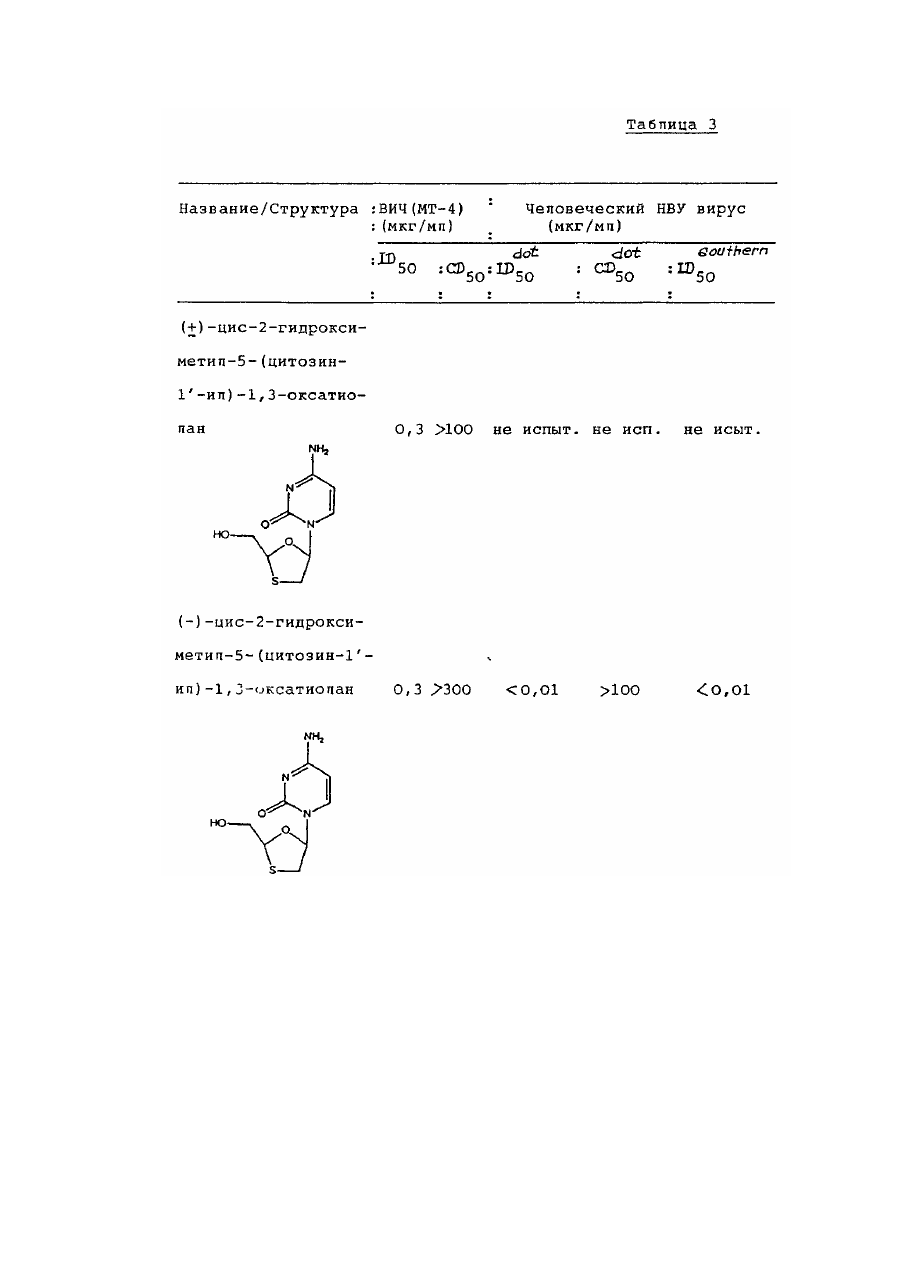
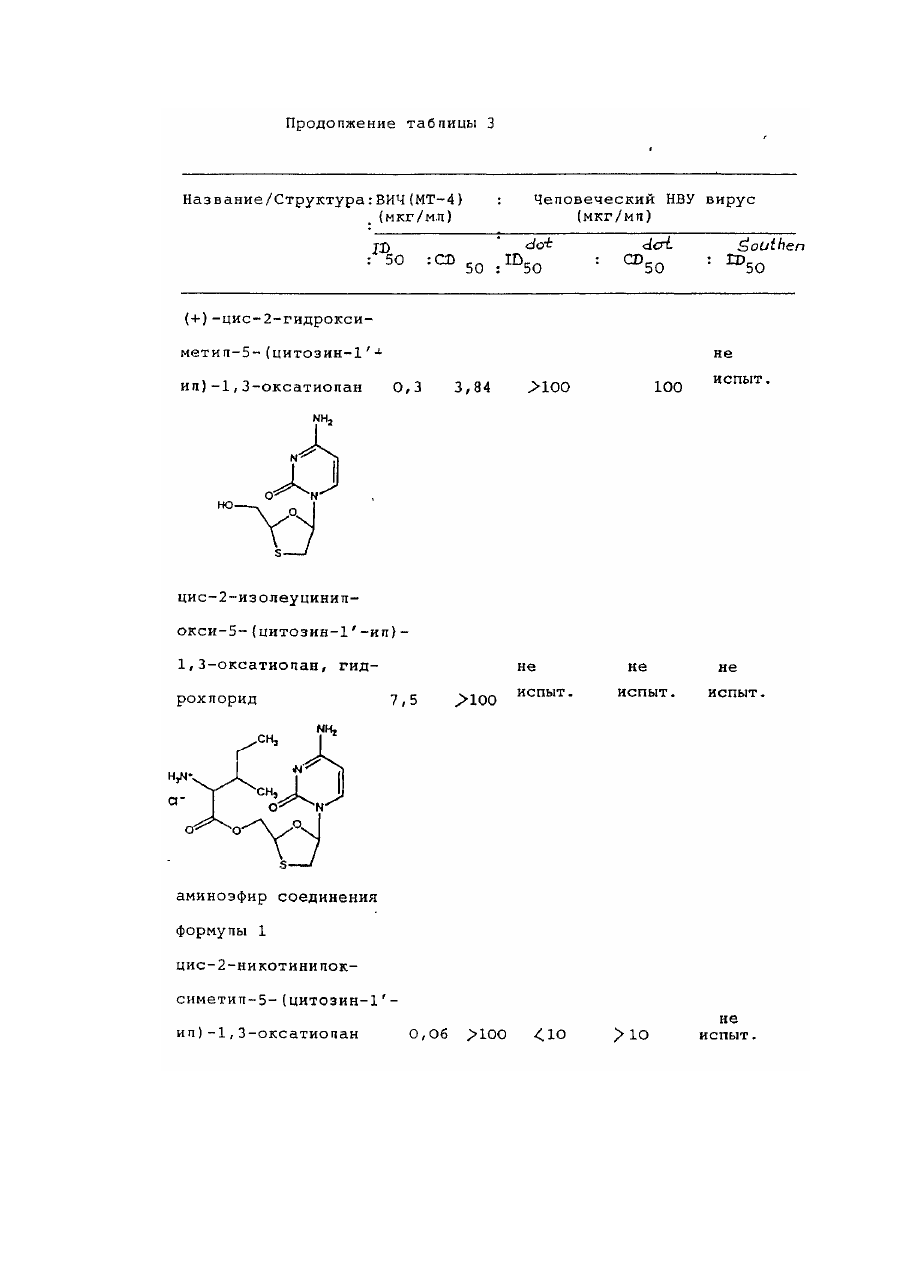
цис-2-гидроксиметил-5-(цитозин-1' -ил)-1,3-оксатиолана,
транс-2-гидроксиметил-5-(цитозин-1¢-ил)-1,3 оксатиоланаи их смесей;
цис-2-бензоилоксиметил-5-(цитозин-Г-ил)-1,3-оксатиолана,
транс-2-бензоилоксиметил-5-(цитозин-1'-ил)-1,3 оксатиолана их смесей;
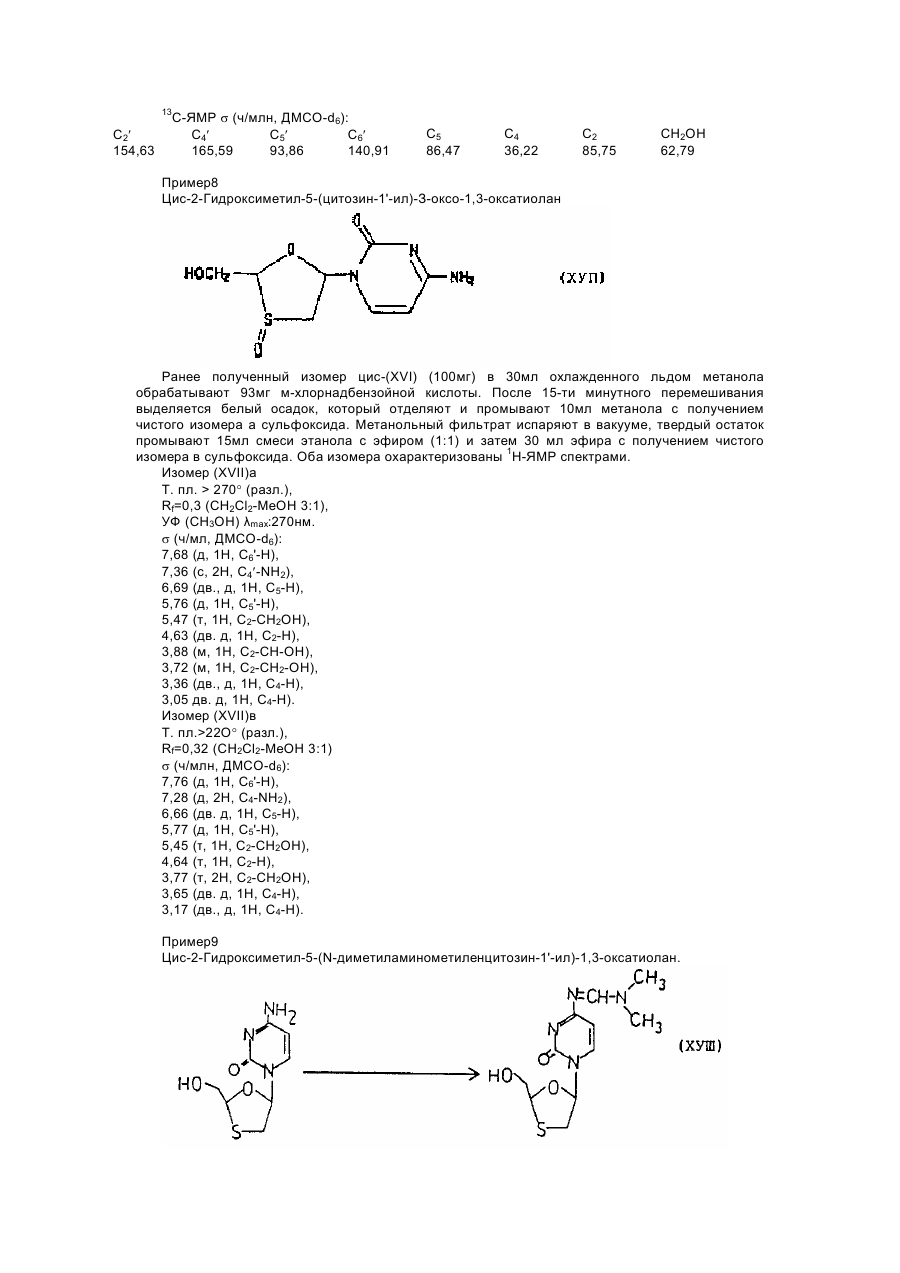
цис-2-гидроксиметил-5-(N'4-ацетилцитозин-1' - ил)-1,3-оксатиолана,
транс-2-гидроксиметил-5-(N'4-ацетилцитозин-1¢- ил)-1,3-оксатиолана и их смесей;
цис-2-бензоилоксиметил-5-(N'4-ацетилцитозин-1'-ил)-1,3-оксатиолана,
транс-2-бензоилоксиметил-5-(N'4-ацетилцитозин-1'-ил)-1,3-оксатиолана и их смесей;
цис-2-гидроксиметил-5-(цитозин-1¢-ил)-3-оксо-1,3-оксатиолана;
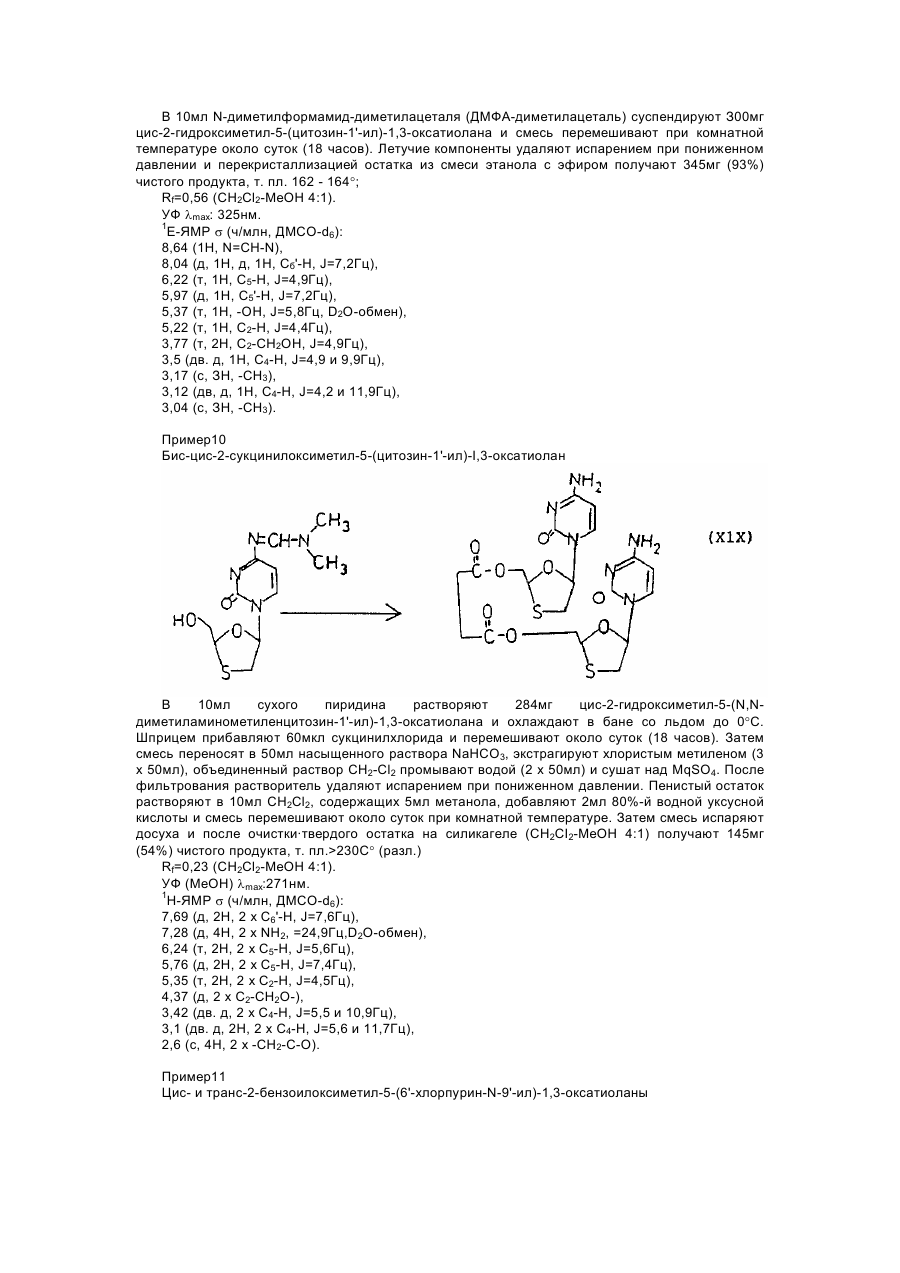
цис-2-гидроксиметил-5-(N-диметиламинометиленцитозин-1' -ил)-1,3-оксатиолана;
бис-цис-2-сукцинилоксиметил-5-(цитозин-1'-ил)-1,3-оксатиолана;
цис-2-бензоилоксиметил-5-(б'-хлорпурин-N-9'-ил)-1,3-оксатиолана,
транс-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиолана и их смесей;
цис-2-гидроксиметил-5-(б' -гидроксипурин-N-9' -ил)-1,3-оксатиолана;
цис-2-бензоилоксиметил-5-(урацил-N-1¢-ил)-1,3-оксатиолана,
транс-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана и их смесей;
цис-2-гидроксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана;
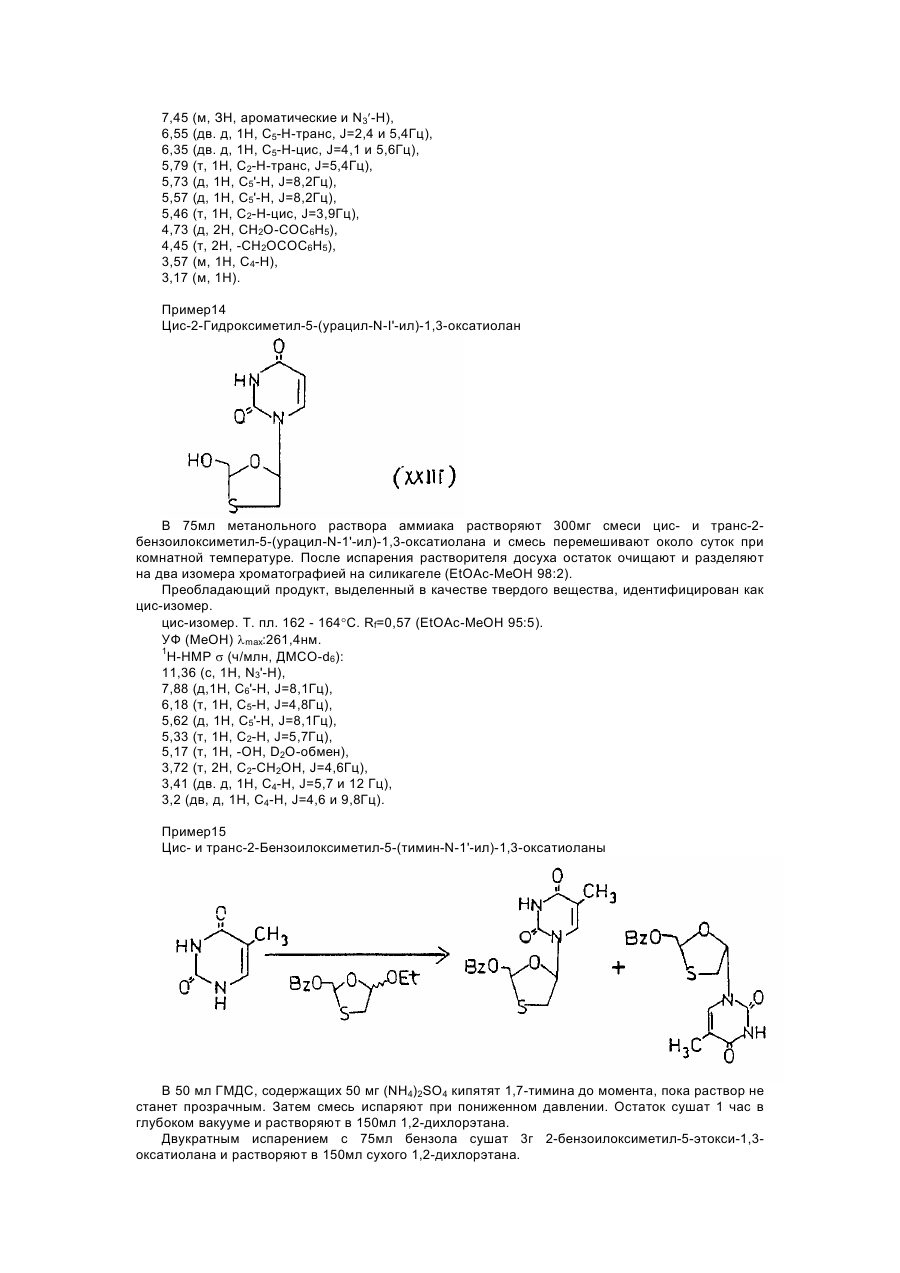
цис-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана,
транс-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана и их смесей;
цис-2-гидроксиметил-5-(тимин-]N-1' -ил)-1,3-оксатиолана;
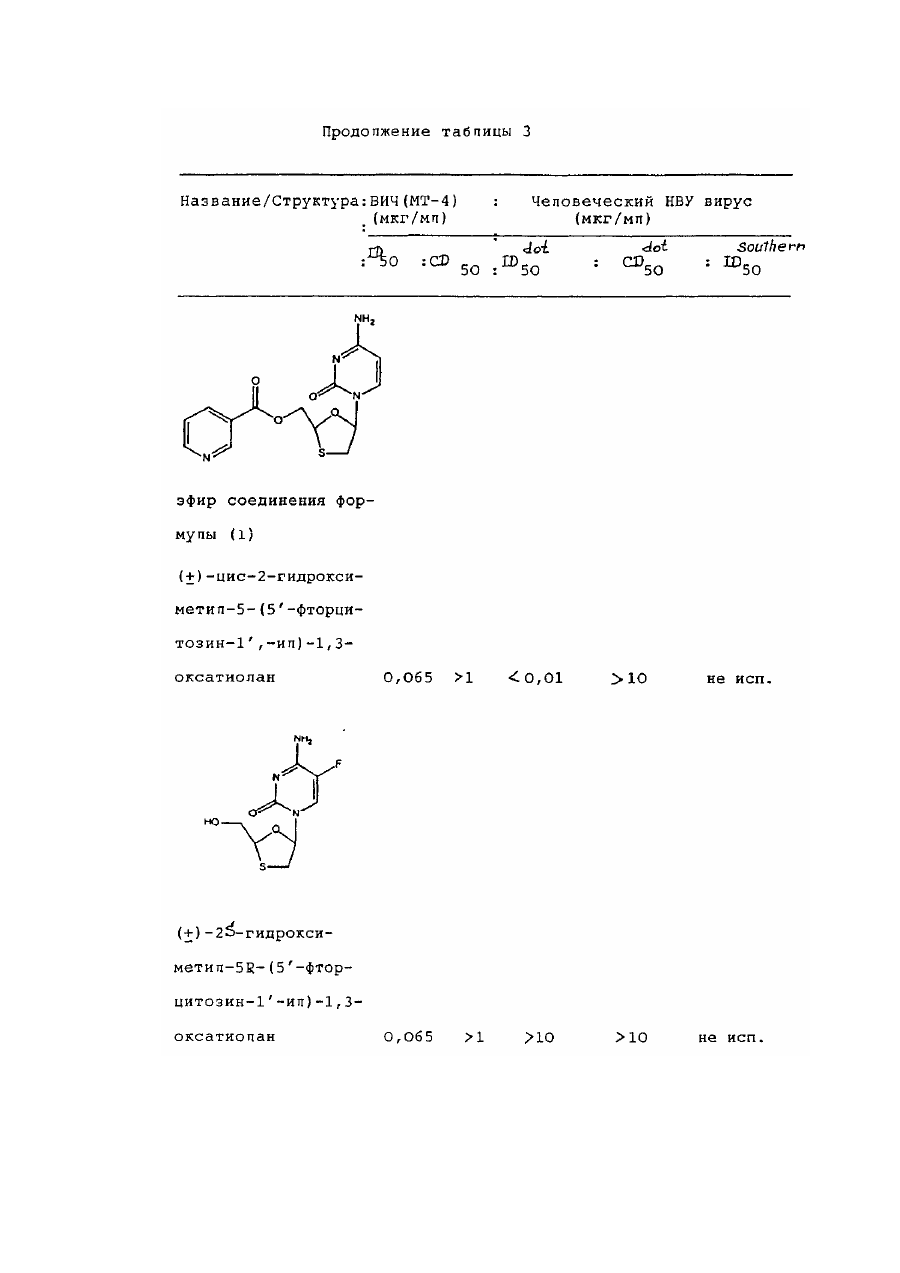
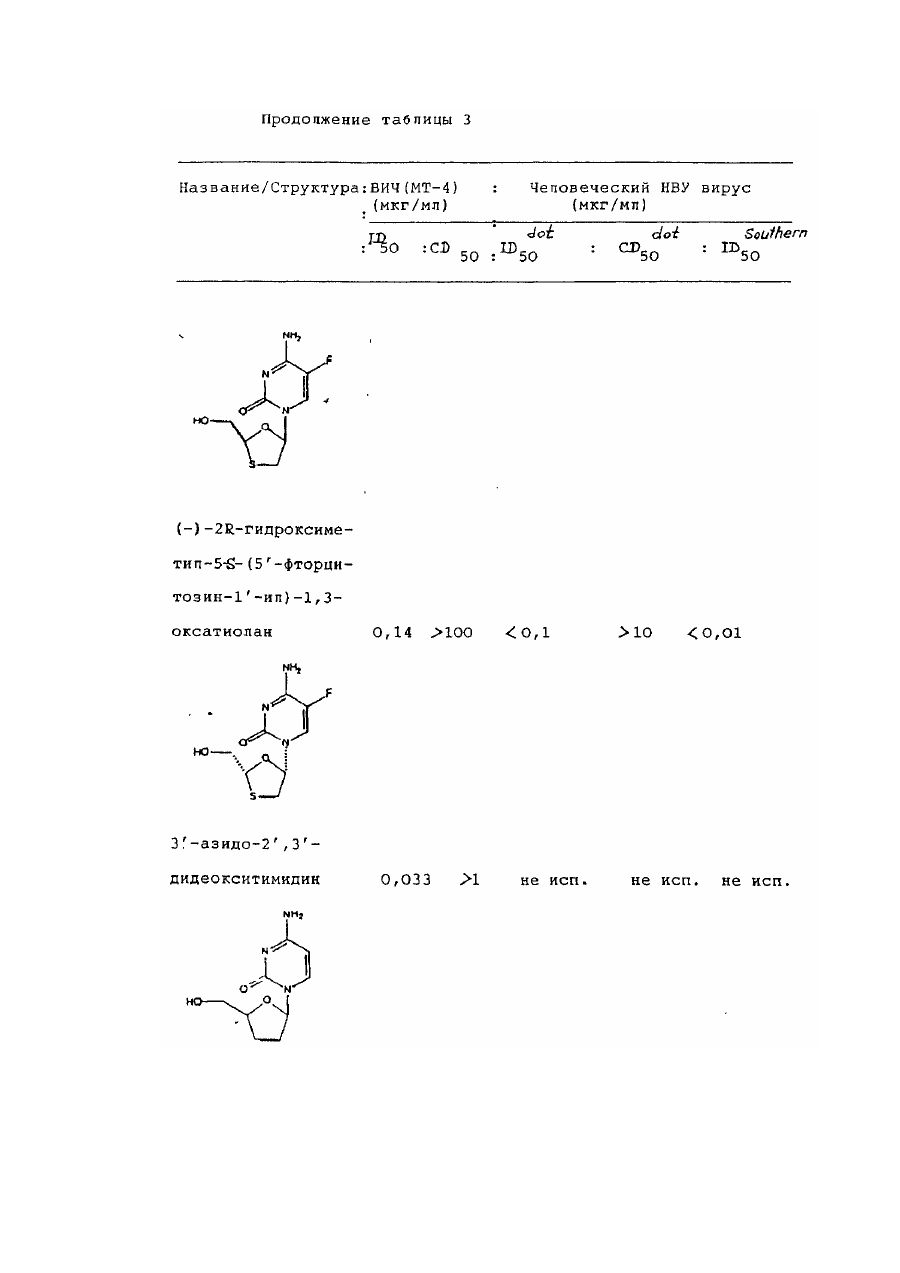
цис-2-гидроксиметил-5-(5'-фторцитозин-1'-ил)-1,3-оксатиолана и его фармацевтически приемлемых производных.
6. 1,3-Оксатиолан по п. 1, отличающийся тем, что он является цис-2-гидроксиметил-5-(цитозин-1'-ил)-1,3-оксатиоланом или его фармацевтически приемлемым производным, проявляющим антивирусную активность.
7. 1,3-Оксатиолан по п. 1, отличающийся тем, что он является цис-2-гидроксиметил-5-(5'-фторцитозин-1'-ил)-1,3-оксатиоланом или его фармацевтически приемлемым производным, проявляющим антивирусную активность.
8. 1,3-Оксатиолан по любому из пп. 1-7, отличающийся тем, что он представляет собой единственный оптический изомер.
9. 1,3-Оксатиолан по любому из пп. 1-7, отличающийся тем, что он представляет собой рацемическую смесь.
10. Фармацевтическая композиция, проявляющая антивирусную активность, включающая активный ингредиент и эксципиент, отличающаяся тем, что в качестве активного ингредиента она содержит эффективное количество 1,3-оксатиолана по одному из пунктов 1-9 или его фармацевтически приемлемого производного.
11. 1,3-Оксатиолан формулы (VIII), его геометрические и оптические изомеры и смеси этих изомеров:
в которой:
R1 является водородом или гидроксилзащитной группой;
Z является S, SO или SO2; и
L является алкоксикарбонильной группой, йодом, бромом, хлором или -OR, где R выбирается из алифатической или ароматической ацильной группы, используемый в качестве промежуточного соединения для получения 1,3-оксатиолана формулы (I).
12. Эфирное производное 1,3-оксатиолана, определенного в п. 1, его геометрические и оптические изомеры или смеси изомеров общей формулы (IV):
, (IV)
в которой:
W является РO4 , SPO3 или -O-СО-(СН2)n-СО-O-, где n представляет собой целое число, равное 1 или 2;
R2 и Z имеют значения, определенные в п. 1, а
J представляет собой остаток оксо- или аминопиримидинона, который может быть замещен низшим алкилом, или остаток 6'-хлор- или 6'-гидроксипурина, используемое в качестве промежуточного соединения для получения 1,3-оксатиолана формулы (1).
13. Эфирное производное 1,3-оксатиолана по п. 12, отличающееся тем, что J представляет собой
a R2 и Z имеют значения, определенные в п. 1.
14. Способ получения 1,3-оксатиолана формулы (I), его геометрических или оптических изомеров или их смесей, или его фармацевтически приемлемых солей и эфиров
в которой:
R1 , R2 и Z имеют значения, определенные в п. 1, отличающийся тем, что осуществляют реакцию соединения формулы (VIII)
, (VIII)
в которой
R1 является водородом или гидроксилзащитной группой,
Z имеет значения, определенные в п. 1, а
L представляет собой алкоксикарбонил, йод, бром, хлор или -OR, где R является замещенной или незамещенной, насыщенной или ненасыщенной алкильной группой, или R является замещенной или незамещенной алифатической или ароматической ацильной группой,
с основной группой R2 - Н, и, если это необходимо, полученное соединение подвергают одной или двум дальнейшим реакциям, включающим: удаление любых защитных групп;
превращение соединения формулы (I) или его соли в его фармацевтически приемлемую соль.
15. Способ по п. 14, отличающийся тем, что соединение формулы (VIII) подвергают взаимодействию с соответствующим силиловым, пуриновым или пиримидиновым основанием в подходящем растворителе в присутствии кислоты Льюиса, такой как четыреххлористый титан или хлорид олова, или триметилсилилтрифлат.
16. Способ получения 1,3-оксатиолана формулы (І) в виде его геометрических или оптических изомеров или их смеси или его фармацевтически приемлемых солей или эфиров, отличающийся тем, что осуществляют взаимодействие соединения формулы (IX)
,(IX)
в которой Z и R2 имеют значения, определенные в п. 1, с соединением формулы (X)
(X)
в которой Р является защитной группой, и, если это необходимо, полученное соединение подвергают двум дальнейшим реакциям, включающим: удаление любых защитных групп;
превращение соединения формулы (1) или его соли в его фармацевтически приемлемую соль.
17. Способ по любому из пп. 14 - 16, отличающийся тем, что соединение формулы (I) получают в виде его цис-изомера.
18. Способ по любому из пп. 14 - 17, отличающийся тем, что используют соединения формул (VIII) и (IX), в которых Z представляет собой S.
19. Способ по любому из пп. 14 - 18, отличающийся тем, что в качестве R2 используют радикал формулы:
в которой R3 выбран из водорода и насыщенного С1-6алкила, a R4 - из водорода,
насыщенного С1-6алкила или фтора.
20. Способ по любому из пп. 14 - 19, отличающийся тем, что 1,3- оксатиолан формулы (I) получают в виде:
цис-2-гидроксиметил-5-(цитозин-1'-ил)-1,3-оксатиолана,
транс-2-гидроксиметил-5-(цитозин-1'-ил)-1,3- оксатиолана и их смесей;
цис-2-бензоксиметил-5-(питозин-1'-ил)-1,3-оксатиолана,
транс-2-бензоксиметил-5-(цитозин- 1'-ил)-1,3 оксатиолана и их смесей;
цис-2-гидроксиметил-5-(N'4-ацетилцитозин-1'-ил)-1,3-оксатиолана,
транс-2-гидроксиметил-5-(N'4-ацетилцитозин-1'-ил)-1,3-оксатиоланаи их смесей;
цис-2-бензоилоксиметил-5-(N'4-ацетилцитозин-1'-ил)-1,3-оксатиолана,
транс-2-бензоилоксиметил-5-(N'4-ацетилцитозин-1'-ил)-1,3-оксатиолана и их смесей;
цис-2-гидроксиметил-5-(цитозин-1'-ил)-3-оксо-1,3-оксатиолана;
цис-2-гидроксиметил-5-(N-диметиламинометиленцитозин-1'-ил)-1,3-оксатиолана;
бис-цис-2-сукцинилоксиметил-5-(цитозин-1'-ил)-1,3-оксатиолана;
цис-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиолана,
транс-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиоланна и их смесей;
цис-2-гидроксиметил-5-(6'-гидроксипурин-N-9'-ил)-1,3-оксатиолана;
цис-2-бензоилоксиметил-5-(урацил-N-1'ил)-1,3-оксатиолана,
транс-2-бензоилоксиметил-5-(урацил-N-1 'ил)-1,3-оксатиолана и их смесей;
цис-2-гидроксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана;
цис-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолана,
транс-2-бензоилоксиметил-5-(тимин-N-1 '-ил)-1,3-оксатиолана и их смесей;
цис-2-гидроксиметил-5-(тимин-N-1' -ил)-1,3-оксатиолана;
цис-2-гидроксиметил-5-(5'-фторцитозин-1'-ил)-1,3-оксатиолана и их фармацевтически приемлемых производных.
21. Способ по любому из пп. 14 - 20, отличающийся тем, что 1,3-оксатиолан формулы (I) получают в виде цис-2-гидроксиметил-5-(цитозин-1'-ил)-1,3-оксатиолана и его фармацевтически приемлемых производных.
22. Способ по любому из пп. 14-21, отличающийся тем, что 1,3-оксатиолан формулы (I) получают в виде единственного оптического изомера.
23. Способ по любому из пп. 14-21, отличающийся тем, что 1,3-оксатиолан формулы (I) получают в виде рацемической смеси.
Текст
Настоящее изобретение относится к новым замещенным циклическим производным 1,3оксатиолана, обладающим фармакологической активностью, к способам их получения и промежуточным соединениям, используемым при их получении, к содержащим эти производные фармацевтическим композициям и к использованию этих производных для лечения вирусных заболеваний млекопитающих. Ретровирусные инфекции являются серьезной причиной заболеваний, и что примечательно, синдрома приобретенного иммуннодефицита (СПИД). Вирус иммуннодефицита человека (ВИЧ) признан этнологический агентом СПИДа, и в связи с этим ведется активный поиск соединений, оказывающих ингибирующее действие на мультипликацию ВИЧ. Mitsuya с сотр. сообщает о ”3¢-Азидо-3¢-дезокситимидине (BW A509V) как о противовирусном средстве, ингибирующем инфекционность и цитопатичное действие лимфотропного вируса типа III Т-лимфоцитов человека, связанного с лимфоденопатией вируса in vitro”, Рroc. Natl. Acad. Sci. США, 82, стр. 7096 - 7100 (1985), и ссылается на соединение формулы (Α) (3¢-азидо-2¢,3¢дидезокоитимидин, обычно называемый сокращенно АЗТ. Это соединение, как указано, может быть использовано для некоторой зашиты носителей СПИДа от цитопатогенного действия вируса иммуннодефицита (ВИЧ). O CH3 HN N O HO O (A) N3 В работе Mitsuya с сотр. “Ингибирование in vitro инфекционности и цитопатического действия лимфотропного вируса типа III Т-лимфоцитов человека, связанного с лимфодонопатией вируса (HTLV III/LAV) с помощью 2,3¢-дидезоксинуклеозидов”, Proc.Natl.Acad.Sci. США, 86, стр. 1511 - 15 (1986) также ссылается на группу 2',3'дидезоксинуклеотидов, отраженных формулой (В), которые, как указано, обладают защитной активностью по отношению к вызванной ВИЧ цитопатогенности. В работе Balzarini с сотр. "Сильное и селективное анти-HTLV-111-LAV действие 2¢,3¢дидезоксицитидинена-2',3'-незамещенного производного 2',3'-дидезоксицитидина", Biochem. Biophys. Res. Comm. 140, стр.735 - 742 (1986) ссылается на ненасыщенный аналог таких нуклеозидов (2',3'-дидезоксицитидин, отраженный формулой (С), как характеризующих противоретровирусной активностью. В работе Вава с сотр. "2',3'-дидезокситимидин и его 2',3'-ненасыщенное производное сильные и селективные ингибиторы репликации вируса иммуннодефицита человека in vitro, Biochem. biophys. Res. Comm. 142, стр.128 - 34 (1987) ссылаются на 2'3'-незамещенный аналог, представленный формулой (D), 2',3'-дидезокситимидина. Этот аналог, как указано, является селективным ингибитором репликации ВИЧ. Аналоги АЗТ, известные как 3'-азидо-2',3'-дидезоксиуридины, представленные формулой (Е), в которой Y представляет бром или йод, как указано, обладают ингибирующим действием по отношению к лейкемии Молони мышей. См. Т.S.Lin с сотр. "Синтез и противовирусная активность различных 3'-азидо, 3'-амино, 2',3'-ненасыщенных и 2',З'-дидезокси аналогов пиримидина, дезоксирибонуклеозидов по отношению к ретровирусам" J. Med. Chem. 30, стр.440 - 41 (1987). И, наконец, 3'-фтораналоги 2',3'-дидезоксицитидина /формула (F)/ и 2',3'-дидезокситимидина /формула (G)/ указаны в работе Herdewijn с сотр. "3'-замещенные аналоги 2',3'дидезоксинуклезидов в качестве потенциальных анти-ВИЧ (HTLV-III/LАV) агентов", J. Med. Chem. 30, стр.1270-1278 (1987), как обладающие сильной противоретровирусной активностью. Таким образом, наиболее сильными из вышеперечисленных анти-ВИЧ соединений являются 2¢,3¢-дидезоксинуклеозиды, более конкретно 2',3'-дидезоксицитидин (ddCyd) и 3'-азидо-2',3'дидезокситимидин (AzddThd или АЗТ). Эти же соединения активны и по отношению к другим видам ретровирусов, таким как вирус лейкемии Молони мышей. Вследствие роста случаев заболевания СПИДом с угрозой для жизни расширяются усилия, направленные на открытие и создание новых нетоксичных и мощных ингибиторов ВИЧ и веществ, блокирующих инфекционность ВИЧ. Таким образом, целью настоящего изобретения является создание эффективных анти-ВИЧ соединений с низкой токсичностью, а так же создание легко доступного способа синтеза таких соединений. Нами открыт структурно определенный класс соединений, а именно, 2-замещенных-5замещенных-1,3-оксатиоланов, для которых обнаружена противоретровирусная активность. В частности, было найдено, что эти соединения действуют как нетоксичные ингибиторы репликации ВИЧ-1 в Т-лимфоцитах продолжительные периоды времени. Таким образом, в первом аспекте изобретения дается соединение формулы (1): где R1 представляет водород; R2 представляет радикал, выбранный из: Специалисту понятно, что соединения формулы (1) имеют по меньшей мере, два хиральных центра (обозначены в формуле (1) знаком x), вследствие чего существуют в виде двух пар оптических изомеров (т.е. энантиомеров) и их смесей, в том числе и рецемических смесей. Кроме того соединения формулы (1) могут являться либо цис-изомерами (формула II), либо транс-изомерами (формула III) или смесью этих изомеров. Каждый из цис- и транс-изомеров может существовать как один из двух энантиомеров или в виде смеси энантиомеров, в том числе и в виде рацемической смеси. Все эти изомеры и их смеси, включая рацемические смеси, включены в объем изобретения. Соединения формулы (1) предпочтительно существуют в виде цис-изомеров. Также понятно, что если Ζ представляет S=0, то соединения существуют в двух дополнительных изомерных формах, представленных формулами (IIа) и (IIв), отличающихся друг от друга конфигурацией оксидного атома кислорода относительно 2,5-заместителей. Соединения изобретения дополнительно охватывают такие изомеры и их смеси. Предпочтительно R2 представляет радикал формулы: где R3 и R4 принимают вышеуказанные значения. Под "фармацевтически приемлемым производным" имеется в виду любая фармацевтически приемлемая соль, сложный эфир или соль такого сложного эфира соединения формулы (1) или иного соединения, способного при введении реципиенту образовывать прямо или косвенно соединение формулы (1) или его противовирусно активный метаболит или остаток. Для специалиста очевидно, что соединения формулы (1) могут быть модифицированы с образованием его фармацевтически приемлемых производных по функциональным группам как в фрагменте основания R2, так и в гидроксиметильной группе оксатиоланового цикла. Модификации по этим функциональным группам включены в объем изобретения. Однако, особый интерес представляют фармацевтически приемлемые производные (напр., сложные эфиры), полученные модифицированием 2-гидроксиметильной группы оксатиоланового цикла. Рекомендуемые сложные эфиры соединений формулы (1) включают соединения, в которых R C O R1 заменена карбоксильной функцией , где некарбонильную часть R сложноэфирной группы выбирают из: водорода, алкила нормального или изо-строения (например: метила, этила, н-пропила, трет-бутила, н-бутила), алкоксиалкила (например, метоксиметила), аралкила, (например, бензила), арилоксиалкила (напр., феноксиметила), арила (напр.,фенила, возможно замещенного галогеном, С1 - С4-алкилом или С1 - С4-алкокси-группой); замещенного дигидропиридинила (напр., N-метилдигидропиридинила); сульфонатных эфиров, таких как алкил или аралкилсульфонил (напр., метансульфонил); сульфатных эфиров; аминокислотных эфиров (напр.: L-валила или L-изолейцина) и моно-,ди- и трифосфатных эфиров. В число таких эфиров также включены эфиры, образованные из полифункциональных кислот, таких как карбоновые кислоты, содержащие более одного карбоксила, например, дикарбоновые кислоты формулы НО2С(СН2)nСО2ОН, где n=1 - 10 (например, янтарная кислота) или фосфорные кислоты. Способы получения таких эфиров хорошо известны. См., например, Hahn с сотр., "Димеры нуклеотидов в качестве средств, направленных на вирус иммуннодефицита человека", Nucleotide Analogues, стр.156 - 159 (1989) и Busso с сотр., "Димеры нуклеотидов, подавляющих экспрессию ВИЧ in vitro", AIDS Research and Human Retroviruses, 4 (6), стр.449 - 455 (1988). При образовании эфиров из таких кислот каждая кислотная группа предпочтительно этерифицирована соединением формулы (1) или другими нуклеозидами, или их аналогами и производными с образованием сложных эфиров формулы (IV): где W представляет РО4-, SPO3- или -O-СО-(СН2)n-СО-O-, где J является остатком оксо- или аминопиримидинона, который может быть замещен низшим алкилом, или остаток 6'-хлор или 6'гидроксипурина, R2 и Ζ имеют значения, указанные выше. Что касается выше описанных сложных эфиров, если нет особых указаний, то любой алкильный фрагмент преимущественно содержит 1 - 16 атомов углерода, предпочтительно 1 -4 атома углерода и может содержать одну или несколько двойных связей. Любой арильный фрагмент, присутствующий в таких эфирах, преимущественно представляет собой фенил. В частности, это может быть С1 - С16-алкиловый эфир, незамещенный бензоиловый эфир или бензоиловый эфир, замещенный по меньшей мере одним галогеном (бромом, хлором, фтором или йодом), насыщенным или ненасыщенным С1 - С6-алкилом, насыщенной или ненасыщенной С1 - С6-алкоксигруппой, нитрогруппой или трифторметилом. Фармацевтически приемлемые соли соединений формулы (1) включают соли, образованные с фармацевтически приемлемыми органическими или неорганическими кислотами и основаниями. Примеры приемлемых кислот включают: хлористоводородную, бромистоводородную, серную, азотную, перхлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, п-толуолсульфоновую, винную, уксусную, лимонную, метансульфоновую, бензойную, малоновую, нафталин-2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, такие как щавелевая, хотя и не являясь фармацевтически приемлемыми, могут быть использованы для получения солей, применимых в качестве промежуточных продуктов для получения соединений изобретений и их фармацевтически приемлемых солей с кислотами. Соли, образованные с соответствующими основаниями, включают: щелочнометаллические соли (напр., натриевые), соли щелочноземельного металла (напр., магниевые), аммониевые соли и соли иона NR4+ (где R-С1-С4-алкил). В последующем ссылки на соединение изобретения включают как соединения формулы (1), так и их фармацевтически приемлемые производные. Конкретные примеры соединений формулы (1) включают: цис-2-гидроксиметил-5-(цитозин-1¢-ил)-1,3-оксатиолан; транс-2-гидроксиметил-5-(цитозин-1¢-ил)-1,3-оксатиолан и их смеси; цис-2-бензоилоксиметил-5-(цитозин-1¢-ил)-1,3-оксатиолан; транс-2-бензоилоксиметил-5-(цитозин-1¢-ил)-1,3-оксатиолан и их смеси; цис-2-гидроксиметил-5-(Ν¢4.-ацетил-цитозин-1¢-ил)-1,3-оксатиолан; транс-2-гидроксиметил-5-(N¢4-ацетил-цитозир-1¢-ил)-1,3-оксатиолан и их смеси; цис-2-бензоилоксиметил-5-(N¢4-ацетил-цитозин-1¢-ил)-1,3-оксатиолан; транс-2-бензоилоксиметил-5-(N'4-ацетил-цитозин-1¢-ил)-1,3-оксатиолан и их смеси· цис-2-гидроксиметил-5-(цитозин-1-ил)-З-оксо-1,3-оксатиолан; цис-2-гидроксиметил-5-(N-диметиламино-метиленцитозин-1¢-ил)-1,3-оксатиолан; бис-цис-2-сукцинилоксиметил-5-(цитозин-1¢-ил)-1,3-оксатиолан; цис-2-бензоилоксиметил-5-(6¢-хлорпурин-N-9¢-ил)-1,3-оксатиолан; транс-2-бензоилоксиметил-5-(6¢-хлорпурин-N-9¢-ил)-1,3-оксатиолана и их смеси; цис-2-гидроксиметил-5-(6¢-гидроксипурин-N-9¢-ил)-1,3-оксатиолан; цис-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолан; транс-2-бензоилоксиметил-5-(урацил-N-1¢-ил)-1,3-оксатиолан и их смеси; цис-2-гидроксиметил-5-(урацил-N-1¢-ил)-1,3-оксатиолан; цис-2-бензоилоксиметил-5-(тимин-N-1¢-ил)-1,3-оксатиолан; транс-2-бензоилоксиметил-5-(тимин-N-1¢-ил)-1,3-оксатиолан и их смеси; цис-2-гидроксиметил-5-(тимин-N-1¢-ил)-1,3-оксатиолан; цис-2-гидроксиметил-5-(5¢-фторцитозин-1¢-ил)-1,3-оксатиолан и их фармацевтически приемлемые производные. Соединения изобретения или сами обладают противовирусной активностью и/или способны к метаболизму в такие соединения. В частности, эти соединения эффективны в ингибировании репликации ретровирусов, включая ретровирусы человека, такие как вирусы иммуннодефицита человека (ВИЧ), являющихся причиной возникновения СПИДа. Таким образом, в качестве еще одного аспекта изобретения дается соединение формулы (1) или его фармацевтически приемлемое производное, предназначенное для применения в качестве активного терапевтического средства, в частности, противовирусного средства, например, для лечения ретровирусных инфекций. В еще одном или альтернативном аспекте изобретения дается способ лечения вирусных заболеваний, в частности, вызванных ретровирусом инфекций, таким как ВИЧ у млекопитающих, в том числе и человека, способ заключается в введении эффективного количества противовирусного соединения формулы (1) или его фармацевтически приемлемого производного. Кроме того, еще в одном или альтернативном аспекте изобретения дается применение соединения формулы (1) или его фармацевтически приемлемого производного для приготовления лекарства, предназначенного для борьбы с вирусными инфекциями. Соединения изобретения также применимы для лечения связанных со СПИДом состояний, таких как: родственный СПИДу комплекс (ARC), стойкая генерализованная лимфоденопатия (PGL), связанные со СПИДом невралогические состояния (такие как слабоумие), состояния с анти-ВИЧ положительными антителами и состояния с ВИЧ-положительной реакцией, саркома Капоси, тробоцитопениа пурпура и условно-патогенные инфекции. Соединения изобретения также применимы для профилактики или развития до клинического заболевания отдельных лиц, имеющих анти-ВИЧ антитела или ВИЧ-положительный антиген, а также для профилактики состояний после заражения ВИЧ. Соединения формулы (1) или их фармацевтически приемлемые производные могут быть также использованы для предотвращения заражения вирусом биологических жидкостей, таких как: кровь или семенная жидкость in vitro. Отдельные соединения формулы (1) также применимы в качестве промежуточных соединений при получении других соединений изобретения. Для специалиста очевидно, что ссылки здесь на лечение распространяются и на профилактику, также как на лечение выявленных инфекций и симптомов. Также понятно, что количество соединения изобретения, необходимое для лечения, будет меняться не только в зависимости от выбранного соединения, но также от пути введения, природы подвергаемому лечению состояния, возраста и состояния больного, и полностью находится в компетенции лечащего врача или ветеринара. Как правило, однако, приемлемая дозировка будет составлять интервал 1 - 750мг/кг массы тела в день, например, 3 - 120мг/кг массы тела реципиента в день, предпочтительно 6-90мг/кг/день, наиболее предпочтительно 15 60мг/кг/день. Целевая дозировка может быть дана в виде разовой дозы или в виде раздельных доз, вводимых через соответствующие интервалы, например, в виде двух, трех, четырех и более субдоз ежедневно. Соединение обычно вводят в единичной дозировочной форме, содержащей, например, 10 1500мг, обычно 20 - 1000мг, более обычно 50 - 700мг активного компонента в единичной дозировочной форме. В идеальном случае активный компонент необходимо ввести таким образом, чтобы пиковая концентрация активного компонента в плазме была 1 - 75мкМ, предпочтительно 2 - 50мкМ, наиболее предпочтительно 3 - 30мкМ. Этого можно достигнуть, например, внутривенной инъекцией 0,1 - 5%-го солевого раствора активного компонента, возможно в солевом растворе или введением в виде болюса, содержащего 0,1 - 110мг/кг активного компонента. Целевые концентрации в крови могут быть достигнуты непрерывным вливанием с обеспечением 0,01 5г/кг/час или прерываемыми вливаниями, содержащими 0,4 - 15мг/кг активного компонента. Хотя в лечебных целях и возможно введение соединения изобретения в виде сырого химиката, тем не менее рекомендуется давать активный компонент в виде фармацевтического состава. Таким образом, изобретением кроме того дается фармацевтический состав, содержащий соединение формулы (1) или его фармацевтически приемлемое производное в смеси с одним или несколькими фармацевтически приемлемыми носителями и, возможно, другими лечебными и/или профилактическими компонентами. Носитель(и) должен быть "приемлемым" в смысле совместимости с другими компонентами состава и не оказывать вреда реципиенту. Фармацевтические составы включают составы, пригодные для перорального, ректального, назального, местного (в том числе трансбуккального и подъязычного), вагинального или парентерального (в том числе внутримышечного, подкожного и внутривенного) введения или в форме, приемлемой для введения ингаляцией или инсуффляцией. Составы могут там, где это необходимо, быть введены в отдельных дозировочных формах и могут быть приготовлены любым хорошо известным в фармации способом. Все способы включают стадию смешивания активного соединения с жидкими носителями или мелко измельченными твердыми носителями, или с тем и другим с последующим, если необходимо формованием продукта в целевой состав. Фармацевтические составы, пригодные для перорального введения, могут представлять собой дискретные единичные формы, такие как: капсулы, облатки, таблетки, в каждой из которых содержится заданное количество активного компонента, порошков или гранул, в виде растворов, суспензий или эмульсий. Активный компонент может также присутствовать в болюсе, электуария или пасте. Таблетки и капсулы для перорального введения могут содержать обычные добавки, такие как: связующие средства, наполнители, смазки, размельчители или смачивающие средства. На таблетки может быть нанесено хорошо известными способами покрытие. Пероральные жидкие препараты могут иметь вид, например: водных или масляных суспензий, растворов, эмульсий, сиропов или элексиров, или могут представлять собой сухой продукт, предназначенный для разбавления водой или другим приемлемым носителем перед употреблением. Такие жидкие препараты могут включать обычные добавки, такие как: суспендирующие средства, эмульгаторы, неводные носители (в том числе и пищевые масла) или консерванты. Соединения изобретения могут быть также введены в парентеральные составы (например, для инъекции, такой как болюсная инъекция или непрерывное вливание), могут присутствовать в единичной дозировочной форме в ампулах, предварительно заполненных шприцах, вливаний небольшого объема или комплекте с несколькими дозами с добавленным консервантом. Композиции могут представлять собой суспензии, растворы или эмульсии в масляном или водном носителе и могут включать вспомогательные средства, такие как: суспендирующие, стабилизирующие и/или диспергирующие средства. Или же активный компонент может представлять собой порошок, приготовленный асептическим выделением стерильного твердого компонента путем лиофилизации раствора с последующим разбавлением перед употреблением приемлемым носителем, например, стерильной, не содержащей пирогена водой. Для местного нанесения на эпидермий соединения изобретения могут быть приготовлены в виде мазей, кремов, лосьонов или пластырей. Мази и кремы могут быть приготовлены, например, на водной или масляной основе с добавлением приемлемого загустителя и/или гельобразующего средства. Лосьоны могут быть приготовлены на масляной или водной основе и кроме того, как правило, включают один или несколько эмульгаторов, стабилизаторов, диспергирующих средств, суспендирующих средств, загустителей или красителей. Составы, пригодные для местного употребления в ротовой полости включают: пожиджис, содержащий активный компонент во вкусовой основе, обычно сахарозе, камеди акации или тригиканте; пастилки, содержащие активный компонент в инертной основе, такой как: желатин и глицерин или сахароза и камедь акации; и средство для полоскания рта, содержащее активный компонент в приемлемом жидком носителе. Фармацевтические составы, пригодные для ректального введения и содержащие твердый носитель, наиболее предпочтительно имеют вид свеч с единичной дозой. Приемлемые носители включают: масло какао и другие материалы, обычно применяемые для этой цели, и свечи обычно готовят смешиванием активного соединения с размягченным или расплавленным носителем(ями) с последующим охлаждением и формованием в форме. Составы для вагинального введения могут иметь вид: пессария, тампона, крема, геля, пасты, пены или состава для опрыскивания, содержащих кроме активного компонента такие носители, которые подходят для данной конкретной цели. Для внутриназального введения соединения изобретения могут быть использованы в виде состава для впрыскивания или диспергируемого порошка, или в капельной форме. Капельная форма может быть приготовлена на водной или неводной основе, содержащей кроме того одно или несколько диспергирующих средств, солюбилизирующих средств или суспендирующих средств. Жидкие составы для впрыскивания обычно поступают из находящихся под давлением контейнеров. При введении путем ингаляций соединения изобретения обычно поступают из инсуффлятора, распылителя или находящегося под давлением контейнера, или иного обычного устройства для подачи аэрозольного состава. Находящиеся под давлением контейнера, или иного обычного устройства для подачи аэрозольного состава. Находящиеся под давлением контейнеры могут содержать приемлемый пропеллант, такой как: дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, двуокись углерода или другой приемлемый газ. В случае находящегося под давлением аэрозоля единичная дозировка может быть задана с помощью предусмотренного клапана, подающего отмеренное количество смеси. Или же для введения ингаляцией или инсуффляцией соединения изобретения могут иметь вид сухой порошковой композиции, например, порошковой смеси соединения и приемлемого порошкового основания, такого как: лактоза или крахмал. Порошковая композиция может представлять собой единичную дозировочную форму, например: капсулы или патрона или, например, желатиновых или пузырьковых упаковок, из которых порошок может быть введен с помощью ингалятора или инсуффлятора. При желании вышеописанные составы могут быть преобразованы в составы с продленным выделением активного компонента. Фармацевтические композиции изобретения могут включать и другие активные компоненты, такие как: противомикробные средства или консерванты. Соединения изобретения могут быть также использованы в сочетании с другими лечебными средствами, к примеру, с другими противоинфекционными средствами. В частности, соединения изобретения могут применяться вместе с известными противовирусными средствами. Таким образом, еще одним аспектом изобретения дается комбинация, включающая соединение формулы (1) или его физиологически приемлемое производное в смеси с другим терапевтически активным средством, в частности, противовирусным средством. Выше указанные комбинации обычно предназначены для применения в виде фармацевтического состава, и таким образом, фармацевтические составы, содержащие вышеуказанные комбинации в смеси с фармацевтически приемлемым носителем, представляют еще один аспект изобретения. Приемлемые терапевтические средства, предназначенные для таких комбинаций, включают: ациклические нуклеозиды, такие как: ацикловир, ганцикловир, интерфероны, такие как: альфа,бета-и гамма-интерферон; глюкуронационные ингибиторы, такие, как пробеницид; ингибиторы переноса нуклеозида, такие как дипиридамол; аналоги нуклеозидов, такие как: 3'-азидо-2',3'дидезокситимидин, 2¢,3'-дидезоксицитидин, 2',3'-дидезиоксиаденозин,2',3'-дидезоксиинозин, 2',3'дидезокситимидин, 2',3'-дидезокси-2', 3'-дидегидротимидин и 2',3'-дидезокси-2',3'дидегидроцитидин, а также рибавирин, иммуномодуляторы, такие как: интерлейкин 11(ІL2) и фактор, стимулирующий колонию гранулоцитных макрофагов (GM-CSF), эритропойэтин, амплиген, тимомодулин, тимопентин, фоскарнет, ингибиторы гликозилации, такие как: 2дезокси-D-глюкоза, кастаноспермин, 1-дезоксинойиримицин, ингибиторы связывания ВИЧ с рецепторами CD4, такие как: растворимые CD4, фрагменты CD4 и гибридные молекулы CD4. Отдельные компоненты таких комбинаций могут быть введены или по отдельности, или одновременно в виде отдельных или смешанных фармацевтических составов. При использовании соединения формулы (1) или его фармацевтически приемлемого производного в сочетании со вторым терапевтическим средством, активным к тому же вирусу, доза каждого соединения может быть той же самой или отличаться от дозы, применяемой при отдельном использовании соединения. Необходимая доза может быть легко определена специалистом. Соединения формулы (1) и их фармацевтически приемлемые производные могут быть синтезированы любым применяемым способом получения соединений аналогичного строения. Символы R1 и R2 в нижеследующих формулах имеют вышеприведенные значения, если нет особых указаний. В одном из таких способов (А) используют реакцию 1,3-оксатиолана формулы (VIII): где R1-представляет водород или защитную для гидроксила группу и L является способной к замещению группой или атомом, с соответствующим основанием R2-H; приемлемые группы L включают: алкоксикарбонил, такой как этоксикарбонил или галогены, например: йод, бром или хлор, или радикал -OR, в котором R представляет замещенный или незамещенный, насыщенный или ненасыщенный алкил, например, С1-С6-алкил, такой как метил или R представляет замещенный или незамещенный, алифатический или ароматический ацил, напр., алифатический С1-С6-ацил, такой как ацетил и ароматический ацил, такой как бензоин. Соединение формулы (VIII) вводят в реакцию с соответствующим пуриновым или пиримидиновым основанием формулы·R2-H, (предварительно силилированным с помощью силилирующего агента, такого как гексаметилдисилазан) в приемлемом растворителе, таком как хлористый метилен, в присутствии кислоты Льюиса (такой как: четыреххлористый титан или хлорид олова (IV) или триметилсилилтрифлата. 1,3-оксатиолан формулы (VIII) может быть приготовлен, например, реакцией альдегида формулы (VII) с меркаптоацеталем формулы (VI) в приемлемом органическом растворителе, таком как толуол, в присутствии кислотного катализатора, такого как: п-толуолсульфокислота или кислота Льюиса, напр., хлористый цинк. (VI) НSСН2СН(ОС2Н5)2, С6Н5СООСН2СНО (VII) Меркаптоацеталь формулы (VI) может быть синтезирован известными способами. См., например, G.Hesse and I.Torder, "Меркаптоацетальдегид и диокси-1,4-дитиан", Chem. Ber, 85, стр.924 - 932(1952). Альдегид формулы (VII) может быть получен известными способами. См., например, E.G. Halloquist and H.Hibbert, “Исследования в области связанных с углеводами и полисахаридами реакций. Часть XLIV. Синтез изомерных бициклических ацетальных простых эфиров", Can.J.Research,8,стр.129 - 136(1933). Полученное соединение формулы (1) превращают в другое соединение формулы (1) путем взаимопревращения оснований. Подобное взаимопревращение может быть осуществлено либо простым химическим превращением (напр., превращением урацилового основания в цитозин) или ферментным путем использованием, например, дезоксирибозилтрансферазы. Такие способы и условия их осуществления хорошо известны в области химии нуклеозидов. В другом способе соединения формулы (1) могут быть получены реакцией соединения формулы (IX): с соединением формулы (X): где Ρ представляет защитную группу, с последующим удалением защитной группы. Соединение формулы (IX) может быть синтезировано реакцией приемлемого эпоксида формулы (XI): с соответствующим серосодержащим соединением, например, тиоацетатом натрия. Соединения формулы (XI) либо известны, либо могут быть синтезированы по аналогичным методикам. Многие из вышеприведенных реакций имеют обширную литературу в контексте синтеза пуриновых нуклеозидов. См., например, "Аналоги нуклеозидов: химия, биология и применение в медицине", под ред. R.Т. Walkeretal., Пленум Пресс, Нью-Йорк, стр.193 - 223, текст данной публикации вводится здесь в качестве ссылки. Очевидно, что вышеприведенные реакции могут потребовать применения защитных групп или могут быть осуществлены с использованием исходных соединений с защищенными функциональными группами, вследствие чего для получения целевого соединения может оказаться необходимым удаление на промежуточной или конечной стадии защитной группы. Защита и снятие защиты с функциональных групп могут быть осуществлены с помощью обычных средств. Примеры приемлемых защитных для гидроксила групп включают: алкил (например, метил, третбутил или метоксиметил), аралкил (например, бензил, дифенилметил или трифенилметил), гетероциклические группы, такие как тетрагидропиранил, ацил (например, ацетил или бензоил) и синильные группы, такие как триалкилсилил (например, третбутилдиметилсилил). Защищающие гидроксил группы могут быть удалены обычными методами. Так, например, алкил, силил, ацил и гетероциклические группы могут быть удалены сольволизом, например, гидролизом в присутствии кислоты или основания. Аралкильные группы, такие как трифенилметил могут быть так же удалены сольволизом, например, кислотным или щелочным гидролизом. Аралкильные группы, такие как бензил могут быть отщеплены, например, обработкой эфиратом BF3 и уксусным ангидридом с последующим удалением ацетатных групп, образующихся на соответствующих стадиях синтеза. Силильные группы могут быть легко удалены использованием источника фторид-ионов, такого как тетра-нбутиламмонийфторид. В вышеописанных способах соединения формулы (1), как правило, образуются в виде смеси цис- и транс-изомеров. Эти изомеры могут быть разделены, например, ацетилированием, например, обработкой уксусным ангидридом с последующим разделением физическими методами, например, хроматографией на силикагеле и дезацетилированием, например, обработкой метанольным раствором аммиака или же фракционной кристаллизацией. Фармацевтически приемлемые соли соединений изобретения могут быть получены так, как описано в патенте США №4383114, описание которого вводится здесь в виде ссылки. Так, например, если необходимо получить соль соединения формулы (1) с кислотой, продукт, полученный по любому из вышеприведенных способов, может быть превращен в соль обработкой полученного свободного основания кислотой использованием обычных методик. Фармацевтически приемлемые соли с кислотами могут быть получены реакцией свободного основания с соответствующей кислотой, возможно в присутствии приемлемого растворителя, такого как: сложный эфир (например, этилацетат), спирта (напр, метанол, этанол или изопропанол). Соли с неорганическими основаниями могут быть получены реакцией свободного основания соединения формулы (1), с соответствующим основанием, таким как алкоксид (например, метоксид натрия), возможно в присутствии растворителя, такого как спирт (например, метанол). Фармацевтически приемлемые соли могут быть также получены из других солей, в том числе других фармацевтически приемлемых солей соединений формулы (1) использованием обычных методик. Соединение формулы (1) может быть превращено в фармацевтически приемлемый фосфат или иной сложный эфир в реакции с фосфорилирующим агентом, таким как РОСl3 или приемлемым этерифицирующим агентом, таким как: галоидангидрид кислоты или ангидрид. Сложный эфир или соль соединения формулы (1) могут быть превращены в исходное соединение, например, гидролизом. Так, где соединение формулы (1) желательно иметь в виде отдельного изомера, тот может быть получен либо разделением конечного продукта, либо стереоспецифичным синтезом из изомерно чистого исходного соединения или любого обычного промежуточного соединения. Разделение конечного продукта, исходных или промежуточных соединений на изомеры может быть осуществлено любым известным способом. См., например, стереохимию соединений углерода, E.L. Eliel (МасГроу Хилл, 1962), а также таблицу разделяющих средств, S.Н.-Wilen. Далее изобретение иллюстрируется нижеследующими примерами, которые ни в коей мере не предназначены для его ограничения. Все температуры даны в градусах Цельсия. Примеры Пример1 Диэтилацеталь 2-тиобензоилацетальдегида C6H5COS-СН2СН(ОС2Н5)2 (V) К раствору трет-бутоксида калия (11,5г, 0,11моля) в ДМФА (100мл) добавляют тиобензойную кислоту (17г, 0,11моля) и раствор частично испаряют в вакууме, двумя последовательными порциями добавляют бензол (2 х 30мл) и каждый раз испаряют в вакууме. К остаточному раствору ДМФА добавляют диэтилацеталь бромацетальдегида (20,3г, 0,1моля) и смесь перемешивают 15ч при 120°. После охлаждения смесь переносят в воду (500мл), продукт экстрагируют эфиром (3 х 200мл), экстракт промывают водным раствором NaНСО3, затем водой, сушат и растворитель удаляют в вакууме. Остаток разгоняют в вакууме и получают 17,2г чистого соединения (V), т. кип. 131 - 133°/0,07мм. 1 Н-ЯМР s (ч/млн, CDCl3): 7,97 (д, 2Н, ароматические), 7,47 (м, 2Н, ароматические), 4,59 (т, 1Н, -СН(ОС2H5)2), 3,66 (м, 4Н, 2 x ОСН2СН3), 3,3 (д, 2Н, SCH2), 1,23 (т, 6Н, 2 x ОСН2СН3). Пример2 Диэтилацеталь меркаптоацетальдегида HS СН2СН(ОС2Н5)2 (VI) Описанный в предыдущем тиобензоилпроизводное (V) (17,2г) растворяют в 100 мл ТГΦ, после чего добавляют 6г NаОН в 20мл Н2О. Смесь кипятят в атмосфере N2 15ч, затем охлаждают, разбавляют водой (200мл) и продукт экстрагируют эфиром (3 х 200мл). Экстракт сушат, растворитель удаляют в вакууме и перегонкой остатка в вакууме получают 7,1г чистого соединения (VI), т. кип. 60 - 62°/18мм. 1 Н-ЯМР s (ч/мин, С Сl3): 4,51 (т, 1Н, СН(ОС2Н5)2), 3/51 (м, 4Н, 2 x ОСН2СН3), 2,65 (дв. д, 2Н, Н-СН2), 1,54 (т, 1Н, HS), 1,23 (т, 6Н, 2 x ОСН2СН3). ПримерЗ Бензоилоксиацетальдегид С6Н5СООСН2СНО (VII) Заглавное известное промежуточное соединение синтезировано ранее не описанным способом на основе известного 1-бензоилглицерина. А именно, 50г последнего в смеси 500мл СН2СІ2 и 25мл Н2О обрабатывают порциями 80г NaIO4, (интенсивное перемешивание при комнатной температуре). По окончании прибавления перемешивание продолжают 2ч, после чего добавляют 100г МgSО4 и перемешивание продолжают еще 30мин. Смесь фильтруют, фильтрат испаряют в вакууме и перегонкой остатка в вакууме получают 26г чистого соединения (VII), т. кип. 92 - 94° (0,25мм). 1 Н-ЯМР (200МГц, CDCl3, ТМС - внутренний стандарт) s (ч/млн): 9,71 (с, 1Н, -СНО), 8,11 (ж, 2Н, ароматические), 7,6 (м, 1Н, ароматические), 7,46 (м, 2Н, ароматические), 4,88 (с, 2Н, -CH2CHO). Пример4 2-Бензоилоксиметил-5-этокси-1,3-оксатиолан Ранее описанный ацеталь меркаптоацетальдегида (VI) (7г) смешивают в 100мл толуола с 7г вышеописанного бензоилокси-ацетальдегида (VII), несколькими кристаллами птолуолсульфокислоты и смесь нагревают в атмосфере N2 на масляной бане при 120°. Образующемуся этанолу позволяют отгоняться, смесь выдерживают при 120° еще 30мин, затем охлаждают, промывают водным раствором NаНСO3, сушат и испаряют в вакууме. Перегонкой остатка в вакууме получают 9,8г чистого соединения (ХIII) в виде смеси цис- и транс-изомеров, т. кип. 140 - 143°/0,1мм, Rf0,51 (гексан-ЕtОаС). s (ч/млн, СDСl3): 8,05 (м 2Н, ароматические), 7,57 (м, 1Н, ароматический), 7,43 (м, 2Н, ароматические), 5,55 (м, 2Н, С2-Н, С5-Н), 4,55 (м, 2Н, С2-С6Н5СО2СН2), 3,8 (м, 1Н, С5-C6H5CО2CH2), 3,76 (м, 1Н, С5-ОСН2СН3), 3,17 (м, 2Н, С4-Н2), 1,21 (т, ЗН, С5-ОСН2СН3). Пример5 Цис- и транс-2-Бензоилоксиметил-5-цитозин-1¢-ил-1,3-оксатиоланы Смесь 2,7г цитозина, 30мл гексаметилдисилазана (ГМДС) и триметилсилилхлорида (ТМСХ) кипятят в сухом N2 до образования прозрачного раствора (3 часа) и избыток реагентов испаряют в вакууме. Оставшиеся летучие компоненты удаляют в глубоком вакууме (15мин), твердый остаток переносят в 250мл 1,2-дихлорэтана и в сухом аргоне добавляют 5г вышеописанного ключевого промежуточного соединения (ХIII) в 50мл дихлорэтана и затем 4,7мл триметилсилилтрифлата (ТМСТФ). После трехдневного кипячения в токе аргона, смесь охлаждают и переносят в З00мл насыщенного водного раствора NaHCO3. Органический слой отделяют, водную фазу экстрагируют СН2Сl2 (2 х 100мл), объединенные экстракты промывают водой, сушат и испаряют в вакууме. Остаток очищают хроматографией на силикагеле с применением в качестве элюента СН2Сl2-СН3ОН (9:1) и получают 2,5г чистой смеси цис-/транс(ХIV) в отношении 1:1, что подтверждено данными 1Н-ЯМР. Смесь разделена в виде Nацетилпроизводных по методике, описанной в нижеследующем примере. Пример6 Цис- и транс-изомеры 2-бензоилоксиметил-5-(N4¢-ацетилцитозин-1'-ил)-1,3-оксатиолана Описанную в предыдущем примере смесь (ХIV) (2,5г) в 100мл сухого пиридина, содержащего 0,1г 4-диметиламинопиридина (ДМАП), обрабатывают уксусным ангидридом (7мл) при комнатной температуре и спустя 6ч смесь переносят в холодную воду, после чего экстрагируют СН2Сl2, (3 x 150мл). Экстракт промывают водой, сушат и испаряют в вакууме. К остатку добавляют толуол, затем испаряют в вакууме, остаточное масло очищают хроматографией на силикагеле (EtOAc-CH3OH 99:1) и получают 1,35г чистого транс-(ХV) в виде более быстро вымываемого продукта и 1,2г чистого цис-(ХV) в виде медленно вымываемого продукта. Оба охарактеризованы 1Н-ЯМР спектроскопией. Транс-(ХV), т. пл. 158 - 160°, Rf 0,48 (EtOAc-CH3OH 95:5). УФ (СН3ОН) lmax:297нм s (ч/млн, CDCl3): 9 (уш., 1Н, С4'-Η-Ac), 8,06 (м, 2Н, ароматические), 7,74 (д, 1Н, С6'-Н), 7,56 (м, 1Н, ароматический), 7,47 (д, 1Н, С5'-Н), 7,45 (м, 2Н, ароматические), 6,53 (дв. д, 1Н, С5-Н), 5,89 (дв. д, 1Н, С2-H), 4,46 (дв. д, 2Н, С2-СН2ОСОС6Н5), 3,66 (дв. д, 1Н, С4-Н), 3,32 (дв. д, 1Н, С4-Н), 2,25 (с, 3Н, NH-СОСН3). Цис-(ХV), т. пл. 150-152°, Rf.: 0,4 (EtOAc-MeOH 95:5). УФ (СН3ОН) lmax: 297нм. 1 Н-ЯМР s (ч/млн, CDCl3): 9,03 (уш., NН-Ас), 8,21 (д, 1Η, С6'-H), 8,05 (м, 2Н, ароматические), 7,6 (м, 1Н, ароматический), 7,5 (м, 2Н, ароматические), 7,29 (д, 1Н, С5'-Н), 6,34 (дв. д, С5-Н), 5,52 (дв. д, 1Н, C2-H), 4,8 (дв. д, 2Н, С2-СН2ОСОС6H5), 3,66 (дв. д, 1Н, С4-Н), 3,24 (дв. д, 1Н, С4-Н), 23 (с, 3Н, NH-СОСН3). Пример7 Цис- и транс-2-гидроксиметил-5-(цитозин-1¢-ил)-1,3-оксатиоланы а) транс-(XVI). В 100мл метанольного раствора аммиака при 24° растворяют 375мг ранее полученного транс-(ХV) и перемешивают 16ч, после чего растворитель удаляют в вакууме, а остаток кристаллизуют из эфира и после перекристаллизации из смеси этанола с эфиром получают 174мг чистого продукта, т. пл. >220° (разл.), охарактеризованного 1Η - и 13С-ЯМР спектрами. 1 Н-ЯМР s (ч/млн), ДМСО-d6): 7,57 (д, 1Н, C6¢-H), 718 (д, 2Н, С4¢NН2), 6,30(дв. д, 1Н, C5-H), 5,68 (д, 1Н, C5¢-H), 5,48 (т, 1Н, С2-Н), 5,18 (т, 1Н, С2-СН2ОН), 5,45 (м, 3Н, С2-СН2ОН+С4-Н), 3,06 (дв. д, 1Н, С4-Н). УФ (СН3OН) lmax: 270нм. 13 С-ЯМР (ДМСО-d6, Вариан XL-300) s (ч/млн): C2¢ 154,71 C3¢ 165,7 C5¢ 93,47 C6¢ 140,95 C5 87,77 C4 36,14 C2 86,80 CH2ОН 64,71 в) цис-(ХVI). Обработкой по вышеприведенной методике 375мг цис-(ХV) получают 165мг чистого продукта, перекристаллизованного из смеси этанола с эфиром, т. пл. 171 - 173°, охарактеризованного 1Н- и 13С-ЯМР спектрами. 1 Н-ЯМР s (ч/млн, ДМСО-d6): 7,8 (д, 1Н, С6¢-Н), 7,2 (д, 2H, С4¢-NН2), 6,18 (т, 1Н, С5-Н), 5,7 (д, 1Н, С5¢-Н), 5,14 (т, 1Н, С2-СН2ОН), 3,71 (м, 2Н, С2-СН2ОН), 3,4 (дв. д, 1Н, С4-Н), 2,99 (дв. д, 1Н, С4-Н). УФ (СН3ОН) lmax: 270нм. 13 С2¢ 154,63 С-ЯМР s (ч/млн, ДМСО-d6): С4¢ С5¢ С6¢ 165,59 93,86 140,91 С5 86,47 C4 36,22 C2 85,75 CH2OH 62,79 Пример8 Цис-2-Гидроксиметил-5-(цитозин-1'-ил)-З-оксо-1,3-оксатиолан Ранее полученный изомер цис-(ХVІ) (100мг) в 30мл охлажденного льдом метанола обрабатывают 93мг м-хлорнадбензойной кислоты. После 15-ти минутного перемешивания выделяется белый осадок, который отделяют и промывают 10мл метанола с получением чистого изомера а сульфоксида. Метанольный фильтрат испаряют в вакууме, твердый остаток промывают 15мл смеси этанола с эфиром (1:1) и затем 30 мл эфира с получением чистого изомера в сульфоксида. Оба изомера охарактеризованы 1Н-ЯМР спектрами. Изомер (ХVII)а Т. пл. > 270° (разл.), Rf=0,3 (СН2Сl2-МеОН 3:1), УФ (СН3ОН) λmax:270нм. s (ч/мл, ДМСО-d6): 7,68 (д, 1Н, С6'-Н), 7,36 (с, 2Н, C4¢-NH2), 6,69 (дв., д, 1Н, С5-Н), 5,76 (д, 1Н, C5'-Η), 5,47 (т, 1Н, С2-СН2ОН), 4,63 (дв. д, 1Н, С2-Н), 3,88 (м, 1Н, С2-СН-ОН), 3,72 (м, 1Н, С2-СН2-ОН), 3,36 (дв., д, 1Н, С4-Н), 3,05 дв. д, 1Н, С4-Н). Изомер (ХVII)в Т. пл.>22О° (разл.), Rf=0,32 (СН2Сl2-МеОН 3:1) s (ч/млн, ДМСО-d6): 7,76 (д, 1Н, C6'-H), 7,28 (д, 2Н, C4-NH2), 6,66 (дв. д, 1Н, С5-Н), 5,77 (д, 1Н, С5'-Н), 5,45 (τ, 1Η, C2-СН2ОН), 4,64 (т, 1Н, С2-Н), 3,77 (т, 2Н, С2-СН2ОН), 3,65 (дв. д, 1Н, С4-Н), 3,17 (дв., д, 1Н, С4-Н). Пример9 Цис-2-Гидроксиметил-5-(N-диметиламинометиленцитозин-1'-ил)-1,3-оксатиолан. В 10мл N-диметилформамид-диметилацеталя (ДМФА-диметилацеталь) суспендируют З00мг цис-2-гидроксиметил-5-(цитозин-1'-ил)-1,3-оксатиолана и смесь перемешивают при комнатной температуре около суток (18 часов). Летучие компоненты удаляют испарением при пониженном давлении и перекристаллизацией остатка из смеси этанола с эфиром получают 345мг (93%) чистого продукта, т. пл. 162 - 164°; Rf=0,56 (СН2Сl2-МеОН 4:1). УФ lmax: 325нм. 1 Е-ЯМР s (ч/млн, ДМСО-d6): 8,64 (1H, N=СН-N), 8,04 (д, 1Н, д, 1Н, Сб'-Н, J=7,2Гц), 6,22 (т, 1Н, C5-H, J=4,9Гц), 5,97 (д, 1Н, С5'-Н, J=7,2Гц), 5,37 (т, 1Н, -OH, J=5,8Гц, D2O-обмен), 5,22 (т, 1Н, С2-Н, J=4,4Гц), 3,77 (т, 2Н, С2-CH2OH, J=4,9Гц), 3,5 (дв. д, 1Н, С4-Н, J=4,9 и 9,9Гц), 3,17 (с, ЗН, -CН3), 3,12 (дв, д, 1Н, С4-Н, J=4,2 и 11,9Гц), 3,04 (с, ЗН, -СН3). Пример10 Бис-цис-2-сукцинилоксиметил-5-(цитозин-1'-ил)-І,3-оксатиолан В 10мл сухого пиридина растворяют 284мг цис-2-гидроксиметил-5-(Ν,Νдиметиламинометиленцитозин-1'-ил)-1,3-оксатиолана и охлаждают в бане со льдом до 0°С. Шприцем прибавляют 60мкл сукцинилхлорида и перемешивают около суток (18 часов). Затем смесь переносят в 50мл насыщенного раствора NaHCO3, экстрагируют хлористым метиленом (3 х 50мл), объединенный раствор СН2-Сl2 промывают водой (2 x 50мл) и сушат над MqSO4. После фильтрования растворитель удаляют испарением при пониженном давлении. Пенистый остаток растворяют в 10мл СН2Сl2, содержащих 5мл метанола, добавляют 2мл 80%-й водной уксусной кислоты и смесь перемешивают около суток при комнатной температуре. Затем смесь испаряют досуха и после очистки·твердого остатка на силикагеле (СН2СІ2-МеОН 4:1) получают 145мг (54%) чистого продукта, т. пл.>230С° (разл.) Rf=0,23 (СН2Сl2-МеОН 4:1). УФ (МеОН) lmax:271нм. 1 Н-ЯМР s (ч/млн, ДМСО-d6): 7,69 (д, 2Н, 2 x С6'-Η, J=7,6Гц), 7,28 (д, 4Н, 2 х NН2, =24,9Гц,D2O-обмен), 6,24 (т, 2Н, 2 x С5-Н, J=5,6Гц), 5,76 (д, 2Н, 2 x С5-Н, J=7,4Гц), 5,35 (т, 2Н, 2 x С2-Н, J=4,5Гц), 4,37 (д, 2 x С2-СН2O-), 3,42 (дв. д, 2 x С4-Н, J=5,5 и 10,9Гц), 3,1 (дв. д, 2Н, 2 x C4-Η, J=5,6 и 11,7Гц), 2,6 (с, 4Н, 2 x -СН2-С-О). Пример11 Цис- и транс-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3-оксатиоланы В 50мл гексаметилдисилазана (ГМДС), содержащих 50мг (NH4)2SO4 кипятят 1,7г 6хлорпурина до момента образования прозрачного раствора (1 час). Избыток ГМДС удаляют при пониженном давлении, маслянистый остаток сушат 1ч в глубоком вакууме и затем растворяют в 100мл сухого 1,2-дихлорэтана. В круглодонной колбе на 500мл двукратным испарением с 50мл бензола сушат 2,7г 2бензоилоксиметил-5-этокси-1,3-оксатиола (ХIII) и затем растворяют в 200 мл сухого 1,2-дихлорэтана. Затем с помощью канюли в атмосфере аргона переносят раствор силилированного 6хлорпурина в раствор 1,3-оксатиолана. В реакционную колбу добавляют 11мл 1М ТМСтрифлата (триметилсилилтрифторметансульфоната), кипятят 5 часов и охлаждают до комнатной температуры. Затем смесь переносят в 300мл насыщенного раствора бикарбоната натрия (раствор NaHCO3) при перемешивании, органический слой отделяют, а водную фазу экстрагируют СН2Сl2 (2 х 100мл). Объединенную органическую фазу промывают водой, сушат над МgSO4, фильтруют и испаряют при пониженном давлении. Очисткой и разделением остатка на силикагеле (гексан-этилацетат 7:3) получают 1,05 (28%) менее полярного продукта в виде пены, идентифицированного как альфа-или транс-изомер, и 710мг другого компонента, идентифицированного как бета- или цис-изомер. Общий выход 46,1%, отношение цис-/транс-1:1,4. транс-изомер (a-изомер): Rf=0,43 (гексан-EtOAc 1:1) УФ (МеОН) lmax:264,7нм 1 Н-ЯМР (CDCl3): 8,76 (с, 1Н, С8'-Н), 8,48 (с, 1Н, С2'-Н), 8,06 (м, 2Н, ароматические), 7,56 (м, 1Н, ароматический), 7,45 (м, 2Н, ароматические), 6,9 (дв.д, 1Н, С5-Н, J=5Гц), 5.78 дв. д, 1Н, С2'-Н, J=6Гц), 4,56 (м, 2Н, С2-СН2ОСОС6Н5), 3,74 (м, 2Н, С4-Н). цис-изомер (b-изомер): Rf=0,35 (гексан-EtОАс 1:1) УФ (МеОН) lmax:264,7нм 1 Н-ЯМР (CDCl3): 8,72 (с 1Н, С8'-Η), 8,51 (с, 1Н, С2'-Η), 8 (м, 2Н, ароматические), 7,56 (м, 1Н, ароматический), 7,44 (м, 2Н, ароматические), 6,61 (т, 1Н, C5-H, J=4,7Гц), 5,62 (т,1Н, С2-Н, J=4,9Гц), 4,69 (м, 2Н, С2-СН2ОСОС6Н5), 3,66 (м., 2Н, С4-Н). Пример12 Цис-2-Гидроксиметил-5-(6'-гидроксипурин-9'-ил)-1,3-оксатиолан (производное инозина) В 25мл метанола растворяют 533мг цис-2-бензоилоксиметил-5-(6'-хлорпурин-N-9'-ил)-1,3оксатиолана, к раствору добавляют 5г гидроксида натрия (NaOH) и 3мл воды и смесь кипятят 5 часов. Охлажденную до комнатной температуры смесь затем разбавляют 100мл воды, нейтрализуют пиридиниевой смолой и фильтруют. Остаток смолы промывают 100мл метанола, объединенный фильтрат испаряют при пониженном давлении. Очисткой остатка на силикагеле (СН2Сl2-МеОН 4:1) получают 183мг (51%) чистого продукта, идентифицированного как производное инозина, т. пл., 208 - 210°С. Rf=0,27(ЕtOАс-МеОН 4:1). УФ (МеОН) lmax:246нм. 1 Н-ЯМР s (ч/млн, ДМСО-d6): 12,42 (с, 1Н, -NH, D2O-обмен), 8,36 (с, 1Н, С8'-Н), 8,07 (с, 1Н, С2'-1Н), 6,37 (т, 1Н, С5-Н, J=5,1Гц), 5,29 (т, 1Н, -ОН, J=6Гц, D2O-обмен), 5,24 (т, 1Н, C2-H, J=4,9Гц), 3,63 (м, 4Н, 2Н от С4-Н и 2Н от СН2-ОН). Пример13 Цис- и транс-2-бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-октиолан В 30мл ГМДС в присутствии 50мг (NH4)2 SО4 кипятят 760мг урацила до момента, пока раствор не станет прозрачным. Затем смесь испаряют при пониженном давлении, остаток сушат 1 час в высоком вакууме и растворяют в 100мл сухого 1,2-дихлорэтана. В круглодонной колбе на 500мл двукратным испарением с 50мл бензола сушат 1,5г 2бензоилоксиметил-5-этокси-1,3-оксатиолана и растворяют в 150мл сухого 1,2-дихлорэтана. С помощью канюли в атмосфере аргона раствор силилированного урацила переносят в раствор оксатиолана, добавляют 1,5мл ТМС-трифлата и реакционную смесь кипятят 48 часов в атмосфере аргона. Охлажденную до комнатной температуры смесь переносят в насыщенный раствор NaHCO3 (30мл), органический слой отделяют, водную фазу дважды экстрагируют СН2Сl2 (2x100мл). Объединенный органический слой промывают водой (2x200мл), один раз раствором NаСl (1x150мл) и сушат над ΜgSO4. После фильтрования растворитель удаляют в вакууме и очисткой остатка на силикагеле (гексан-EtОАс 1:1) получают 594мг (32%) чистого продукта. Продукт дает только одно пятно в ТСХ. Однако, 1Н-ЯМР спектр показывает присутствие двух изомеров (цис- и транс-) в отношении 1:1,2, которые не были разделены на данной стадии. Rf=0,35 (гексан-EtOAc 3:7). УФ (МеОН) lmax:261нм. 1 Н-ЯМР s (ч/млн, СDCІ3): 8,88 (уш, с, 1Н, N3'-H), 8,05 (м, 2Н, ароматические), 7,71 (д, 1Н, C6'-Н-цис, J=8,2Гц), 7,57 (м, 1Н, ароматический), 7,45 (м, ЗН, ароматические и N3¢-Н), 6,55 (дв. д, 1Н, С5-Н-транс, J=2,4 и 5,4Гц), 6,35 (дв. д, 1Н, С5-Н-цис, J=4,1 и 5,6Гц), 5,79 (т, 1Н, С2-Н-транс, J=5,4Гц), 5,73 (д, 1Н, С5'-Н, J=8,2Гц), 5,57 (д, 1Н, С5'-Н, J=8,2Гц), 5,46 (т, 1Н, С2-Н-цис, J=3,9Гц), 4,73 (д, 2Н, СН2O-СОС6Н5), 4,45 (т, 2Н, -СН2ОСОС6Н5), 3,57 (м, 1Н, С4-Н), 3,17 (м, 1Н). Пример14 Цис-2-Гидроксиметил-5-(урацил-N-І'-ил)-1,3-оксатиолан В 75мл метанольного раствора аммиака растворяют 300мг смеси цис- и транс-2бензоилоксиметил-5-(урацил-N-1'-ил)-1,3-оксатиолана и смесь перемешивают около суток при комнатной температуре. После испарения растворителя досуха остаток очищают и разделяют на два изомера хроматографией на силикагеле (EtOAc-MeOH 98:2). Преобладающий продукт, выделенный в качестве твердого вещества, идентифицирован как цис-изомер. цис-изомер. Т. пл. 162 - 164°С. Rf=0,57 (EtOAc-MeOH 95:5). УФ (МеОН) lmax:261,4нм. 1 Η-ΗΜΡ s (ч/млн, ДМСО-d6): 11,36 (с, 1Н, N3'-Н), 7,88 (д,1Н, C6'-H, J=8,1Гц), 6,18 (т, 1Н, C5-H, J=4,8Гц), 5,62 (д, 1Н, С5'-Н, J=8,1Гц), 5,33 (т, 1Н, C2-H, J=5,7Гц), 5,17 (т, 1Н, -ОН, D2О-обмен), 3,72 (т, 2Н, С2-СН2ОН, J=4,6Гц), 3,41 (дв. д, 1Н, С4-Н, J=5,7 и 12 Гц), 3,2 (дв, д, 1Н,С4-Н, J=4,6 и 9,8Гц). Пример15 Цис- и транс-2-Бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиоланы В 50 мл ГМДС, содержащих 50 мг (NH4)2SO4 кипятят 1,7-тимина до момента, пока раствор не станет прозрачным. Затем смесь испаряют при пониженном давлении. Остаток сушат 1 час в глубоком вакууме и растворяют в 150мл 1,2-дихлорэтана. Двукратным испарением с 75мл бензола сушат 3г 2-бензоилоксиметил-5-этокси-1,3оксатиолана и растворяют в 150мл сухого 1,2-дихлорэтана. Раствор силилированного тимина через канюлю в атмосфере аргона переносят в раствор оксатиолана и в реакционную смесь через канюлю в атмосфере аргона вводят 3,3мл ТМСтрифлата (триметилсилил-трифата в 30мл сухого 1,2-дихлорэтана. Раствор кипятят в атмосфере аргона 36 часов, охлаждают до комнатной температуры и переносят в 30мл насыщенного водного раствора NаНСО3. Органический слой отделяют и водную фазу дважды экстрагируют хлористым метиленом (2 х 100мл). Объединенную органическую фазу дважды промывают водой (2 x 200мл), один раз раствором NаСl (1 x 150мл) и сушат над MgSO4. Раствор фильтруют, фильтрат испаряют в вакууме и хроматографией остатка на силикагеле (гексанEtОАс 1:1) получают 1,3г (35%) чистого продукта. Продукт дает только одно пятно в ТСХ, но 1Н-ЯМР спектр показывает наличие двух изомеров (цис- и транс) в отношении 1:1,2. Rf=0,3 (гексан-EtOAc). УФ (МеОН) lmax.:266нм. 1 Н-ЯМР (ч/млн, СDСl3): 8,6 (уш, с, N3¢-H), 8,06 (м, 2Н, ароматические), 7,59 (м, 1Н, ароматический), 7,49 (м, 2Н, ароматические), 7,38 (д, 1Н, C6'-цис, J=1,3Гц), 7,28 (д, 1Н, C6'-транс, J=1,3Гц), 6,55 (дв. д, 1Н, С5-Н-транс-изомер. J=3,1 и 5,6Гц), 6,38 (т, 1Н, С5-Н-цис-изомер, J=5,5Гц), 5,78 (дв., д, 1Н, С2-Н-транс, J=4,4 и 6,4Гц), 5,46 (т, 1Н, С2-Н-цис-изомер, J=4,3Гц), 4,69 (д, 2Н, С2-СН2ОСОС6Н5, J=4,2 Гц), 4,45 (м, 2Н, С2-СН2ОСОС6Н5), 3,58 (м, 1Н, С4-Н), 3,13 (м, 1Н, С4-Н), 1,93 (д, 1Н, С5'-СН3-транс-изомер, J=1,2Гц), 1,78 (д, 1Н, С5'-СН3-цис-изомер, J=1,2Гц). Пример16 Цис-2-Гидроксиметил-5-(тимин-N-1'-ил)-1,3-оксатиолан В 100мл насыщенного метанольного раствора аммиака растворяют 500мг смеси цис- и транс-2-бензоилоксиметил-5-(тимин-N-1'-ил)-1,3-оксатиоланов (ХХIV) и смесь перемешивают около суток (18 часов) при комнатной температуре. После испарения смеси при пониженном давлении остаток разделяют на силикагеле (EtOAc-MeOH 98:2). Менее полярный продукт идентифицирован как цис-изомер, т. пл. 167 - 168°С. Rf=0,66 (EtOAc-MeOH 95:5). УФ (МеОН), lmax:266нм 1 Н-ЯМР s (ч/млн, ДМСО-d6): 11,38 (с, 1Н, N3'-Н), 7,73 (д, 1Н, С'-Н, J=1,1Гц), 6,16 (т, 1H, C5-H, J=5,5Гц), 5,31 (т, 1Н, С2-Н, J=5,9Гц), 5,14 (т, 1Н, ОН, D2О-обмен), 3,7 (т, 2Н, С2-СН2ОН, J=5,1Гц), 3,36 (дв. д, 1Н, С4-Н, J=5,7 и 1,7Гц), 3,16 (дв. д, 1Н, С4-Н, J=5,5 и 11,7Гц), 1,75 (д, ЗН, С5'-СН3, J=1,7Гц). Пример17 Малеат цис-5-(4-амино-1,2-дигидро-2-оксо-1-пиримидинил)-1,З-оксатиолан-2-метанола Смесь цис-5-(4-амино-1, 2-дигидро-2-оксо-1-пиримидинил)-1,3-оксатиолан-2-метанола (1,0г, 4,6ммоля) и малеиновой кислоты (506мг, 4,36ммоля) в промышленном метилированном спирте (ІМS 320мл) нагревалась до температуры дефлегмации. Получающийся в результате прозрачный раствор концентрировался с помощью перегонки из 140мл растворителя, а затем охлаждался до 5°С. С помощью фильтрования отделялось белое кристаллическое твердое вещество, промывалось IMS (15мл) и сушилось в вакууме при 40°С, давая цис-5-(4-амино-1,2дигидро-2-оксо-1-пиридимидинил)-1,З-оксатиолан-2-метанол малеат (1,22г), т.пл. 187°С. Найдено С 41,7 Η 4,4 N 12,1% Вычислено С 41,7 Η 4,4 N 12,2% С8Н11N303×С4Н4О4 Пример18 Хлоргидрат цис-5-(4-амино-1,2-дигидро-2-оксо-1-пиримидинил)-1,З-оксатиолан-2-метанола Раствор цис-5-(4-амино-1,2-дигидро-2-оксо-1-пиримидинил) 1,З-оксатиолан-2-метанола (1,0г, 4,6ммоля) в промышленном метилированном спирте (IMS 320мл) обрабатывался при дефлегмации раствором концентрированной соляной кислоты (160мг, 4,36ммоля) в ІMS (8мл). Смесь затем охлаждалась до 0°С. Получающееся в результате белое кристаллическое твердое вещество отделялось с помощью фильтрования, промывалось 1МS (5мл) и сушилось в вакууме при 40°С, давая хлоргидрат цис-5-(4-амино-1,2-дигидро-2-оксо-1-пиримидинил)-1,2-оксатиолан2-метанола (912г), т. пл. 192°С. Найдено С 36, Η 4,7 N 2 Вычислен о С 36, 2 15,9 % Η 4,5 5 Ν 15,8 % C8H11N3O3×НСl. Пример19 Цис- и транс-2-бензоилоксиметил-5-(5'-азацитозин-N-1'-ил)-1,3-оксатиоланы 5-азацитозин (2:0г) нагревали с обратным холодильником в HMDS (50мл), содержащем каталитическое количество (NH4)2SO4 (50мг) до тех пор, пока раствор не становился чистым. Смесь выпаривали досуха, остаток высушивали в высоком вакууме в течение 1 часа и растворяли в сухом дихлорметане (100мл). 2-бензоилоксиметил-5-этокси-1,3-оксатиолан высушивали путем двукратного совместного выпаривания с бензолом (2x50мл) в 500-мл колбе с круглым дном и растворяли в сухом дихлорметане (150мл). Силилированный раствор 5-азацитозина переносили в раствор оксатиолана посредством канюли в атмосфере аргона с последующим добавлением раствора триметилсилилтрифторметансульфоната (ТМS-трифлат, 3,5мл) в дихлорметане (20мл). Смесь нагревали с обратным холодильником 24 часа, охлаждали до комнатной температуры и выливали в насыщенный водный раствор NаНСО3 (З00мл). Органическую фазу собирали. Водную фазу экстрагировали метиленхлоридом (2 х 100мл). Объединенные экстракты промывали водой (2 х 200мл), один раз раствором NaCl (100мл) и высушивали сульфатом магния. После фильтрации, фильтрат выпаривали при пониженном давлении. Остаток очищали на силикагеле, в качестве элюента используя EtOAc-MeOH (95:5). Получали 1,6г (34%) чистого твердого продукта, который обнаруживал только одно пятно на ТСХ, но 1Н-ЯМР-спектр показал присутствие цис- и транс-изомеров в отношении 1:1,2. 1 Н-ЯМР (CDCl3): s (ррm): 8,41 (с, 1Н, C6-H, цис-изомер), 8,26 (с, 1Н, С6, транс-изомер), 7,95 (м, ароматич.), 7,54 (м., ароматич.), 6,36 (дд, 1Н, С5-Н транс-изомер, J=1,9 и 5,0Гц), 6,17 (т, 1Н, С5-Н цис-изомер), 6,О5 (т, 1Н, С2-Н транс-изомер), 5,53 (т, 1Н, С2-Н цис-изомер), 4,68 (м, 2Н, С2-СН2ОСОС6Н5 цис-изомер), 4,42 (м, 2Н, С2-СН2ОСОС6Н5 транс-изомер), 3,54 (м, 2Н, С1-Н цис и транс), 3,36 (м, 2Н, С4-Н цис и транс). Пример20 Цис- и транс-2-гидроксиметил-5-(5'-азацитозин-N-1'-мл)-1,3-оксатиоланы Смесь цис- и транс-2-бензоилоксиметил-5-(5'-азацитозин-N-1'-ил)-1,3-оксатиоланов (505мг) растворяли в метанольном аммиаке (100мл) и перемешивали при комнатной температуре в течение 18 часов. Раствор выпаривали досуха. Остаток обрабатывали дважды диэтиловым эфиром (2 x 50мл) и декантировали. Твердый остаток перекристаллизировали в метаноле и кристаллы собирали путем фильтрации. Продукт идентифицировали как чистый цис-изомер. Цис-изомер: Т. пл.>210°С (разлож.), УФ:lmax (МеОН): 243нм 1 Н-ЯМР (ДМСО-d6): s (ррm): 8,62 (с, 1Н, С6-Н), 7,53 (шс, 2Н, -NН2), 6,12 (дд, 1Н, С5-Н), 5,40 (т, 1Н, -ОН), 5,20 (т, 1H, С2-Н, J=3,9Гц), 3,75 (м, 2Н, С2-СН2ОН), 3,45 (дд, 1Н, С4-Н, J=5,3Гц), 3,25 (дд, 1Н, с4-Н, J=3,5Гц) Другой продукт был получен в виде пенистого вещества и идентифицирован как трансизомер. Транс-изомер: 1 Н-ЯМР (ДМСО-d6): s (ррm): 8,25 (c 1H, C6-H), 7,58 (шс, 2Η, -ΝΗ2); 6,29 (дд, 1Н, С5-Н, J=3,1 и 4,9Гц), 5,65 (т, 1Н, С2-Н, J=5,2Гц), 5,44 (шс, 1Н, -ОН), 3,49 (м, 3Н, 2Н от С2-СН2ОН и 1Н от С4-Н), 3,24 (м, 1Н, С4-Н). Пример21 Цис- и транс 2-бензоилоксиметил-5-(8'-азаденин-N-9'-ил)-1,3-оксатиоланы и цис и транс 2бензоилоксиметил-5-(8'-азааденин-N-8¢-ил)-1,3-оксатиоланы Суспензию 8-азааденина (1,00г, 7,348мМ) и сульфата аммония (З0мг) в HMDS (З0мл) нагревали с обратным холодильником в, течение ночи (16 часов). Прозрачный раствор концентрировали при пониженном давлении. Белый твердый остаток высушивали в высоком вакууме в течение 2 часов, растворяли в свежедистиллированном 1,2-дихлорэтане (30мл) и переносили в атмосфере аргона посредством канюли в раствор 2-бензоилоксиметил-5метилкарбонат-1,3-оксатиолана (1,461г, 4,90мМ) в безводном 1,2-дихлорэтане (50мл). Затем добавляли ТМS-трифлат (1,42мл, 7,348мМ) и полученную смесь нагревали с обратным холодильником в атмосфере аргона в течение 2 дней, затем охлаждали до комнатной температуры и выливали в насыщенный водный раствор NaHCO3 (100мл). Органическую фазу отделяли, а водную фазу экстрагировали метиленхлоридом (Зх50мл). Объединенные органические экстракты промывали солевым раствором (50мл), осушали безводным сульфатом магния, фильтровали, и концентрировали при пониженном давлении. Остаток очищали путем флеш-хроматографии на силикагеле, элюируя СH2СІ2:МеОН (98:2), в результате чего получали 0,875г (49,6%) светло-желтого твердого вещества, который обнаруживал только одно пятно на ТСХ, но 1Н-ЯМР - спектр показал присутствие двух N-9'-изомеров, цис- и транс-2бензоилоксиметил-5-(8'-азааденин-N-9'-ил)-1,3-оксатиолан. Η-9'-региоизомеры: УФ:lmax(EtOH):280,19нм; 1 Н-ЯМР (CDCl3): s (ррm): 8,50 (с, 1Н, С2Н, цис-изомер), 8,46 (с, 1Н, С2Н, транс-изомер), 8,03 (м, 4Н, ароматич.), 7,57 (м, 2Н, ароматич.), 7,44 (м, 4Н, ароматич.), 7,08 (дд, 1Н, C5-H,J=2,97 и 6,14Гц, транс-изомер), 6,73 (дд, 1Н, С5-Н, J=5,53 и 6,53Гц, цис-изомер), 6,64 (шс, 4H,-NH2), 5,89 (дд, 1Н, С2-Н, J=4,15 и 5,59Гц, транс-изомер), 5,72 (т, 1Н, С2-Н, J=5,37Гц, цис-изомер), 4,64 (τ, 2Н, С2-СН2ОСОС6Η5, J=5,76, цис-изомер), 4,6О (д, 2Н, С2-СН2ОСОС6Н5,J=5,32, транс-изомер), 4,37 (дд,1Н, С4-Н, J=6,53 и 11,42Гц, цис-изомер), 4,04 (дд, 1Н, С4-Н, J=3,14 и 11,81Гц, транс-изомер), 3,79 (дд, 1Н, С4-Н, J=6,14 и 11,6Гц, цис-изомер), 3,61 (дд, 1Н, C4-H, J=5,52 и 11,45Гц, транс-изомер). Другой продукт получали в виде желтого маслянистого продукта (0,313г, 17,7%) и идентифицировали как два N-8'-региомера, цис- и транс-2-бензоилоксиметил-5-(8'-азааденин-N8¢-ил)-1,3-оксатиолан. N-8¢-региоизомеры: УФ:lmax (ЕtОН):295нм, 1 Н-ЯМР (CDCl3): s (ррm): 8,50 (с, 1Н, С2-Н, цис-изомер), 8,46 (с, 1Н, С2-Н, транс-изомер), 8,03 (м, 4Н, ароматич.), 7,57 (м, 2Н, ароматич.), 7,44 (м, 4Н, ароматич.), 7,08 (дд, 1Н, С5-Н, J=2,97 и 6,14Гц, транс-изомер), 6,73 (дд, 1Н, С5-Н, J=5,53 и 6,53Гц, цис-изомер), 6,64 (шир.с., 4Н, -NH2), 5,89 (дд, 1Н, С2-Н, J=4,15 и 5,59Гц, транс-изомер), 5,72 4,64 4,60 4,37 4,04 3,79 3,61 (т, 1Н, С2-Н, J=5,37 Гц, цис-изомер), (т, 2Н, С2-СН2ОСОС6Н5, J=5,76 Гц, цис-изомер), (д, 2Н, С2-СН2ОСОС6Н5, J=5,32 Гц, транс-изомер), (дд, 1Н, С4-Н, J=6,53 и 11,42Гц, цис-изомер), (дд, 1Н,С4-Н, J=3,14 и 11,81Гц, транс-изомер), (дд, 1Н, С4-Н, J=6,14 и 11,6Гц, цис-изомер), (дд, 1Н, С4-Н, J=5,52 и 11,45Гц, транс-изомер). Пример22 Цис- и транс-2-гиддроксиметил-5-(8'-азааденин-N-9'-ил)-1,3-оксатиоланы Раствор цис- и транс-2-бензоилоксиметил-5-(8'-азааденин-N-9'-ил)-1,3-оксатиоланов (0,285г, 0,7908мМ) в метаноловом аммиаке (50мл) размешивали в течение 1 дня при комнатной температуре. Эту смесь концентрировали при пониженном давлении, и твердый остаток очищали с помощью флеш-хроматографии на силикагеле, элюируя градиентом МеОН (1%-6%) в СН2Сl2, в результате чего получали 0,079г цис-изомера и 0,084г транс-изомера в виде белых твердых веществ. Полный выход составлял 81%. Цис-изомер: Т. пл. 203-204°С, УФ: lmax(МеОН):278нм, Rf: 0,31 (СН2Сl2:МеОН 9:1), 1 Н-ЯМР (ДМСО-d6): s (ррm): 8,54 (шир.с., 1Η, -NH2), 8,33 (с, 1Н, С2-Н), 8,20 (шир.с., 1Η, -ΝΗ2), 7,69 (τ, 1Η, C5-H, J=6,38Гц), 5,34 (т, 1Н, C2-H, J=5,53Гц), 5,22 (т, 1Н, -ОН, J=5,74Гц), 4,05 (дд, 1Н, C4-H, J=6,93 и 11,05Гц), 3,63 (м, 2Н, С2-СН2ОН), 3,50 (дд, 1Н, С4-Н, J=5,44 и 11,32Гц), 13 С-ЯМР (ДМСО-d6): б (ррm):157,153; 156, 119; 149, 049; 123, 631; 87,674; 85, 339; 64,137; 32.846. Транс-изомер: Т. пл. > 213-214°С, УФ:lmax(МеОН): 278нм, Rf: 0,24 (СН2Сl2:МеОН 9:1) 1 Н-ЯМР (ДМСО-d6): s (ррm): 8,53 (шир.с., 1Н, -NH2), 8,33 (с, 1Н, С2-Н), 8,18 (шир.с., 1Н,-NH2), 7,01 (дд, 1Н, С5-Н, J=3,24 и 6,54Гц), 5,35 (τ, 1Η, С2-Н, J=4,97), 5,55 (т, 1Н, -ОН, J=6,05), 3,89 (дд, 1Н, С4-Н, J=3,24 и 11,53Гц), 3,67 (м, ЗН, С2-СН2ОН и С4-Н). Пример23 Цис- и транс-2-гидроксиметил-5-(8'-азааденин-N-8'-ил)-1,3-оксатиолан Раствор цис- и транс-2-бензоилоксиметил-5-(8'-азааденин-N-8'-ил)-1,3-оксатиоланов (0,300г, 0,8324мМ) в метаноловом аммиаке (50мл) размешивали З0 часов при комнатной температуре. Смесь концентрировали при пониженном давлении, и твердый остаток очищали с помощью флеш-хроматографии на силикагеле, используя в качестве элюента градиент МеОН (2 - 6%) в СН2Сl, в результате чего получали 0,037г цисизомера, 0,058г трансизомера, и 0,095г смеси изомеров в виде бледно желтых твердых продуктов. Полный выход составлял 90%. Цис-изомер: т. пл. 182 - 183°С, Rf: 0,44 (СН2Сl2: МеОН 9:1), УФ: lmax (МеОН): 296нм, 1 Н-ЯМР (ДМСО-d6): s (ррm): 8,38 (шир.с., 1Н, NH2), 8,30 (с, 1Н, С2'Н), 8,17 (шир.с., 1Η, -ΝΗ2), 6,77 (дд, 1Н, С5-Н, J=4,12 и 5,28Гц), 5,41 (т, 1Н, С2-Н, J=6,04Гц), 5,17 (т, 1Н, -ОН, J=5,77Гц), 3,92 (дд, 1Н, С4-Н, J=4,15 и 12,05Гц), 3,70 (м, 3H, С4-Н и С2-СН2ОН), Транс-изомер: т. пл. 206-207°С, Rf: 0,38 (СН2Сl2: МеОН 9:1), УФ: lmax (МеОН): 196нм, 1 Н-ЯМР (ДМСO-d6): s (ppm): 8,38 (шир.с., 1Н, -NH2), 8,30 (с, 1Н, С2-Н), 8,16 (шир.с., 1Η, NΗ2), 7,04 (дд, 1Н, С5-Н, J=1,92 и 5,76(Гц), 5,46 (т, 1Н, С2-Н, J=5,01Гц), 5,24 (τ, 1Η, -ОН, J=5,77Гц), 3,85 (дд, 1Н, С4-Н, J=1,98 и 12,96Гц), 3,62 (м, ЗН, С4-Н и С2-СН2ОН). Пример24 Цис- и транс-2-бензоилоксиметил-5-(8'-азагуанин-9'-ил)-1,3-оксатиолан 8-азагуанин (1,0г, 6,58мМ) подвергали персилилированию посредством нагревания с обратным холодильником с 1,1,1,3,3,3-гексаметилдисилазаном (HMDS, 50мл) в присутствии каталитического количества сульфата аммония (50мг) в течение ночи (16 часов). Прозрачный раствор выпаривали досуха при пониженном давлении. Остаток осушали в высоком вакууме в течение 1 часа и растворяли в безводном 1,2-дихлорэтане (100мл). 2-бензоилоксиметил-5-метилкарбонат-1,3-оксатиолан (1,96г, 6,58мМ) осушали путем двухкратного выпаривания с бензолом (2 х 50мл) в 500-мл колбе с круглым дном, и растворяли в безводном 1,2-дихлорэтане (150мл). Раствор силилированного 8-азагуанина вводили посредством канюли в раствор оксатиолана в атмосфере аргона с последующим добавлением ТМS-Трифлата (1,3мл, 6,58мМ). Реакционную смесь нагревали с обратным холодильником в атмосфере аргона в течение 5 часов, охлаждали до комнатной температуры, и выливали в насыщенный водный раствор NaHCO3 (100мл). Органический слой собирали. Водную фазу экстрагировали СН2Сl2 (3 x 100мл). Объединенный органический слой промывали водой (2 x 100мл), один раз раствором NaCl (100мл) и осушали сульфатом магния. После фильтрации, растворитель удаляли путем выпаривания в вакууме, и остаток очищали на силикагеле, элюируя EtOAc: MeOH=97:3. В результате получали 712мл (29%) целевого продукта в виде смеси цис- и транс-изомеров в отношении 1:1. Rf: 0,40 (СН2Сl2:МеОН 95:5) 1 Н-ЯМР (ДМСО-d6): s (ррm): 11,06 (ш.с., 1Н, NΗ), 7,92 (м, 2Н, ароматич.), 7,66(м, 1H, ароматич.), 7,55 (м, 2Н, ароматич.), 7,05 (ш.с., 2Η, NΗ2-), 6,74 (дд, 1Н, Н-5, транс-изомер, J=3 и 6Гц), 6,45 (т, 1Н, Н-5, цис-изомер, J=6Гц), 5,68 (м, 1H, Η-2), 4,55 (м, 2Н, СН2ОВz), 3,65 (м, 2 , Н-4). Пример25 Цис- и транс-2-гидроксиметил-5-(8'-азагунин-9'-ил)-1,3-оксатиолан Раствор цис- и транс-2-бензоилоксиметил-5-(8'-азагуанин-9'-ил)-1,3-оксатиолана (350мг) в метаноле (100мл) охлаждали до 0°С в ледяной бане, и аммиачный газ барбатировали через раствор в течение 15 минут. Реакционную смесь перемешивали при комнатной температуре в течение ночи (16 часов). Раствор выпаривали досуха. Остаток очищали, а два изомера частично разделяли на силикагеле, элюируя СH2СІ2: МеОН=9:1, в результате чего получали чистый целевой продукт, который идентифицировали как цис-изомер (30мг). Цис-изомер: Т. пл. > 260°С (разлож.) Rf: 0,26 (СН2Сl2 : МеОН 9:1), Уф: lmax(pН14): 278нм, 1 Н-ЯМР (ДМСО-d6): s (ррm): 11,08 (ш.с., 1Н, NН-), 7,05(ш.с., 2Н, NH2), 6,33 (дд, 1Н, С2-Н, J=6 и 7Гц), 5,26 (τ, 1Н, С2-Н, J=6Гц), 5,17 (т, 1Н, ОН-, J=6Гц) , 3,93 (дд, 1Н, C4-H, J=7 и 11 Гц), 3,47 (м, ЗН, 1Н, С4-Н и 2Н, С2-СН2ОН), 13 С-ЯМР (ДМСО-d6): s (ррm): 155,81; 155,46; 151,79; 124,35; 86,73; 84,94; 64,22 и 32,42. Другие фракции объединяли и концентрировали досуха. Остаток очищали с помощью ЖХВД (жидкостная хроматография высокого давления), в результате чего получали 72 мг трансизомера. Транс-изомер: Т. пл.. 220 - 222°С (разлож.): УФ:lmax (pH14):280нм 1 Н-ЯМР (ДМСО-d6): s (ррm): 11,0 (ш.с., 1Н, -NH), 7,06 (щ.с., 2Н, -ΝΗ2), 6,67 (дд, 1Н, С5-Н, J=3 и 7Гц), 5,28 (т, 1Н, С2-Н, J=5Гц), 5,20 (ш.т., 1Н, -ОН, J=6Гц), 3,78 (дд, 1Н, 1Н, С4-Н, J=3 и 12Гц), 3,67 (м, 1Н, С4-Н и 2Н-СН2ОН), 13 С-ЯМР (ДМСО-d6): s (ррm): 155,8; 155,6; 151,4; 124,3; 86,7, 86,4; 63,6; 34,4. Пример26 Цис- и транс-2-бензоилоксиметил-5-(3'-карбоэтокси-1',2'-4'-триазол-1'-ил)-1,3-оксатиолан З-карбоэтокси-1,2,4-триазол (400мг, 2,83ммоля) грели в сосуде с обратным холодильником в НМDS (1,1,1,3,3,3-гексаметилдисилазан, 20мл), содержащем каталитическое количество сульфата аммония (20мг) в течение 2ч. Прозрачный раствор упаривали до сухого состояния при пониженном давлении, и остаток растворяли в сухом дихлорэтане (50мл). Раствор 2-бензоилоксиметил-5-ацетокси-1,3-оксатиолана (1,2г, 4,20ммоля) в сухом дихлорэтане (100мл) добавляли к силированному триазольному производному, делая это через трубку в атмосфере аргона, после чего добавляли 1Μ дихлорэтановый раствор триметилсилилтрифторметансульфоната (ТMSOTf) (5мл). Реакционную смесь грели в сосуде с обратным холодильником в атмосфере аргона в течение 2ч, охлаждали до комнатной температуры и выливали в насыщенный раствор бикарбоната натрия (100 мл). Органический слой собирали. После этого водный раствор экстрагировали метиленхлоридом (2 раза по 50мл). Объединенную органическую фазу промывали водой (2 раза по 100мл), сушили над сульфатом магния и фильтровали. Растворитель удаляли при пониженном давлении. Остаток очищали на силикагеле с использованием смеси гексана с этилацетатом при соотношении 1:1 в качестве элюента, в результате чего получали требуемый продукт (800мг) с выходом 77% в виде смеси цис-и трансизомеров в соотношении 3:2. Спектр ЯМР на 1Η (300МГц, CDCl3) был следующим: величина s в миллионных долях составляла: 8,57 (синглет, 1Н, Н'-5, цис-изомер), 8,43 (синглет, 1Н, Н'-5, транс-изомер), 8,04 (мультиплет, 4Н, бензольное кольцо, цис- и транс-изомеры), 7,57 (мультиплет, 2Н, бензольное кольцо, цис- и транс-изомеры), 7,47 (мультиплет, 4Н, бензольное кольцо, цис- и трансизомеры), 6,57 (дублет из дублета, 1Н, Η-5, транс-изомер, J=1,6 и 4,8Гц), 6,37 (дублет из дублета, 1Н, Н-5, цисизомер, J=3,2 и 7,8Гц), 5,79 (дублет из дублета, 1Н, Н-2,трансизомер, J=4 и 6,1Гц), 5,63 (дублет из дублета, 1Н, Н-2, цис-изомер, J=3,6 и 5,3Гц), 4,71 (мультиплет, 2Н, -СН2ОС(C6H5)), 4,50 (мультиплет, 6Н, 2Н, из –СН2ОС(C6H5) и 4Н из СОО(С2Н5), цис- и транс-изомеры), 3,65 (мультиплет, 4Н, Н-4, цис- и трансизомеры), 1,43 (триплет, 6Н, СОО(С2Н5), цис- и трансизомеры). Пример27 Цис- и транс-2-гидроксиметил-5-(3'-карбоксамид-1',2',4'-триазол-1'-ил)-1,3-оксатиолан Смесь цис- и транс-изомеров 2-бензоилоксиметил-5-(3'-карбоэтокси-1',2'4'-триазол-1'-ил)1,3-оксатиолана (800мг, 2,2ммоля) растворяли в метанольном аммиаке (80мл). Раствор перемешивали в герметичной колбе при комнатной температуре в течение 4 дней, растворитель удаляли выпариванием при пониженном давлении, и маслянистый остаток растирали с простым эфиром (3 раза по 30мл). Остаток после этого очищали на силикагеле при использовании смеси этилацетата с метанолом в соотношении 95:5 в качестве элюента, в результате чего в чистой твердой форме получали оба цис- и транс-изомера. Цис-изомер. Температура плавления оставляла 119 - 120°С. Спектр ЯМР на 1Η (300МГц, диметилсульфоксид-d6): величина s в миллионных долях составляла: 8,85 (синглет, 1Н, С5'-Н), 7,81 (широкий синглет, 1Н, СОNH2-,D2О (способная обмениваться)), 7,59 (широкий синглет, 1Н, (способная обмениваться)), 6,38 (триплет, 1Н, С5-Н), 5,27 (триплет, 2Н, С2-Н и ОН), 3,56 (мультиплет, 4Н, С4-Н и С2-СН2ОН). Транс-изомер. Температура плавления составляла 215 - 216°С. Спектр ЯМР на 1Η (300МГц, диметилсульфоксид-d6): величина s в миллионных долях составляла: 8,83 (синглет, 1Н, С5'-Н), 7,87 (широкий синглет, 1Н, CONH2-, D2O (способная обмениваться)), 7,65 (широкий синглет, 1Н, СОNН2-, D2О (способная обмениваться)), 6,69 (дублет из дублета, 1Н, C5-H, J=3 и 4,2Гц), 5,43 (триплет, 1Н, С2-Н, J=5,1Гц), 5,23 (триплет, 1Н, ОН, D2О (способная обмениваться)), 3,60 (мультиплет, 4Н, С4-Н и С2-СН2ОН). Пример28 Цис- и транс-2-бензоилоксиметил-5-(2'-амино-6'-хлор-пурин-9'-ил)-1,3-оксатиолан 6-хлор-2-аминопурин (3,96г, 23,35ммоля) грели в сосуде с обратным холодильником в HMDS (1,1,1,3,3,3-гексаметилдисилазане, 100мл), содержащем каталитическое количество сульфата аммония (20мг) в течение ночи (16ч). Прозрачный раствор упаривали досуха при пониженном давлении, и остаток растворяли в дихлорэтане (60мл). Раствор добавляли к смеси 2бензоилоксиметил-5-ацетокси-1,3-оксатиолана (5,98г, 21,33ммоля) в сухом дихлорэтане (30мл) с молекулярными ситами 4Å (2г), после чего добавляли триметилсилилтрифторметансульфонат (ТМS-triflate 4,1мл). Реакционную смесь грели в сосуде с обратным холодильником в атмосфере аргона в течение 10ч и выливали в насыщенный водный раствор бикарбоната натрия (100 мл). Органический слой собирали. Водный раствор затем экстрагировали метиленхлоридом (2 раза по 60мл). Объединенную органическую фазу промывали водой (2 раза по 100мл), сушили над сульфатом магния и фильтровали. Растворитель удаляли при пониженном давлении. Остаток очищали на силикагеле, используя смесь из гексана и этилацетата при соотношении 1:1 в качестве элюента, в результате чего получали требуемые цис-изомер (2г, 24%) и транс-изомер (3,10г, 37,3%) с общим выходом 61%. Цис-изомер. Температура плавления составляла 137 - 138°С. Величина Rf. составляла 0,29 (смесь гексана с этилацетатом при соотношении 1:1). Спектр ЯМР на 1Η (300МГц, CDCl3): величина s в миллионных долях составляла: 8,11 (синглет, 1Н, С8'-Н), 8,02 (мультиплет, 2Н, бензольное кольцо), 7,55 (мультиплет, 1Н, бензольное кольцо), 7,44 (мультиплет, 2Н, бензольное кольцо), 6,38 (триплет, 1Н, С5-Н, J=5,2Гц), 5,6О (дублет из дублета, 1Н, С2-Н, J=4,2 и 5,4Гц), 5,32 (широкий синглет, 2Н, ΝΗ2), 4,66 (мультиплет, 2Н, -СН2ОС(С6Н5)), 3,58 (мультиплет, 2Н, С4-Н). Транс-изомер. Температура плавления составляла 152 - 153°С. Величина Rf составляла 0,29 (смесь гексана с этилацетатом при соотношении 1:1). Спектр ЯМР на 1Η (300МГц, СDСl3): величина s в миллионных долях составляла: 8,15 (синглет, 1Н, С8'-Н), 8,02 (мультиплет, 2Н, бензольное кольцо), 7,56 (мультиплет, 1Н, бензольное кольцо), 7,43 (мультиплет, 2Н, бензольное кольцо), 6,67 (дублет из дублета, 1Н, С5-Н, J=1,7 и 5,2Гц), 5,69 (дублет из дублета, ІН, С2-Н, J=4,1 и 6,0Гц), 5,50 (широкий синглет, 2Н, NН2), 4,57 (мультиплет, 2Н, -СН2ОС(C6H5)), 3,66 (дублет из дублета, 1Н, С4-Н, J=5,3 и 12,0Гц), 3,55 (дублет из дублета, 1Н, С4-Н, J=2,8 и 12Гц). Пример29 Цис-2-гидроксиметил-5-(гуанин-9'-ил)-1,3-оксатиолан К 10%-ному водному метанольному раствору цис-2-бензоил-оксиметил-5-(2'-амино-6'хлорпурин-9'-ил)-1,3-оксатиолана (200мг, 0,73ммоля) добавляли в виде одной порции гидроксид натрия (3г, 75ммолей). Реакционную смесь грели в сосуде с обратным холодильником в течение 16ч, затем охлаждали до комнатной температуры, и растворители удаляли при пониженном давлении. Остаток вновь растворяли в воде (100мл), раствор нейтрализовали пиридиниевой смолой и фильтровали. Фильтрат упаривали досуха при пониженном давлении, и остаток очищали высокопроизводительной жидкостной хроматографией на колонке с обрашенной фазой, в результате чего получали названное соединение (146мг) с выходом 74%. Температура плавления превышала 258°С (идет разложение). Величина Rf составляла 0,54 (смесь этилацетата с метанолом при соотношении 4:1). Ультрафиолетовый спектр: величина lmax (в воде) составляла 254 и 275 (коротковолновая область) нм. Спектр ЯМР на 1Η (300МГц, диметилсульфоксид-d6): величина s в миллионных долях составляла: 7,89 (синглет, 1Н, С8'-Н), 7,00 (широкий синглет, 2Н, NH2), 6,15 (триплет, 1Н, С5-Н, J=5,6Гц), 5,50 (широкая линия, 1Н, ОН), 5,22 (триплет, 1Н, С2-Н, J=4,7Гц), 3,62 (мультиплет, 4Н, С4-Н и С2-СН2ОН). Спектр ЯМР на 13С (75,46МГц, диметилсульфоксид-d6: величина s в миллионных долях составляла 162,25, 157,79, 151,72, 134,33, 117,18, 85,52, 85,22, 64,18 и 34,81. Пример30 Цис-2-гидроксиметил-5-(2'-6'-диаминопурин-9'-ил)-1,3-оксатиолан Аммиак пробулькивали через раствор цис-2-бензоилоксиметип-5-(2'-амино-6'-хлорпурин-9'ил)-1,3-оксатиолана (185мг, 0,64ммоля) в этаноле (25мл) при 0°С в течение 20мин. Раствορ помещали в стальную бомбу и грели при 110°С в течение 16ч. Бомбу охлаждали до комнатной температуры и затем освобождали. Растворители удаляли при пониженном давлении, и остаток очищали на силикагеле с использованием смеси этилацетата с метанолом при соотношении 9:1 в качестве элюента, в результате чего получали требуемый продукт (125мг) с выходом 73%. Температура плавления составляла 120 - 122°С (разложение). Величина Rf составляла 0,48 (смесь этилацетата с метанолом при соотношении 4:1). Ультрафиолетовый спектр: величина lmax (в воде) составляла 256 и 280нм. Спектр ЯМР на 1Η (300МГц, диметилсульфоксид-d6): величина s в миллионных долях составляла: 8,31 (синглет, 1Н, С8'-Н), 6,86 (широкий синглет, 2Н, NH2), 6,19 (триплет, 1Н, С5-Н, J=5,2Гц), 5,90 (широкая линия, 2Н, NН2), 5,40 (триплет, 1Н, ОН), 5,22 (триплет, 1Н, С2-Н), 3,62 (мультиплет, 4Н, C4-H и C2-CH2OH). Спектр ЯМР на 13С (75,46МГц, диметилсульфоксид-d6): величина s в миллионных долях составляла: 160,70, 156,44, 151,65, 135,91, 113,07, 85,47, 85,39, 63,83 и 34,92. Транс-2-гидроксиметил-5-(2',6'-диаминопурин-9'-ил)-1,3-оксатиолан Аммиак пробулькивали через раствор цис-2-бензоилоксиметил-5-(2'-амино-6'-хлорпурин-9'ил)-1,3-оксатиолана (200мг, 0,69ммоля) в этаноле (25мл) при 0°Св течение 20 мин. Раствор помещали в стальную бомбу и грели при 110°С в течение 16ч. Бомбу охлаждали до комнатной температуры и освобождали. Растворители удаляли при пониженном давлении, и остаток очищали на силикагеле с использованием смеси из этилацетата и метанола при соотношении 9:1 в качестве элюента, в результате чего получали требуемый продукт (136мг с выходом 72%). Температура плавления превышала 220°С (идет разложение). Величина Rf составляла 0,40 (смесь этилацетата с метанолом при соотношении 4:1). Ультрафиолетовый спектр: величина lmax (в воде) составляла 256 и 280нм. Спектр ЯМР на 1Η (300МГц, диметилсульфоксид-d6): величина s в миллионных долях составляла: 7,90 (синглет, 1Н, С8'-Н), 6,76 (широкий синглет, 2Н, -NH2), 6,49 (дублет из дублета, 1Н, С5-Н, J=3,О и 5,4Гц), 5,88 (широкая линия, 2Н, NH2), 5,32 (триплет, 1Н, С2-Н, J=4,7Гц), 5,21 (триплет, 1Н, ОН), 3,62 (мультиплет, 4Н, С4-Н и С2-СН2ОН). Спектр ЯМР на 13С (75,46МГц, диметилсульфоксид-d6): величина s в миллионных долях составляла 160,90, 156,64, 151,81, 135,27, 113,35, 86,00, 85,31, 64,50 и 35,23. Пример31 Цис- и транс-2-бензоилоксиметип-5-(N4'-ацетил-5'-фтор-цитозин-1'-ил)-1,3-оксатиолан 5-фторцитозин (4,30г, 33,3ммол), гексаметилдисилозан (25мл) и сульфат аммония (120мг) кипятили с обратным холодильником до растворения цитозина (3 часа) и затем кипятили еще в течение 2 часов. Гексаметилдисилозан испаряли в вакууме и к остатку добавляли толуол (100мл) для совместного испарения растворителей. Образующийся раствор, бис(триметилсилил)-фторцитозин в дихлорметане (40мл) добавляли в атмосфере аргона к раствору 2-бензоилоксиметил-5-ацетокси-1,3-оксатиолана (8,537г, 30,3ммол) в сухом дихлорметане (100мл) и к молекулярным ситам (4Å, 2г), предварительно охлажденный до 0°С и выдерживании в атмосфере аргона в течение 20 минут. К этой смеси добавляли (трифторметан-сульфонил)окси триметилсилан (6мл, 31ммол) при 0°С и образующийся раствор перемешивали при 25°С в течение приблизительно 18 часов. Затем, реакционную смесь обрабатывали 300мл насыщенного раствора бикарбоната натрия и перемешивали при комнатной температуре в течение 2 часов. Фильтрат дважды встряхивали с 300мл солевого раствора и один раз с дистиллированной водой. Органический слой высушивали над сульфатом магния, фильтровали и выпаривали до сухого состояния. Это давало неочищенное производное 5-фторцистозина (10,1г). Rf: 0,57 (ЕtОАс:МеОН 9:1). Этот остаток подвергали ацетилированию на следующем этапе без дальнейшей очистки. Неочищенное вещество растворяли в сухом дихлорметане (120мл) в атмосфере аргона в 500миллилитровой круглодонной колбе. К раствору добавляли триэтиламин (12,7мл, 91,1ммол) и диметиламинопиридин (111мг, 0,9ммол). Затем, колбу погружали в ледяную баню на 1 час при создании в ней атмосферы аргона. В охлажденную колбу впрыскивали уксусный ангидрид (4,3мл, 45ммол), очищенный над ацетатом натрия. Смесь перемешивали в течение ночи и затем тщательно декантировали в эрленмейеровской колбе, содержащей насыщенный раствор бикарбоната натрия. Затем, полученный продукт промывали дистиллированной водой, за которой следовал соляной раствор. Метиленхлоридные порции сушили и выпаривали в высоком вакууме до сухого состояния, образуя ацетилированную смесь в виде бесцветной пены, имеющей после высушивания вес 9,6г. Флеш-хроматография этого вещества при использовании смеси этилацетат:метанол (9:1) дала 3,1г, 7,8ммол (46%) чистого транс-(L1) и 3,5г, 8,9ммол (30%) чистого цис-(L1). Транс-изомер: Rf: 0,65 в смеси этилацетат:метанол 9:1 У.Ф.: (МеОН) lmax: 309нм. 1 Н-ЯМР s (мил.д. в CDCl) 8,77 (уш., 1Н, С4¢-NH-Ас), 8,06 (м, 2Н; аромат), 7,70 (д, 1Н; Сб'-Н, J6, F=6,3Гц), 7,62 (м, 1Н; аромат), 7,49 (м, 2 Η; аромат), 6,51 (дд, 1Н; С5-Н), 5,91 (дд, 1Н; C2-Н), 4,48 (дд, 2Н; С2-СH2ОСОС6Н5) 3,66 (дд, 1Н; С4-Н), 3,44 (дд, 1Н; С4-Н) 2,56 (с, ЗН; NН-СОСН3) Цис-иэомер: Rf:0,58 в смеси этилацетат:метанол 9:1 У.Ф.: (МеОН) lmax: 309нм 1 Н-ЯМР s (мил.д. в CDCl3) 8,72 (уш, 1Н, С4'-NН-Ас) 8,06 (мг 2Н; аромат.) 7,87 (д, 1Н; C6'-H, J6, F=6,2Гц) 7,60 (м, 1Н; аромат) 7,49 (м, 1Н; аромат.) 6,32 (дд, 1Н; С5-Н) 5,47 (дд, 1Н; С2-Н) 4,73 (дд, 2Н; С2-СН2 ОСОС6Н5)
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/445, C07D 411/00, A61K 31/52, A61K 31/522, A61K 31/53, A61P 31/18, C07D 473/16, C07D 327/00, A61K 31/41, A61K 31/495, C07D 473/00, C07D 473/40, A61K 31/513, A61P 31/12, A61K 31/42, C07B 53/00, C07D 473/18, A61K 31/505, C07D 473/32, C07D 487/04, C07D 405/04, C07D 473/34
Мітки: варіанти, спосіб, фармацевтична, 1,3-оксатіолан, одержання, композиція, похідні
Код посилання
<a href="https://ua.patents.su/38-45942-13-oksatiolan-jjogo-pokhidni-sposib-varianti-jjogo-oderzhannya-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">1,3-оксатіолан, його похідні, спосіб (варіанти) його одержання та фармацевтична композиція</a>
Попередній патент: Композиція для дефоліації рослин та спосіб дефоліації рослин
Наступний патент: Транспортний засіб для транспортування рідких, включаючи нафту і нафтопродукти,сипучих та твердих вантажів
Випадковий патент: Магніторезонансний трибореактор