Похідні азаіндолу, з комбінацією часткового агонізму до нікотинового ацетилхолінового рецептора та інгібування зворотного захоплення допаміну
Номер патенту: 97374
Опубліковано: 10.02.2012
Автори: Коолен Гейн К.А.К., Крузе Корнеліс Г., Стойт Аксель, ван дер Ньот Мартіна А.В.
Формула / Реферат
1. Сполуки загальної формули (І):
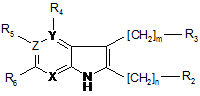 (І)
(І)
або їх таутомери, стереоізомери, N-оксиди або фармакологічно прийнятні солі, гідрати або сольвати будь-якої з зазначених сполук, де
X, Y та Z незалежно один від одного представляють N або C, за умови, що кільце містить принаймні один і не більше двох атомів N,
m та n - незалежно один від одного 0 (нуль) або 1, за умови, що, коли Y та Z представляють вуглець, а X представляє азот, m дорівнює 0 (нулю),
R2 та R3 незалежно один від одного представляють водень, галоген, (C1-3)алкіл, (C1-3)алкініл, NH(C1-3)алкіл, CF3, гідроксил, (C1-3)алкілокси або піперидинільну, піролідинільну, тетрагідропіридинільну, морфолінільну, азепанільну, 1-aзабіцикло[2.2.2]октанільну або 1-aзабіцикло[2.2.2]окт-2-енільну групу, незаміщену або заміщену одним або більше замісниками, вибраними з галогену, (C1-3)алкілу, фенілу або бензилу,
R4, R5 та R6 незалежно один від одного представляють водень, галоген, (C1-3)алкіл, (C2-3)алкініл, CF3, NH(C1-3)алкіл, гідроксил або (C1-3)алкілокси, за умови, що R4 існує лише при Y = C, a R5 - лише при Z = C,
за умови, що, коли X та Z представляють N, Y представляє C, R4 представляє Cl, R5 та R6 представляють H, m та n дорівнюють нулю (0) та R2 - це H, R3 - не йод або 1,2,3,6-тетрагідропіридин-4-іл;
за умови, що, коли X - це N, Y та Z - це C, R4 - це Cl, R5 - це Br, R6 - це H, m та n дорівнюють нулю (0) та R3 - це H, R2 - не йод або H;
за умови, що, коли X та Z - це C, Y - це N, R5 - гідрокси, R2, R4 та R6 - це H, m та n дорівнюють нулю (0), R3 - не 1,2,3,6-тетрагідропіридин-4-іл;
за умови, що, коли X - це N, Y та Z - це C, m та n дорівнюють нулю (0) та R2, R3, R4 та R5 - це H, R6 - не хлор або фтор,
за умови, що, коли X представляє N, Y та Z представляють C, m та n дорівнюють нулю (0) та R2, R3 R4 та R6 - це Н, R5 - не бром, хлор або фтор;
за умови, що, коли X представляє N, Y та Z представляють C, m дорівнює 1, n дорівнює нулю (0) та R2, R4 R5 та R6 - це Н, R3 - не етил або морфолін-4-іл;
за умови, що, коли X представляє N, Y та Z представляють C, m та n дорівнюють нулю (0) та R2, R4 R5 та R6 - це H, R3 - не бром;
за умови, що, коли X представляє N, Y та Z представляють C, m та n дорівнюють нулю (0), та R2, R3 R5 та R6 - це H, R4 - не хлор;
за умови, що, коли X представляє N, Y та Z представляють C, m дорівнює нулю (0), n дорівнює 1 та R3, R4 R5 та R6 - це H, R2 - не водень або піридин-4-іл;
за умови, що, коли X представляє N, Y та Z представляють C, m дорівнює нулю (0), n дорівнює 1 та R4, R5 та R6 - це H, R3 - це бромо, R2 - не піридин-4-іл, 2-метилпіридиніл-4-іл, 2-етилпіридиніл-4-іл або морфолін-4-іл.
2. Сполуки, як заявлено в п. 1, формули (I), у яких R2 та R3 незалежно один від одного представляють водень або піперидинільну, піролідинільну, тетрагідропіридинільну, морфолінільну, азепанільну, 1-aзабіцикло[2.2.2]октанільну або 1-aзабіцикло[2.2.2]окт-2-енільну групу, незаміщену або заміщену одним або кількома замісниками, вибраними з галогену, (C1-3)алкілу, фенілу або бензилу, R4, R5 та R6 незалежно один від одного представляють водень, галоген, (C1-3)алкіл або алкіл(C1-3)окси, за умови, що R4 існує лише при Y = C, R5 - лише при Z = C, a X, Y, Z, m та n мають значення, наведені у п. 1.
3. Сполука згідно з п. 1, що вибрана з групи:
2-піролідин-3-іл-1H-пірол[3,2-b]піридин;
2-піролідин-3-іл-1H-пірол[2,3-b]піридин;
(S)-2-піролідин-3-іл-1H-пірол[2,3-b]піридин;
(R)-2-піролідин-3-іл-1H-пірол[2,3-b]піридин;
2-піперидин-3-іл-1H-пірол[2,3-b]піридин;
2-піперидин-3-іл-1H-пірол[2,3-b]піридин 7-оксид;
(S)-2-піперидин-3-іл-1H-пірол[2,3-b]піридин;
(R)-2-піперидин-3-іл-1H-пірол[2,3-b]піридин;
3-піперидин-3-іл-1H-пірол[2,3-b]піридин;
3-піперидин-3-іл-1H-пірол[2,3-b]піридин 7-оксид;
4-хлор-2-піперидин-3-іл-1H-пірол[2,3-b]піридин;
6-хлор-2-піперидин-3-іл-1H-пірол[2,3-b]піридин;
(S)-6-хлор-2-піперидин-3-іл-1H-пірол[2,3-b]піридин;
(R)-6-хлор-2-піперидин-3-іл-1H-пірол[2,3-b]піридин;
6-хлор-3-піперидин-3-іл-1H-пірол[2,3-b]піридин;
2-(1-метилпіперидин-3-іл-1H-пірол[2,3-b]піридин;
2-(1,2,5,6-тетрагідропіридин-3-іл)-1H-пірол[2,3-b]піридин;
3-(1H-пірол[2,3-b]піридин-2-іл)-піперидин-3-oл;
3-(1H-пірол[2,3-b]піридин-2-іл)-1-азабіцикло[2.2.2]oктан-3-ол;
3-(1H-пірол[2,3-b]піридин-2-іл)-1-азабіцикло[2.2.2]октан;
3-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-3-oл;
3-(1H-пірол[2,3-b]піридин-3-іл)-1-азабіцикло[2.2.2]октан;
3-(1H-пірол[2,3-b]піридин-3-іл)-1-азабіцикло[2.2.2]окт-2-eн;
2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(R)-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(R)-6-піролідин-2-ілметил-7H-пірол[2,3-d]піримідин;
(R)-6-фтор-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(R)-6-хлор-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(R)-6-бром-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(R)-6-метокси-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(R)-5-бром-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(R)-5-метил-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(R)-5-метокси-2-піролідин-2-ілметил-1H-пірол[3,2-b]піридин;
(R)-2-піролідин-2-ілметил-1H-пірол[3,2-b]піридин;
(R)-3-піролідин-2-ілметил-1H-пірол[3,2-b]піридин;
(S)-2-піролідин-2-ілметил-1H-пірол[3,2-b]піридин;
(S)-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(S)-6-фтор-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(S)-6-хлор-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(S)-6-бром-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(S)-5-бром-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин;
(S)-2-(1-метилпіролідин-2-ілметил)-1H-пірол[2,3-b]піридин;
(R)-2-(1-метилпіролідин-2-ілметил)-1H-пірол[2,3-b]піридин;
2-піролідин-3-ілметил-1H-пірол[2,3-b]піридин;
2-(1-метилпіролідин-3-ілметил)-1H-пірол[2,3-b]піридин;
2-(1-бензилпіролідин-3-ілметил)-1H-пірол[2,3-b]піридин.
4. (R)-eнантіомери сполук, як заявлено в п. 1, у яких R2 та R3 незалежно один від одного представляють піперидинільну, піролідинільну, тетрагідропіридинільну, морфолінільну, азепанільну, 1-aзабіцикло[2.2.2]октанільну або 1-aзабіцикло[2.2.2]окт-2-енільну групу, незаміщену або заміщену одним або кількома замісниками, вибраними з галогену, (C1-3)алкілу, фенілу або бензилу, а кільце містить асиметричний атом вуглецю, який є приєднаний до азаіндольного ядра або прямо (коли m та n дорівнюють 0), або через метиленовий місток (коли m або n дорівнюють 1), а всі інші символи мають значення, наведені у п. 1.
5. Фармацевтична композиція, яка містить, на додаток до фармацевтично прийнятного носія та/або принаймні однієї допоміжної речовини, фармакологічно діючу кількість принаймні однієї сполуки за одним з пп. 1-4 або її солі як діючу речовину.
6. Спосіб одержання фармацевтичної композиції, як заявлено в п. 5, який відрізняється тим, що сполуці за одним з пп. 1-4 надають форми, придатної для введення до організму.
7. Сполука, як заявлено в будь-якому з пп. 1-4, або її сіль для використання як лікарського засобу.
8. Сполука загальної формули (І*)
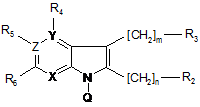 , (I*)
, (I*)
де
Q представляє захисну групу:
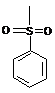 або
або 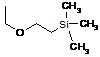 ,
,
X, Y та Z незалежно один від одного представляють N або C,
за умови, що кільце містить принаймні один і не більше двох атомів N,
m та n - незалежно один від одного 0 (нуль) або 1, за умови, що, коли Y та Z представляють вуглець, а X представляє азот, m дорівнює 0 (нулю),
R2 та R3 незалежно один від одного представляють піперидинільну, піролідинільну, тетрагідропіридинільну, морфолінільну, азепанільну, 1-aзабіцикло[2.2.2]октанільну або 1-aзабіцикло[2.2.2]окт-2-енільну групу, незаміщену або заміщену одним або кількома замісниками, вибраними з галогену, (C1-3)алкілу, фенілу або бензилу, причому в кільці, коли воно містить один атом азоту, зазначений атом азоту є заміщений атомом водню, бензильною групою, t-BOC групою або групою SO2-OH,
R4, R5 та R6 незалежно один від одного представляють водень, галоген, (C1-3)алкіл, (C1-3)алкініл, CF3, NH(C1-3)алкіл, гідроксил або алкілокси, за умови, що R4 існує лише при Y = C, a R5 - лише при Z = C,
придатна для синтезу деяких сполук формули (I).
9. Застосування сполуки, як заявлено в будь-якому з пп. 1-4, для приготування фармацевтичної композиції для лікування розладів ЦНС, вибраних з групи: нейроендокринні, неврологічні та нейропсихіатричні розлади, шизофренія, втрата пам’яті та здатності до навчання, гіперактивність при дефіциті уваги, розлади бентежності, депресивні розлади, нейродегенеративні розлади, хвороба Альцгеймера, розлади залежності, розлади харчування, біль, запальні процеси, судорожний синдром, очні розлади, глаукома, дегенерація жовтої плями, діабетична ретинопатія, серцево-судинні, шлунково-кишкові розлади та рак.
10. Застосування, як заявлено у п.9, де зазначені розлади залежності вибрані з нікотинової залежності, кокаїнової залежності та амфетамінової залежності.
Текст
1. Сполуки загальної формули (І): R4 C2 2 (19) 1 3 за умови, що, коли X представляє N, Y та Z представляють C, m дорівнює 1, n дорівнює нулю (0) та R2, R4 R5 та R6 - це Н, R3 - не етил або морфолін-4іл; за умови, що, коли X представляє N, Y та Z представляють C, m та n дорівнюють нулю (0) та R2, R4 R5 та R6 - це H, R3 - не бром; за умови, що, коли X представляє N, Y та Z представляють C, m та n дорівнюють нулю (0), та R2, R3 R5 та R6 - це H, R4 - не хлор; за умови, що, коли X представляє N, Y та Z представляють C, m дорівнює нулю (0), n дорівнює 1 та R3, R4 R5 та R6 - це H, R2 - не водень або піридин4-іл; за умови, що, коли X представляє N, Y та Z представляють C, m дорівнює нулю (0), n дорівнює 1 та R4, R5 та R6 - це H, R3 - це бромо, R2 - не піридин4-іл, 2-метилпіридиніл-4-іл, 2-етилпіридиніл-4-іл або морфолін-4-іл. 2. Сполуки, як заявлено в п. 1, формули (I), у яких R2 та R3 незалежно один від одного представляють водень або піперидинільну, піролідинільну, тетрагідропіридинільну, морфолінільну, азепанільну, 1-aзабіцикло[2.2.2]октанільну або 1aзабіцикло[2.2.2]окт-2-енільну групу, незаміщену або заміщену одним або кількома замісниками, вибраними з галогену, (C1-3)алкілу, фенілу або бензилу, R4, R5 та R6 незалежно один від одного представляють водень, галоген, (C1-3)алкіл або алкіл(C1-3)окси, за умови, що R4 існує лише при Y = C, R5 - лише при Z = C, a X, Y, Z, m та n мають значення, наведені у п. 1. 3. Сполука згідно з п. 1, що вибрана з групи: 2-піролідин-3-іл-1H-пірол[3,2-b]піридин; 2-піролідин-3-іл-1H-пірол[2,3-b]піридин; (S)-2-піролідин-3-іл-1H-пірол[2,3-b]піридин; (R)-2-піролідин-3-іл-1H-пірол[2,3-b]піридин; 2-піперидин-3-іл-1H-пірол[2,3-b]піридин; 2-піперидин-3-іл-1H-пірол[2,3-b]піридин 7-оксид; (S)-2-піперидин-3-іл-1H-пірол[2,3-b]піридин; (R)-2-піперидин-3-іл-1H-пірол[2,3-b]піридин; 3-піперидин-3-іл-1H-пірол[2,3-b]піридин; 3-піперидин-3-іл-1H-пірол[2,3-b]піридин 7-оксид; 4-хлор-2-піперидин-3-іл-1H-пірол[2,3-b]піридин; 6-хлор-2-піперидин-3-іл-1H-пірол[2,3-b]піридин; (S)-6-хлор-2-піперидин-3-іл-1H-пірол[2,3-b]піридин; (R)-6-хлор-2-піперидин-3-іл-1H-пірол[2,3-b]піридин; 6-хлор-3-піперидин-3-іл-1H-пірол[2,3-b]піридин; 2-(1-метилпіперидин-3-іл-1H-пірол[2,3-b]піридин; 2-(1,2,5,6-тетрагідропіридин-3-іл)-1H-пірол[2,3b]піридин; 3-(1H-пірол[2,3-b]піридин-2-іл)-піперидин-3-oл; 3-(1H-пірол[2,3-b]піридин-2-іл)-1азабіцикло[2.2.2]oктан-3-ол; 3-(1H-пірол[2,3-b]піридин-2-іл)-1азабіцикло[2.2.2]октан; 3-(1H-пірол[2,3-b]піридин-3-іл)-піперидин-3-oл; 3-(1H-пірол[2,3-b]піридин-3-іл)-1азабіцикло[2.2.2]октан; 3-(1H-пірол[2,3-b]піридин-3-іл)-1азабіцикло[2.2.2]окт-2-eн; 2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин; (R)-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин; (R)-6-піролідин-2-ілметил-7H-пірол[2,3-d]піримідин; 97374 4 (R)-6-фтор-2-піролідин-2-ілметил-1H-пірол[2,3b]піридин; (R)-6-хлор-2-піролідин-2-ілметил-1H-пірол[2,3b]піридин; (R)-6-бром-2-піролідин-2-ілметил-1H-пірол[2,3b]піридин; (R)-6-метокси-2-піролідин-2-ілметил-1H-пірол[2,3b]піридин; (R)-5-бром-2-піролідин-2-ілметил-1H-пірол[2,3b]піридин; (R)-5-метил-2-піролідин-2-ілметил-1H-пірол[2,3b]піридин; (R)-5-метокси-2-піролідин-2-ілметил-1H-пірол[3,2b]піридин; (R)-2-піролідин-2-ілметил-1H-пірол[3,2-b]піридин; (R)-3-піролідин-2-ілметил-1H-пірол[3,2-b]піридин; (S)-2-піролідин-2-ілметил-1H-пірол[3,2-b]піридин; (S)-2-піролідин-2-ілметил-1H-пірол[2,3-b]піридин; (S)-6-фтор-2-піролідин-2-ілметил-1H-пірол[2,3b]піридин; (S)-6-хлор-2-піролідин-2-ілметил-1H-пірол[2,3b]піридин; (S)-6-бром-2-піролідин-2-ілметил-1H-пірол[2,3b]піридин; (S)-5-бром-2-піролідин-2-ілметил-1H-пірол[2,3b]піридин; (S)-2-(1-метилпіролідин-2-ілметил)-1H-пірол[2,3b]піридин; (R)-2-(1-метилпіролідин-2-ілметил)-1H-пірол[2,3b]піридин; 2-піролідин-3-ілметил-1H-пірол[2,3-b]піридин; 2-(1-метилпіролідин-3-ілметил)-1H-пірол[2,3b]піридин; 2-(1-бензилпіролідин-3-ілметил)-1H-пірол[2,3b]піридин. 4. (R)-eнантіомери сполук, як заявлено в п. 1, у яких R2 та R3 незалежно один від одного представляють піперидинільну, піролідинільну, тетрагідропіридинільну, морфолінільну, азепанільну, 1aзабіцикло[2.2.2]октанільну або 1aзабіцикло[2.2.2]окт-2-енільну групу, незаміщену або заміщену одним або кількома замісниками, вибраними з галогену, (C1-3)алкілу, фенілу або бензилу, а кільце містить асиметричний атом вуглецю, який є приєднаний до азаіндольного ядра або прямо (коли m та n дорівнюють 0), або через метиленовий місток (коли m або n дорівнюють 1), а всі інші символи мають значення, наведені у п. 1. 5. Фармацевтична композиція, яка містить, на додаток до фармацевтично прийнятного носія та/або принаймні однієї допоміжної речовини, фармакологічно діючу кількість принаймні однієї сполуки за одним з пп. 1-4 або її солі як діючу речовину. 6. Спосіб одержання фармацевтичної композиції, як заявлено в п. 5, який відрізняється тим, що сполуці за одним з пп. 1-4 надають форми, придатної для введення до організму. 7. Сполука, як заявлено в будь-якому з пп. 1-4, або її сіль для використання як лікарського засобу. 8. Сполука загальної формули (І*) 5 97374 R4 R5 Z R6 [CH2]m X N R3 [CH2]n Y R2 Q , (I*) де Q представляє захисну групу: O S O CH3 O Si CH3 CH 3 або , X, Y та Z незалежно один від одного представляють N або C, за умови, що кільце містить принаймні один і не більше двох атомів N, m та n - незалежно один від одного 0 (нуль) або 1, за умови, що, коли Y та Z представляють вуглець, а X представляє азот, m дорівнює 0 (нулю), R2 та R3 незалежно один від одного представляють піперидинільну, піролідинільну, тетрагідропіридинільну, морфолінільну, азепанільну, 1aзабіцикло[2.2.2]октанільну або 1aзабіцикло[2.2.2]окт-2-енільну групу, незаміщену або заміщену одним або кількома замісниками, Галузь техніки Цей винахід стосується похідних азаіндолу загальної формули (І): де значення позначок наведені в описі. У цих сполуках частковий агонізм до рецепторів нікотинового ацетилхоліну сполучається з інгібуванням повторного засвоєння допаміну. Винахід також стосується фармацевтичних композицій, які містять ці сполуки, способів їх одержання, способів одержання нових проміжних продуктів, придатних для їх синтезу, та застосування таких сполук та композицій, зокрема, при введенні їх хворим для досягнення лікувального ефекту при розладах, у яких беруть участь рецептори нікотину та транспортери допаміну, або таких, що піддаються лікуванню шляхом дії на зазначені рецептори. Передумови створення винаходу Запропоновано застосування нікотину для досягнення низки фармакологічних ефектів (Pullan, 1994). Деякі з них стосуються виділення нейротрансмітерів. Повідомлялося про виділення ацетилхоліну, допаміну, норепінефрину, серотоніну та глютамату при введенні нікотину (Toth, 1992). Це 6 вибраними з галогену, (C1-3)алкілу, фенілу або бензилу, причому в кільці, коли воно містить один атом азоту, зазначений атом азоту є заміщений атомом водню, бензильною групою, t-BOC групою або групою SO2-OH, R4, R5 та R6 незалежно один від одного представляють водень, галоген, (C1-3)алкіл, (C1-3)алкініл, CF3, NH(C1-3)алкіл, гідроксил або алкілокси, за умови, що R4 існує лише при Y = C, a R5 - лише при Z = C, придатна для синтезу деяких сполук формули (I). 9. Застосування сполуки, як заявлено в будьякому з пп. 1-4, для приготування фармацевтичної композиції для лікування розладів ЦНС, вибраних з групи: нейроендокринні, неврологічні та нейропсихіатричні розлади, шизофренія, втрата пам’яті та здатності до навчання, гіперактивність при дефіциті уваги, розлади бентежності, депресивні розлади, нейродегенеративні розлади, хвороба Альцгеймера, розлади залежності, розлади харчування, біль, запальні процеси, судорожний синдром, очні розлади, глаукома, дегенерація жовтої плями, діабетична ретинопатія, серцево-судинні, шлунково-кишкові розлади та рак. 10. Застосування, як заявлено у п.9, де зазначені розлади залежності вибрані з нікотинової залежності, кокаїнової залежності та амфетамінової залежності. підтверджують інші автори, які також провели додаткові дослідження з модулювання у ЦНС глютамату, оксиду азоту, GABA (гамма-аміноолійної кислоти), такікінинів, цитокінів та пептидів (Вrіоnі, 1997). Більш того, повідомлялося про нейрозахисну та іншу сприятливу фармакологічну дію нікотину (Sjak-shie, 1993; Onaivi, 1994). Повідомлялося про різні сполуки, націлені на nAChRs, які здатні виліковувати різноманітні стани та розлади (Damaj, 1999; Ваnnоn, 1998; Bencherif, 2002; Levin, 2002; O'Neill, 2002; Breining, 2005). В літературі обговорюються такі терапевтичні показання: розлади ЦНС, як от невроендокринні, неврологічні та невропсихіатричні розлади, шизофренія, враження пам'яті та здатності до навчання, гіперактивність при дефіциті уваги, бентежність, депресії, нейродегенеративні розлади, хвороба Альцгеймера, наркозалежність, нікотинова залежність, кокаїнова залежність, амфетамінова залежність, розлади харчування, біль, запалювальні процеси, судорожний синдром, очні розлади, глаукома, дегенерація жовтої плями, діабетична ретинопатія, серцево-судинні, шлунково-кишкові розлади та рак. Антагоністи рецепторів нікотину посідають великий потенціал як лікувальні засоби, оскільки дозволяють модулювати функцію рецепторів нікотину. Агоністи нікотину швидко десенситизують ці рецептори, по суті інгібуючи їх функціонування. Тому інгібування рецепторів нікотину може бути клінічно корисним, що вказує на можливу сприят 7 ливу роль антагоністів рецепторів нікотину при лікуванні хвороб, для яких зараз розробляються агоністи нікотину. Наприклад, шизофренія та наркоманія пов'язані з гіперактивністю допамінергійних систем ЦНС, а інгібування рецепторів нікотину може сприяти зниженню такої гіперактивності. Розлади ЦНС як різновид неврологічних розладів можуть спричинюватися вживанням ліків, бути наслідком генетичної схильності, інфекції або травми, або мати невідому етіологію. Йдеться про невропсихіатричні розлади, нервові захворювання та розумові розлади, у тому числі нейродегенеративні розлади, розлади поведінки, розлади пізнання та афективні розлади пізнання. Клінічні прояви деяких розладів ЦНС приписуються дисфункції ЦНС (тобто вони пояснюються невідповідними рівнями виділення нейротрансмітерів, невідповідними властивостями рецепторів нейротрансмітерів та/або невідповідною взаємодією між нейротрансмітерами та їх рецепторами). Кілька розладів ЦНС можна пояснити дефіцитом ацетилхоліну, допаміну, норепінефрину та/або серотоніну. До поширених розладів ЦНС можна віднести передчасне слабоумство (ранню появу хвороби Альцгеймера), старече слабоумство (типу Альцгеймера), слабоумство, спричинене мікроінфарктами, СНІДом, судинними спазмами, хворобу Крейцфельда-Якоба (губчасту енцефалопатію людини), хворобу Піка (передстаречу обмежену атрофію мозку), паркінсонізм, у тому числі хворобу Паркінсона, слабоумство, спричинене тілами Леві, прогресивний надядровий параліч, хорею Гантінгтона, пізню дискінезію, гіперкінезію, манію, дефіцит уваги, бентежність, дислексію, шизофренію, депресію, невроз нав'язливих станів та синдром Туретта. Дія багатьох нейрофармакологічних лікарських засобів пов'язана з модулюванням виділення допаміну, норепінефрину та серотоніну, засвоєнням та зберіганням їх у відповідних нішах у ЦНС. Більшість нейротрансмітерів зберігаються у синаптичних бульбашках - приналежностях нервових закінчень. Скоріш за все, саме концентрація у бульбашках забезпечує постійне надходження нейротрансмітера для позаклітинного виділення з нейрону до синаптичної щілини. Бульбашки також захищають нейротрансмітер від метаболічного розкладу. Одним з транспортних сайтів на мембрані бульбашки є бульбашковий транспортер-2 моноаміну (VMAT2), який транспортує трансмітер з цитозолю до синаптичної бульбашки. Дігідротетрабеназин, структурно пов'язаний з метоксітетрабеназином, слугує радіоміткою для дослідження взаємодії лікарських засобів з VMAT2. Обидві сполуки діють на той самий сайт на VMAT2. При виділенні нейротрансмітера із закінчення до синаптичного простору він взаємодіє з постсинаптичними рецепторами, внаслідок чого повторно засвоюється до нервового закінчення через плазмовий мембранний транспортер (наприклад, транспортер допаміну та/або транспортер серотоніну). Таким чином, транспортерні протеїни модифікують концентрацію нейротрансмітера у цитозольному та бульбашковому резервуарах, а відтак здатні змінювати подальшу нейротрансмісію. 97374 8 Допамін - це моноамінний нейтротрансмітер, який відіграє вирішальну роль у функціонуванні осі гіпоталамус-гіпофіз-наднирковик та в інтегруванні інформації у сенсорній, лімбічній та моторній системах. Припинити нейротрансмісію допаміну можливо у першу чергу шляхом повторного засвоєння + виділеного допаміну залежними від Na /Cl плазмовими мембранними транспортерами. У залежності від іонного оточення транспортер допаміну може слугувати медіатором як у скерованому досередини транспортуванні допаміну (тобто "повторному засвоєнні"), так і у скерованому назовні транспортуванні допаміну (тобто "виділенні"). Функціональна роль транспортера допаміну полягає у регулюванні нейротрансмісії допаміну шляхом припинення дії допаміну в синапсі внаслідок повторного засвоєння. Шляхи компенсації допаміну з'являються при розладах, спричинених споживанням наркотиків. Генні варіанти рецептора допаміну D2 пов'язують з алкоголізмом, обжерливістю, патологічним картярством, гіперактивністю при дефіциті уваги, синдромом Туретта, кокаїновою залежністю, нікотиновою залежністю, зловживанням кількома наркотиками та іншими формами наркозалежності. Оскільки виявлене зниження допамінергійних функцій в осіб із малим вмістом алелю А1 рецептора допаміну D2, припускається, що рецептор допаміну D2 може підсилювати компенсаційний ген. Більш того, кілька авторів припускають, що поліморфізми гена рецептора допаміну D2 пов'язані з синдромом нав'язливих станів, тобто "синдромом дефіциту компенсації" (Blum, 1995). Транспортер допаміну являє собою передсинаптичну макромолекулу, яка відіграє важливу роль у патофізиологічних процесах у ЦНС. Транспортер допаміну припиняє допамінергійну нейротрансмісію, наново накопичуючи виділений допамін у пресинаптичних нейронах. При кокаїновій залежності прив'язування кокаїну до транспортера допаміну, що призводить до блокуваннязасвоєння допаміну, приписується підсилювальним властивостям цього наркотику. З транспортною функцією також пов'язане накопичення нейротоксичних речовин у допамінергійних нейронах, яке має місце при хворобі Паркінсона. Макромолекулатранспортер може слугувати маркером для хвороби Паркінсона, про що свідчить її відсутність у зрізах тканин хворих. Також транспортер допаміну відіграє важливу роль у нейротоксичній дії 1метил-4-феніл-1,2,3,6-тетрагідропіридину (МРТР), який спричинює ідіопатичний синдром Паркінсона у людини. Отже, потужні, але селективні ліганди до транспортера допаміну здатні здійснювати in vivo контроль головних цілей кокаїну у мозку, характеризувати сайти прив'язування кокаїну, слугувати фармакотерапевтичними агентами для лікування кокаїнової залежності та здійснювати моніторинг хвороби Паркінсона. Безліч речовин можуть спричинювати фізичну та/або психологічну залежність. Найвідомішими є опіати, як героїн, опіум та морфій; симпатоміметики, у тому числі кокаїн та амфетаміни; снотворнігіпнотики, включаючи алкоголь, бензодіазепини та барбітурати, та нікотин, дія якого подібна до опіої 9 97374 10 дів та симпатоміметиків. Наркозалежність характеризується нестримним потягом до вживання речовини та нездатністю обмежити це вживання. Крім того, наркозалежність пов'язана з переносністю, втратою дійовості препарату після тривалого вживання та ломкою - появою певних фізичних та психологічних симптомів, коли препарат не вживається. Якщо тривалий прийом препарату спричинює посилену реакцію на кожну дозу, має місце сенситизація. Переносність, сенситизація та ломка свідчать про зміни у центральній нервовій системі внаслідок тривалого вживання препарату. Ці зміни спонукають людину продовжувати вживання наркотику, незважаючи на серйозні суспільні, юридичні, фізичні та/або професійні наслідки. Зловживан ня кокаїном залишається однією з найтяжчих проблем охорони здоров'я у США. Фундаментальні дослідження у багатьох лабораторіях доводять, що кокаїн блокує засвоєння допаміну з синаптичної щілини транспортера допаміну. Номілфенсин та бупропіон - це фармакологічні стандарти інгібіторів транспортера допаміну. Вони вживаються у клінічній практиці як антидепресанти, а бупропіон, крім того, є однією з небагатьох сполук, застосованих для терапії нікотинової залежності. Сполуки класу "GBR" відомі своєю надзвичайною селективністю та потужністю щодо транспортера допаміну. Дві ці сполуки мають спорідненість у наномолярному діапазоні (DeVries, 1997). Радіомічення цих сполук полегшує вивчення нейрофармакологічної активності. GBR 12909 (ваноксерин) дуже повільно дисоціює від DAT та попереджує зростання позаклітинних рівнів допаміну, спричинене кокаїном, як показує мікродіаліз. Ця сполука виявилася нестимулюючою для добровільних учасників дослідів і блокує спричинену кокаїном поведінку у макак резус (Dutta, 1993). Такі дослідження дають змогу припускати, що деякі сполуки можуть діяти як антагоністи кокаїну, не спричинюючи привикання до себе. Нікотин сприяє виділенню допаміну. Те саме роблять інгібітори транспортера допаміну, але механізм їх дії зовсім інший. Тому в умовах, коли підвищення рівнів ендогенного допаміну є бажане, вірогідність того, що сполука з подвійним механізмом дії спрацює ефективніше, більша, ніж у сполуки з лише одним механізмом. Сполуки з таким подвійним механізмом дії відомі. Першою став, як часто трапляється в історії медицини, натуральний продукт. -лобелин (лобелин), ліпофільний непіридиновий алкалоїдний компонент індіанського тютюну, є головним алкалоїдом у родині структурно пов'язаних сполук, що містяться у Lobelia inflata. Лобелин спричинює ті самі ефекти, що нікотин, у тому числі тахікардію та гіпертензію, гіперальгезію та поліпшення навчання й пам'яті. Лобелин має високу спорідненість до рецепторів нікотину, але структурної схожості між ними немає, і структурні функціональні взаємини між S(-)нікотином та лобелином не дають підстав підозрювати спільний фармакофор. Крім того, різна дія лобелину та нікотину припускає, що ці речовини не діють крізь спільний механізм у ЦНС, хоча лобелин і вважається мішаним агоністом-антагоністом нікотину. Лобелин провокує виділення допаміну із стріальних зрізів щурів. Однак спричинене лобелином виділення допаміну не залежить ані від позаклітинного кальцію, ані від мекаміламіну - неконкурентного антагоніста рецепторів нікотину. Отже, спричинене лобелином виділення допаміну відбу вається іншим шляхом, ніж це робить нікотин. Лобелін також інгібує засвоєння допаміну у стріальних синаптичних бульбашках щурів шляхом взаємодії з сайтом дігідротетрабеназину на VMAT2, збільшуючи таким чином кількість цитозольного допаміну, придатного для зворотного транспорту 11 вання плазмовим мембранним транспортером (DAT) (Teng, 1997, 1998). Отже, лобелін взаємодіє з рецепторами нікотину й блокує спричинене нікотином виділення допаміну, але він також взаємодіє з транспортними протеїнами допаміну (DAT та VMAT2), модифікуючи концентрацію допаміну у цитозольних та бульбашкових пулах і через те змінюючи подальшу допамінергійну нейротрансмісію. У US 20030100547 та US 20040266824 описуються похідні 2,6-двозаміщених піперидину та піперазину - структурні аналоги лобеліну: Ці сполуки синтезують та випробують на активність у дослідах з рецепторами нікотину та транспортерами допаміну і у дослідах виділення з метою визначити взаємодію цих сполук зі специфічними протеїнами на пресинаптичному закінченні моноамінергійних нейронів у ЦНС. Деякі сполуки посідають більшу селективність при взаємодії з DAT, ніж з рецепторами нікотину, тоді як інші взаємодіють і з рецепторами нікотину, і з DAT, подібно до лобеліну. Є і сполуки, більш селективні до рецепторів нікотину, ніж до DAT. Ці комбінації фармакологічної активності є сприятливі при лікуванні зловживань психостимуляторами та абстиненції, розладів харчування, хвороб та патологій центральної нервової системи. Похідні азаіндолу-етиламіну як агенти зв'язування нікотинових рецепторів ацетилхолину, придатні для лікування станів, пов'язаних з виснаженням рецепторів нікотину у ссавців, зокрема, нікотинової залежності, описані у ЕР 0870768 А1 та ЕР 1178045 А1. Деякі з цих сполук структурно пов'язані із сполуками за винаходом. Вони є поту3 жними витискувачами [ Н]-нікотину із значеннями ІС50 менше 2 мкМ, тобто із значеннями pIC50 5.7 і вище. Жодної спорідненості до специфічних окремих сполук не виявлено. У наведених вище застосуваннях не йдеться про інгібування повторного засвоєння допаміну. Ніякого дива, бо синтез та випробування низки заявлених сполук доводять відсутність активності щодо інгібування повторного засвоєння допаміну. Метою винаходу є створення подальших сполук з подвійним механізмом дії: (частковим) агонізмом до нікотинових рецепторів ацетилхолину та інгібуванням повторного засвоєння допаміну. Докладний опис винаходу Несподівано встановлено, що сполуки загальної формули (І): 97374 12 де - Φ, Υ та Ζ незалежно один від одного представляють N або С, за умови, що кільце містить принаймні один і не більше двох атомів Ν, - m та n - незалежно один від одного 0 (нуль) або 1, за умови, що, коли Υ та Ζ представляють вуглець, а X представляє азот, m дорівнює 0 (нулю), - R2 та R3 незалежно один від одного представляють водень, галоген, (С1-3)алкіл, (С1-3)алкініл, NH(С1-3)алкіл, CF3, гідроксил, (С1-3)алкілоксі, або групу піперидиніл, піролідиніл, тетрагідропіридиніл, морфолініл, азепаніл, 1-азабіцикло[2.2.2]октаніл або 1-аза-біцикло[2.2.2]окт-2еніл, незаміщену або заміщену одним або кількома замісниками, обраними з-поміж галогену, (С13)алкілу, фенілу або бензилу, - R4, R5 та R6 незалежно один від одного представляють водень, галоген, (С1-3)алкіл, (С13)алкініл, NH(С1-3)алкіл, CF3, гідроксил або (С13)алкілоксі, за умови, що R4 існує лише при Υ=С, a R5 лише при Ζ=С, та їх таутомери, стереоізомери та N-оксиди, а також фармакологічно прийнятні солі, гідрати та сольвати зазначених сполук формули (І) та їх таутомерів, стереоізомерів та Ν-оксидів є новими й поєднують частковий агонізм до нікотинових рецепторів ацетилхолину з інгібуванням повторного засвоєння допаміну. Зокрема, винахід стосується сполук загальної формули (І), де R2 та R3 незалежно один від одного представляють водень або групу піперидиніл, піролідиніл, тетрагідропіридиніл, морфолініл, азепаніл, 1-аза-біцикло[2.2.2]октаніл або 1-азабіцикло[2.2.2]окт-2-еніл, незаміщену або заміщену одним або кількома замісниками, обраними зпоміж галогену, (С1-3)алкілу, фенілу або бензилу, R4, R5 та R6, незалежно один від одного представляють водень, галоген, (С1-3)алкіл або (С13)алкілоксі, за умови, що R4 існує лише при Υ=С, a R5 лише при Ζ=С, а X, Υ, Ζ, m та n мають значення, наведені вище. Сполуки за винаходом загальної формули (І), а також їх фармакологічно прийнятні солі посідають (часткову) агоністичну активність щодо нікотинових рецепторів ацетилхолину та інгібують повторне засвоєння допаміну. Вони придатні для лікування розладів, пов'язаних із зазначеними рецепторами, або таких, що піддаються лікуванню шляхом дії на ці рецептори, серед яких можна навести невроендокринні, неврологічні та невропсихіатричні розлади, шизофренію, враження пам'яті та здатності до навчання, гіперактивність при дефіциті уваги, бентежність, депресії, нейродегенеративні розлади, хворобу Альцгеймера, наркозалежність, нікотинову залежність, кокаїнову залежність, амфетамінову залежність, розлади харчування, біль, запалювальні процеси, судоро 13 жний синдром, очні розлади, глаукому, дегенерацію жовтої плями, діабетичну ретинопатію, серцево-судинні, шлунково-кишкові розлади та рак. Винахід також охоплює: фармацевтичні композиції для лікування розладів або станів, які піддаються лікуванню при активації та/або блокуванні зазначених рецепторів, які містять сполуку формули (І) або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій; способи лікування розладів або станів, які піддаються лікуванню при активації та/або блокуванні зазначених рецепторів шляхом введення ссавцю, який їх потребує, сполуки формули (І) або її фармацевтично прийнятної солі; фармацевтичні композиції для лікування розладів або станів, обраних з-поміж таких, як невроендокринні, неврологічні та невропсихіатричні розлади, шизофренія, враження пам'яті та здатності до навчання, гіперактивність при дефіциті уваги, бентежність, депресії, нейродегенеративні розлади, хвороба Альцгеймера, наркозалежність, нікотинова залежність, кокаїнова залежність, амфетамінова залежність, розлади харчування, біль, запалювальні процеси, судорожний синдром, очні розлади, глаукома, дегенерація жовтої плями, діабетична ретинопатія, серцево-судинні, шлунковокишкові розлади та рак; способи лікування розладів або станів, обраних з перелічених вище, шляхом введення ссавцю, який їх потребує, сполуки формули (І) або її фармацевтично прийнятної солі; фармацевтичні композиції для лікування розладів або станів, обраних з перелічених вище, які містять сполуку формули (І) або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій; способи лікування розладів або станів, обраних з перелічених вище, шляхом введення хворому, який потребує такого лікування, сполуки формули (І) або її фармацевтично прийнятної солі; способи активації рецептора нікотину та/або інгібування повторного засвоєння допаміну шляхом введення хворому, який цього потребує, ефективної кількості сполуки формули (І). Винахід також передбачає застосування сполуки або солі згідно з формулою (І) для одержання лікарського засобу. Також винахід стосується комбінованої терапії, у якій сполуку за винаходом, або її фармацевтично прийнятну сіль, або композицію з вмістом сполуки за винаходом вводять одночасно, або послідовно, або у сполученні з іншим лікарським засобом або засобами для лікування одного або кількох із перелічених станів. Такий інший лікарський засіб (засоби) можна вводити до, одночасно або після прийому сполук за винаходом. Винахід також пропонує сполуки, фармацевтичні композиції, набори та методики для лікування перелічених розладів шляхом введенням хворому, який потребує такого лікування, сполуки формули (І) або її фармацевтично прийнятної солі. Сполуки за винаходом посідають (часткову) агоністичну активність щодо нікотинових рецепторів ацетилхолину та інгібують повторне засвоєння допаміну. Така активність легко демонструється за 97374 14 допомогою дослідів, описаних тут або відомих фахівцям. Винахід також пропонує способи одержання сполук за винаходом та проміжних сполук, що використовуються у цих способах. Сполуки за винаходом можуть містити один або кілька асиметричних центрів, а відтак приймати форму рацематів та рацемічних сумішей, поодиноких енантіомерів, діастереометрних сумішей та поодиноких діастереомерів. У залежності від характеру замісників молекула може мати додаткові асиметричні центри. Кожний такий асиметричний центр незалежно продукує два оптичні ізомери. Усі можливі оптичні ізомери та діастереомери, у сумішах і у вигляді чистих чи частково очищених сполук, охоплюються обсягом цього винаходу. Під винахід підпадають усі такі ізомерні форми зазначених сполук. Формула (І) показує структуру класу сполук, не вдаючись до конкретної стереохімії. Незалежний синтез цих діастереомерів або їх хроматографічне розділення можна здійснювати відомими прийомами з відповідною модифікацією наведених методик. Конкретна стереохімія визначається рентгенокристалографією кристалічних продуктів або кристалічних проміжних сполук, які за потреби дериватизують реагентом, що містить асиметричний центр з відомою абсолютною конфігурацією. Рацемічні суміші сполук можна розділяти на окремі енантіомери відомими прийомами, наприклад, прив'язуванням рацемічної суміші сполук до енантіомерно чистої сполуки з утворенням діастереомерної суміші, яку надалі розділяють на окремі діастереомери стандартними способами, наприклад, фракційною кристалізацією або хроматографією. Прив'язування часто полягає в утворенні солей з використанням енантіомерно чистої кислоти або основи, наприклад, (-)-ді-р-толуоїл-Dвинної кислоти та/або (+)-ді-р-толуоїл-L-винної кислоти. Діастереомерні похідні можна потім перетворити на чисті енантіомери відщепленням доданого хірального залишку. Рацемічну суміш можна також прямо розділити хроматографічними методами за допомогою хіральних стаціонарних фаз. Ці методи добре відомі фахівцям. Або ж можна одержати будь-який енантіомер сполуки стереоселективним синтезом з використанням оптично чистих вихідних матеріалів або реагентів з відомою конфігурацією відомими методами. Таутомери сполук формули (І) або їх фармацевтично прийнятні солі також охоплюються обсягом винаходу. Деякі кристалічні форми можуть існувати як поліморфи; вони також належать до обсягу винаходу. Крім того, деякі сполуки можуть утворювати сольвати з водою (наприклад, гідрати) або звичайними органічними розчинниками. Ці сольвати також охоплюються винаходом. Мічені ізотопами сполуки формули (І) або їх фармацевтично прийнятні солі, у тому числі мічені ізотопами сполуки формули (І), які визначаються методами PET (позитронної емісійної томографії) або SPECT, також входять до обсягу винаходу. Те 13 саме стосується сполук формули (І), мічених [ С]-, 14 3 18 125 [ С]-, [ Н]-, [ F]-, [ I]- або іншими збагаченими 15 ізотопами атомами, придатних для досліджень зв'язування рецепторів або метаболізму. Визначення хімічних та інших термінів Термін 'алкіл' стосується прямих чи розгалужених насичених вуглеводневих радикалів. 'Алкіл(С1-3), наприклад, означає метил, етил, nпропил або ізопропил, а 'алкіл(С1-4)' означає 'метил, етил, n-пропил, ізопропил, n-бутил, 2-бутил, ізобутил або 2-метил-n-пропил'. Під 'алкенілом' розуміються прямі або розгалужені вуглеводневі радикали з одним або кількома подвійними вуглець-вуглецевими зв'язками, наприклад, вініл, аліл, бутеніл тощо. В 'алкінільних' групах прямі або розгалужені вуглеводневі радикали мають один або кілька потрійних вуглець-вуглецевих зв'язків, наприклад, етиніл, пропаргіл, 1-бутиніл, 2-бутиніл тощо. 'Ацил' - це алкіл(С1-3)карбоніл, арилкарбоніл або арилалкіл(С1-3карбоніл. 'Гало' або 'галоген' означає хлор, фтор, бром або йод; 'гетеро' у термінах типу 'гетероалкіл, гетероароматичний' тощо означає такий, що містить один або кілька атомів N, О або S. 'Гетероалкіл' включає алкільні групи з гетероатомами у будьяких положеннях, у тому числі N-зв'язані, Озв'язані або S-зв'язані алкільні групи. Терміни "оксі", "тіо" та "карбо" у складі груп стосуються атома кисню, атома сірки та карбонільної (С=О) групи, що слугує зв'язувальною ланкою між двома групами, наприклад, гідроксил, оксіалкіл, тіоалкіл, карбоксіалкіл тощо. "Амін" окремо або у складі групи стосується атома азоту, який може слугувати або закінченням, або зв'язкою між двома іншими первинними, вторинними або третинними амінними групами (два атоми водню зв'язані з атомом азоту, один атом водню зв'язаний з атомом азоту або жодний атом водню не зв'язаний з атомом азоту відповідно). "Сульфініл" та "сульфоніл" у складі груп - це відповідно групи -SO- або - SO2-. Якщо не зазначене інше, термін "вихідна група" означає заряджений або незаряджений атом чи групу, що виходить під час реакції заміщення. Це може бути, наприклад, Вr, СІ, І, мезилат, тозилат тощо. N-оксиди наведених сполук входять до обсягу винаходу. Третинні аміни або породжують, або не породжують N-оксидні метаболіти. Ступінь Nокислення сягає від слідів до практично повної конверсії. N-оксиди можуть посідати більшу або меншу активність, ніж відповідні третинні аміни. Хоча N-оксиди легко відновлюються до відповідних третинних амінів хімічними засобами, у людському організмі це відбувається у різному ступені. Деякі N-оксиди майже повністю відновлюються до третинних амінів, а в інших випадках така реакція майже або взагалі не відбувається (Вісkеl, 1969). Щодо замісників термін "незалежно" означає, що при наявності кількох замісників вони можуть бути однакові або різні. З метою точнішого опису деякі кількісні показники наводяться з виразом "біля". Незалежно від наявності або відсутності цього "біля" усі наведені кількісні значення є фактичні, а ступінь наближення цієї величини цілком зрозумілий для фахівця з урахуванням експериментальних та/або вимірювальних умов для такої 97374 16 величини. В описі та формулі термін "містити" та його варіанти на зразок "такий, що містить" або "містять" не включає інших добавок, компонентів, цілих чисел або операцій. Термін "композиція" у цьому винаході охоплює продукти, що містять зазначені компоненти у завданих кількостях або пропорціях, а також продукти, що утворюються прямо чи непрямо з комбінації зазначених компонентів у зазначених кількостях. Відносно фармацевтичних композицій йдеться про продукт, який містить один або кілька діючих компонентів та носій з інертних компонентів, а також продукт, що є прямим або непрямим результатом комбінації, комплексоутворення або агрегатування двох чи більше компонентів, або розкладу одного чи кількох компонентів, або інших видів реакцій чи взаємодій між компонентами. Як правило, фармацевтичні композиції одержують рівномірним та ретельним змішуванням діючого компонента з рідким або подрібненим твердим носієм чи обома, після чого за потреби продукту надають завдану форму. У фармацевтичній композиції діючу сполуку вводять у достатній кількості для досягнення потрібної дії на хід стану або хвороби. Відповідно фармацевтичною композицією за винаходом є будь-яка композиція, одержана змішуванням сполуки за винаходом з фармацевтично прийнятним носієм. "Фармацевтично прийнятний" носій, розбавник або наповнювач має бути сумісним з іншими компонентами композиції, нешкідливим для хворого. Доза. Спорідненість сполук за винаходом до рецепторів канабіноїдів СВ1 визначають, як описано далі. Знаючи спорідненість зв'язування, виміряну для даної сполуки формули (І), можна визначити теоретичну мінімальну ефективну дозу. При концентрації сполуки, яка дорівнює двом виміряним значенням Ki, майже 100% рецепторів канабіноїдів СВ1 мають бути зайняті цією сполукою. Переводячи цю концентрацію у мг речовини на кг маси хворого, визначають теоретичну мінімальну ефективну дозу, що відповідає ідеальній біозасвоюваності. Фактично можна призначати більшу чи меншу дозу, виходячи з міркувань фармакокінетики, фармакодинаміки та ін. Доза сполуки, яку вводять конкретному хворому, залежить від показань, віку, маси тіла та статі хворого й визначається лікарем. Доза може знаходитися у межах від 0.01 мг/кг до 10 мг/кг. Денна доза діючих речовин коливається у широких межах залежить від різноманітних факторів, а саме показань, шляху введення, віку, маси тіла та статі хворого й визначається лікарем. Як правило, оральні та парентеральні дози становлять від 0.1 до 1,000 мг на добу всіх діючих компонентів. "Терапевтично дійова кількість" - це така кількість лікарського засобу, яка дозволяє вилікувати або попередити стан, для лікування якого призначена композиція. Ця кількість є достатньою, щоб спричинити помітну терапевтичну, профілактичну реакцію або поліпшення у тканинній системі, у тварини чи людини. Це може бути, наприклад, загоєння або попередження одного із наведених станів. Точна дійова кількість для хворого залежить від його маси та стану здоров'я, природи та 17 важкості стану, що лікується, рекомендацій лікаря (дослідника, ветеринара, медика або іншого клініциста) та методики лікування й комбінації застосованих ліків. Через те визначати ефективну терапевтичну кількість наперед недоцільно. Термін "фармацевтично прийнятна сіль" охоплює солі, які, на здоровий медичний розсуд, є придатні для застосування у контакті з тканинами людей та тварин, не спричинюючи небажаної токсичності, подразнення, алергічної реакції тощо, й відповідають позитивному критерію ефект/ризик. Фармацевтично прийнятні солі добре відомі фахівцям. Їх можна готувати на місці з виділених та очищених сполук за винаходом або уособицю реакцією з фармацевтично прийнятними нетоксичними основами чи кислотами, включаючи органічні та неорганічні кислоти, неорганічні та органічні основи. Термін "лікування" стосується будь-якого лікування станів або хвороб ссавців, переважно людей, і включає: (1) профілактику настання хвороби або стану у суб'єкта, який має схильність до подібного захворювання, але воно ще не діагностовано, (2) інгібування хвороби або стану, тобто припинення її поширення, (3) вилікування хвороби або стану, коли її примушують відступити, (4) усунення симптомів хвороби. Термін "медична терапія" охоплює профілактичні, діагностичні або лікувальні процедури, що проводяться in vivo або ex vivo на людях та інших ссавцях. "Суб'єктом" у цьому описі є тварина, зокрема, ссавець, переважно людина, котра є об'єктом лікування, нагляду або експерименту. Скорочення APT 9-BBN ВОС n-BuLi CNS CUR DA DAT DCM DF DHBE DMAP DMC DME DMF DMG DMSO DOM EP EtOAc EtOH FAB FP g h HMDS HPLC випробування з приєднаним протоном 9-боробіцикло [3.3.1]нонан трет-бутоксікарбоніл п-бутиллітій центральна нервова система захисний газ допамін транспортер допаміну діхлорметан відхильна напруга дігідро--еритроїдин 4-діметиламінпіридин 2-хлор-1,3-діметилімідазолінійхлорид 1,2-діметоксіетан Ν,Ν'-діметилформамід скерована металююча група діметилсульфоксид скероване ортометилювання вхідний потенціал етилацетат етанол бомбардування швидкими атомами фокусуючий потенціал грам година гексаметилдісилазан високоточна рідинна хроматографія 97374 18 напруга іонного розпилення діізопропиламід літію метахлорпербензойна кислота метилйодид метанол міліграм хвилина мілілітр точка топлення або інтервал топлення мас-спектрометрія етоксид натрію метоксид натрію N-бромсукцинімід розпилювальний газ петролейний етер (40-60) позитронна емісійна томографія квадрупольний час польоту коефіцієнт утримання (тонкошарова Rf хроматографія) час утримання (рідинна хроматограRt фія/мас-спектрометрія) SEMCl 2-(триметилсиліл)етоксіметилхлорид однофотонна емісійна комп'ютерна тоSPECT мографія TBAF тетрабутиламонійфторид TEA триетиламін ТЕМ температура THF тетрагідрофуран TIPS триізопропилсиліл TIPSCl триізопропилхлорсилан TMEDA тетраметилетилендіамін TMSA етинілтриметилсилан бульбашковий моноамінний транспорVMAT2 тер-2 IS LDA mClPBA Mel MeOH мг хв мл m.p. MS NaOEt NaOMe NBS NEB PE PET QTOF Приклади Приклад 1: аналітичні методи 1 Спектри ядерного магнітного резонансу ( Н 13 ЯМР та С ЯМР , APT) визначають у зазначеному 1 розчиннику на приладі Bruker ARX 400 ( Η: 400 13 МГц, С: 100 МГц) при 300 K, якщо не вказано 19 13 інше. Експерименти з ЯМР F та С проводять на спектрометрі Varian Inova 500 при 11.74 Τ (499.9 1 13 МГц для Н; 125.7 МГц для С; 50.7 МГц, 470.4 19 МГц для F) з датчиком коротких хвиль 5 мм. Спектри визначають у дейтерованому хлороформі або діхлорметані фірми Cambridge Isotope Laboratories Ltd. Хімічні зсуви () показують у частинах на млн. 19 від тетраметилсилану (1Н, 13С) або CCl3F ( F). Сталі зв'язування J наведені у герцах (Гц). Піки ЯМР спектрів позначаються 'q' (квартет), 'dq' (подвійний квартет), 't' (триплет), 'dt' (подвійний триплет), 'd' (дублет), 'dd' (подвійний дублет), 's' (синглет), 'bs' (широкий синглет) та 'm' (мультиплет). Сигнали NH та ОН визначають після змішування проби з краплиною D2O. Випарювальна хроматографія стосується очистки із зазначеним елюентом та силікагелем (Acros: 0.030-0.075 мм або силікагель Merck 60: 0.040-0.063 мм). Колонкову хроматографію виконують з силікагелем 60 (0.063-0.200 mm, Merck). Точки топлення вимірюють на апараті Buchi B-545. Мас-спектри фіксують на приладі Micromass QTOF-2 instrument з прикладною програмою 19 97374 MassLynx для збирання та відновлення даних. Виконують точні вимірювання маси квазімолеку+ лярного іона [М+Н] . Точні вимірювання маси здійснюють на тандемному мас-спектрометрі JEOL JMS-SX/SX 102 А з використанням бомбардування швидкими атомами. При високоточній масспектрометрії з бомбардуванням швидкими атомами використовують розрізнювальну здатність 10,000 (западина 10%). Усі реакції з вологочутливими сполуками або у вологочутливих умовах виконують в атмосфері безводного азоту. Реакції контролюють за допомогою тонкошарової хроматографії (TLC) на вкритих силікагелем пластикових листах (покритий силікагель Merck 60 F254) з зазначеним елюентом. Плями проявляють ультрафіолетовим світлом (254 нм) або I2. Коефіцієнти затухання визначають спектрофотометром HP 8453 UV-Vis. Аналітичну високоточну рідинну хроматографію (HPLC) проводять на колонці С18 (Inertsil ODS-3, розмір часток 3 мм; 4.6мм 50 мм) з наступним градієнтом елюювання: лінійний градієнт від 5% до 95% водного CH3CN з вмістом 0.04% НСО2Н протягом 5 хв, потім 95% водний CH3CN з вмістом 0.04% НСО2Н протягом 2 хв при 2.0 мл хв 1 . Продукти виявляють при =254 нм. Рідинна хроматографія - мас-спектрометрія (LC-MS) Система LC-MS складається з двох мікронасосів Perkin Elmer серії 200. насоси з'єднані між собою трійниковим змішувачем на 50 мкл, приєднаним до автоматичного пробовідбирача Gilson 215. Методика є наступна: етап повний час витрата (мкл/хв) 0 0 2000 1 1.8 2000 2 2.5 2000 3 2.7 2000 4 3.0 2000 А(%) 95 0 0 95 95 В(%) 5 100 100 5 5 20 А=100% води з 0.025% НСООН та 10 ммолів NH4HCOO рН=+/-3 В=100% ACN з 0.025% НСООН Автоматичний пробовідбирач має впорскувач на 2 мкл. Він з'єднаний з колонкою Waters Atlantis C18 30*4.6 мм з розміром часток 3 мкм. Колонка термостатована у печі Perkin Elmer серії 200 при 40° С. Колонка з'єднана з вимірювачем ультрафіолетового випромінювання Perkin Elmer серії 200 з коміркою на 2.7 мкл. Довжина хвилі встановлюється 254 нм. Вимірювач з'єднаний з масспектрометром Sciex API 150EX. Параметри масспектрометра наступні: діапазон розгортки: 150900 одиниць маси; полярність: позитивна; режим розгортки: профільний; розрізнення Q1: одиниця; крок розгортки: 0.10 одиниць маси; повна розгортка: 0.500 с; NEB: 10; CUR: 10; IS: 5200; ТЕМ: 325; DF: 30; FP: 225 та ЕР: 10. Детектор розсіяння світла підключений до Sciex АРІ 150. Це Sedere Sedex 55, який працює при 50° С та 3 бар N2. Системою в цілому управляє блок G3. Приклад 2: загальні аспекти синтезу Сполуки загальної формули (І) одержують з легкодоступних вихідних матеріалів. Заміщені 1Нпірол-[2,3-b]піридини закуповують на ринку, або вони відомі у хімічній літературі (Synthesis, 1992; Heterocydes, 1999; US 2002/0061892; Current Organic Chemistry, 2001). В одному прикладі загальної методики (схема 1) 1Η-пірол-[2,3-b] піридин (7-азаіндол (1)) реагує з 1-бензил-піперидин-3-оном (2) у присутності основи з одержанням сполуки 3 піперидин-3-олу, а не бензильного аналога сполуки 5 (Bioorganic & Medicinal Chemistry Letters, 2002). Видалити бензильну групу можна відомими прийомами. Особливі умови - наявність форміату амонію та гідроксиду паладію в метанолі для одержання сполуки 4, яку збезводнюють (5) та відновлюють з одержанням цільового 3-піперидин-3-іл-1Н-пірол[2,3-b]піридину (6). Деякі окремі сполуки структури 7 можна одержати за методикою, наведеною на схемі 1, виходячи з (4, 5 або 6)-заміщеного 1Н-пірол-[2,3b]піридину. У прикладах R представляє нижчий алкіл, алкілоксі та фтор. 21 97374 22 Схема 1 Інший спосіб одержання сполук структури 7 наведений на схемі 2. Йдеться при синтез 6-хлор3-піперидин-3-іл-1Н-пірол-[2,3-b]піридину (13). Отже, сполука 6 реагує з ді-трет-бутил-дікарбонатом у дві стадії з утворенням сполуки 9. У книзі Greene (1999) докладніше описано додання і наступне зняття захисних груп в органічному синтезі. Селективне хлорування аналога 7-азаіндолу 9 у позиції 6 виконують реакцією типу РейсертаГенце (через N-оксид 10А) за відомою методикою (Synthesis, 1992). Отже, одержану у цій реакції сполуку 11 Ν1-метоксікарбонілу перетворюють за основних умов на сполуку 12. Після видалення N-tBoc групи одержують сполуку 13. Схема 2 За ще одним шляхом (схема 3) 7-азаіндол (1) реагує з 1-аза-біцикло[2,2,2]октан-3-оном (14), даючи збезводнений продукт 15, з якого віднов ленням одержують цільовий 3-(1Н-пірол [2,3b]піридин-3-іл)-1-аза-біцикло[2,2,2]октан (16). 23 97374 24 Схема 3 Утворення аніонів в орто-положенні ароматичних систем, яке має місце у методиках синтезу згідно з винаходом, є елементом відомої фахівцям стратегії синтезу - так званої скерованої ортометалізації (DOM). З цією метою випробувано чимало функціональних груп, відомих як групи скерованої металізації (DMG). 1-фенілсульфонільна група в якості DMG у положенні 1- аналогів азаіндолу забезпечує літіювання позиції 2, а відтак її Схема 4 2 функціоналізацію (Synthesis, 2005 ; Tetrahedron, 1997). 2-літійпохідне 17, одержане у кількості кількох грамів шляхом -металізації (1,1 еквів. LDA, THF, від -10°С до 0°С) уловлюють за допомогою 14 з одержанням сполуки 18, з якої знімають захисну групу, щоб отримати потрібну суміш спирту 19 та енаміну 20. Відновлення 20 дає 3-(1Н-пірол [2,3b]піридин-3-іл)-1-аза-біцикло[2,2,2]октан (21). 25 Вихідний матеріал 17 зі схеми 3 перетворюють на сполуку 22 (схема 4). Після основного гідролізу Ν1-фенілсульфонільної групи (23) переважно видаляють бензильну групу (24) з наступним зневоднюванням (25). Відновлення дає цільову сполуку 26 (2-піперидин-3-іл-1Н-пірол[2,3-b]піридин). Як і на схемі 2, відновлення 27 потужним відновником, наприклад, LiАІH4, є переважним шляхом одержання N-СН3 сполуки (28). Схема 5 97374 26 Більш того, згідно з послідовністю за схемою 2 вихідний матеріал 27 перетворюють на суміш 30 та 31, яка піддається розділенню (схема 4). Фахівцям зрозуміла неселективність цієї конкретної реакції типу Рейсерта-Генце (через N-оксид 29А). Основний гідроліз з наступним зняттям захисної групи N-t-Boc дає відповідні 6-(або 4)-хлор-2піперидин-3-іл-1Н-пірол[2,3-b]-піридини (32 та 33). 27 В іншому аспекті 5-(R)-[3,3,0]-1-аза-2-тіа-3оксабіциклооктан-2,2-діоксид (сполука 35, схема 5) або його 5-(S)-аналог (сполука 36, Tetrahedron Asymmetry, 1990) слугують вихідними матеріалами для одержання сполук за винаходом формули І. 2-літійпохідне 17 реагує з (R)-сульфамідатом 35 з одержанням літійсульфонату 37, який піддають гідролізу для одержання 38А. Видалення Ν1фенілсульфонільної групи можна здійснювати відомими прийомами, наприклад, за бажанням, реакцією сполуки 38А з гідроксидом калію у діе 97374 28 тиленгліколі у присутності гідразину з одержанням (R)-2-піролідин-2-ілметил-1-Н-пірол[2,3b]піридину (39А). (S)-похідне 39В одержують, починаючи з (S)-сульфамідату 36. Існують різні методи відновлювального алкілювання 39А до сполуки 41А (схема 5). Поряд з перетворенням 26 на 28 (схема 4) , відновлювальне метилування 38А з наступним видаленням Ν 1фенілсульфонільної групи із сполуки 40А дає цільовий (R)-2-(1-метилпіролідин-2-ілметил)-1-Нпірол[2,3-b]піридин (41А). Схема 6 Схема 6 демонструє одержання сполук формули І, де R5 та R6 представляють галоген, (С13)алкіл або алкілоксі. За вищенаведеною процедурою (з хіральними сульфамідатами 35 та 36) 42 та 43 (Synthesis, 1992), 44 (схема 7), 50 (Heterocycles, 1999) та 51 (Current Organic Chemistry, 2001) перетворюють на відповідні сполуки 5А/В, 46А/В, 47А/В, 52А/В та 53А/В. Як приклад функціоналізації 7-азаіндольної системи у позиції 6 наводиться каталізоване Cu(І)бромидом перетворення 48 (з наступним зняттям t-Boc захисної групи)для одержання (R)-6-метоксі-2піролідин-2-ілметил)-1-Н-пірол[2,3-b]піридину (49). Треба підкреслити, що про синтез 6-фтор-7азаіндолу (44) досі не повідомлялося. Отже, цей винахід пропонує спосіб одержання сполуки 44, хоча він оснований на відомих стратегіях синтезу, як показано на схемі 7. 29 97374 30 Схема 7 Доступний на ринку 2,6-діфторпіридин (54) перетворюють на 2-амін-6-фторпіридин (55, Tetrahedron, 2002). Випробувані різні DMG групи (наприклад, 2,2-діметилпропанамід {Heterocydes, 1999; WO 2003/053970). Втім, встановлено, що карбамат у ролі DMG (Chem. Pharm. Bull, 1987) відіграє важливу роль при селективному йодуванні сполуки 56 для одержання сполуки 57 етилефіру (6-фтор-3-йодпіридин-2-іл)Схема 8 карбамінової кислоти. Після того реакцією Соногасіра з наступним закриттям кільця у присутності 1 Cu(І)йодиду (Synthesis, 2005 ) одержують сполуку 59. Відщеплення Ν1-карбамату дає 6-фтор-1Нпірол[2,3-b]піридин (44). Синтез сполук 47А/В показаний на схемі 6 згідно з послідовністю, зображеною на схемі 5. Також сполуки за винаходом формули І представлені на схемі 8. 31 М'якість та селективність 9-BBN демонструє його здатність селективно відновлювати лактамну частину у промислово виробленому третинному лактамі 61 (Tetrahedron Letters, 1999) до циклічного аміну 62, який перетворюють на амід Вайнреба 63 (Tetrahedron Letters, 1997). 2літійпохідне 17 за схемою 5 реагує з амідом Вайнреба 63, даючи сполуку 64. У загальному способі ведення реакції між 2-літійпохідним 17 та відповідною електрофільною сполукою (див. попередні схеми), оптимальні умови мають місце 97374 32 при температурах від біля -50°С до -10°С, переважно від -30°С до -20°С, протягом біля 2 годин. Сполуку 64 піддають відновленню ХуангаМінлона з супутнім відщепленням Ν 1фенілсульфонільної групи, одержуючи сполуку 65. Далі можна здійснити відновлювальне відщеплення бензильної групи в умовах, наведених вище (схема 4), з одержанням 2-піролідин-3ілметил-1Н-пірол[2,3-b]піридину (66). Перетворенням 66 на 67 згідно із схемою 4 з наступним відновленням одержують сполуку 68. Схема 9 В іншому прикладі загального шляху (схема 9) 2-літійпохідне 17 (або 70) реагує з Се(III)хлоридом (J. Med. Chem., 2002) і надалі уловлюється трет-бутилефіром 3-оксо-піролідин1-карбонової кислоти (71) з одержанням відповідних третинних спиртів (72, 73). Як і на схемі 5, Ν1-відщеплення фенілсульфонільної групи дає сполуки 74, 75. У кислому середовищі (переваж но 6Μ НCl) каталітичне зняття N-t-Boc захисної групи з наступним зневоднюванням дає сполуки 76, 77, які відновлюють до цільових 2-піролідин-3ілметил-1Н-пірол[2,3-b]піридину (78) та 2піролідин-3-іл-1Н-пірол[2,3-b]піридину (79). Ізомери можна розділяти у хіральній колонці. Щодо приготування 83 див. (схема 10, European Journal of Medicinal Chemistry, 2004). 33 97374 34 Схема 10 2-літійпохідне 70 та/або 83 (переважно у присутності t-BuLi/TMEDA у THF) реагує з 35 та/або 36 з одержанням відповідних 80А/В та 84. Перетворити 80А/В та 84 на 81А/В та 85 можна згідно із схемою 5. Бромувати положення 3 у різних ізомерних азаіндолах можна відомими способами (Heterocycles, 1999, 2000; Tetrahedron Letters, 1969; WO2004/078757). Нами несподівано встановлено, що переважною умовою є розчинник NBS/DMF, у якому бромування 69 до 86 відбувається із майже повною конверсією. Правильний вибір захисної групи, зокрема, триізопропилсилільної групи, дозволяє заміну 3-бром на 3 літійпохідне 87, яке наділі уловлюють (R)сульфамідатом (сполука 35). Кислотне зняття TIPS з наступним гідролізом сульфонатної групи (за схемою 5) дає цільовий (R)-3-піролідин-2ілметил-1Н-пірол[2,3-b]піридин (88). Також сполуки за винаходом формули І ілюструються на схемі 11. Доступний на ринку 4-хлор-7Н-пірол[2,3d]піримідин (89) відновлюють до і 7Н-пірол[2,3d]піримидину (90). 2(триметилсиліл)етоксіметильна група в якості DMG у положенні 1 похідних індолу дає змогу літіювати положення 2 (Helvetica Chimica Acta, 1993). Схема 11 Згідно з цією відомою методикою 2літійпохідне 91 уловлюють (наприклад) сполукою 35. Щоб уникнути турбот з застосуванням алкіллітію або діалкіламідів літію, обрано тетраметил піперидин літію (92). Отже, 2-літійпохідне 91 реагує з (R)-сульфамідатом (35) з одержанням сполуки 93, з якої потім знімають захисну групу SEM (94). 35 Гідроліз сульфонатної групи за стандартних умов, як описано вище, дає цільовий (R)-6піролідин-2-ілметил-1Н-пірол[2,3-b]піридин (95). Фармацевтично прийнятні солі одержують відомими способами, наприклад, змішуванням сполук за винаходом з відповідною кислотою, наприклад, органічною або неорганічною. Приклад 3: синтез окремих сполук Окремі сполуки, синтез яких описується далі, лише докладніше ілюструють винахід і ніяким чином не обмежують його обсяг. Фахівцям будуть очевидні інші варіанти здійснення винаходу при вивченні опису та практики здійснення винаходу, як вони описані тут. Отже, опис можна вважати лише прикладами здійснення винаходу. 1-бензил-3-(1Н-пірол[2,3-b]піридин-3-іл)піперидин-3-ол. (сполука 3) 60% дисперсію NaH у мінеральному маслі (9.5 г, 179 ммолів) повільно додають до 150 мл EtOH (0°С). Цей розчин додають до 7-азаіндолу (5.3 г, 44.9 ммоля) та 11.25 г (44.9 ммоля) 1бензил-піперидин-3-ону (у вигляді солі НCl). Одержану суміш перемішують 72 години при кімнатній температурі. Етилацетат додають до суміші, органічну фазу промивають тричі насиченим розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують. Одержаний осад очищують випарювальною хроматографією (градієнт діетилетер/етилацетат (1:1 відносно чистого етилацетату)), одержуючи сполуку 3 у вигляді олії (10.3 g, 1 74.7%). Η-ЯΜΡ (400 МГц, CDCl3): 10.0 (bs, 1H), 8.27 (dd, J=5 Гц, 2 Гц, 1Н), 8.14 (dd, J=8 Гц, 2 Гц, 1Н), 7.35-7.24 (m, 6H), 7.03 (dd, J=5 Гц, 8 Гц, 1Н), 3.96-3.88 (bs, 1H), 3.60 (dd, Jgem=13 Гц, 2H), 3.073.01 (m, 1H), 2.95-2.89 (m, 1H), 2.39 (d, J=10 Гц, 1H), 2.16-1.96 (m,2H), 1.92-1.78 (m, 2H), 1.72-1.65 (m, 1H). (TLC EtOAc Rf 0.09). 3-(1Н-пірол[2,3-b]піридин-3-іл)-піперидин-3ол. (сполука 4) Сполуку 3 (2.4 г, 7.8 ммолів), 1.5 г форміату амонію (23.8 ммоля) та 20% Pd(OH)2/C (240 мг) з'єднують у МеОН (50 мл) та нагрівають до температури флегми 2 години. Суміш охолоджують, фільтрують, концентрують та наново розчиняють у МеОН. Фільтрація крізь 25 г SCX-2 (МеОН, потім 1N NH3/MeOH) дає зазначену сполуку (1.5 г, 1 6.9 ммолів, 88%) у вигляді аморфної маси. НЯМР (400 МГц, D6DMSO): 11.3 (bs, 1Н), 8.178.13 (m, 2H), 7.24 (s, 1H), 7.0-6.95 (m, 1H), 3.02.89 (m, 2H), 2.85 (d, J=13 Гц, 1H), 2.6-2.51 (m, 1H), 2.06-1.8 (m, 3H), 1.5-1.42 (m, 1H). (TLC МеОН/триетиламін (97/3 Rf 0.16). 3-(1,2,5,6-тетрагідропіридин-3-іл)-1Нпірол[2,3-b]піридин. (сполука 5) 10 мл ацетилхлориду повільно додають до 200 мл EtOН (-10°С). Через 15 хвилин цей розчин додають до сполуки 4 (5 г, 16.3 ммолів) та нагрівають із зворотним холодильником 1 годину. Суміш охолоджують, концентрують та наново розчиняють у МеОН. Фільтрація крізь 25 г SCX-2 (МеОН, потім 1N NH3/MeOH) дає зазначену сполуку (1.43 g, 7.18 ммолів, 44.1%) у вигляді амор1 фної маси. Н-ЯМР (400 МГц, CDCl3): 11.4-10.8 (bs, 1H), 8.32 (dd, J=5 Гц, 2 Гц, 1H), 8.2 (dd, J=8 Гц, 2 Гц, 1Н), 7.15 (dd, J=8 Гц, J=5 Гц, 1H), 6.32 97374 36 6.27 (m, 1H), 3.76-3.72 (m, 2H), 3.10-3.04 (m, 2H), 2.36-2.29 (m, 2H). (TLC МеОН/триетиламін (97/3 Rf 0.25). 3-піперидин-3-іл-1Н-пірол[2,3-b]піридин. (сполука 6) 10 мл ацетилхлориду повільно додають до 200 мл МеОН (-10°С). Через 15 хвилин цей розчин додають до сполуки 5 (1.43 г, 7.18 ммолів) та 20% Pd(OH)2/C (130 мг). Суміш гідрогенують при 50 фунтах/кв.дюйм (345 кПа) 1 годину. Суміш фільтрують та концентрують. Далі фільтрацією крізь SCX-2 з наступною випарювальною хроматографією (МеОН/триетиламін (97/3) одержують сполуку 6 (0.81 г, 4.02 ммоля, 55%) яка реагує з 1 еквівалентом фумарової кислоти в EtOH, та концентрують. Перекристалізацією з EtOН/етилацетату одержують тверду масу (вільна основа/фумарова кислота (2:1)), точка топ1 лення >225°С (розклад). Η-ЯΜΡ (400 МГц, D2O): 8.04 (bd, J=5 Гц, 1Н), 7.93 (bd, J=8 Гц, 1H), 7.13 (bs, 1H), 7.01 (dd, J=8 Гц, 5 Гц, 1H), 6.36 (s, 1H), 3.46-3.40 (m, 1H), 3.37-3.31 (m, 1H), 3.14-3.04 (m, 1H), 2.92-2.82 (m, 2H), 2.0-1.87 (m, 2H), 1.8-1.54 (m, 2H). Трет-бутилефір 3-(1Н-пірол[2,3-b]піридин-3іл)-піперидин-1-карбонової кислоти, (сполука 9) Сполуку 6 (0.3 г, 1.5 ммоля), 1.0 г ді-третбутилдікарбонату (4.58 ммоля) та 0.5 мл триетиламіну з'єднують у діхлорметані (20 мл) та нагрівають до температури флегми 15 хвилин. Суміш охолоджують та концентрують у вакуумі. Одержаний осад витримують у етилацетаті, промивають розсолом, сушать (Na2SO4), фільтрують та концентрують у вакуумі, одержуючи сполуку 8 у вигляді олії та осад, який без обробки використовують на наступній стадії (подальша очистка не 1 потрібна). Η-ЯΜΡ (400 МГц, CDCl3): 8.5 (dd, J=5 Гц, 2 Гц, 1H), 7.98-7.91 (bd, J=8 Гц, 1H), 7.39 (s, 1H), 7.18 (dd, J=8 Гц, 5 Гц, 1Н), 4.48-4.04 (m, 2H), 2.97-2.75 (m, 3H), 2.2-2.14 (m, 1H), 1.84-1.63 (m, 3H), 1.67 (s, 9H), 1.49 (s, 9H). (TLC діетилетер Rf 0.39). Цей матеріал (8) розчиняють у 10 мл МеОН та 3 мл 2N NaOH. Реакційну суміш перемішують 0.5 година при кімнатній температурі. Етилацетат Додають до суміші етилацетат, органічну фазу промивають тричі 2N NaOH, сушать (Na2SO4), фільтрують та концентрують. Одержаний осад очищують випарювальною хроматографією (діетилетер), одержуючи сполуку 9 у вигляді олії 1 (0.25 г, 0.83 ммоля, 55% (загальний вихід)). ΗЯΜΡ (400 МГц, CDCl3): 9.8 (bs, 1Н), 8.3 (bd, J=5 Гц, 1Н), 8.04-7.98 (bd, J=8 Гц, 1H), 7.13 (bs, 1H), 7.07 (dd, J=8 Гц, 5 Гц, 1H), 4.45-4.02 (m, 2H), 3.042.76 (m, 3H), 2.2-2.14 (m, 1H), 1.83-1.60 (m, 3H), 1.49 (s, 9H). (TLC діетилетер Rf 0.13). Трет-бутилефір 3-(7-оксі-1Н-пірол[2,3b]піридин-3-іл)-піперидин-1-карбонової кислоти, (сполука 10А) Сполуку 9 (0.23 г, 0.76 ммоля) та 0.23 г метахлорпербензойної кислоти (1.4 екв., 1.07 ммоля) з'єднують у діметоксіетані (10 мл) та перемішують 10 хвилин при кімнатній температурі. Суміш концентрують на SiO2 та очищують випарювальною хроматографією (етилацетат, потім етилацетат/МеОН/триетиламін (90/10/1), одержуючи спо 37 луку 10А (аморфна маса, 0.23 г, 0.72 ммоля, 1 95%). Н-ЯМР (400 МГц, CDCl3): 8.2 (bd, J=5 Гц, 1Н), 7.8-7.5 (bs, 1H), 7.22 (s, 1H), 7.04 (dd, J=8 Гц, 5 Гц, 1Н), 4.44-4.02 (m, 2H), 2.99-2.78 (m, 3H), 2.22.12 (m, 1H), 1.81-1.60 (m, 3H), 1.48 (s, 9H). 3-піперидин-3-іл-1Н-пірол[2,3-b]піридин-7оксид. (сполука 10В) 0.4 мл ацетилхлориду повільно додають до 10 мл EtOН (-10°С). Через 15 хвилин цей НCl/EtOН розчин додають до сполуки 10А (0.27 г, 0.85 ммоля) та нагрівають із зворотним холодильником 1 годину. Суміш охолоджують і частково концентрують, додають етилацетат, одержаний осад відокремлюють фільтрацією та промивають діізопропилетером. Зазначену сполуку (10В, у вигляді солі НCl) одержують у вигляді твердої маси (220 мг, 100%). точка топлення >145°С (роз1 клад). Н-ЯМР (400 МГц, D2O): N1-Η не проглядається, 8.21-8.18 (m, 1Н), 8.15-8.12 (m, 1H), 7.40 (bs, 1H), 7.25-7.0 (m, 1Н), 3.56-3.49 (m, 1H), 3.413.34 (m, 1H), 3.31-3.22 (m, 1H), 3.04-2.90 (m, 2H), 2.14-2.06 (m, 1H), 2.05-1.94 (m, 1H), 1.86-1.66 (m, 2H). 6-хлор-3-піперидин-3-іл-1Н-пірол[2,3b]піридин. (сполука 13) Сполуку 10А (0.22 г, 0.69 ммоля) та 0.15 мл 1,1,1,3,3,3-гексаметилдісилазану (0.72 ммоля) з'єднують у 10 мл THF. До цього розчину додають 0.14 мл (1.8 ммоля) метилхлорформіату й реакційну суміш перемішують 30 хвилин при кімнатній температурі. Реакційну суміш концентрують у вакуумі. Одержаний осад витримують у етилацетаті, промивають 5% розчином NaHCO3 і потім розсолом, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Очисткою випарювальною хроматографією (діетилетер/РА:1/1) одержують 1 сполуку 11 у вигляді олії (0.16 г, 58.6%). Н-ЯМР (400 МГц, CDCl3) 7.95-7.84 (bd, J=8 Гц, 1H), 7.53 (s, 1H), 7.24 (d, J=8, 1H), 4.42-4.20 (m, 1H), 4.104.01 (m, 1H), 4.09 (s, 3H), 3.14-2.84 (m, 2H), 2.842.68 (m, 1H), 2.19-2.11 (m, 1Н), 1.82-1.60 (m, 3H), 1.49 (s, 9H). (TLC діетилетер/РЕ (1/1) Rf 0.19). Сполуку 11 (0.16 г) розчиняють у 25 мл МеОН з вмістом 3 мл 2N NaOH та перемішують 18 годин при кімнатній температурі. Реакційну суміш концентрують у вакуумі. Одержаний осад витримують у діхлорметані, промивають 5% розчином NaHCO3 і потім розсолом, сушать (Na2SO4), фільтрують та концентрують у вакуумі, одержуючи 1 сполуку 12 (0.13 г, 95%). Н-ЯМР (400 МГц, CDCl3) 7.99-7.91 (bd, J=8 Гц, 1Н), 7.12-7.07 (m, 2H), 4.42-4.20 (m, 1Н), 4.16-4.02 (m, 1H), 3.02-2.75 (m, 3H), 2.20-2.12 (m, 1H), 1.82-1.60 (m, 3H), 1.49 (s, 9H). (TLC діетилетер/РЕ (1/1) Rf 0.17). 0.2 мл ацетилхлориду повільно додають до 10 мл EtOH (-10°C). Через 15 хвилин цей розчин додають до сполуки 12 (0.13 г, 0.39 ммоля) та нагрівають із зворотним холодильником 1.5 години. Суміш охолоджують та частково концентрують, додають етилацетат, одержаний осад відокремлюють фільтрацією та промивають діізопропилетером. Зазначену сполуку, 6-хлор-3-піперидин-3-іл1Н-пірол[2,3-b]піридин 13 (у вигляді солі НCl) 97374 38 одержують у вигляді твердої маси (80 мг, 76%). 1 точка топлення >279°С (розклад). Η-ЯΜΡ (400 МГц, D2O): 7.60 (d, J=8 Гц, 1H), 7.14 (s, 1H), 6.99 (d, J=8 Гц, 1Н), 3.52-3.44 (m, 1H), 3.40-3.32 (m, 1H), 3.19-3.09 (m, 1H), 2.97-2.87 (m, 2H), 2.08-1.91 (m, 2H), 1.84-1.60 (m, 2H). 3-(1Н-пірол[2,3-b]піридин-3-іл)-1-азабіцикло[2.2.2]октан. (сполука 16) 60% дисперсію NaH у мінеральному маслі (4 г, 75 ммолів) повільно додають до 75 мл EtOH (0°С). Цей розчин додають до 7-азаіндолу (2 г, 16.9 ммолів) та 3.4 г (21 ммоль) 1-азабіцикло[2.2.2]октан-3-ону (14) (у вигляді солі НCl). Одержану суміш перемішують 24 години при 60°С. Розчину дають досягти кімнатної температури. До реакційної суміші додають 0.5 мл Н2О та 25 г SiO2, після чого концентрують у вакуумі. Одержаний осад очищують випарювальною хроматографією (діхлорметан/МеОН/7N NН3/МеОН (від 960/35/5 до 910/100/10)), одержуючи сполуку 15 у вигляді твердої маси (2.5 г, 69%). точка топ1 лення 180°С. Н-ЯМР (400 МГц, D6DMSO): 11.8 (bs, 1Н), 8.24 (dd, J=5 Гц, 2 Гц, 1H), 8.12 (dd, J=8 Гц, 2 Гц, 1Н), 7.61 (s, 1Н), 7.08 (dd, J=5 Гц, 8 Гц, 1Н), 6.87 (d, J=2 Гц, 1H), 3.14-3.09 (m, 1H), 3.012.91 (m, 2H), 2.64-2.54 (m, 2H), 1.78-1.69 (m,2H), 1.59-1.49 (m, 2H). Сполуку 15 (1.9 г, 7.11.95 ммолів) та 20% Pd(OH)2/C (190 мг) з'єднують у МеОН (100 мл). Суміш гідрогенують при 50 фунтах/кв.дюйм (345 кПа) 72 години. Суміш фільтрують та концентрують на 25 г SiO2. Одержаний осад очищують випарювальною хроматографією (діхлорметан/МеОН/7N NH3/MeOH (від 960/35/5 до 910/100/10)), одержуючи зазначену сполуку 16 у вигляді твердої маси (1.55 g, 57%). точка топлен1 ня 185°С. Η-ЯΜΡ (400 МГц, D6DMSO): 11.35 (bs, 1Н), 8.17 (dd, J=5 Гц, 2 Гц, 1Н), 7.85 (dd, J=8 Гц, 2 Гц, 1Н), 7.31 (d, J=2 Гц, 1H), 6.98 (dd, J=5 Гц, 8 Гц, 1H), 3.32-3.24 (m, 1H), 3.22-2.95 (m, 1H), 3.02.83 (m, 4H), 2.78-2.68 (m, 1H), 1.95-1.91 (m, 1H), 1.84-1.54 (m, 3H), 1.35-1.24 (m, 1H). 3-(1-бензолсульфоніл-1Н-пірол[2.3-b]піридин2-іл)-1-аза-біцикло[2.2.2]октан-3-ол. (сполука 18) LDA (2.0 Μ у THF/гептані) (5.5 мл, 11 ммолів) додають до 100 мл безводного THF а при -10°С в атмосфері Ν2. Розчин безводного THF (10 мл) з вмістом сполуки 17 (Tetrahedron, 1997) (2.58 г, 10 ммолів) додають по краплинах. Після додання одержаний розчин перемішують 30 хвилин при 10°С-0°С. Далі температуру знижують до -70°С. При цій температурі розчин 14 (1.25 г, 10 ммолів) у 10 мл THF додають по краплинах. Вільну основу солі НCl доступного на ринку 1-азабіцикло[2.2.2]октан-3-ону (14) одержують фільтрацією крізь SCX-2 (МеОН, потім 1N NН3/МеОН) з наступним випарюванням . Після додання 14, температуру підвищують до -30°С-25°С й одержаний розчин перемішують 60 хвилин. Розчину дають досягти кімнатної температури. До реакційної суміші додають 5 мл Н2О та 50 г SiO2, після чого концентрують у вакуумі. Одержаний осад очищують випарювальною хроматографією (дiхлорметан/МеОН/7N NН3/МеОН (960/35/5)) одержуючи сполуку 18 у вигляді олії (1.4 g, 37%). 39 Η-ЯΜΡ (200 МГц, CDCl3): 8.30 (dd, J=5 Гц, 2 Гц, 1Н), 8.15-8.05 (m, 2H), 7.75 (dd, J=8 Гц, 2 Гц, 1Н), 7.60-7.38 (m, 3H), 7.12 (dd, J=5 Гц, 8 Гц, 1Н), 6.71 (s, 1H), 5.10-4.85 (bs, 1H), 3.20-2.74 (m, 6H), 2.452.25 (m, 1H), 2.08-1.92 (m, 2H), 1.74-1.44 (m, 2H). (TLC діхлорметан/MeOH/7N NH3/MeOH (960/35/5)) Rf 0.33). 3-(1Н-пірол[2,3-b]піридин-2-іл)-1-азабіцикло[2.2.2]октан. (сполука 21) Сполуку 18 (2.4 г, 6.26 ммолів) та 31 мл 2N NaOH з'єднують в EtOH (310 мл) та нагрівають до температури флегми 2 години. Суміш охолоджують та концентрують. До осаду додають 50 г SiO2 та 100 мл МеОН. Цю суміш концентрують у вакуумі, після чого очищують випарювальною хроматографією (діхлорметан/МеОН/7N NH3/MeOH (960/35/5)) одержуючи сполуку 20 у вигляді олії 1 (0.54 г, 38.3%). Η-ЯΜΡ (200 МГц, CDCl3): 11.3 (bs, 1Н), 8.33 (dd, J=5 Гц, 2 Гц, 1Н), 7.87 (dd, J=8 Гц, 2 Гц, 1Н), 7.14-7.02 (m, 2H), 6.52 (bs, 1H), 3.252.65 (m, 5H), 1.95-1.40 (m, 4H) (TLC діхлорметан/МеОН/7N NH3/MeOH (960/35/5)) Rf 0.20). Другу сполуку при такій хроматографії (19) одержують у вигляді твердої маси (0.71 g, 46.6%). 1 Точка топлення 272°С. Η-ЯΜΡ (400 МГц, D6DMSO): 11.38 (s, 1H), 8.17 dd, J=5 Гц, 2 Гц, 1Н), 7.87 ((dd, J=8 Гц, 2 Гц, 1Н), 7.02 (dd, J=8 Гц, 5 Гц, 1Н), 6.43 (d, J=2 Гц, 1H), 5,32-5.28 (bs, 1H), 3.5-3.43 (m, 1H), 2.97-2.88 (m, 2H), 2.84-2.64 (m, 3H), 2.24-2.12 (m, 2H), 1.48-1.37 (m, 2H), 1.33-1.24 (m, 1H). (TLC діхлорметан/МеОН/7N NH3/MeOH (960/35/5)) Rf 0.09). Сполуку 20 (0.54 г, 2.4 ммоля), 0.76 г форміату амонію (12 ммолів) та 20% Pd(OH)2/C (54 мг) з'єднують у МеОН (50 мл) та нагрівають до температури флегми 2 години. Суміш охолоджують, фільтрують, концентрують та наново розчиняють у МеОН, після чого фільтрують крізь 5 г SCX-2 (МеОН, потім 1N NН3/МеОН). Очисткою випарювальною хроматографією (діхлорметан/МеОН/7N NH3/MeOH (960/35/5)) одержують сполуку 21 у вигляді твердої маси (0.25 g, 46%). Точка топлен1 ня 190°С. Η-ЯΜΡ (400 МГц, CDCl3): 11.65 (bs, 1Н), 8.21 (dd, J=5 Гц, 2 Гц, 1Н), 7.88 (dd, J=8 Гц, 2 Гц, 1Н), 7.06 (dd, J=8 Гц, 5 Гц, 1H), 6.34 (s, 1H), 3.46-3.37 (m, 1H), 3.29-3.20 (m, 2H), 3.03-2.93 (m, 3H), 2.91-2.80 (m, 1H), 2.27-2.21 (m, 1H), 1.90-1.78 (m, 2H), 1.70-1.60 (m, 1H), 1.43-1.33 (m, 1H). 1-бензил-3-(1Н-пірол[2,3-b]піридин-2-іл)піперидин-3-ол. (сполука 23) LDA (2.0 Μ у THF/гептані) (28 мл, 56 ммолів) додають до 200 мл безводного THF при -10°С в атмосфері N2. Розчин безводного THF (20 мл) з вмістом сполуки 17 (14.54 г, 56 ммолів) додають по краплинах. Після додання одержаний розчин перемішують 30 хвилин при -10°С-0°С. Далі температуру знижують до -70°С. При цій температурі, розчин 2 (11.5 г, 60.8 ммолів) у 25 мл THF додають по краплинах (10 хвилин). Вільну основу солі НCl доступного на ринку 1-бензил-піперидин3-ону (2) одержують фільтрацією крізь SCX-2 (МеОН, потім 1N NH3/MeOH) з наступним випарюванням . Після додання 2 температуру підвищують до -35°С-30°С й одержаний розчин перемішують 2 години. Суміші дають нагрітися до 1 97374 40 кімнатної температури й виливають до розчину NH4CI (10 г/50 мл НгО). Додають етилацетат, органічну фазу промивають 5% розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Одержаний осад очищують випарювальною хроматографією (діетилетер/РА, градієнт 1:2 відносно чистого діетилетеру), одер1 жуючи сполуку 22 у вигляді олії (5.8 g, 23%). ΗЯΜΡ (400 МГц, CDCl3): 8.31 (dd, J=5 Гц, 2 Гц, 1Н), 8.10-8.05 (m, 2H), 7.55 (dd, J=8 Гц, 2 Гц, 1Н), 7.51-7.45 (m, 1H), 7.41-7.24 (m, 7H), 7.09 (dd, J=5 Гц, 8 Гц, 1Н), 6.80 (s, 1H), 4.97-4.86 (bs, 1H), 3.69 та 3.59 (2xd, Jgem=13 Гц, 2H), 3.12-2.87 (m, 2H), 2.58-2.38 (m, 2H), 2.14-2.04 (m, 1H), 1.96-1.83 (m, 1H), 1.68-1.44 (m, 2H). (TLC діетилетер Rf 0.2). Сполуку 22 (1.49 г, 3.3 ммоля) та 3.1 мл 2N NaOH з'єднують у МеОН (31 мл) й нагрівають до температури флегми 2 години. Суміш охолоджують та концентрують. Додають етилацетат, органічну фазу промивають 5% розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Одержаний осад очищують випарювальною хроматографією (етилацетат), одержуючи зазначену сполуку (23) у вигляді твердої маси. Перекристалізують з етилацетату/діізопропилетеру. Вихід 0.68 г, 66.5%. точка 1 топлення 122-126°С. Η-ЯΜΡ (400 МГц, CDCl3): 10.9 (bs, 1Н), 8.26 (dd, J=5 Гц, 2 Гц, 1Н), 7.84 (dd, J=8 Гц, 2 Гц, 1Н), 7.34-7.22 (m, 5H) 7.02 (dd, J=5 Гц, 8 Гц, 1Н), 6.28 (d, J=2 Гц, 1Н), 3.98-3.86 (bs, 1H),3.59 (dd, Jgem=13 Гц, 2H), 2.93-2.83 (m, 2H), 2.45-2.39 (m, 1Н), 2.25-1.95 (m, 1H), 2.04-1.80 (m, 3H), 1.75-1.66 (m, 1H) (TLC діетилетер Rf 0.2). 3-(1Н-пірол[2,3-b]піридин-2-іл)-піперидин-3ол. (сполука 24) Сполуку 23 (3.07 г, 10 ммолів), 3.5 г форміату амонію (58.3 ммолів) та 20% Pd(OH)2/C (340 мг) з'єднують у МеОН (100 мл) та нагрівають до температури флегми 1 годину. Суміш охолоджують, фільтрують, концентрують та наново розчиняють у МеОН. Фільтрацією крізь 40 г SCX-2 (МеОН, потім 1N NН3/МеОН) з наступною очисткою випарювальною хроматографією (МеОН/триетиламін (90/3) одержують зазначену сполуку 24 (аморфна 1 маса,1.73 г, 80%). Η-ЯΜΡ (400 МГц, D6DMSO): 11.4 (bs, 1Н), 8.15 (dd, J=5 Гц, 2 Гц, 1Н), 7.84 (dd, J=8 Гц, 2 Гц, 1H), 7.01 (dd, J=8 Гц, J=5 Гц, 1H), 6.32 (bs, 1H), 5.24-5.0 (bs, 1H), 2.99-2.85 (m, 3H), 2.63-2.56 (m, 1Н), 2.12-2.02 (m, 1H), 1.97-1.75 (m, 2H), 1.51-1.42 (m, 1H). (TLC МеОН/триетиламін (97/3 Rf 0.26). 2-піперидин-3-іл-1Н-пірол[2,3-b]піридин (сполука 26) Сполуку 24 (1.73 г, 7.97 ммолів) розчиняють у 75 мл 6N НCl й нагрівають із зворотним холодильником 18 годин. Суміш охолоджують та концентрують. Кристалізацією з етилацетату/EtOН одержують сполуку 25 (1.99 г, 92% (у вигляді подвійної солі НCl)), точка топлення >275°С (розк1 лад). H-ЯМР (400 МГц, D6DMSO): 12.75 (bs, 1H), 8.33 (dd, J=5 Гц, 2 Гц, 1Н), 8.24 (dd, J=8 Гц, 2 Гц, 1Н), 7.30 (dd, J=8 Гц, J=5 Гц, 1Н), 6.89-6.85 (m, 1H), 6.42 (bs, 1Н), 4.10-4.04 (m, 2H), 3.34-3.27 (m, 2H), 2.65-2.58 (m, 2H). (TLC МеОН/триетиламін (97/3 Rf 0.25). 41 Сполуку 25 (1.71 г, 6.3 ммолів) та 20% Pd(OH)2/C (210 мг) з'єднують у 100 мл МеОН та гідрогенують при 50 фунтах/кв.дюйм (345 кПа) 1 годину. Суміш фільтрують та концентрують. Далі фільтрацією крізь 30 г SCX-2 (МеОН, потім 1N NH3/MeOH), одержують зазначену сполуку 26 (1.06 г, 84%) яка реагує з 1 еквівалентом фумарової кислоти в EtOH, та концентрують. Перекристалізацією з EtOН/етилацетату одержують тверду масу (вільна основа/фумарова кислота (1:1)), 1 точка топлення >211°С (розклад). Η-ЯΜΡ (400 МГц, D6DMSO): 12.75 (bs, 1Н), 8.33 (dd, J=5 Гц, 2 Гц, 1Н), 8.24 (dd, J=8 Гц, 2 Гц, 1Н), 7.30 (dd, J=8 Гц, J=5 Гц, 1H), 6.89-6.85 (m, 1H), 6.42 (bs, 1H), 4.10-4.04 (m, 2H), 3.34-3.27 (m, 2H), 2.65-2.58 (m, 2H). (TLC МеОН/триетиламін (97/3) Rf 0.14). Енантіочисті ізомери розділяють у хіральній колонці (Chiralpak AD 20мкм, 250X4.6, MeOH/EtOH 1/1, 2 мл/хв, =220 нм, Rt: 5.6 хв 25 (26А), ([]D +4 (с 1, толуол) та Rt: 8.3 хв (26В), 25 ([]D -4 (с 1, толуол). Трет-бутилефір2-(1Н-пірол[2,3-b]піридин-3іл)-піперидин-1-карбонової кислоти, (сполука 27) Сполуку 26 (8.3 г, 41.29 ммоля) перетворюють на зазначену сполуку (27) способом, описаним для сполуки 9. Вихід 10.9 г (36.21 ммолів, 87.7%). точка топлення 144-145°С. (TLC діетилетер Rf 0.20). 2-(1-метилпіперидин-3-іл)-1Н-пірол[2,3b]піридин. (сполука 28) Сполуку 27 (0.54 г, 1.8 ммоля) розчиняють у 5 мл безводного THF. Одержаний розчин повільно додають до перемішуваного розчину LiАІH4 (0.2 г, 5.2 ммолів) у 25 мл безводного THF (60°С в атмосфері N2). Після 1.5 годин перемішування суміш охолоджують. До одержаної суміш додають послідовно 0.2 мл Н2О, 0.4 мл 2Ν NaOH та 0.2 мл Н2О й нагрівають при 60°С в атмосфері N2. Суміш охолоджують, фільтрують та промивають МеОН, після чого фільтрують крізь 5 г SCX-2 (МеОН, потім 1N NН3/МеОН). Очисткою випарювальною хроматографією (МеОН/триетиламін (97/3)) одержують зазначену сполуку 28 у вигляді твердої маси (0.32 г, 83%), яка реагує з 1 еквівалентом фумарової кислоти в EtOH, та концентрують. Перекристалізацією з EtOН/етилацетату одержують тверду масу (0.47g, вільна основа/фумарова кислота 1 (1:1)), точка топлення >218°С (розклад). Н-ЯМР (400 МГц, D6DMSO): 11.58 (bs, 1H), 8.13 (dd, J=5 Гц, 2 Гц, 1Н), 7.83 (dd, J=8 Гц, 2 Гц, 1Н), 7.00 (dd, J=8 Гц, 5 Гц, 1H), 6.56 (s, 2H), 6.20 (bs, 1H), 3.363.30 (m, 1H), 3.18-3.04 (m, 2H), 2.56-2.50 (m, 1H), 2.47 (s, 3H), 2.41-2.32 (m, 1H), 2.11-2.03 (m, 1H), 1.86-1.67 (m, 2H), 1.58-1.45 (m, 1H). 2-піперидин-3-іл-1Н-пірол[2,3-b]піридин-7оксид (сполука 29В) Сполуку 27 (5.95 г, 19.7 ммолів) та 5 г метахлорбензойної кислоти (23.2 ммоля) з'єднують у діметоксіетані (60 мл) та перемішують 10 хвилин при кімнатній температурі. Реакційну суміш концентрують у вакуумі. Одержаний осад витримують у етилацетаті, промивають 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Суміш концентрують на SiO2 та очищують випа 97374 42 рювальною хроматографією (етилацетат/МеОН/триетиламін (90/10/1), одержуючи сполуку 29А (аморфна маса, 5.48 г, 87.5%). LCMS; + Rt: 1.50 хв, ([М+Н] =318), (TLC МеОН/етилацетат/триетиламін (10/90/1 Rf 0.46). Сполуку 29А (0.44 г, 1.38 ммоля) перетворюють на зазначену сполуку (29В) способом, описаним для сполуки 10В. Зазначену сполуку (29В у вигляді солі НCl) одержують у вигляді твердої маси (0.33 г, 95%). точка топлення >245°С (розк+ 1 лад). LCMS; Rt: 0.63 хв, ([М+Н] =218), Н-ЯМР (400 МГц, D2O): N1-H не проглядається, 8.208.16 (m, 1Н), 8.10-8.05 (m, 1H), 7.25-7.20 (m, 1Н), 6.53 (bs, 1H), 3.64-3.57 (m, 1H), 3.40-3.33 (m, 1H), 3.31-3.22 (m, 1H), 3.10 (bt, J=10 Гц, 1H), 2.99-2.90 (m, 1H), 2.19-2.12 (m, 1H), 2.01-1.94 (m, 1H), 1.851.66 (m, 2H). 6-хлор-2-піперидин-3-іл-1Н-пірол[2,3b]піридин (сполука 32) та 4-хлор-2-піперидин-3-іл1Н-пірол[2,3-b]піридин (сполука 33) Сполуку 29А (4.87 г, 15.36 ммолів) та 3.4 мл 1,1,1,3,3,3-гексаметилдісилазану (16.30 ммолів) з'єднують у 100 мл THF. До цього розчину додають 3.2 мл (41.4 ммоля) метилхлорформіату й реакційну суміш перемішують 1.5 годин із зворотним холодильником. Реакційну суміш охолоджують та концентрують у вакуумі. Одержаний осад витримують у етилацетаті, промивають 5% розчином NaHCO3, а потім розсолом, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Очисткою випарювальною хроматографією (діетилетер/РА:1/2, потім етер) одержують сполуку 30А (аморфна маса, 2.08 г, 34.4%). (TLC діетилетер/РЕ (1/1) Rf 0.17). Другу сполуку при такій хроматографії (31А) одержують у вигляді олії (2.7 г, 44.6%) (TLC діетилетер/РЕ (1/1) Rf 0.08). N1-карбаматну групу піддають основному відщепленню, як для сполуки 12А саме, сполуку 30А (2.08 г, 5.29 ммолів) розчиняють у 75 мл МеОН з вмістом 20 мл 2N NaOH та перемішують 18 годин при кімнатній температурі. Реакційну суміш концентрують у вакуумі. Одержаний осад витримують у діхлорметані, промивають 5% розчином NaHCO3, потім розсолом, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Очисткою випарювальною хроматографією (діетилетер/РЕ:1/1) одержують сполуку 30В (аморфна маса, 1.74 г, 98%). (TLC діетилетер/РЕ (1/1) Rf + 0.21). LCMS; Rt: 2.33 хв, ([М+Н] =336). Сполуку 31А (0.35 г, 0.89 ммолів) розчиняють у 8 мл МеОН з вмістом 2 мл 2N NaOH та перемішують 18 годин при кімнатній температурі. Реакційну суміш концентрують у вакуумі. Одержаний осад витримують у діхлорметані, промивають 5% розчином NaHCO3, потім розсолом, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Повторною очисткою випарювальною хроматографією (діетилетер/РЕ:1/1) одержують сполуку 31В (аморфна маса, 0.1 г, 33%). (TLC діетилетер + Rf 0.3). LCMS; Rt: 2.27 хв, ([М+Н] =336). 2 мл ацетилхлориду повільно додають до 40 мл EtOH (-10°C). Через 15 хвилин цей розчин додають до сполуки 30В (1.67 г, 5 ммолів) та нагрівають із зворотним холодильником 1.5 години. 43 Суміш охолоджують та частково концентрують, додають етилацетат, одержаний осад відокремлюють фільтрацією та промивають діізопропилетером. Зазначену сполуку, 6-хлор-2-піперидин-3-іл1Н-пірол[2,3-b]піридин 32 (у вигляді солі НCl) одержують у вигляді твердої маси (1.29 г, 100%). 1 точка топлення >290°С (розклад). Η-ЯΜΡ (400 МГц, D6DMSO): 12.0 (bs, 1Н), 7.93 (d, J=8 Гц, 1Н), 7.08 (d, J=8 Гц, 1Н), 6.31 (d, J=2 Гц, 1H), 3.583.49 (m, 1H), 3.34-3.24 (m, 2H), 3.15-3.02 (m, 1H), 2.92-2.79 (m, 1H), 2.18-2.10 (m, 1H), 1.94-1.80 (m, 2H), 1.78-1.64 (m, 1H). Енантіочисті ізомери розділяють у хіральній колонці (Chiralpak AD-Η 5мкм, 250x4.6, 100% EtOH+0.1% діетиламін, 0.5 мл/хв, =220 нм, Rt: 25 18.4 хв (32А), ([]D -10 (с 1,толуол) та Rt: 25.2 хв 25 (32В), ([]D +10 (с 1, толуол). Обидва ізомери реагують з 1 еквівалентом фумарової кислоти в EtOH та концентрують. Перекристалізацією з EtOH/етилацетату одержують тверду масу (вільна основа/фумарова кислота (1:1)), точка топлення >206°С (розклад). 0.22 мл ацетилхлориду повільно додають до 5 мл EtOH (-10°C). Через 15 хвилин цей розчин додають до сполуки 31В (0.1 г, 0.3 ммоля) та нагрівають із зворотним холодильником 1.5 години. Суміш охолоджують та частково концентрують, додають етилацетат, одержаний осад відокремлюють фільтрацією та промивають діізопропилетером, одержуючи сполуку 33: 4-хлор-2піперидин-3-іл-1Н-пірол[2,3-b]піридин (у вигляді солі НCl), (52 мг, 64%). точка топлення >250°С 1 (розклад). H-ЯМР (400 МГц, D2O): N1-H 8 не проглядається, 8.30 (bd, J=8 Гц, 1H), 7.39 (bd, J=8 Гц, 1H), 6.63 (bs, 1H), 3.66-3.58 (m, 1H), 3.42-3.23 (m, 2Н), 3.16-3.06 (m, 1H), 3.0-2.90 (m, 1H), 2.232.14 (m, 1H), 2.04-1.92 (m, 1H), 1.86-1.67 (m, 2H). (R)-2-піролідин-2-ілметил-1Н-пірол[2,3b]піридин. (сполука 39А) та (S)-2-піролідин-2ілметил-1Н-пірол[2,3-b]піридин. (сполука 39В) До розчину безводного THF (75 мл) з вмістом сполуки 17 (6.2 г, 24 ммоля) додають 12 мл (24 ммоля) LDA (2.0 Μ у THF/гептані) по краплинах при -10°С в атмосфері Ν2. Після додання одержаний розчин перемішують 30 хвилин при -10°С0°С. Далі температуру знижують до -70°С. При цій температурі, розчин 35 (4 г, 24.5 ммоля) у 25 мл THF додають по краплинах (10 хвилин). Після додання 35 температуру підвищують до -20°С й одержаний розчин перемішують 2 годин. Суміш дають нагрітися до кімнатної температури та перемішують ще 2 години. Реакційну суміш концентрують, осад розчиняють у 40 мл 1N HCl, 40 мл EtOH та 40 мл THF. Суміш перемішують при 80°С 18 годин. Реакційну суміш концентрують у вакуумі. Одержаний осад витримують у етилацетаті, промивають 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Очисткою випарювальною хроматографією (МеОН/триетиламін 97/3) одержують сполу1 ку 38А (аморфна маса, 3.63 g, 44%). Н-ЯМР (400 МГц, CDCl3): 8.35 (bd, J=5 Гц, 1Н), 8.09 (bd, J=8 Гц, 2Н), 7.67 (bd, J=8 Гц, 1Н), 7.57-7.41 (m, 3H), 7.12 (dd, J=8 Гц, 5 Гц, 1Н), 6.46 (s, 1H), 3.70-3.58 97374 44 (m, 1H), 3.39-3.31 (m, 1H), 3.23-3.15 (m, 1H), 3.133.03 (m, 1H), 2.98-2.86 (m, 1H), 2.10-1.70 (m, 3H), 1.57-1.44 (m, 1H). (TLC МеОН/триетиламін 97/3 Rf + 0.18). LCMS; Rt: 1.27 хв, ([М+Н] =342). Сполуку 38А (3.63 r, 10.6 ммолів), 11 г KOН та 22 мл моногідрату гідразину з'єднують у 2-(2гідроксіетоксі)-етанолі (100 мл) та перемішують 1 годину при 100°С. До охолодженої реакційної суміші додають етилацетат й одержану органічну фазу промивають 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Суміш розчиняють у МеОН та фільтрують крізь 40 г SCX-2 (МеОН, потім 1N NH3/MeOH). Наступною очисткою випарювальною хроматографією (МеОН/триетиламін (98/2) одержують зазначену спо+ луку 39А. LCMS; Rt: 0.91 хв, ([М+Н] =202). (амор25 фна маса, 1.42 г, 66%). ([]D -50 (с 1, толуол), яка реагує з 1 еквівалентом фумарової кислоти в EtOH та концентрують. Перекристалізацією з EtOH/етилацетату одержують тверду масу (вільна основа/фумарова кислота (1:1)), точка топ1 лення >163°С (розклад). Н-ЯМР (400 МГц, D6DMSO): 11.7 (bs, 1H), 8.13 (dd, J=5 Гц, 2 Гц, 1Н), 7.84 (dd, J=8 Гц, 2 Гц, 1H), 7.0 (dd, J=8 Гц, 5 Гц, 1H), 6.51 (s, 2H), 6.32 (s, 1H), 3.85-3.77 (m, 1H), 3.26-3.04 (m, 4H), 2.09-1.80 (m, 3H), 1.71-1.61 (m, 1Н). (S)-2-піролідин-2-ілметил-1Н-пірол[2,3b]піридин (сполуку 39В) одержують способом, наведеним для сполуки 39А, за допомогою суль25 фамідату 36. ([]D +50 (с 1, толуол). (R)-2-(1-метил-піролідин-2-ілметил)-1Нпірол[2,3-b]піридин. (сполука 41 А) та (S)-2-(1метил-піролідин-2-ілметил)-1Н-пірол[2,3b]піридин. (сполука 41В) Сполуку 38А (0.39 г, 1.14 ммоля), 0.5 г NaBH(OAc)3 та 0.2 мл формальдегіду (37%) з'єднують у діхлоретані (15 мл) та перемішують 1 годину при кімнатній температурі. Реакційну суміш концентрують у вакуумі. Одержаний осад витримують у етилацетаті, промивають 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі, одержуючи 40А (аморфна маса, 0.40 g, 1 98%). Η-ЯΜΡ (400 МГц, CDCl3): 8.35 (dd, J=5 Гц, 2 Гц, 1H), 8.12-8.07 (m, 2H), 7.69 (dd, J=8 Гц, 2 Гц, 1Н), 7.56-7.41 (m, 3Н), 7.12 (dd, J=8 Гц, 5 Гц, 1H), 6.40 (s, 1H), 3.73-3.67 (m, 1H), 3.16-3.10 (m, 1H), 2.87-2.73 (m, 2H), 2.47 (s, 3H), 2.33-2.25 (m, 1H), 1.95-1.50 (m, 4H). Сполуку 40А (0.4 г, 11.2 ммолів), 1.1 г KOН та 2.2 мл моногідрату гідразину з'єднують у 2-(2гідроксіетоксі)-етанолі (10 мл) та перемішують 1 годину при 100°С. До охолодженої реакційної суміші додають етилацетат й одержану органічну фазу промивають 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Суміш розчиняють у МеОН та фільтрують крізь 40 g SCX-2 (МеОН, потім 1N NH3/MeOH). Наступною очисткою випарювальною хроматографією (МеОН/триетиламін (99/1) одержують зазначену спо25 луку 41А (тверда маса, 0.19 g, 76%). ([]D +44 (с 1 1, толуол). Н-ЯМР (400 МГц, CDCl3): 10.4 (bs, 1Н), 8.18 (dd, J=5 Гц, 2 Гц, 1Н), 7.79 (dd, J=8 Гц, 2 Гц, 1Н), 6.99 (dd, J=8 Гц, 5 Гц, 1Н), 6.18 (bs, 1H), 3.18-3.07 (m, 2H), 2.90-2.83 (m, 1H), 2.61-2.53 (m, 45 1H), 2.45 (s, 3H), 2.25-2.17 (m, 1H), 1.89-1.79 (m, 1H), 1.69-1.43 (m, 3H). (S)-2-(1-метил-піролідин-2-ілметил)-1Нпірол[2,3-b]піридин. (сполуку 41В) одержують 25 способом, наведеним для сполуки 41А. ([]D -42 (с 1, толуол), точка топлення 130-131°С. (R)-6-хлор-2-піролідин-2-ілметил-1Н-пірол[23b]піридин. (сполука 45А) та (S)-6-хлор-2піролідин-2-ілметил-1Н-пірол[2,3-b]піридин. (сполука 45В) 6-хлор-7-азаіндол (9.3 г, 61.1 ммоля), одержаний за методикою (Synthesis, 1992), розчиняють у 100 мл безводного THF в атмосфері N2 при 0°С, й додають 60% дисперсію NaH 3.5 г (65.9 ммолів) у мінеральному маслі. Після перемішування 1 годину при кімнатній температурі суміш охолоджують (0°С) і додають 8.7 мл (67.2 ммолів) бензолсульфонілхлориду, розчиненого у 20 мл безводного THF. Реакційну суміш перемішують при кімнатній температурі 1 годину. Етилацетат додають до суміші, органічну фазу промивають тричі насиченим розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують. Одержаний осад очищують випарювальною хроматографією (діетилетер/РЕ градієнт (1:4 відносно чистого діетилетеру), одержуючи 1-бензолсульфоніл6-хлор-1Н-пірол[2,3-b]піридин (аморфна маса, 14.4 г, 80.7%) (TLC діетилетер/РЕ (1/1) Rf 0.37). + LCMS; Rt: 1.98 хв, ([М+Н] =293). До розчину безводного THF (100 мл) з вмістом сполуки 1-бензолсульфоніл-6-хлор-1Нпірол[2,3-b]піридину (2.52 г, 8.6 ммолів) додають 4.3 мл (24 ммоля) LDA (2.0 Μ у THF/гептані ) по краплинах при -78°С в атмосфері N2. Після додання одержаний розчин перемішують 60 хвилин при -78°С. При цій температурі, розчин 35 (1.4 г, 8.6 ммолів) у 10 мл THF додають по краплинах (5 хвилин). Після додання 35 температуру підвищують до -20°С й одержаний розчин перемішують 2 години. Суміші дають нагрітися до кімнатної температури та концентрують, а осад розчиняють у 40 мл 1N HCl, 40 мл EtOH та 40 мл THF. Суміш перемішують при 80°С 18 годин. Реакційну суміш концентрують у вакуумі. Одержаний осад витримують у етилацетаті, промивають 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Очисткою випарювальною хроматографією (МеОН/триетиламін 98/2) одержують (R)-1бензолсульфоніл-6-хлор-2-піролідин-2-ілметил1Н-пірол[2,3-b]піридин (аморфна маса, 1.01 г, 31%) (TLC МеОН/триетиламін 98/2 Rf 0.32). (R)-1-бeнзoлcyльфoнiл-6-xлop-2-пipoлiдин-2iлмeтил-1Н-пipoл[2,3-b]пipидин (1.01 г, 2.69 ммоля), 20 мл 2N NaOH та 30 мл ізопропанолу з'єднують та перемішують 3 години при 100°С. До охолодженої реакційної суміші додають етилацетат й одержану органічну фазу промивають 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Суміш розчиняють у МеОН та фільтрують крізь 10 g SCX-2 (МеОН, потім 1N ΝΗ3/ΜeΟΗ). Наступною очисткою випарювальною хроматографією (МеОН/триетиламін (98/2) одержують зазначену сполуку 45А (тверда маса, 25 1 366 мг, 58%). ([]D -48 (с 1, толуол). Н-ЯМР (400 МГц, CDCl3): 11.0-10.0 (bs, 1Н), 7.52 (d, J=8 97374 46 Гц, 1Н), 7.01 (d, J=8 Гц, 1H), 6.16 (s, 1H), 3.50-3.42 (m, 1H), 3.02-2.90 (m, 3H), 2.81-2.73 (m, 1H), 1.951.85 (m, 1H), 1.82-1.64 (m, 2H), 1.43-1.33 (m, 1H). Сполука 45А реагує з 1 еквівалентом фумарової кислоти у EtOH, й її концентрують. Перекристалізацією з EtOH/етилацетату одержують тверду масу (вільна основа/фумарова кислота (2:1)), точка топлення >222°С (розклад). (S)-6-хлор-2-піролідин-2-ілметил-1Нпірол[2,3-b]піридин (сполуку 45В) одержують (з 25 36) способом, наведеним для сполуки 45Α. ([]D +44 (с 1, толуол). Сполука 45В реагує з 1 еквівалентом фумарової кислоти у EtOH, й її концентрують. Перекристалізацією з EtOH/етилацетату одержують тверду масу (вільна основа/фумарова кислота (1:1)), точка топлення 189-190°С. (R)-6-бром-2-піролідин-2-ілметил-1Нпірол[2,3-b]піридин. (сполука 46А) та (S)-6-бром2-піролідин-2-ілметил-1Н-пірол[2,3-b]піридин. (сполука 46В) 6-бром-7-азаіндол (4.65 г, 23.6 ммоля), одержаний, як наведено у (Synthesis, 1992), перетворюють на 1-бензолсульфоніл-6-бром-1Нпірол[2,3-b]піридин вищеописаним способом (тверда маса, точка топлення 121-124°С). (7.57 г, 1 95%) Η-ЯΜΡ (400 МГц, CDCl3): 8.28-8.22 (m, 2H), 7.70-7.50 (m, 5H), 7.32 (d, J=8 Гц, 1Н), 6.56 (d, J=4 Гц, 1Н). (TLC діетилетер Rf 0.55). 1-бензолсульфоніл-6-бром-1Н-пірол[2,3b]піридин (2.07 г, 6.1 ммолів) перетворюють на (R)-1-бензолсульфоніл-6-бром-2-піролідин-2ілметил-1Н-пірол[2,3-b]піридин вищеописаним 1 способом (аморфна маса, 1.24 г, 48%). Η-ЯΜΡ (400 МГц, CDCl3): 8.21-7.97 (m, 2H), 7.61-7.47 (m, 5H), 7.25 (d, J=8 Гц, 1Н), 6.46 (s, 1Н), 3.65-3.57 (m, 1Н), 3.37-3.31 (m, 1H), 3.09-3.03 (m, 1H), 2.962.89 (m, 1H), 2.06-1.73 (m, 3H), 1.54-1.45 (m, 1H). (TLC МеОН/триетиламін 97/3 Rf 0.22). (R)-1-бензолсульфоніл-6-бром-2-піролідин-2ілметил-1Н-пірол[2,3-b]піридин (1.24 r, 2.95 ммоля), 30 мл 2N NaOH та 50 мл MeOH з'єднують та перемішують 30 хвилин годин при 60°С. До охолодженої реакційної суміші додають етилацетат й одержану органічну фазу промивають 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Суміш розчиняють у МеОН та фільтрують крізь 10 г SCX-2 (MeOH, потім 1N NH3/MeOH). Подальшою очисткою випарювальною хроматографією (МеОН/триетиламін (97/3) одержують зазначену сполуку 46А (аморфна ма25 са, 630 мг, 76%). ([]D -50 (с 1, толуол), яку перетворюють на її сіль (вільна основа/фумарова 1 кислота (1:1)), Η-ЯΜΡ (400 МГц, D6DMSO): N1H не проглядається, 7.82 (d, J=8 Гц, 1Н), 7.18 (d, J=8 Гц, 1Н), 6.49 (s, 2H), 6.38 (s, 1H), 3.82-3.72 (m, 1H), 3.27-3.05 (m, 4H), 2.09-1.80 (m, 3H), 1.70-1.60 (m, 1H). (S)-6-бром-2-піролідин-2-ілметил-1Нпірол[2,3-b]піридин (сполуку 46В) одержують (з 25 36) способом, наведеним для сполуки 46А. ([]D +50 (с 1, толуол). (R)-6-фтор-2-піролідин-2-ілметил-1Нпірол[2,3-b]піридин. (сполука 47А) та (S)-6-фтор2-піролідин-2-ілметил-1Н-пірол[2,3-b]піридин. (сполука 47В) 47 Сполуку 55 (18 г, 161 ммоль), 70 г K2СО3 (506 ммолів) та 15.4 мл (161 ммоль) етилхлорформіату з'єднують у CH3CN (400 мл) та перемішують 4 доби при 40°С. TLC показує неповну конверсію. Додають ще 15.4 мл етилхлорформіату та продовжують перемішування ще 2 доби. Суміш охолоджують. Етилацетат додають до суміші, а органічну фазу промивають насиченим розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують. Одержаний осад очищують випарювальною хроматографією (діетилетер/РЕ (1:3)) і одержують етилефір (6-фтор-піридин-2-іл)карбамінової кислоти (56) (аморфна маса, 19.68 1 г, 66.5%). Η-ЯΜΡ (400 МГц, CDCl3): 7.83 (dd, J=8 Гц, 2 Гц, 1H), 7.80-7.73 (m, 1Н), 7.50-7.40 (bs, 1H), 6.61-6.57 (m, 1H), 4.25 (q, J=8 Гц, 2Н), 1.32 (t, J=8 Гц, 3Н). (TLC діетилетер/РЕ 1/1 Rf 0.5). 28.6 мл (0.18 моля) TMEDA додають до розчину сполуки 56 (13.41 г, 72.9 ммоля) у 300 мл безводного THF. Суміш охолоджують до -78°С (в атмосфері N2). До перемішуваної реакційної суміші додають 76 мл (2.5Μ n-BuLi) й суміш перемішують 2 години при -78°С. Після додання I2 (48 г, 0.17 моля), суміш перемішують 1 годину при 78°С. Реакційну суміш охолоджують насиченим розчином Nа2S2О3 та дають нагрітися до кімнатної температури. Етилацетат додають до суміші, а органічну фазу промивають насиченим розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують. Одержаний осад очищують випарювальною хроматографією (діетилетер/РЕ (1/3) to 1/1) і одержують етилефір (6-фтор-3-йодпіридин-2-іл)-карбамінової кислоти (57) (аморфна 1 маса, 15.86 г, 70%). Η-ЯΜΡ (400 МГц, CDCl3): 8.07 (bt, J=8 Гц, 1Н), 7.24-7.14 (bs, 1H), 6.49 (dd, J=8 Гц, 3 Гц, 1Н), 4.29 (q, J=8 Гц, 2Н), 1.35 (t, J=8 Гц, 3Н). (TLC діетилетер/РЕ 1/1 Rf 0.27). Суміш сполуки 57 (4 г, 12.9 ммолів), 3.3 мл (23.4 ммоля) TMSA (етинілтриметилсилан), 246 мг (1.29 ммоля) Cu(I)-йодиду, 454 мг (0.65 ммоля), PdCl2(PPh3)2 (454 м г, 0.64 ммоля) та триетиламіну (6.3 мл) перемішують і дегазують (N2). Одержану реакційну суміш перемішують 10 годин при 100°С (у зачиненій ємності), охолоджують й виливають до етилацетату та Н2O. Органічну фазу промивають Н2О, сушать (Na2SO4), фільтрують та концентрують. Осад очищують випарювальною хроматографією (діетилетер/РЕ (1/3)) одержуючи етилефір (6-фтор-3триметилсиланілетинілпіридин-2-іл)-карбамінової 1 кислоти (олія, 1.5 г, 42%). Η-ЯΜΡ (200 МГц, CDCl3): 7.76 (bt, J=8 Гц, 1Н), 7.68-7.60 (bs, 1H), 6.56 (dd, J=8 Гц, 3 Гц, 1Н), 4.29 (q, J=8 Гц, 2H), 1.34 (t, J=8 Гц, 3H), 0.3 (s, 9H). (TLC діетилетер/РЕ 1/1 Rf 0.39). Суміш сполуки 58 (6 г, 21.4 ммоля) та 8.2 г (43 ммоля) Cu(І)йодиду розчиняють у 100 мл DMF та дегазують 0.5 години. Реакційну суміш перемішують при 150°С (підігріта олійна баня) 30 хвилин. Суміш охолоджують, розбавляють етилацетатом та фільтрують. Осад промивають Н2О, сушать (Na2SO4), фільтрують та концентрують. Після подальшої очистки випарювальною хроматографією (діетилетер/РЕ (1/1)) настає вихід сполуки 59 (аморфна маса, 2.58 г, 12.4 ммолів, 97374 48 57,9%), Н-ЯМР (200 МГц, CDCl3): 7.95 (bt, J=8 Гц, 1Н), 7.69 (d, J=4 Гц, 1Н), 6.87 (dd, J=8 Гц, 2 Гц, 1Н), 6.57 (d, J=4 Гц, 1Н), 4.55 (q, J=8 Гц, 2Н), 1.49 (t, J=8 Гц, 3Н). (TLC діетилетер/РЕ 1/1 Rf 0.42). Сполуку 59 (2.58 г, 12.4 ммолів) розчиняють у 50 мл МеОН та 20 мл 2N NaOH. Реакційну суміш перемішують 30 хвилин при кімнатній температурі. Етилацетат додають до суміші, органічну фазу промивають 5% водним розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують одержуючи 6-фтор-1Н-пірол[2,3-b]піридин (6-фтор-7азаіндол, сполука 44) у вигляді напівтвердої маси 1 (1.68 г, 12.3 ммолів, 99%). Η-ЯΜΡ (400 МГц, CDCl3): 9.6 (bs, 1Н), 7.95 (bt, J=8 Гц, 1H), 7.317.27 (m, 1H), 6.75 (dd, J=8 Гц, 2 Гц, 1Н), 6.55-6.50 (m, 1Н). (TLC діетилетер/РЕ (1/1) Rf 0.34). LCMS; + Rt: 1.39 хв, ([М+Н] =137). 6-фтор-7-азаіндол (сполука 44, 1.72 г, 12.6 ммолів) реагує з бензолсульфонілхлоридом, як описано для синтезу 45А/В, з одержанням 1бензолсульфоніл-6-фтор-1Н-пірол[2,3-b]піридину (сполука 60), (тверда маса, 3.03 г, 86.6%) точка топлення 130-132°С. (TLC діетилетер/РЕ (1/1) Rf + 0.29). LCMS; R,: 1.79 хв, ([М+Н] =277). 1-бензолсульфоніл-6-фтор-1Н-пірол[2,3b]піридин (0.8 г, 2.9 ммоля) перетворюють на (R)1-бензолсульфоніл-6-фтор-2-піролідин-2ілметил-1Н-пірол[2,3-b]піридин, як описано для 45А/В (аморфна маса, 0.31 г, 30%). (TLC МеОН/триетиламін (97/3) Rf 0.28). (R)-1-бензолсульфоніл-6-фтор-2-піролідин-2ілметил-1Н-пірол[2,3-b]піридин (0.26 г, 0.72 ммоля) перетворюють на (R)-6-фтор-2-піролідин-2ілметил-1Н-пірол[2,3-b]піридин (сполука 47А, 90 мг, 57%) за умов, наведених для 45А/В. Зазначену сполуку 47А (аморфна маса), 25 ([]D -38 (с 1, толуол), перетворюють на її (аморфну) сіль (вільна основа/фумарова кислота 1 (1:1)), Η-ЯΜΡ (400 МГц, D6DMSO): 12.2-11.7 (bs, 1H), 8.0 (bt, J=8 Гц, 1H), 6.76 (bd, J=8 Гц, 1H), 6.51 (s, 2H), 6.37 (s, 1H), 3.83-3.74 (m, 1H), 3.263.03 (m, 4H), 2.10-1.79 (m, 3H), 1.71-1.61 (m, 1H). (TLC МеОН/триетиламін (97/3) Rf 0.22). (S)-6-фтор-2-піролідин-2-ілметил-1Нпірол[2,3-b]піридин (сполуку 47В) одержують (з 36) за способом, наведеним для сполуки 47А. 25 ([]D +38 (с 1, толуол). (R)-6-метоксі-2-піролідин-2-ілметил-1Нпірол[2,3-b]піридин. (сполука 49) (R)-6-бром-2-піролідин-2-ілметил-1Нпірол[2,3-b]піридин (46А, 0.67 г, 2.39 ммоля) перетворюють на аналог піролідину (захищений Вос) 48 (аморфна маса, 0.72 г, загальний вихід 1 79%), за способом, наведеним для сполука 9. ΗЯΜΡ (400 МГц, CDCl3): 9.4 (bs, 1Н), 7.66 (bd, J=8 Гц, 1Н), 7.18 (bd, J=8 Гц, 1Н), 6.19 (bs, 1H), 4.104.03 (m, 1H), 3.42-3.25 (m, 2H), 3.16-3.07 (m, 1H), 3.04-2.88 (m, 1H), 2.0-1.89 (m, 1H), 1.8-1.63 (m, 3H). Сполуку 48 (0.34 г, 0.89 ммоля) розчиняють у 4 мл DMF та 2.5 мл МеОН (в атмосфері N2). До цієї суміші додають 1.6 г (29.6 ммолів) NaOMe та 0.25 g (1.74 ммоля) Cu(І)-бромиду, суміш перемішують 1 годину при кімнатній температурі. Етилацетат додають і органічну фазу промивають 1 49 5% розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Одержаний осад очищують випарювальною хроматографією (діетилетер) одержуючи піролідиновий (захищений Вос) прекурсор сполуки 49 у вигляді олії (0.32 1 г, 56%). (TLC діетилетер Rf 0.8). Η-ЯМР (400 МГц, CDCl3): 8.7 (bs, 1Н), 7.68 (bd, J=8 Гц, 1H), 6.52 (bd, J=8 Гц, 1H), 6.1 (bs, 1H), 4.11-4.01 (m, 1H), 3.94 (s, 3H), 3.46-3.23 (m, 2H), 3.18-2.96 (m, 1H), 2.93-2.78 (m, 1H), 1.97-1.84 (m, 1H), 1.83-1.71 (m, 3H), 1.51 (s, 9H), з якого знімають захист (НСІ/EtOH, як описано вище), одержуючи зазначену сполуку (49) у вигляді солі НCl (аморфна 25 гігроскопічна маса). Вихід 0.180 мг (80%), ([]D + 12 (с 1, МеОН). LCMS; R,: 1.17 хв, ([М+Н] =232). Сполуку 49 (вільна основа одержана після фільтрації солі НCl крізь SCX-2), перетворюють на її сіль вищенаведеним способом (вільна осно1 ва/фумарова кислота (1:1), аморфна маса), ΗЯΜΡ (400 МГц, D6DMSO): 11.61 (bs, 1Н), 7.75 (d, J=8 Гц, 1H), 6.49 (s, 2H), 6.47 (d, J=8 Гц, 1Н), 6.21 (s, 1H), 3.84 (s, 3H), 3.78-3.71 (m, 1H), 3.23-3.18 (m, 1H), 3.14-3.08 (m, 1H), 3.01-2.95 (m, 1H), 2.051.80 (m, 3H), 1.67-1.59 (m, 1H). (R)-5-бром-2-піролідин-2-ілметил-1Нпірол[2,3-b]піридин. (сполука 52А) та (S)-5-бром2-піролідин-2-ілметил-1Н-пірол[2,3-b]піридин. (сполука 52В) Доступний на ринку 5-бром-7-азаіндол (5.19 г, 26.3 ммолів) перетворюють на 1бензолсульфоніл-5-бром-1Н-пірол[2,3-b]піридин за способом, наведеним для 45А/В. тверда маса, 1 точка топлення 141-142°С. (6.9 г, 78%). Η-ЯΜΡ (400 МГц, CDCl3): 8.45 (d, J=2 Гц, 1H), 8.19-8.15 (m, 2H), 7.98 (d, J=2 Гц, 1Н), 7.74 (d, J=4 Гц, 1Н), 7.62-7.47 (m, 3H), 6.55 (d, J=4 Гц, 1Н). LCMS; Rt: + 1.92 хв, ([М+Н] =337). 1-бензолсульфоніл-5-бром-1Н-пірол[2,3b]піридин (5.52 г, 16.3 ммолів) перетворюють на (R)-1-бензолсульфоніл-5-бром-2-піролідин-2ілметил-1Н-пірол[2,3-b]піридин за способом, наведеним для 45А/В (аморфна маса, 3.02 г, суміш сполук з вмістом біля 70% передбаченого С2регіоізомеру). (TLC МеОН/триетиламін (97/3) Rf + 0.3). LCMS; Rt: 1.44 хв, ([М+Н] =420, 422). Зазначену суміш з вмістом (R)-1бензолсульфоніл-5-бром-2-піролідин-2-ілметил1Н-пірол[2,3-b]піридину (3.02 г, приблизно 7.1 ммолів), перетворюють на зазначену сполуку 52А за способом, наведеним для 45А/В (повторна випарювальна хроматографія), (аморфна маса, 0.5 г, приблизно 25%), яку перетворюють на її 1 сіль (вільна основа/фумарова кислота (1:1)). ΗЯΜΡ (400 МГц, D6DMSO): N1-Η не проглядається, 8.16 (d, J=2 Гц, 1Н), 8.06 (d, J=2 Гц, 1H), 6.46 (s, 2H), 6.30 (s, 1H), 3.80-3.72, (m, 1H), 3.23-3.03 (m, 4H), 2.06-1.77 (m, 3H), 1.67-1.57 (m, 1H). (S)-5-бром-2-піролідин-2-ілметил-1Нпірол[2,3-b]піридин (сполуку 52В) одержують (з 36) за способом, наведеним для сполуки 52А. + 25 LCMS; Rt: 1.27 хв, ([М+Н] =280). ([]D +38 (с 1, толуол). (R)-5-метил-2-піролідин-2-ілметил-1Нпірол[2,3-b]піридин. (сполука 53А) 97374 50 5-метил-7-азаіндол (4.15 г, 31.4 ммолів), перетворюють на 1-бензолсульфоніл-5-метил-1Нпірол[2,3-b]піридин за способом, наведеним для 1 45А/В (аморфна маса, 7.07 г, 82%). Н-ЯМР (400 МГц, CDCl3): 8.25 (bd, J=2 Гц, 1H), 8.19-8.15 (m, 2H), 7.66 (d, J=4 Гц, 1Н), 7.62 (bd, J=2 Гц, 1H), 7.58-7.43 (m, 3H), 6.51 (d, J=2 Гц, 1H), 2.38 (s, 3H). (TLC діетилетер Rf 0.52). LCMS; Rt: 1.75 хв, + ([М+Н] =273). 1-бензолсульфоніл-5-метил-1Нпірол[2,3-b]піридин (3.15 г, 11.5 ммолів) перетворюють на (R)-1-бензолсульфоніл-5-метил-2піролідин-2-ілметил-1Н-пірол[2,3-b]піридин за способом, наведеним для 45А/В (аморфна маса, + 7.04 г, 61%). LCMS; Rt: 1.41 хв, ([М+Н] =356). (R)-1-бензолсульфоніл-5-метил-2-піролідин2-ілметил-1Н-пірол[2,3-b]піридин (1.5 г, 4.22 ммоля), 3.5 г KOН та 1 мл моногідрату гідразину з'єднують у 2-(2-гідроксіетоксі)-етанолі (25 мл) та перемішують 1 годину при 0°С. До охолодженої реакційної суміші додають МеОН, реакційну суміш фільтрують крізь 60 г SCX-2 (МеОН, потім 1N NН3/МеОН). Подальшою очисткою випарювальною хроматографією (МеОН/триетиламін (90/2) одержують зазначену сполуку 53А (аморфна ма25 са, 0.46 г, 50%). ([]D -10 (с 1, діоксан), яка реагує з 1 еквівалентом фумарової кислоти у МеОН, та концентрують одержуючи зазначену сполуку 53А (аморфна маса) (вільна основа/фумарова 1 кислота (1:1)). Η-ЯΜΡ (400 МГц, D6DMSO): 11.6 (bs, 1Н), 7.97 (bs, 1H), 7.63 (bs, 1H), 6.51 (s, 2H), 6.22 (s, 1H), 3.84-3.77 (m, 1H), 3.26-3.03 (m, 4H), 2.33 (s, 3H), 2.07-1.81 (m, 3H), 1.69-1.61 (m, 1H). 2-піролідин-3-ілметил-1Н-пірол[2,3-b]піридин. (сполука 66). 8.83 г (91 ммоль) метоксіметиламіну (НCl солі) перемішують у 200 мл безводного бензолу (0°С, в атмосфері N2). Додають 46.2 мл триметилалюімінію/толуолу (2.5М) і суміш перемішують 2.5 години при 0°С. Додають розчин сполуки 62 (6.73 г, 30.7 ммолів) у 100 мл бензолу й одержану суміш перемішують 1 годину при кімнатній температурі. До суміші додають послідовно насичений розчин NaHCO3 (0°С) та етилацетат. Органічну фазу промивають тричі 5% розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують. Одержаний осад очищують випарювальною хроматографією (МеОН/етилацетат (1/9)), одержуючи метоксіметиламід 1-бензил-піролідин3-карбонової кислоти (сполука 63, 6.76 г, 1 88.7%). Н-ЯМР (400 МГц, CDCl3): 7.38-7.22 (m, 5H), 3.69-3.62 (m, 5H), 3.45-3.35 (m, 1H), 3.19-3.18 (2xs, 3H), 3.06-2.99 (m, 1H), 2.88-2.81 (m, 1H), 2.56-2.41 (m, 2H), 2.14-2.03 (m, 2H). До розчину безводного THF (75 мл) з вмістом сполуки 17 (7.2 г, 27.1 ммолів) додають 13.6 мл LDA (2.0Μ у THF/гептані) по краплинах при -10°С в атмосфері N2. Після додання одержаний розчин перемішують 30 хвилин при -10°С-0°С. Далі температуру знижують до -70°С. При цій температурі розчин 63 (6.72 г, 27 ммолів) у 25 мл THF додають по краплинах (10 хвилин). Після додання 63 температуру підвищують до -30°С (0.5 години) й одержаний розчин перемішують 1 годину при 30°С. Далі суміш гасять насиченим розчином NH4CI при -30°С та дають нагрітися до кімнатної 51 температури. Етилацетат додають і органічну фазу промивають 5% NaHCO3, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Очисткою випарювальною хроматографією (діетилетер, потім етилацетат) одержують сполука 64 (аморфна маса, 5.38 g, 44.6%) LCMS; Rt: 1.27 хв, + ([М+Н] =342). Сполуку 64 (1.05 г, 2.35 ммолів), 2 г KOН та 3.56 мл моногідрату гідразину з'єднують у 2-(2гідроксіетоксі)-етанолі (20 мл) та перемішують 30 хвилин при 100°С (в атмосфері N2), потім ще 45 хвилин при 200°С. До охолодженої реакційної суміші додають етилацетат й одержану органічну фазу промивають 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Суміш розчиняють у МеОН та фільтрують крізь 80 г SCX-2 (МеОН, потім 1 Ν ΝΗ3/ΜeΟΗ). Подальшою очисткою випарювальною хроматографією (МеОН/етилацетат) одержують сполуку 65 (аморфна 1 маса, 0.6 г, 83%). Н-ЯМР (400 МГц, CDCl3): 10.65 (bs, 1Н), 8.20 (dd, J=5 Гц, 2 Гц, 1H), 7.80 (dd, J=8 Гц, 2 Гц, 1Н), 7.37-7.20 (m, 5H), 7.02 (dd, J=8 Гц, 5 Гц, 1H), 6.17 (s, 2H), 3.63 (dd, Jgem=13 Гц, 2Н), 2.95-2.90 (m, 2H), 2.77-2.54 (m, 4H), 2.43-2.38 (m, 1H), 2.12-2.02 (m, 1H), 1.65-1.55 (m, 1H). + LCMS; Rt: 1.46 хв, ([M+H] =292). Сполуку 65 (0.52 г, 1.8 ммоля), 0.3 г форміату амонію (4.7 ммоля) та 20% Pd(OH)2/C (50 мг) з'єднують у МеОН (10 мл) та нагрівають до температури флегми 1 годину. Суміш охолоджують, фільтрують, концентрують та розчиняють у МеОН. Наступна фільтрація крізь 25 г SCX-2 (МеОН, потім 1N NH3/MeOH) дає зазначену сполуку: 2-піролідин-3-ілметил-1Нпірол[2,3-b]піридин (сполука 66, 0.34 г, 94%) яка реагує з 1 еквівалентом фумарової кислоти у МеОН, й її концентрують, одержуючи зазначену сполуку 66 (аморфна маса) (вільна осно1 ва/фумарова кислота (1:1)). Н-ЯМР (400 МГц, D6DMSO): 11.6 (bs, 1Н), 8.11 (dd, J=5 Гц, 2 Гц, 1Н), 7.81 (dd, J=8 Гц, 2 Гц, 1Н), 6.99 (dd, J=8 Гц, 5 Гц, 1Н), 6.5 (s, 2H), 6.21 (bs, 1H), 3.29-3.22 (m, 2H), 3.17-3.09 (m, 1H), 2.90-2.76 (m, 3H), 2.72-2.61 (m, 1H), 2.06-1.97 (m, 1H), 1.69-1.59 (m, 1H). (TLC МеОН/триетиламін (97/3) Rf 0.08). 2-(1-метилпіролідин-3-ілметил)-1Н-пірол[2,3b]піридин. (сполука 68). Сполуку 66 (0.3 г, 1.49 ммоля) перетворюють на сполуку 67 за способом, наведеним для сполуки 9. Вихід 0.362 g (80.7%). (TLC етер Rf 0.11), який без обробки використовують для одержання зазначеної сполуки (68) за способом, наведеним для сполуки 28. (Вихід 0.17 g, 65%), точка топ1 лення 96-97°С. H-ЯМР (400 МГц, CDCl3): N1-H не проглядається, 8.16 (dd, J=5 Гц, 2 Гц, 1Н), 7.77 (dd, J=8 Гц, 2 Гц, 1Н), 6.98 (dd, J=8 Гц, 5 Гц, 1Н), 6.16 (bs, 1H), 2.92-2.84 (m, 2H), 2.76-2.64 (m, 2H), 2.62-2.50 (m, 2H), 2.34 (s, 3H), 2.40-2.31 (m, 1H), 2.11-2.01 (m, 1H), 1.63-1.53 (m, 1H). (TLC МеОН/триетиламін (97/3) Rf 0.2). 2-піролідин-3-іл-1Н-пірол[2,3-b]піридин. (сполука 78). До розчину безводного THF (75 мл) з вмістом сполуки 17 (6.0 г, 23.2 ммоля) додають 12.5 мл (24 ммоля) LDA (2.0 Μ у THF/гептані) по краплинах при -10°С в атмосфері N2. Після додання 97374 52 одержаний розчин перемішують 30 хвилин при 10°С-0°С, а далі охолоджують до -70°С. Безводний СеСl3 (6 г, 24.3 ммоля) додають до 50 мл безводного THF, одержану суміш перемішують 0.5 години при 30°С (в атмосфері N2). Цю суміш додають до 2-літійпохідного 17, підтримуючи температуру -70°С. Температуру підвищують до -10°С та перемішують 10 хвилин. Після того температуру знижують до -50°С. Розчин сполуки 71 (5 г, 28.5 ммолів) у 50 мл THF додають до реакційної суміші, одержану суміш перемішують 2 годин при -30°С. Суміші дають нагрітися до кімнатної температури та перемішують ще 2 години. Суміш концентрують у вакуумі, додають етилацетат, органічну фазу промивають 5% розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Одержаний осад очищують випарювальною хроматографією (дієтилетер/РЕ градієнт 1:1 відносно чистого діетилетеру), одержуючи сполуку 72: трет-бутилефір 3-(1бензолсульфоніл-1Н-пірол[2,3-b]піридин-2-іл)-3гідроксіпіролідин-1-карбонової кислоти (аморфна 1 маса, 6.0 g, 58%). Н-ЯМР (400 МГц, CDCl3): 8.38-8.32 (m, 1H), 8.17-8.12 (m, 2H), 7.80-7.50 (m, 1H), 7.60-7.43 (m, 3H), 7.17-7.12 (m, 1H), 6.55 (s, 1H), 4.90 та 4.85 (2 x bs, 1H), 4.24-4.13 (m, 1H), 3.92-3.79 (m, 1H), 3.75-3.48 (m, 2H), 2.68-2.47 (m, + 2H), 1.49 (s, 9H). LCMS; Rt: 1.83 хв, ([М+Н] =444). Сполуку 72 (8.6 г, 19.4 ммолів), 12 г KOН та 20 мл моногідрату гідразину з'єднують у 2-(2гідроксіетоксі)-етанолу (150 мл) та перемішують 30 хвилин при 100°С (в атмосфері N2). До охолодженої реакційної суміші додають етилацетат й одержану органічну фазу промивають кілька разів 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Подальшою очисткою випарювальною хроматографією (діетилетер, потім етилацетат) одержують сполуку 74 (олія, 1 4.97 г, 84%). Н-ЯМР (400 МГц, D6DMSO): 11.6 (bs, 1Н), 8.15 (dd, J=5 Гц, 2 Гц, 1Н), 7.87 (dd, J=8 Гц, 2 Гц, 1Н), 7.01 (dd, J=8 Гц, 5 Гц, 1H), 6.38 (d, J=2 Гц, 1H), 5.67 (bs, 1H), 3.61-3.41 (m, 4H), 2.372.28 (m, 1H), 2.16-2.07 (m, 1H), 1.43 та 1.41 (2 x s, + 9H). LCMS; R,: 1.48 хв, ([М+Н] =304). Сполуку 74 (4.92 г, 16.23 ммолів), 100 мл Н2О та 100 мл 38% розчину НCl з'єднують та нагрівають із зворотним холодильником 12 годин. Суміш охолоджують, концентрують та розчиняють у МеОН. Фільтрацією крізь 50 г SCX-2 (МеОН, потім 1Ν ΝΗ3/ΜeΟΗ) з наступною випарювальною хроматографією (МеОН/триетиламін (99/1)) оде1 ржують сполуку 76 (олія, 1.75 г, 58%). Η-ЯΜΡ (400 МГц, D6DMSO): 12.1 (bs, 1Η), 8.22 (dd, J=5 Гц, 2 Гц, 1H), 7.92 (dd, J=8 Гц, 2 Гц, 1Н), 7.05 (dd, J=8 Гц, 5 Гц, 1H), 6.55-650 (m, 1H), 6.49 (s, 1H), 4.23-4.17 (m, 2H), 4.07-4.02 (m, 2H). LCMS; Rt: + 0.91 хв, ([М+Н] =186). Сполуку 76 (1.8 г, 9.73 ммолів) та 20% Pd(OH)2/C (180 мг) з'єднують у МеОН (100 мл). Суміш гідрогенують при 50 фунтах/кв.дюйм (345 кПа) 2 години. Суміш фільтрують, концентрують, наново розчиняють у МеОН та фільтрують крізь 50 r SCX-2 (МеОН, потім 1N NН3/МеОН), з наступною випарювальною хроматографією (МеОН/триетиламін (98/2)) одержуючи зазначену 53 сполуку: 2-піролідин-3-іл-1Н-пірол[2,3-b]піридин. (сполука 78). (аморфна маса, 1.09 g, 59%). LCMS; + Rt: 0.75 хв, ([М+Н] =188). Енантіочисті ізомери розділяють у хіральній колонці (Chiralpak AD 20мкм, 250x4.6, 20% МеОН, 20% EtOH, 60% гептану, 2 мл/хв, =220 нм, Rt: 6.0 25 хв (78А), ([]D -10 (с 1, МеОН) та Rt: 7.9 хв (78В), 25 ([]D +12 (с 1, МеОН). Обидва ізомери реагують з 1 еквівалентом фумарової кислоти у МеОН, і їх концентрують, одержуючи сіль зазначеної сполуки, точка топлення 130-133°С. (вільна основа/фумарова кис1 лота (1:1.5)). Н- ЯМР (400 МГц, D6DMSO): 11.7 (bs, 1Н), 8.08 (dd, J=5 Гц, 2 Гц, 1Н), 7.78 (dd, J=8 Гц, 2 Гц, 1H), 6.95 (dd, J=8 Гц, 5 Гц, 1Н), 6.4 (s, 3H), 6.27 (bs, 1H), 3.63-3.53 (m, 2H), 3.33-3.15 (m, 3H), 2.36-2.25 (m, 1H), 2.08-1.97 (m, 1H). 2-піролідин-3-іл-1Н-пірол[3,2-b]піридин. (сполука 79). Доступна на ринку сполука 69 реагує з бензолсульфонілхлоридом, як описано для 45А/В, або у Eur. J. of Med. Chem (2004). Вихід 80-90%. Сполуку 70 одержують у вигляді олії, яка криста1 лізується при відстої. Н-ЯМР (400 МГц, CDCl3): 8.54 (dd, J=5 Гц, 2 Гц, 1Н), 8.27 (bd, J=8 Гц, 1H), 8.0-7.85 (m, 2H), 7.81 (d, J=4 Гц, 1H), 7.60-7.54 (m, 1H), 7.49-7.43 (m, 2H), 7.24 (dd, J=8 Гц, 5 Гц, 1Н), 6.88 (bd, J=4 Гц, 1Н). Сполука 70 (2.58 г, 10 ммолів) реагує із сполукою 71 за способом, наведеним для синтезу вищезазначеної сполуки 72, з одержанням сполуки 73. Сполука 73: трет-бутилефір 3-(1бензолсульфоніл-1Н-пірол[3,2-b]піридин-2-іл)-3гідроксі-піролідин-1-карбонової кислоти), (амор1 фна маса, 1.23 g, 28%). Н-ЯМР (400 МГц, CDCl3): 8.52-8.48 (m, 1H), 8.28-8.21 (m, 2H), 7.82-7.78 (m, 2H), 7.58-7.51 (m, 1H), 7.45-7.39 (m, 2H), 7.237.17 (m, 1Н), 6.93 (bs, 1H), 4.58 та 4.53 (2 x bs, 1H), 4.14-4.08 (m, 1H), 3.81-3.50 (m, 3H), 2.64-2.45 (m, 2H), 1.49 (s, 9H). Сполука 75: трет-бутилефір 3-гідроксі-3-(1Нпірол[3,2-b]піридин-2-іл)-3-гідроксі-піролідин-1карбонової кислоти одержують із сполуки 73 (1.2 г, 2.7 ммоля) за способом, наведеним для синтезу вищезазначеної сполуки 74. 1 Сполука 75, (аморфна маса, 0.42 г, 51%). ΗЯΜΡ (400 МГц, CDCl3) показує поворотні ізомери (наведені найважливіші): 9.02-9.0 (2 x s, 1Н), 8.40-8.32 (m, 1Н), 7.66-7.59 (m, 1H), 7.08-7.02 (bdd, J=8 Гц, 5 Гц, 1Н), 6.41 та 6.33 (2 x bs, 1H). Сполука 77: 2-(2,5-дігідро-1Н-пірол-3-іл)-1Нпірол[3,2]піридин одержують із сполуки 75, (0.42 г, 1.38 ммоля) за способом, наведеним для синтезу вищезазначеної сполуки 76. 1 Сполука 77, (аморфна маса, 0.2 г, 78%). ΗЯΜΡ (400 МГц, D6DMSO): 11.4 (bs, 1H), 8.19 (bd, J=5 Гц, 1H), 7.61 (bd, J=8 Гц, 1Н), 7.0 (dd, J=8 Гц, 5 Гц, 1H), 6.43-6.38 (m, 2H), 3.93-3.88 (m, 2H), 3.77-3.72 (m, 2H). Зазначену сполуку: 2-піролідин-3-іл-1Нпірол[3,2-b]піридин. (сполука 79) одержують із сполуки 77 (0.19 г, 1.02 ммоля) за способом, наведеним для синтезу вищезазначеної сполуки 78. 97374 54 Сполука 79, (аморфна маса, 0.16 г, 83%), реагує з 1 еквівалентом фумарової кислоти у МеОН, й її концентрують, одержуючи сіль зазначеної сполуки, (аморфна маса, вільна 1 основа/фумарова кислота (1:1.5)). Η-ЯΜΡ (400 МГц, D6DMSO): 11.6 (bs, 1Н), 8.26 (bd, J=5 Гц, 1Н), 7.69 (bd, J=8 Гц, 1H), 7.05 (bdd, J=8 Гц, 5 Гц, 1H), 6.54 (s, 3H), 6.48 (bs, 1H), 3.74-3.62 (m, 2H), 3.40-3.25 (m, 2H), 2.44-2.37 (m, 1H), 2.09-1.97 (m, 1H). (R)-2-піролідин-2-ілметил-1Н-пірол[3,2b]піридин. (сполука 81А) та (S)-2-піролідин-2ілметил-1Н-пірол[3,2-b]піридин. (сполука 81В). Літіювання (LDA) сполуки 70 (1.42 г, 5.05 ммолів) з наступною реакцією з 35 здійснюють за способом, наведеним для синтезу (перший етап) сполуки 39А. Сполука 80А: (R)-1бензолсульфоніл-2-піролідин-2-ілметил-1Н1 пірол[3,2-b]піридин. (1.32 г, 70%). Н-ЯМР (400 МГц, CDCl3): 8.48 (dd, J=5 Гц, 2 Гц, 1Н), 8.40 (bd, J=8 Гц, 1H), 7.73-7.70 (m, 2H), 7.57-7.53 (m, 1H), 7.44-7.40 (m, 2H), 7.18 (dd, J=8 Гц, 5 Гц, 1Н), 3.623.55 (m, 1H), 3.23-3.13 (m, 2H), 3.08-3.02 (m, 1H), 2.95-2.88 (m, 1H), 2.0-1.95 (m, 1H), 1.90-1.75 (m, 1H), 1.51-1.42 (m, 1H). Готують розчин 247 мг KOt-Bu (1.1 екв.) у 40 мл МеОН та перемішують 30 хвилин в атмосфері N2. Додають сполуку 80А (683 мг, 2 ммоля), суміш перемішують 20 годин при 50°С. Суміш охолоджують, фільтрують, концентрують та наново розчиняють у МеОН. Фільтрацією крізь 25 г SCX2 (МеОН, потім 1N NН3/МеОН) з наступною випарювальною хроматографією (МеОН/триетиламін (97/3)) одержують зазначену сполуку: (R)-2піролідин-2-ілметил-1Н-пірол[3,2-b]піридин. (спо25 1 лука 81А). ([]D -74 (с 1, толуол). Η-ЯΜΡ (400 МГц, D6DMSO): 11.0 (bs, 1Н), 8.20 (bd, J=5 Гц, 1Н), 7.62 (bd, J=8 Гц, 1Н), 6.98 (dd, J=8 Гц, 5 Гц, 1Н), 6.30 (bs, 1H), 3.37-3.28 (m, 1H), 2.90-2.70 (m, 4H), 1.82-1.55 (m, 3H), 1.37-1.28 (m, 1H). (S)-2-піролідин-2-ілметил-1Н-пірол[3,2b]піридин (сполука 81В) одержують за способом, наведеним для сполуки 81А, за допомогою суль25 фамідату 36. ([]D +74 (с 1, толуол). (R)-5-метоксі-2-піролідин-2-ілметил-1Нпірол[3,2-b]піридин. (сполука 85) До розчину 9.5 мл (59 ммолів) TMEDA у безводному THF (60 мл) додають 10.5 мл третбутиллітію (1.5 Μ у пентані) по краплинах при 70°С в атмосфері N2. Після додання одержаний розчин перемішують 15 хвилин при -70°С. При цій температурі розчин 83 (3.7 г, 14.3 ммолів) у 25 мл THF додають по краплинах (10 хвилин). Суміш перемішують 60 хвилин при -70°С. При цій температурі додають розчин 35 (2.33 г, 14.3 ммолів) у 30 мл безводного THF і суміш перемішують 30 хвилин при -70°С, після чого підвищують температуру до -20°С. Суміші дають нагрітися до кімнатної температури та перемішують ще 20 годин. Реакційну суміш концентрують, осад розчиняють у 100 мл 1N HCl та 100 мл THF. Суміш перемішують при 70°С 20 годин. Реакційну суміш концентрують у вакуумі. Одержаний осад витримують у етилацетаті, промивають 2N NaOH, сушать (Na2SO4), фільтрують та концентрують у 55 вакуумі. Очисткою випарювальною хроматографією (МеОН/триетиламін (97/3)) одержують сполуку 84 (тверда маса, 2.83 g, 53%). точка топлен1 ня 101-103°С. Н-ЯМР (400 МГц, CDCl3): 8.30 (d, J=9 Гц, 1Н), 7.71-7.65 (m, 2H), 7.57-7.50 (m, 1H), 7.45-7.35 (m, 2H), 6.65 (d, J=9 Гц,1Н), 6.54 (s, 1H), 3.94 (s, 3H), 3.56-3.47 (m, 1H), 3.15-2.98 (m, 4H), 2.05-1.65 (m, 3H), 1.48-1.37 (m, 1H). Сполуку 84 перетворюють на зазначену сполуку (85), як описано для синтезу 39А. Зазначену сполуку: (R)-5-метоксі-2-піролідин-2-ілметил-Шпірол[3,2-b]піридин одержують у вигляді сиропу 25 (1.18 г, 68%), []D -42 (с 1, СНСІ3), який реагує з 1 еквівалентом фумарової кислоти у МеОН, та концентрують, одержуючи зазначену сполуку 95 (аморфна маса) (вільна основа/фумарова кислота (1:1)). точка топлення 180-182°С. (R)-3-піролідин-2-ілметил-1Н-пірол[32b]піридин. (сполука 88) 4.6 г (25.8 ммолів) NBS додають до 3.05 г (25.8 ммолів) 4-азаіндолу у 40 мл DMF (0°С).). Суміш перемішують 30 хвилин при 0°С. Додають МеОН і фільтрують суміш крізь SCX-2, наступною випарювальною хроматографією (етилацетат, потім МеОН) одержують 3-бром-1Н-[3,2-b]піридин (86) у вигляді твердої маси, точка топлення 241°С 1 (4.52 г, 89%). Н-ЯМР (400 МГц, D6DMSO): 11.7 (bs, 1Н), 8.39 (dd, J=5 Гц, 2 Гц, 1H), 7.85 (s, 1H), 7.82 (dd, J=8 Гц, 2 Гц, 1H), 7.19 (dd J=8 Гц, 5 Гц, 1Н). До розчину безводного THF (75 мл) з вмістом сполуки 86 (2.28 г, 11.6 ммолів) додають 4.6 мл nBuli (2.5 Μ у гексані) по краплинах при -78°С в атмосфері N2. Після додання одержаний розчин перемішують 45 хвилин при -78°С. При цій температурі розчин TIPS-Cl (2.73 мл) у 10 мл THF додають по краплинах. Після додання одержаний розчин перемішують 1 годину при -78°С. Далі суміші дають нагрітися до кімнатної температури. Реакційну суміш концентрують, одержаний осад витримують у етилацетаті, промивають 5% розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Очисткою випарювальною хроматографією (діетилетер/РЕ (1/1)) одержують 3-бром-1-три-трет-бутилсиланіл-1Нпірол[3,2-b]піридин (87) у вигляді твердої маси, 1 точка топлення 79-80°С (3.52 g, 86%). Η-ЯΜΡ (400 МГц, CDCl3): 8.55 (dd, J=5 Гц, 2 Гц, 1Н), 7.76 (dd, J=8 Гц, 2 Гц, 1H), 7.49 (s, 1H), 7.13 (dd, J=8 Гц, 5 Гц, 1Н), 1.73-1.60 (m, 3H), 1.15 та 1.13 (2 x s, 18H). До розчину безводного THF (100 мл) з вмістом сполуки 87 (3.42 г, 9.69 ммолів) додають 3.9 мл n-Buli (2.5 Μ у гексані) по краплинах (-78°С в атмосфері N2). Після додання одержаний розчин перемішують 60 хвилин при -78°С. При цій температурі, розчин 35 (1.58 г, 9.69 ммолів) у 10 мл THF додають по краплинах (5 хвилин). Після додання 35 температуру підвищують до -20°С й одержаний розчин перемішують 2 години. Суміші дають нагрітися до кімнатної температури та перемішують ще 2 години. Реакційну суміш концентрують, осад розчиняють у 40 мл 1N HCl, 40 мл EtOH та 40 мл THF. Суміш перемішують при 80°С 18 годин. Реакційну 97374 56 суміш концентрують у вакуумі. Додають МеОН (25 мл) і суміш концентрують на 25 г SiO2. Наступною випарювальною хроматографією (МеОН/триетиламін (98/2) одержують зазначену сполуку: (R)-3-піролідин-2-ілметил-1Н-пірол[3,2b]піридин. (сполука 88), (аморфна маса, 0.32 г, 1 0.72 ммоля, 9.3%). Η-ЯΜΡ (400 МГц, CDCl3): 9.1 (bs, 1H), 8.42 (dd, J=5 Гц, 2 Гц, 1Н), 7.58 (dd, J=8 Гц, 2 Гц, 1Н), 7.20 (s, 1H), 7.06 (dd, J=8 Гц, 5 Гц, 1H), 3.59-3.51 (m, 1H), 3.14-3.02 (m, 2H), 2.972.85 (m, 2H), 2.0-1.90 (m, 1H), 1.86-1.71 (m, 2H), + 1.54-1.43 (m, 1H). LCMS: Rt; 0.64 хв, ([M+H] =202). 25 []D -10 (c 1, діоксан). (R)-6-піролідин-2-ілметил-7Н-пірол[2,3d]піримідин. (сполука 95) Доступний на ринку 6-хлор-7-деазапурин (1.58 г, 10.3 ммолів), 3.25 г форміату амонію (51.6 ммолів) та 20% Pd(OH)2/C (140 мг) з'єднують у МеОН (50 мл) та нагрівають до температури флегми 2 години. Суміш охолоджують, фільтрують, концентрують і наново розчиняють у МеОН. Фільтрацією крізь 25 г SCX-2 (МеОН, потім 1N NН3/МеОН) й наступною випарювальною хроматографією (етилацетат/МеОН (9/1)) одержують сполука 90 (1.2 г, 4.02 ммолів, 97%) аморфна 1 маса. Н-ЯМР (400 МГц, CDCl3): 11.1 (bs, 1Н), 9.1 (bs, 1Н), 9.0 (bs, 1H), 7.45-7.40 (m, 1H), 6.686.62 (m, 1H). 7Н-пірол[2,3-d]піримідин (1.16 г, 9.74 ммолів) розчиняють у 100 мл безводного THF в атмосфері N2. При 0°С додають 60% дисперсію NaH 0.51 г у мінеральному маслі. Суміш перемішують при кімнатній температурі й додають розчин 2.93 мл (9.8 ммолів) (2-хлорметоксіетил)-триметилсилану у 15 мл безводного THF. Реакційну суміш перемішують при кімнатній температурі 2 години, після чого концентрують у вакуумі. Етилацетат додають до суміші, органічну фазу промивають тричі насиченим розчином NaHCO3, сушать (Na2SO4), фільтрують та концентрують. Одержаний осад очищують випарювальною хроматографією (діетилетер), одержуючи 7-(2триметилсиланіл-етоксіметил-7Н-пірол[2,3d]піримідину (сполука 91), (аморфна маса, 0.84 g, 1 35%) . Н-ЯМР (400 МГц, CDCl3): 9.1 (bs, 1Н), 9.0 (bs, 1H), 7.43 (bd, J=4 Гц, 1Н), 6.68 (bd, J=4 Гц, 1H), 5.73 (s, 1H), 3.6 (t, J=8 Гц, 2H), 0.97 (t, J=8 Гц, 2H), 0.1 (s, 9H). В атмосфері азоту 0.62 мл (3.7 ммоля) 2,2,6,6-тетраметилпіперидину додають до 20 мл безводного THF (-78°С). Додають n-Buli 1.3 мл (2.5 Μ, 3.33 ммоля) й реакційну суміш перемішують 30 хвилин. Додають розчин сполуки 91 (0.83 г, 2.16 ммоля) у 10 мл THF і суміш перемішують 30 хвилин. Додають розчин сполуки 35 (557 мг, 2.16 ммоля) у 5 мл THF. Після додання 35 температуру підвищують до -30°С й одержаний розчин перемішують 2 години. Суміші дають нагрітися до кімнатної температури та перемішують ще 2 години. Насичений розчин NH4CI (5 мл) додають до реакційної суміші, далі додають 25 г S1O2 й суміш концентрують у вакуумі. Одержаний осад очищують випарювальною хроматографією (діхлорметан/МеОН/NH4ОН) (90/10/1), одержуючи 57 сполуку 93 (0.4 г, 44.9%). LCMS; Rt: 1.38 хв, + ([М+Н] =413). Сполуку 93 (0.63 г, 1.53 ммоля), 11.4 мл тетрабутиламонійфториду (1М у THF) та 25 мл THF з'єднують і суміш нагрівають із зворотним холодильником (36 годин). Суміш охолоджують, додають 25 г SiO2, після чого концентрують у вакуумі. Одержаний осад очищують випарювальною хроматографією (діхлорметан/МеОН/NH4ОН) (90/10/0.5) одержуючи 1 сполуку 94 (0.35 г, 81%). Н-ЯМР (400 МГц, CDCl3): 11.3 (bs, 1Н), 8.80 (bs, 1H), 8.65 (bs, 1H), 6.2 (bs, 1H), 3.95-3.88 (m, 1H), 3.65-3.58 (m, 1H), 3.24-3.17 (m, 2H), 2.89-2.82 (m, 1H), 2.05-1.96 (m, 2H), 1.74-1.6 (m, 2H). Сполуку 94 (0.35 г, 1.24 ммоля), 10 мл 1N HCl та 10 мл EtOH з'єднують і нагрівають із зворотним холодильником 18 годин. Реакційну суміш охолоджують та концентрують у вакуумі. Одер 97374 58 жаний осад витримують у етилацетаті, промивають 2N розчином NaOH, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Очисткою випарювальною хроматографією (МеОН/триетиламін 97/3)) одержують зазначену сполуку: (R)-6-піролідин-2-ілметил-7Н-пірол[2,3d]піримідин. (95), (аморфна маса, 70 мг. 27.9%). + LCMS; Rt: 0.68 хв, ([М+Н] =203), яка реагує з 1 еквівалентом фумарової кислоту у МеОН, й її концентрують, одержуючи зазначену сполуку 95 (аморфна маса) (вільна основа/фумарова кисло1 та (1:2)). H-ЯМР (400 МГц, D5DMSO): 12.8-11.8 (bs, 1H), 8.86 (s, 1H), 8.68 (s, 1H), 6.54 (s, 4H), 6.45 (s, 1H), 3.85-3.79 (m, 1H), 3.25-3.19 (m, 2H), 3.17-3.09 (m, 2H), 2.10-2.03 (m, 1H), 2.00-1.92 (m, 1H)), 1.90-1.82 (m, 1H), 1.69-1.62 (m, 1H). Структури сполук за винаходом, синтез яких було описано вище, наведені у таблиці. 59 97374 60
ДивитисяДодаткова інформація
Назва патенту англійськоюAzaindole derivatives with a combination of partial nicotinic acetylcholine receptor agonism and dopamine reuptake inhibition
Автори англійськоюStoit, Axel, Coolen Hein K.A.C., van der Neut, Martina A.W., Kruse, Cornelis G.
Назва патенту російськоюПроизводные азаиндола с комбинацией частичного агонизма к никотиновому ацетилхолиновому рецептору и ингибирование обратного захвата допамина
Автори російськоюСтойт Аксель, Коолен Гейн К.А.К., ван дер Ньот Мартина А.В., Крузе Корнелис Г.
МПК / Мітки
МПК: A61K 31/40, A61K 31/445, C07D 453/02, C07D 487/04, A61P 25/16, A61P 25/28, C07D 471/04, A61P 25/30
Мітки: ацетилхолінового, азаіндолу, рецептора, нікотинового, агонізму, захоплення, комбінацією, часткового, інгібування, похідні, зворотного, допаміну
Код посилання
<a href="https://ua.patents.su/38-97374-pokhidni-azaindolu-z-kombinaciehyu-chastkovogo-agonizmu-do-nikotinovogo-acetilkholinovogo-receptora-ta-ingibuvannya-zvorotnogo-zakhoplennya-dopaminu.html" target="_blank" rel="follow" title="База патентів України">Похідні азаіндолу, з комбінацією часткового агонізму до нікотинового ацетилхолінового рецептора та інгібування зворотного захоплення допаміну</a>
Попередній патент: Спосіб і пристрій для формування стального контейнера для зберігання субстанції під тиском
Наступний патент: Спосіб і пристрій для відновлення металовмісного матеріалу у продукт відновлення та застосування цього продукту для одержання водню
Випадковий патент: Спосіб прогнозування перебігу гострого розсіяного енцефаломієліту при його трансформації у розсіяний склероз












