Спосіб одержання 3,4,6-заміщеного 2-хлоралкілхіноліну
Номер патенту: 81188
Опубліковано: 10.12.2007
Автори: Воловенко Юліан Михайлович, Толмачев Андрій Олексійович, Дегтяренко Олексій Сергійович
Формула / Реферат
1. Спосіб одержання 3,4,6-заміщеного 2-хлоралкілхіноліну загальної формули І
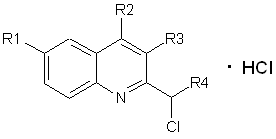 , І
, І
де R1 = H, Cl;
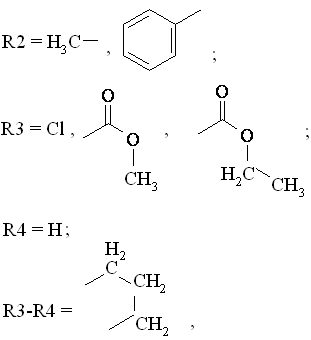
який відрізняється тим, що о-алкіл(арил)карбоніланілін загальної формули ІІ піддають взаємодії з заміщеним α-хлоркетоном загальної формули ІІІ у присутності триметилхлорсилану в органічних розчинниках
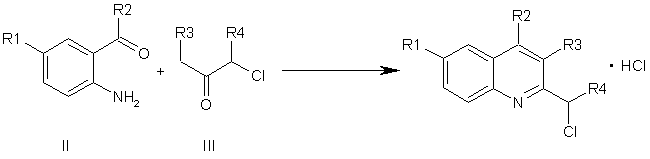 ,
,
де R1, R2, R3, R4 мають значення, як визначено вище.
2. Спосіб за п. 1, який відрізняється тим, що як розчинник використовують диметилформамід.
Текст
1. Спосіб одержання 3,4,6-заміщеного 2хлоралкілхіноліну загальної формули І R3 R4 N Cl , (I) 3 81188 взагалі є незручним способом очищення продукту реакції. 2. Ще раніше цим способом також було синтезовано 6-похідні етил-2-(хлорметил)-4фенілхінолін-3-карбоксілату [Anzini М., Vomero S., Garofalo A., Cappeli. // FRMCE8, Farmako, - 1989, vol. 44(6), - p. 555-564] за схемою 2, яка принципово не відрізняється від схеми 1 R1= H,Cl R2=H3C O O R3=Cl O O H2C CH3 4 R O O + O Cl NH2 CH3 O Et 1) R O Et O N Cl R1= H,Cl R4=H 1) HoAc(H2SO4)\3 h., 1000C H2 C CH2 R3-R4= CH2 які можуть бути застосовані як фізіологічно активні речовини в медицині або проміжні продукти при їх синтезі. Відомий наступний спосіб отримання заміщених 2-хлорметилхінолшів,які визначені вище. 1. Отримання етил-2-(хлорметил)-4-(3,4диметоксіфеніл)-6,7-диметоксіхинолін-3карбоксілату конденсацією 2-аміно-3,4,4',5тетраметоксібензофенону з 4-хлорацетооцтовим естером в присутності сірчаної кислоти (нагріванням в продовж 3-х годин в оцтовій к-ті при 100°C)[Atsw Baba, Noriaki Kawamura, Haruhiko Makino, Yoshikazu Ohta, Shigehisa Taketomi,and Takashi Sonda.// Studies on Disease-Modifying Antirheumatic Dmgs: Synthesis of Novel Quinoline and Quinazoline Derivatives and Anti-inflammatoryy Effect// J.Med.Chem-1996,-vol.39,-p.5176-5182] за схемою 1 схема 2 Недоліки при проведенні цього синтезу принципово аналогічні вищезазначеним. В основу винаходу поставлено задачу створити новий, більш зручний спосіб отримання похідних 2-хлорметилхіноліну, підвищити вихід продукту реакції, зменшити трудоемкость виділення продукту та час проведення самої реакції. Поставлена задача вирішується тим, що в способі отримання 3,4,6-заміщених 2хлоралкілхінолінів загальної формули І, R2 R1 R3 R4 N Cl , (I) R1= H,Cl MeO MeO OMe OMe R2=H3C O NH2 + O Cl O O O O Et MeO R3=Cl OMe 1) O O O OMe O Et CH3 1) HoAc(H2SO4)\3 h., 1000C OMe N H2C CH3 Cl схема 1 Недоліком цього способу є: 1) відносно низький вихід продукту реакціі, а саме 53%; 2) тривалий час проведення самої реакції (нагрівання впродовж 3-х годин); 3) ускладнення на стадії виділення. Автори, які реалізували синтез вищезазначеного продукту за схемою 1, вважають за необхідність проводити хроматографування на колонці з силікагелем, що різко знижує вихід, потребує зайвого часу та R4=H H2 C CH2 R3-R4= CH2 згідно з винаходом , о-алкіл(арил)карбоніланіліни загальної формули II піддаються взаємодії з заміщеними a-хлоркетонами загальної ф-ли III у присутності триметилхлорсилану у органічних розчинниках 5 81188 R2 R1 R2 R4 R3 R1 O + NH2 R3 *HCl Cl O N R4 Cl де R1, R2, R3, R4 мають значення, як визначено вище, при цьому у якості розчинника використовують диметилформамід. Винахід підтверджується нижченаведеними прикладами. Методика синтезу 6,4,3,-похідних 2хлорметилхіноліну. Методика А: о-амінобензофенону(0.07моль) та aхлоркетону(0.07моль) розчиняємо у 2.0 мл диметилформаміду (диметилацетаміду) та обережно приливаємо 0.28 моль триметилхлорсилану. Після цього колбу з реакційною сумішшю (обернений холодильник!) несильно взбовтують в руках протягом 1-5 хвилин до початку бурхливої реакції ( в деяких випадках допускається паралельно із взбовтуванням підігрів на водяній бані до початку бурхливої реакціі). Далі, після припинення закіпання, колбу витримують на водяній бані при 50-80°С протягом 1-1.5 годин. Охолоджують. Верхній шар силоксану, який утворився, зливаємо та доливаємо 10-15 мл води. Знов охолоджуємо, фільтруємо, промиваємо ізопропанолом. Отримуємо чистий продукт у формі гідрохлориду. При необхідності, якщо використовувалися забруднені вихідні речовини, перекристалізовуємо з ізопропанолу. Методика Б: о-амінобензофенону (0.07моль) та aхлоркетону (0.07моль) розчиняємо у 20 мл диметилформаміду (диметилацетаміду) та обережно приливаємо 0.28 моль триметилхлорсилану. Після цього колбу з реакційною сумішшю (обернений холодильник!) несильно взбовтують в руках протягом 1-5 хвилин до початку бурхливої реакції ( в деяких випадках допускається паралельно із взбовтуванням підігрів на водяній бані до початку бурхливої реакції). Після закіпання колбу добре охолоджують, верхній шар силоксану,який утворився, зливаємо та доливаємо 10-15 мл води. Знов охолоджуємо, фільтруємо, промиваємо ізопропанолом. Отримуємо чистий продукт у формі гідрохлориду. При необхідності, якщо використовувалися забруднені вихідні речовини, перекристалізовуємо з ізопропанолу. Приклад 1: етил 4-метил-2-хлорметил-3хінолінкарбоксилат гідрохлорид. С14Н15Сl2NO2.М.r=300,2;М.r.(основи)=263,7;т.топл.144°С; вихід 78%.Поелементний аналіз: вирахувано %(М)=4,67;%(Сl)=23,62, знайдено %(N)=4,674,66;%(Cl)=23,60-23,61. Мас спектр (високоефективний рідинний хроматограф "Agilent 1100 Series", оснащений мас-селективним детектором "Agilent LC/MSD SL"), m/z: 264,6;266. ЯМР 1Н (у ДМСО-d6, Varian Mercury 400 з робочею частотою 400 МГц), d, м.ч.: 1,43(3Н,т.,-ОСН2СН3), 2,74(3Н,с.), 4,47(2Н,к.- ОСН2СН3), 4,94(2Н,с.), 7,72(1 Н,т.), 7,85(1Н,т.), 8,07(1Н,д.), 8,20(1Н,д.). Приклад 2: 4-метил-3-хлор-2 6 хлорметилхіноліну гідрохлорид. С11Н10Сl3N. М.r.=261,6; М.r.(основи)=226,1, т.топл. 101-102°C (лит. 102-103°C: J.Org.Chem.,-1973,-vol.38,-p.927931); вихід 81,3%. Mac-спектр. m/z: 192,4; 194,4.ЯМР 1H (у ДМСО-d6), δ, м.ч.: 2,92(3Н,с.),??? 4,95(2Н,с.), 7,81(1Н,т.), 7,96(1Н,т.), 8,30(2Н,к.), 8,43(1Н,д.). Приклад 3: 4-феніл-3-хлор-2хлорметилхіноліну гідроxлopид. C16H12Cl3N. М.r.=324,6; М.r.(ocнoви)=288,1; т.топл. 143-144°C; виxiд 80 %. Поелементний аналіз: вирахувано %(N)=4,31; %(Сl)=32,76, знайдено %(N)=4,30-4,32; %(Cl)=32,77-32,76. Мас-спектр, m/z: 288,0-290,0. ЯМР 1H (у ДМСО-d6), δ, м.ч.: 5,03(2Н,с.), 7,34(2Н,д.), 7,40(1Н,д.), 7,53-7,62(4Н-м.), 7,79(1Н,т.), 8,09(1Н,д.). Приклад 4: 9-метил-4-хлоро-1,2,3,4,тетрагідроакрідину гідрохлорид. С14Н15Cl2N. М.r.=268,2; М.r.(основи)=231,7; т.топл. 114-115°C (лит. 115°C: Chem.Ber.,-1964,-vol 97,-р.16); вихід 75 %. Мас-спектр, m/z: 269,0-270,2. ЯМР 1H (у ДМСО-d6), δ, м.ч.: 2,13(1Н,ш.с), 2,26(1Н,м.), 2,38(2Н,с.), 2,80(3Н,с.), 2,90(1Н,м.), 3,21 (1Н,д.), 6,00(1Н,с.) 7,82(1Η,т.), 7,99(1Н,т.), 8,37(1Н,д.), 8,46(1Н,д.). Приклад 5: етил 4-фенил-2-хлорметил-3хінолінкарбоксілат гідрохлорид. С19Н17Cl2NО2. М.r.=362,3; М.r.(основи)=325,8; т.топл. 75°С (лит.75-76°С: Farmako,-1989,-νο1.44(6),-ρ.555-564); вихід 93%. Мас-спектр, m/z: 250,0-252,0. ЯМР 1H (у ДМСО-d6), δ, м.ч.: 0.89(3Н,т.-ОСН2СН3), 3,99(2Н,к.ОСН2СН3), 5,00(2Н,с.), 7,34(2Н,д.), 7,537,60(5Н,м.), 7,84(1Н,м.), 8,11(1Н,д.). Приклад 6: етил 4-фенил-6-хлор-2-хлорметил3-хінолінкарбоксілат гідрохлорид. С19Н16Cl3NО2. М.r.=396,7; М.r.(основи)=360,2; т.топл. 108-109°С (лит. 107-108°С: Farmako,-1989,- νо1.44(6),-р.555564); вихід 87 %. Мас-спектр, m/z: 360,0-362,0. ЯМР 1H (у ДМСО-d6), δ, м.ч.: 0,89(3Н,т.- ОСН2СН3), 4,00(2Н,к- ОСН2СН3), 4,96(2Н,с.), 7,34(2Н,д ), 7,50(1Н,с.), 7,56-7,57(3Н,м.), 7,82(1Н,д.),8,12(1Н,д.). Приклад 7: метил 4-метил-2-хлорметил-3хінолінкарбоксілат гідрохлорид. С13Н13Cl2NО2. М.r.=286,2; M.r.(ocнoви)=249,7; т.тoпл. l490C; виxiд 79 %. Поелементний аналіз: вирахувано %(N)=:4,89; %(Cl)=24,78, знaйдeнo %(N)=4,87-4,90; %(Cl)=24,76-24,79. Мас-спектр, m/z: 326,0-328,0. ЯМР 1H (у ДМСО-d6), δ, м.ч.: 2,72(3Н,с.), 4,00(3Н.с„—ОСН3), 4,91(2Н,с.), 7,71(1Н,т.), 7,84(1Н,т.), 8,03(1Н,д.), 8,19(1Н,д.). Приклад 8: 4-фенил-3,6-дихлор-2хлорметилхіноліну гідрохлорид. С16Н11Cl4N. М.r.=359,1; М.r.(основи)=322,6; т.топл. 122-123°С; вихід 83,8 %. Поелементний аналіз: вирахувано %(N)=3,90; %(Cl)=39,49, знaйдeнo %(N)=3,89-3,92; %(Сl)=39,48-39,50. Мас-спектр, m/z:. ЯМР 1H (у ДМСО-d6), δ, м.ч.: 5,02(2Н,с.), 7,29(1Н,с.), 7,34(2Н,д.), 7,61(3Н,м.), 7,76(1Н,д.), 8,10(1 Н,с.). Приклад 9: 9-фенил-4-хлор-1,2,3,4,тетрагідроакрідину гідрохлорид. С19Н17Cl2N. М.r.=330,3; М.r. (основи)=293,8; т.топл. 182-183°С; вихід 76 %. Поелементний аналіз: вирахувано %(N)=4,24; %(Сl)=21,47, знайдено %(N)=4,22-4,24; %(Cl)=21,46-21,45. Мас-спектр, m/z:. 330,0-332,0. 7 ЯМР 1H (у ДМСО-d6), δ, м.ч.: 1,91(1Н,ш.с.), 2,14(1Н.ш.с.), 2,50(2Н,с.), 2,73(2Н,м.), 5,91(1Н,с.), 7,25(1Н,д.), 7,39(2Н,д.), 7,59(4Н,м.), 7,89(1Н,т.), 8,38(1Н,д.). Приклад 10: 9-фенил-4,7-дихлор-1,2,3,4,тетрагідроакрідину гідрохлорид. С19Н16Cl3N. М.r.=364,7; M.r.(ocнoви)=328,2; т.тoпл. 171-172°C; виxiд 77,6 %. Поелементний аналіз: вирахувано %(N)=3,84; %(Cl)=29,16, знaйдeнo %(N)=3,82-3,83; %(Cl)=29,14-29,16. Мас-спектр, m/z:. 365,3-366,0. ЯМР 1H (у ДМСО-d6), δ, м.ч.: 1,87(1Н,м.), 2,14(1Н,м.), 2,37(2Н,м.), 2,66(2н,м.), 5,59(1Н,с.), 7,21(1Н,с.), 7,31(2Н,д.), 7,58(3Н,м.), 7,67(1Н,д.), 8,08(1Н,д.). Таким чином, результатом винаходу є спрощення синтезу 2-хлоралкілхінолінів загальної формули 1 та підвищення виходу продукту за рахунок застосування нової методики з використанням триметилхлорсилану. 81188 8
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 3,4,6-substituted 2-chloroalkylquinoline
Автори англійськоюVolovenko Yulian Mykhailovych, Volovenko Yulian Mykchaylovich, Tolmachov Andrii Oleksiiovych, Dehtiarenko Oleksii Serhiiovych
Назва патенту російськоюСпособ получения 3,4,6-замещенного 2-хлоралкилхинолина
Автори російськоюВоловенко Юлиан Михайлович, Толмачев Андрей Алексеевич, Дегтяренко Алексей Сергеевич
МПК / Мітки
МПК: C07D 215/00, C07D 219/00
Мітки: 2-хлоралкілхіноліну, 3,4,6-заміщеного, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/4-81188-sposib-oderzhannya-346-zamishhenogo-2-khloralkilkhinolinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 3,4,6-заміщеного 2-хлоралкілхіноліну</a>
Попередній патент: Ортез на колінний суглоб
Випадковий патент: Спосіб визначення міцності та подовження натуральних ковбасних оболонок








