Протипухлинні аналоги пептидів, спосіб їх одержання та фармацевтична композиція на їх основі
Номер патенту: 104281
Опубліковано: 27.01.2014
Автори: Дігон Хуарес Ісабель, Родрігес Вісенте Альберто, Гаррансо Гарсіа-Ібаррола Марія, Мурсія Перес Кармен, Куевас Марчанте Марія дель Кармен, Санчес Санчо Франсіско, Матео Урбано Крістіна
Формула / Реферат
1. Сполука загальної формули
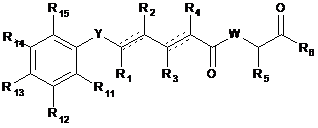 , (I)
, (I)
де Y вибраний з -CRay=CRby- і -CHRay-CRby=CRcy-;
кожний Ray, Rby і Rcy незалежно вибраний з атома водню і заміщеного або незаміщеного С1-С12алкілу;
кожний R1, R2, R3, R4 і R5 незалежно вибраний з атома водню і заміщеного або незаміщеного С1-С12алкілу;
R6 вибраний з NR8R9 і OR10;
W вибраний з О і NR7;
R7 вибраний з атома водню;
R8 вибраний з атома водню;
R10 вибраний з атома водню і заміщеного або незаміщеного С2-С12алкенілу;
кожна пунктирна лінія представляє необов'язковий додатковий зв'язок, при умові, що є один або більше додаткових зв'язків, але, якщо є потрійний зв'язок між атомами С, до яких приєднані R1 і R2, то R1 і R2 відсутні, і, якщо є потрійний зв'язок між атомами С, до яких приєднані R3 і R4, то R3 і R4 відсутні;
R9 являє собою заміщений або незаміщений С2-С12алкеніл;
кожний з R11, R12, R13, R14 і R15 незалежно вибраний з атома водню, ORa, OCORa і OSiRaRbRc; і
кожний Ra, Rb і Rc незалежно вибраний з атома водню і заміщеного або незаміщеного С1-С12алкілу;
або її фармацевтично прийнятна сіль, таутомер або стереоізомер, і
де вищезгадана заміщена група заміщена в одному або більше доступних положеннях однією або більше придатними групами, які вибрані з OR', =O, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галогену, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', захищеного ОН, С1-С12алкілу, С2-С12алкенілу, С2-С12алкінілу, С6-С18арилу і гетероциклічної групи, кожна з R' груп необов'язково вибрана з групи, що складається з водню, ОН, NO2, NH2, SH, CN, галогену, С1-С12алкілу, С2-С12алкенілу, С2-С12алкінілу, С6-С18арилу і гетероциклічної групи;
причому гетероциклічні групи являють собою 1-3 окремих або конденсованих кільця, що включають 5-18 атомів в кільці, і один, два або три гетероатоми, що вибрані з N, О або S.
2. Сполука за п. 1, де R1, R2, R3 і R4 незалежно вибрані з атома водню і заміщеного або незаміщеного С1-С6алкілу.
3. Сполука за п. 2, де R1, R2, R3 і R4 означають атом водню.
4. Сполука за будь-яким з пп. 1, 2 або 3, де R11, R14 і R15 означають атом водню.
5. Сполука за будь-яким з пп. 1-3, де Y вибраний з -CRay=CRby- і -CHRay-CRby=CRcy- і де Ray, Rby і Rcy незалежно вибрані з атома водню і заміщеного або незаміщеного C1-С6алкілу.
6. Сполука за п. 5, де Ray, Rby і Rcy незалежно вибрані з атома водню і метилу.
7. Сполука за будь-яким з пп. 1-3, де R12 і R13 незалежно вибрані з атома водню, ORa і OSiRaRbRc і де Ra, Rb і Rc незалежно вибрані з атома водню і заміщеного або незаміщеного С1-С6алкілу.
8. Сполука за п. 7, де R12 вибраний з атома водню і ORa.
9. Сполука за п. 7, де Ra, Rb і Rc незалежно вибрані з атома водню, заміщеного або незаміщеного метилу, заміщеного або незаміщеного етилу, заміщеного або незаміщеного пропілу, заміщеного або незаміщеного ізопропілу, заміщеного або незаміщеного трет-бутилу.
10. Сполука за будь-яким з пп. 1-3, де R5 вибраний з атома водню і заміщеного або незаміщеного C1-С6алкілу.
11. Сполука за п. 10, де R5 вибраний з метилу, ізопропілу і трет-бутилу.
12. Сполука за будь-яким з пп. 1-3, де W означає NR7 і де R7 такий, як визначено в п. 1.
13. Сполука за будь-яким з пп. 1-3, де R6 означає NR8R9 і де R8 і R9 визначені в п. 1.
14. Сполука за п. 13, де R9 означає заміщений С2-С12алкеніл, який заміщений в одному або більше положеннях галогеном, OR', =О, OCOR', OCONНR', OCONR'R', CONHR', CONR'R' і захищеною ОН, де кожна з груп R' незалежно вибрана з атома водню, заміщеного або незаміщеного С1-С12алкілу, заміщеного або незаміщеного С2-С12алкенілу, заміщеного або незаміщеного С2-С12алкінілу і заміщеного або незаміщеного арилу.
15. Сполука за будь-яким з пп. 1-3, де присутній один додатковий зв'язок між атомами С, до яких приєднані R1 і R2, і присутній інший додатковий зв'язок між атомами С, до яких приєднані R3 і R4.
16. Сполука за п. 11, що вибрана з групи:
 ,
,
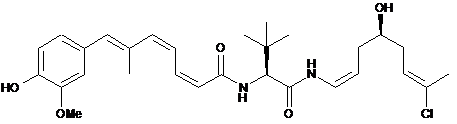 ,
,
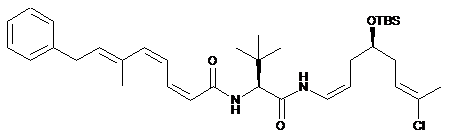 ,
,
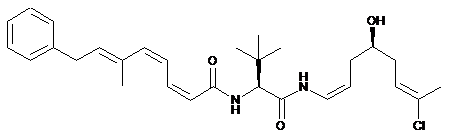 ,
,
 ,
,
 ,
,
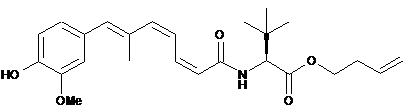 ,
,
 ,
,
 ,
,
 ,
,
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
17. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-16 або її фармацевтично прийнятну сіль, таутомер або стереоізомер і фармацевтично прийнятний розріджувач або носій.
18. Сполука за будь-яким з пп. 1-16 або її фармацевтично прийнятна сіль, таутомер або стереоізомер для застосування як лікарського засобу.
19. Композиція за п. 17, яка використовується як лікарський засіб.
20. Сполука за будь-яким з пп. 1-16 або її фармацевтично прийнятна сіль, таутомер або стереоізомер для застосування при лікуванні раку.
21. Композиція за п. 17 для застосування при лікуванні раку.
22. Застосування сполуки за будь-яким з пп. 1-16 або її фармацевтично прийнятних солей, таутомерів або стереоізомерів в одержанні лікарського засобу, призначеного для лікування раку.
23. Застосування композиції за п. 17 для одержання лікарського засобу, призначеного для лікування раку.
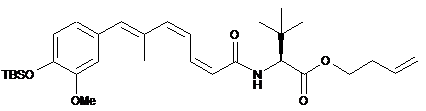
24. Спосіб одержання сполук формули І
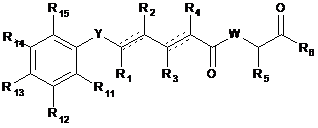 ,
,
як визначено за будь-яким з пп. 1-16, де Y, W і R1, R2, R3, R4, R5, R6, R11, R12, R13, R14 і R15 визначені в будь-якому з пп. 1-16,
який полягає в тому, що Фрагмент С піддають взаємодії з Фрагментом D
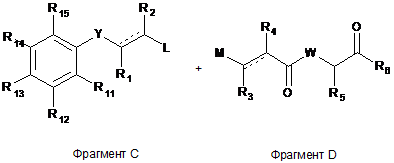 ,
,
де Y, W і R1, R2, R3, R4, R5, R6, R11, R12, R13, R14 і R15 мають значення, як для сполук формули І за будь-яким з пп. 1-16,
або відповідною захисною групою, якщо необхідно, і L і М є відповідними реакційноздатними або відхідними групами.
25. Спосіб за п. 24, де сполука формули І є будь-якою сполукою, визначеною в п. 16.
26. Спосіб одержання сполуки формули І
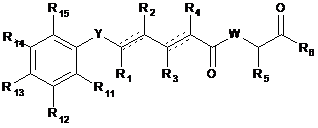 ,
,
як визначено за будь-яким з пп. 1-16, де Y, W і R1, R2, R3, R4, R5, R6, R11, R12, R13, R14 і R15 визначені в будь-якому з пп. 1-16,
який полягає в тому, що Фрагмент А піддають взаємодії з Фрагментом В
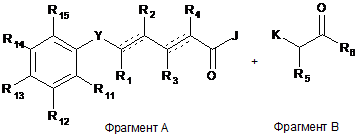 ,
,
де Y і R1, R2, R3, R4, R5, R6, R11, R12, R13, R14 і R15 мають значення, як для сполук формули І за будь-яким з пп. 1-16,
або відповідною захисною групою, якщо необхідно, і J і K є відповідними реакційноздатними або відхідними групами.
27. Спосіб за п. 26, де сполука формули І являє собою будь-яку сполуку за п. 16.
Текст
Реферат: Сполука загальної формули (І), де R11, R12, R13, R14, R15, W, Y, R1, R2, R3, R4, R5 і R6 мають різні значення, для застосування при лікуванні раку. UA 104281 C2 (12) UA 104281 C2 R 15 R2 R 14 R 11 O Y R 13 R4 R 12 W R1 R3 O R6 R5 . (I) UA 104281 C2 5 ОПИС ГАЛУЗЬ ВИНАХОДУ Даний винахід стосується нових протипухлинних сполук, фармацевтичних композицій, що містять їх, і їх застосування як протипухлинних агентів. ПЕРЕДУМОВИ ВИНАХОДУ У роботі 1990 Gunasekera SP et al. повідомляється про виділення нового полігідроксильованого лактону (+)-дискодермоліду з глибоководної карибської губки Discodermia dissoluta (Gunasekera SP et al., J. Org. Chem. 1990, 55, 4912-4915, і J. Org. Chem. 1991, 56, 1346). 10 (+)-Дискодермолід 15 20 25 Було виявлено, що ця сполука є сильнодіючим антимітотичним агентом (Hung DT et al. Chem. Biol. 1996, 3, 287-293 і ter Haar Е et al. Biochemistry 1996, 35, 243-250), спосіб дії якої аналогічний способу дії клінічно доведеного протиракового агенту паклітакселу (Schiff PB et al. Nature 1979, 277, 665-667). Обидва природних продукти затримують клітинний цикл на фазі M, промотують утворення мікротрубочок і мають аналогічні інгібуючі ефекти проти злоякісної карциноми молочної залози (IC50 2,4 нМ і 2,1 нМ, відповідно). З іншого боку, виділені деякі рідкі лінійні дипептиди, що містять N-ациленамідну функціональність, з міксобактерій, що належать роду Chondromyces (Kunze В et al., J. Antibiot. 1994, 47, 881-886 і Jansen R et al., J. Org. Chem. 1999, 1085-1089). Конкретно, ці сполуки являють собою крокацини А, В, С і D і утворюють групу інгібіторів транспорту електронів. Крокацин А, R=Me Крокацин В, R=Н Крокацин С 30 35 Крокацин D Крокацини A-D помірно інгібують ріст деяких грам-позитивних бактерій і є сильнодіючими інгібіторами тваринних клітинних культур і деяких дріжджів і грибів. Найбільш активним є крокацин D, який демонструє MIC 1,4 нг/мл проти гриба Saccharomyces cerevisiae і сильну токсичність (IC50 0,06 мг/л) відносно культури мишачих фібробластних клітин L929. У роботах Gudasheva et al. (Russian Journal of Bioorganic Chemistry, 2007, 44(4), 413-420 і Pharmaceutical Chemistry Journal, 2006, 40(7), 367-372) повідомляється про модель дипептидних сполук на основі структури ендогенного тетрапептиду холесцистокініну-4 (CCK-4). У цьому 1 UA 104281 C2 відношенні, розкрито, що похідні L-триптофану демонструють анксіолітичні властивості, і похідні D-триптофану демонструють анксіогенні властивості. Дві розкритих Gudasheva et al. дипептидних сполуки являють собою наступні: , 5 Сполука R , Сполука U 10 і як проміжні продукти в синтезі сполук R і U розкриті наступні сполуки: , Сполука S , 15 Сполука Т , Сполука V 2 UA 104281 C2 5 Рак є головною причиною смерті тварин і людей. Величезні зусилля робилися і все ще робляться для одержання протипухлинного агента, активного і безпечного для введення пацієнтам, що страждають на рак. Проблемою, яку повинен вирішити даний винахід, є створення сполук, які придатні при лікуванні раку. КОРОТКИЙ ЗМІСТ ВИНАХОДУ В одному аспекті даний винахід стосується сполук загальної формули I або їх фармацевтично прийнятних солей, таутомерів, проліків або стереоізомерів. , 10 15 20 25 30 35 де Y вибраний з -CHRay-, -CHRay-CHRby-, -CRay=CRby-, -CC-, -CHRay-CHRby-CHRcy-, -CHRayCRby=CRcy- і -CHRay-CС-; кожний Ray, Rby і Rcy незалежно вибраний з атома водню, заміщеного або незаміщеного C1C12 алкілу, заміщеного або незаміщеного C 2-C12 алкенілу і заміщеного або незаміщеного C2C12алкінілу; кожний R1, R2, R3, R4 і R5 незалежно вибраний з атома водню, заміщеного або незаміщеного C1-C12 алкілу, заміщеного або незаміщеного C2-C12 алкенілу і заміщеного або незаміщеного C2C12алкінілу; R6 вибраний з NR8R9 і OR10; W вибраний з О і NR7; R7 вибраний з атома водню, CORa, COORa, заміщеного або незаміщеного C1-C12 алкілу, заміщеного або незаміщеного C2-C12 алкенілу і заміщеного або незаміщеного C2-C12алкінілу; або R7 і R5 разом з відповідними атомами N і С, до яких вони приєднані, можуть утворювати заміщену або незаміщену гетероциклічну групу; R8 вибраний з атома водню, CORa, COORa, заміщеного або незаміщеного C2-C12алкенілу, заміщеного або незаміщеного C2-C12алкінілу і заміщеного або незаміщеного C4-C12алкенінілу; R10 вибраний з атома водню, заміщеного або незаміщеного C2-C12 алкенілу і заміщеного або незаміщеного C2-C12алкінілу; кожна пунктирна лінія представляє необов'язковий додатковий зв'язок при умові, що присутній один або більше додаткових зв'язків, але коли є потрійний зв'язок між атомами С, до яких приєднані R1 і R2, то R1 і R2 відсутні, і якщо є потрійний зв'язок між атомами С, до яких приєднані R3 і R4, то R3 і R4 відсутні; R9 вибраний з атома водню, CORa, COORa, заміщеного або незаміщеного C2-C12алкенілу, заміщеного або незаміщеного C2-C12алкінілу і заміщеного або незаміщеного C4-C12алкенінілу; 3 UA 104281 C2 5 10 15 20 25 30 35 40 45 50 55 кожний R11, R12, R13, R14 і R15 незалежно вибраний з наступних груп: атом водню, галоген, ORa, CORa, COORa, OCORa, OCOORa, OCONRaRb, CONRaRb, OS(О)Ra, OSO2Ra, OP(О)(Ra)ORb, OSiRaRbRc, NRaRb, NRaCORb, NRaCONRaRb, NRaS(О)Rb, NRaSO2Rb, NRaC(=NRa)NRaRb, SRa, S(О)Ra, SO2Ra, S(О)NRaRb, SO2NRaRb, S(О)ORa, SO2ORa, заміщений або незаміщений C1C12алкіл, заміщений або незаміщений C2-C12алкеніл і заміщений або незаміщений C2-C12 алкініл; і кожний Ra, Rb і Rc незалежно вибраний з наступних груп: атом водню, заміщений або незаміщений C1-C12 алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2C12алкініл, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група. В іншому аспекті даний винахід також стосується сполуки формули I або її фармацевтично прийнятної солі, таутомеру, проліків або стереоізомеру для застосування як лікарського засобу. В іншому аспекті даний винахід також стосується сполуки формули I або її фармацевтично прийнятної солі, таутомеру, проліків або стереоізомеру для застосування як лікарського засобу для лікування раку. Ще в одному аспекті даний винахід також стосується застосування сполук формули I або їх фармацевтично прийнятних солей, таутомерів, проліків або стереоізомерів при лікуванні раку або при одержанні лікарського засобу для лікування раку. Інші аспекти даного винаходу стосуються способів лікування і сполук для застосування в цих способах. Таким чином, даний винахід також стосується способу лікування будь-якого ссавця, особливо, людини, що страждаючої від раку, який включає введення індивідууму, що страждає, терапевтично ефективної кількості сполуки формули I або її фармацевтично прийнятної солі, таутомеру, проліків або стереоізомеру. Ще в одному аспекті даний винахід також стосується сполуки формули I або її фармацевтично прийнятної солі, таутомеру, проліків або стереоізомеру для застосування як протиракового агента. В іншому аспекті даний винахід стосується фармацевтичних композицій, що містять сполуку формули I або її фармацевтично прийнятну сіль, таутомер, проліки або стереоізомер разом з фармацевтично прийнятним носієм або розріджувачем. ДОКЛАДНИЙ ОПИС ПЕРЕВАЖНИХ ВАРІАНТІВ Даний винахід стосується сполук загальної формули I, які визначені вище. У цих сполуках групи можуть бути вибрані згідно з наступною вказівкою: алкільні групи можуть бути розгалуженими або нерозгалуженими і переважно мають від 1 до приблизно 12 атомів вуглецю. Один більш переважний клас алкільних груп має від 1 до приблизно 6 атомів вуглецю. Ще більш переважні алкільні групи, що мають 1, 2, 3 або 4 атомів вуглецю. Особливо переважними алкільними групами в сполуках за даним винаходом є метил, етил, пропіл, ізопропіл і бутил, в тому числі трет-бутил, втор-бутил і ізобутил. Інший переважний клас алкільних груп має від 6 до приблизно 10 атомів вуглецю; і ще більш переважно 7, 8 або 9 атомів вуглецю. Найбільш переважними алкільними групами цього класу є гептил, октил і ноніл. Переважні алкенільні і алкінільні групи в сполуках за даним винаходом можуть бути розгалуженими або нерозгалуженими і мають один або більше ненасичених зв'язків і від 2 до приблизно 12 атомів вуглецю. Один більш переважний клас алкенільних і алкінільних груп має від 2 до приблизно 6 атомів вуглецю. Ще більш переважні алкенільні і алкінільні групи, що мають 2, 3 або 4 атоми вуглецю. Інший переважний клас алкенільних і алкінільних груп має від 4 до приблизно 10 атомів вуглецю, більш переважно від 6 до приблизно 10 атомів вуглецю; і ще більш переважно 7, 8 або 9 атомів вуглецю. Заявники визначають алкенінільну групу як алкільну групу, що містить один або більше подвійних зв'язків і один або більше потрійних зв'язків, і переважними алкенінільними групами є групи, що мають від 4 до приблизно 12 атомів вуглецю. Один більш переважний клас алкенінільних груп має від 6 до приблизно 10 атомів вуглецю. Прийнятні арильні групи в сполуках за даним винаходом включають сполуки з одним або декількома циклами, в тому числі сполуки з декількома циклами, які містять окремі і/або конденсовані арильні групи. Типові арильні групи містять від 1 до 3 окремих або конденсованих циклів і від 6 до приблизно 18 кільцевих атомів вуглецю. Переважно, якщо арильні групи містять від 6 до приблизно 10 кільцевих атомів вуглецю. Особливо переважні арильні групи включають заміщений або незаміщений феніл, заміщений або незаміщений нафтил, заміщений або незаміщений біфеніл, заміщений або незаміщений фенантрил і заміщений або незаміщений антрил. 4 UA 104281 C2 5 10 15 20 25 30 35 40 45 50 55 60 Прийнятні гетероциклічні групи включають гетероароматичні і гетероаліциклічні групи, що містять від 1 до 3 окремих або конденсованих циклів і від 5 до приблизно 18 кільцевих атомів. Переважно, якщо гетероароматичні і гетероаліциклічні групи містять від 5 до приблизно 10 кільцевих атомів, найбільш переважно 5, 6 або 7 кільцевих атомів. Прийнятні гетероароматичні групи в сполуках за даним винаходом містять один, два або три гетероатоми, вибрані з атомів N, О або S, і включають, наприклад, кумариніл, в тому числі 8-кумариніл, хіноліл, в тому числі 8-хіноліл, ізохіноліл, піридил, піразиніл, піразоліл, піримідиніл, фурил, піроліл, тієніл, тіазоліл, ізотіазоліл, триазоліл, тетразоліл, ізоксазоліл, оксазоліл, імідазоліл, індоліл, ізоіндоліл, індазоліл, індолізиніл, фталазиніл, птеридиніл, пуриніл, оксадіазоліл, тіадіазоліл, фуразаніл, піридазиніл, триазиніл, цинолініл, бензімідазоліл, бензофураніл, бензофуразаніл, бензотіофеніл, бензотіазоліл, бензоксазоліл, хіназолініл, хіноксалініл, нафтиридиніл і фуропіридил. Прийнятні гетероаліциклічні групи в сполуках за даним винаходом містять один, два або три гетероатоми, вибрані з атомів N, О або S і включають, наприклад, піролідиніл, тетрагідрофураніл, дигідрофураніл, тетрагідротієніл, тетрагідротіопіраніл, піперидил, морфолініл, тіоморфолініл, тіоксаніл, піперазиніл, азетидиніл, оксетаніл, тієтаніл, гомопіперидил, оксепаніл, тієпаніл, оксазепініл, діазепініл, тіазепініл, 1,2,3,6-тетрагідропіридил, 2-піролініл, 3-піролініл, індолініл, 2H-піраніл, 4H-піраніл, діоксаніл, 1,3-діоксоланіл, піразолініл, дитіаніл, дитіоланіл, дигідропіраніл, дигідротієніл, дигідрофураніл, піразолідиніл, імідазолініл, імідазолідиніл, 3-азабіцикло[3.1.0]гексил, 3-азабіцикло[4.1.0]гептил, 3H-індоліл і хінолізиніл. Групи, що згадуються вище, можуть бути заміщеними по одному або більшій кількості доступних положень однією або великою кількістю прийнятних груп, таких як OR', =О, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', захищена OH, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожна з груп R' незалежно вибрана з групи, що включає атом водню, OH, NO2, NH2, SH, CN, галоген, COH, COалкіл, CO 2H, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12 алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. У тих випадках, коли самі такі групи є заміщеними, замісники можуть бути вибрані з наведеного вище списку. Прийнятні галогенові замісники в сполуках за даним винаходом включають F, Cl, Br і I. Прийнятні захисні групи для OH добре відомі фахівцям в даній галузі. Широкий огляд захисних груп в органічній хімії даний Wuts, PGM і Greene TW в роботах Protecting Groups in Organic Synthesis, 4-те видання, Wiley-Interscience, і Kocienski PJ в Protecting Groups, 3-тє видання, Georg Thieme Verlag. У цих роботах наведені розділи по захисних групах для OH. Всі ці роботи включені у вигляді посилань у всій своїй повноті. Приклади таких захищених OH включають простий ефір, силілові прості ефіри, складні ефіри, сульфонати, сульфенати і сульфінати, карбонати і карбамати. У разі простого ефіру захисна група для OH може бути вибрана з наступних груп: метил, метоксиметил, метилтіометил, (фенілдиметилсиліл)метоксиметил, бензилоксиметил, п-метоксибензилоксиметил, (3,4диметоксибензил)[окси]метил, п-нітробензилоксиметил, о-нітробензилоксиметил, [(R)-1-(2нітрофеніл)етокси]метил, (4-метоксифенокси)метил, гваяколметил, (парафенілфеніл)[окси]метил, трет-бутоксиметил, 4-пентенілоксиметил, силоксиметил, 2метоксіетоксиметил, 2-ціаноетоксиметил, біс(2-хлоретокси)метил, 2,2,2-трихлоретоксиметил, 2(триметилсиліл)етоксиметил, метоксиметил, о-біс(2-ацетоксіетокси)метил, тетрагідропіраніл, фтористий тетрагідропіраніл, 3-бромтетрагідропіраніл, тетрагідротіопіраніл, 1метоксициклогексил, 4-метокситетрагідропіраніл, 4-метокситетрагідротіопіраніл, 4метокситетрагідротіопіраніл S,S-діоксид, 1-[{2-хлор-4-метил)феніл]-4-метоксипіперидин-4-іл, 1(2-фторфеніл)-4-метоксипіперидин-4-іл, 1-(4-хлорфеніл)-4-метоксипіперидин-4-іл, 1,4-діоксан-2іл, тетрагідрофураніл, тетрагідротіофураніл, 2,3,3a,4,5,6,7,7а-октагідро-7,8,8-триметил-4,7метанобензофуран-2-іл, 1-етоксіетил, 1-(2-хлоретоксі)етил, 2-гідроксіетил, 2-брометил, 1-[2(триметилсиліл)етоксі]етил, 1-метил-1-метоксіетил, 1-метил-1-бензилоксіетил, 1-метил-1бензилокси-2-фторетил, 1-метил-1-феноксіетил, 2,2,2-трихлоретил, 1,1-діанізил-2,2,2трихлоретил, 1,1,1,3,3,3-гексафтор-2-фенілізопропіл, 1-(2-ціаноетоксі)етил, 2триметилсилілетил, 2-(бензилтіо)етил, 2-фенілселенілетил, трет-бутил, циклогексил, 1-метил1'-циклопропілметил, аліл, преніл, цинаміл, 2-феналіл, пропаргіл, п-хлорфеніл, п-метоксифеніл, п-нітрофеніл, 2,4-динітрофеніл, 2,3,5,6-тетрафтор-4-(трифторметил)феніл, бензил, пметоксибензил, 3,4-диметоксибензил, 2,6-диметоксибензил, о-нітробензил, п-нітробензил, пентадієнілнітробензил, пентадієнілнітропіпероніл, галогенбензил, 2,6-дихлорбензил, 2,4 5 UA 104281 C2 5 10 15 20 25 30 35 40 45 50 55 60 дихлорбензил, 2,6-дифторбензил, п-ціанобензил, фтористий бензил, 4-фторалкоксибензил, триметилсилілоксиліл, п-фенілбензил, 2-феніл-2-пропіл, п-ациламінобензил, п-азидобензил, 4азидо-3-хлорбензил, 2-трифторметилбензил, 4-трифторметилбензил, п(метилсульфініл)бензил, п-силетанілбензил, 4-ацетоксибензил, 4-(2триметилсиліл)етоксиметоксибензил, 2-нафтилметил, 2-піколіл, 4-піколіл, 3-метил-2-піколіл Nоксидо, 2-хінолінілметил, 6-метокси-2-(4-метилфеніл-4-хінолінметил, 1-піренілметил, дифенілметил, 4-метоксидифенілметил, 4-фенілдифенілметил, п,п'-динітробензгідрил, 5дибензосуберил, трифенілметил, трис(4-трет-бутилфеніл)метил, α-нафтилдифенілметил, пметоксифенілдифенілметил, ди(п-метоксифеніл)фенілметил, три(п-метоксифеніл)метил, 4-(4'бромфенацилокси)фенілдифенілметил, 4,4',4"-трис(4,5-дихлорфталімідофеніл)метил, 4,4',4"трис(левуліноїлоксифеніл)метил, 4,4',4"-трис(бензоїлоксифеніл)метил, 4,4'-диметокси-3"-[N(імідазолілметил)]тритил, 4,4'-диметокси-3"-[N-(імідазолілетил)карбамоїл]тритил, біс(4метоксифеніл)-1'-піренілметил, 4-(17-тетрабензо[a,с,g,i]флуоренілметил)-4,4"-диметокситритил, 9-антрил, 9-(9-феніл)ксантеніл, 9-фенілтіоксантил, 9-(9-феніл-10-оксо)антрил, 1,3бензодитіолан-2-іл і 4,5-біс(етоксикарбоніл)-[1,3]-діоксолан-2-іл, бензізотіазоліл S,S-діоксидо. У разі силілових простих ефірів захисна група для OH може бути вибрана з наступних груп: триметилсиліл, триетилсиліл, триізопропілсиліл, диметилізопропілсиліл, діетилізопропілсиліл, диметилгексилсиліл, 2-норборнілдиметилсиліл, трет-бутилдиметилсиліл, третбутилдифенілсиліл, трибензилсиліл, три-п-ксилілсиліл, трифенілсиліл, дифенілметилсиліл, дитрет-бутилметилсиліл, біс(трет-бутил)-1-піренілметоксисиліл, трис(триметилсиліл)силіл, (2гідроксистирил)диметилсиліл, (2-гідроксистирил)діізопропілсиліл, трет-бутилметоксифенілсиліл, трет-бутоксидифенілсиліл, 1,1,3,3-тетраізопропіл-3-[2-(трифенілметоксі)етокси]дисилоксан-1-іл і фторсиліл. У разі складного ефіру захисна група для OH може бути вибрана з наступних груп: форміат, бензоїлформіат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трихлорацетамідат, трифторацетат, метоксіацетат, трифенілметоксіацетат, феноксіацетат, пхлорфеноксіацетат, фенілацетат, дифенілацетат, 3-фенілпропіонат, бісфторпропаноїл, 4пентеноат, 4-оксопентаноат, 4,4-(етилендитіо)пентаноат, 5-[3-біс(4метоксифеніл)гідроксиметилфенокси]левулінат, півалоат, 1-адамантоат, кротонат, 4метоксикротонат, бензоат, п-фенілбензоат, 2,4,6-триметилбензоат, 4-бромбензоат, 2,5дифторбензоат, п-нітробензоат, піколінат, нікотинат, 2-(азидометил)бензоат, 4-азидобутират, (2-азидометил)фенілацетат, 2-{(тритилтіо)[окси]метил}бензоат, 2-{(4метокситритилтіо)[окси]метил}бензоат, 2-{[метил(тритилтіо)аміно]метил}бензоат, 2-{{(4метокситритил)[тіо]метиламіно}метил}бензоат, 2-(алілокси)фенілацетат, 2(пренілоксиметил)бензоат, 6-(левулінілоксиметил)-3-метокси-2-нітробензоат, 6(левулінілоксиметил)-3-метокси-4-нітробензоат, 4-бензилоксибутират, 4триалкілсилілоксибутират, 4-ацетокси-2,2-диметилбутират, 2,2-диметил-4-пентеноат, 2йодбензоат, 4-нітро-4-метилпентаноат, о-(дибромметил)бензоат, 2-формілбензолсульфонат, 4(метилтіометокси)бутират, 2-(метилтіометоксиметил)бензоат, 2-(хлорацетоксиметил)бензоат, 2[(2-хлорацетоксі)етил]бензоат, 2-[2-(бензилоксі)етил]бензоат, 2-[2-(4метоксибензилоксі)етил]бензоат, 2,6-дихлор-4-метилфеноксіацетат, 2,6-дихлор-4-(1,1,3,3тетраметилбутил)феноксіацетат, 2,4-біс(1,1-диметилпропіл)феноксіацетат, хлордифенілацетат, ізобутират, моносукциноат, (Е)-2-метил-2-бутеноат, о-(метоксикарбоніл)бензоат, α-нафтоат, нітрат, алкіл N,N,N',N'-тетраметилфосфордіамідат і 2-хлорбензоат. У випадку сульфонатів, сульфенатів і сульфінатів захисна група для OH може бути вибрана з наступних груп: сульфат, алілсульфонат, метансульфонат, бензилсульфонат, тозилат, 2-[(4-нітрофеніл)етил]сульфонат, 2-трифторметилбензолсульфонат, 4-монометокситритилсульфенат, алкіл 2,4динітрофенілсульфенат, 2,2,5,5-тетраметилпіролідин-3-он-1-сульфінат, борат і диметилфосфінотіоліл. У випадку карбонатів захисна група для OH може бути вибрана з наступних груп: метилкарбонат, метоксиметилкарбонат, 9-флуоренілметилкарбонат, етилкарбонат, брометилкарбонат, 2-(метилтіометоксі)етилкарбонат, 2,2,2трихлоретилкарбонат, 1,1-диметил-2,2,2-трихлоретилкарбонат, 2-(триметилсиліл)етилкарбонат, 2-[диметил(2-нафтилметил)силіл]етилкарбонат, 2-(фенілсульфоніл)етилкарбонат, 2(трифенілфосфоніо)етилкарбонат, цис-[4-[[(метокситритил)сульфеніл)окси]тетрагідрофуран-3іл]оксикарбонат, ізобутилкарбонат, трет-бутилкарбонат, вінілкарбонат, алілкарбонат, цинамілкарбонат, пропаргілкарбонат, п-хлорфенілкарбонат, п-нітрофенілкарбонат, 4-етокси-1нафтилкарбонат, 6-бром-7-гідроксикумарин-4-ілметилкарбонат, бензилкарбонат, онітробензилкарбонат, п-нітробензилкарбонат, п-метоксибензилкарбонат, 3,4диметоксибензилкарбонат, антрахінон-2-ілметилкарбонат, 2-дансилетилкарбонат, 2-(4нітрофеніл)етилкарбонат, 2-(2,4-динітрофеніл)етилкарбонат, 2-(2-нітрофеніл)пропілкарбонат, алкіл 2-(3,4-метилендіокси-6-нітрофеніл)пропілкарбонат, 2-ціано-1-фенілетилкарбонат, 2-(2 6 UA 104281 C2 5 10 15 20 25 30 35 40 45 50 55 60 піридил)аміно-1-фенілетилкарбонат, 2-[N-метил-N-(2-піридил)]аміно-1-фенілетилкарбонат, фенацилкарбонат, 3',5'-диметоксибензоїнкарбонат, метилдитіокарбонат і S-бензилтіокарбонат. І у випадку карбаматів захисна група для OH може бути вибрана з диметилтіокарбамату, Nфенілкарбамату, N-метил-N-(о-нітрофеніл)карбамату. Згадування цих груп не слід інтерпретувати як обмеження галузі винаходу, оскільки вони згадуються тільки як ілюстрація захисних груп для OH, але фахівцям в даній галузі можуть бути відомі додаткові групи, що мають вказану функцію, і потрібно розуміти, що вони також включені в даний винахід. Вираз "фармацевтично прийнятні солі, проліки" стосується будь-якої фармацевтично прийнятної солі, складного ефіру, сольвату, гідрату або будь-якої іншої сполуки, яка після введення пацієнту здатна забезпечити (прямо або опосередковано) сполуку, яка тут описана. Однак потрібно брати до уваги, що солі, що не є фармацевтично прийнятними, також попадають в галузь винаходу, оскільки вони можуть бути корисні при одержанні фармацевтично прийнятних солей. Одержання солей і проліків можна здійснити способами, відомими в даній галузі. Наприклад, фармацевтично прийнятні солі наведених в описі сполук синтезують загальновідомими хімічними способами з вихідної сполуки, яка містить основний або кислотний фрагмент. Звичайно такі солі одержують, наприклад, взаємодією вільних кислотних або основних форм цих сполук із стехіометричною кількістю прийнятної основи або кислоти у воді або органічному розчиннику або в суміші обох розчинників. Звичайно переважними є неводні середовища, такі як ефір, етилацетат, етанол, ізопропанол або ацетонітрил. Приклади кислотно-адитивних солей включають адитивні солі мінеральних кислот, такі як, наприклад, гідрохлорид, гідробромід, гідройодид, сульфат, нітрат, фосфат і адитивні солі органічних кислот, такі як, наприклад, ацетат, трифторацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат і п-толуолсульфонат. Приклади адитивних солей лугів включають неорганічні солі, такі як, наприклад, солі натрію, калію, кальцію і амонію і органічні солі лугів, такі як, наприклад, солі етилендіаміну, етаноламіну, N,Nдіалкіленетаноламіну, триетаноламіну і основні солі амінокислот. Сполуки за винаходом можуть являти собою вільні сполуки або сольвати (наприклад, гідрати) в кристалічному виді, і передбачається, що обидві форми входять в галузь даного винаходу. Методи сольватації звичайно відомі в даній галузі. Будь-яка сполука, яка є проліками сполуки формули I, відповідає галузі і духу винаходу. Вираз "проліки", що використовується в даній заявці, визначений в описі як хімічна сполука, що зазнає хімічного перетворення, такого як заміщення або додавання додаткової хімічної групи, для зміни (з метою фармацевтичного застосування) деякої з її фізико-хімічних властивостей, таких як розчинність або біодоступність, наприклад, складноефірні і ефірні похідні активної сполуки, які дають активну сполуку як таку після введення суб'єкту. Приклади добре відомих способів одержання проліків даної діючої сполуки відомі фахівцям в даній галузі і можуть бути виявлені, наприклад, в роботі Krogsgaard-Larsen et al., Textbook of Drugdesign and Discovery, Taylor & Francis (April 2002). Передбачається, що будь-яка вказана в описі сполука являє собою таку специфічну сполуку, а також деякі її варіації і форми. Зокрема, вказані в описі сполуки можуть мати асиметричні центри і, отже, існувати в різних енантіомерних формах. Всі оптичні ізомери і стереоізомери сполук, що згадуються в описі, і їх суміші вважаються такими, що входять в галузь даного винаходу. Таким чином, передбачається, що будь-яка дана сполука, що згадується в описі, являє собою рацемат або одну або більше енантіомерних форм, одну або більше діастереомерних форм, одну або більше атропоізомерних форм або їх суміш. Зокрема, сполуки за даним винаходом, представлені описаною вище формулою I, можуть включати енантіомери, в залежності від їх асиметрії або діастереоізомери. Можлива також стереоізомерія навколо подвійного зв'язку, отже, в деяких випадках молекула може існувати у вигляді (Е)-ізомеру або {Z)-ізомеру. Якщо молекула містить декілька подвійних зв'язків, то кожний подвійний зв'язок буде мати власну стереоізомерію, яка може бути такою ж, як стереоізомерія інших подвійних зв'язків молекули, або відрізнятися. Окремі ізомери і суміші ізомерів потрапляють в галузь даного винаходу. Крім того, сполуки, що згадуються в описі, можуть існувати у вигляді геометричних ізомерів (наприклад, цис- і транс-ізомерів), таутомерів або атропоізомерів. Конкретно, вираз «таутомер» стосується одного з двох або більшої кількості структурних ізомерів сполуки, які існують в рівновазі і легко перетворюються з однієї ізомерної форми в іншу. Звичайними таутомерними парами є амін-імін, амід-імід, кето-енол, лактам-лактим та інш. Крім того, передбачається, що будь-яка сполука, що згадується в описі, являє собою гідрати, сольвати, поліморфи і їх суміші, якщо такі форми існують в середовищі. Крім того, сполуки, що 7 UA 104281 C2 5 10 15 20 25 30 35 40 45 50 55 згадуються в описі, можуть існувати у вигляді ізотопно мічених форм. Всі геометричні ізомери, таутомери, атропоізомери, гідрати, сольвати, поліморфи і ізотопно мічені форми сполук, що згадуються в описі, і їх суміші вважаються включеними в галузь даного винаходу. Для одержання більш короткого опису деякі дані в описі кількісні вирази не визначають з використанням виразу "приблизно". Чи використовується вираз "приблизно" явно чи ні, зрозуміло, що кожна дана в описі кількість, як вважається, означає фактично дане значення, а також наближення до такого даного значення, яке фахівець в даній галузі розумно має на увазі для такого даного значення (включаючи еквіваленти і наближення), виходячи з умов експерименту і/або вимірювання. У сполуках загальної формули I особливо переважними Y є -CHRay-, -CRay=CRby- і -CHRayCRby=CRcy-, де Ray, Rby і Rcy такі, як визначено вище. Особливо переважними Ray, Rby і Rcy є атом водню і заміщений або незаміщений C1-C12алкіл. Більш переважними Ray, Rby і Rcy є атом водню і заміщений або незаміщений C1-C6 алкіл, і ще більш переважні атом водню, заміщений або незаміщений метил, заміщений або незаміщений етил, заміщений або незаміщений пропіл, заміщений або незаміщений ізопропіл і заміщений або незаміщений бутил, в тому числі заміщений або незаміщений трет-бутил, заміщений або незаміщений ізобутил і заміщений або незаміщений втор-бутил. Переважними замісниками вказаних груп є OR', =О, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', захищена OH, заміщений або незаміщений C1-C12 алкіл, заміщений або незаміщений C2-C12 алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожна з груп R' незалежно вибрана з групи, що включає атом водню, OH, NO2, NH2, SH, CN, галоген, COH, COалкіл, COOH, заміщений або незаміщений C1-C12 алкіл, заміщений або незаміщений C2-C12 алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. У тих випадках, коли самі такі групи є заміщеними, замісники можуть бути вибрані з наведеного вище списку. Ще більш переважними замісниками груп, що згадуються вище, є OH, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, феніл, п-, м- або о-гідроксифеніл, індоліл, в тому числі 1-, 2- і 3-індоліл, і імідазоліл, в тому числі 4- і 5-імідазоліл. Атом водню і метил є найбільш переважними групами Ray, Rby і Rcy. Конкретно, якщо Y означає -CHRay-, то особливо переважним Ray є метил, якщо Y означає -CRay=CRby-, то особливо переважним Ray є атом водню і особливо переважний Rby є метил, і якщо Y означає -CHRay-CRby=CRcy-, то особливо переважним Ray є атом водню або метил, особливо переважним Rby є атом водню і особливо переважним Rcy є метил. Особливо переважними R1, R2, R3, R4 і R5 є атом водню і заміщений або незаміщений C1C12алкіл. Більш переважними R1, R2, R3, R4 і R5 є атом водню і заміщений або незаміщений C1C6 алкіл, і ще більш переважні атом водню, заміщений або незаміщений метил, заміщений або незаміщений етил, заміщений або незаміщений пропіл, заміщений або незаміщений ізопропіл і заміщений або незаміщений бутил, в тому числі заміщений або незаміщений трет-бутил, заміщений або незаміщений ізобутил і заміщений або незаміщений втор-бутил. Переважними замісниками вказаних груп є OR', =О, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', захищена OH, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12 алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожна з груп R' незалежно вибрана з групи, що включає атом водню, OH, NO2, NH2, SH, CN, галоген, COH, COалкіл, COOH, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. У тих випадках, коли самі такі групи є заміщеними, замісники можуть бути вибрані з наведеного вище списку. Ще більш переважними замісниками груп, що згадуються вище, є OH, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, феніл, п-, м- або о-гідроксифеніл, індоліл, в тому числі 1-, 2- і 3-індоліл і імідазоліл, в тому числі 4- і 5-імідазоліл. Атом водню, метил, ізопропіл, трет-бутил і бензил є найбільш переважними R1, R2, R3, R4 і R5 групами. Конкретно, особливо переважними R 1, R2, R3 і R4 є атоми водню і особливо переважними R5 є метил, ізопропіл і трет-бутил. Особливо переважним W є NR7, де R7 такий, як визначено раніше. Особливо переважними R7 є атом водню і заміщений або незаміщений C1-C12алкіл. Більш переважними R7 є атом водню і заміщений або незаміщений C1-C6алкіл; і ще більш переважні атом водню, метил, етил, пропіл, ізопропіл і бутил, в тому числі трет-бутил. Найбільш переважним є атом водню. 8 UA 104281 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому варіанті особливо переважно, якщо R7 і R5 разом з прийнятним атомом N і атомом С, до яких вони приєднані, утворюють заміщену або незаміщену гетероциклічну групу. У цьому відношенні переважною гетероциклічною групою є гетероаліциклічна група, що містить один, два або три гетероатоми, вибрані з атомів N, О або S, найбільш переважно один атом N, і що має від 5 до приблизно 10 кільцевих атомів, найбільш переважно 5, 6 або 7 кільцевих атомів. Найбільш переважною є піролідинова група. Особливо переважними R6 є NR8R9 і ОR10, де R8, R9 і R10 такі, як визначено вище, і ще більш переважним R6 є NR8R9. Особливо переважним R8 є атом водню. Особливо переважними R9 є атом водню, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл і заміщений або незаміщений C4-C12алкенініл. Переважний заміщений алкеніл, заміщений алкініл і заміщений алкенініл можуть представляти не тільки один, але два або більше замісників. Більш переважними алкенільними групами є групи, що мають від 6 до приблизно 10 атомів вуглецю; і ще більш переважно 7, 8 або 9 атомів вуглецю. Найбільш переважними алкенільними групами є окта-1,6-дієніл, окта-1,5-дієніл, окта1,4-дієніл, окта-1,3-дієніл, нона-1,7-дієніл, нона-1,6-дієніл, нона-1,5-дієніл, нона-1,4-дієніл, нона1,3-дієніл, гепта-1,5-дієніл, гепта-1,4-дієніл, гепта-1,3-дієніл. З іншого боку, більш переважними алкінільними групами є групи, що мають від 6 до приблизно 10 атомів вуглецю; і ще більш переважно 7, 8 або 9 атомів вуглецю. Найбільш переважними алкінільними групами є окт-7иніл, окт-6-иніл, окт-5-иніл, окт-4-иніл, окт-3-иніл, окт-2-иніл, окт-1-иніл, нон-8-ініл, нон-7-ініл, нон-6-ініл, нон-5-ініл, нон-4-ініл, нон-3-ініл, нон-2-ініл, нон-1-ініл, гепт-6-иніл, гепт-5-иніл, гепт-4иніл, гепт-3-иніл, гепт-2-иніл і гепт-1-иніл. З іншого боку, більш переважними алкенінільними групами є групи, що мають від 6 до приблизно 10 атомів вуглецю; і ще більш переважно 7, 8 або 9 атомів вуглецю. Найбільш переважними алкенінільними групами є окт-1-ен-7-ініл, окт-1-ен-6ініл, окт-1-ен-5-ініл, окт-1-ен-4-ініл, окт-1-ен-3-ініл, нон-1-ен-8-ініл, нон-1-ен-7-ініл, нон-1-ен-5ініл, нон-1-ен-5-ініл, нон-1-ен-4-ініл, нон-1-ен-3-ініл, гепт-1-ен-6-ініл, гепт-1-ен-5-ініл, гепт-1-ен-4ініл і гепт-1-ен-3-ініл. Переважними замісниками для вказаних алкенільних, алкінільних і алкенінільних груп є OR', =О, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', захищена OH, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожна з груп R' незалежно вибрана з групи, що включає атом водню, OH, NO2, NH2, SH, CN, галоген, COH, COалкіл, COOH, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. У тих випадках, коли самі такі групи є заміщеними, замісники можуть бути вибрані з наведеного вище списку. Більш переважними замісниками для алкенільних, алкінільних і алкенінільних груп , що згадуються вище, є галоген, OR', =О, OCOR', OCONHR', OCONR'R', CONHR', CONR'R' і захищена OH, де кожна з груп R' переважно вибрана з атома водню, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C 2-C12алкеніл, заміщений або незаміщений C2-C12алкініл і заміщений або незаміщений арил. Ще більш переважними замісниками для цих алкенільних, алкінільних і алкенінільних груп є галоген, OR', =О, OCONHR', OCONR'R', CONHR', CONR'R' і захищена OH, де захисна група для OH переважно вибрана з наступних груп: триметилсиліл, триетилсиліл, триізопропілсиліл, диметилізопропілсиліл, діетилізопропілсиліл, диметилгексилсиліл, 2-норборнілдиметилсиліл, трет-бутилдиметилсиліл, трет-бутилдифенілсиліл, трибензилсиліл, три-п-ксилілсиліл, трифенілсиліл, дифенілметилсиліл, ди-трет-бутилметилсиліл, біс(трет-бутил)-1піренілметоксисиліл, трис(триметилсиліл)силіл, (2-гідроксистирил)диметилсиліл, (2гідроксистирил)діізопропілсиліл, трет-бутилметоксифенілсиліл, трет-бутоксидифенілсиліл, 1,1,3,3-тетраізопропіл-3-[2-(трифенілметоксі)етокси]дисилоксан-1-іл і фторсиліл, і де кожна з груп R' більш переважно вибрана з атома водню, незаміщеного C1-C6 алкілу і заміщеного або незаміщеного арилу. Найбільш переважними замісниками для цих алкенільних, алкінільних і алкенінільних груп є Cl, OH, =О, OCONH2, OCONHфеніл і захищена OH, де захисна група для OH переважно вибрана з наступних груп: триметилсиліл, триетилсиліл, триізопропілсиліл, диметилізопропілсиліл, діетилізопропілсиліл, диметилгексилсиліл, 2-норборнілдиметилсиліл, трет-бутилдиметилсиліл, трет-бутилдифенілсиліл, трибензилсиліл, три-п-ксилілсиліл, трифенілсиліл, дифенілметилсиліл, ди-трет-бутилметилсиліл, біс(трет-бутил)-1піренілметоксисиліл, трис(триметилсиліл)силіл, (2-гідроксистирил)диметилсиліл, (2гідроксистирил)діізопропілсиліл, трет-бутилметоксифенілсиліл, трет-бутоксидифенілсиліл, 1,1,3,3-тетраізопропіл-3-[2-(трифенілметоксі)етокси]дисилоксан-1-іл і фторсиліл. 9 UA 104281 C2 5 10 Особливо переважними R11, R12, R13, R14 і R15 є атом водню, ORa, OCORa і OSiRaRbRc, де Ra, Rb і Rc такі, як визначено вище. Конкретно, особливо переважними R11, R14 і R15 є атоми водню, особливо переважними R12 є атом водню і ORa, і особливо переважними R13 є атом водню, ORa і OSiRaRbRc. Особливо переважними Ra, Rb і Rc є атом водню і заміщений або незаміщений C1C12алкіл. Ще більш переважними Ra, Rb і Rc є атом водню і заміщений або незаміщений C1-C6 алкіл; і ще більш переважні атом водню, метил, етил, пропіл, ізопропіл і бутил, в тому числі трет-бутил, причому найбільш переважні атом водню, метил і трет-бутил. Особливо переважна наявність одного додаткового зв'язку між атомами С, до яких приєднані R1 і R2, і наявність одного або двох додаткових зв'язків між атомами С, до яких приєднані R3 і R4. Крім того, стереохімія кожного подвійного зв'язку може відповідати (Е) або (Z). У галузь даного винаходу включені окремі ізомери і суміші ізомерів. Більш конкретно, переважними сполуками загальної формули I є також сполуки, що мають загальну формулу IA або їх фармацевтично прийнятні солі, таутомери, проліки або стереоізомери, 15 , 20 25 30 35 40 45 50 де Y вибраний з -CHRay-, -CHRay-CHRby-, -CRay=CRby-, -CC-, -CHRay-CHRby-CHRcy-, -CHRayCRby=CRcy- і -CHRay-CС-; кожний Ray, Rby і Rcy незалежно вибраний з атома водню, заміщеного або незаміщеного C1C12алкілу, заміщеного або незаміщеного C2-C12алкенілу і заміщеного або незаміщеного C2C12алкінілу; R5 вибраний з атома водню, заміщеного або незаміщеного C1-C12алкілу, заміщеного або незаміщеного C2-C12алкенілу і заміщеного або незаміщеного C2-C12алкінілу; R6 вибраний з NR8R9 і ОR10; W вибраний з О і NR7; R7 вибраний з атома водню, CORa, COORa, заміщеного або незаміщеного C1-C12алкілу, заміщеного або незаміщеного C2-C12алкенілу і заміщеного або незаміщеного C2-C12 алкінілу, або R7 і R5 разом з відповідними атомами N і С, до яких вони приєднані, можуть утворювати заміщену або незаміщену гетероциклічну групу; кожний R8 і R9 незалежно вибраний з атома водню, CORa, COORa, заміщеного або незаміщеного C2-C12 алкенілу, заміщеного або незаміщеного C2-C12 алкінілу і заміщеного або незаміщеного C4-C12 алкенінілу; R10 вибраний з атома водню, заміщеного або незаміщеного C2-C12алкенілу і заміщеного або незаміщеного C2-C12алкінілу; кожний R12 і R13 незалежно вибраний з наступних груп: атом водню, галоген, ORa, CORa, COORa, OCORa, OCOORa, OCONRaRb, CONRaRb, OS(О)Ra, OSO2Ra, OP(О)(Ra)ORb, OSiRaRbRc, NRaRb, NRaCORb, NRaCONRaRb, NRaS(О)Rb, NRaSО2Rb, NRaC(=NRa)NRaRb, SRa, S(О)Ra, SO2Ra, S(О)NRaRb, SО2NRaRb, S(О)ORa, SO2ORa, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл і заміщений або незаміщений C2-C12алкініл; кожний Ra, Rb і Rc незалежно вибраний з наступних груп: атом водню, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група; і кожна пунктирна лінія представляє необов'язковий додатковий зв'язок при умові, що присутній один або більше додатковий зв'язок. У сполуках загальної формули IA особливо переважними Y є -CHRay-, -CRay=CRby- і -CHRayCRby=CRcy-, де Ray, Rby і Rcy такі, як визначено вище. Особливо переважними Ray, Rby і Rcy є атом водню і заміщений або незаміщений C1-C12алкіл. Більш переважними Ray, Rby і Rcy є атом водню і заміщений або незаміщений C1-C6 алкіл, і ще більш переважні атом водню, заміщений або незаміщений метил, заміщений або незаміщений етил, заміщений або незаміщений пропіл, заміщений або незаміщений ізопропіл і заміщений або незаміщений бутил, в тому числі заміщений або незаміщений трет-бутил, заміщений або незаміщений ізобутил і заміщений або незаміщений втор-бутил. Переважними замісниками 10 UA 104281 C2 5 10 15 20 25 30 35 40 45 50 55 60 вказаних груп є OR', =О, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', захищена OH, заміщений або незаміщений C 1-C12алкіл, заміщений або незаміщений C2C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожна з груп R' незалежно вибрана з групи, що включає атом водню, OH, NO2, NH2, SH, CN, галоген, COH, COалкіл, COOH, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. У тих випадках, коли самі такі групи є заміщеними, замісники можуть бути вибрані з наведеного вище списку. Ще більш переважними замісниками груп, що згадуються вище, є OH, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, феніл, п-, м- або о-гідроксифеніл, індоліл, в тому числі 1-, 2- і 3-індоліл, і імідазоліл, в тому числі 4- і 5-імідазоліл. Найбільш переважними групами Ray, Rby і Rcy є водень і метил. Конкретно, якщо Y означає -CHRay-, то особливо переважним Ray є метил, якщо Y означає -CRay=CRby-, то особливо переважним Ray є атом водню і особливо переважним Rby є метил, і якщо Y означає -CHRay-CRby=CRcy-, то особливо переважними Ray є атом водню або метил, особливо переважним Rby є атом водню і особливо переважний Rcy є метил. Особливо переважним R5 є атом водню і заміщений або незаміщений C 1-C12алкіл. Більш переважними R5 є атом водню і заміщений або незаміщений C1-C6алкіл, і ще більш переважні атом водню, заміщений або незаміщений метил, заміщений або незаміщений етил, заміщений або незаміщений пропіл, заміщений або незаміщений ізопропіл і заміщений або незаміщений бутил, в тому числі заміщений або незаміщений трет-бутил, заміщений або незаміщений ізобутил і заміщений або незаміщений втор-бутил. Переважними замісниками вказаних груп є OR', =О, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(COR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR', OCOR', OCONHR', OCONR'R', CONHR', CONR'R', захищена OH, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожна з груп R' незалежно вибрана з групи, що включає атом водню, OH, NO2, NH2, SH, CN, галоген, COH, COалкіл, COOH, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. У тих випадках, коли самі такі групи є заміщеними, замісники можуть бути вибрані з наведеного вище списку. Ще більш переважними замісниками груп, що згадуються вище, є OH, SCH3, SH, NH2, NHC(=NH)NH2, CONH2, COOH, феніл, п-, м- або о-гідроксифеніл, індоліл, в тому числі 1-, 2- і 3-індоліл, і імідазоліл, в тому числі 4- і 5-імідазоліл. Найбільш переважними групами R5 є атом водню, метил, ізопропіл, трет-бутил і бензил, і найбільш переважні метил, ізопропіл і трет-бутил. Особливо переважним W є NR7, де R7 такий, як визначено раніше. Особливо переважними R7 є атом водню і заміщений або незаміщений C1-C12алкіл. Більш переважними R7 є атом водню і заміщений або незаміщений C1-C6алкіл; і ще більш переважні атом водню, метил, етил, пропіл, ізопропіл і бутил, в тому числі трет-бутил. Найбільш переважним є атом водню. В іншому варіанті особливо переважно, якщо R7 і R5 разом з відповідними атомами N і С, до яких вони приєднані, утворюють заміщену або незаміщену гетероциклічну групу. У цьому відношенні переважною гетероциклічною групою є гетероаліциклічна група, що містить один, два або три гетероатоми, вибрані з атомів N, О або S, найбільш переважно один атом N, і що має від 5 до приблизно 10 кільцевих атомів, найбільш переважно 5, 6 або 7 кільцевих атомів. Найбільш переважною є піролідинова група. Особливо переважними R6 є NR8R9 і ОR10, де R8, R9 і R10 такі, як визначено вище, і ще більш переважним R6 є NR8R9. Особливо переважним R8 є атом водню. Особливо переважними R9 є атом водню, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл і заміщений або незаміщений C4-C12алкенініл. Переважні заміщений алкеніл, заміщений алкініл і заміщений алкенініл можуть представляти не тільки один, але два і більше замісників. Більш переважними алкенільними групами є групи, що мають від 6 до приблизно 10 атомів вуглецю; і ще більш переважно 7, 8 або 9 атомів вуглецю. Найбільш переважними алкенільними групами є окта-1,6-дієніл, окта-1,5-дієніл, окта1,4-дієніл, окта-1,3-дієніл, нона-1,7-дієніл, нона-1,6-дієніл, нона-1,5-дієніл, нона-1,4-дієніл, нона1,3-дієніл, гепта-1,5-дієніл, гепта-1,4-дієніл, гепта-1,3-дієніл. З іншого боку, більш переважними алкінільними групами є групи, що мають від 6 до приблизно 10 атомів вуглецю; і ще більш переважно 7, 8 або 9 атомів вуглецю. Найбільш переважними алкінільними групами є окт-7 11 UA 104281 C2 5 10 15 20 25 30 35 40 45 50 55 иніл, окт-6-иніл, окт-5-иніл, окт-4-иніл, окт-3-иніл, окт-2-иніл, окт-1-иніл, нон-8-ініл, нон-7-ініл, нон-6-ініл, нон-5-ініл, нон-4-ініл, нон-3-ініл, нон-2-ініл, нон-1-ініл, гепт-6-иніл, гепт-5-иніл, гепт-4иніл, гепт-3-иніл, гепт-2-иніл і гепт-1-иніл. З іншого боку, більш переважними алкенінільними групами є групи, що мають від 6 до приблизно 10 атомів вуглецю; і ще більш переважно 7, 8 або 9 атомів вуглецю. Найбільш переважними алкенінільними групами є окт-1-ен-7-ініл, окт-1-ен-6ініл, окт-1-ен-5-ініл, окт-1-ен-4-ініл, окт-1-ен-3-ініл, нон-1-ен-8-ініл, нон-1-ен-7-ініл, нон-1-ен-6ініл, нон-1-ен-5-ініл, нон-1-ен-4-ініл, нон-1-ен-3-ініл, гепт-1-ен-6-ініл, гепт-1-ен-5-ініл, гепт-1-ен4-ініл і гепт-1-ен-3-ініл. Переважними замісниками для вказаних алкенільних, алкінільних і алкенінільних груп є OR', =О, SR', SOR', SO2R', NO2, NHR', NR'R', =N-R', NHCOR', N(CОR')2, NHSO2R', NR'C(=NR')NR'R', CN, галоген, COR', COOR' OCOR', OCONHR', OCONR'R', CONHR', CONR'R', захищена OH, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл, заміщений або незаміщений арил і заміщена або незаміщена гетероциклічна група, де кожна з груп R' незалежно вибрана з групи, що включає атом водню, OH, NO2, NH2, SH, CN, галоген, COH, COалкіл, COOH, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12 алкініл, заміщений або незаміщений арил і заміщену або незаміщену гетероциклічну групу. У тих випадках, коли самі такі групи є заміщеними, замісники можуть бути вибрані з наведеного вище списку. Більш переважними замісниками для алкенільних, що згадуються вище, алкінільних і алкенінільних груп є галоген, OR', =О, OCOR', OCONHR', OCONR'R', CONHR', CONR'R' і захищена OH, де кожна з груп R' переважно вибрана з наступних груп: атом водню, заміщений або незаміщений C1-C12алкіл, заміщений або незаміщений C2-C12алкеніл, заміщений або незаміщений C2-C12алкініл і заміщений або незаміщений арил. Ще більш переважними замісниками для цих алкенільних, алкінільних і алкенінільних груп є галоген, OR', =О, OCONHR', OCONR'R', CONHR', CONR'R' і захищена OH, де захисна група для OH переважно вибрана з наступних груп: триметилсиліл, триетилсиліл, триізопропілсиліл, диметилізопропілсиліл, діетилізопропілсиліл, диметилгексилсиліл, 2норборнілдиметилсиліл, трет-бутилдиметилсиліл, трет-бутилдифенілсиліл, трибензилсиліл, три-п-ксилілсиліл, трифенілсиліл, дифенілметилсиліл, ди-трет-бутилметилсиліл, біс(третбутил)-1-піренілметоксисиліл, трис(триметилсиліл)силіл, (2-гідроксистирил)диметилсиліл, (2гідроксистирил)діізопропілсиліл, трет-бутилметоксифенілсиліл, трет-бутоксидифенілсиліл, 1,1,3,3-тетраізопропіл-3-[2-(трифенілметоксі)етокси]дисилоксан-1-іл і фторсиліл, і де кожна з груп R' більш переважно вибрана з атома водню, незаміщеного C1-C6алкілу і заміщеного або незаміщеного арилу. Найбільш переважними замісниками для цих алкенільних, алкінільних і алкенінільних груп є Cl, OH, =О, OCONH2, OCONHфеніл і захищена OH, де захисна група для OH переважно вибрана з наступних груп: триметилсиліл, триетилсиліл, триізопропілсиліл, диметилізопропілсиліл, діетилізопропілсиліл, диметилгексилсиліл, 2-норборнілдиметилсиліл, трет-бутилдиметилсиліл, трет-бутилдифенілсиліл, трибензилсиліл, три-п-ксилілсиліл, трифенілсиліл, дифенілметилсиліл, ди-трет-бутилметилсиліл, біс(трет-бутил)-1піренілметоксисиліл, трис(триметилсиліл)силіл, (2-гідроксистирил)диметилсиліл, (2гідроксистирил)діізопропілсиліл, трет-бутилметоксифенілсиліл, трет-бутоксидифенілсиліл, 1,1,3,3-тетраізопропіл-3-[2-(трифенілметоксі)етокси]дисилоксан-1-іл і фторсиліл. Особливо переважними R12 і R13 є атом водню, ORa, OCORa і OSiRaRbRc, де Ra, Rb і Rc такі, як визначено вище. Ще більш переважними R12 є атом водню і ORa, і більш переважними R13 є атом водню, ORa і OSiRaRbRc. Особливо переважними Ra, Rb і Rc є атом водню і заміщений або незаміщений C1-C12алкіл. Ще більш переважними Ra, Rb і Rc є атом водню і заміщений або незаміщений C1-C6 алкіл; і ще більш переважні атом водню, метил, етил, пропіл, ізопропіл і бутил, в тому числі трет-бутил, притому що найбільш переважні атом водню, метил і третбутил. Особливо переважною є наявність одного додаткового зв'язку між C1 і C2 і/або наявність однієї або двох додаткових зв'язків між C3 і C4. Крім того, стереохімія кожного подвійного зв'язку може відповідати (Е) або (Z). У галузь даного винаходу включені окремі ізомери і суміші ізомерів. Сполуки за винаходом можна одержати синтетично, об'єднуючи різні фрагменти, як показано на схемі А. Схема А 12 UA 104281 C2 , 5 10 15 20 25 30 35 40 45 де R1, R2, R3, R4, R5, R6, R11, R12, R13, R14, R15, Y і W являють собою бажані групи або прийнятні захисні групи, які потрібні, і J, K, L і M являють собою прийнятні реакційні або відхідні групи. Сполуки за винаходом можна одержати, слідуючи будь-якій з наступних стратегій: 1) Сполуки фрагментів А і В можна здійснити, слідуючи стандартним методикам органічної хімії (наприклад, по роботі Bodanszky M і Bodanszky А, The Practice of Peptide Synthesis, Springer-Verlag, 1993). 2) Сполуки фрагментів С і D можна здійснити, слідуючи стандартним методикам металоорганічної хімії (наприклад, по роботі R.B. Crabtree, "The Organometallic Chemistry of the Transition Metals", 2nd Ed., Wiley, Nueva York, 1994). Фрагменти А, В, С і D можна незалежно одержати, слідуючи стандартним методикам органічного синтезу. Видалення захисних груп можна здійснити згідно з методиками, відомими в органічному синтезі (Greene і Wuts, Protective Groups in Organic Synthesis, 3-тє вид., Wiley-Interscience; Burke and Danheiser, Handbook of Reagents for Organic Synthesis: Oxidizing and Reducing Agents, Wiley; Pla D et al. J. Org. Chem. 2005, 70, 8231). Якщо необхідно, можна використати прийнятні захисні групи на замісниках для гарантії, що реактивні групи не будуть порушені. Синтез може передбачати використання замісниківпопередників, які можна перетворити на прийнятній стадії в бажаний замісник. Можна вводити або видаляти з циклічної структури насиченість або ненасиченість як частину синтезу. Вихідні матеріали і реагенти можна модифікувати, як бажано, для гарантії синтезу передбачуваної сполуки. Крім того, з одержаних сполук можна також синтезувати аналоги по звичайних методиках синтетичної органічної хімії, які відомі фахівцям в даній галузі. Синтетичні способи, що згадуються вище, можна модифікувати, як бажано для одержання стереоспецифічних сполук, а також сумішей стереоізомерів. Можна синтезувати конкретні стереоізомери або конкретні суміші різними способами, що включають використання стереоспецифічних реагентів або введення в сполуки хіральних центрів під час синтезу. У ході синтезу можна вводити один або більше стереоцентрів і також інвертувати стереоцентри, що є. Крім того, коли сполука синтезована, можна розділити стереоізомери стандартними методиками розділення, відомими фахівцеві. Важливою відмітною ознакою описаних вище сполук формули I є їх біологічна активність і, зокрема, їх цитотоксична активність. Даним винаходом автори забезпечують нові фармацевтичні композиції сполук загальної формули I, які мають цитотоксичну активність, і їх застосування як протипухлинних агентів. Таким чином, даний винахід також стосується фармацевтичних композицій, що містять сполуку за даним винаходом, її фармацевтично прийнятну сіль, таутомер, проліки або стереоізомер з фармацевтично прийнятним носієм. Вираз "носій" стосується розріджувача, ад’юванта, наповнювача або носія, з яким застосовують активний інгредієнт. Прийнятні фармацевтичні носії описані в "Remington's Pharmaceutical Sciences" by E. W. Martin, 1995. Приклади фармацевтичних композицій включають будь-які тверді (таблетки, пілюлі, капсули, гранули і інш.) або рідкі (розчини, суспензії або емульсії) композиції для перорального, локального або парентерального застосування. Застосування сполук або композицій за даним винаходом можна здійснювати будь-яким прийнятним способом, таким як внутрішньовенне вливання, пероральне, 13 UA 104281 C2 5 10 15 20 внутрішньоочеревинне і внутрішньовенне введення. Автори надають перевагу тому, щоб час вливання складав до 24 годин, більш переважно 1-12 годин і найбільш переважно 1-6 годин. Особливо бажаними є короткі терміни вливання, які дозволяють провести лікування, не залишаючи пацієнта в госпіталі на ніч. Однак, якщо потрібно, вливання може тривати від 12 до 24 годин або навіть довше. Вливання можна провести з прийнятними інтервалами, наприклад, від 1 до 4 тижнів. Фармацевтичні композиції, що містять сполуку за винаходом, можна доставляти в інкапсульованому вигляді в ліпосомах або наносферах, у вигляді препаратів з тривалим вивільненням або іншими стандартними способами доставки. Належне дозування сполук варіюється в залежності від конкретного препарату, способу застосування і конкретного місця, реципієнта і пухлини, що підлягає лікуванню. Потрібно брати до уваги інші чинники, такі як вік, маса тіла, стать, харування, час прийому, швидкість екскреції, стан реципієнта, комбінації ліків, реакційну чутливість і тяжкість захворювання. Введення можна виконувати безперервно або періодично в межах максимальної переносимої дози. Сполуки і композиції за даним винаходом можна застосовувати з іншими лікарськими засобами, забезпечуючи комбінаційну терапію. Інші лікарські засоби можуть становити частину однієї композиції або надаватися у вигляді окремої композиції для одночасного введення або в інший час. Протипухлинні активності цих сполук включають, але не обмежені цим, рак легень, рак ободової кишки і рак грудей. Приклади ПРИКЛАД 1: СИНТЕЗ ФРАГМЕНТІВ 12 і 13 Схема 1 представляє приклад синтезу фрагментів 12 і 13. Схема 1 14 UA 104281 C2 . Синтез проміжного продукту 2 5 10 До розчину проміжного продукту 1 (72,3 г, 0,39 моль) в безводному ДХМ (918 мл) при кімнатній температурі додають частинами 3-хлорпероксибензойну кислоту (m-CPBA) (100 г, 0,58 моль) і суміш перемішують при кімнатній температурі протягом 18 годин. Білий осад гасять насиченим водним розчином NaHCO3, екстрагують ДХМ (3×250 мл) і знов промивають насиченим водним розчином NaHCO3 (3×250 мл). Органічні шари об'єднують, сушать над безводним Na2SO4 і концентрують у вакуумі. Одержане масло очищають на силікагелі (гексанEtOAc 15:1), одержуючи епоксид у вигляді безбарвного масла (64,5 г, 82%). До розчину 15 UA 104281 C2 5 10 15 20 25 30 35 40 45 50 рацемічного епоксиду (30 г, 0,15 моль) в безводному ТГФ (7,5 мл) додають (R,R)-(-)-N,N'біс(3,5-ди-трет-бутилсаліциліден)-1,2-циклогександіамінокобальт(II) [(R,R)Co(II) комплекс] (448 мг, 0,74 ммоль), а потім AcOH (0,14 мл). Розчин охолоджують до 0°С і додають по краплі воду (1,2 мл). Реакційній суміші дають нагрітися до кімнатної температури і перемішують протягом 18 годин. Після цього леткі матеріали концентрують у вакуумі і сирий продукт завантажують безпосередньо на колонку з силікагелем. Флеш-хроматографія з використанням суміші гексан/EtOAc (від 15:1 до 12:1) як елюента дає хіральний епоксид (+)-2 (13,6 г, вихід: 46%) у вигляді безбарвного масла. [α]D = +14,1 (с 1, CHCl3). 1 H ЯМР (300 МГц, CDCl3) : 3,74 (т, 2H, J=6,3 Гц), 3,01 (м, 1H), 2,74 (т, 1H, J=4,6 Гц), 2,48 (дд, 1Н, J=5,1, 3,1 Гц), 1,70 (м, 2Н), 0,87 (с, 9Н), 0,04 (с, 6H). 13 C ЯМР (75 МГц, CDCl3) : 60,2, 50,2, 47,3, 36,1, 26,1, 18,4, -5,2. Синтез проміжного продукту 3 Пропін (10 мл, 0,176 моль) конденсують при -78°С і розчиняють в безводному ТГФ (165 мл). Додають по краплі н-бутиллітій (75,1 мл, 0,188 моль) в атмосфері N2 протягом 30 хв. і одержану білу суспензію перемішують ще 30 хв. при -78°С. Потім додають по краплі розчин (+)(R)-2-[2(трет-бутилдиметилилсилілоксі)етил]оксирану 2 (23,7 г, 0,117 моль) в безводному ТГФ (125 мл), а потім додають BF3OEt2 (22,1 мл, 0,176 моль). Суміш перемішують протягом 1 години при -78°С і ще годину при -0°С. Реакційну суміш гасять насиченим водним розчином NH 4Cl (150 мл) і екстрагують Et2O (3×150 мл). Об'єднані органічні шари сушать над Na2SO4, фільтрують і концентрують. Флеш-хроматографія (гексан/EtOAc від 10:1 до 1:1) дає спирт 3 (22,7 г, вихід 80%) у вигляді безбарвного масла. [α]D = +5,6 (с 0,1, CHCl3). 1 H ЯМР (500 МГц, CDCl3) : 3,75-3,90 (м, 3H), 3,47 (д, 1H, J=2,7 Гц, ОН), 2,34 (м, 2Н), 1,79 (т, 3H, J=2,4 Гц), 1,75 (м, 2Н), 0,89 (с, 9H), 0,07 (с, 6H). 13 C ЯМР (125 МГц, CDCl3) : 77,8, 75,8, 70,7, 62,4, 37,6, 27,6, 26,1, 18,3, 3,7, -5,3, -5,4. + + MS (ES) m/z 243,2 [M+Н] , 265,2 [M+Na] . Синтез проміжного продукту 4 Зверху розчину 3 (41,8 г, 0,173 моль) і 18-краун-6-ефіру (50,27 г, 0,190 моль) в безводному ТГФ (1190 мл) при -78°С в атмосфері N2 додають за допомогою крапельної лійки 0,5 N розчин KHMDS в толуолі (380 мл, 0,190 моль) за період 30 хв. Суміш перемішують при даній температурі протягом 45 хв., а потім додають розчин 4-метоксибензилхлориду (PMBCl) (23,89 г, 0,176 моль) в безводному ТГФ (100 мл). Через 2 години при -78°С суміш гасять насиченим водним розчином NH4Cl (600 мл). Органічний шар відділяють і водну фазу ретельно екстрагують EtOAc (3×500 мл). Об'єднані органічні шари промивають насиченим водним розчином NaCl, сушать над безводним Na2SO4, фільтрують і концентрують, одержуючи 4 у вигляді жовтого масла, яке використовують на наступних стадіях без додаткового очищення (61,3 г, вихід: 99%). 1 H ЯМР (300 МГц, CDCl3) : 7,25 (д, 2H, J=8,7 Гц), 6,90 (д, 2H, J=8,7 Гц), 4,45 (м, 2H), 3,80 (с, 3H), 3,65 (м, 3H), 2,40 (м, 2H), 1,82 (м, 2H), 1,79 (т, 3H, J=2,4 Гц), 0,92 (с, 9H), 0,05 (с, 6H). Синтез проміжного продукту 5 До розчину 4 (61,3 г, 0,169 моль) в безводному толуолі (2,1 л) додають в атмосфері N2 і при 0°С реагент Шварца (біс(циклопентадієніл)цирконій(IV) хлорид гідрид, Cp2ZrHCl) (130,3 г, 0,507 моль) і реакційну суміш перемішують 5 хв. при кімнатній температурі. Реакційну температуру підвищують до 50°С за період 20 хв. і перемішують при 50°С протягом 2,5 годин. Протягом цього часу реакційний розчин змінює колір на оранжевий. Реакційну суміш охолоджують до 0°С і додають однією порцією N-хлорсукцинімід (58,45 г, 0,440 моль). Перемішування продовжують 16 UA 104281 C2 5 10 15 20 25 30 35 40 45 протягом 30 хв. при кімнатній температурі і реакційну суміш розбавляють сумішшю гексан/EtOAc (95:5; 500 мл). Видалення твердої речовини за допомогою фільтрування і випарювання летких речовин дає 5 у вигляді жовтого масла, яке використовують без додаткового очищення (15,1 г, вихід: 86%). [α]D = +20,5 (с 1, CHCl3). 1 H ЯМР (300 МГц, CDCl3) : 7,25 (д, 2H, J=8,7 Гц), 6,87 (д, 2H, J=8,7 Гц), 5,64 (тд, 1H, J=7,8, 0,9 Гц), 4,45 (кв, 2H, J=11,1 Гц), 3,80 (с, 3H), 3,70 (м, 2H), 3,62 (м, 1H), 2,27 (т, 2H, J=6,9 Гц), 2,03 (с, 3H), 1,70 (м, 2H), 0,89 (с, 9H), 0,05 (с, 6H). 13 C ЯМР (75 МГц, CDCl3) : 159,4, 130,9, 130,7, 129,6, 124,2, 114,0, 75,2, 71,4, 59,8, 55,5, 37,7, 33,8, 26,1, 21,2, 18,5, -5,1. Синтез проміжного продукту 6 До розчину 5 (23 г, 0,058 моль) в безводному ТГФ (288 мл) в атмосфері N2 і при 0°С додають по краплі розчин фториду тетрабутиламонію (TBAF) (115,3 мл, 0,115 моль) за період 20 хв. (розчин стає червоним). Реакційну суміш перемішують при кімнатній температурі протягом 2 годин і потім гасять насиченим водним розчином NH 4Cl (200 мл). Шари розділяють і водну фазу ретельно екстрагують EtOAc (3×150 мл). Об'єднані органічні шари сушать над Na2SO4, фільтрують і концентрують. Флеш-хроматографія (гексан/EtOAc від 4:1 до 1:1) дає 6 у вигляді безбарвного масла (11,9 г, вихід: 73%). 1 H ЯМР (300 МГц, CDCl3) : 7,25 (д, 2H, J=8,7 Гц), 6,86 (д, 2H, J=8,7 Гц), 5,62 (т, 1H, J=7,8 Гц), 4,45 (м, 2H), 3,80 (с, 3H), 3,70 (м, 3H), 2,35 (м, 2H), 2,03 (с, 3H), 1,75 (м, 2H). Синтез проміжного продукту 7 (Діацетоксийод)бензол (BAIB) (11,5 г, 35,7 ммоль) додають до розчину спирту 6 (9,2 г, 32,4 ммоль) і 2,2,6,6-тетраметилпіперидин 1-оксилу (TEMPO) (515 мг, 3,3 ммоль) в безводному дихлорметані (92 мл). Реакційну суміш перемішують при кімнатній температурі протягом 20 годин доти, поки спирт не буде детектуватися (ТШХ), і потім гасять насиченим водним розчином NH4Cl і екстрагують ДХМ (3(100 мл). Об'єднані органічні фази сушать над безводним Na2SO4, фільтрують і концентрують. Залишок очищають методом флеш-хроматографії (гексан/EtOAc від 4:1 до 1:1), одержуючи 7 у вигляді безбарвного масла (6,3 г, вихід: 69%). 1 H ЯМР (300 МГц, CDCl3) : 9,78 (с, 1H), 7,25 (д, 2H, J=8,7 Гц), 6,85 (д, 2H, J=8,7 Гц), 5,64 (т, 1H, J=7,8 Гц), 4,45 (кв, 2H, J=11,1 Гц), 4,02 (м, 1H), 3,80 (с, 3H), 2,60 (м, 2H), 2,35 (м, 2H), 2,03 (с, 3H). 13 C ЯМР (75 МГц, CDCl3) : 201, 159,6, 132,1, 130,1, 129,7, 122,8, 114,1, 73,3, 71,5, 55,5, 48,3, 33,5, 21,3. Синтез проміжного продукту 8 До суспензії йодметилтрифенілфосфоній йодиду (15,6 г, 31 ммоль) в безводному ТГФ (126 мл) повільно додають при кімнатній температурі 1M розчин NaHMDS в безводному ТГФ (31,27 мл, 31,27 моль). Після перемішування протягом 2 хв. жовту суміш охолоджують до -78°С і потім додають розчин 7 (6,3 г, 22 ммоль) в безводному ТГФ (82 мл). Реакційну суміш перемішують при -78°С протягом 2 годин, і при кімнатній температурі протягом 5 хв., розбавляють гексаном і фільтрують через шар Celite®. Шар Celite® промивають гексаном, об'єднані фільтрати випарюють при зниженому тиску і одержане масло очищають методом колонкової хроматографії (гексан/EtOAc від 12:1 до 8:1), одержуючи 8 у вигляді жовтого масла (5,6 г, вихід: 62%). 1 H ЯМР (300 МГц, CDCl3) : 7,25 (д, 2H, J=8,7 Гц), 6,85 (д, 2H, J=8,7 Гц), 6,25 (м, 2H) 5,64 (т, 1H, J=7,8 Гц), 4,42 (м, 2H), 3,80 (с, 3H), 3,55 (м, 1H), 2,40 (м, 2H), 2,25 (м, 2H), 2,03 (с, 3H). Синтез проміжного продукту 9 17 UA 104281 C2 5 10 15 20 25 30 35 40 45 2,3-Дихлор-5,6-диціано-п-бензохінон (DDQ) (3,6 г, 16 ммоль) додають до розчину 8 (5 г, 12 ммоль) в ДХМ-H2O (20:1, 98 мл) в атмосфері N2 при кімнатній температурі. Через 1,5 години (ТШХ, гексан/EtOAc 4:1, показує відсутність вихідного матеріалу) реакційну суміш гасять, виливаючи в Et2O (200 мл) і промиваючи 1M NaOH (3(50 мл) і насиченим розчином солі (50 мл). Органічну фазу сушать над безводним Na2SO4, фільтрують і концентрують. Хроматографічне відділення п-метоксибензальдегіду спрощується при відновленні до п-метоксибензилового спирту. З цією метою розчин одержаного залишку в MeOH (98 мл) з NaBH4 (0,60 г, 16 ммоль) в атмосфері N2 витримують при кімнатній температурі протягом 1 години. Потім реакційну суміш гасять, виливаючи в Et2O (100 мл) і промиваючи 1M HCl (40 мл) і насиченим розчином солі (40 мл). Органічну фазу сушать над безводним Na2SO4, фільтрують і концентрують. Одержане масло очищають на силікагелі (гексан/EtOAc від 10:1 до 4:1), одержуючи вторинний спирт у вигляді безбарвного масла (2,8 г, вихід: 80%). До розчину вторинного спирту (2,8 г, 10 ммоль) в безводному ДХМ (38 мл) в атмосфері N2 і при 0°С додають по краплі 2,6-лутидин (2,28 мл, 20 ммоль), а потім додають третбутилдиметилсилілтрифторметансульфонат (TBSOTf) (2,33 мл, 12 ммоль). Реакційну суміш перемішують протягом 2 годин. У цей момент сирий продукт гасять за допомогою 0,5 M HCl (25мл) і екстрагують ДХМ (2×25 мл). Об'єднані органічні шари промивають насиченим водним розчином NaHCO3 і насиченим розчином солі. Органічну фазу сушать над Na 2SO4, фільтрують і концентрують. Флеш-хроматографія (гексан/EtOAc від 100:1 до 20:1) дає 9 у вигляді безбарвного масла (3,14 г, вихід: 80%). 1 H ЯМР (300 МГц, CDCl3) : 6,25 (м, 2H) 5,64 (т, 1H, J=7,8 Гц), 3,82 (м, 1H), 2,38 (т, 2H, J=6,0 Гц), 2,20 (т, 2H, J=6,3 Гц), 2,03 (с, 3H), 0,86 (с, 9H), 0,05 (с, 6H). 13 C ЯМР (75 МГц, CDCl3) : 137,7, 130,9, 124,3, 84,6, 70,6, 42,5, 36,6, 25,9, 21,3, 18,2, -4,4. Синтез проміжного продукту 10a У трубку Шленка, що перекривається, завантажують йодид міді (I) (148 мг, 0,78 ммоль), карбонат калію (1,076 г, 7,78 ммоль) і Boc-трет-LeuCONH2 (одержаний по методиці, описаній в роботі Pozdnev, V. F., Tetrahedron Letters 1995, 36, 7115-7118) (0,96 г, 4,15 ммоль), відкачують її і заповнюють N2. Додають N,N'-диметилетилендіамін (DMEDA) (0,166 мл, 1,55 ммоль), вінілйодид 9 (1,04 г, 2,59 ммоль) і безводний ДМФА (15 мл) в атмосфері N2. Трубку Шленка перекривають, нагрівають при 90°С протягом 18 годин і охолоджують до кімнатної температури. Одержану суміш розбавляють EtOAc і гасять водою. Органічний шар промивають водою і сушать над безводним Na2SO4. Розчинник видаляють при зниженому тиску і залишок очищають методом флеш-хроматографії на силікагелі (гексан/EtOAc, від 20:1 до 15:1). Проміжний продукт 10a (670 мг, вихід: 53%) одержують у вигляді масла. 1 H ЯМР (300 МГц, CDCl3) : 7,72 (д, 1H, J=9,9 Гц), 6,70 (т, 1H, J=9,6 Гц), 5,54 (т, 1H, J=7,8 Гц), 5,35 (д, 1H, J=9,0 Гц), 4,76 (кв, 1H, J=7,8 Гц), 3,89 (д, 1H, J=9,0 Гц), 3,73-3,68 (м, 1H), 2,12 (м, 4H), 1,98 (с, 3H), 1,40 (с, 9H), 0,97 (с, 9H), 0,84 (с, 9H), 0,02 (с, 3H), 0,01 (с, 3H). 13 C ЯМР (75 МГц, CDCl3) : 168,9, 156,0, 131,1, 123,9, 122,6, 108,2, 79,9, 71,6, 62,5, 36,5, 34,8, 33,8, 28,1, 26,7, 25,9, 21,2, 18,3, -4,3, -4,4. Синтез проміжного продукту 10b У трубку Шленка, що перекривається, завантажують йодид міді(I) (40,4 мг, 0,213 ммоль), карбонат калію (294 мг, 2,13 ммоль) і Boc-Val-CONH2 (одержаний по методиці, описаній в роботі 18 UA 104281 C2 5 10 15 20 25 30 35 40 Pozdnev, V. F., Tetrahedron Letters 1995, 36, 7115-7118) (230 мг, 1,06 ммоль), відкачують її і заповнюють N2. Додають N,N'-диметилетилендіамін (45 мкл, 0,426 ммоль), вініл йодид 9 (283 мг, 0,71 ммоль) і безводний ДМФА (35 мл) в атмосфері N2. Трубку Шленка перекривають, нагрівають при 90°С протягом 16-18 годин і охолоджують до кімнатної температури. Одержану суміш розбавляють EtOAc і гасять водою. Органічний шар промивають водою і сушать над безводним Na2SO4. Розчинник видаляють при зниженому тиску і залишок очищають методом флеш-хроматографії на силікагелі (гексан/EtOAc, від 7:1 до 3:1). Проміжний продукт 10b (270 г, вихід: 77%) одержують у вигляді масла. 1 H ЯМР (300 МГц, CDCl3) : 7,80 (д, 1H, J=9,3 Гц), 6,79-6,73 (м, 1H), 5,58 (т, 1H, J=7,5 Гц), 5,02 (ушир.с, 1H), 4,85-4,76 (м, 1H), 3,93 (дд, 1H, J=8,4, 6,0 Гц), 3,80-3,73 (м, 1H), 2,12-2,22 (м, 5H), 2,02 (с, 3H), 1,45 (с, 9H), 0,98 (д, 3H, J=6,9 Гц), 0,93 (д, 3H, J=6,9 Гц), 0,89 (с, 9H), 0,07 (с, 3H), 0,06 (с, 3H). Синтез проміжного продукту 11a Розчин аміно-захищеного похідного 10a (670 мг, 1,33 ммоль) в етиленгліколі (30 мл) нагрівають при 200°С протягом 15 хв. Потім реакційну суміш охолоджують при кімнатній температурі, розбавляють ДХМ, гасять насиченим розчином солі і виливають у воду. Додають декілька крапель 3M NaOH до досягнення рН розчину 14 і потім ретельно екстрагують ДХМ. Об'єднані органічні фази сушать над безводним Na2SO4, фільтрують і концентрують у вакуумі, одержуючи первинний амін 11a (510 мг, вихід: 95%) у вигляді жовтого масла, яке використовують без додаткового очищення. 1 H ЯМР (CDCl3, 300 МГц) : 8,77 (д, 1H, J=9,9 Гц), 6,71 (т, 1H, J=9,6 Гц), 5,56 (т, 1H, J=7,8 Гц), 4,71 (м, 1H), 3,72 (м, 1H), 3,14 (с, 1H), 2,14 (м, 4H), 1,97 (с, 3H), 0,97 (с, 9H), 0,84 (с, 9H), 0,02 (с, 6H). 13 C ЯМР (75 МГц, CDCl3) : 171,2, 131,0, 124,1, 122,5, 107,1, 71,5, 64,3, 36,2, 34,5, 33,8, 26,5, 26,0, 21,2, 18,2, -4,4, -4,5. Синтез проміжного продукту 11b Розчин аміно-захищеного похідного 10b (255 мг, 0,52 ммоль) в етиленгліколі (15 мл) нагрівають при 200°С протягом 15 хв. Потім реакційну суміш охолоджують при кімнатній температурі, розбавляють ДХМ, гасять насиченим розчином солі і виливають у воду. Додають декілька крапель 3M NaOH до досягнення pH розчину 14 і потім ретельно екстрагують ДХМ. Об'єднані органічні фази сушать над безводним Na2SO4, фільтрують і концентрують у вакуумі, одержуючи первинний амін 11b (170 мг, вихід: 85%) у вигляді жовтого масла, яке використовують без додаткового очищення. 1 H ЯМР (300 МГц, CDCl3) : 9,27 (д, 1H, J=10,2 Гц), 6,76 (дд, 1H, J=9,6 Гц), 5,61 (т, 1H, J=7,8 Гц), 4,80-4,72 (м, 1H), 3,81-3,73 (м, 1H), 3,31 (д, 1H, J=3,6 Гц) 2,44-2,33 (м, 1H), 2,20-2,16 (м, 4H), 2,03 (с, 3H), 1,59 (ушир.с, 2H), 1,00 (д, 3H, J=6,9 Гц), 0,89 (с, 9H), 0,82 (д, 3H, J=6,9 Гц), 0,05 (с, 6H). 13 C ЯМР (75 МГц, CDCl3) : 172,1, 131,1, 124,1, 122,5, 107,4, 71,5, 60,2, 36,2, 33,7, 30,8, 26,0, 21,3, 20,0, 18,3, 16,1, -4,3, -4,4. Синтез проміжного продукту 12a 19 UA 104281 C2 5 10 15 20 25 30 35 40 45 До розчину аміну 11a (918 мг, 2,27 ммоль) в безводному ДХМ/ДМФА (10:1, 39,6 мл) додають в атмосфері N2 розчин (Z)-3-трибутилстанілпропеноєвої кислоти (1028 мг, 2,84 ммоль) в безводному ДХМ і потім охолоджують при 0°С. Додають до розчину діізопропілетиламін (DIPEA) (0,6 мл, 3,4 ммоль), 1-гідрокси-7-азабензотриазол (HOAt) (310 мг, 2,27 ммоль) і N,N,N',N'-тетраметил-О-(7-азабензотриазол-1-іл)уроній гексафторфосфат (HATU) (860 мг, 2,27 ммоль) і через 30 хв. видаляють холодну баню. Реакційну суміш перемішують при кімнатній температурі протягом 2 годин, гасять насиченим водним розчином NH 4Cl, виливають у воду і екстрагують ДХМ. Об'єднані органічні фази сушать над безводним Na 2SO4, фільтрують і концентрують. Залишок очищають методом флеш-хроматографії (гексан/EtOAc від 20:1 до 15:1), одержуючи амід 12a (1,11 г; вихід: 66%) у вигляді масла. 1 H ЯМР (300 МГц, CDCl3) : 7,63 (д, 1H, J=10,5 Гц), 6,97 (д, 1H, J=12,3 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,72 (т, 1H, J=9,5 Гц), 6,50 (д, 1H, J=9,0 Гц), 5,56 (т, 1H, J=6,6 Гц), 4,83 (кв, 1H, J=9,0 Гц), 4,41 (д, 1H, J=9,6 Гц), 3,76 (м, 1H), 2,17 (м, 4H), 2,01 (с, 3H), 1,45 (м, 6H), 1,25 (м, 8H), 1,0 (с, 9H), 0,88 (с, 9H), 0,84 (м, 13H), 0,06 (с, 6H). Синтез проміжного продукту 12b До розчину аміну 11b (170 мг, 0,437 ммоль) в безводному ДХМ/ДМФА (10:1, 7,7 мл) додають в атмосфері N2 розчин (Z)-3-трибутилстанілпропеноєвої кислоти (197,2 мг, 0,546 ммоль) в безводному ДХМ і потім охолоджують при 0°С. Додають до розчину DIPEA (0,11 мл, 0,655 ммоль), HOAt (59,4 мг, 0,437 ммоль) і HATU (166 мг, 0,437 ммоль) і через 30 хв. холодну баню видаляють. Реакційну суміш перемішують при кімнатній температурі протягом 2 годин, гасять насиченим водним розчином NH4Cl, виливають у воду і екстрагують ДХМ. Об'єднані органічні фази сушать над безводним Na2SO4, фільтрують і концентрують. Залишок очищають методом флеш-хроматографії (гексан/EtOAc від 20:1 до 15:1), одержуючи амід 12b (250 мг, вихід: 78%) у вигляді білої піни. 1 H ЯМР (300 МГц, CDCl3) : 7,94 (д, 1H, J=10,8 Гц), 7,00 (д, 1H, J=12,3 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,72 (т, 1H, J=9,5 Гц), 6,50 (д, 1H, J=9,0 Гц), 5,56 (т, J=6,6 Гц, 1H), 4,83 (кв, 1H, J=9,0 Гц), 4,41 (т, 1H, J=9,0 Гц), 3,76 (м, 1H), 2,17 (м, 4H), 2,01 (с, 3H), 1,45 (м, 7H), 1,25 (м, 8H), 0,88 (с, 9H), 0,84 (м, 19H), 0,06 (с, 6H). 13 C ЯМР (75 МГц, CDCl3) : 169,2, 166,8, 153,8, 136,2, 131,1, 123,9, 122,6, 108,7, 71,6, 59,2, 36,5, 33,7, 31,4, 29,5, 27,6, 26,1, 21,3, 19,5, 18,5, 14,0, 11,8, -4,3, -4,4. Синтез проміжного продукту 13а До розчину 11a (120 мг, 0,30 ммоль) і пропіолової кислоти (23 мкл, 0,37 ммоль) в безводному ДХМ/ДМФА 10:1 (4,2 мл) додають при 0°С HATU (113 мг, 0,30 ммоль), HOAt (40 мг, 0,30 ммоль) і DIPEA (0,78 мкл, 0,44 ммоль). Реакційну суміш перемішують при 0°С протягом 30 хв. і 2 години при кімнатній температурі. Потім сиру суміш обробляють насиченим водним розчином NH4Cl і екстрагують CH2Cl2. Об'єднані фільтрати промивають H2O. Після сушіння і випарювання розчинника при зниженому тиску сирий продукт очищають методом колонкової хроматографії (суміш етилацетат/гексани), одержуючи чисту сполуку 13a (50 мг, вихід; 40%). 1 H ЯМР (300 МГц, CDCl3) : 8,20 (д, 1H, J=10,2 Гц), 6,83 (д, 1H, J=9,6 Гц), 6,72 (т, 1H, J=9,3 Гц), 5,55 (т, 1H, J=6,9 Гц), 4,88 (кв, 1H, J=8,7 Гц), 4,58 (д, 1H, J=9,6 Гц), 3,75 (м, 1H), 2,90 (с, 1H), 2,17 (м, 4H), 2,00 (с, 3H), 1,02 (с, 9H), 0,87 (с, 9H), 0,05 (с, 3H), 0,04 (с, 3H). 13 C ЯМР (75 МГц, CDCl3) : 167,5, 152,1, 131,0, 124,1, 122,3, 109,4, 77,1, 74,8, 71,7, 60,9, 36,5, 35,7, 33,8, 26,7, 26,1, 21,2, 18,3, -4,3, -4,4. Синтез проміжного продукту 13b 20 UA 104281 C2 5 10 15 До розчину 11b (200 мг, 0,51 ммоль) і пропіолової кислоти (39 мкл, 0,64 ммоль) в безводному ДХМ/ДМФА 10:1 (8 мл) додають при 0°С HATU (194 мг, 0,51 ммоль), HOAt (69 мг, 0,51 ммоль) і DIPEA (133 мкл, 0,76 ммоль). Реакційну суміш перемішують при 0°С протягом 30 хв. і 2 години при кімнатній температурі. Потім сиру суміш обробляють насиченим водним розчином NH4Cl і екстрагують CH2Cl2. Об'єднані фільтрати промивають H2O. Після сушіння і випарювання розчинника при зниженому тиску сирий продукт очищають методом колонкової хроматографії (суміш етилацетат/гексани), одержуючи чисту сполуку 13b (150 мг, вихід: 67%). 1 H ЯМР (300 МГц, CDCl3) : 7,02 (д, 1H, J=11,4 Гц), 6,75 (дд, 1H, J=10,8, 9,0 Гц), 6,53 (д, 1H, J=10,2 Гц), 5,58 (дд, 1H, J=9,0, 7,8 Гц), 4,87 (кв, 1H, J=7,8 Гц), 4,33 (дд, 1H, J=8,7, 6,3 Гц), 3,843,76 (м, 1H), 2,83 (с, 1H), 2,23-2,11 (м, 5H), 2,05-2,03 (м, 3H), 0,99 (д, 6H, J=6,9 Гц), 0,89 (с, 9H), 0,08 (с, 3H), 0,06 (с, 3H). ПРИКЛАД 2: СИНТЕЗ ФРАГМЕНТА 18 Схема 2 представляє приклад синтезу фрагмента 18. Схема 2 Синтез проміжного продукту 14 20 25 До розчину 4-гідрокси-3-метоксибензальдегіду (1 г, 6,57 ммоль) в безводному ДХМ (14 мл) додають в атмосфері N2 і при 0°С імідазол (1,118 г, 8,21 ммоль) і третбутилдиметилсилілхлорид (1,084 г, 7,22 ммоль). Через 3 години при кімнатній температурі реакційну суміш гасять 0,5 N розчином HCl і розбавляють CH 2Cl2 (100 мл). Об'єднані органічні шари промивають насиченим водним розчином NaHCO 3 і насиченим розчином солі. Органічну фазу сушать над безводним Na2SO4, фільтрують і концентрують, одержуючи 1,71 г (вихід: 98%) альдегіду 14. 1 H ЯМР (300 МГц, CDCl3) : 9,84 (с, 1H), 7,40-7,36 (м, 2H), 6,96 (д, 1H, J=7,8 Гц), 3,87 (с, 3H), 1,00 (с, 9H), 0,19 (с, 6H). 21 UA 104281 C2 Синтез проміжного продукту 15 5 10 15 20 25 30 35 40 Зверху розчину альдегіду 14 (1 г, 3,75 ммоль) в толуолі (20 мл) додають карбоетоксіетиліден-трифенілфосфоран (3,4 г, 9,38 ммоль) і суміш нагрівають при 60°С протягом 2,5 годин. Потім розчинник видаляють при зниженому тиску і одержане масло очищають методом колонкової хроматографії (гексан/EtOAc 12:1), одержуючи 1,1 г (вихід: 81%) складноефірної сполуки 15. 1 H ЯМР (300 МГц, CDCl3) : 7,62 (с, 1H), 6,96-6,85 (м, 3H), 4,26 (кв, 2H, J=7,2 Гц), 3,82 (с, 3H), 2,14 (с, 3H), 1,34 (т, 3H, J=7,2 Гц), 1,00 (с, 9H),0,18 (с, 6H). Синтез проміжного продукту 16 Зверху охолодженого до -78°С розчину складного ефіру 15 (640 мг, 1,746 ммоль) в безводному ТГФ (8,7 мл) додають в атмосфері N2, 1M діізобутилалюмінійгідрид (DIBAL) в толуолі (3,84 мл, 3,84 ммоль) за період 10 хв. і суміш перемішують при -78°C. Через 4 години реакційну суміш гасять MeOH (0,16 мл) і додають насичений водний розчин натрій-калій тартрату (15 мл) і розбавляють EtOAc. Цю суміш перемішують протягом 1 години і потім органічний шар декантують. Водний залишок екстрагують додатковою кількістю EtOAc і об'єднані органічні шари сушать над безводним Na2SO4 і випарюють розчинник. Одержане масло очищають методом колонкової хроматографії (гексан/EtOAc від 9:1 до 6:4), одержуючи 360 мг (вихід; 68%) спирту 16. 1 H ЯМР (300 МГц, CDCl3) : 6,80-6,76 (м, 3H), 6,43 (ушир.с, 1H), 4,16 (д, 2H, J=3,3 Гц), 3,79 (с, 3H), 1,91 (с, 3H), 1,00 (с, 9H), 0,16 (с, 6H). Синтез проміжного продукту 17 Зверху розчину спирту 16 (270 мг, 0,875 ммоль) в етиловому ефірі (4,4 мл) додають в атмосфері N2 MnО2 (1,141 г, 13,12 ммоль) і суміш перемішують при кімнатній температурі протягом 2 годин. Цю суміш фільтрують на колонці з силікагелем, елююючи EtOAc і одержаний розчин сушать при зниженому тиску, одержуючи 256 мг (вихід: 96%) альдегіду 17. 1 H ЯМР (300 МГц, CDCl3) : 9,54 (с, 1H), 7,18 (ушир.с, 1H), 7,109-7,081 (м, 2H), 6,92 (д, 1H, J=8,1 Гц), 3,86 (с, 3H), 2,10 (с, 3H), 1,00 (с, 9H), 0,19 (с, 6H). Синтез проміжного продукту 18 До суспензії йодметилтрифенілфосфіній йодиду (Gilbert Stork, KZ. Tetrahedron letters 1989, 30 (17), 2173) (605 мг, 1,142 ммоль) в ТГФ (4,6 мл) повільно додають при кімнатній температурі 1M розчин натрій гексаметилдисилазану (NaHMDS) (1,142 мл, 1,142 ммоль). Після перемішування протягом ще 2 хв. розчин охолоджують до -78°С і додають розчин альдегіду 17 (250 мг, 0,815 ммоль) в ТГФ (3 мл). Температуру підтримують при -78°С протягом 2 годин при перемішуванні реакційної суміші. Додають гексан і одержану суспензію фільтрують через Celite® і промивають додатковою кількістю гексану. Фільтрат випарюють при зниженому тиску і одержане масло очищають методом колонкової хроматографії (гексан/EtOAc від 100:0 до 20:1), одержуючи 250 мг (вихід: 71%) йодиду 18. 1 H ЯМР (300 МГц, CDCl3) : 6,92 (д, 1H, J=8,1 Гц), 6,83 (ушир.с, 3H), 6,66 (с, 1H), 6,25 (д, 1H, J=8,1 Гц) 3,82 (с, 3H), 2,18 (с, 3H), 1,00 (с, 9H), 0,18 (с, 6H). 22 UA 104281 C2 ПРИКЛАД 3: СИНТЕЗ ФРАГМЕНТА 22 Схема 3 представляє приклад синтезу фрагмента 22. Схема 3 . 5 Синтез проміжного продукту 19 10 15 20 25 30 Зверху розчину фенілацетальдегіду (100 мг, 0,83 ммоль) в толуолі (5,0 мл) додають карбоетоксіетиліден-трифенілфосфоран (754 мг, 2,08 ммоль) і суміш перемішують при кімнатній температурі протягом 18 годин. Потім видаляють розчинник при зниженому тиску і одержане масло очищають методом колонкової хроматографії (суміш етилацетат/гексани), одержуючи 150 мг (90% вихід) чистої складноефірної сполуки 19. 1 H ЯМР (300 МГц, CDCl3) : 7,35-7,18 (м, 5H), 6,94 (т, 1H, J=7,5 Гц), 4,20 (кв, 2H, J=7,2 Гц), 3,54 (д, 2H, J=7,8 Гц), 1,97 (с, 3H), 1,29 (т, 3H, J=7,2 Гц). Синтез проміжного продукту 20 Зверху охолодженого до -78°С розчину складного ефіру 19 (150 мг, 0,73 ммоль) в безводному ТГФ (3,6 мл) додають в атмосфері N2, 1M діізобутилалюміній гідрид (DIBAL) в толуолі (1,62 мл, 1,62 моль) за 5 хв. і суміш перемішують при -78°C. Через 4 години реакційну суміш гасять за допомогою MeOH (0,7 мл), додають насичений водний розчин натрій-калій тартрату (4 мл) і розбавляють EtOAc (10 мл). Цю суміш перемішують протягом 2 годин і потім органічний шар декантують. Водний залишок екстрагують додатковою кількістю EtOAc (2×15 мл), об'єднані органічні шари сушать (безводний Na2SO4) і випарюють розчинник, одержуючи 110 мг (вихід: 92%) спирту 20, який використовують без додаткового очищення. 1 H ЯМР (300 МГц, CDCl3) : 7,32 (м, 3H), 7,23 (м, 2H), 5,64 (т, 1H, J=6,3 Гц), 4,04 (с, 2H), 3,43 (д, 2H, J=7,2 Гц), 2,19 (ушир.с, 1H), 1,80 (с, 3H). Синтез проміжного продукту 21 Зверху розчину спирту 20 (96 мг, 0,59 ммоль) в дихлорметані (3,8 мл) додають в атмосфері N2 періодинан Десса-Мартина (DMP) (502 мг, 1,18 моль) і суміш перемішують при кімнатній 23 UA 104281 C2 5 10 15 20 температурі протягом 2 годин. Цю суміш гасять насиченим водним розчином NH 4Cl (3 мл) і розбавляють дихлорметаном (5 мл). Органічну фазу сушать над безводним Na2SO4 і випарюють при зниженому тиску. Очищення методом колонкової хроматографії (гексан/етилацетат 10:1) дає чистий альдегід 21 (75 мг, вихід: 80%). 1 H ЯМР (300 МГц, CDCl3) : 9,43 (с, 1H), 7,35-7,18 (м, 5H), 6,64 (т, 1H, J=7,2 Гц), 3,43 (д, 2H, J=7,2 Гц), 1,88 (с, 3H). 13 C ЯМР (75 МГц, CDCl3) : 195,3, 152,4, 139,8, 138,4, 129,1, 128,7, 127,0, 62,2, 35,4. Синтез проміжного продукту 22 До суспензії йодметилтрифенілфосфіній йодиду (Gilbert Stork, KZ. Tetrahedron letters, 1989, 30(17), 2173) (347 мг, 0,66 ммоль) в ТГФ (2,7 мл) повільно додають при кімнатній температурі 1M розчин натрій гексаметилдисилазану (NaHMDS) (0,66 мл, 0,66 ммоль) в ТГФ. Після перемішування ще протягом 2 хв. розчин охолоджують до -78°С і додають розчин альдегіду 21 (75 мг, 0,47 ммоль) в ТГФ (1,75 мл). Температуру підтримують при -78°С протягом 2 годин при перемішуванні реакційної суміші. Додають гексан (25 мл) і одержану суспензію фільтрують через Celite® і промивають додатковою кількістю гексану (50 мл). Фільтрат випарюють при зниженому тиску і одержане масло очищають методом колонкової хроматографії (гексан/EtOAc від 20:1 до 15:1), одержуючи 82 мг (вихід: 62%) йодиду 22. 1 H ЯМР (300 МГц, CDCl3) : 7,35-7,18 (м, 5H), 6,82 (д, 1H, J=8,4 Гц), 6,17 (дд, 1H, J=8,4 Гц), 5,90 (тт, 1H, J=7,5, 1,2 Гц), 3,50 (д, 2H, J=7,5 Гц), 2,03 (с, 3H). ПРИКЛАД 4: СИНТЕЗ ФРАГМЕНТА 26 Схема 4 представляє приклад синтезу фрагмента 26. Схема 4 . 25 Синтез проміжного продукту 23 30 Зверху розчину (R)-2-фенілпропаналу (одержаного по методиці, описаній в Tetrahedron Asymmetry 1998, 1929-1931) (80 мг, 0,59 ммоль) в толуолі (2,8 мл) додають карбоетоксіетилідентрифенілфосфоран (540 мг, 1,49 ммоль) і суміш перемішують при 24 UA 104281 C2 5 10 15 20 25 30 35 40 45 кімнатній температурі протягом 4 годин. Потім розчинник видаляють при зниженому тиску і одержане масло очищають методом колонкової хроматографії (гексан/EtOAc 10:1), одержуючи 70 мг (55% вихід) складноефірної сполуки 23. 1 H ЯМР (300 МГц, CDCl3) : 7,34-7,19 (м, 5H), 6,87 (д.кв., 1H, J=9,9, 1,4 Гц), 4,18 (кв, 2H, J=7,1 Гц), 3,80 (м, 1H), 1,92 (д, 3H, J=1,4 Гц), 1,41 (д, 3H, J=7,0 Гц), 1,29 (т, 3H, J=7,1 Гц). Синтез проміжного продукту 24 Зверху охолодженого до -78°С розчину складного ефіру 23 (70 мг, 0,321 ммоль) в безводному ТГФ (1,6 мл) додають в атмосфері N2 1M діізобутилалюмінійгідрид (DIBAL) в толуолі (0,71 мл, 0,71 ммоль) і суміш перемішують при -78°C. Через 4 години реакцію гасять MeOH (0,4 мл), додають насичений водний розчин натрій-калій тартрату (1,5 мл) і розбавляють EtOAc (6 мл). Цю суміш перемішують протягом 1 години і потім органічний шар декантують. Водний залишок екстрагують додатковою кількістю EtOAc (2×6 мл), об'єднані органічні шари сушать (безводний Na2SO4) і випарюють розчинник. Одержане масло очищають методом колонкової хроматографії (гексан/EtOAc 5:1), одержуючи 40 мг (75% вихід) спирту 24 у вигляді безбарвного масла. 1 H ЯМР (300 МГц, CDCl3) : 7,34-7,16 (м, 5H), 5,57 (дкв., 1H, J=9,4, 1,2 Гц), 4,00 (с, 2H), 3,71 (м, 1H), 1,75 (д, 3H, J=1,2 Гц), 1,35 (д, 3H, J=7,0 Гц). 13 C ЯМР (75 МГц, CDCl3) : 146,7, 133,9, 131,4, 128,7, 127,1, 126,2, 68,9, 37,9, 22,3, 14,1. Синтез проміжного продукту 25 Зверху розчину спирту 24 (40 мг, 0,226 ммоль) в дихлорметані (1,5 мл) додають в атмосфері N2 періодинан Десс-Мартина (DMP) (193 мг, 0,454 моль) і суміш перемішують при кімнатній температурі протягом 2 годин. Цю суміш гасять насиченим водним розчином NaHCO 3 (2 мл) і розбавляють дихлорметаном (5 мл). Органічну фазу сушать над безводним Na2SO4 і випарюють при зниженому тиску. Очищення методом колонкової хроматографії (гексан/EtOAc 10:1) дає чистий альдегід 25 (18 мг, 50% вихід) у вигляді безбарвного масла. 1 H ЯМР (300 МГц, CDCl3) : 9,42 (с, 1H), 7,39-7,23 (м, 5H), 6,56 (дкв., 1H, J=9,7, 0,9 Гц), 4,00 (м, 1H), 1,83 (с, 3H), 1,47 (д, 3H, J=7,0 Гц). 13 C ЯМР (75 МГц, CDCl3) : 195,6, 158,2, 143,8, 137,9, 129,1, 127,2, 127,1, 39,1, 21,1, 9,6. Синтез проміжного продукту 26 До суспензії йодметилтрифенілфосфініййодиду (Gilbert Stork, KZ. Tetrahedron letters, 1989, 30(17), 2173) (77 мг, 0,144 ммоль) в ТГФ (0,6 мл) повільно додають при кімнатній температурі 1M розчин гексаметилдисилазану натрію (NaHMDS) в ТГФ (0,144 мл, 0,144 ммоль). Після перемішування ще протягом 2 хв. розчин охолоджують до -78°С і додають розчин альдегіду 25 (18 мг, 0,103 ммоль) в ТГФ (0,5 мл). Температуру підтримують при -78°С протягом 2 годин при перемішуванні реакційної суміші. Додають гексан (15 мл) і одержану суспензію фільтрують через Celite® і промивають додатковою кількістю гексану (30 мл). Фільтрат випарюють при зниженому тиску і одержане масло очищають методом колонкової хроматографії (гексан/EtOAc 10:1), одержуючи 22 мг (72% вихід) йодиду 26 у вигляді безбарвного масла. 1 H ЯМР (300 МГц, CDCl3) : 7,34-7,17 (м, 5H), 6,73 (д, 1H, J=8,4 Гц), 6,14 (д, 1H, J=8,4 Гц), 5,83 (д, 1H, J=9,5 Гц), 3,79 (м, 1H), 1,95 (с, 3H), 1,40 (д, 3H, J=7,0 Гц). 25 UA 104281 C2 C ЯМР (75 МГц, CDCl3) : 145,9, 142,3, 139,1, 131,9, 128,7, 127,3, 127,2, 126,3, 38,4, 22,1, 16,0. ПРИКЛАД 5: СИНТЕЗ ФРАГМЕНТА 29 Схема 5 представляє приклад синтезу фрагмента 29. Схема 5 13 5 . Синтез проміжного продукту 27 10 15 20 25 30 До суміші L-Boc-трет-лейцину (300 мг, 1,3 ммоль) в безводному ДХМ (13 мл) і дициклогексилкарбодііміду (DCC) (295 мг, 1,43 ммоль) додають при 0°С в атмосфері N2 3бутенол (0,3 мл, 3,9 ммоль) і диметиламінопіридин (DMAP) (15,9 мг, 0,13 ммоль). Реакційну суміш перемішують протягом 5 хв. при 0°С і 4 години при кімнатній температурі. Органічний розчинник випарюють при зниженому тиску і одержану тверду речовину очищають методом колонкової хроматографії (гексан/EtOAc 10:1), одержуючи 300 мг (вихід: 81%) складного ефіру 27. 1 H ЯМР (300 МГц, CDCl3) : 5,82-5,71 (м, 1H), 5,14-5,06 (м, 2H), 4,24-4,12 (м, 2H), 4,08 (д, 1H, J=9,8 Гц), 2,41 (кв, 2H, J=6,7 Гц), 1,43 (с, 9H), 0,96 (с, 9H). Синтез проміжного продукту 28 Розчин складного ефіру 27 (180 мг, 0,63 ммоль) в 1M HCl·MeOH (3,6 мл) перемішують при кімнатній температурі протягом 24 годин. Органічний розчинник випарюють при зниженому тиску і одержану тверду речовину розводять в ДХМ і промивають H2O. Одержану органічну фазу сушать над безводним Na2SO4, фільтрують і розчинник випарюють, одержуючи 116 мг (вихід: 100%) 28. 1 H ЯМР (300 МГц, CDCl3) : 5,85-5,72 (м, 1H), 5,15-5,06 (м, 2H), 4,16 (т, 2H, J=6,7 Гц), 3,15 (с, 1H), 4,44-4,37 (м, 2H), 0,96 (с, 9H). Синтез проміжного продукту 29 26 UA 104281 C2 5 10 DIPEA (0,24 мл, 1,4 ммоль), HOAt (123,3 мг, 0,9 ммоль) і HATU (345 мг, 0,9 ммоль) додають до розчину 28 (168 мг, 0,9 ммоль) і (Z)-3-трибутилстанілпропеноєвої кислоти (393 мг, 1,2 ммоль) в ДХМ/ДМФА (10:1, 14 мл) при 0°С в атмосфері N2. Через 2 години холодну баню видаляють і реакційну суміш перемішують при кімнатній температурі протягом 1 години, гасять насиченим водним розчином NH4Cl, виливають у воду і екстрагують ДХМ. Об'єднані органічні фази сушать над безводним Na2SO4, фільтрують і концентрують. Залишок очищають методом флеш-хроматографії (гексан/EtOAc від 15:1 до 10:1), одержуючи 29 (340 мг; вихід: 72%). 1 H ЯМР (300 МГц, CDCl3) : 7,01 (д, 1H, J=12,3 Гц), 6,75 (д, 1H, J=12,3 Гц), 6,03 (д, NH, J=9,73 Гц), 5,84-5,69 (м, 1H), 5,14-5,05 (м, 2H), 4,60 (д, 1H, J=9,76 Гц), 4,19-4,14 (м, 2H), 2,40 (кв, 2H, J=6,70 Гц), 1,48-1,40 (м, 6H), 1,31-1,19 (м, 6H), 0,96 (с, 9H), 0,93-0,83 (м, 15H). ПРИКЛАД 6 Схема 6 представляє синтез деяких сполук по винаходу. Схема 6 . 15 Синтез сполуки 30 20 25 До розчину алкенілстанану 12a (130 мг, 0,174 ммоль) і 18 (90 мг, 0,209 ммоль) в 1-метил-2піролідиноні (NMP) (1,75 мл) при 0°С додають тіофенкарбоксилат міді (CuTC) (49,6 мг, 0,261 ммоль). Реакційну суміш перемішують при 0°С протягом 45 хв. і 20 хв. при кімнатній температурі. Потім сиру суміш фільтрують через шар з нейтрального оксиду алюмінію, промивають сумішшю EtOAc/простий ефір 50:50 і об'єднані фільтрати промивають 0,5 N HCl (3×15 мл). Органічний розчин сушать і випарюють, одержуючи сирий продукт, який очищають 27 UA 104281 C2 5 методом колонкової хроматографії (гексан/EtOAc від 8:1 до 1:1), одержуючи триєн 30 (65 мг, вихід: 49%) у вигляді масла. 1 H ЯМР (CDCl3, 300 МГц) : 7,64 (д, 1H, J=11,1 Гц), 7,33 (дд, 1Н, J=11,7, 11,4 Гц), 7,04 (дд, 1H, J=12,0, 11,1 Гц), 6,83-6,81 (м, 3H), 6,77-6,70 (м, 1Н), 6,45 (ушир.с, 1Н), 6,33 (д, 1H, J=11,7 Гц), 6,22 (д, 1H, J=9,0 Гц), 5,64 (д, 1H, J=11,4 Гц), 5,62-5,56 (м, 1H), 4,89-4,80 (м, 1H), 4,36 (д, 1H, J=9,3 Гц), 3,81 (с, 3H), 3,80-3,78 (м, 1H), 2,23-2,14 (м, 4H), 2,08 (с, 3H), 2,03 (с, 3H), 1,05 (с, 9H), 1,00 (с, 9H), 0,89 (с, 9H), 0,17 (с, 6H), 0,08 (с, 3H), 0,06 (с, 3H). Синтез сполуки 31 10 15 20 До розчину 30 (60 мг, 0,08 ммоль) в ТГФ (1,5 мл) додають в атмосфері N2 і при кімнатній температурі 1M тетрабутиламоній фторид (TBAF) в ТГФ (0,23 мл, 0,23 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 18 годин і потім гасять насиченим водним розчином NH4Cl і екстрагують EtOAc. Об'єднані органічні фази сушать над безводним Na2SO4, фільтрують і концентрують. Залишок очищають методом флеш-хроматографії (гексан/EtOAc від 5:1 до 1:1), одержуючи спирт 31 (25,4 мг; вихід: 60%) у вигляді білої твердої речовини. 1 H ЯМР (300 МГц, CDCl3) : 8,74 (д, 1H, J=10,2 Гц), 7,77-7,68 (м, 1H), 6,90-6,50 (м, 4H), 6,616,57 (м, 3H), 6,36 (д, 1H, J=9,0 Гц), 5,62 (м, 2H), 4,86 (кв, 1H, J=8,5 Гц), 4,37 (д, 1H, J=9,0 Гц), 3,90 (с, 3H), 3,77 (м, 1H), 2,67 (ушир.с, 1H), 2,20 (м, 4H), 2,09 (с, 3H), 2,07 (с, 3H), 1,05 (с, 9H). ПРИКЛАД 7 Схема 7 представляє синтез деяких сполук по винаходу. Схема 7 . 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntitumoral compounds
Автори російськоюRodriguez Vicente, Alberto, Garranzo Garcia-Ibarrola, Maria, Murcia Perez, Carmen, Sanchez Sancho, Francisco, Cuevas Marchante, Maria del Carmen, Mateo Urbano, Cristina, Digon Juarez, Isabel
МПК / Мітки
МПК: C07C 233/51, C07C 235/34, A61K 31/165
Мітки: основі, пептидів, спосіб, протипухлинні, аналоги, одержання, композиція, фармацевтична
Код посилання
<a href="https://ua.patents.su/40-104281-protipukhlinni-analogi-peptidiv-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Протипухлинні аналоги пептидів, спосіб їх одержання та фармацевтична композиція на їх основі</a>
Попередній патент: Великогабаритний пакувальний контейнер для бітуму
Наступний патент: Спосіб селективного депротонування і введення замісника до 1-фтор-2-заміщених-3-хлорбензолів
Випадковий патент: Фіксатор панельних фасадних елементів просторової каркасно-модульної системи