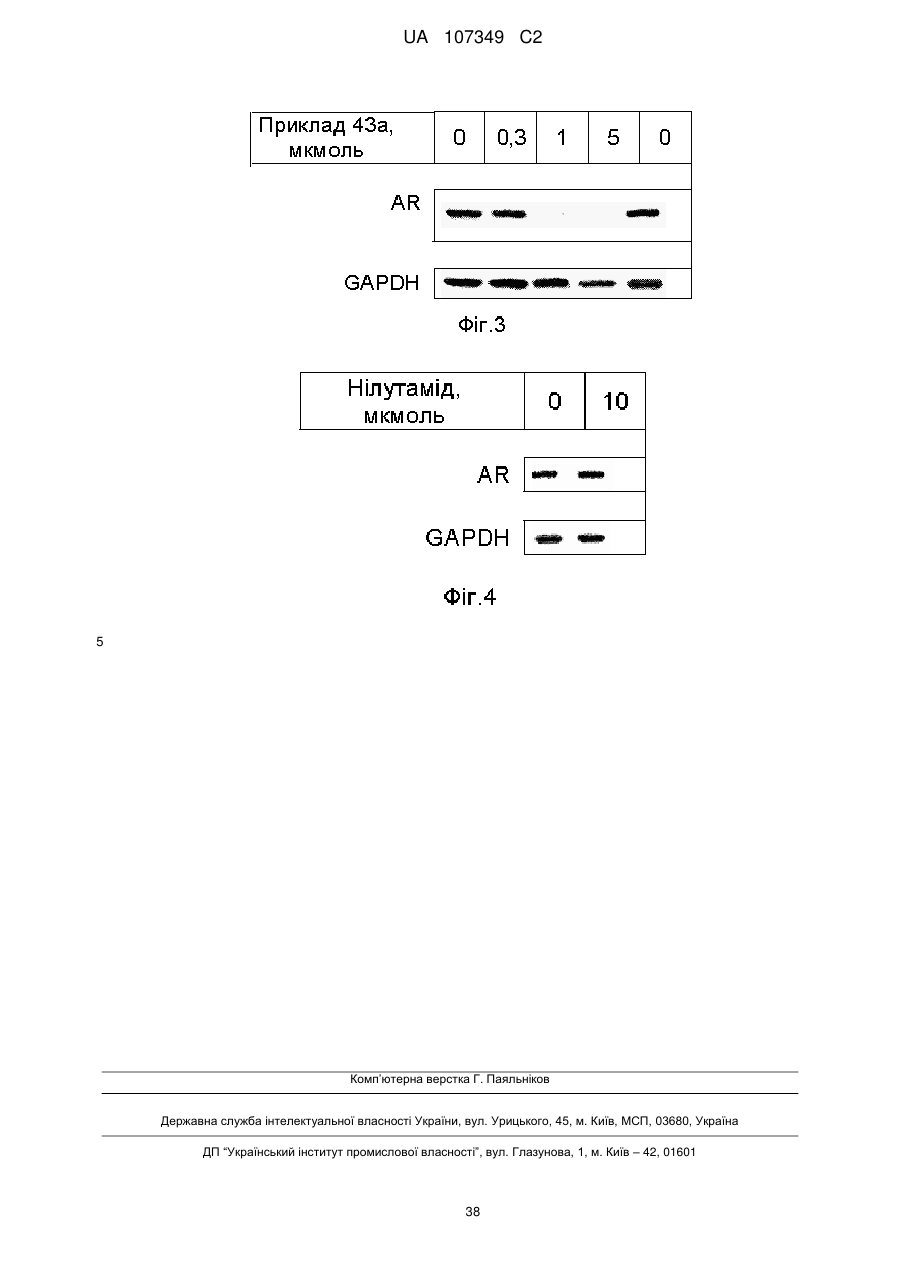
Похідні імідазолідин-2,4-діону та їх застосування як медикаменту для лікування раку
Номер патенту: 107349
Опубліковано: 25.12.2014
Автори: Лаверньє Олівьє, Лібератор Анне-Маріє, Превост Грегуар, ЛАНКО Крістоф, Овін Серж
Формула / Реферат
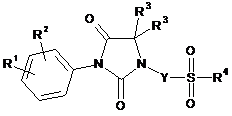
1. Сполука за загальною формулою (І)
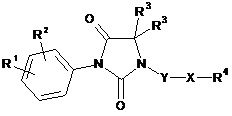 (I)
(I)
у рацемічній, енантіомерній або в будь-якій комбінованій із них формі, де:
R1 і R2 незалежно один від одного є атом галогену або радикали алкіл, галоїдалкіл, алкокси, ціано, нітро, аміно, алкіламіно, діалкіламіно, -NR8-CO-R5, -NR8-SO2-R5, -NR8-CO-(CH2)n-NR6R7, -NR8-SO2-(CH2)n-NR6R7 або -CO-NH2;
n є ціле число, вибране з 0, 1, 2, 3, 4, 5 і 6;
R5 є радикал алкіл, арил або гетероарил;
R6 і R7 незалежно один від одного є атом водню, радикали алкіл або алкілоксикарбоніл;
R8 є атом водню або радикал алкіл;
R3 є радикал алкіл або атом водню; або ж два радикали R3 разом з атомом вуглецю, до якого вони приєднані, утворюють радикал циклоалкіл, що містить від 3 до 6 ланок у циклі;
R4 є радикал галоїдалкіл із 2-10 атомами вуглецю;
Y є алкіленовий ланцюг, що складається із 2-14 атомів вуглецю, прямий або розгалужений, який може бути насиченим або ненасиченим і містити один або декілька додаткових атомів -О-;
X є -S-, -SO-, -SO2-, -S=N(R9)- або -S(O)=N(R9)-;
R9 є атом водню або радикал галоїдалкілкарбоніл,
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, де R1 є атом галогену або радикали алкіл, алкокси, ціано, нітро, аміно, алкіламіно, діалкіламіно, -NR8-CO-R5, -NR8-SO2-R5, -NR8-CO-(CH2)n-NR6R7, -NR8-SO2-(CH2)n-NR6R7 або -CO-NH2; R2 є атом галогену, радикал алкіл або галоїд алкіл,
або її фармацевтично прийнятна сіль.
3. Сполука за будь-яким із пп. 1 або 2, де R5 є радикал алкіл.
4. Сполука за будь-яким із пп. 1-3, де R3 є радикал алкіл.
5. Сполука за будь-яким із пп. 1-4, де R4 є радикал галоїдалкіл, що містить від 4 до 6 атомів вуглецю і від 3 до 9 атомів фтору; a Y є алкіленовий ланцюг із 5-10 атомами вуглецю.
6. Сполука за будь-яким із пп. 1-5, де R1 є в пара-положенні.
7. Сполука за будь-яким із пп. 1-6, де R2 є в мета-положенні.
8. Сполука за будь-яким із пп. 1-7, де
R1 є радикал ціано, нітро, аміно, -NR8-CO-R5, -NR8-SO2-R5, -NR8-CO-(CH2)n-NR6R7, -NR8-SO2-(CH2)n-NR6 R7 або -CO-NH2;
R2 є радикал алкіл або галоїдалкіл;
R5 є радикал алкіл;
R6 і R7 незалежно один від одного є атом водню, радикали алкіл або алкілоксикарбоніл;
R3 є радикал алкіл, або ж два радикали R3 разом з атомом вуглецю, до якого вони приєднані, утворюють радикал циклоалкіл, що містить від 3 до 6 ланок у циклі;
R4 є радикал галоїдалкіл, що містить від 4 до 6 атомів вуглецю і від 3 до 9 атомів фтору;
n дорівнює 0 або 1;
R9 є атом водню або -COCF3.
9. Сполука за будь-яким із пп. 1-8, де R1 є радикали ціано, нітро, -NR8-CO-R5, -NR8-SO2-R5, -NR8-CO-(CH2)nNR6R7, -NR8-SO2-(CH2)n-NR6R7 або -СО-NH2; n дорівнює 0 або 1; R5 є радикал алкіл, R6 і R7 незалежно один від одного є атом водню або радикал алкіл, a R2 є радикал алкіл або галоїдалкіл.
10. Сполука за будь-яким із попередніх пунктів, де R1 є радикал нітро або -NR8-CO-R5, в котрому R5 є радикал алкіл.
11. Сполука за будь-яким із пп. 1-10, де радикал алкіл є метильною групою, і/або радикал галоїдалкіл являє собою трифторметильну групу або радикал з загальною формулою C5H6F5, C5H4F7, С6Н8F5, C6H6F7 або C6H4F9.
12. Сполука за будь-яким із попередніх пунктів, де Y є алкіленовий ланцюг із 9-10 атомами вуглецю.
13. Сполука за будь-яким із попередніх пунктів, вибрана із групи:
5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діону,
5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{10-[(4,4,5,5,5-пентафторпентил)сульфініл]децил}імідазолідин-2,4-діону,
5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4-трифторбутил)тіо]ноніл}імідазолідин-2,4-діону,
5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4-трифторбутил)сульфініл]ноніл}імідазолідин-2,4-діону,
N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]-ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл]ацетаміду,
N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]ноніл}-імідазолідин-1-іл)-2-(трифторметил)феніл]-N2,N2-диметилгліцинаміду,
хлоргідрату N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]ноніл}-імідазолідин-1-іл)-2-(трифторметил)феніл]-N2,N2-диметилгліцинаміду,
або її фармацевтично прийнятна сіль.
14. Сполука за будь-яким із попередніх пунктів, що є N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл]ацетамідом, або її фармацевтично прийнятна сіль.
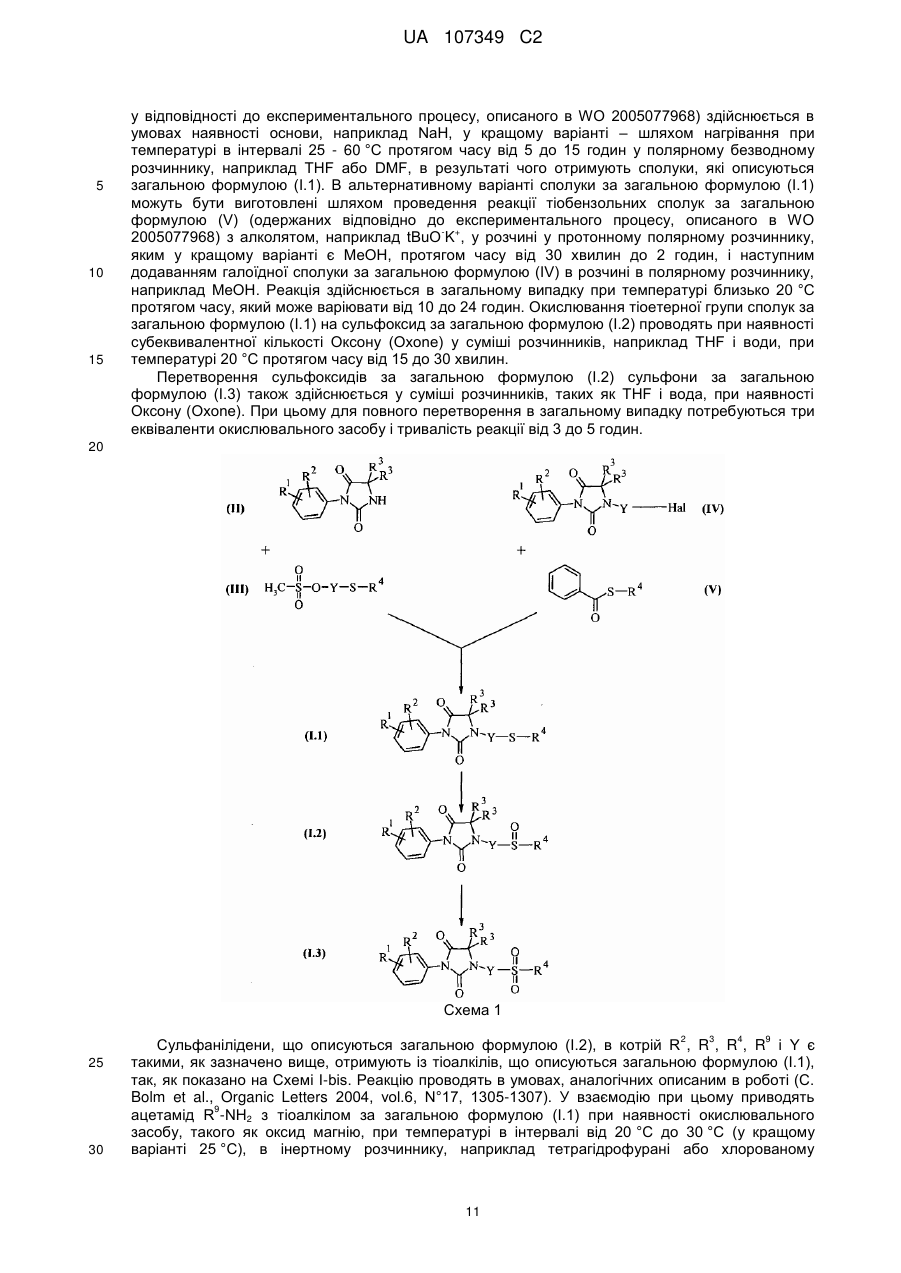
15. Спосіб отримання сполуки за формулою (І) за будь-яким із пунктів пп. 1-14, який відрізняється тим, що здійснюють одержання сполуки, що описується загальною формулою (I.1) (сполука за загальною формулою (І), в якій X є атом сірки)
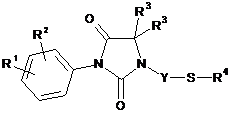 , (I.1)
, (I.1)
де R1, R2, R3, R4 i Y є такими, як визначено в будь-якому із пп. 1-14,
шляхом конденсації похідної гідантоїну за загальною формулою (II)
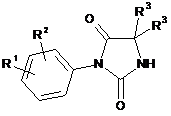 , (II)
, (II)
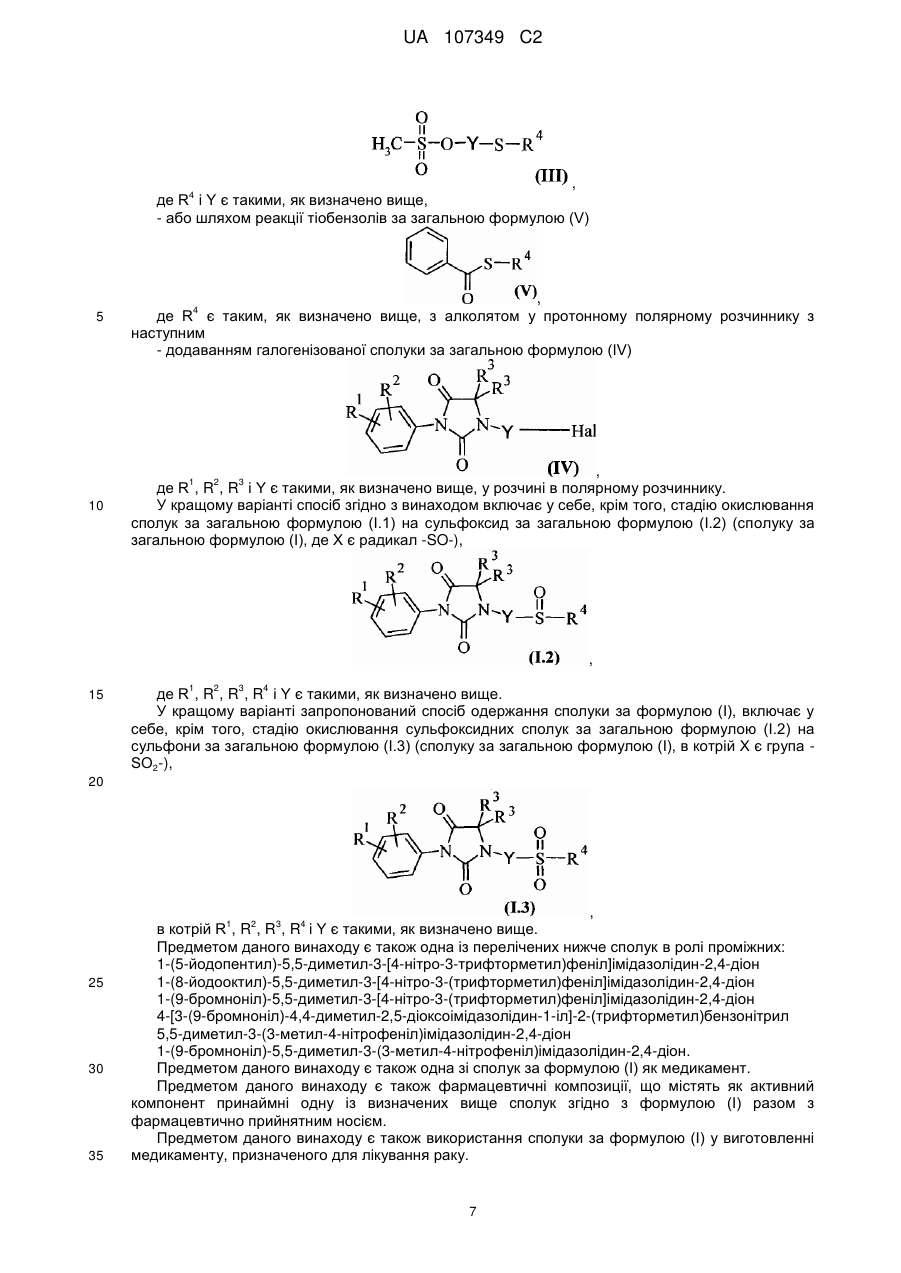
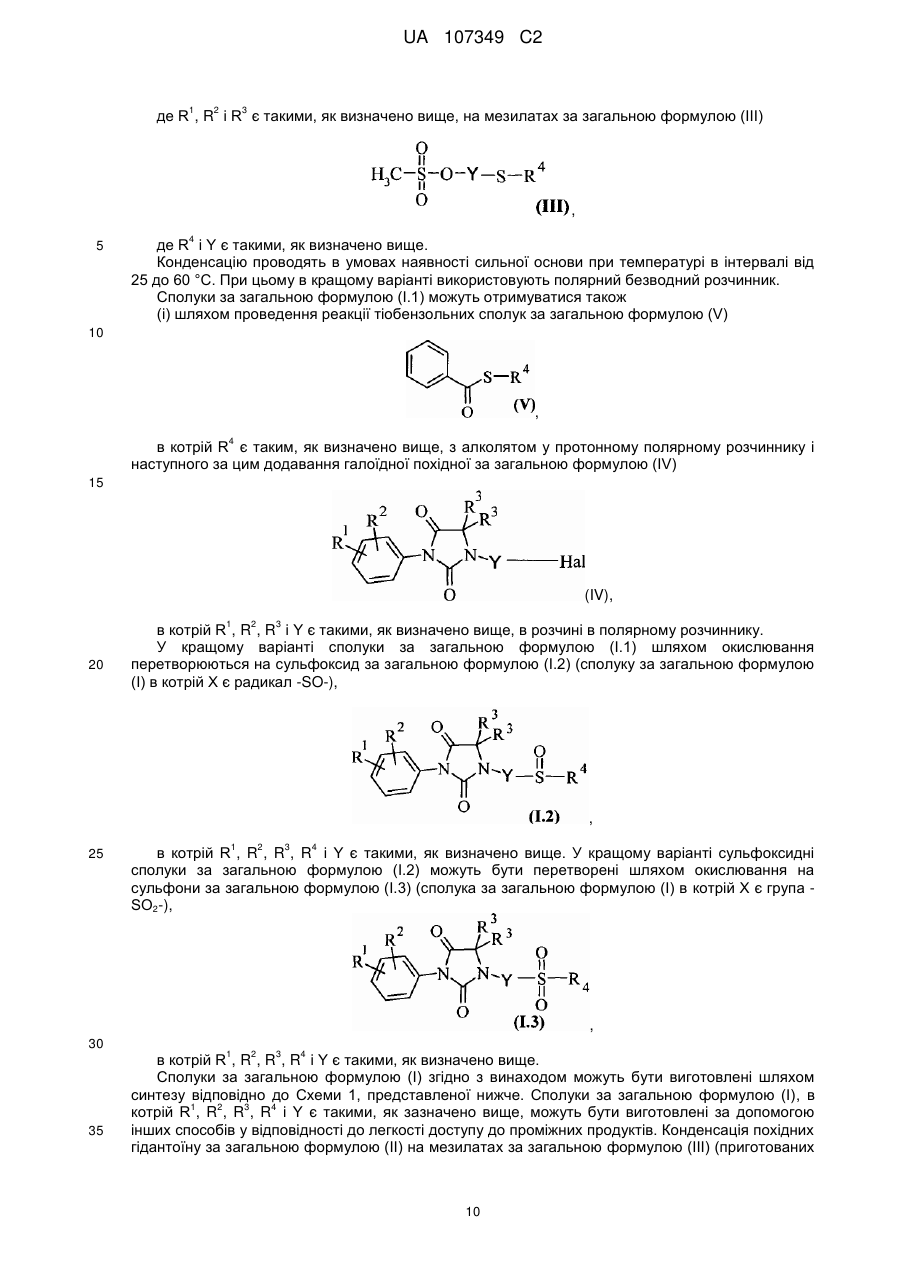
де R1, R2, і R3 є такими, як визначено в будь-якому із пп. 1-14, при наявності сильної основи та за температури в інтервалі від 25 до 60 °C, в полярному безводному розчиннику, із мезилатом за загальною формулою (III)
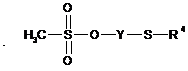 , (III)
, (III)
де R4 і Y є такими, як визначено в будь-якому із пп. 1-12.
16. Спосіб отримання сполуки за формулою (І) за будь-яким із пунктів пп. 1-14, який відрізняється тим, що здійснюють одержання сполуки, що описується загальною формулою (I.1) (сполука за загальною формулою (І), в якій X є атом сірки)
 , (I.1)
, (I.1)
де R1, R2, R3, R4 i Y є такими, як визначено в будь-якому із пп. 1-14, шляхом реакції тіобензолу за загальною формулою (V)
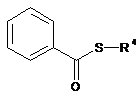 , (V)
, (V)
де R4 є таким, як визначено в будь-якому із пп. 1-14, з алколятом у протонному полярному розчиннику з наступним додаванням галогенізованої сполуки за загальною формулою (IV)
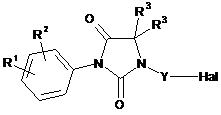 , (IV)
, (IV)
де R1, R2, R3 і Y є такими, як визначено в будь-якому із пп. 1-14, в розчині в полярному розчиннику.
17. Спосіб отримання сполуки за формулою (І) за п. 15, в якому додатково здійснюють стадію
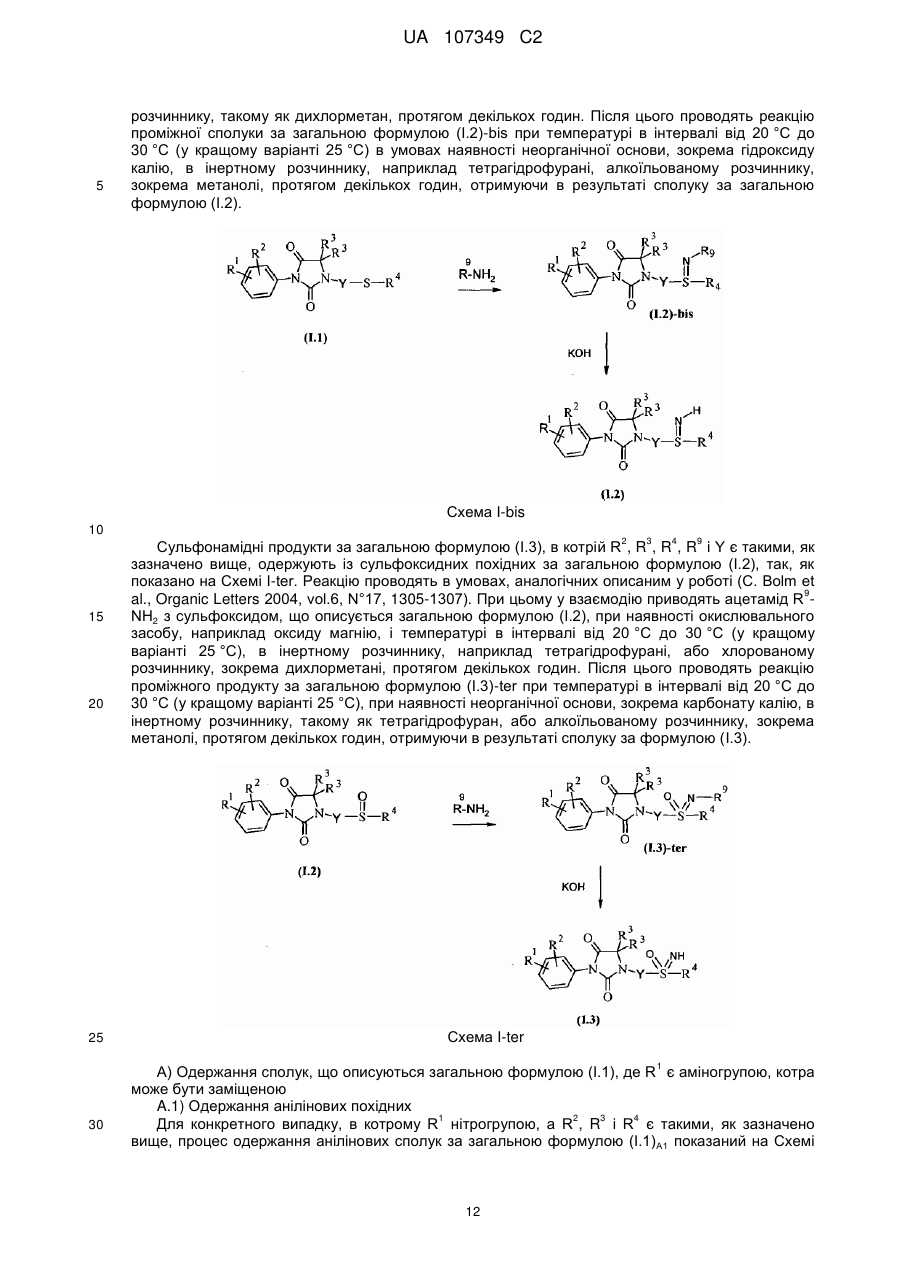
окиснення сполуки за загальною формулою (I.1), що відповідає визначеній в п. 15, до сульфоксиду за загальною формулою (I.2) (сполука за загальною формулою (І), в якій X є радикалом -SO-)
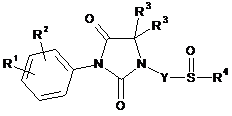 , (I.2)
, (I.2)
де R1, R2, R3, R4 i Y є такими, як визначено в будь-якому із пп. 1-14, причому окиснення здійснюють при наявності оксону або оксиду магнію.
18. Спосіб отримання сполуки за формулою (І) за п. 16, в якому додатково здійснюють стадію
окиснення сполуки за загальною формулою (I.1), що відповідає визначеній в п. 15, до сульфоксиду за загальною формулою (I.2) (сполука за загальною формулою (І), в якій X є радикалом -SO-)
 , (I.2)
, (I.2)
де R1, R2, R3, R4 і Y є такими, як визначено в будь-якому із пп. 1-14, причому окиснення здійснюють при наявності оксону або оксиду магнію.
19. Спосіб отримання сполуки за формулою (І) за п. 17, в якому додатково здійснюють стадію
окиснення сульфоксиду за загальною формулою (I.2) до сульфону за загальною формулою (І.3) (сполука за загальною формулою (І), в якій X є групою -SO2-)
 , (I.3)
, (I.3)
де R1, R2, R3, R4 i Y є такими, як визначено в будь-якому із пп. 1-14, причому окиснення здійснюють при наявності оксону або оксиду магнію.
20. Спосіб отримання сполуки за формулою (І) за п. 18, в якому додатково здійснюють стадію
окиснення сульфоксиду за загальною формулою (I.2) до сульфону за загальною формулою (І.3) (сполука за загальною формулою (І), в якій X є групою -SO2-)
 , (I.3)
, (I.3)
де R1, R2, R3, R4 і Y є такими, як визначено в будь-якому із пп. 1-14, причому окиснення здійснюють при наявності оксону або оксиду магнію.
21. Проміжна сполука, яка є однією із перелічених нижче сполук:
1-(5-йодопентил)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон,
1-(8-йодоктил)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон,
1-(9-бромноніл)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон,
4-[3-(9-бромноніл)-4,4-диметил-2,5-діоксоімідазолідин-1-іл]-2-(трифторметил)бензонітрил,
5,5-диметил-3-(3-метил-4-нітрофеніл)імідазолідин-2,4-діон,
1-(9-бромноніл)-5,5-диметил-3-(3-метил-4-нітрофеніл)імідазолідин-2,4-діон.
22. Сполука за будь-яким із пунктів пп. 1-14 як медикамент.
23. Фармацевтична композиція, що містить як активний компонент принаймні одну сполуку за формулою (І) відповідно до визначеної в будь-якому з пп. 1-14 разом із фармацевтично прийнятним носієм.
24. Застосування сполуки за формулою (І) за будь-яким із пп. 1-14 для виготовлення медикаменту, призначеного для лікування раку.
25. Застосування за п. 24, яке відрізняється тим, що медикамент призначається для лікування гормонозалежного раку.
26. Застосування за п. 24, яке відрізняється тим, що медикамент призначається для лікування раку, що експресує рецептори андрогенів.
27. Застосування за будь-яким із пп. 25 або 26, яке відрізняється тим, що медикамент призначається для лікування раку молочної залози або простати.
Текст
Реферат: Предметом даного винаходу є нові похідні імідазолідин-2,4-діону, що описуються загальною 1 2 3 4 формулою (І), де R , R , R , R , X і Υ є змінними. Ці матеріали мають антипроліферативну активність. Вони є особливо корисними в лікуванні патологічних станів і хвороб, пов'язаних з аномальною клітинною проліферацією, а саме таких як рак. Винахід стосується також фармацевтичних композицій, що містять ці матеріали, та їх застосування у виготовленні медикаменту. UA 107349 C2 (12) UA 107349 C2 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 Галузь техніки, до якої належить винахід Предметом даного винаходу є нові похідні імідазолідин-2,4-діону. Ці молекули володіють антипроліферативною активністю. Вони є особливо корисними в лікуванні патологічних станів і хвороб, пов’язаних з аномальною проліферацією клітин, тобто, таких як рак. Винахід стосується, в тому числі, фармацевтичних композицій, що містять зазначені молекули, а також їх використання у виготовленні медикаменту. Рівень техніки На сьогоднішній день рак все ще залишається однією з головних причин смертей, незважаючи на наявність численних відповідних молекул на ринку медикаментів. Це робить необхідним пошук нових, більш потужних молекул, здатних на кращу протипухлинну дію, зумовлену їхньою кращою спроможністю інгібувати проліферацію клітинних пухлинних колоній. Отже, такі молекули могли б використовуватися в лікуванні патологічних станів, пов’язаних з аномальною проліферацією клітин. Об’єктами їх застосування можуть бути, наприклад, ракові клітини стравоходу, шлунку, кишечнику, прямої кишки, ротової порожнини, глотки, гортані, легенів, ободової кишки, молочної залози, шийки матки, тіла матки, яєчників, простати, тестикулів, сечового міхура, нирок, печінки, підшлункової залози, кісток, з’єднувальних тканин, шкіри (наприклад, меланоми), очей, мозку і центральної нервової системи, а також рак щитовидної залози, лейкемія, хвороба Ходжкіна, інші лімфоми, відмінні від лімфоми Ходжкіна, множинні меланоми та інші види раку. Особливо цікавим видається знайти засоби лікування гормонозалежних видів раку, пухлин, що експресують рецептори андрогенів, засоби лікування раку молочної залози і простати. Використання антиандрогенів при лікуванні раку простати ґрунтується на їхній здатності конкурувати з природними агоністами рецептора андрогенів. Але через обмежену в часі ефективність цих антиандрогенів, хвороби, кінець кінцем, вислизали з під їхнього впливу. Стосовно цього вислизання було запропоновано чимало гіпотез, які вказували на агоністичну, а не на антагоністичну активність зазначених молекул (Veldscholte J, Berrevoets CA, Brinkmann AO, Grootegoed JA, Mulder E. Biochemistry 1992 Mar 3; 31(8):2393-9). На підтвердження цього, наприклад, нілутамід є здатним стимулювати ріст людських клітин раку простати в культурі. В додаток до цих експериментальних свідчень, злоякісну роль антиандрогенів підтверджують також клінічні дані (Akimoto S.; Antiandrogen withdrawal syndrome Nippon Rinsho. 1998 Aug; 56(8):2135-9. Paul R, Breul J. Antiandrogen withdrawal syndrome associated with prostate cancer therapies: incidence and clinical significance Drug Saf. 2000 Nov; 23(5):381-90). Крім того, не простою справою виявилося отримання чистих антиандрогенних сполук, а роботи К. Татібани (K. Tachibana et al., Bioorg. Med. Chem. 15 (2007) 174-185) і Кентина (Cantin et al., The Journal of Biological Chemistry, 282, 42, (2007) 30910-30919) показують, що сполуки з дуже близькими між собою хімічними структурами, які мають фармакофорний ліганд рецепторів андрогенів, можуть призводити до агоністичної біологічної активності, що є «неначе антагоністичною». Заявником були визначені сполуки, що демонструють антипроліферативну активність до пухлини простати і, на подив, не виказують агоністичної активності при концентраціях, в котрих нілутамід веде себе як агоніст. Ця відмінність нових сполук у впливі на проліферацію, порівняно з нілутамідом, підтверджується їхньою здатністю викликати зникнення рецепторів андрогенів в їхній білковій формі. Що ж до нілутаміду, то він не чинить будь-якого впливу на цю рецепторну популяцію. Властивості нових сполук дозволять найкращим чином взятися за справу лікування раку простати, уникаючи при цьому явища «вислизання» з під дії ліків, притаманного сучасним антиандрогенам. Крім того, сполуки за даним винаходом можуть використовуватися також у лікуванні патологій, пов’язаних з наявністю рецепторів андрогенів, тобто таких, наприклад, як доброякісна гіперплазія простати, збільшення простати, акне, андрогенна алопеція, гірсутизм тощо. Суть винаходу Таким чином, предметом даного винаходу є сполуки, які мають загальну формулу (І) 1 UA 107349 C2 , 5 10 15 20 25 30 35 40 45 50 у рацемічній, енантіомерній або в будь-який комбінованій із них формі, де: 1 2 R і R незалежно один від одного є атом галогену або радикали алкіл, галоїдалкіл, алкокси, 8 5 8 5 8 6 7 ціано, нітро, аміно, алкіламіно, діалкіламіно, -NR -CO-R , -NR -SO2-R , -NR -CO-(CH2)n-NR R , 8 6 7 NR -SO2-(CH2)n-NR R або -CO-NH2; n є ціле число, вибране серед 0, 1, 2, 3, 4, 5 і 6; 5 R є радикал алкіл, арил або гетероарил; 6 7 R і R незалежно один від одного є атом водню, радикали алкіл або алкілоксикарбоніл; 8 R є атом водню або радикал алкіл; 3 3 R є радикал алкіл або атом водню; або ж два радикали R разом з атомом вуглецю, до якого вони приєднані, утворюють радикал циклоалкіл, що містить від 3 до 6 ланок ланцюга; 4 R є радикал галоїдалкіл із 2 - 10 атомів вуглецю; Y є алкіленовий ланцюг із 2 - 14 атомів вуглецю, прямий або розгалужений, який може бути насиченим або ненесиченим і містити одну чи багато додаткових ланок -O-; 9 9 X є -S-, -SO-, -SO2-, -S=N(R )- або -S(O)=N(R )-, 9 R є атом водню або радикал галоїдалкілкарбоніл або фармацевтично прийнятна сіль останньої. У кращому варіанті Y є прямий насичений алкіленовий ланцюг, що складається із 2 - 14 атомів вуглецю. 1 У кращому варіанті R є атом галогену або радикали алкіл, алкокси, ціано, нітро, аміно, 8 5 8 5 8 6 7 8 алкіламіно, діалкіламіно, -NR -CO-R , -NR -SO2-R , -NR -CO-(CH2)n-NR R , -NR -SO2-(CH2)n6 7 2 NR R або -CO-NH2; R є атом галогену, радикал алкіл або галоїдалкіл. 2 У кращому варіанті R є атом водню. 8 У кращому варіанті R є атом водню. 5 У кращому варіанті R є радикал алкіл. 3 У кращому варіанті R є радикал алкіл. 4 У кращому варіанті R є радикал галоїдалкіл, що містить від 4 до 6 атомів вуглецю і від 3 до 9 атомів фтору; а Y є алкіленовий ланцюг із 5 - 10 атомів вуглецю. У кращому варіанті n є ціле число, вибране серед 0, 1, 2, 3 і 4. У кращому варіанті n дорівнює 0 або 1. У кращому варіанті n дорівнює 0. У кращому варіанті n дорівнює 1. В одному із альтернативних варіантів n дорівнює 2. В одному із альтернативних варіантів n дорівнює 3. 1 У кращому варіанті R є в пара-положенні. 2 У кращому варіанті R є в мета-положенні. 1 8 5 8 5 8 У кращому варіанті R є радикали ціано, нітро, аміно, -NR -CO-R , -NR -SO2-R , -NR -CO6 7 8 6 7 (CH2)n-NR R , -NR -SO2-(CH2)n-NR R або -CO-NH2; 2 R є радикал алкіл або галоїдалкіл; 5 R є радикал алкіл; 6 7 R і R незалежно один від одного є атом водню, радикали алкіл або алкілоксикарбоніл; 3 3 R є радикал алкіл, або два радикали R разом з атомом вуглецю, до якого вони приєднані, утворюють радикал циклоалкіл, що містить від 3 до 6 ланок; 4 R є радикал галоїдалкіл, що містить від 4 до 6 атомів вуглецю і від 3 до 9 атомів фтору; n дорівнює 0 або 1; а 9 R є атом водню або –COCF3. 1 5 6 У кращому варіанті R є радикали ціано, нітро, аміно, -NH-CO-R , -CO-NH2, -NH-CO-NHR , 6 NH-SO2-NHR ; 2 R є радикал алкіл або галоїдалкіл; 5 R є радикал алкіл; 6 R є атом водню, радикали алкіл або алкілоксикарбоніл; 3 R є радикал алкіл; 4 R є радикал галоїдалкіл, що містить від 4 до 6 атомів вуглецю і від 3 до 9 атомів фтору; і n є ціле число, що лежить в інтервалі від 5 до 11. 2 UA 107349 C2 1 5 10 15 20 25 30 35 40 45 50 55 8 5 8 5 8 У кращому варіанті R є радикали ціано, нітро, -NR -CO-R , -NR -SO2-R , -NR -CO6 7 8 6 7 5 6 7 (CH2)nNR R , -NR -SO2-(CH2)n-NR R або -CO-NH2; n дорівнює 0 або 1; R є радикал алкіл, R і R 2 незалежно один від одного є атом водню або радикал алкіл, а R є радикал алкіл або галоїдалкіл. 1 5 6 У кращому варіанті R є радикали ціано, нітро, -NH-CO-R , -CO-NH2, -NH-CO-NHR , -NH-SO26 5 6 2 NHR ; R є радикал алкіл, R є атом водню або радикал алкіл, а R є радикал алкіл або галоїдалкіл. 1 8 5 5 У кращому варіанті R є радикал нітро або -NR -CO-R , в котрому R є радикал алкіл. 1 5 5 У кращому варіанті R є радикал нітро або -NH-CO-R , в котрому R є радикал алкіл. У кращому варіанті радикал алкіл являє собою метильну групу і/або радикал галоїдалкіл являє собою трифторметильну групу або радикал з загальною формулою C5H6F5, C5H4F7, C6H8F5, C6H6F7 або C6Н4F9. У кращому варіанті Y є алкіленовий ланцюг, що складається із 9 - 10 атомів вуглецю. У кращому варіанті предметом даного винаходу є сполука за загальною формулою (I), вибрана серед: 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)тіо]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфоніл]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{5-[(4,4,5,5,5пентафторпентил)тіо]пентил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{5-[(4,4,5,5,5пентафторпентил)сульфініл]пентил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{8-[(4,4,5,5,5пентафторпентил)тіо]октил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{8-[(4,4,5,5,5пентафторпентил)сульфініл]октил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{10-[(4,4,5,5,5пентафторпентил)тіо]децил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{10-[(4,4,5,5,5пентафторпентил)сульфініл]децил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{11-[(4,4,5,5,5пентафторпентил)тіо]ундецил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{11-[(4,4,5,5,5пентафторпентил)сульфініл]ундецил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4трифторбутил)тіо]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4трифторбутил)сульфініл]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(3,3,4,4,5,5,6,6,6нонафторгексил)тіо]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(3,3,4,4,5,5,6,6,6нонафторгексил)сульфініл]ноніл}імідазолідин-2,4-діону 3-[4-аміно-3-(трифторметил)феніл]-5,5-диметил-1-{9-[(4,4,5,5,5пентафторпентил)тіо]ноніл}імідазолідин-2,4-діону N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)тіо]ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл]ацетаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]-ноніл}імідазолідин1-іл)-2-(трифторметил)феніл]ацетаміду 4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентилсульфаніл]ноніл} імідазолідин-1іл)-2-(трифторметил)бензонітрилу 4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл} імідазолідин-1-іл)-2-(трифторметил)бензонітрилу 4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфаніл] ноніл} імідазолідин-1-іл)-2-(трифторметил)бензаміду 4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл} імідазолідин-1-іл)-2-(трифторметил)бензаміду 3 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 55 5,5-диметил-3-(3-метил-4-нітрофеніл)-1-{9-[(4,4,5,5,5-пентафторпентил) сульфаніл]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-(3-метил-4-нітрофеніл)-1-{9-[(4,4,5,5,5-пентафторпентил) сульфініл]ноніл}імідазолідин-2,4-діону 3-(4-аміно-3-метилфеніл)-5,5-диметил-1-{9-[(4,4,5,5,5-пентафторпентил) сульфаніл]ноніл}імідазолідин-2,4-діону 3-(4-аміно-3-метилфеніл)-5,5-диметил-1-{9-[(4,4,5,5,5-пентафторпентил) сульфініл]ноніл}імідазолідин-2,4-діону 1-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфаніл] ноніл}імідазолідин1-іл)-2-метилфеніл]-3-(1-метилпропіл)сечовини 1-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл}імідазолідин1-іл)-2-метилфеніл]-3-(1-метилпропіл)сечовини трет-бутил{[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил) сульфаніл]ноніл}імідазолідин-1-іл)-2-метилфеніл]сульфамоїл}карбамату N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфаніл] ноніл}імідазолідин1-іл)-2-метилфеніл]сульфаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл} імідазолідин-1-іл)-2-метилфеніл]сульфаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфоніл] ноніл}імідазолідин1-іл)-2-метилфеніл]сульфаміду 3-[4-аміно-3-(трифторметил)феніл]-5,5-диметил-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діону 7-[4-нітро-3-(трифторметил)феніл]-5-{9-[(4,4,5,5,5-пентафторпентил) сульфініл]ноніл}-5,7діазаспіро[3.4]октан-6,8-діону 5,5-диметил-3-[4-нітро-2-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-[2-(2-{2-[(4,4,5,5,5пентафторпентил)сульфаніл]етоксі}етоксі)етил]імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-[2-(2-{2-[(4,4,5,5,5пентафторпентил)сульфініл]етоксі}етоксі)етил]імідазолідин-2,4-діону N-[4-{4,4-диметил-2,5-діоксо-3-[2-(2-{2-[(4,4,5,5,5-пентафторпентил) сульфаніл]етоксі}етоксі)етил]імідазолідин-1-іл}-2-(трифторметил)феніл]ацетаміду N-[4-{4,4-диметил-2,5-діоксо-3-[2-(2-{2-[(4,4,5,5,5-пентафторпентил) сульфініл]етоксі}етоксі)етил]імідазолідин-1-іл}-2-(трифторметил)феніл]ацетаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл}імідазолідин1-іл)-2-(трифторметил)феніл]-N-метилацетаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл}імідазолідин1-іл)-2-(трифторметил)феніл]метансульфонаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфаніл] ноніл}імідазолідин1-іл)-2-(трифторметил)феніл]-N2,N2-диметилгліцинаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл}імідазолідин1-іл)-2-(трифторметил)феніл]-N2,N2-диметилгліцинаміду хлоргідрату N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил) сульфініл]ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл]-N2,N2-диметилгліцинаміду N-[(1Z)-(9-{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-2,4-діоксоімідазолідин-1іл}ноніл)(4,4,5,5,5-пентафторпентил)-□4-сульфаніліден]-2,2,2-трифторацетаміду N-[(9-{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-2,4-діоксоімідазолідин-1іл}ноніл)(оксид)(4,4,5,5,5-пентафторпентил)-□4-сульфаніліден]-2,2,2-трифторацетаміду 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[S-(4,4,5,5,5пентафторпентил)сульфонімідоїл]ноніл}імідазолідин-2,4-діону. У кращому варіанті сполуку за формулою (I) вибирають серед: 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)тіо]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфоніл]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{5-[(4,4,5,5,5пентафторпентил)тіо]пентил}імідазолідин-2,4-діону 4 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 55 60 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{5-[(4,4,5,5,5пентафторпентил)сульфініл]пентил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{8-[(4,4,5,5,5пентафторпентил)тіо]октил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{8-[(4,4,5,5,5пентафторпентил)сульфініл]октил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{10-[(4,4,5,5,5пентафторпентил)тіо]децил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{10-[(4,4,5,5,5пентафторпентил)сульфініл]децил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{11-[(4,4,5,5,5пентафторпентил)тіо]ундецил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{11-[(4,4,5,5,5пентафторпентил)сульфініл]ундецил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4трифторбутил)тіо]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4трифторбутил)сульфініл]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(3,3,4,4,5,5,6,6,6нонафторгексил)тіо]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(3,3,4,4,5,5,6,6,6нонафторгексил)сульфініл]ноніл}імідазолідин-2,4-діону 3-[4-аміно-3-(трифторметил)феніл]-5,5-диметил-1-{9-[(4,4,5,5,5пентафторпентил)тіо]ноніл}імідазолідин-2,4-діону N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)тіо]ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл]ацетаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]- ноніл}імідазолідин1-іл)-2-(трифторметил)феніл]ацетаміду 4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентилсульфаніл]ноніл} імідазолідин-1іл)-2-(трифторметил)бензонітрилу 4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]ноніл} імідазолідин-1іл)-2-(трифторметил)бензонітрилу 4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфаніл] ноніл}імідазолідин-1іл)-2-(трифторметил)бензаміду 4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]ноніл} імідазолідин-1іл)-2-(трифторметил)бензаміду 5,5-диметил-3-(3-метил-4-нітрофеніл)-1-{9-[(4,4,5,5,5-пентафторпентил) сульфаніл]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-(3-метил-4-нітрофеніл)-1-{9-[(4,4,5,5,5-пентафторпентил) сульфініл]ноніл}імідазолідин-2,4-діону 3-(4-аміно-3-метилфеніл)-5,5-диметил-1-{9-[(4,4,5,5,5-пентафторпентил) сульфаніл]ноніл}імідазолідин-2,4-діону 3-(4-аміно-3-метилфеніл)-5,5-диметил-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діону 1-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфаніл] ноніл}імідазолідин1-іл)-2-метилфеніл]-3-(1-метилпропіл)сечовини 1-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл}імідазолідин1-іл)-2-метилфеніл]-3-(1-метилпропіл)сечовини трет-бутил{[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил) сульфаніл]ноніл}імідазолідин-1-іл)-2-метилфеніл]сульфамоїл}карбамату N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфаніл] ноніл}імідазолідин1-іл)-2-метилфеніл]сульфаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл}імідазолідин1-іл)-2-метилфеніл]сульфаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфоніл] ноніл}імідазолідин-1-іл)-2-метилфеніл]сульфаміду 3-[4-аміно-3-(трифторметил)феніл]-5,5-диметил-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діону. У ще кращому варіанті предметом даного винаходу є сполука за загальною формулою (I), яку вибирають серед: 5 UA 107349 C2 5 10 15 20 25 30 35 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{10-[(4,4,5,5,5пентафторпентил)сульфініл]децил}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4-трифторбутил) тіо]ноніл}імідазолідин-2,4-діону 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4-трифторбутил) сульфініл]ноніл}імідазолідин-2,4-діону N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]- ноніл}імідазолідин1-іл)-2-(трифторметил)феніл]ацетаміду N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл}імідазолідин1-іл)-2-(трифторметил)феніл]-N2,N2-диметилгліцинаміду Хлоргідрату N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл]-N2,N2диметилгліцинаміду. В одному з кращих варіантів сполуку згідно з винаходом вибирають серед: 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діону; 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{10-[(4,4,5,5,5пентафторпентил)сульфініл]децил}імідазолідин-2,4-діону; 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4трифторбутил)тіо]ноніл}імідазолідин-2,4-діону; 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4трифторбутил)сульфініл]ноніл}імідазолідин-2,4-діону; N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]-ноніл}імідазолідин1-іл)-2-(трифторметил)феніл]ацетаміду. У кращому варіанті сполукою згідно з даним винаходом є N-[4-(4,4-диметил-2,5-діоксо-3-{9[(4,4,5,5,5-пентафторпентил)сульфініл]-ноніл}імідазолідин-1-іл)-2(трифторметил)феніл]ацетамід. У кращому варіанті сполукою згідно з даним винаходом є N-[4-(4,4-диметил-2,5-діоксо-3-{9[(4,4,5,5,5-пентафторпентил)сульфініл]ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл]-N2,N2диметилгліцинамід. У кращому варіанті сполукою згідно з даним винаходом є хлоргідрат N-[4-(4,4-диметил-2,5діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл]ноніл}імідазолідин-1-іл)-2(трифторметил)феніл]-N2,N2-диметилгліцинамід. Предметом даного винаходу є також спосіб одержання сполуки за формулою (I) згідно з визначеним вище, який відрізняється тим, що він включає у себе одержання сполук, що описуються загальною формулою (І.1) (сполуки за загальною формулою (I), в котрій X є атом сірки), 40 1 2 3 4 де R , R , R , R і Y є такими, як визначено вище, - або шляхом конденсації похідних гідантоїну за загальною формулою (II) 45 , 1 50 2 3 де R , R і R є такими, як визначено вище, в умовах наявності сильної основи при температурі в інтервалі 25 - 60 °C, у полярному безводному розчиннику на мезилатах за загальною формулою (III) 6 UA 107349 C2 , 4 де R і Y є такими, як визначено вище, - або шляхом реакції тіобензолів за загальною формулою (V) 5 10 , 4 де R є таким, як визначено вище, з алколятом у протонному полярному розчиннику з наступним - додаванням галогенізованої сполуки за загальною формулою (IV) , 1 2 3 де R , R , R і Y є такими, як визначено вище, у розчині в полярному розчиннику. У кращому варіанті спосіб згідно з винаходом включає у себе, крім того, стадію окислювання сполук за загальною формулою (І.1) на сульфоксид за загальною формулою (І.2) (сполуку за загальною формулою (I), де X є радикал -SO-), , 15 1 2 3 4 де R , R , R , R і Y є такими, як визначено вище. У кращому варіанті запропонований спосіб одержання сполуки за формулою (I), включає у себе, крім того, стадію окислювання сульфоксидних сполук за загальною формулою (І.2) на сульфони за загальною формулою (І.3) (сполуку за загальною формулою (I), в котрій X є група SО2-), 20 25 30 35 , 1 2 3 4 в котрій R , R , R , R і Y є такими, як визначено вище. Предметом даного винаходу є також одна із перелічених нижче сполук в ролі проміжних: 1-(5-йодопентил)-5,5-диметил-3-[4-нітро-3-трифторметил)феніл]імідазолідин-2,4-діон 1-(8-йодооктил)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон 1-(9-бромноніл)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон 4-[3-(9-бромноніл)-4,4-диметил-2,5-діоксоімідазолідин-1-іл]-2-(трифторметил)бензонітрил 5,5-диметил-3-(3-метил-4-нітрофеніл)імідазолідин-2,4-діон 1-(9-бромноніл)-5,5-диметил-3-(3-метил-4-нітрофеніл)імідазолідин-2,4-діон. Предметом даного винаходу є також одна зі сполук за формулою (I) як медикамент. Предметом даного винаходу є також фармацевтичні композиції, що містять як активний компонент принаймні одну із визначених вище сполук згідно з формулою (І) разом з фармацевтично прийнятним носієм. Предметом даного винаходу є також використання сполуки за формулою (I) у виготовленні медикаменту, призначеного для лікування раку. 7 UA 107349 C2 5 10 15 У кращому варіанті вищезгаданий медикамент призначається для лікування гормонозалежного раку. У кращому варіанті вищезгаданий медикамент призначається для лікування раку, що експресує рецептори андрогенів. У кращому варіанті вищезгаданий медикамент призначається для лікування раку молочної залози або простати. Перелік фігур креслення На Фіг. 1 показаний вплив сполук 18 і 43a на проліферацію клітин LNCaP, вирощуваних у середовищі без стероїду. На Фіг. 2 і 3 показаний вплив сполук 18 і 43a на зниження білкової експресії рецептора андрогенів. На Фіг. 4 показаний вплив нілутаміду на зниження білкової експресії рецептора андрогенів. Докладний опис деяких варіантів здійснення даного винаходу Згідно з вищевикладеним, предметом даного винаходу є сполуки, що описуються загальною формулою (I) , 20 25 30 35 40 45 50 у рацемічній, енантіомерній або в будь-який комбінованій із них формі. 1 2 R і R незалежно один від одного є атом галогену або ж радикали алкіл, галоїдалкіл, 8 5 8 5 8 алкокси, ціано, нітро, аміно, алкіламіно, діалкіламіно, -NR -CO-R , -NR -SO2-R , -NR -CO-(CH2)n6 7 8 6 7 NR R , -NR -SO2-(CH2)n-NR R або -CO-NH2. n є ціле число, що лежить в інтервалі від 0 до 6. 5 5 R є радикал алкіл, арил або гетероарил. У кращому варіанті R є радикал алкіл. 6 7 R і R незалежно один від одного є атом водню, радикали алкіл або алкілоксикарбоніл. 8 8 R є атом водню або радикал алкіл. У кращому варіанті R є атом водню. 3 3 R є радикал алкіл або атом водню. В альтернативному варіанті два радикали R разом з атомом вуглецю, до якого вони приєднані, утворюють радикал циклоалкіл, що містить від 3 до 6 ланок. 4 R є радикал галоїдалкіл, що складається із 2 - 10 атомів вуглецю. Y є алкіленовий ланцюг, що складається із 2 - 14 атомів вуглецю. Ланцюг Y може бути прямим або розгалуженим. Крім того, цей ланцюг може бути насиченим або ненасиченим. Він може містити одну або множину додаткових ланок -O-. 9 9 X є -S-, -SO-, -SO2-, -S=N(R )- або -S(O)=N(R )-. 9 R є атом водню або радикал галоїдалкілкарбоніл. Сполуки за формулою (I) можуть бути у формі фармацевтично прийнятних солей. Під терміном «фармацевтично прийнятна сіль» тут маються на увазі солі додавання неорганічних кислот, наприклад, хлоргідрат, бромгідрат, сульфат, фосфат, дифосфат і нітрат, або органічна сіль, наприклад, ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, бензолсульфонат, p-толуолсульфонат, памоат і стеарат. Об’ємом даного винаходу охоплюються також, у разі можливості їх використання, солі, утворені із основ, такі як гідроксид натрію або калію. Інші приклади фармацевтично прийнятних солей можна знайти в публікації ("Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217). Під використовуваним у контексті даного винаходу терміном «гало» (або «галоїд») слід розуміти радикали, що містять фтор, хлор, бром або йод, а в кращому варіанті – радикали, що містять хлор, фтор або бром. У ще кращому варіанті термін «галоген» (або «галоїд») означає фторвмісний радикал. Якщо не зазначено іншого, то використовуваний у контексті даного винаходу термін «алкіл» означає прямий або розгалужений алкіл-радикал, який містить від 1 до 12 атомів вуглецю, наприклад, радикали метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил і трет-бутил, пентил або аміл, ізопентил, неопентил, гексил або ізогексил, гептил, октил, ноніл, децил, ундецил або додецил. У кращому варіанті алкіл-радикалом є (C1-C6)алкіл-радикал, тобто алкілрадикал, який має від 1 до 6 атомів вуглецю згідно з визначеним вище, або (C1-C4)алкіл 8 UA 107349 C2 5 10 15 20 25 30 35 радикал, тобто алкіл-радикал, який має від 1 до 4 атомів вуглецю, такий, наприклад, як радикали метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил і трет-бутил. Термін «алкіл» у складних термінах алкокси (або алкілокси), алкіламіно, діалкіламіно, галоїдалкіл або алкоксикарбоніл (чи алкілоксикарбоніл) означає алкіл-радикал згідно з визначеним вище. Більш докладно, під терміном «галоїдалкіл» слід розуміти алкільний радикал, в котрому принаймні один (а можливо і всі) атоми водню є заміщеним атомом галогену (галоїду), як, наприклад, в кращому варіанті – у трифторметилі або в радикалах з загальними формулами C5H6F5, C5H4F7, C6H8F5, C6H6F7 або C6H4F9. Термін «галоїдалкіл» у складному терміні «галоїдалкілкарбоніл» означає радикал галоїдалкіл, що відповідає визначенню, даному вище. Під терміном «циклоалкіл», якщо не дано більш точних роз’яснень, слід розуміти циклічний вуглецевий насичений радикал, що містить від 3 до 6 ланок, такий як циклопропіл, циклобутил, циклопентил або циклогексил. У контексті даного винаходу арильні радикали можуть бути моно- або поліциклічними ароматичними сполуками. Моноциклічні арильні радикали можуть бути вибрані серед фенільних, толільних, ксилільних, мезитильних, куменільних, а в кращому варіанті – серед фенільних радикалів. Поліциклічні арильні радикали можуть бути вибрані серед нафтильного, антрильного, фенантрильного, фторенільного радикалів. У разі потреби вони можуть бути заміщеними одним або багатьма ідентичними або відмінними радикалами, такими як алкіл-, галоїдалкіл-, алкокси-, алкоксикарбоніл-, алкілкарбонілокси-, галоїд-вмісний, ціано-, нітро-, арильний, арилокси-, арилоксикарбоніл- або арилкарбонілокси- радикали. У контексті даного винаходу термін «гетероарил» означає циклічну ненасичену ароматичну сполуку, що містить один або множину идентичних або різних гетероатомів, вибраних серед Ν, Ο і S, таку як фурил, тієніл, ізоксазоліл, бензотіадіазоліл, піридиніл, oxaзоліл, піразоліл, піримідиніл або хіноксаліл. Під терміном «прямий або розгалужений, насичений або ненасичений ланцюг алкілену із 214 атомів вуглецю», слід розуміти, наприклад, ланцюг метилу, етилу, пропілу, ізопропілу, бутилу, ізобутилу, втор-бутилу і трет-бутилу, пентилу або амілу, ізопентилу, неопентилу, гексилу або ізогексилу, гептилу, октилу, нонілу, децилу, ундецилу, додецилу, етену, пропену, бутену, пентену, гексену, гептену, октену, нонену, децилену, ундецилену, додецилену або бут1,3-дієну. Під терміном «фармацевтично прийнятна сіль» слід розуміти солі додавання неорганічних кислот, такі як хлоргідрат, бромгідрат, сульфат, фосфат, дифосфат і нітрат, або органічних кислот, такі як ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, бензолсульфонат, p-толуолсульфонат, памоат і стеарат. Об’ємом даного винаходу охоплюються, у разі можливості їх використання, також солі, утворені із основ, такі як гідроксид натрію або калію. Інші приклади фармацевтично прийнятних солей можна знайти в публікакції ("Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217). 40 Предметом даного винаходу є також спосіб виготовлення сполуки за формулою (I), що відповідає визначенню, поданому вище. Сполуки, які описуються загальною формулою (І.1) (сполука за загальною формулою (I), в котрій X є атом сірки), , 45 1 2 3 4 в котрій R , R , R , R і Y є такими, яка визначено вище, можуть бути отримані шляхом конденсації похідних гідантоїну за загальною формулою (II) , 50 9 UA 107349 C2 1 2 3 де R , R і R є такими, як визначено вище, на мезилатах за загальною формулою (III) , 5 4 де R і Y є такими, як визначено вище. Конденсацію проводять в умовах наявності сильної основи при температурі в інтервалі від 25 до 60 °C. При цьому в кращому варіанті використовують полярний безводний розчинник. Сполуки за загальною формулою (І.1) можуть отримуватися також (і) шляхом проведення реакції тіобензольних сполук за загальною формулою (V) 10 , 4 в котрій R є таким, як визначено вище, з алколятом у протонному полярному розчиннику і наступного за цим додавання галоїдної похідної за загальною формулою (IV) 15 (IV), 1 20 2 3 в котрій R , R , R і Y є такими, як визначено вище, в розчині в полярному розчиннику. У кращому варіанті сполуки за загальною формулою (І.1) шляхом окислювання перетворюються на сульфоксид за загальною формулою (І.2) (сполуку за загальною формулою (I) в котрій X є радикал -SO-), , 25 1 2 3 4 в котрій R , R , R , R і Y є такими, як визначено вище. У кращому варіанті сульфоксидні сполуки за загальною формулою (І.2) можуть бути перетворені шляхом окислювання на сульфони за загальною формулою (І.3) (сполука за загальною формулою (I) в котрій X є група SО2-), , 30 35 1 2 3 4 в котрій R , R , R , R і Y є такими, як визначено вище. Сполуки за загальною формулою (I) згідно з винаходом можуть бути виготовлені шляхом синтезу відповідно до Схеми 1, представленої нижче. Сполуки за загальною формулою (I), в 1 2 3 4 котрій R , R , R , R і Y є такими, як зазначено вище, можуть бути виготовлені за допомогою інших способів у відповідності до легкості доступу до проміжних продуктів. Конденсація похідних гідантоїну за загальною формулою (II) на мезилатах за загальною формулою (III) (приготованих 10 UA 107349 C2 5 10 15 у відповідності до експериментального процесу, описаного в WO 2005077968) здійснюється в умовах наявності основи, наприклад NaH, у кращому варіанті – шляхом нагрівання при температурі в інтервалі 25 - 60 °C протягом часу від 5 до 15 годин у полярному безводному розчиннику, наприклад THF або DMF, в результаті чого отримують сполуки, які описуються загальною формулою (І.1). В альтернативному варіанті сполуки за загальною формулою (І.1) можуть бути виготовлені шляхом проведення реакції тіобензольних сполук за загальною формулою (V) (одержаних відповідно до експериментального процесу, описаного в WO - + 2005077968) з алколятом, наприклад tBuO K , у розчині у протонному полярному розчиннику, яким у кращому варіанті є MeOH, протягом часу від 30 хвилин до 2 годин, і наступним додаванням галоїдної сполуки за загальною формулою (IV) в розчині в полярному розчиннику, наприклад MeOH. Реакція здійснюється в загальному випадку при температурі близько 20 °C протягом часу, який може варіювати від 10 до 24 годин. Окислювання тіоетерної групи сполук за загальною формулою (І.1) на сульфоксид за загальною формулою (І.2) проводять при наявності субеквивалентної кількості Оксону (Oxone) у суміші розчинників, наприклад THF і води, при температурі 20 °C протягом часу від 15 до 30 хвилин. Перетворення сульфоксидів за загальною формулою (І.2) сульфони за загальною формулою (І.3) також здійснюється у суміші розчинників, таких як THF і вода, при наявності Оксону (Oxone). При цьому для повного перетворення в загальному випадку потребуються три еквіваленти окислювального засобу і тривалість реакції від 3 до 5 годин. 20 Схема 1 2 25 30 3 4 9 Сульфанілідени, що описуються загальною формулою (І.2), в котрій R , R , R , R і Y є такими, як зазначено вище, отримують із тіоалкілів, що описуються загальною формулою (І.1), так, як показано на Схемі I-bis. Реакцію проводять в умовах, аналогічних описаним в роботі (C. Bolm et al., Organic Letters 2004, vol.6, N°17, 1305-1307). У взаємодію при цьому приводять 9 ацетамід R -NН2 з тіоалкілом за загальною формулою (І.1) при наявності окислювального засобу, такого як оксид магнію, при температурі в інтервалі від 20 °C до 30 °C (у кращому варіанті 25 °C), в інертному розчиннику, наприклад тетрагідрофурані або хлорованому 11 UA 107349 C2 5 розчиннику, такому як дихлорметан, протягом декількох годин. Після цього проводять реакцію проміжної сполуки за загальною формулою (I.2)-bis при температурі в інтервалі від 20 °C до 30 °C (у кращому варіанті 25 °C) в умовах наявності неорганічної основи, зокрема гідроксиду калію, в інертному розчиннику, наприклад тетрагідрофурані, алкоїльованому розчиннику, зокрема метанолі, протягом декількох годин, отримуючи в результаті сполуку за загальною формулою (І.2). Схема І-bis 10 15 20 25 2 3 4 Схема I-ter 1 30 9 Сульфонамідні продукти за загальною формулою (І.3), в котрій R , R , R , R і Y є такими, як зазначено вище, одержують із сульфоксидних похідних за загальною формулою (І.2), так, як показано на Схемі I-ter. Реакцію проводять в умовах, аналогічних описаним у роботі (C. Bolm et 9 al., Organic Letters 2004, vol.6, N°17, 1305-1307). При цьому у взаємодію приводять ацетамід R NН2 з сульфоксидом, що описується загальною формулою (І.2), при наявності окислювального засобу, наприклад оксиду магнію, і температурі в інтервалі від 20 °C до 30 °C (у кращому варіанті 25 °C), в інертному розчиннику, наприклад тетрагідрофурані, або хлорованому розчиннику, зокрема дихлорметані, протягом декількох годин. Після цього проводять реакцію проміжного продукту за загальною формулою (I.3)-ter при температурі в інтервалі від 20 °C до 30 °C (у кращому варіанті 25 °C), при наявності неорганічної основи, зокрема карбонату калію, в інертному розчиннику, такому як тетрагідрофуран, або алкоїльованому розчиннику, зокрема метанолі, протягом декількох годин, отримуючи в результаті сполуку за формулою (І.3). A) Одержання сполук, що описуються загальною формулою (І.1), де R є аміногрупою, котра може бути заміщеною A.1) Одержання анілінових похідних 1 2 3 4 Для конкретного випадку, в котрому R нітрогрупою, а R , R і R є такими, як зазначено вище, процес одержання анілінових сполук за загальною формулою (І.1) А1 показаний на Схемі 12 UA 107349 C2 A1. Відновлення групи нітро сполук за загальною формулою (І.1) здійснюють за допомогою SnCl2, 2H2O (J. Heterocyciic Chem. 1987, 24, 927-930; Tetrahedron Letters 1984, 25 (8), 839-842) шляхом нагрівання зі зворотним холодильником реакційної суміші у розчиннику, наприклад етилацетаті, протягом кількох годин. 5 Схема A1 10 15 A.2) Одержання похідних ацетамідів 2 3 4 5 Ацетамідні сполуки за загальною формулою (I.1)A2, в котрій R , R , R і R є такими, як зазначено вище, одержують в одну стадію із анілінових похідних за загальною формулою (І.1) А1, відповідно до схеми A2. Реакція ацилювання при цьому може здійснюватися за допомогою 5 надлишкового хлору із кислоти за загальною формулою R -COCІ, наприклад хлору із ацетилу 5 або із ангідриду типу (R -CO)2O, яким може бути, наприклад, ангідрид оцтової кислоти. Реакцію в загальному випадку проводять при температурі близько 20 °C у безводному розчиннику, такому як дихлорметан, протягом кількох годин. Схема A2 20 25 2 3 4 5 8 Синтез проміжних сполук за загальною формулою (I.1)A2bis, де R , R , R , R , R і Y є такими, як зазначено вище, проводять так, як показано на Схемі A2bis, шляхом нуклеофільного 8 заміщення атома галогену галогенізованого реактиву за загальною формулою R -Hal аніоном ацетаміду за загальною формулою (I.1)A2, створеного при наявності основи, наприклад NaH, в апротонному полярному розчиннику, такому як DMF або DMSO. Реакцію здійснюють у загальному випадку при температурі в інтервалі від 20 до 30° C протягом часу від 1 до 5 годин. Схема A2bis 30 35 A.3) Одержання уреїдопохідних 2 3 4 6 Уреїдопохідні за загальною формулою (I.1) A3, в котрій R , R , R і R є такими, як зазначено вище, одержують в одну стадію із анілінових сполук за загальною формулою (І.1) А1 так, як 6 показано на Схемі A3. Реакцію здійснюють при наявності ізоціанату R -N=C=O шляхом нагрівання і витримування реакційної суміші при температурі в інтервалі від 70 до 120 °C протягом декількох годин, у загальному випадку, в інертному розчиннику, котрим може бути, наприклад, хлорований розчинник і, зокрема, 1,2-дихлоретан. 13 UA 107349 C2 Схема A3 5 A.4) Одержання похідних сульфамідів 2 3 4 6 Сульфамідні похідні, що описуються загальною формулою (I.1) A3, в котрій R , R , R і R є такими, як зазначено вище, одержують із анілінових сполук за загальною формулою (І.1)А1 згідно зі Схемою A4. Реакцію проводять в умовах, аналогічних описаним у WO2007125197. Схема A4 10 15 20 A.5) Одержання похідних сульфонамідів 2 3 4 5 Сульфонамідні похідні за загальною формулою (I.1) A5, в котрій R , R , R , R і Y є такими, як зазначено вище, одержують із анілінових сполук за загальною формулою (І.1) А1 так, як показано на Схемі A5. Реакцію проводять в умовах, аналогічних описаним у роботі (G.H. Chu et al., Bioorg. Med. Chem. Lett. 2007,17, 1951-1955). При цьому у взаємодію приводять хлорид 5 2 3 4 сульфонілу R -SО2-CІ з аніліновою сполукою за загальною формулою (І.1) А1, в котрій R , R , R є такими, як визначено вище, при температурі в інтервалі від 20 °C до 30 °C (у кращому варіанті 25 °C), в інертному розчиннику, такому як тетрагідрофуран, хлорованому розчиннику, зокрема 1,2-дихлоретані, протягом декількох годин. Після цього дисульфонамідну похідну за загальною формулою (I.1)A5-1 приводять у взаємодію при температурі в інтервалі від 20 °C до 30 °C (у кращому варіанті 25 °C) з неорганічною основою, зокрема гідроксидом літію, в інертному розчиннику, такому як тетрагідрофуран, алкоїльованому розчиннику, зокрема метанолі, протягом декількох годин. 25 Схема A5 1 30 Β) Синтез для одержання сполуки за загальною формулою (І.1), в котрій компонентом R є карбоксамідна група B.1) Одержання карбоксамідних похідних 14 UA 107349 C2 2 5 3 4 Карбоксамідні сполуки за загальною формулою (І.1) В1, в котрій R , R і R є такими, як зазначено вище, одержують в одну стадію із нітрильних похідних за загальною формулою (І.1) так, як показано на Схемі B1. Реакцію гідролізу здійснюють у суміші трифтороцтової і сірчаної кислот, а після цього проводять обробку водним середовищем (J. Org. Chem. 2005, 70 (5), 19261929). Схема Β1 10 15 20 C) Одержання проміжних продуктів, що описуються загальною формулою (II) 1 2 3 Синтез проміжних арилгідантоїнів за загальною формулою (II), в котрій R , R і R є такими, як зазначено вище, може здійснюватися так, як для загального підходу показано на схемах нижче. C.1) Одержання арилгідантоїнів шляхом конденсації Синтез арилгідантоїнів, що описуються загальною формулою (II), може здійснюватися так, як показано на Схемі В1, шляхом нуклеофільного заміщення атома фтору, утримуваного на ароматичному ядрі сполуки за загальною формулою (II) 1 аніоном гідантоїну за загальною формулою (ІІ)2, створеним при наявності основи, наприклад K 2CO3. Реакцію здійснюють нагрівання і витримування при температурі в інтервалі від 65 до 140 °C в апротонному полярному розчиннику, наприклад DMF або DMSO. Температура і тривалість реакції при цьому залежать від нуклеофугності атома фтору, яка значною мірою залежить від природи 1 2 компонентів R і R . Відсутні у продажу гідантоїни за загальною формулою (ІІ) 2 можуть бути одержані за допомогою методів, описаних в літературі (J. Med. Chem. 1984, 27 (12), 1663-8). 25 Схема C1 1 30 35 40 45 2 У тому випадку, коли R і R не є в достатній мірі електро-притягальними для того, щоб сприяти нуклеофільному ароматичному заміщенню відповідно до Схеми C1, може бути застосоване зближення зв'язком між арилбороновою кислотою і гідантоїном за загальною формулою (ІІ)2 при наявності ацетату міді (Synlett 2006, 14, 2290-2) з отриманням у результаті сполуки за загальною формулою (II). C.2) Одержання арилгідантоїнів шляхом побудови гідантоїнового циклу із арилізоціанату У цьому випадку гідантоїни за загальною формулою (II) одержуються відповідно до процесу, описаного в публікації (Bioorg. Med. Chem. Lett. 2004,14, 5285). C.3) Одержання арилгідантоїнів шляхом побудови гідантоїнового циклу із ізоціанатів аміноестерів В альтернативному варіанті арилгідантоїни за загальною формулою (II) можуть бути синтезовані із ізоціанату аміноестерів так, як описано в публікації (Eur. J. Med. Chem. 1984, 19 (3), 261). D) Одержання проміжних продуктів за загальною формулою (IV) 1 1 3 Синтез проміжних сполук за загальною формулою (IV), схема D1, в котрій R , R , R і Y є такими, як зазначено вище, здійснюють шляхом нуклеофільного заміщення атома галогену дигалогенізованого реактиву за загальною формулою HaІ-(CH2)n-Hal аніоном гідантоїну за загальною формулою (II), створеного при наявності основи, наприклад NaH, в апротонному полярному розчиннику, такому як DMF або DMSO. Дану реакцію у загальному випадку проводять при температурі в інтервалі від 20 до 60 °C протягом часу від 1 до 15 годин. 15 UA 107349 C2 Схема D1 5 10 15 Таким чином, предметом даного винаходу є також спосіб виготовлення сполуки за формулою (I) згідно з визначеним вище, де зазначений спосіб включає у себе одержання сполук за загальною формулою (І.1) (сполуки за загальною формулою (I), де X є атом сірки , 1 2 3 4 де R , R , R , R і Y є такими, як визначено вище, або шляхом конденсації похідних гідантоїну за загальною формулою (II), , 1 2 3 де R , R , і R є такими, як визначено вище, в умовах наявності сильної основи при температурі в інтервалі від 25 до 60 °C в полярному безводному розчиннику на мезилатах за загальною формулою (III) , 4 де R і Y є такими, як визначено вище, або шляхом обробки тіобензоїлів за загальною формулою (V) 20 , 4 де R є таким, як визначено вище, алколятом у протонному полярному розчиннику і наступного додавання галогенізованої похідної за загальною формулою (IV) 25 , 1 2 3 де R , R , R і Y є такими, як визначено вище, в розчині в полярному розчиннику; сполук за загальною формулою (І.1), тіоетерна група котрих окислюється на сульфоксид за загальною формулою (І.2) (сполуки за загальною формулою (I), де X є радикал -SO-), 16 UA 107349 C2 , 1 2 3 4 де R , R , R , R і Y є такими, як визначено вище, сульфоксидів за загальною формулою (І.2), які окислюються на сульфони за загальною формулою (І.3) (сполуки за загальною формулою (I), де X є група -SО2-), 5 10 15 20 25 30 35 40 45 , 1 2 3 4 де R , R , R , R і Y є такими, як визначено вище. У кращому варіанті вищезгадані операції окислювання здійснюються при наявності Оксону (Oxone®). Утворення солей сполук за формулою (I) може здійснюватися будь-яким способом, відомим фахівцям у даній галузі. Так, наприклад, утворювати солі можна шляхом додавання основи або кислоти, зокрема, гідроксиду натрію, калію, або соляної кислоти. Предметом даного винаходу в одному із його варіантів є одна із перелічених нижче сполук в ролі проміжної: 1-(5-йодопентил)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон, 1-(8-йодооктил)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон, 1-(9-бромноніл)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон, 4-(4,4-диметил-2,5-діоксоімідазолідин-1-іл)-2-(трифторметил)бензонітрил, 4-[3-(9-бромноніл)-4,4-диметил-2,5-діоксоімідазолідин-1-іл]-2-(трифторметил)бензонітрил, 5,5-диметил-3-(3-метил-4-нітрофеніл)імідазолідин-2,4-діон, 1-(9-бромноніл)-5,5-диметил-3-(3-метил-4-нітрофеніл)імідазолідин-2,4-діон. Сполуки за формулою (I) згідно з даним винаходом володіють цікавими фармакологічними властивостями. Так, було виявлено, що сполуки за формулою (I) згідно з даним винаходом володіють протипухлинною (протираковою) активністю і, зокрема, здатністю інгібувати проліферацію клітин, що експресують рецептори андрогенів, тобто таких, як простатичні клітини типу LnCAP. Таким чином, сполуки згідно з даним винаходом можуть використовуватися в різноманітних терапевтичних цілях. У кращому варіанті цариною їх застосування є лікування раку і, зокрема, його гормонозалежних видів, видів раку, що експресують рецептори андрогенів, зокрема, раку молочної залози і раку простати. Нижче, в експериментальній частині, представлена ілюстрація фармакологічних властивостей сполук згідно з даним винаходом. Предметом даної заявки є також сполуки, що описуються формулою (I) відповідно до визначеного вище, придатні служити медикаментами. Крім того, предметом даної заявки є сполуки, що описуються формулою (I) відповідно до визначеного вище, придатні служити медикаментами, що призначаються для лікування проліферативних розладів, в кращому варіанті – різноманітних видів раку, а в ще кращому варіанті – гормонозалежних видів раку, або ж видів раку, що експресують рецептори андрогенів, ще точніше – раку простату і раку молочної залози, а в найкращому спрямуванні – різноманітних видів раку простати. Предметом даної заявки є також фармацевтичні композиції, що містять як активний компонент принаймні одну сполуку за формулою (I), яка була визначена вище, разом з фармацевтично прийнятним носієм. Предметом даної заявки є також використання сполуки за формулою (I) згідно з даним винаходом у виготовленні протипухлинного медикаменту. Предметом даної заявки є також використання сполуки за формулою (I) згідно з даним винаходом, у виготовленні медикаменту, призначеного для інгібування клітинної проліферації. Предметом даної заявки є також використання сполуки за формулою (I) згідно з даним винаходом у виготовленні медикаменту, призначеного для лікування проліферативних розладів, в кращому варіанті – різноманітних видів раку, а в ще кращому варіанті – гормонозалежних 17 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 55 60 видів раку, або ж видів раку, що експресують рецептори андрогенів, ще точніше – раку простату і раку молочної залози, а в найкращому спрямуванні – різноманітних видів раку простати. Запропонована фармацевтична композиція може мати форму твердої речовини, наприклад, порошку, гранул, таблеток, желатинозних капсул. Підходящими твердими носіями для нього можуть бути, наприклад, фосфат кальцію, стеарат магнію, тальк, цукри, лактоза, декстрин, крохмаль, желатин, целюлоза, метилцелюлоза, карбоксиметилцелюлоза натрію, полівінілпіролідин і віск. Фармацевтичні композиції, що містять сполуку згідно з даним винаходом, можуть готуватися також у рідкій формі, наприклад, розчинів, емульсій, суспензій або сиропів. Підходящими рідкими носіями для них можуть служити, наприклад, вода, органічні розчинники, такі як гліцерин або гліколі, а також їх суміші у різноманітних пропорціях у воді, добавлені до фармацевтично прийнятних масел або жирів. Рідкі стерильні композиції можуть використовуватися для внутрішньом'язових, інтраперитонеальних або підшкірних ін'єкцій, а стерильні композиції можуть уводитися також внутрішньовенним шляхом. Усі технічні та наукові терміни, використані в даному тексті, несуть значення, відомі фахівцям у даній галузі. Всі цитовані в даному тексті патенти (і заявки на патенти), а також інші літературні джерела включені тут шляхом посилання. Експериментальна частина 1 2 3 4 У відповідності до поданих визначень змінних R , R , R , Х, n і R , сполуки згідно з винаходом можуть бути одержані згідно з різноманітними процесами, описаними вище. Наведені тут приклади здійснення описаних вище процесів несуть виключно ілюстративне призначення і не повинні розглядатися як такі, що тим чи іншим чином обмежують даний винахід. Приклад 1: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)тіо]ноніл}імідазолідин-2,4-діон В атмосфері аргону до розчину 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-імідазолідин2,4-діону (317 мг, 1 ммоль) у безводному DMF (8 мл) додають NaH (60 %) (44 мг, 1,1 ммоль). У супроводженні вивільненням газів відбувається зміна кольору реакційного середовища, яке стає оранжевим. Перемішування триває протягом 1 години при 23 °C, після чого додають 9[(4,4,5,5,5-пентафторпентил)тіо]нонілметансульфонат (приготований відповідно до експериментальної методики, описаної у WO 2005077968) (332 мг, 0,8 ммоль). Через 15 годин реакції реакційне середовище виливають у воду (25 мл) та екстрагують за допомогою AcOEt (2 × 25 мл). Органічні фази збирають і промивають послідовно водою (25 мл) і розсолом (25 мл). Після сушки над Na2SО4 органічний розчин фільтрують і концентрують випарюванням у вакуумі. Залишок від випарювання очищають на колонці двоокису кремнію (елюент: CH 2Cl2/AcOEt: від 1/1 до 0/1). Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 72 % (364 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,29 (m, 2H, NCH2); 2,57 (m, 2H, SCH2); 2,48 (m, 2H, SCH2); 2,28 (m, 2H, CH2); 1,76 (m, 2H, CH2); 1,61 (m, 2H, CH2); 1,50 (m, 2H, CH2); 1,46 (s, 6H, 2 х CH3); 1,30 (m, 10H, 5 х CH2). Приклад 2: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діон До розчину сполуки, описаної у Прикладі 1 (364 мг, 0,57 ммоль) у THF (75 мл) додають Oxone® (211 мг, 0,34 ммоль) і воду (10 мл). Цю реакційну суміш перемішують протягом 20 хвилин – часу, потрібного для повного перетворення первинного продукту, і після цього виливають у воду (100 мл). Зазначену сполуку екстрагують за допомогою AcOEt (2 × 75 мл), органічні фази збирають і промивають розсолом. Після сушки над Na 2SО4 органічний розчин фільтрують і концентрують випарюванням у вакуумі. Залишок від випарювання очищають на колонці двоокису кремнію (елюент: CH2CІ2/AcOEt: від 1/1 до 1/4). Цільову сполуку отримують у формі безбарвного масла з корисним виходом 86 % (321 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,42 (d, 1H, Ph); 8,30 (d, 1H, Ph); 8,17 (dd, 1H, Ph); 3,39 (m, 2H, NCH2); 2,88 (m, 4H, CH2S(=O)CH2); 2,48 (m, 2H, CH2); 2,02 (m, 2H, CH2); 1,72 (m, 4H, 2 х CH2); 1,56 (s, 6H, 2 х CH3); 1,51 (m, 2H, CH2); 1,42 (m, 8H, 4 х CH2). Приклад 3: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфоніл]ноніл}імідазолідин-2,4-діон До розчину сполуки Прикладу 2 (200 мг, 0,31 ммоль) у THF (6 мл) додають Oxone® (566 мг, 0,93 ммоль). Цю реакційну суміш доповнюють водою (3 мл) і перемішують при 23° C протягом 3 годин 30 хвилин – часу, потрібного для повного перетворення первинного продукту. Після цього суміш виливають у воду (25 мл) та екстрагують за допомогою AcOEt (2 × 25 мл). Після декантації органічні фази збирають і промивають розсолом (20 мл), просушують над Na2SO4, 18 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 55 60 фільтрують і концентрують випарюванням до сухого стану під вакуумом. Залишок від випарювання очищають на колонці двоокису кремнію (елюент: гептан/AcOEt: від 1/1 до 3/7). Цільову сполуку отримують у формі безбарвного масла з корисним виходом 89 % (185 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,28 (d, 1H, Ph); 8,15 (d, 1H, Ph); 8,04 (dd, 1H, Ph); 3,24 (m, 2H, NCH2); 3,15 (m, 2H, CH2S(=O)2); 3,05 (m, 2H, CH2S(=O)2); 2,32 (m, 2H, CH2); 1,87 (m, 2H, CH2); 1,59 (m, 4H, 2 х CH2); 1,41 (s, 6H, 2 х CH3); 1,35 (m, 2H, CH2); 1,24 (m, 8H, 4 х CH2). Приклад 4: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{5-[(4,4,5,5,5пентафторпентил)тіо]пентил}імідазолідин-2,4-діон 4.1) 1-(5-йодопентил)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон В атмосфері аргону додають NaH (до 60 %) (65 мг, 1,6 ммоль) до розчину 5,5-диметил-3-[4нітро-3-(трифторметил)феніл]-імідазолідин-2,4-діону (500 мг, 1,6 ммоль) у безводному DMF (20 мл). У супроводженні вивільненням газів відбувається зміна кольору реакційного середовища, яке стає оранжевим. Перемішування триває протягом 1 години при температурі 23° C, після чого додають, без розбавляння, 1,5-дийодопентан (350 мкл, 2,4 ммоль). Через 15 годин реакції реакційне середовище виливають у насичений водний розчин NH4Cl (25 мл) та екстрагують за допомогою AcOEt (2 × 25 мл). Органічні фази об'єднують і промивають послідовно водою (25 мл) і розсолом (25 мл). Після сушки над Na 2SO4 органічний розчин фільтрують і концентрують випарюванням у вакуумі. Залишок від випарювання очищають на колонці двоокису кремнію (елюент: гептан/AcOEt: від 7/3 до 6/4). Цільову сполуку отримують у формі безбарвного масла з корисним виходом 47 % (380 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,29 (m, 4H, 2 х CH2); 1,81 (m, 2H, CH2); 1,65 (m, 2H, CH2); 1,47 (s, 6H, 2 х CH3); 1,41(m, 2H, CH2). 4.2) 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{5-[(4,4,5,5,5пентафторпентил)тіо]пентил}імідазолідин-2,4-діон В атмосфері аргону до розчину S-(4,4,5,5,5-пентафторпентил)бензол-карботіоату (приготованого відповідно до експериментальної методики, описаної у WO 2005077968), (221 - + мг, 0,74 ммоль) у MeOH (10 мл) додають tBuO K (124 мг, 1,11 ммоль), і суміш перемішують протягом 30 хвилин при температурі 23° C. Після цього до суміші однією порцією додають проміжний продукт 4.1 (380 мг, 0,74 ммоль) у розчині в MeOH (10 мл). Через 24 години перемішування цю реакційну суміш виливають у воду (25 мл) та екстрагують за допомогою AcOEt (2 × 25 мл). Після декантації органічні фази об'єднують і промивають водою (20 мл) і розсолом (20 мл), просушують над Na2SO4, фільтрують і концентрують випарюванням до сухого стану під вакуумом. Залишок від випарювання очищають на колонці двоокису кремнію (елюент: гептан/AcOEt: від 7/3 до 6/4). Цільову сполуку отримують у формі безбарвного масла з корисним виходом 75 % (320 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,30 (m, 2H, NCH2); 2,59 (m, 2H, SCH2); 2,50 (m, 2H, SCH2); 2,29 (m, 2H, CH2); 1,76 (m, 2H, CH2); 1,63 (m, 2H, CH2); 1,55 (m, 2H, CH2); 1,46 (s, 6H, 2 х CH3); 1,41(m, 2H, CH2). Приклад 5: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{5-[(4,4,5,5,5пентафторпентил)сульфініл]пентил}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 4. У результаті отримують 136 мг твердої речовини білого кольору (73 %). Температура плавлення: 95-96 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,33 (m, 2H, NCH2); 2,80 (m, 2H, S(=O)CH2); 2,76 (m, 2H, S(=O)CH2); 2,37 (m, 2H, CH2); 1,92 (m, 2H, CH2); 1,67 (m, 4H, 2 х CH2); 1,47 (m, 8H, (2 х CH3) + CH2). Приклад 6: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{8-[(4,4,5,5,5пентафторпентил)тіо]октил}імідазолідин-2,4-діон 6.1) 1-(8-Йодооктил)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу проміжного продукту 4.1, за винятком того, що замість 1,5-дийодопентану тут використовують 1,8-дийодооктан. Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 44 % (229 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,28 (m, 4H, CH2I+NCH2); 1,73 (m, 2H, CH2); 1,63 (m, 2H, CH2); 1,46 (s, 6H, 2 х CH3); 1,30 (m, 8H, 4 х CH2). 6.2) 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{8-[(4,4,5,5,5пентафторпентил)тіо]октил}імідазолідин-2,4-діон 19 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 4, за винятком того, що замість проміжного продукту 4.1, тут використовують проміжний продукт 6.1. У результаті отримують масло блідо-жовтого кольору з корисним виходом 78 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,28 (m, 2H, NCH2); 2,58 (m, 2H, SCH2); 2,47 (m, 2H, SCH2); 2,27 (m, 2H, CH2); 1,76 (m, 2H, CH2); 1,62 (m, 2H, CH2); 1,51 (m, 2H, CH2); 1,46 (s, 6H, 2 х CH3); 1,30(m, 8H, 4 x CH2). Приклад 7: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{8-[(4,4,5,5,5пентафторпентил)сульфініл]октил}імідазолідин-2,4-діон Використовуваний у даному прикладі експериментальний процес одержання цільової сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 6. У результаті отримують 61 мг масла блідо-жовтого кольору (64 %). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,28 (m, 2H, NCH2); 2,74 (m, 4H, CH2S(=O)CH2); 2,37 (m, 2H, CH2); 1,90 (m, 2H, CH2); 1,63 (m, 4H, 2 х CH2); 1,46 (s, 6H, 2 х CH3); 1,40 (m, 2H, CH2); 1,32 (m, 6H, 3 х CH2). Приклад 8: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{10-[(4,4,5,5,5пентафторпентил)тіо]децил}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 9-[(4,4,5,5,5пентафторпентил)тіо]нонілметансульфонату тут використовують 10-[(4,4,5,5,5пентафторпентил)тіо]децилметансульфонат (приготовинй згідно з експериментальним процесом, аналогічним процесу, описаному в WO 2005077968). Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 13 % (125 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,29 (m, 2H, NCH2); 2,57 (m, 2H, SCH2); 2,47 (m, 2H, SCH2); 2,27 (m, 2H, CH2); 1,75 (m, 2H, CH2); 1,61 (m, 2H, CH2); 1,50 (m, 2H, CH2); 1,46 (s, 6H, 2 х CH3); 1,29 (m, 12H, 6 х CH2). Приклад 9: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{10-[(4,4,5,5,5пентафторпентил)сульфініл]децил}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 8. Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 74 % (71 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,28 (m, 2H, NCH2); 2,80 (m, 2H, S(=O)CH2); 2,71 (m, 2H, S(=O)CH2); 2,37 (m, 2H, CH2); 1,92 (m, 2H, CH2); 1,60 (m, 4H, 2 х CH2); 1,46 (s, 6H, 2 х CH3); 1,33 (m, 12H, 6 x CH2). Приклад 10: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{11-[(4,4,5,5,5пентафторпентил)тіо]ундецил}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 9-[(4,4,5,5,5пентафторпентил)тіо]нонілметансульфонату тут використовують 10-[(4,4,5,5,5пентафторпентил)тіо]ундецилметансульфонат (приготовинй згідно з експериментальним процесом, аналогічним процесу, описаному в WO 2005077968). Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 43 % (328 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,42 (d, 1H, Ph); 8,30 (d, 1H, Ph); 8,18 (dd, 1H, Ph); 3,38 (m, 2H, NCH2); 2,67 (m, 2H, SCH2); 2,57 (m, 2H, SCH2); 2,37 (m, 2H, CH2); 1,85 (m, 2H, CH2); 1,71 (m, 2H, CH2); 1,58 (m, 2H, CH2); 1,56 (s, 6H, 2 х CH3); 1,40 (m, 14H, 7 х CH2). Приклад 11: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{11-[(4,4,5,5,5пентафторпентил)сульфініл]ундецил}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 10. Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 72 % (240 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,28 (m, 2H, NCH2); 2,75 (m, 4H, CH2S(=O)CH2); 2,40 (m, 2H, CH2); 1,90 (m, 2H, CH2); 1,60 (m, 4H, 2 х CH2); 1,46 (s, 6H, 2 х CH3); 1,39 (m, 2H, CH2); 1,30 (m, 12H, 6 x CH2). Приклад 12: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4трифторбутил)тіо]ноніл}імідазолідин-2,4-діон 12.1) 1-(9-бромноніл)-5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон 20 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 55 Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу проміжного продукту 4.1, за винятком того, що замість 1,5-дийодопентану тут використовують 1,9-дибромнонан. Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 45 % (1,24 г). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,51 (m, 2H, CH2Br); 3,29 (m, 2H, NCH2); 1,78 (m, 2H, CH2); 1,62 (m, 2H, CH2); 1,46 (s, 6H, 2 х CH 3); 1,32 (m, 10H, 5 х CH2). 12.2) 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4трифторбутил)тіо]ноніл}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 4, за винятком того, що замість проміжного продукту 4.1 тут використовують проміжний продукт 12.1, а замість проміжного S-(4,4,5,5,5пентафторпентил)бензолкарботіоату використовують S-(4,4,4-трифторбутил)бензолкарботіоат (приготований згідно з WO 2005077968). Цільову сполуку отримують у формі масла блідожовтого кольору з корисним виходом 83 % (231 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,42 (d, 1H, Ph); 8,30 (d, 1H, Ph); 8,18 (dd, 1H, Ph); 3,38 (m, 2H, NCH2); 2,60 (m, 4H, CH2SCH2); 2,42 (m, 2H, CH2); 1,82 (m, 2H, CH2); 1,71 (m, 2H, CH2); 1,61 (m, 2H, CH2); 1,46 (s, 6H, 2 х CH3); 1,32 (m, 10H, 5 х CH2). Приклад 13: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,4трифторбутил)сульфініл]ноніл}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 12. У результаті отримують масло блідо-жовтого кольору з кориснимвиходом 73 % (140 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,08 (dd, 1H, Ph); 3,30 (m, 2H, NCH2); 2,71 (m, 4H, CH2S(=O)CH2); 2,41 (m, 2H, CH2); 1,86 (m, 2H, CH2); 1,62 (m, 4H, 2 х CH2); 1,46 (s, 6H, 2 х CH3); 1,35 (m, 10H, 5 х CH2). Приклад 14: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9[(3,3,4,4,5,5,6,6,6-нонафторгексил)тіо]ноніл}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу Прикладу 4, за винятком того, що замість проміжного продукту 4.1 тут використовують проміжний продукт 12.1, а замість проміжного S-(4,4,5,5,5пентафторпентил)бензолкарботіоату використовують S-(3,3,4,4,5,5,6,6,6нонафторгексил)бензолкарботіоат (приготований згідно з WO 2005077968). Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 78 % (212 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,42 (d, 1H, Ph); 8,30 (d, 1H, Ph); 8,18 (dd, 1H, Ph); 3,39 (m, 2H, NCH2); 2,80 (m, 2H, SCH2); 2,64 (m, 2H, SCH2); 2,59 (m, 2H, CH2); 1,71 (m, 2H, CH2); 1,61 (m, 2H, CH2); 1,56 (s, 6H, 2 х CH3); 1,41 (m, 10H, 5 х CH2). Приклад 15: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9[(3,3,4,4,5,5,6,6,6-нонафторгексил)сульфініл]ноніл}імідазолідин2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 14. У результаті отримують масло блідо-жовтого кольору з корисним виходом 85 % (145 мг). 1 H ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (dd, 1H, Ph); 3,29 (m, 2H, NCH2); 3,00 (m, 2H, S(=O)CH2); 2,78 (m, 2H, S(=O)CH2); 2,65 (m, 2H, CH2); 1,62 (m, 4H, 2 x CH2); 1,46 (s, 6H, 2 x CH3); 1,39 (m, 2H, CH2); 1,31 (m, 8H, 4 x CH2). Приклад 16: 3-[4-Аміно-3-(трифторметил)феніл]-5,5-диметил-1-{9-[(4,4,5,5,5пентафторпентил)тіо]ноніл}імідазолідин-2,4-діон До сполуки Прикладу 1 (1,08 г, 1,7 ммоль), розчиненій в AcOEt (30 мл), додають SnCl 2, 2H2O (3,84 г, 17 ммоль). Цю реакційну суміш гріють зі зворотним холодильником аж до зникнення первинної сполуки (5 годин 30), а потім охолоджують за допомогою льодяної бані. Після розбавляння етилацетатом AcOEt (30 мл) суміш виливають на водний розчин 1M NaHCO 3 (120 мл). Далі суміш перемішують протягом кількох годин, у процесі чого утворюється осад білого кольору. Цей осад видаляють шляхом фільтрування на целіті. Фільтрат декантують, і органічний розчин висушують над Na2SО4, фільтрують і концентрують випарюванням до сухого стану під вакуумом. Цільову сполуку отримують у формі масла жовтого кольору з корисним виходом 84 % (868 мг). 21 UA 107349 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H ЯМР 400 МГц (DMSO-d6) δ: 7,31 (d, 1H, Ph); 7,22 (dd, 1H, Ph); 6,86 (d, 1H, Ph); 5,80 (s, 2H, NH2); 3,27 (m, 2H, NCH2); 2,57 (m, 2H, SCH2); 2,47 (m, 2H, SCH2); 2,29 (m, 2H, CH2); 1,74 (m, 2H, CH2); 1,58 (m, 2H, CH2); 1,48 (m, 2H, CH2); 1,39 (s, 6H, 2 x CH3); 1,25 (m, 10H, 5 x CH2). Приклад 17: N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)тіо]ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл]ацетамід До розчину сполуки Прикладу 16 (230 мг, 0,38 ммоль) у безводному CH2CІ2 (2 мл) по краплям при температурі 23° C додають ацетилхлорид (1 мл, 37 екв.). Цю реакційну суміш перемішують протягом 1 години і концентрують випарюванням до сухого стану під вакуумом. Залишок від випарювання очищають на колонці двоокису кремнію (елюент: гептан/AcOEt: від 1/1 до 3/7). Після збирання і концентрування чистих фракцій отримують цільову сполуку у формі безбарвного масла, яке повільно кристалізується з корисним виходом 91 % (225 мг). Температура плавлення: 84-86 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 9,67 (s, 1H, NH); 7,80 (d, 1H, Ph); 7,69 (dd, 1H, Ph); 7,58 (d, 1H, Ph); 3,28 (m, 2H, NCH2); 2,57 (m, 2H, SCH2); 2,48 (m, 2H, SCH2); 2,30 (m, 2H, CH2); 2,06 (s, 3H, CH3-CO); 1,74 (m, 2H, CH2); 1,60 (m, 2H, CH2); 1,48 (m, 2H, CH2); 1,43 (s, 6H, 2 х CH3); 1,28 (m, 10H, 5 х CH2). Приклад 18: N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил) сульфініл]-ноніл}імідазолідин-1-іл)-2(трифторметил)феніл]ацетамід Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 17. У результаті отримують безбарвне масло з корисним виходом 61 % (98 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 9,63 (s, 1H, NH); 7,81 (d, 1H, Ph); 7,68 (dd, 1H, Ph); 7,58 (d, 1H, Ph); 3,28 (m, 2H, NCH2); 2,72 (m, 4H, CH2S(=O)CH2); 2,38 (m, 2H, CH2); 2,06 (s, 3H, CH3-CO); 1,90 (m, 2H, CH2); 1,60 (m, 4H, 2 х CH2); 1,44 (s, 6H, 2 х CH3); 1,39 (m, 2H, CH2); 1,30 (m, 8H, 4 х CH2). Приклад 19: 4-(4,4-Диметил-2,5-діоксо-3-{9-[(4,4,5,5,5пентафторпентилсульфаніл]ноніл}імідазолідин-1-іл)-2(трифторметил)бензонітрил 19.1) 4-(4,4-Диметил-2,5-діоксоімідазолідин-1-іл)-2-(трифторметил)бензонітрил Суміш 4-фтор-2-(трифторметил)бензонітрилу (5,67 мг, 30 ммоль), 5,5-диметилгідантоїну (7,68 г, 60 ммоль) і K2CO3 (8,28 г, 60 ммоль) у DMF (45 мл) розділяють на рівні частини у три пробірки, які поміщають у мікрохвильову піч. В умовах магнітного перемішування кожну пробірку гріють опромінюванням печі при 140° C протягом 20 хвилин. Після цього реакційні маси пробірок об'єднують, виливають у воду (200 мл) та екстрагують за допомогою AcOEt (2 × 75 мл). Органічні фази об'єднують, промивають розсолом, просушують над Na 2SO4 і фільтрують. Фільтрат концентрують випарюванням під зниженим тиском, і залишок кристалізують в Et 2O (25 мл). Після рекристалізації в EtOH (75 мл) порошок фільтрують і сушать під вакуумом. Цільову сполуку отримують у формі твердої речовини білого кольору з корисним виходом 46 % (4,1 г). Температура плавлення: 212-213° C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,80 (s, 1H, NH); 8,29 (d, 1H, Ph); 8,18 (s, 1H, Ph); 8,02 (d, 1H, Ph); 1,42 (s, 6H, 2 х CH3). 19.2) 4-[3-(9-Бромноніл)-4,4-диметил-2,5-діоксоімідазолідин-1-іл]-2(трифторметил) бензонітрил Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу проміжного продукту 12.1, за винятком того, що замість 5,5-диметил-3-[4-нітро3-(трифторметил)феніл]імідазолідин-2,4-діону тут використовують проміжний продукт 19.1. Цільову сполуку отримують у формі масла жовтого кольору з корисним виходом 80 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,29 (d, 1H, Ph); 8,18 (d, 1H, Ph); 8,04 (dd, 1H, Ph); 3,50 (m, 2H, CH2Br); 3,29 (m, 2H, NCH2); 1,78 (m, 2H, CH2); 1,61 (m, 2H, CH2); 1,46 (s, 6H, 2 х CH3); 1,32 (m, 10H, 5 х CH2). 19.3) 4-(4,4-Диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентилсульфаніл]ноніл}імідазолідин-1-іл)-2-(трифторметил)бензонітрил Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу проміжного продукту 4.2, за винятком того, що замість проміжного продукту 4.1 тут використовують проміжний продукт 19.2. Цільову сполуку отримують у формі масла жовтого кольору з корисним виходом 89 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,24 (d, 1H, Ph); 8,13 (d, 1H, Ph); 7,99 (dd, 1H, Ph); 3,22 (m, 2H, NCH2); 2,52 (m, 2H, SCH2); 2,44 (m, 2H, SCH2); 2,26 (m, 2H, CH2); 1,70 (m, 2H, CH2); 1,56 (m, 2H, CH2); 1,48 (m, 2H, CH2); 1,40 (s, 6H, 2 х CH3); 1,21 (m, 10H, 5 x CH2). 22 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 20: 4-(4,4-Диметил-2,5-діоксо-3-{9-[(4,4,5,5,5- пентафторпентил) сульфініл]ноніл}імідазолідин-1-іл)-2-(трифторметил)бензонітрил Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 19. У результаті отримують безбарвне масло з корисним виходом 78 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,29 (d, 1H, Ph); 8,18 (d, 1H, Ph); 8,03 (dd, 1H, Ph); 3,28 (m, 2H, NCH2); 2,82 (m, 4H, CH2S(=O)CH2); 2,38 (m, 2H, CH2); 1,89 (m, 2H, CH2); 1,62 (m, 4H, 2 х CH2); 1,45 (s, 6H, 2 х CH3); 1,31 (m, 10H, 5 х CH2). Приклад 21: 4-(4,4-Диметил-2,5-діоксо-3-{9-[(4,4,5,5,5- пентафторпентил) сульфаніл]ноніл}імідазолідин-1-іл)-2-(трифторметил)бензамід Сполуку Прикладу 19 (359 мг, 0,58 ммоль) змішують з трифтороцтовою кислотою (4 мл) і сірчаною кислотою (1 мл). Після 15 годин перемішування при 60 °C реакційне середовище виливають на суміш води з льодом та екстрагують за допомогою AcOEt (2 × 50 мл). Органічні фази об'єднують і промивають послідовно водою, насиченим водним розчином NaHCO 3 і розсолом. Після цього органічний розчин висушують над Na2SО4, фільтрують, і розчинник випарюють під зниженим тиском. Залишок від випарювання очищають шляхом хроматографії на колонці двоокису кремнію (елюент: гептан/AcOEt: від 9/1 до 4/6). Цільову сполуку отримують у формі масла жовтого кольору з корисним виходом 70 %. РХ-MС (УФ) (рідинна хромато-массмектрометрія): чистота (220 нM): 99 %. ES : (M+TFA-H) : 746. Приклад 22: 4-(4,4-Диметил-2,5-діоксо-3-{9-[(4,4,5,5,5- пентафторпентил) сульфініл]ноніл}імідазолідин-1-іл)-2-(трифторметил)бензамід Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 21. У результаті отримують безбарвне масло з корисним виходом 50 %. 1 1 Н ЯМР 400 МГц (DMSO-d6) δ: 7,96 (s широкий, 1H, /2NH2); 7,81 (s, 1H, Ph); 7,70 (d, 1H, Ph); 1 7,59 (m, 2H, Ph+ /2NH2); 3,25 (m, 2H, NCH2); 2,70 (m, 4H, CH2S(O)CH2); 2,30 (m, 2H, CH2); 1,83 (m, 2H, CH2); 1,57 (m, 4H, 2 х CH2); 1,40 (s, 6H, 2 х CH3); 1,25 (m, 10H, 5 х CH2). Приклад 23: 5,5-Диметил-3-(3-метил-4-нітрофеніл)-1-{9-[(4,4,5,5,5пентафторпентил)сульфаніл]ноніл}імідазолідин-2,4-діон 23.1) 5,5-Диметил-3-(3-метил-4-нітрофеніл)імідазолідин-2,4-діон Суміш 5-фтор-2-нітротолуолу (1,55 г, 10 ммоль), 5,5-диметилгідантоїну (1,28 г, 10 ммоль) і K2CO3 (1,38 г, 10 ммоль) у DMF (15 мл) поміщають у флакон, який гріють у мікрохвильовій печі при температурі 100° C протягом 70 хвилин в умовах магнітного перемішування. Після цього реакційну суміш виливають у воду (200 мл) та екстрагують за допомогою AcOEt (2 × 75 мл). Органічні фази об'єднують, промивають розсолом, просушують над Na 2SО4 і фільтрують. Фільтрат концентрують випарюванням під зниженим тиском, а залишок очищають шляхом хроматографії на колонці двоокису кремнію (елюент: гептан/AcOEt: 7/3). Цільову сполуку отримують у формі твердої речовини білого кольору з корисним виходом 25 % (666 мг). Температура плавлення: 177-178° C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,70 (s, 1H, NH); 8,10 (d, 1H, Ph); 7,58 (s, 1H, Ph); 7,52 (dd, 1H, Ph); 2,54 (s, 3H, CH3); 1,41 (s, 6H, 2 х CH3). 23.2) 1-(9-Бромноніл)-5,5-диметил-3-(3-метил-4-нітрофеніл)імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим,що і процес синтезу проміжного продукту 12.1, за винятком того, що тут замість 5,5-диметил-3-[4нітро-3-(трифторметил)феніл]імідазолідин-2,4-діону використовують проміжний продукт 23.1. Цільову сполуку отримують у формі масла жовтого кольору з корисним виходом 74 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,10 (d, 1H, Ph); 7,59 (d, 1H, Ph); 7,53 (dd, 1H, Ph); 3,51 (m, 2H, CH2Br); 3,29 (m, 2H, NCH2); 2,54 (s, 3H, 1 CH3); 1,78 (m, 2H, CH2); 1,61 (m, 2H, CH2); 1,44 (s, 6H, 2 х CH3); 1,32 (m, 10H, 5 х CH2). 23.3) 5,5-диметил-3-(3-метил-4-нітрофеніл)-1-{9-[(4,4,5,5,5-пентафторпентил) сульфаніл]ноніл}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу проміжного продукту 4.2, за винятком того, що замість проміжного продукту 4.1 тут використовують проміжний продукт 23.2. Цільову сполуку отримують у формі масла жовтого кольору з корисним виходом 90 %. 23 UA 107349 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Н ЯМР 400 МГц (DMSO-d6) δ: 8,10 (d, 1H, Ph); 7,59 (d, 1H, Ph); 7,54 (dd, 1H, Ph); 3,26 (m, 2H, NCH2); 2,56 (m, 5H, SCH2+CH3); 2,49 (m, 2H, SCH2); 2,28 (m, 2H, CH2); 1,74 (m, 2H, CH2); 1,61 (m, 2H, CH2); 1,52 (m, 2H, CH2); 1,45 (s, 6H, 2 х CH3); 1,28 (m, 10H, 5 x CH2). Приклад 24: 5,5-Диметил-3-(3-метил-4-нітрофеніл)-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 23. У результаті отримують безбарвне масло з корисним виходом 50 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,05 (s, 1H, Ph); 7,53 (d, 1H, Ph); 7,49 (m, 1H, Ph); 3,24 (m, 2H, NCH2); 2,70 (m, 4H, CH2S(=O)CH2); 2,49 (s, 3H, CH3); 2,30 (m, 2H, CH2); 1,85 (m, 2H, CH2); 1,57 (m, 4H, 2 х CH2); 1,40 (s, 6H, 2 х CH3); 1,25 (m, 10H, 5xCH2). Приклад 25: 3-(4-Аміно-3-метилфеніл)-5,5-диметил-1-{9-[(4,4,5,5,5пентафторпентил)сульфаніл]ноніл}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес одержання сполуки Прикладу 16, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 23. Цільову сполуку отримують у формі масла коричневого кольору з корисним виходом 93 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 6,81 (d, 1H, Ph); 6,78 (dd, 1H, Ph); 6,60 (d, 1H, Ph); 5,02 (s, 2H, NH2); 3,25 (m, 2H, NCH2); 2,57 (m, 2H, SCH2); 2,48 (m, 2H, SCH2); 2,30 (m, 2H, CH2); 2,04 (s, 3H, CH3); 1,75 (m, 2H, CH2); 1,55 (m, 2H, CH2); 1,48 (m, 2H, CH2); 1,37 (s, 6H, 2 х CH3); 1,22 (m, 10H, 5 х CH2). Приклад 26: 3-(4-Аміно-3-метилфеніл)-5,5-диметил-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 25. У результаті отримують безбарвне масло з корисним виходом 56 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 6,82 (d, 1H, Ph); 6,79 (dd, 1H, Ph); 6,60 (d, 1H, Ph); 5,02 (s, 2H, NH2); 3,25 (m, 2H, NCH2); 2,72 (m, 4H, CH2S(=O)CH2); 2,34 (m, 2H, CH2); 2,04 (s, 3H, CH3); 1,91 (m, 2H, CH2); 1,61 (m, 4H, 2 х CH2); 1,41 (m, 8H, 2 х CH3+CH2); 1,25 (m, 8H, 4 х CH2). Приклад 27: 1-[4-(4,4-Диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил) сульфаніл]ноніл}імідазолідин-1-іл)-2-метилфеніл]-3-(1метилпропіл)сечовина В атмосфері аргону сполуку Прикладу 25 (395 мг, 0,72 ммоль) розчиняють у безводному 1,2дихлоретані (10 мл), після чого до розчину по краплям при температурі 23° C додають вторбутилізоціанат (0,35 мл, 3 ммоль). Далі суміш гріють зі зворотним холодильником протягом 24 годин. Після цього реакційне середовище виливають на холодну воду та екстрагують за допомогою CH2CІ2. Після декантації органічну фазу промивають водою і розсолом, а потім органічний розчин висушують над MgSO4, фільтрують, концентрують випарюванням до сухого стану під вакуумом, і залишок від випарювання очищають на колонці двоокису кремнію (елюент: гептан/AcOEt: від 1/0 до 4/6). Цільову сполуку отримують у формі безбарвного масла з корисним виходом 36 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 7,96 (d, 1H, NH); 7,61 (s, 1H, NH); 7,07 (d, 1H, Ph); 7,02 (dd, 1H, Ph); 6,48 (d, 1H, Ph); 3,59 (m, 1H, CH); 3,26 (m, 2H, NCH 2); 2,57 (m, 2H, SCH2); 2,48 (m, 2H, SCH2); 2,28 (m, 2H, CH2); 2,18 (s, 3H, CH3); 1,74 (m, 2H, CH2); 1,58-1,42 (m, 6H, 3 х CH2); 1,40 (s, 6H, 2 х CH3); 1,30 (m, 10H, 5 х CH2); 1,07 (d, 3H, CH3); 0,88 (t, 3H, CH3). Приклад 28: 1-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил) сульфініл]ноніл}імідазолідин-1-іл)-2-метилфеніл]-3-(1метилпропіл)сечовина Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 25. У результаті отримують безбарвне масло з корисним виходом 63 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 7,96 (d, 1H, NH); 7,61 (s, 1H, NH); 7,07 (d, 1H, Ph); 7,02 (dd, 1H, Ph); 6,48 (d, 1H, Ph); 3,59 (m, 1H, CH); 3,26 (m, 2H, NCH2); 2,86-2,65 (m, 4H, CH2S(=O)CH2); 2,40 (m, 2H, CH2); 2,18 (s, 3H, CH3); 1,91 (m, 2H, CH2); 1,61 (m, 4H, 2 х CH2); 1,41 (m, 10H, 2 х CH2+2 х CH3); 1,30 (m, 8H, 4 х CH2); 1,07 (d, 3H, CH3); 0,88 (t, 3H, CH3). Приклад 29: трет-Бутил{[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5пентафторпентил)сульфаніл]ноніл}імідазолідин-1-іл)-2 24 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 55 метилфеніл]сульфамоїл}карбамат Розчин сполуки Прикладу 25 (612 мг, 1,1 ммоль) і Et3N (0,19 мл, 1,33 ммоль) у безводному CH2CІ2 (30 мл) перемішують при температурі 0° C. З іншого боку, охолоджений до 0° C розчин хлорсульфонілізоціанату (0,11 мл, 1,22 ммоль) у безводному CH 2CІ2 (10 мл) доповнюють tBuOH (0,12 мл, 1,22 ммоль) і швидко додають до розчину сполуки Прикладу 25. Утворену суміш перемішують протягом 30 хвилин при 0° C, а потім ще 1,5 години при 23° C. Після цього реакційне середовище промивають послідовно водою (2 × 100 мл), насиченим водним розчином NaHCO3 (50 мл) і розсолом (50 мл). Органічний розчин висушують над Na 2SО4, фільтрують і концентрують випарюванням до сухого стану. Залишок від випарювання очищають на колонці двоокису кремнію (елюент: гептан/AcOEt: від 1/0 до 6/4). Цільову сполуку отримують у формі твердої речовини білого кольору з корисним виходом 85 %. Температура плавлення: 122-124 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 11,07 (s, 1H, NH); 9,64 (s, 1H, NH); 7,28 (d, 1H, Ph); 7,20 (m, 2H, Ph); 3,28 (m, 2H, NCH2); 2,56 (m, 2H, SCH2); 2,48 (m, 2H, SCH2); 2,29 (m, 5H, CH2+CH3); 1,75 (m, 2H, CH2); 1,58 (m, 2H, CH2); 1,49 (m, 2H, CH2); 1,42 (s, 15H, 2 х CH3+tBu); 1,28 (m, 10H, 5 х CH2). Приклад 30: N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил) сульфаніл]ноніл}імідазолідин-1-іл)-2-метилфеніл]сульфамід До розчину сполуки Прикладу 29 (250 мг, 0,36 ммоль) в суміші CH 2Cl2/AcOEt (5 мл/3 мл), охолодженої до 0° C, трьома порціями по 1 мл додають розчин HCl в етиловому етері (2N, 3 мл), і цю суміш перемішують протягом 60 годин при температурі 23° C. Леткі речовини випаровують під вакуумом, а залишок знову поміщають у суміш CH 2CІ2 (50 мл) і NaHCO3 (50 мл). Після перемішування і декантації органічну фазу промивають водою (50 мл), а потім розсолом. Після сушки над Na2SO4, фільтрування і концентрування випарюванням до сухого стану, залишок очищають на колонці двоокису кремнію (гептан/AcOEt: від 10/0 до 1/1). Цільовий продукт отрмують у формі твердої речовини білого кольору з корисним виходом 76 %. Температура плавлення: 102-104° C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,60 (s, 1H, NH); 7,42 (d, 1H, Ph); 7,14 (m, 2H, Ph); 6,97 (s, 2H, NH2); 3,26 (m, 2H, NCH2); 2,57 (m, 2H, SCH2); 2,48 (m, 2H, SCH2); 2,27 (m, 5H, CH2+CH3); 1,75 (m, 2H, CH2); 1,58 (m, 2H, CH2); 1,52 (m, 2H, CH2); 1,48 (m, 2H, CH2); 1,41 (s, 6H, 2 х CH3); 1,30 (m, 10H, 5 х CH2). Приклад 31: N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил) сульфініл]ноніл}імідазолідин-1-іл)-2-метилфеніл]сульфамід Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість сполуки Прикладу 1 тут використовують сполуку Прикладу 30. У результаті отримують тверду речовину білого кольору з корисним виходом 62 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,60 (s, 1H, NH); 7,42 (d, 1H, Ph); 7,14 (m, 2H, Ph); 6,97 (s, 2H, NH2); 3,28 (m, 2H, NCH2); 2,78 (m, 4H, CH2S(=O)CH2); 2,38 (m, 2H, CH2); 2,29 (s, 3H, CH3); 1,90 (m, 2H, CH2); 1,60 (m, 4H, 2 х CH2); 1,40 (m, 8H, 2 х CH3+CH2); 1,30 (m, 8H, 4 х CH2). Приклад 32: N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил) сульфоніл]ноніл}імідазолідин-1-іл)-2-метилфеніл]сульфамід Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 3, за винятком того, що замість сполуки Прикладу 2 тут використовують сполуку Прикладу 31. У результаті отримують безбарвне масло. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,55 (s, 1H, NH); 7,37 (d, 1H, Ph); 7,09 (m, 2H, Ph); 6,92 (s, 2H, NH2); 3,15 (m, 4H, CH2S(=O)2CH2); 3,05 (m, 2H, NCH2); 2,32 (m, 2H, CH2); 2,24 (s, 3H, CH3); 1,91 (m, 2H, CH2); 1,60 (m, 4H, 2 х CH2); 1,39 (m, 8H, 2 х CH3+CH2); 1,22 (m, 8H, 4 х CH2). Приклад 33: 3-[4-Аміно-3-(трифторметил)феніл]-5,5-диметил-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 3, за винятком того, що замість сполуки Прикладу 2 тут використовують сполуку Прикладу 16. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 7,30 (d, 1H, Ph); 7,21 (dd, 1H, Ph); 6,85 (d, 1H, Ph); 5,80 (s, 1H, NH); 3,27 (m, 2H, NCH2); 2,74 (m, 4H, CH2S(=O)CH2); 2,38 (m, 2H, CH2); 1,90 (m, H, CH2); 1,60 (m, 4H, 2 х CH2); 1,40 (s, 8H, 2 х CH3+CH2); 1,29 (m, 8H, 4 x CH2). Приклад 34: 7-[4-Нітро-3-(трифторметил)феніл]-5-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}-5,7-діазаспіро[3.4]октан-6,8-діон 34.1) 5,7-Діазаспіро[3.4]октан-6,8-діон 25 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 55 60 В атмосфері аргону при температурі 23° до розчину циклобутанону (1,49 мл, 20 ммоль), розбавленого в розчинній суміші етанол-вода (16 мл), додають ціанід натрію (1,47 г, 30 ммоль), а потім карбонат амонію (7,5 г, 78 ммоль). Цю реакційну суміш гріють протягом 6 годин при 70° C. Після охолодження в це реакційне середовище вливають воду (15 мл), а потім обережно додають концентрований розчин соляної кислоти (13 мл). Все це перемішують протягом 10 годин при 23 °C, потім на роторному випарнику випаровують етанол і частину води, що міститься в реакційній суміші. На фриті відфільтровують осад, який промивають водою. Цільову сполуку отримують у формі порошку бежевого кольору з корисним виходом 39 % (1,1 г). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 10,49 (se, 1H, NH); 8,27 (s, 1H, NH); 2,31-2,37 (m, 2H, CH2); 2,19-2,27 (m, 2H, CH2); 1,83-1,90 (m, 1H, CHA); 1,71-1,76 (m, 1H, CHB). Температура плавлення: 223-225 °C. 34.2) 7-[4-Нітро-3-(трифторметил)феніл]-5,7-діазаспіро[3.4]октан-6,8-діон В атмосфері аргону до розчину 5,7-діазаспіро[3.4]октан-6,8-діону (приготованого так, як описано вище) (221 мг, 0,74 ммоль) у DMF (6 мл) додають карбонат калію (1,09 г, 7,85 ммоль) і сполуку 5-фтор 2нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон (500 мг, 1,6 ммоль). Суміш гріють при 65 °C протягом 2 годин, а потім перемішують протягом 12 годин при 23 °C. Реакційне середовище виливають у водний насичений розчин NН 4Cl (25 мл) та екстрагують за допомогою AcOEt (2 × 25 мл). Органічні фази об'єднують і промивають послідовно водою (25 мл) і розсолом (25 мл). Після сушки над Na2SО4 органічний розчин фільтрують і концентрують випарюванням у вакуумі. Залишок від випарювання очищають на колонці двоокису кремнію (елюент: гептан/AcOEt: від 7/3 до 3/7). Після промивання ізопентаном і наступного фільтрування отримують цільову сполуку у формі порошку блідо-жовтого кольору з корисним виходом 50 % (645 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 9,15 (s, 1H, NH); 8,30 (d, 1H, Ph); 8,18 (d, 1H, Ph); 8,00 (dd, 1H, Ph); 2,51 (m, 2H, CH2); 2,37 (m, 2H, CH2); 1,94 (m, 1H, CHA); 1,73 (m, 1H, CHB). 34.3) 7-[4-Нітро-3-(трифторметил)феніл]-5-{9-[(4,4,5,5,5-пентафторпентил) сульфаніл]ноніл}-5,7-діазаспіро[3.4]октан-6,8-діон В атмосфері аргону до розчину 7-[4-нітро-3-(трифторметил)феніл]-5,7-діазаспіро[3.4]октан6,8-діону (329 мг, 1 ммоль) у безводному DMF (9 мл) додають NaH (60 %) (44 мг, 1,1 ммоль). У супроводженні вивільненням газів відбувається зміна кольору реакційного середовища, яке стає оранжевим. Перемішування триває протягом 1 години при температурі 23° C, після чого до суміші додають 9-[(4,4,5,5,5-пентафторпентил)тіо]нонілметансульфонат (приготований відповідно до експериментальної методики, описаної у (WO 2005077968) (332 мг, 0,8 ммоль). Через 15 годин реакції реакційне середовище виливають у воду (25 мл) та екстрагують за допомогою AcOEt (2 × 25 мл). Органічні фази збирають і промивають послідовно водою (25 мл) і розсолом (25 мл). Після сушки над Na2SO4 органічний розчин фільтрують і концентрують випарюванням у вакуумі. Залишок від випарювання очищають на колонці двоокису кремнію RP18 (елюент: ACN/Н2Ο: від 8/2 до 100). Цільову сполуку отримують у формі безбарвного масла з корисним виходом 33 % (214 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,31 (d, 1H, Ph); 8,18 (d, 1H, Ph); 8,05 (dd, 1H, Ph); 3,40 (m, 2H, NCH2); 2,55 (m, 4H, SCH2, CH2); 2,45 (m, 2H, SCH2); 2,30 (m, 2H, CH2); 2,03 (m, 1H, CHA); 1,81 (m, 2H, CH2); 1,74 (m, 3H, CH2, CHB); 1,62 (m, 2H, CH2); 1,49 (s, 2H, CH2); 1,30 (m, 10H, 5 х CH2). 34.4) 7-[4-Нітро-3-(трифторметил)феніл]-5-{9-[(4,4,5,5,5-пентафторпентил) сульфініл]ноніл}-5,7-діазаспіро[3.4] октан-6,8-діон Сполуку 34.4 синтезують відповідно до процесу, аналогічного описаному у Прикладі 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)тіо]ноніл}імідазолідин-2,4-діону Прикладу 1 тут використовують проміжний продукт 34.3. Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 79 % (170 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,31 (d, 1H, Ph); 8,18 (d, 1H, Ph); 8,06 (dd, 1H, Ph); 3,44 (m, 2H, NCH2); 2,61 (m, 6H, CH2S(=O)CH2, CH2); 2,43 (m, 4H, 2CH2); 2,03 (m, 1H, CH2); 1,87 (m, 3H, CH2, CHB); 1,62 (m, 4H, 2CH2); 1,31 (m, 10H, 5 х CH2). Приклад 35: 5,5-Диметил-3-[4-нітро-2-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діон 35.1) 5,5-диметил-3-[4-нітро-2-(трифторметил)феніл]імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 19.1, за винятком того, що замість 4-фтор-2(трифторметил)бензонітрил тут використовують 1-фтор-4-нітро-2-(трифторметил)бензол. Цільову сполуку отримують у формі порошку білого кольору з корисним виходом 77 %. Температура плавлення: 201-203 °C. 26 UA 107349 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Н ЯМР 400 МГц (DMSO-d6) δ: 8,76 (s, 1H, NH); 8,67 (dd, 1H, Ph); 8,58 (d, 1H, Ph); 8,04 (d, 1H, Ph); 1,44 (s, 3H, CH3); 1,38 (s, 3H, CH3). 35.2) 5,5-Диметил-3-[4-нітро-2-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфаніл]ноніл}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 5,5-диметил-3-[4-нітро-3(трифторметил)феніл]імідазолідин-2,4-діону тут використовують проміжний продукт 35.1. Цільову сполуку отримують у формі безбарвного масла з корисним виходом 50 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,69 (dd, 1H, Ph); 8,57 (d, 1H, Ph); 8,05 (d, 1H, Ph); 3,27 (m, 2H, NCH2); 2,57 (m, 2H, SCH2); 2,48 (m, 2H, SCH2); 2,29 (m, 2H, CH2); 1,76 (m, 2H, CH2); 1,59 (m, 2H, CH2); 1,40 (s, 8H, 2 х CH3+CH2); 1,28 (m, 10H, 5xCH2). 35.3) 5,5-Диметил-3-[4-нітро-2-(трифторметил)феніл]-1-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3(трифторметил)феніл]-1-{9-[(4,4,5,5,5-пентафторпентил)тіо]ноніл} імідазолідин-2,4-діону Прикладу 1 тут використовується проміжний продукт 35.2. Цільову сполуку отримують у формі безбарвного масла з корисним виходом 85 %. 1Н ЯМР 400 МГц (DMSO-d6) δ: 8,69 (dd, 1H, Ph); 8,57 (d, 1H, Ph); 8,05 (d, 1H, Ph); 3,30 (m, 2H, NCH2); 2,82 (m, 2H, S(=O)CH2); 2,66 (m, 2H, S(=O)CH2); 2,39 (m, 2H, CH2); 1,90 (m, 2H, CH2); 1,60 (m, 4H, 2CH2); 1,50 (s, 3H, CH3); 1,41 (s, 3H, CH3); 1,30 (m, 10H, 5 х CH2). Приклад 36: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-[2-(2-{2[(4,4,5,5,5- пентафторпентил)сульфаніл]етоксі}етоксі)етил] імідазолідин-2,4-діон 36.1) 1-{2-[2-(2-Йодоетоксі)етоксі]етил}-5,5-диметил-3-[4-нітро-3(трифторметил)феніл]імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу проміжного продукту 4.1, за винятком того, що замість 1,5-дийодопентану тут використовується 1,2bis-(2-йодетоксі)етан. Цільову сполуку отримують у формі масла блідожовтого кольору з корисним виходом 59 % (666 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,08 (m, 1H, Ph); 3,64 (m, 4H, 2 х OCH2); 3,57 (s, 4H, 2 х OCH2); 3,51 (m, 2H, NCH2); 3,29 (m, 2H, CH2I); 1,47 (s, 6H, 2 х CH3). 36.2) 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-[2-(2-{2-[(4,4,5,5,5пентафторпентил)сульфаніл]етоксі}етоксі)етил]імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 4, за винятком того, що замість 1-(5-йодопентил)-5,5диметил-3-[4-нітро-3-(трифторметил)феніл]-імідазолідин-2,4-діону тут використовують проміжний продукт 36.1. Цільову сполуку отримують у формі безбарвного масла з корисним виходом 73 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,08 (m, 1H, Ph); 3,52 (m, 10H, 5 х CH2); 2,63 (s, 4H, 2 х CH2); 2,28 (m, 2H, CH2); 1,75 (m, 2H, CH2); 1,47(s, 6H, 2 x CH3). Приклад 37: 5,5-Диметил-3-[4-нітро-3-(трифторметил)феніл]-1-[2-(2-{2[(4,4,5,5,5- пентафторпентил)сульфініл]етоксі}етоксі)етил] імідазолідин-2,4-діон Синтез сполуки Прикладу 37 здійснюють відповідно до процесу, аналогічного описаному в Прикладі 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9[(4,4,5,5,5-пентафторпентил)тіо]ноніл}-імідазолідин-2,4-діону тут як первинний реактив використовують сполуку Прикладу 36. Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 88 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 1H, Ph); 8,20 (d, 1H, Ph); 8,07 (m, 1H, Ph); 3,76 (m, 2H, CH2); 3,55 (m, 8H, 8 х CH2); 3,00 (m, 1H, CH); 2,85 (m, 3H, 2 х CH2+CH); 2,35 (m, 2H, CH2); 1,89 (m, 2H, CH2); 1,48 (s, 6H, 2CH3). Приклад 38: N-[4-{4,4-диметил-2,5-діоксо-3-[2-(2-{2-[(4,4,5,5,5пентафторпентил)сульфаніл]етоксі}етоксі)етил]імідазолідин-1іл}-2-(трифторметил)феніл]ацетамід 38.1) 3-[4-Аміно-3-(трифторметил)феніл]-5,5-диметил-1-[2-(2-{2-[(4,4,5,5,5пентафторпентил)сульфаніл]етоксі}етоксі)етил]імідазолідин-2,4-діон Синтез сполуки Прикладу 38 здійснюють відповідно до процесу, аналогічного описаному в Прикладі 16, за винятком того, що замість 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-1-{9[(4,4,5,5,5-пентафторпентил)тіо]ноніл}-імідазолідин-2,4-діону тут як первинний реактив 27 UA 107349 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовують сполуку Прикладу 36. Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 88 %. Експериментальне значення MH+ = 596,1; Розрахункове значення M=595,2 38.2) N-[4-{4,4-Диметил-2,5-діоксо-3-[2-(2-{2-[(4,4,5,5,5-пентафторпентил)сульфаніл]етоксі}етоксі)етил]імідазолідин-1-іл}-2(трифторметил)феніл]ацетамід Синтез сполуки Прикладу 38 здійснюють відповідно до процесу, аналогічного описаному в Прикладі 17, за винятком того, що замість 3-[4-аміно-3-(трифторметил)феніл]-5,5-диметил-1-{9[(4,4,5,5,5-пентафторпентил)тіо]ноніл}-імідазолідин-2,4-діону, тут як первинний реактив використовують сполуку 38.1. Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 88 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 9,64 (s, 1H, Ph); 7,80 (d, 1H, Ph); 7,68 (m, 1H, Ph); 7,59 (m, 1H, Ph); 3,52 (m, 10H, 5 х CH2); 2,63 (m, 4H, 2 х CH2); 2,35 (m, 2H, CH2); 2,06 (s, 3H, CH3); 1,75 (m, 2H, CH2); 1,45 (s, 6H, 2CH3). Приклад 39: N-[4-{4,4-Диметил-2,5-діоксо-3-[2-(2-{2-[(4,4,5,5,5пентафторпентил)сульфініл]етоксі}етоксі)етил]імідазолідин-1іл}-2-(трифторметил)феніл]ацетамід Синтез сполуки Прикладу 39 здійснюють відповідно до процесу, аналогічного описаному в Прикладі 2, за винятком того, що замість сполуки Прикладу 1, тут як первинний реактив використовують сполуку Прикладу 38. Цільову сполуку отримують у формі масла блідо-жовтого кольору з корисним виходом 75 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 9,64 (s, 1H, Ph); 7,81 (s, 1H, Ph); 7,68 (m, 1H, Ph); 7,59 (m, 1H, Ph); 3,59 (m, 10H, 5 х CH2); 2,98 (m, 1H, CH); 2,86 (m, 3H, CH2+CH); 2,38 (m, 2H, CH2); 2,06 (s, 3H, CH3); 1,91 (m, 2H, CH2); 1,45 (s, 6H, 2CH3). Приклад 40: N-[4-(4,4-Диметил-2,5-діоксо-3-{9-[(4,4,5,5,5пентафторпентил)сульфініл]ноніл}імідазолідин-1-іл)-2(трифторметил)феніл]-N-метилацетамід В атмосфері аргону до розчину N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5пентафторпентил)сульфініл]-ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл]-ацетаміду (100 мг, 0,15 ммоль) (приготованого згідно з Прикладом 18) у безводному DMF (2 мл) додають NaH (60 %) (6 мг, 0,16 ммоль). У супроводженні вивільненням газів відбувається зміна кольору реакційного середовища. Перемішування триває протягом 1 години при температурі 23° C, після чого додають йодид метилу (10 мкл, 0,16 ммоль). Через 1 години реакції додають таку саму кількість гідриду натрію і йодиду метилу, що і перед цим, після чого суміш перемішують ще протягом 3 годин при 23 °C. Реакційне середовище виливають у воду (25 мл) та екстрагують за допомогою AcOEt (2 × 25 мл). Органічні фази збирають і промивають послідовно водою (25 мл) і розсолом (25 мл). Після сушки над Na2SО4 органічний розчин фільтрують і концентрують випарюванням у вакуумі. Залишок від випарювання очищають на колонці двоокису кремнію (елюент: CH2Cl2/MeOH: від 95/5 до 90/10). Цільову сполуку отримують у формі безбарвного масла з корисним виходом 72 % (72 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 7,98 (d, 1H, Ph); 7,86 (m, 1H, Ph); 7,73 (d, 1H, Ph); 3,28 (m, 2H, NCH2); 3,08 (s, 3H, CH3); 2,85 (m, 4H, 2CH2); 2,38 (m, 2H, CH2); 1,90 (m, 2H, CH2); 1,66 (s, 5H, CH3CO, CH2); 1,44 (s, 6H, 2 х CH3); 1,30 (m, 4H, 2 х CH2); 1,30 (m, 8H, 4 х CH2). Приклад 41: N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил) сульфініл]ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл] метансульфонамід 41.1) N-[4-(4,4-диметил-2,5-діоксо-3-{9-[(4,4,5,5,5-пентафторпентил)сульфініл] ноніл}імідазолідин-1-іл)-2-(трифторметил)феніл]-N-(метилсульфоніл) метансульфонамід До розчину сполуки Прикладу 16 (151 мг, 0,25 ммоль) у безводному CH 2CІ2 (5 мл) по краплям при температурі 23° C додають хлорид сульфонілу (193 мкл, 10 екв.). Суміш перемішують протягом 15 годин при 23° C, після чого до неї додають хлорид сульфонілу (0,58 мл, 30 екв.) і діізопропілетиламін (1,75 мл, 40 екв.). Далі перемішування триває ще протягом 3 годин при 23 °C, після чого цю реакційну суміш концентрують випарюванням до сухого стану під вакуумом. Залишок від випарювання розріджують розчинною сумішшю тетрагідрофуран/метанол/вода 1/1/1 (3 мл) і додають гідроксид літію (25 мг, 1 ммоль). Далі суміш перемішують ще протягом 15 годин при температурі 23° C, після чого до неї додають гідроксид літію (50 мг, 2 ммоль.) в розчинній суміші тетрагідрофуран/метанол/вода 2/2/2 (6 мл). За 2 години витримування при 23 °C реакційне середовище виливають у воду (25 мл) та екстрагують за допомогою AcOEt (2 × 25 мл). Органічні фази збирають і промивають послідовно 28
ДивитисяДодаткова інформація
Назва патенту англійськоюImidazolidine-2,4-dione derivatives, and use thereof as a cancer drug
Автори англійськоюPrevost, Gregoire, Auvin, Serge, Lanco, Christophe, Liberatore, Anne-Marie, Lavergne, Olivier
Автори російськоюПревост Грегуар, Овин Серж, Ланко Кристоф, Либератор Анне-Марие, Лавернье Оливье
МПК / Мітки
МПК: C07D 233/76, A61P 35/00, A61K 31/4166, C07D 233/72
Мітки: лікування, медикаменту, раку, імідазолідин-2,4-діону, похідні, застосування
Код посилання
<a href="https://ua.patents.su/40-107349-pokhidni-imidazolidin-24-dionu-ta-kh-zastosuvannya-yak-medikamentu-dlya-likuvannya-raku.html" target="_blank" rel="follow" title="База патентів України">Похідні імідазолідин-2,4-діону та їх застосування як медикаменту для лікування раку</a>
Попередній патент: Пристрій для підтримання у гарячому стані, порціонування і розподілення харчових продуктів
Наступний патент: Струг для стругових установок і стругова установка для похилої формації
Випадковий патент: Спосіб лікування амбліопії