Похідні імідазолідин-2,4-діону та їх застосування як медикаменту
Номер патенту: 106884
Опубліковано: 27.10.2014
Автори: Превост Грегуар, БІГГ Денніс, Овін Серж, ЛАНКО Крістоф
Формула / Реферат
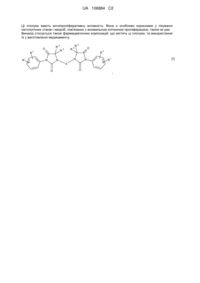
1. Сполука, яка має загальну формулу (І)
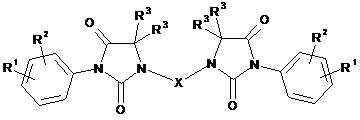 , (І)
, (І)
в якій
R1 являє собою радикали ціано, нітро, аміно, -NHCOOR4 або -NHCOR4;
R2 являє собою радикали галоген, алкіл, галогеналкіл або алкокси;
R3 являє собою радикал алкіл або атом водню; або ж два радикали R3 разом з атомом вуглецю, до якого вони приєднані, утворюють циклоалкіл, який містить від 3 до 4 членів в ланцюзі;
X являє собою
або алкіленовий ланцюг із 3-7 атомів вуглецю, прямий або розгалужений, який може містити одну або багато ідентичних або різних додаткових ланок, вибраних з -О-, -N(R5)-, -S-, -SO- або -SO2-;
або групу 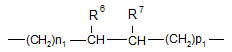 , в якій n1 і р1 є два цілих числа, сума n1+р1 яких є цілим числом, вибраним із сукупності чисел 2, 3, 4 і 5;
, в якій n1 і р1 є два цілих числа, сума n1+р1 яких є цілим числом, вибраним із сукупності чисел 2, 3, 4 і 5;
R6 і R7 утворюють разом ковалентний зв'язок, або R6 і R7 разом з атомами вуглецю, з якими вони з'єднані, утворюють цикл ![]() або циклоалкіл, що містить від 3 до 6 членів в ланцюзі;
або циклоалкіл, що містить від 3 до 6 членів в ланцюзі;
R4 являє собою радикал алкіл, арил або гетероарил;
R5 являє собою водень, радикал алкіл або аралкіл;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, в якій X являє собою прямий або розгалужений алкіленовий ланцюг із 3-7 атомів вуглецю, який може містити одну або багато ідентичних або різних додаткових ланок, вибраних з -О-, -N(R5)-, -S-, -SO- або -SO2-, або її фармацевтично прийнятна сіль.
3. Сполука за п. 1 або 2, в якій X являє собою алкіленовий ланцюг, який може містити одну єдину ланку, вибрану з -О-, -N(R5)-, -S-, -SO- або -SO2-, або її фармацевтично прийнятна сіль.
4. Сполука за п. 1, в якій X являє собою групу 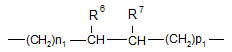 , де n1 і р1 є двома цілими числами, сума n1+р1 яких є цілим числом, вибраним із сукупності чисел 2, 3, 4 і 5;
, де n1 і р1 є двома цілими числами, сума n1+р1 яких є цілим числом, вибраним із сукупності чисел 2, 3, 4 і 5;
R6 і R7 утворюють разом ковалентний зв'язок, або R6 і R7 разом з атомами вуглецю, з якими вони з'єднані, утворюють цикл ![]() або циклоалкіл, який містить від 3 до 4 членів в ланцюзі; або її фармацевтично прийнятна сіль.
або циклоалкіл, який містить від 3 до 4 членів в ланцюзі; або її фармацевтично прийнятна сіль.
5. Сполука за п. 4, в якій n1 і р1 є однаковими.
6. Сполука за п. 1, в якій X являє собою групу ![]() , де X' являє собою групу -О-, -N(R5)- або -S-, -SO-, -SO2-, -(СН2)- або
, де X' являє собою групу -О-, -N(R5)- або -S-, -SO-, -SO2-, -(СН2)- або 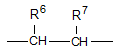 , а n2 і р2 є цілими числами, сума n2+р2 яких є або цілим числом, вибраним з чисел 3, 4, 5, 6 і 7, коли X' являє собою групу -О-, -N(R5)- або -S-, -SO-, -SO2-, або цілим числом, вибраним з чисел 2, 3, 4 і 5, коли X' являє собою групу
, а n2 і р2 є цілими числами, сума n2+р2 яких є або цілим числом, вибраним з чисел 3, 4, 5, 6 і 7, коли X' являє собою групу -О-, -N(R5)- або -S-, -SO-, -SO2-, або цілим числом, вибраним з чисел 2, 3, 4 і 5, коли X' являє собою групу 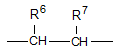 або -(СН2)-.
або -(СН2)-.
7. Сполука за п. 6, в якій X' являє собою групу 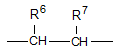 .
.
8. Сполука за п. 6, у котрій X' являє собою групу -О-, -N(R5)- або -(СН2)-.
9. Сполука за будь-яким із пп. 6-8, в якій n2 і р2 є однаковими.
10. Сполука за будь-яким із пп. 1-9, в якій R3 являє собою радикал алкіл, або два радикали R3 разом з атомами вуглецю, з якими вони зв'язані, утворюють циклоалкіл, який містить від 3 до 4 членів в ланцюзі.
11. Сполука за будь-яким із пп. 1-10, в якій R4 являє собою радикал алкіл.
12. Сполука за будь-яким із пп. 1-11, в якій R5 являє собою радикал алкіл.
13. Сполука за будь-яким із пп. 1-12, в якій R1 є в пара-положенні.
14. Сполука за будь-яким із пп. 1-13, у котрій R2 є в мета-положенні.
15. Сполука за будь-яким із пп. 1-14, в якій R6 і R7 утворюють разом ковалентний зв'язок.
16. Сполука за будь-яким із пп. 1-14, в якій R6 і R7 разом з атомами вуглецю, з якими вони зв'язані, утворюють цикл ![]() .
.
17. Сполука за будь-яким із пп. 1-14, в якій R6 і R7 разом з атомами вуглецю, з якими вони зв'язані, утворюють циклоалкіл, який містить від 3 до 6 членів в ланцюзі.
18. Сполука за будь-яким із пп. 1-17, в якій радикал алкіл являє собою метильну групу.
19. Сполука за будь-яким із попередніх пунктів, яка вибрана з:
1,1'-бутан-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону},
1,1'-пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону}
1,1'-(оксидіетан-2,1-діїл)біс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діону},
4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2-метилбензонітрилу),
1,1'-(2Z)-бут-2-ен-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діону},
або її фармацевтично прийнятна сіль.
20. Сполука за будь-яким із попередніх пунктів, яка являє собою 1,1'-пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діон} або 1,1'-(2Z)-бут-2-ен-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діоном} або їх фармацевтично прийнятні солі.
21. Спосіб одержання сполуки за формулою (І) відповідно до п. 1, який включає у себе стадію, на котрій
(і) конденсують два еквіваленти арилгідантоїнів за загальною формулою (II)
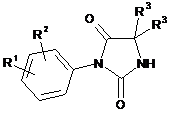 , (II)
, (II)
в якій R2 і R3 є такими, як визначено в п. 1, a R1 є нітрогрупою або ціаногрупою, із сполукою, що має загальну формулу Gp1-X-Gp2, де Gp1 і Gp2 є відхідні групи, а X є таким, як визначено вище, в присутності сильної основи, у результаті чого утворюється сполука, що описується загальною формулою (І)
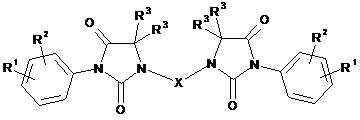 , (І)
, (І)
в котрій R2, R3 і X є такими, як визначено в п. 1, a R1 є нітрогрупою або ціаногрупою;
у разі потреби, якщо R1 є нітрогрупою, то в зазначеному способі здійснюють, крім того:
(іі) відновлення нітрогрупи та одержання в результаті сполуки за формулою (III)
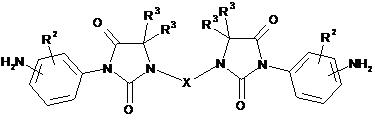 , (III)
, (III)
у разі потреби, в зазначеному способі здійснюють, крім того, стадію, вибрану з:
(ііі) проведення реакції між сполукою за формулою (III), одержаною на стадії (іі), та хлорангідридом кислоти, що має загальну формулу R4-COCl, у якій R4 є таким, як визначено в п. 1, з одержанням у результаті сполуки за формулою (IV)
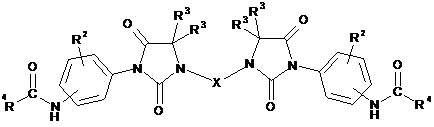 , (IV)
, (IV)
(iv) проведення реакції між сполукою за формулою (III), одержаною на стадії (іі), та хлорформіатом, що має загальну формулу R4-O-CO-Cl, у якій R4 є таким, як визначено в п. 1, з одержанням у результаті сполуки за формулою (V)
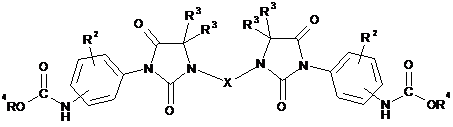 , (V)
, (V)
у разі потреби, якщо R6 і R7 утворюють разом ковалентний зв'язок, то в зазначеному способі здійснюють, крім того:
(v) окиснення подвійного зв’язку сполуки за формулою (І), що утворений замісниками R6 і R7, з одержанням у результаті сполуки за формулою (VI)
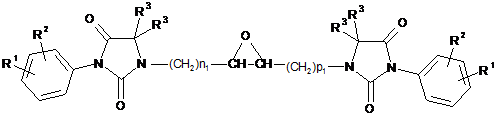 (VI).
(VI).
22. Сполука за будь-яким із пп. 1-20 як медикамент.
23. Фармацевтична композиція, яка містить як активний інгредієнт принаймні одну сполуку за формулою (І), таку, як визначено в будь-якому з пп. 1-20, разом з фармацевтично прийнятним носієм.
24. Застосування сполуки за формулою (І) за будь-яким із пп. 1-20 для одержання медикаменту, призначеного для лікування раку.
25. Застосування за п. 24, в якому медикамент призначається для лікування гормонозалежного раку.
26. Застосування за п. 24, в якому медикамент призначається для лікування раку, що експресує рецептори андрогенів.
27. Застосування за будь-яким із пп. 24-26, в якому медикамент призначається для лікування раку молочної залози або простати.
Текст
Реферат: 1 2 3 Описані нові похідні імідазолідин-2,4-діону за формулою (І), в котрій R , R , R і X є змінними. UA 106884 C2 (12) UA 106884 C2 Ці сполуки мають антипроліферативну активність. Вони є особливо корисними у лікуванні патологічних станів і хвороб, пов'язаних з аномальною клітинною проліферацією, такою як рак. Винахід стосується також фармацевтичних композицій, що містять ці сполуки, та використання їх у виготовленні медикаменту. R R 1 2 R O 3 R N R 3 3 R 3 O R N N N 2 R (І) 1 X O O , UA 106884 C2 5 10 15 20 25 30 35 40 45 ГАЛУЗЬ ТЕХНІКИ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД Предметом даного винаходу є нові похідні імідазолідин-2,4-діону. Ці молекули володіють антипроліферативною активністю. Вони є особливо корисними в лікуванні патологічних станів і хвороб, пов'язаних з аномальною проліферацією клітин, тобто, таких як рак. Винахід стосується, в тому числі, фармацевтичних композицій, що містять зазначені молекули, а також їх використання у виготовленні медикаменту. РІВЕНЬ ТЕХНІКИ На сьогоднішній день рак все ще залишається однією з головних причин смертей, незважаючи на наявність численних відповідних молекул на ринку медикаментів. Це робить необхідним пошук нових, більш потужних молекул, здатних на кращу протипухлинну дію, зумовлену їхньою кращою спроможністю інгібувати проліферацію клітинних пухлинних колоній. Отже, такі молекули могли б використовуватися в лікуванні патологічних станів, пов'язаних з аномальною проліферацією клітин. Об'єктами їх застосування можуть бути, наприклад, ракові клітини стравоходу, шлунку, кишечнику, прямої кишки, ротової порожнини, глотки, гортані, легенів, ободової кишки, молочної залози, шийки матки, тіла матки, яєчників, простати, тестикулів, сечового міхура, нирок, печінки, підшлункової залози, кісток, з'єднувальних тканин, шкіри (наприклад, меланоми), очей, мозку і центральної нервової системи, а також рак щитовидної залози, лейкемія, хвороба Ходжкіна, інші лімфоми, відмінні від лімфом Ходжкіна, множинні меланоми та інші види раку. Особливо цікавим видається знайти засоби лікування гормонозалежних видів раку, пухлин, що експресують рецептори андрогенів, засоби лікування раку молочної залози і простати. Використання антиандрогенів при лікуванні раку простати ґрунтується на їхній здатності конкурувати з природними агоністами рецептора андрогенів. Але через обмежену в часі ефективність цих антиандрогенів, хвороби, кінець кінцем, вислизали з під їхнього впливу. Стосовно цього вислизання було запропоновано чимало гіпотез, які вказували на агоністичну, а не на антагоністичну активність зазначених молекул (Veldscholte J, Berrevoets CA, Brinkmann AO, Grootegoed JA, Mulder E. Biochemistry 1992 Mar 3; 31(8):2393-9). На підтвердження цього, наприклад, нілутамід є здатним стимулювати ріст людських клітин раку простати в культурі. В додаток до цих експериментальних свідчень, злоякісну роль антиандрогенів підтверджують також клінічні дані (Akimoto S.; Antiandrogen withdrawal syndrome Nippon Rinsho. 1998 Aug; 56(8):2135-9. Paul R, Breul J. Antiandrogen withdrawal syndrome associated with prostate cancer therapies: incidence and clinical significance Drug Saf. 2000 Nov; 23(5):381-90). Заявником були визначені сполуки, що демонструють антипроліферативну активність до пухлини простати і, на подив, не виказують агоністичної активності при концентраціях, в котрих нілутамід веде себе як агоніст. Ця відмінність нових сполук у впливі на проліферацію, порівняно з нілутамідом, підтверджується їхньою здатністю викликати зникнення рецепторів андрогенів в їхній білковій формі. Що ж до нілутаміду, то він не чинить будь-якого впливу на цю рецепторну популяцію. Властивості нових сполук дозволять найкращим чином взятися за справу лікування раку простати, уникаючи при цьому явища "вислизання" з під дії ліків, притаманного сучасним антиандрогенам. Крім того, сполуки за даним винаходом можуть використовуватися також у лікуванні патологій, пов'язаних з наявністю рецепторів андрогенів, тобто таких, наприклад, як доброякісна гіперплазія простати, збільшення простати, акне, андрогенна алопеція, гірсутизм тощо. СУТЬ ВИНАХОДУ Таким чином, предметом даного винаходу є сполуки, які мають загальну формулу (І) R R 1 2 R O 3 R N R 3 3 R 3 O R N N N 2 R (І) 1 X O 50 O , де 1 4 4 R являє собою радикали ціано, нітро, аміно, -NHCOOR або -NHCOR ; 2 R являє собою радикали гало, алкіл, галоалкіл або алкокси; 1 UA 106884 C2 3 5 3 R являє собою радикал алкіл або атом водню; або ж два радикали R разом з атомом вуглецю, до якого вони приєднані, утворюють циклоалкіл, який містить від 3 до 4 ланок ланцюга; X являє собою • або прямий або розгалужений алкіленовий ланцюг із 3-7 атомів вуглецю, який може 5 містити одну або багато ідентичних або різних додаткових ланок, вибраних серед -O-, -N(R )-, S-, -SO- або —SO2-; або 6 R7 CH CH R (CH )n (CH )p 2 1 2 1 • групу , в котрій n1 і p1 є два цілих числа, сума n1+p1 яких є цілим числом, вибраним із сукупності чисел 2, 3, 4 і 5; 6 7 6 7 R і R утворюють разом ковалентний зв'язок, або R і R разом з атомами вуглецю, з якими O 10 15 CH CH вони з'єднані, утворюють цикл або циклоалкіл, що містить від 3 до 6 ланок ланцюга; 4 R являє собою радикал алкіл, арил або гетероарил; 5 R являє собою водень, радикал алкіл або аралкіл; або фармацевтично прийнятна сіль останньої. В одному з кращих варіантів X являє собою прямий або розгалужений алкіленовий ланцюг із 3-7 атомів вуглецю, який може містити одну або багато ідентичних або різних додаткових ланок, 5 вибраних серед -O-, -N(R )-, -S-, -SO- або —SO2-. У ще кращому варіанті X являє собою алкіленовий ланцюг, який може містити одну єдину 5 ланку, вибрану серед -O-, -N(R )-, -S-, -SO- або -SO2-. 6 R7 CH CH R 20 (CH )n (CH )p 2 1 2 1 В одному із варіантів Х являє собою групу , в котрій n1 і p1 є двома цілими числами, сума n1+p1 яких є цілим числом, вибраним із сукупності чисел 2, 3, 4 і 5. R6 і R7 утворюють разом ковалентний зв'язок, або R6 і R7 разом з атомами вуглецю, з якими O 25 30 CH CH вони з'єднані, утворюють цикл або циклоалкіл, який містить від 3 до 6 ланок ланцюга. В одному з кращих варіантів n1 і p1 є однаковими. В одному з кращих варіантів сума n1+p1 дорівнює 2. В одному з кращих варіантів сума n1+p1 дорівнює 3. В одному з кращих варіантів сума n1+p1 дорівнює 4. В одному з кращих варіантів сума n1+p1 дорівнює 5. В іншому варіанті X являє собою групу —(CH2)n2—X’—(CH2)p2, де X' являє собою групу -O-, R6 R7 CH CH N(R )- або -S-, -SO-, —SО2-, -CH2- або , а n2 і p2 є цілими числами, сума n2+p2 яких є або цілим числом, вибраним серед чисел 3, 4, 5, 6 і 7, коли X' являє собою групу -O-, 5 N(R )-, -S-, -SO-, -SО2-, або цілим числом, вибраним серед чисел 2, 3, 4 і 5, коли X' являє собою 5 R6 групу -CH2- або R7 CH CH . R6 35 40 CH R7 CH В одному з кращих варіантів X' являє собою групу . 5 В одному з кращих варіантів X' являє собою групу -O-, -N(R )- або -(CH2)-. В одному з кращих варіантів n2 і p2 є однаковими. В одному з кращих варіантів сума n2+p2 дорівнює 2. В одному з кращих варіантів сума n2+p2 дорівнює 3. В одному з кращих варіантів сума n2+p2 дорівнює 4. В одному з кращих варіантів сума n2+p2 дорівнює 5. В одному з кращих варіантів сума n2+p2 дорівнює 6. В одному з кращих варіантів сума n2+p2 дорівнює 7. 3 3 В одному з кращих варіантів R являє собою радикал алкіл, або два радикали R разом з атомом вуглецю, до якого вони приєднані, утворюють циклоалкіл, який містить від 3 до 4 ланок. 2 UA 106884 C2 4 5 В одному з кращих варіантів R являє собою радикал алкіл. 5 В одному з кращих варіантів R являє собою радикал алкіл. В одному з кращих варіантів X являє собою прямий алкіленовий ланцюг із 3-7 атомів вуглецю. 1 В одному з кращих варіантів R є в пара-положенні. 2 В одному з кращих варіантів R є в мета-положенні. 2 В одному з кращих варіантів R являє собою радикал галоалкіл. 6 7 В одному з кращих варіантів R і R утворюють разом ковалентний зв'язок. 6 7 В одному з кращих варіантів R і R разом з атомами вуглецю, з якими вони зв'язані, O 10 15 20 25 30 35 40 45 50 55 CH CH утворюють цикл . 6 7 В одному з кращих варіантів R і R разом з атомами вуглецю, з якими вони зв'язані, утворюють циклоалкіл, який містить від 3 до 6 ланок ланцюга. 3 В іншому варіанті R являє собою радикал алкіл або водень, а в ще кращому варіанті – радикал алкіл. 4 5 В одному з кращих варіантів R являє собою радикал алкіл і R являє собою радикал алкіл. Кращими є варіанти, в яких: 1 4 4 R являє собою радикали ціано, нітро, аміно, -NHCOOR або -NHCOR ; 2 R являє собою радикали гало, алкіл, галоалкіл, алкокси; 3 R являє собою радикал алкіл; X являє собою прямий або розгалужений алкіленовий ланцюг із 3-7 атомів вуглецю, який 5 може містити додаткову ланку -O- або -N(R )-; 4 R являє собою радикал алкіл; 5 і R являє собою радикал алкіл. 1 4 Ще кращими є варіанти, в яких R являє собою радикали ціано, нітро або -NHCOOR . Дуже добрими є також варіанти, в котрих X являє собою алкіленовий ланцюг із 4-7 атомів вуглецю, який може містити додаткову ланку -O-. В одному з кращих варіантів радикал алкіл являє собою метильну групу. Сполуку за формулою (I) вибирають серед: 1,1'-бутан-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону} 1,1’-пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4діону} 1,1’-гексан-1,6-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону} 1,1'-гептан-1,7-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону} 4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс[2(трифторметил)бензонітрилу] 1,1’-(3-метилпентан-1,5-діїл)біс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл] імідазолідин2,4-діону} 1,1’-(оксидіетан-2,1-діїл)біс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-імідазолідин-2,4діону} 1,1’-пентан-1,5-діїлбіс{3-[4-аміно-3-(трифторметил)феніл]-5,5-диметилімідазолідин-2,4-діону} N, N'-(пентан-1,5-діїлбіс{(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)[2-трифторметил)-4,1фенілен]})діацетаміду 1,1’-пентан-1,5-діїлбіс[5,5-диметил-3-(3-метил-4-нітрофеніл)-імідазолідин-2,4-діону] 1,1'-пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-2-(трифторметил)феніл]імідазолідин-2,4-діону} 1,1’-пентан-1,5-діїлбіс[3-(3-хлор-4-нітрофеніл)-5,5-диметил-імідазолідин-2,4-діону] 1,1’-пентан-1,5-діїлбіс[3-(3-метокси-4-нітрофеніл)-5,5-диметилімідазолідин-2,4-діону] диметил{пентан-1,5-діїлбіс[(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)(2-метил-4,1фенілен)]}біскарбамату 4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2-метилбензонітрилу) 4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2-хлорбензонітрилу) 1,1’-пропан-1,3-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4діону} 2-{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]-2,4-діоксоімідазолідин-1-іл}-N-(2-{5,5диметил-3-[4-нітро-3-(трифторметил)-феніл]-2,4-діоксоімідазолідин-1-іл}етил)-N-метилетанаміну 1,1'-(2Z)-бут-2-ен-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл] імідазолідин2,4-діону} 4,4'-[пентан-1,5-діїлбіс(5,7-діоксо-4,6-діазаспіро[2.4]гептан-4,6-діїл)]біс[2(трифторметил)бензонітрилу] 3 UA 106884 C2 5 10 15 20 25 30 35 40 45 50 55 4,4'-[(2Z)-бут-2-ен-1,4-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс[2(трифторметил)бензонітрилу] 4,4'-{(2R, 3S)-оксиран-2,3-діїлбіс[метандіїл(4,4-диметил-2,5-діоксоімідазолідин-3,1діїл)]}біс[2-(трифторметил)бензонітрилу] 4,4'-{(1R, 2R)-циклопропан-1,2-діїлбіс[метандіїл(4,4-диметил-2,5-діоксоімідазолідин-3,1діїл)]}біс[2-(трифторметил)бензонітрилу] або її фармацевтично прийнятної солі. Особливо кращою є сполука за формулою (I), вибрана серед: 1,1’-бутан-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону} 1,1’-пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4діону} 1,1'-гексан-1,6-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону} 1,1’-гептан-1,7-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону} 4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс[2(трифторметил)бензонітрилу] 1,1’-(3-метилпентан-1,5-діїл)біс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин2,4-діону} 1,1’-(оксидіетан-2,1-діїл)біс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4діону} 1,1’-пентан-1,5-діїлбіс{3-[4-аміно-3-(трифторметил)феніл]-5,5-диметилімідазолідин-2,4-діону} N, N'-(пентан-1,5-діїлбіс{(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)[2-(трифторметил)-4,1фенілен]})діацетаміду 1,1’-пентан-1,5-діїлбіс[5,5-диметил-3-(3-метил-4-нітрофеніл)-імідазолідин-2,4-діону] 1,1’-пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-2-(трифторметил)-феніл]імідазолідин-2,4діону} 1,1'-пентан-1,5-діїлбіс[3-(3-хлор-4-нітрофеніл)-5,5-диметил-імідазолідин-2,4-діону] 1,1'-пентан-1,5-діїлбіс[3-(3-метокси-4-нітрофеніл)-5,5-диметил-імідазолідин-2,4-діону] диметил{пентан-1,5-діїлбіс[(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)(2-метил-4,1фенілен)]}біскарбамату 4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2-метилбензонітрилу) 4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2-хлорбензонітрилу) 1,1'-пропан-1,3-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4діону} 2-{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-2,4-діоксоімідазолідин-1-іл}-N-(2-{5,5диметил-3-[4-нітро-3-(трифторметил)-феніл]-2,4-діоксоімідазолідин-1-іл}етил)-N-метилетанаміну 1,1'-(2Z)-бут-2-ен-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл] імідазолідин2,4-діону} 4,4'-[пентан-1,5-діїлбіс(5,7-діоксо-4,6-діазаспіро[2.4]гептан-4,6-діїл)]біс[2(трифторметил)бензонітрилу] 4,4'-[(2Z)-бут-2-ен-1,4-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс[2(трифторметил)бензонітрилу] 4,4'-{(2R, 3S)-оксиран-2,3-діїлбіс[метандіїл(4,4-диметил-2,5-діоксоімідазолідин-3,1діїл)]}біс[2-(трифторметил)бензонітрилу] 4,4'-{(1R, 2R)-циклопропан-1,2-діїлбіс[метандіїл(4,4-диметил-2,5-діоксоімідазолідин-3,1діїл)]}біс[2-(трифторметил)бензонітрилу] або її фармацевтично прийнятної солі. В одному з кращих варіантів, сполуку, що описується загальною формулою (I), вибирають серед: 1,1’-бутан-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону} 1,1’-пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4діону} 1,1’-(оксидіетан-2,1-діїл)біс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл] імідазолідин-2,4діону} 4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2-метилбензонітрилу) 1,1’-(2Z)-бут-2-ен-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл] імідазолідин2,4-діону} або її фармацевтично прийнятної солі. Більш конкретно, сполуку за формулою (I) вибирають серед: 1,1’-бутан-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону} 4 UA 106884 C2 5 10 15 1,1’-пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4діону} 1,1’-(оксидіетан-2,1-діїл)біс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4діону} 4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2-метилбензонітрилу) 1,1’-(2Z)-бут-2-ен-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл] імідазолідин2,4-діону} або її фармацевтично прийнятної солі. В одному з кращих варіантів сполукою, що описується загальною формулою (I), є 1,1'пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діон} або 1,1'-(2Z)-бут-2-ен-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4діон}. У найкращому варіанті сполукою за формулою (I) є 1,1'-пентан-1,5-діїлбіс{5,5-диметил-3-[4нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діон}. Предметом даного винаходу є також спосіб виготовлення сполуки за формулою (I), який включає у себе стадію, що полягає в (і) конденсації двох еквівалентів арилгідантоїнів за загальною формулою (ІІ) R R 2 1 3 R O R N 3 (II) NH O 20 2 , 3 1 в котрій R і R є такими, як визначено вище, а R є нітро- або ціаногрупою, на сполуці, що 1 2 1 2 описується загальною формулою Gp -X-Gp , де Gp і Gp є відхідними групами, а X є таким, як визначено вище, при наявності сильної основи, в результаті чого утворюється сполука, що описується загальною формулою (I) R R 2 1 3 R O R N R 3 3 R 3 O R N N 2 N R (І) 1 X O O 25 30 2 , 3 1 в котрій R , R і X є такими, як визначено вище, а R є нітро- або ціаногрупою. В одному з кращих варіантів реакцію конденсації проводять шляхом нагріву реакційної суміші при температурі в інтервалі від 20 до 100 °C, а в кращому варіанті – в інтервалі від 45 до 65 °C. В одному з кращих варіантів цю реакцію здійснюють у полярному апротонному розчиннику. В одному з кращих варіантів запропонований спосіб включає у себе, крім того, стадію (ii) відновлення нітрогрупи та одержання внаслідок цього сполуки за формулою (III) R H2 N 2 R O 3 R N R 3 3 R 3 O R N N 2 (ІII) NH2 N X O 35 O , В одному з кращих варіантів запропонований спосіб включає у себе, крім того, стадію, на котрій: 5 UA 106884 C2 (iii) проводять реакцію сполуки за формулою (III), одержаної на стадії (ii), з хлоридом 4 4 кислоти, що має загальну формулу R -COCІ, в котрій R є таким, як визначено вище, отримуючи в результаті сполуку за формулою (IV) R O 2 O 4 R R 3 R N R 3 3 R 3 O R N N 2 O N X C N H C N H O O (IV) R 4 , 5 10 В одному з варіантів запропонований спосіб включає у себе, крім того, стадію, на котрій проводять (iv) реакцію сполуки, одержаної на стадії (ii), з хлорформіатом, який має загальну формулу 4 4 R -O-CO-CІ, у котрій R є таким, як визначено вище, отримуючи в результаті сполуку за формулою (V): R 2 O 4 RO C R O R N R 3 3 R 3 O R N N N H C (V) OR 4 , 7 1 2 R O 3 R N N 3 R O (CH2)n1 CH CH (CH2)p1 O 35 N H O O 6 R 30 O N В іншому варіанті, якщо R і R утворюють разом ковалентний зв'язок, то зазначений спосіб може включати у себе, крім того: 6 7 (v) окислювання сполуки за формулою (I), у котрій R і R утворюють разом ковалентний 6 7 зв'язок, і завдяки створеному, таким чином, компонентами R і R подвійному зв'язку отримують сполуку за формулою (VI) R 25 2 X 15 20 3 3 R 3 O R N N O 2 R (VI) 1 , Даний винахід стосується також сполуки за формулою (I) як медикаменту. Даний винахід стосується також фармацевтичних композицій, котрі містять як активний інгредієнт принаймні одну сполуку за формулою (I) разом з фармацевтично прийнятним носієм. Даним винаходом передбачено також застосування сполуки за формулою (I) у виготовленні медикаменту, призначеного для лікування раку. В одному з кращих варіантів зазначений медикамент призначається для лікування гормонозалежного раку. В одному з кращих варіантів зазначений медикамент призначається для лікування раку, що експресує рецептори андрогенів. В одному з кращих варіантів зазначений медикамент призначається для лікування раку молочної залози або простати, а в ще кращому варіанті – для лікування раку простати. ПЕРЕЛІК ФІГУР КРЕСЛЕННЯ На Фіг. 1 графічно ілюстрована дія сполук Прикладів 2 і 19 на проліферацію клітин LNCaP, культивованих у безстероїдному середовищі. 6 UA 106884 C2 5 На Фіг. 2-9 ілюстрована дія сполук Прикладів 2, 7, 10, 15, 16, 19, 21 і 22 на зниження протеїнової експресії рецептора андрогенів. На Фіг. 10 ілюстрована дія нілутаміду на зниження протеїнової експресії рецептора андрогенів. ДОКЛАДНИЙ ОПИС ДЕЯКИХ ВАРІАНТІВ ЗДІЙСНЕННЯ ДАНОГО ВИНАХОДУ Отже, предметом даного винаходу є сполуки, які мають загальну формулу (I) R R 2 1 R O 3 R N R 3 3 R 3 O R N N N 2 R (І) 1 X O O 10 15 в котрій 1 4 4 R являє собоюрадикали ціано, нітро, аміно, -NHCOOR або -NHCOR ; 2 3 R являє собою радикали гало, алкіл, галоалкіл, алкокси; R являє собою радикал алкіл або 3 водень; в альтернативному варіанті два радикали R разом з атомом вуглецю, до якого вони приєднані, утворюють радикал циклоалкіл, який містить від 3 до 4 ланок ланцюга; X являє собою прямий або розгалужений алкіленовий ланцюг, що складається із 3-7 атомів вуглецю, який може містити один або багато ідентичних або різних додаткових ланок -O-, 5 N(R )- або -S-, -SO- або –SO2-; в альтернативному варіанті X являє собою 6 R7 CH CH R (CH )n 20 , (CH )p 2 1 2 1 групу , в котрій n1 і p1 є два цілих числа, сума n1+p1 яких є цілим числом від 2 до 5. Наприклад, n1 і p1 кожне має значення 1 або 2, а в кращому варіанті n1 і p1 кожне дорівнюють 1; 6 7 R і R утворюють разом ковалентний зв'язок; у цьому випадку X являє собою групу (CH 2)n1CH=CH-(CH2)p1; 6 7 в альтернативному варіанті R і R разом з атомами вуглецю, з якими вони зв'язані, O 25 30 35 40 45 CH CH утворюють цикл . 6 7 В іншому альтернативному варіанті R і R разом з атомами вуглецю, з якими вони зв'язані, утворюють радикал циклоалкіл, який містить від 3 до 6 ланок, наприклад, циклобутил, циклопентил або циклогексил; 4 R являє собою радикали алкіл, арил або гетероарил; 5 R являє собою водень, радикали алкіл або аралкіл; Сполуки за формулою (I) можуть мати форму фармацевтично прийнятних солей. Під терміном "фармацевтично прийнятні солі" тут маються на увазі солі додавання неорганічних кислот, наприклад, хлоргідрат, бромгідрат, сульфат, фосфат, дифосфат і нітрат, або органічні солі, наприклад, ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, бензолсульфонат, p-толуолсульфонат, памоат і стеарат. Об'ємом даного винаходу охоплюються також, у разі можливості їх використання, солі, утворені із основ, такі як гідроксид натрію або калію. Інші приклади фармацевтично прийнятних солей можна знайти в публікації ("Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217). Під використовуваним у контексті даного винаходу терміном "гало" (або "галоїд") слід розуміти радикали, що містять фтор, хлор, бром або йод, а в кращому варіанті – радикали, що містять хлор, фтор або бром. Якщо не зазначено іншого, то використовуваний у контексті даного винаходу термін "алкіл" означає прямий або розгалужений алкіл-радикал, який містить від 1 до 12 атомів вуглецю, наприклад, радикали метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил і трет-бутил, пентил або аміл, ізопентил, неопентил, гексил або ізогексил, гептил, октил, ноніл, децил, ундецил або додецил. У кращому варіанті алкіл-радикалом є (C1-C6)алкіл-радикал, тобто алкілрадикал, який має від 1 до 6 атомів вуглецю згідно з визначеним вище, або (C 1-C4)алкілрадикал, тобто алкіл-радикал, який має від 1 до 4 атомів вуглецю, такий, наприклад, як радикали метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил і трет-бутил. Особливо кращим при цьому алкіл-радикалом є метил-радикал. 7 UA 106884 C2 5 10 15 20 25 Термін "алкіл" у складних термінах алкокси (або алкілокси), або галоїдалкіл означає алкілрадикал, що відповідає визначенню, даному вище. Більш докладно, під терміном "галоїдалкіл" слід розуміти алкільний радикал, в котрому принаймні один (а можливо і всі) атоми водню є заміщеним атомом галогену (галоїду), як, наприклад, в кращому варіанті – у трифторметилі. Під терміном "циклоалкіл", якщо не дано більш точних роз'яснень, слід розуміти циклічний вуглецевий насичений радикал, що містить від 3 до 4 ланок, такий як циклопропіл або циклобутил. У контексті даного винаходу арильні радикали можуть бути моно- або поліциклічними ароматичними сполуками. Моноциклічні арильні радикали можуть бути вибрані серед фенільних, толільних, ксилільних, мезитильних, куменільних, а в кращому варіанті – серед фенільних радикалів. Поліциклічні арильні радикали можуть бути вибрані серед нафтильного, антрильного, фенантрильного, фторенільного радикалів. У разі потреби вони можуть бути заміщеними одним або багатьма ідентичними або відмінними радикалами, такими як алкіл-, галоїдалкіл-, алкокси-, алкоксикарбоніл-, алкілкарбонілокси-, галоїд-вмісний, ціано-, нітро-, арильний, арилокси-, арилоксикарбоніл- або арилкарбонілокси- радикали. У контексті даного винаходу термін "аралкіл" означає алкіл-радикал, що відповідає визначенню, даному вище, заміщений арильним радикалом, що відповідає визначенню, даному вище. У контексті даного винаходу термін "гетероарил" означає циклічну ненасичену ароматичну сполуку, що містить один або множину ідентичних або різних гетероатомів, вибраних серед Ν, Ο і S, таку як фурил, тієніл, ізоксазоліл, бензотіадіазоліл,піридиніл, oxaзоліл, піразоліл, піримідиніл або хіноксаліл. Предметом даного винаходу є також спосіб виготовлення сполуки за формулою (I), який включає у себе стадію (і) проведення реакції конденсації двох еквівалентів арилгідантоїнів, що мають загальну формулу (II) R R R O 2 1 3 R N 3 (II) NH O 30 2 , 3 1 в котрій R і R є такими, як визначено вище, а R є нітрогрупою або ціаногрупою, на сполуці, 1 2 1 2 що має загальну формулу Gp -X-Gp , де Gp і Gp є відхідні групи, а X є таким, як визначено вище, при наявності сильної основи, з утворенням сполуки, що описується загальною формулою (I) R R R O 2 1 3 R N R 3 3 R 3 O R N N 2 N R (І) 1 X O 35 40 45 2 O , 3 1 в котрій R , R і X є такими, як визначено вище, а R є нітрогрупою або ціаногрупою. 1 A) Одержання сполук, в котрих R є нітрогрупою або ціаногрупою Сполуки згідно з винаходом, що мають загальну формулу (I), можуть одержуватися шляхом синтезу, процес якого відображений нижче, на Схемі 1. Сполуки, які описуються загальною 1 2 3 формулою (I), в котрій R , R , R і X, є такими, як визначено вище, можуть одержуватися в одну стадію шляхом реакції конденсації двох еквівалентів проміжних арилгідантоїнів, що мають 1 2 1 2 загальну формулу (II), на сполуці, що має загальну формулу Gp -X-Gp , де Gp і Gp є відхідні групи, а X є такий, як визначено вище, тобто, наприклад, атом галогену або сульфонатна група. Реакцію конденсації при цьому проводять при наявності основи, наприклад NaH. В одному з кращих варіантів реакцію конденсації проводять шляхом нагріву реакційної суміші при 8 UA 106884 C2 температурі в інтервалі від 20 до 100 °C, а в ще кращому варіанті – в інтервалі від 45 до 65 °C. В одному з кращих варіантів реакцію конденсації проводять у полярному розчиннику, а саме в апротонному полярному розчиннику, наприклад в THF, DMF або DMSO. У загальному випадку тривалість реакції складає від 1 до 15 годин. 5 10 Схема 1 1 A.1) Одержання сполук, у котрих R є аміногрупою 1 2 3 В одному з варіантів, в якому R нітрогрупою, а R , R і X є такими, як визначено вище, анілінові сполуки, що мають загальну формулу (I) A1, одержують відповідно до Схеми A1. Відновлення нітрогруп здійснюється хлоридом олова SnCl2 і 2H2О (J. Heterocyclic Chem. 1987, 24, 927-930; Tetrahedron Letters 1984, 25 (8), 839-842) в апротонному розчиннику, наприклад ацетаті літію. 15 20 25 30 Схема A1 1 A.2) Одержання сполук, у котрих R є ацетамідною групою 2 3 4 Ацетамідні сполуки, що описуються загальною формулою (I) A2, в котрій R , R , R і X є такими, як визначено вище, отримуються в одну стадію із анілінових сполук, які мають загальну формулу (І)A1, Схема A2. Реакція ацилювання може здійснюватися при використанні великого 4 надлишку хлориду кислоти, що має загальну формулу R -COCІ, наприклад ацетилхлориду, або 4 ангідриду типу (R -CO)2O, наприклад оцтового ангідриду, котрі, як і розчинник, беруться в надлишковій кількості. Схема A2 1 A.3) Одержання сполук, у котрих R карбаматною групою 2 3 4 Карбамати, які описуються загальною формулою (I)A3, в котрій R , R , R і X є такими, як визначено вище, отримуються в одну стадію, як показано на Схемі A3, із анілінових сполук, які мають загальну формулу (І)А1. Утворення карбамату відбувається в умовах великого надлишку 4 хлорформіату, що має загальну формулу R -O-CO-CІ, при наявності безводного розчинника, 9 UA 106884 C2 котрим у кращому варіанті є апротонний полярний безводний розчинник. В одному з кращих варіантів для цього використовують безводний піридин. Реакцію в загальному випадку проводять шляхом нагріву при температурі в інтервалі від 60 до 100 °C протягом часу від 12 до 24 годин. 5 10 15 20 25 30 Схема A3 A.4) Одержання сполук, у котрих X містить оксиран. 1 2 3 У конкретному випадку, в котрому X містить подвійний зв'язок, де R , R і R є такими, як визначено вище, сполуки за загальною формулою (I)A4 можуть одержуватися шляхом окислювання сполук, що має загальну формулу (I), за допомогою відповідного окисника, такого як, наприклад, пербензойна кислота або пероцтова кислота, в апротонному розчиннику. Реакцію в загальному випадку проводять при навколишній температурі протягом часу від 1 до 4 днів. Схема A4 B) Одержання проміжних продуктів, що мають загальну формулу (II) 1 2 Синтез проміжних арилгідантоїнів, які описуються загальною формулою (II), в котрій R , R і 3 R є такими, як визначено вище, може здійснюватися у відповідності до загальних підходів, ілюстрованих на представлених нижче схемах. B.1) Одержання арилгідантоїнів шляхом конденсації: Синтез арилгідантоїну, що має загальну формулу (II), схема Β1, може здійснюватися шляхом нуклеофільного заміщення атома фтору, утримуваного на ароматичному ядрі сполуки, що має загальну формулу (II)1, аніоном гідантоїну, що має загальну формулу (ІІ) 2, утвореним при наявності основи, такої, наприклад, як K2CO3. Реакцію проводять шляхом нагріву при температурі в інтервалі від 65 до 140 °C у полярному апротонному розчиннику, наприклад, DMF або DMSO. Температура і тривалість реакції залежать від нуклеофугового характеру атома 1 2 фтору, який, у свою чергу, сильно залежить від природи R і R . У разі відсутності продажних гідантоїнів, які мають загальну формулу (ІІ) 2, їх можна одержувати за допомогою методів, описаних у літературі, див. наприклад (J. Med. Chem. 1984, 27 (12), 1663-8). 35 40 45 Схема Β1 1 2 У тому випадку, якщо R і R не володіють достатньою електропритягувальною здатністю для того, щоб сприяти нуклеофільному ароматичному заміщенню, показаному на Схемі B1, то для одержання сполук, що мають загальну формулу (II), може бути застосований метод створення зв'язку між арилбороновою кислотою і гідантоїном, який має загальну формулу (ІІ) 2, при наявності ацетату міді (Synlett 2006, 14, 2290-2). B.2) Одержання арилгідантоїнів шляхом створення гідантоїнового циклу із арилізоціанату Первинні гідантоїни, що мають загальну формулу (II), можуть бути приготовані за допомогою процесу, описаного в (Bioorg. Med. Chem. Lett. 2004,14, 5285). B.3) Одержання арилгідантоїнів із арилсечовин шляхом циклізації 10 UA 106884 C2 1 Синтез проміжних арилгідантоїнів, що має загальну формулу (II), Схема B3, у котрих R , R і R є такими, як визначено вище, може здійснюватися шляхом циклізації проміжного продукту, що має загальну формулу (ІІ)3, одержаного за допомогою процесів, описаних у літературі, див., наприклад, (Organic Process Research & Development 2002, 6, 759-761). Реакція циклізації може здійснюватися шляхом проміжного утворення ацилгалогеніду з наступним нагрівом. Ацилгалогенід при цьому може створюватися галогенізатора, наприклад оксалілхлориду або тіонілхлориду, в апротонному розчиннику, такому як 1-4, діоксан або тетрагідрофуран. 3 5 10 15 20 25 30 35 40 45 50 55 Схема B3 B.4) Одержання арилгідантоїнів створення гідантоїнового циклу із ізоціанатів аміноестерів В альтернативному варіанті арилгідантоїни, які мають загальну формулу (II), можуть бути синтезовані із ізоціанатів аміноестерів так, як описано в роботі (Eur. J. Med. Chem. 1984, 19 (3), 261). Солі сполук за формулою (І) можуть одержуватися будь-яким способом, відомим фахівцям у даній галузі. Це може бути, наприклад, спосіб додавання основи або кислоти, наприклад, гідроксиду натрію або калію, або хлористоводневої кислоти. Сполуки за формулою (I) згідно з даним винаходом мають цікаві фармакологічні властивості. Зокрема, було встановлено, що сполуки за формулою (I) згідно з даним винаходом володіють протипухлинною (протираковою) активністю, а саме здатністю інгібувати проліферацію клітин, що експресують рецептори андрогенів, тобто, наприклад, простатичних клітин типу LnCAP. Отже, сполуки згідно з даним винаходом можуть використовуватися в різноманітних терапевтичних цілях. У кращому варіанті цариною їх застосування є лікування раку і, зокрема, його гормонозалежних видів, видів раку, що експресують рецептори андрогенів, зокрема, раку молочної залози і раку простати. Нижче, в експериментальній частині, представлена ілюстрація фармакологічних властивостей сполук згідно з даним винаходом. Предметом даної заявки є також сполуки, що описуються формулою (I) відповідно до визначеного вище, придатні служити медикаментами. Крім того, предметом даної заявки є сполуки, що описуються формулою (I) відповідно до визначеного вище, придатні служити медикаментами, що призначаються для лікування проліферативних розладів, в кращому варіанті – різноманітних видів раку, а в ще кращому варіанті – гормонозалежних видів раку або ж видів раку, що експресують рецептори андрогенів, ще точніше – раку простату і раку молочної залози, а в найкращому спрямуванні – різноманітних видів раку простати. Предметом даної заявки є також фармацевтичні склади, що містять як активний компонент принаймні одну сполуку за формулою (I), яка була визначена вище, разом з фармацевтично прийнятним носієм. Предметом даної заявки є також використання сполуки за формулою (I) згідно з даним винаходом у виготовленні протипухлинного медикаменту. Предметом даної заявки є також використання сполуки за формулою (I) згідно з даним винаходом, у виготовленні медикаменту, призначеного для інгібування клітинної проліферації. Предметом даної заявки є також використання сполуки за формулою (I) згідно з даним винаходом у виготовленні медикаменту, призначеного для лікування проліферативних розладів, в кращому варіанті – різноманітних видів раку, а в ще кращому варіанті – гормонозалежних видів раку або ж видів раку, що експресують рецептори андрогенів, ще точніше – раку простату і раку молочної залози, а в найкращому спрямуванні – різноманітних видів раку простати. Запропонований фармацевтичний склад може бути у формі твердої речовини, наприклад, порошку, гранул, таблеток, желатинозних капсул. Підходящими твердими носіями для нього можуть бути, наприклад, фосфат кальцію, стеарат магнію, тальк, цукри, лактоза, декстрин, крохмаль, желатин, целюлоза, метилцелюлоза, карбоксиметилцелюлоза натрію, полівінілпіролідин і віск. Фармацевтичні склади, що містять сполуку згідно з даним винаходом, можуть готуватися також у рідкій формі, наприклад, розчинів, емульсій, суспензій або сиропів. Підходящими рідкими носіями для них можуть служити, наприклад, вода, органічні розчинники, такі як 11 UA 106884 C2 5 10 15 20 25 30 35 40 45 50 55 60 гліцерин або гліколі, а також їх суміші у різноманітних пропорціях у воді, добавлені до фармацевтично прийнятних масел або жирів. Рідкі стерильні склади можуть використовуватися для внутрішньом'язових, інтраперитонеальних або підшкірних ін'єкцій, а стерильні склади можуть уводитися також внутрішньовенним шляхом. Усі технічні та наукові терміни, використані в даному тексті, несуть значення, відомі фахівцям у даній галузі. Всі цитовані в даному тексті патенти (і заявки на патенти), а також інші літературні джерела включені тут шляхом посилання. Експериментальна частина Сполуки згідно з винаходом можуть бути одержані згідно з різноманітними процесами, 1 2 3 описаними вище, у відповідності до поданих тут визначень змінних груп R , R , R і X. Аналіз зразків 1 – 23 методом ядерного магнітного резонансу (ЯМР) проводився на спектрометрі Bruker-Avance II з робочою частотою 400 МГц. Наведені тут приклади здійснення описаних вище процесів несуть виключно ілюстративне призначення і не повинні розглядатися як такі, що тим або іншим чином обмежують даний винахід. У номенклатурі розглянутих нижче сполук і Прикладах використовується термінологія IUPAC (Міжнародного союзу з теоретичної та прикладної хімії). Приклад 1 1,1'-Бутан-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон} В атмосфері аргону до розчину 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин2,4-діону (158 мг, 0,5 ммоль) у безводному DMF (8 мл) додають NaH (60 %) (22 мг, 0,55 ммоль). У супроводженні вивільненням газів відбувається зміна кольору реакційного середовища, яке стає оранжевим. Перемішування триває протягом 30 хвилин при температурі 23 °C, після чого додають 1,4-дибромбутан (30 мкл, 0,25 ммоль). Утворену реакційну суміш гріють при 55 °C протягом 1 години, після чого її виливають у насичений водний розчин NH 4Cl (25 мл) та екстрагують за допомогою AcOEt (2 × 25 мл). Органічні фази збирають і промивають послідовно водою (25 мл) і розсолом (25 мл). Після сушки над Na 2SO4 органічний розчин фільтрують і концентрують випарюванням у вакуумі. Залишок від випарювання очищають на колонці двоокису кремнію (елюент: гептан/AcOEt: від 4/6 до 1/9). Цільову сполуку одержують у формі твердої речовини світло-жовтого кольору з корисним виходом 45 %. Температура плавлення: 211-212 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 2H, Ph); 8,21 (d, 2H, Ph); 8,08 (dd, 2H, Ph); 3,39 (m, 4H, 2 х NCH2); 1,70 (m, 4H, 2 х CH2); 1,49 (s, 12H, 4 х CH3). Приклад 2: 1,1'-Пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон} Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 1,4-дибромбутану тут використовують 1,5-дійодпентан. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 40 %. Температура плавлення: 163-164 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,33 (d, 2H, Ph); 8,21 (d, 2H, Ph); 8,07 (d, 2H, Ph); 3,34 (m, 4H, 2 х NCH2); 1,69 (m, 4H, 2 х CH2); 1,50 (s, 12H, 4 х CH3); 1,41 (m, 2H, CH2). Приклад 3 1,1’-Гексан-1,6-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон} Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 1,4-дибромбутану тут використовують 1,6-дійодгексан. У результаті одержують цільову сполуку у формі твердої речовини світло-жовтого кольору з корисним виходом 27 %. Температура плавлення: 187188 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,31 (d широкий, 2H, Ph); 8,20 (s широкий, 2H, Ph); 8,07 (d широкий, 2H, Ph); 3,32 (m, 4H, 2 х NCH2); 1,64 (m, 4H, 2 х CH2); 1,46 (s, 12H, 4 х CH3); 1,38 (m, 4H, 2 х CH2). Приклад 4 1,1'-Гептан-1,7-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон) Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 1,4-дибромбутану тут використовують 1,7-дибромгептан. У результаті одержують цільову сполуку у формі твердої речовини світло-жовтого кольору з корисним виходом 35 %. Температура плавлення: 137138 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,31 (d, 2H, Ph); 8,19 (d, 2H, Ph); 8,06 (dd, 2H, Ph); 3,30 (m, 4H, 2 х NCH2); 1,64 (m, 4H, 2 х CH2); 1,46 (s, 12H, 4 х CH3); 1,36 (m, 6H, 3x CH2). 12 UA 106884 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 5 4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс[2(трифторметил)бензонітрил] 5.1) 4-(4,4-Диметил-2,5-діоксоімідазолідин-1-іл)-2-(трифторметил)бензонітрил Суміш 4-фтор-2-(трифторметил)бензонітрилу (5,67 г, 30 ммоль), 5,5-диметил-гідантоїну (7,68 г, 60 ммоль) і K2CO3 (8,28 г, 60 ммоль) у DMF (45 мл) розділяють на рівні частини у три пробірки, які поміщають у мікрохвильову піч. В умовах магнітного перемішування кожну пробірку гріють опромінюванням печі при 140 °C протягом 20 хвилин. Після цього реакційні маси пробірок об'єднують, виливають у воду (200 мл) та екстрагують за допомогою AcOEt (2 × 75 мл). Органічні фази об'єднують, промивають розсолом, просушують над Na 2SO4 і фільтрують. Фільтрат концентрують випарюванням під зниженим тиском, і залишок кристалізують в Et 2O (25 мл). Після рекристалізації в EtOH (75 мл) порошок фільтрують і сушать під вакуумом. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 46 % (4,1 г). Температура плавлення: 212-213 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,80 (s, 1H, NH); 8,29 (d, 1H, Ph); 8,18 (s, 1H, Ph); 8,02 (d, 1H, Ph); 1,42 (s, 6H, 2 х CH3). 5.2) 4,4'-[Пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс[2(трифторметил)бензонітрил] Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3(трифторметил)-феніл]-імідазолідин-2,4-діону тут використовують проміжний продукт 5.1. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 50 % (330 мг). Температура плавлення: 167-169 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,28 (d, 2H, Ph); 8,18 (s, 2H, Ph); 8,02 (d, 2H, Ph); 3,30 (m, 4H, 2 х NCH2); 1,67 (m, 4H, 2 х CH2); 1,46 (s, 12H, 4 х CH3); 1,40 (m, 2H, CH2). Приклад 6 1,1'-(3-Метилпентан-1,5-діїл)біс{5,5-диметил-3-[4-нітро-3(трифторметил)феніл]імідазолідин-2,4-діон} Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 1,4-дибромбутану тут використовують 1,5-дибром-3-метилпентан. У результаті одержують цільову сполуку у формі піни світло-жовтого кольору з корисним виходом 39 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,30 (d, 2H, Ph); 8,20 (d, 2H, Ph); 8,07 (dd, 2H, Ph); 3,38 (m, 4H, 2 х NCH2); 1,72 (m, 4H, 2 х CH2); 1,53 (m, 1H, CH); 1,49 (s, 12H, 4xCH3); 1,00 (d, 3H, CH3). Приклад 7 1,1'-(Оксидіетан-2,1-діїл)біс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діон} Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 1,4-дибромбутану тут використовують біс-(2-брометиловий) етер. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 70 %. Температура плавлення: 186188 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,28 (d, 2H, Ph); 8,16 (d, 2H, Ph); 8,03 (dd, 2H, Ph); 3,67 (t, 4H, 2 х CH2); 3,52 (t, 4H, 2 х CH2); 1,47 (s, 12H, 4 х CH3). Приклад 8 1,1’-Пентан-1,5-діїлбіс{3-[4-аміно-3-(трифторметил)феніл]-5,5диметилімідазолідин-2,4-діон} Суміш сполуки Прикладу 2 (410 мг, 0,58 ммоль) і SnCl2, 2H2O (1,32 г, 5,8 ммоль) в AcOEt (10 мл) гріють при температурі 80 °C протягом 90 хвилин. Після цього реакційне середовище охолоджують при 0 °C і виливають у насичений водний розчин Na 2CO3 (40 мл). Отриману в результаті гетерогенну суміш фільтрують через целіт і промивають AcOEt (2 × 50 мл). Після декантації органічні фази об'єднують, сушать над Νа2SO4, фільтрують, і розчинник випарюють під зниженим тиском. Отриманий залишок поміщають у суміш гептан/AcOEt, і після фільтрації одержують тверду речовину білого кольору з корисним виходом 78 % (290 мг). Температура плавлення: 108-109 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 7,32 (d, 2H, Ph); 7,23 (dd, 2H, Ph); 6,85 (d, 2H, Ph); 5,80 (s, 4H, 2 х NH2); 3,27 (m, 4H, 2 х NCH2); 1,64 (m, 4H, 2 х CH2); 1,40 (s, 12H, 4 х CH3); 1,31 (m, 2H, CH2). Приклад 9 N, N'-(Пентан-1,5-діїлбіс{(4,4-диметил-2,5-діоксоімідазоліден-3,1-діїл)[2(трифторметил)-4,1-фенілен]})діацетамід В атмосфері аргону сполуку Прикладу 8 (161 мг, 0,25 ммоль) змішують з ацетилхлоридом (10 мл), і суміш перемішують протягом 15 годин при температурі 23 °C. Після цього реакційну суміш випарюють до сухого стану (у толуолі) і одержаний залишок очищають на колонці двоокису кремнію (елюент: CH2Cl2/EtOH від 99/1 до 90/10). Після випарювання одержують цільову сполуку у формі піни кремового кольору з корисним виходом 52 %. 13 UA 106884 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Н ЯМР 400 МГц (DMSO-d6) δ: 9,63 (s, 2H, CONH); 7,81 (d, 2H, Ph); 7,69 (dd, 2H, Ph); 7,58 (d, 2H, Ph); 3,30 (m, 4H, 2 х NCH2); 2,06 (s, 6H, 2 х CH3); 1,67 (m, 4H, 2 х CH2); 1,40 (s, 12H, 4 х CH3); 1,40 (m, 2H, CH2). Приклад 10 1,1'-Пентан-1,5-діїлбіс[5,5-диметил-3-(3-метил-4-нітрофеніл)-імідазолідин-2,4діон] 10.1) 5,5-Диметил-3-(3-метил-4-нітрофеніл)імідазолідин-2,4-діон Суміш 5-фтор-2-нітротолуолу (1,55 г, 10 ммоль), 5,5-диметилгідантоїну (1,28 г, 10 ммоль) і K2CO3 (1,38 г, 10 ммоль) у DMF (15 мл) поміщають у пробірку, яку гріють у мікрохвильовій печі при температурі 100 °C протягом 70 хвилин в умовах магнітного перемішування. Після цього реакційну суміш виливають у воду (200 мл) та екстрагують за допомогою AcOEt (2 × 75 мл). Органічні фази об'єднують, промивають розсолом, сушать над Na2SО4 і фільтрують. Фільтрат концентрують випарюванням під зниженим тиском, а залишок очищають шляхом хроматографії на колонці двоокису кремнію (елюент: гептан/AcOEt: 7/3). У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 25 % (666 мг). Температура плавлення: 177-178 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,70 (s, 1H, NH); 8,10 (d, 1H, Ph); 7,58 (s, 1H, Ph); 7,52 (dd, 1H, Ph); 2,54 (s, 3H, CH3); 1,41 (s, 6H, 2 х CH3). 10.2) 1,1'-Пентан-1,5-діїлбіс[5,5-диметил-3-(3-метил-4-нітрофеніл)- імідазолідин-2,4-діон] Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3(трифторметил)феніл]-імідазолідин-2,4-діону тут використовують проміжний продукт 10.1. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 67 % (495 мг). Температура плавлення: 130-131 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,09 (d, 2H, Ph); 7,58 (s, 2H, Ph); 7,52 (dd, 2H, Ph); 3,32 (s, 4H, 2 х NCH2); 2,53 (s, 6H, 2 х CH3); 1,68 (m, 4H, 2 х CH2); 1,46 (s, 12H, 4 х CH3); 1,38 (m, 2H, CH2). Приклад 11 1,1'-Пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-2-(трифторметил)феніл]імідазоліден-2,4-діон} 11.1) 5,5-Диметил-3-[4-нітро-2-(трифторметил)феніл]імідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу проміжного продукту 10.1, за винятком того, що замість 5-фтор-2-нітротолуолу тут використовують 2-фтор-5-нітробензотрифторид. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 29 %. Температура плавлення: 175176 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,76 (s, 1H, NH); 8,68 (dd, 1H, Ph); 8,58 (d, 1H, Ph); 8,04 (d, 1H, Ph); 1,47 (s, 3H, CH3); 1,38 (s, 3H, CH3). 11.2) 1,1'-Пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-2-(трифторметил)феніл] імідазолідин-2,4діон} Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3(трифторметил)феніл]-імідазолідин-2,4-діону тут використовують проміжний продукт 11.1. У результаті одержують цільову сполуку у формі піни світло-жовтого кольору з корисним виходом 12 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,68 (m, 2H, Ph); 8,58 (d, 2H, Ph); 8,04 (d, 2H, Ph); 3,33 (m, 4H, 2 х NCH2); 1,66 (m, 4H, 2 х CH2); 1,50 (m, 6H, 2 х CH3); 1,42 (m, 6H, 2 х CH3); 1,35 (m, 2H, CH2). Приклад 12 1,1'-Пентан-1,5-діїлбіс[3-(3-хлор-4-нітрофеніл)-5,5-диметил-імідазолідин-2,4діон] 12.1) 3-(3-Хлор-4-нітрофеніл)-5,5-диметилімідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу проміжного продукту 10.1, за винятком того, що замість 5-фтор-2-нітротолуолу тут використовують 2-хлор-4-фторнітробензол. У результаті одержують цільову сполуку у формі твердої речовини блідо-жовтого кольору з корисним виходом 28 %. Температура плавлення: 144-145 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,77 (s, 1H, NH); 8,21 (d, 1H, Ph); 7,92 (d, 1H, Ph); 7,71 (dd, 1H, Ph); 1,41 (s, 6H, 2 х CH3). 12.2) 1,1'-Пентан-1,5-діїлбіс[3-(3-хлор-4-нітрофеніл)-5,5-диметилімідазолідин-2,4-діон] Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3(трифторметил)-феніл]-імідазолідин-2,4-діону тут використовують проміжний продукт 12.1. У результаті одержують цільову сполуку у формі піни світло-жовтого кольору з корисним виходом 7 %. 14 UA 106884 C2 1 5 10 15 20 25 30 35 40 45 50 55 Н ЯМР 400 МГц (DMSO-d6) δ: 8,28 (d, 2H, Ph); 7,99 (d, 2H, Ph); 7,79 (dd, 2H, Ph); 3,37 (m, 4H, 2 х NCH2); 1,74 (m, 4H, 2 х CH2); 1,53 (m, 12H, 4 х CH3); 1,46(m, 2H, CH2). Приклад 13 1,1'-Пентан-1,5-діїлбіс[3-(3-метокси-4-нітрофеніл)-5,5-диметил-імідазолідин-2,4діон] 13.1) 3-(3-Метокси-4-нітрофеніл)-5,5-диметилімідазолідин-2,4-діон Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу проміжного продукту 10.1. за винятком того, що замість 5-фтор-2-нітротолуолу тут використовують 5-фтор-2-нітроанізол. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 20 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,70 (s, 1H, NH); 7,99 (d, 1H, Ph); 7,47 (d, 1H, Ph); 7,20 (dd, 1H, Ph); 3,91 (s, 3H, OCH3); 1,42 (s, 6H, 2 х CH3). 13.2) 1,1'-Пентан-1,5-діїлбіс[3-(3-метокси-4-нітрофеніл)-5,5-диметил- імідазолідин-2,4-діон| Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3(трифторметил)феніл]-імідазолідин-2,4-діону тут використовують проміжний продукт 13.1. У результаті одержують цільову сполуку у формі піни білого кольору з корисним виходом 10 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,07 (d, 2H, Ph); 7,54 (d, 2H, Ph); 7,28 (dd, 2H, Ph); 3,97 (s, 6H, 2 х OCH3); 3,38 (m, 4H, 2 х NCH2); 1,74 (m, 4H, 2 х CH2); 1,53 (m, 12H, 4 х CH3); 1,46 (m, 2H, CH2). Приклад 14 Диметил {пентан-1,5-діїлбіс[(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)(2метил-4,1-фенілен)]}біскарбамат 14.1) 1,1'-Пентан-1,5-діїлбіс[3-(4-аміно-3-метилфеніл)-5,5-диметилімідазолідин-2,4-діон| Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 8, за винятком того, що замість сполуки Прикладу 2 тут використовують сполуку Прикладу 10. У результаті одержують цільову сполуку у формі піни білого кольору з корисним виходом 69 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 6,79 (m, 4H, Ph); 6,60 (d, 2H, Ph); 5,02 (s, 4H, 2 х NH 2); 3,26 (m, 4H, 2 х NCH2); 2,03 (s, 6H, 2 х CH3); 1,62 (m, 4H, 2 х CH2); 1,39 (s, 12H, 4 х CH3); 1,31 (m, 2H, CH2). 14.2) Диметил{пентан-1,5-діїлбіс[(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)(2-метил-4,1фенілен)]}біскарбамат В атмосфері аргону проміжний продукт 14.1 (268 мг, 0,5 ммоль) розчиняють у безводному піридині (10 мл), і розчин змішують з метилхлорформіатом (0,8 мл, 10 ммоль). Суміш перемішують протягом 18 годин при температурі 90 °C. Після цього реакційну суміш виливають у воду з льодом та екстрагують за допомогою AcOEt (2 × 50 мл). Органічні фази об'єднують і промивають розсолом (25 мл). Органічний розчин висушують над Na2SО4, фільтрують, і розчинник випарюють під зниженим тиском. Залишок очищають на колонці двоокису кремнію (елюент: гептан/AcOEt: від 4/6 до 0/1). У результаті одержують цільову сполуку у формі піни білого кольору з корисним виходом 40 % (130 мг). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,92 (s, 2H, NH); 7,43 (d, 2H, Ph); 7,17 (d, 2H, Ph); 7,12 (dd, 2H, Ph); 3,66 (s, 6H, 2 х OCH3); 3,29 (m, 4H, 2 х NCH2); 2,20 (s, 6H, 2 х CH3); 1,66 (m, 4H, 2 х CH2); 1,42 (s, 12H, 4 х CH3); 1,37 (m, 2H, CH2). Приклад 15 4,4'-[Пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2метилбензонітрил) 15.1) 4-(4,4-Диметил-2,5-діоксоімідазолідин-1-іл)-2-метилбензонітрил Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу проміжного продукту 5.1, за винятком того, що замість 4-фтор-2(трифторметил)бензонітрилу тут використовують 4-фтор-2-метилбензонітрил. Після рекристалізації EtOH (75 мл) одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 5 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,70 (s, 1H, NH); 7,89 (d, 1H, Ph); 7,54 (s, 1H, Ph); 7,43 (d, 1H, Ph); 2,49 (s, 3H, CH3); 1,40 (s, 6H, 2 х CH3). 15.2) 4,4'-[Пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин3,1-діїл)]біс(2метилбензонітрил) Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3(трифторметил)феніл]-імідазолідин-2,4-діону тут використовують проміжний продукт 15.1. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 66 %. Температура плавлення: 148-149 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 7,81 (d, 2H, Ph); 7,49 (d, 2H, Ph); 7,39 (dd, 2H, Ph); 3,30 (m, 4H, 2 х NCH2); 2,43 (s, 6H, 2 х CH3); 1,62 (m, 4H, 2 х CH2); 1,39 (s, 12H, 4 х CH3); 1,31 (m, 2H, CH2). 15 UA 106884 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 16 4,4'-[Пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2хлорбензонітрил) 16.1) 2-хлор-4-(4,4-диметил-2,5-діоксоімідазолідин-1-іл)бензонітрил Використовуваний експериментальний процес одержання даної сполуки є таким самим, що й описаний вище процес одержання проміжного продукту 5.1, за винятком того, що замість 4фтор-2-(трифторметил)бензонітрилу тут використовують 2-хлор-4-фторбензонітрил. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 23 %. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,76 (s, 1H, NH); 8,08 (d, 1H, Ph); 7,90 (d, 1H, Ph); 7,67 (dd, 1H, Ph); 1,40 (s, 6H, 2 х CH3). 16.2) 4,4'-[Пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2хлорбензонітрил) Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3(трифторметил) феніл]-імідазолідин-2,4-діону тут використовують проміжний продукт 16.1. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 51 %. Температура плавлення: 166-167 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,08 (d, 2H, Ph); 7,90 (d, 2H, Ph); 7,68 (dd, 2H, Ph); 3,30 (m, 4H, 2 х NCH2); 1,64 (m, 4H, 2 х CH2); 1,45 (s, 12H, 4 х CH3); 1,38 (m, 2H, CH2). Приклад 17 1,1'-Пропан-1,3-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-phény I]імідазолідин-2,4-діон} Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 1,4-дибромбутану тут використовують 1,3-дийодпропан. У результаті одержують цільову сполуку у формі твердої речовини білого кольору з корисним виходом 15 % (50 мг). Температура плавлення: 164-165 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,33 (d, 2H, Ph); 8,21 (d, 2H, Ph); 8,09 (dd, 2H, Ph); 3,45 (t, 4H, 2 х NCH2); 2,01 (m, 2H, CH2); 1,50 (s, 12H, 4 х CH3). Приклад 18 Хлорид 2-{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-2,4діоксоімідазолідин-1-іл}-N-(2-{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]-2,4діоксоімідазолідин-1-іл}етил)-N-метилетанамін Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 1,4-дибромбутану тут використовують хлоргідрат мехлоретаміну. У результаті одержують цільову сполуку у формі твердої речовини світло-жовтого кольору з корисним виходом 30 %. Температура плавлення: 136-137 °C. 1 + Н ЯМР 400 МГц (DMSO-d6) δ: 11,08 (s широкий, 1H, NH ); 8,31 (m, 4H, Ph); 8,10 (d, 2H, Ph); 3,87 (m, 4H, 2 х NCH2); 3,51 (m, 2H, NCH2); 3,38 (m, 2H, NCH2); 2,99 (s широкий, 3H, CH3); 1,55 (s, 12H, 4 х CH3). Приклад 19 1,1'-(2Z)-Бут-2-ен-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил) феніл]імідазолідин-2,4-діон} Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 1,4 дибромбутану тут використовують цис-1,4-дихлор-2-бутен. У результаті одержують цільову сполуку у формі твердої речовини блідо-жовтого кольору з корисним виходом 40 %. Температура плавлення:191-193 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,34 (d, 2H, Ph); 8,22 (d, 2H, Ph); 8,09 (dd, 2H, Ph); 5,61 (q, 2H, CH=CH); 4,2 (q, 4H, 2 х CH2); 1,50 (s, 12H, 4 х CH3). Приклад 20: 4,4'-[пентан-1,5-діїлбіс(5,7-діоксо-4,6-діазаспіро[2.4]гептан-4,6-діїл)]біс[2(трифторметил)бензонітрил] 20.1) 1-({[4-ціано-3-(трифторметил)феніл]карбамоїл}аміно)циклопропан-карбонова кислота Розчин 4-ізоціанат-2-(трифторметил)бензонітрилу (4,56 г, 21,5 ммоль) в ацетаноні (12 мл) додають по краплям до 1-аміноциклопропанкарбонової кислоти (2,02 г, 20 ммоль), розчиненої у водному розчині гідроксиду натрію (12 мл, 0,8 г, 20 ммоль). Цю реакційну масу перемішують протягом 1 години при навколишній температурі, а після цього виливають на водний розчин гідроксиду натрію (1 н., 40 мл). Одержаний розчин промивають етилацетатом (30 мл), а потім підкислюють додаванням водного розчину сірчаної кислоти (2M, 30 мл) та екстрагують етилацетатом (2 × 50 мл). Одержану таким чином органічну фазу промивають водою, потім насиченим водним розчином хлориду натрію, просушують над Na 2SО4 і фільтрують. Розчинник випарюють під зниженим тиском. Утворений залишок змішують з етиловим етером, і після фільтрації одержують тверду речовину білого кольору з корисним виходом 50 % (3,16 г). 16 UA 106884 C2 5 10 15 20 25 30 35 40 45 50 55 20.2) 4-(5,7-Діоксо-4,6-діазаспіро[2.4]гепт-6-ил)-2-(трифторметил)бензонітрил В атмосфері аргону до розчину проміжного продукту 20.1 (3,16 г, 10 ммоль) і DMF (0,5 мл) у 1,4-діоксані (20 мл) додають оксалілхлорид (1,12 мл, 13 ммоль). Утворену реакційну масу перемішують в умовах нагріву зі зворотним холодильником протягом однієї години і розчинник випарюють під зниженим тиском. Залишок розчиняють у воді (30 мл), і одержаний розчин екстрагують етилацетатом (50 мл). Органічну фазу промивають послідовно водою і насиченим розчином у хлориді натрію та просушують над Na2SО4. Розчинник випарюють під зниженим тиском. Одержаний залишок екстрагують етиловим етером, і після фільтрації одержують тверду речовину білого кольору з корисним виходом 20 % (0,6 г). 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,91 (s, 1H, NH); 8,27 (d, 1H, Ph); 8,18 (s, 1H, Ph); 8,04 (d, 1H, Ph); 1,3-1,45 (m, 4H, 2 х CH2 спіро). 20.3) 4,4'-[Пентан-1,5-діїлбіс(5,7-діоксо-4,6-діазаспіро[2.4]гептан-4,6-діїл)]біс[2(трифторметил)бензонітрил] Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 2, за винятком того, що замість 5,5-диметил-3-[4-нітро-3(трифторметил)-феніл]-імідазолідин-2,4-діону тут використовують проміжний продукт 20.2. У результаті одержують цільову сполуку у формі твердої речовини білого кольору. Температура плавлення: 154-155 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,27 (d, 2H, Ph); 8,17 (d, 2H, Ph); 8,03 (dd, 2H, Ph); 3,14 (t, 4H, CH2 × 2); 1.64 (m, 4H, 2 х CH2); l, 55(m, 4H, 2x CH2 спіро); 1,36 (m, 6H, CH2 центральний, 2x CH2 спіро). Приклад 21 4,4'-[(2Z)-Бут-2-ен-1,4-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс[2(трифторметил)бензонітрил] Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 1,4 дибромбутану тут використовують цис-1,4-дихлор-2-бутен, а замість 5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]-імідазолідин-2,4-діону тут використовують проміжний продукт 5.1. У результаті одержують цільову сполуку у формі твердої речовини бежевого кольору. Температура плавлення: 188-190 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 2H, Ph); 8,19 (d, 2H, Ph); 8,05 (dd, 2H, Ph); 5,60 (q, 2H, CH=CH); 4,2 (q, 4H, 2 х CH2); 1,49 (s, 12H, 4 х CH3). Приклад 22 4.4'-((2R, 3S)-Оксиран-2,3-диїлбіс[метандиїл(4.4-диметил-2.5-діоксоімідазолідин3,1-діїл)]}біс[2-(трифторметил)бензонітрил] В атмосфері аргону сполуку Прикладу 21 (90 мг, 0.139 ммоль) змішують з 3метахлорпербензойною кислотою (72,5 мг, 0,210 ммоль) у безводному дихлорметані (10 мл). Утворену суміш перемішують при навколишній температурі. За розвитком реакції стежать за допомогою тонкошарової хроматографії (елюент DCM/EtOH: 95/05). Через 4 дні спостерігається наявність залишку первинної сполуки. До реакційної маси додають ще певну кількість метахлорпербензойної кислоти (0,124 г, 0,36 ммоль), і суміш перемішують при навколишній температурі протягом ще 4 днів. Розчинник випарюють під зниженим тиском, а залишок очищають за допомогою флеш-хроматографії (колонка BIOTAGE 25+M, градієнт дихлорметан/ацетон: від 0 % до 8 % в ацетоні). Цільову сполуку одержують у формі твердої речовини білого кольору з корисним виходом 50 %. Температура плавлення: 108-110 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,32 (d, 2H, Ph); 8,21 (d, 2H, Ph); 8,05 (dd, 2H, Ph); 4,05 (q, 2H, CH-CH); 3,28 (m, 4H, 2 х CH2); 1,53(d, 12H, 4 х CH3). Приклад 23 4,4'-{(1R, 2R)-циклопропан-1,2-діїлбіс[метандіїл(4,4-диметил-2,5діоксоімідазолідин-3,1-діїл)]}біс[2-(трифторметил)бензонітрил] Використовуваний експериментальний процес одержання даної сполуки є таким самим, що і процес синтезу сполуки Прикладу 1, за винятком того, що замість 1,4-дибромбутану тут використовують транс-1,2-біс(бромметил)циклопропан, приготований відповідно до (J. Med. Chem. 2003, 46 (21), 4586-4600). У результаті одержують цільову сполуку у формі твердої речовини кремового кольору. Температура плавлення: 178-180 °C. 1 Н ЯМР 400 МГц (DMSO-d6) δ: 8,26 (d, 2H, Ph); 8,15 (d, 2H, Ph); 8,01 (dd, 2H, Ph); 3,2-3,4 (m, 4H, 2 х NCH2); 2,49 (s, 12H, 4 х CH3); 1,24 (m, 2H, 2 х CH); 0,61 (t, 2H, 1 х CH 2). Фармакологічні дослідження сполук згідно з винаходом Вимірювання антипроліферативної активності 1. Антипроліферативна активність на клітинах LNCaP у повному середовищі Антипроліферативну активність сполук згідно з даним винаходом визначають на клітинах LNCaP у повному культуральному середовищі згідно з такою методикою експерименту. 17 UA 106884 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовують клітинний тип LNCaP (ATCC, 1740), який походить із карциноми простати, що експресує рецептор андрогенів; ця клітинна лінія є гормонозалежною. Культивування лінії LNCaP здійснюють у повному культуральному середовищі: RPMI середовище, 10 % телячої фетальної сироватки, 2 мM глутаміну, 100 U/мл пеніциліну, 0,1 мг/мл стрептоміцину і HEPES 0,01 M, піруват натрію 1 мM, 40 % D-глюкози. Засівання планшетів Клітини лінії LNCaP засівають по 20000 клітин/лунку у 90 мкл повного середовища на 96лункові планшети, покриті полі-D-лізином (Biocoat, Costar). Обробка клітин: через 24 год. після засівання клітини піддають обробці добавлянням по 10 мкл/лунку сполуки, розрідженої в культуральному середовищі. Використовують такі концентрації: 1/10/30/100/300/1000/3000/10000/100000 нM. Клітини інкубують протягом 144 годин при 37 °C, 5 % CО2. Зчитування: через 6 днів інкубування до кожної лунки додають 10 мкл реактиву "проліферація клітин WST-1 " (Roche № 1644807). Після інкубування протягом 2 годин при 37 °C, 5 % CО2, проводять вимірювання поглинання на хвилі 450 нм шляхом спектрофотометрії (Envision, Perkin Elmer). Результати: досліди проводять з дублюванням, і кращі сполуки піддають подвійному тестуванню. Обчислюють величину концентрації 50 % інгібування клітинної проліферації (CI50). Всі сполуки описаних вище Прикладів 1-23 мають значення CI50, що не перевищують 5000 нМ на клітинах LNCaP в культурі. Серед них сполуки перелічених нижче Прикладів мають значення CI 50, що не перевищують 1500 нМ на клітинах LNCaP в культурі: 1, 2, 4, 7, 10, 13, 14, 15, 16, 19, 20, 21 і 22. Сполуки перелічених нижче Прикладів мають величину CI 50 нижче 500 нM на клітинах LNCaP в культурі: 1, 2, 7, 15, 19, 20, 21 і 22. 2. Антипроліферативна активність на клітинах LNCaP у збідненому на стероїди середовищі Антипроліферативну активність сполук згідно з даним винаходом визначають на клітинах LNCaP у збідненому на стероїди середовищі. Клітинна лінія LNCaP (ATCC, 1740) походить із карциноми простати, що експресує рецептор андрогенів; ця клітинна лінія є гормонозалежною. Культивування клітинної лінії LNCaP здійснюють у звичайних умовах у RPMI, 10 % телячої фетальної сироватки, 2 мM глутаміну, 100 U/мл пеніциліну, 0,1 мг/мл стрептоміцину і HEPES 0,01 M, піруват натрію 1 мM, 40 % D-глюкози. Для проведення досліджень у безстероїдних умовах середовище культивування клітин видаляють за 24 години до засівання. Клітини промивають фізіологічним розчином, забуференим фосфатом (PBS), а потім інкубують при наявності RPMI середовища без фенольного червоного, 10 % телячої фетальної сироватки безстероїдної (обробка вуглецем), 2 мМ глутаміну, 100 U/мл пеніциліну, 0,1 мг/мл стрептоміцину і HEPES 0,01 M, піруват натрію 1 мM, 40 % D-глюкози. Засівання планшетів Клітинну лінію LNCaP засівають по 20000 клітин/лунку у 90 мкл середовища RPMI з 10 % збідненої на стероїди телячої фетальної сироватки на 96 лункові планшети, покриті полі-Dлізином (Biocoat, Costar). Обробка клітин: через 24 год. після засівання клітини піддають обробці добавлянням розрідженої в культуральному середовищі випробуваної сполуки в кількості 10 мкл/лунку. Використовують такі концентрації: 1 / 10 /30 / 100 / 300 / 1000 / 3000 / 10000 / 100000 нM. Клітини інкубують протягом 144 год. при температурі 37 °C, 5 % CO2. Зчитування Через 6 днів інкубування до кожної лунки додають 10 мкл реактиву "проліферація клітин WST-1 " (Roche № 1644807). Після інкубування протягом 2-4 годин при 37 °C, 5 % CО2, проводять вимірювання поглинання на хвилі 450 нм шляхом спектрофотометрії (Envision, Perkin Elmer). Результати Досліди проводять з дублюванням, і кращі сполуки піддають подвійному тестуванню. Обчислюють величину концентрації 50 % інгібування клітинної проліферації (CI50). Як зазначалося вище (Veldscholte J, Berrevoets ÇA, Brinkmann AO, Grootegoed JA, Mulder E. Biochemistry 1992 Mar 3;31(8):2393-9), нілутамід виказує агоністичну активність при малих концентраціях, але інгібіторну активність при високих концентраціях. У сполук 1-23 не виявлялося агоністичної дії на LNCaP клітини, культивовані у збідненому на стероїди середовищі. Більш того, сполуки 2 і 19 вочевидь демонструють інгібіторну активність при малих концентраціях. Дія сполук 2 і 19 на проліферацію клітин LNCaP, культивованих у збідненому на стероїди середовищі, ілюстрована графічно на Фіг. 1. 3. Вимірювання білкової експресії рецептора андрогенів 18 UA 106884 C2 5 10 15 20 25 30 35 Клітини лінії LNCaP засівають у розрахунку по 2,5 мільйонів клітин на 10 см чашку Петрі у RPMI середовищі, 10 % телячої фетальної сироватки, 2 мM глутаміну, 100 U/мл пеніциліну, 0,1 мг/мл стрептоміцину і HEPES 0,01 M, піруват натрію 1 мM, 40 % D-глюкози. Через 4 дні після засівання клітини піддають обробці випробуваною сполукою. Через 72 години після обробки клітини піддають лізису в лізисному буфері (Tris pH 7,4 50 мM, NaCl 150 мM, EDTA 1 мM, NaF 20 mM, Na2VO3 100 мM, NP40 0,5 %, Triton X-100 1 %, EGTA 1 мM, Pefabloc, протеаза-інгібіторний коктейль 11836170001 Roche Diagnostics, фосфатаза-інгібіторний коктейль, комплект II, Calbiochem). Після цього клітини зішкрябають, і лізат переносять у пробірки QIAshredder (кат. № 79656 Qiagen), у котрих їх піддають центрифугуванню зі швидкістю 13000 об./хв. протягом 15 хвилин при температурі 4 °C. Супернатант від центрифугування переносять у пробірки QIAshredder, в котрих його піддають другому центрифугуванню зі швидкістю 13000 об./хв. протягом 5 хвилин для повного видалення ниток ДНК. Далі визначають концентрацію білка (набір для аналізу білків: Bio-Rad DC protein assay kit) (і встановлюють її на 10 і 20 мкг на лунку, в залежності від досліду). До зразків додають буфер завантажування зразків (sample loading buffer 3 X № 7722 Cell signaling technology) з доданим до нього бета-меркаптоетанолом 1 % і DTT 50 мM, і зразки гріють протягом 10 хвилин при температурі 90 °C. Зразки поміщають під об'єм 20 мкл на гелі NuPAGE 4-12 % Bis-Tris гель (кат. № NP0322BOX, Invitrogen). Міграція відбувається у буфері MOPS (Invitrogen) і здійснюється протягом 1 години при 180 В. Білки переносяться на мембрану із нітроцелюлози (Hybond ECL RPN78D, GE Healthcare) у напівсухому стані при наявності буферу для блотингу (NP0006-1, Invitrogen) протягом 45 хвилин при 15 В. Після цього мембрану блокують протягом 1 години у буфері для блокування (нежирне сухе молоко, кат. 170-6404, Biorad) 5 % у трис-буферизованому фізіологічному розчині (TBS), 0,1 % Tween 20. Далі її інкубують при температурі 4 °C протягом ночі при наявності первинного антитіла, спрямованого проти андрогенного рецептора (AR441, sc-7305, Santa Cruz), розрідженого у співвідношенні 1/2000 у буфері для блокування, і так само при наявності первинного антитіла проти GAPDH (кат. MAB374, Millipore), розрідженого у співвідношенні 1/20000 у буфері для блокування (контроль завантаження білками). Після цього мембрану тричі промивають у промивному буфері (TBS, 0,1 % Tween 20). Далі її інкубують при наявності вторинного антитіла проти імуноглобуліну миші, зв'язаного з HRP (коза проти миші IgG-HRP, sс 2031, Santa Cruz), розрідженого у співвідношенні 1/5000 у буфері для блокування. Після цього мембрану тричі промивають у промивному буфері. Білки виявляють методом електрохемолюмінесценції (прилад для детектування методом вестерн-блотінгу ECL+, Amersham) за допомогою фотоплівки (Biomax light, Sigma) або за допомогою приладу для прийому хемолюмінесценції (G:Box, Syngene). На Фіг. 2 – 9 показана дія сполук 2, 7, 10, 15, 16, 19, 21, 22. Ці сполуки зменшують білкову експресію рецептора андрогенів. На відміну від них, як можна бачити на Фіг. 10, нілутамід не зменшує білкову експресію цього рецептора. ФОРМУЛА ВИНАХОДУ 40 1. Сполука, яка має загальну формулу (І) R R 1 2 R O 3 R N R 3 3 R 3 O R N N N 2 R 1 X O 45 50 O , (І) в якій 1 4 4 R являє собою радикали ціано, нітро, аміно, -NHCOOR або -NHCOR ; 2 R являє собою радикали галоген, алкіл, галогеналкіл або алкокси; 3 3 R являє собою радикал алкіл або атом водню; або ж два радикали R разом з атомом вуглецю, до якого вони приєднані, утворюють циклоалкіл, який містить від 3 до 4 членів в ланцюзі; X являє собою або алкіленовий ланцюг із 3-7 атомів вуглецю, прямий або розгалужений, який може містити 5 одну або багато ідентичних або різних додаткових ланок, вибраних з -О-, -N(R )-, -S-, -SO- або SO2-; 19 UA 106884 C2 6 R7 CH CH R (CH )n (CH )p 2 1 2 1 або групу , в якій n1 і р1 є два цілих числа, сума n1+р1 яких є цілим числом, вибраним із сукупності чисел 2, 3, 4 і 5; 6 7 6 7 R і R утворюють разом ковалентний зв'язок, або R і R разом з атомами вуглецю, з якими O 5 10 CH CH вони з'єднані, утворюють цикл або циклоалкіл, що містить від 3 до 6 членів в ланцюзі; 4 R являє собою радикал алкіл, арил або гетероарил; 5 R являє собою водень, радикал алкіл або аралкіл; або її фармацевтично прийнятна сіль. 2. Сполука за п. 1, в якій X являє собою прямий або розгалужений алкіленовий ланцюг із 3-7 атомів вуглецю, який може містити одну або багато ідентичних або різних додаткових ланок, 5 вибраних з -О-, -N(R )-, -S-, -SO- або -SO2-, або її фармацевтично прийнятна сіль. 3. Сполука за п. 1 або 2, в якій X являє собою алкіленовий ланцюг, який може містити одну 5 єдину ланку, вибрану з -О-, -N(R )-, -S-, -SO- або -SO2-, або її фармацевтично прийнятна сіль. 6 R7 CH CH R (CH )n 15 (CH )p 2 1 2 1 4. Сполука за п. 1, в якій X являє собою групу , де n1 і р1 є двома цілими числами, сума n1+р1 яких є цілим числом, вибраним із сукупності чисел 2, 3, 4 і 5; 6 7 6 7 R і R утворюють разом ковалентний зв'язок, або R і R разом з атомами вуглецю, з якими O CH CH вони з'єднані, утворюють цикл або циклоалкіл, який містить від 3 до 4 членів в ланцюзі; або її фармацевтично прийнятна сіль. 5. Сполука за п. 4, в якій n1 і р1 є однаковими. 20 (CH2)n2 6. Сполука за п. 1, в якій X являє собою групу X' R6 (CH2)p2 , де X' являє собою R7 CH CH групу -О-, -N(R )- або -S-, -SO-, -SO2-, -(СН2)- або , а n2 і р2 є цілими числами, сума n2+р2 яких є або цілим числом, вибраним з чисел 3, 4, 5, 6 і 7, коли X' являє собою групу 5 О-, -N(R )- або -S-, -SO-, -SO2-, або цілим числом, вибраним з чисел 2, 3, 4 і 5, коли X' являє 5 R6 собою групу R7 CH CH або -(СН2)-. R6 25 30 35 R7 CH CH 7. Сполука за п. 6, в якій X' являє собою групу . 5 8. Сполука за п. 6, у котрій X' являє собою групу -О-, -N(R )- або -(СН2)-. 9. Сполука за будь-яким із пп. 6-8, в якій n2 і р2 є однаковими. 3 3 10. Сполука за будь-яким із пп. 1-9, в якій R являє собою радикал алкіл, або два радикали R разом з атомами вуглецю, з якими вони зв'язані, утворюють циклоалкіл, який містить від 3 до 4 членів в ланцюзі. 4 11. Сполука за будь-яким із пп. 1-10, в якій R являє собою радикал алкіл. 5 12. Сполука за будь-яким із пп. 1-11, в якій R являє собою радикал алкіл. 1 13. Сполука за будь-яким із пп. 1-12, в якій R є в пара-положенні. 2 14. Сполука за будь-яким із пп. 1-13, у котрій R є в мета-положенні. 6 7 15. Сполука за будь-яким із пп. 1-14, в якій R і R утворюють разом ковалентний зв'язок. 6 7 16. Сполука за будь-яким із пп. 1-14, в якій R і R разом з атомами вуглецю, з якими вони O 40 CH CH зв'язані, утворюють цикл . 6 7 17. Сполука за будь-яким із пп. 1-14, в якій R і R разом з атомами вуглецю, з якими вони зв'язані, утворюють циклоалкіл, який містить від 3 до 6 членів в ланцюзі. 18. Сполука за будь-яким із пп. 1-17, в якій радикал алкіл являє собою метильну групу. 20 UA 106884 C2 5 10 15 19. Сполука за будь-яким із попередніх пунктів, яка вибрана з: 1,1'-бутан-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону}, 1,1'-пентан-1,5-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діону} 1,1'-(оксидіетан-2,1-діїл)біс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4діону}, 4,4'-[пентан-1,5-діїлбіс(4,4-диметил-2,5-діоксоімідазолідин-3,1-діїл)]біс(2-метилбензонітрилу), 1,1'-(2Z)-бут-2-ен-1,4-діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4діону}, або її фармацевтично прийнятна сіль. 20. Сполука за будь-яким із попередніх пунктів, яка являє собою 1,1'-пентан-1,5-діїлбіс{5,5диметил-3-[4-нітро-3-(трифторметил)-феніл]імідазолідин-2,4-діон} або 1,1'-(2Z)-бут-2-ен-1,4діїлбіс{5,5-диметил-3-[4-нітро-3-(трифторметил)феніл]імідазолідин-2,4-діоном} або їх фармацевтично прийнятні солі. 21. Спосіб одержання сполуки за формулою (І) відповідно до п. 1, який включає у себе стадію, на котрій (і) конденсують два еквіваленти арилгідантоїнів за загальною формулою (II) R R 2 1 3 R O R N 3 NH O , (II) 1 в якій R і R є такими, як визначено в п. 1, a R є нітрогрупою або ціаногрупою, із сполукою, що 1 2 1 2 має загальну формулу Gp -X-Gp , де Gp і Gp є відхідні групи, а X є таким, як визначено вище, в присутності сильної основи, у результаті чого утворюється сполука, що описується загальною формулою (І) 2 20 R R 3 2 1 3 R O R N R 3 3 R 3 O R N N 2 N R 1 X O O 25 , (І) 2 3 1 в котрій R , R і X є такими, як визначено в п. 1, a R є нітрогрупою або ціаногрупою; 1 у разі потреби, якщо R є нітрогрупою, то в зазначеному способі здійснюють, крім того: (іі) відновлення нітрогрупи та одержання в результаті сполуки за формулою (III) R O 2 H2 N 3 R R N R 3 3 R 3 O R N N 2 NH2 N X O O 30 , (III) у разі потреби, в зазначеному способі здійснюють, крім того, стадію, вибрану з: (ііі) проведення реакції між сполукою за формулою (III), одержаною на стадії (іі), та 4 4 хлорангідридом кислоти, що має загальну формулу R -COCl, у якій R є таким, як визначено в п. 1, з одержанням у результаті сполуки за формулою (IV) R O 4 R C 2 R O 3 R N R 3 3 R 3 O R N N 2 O N X N H O N H O 21 C R 4 , (IV) UA 106884 C2 (iv) проведення реакції між сполукою за формулою (III), одержаною на стадії (іі), та 4 4 хлорформіатом, що має загальну формулу R -O-CO-Cl, у якій R є таким, як визначено в п. 1, з одержанням у результаті сполуки за формулою (V) R 2 O 4 5 RO C R O 3 R N R 3 3 R 3 O R N N R N H N H O O 1 2 R O 3 R N N 3 R O (CH2)n1 CH CH (CH2)p1 O 15 20 O N X C OR 4 , (V) 6 7 у разі потреби, якщо R і R утворюють разом ковалентний зв'язок, то в зазначеному способі здійснюють, крім того: 6 7 (v) окиснення подвійного зв’язку сполуки за формулою (І), що утворений замісниками R і R , з одержанням у результаті сполуки за формулою (VI) R 10 2 3 R 3 O R N N O 2 R 1 (VI). 22. Сполука за будь-яким із пп. 1-20 як медикамент. 23. Фармацевтична композиція, яка містить як активний інгредієнт принаймні одну сполуку за формулою (І), таку, як визначено в будь-якому з пп. 1-20, разом з фармацевтично прийнятним носієм. 24. Застосування сполуки за формулою (І) за будь-яким із пп. 1-20 для одержання медикаменту, призначеного для лікування раку. 25. Застосування за п. 24, в якому медикамент призначається для лікування гормонозалежного раку. 26. Застосування за п. 24, в якому медикамент призначається для лікування раку, що експресує рецептори андрогенів. 27. Застосування за будь-яким із пп. 24-26, в якому медикамент призначається для лікування раку молочної залози або простати. 22 UA 106884 C2 23 UA 106884 C2 24 UA 106884 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 25
ДивитисяДодаткова інформація
Назва патенту англійськоюImidazolidine-2,4-dione derivatives and use thereof as a medicament
Автори англійськоюBigg, Dennis, Auvin, Serge, Lanco, Christophe, Prevost, Gregoire
Автори російськоюБигг Деннис, Овин Серж, Ланко Кристоф, Превост Грегуар
МПК / Мітки
МПК: A61K 31/4166, C07D 403/06, A61P 35/00, C07D 403/12
Мітки: похідні, застосування, медикаменту, імідазолідин-2,4-діону
Код посилання
<a href="https://ua.patents.su/27-106884-pokhidni-imidazolidin-24-dionu-ta-kh-zastosuvannya-yak-medikamentu.html" target="_blank" rel="follow" title="База патентів України">Похідні імідазолідин-2,4-діону та їх застосування як медикаменту</a>
Попередній патент: Безкольорова магнітна фарба для глибокого друку
Наступний патент: Dig-3 інсектицидні cry-токсини
Випадковий патент: Вузол охолодження обладнання для переробки полімерів