Поліарилкарбоксаміди, придатні для застосування як ліпідознижуючі агенти
Номер патенту: 77946
Опубліковано: 15.02.2007
Автори: Ровенс Петер Волтер Марія, Мірпол Лівен, ван дер Векен Луі Жозеф Елізабет, Віллвой Марсель, Бакс Лео Якобус Жозеф
Формула / Реферат
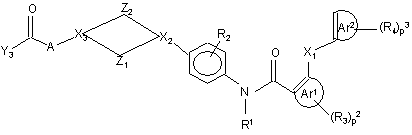
1. Поліарилкарбоксамідна сполука формули (I)
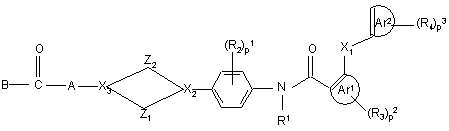 , (I)
, (I)
її N-оксиди, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де
- Z1 обирають з (CH2)n, де n дорівнює 1-3, CH2CH2O та OCH2CH2,
- Z2 позначає (CH2)m, де m дорівнює 1 чи 2,
- X1 позначає O, CH2, CO, NH, CH2O, OCH2, CH2S, SCH2 чи простий зв’язок,
- X2 та X3 кожен незалежно обирають з CH, N та sp2-атома карбону,
- R1 позначає гідроген чи C1-4-алкіл,
- Ar1 позначає ароматичне кільце, обране з фенілу, нафталенілу, піридинілу, піразинілу, піримідинілу, піридазинілу, триазинілу, триазолілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов’язково заміщених одним чи двома замісниками R3,
- Ar2 позначає ароматичне кільце, обране з фенілу, нафталенілу, піридинілу, піразинілу, піримідинілу, піридазинілу, триазинілу, триазолілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов’язково заміщених одним, двома чи трьома замісниками R4,
- кожен з R2 та R3 незалежно обирають з C1-4-алкіл, C1-4-алкілоксигрупи, галоїду та трифторметилу,
- кожен з R4 незалежно обирають з C1-4-алкіл, C1-4-алкілоксигрупи, галоїду, гідроксилу, меркаптогрупи, ціаногрупи, нітрогрупи, C1-4-алкілтіогрупи чи полігалоїд-C1-6-алкілу, аміногрупи, C1-4-алкіламіногрупи та ді-(C1-4-алкіл)аміногрупи,
- p1 та p2 дорівнюють кожен 0-2,
- p3 дорівнює 0-3,
- X1 та R4 разом з ароматичними кільцями Ar1 та Ar2, до яких вони приєднані, можуть утворювати флуорен-1-ільну чи флуорен-4-ільну групу,
- A позначає C1-6-алкандіїл, заміщений однією чи двома групами, обраними з арилу, гетероарилу та C3-10-циклоалкілу, або якщо X3 позначає CH, A може також позначати атом нітрогену, заміщений гідрогеном, C1-10-алкілом, арилом, гетероарилом, арил-C1-10-алкілом, гетероарил-C1-10-алкілом чи C3-10-циклоалкілом,
- B позначає гідроген, C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкоксикарбонілу, C1-10-алкіламінокарбонілу і ді-(C1-10-алкіл)амінокарбонілу, арил-C1-6-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, полігалоїд-C1-6-алкіл, C3-6-алкеніл, C3-6-алкініл, NR6R7 чи OR8,
- R6 та R7 кожен незалежно позначають гідроген, C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3.8-алкініл, конденсований бензо-C5-8-циклоалкіл, причому R6 та R7 разом з атомом нітрогену, до якого вони приєднані, можуть утворювати насичений C4-8-гетероциклічний радикал,
- R8 позначає C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3-8-алкініл чи конденсований бензо-C5-8-циклоалкіл.
2. Поліарилкарбоксамідна сполука за п. 1, у якій Z1, Z2, X2 та X3 разом утворюють шестичленний гетероцикл.
3. Поліарилкарбоксамідна сполука за п. 1 чи п.2, у якій Z1, Z2, X2 та X3 разом утворюють піперидинову чи піперазинову групу, а X1 позначає простий зв’язок.
4. Поліарилкарбоксамідна сполука за будь-яким з пп. 1-3, у якій р1 та р3 дорівнюють кожен 0,1, а R4 позначає гідроген, трифторметил, хлор чи трет-бутил.
5. Поліарилкарбоксамідна сполука за будь-яким з пп. 1-4, призначена для використання як лікарський засіб.
6. Поліарилкарбоксамідна сполука за п. 5, призначена для використання у лікуванні гіперліпідемії, ожиріння, діабету типу II, атеросклерозу, ішмічної хвороби серця, захворювань периферичних судин, захворювань судин мозку, гіперхолестеринемії, гіпертригліцеридемії, панкреатиту чи захворювань коронарної артерії.
7. Сполука за п. 1, у якій сполука є (+)-феніл-(4-(4-[(4’-трифторметил-біфеніл-2-карбоніл]-аміно]-феніл)-піпередин-1-іл)- оцтова кислота метилового ефіру, або фармацевтично прийнятні кислотно адитивні солі з них.
8. Спосіб одержання поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4, у якому проміжний феніленамін формули (II)
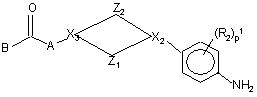 , (II)
, (II)
де Z1, Z2, X2, X3, p1, R1, R2, A та B мають значення, визначені у формулі (I), вводять у реакцію з поліарилкарбоновою кислотою чи галоїдангідридом формули (III),
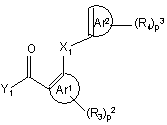 , (III)
, (III)
у якій X1, Ar1, Ar2, p2, p3, R3 та R4 мають значення, визначені у формулі (I), а Y1 обирають з гідроксилу та галоїду, у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності придатної основи, причому вказаний спосіб далі необов’язково включає перетворення сполуки формули (I) на її адитивну сіль, та/або одержання її стереохімічно ізомерної форми.
9. Спосіб одержання поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4, де X3 позначає нітроген, у якому проміжну сполуку формули (IV)
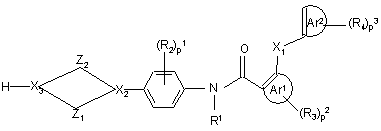 , (IV)
, (IV)
де Z1, Z2, X1, X2, p1, p2, p3, Ar1, Ar2, R1, R2, R3 та R4 мають значення, визначені у формулі (I), а X3 позначає нітроген, вводять у реакцію з реагентом формули (V)
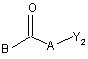 , (V)
, (V)
де A та B мають значення, визначені у формулі (I), а Y2 обирають з галоїду, тозилоксигрупи, мезилоксигрупи, нафтилсульфонілоксигрупи, або -A-Y2 позначає R’5COR5, де R5 та R'5 мають такі значення, що радикал R'5CHR5 підпадає під визначення A у формулі (I), у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності щонайменше одного придатного активатора нуклеофільного заміщення та/або придатної основи, причому вказаний спосіб далі необов’язково включає перетворення сполуки формули (I) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм.
10. Спосіб одержання поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4, у якому проміжну сполуку, що має формулу
 , (VI)
, (VI)
де Z1, Z2, X1, X2, X3, p1, p2, p3, Ar1, Ar2, R1, R2, R3, R4 та A мають значення, визначені у формулі (I), а Y3 обирають з галоїду та гідроксилу, вводять у реакцію з реагентом формули BH, у якій B позначає NR6R7 чи OR8, і R6, R7 та R8 мають значення, визначені у формулі (I), у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності щонайменше одного придатного сполучального реагенту та/або придатної основи, причому вказаний спосіб далі необов’язково включає перетворення сполуки формули (I) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм.
11. Спосіб одержання поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4, де X3 позначає нітроген, і у якому A позначає групу, придатну для проведення реакції приєднання Міхаеля, у якому проміжну сполуку формули
 , (IV)
, (IV)
де Z1, Z2, X1, X2, Ar1, Ar2, R1, R2, R3 та R4 мають значення, визначені у формулі (I), а X3 позначає нітроген, вводять у реакцію з реагентом формули (VII)
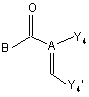 , (VII)
, (VII)
у якій B має значення, визначені у формулі (I), а Y4 та Y'4 мають такі значення, що радикал 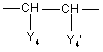 підпадає під визначення A у формулі (I), у щонайменше одному розчиннику, інертному щодо реакції, причому вказаний спосіб далі необов’язково включає перетворення сполуки формули (I) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм.
підпадає під визначення A у формулі (I), у щонайменше одному розчиннику, інертному щодо реакції, причому вказаний спосіб далі необов’язково включає перетворення сполуки формули (I) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм.
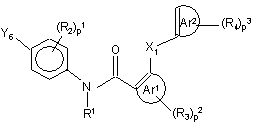
12. Спосіб одержання поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4, у якому проміжну сполуку формули (VIII)
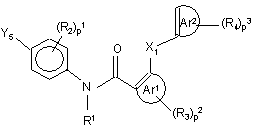 , (VIII)
, (VIII)
де X1, p1, p2, p3, Ar1, Ar2, R1, R2, R3 та R4 мають значення, визначені у формулі (I), а Y5 обирають з галоїду, B(OH)2, алкілборонатів та їхніх циклічних аналогів, вводять у реакцію з реагентом формули (IX)
 , (IX)
, (IX)
де Z1, Z2, X3, A та B мають значення, визначені у формулі (I), у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності щонайменше одного сполучального реагенту на основі перехідного металу та/або щонайменше одиного придатного ліганду, причому вказаний спосіб далі необов’язково включає перетворення сполуки формули (I) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм.
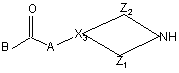
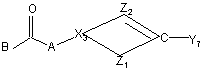
13. Спосіб одержання поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4, у якому проміжну сполуку формули (X)
 , (X)
, (X)
де p1, p2, p3, Ar1, Ar2, X1, R1, R2, R3 та R4 мають значення, визначені у формулі (I), вводять у реакцію з реагентом формули (Xl)
 , (XI)
, (XI)
де Z1, Z2, X3, A та B мають значення, визначені у формулі (I), один з Y6 та Y7 обирають з брому, йоду та трифторметилсульфонату, а другий з Y6 та Y7 обирають з три(C1-4-алкіл)олова, B(OH)2, алкілборонатів та їхніх циклічних аналогів, у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності щонайменше одного сполучального реагенту на основі перехідного металу та/або щонайменше одного придатного ліганду, причому вказаний спосіб далі необов’язково включає перетворення сполуки формули (I) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм.
14. Спосіб одержання поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4, у якому проміжну сполуку формули (XII)
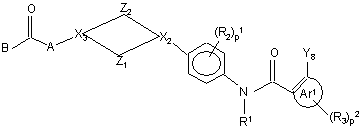 , (XII)
, (XII)
де Z1, Z2, X2, X3, p1, p2, Ar1, R1, R2, R3, A та B мають значення, визначені у формулі (I), а Y8 обирають з брому, йоду та трифторметилсульфонату, вводять у реакцію з арилборною кислотою формули (XIIIa)
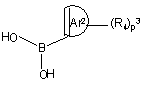 , (XIIIa)
, (XIIIa)
де p3, Ar2 та R4 мають значення, визначені у формулі (I), або з реагентом арилолова формули (XIII b)
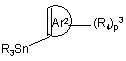 , (XIIIb)
, (XIIIb)
де R3, R4, Ar2 та p3 мають значення, визначені у формулі (I), у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності щонайменше одного сполучального реагенту на основі перехідного металу та/або щонайменше одного придатного ліганду, причому вказаний спосіб далі необов’язково включає перетворення сполуки формули (I) на її адитивну сіль та/або одержання її стереохімічно ізомерних форм.
15. Спосіб одержання поліарилкарбоксамідних сполук за будь-яким з пп. 1-4, у якому B позначає NR6R7, з поліарилкарбоксамідної сполуки за п. 1, у якій B позначає OR5, що включає на першій тадії гідроліз останньої сполуки, і на другій стадії – проведення реакції одержаної відповідної карбонової кислоти з аміном формули HNR6R7 у щонайменше одному інертному щодо реакції розчиннику та далі, необов’язково, включає перетворення одержаної сполуки формули (I), у якій B позначає NR6R7, на її адитивну сіль та/або одержання її стереохімічно ізомерних форм.
16. Сполуки формули:
 , (II)
, (II)
у якій:
- Z1 обирають з (CH2)n, де n дорівнює 1-3, CH2CH2O та OCH2CH2,
- Z2 позначає (CH2)m, де m дорівнює 1 чи 2,
- X1 позначає O, CH2, CO, NH, CH2O, OCH2, CH2S, SCH2 чи простий зв’язок,
- X2 та X3 кожен незалежно обирають з CH, N та sp2-атома карбону,
- R1 позначає гідроген чи C1-4-алкіл,
- Ar1 позначає ароматичне кільце, обране з фенілу, нафталенілу, піридинілу, піразинілу, піримідинілу, піридазинілу, триазинілу, триазолілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов’язково заміщених одним чи двома замісниками R3,
- Ar2 позначає ароматичне кільце, обране з фенілу, нафталенілу, піридинілу, піразинілу, піримідинілу, піридазинілу, триазинілу, триазолілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов’язково заміщених одним, двома чи трьома замісниками R4,
- кожен з R2 та R3 незалежно обирають з C1-4-алкілу, C1-4-алкілоксигрупи, галоїду та трифторметилу,
- кожен з R4 незалежно обирають з C1-4-алкілу, C1-4-алкілоксигрупи, галоїду, гідроксигрупи, меркаптогрупи, ціаногрупи, нітрогрупи, C1-4-алкілтіогрупи чи полігалоїд-C1-6-алкілу, аміногрупи, C1-4-алкіламіногрупи та ді-(C1-4-алкіл)аміногрупи,
- p1 та p2 кожен дорівнює 0-2,
- p3 дорівнює 0-3,
- X1 та R4 разом з ароматичними кільцями Ar1 та Ar2, до яких вони приєднані, можуть утворювати флуорен-1-ільну чи флуорен-4-ільну групу,
- A позначає C1-6-алкандіїл, необов’язково заміщений однією чи двома групами, обраними з арилу, гетероарилу та C3-10-циклоалкілу, оксиген чи простий зв’язок,
- B позначає гідроген, C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкоксикарбонілу, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, полігалоїд-C1-6-алкіл, C3-6-алкеніл, C3-6-алкініл, NR6R7 чи OR8,
- R6 та R7 кожен незалежно позначають гідроген, C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3-8-алкініл, конденсований бензо-C5-8-aциклоалкіл, причому R6 та R7 разом з атомом нітрогену, до якого вони приєднані, можуть утворювати насичений C4-8-гетероциклічний радикал,
- R8 позначає C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкенілу, C3-8-алкінілу чи конденсований бензо-C5-8-циклоалкіл,
- якщо X3 позначає CH, A може також позначати атом нітрогену, заміщений гідрогеном, C1-10-алкілом, арилом, гетероарилом, арил-C1-10-алкілом, гетероарил-C1-10-алкілом чи C3-10-циклоалкілом,
- Y1 та Y3 кожен незалежно обирають з гідроксилу та галоїду,
- Y5 обирають з галоїду, B(OH)2, алкілборонатів та їхніх циклічних аналогів, і
- Y6 та Y8 кожен незалежно обирають з брому, йоду та трифторметилсульфонату,
придатні для використання як проміжні сполуки для одержання поліарилкарбоксамідних сполук за будь-яким з пп. 1-4.
17. Сполука формули:
 , (IV)
, (IV)
у якій:
- Z1 обирають з (CH2)n, де n дорівнює 1-3, CH2CH2O та OCH2CH2,
- Z2 позначає (CH2)m, де m дорівнює 1 чи 2,
- X1 позначає O, CH2, CO, NH, CH2O, OCH2, CH2S, SCH2 чи простий зв’язок,
- X2 та X3 кожен незалежно обирають з CH, N та sp2-атома карбону,
- R1 позначає гідроген чи C1-4-алкіл,
- Ar1 позначає ароматичне кільце, обране з фенілу, нафталенілу, піридинілу, піразинілу, піримідинілу, піридазинілу, триазинілу, триазолілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов’язково заміщених одним чи двома замісниками R3,
- Ar2 позначає ароматичне кільце, обране з фенілу, нафталенілу, піридинілу, піразинілу, піримідинілу, піридазинілу, триазинілу, триазолілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов’язково заміщених одним, двома чи трьома замісниками R4,
- кожен з R2 та R3 незалежно обирають з C1-4-алкілу, C1-4-алкілоксигрупи, галоїду та трифторметилу,
- кожен з R4 незалежно обирають з C1-4-алкілу, C1-4-алкілоксигрупи, галоїду, гідроксигрупи, меркаптогрупи, ціаногрупи, нітрогрупи, C1-4-алкілтіогрупи чи полігалоїд-C1-6-алкілу, аміногрупи, C1-4-алкіламіногрупи та ді-(C1-4-алкіл)аміногрупи,
- p1 та p2 кожен дорівнює 0-2,
- p3 дорівнює 0-3,
- X1 та R4 разом з ароматичними кільцями Ar1 та Ar2, до яких вони приєднані, можуть утворювати флуорен-1-ільну чи флуорен-4-ільну групу,
- A позначає C1-6-алкандіїл, необов’язково заміщений однією чи двома групами, обраними з арилу, гетероарилу та C3-10-циклоалкілу, оксиген чи простий зв’язок,
- B позначає гідроген, C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкоксикарбонілу, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, полігалоїд-C1-6-алкіл, C3-6-алкеніл, C3-6-алкініл, NR6R7 чи OR8,
- R6 та R7 кожен незалежно позначають гідроген, C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3-8-алкініл, конденсований бензо-C5-8-aциклоалкіл, причому R6 та R7 разом з атомом нітрогену, до якого вони приєднані, можуть утворювати насичений C4-8-гетероциклічний радикал,
- R8 позначає C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкенілу, C3-8-алкінілу чи конденсований бензо-C5-8-циклоалкіл,
- якщо X3 позначає CH, A може також позначати атом нітрогену, заміщений гідрогеном, C1-10-алкілом, арилом, гетероарилом, арил-C1-10-алкілом, гетероарил-C1-10-алкілом чи C3-10-циклоалкілом,
- Y1 та Y3 кожен незалежно обирають з гідроксилу та галоїду,
- Y5 обирають з галоїду, B(OH)2, алкілборонатів та їхніх циклічних аналогів, і
- Y6 та Y8 кожен незалежно обирають з брому, йоду та трифторметилсульфонату,
придатні для використання як проміжні сполуки для одержання поліарилкарбоксамідних сполук за будь-яким з пп. 1-4.
18. Сполука формули:
 , (VI)
, (VI)
у якій:
- Z1 обирають з (CH2)n, де n дорівнює 1-3, CH2CH2O та OCH2CH2,
- Z2 позначає (CH2)m, де m дорівнює 1 чи 2,
- X1 позначає O, CH2, CO, NH, CH2O, OCH2, CH2S, SCH2 чи простий зв’язок,
- X2 та X3 кожен незалежно обирають з CH, N та sp2-атома карбону,
- R1 позначає гідроген чи C1-4-алкіл,
- Ar1 позначає ароматичне кільце, обране з фенілу, нафталенілу, піридинілу, піразинілу, піримідинілу, піридазинілу, триазинілу, триазолілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов’язково заміщених одним чи двома замісниками R3,
- Ar2 позначає ароматичне кільце, обране з фенілу, нафталенілу, піридинілу, піразинілу, піримідинілу, піридазинілу, триазинілу, триазолілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов’язково заміщених одним, двома чи трьома замісниками R4,
- кожен з R2 та R3 незалежно обирають з C1-4-алкілу, C1-4-алкілоксигрупи, галоїду та трифторметилу,
- кожен з R4 незалежно обирають з C1-4-алкілу, C1-4-алкілоксигрупи, галоїду, гідроксигрупи, меркаптогрупи, ціаногрупи, нітрогрупи, C1-4-алкілтіогрупи чи полігалоїд-C1-6-алкілу, аміногрупи, C1-4-алкіламіногрупи та ді-(C1-4-алкіл)аміногрупи,
- p1 та p2 кожен дорівнює 0-2,
- p3 дорівнює 0-3,
- X1 та R4 разом з ароматичними кільцями Ar1 та Ar2, до яких вони приєднані, можуть утворювати флуорен-1-ільну чи флуорен-4-ільну групу,
- A позначає C1-6-алкандіїл, необов’язково заміщений однією чи двома групами, обраними з арилу, гетероарилу та C3-10-циклоалкілу, оксиген чи простий зв’язок,
- B позначає гідроген, C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкоксикарбонілу, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, полігалоїд-C1-6-алкіл, C3-6-алкеніл, C3-6-алкініл, NR6R7 чи OR8,
- R6 та R7 кожен незалежно позначають гідроген, C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3-8-алкініл, конденсований бензо-C5-8-aциклоалкіл, причому R6 та R7 разом з атомом нітрогену, до якого вони приєднані, можуть утворювати насичений C4-8-гетероциклічний радикал,
- R8 позначає C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкенілу, C3-8-алкінілу чи конденсований бензо-C5-8-циклоалкіл,
- якщо X3 позначає CH, A може також позначати атом нітрогену, заміщений гідрогеном, C1-10-алкілом, арилом, гетероарилом, арил-C1-10-алкілом, гетероарил-C1-10-алкілом чи C3-10-циклоалкілом,
- Y1 та Y3 кожен незалежно обирають з гідроксилу та галоїду,
- Y5 обирають з галоїду, B(OH)2, алкілборонатів та їхніх циклічних аналогів, і
- Y6 та Y8 кожен незалежно обирають з брому, йоду та трифторметилсульфонату,
придатні для використання як проміжні сполуки для одержання поліарилкарбоксамідних сполук за будь-яким з пп. 1-4.
19. Сполука формули:
 , (XII)
, (XII)
у якій:
- Z1 обирають з (CH2)n, де n дорівнює 1-3, CH2CH2O та OCH2CH2,
- Z2 позначає (CH2)m, де m дорівнює 1 чи 2,
- X1 позначає O, CH2, CO, NH, CH2O, OCH2, CH2S, SCH2 чи простий зв’язок,
- X2 та X3 кожен незалежно обирають з CH, N та sp2-атома карбону,
- R1 позначає гідроген чи C1-4-алкіл,
- Ar1 позначає ароматичне кільце, обране з фенілу, нафталенілу, піридинілу, піразинілу, піримідинілу, піридазинілу, триазинілу, триазолілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов’язково заміщених одним чи двома замісниками R3,
- Ar2 позначає ароматичне кільце, обране з фенілу, нафталенілу, піридинілу, піразинілу, піримідинілу, піридазинілу, триазинілу, триазолілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов’язково заміщених одним, двома чи трьома замісниками R4,
- кожен з R2 та R3 незалежно обирають з C1-4-алкілу, C1-4-алкілоксигрупи, галоїду та трифторметилу,
- кожен з R4 незалежно обирають з C1-4-алкілу, C1-4-алкілоксигрупи, галоїду, гідроксигрупи, меркаптогрупи, ціаногрупи, нітрогрупи, C1-4-алкілтіогрупи чи полігалоїд-C1-6-алкілу, аміногрупи, C1-4-алкіламіногрупи та ді-(C1-4-алкіл)аміногрупи,
- p1 та p2 кожен дорівнює 0-2,
- p3 дорівнює 0-3,
- X1 та R4 разом з ароматичними кільцями Ar1 та Ar2, до яких вони приєднані, можуть утворювати флуорен-1-ільну чи флуорен-4-ільну групу,
- A позначає C1-6-алкандіїл, необов’язково заміщений однією чи двома групами, обраними з арилу, гетероарилу та C3-10-циклоалкілу, оксиген чи простий зв’язок,
- B позначає гідроген, C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкоксикарбонілу, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, полігалоїд-C1-6-алкіл, C3-6-алкеніл, C3-6-алкініл, NR6R7 чи OR8,
- R6 та R7 кожен незалежно позначають гідроген, C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3-8-алкініл, конденсований бензо-C5-8-aциклоалкіл, причому R6 та R7 разом з атомом нітрогену, до якого вони приєднані, можуть утворювати насичений C4-8-гетероциклічний радикал,
- R8 позначає C1-10-алкіл, арил чи гетероарил, кожен з яких є необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил-C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкенілу, C3-8-алкінілу чи конденсований бензо-C5-8-циклоалкіл,
- якщо X3 позначає CH, A може також позначати атом нітрогену, заміщений гідрогеном, C1-10-алкілом, арилом, гетероарилом, арил-C1-10-алкілом, гетероарил-C1-10-алкілом чи C3-10-циклоалкілом,
- Y1 та Y3 кожен незалежно обирають з гідроксилу та галоїду,
- Y5 обирають з галоїду, B(OH)2, алкілборонатів та їхніх циклічних аналогів, і
- Y6 та Y8 кожен незалежно обирають з брому, йоду та трифторметилсульфонату,
придатні для використання як проміжні сполуки для одержання поліарилкарбоксамідних сполук за будь-яким з пп. 1-4.
20. Фармацевтична композиція, що включає щонайменше один фармацевтично прийнятний носій та терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4.
21. Фармацевтична композиція за п.20, яка додатково включає щонайменше один додатковий ліпідзнижувальний агент.
22. Спосіб лікування стану, обраного з гіперліпідемії, ожиріння, діабету типу II, атеросклерозу, ішемічної хвороби серця, захворювань периферичних судин, захворювань судин мозку, гіперхолестеринемії, гіпертригліцеридемії, панкреатиту чи захворювань коронарної артерії, який включає введення ссавцю, що потребує такого лікування, поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4 у кількості, достатній для зниження секреції аполіпопротеїну B.
Текст
1. Поліарилкарбоксамідна сполука формули (I) C2 2 (19) 1 3 77946 4 C1-10-алкіл, C3-10-циклоалкіл, полігалоїд-C1-6-алкіл, C3-6-алкеніл, C3-6-алкініл, NR6R7 чи OR8, Ar2 (R4)p 3 - R6 та R7 кожен незалежно позначають гідроген, X1 C1-10-алкіл, арил чи гетероарил, кожен з яких є O необов’язково заміщеним групою, обраною з галоїду, ціаногрупи, C1-4-алкілоксигрупи, аміногрупи, Y1 C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, Ar1 C1-10-ацилу, C1-10-алкілтіогрупи, C1-10(R3 )p2 алкіламінокарбонілу та ді-(C1-10, (III) алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарилу якій X1, Ar1 , Ar2 , p2, p3, R3 та R4 мають значення, C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, визначені у формулі (I), а Y1 обирають з гідроксилу полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3.8-алкініл, та галоїду, у щонайменше одному інертному щодо конденсований бензо-C5-8-циклоалкіл, причому R6 реакції розчиннику та, необов’язково, у присутності та R7 разом з атомом нітрогену, до якого вони придатної основи, причому вказаний спосіб далі приєднані, можуть утворювати насичений C4-8необов’язково включає перетворення сполуки фогетероциклічний радикал, рмули (I) на її адитивну сіль, та/або одержання її - R8 позначає C1-10-алкіл, арил чи гетероарил, костереохімічно ізомерної форми. жен з яких є необов’язково заміщеним групою, 9. Спосіб одержання поліарилкарбоксамідної спообраною з галоїду, ціаногрупи, нітрогрупи, C1-4луки за будь-яким з пп. 1-4, де X3 позначає нітроалкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, ген, у якому проміжну сполуку формули (IV) ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10(R 4)p3 Ar2 алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1(R 2)p1 X1 O 10-алкіл)амінокарбонілу, арил-C 1-10-алкіл, гетероZ2 арил-C1-10-алкіл, C3-10-циклоалкіл, C7-10H X3 N X2 Ar1 поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8-алкеніл, Z1 (R 3)p2 C3-8-алкініл чи конденсований бензо-C5-8R1 , (IV) циклоалкіл. де Z1, Z 2, X1, X2, p1 , p2, p3 , Ar1 , Ar2, R1, R2 , R3 та R4 2. Поліарилкарбоксамідна сполука за п. 1, у якій мають значення, визначені у формулі (I), а X3 поZ1, Z2 , X2 та X3 разом утворюють шестичленний значає нітроген, вводять у реакцію з реагентом гетероцикл. формули (V) 3. Поліарилкарбоксамідна сполука за п. 1 чи п.2, у O якій Z1, Z2, X2 та X3 разом утворюють піперидинову чи піперазинову груп у, а X1 позначає простий Y2 зв’язок. A B 4. Поліарилкарбоксамідна сполука за будь-яким з , (V) пп. 1-3, у якій р1 та р3 дорівнюють кожен 0,1, а R4 де A та B мають значення, визначені у формулі (I), позначає гідроген, трифторметил, хлор чи трета Y2 обирають з галоїду, тозилоксигрупи, мезилоксигрупи, нафтилсульфонілоксигрупи, або -A-Y2 бутил. 5. Поліарилкарбоксамідна сполука за будь-яким з позначає R’5COR5, де R5 та R'5 мають такі значенпп. 1-4, призначена для використання як лікарсьня, що радикал R'5CHR5 підпадає під визначення A кий засіб. у формулі (I), у щонайменше одному інертному 6. Поліарилкарбоксамідна сполука за п. 5, признащодо реакції розчиннику та, необов’язково, у присутності щонайменше одного придатного активачена для використання у лікуванні гіперліпідемії, ожиріння, діабету типу II, атеросклерозу, ішмічної тора нуклеофільного заміщення та/або придатної хвороби серця, захворювань периферичних судин, основи, причому вказаний спосіб далі необзахворювань судин мозку, гіперхолестеринемії, ов’язково включає перетворення сполуки формули гіпертригліцеридемії, панкреатиту чи захворювань (I) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм. коронарної артерії. 7. Сполука за п. 1, у якій сполука є (+)-феніл-(4-(410. Спосіб одержання поліарилкарбоксамідної [(4’-трифторметил-біфеніл-2-карбоніл]-аміно]сполуки за будь-яким з пп. 1-4, у якому проміжну феніл)-піпередин-1-іл)- оцтова кислота метилового сполуку, що має формулу O Z ефіру, або фармацевтично прийнятні кислотно Ar (R ) X R X адитивні солі з них. A Y X O Z 8. Спосіб одержання поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4, у якому проміжний N Ar феніленамін формули (II) (R ) R , (VI) O Z2 1 2 3 1 де Z1, Z2, X1 , X2, X3, p , p , p , Ar , Ar2, R1, R2 , R3, R4 1 (R2 )p X3 X2 та A мають значення, визначені у формулі (I), а Y3 A B обирають з галоїду та гідроксилу, вводять у реакZ1 цію з реагентом формули BH, у якій B позначає NH2 NR6R7 чи OR8, і R6, R7 та R8 мають значення, ви, (II) значені у формулі (I), у щонайменше одному інерде Z1, Z2 , X2, X3 , p1, R1, R2 , A та B мають значення, тному щодо реакції розчиннику та, необов’язково, визначені у формулі (I), вводять у реакцію з поліу присутності щонайменше одного придатного арилкарбоновою кислотою чи галоїдангідридом сполучального реагенту та/або придатної основи, формули (III), 2 2 3 2 2 3 1 1 1 1 2 3 p 4 p 3 5 77946 6 причому вказаний спосіб далі необов’язково вклюсполуки формули (I) на її адитивну сіль, та/або чає перетворення сполуки формули (I) на її адитиодержання її стереохімічно ізомерних форм. вну сіль, та/або одержання її стереохімічно ізоме13. Спосіб одержання поліарилкарбоксамідної рних форм. сполуки за будь-яким з пп. 1-4, у якому проміжну 11. Спосіб одержання поліарилкарбоксамідної сполуку формули (X) сполуки за будь-яким з пп. 1-4, де X3 позначає ніт(R4)p3 роген, і у якому A позначає групу, придатну для Ar 2 (R2) p1 Y6 проведення реакції приєднання Міхаеля, у якому X1 O проміжну сполуку формули (R 4)p3 Ar 2 (R 2) p1 Z2 H N X2 Z1 Ar 1 2 , (IV) де Z1, Z2 , X1, X2, Ar , Ar , R1 , R2, R3 та R4 мають значення, визначені у формулі (I), а X3 позначає нітроген, вводять у реакцію з реагентом формули (VII) O 2 Y4 A Y4 ' , (VII) у якій B має значення, визначені у формулі (I), а Y4 та Y'4 мають такі значення, що радикал CH CH Y4 Y4' підпадає під визначення A у формулі (I), у щонайменше одному розчиннику, інертному щодо реакції, причому вказаний спосіб далі необов’язково включає перетворення сполуки формули (I) на її адитивн у сіль, та/або одержання її стереохімічно ізомерних форм. 12. Спосіб одержання поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4, у якому проміжну сполуку формули (VIII) Ar2 ( R2 )p1 O (R3) p2 , (X) де p , p , p , Ar , Ar , X1, R1, R2 , R3 та R4 мають значення, визначені у формулі (I), вводять у реакцію з реагентом формули (Xl) Z2 O 1 (R 3)p R1 1 Y5 Ar1 R1 X3 B N X1 O 2 B 3 A 1 2 X3 C Z1 , (XI) де Z1, Z2 , X3, A та B мають значення, визначені у формулі (I), один з Y6 та Y7 обирають з брому, йоду та трифторметилсульфонату, а др угий з Y6 та Y7 обирають з три(C1-4-алкіл)олова, B(OH)2, алкілборонатів та їхніх циклічних аналогів, у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності щонайменше одного сполучального реагенту на основі перехідного металу та/або щонайменше одного придатного ліганду, причому вказаний спосіб далі необов’язково включає перетворення сполуки формули (I) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм. 14. Спосіб одержання поліарилкарбоксамідної сполуки за будь-яким з пп. 1-4, у якому проміжну сполуку формули (XII) Z2 O B X3 A O Z1 N R1 Ar1 (R3 )p2 R1 , (VIII) де X1, p1, p2, p3, Ar 1, Ar2, R1, R2 , R3 та R4 мають значення, визначені у формулі (I), а Y5 обирають з галоїду, B(OH)2 , алкілборонатів та їхніх циклічних аналогів, вводять у реакцію з реагентом формули (IX) Z2 O B A X3 NH Z1 , (IX) де Z1, Z2 , X3, A та B мають значення, визначені у формулі (I), у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності щонайменше одного сполучального реагенту на основі перехідного металу та/або щонайменше одиного придатного ліганду, причому вказаний спосіб далі необов’язково включає перетворення Y8 Ar 1 (R3)p2 , (XII) де Z1, Z2, X2, X3 , p , p , Ar , R1, R2, R3, A та B мають значення, визначені у формулі (I), а Y8 обирають з брому, йоду та трифторметилсульфонату, вводять у реакцію з арилборною кислотою формули (XIIIa) 1 N (R2) p1 X2 (R4 )p3 X1 Y7 Ar2 HO 2 1 (R4)p 3 B OH , (XIIIa) де p , Ar2 та R4 мають значення, визначені у формулі (I), або з реагентом арилолова формули (XIII b) 3 Ar2 R 3Sn (R 4)p 3 , (XIIIb) де R3, R4, Ar2 та p3 мають значення, визначені у формулі (I), у щонайменше одному інертному щодо реакції розчиннику та, необов’язково, у присутності щонайменше одного сполучального реагенту 7 77946 8 на основі перехідного металу та/або щонайменше алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10одного придатного ліганду, причому вказаний споацилу, C1-10-алкілтіогрупи, C1-10-алкоксикарбонілу, сіб далі необов’язково включає перетворення споC1-10-алкіламінокарбонілу та ді-(C1-10луки формули (I) на її адитивну сіль та/або одералкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарилжання її стереохімічно ізомерних форм. C1-10-алкіл, C3-10-циклоалкіл, полігалоїд-C1-6-алкіл, 15. Спосіб одержання поліарилкарбоксамідних C3-6-алкеніл, C3-6-алкініл, NR6R7 чи OR8, сполук за будь-яким з пп. 1-4, у якому B позначає - R6 та R7 кожен незалежно позначають гідроген, NR6R7, з поліарилкарбоксамідної сполуки за п. 1, у C1-10-алкіл, арил чи гетероарил, кожен з яких є якій B позначає OR5, що включає на першій тадії необов’язково заміщеним групою, обраною з галогідроліз останньої сполуки, і на другій стадії – проїду, ціаногрупи, C1-4-алкілоксигрупи, аміногрупи, ведення реакції одержаної відповідної карбонової C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, кислоти з аміном формули HNR6R7 у щонайменше C1-10-ацилу, C1-10-алкілтіогрупи, C1-10одному інертному щодо реакції розчиннику та далі, алкіламінокарбонілу та ді-(C1-10необов’язково, включає перетворення одержаної алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарилсполуки формули (I), у якій B позначає NR6R7, на її C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, адитивну сіль та/або одержання її стереохімічно полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3-8-алкініл, ізомерних форм. конденсований бензо-C5-8-aциклоалкіл, причому R6 16. Сполуки формули: та R7 разом з атомом нітрогену, до якого вони O Z2 приєднані, можуть утворювати насичений C4-8гетероциклічний радикал, 1 X3 (R 2) p X2 - R8 позначає C1-10-алкіл, арил чи гетероарил, коA B жен з яких є необов’язково заміщеним групою, Z1 обраною з галоїду, ціаногрупи, нітрогрупи, C1-4NH2 алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, , (II) ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10у якій: алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1- Z1 обирають з (CH2)n, де n дорівнює 1-3, 10-алкіл)амінокарбонілу, арил-C 1-10-алкіл, гетероCH2CH2O та OCH2CH2, арил-C1-10-алкіл, C3-10-циклоалкіл, C7-10- Z2 позначає (CH2)m, де m дорівнює 1 чи 2, поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8- X1 позначає O, CH2, CO, NH, CH2O, OCH 2, CH2S, алкенілу, C3-8-алкінілу чи конденсований бензо-C5-8 SCH2 чи простий зв’язок, -циклоалкіл, - X2 та X3 кожен незалежно обирають з CH, N та - якщо X3 позначає CH, A може також позначати sp2-атома карбону, атом нітрогену, заміщений гідрогеном, C1-10- R1 позначає гідроген чи C1-4-алкіл, алкілом, арилом, гетероарилом, арил-C1-10- Ar 1 позначає ароматичне кільце, обране з феніалкілом, гетероарил-C1-10-алкілом чи C3-10лу, нафталенілу, піридинілу, піразинілу, піримідициклоалкілом, нілу, піридазинілу, триазинілу, триазолілу, імідазо- Y1 та Y3 кожен незалежно обирають з гідроксилу лілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, та галоїду, піролілу, фуранілу та тієнілу, необов’язково замі- Y5 обирають з галоїду, B(OH)2, алкілборонатів та щених одним чи двома замісниками R3, 2 їхні х циклічних аналогів, і - Ar позначає ароматичне кільце, обране з фені- Y6 та Y8 кожен незалежно обирають з брому, йолу, нафталенілу, піридинілу, піразинілу, піримідиду та три фторметилсульфонату, нілу, піридазинілу, триазинілу, триазолілу, імідазопридатні для використання як проміжні сполуки лілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, для одержання поліарилкарбоксамідних сполук за піролілу, фуранілу та тієнілу, необов’язково замібудь-яким з пп. 1-4. щених одним, двома чи трьома замісниками R4, 17. Сполука формули: - кожен з R2 та R3 незалежно обирають з C1-4алкілу, C1-4-алкілоксигрупи, галоїду та трифтормеAr 2 (R4 ) p3 тилу, (R 2) p 1 X1 O Z2 - кожен з R4 незалежно обирають з C1-4-алкілу, C14-алкілоксигрупи, галоїду, гідроксигрупи, меркаптоH X3 N X2 Ar 1 групи, ціаногрупи, нітрогрупи, C1-4-алкілтіогрупи чи (R3 ) p2 Z1 1 R , (IV) полігалоїд-C1-6-алкілу, аміногрупи, C1-4у якій: алкіламіногрупи та ді-(C1-4-алкіл)аміногрупи, - Z1 обирають з (CH2)n, де n дорівнює 1-3, - p1 та p2 кожен дорівнює 0-2, CH2CH2O та OCH2CH2, - p3 дорівнює 0-3, - Z2 позначає (CH2)m, де m дорівнює 1 чи 2, - X1 та R4 разом з ароматичними кільцями Ar1 та - X1 позначає O, CH2, CO, NH, CH2O, OCH 2, CH2S, Ar2 , до яких вони приєднані, можуть утворювати SCH2 чи простий зв’язок, флуорен-1-ільну чи флуорен-4-ільну гр упу, - X2 та X3 кожен незалежно обирають з CH, N та - A позначає C1-6-алкандіїл, необов’язково заміщеsp2-атома карбону, ний однією чи двома групами, обраними з арилу, - R1 позначає гідроген чи C1-4-алкіл, гетероарилу та C3-10-циклоалкілу, оксиген чи прос- Ar 1 позначає ароматичне кільце, обране з фенітий зв’язок, лу, нафталенілу, піридинілу, піразинілу, піриміди- B позначає гідроген, C1-10-алкіл, арил чи гетеронілу, піридазинілу, триазинілу, триазолілу, імідазоарил, кожен з яких є необов’язково заміщеним лілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, групою, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4-алкілоксигрупи, аміногрупи, C1-10 9 77946 10 піролілу, фуранілу та тієнілу, необов’язково замі- Y1 та Y3 кожен незалежно обирають з гідроксилу щених одним чи двома замісниками R3, та галоїду, - Ar 2 позначає ароматичне кільце, обране з фені- Y5 обирають з галоїду, B(OH)2, алкілборонатів та лу, нафталенілу, піридинілу, піразинілу, піримідиїхні х циклічних аналогів, і нілу, піридазинілу, триазинілу, триазолілу, імідазо- Y6 та Y8 кожен незалежно обирають з брому, йолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, ду та три фторметилсульфонату, піролілу, фуранілу та тієнілу, необов’язково заміпридатні для використання як проміжні сполуки щених одним, двома чи трьома замісниками R4, для одержання поліарилкарбоксамідних сполук за - кожен з R2 та R3 незалежно обирають з C1-4будь-яким з пп. 1-4. алкілу, C1-4-алкілоксигрупи, галоїду та трифторме18. Сполука формули: O Z тилу, Ar (R ) X R X - кожен з R4 незалежно обирають з C1-4-алкілу, C1-4 A Y X O Z -алкілоксигрупи, галоїду, гідроксигрупи, меркаптогрупи, ціаногрупи, нітрогрупи, C1-4-алкілтіогрупи чи N Ar полігалоїд-C1-6-алкілу, аміногрупи, C1-4(R ) R , (VI) алкіламіногрупи та ді-(C1-4-алкіл)аміногрупи, 1 2 у якій: - p та p кожен дорівнює 0-2, - Z1 обирають з (CH2)n, де n дорівнює 1-3, - p3 дорівнює 0-3, CH2CH2O та OCH2CH2, - X1 та R4 разом з ароматичними кільцями Ar1 та - Z2 позначає (CH2)m, де m дорівнює 1 чи 2, Ar2 , до яких вони приєднані, можуть утворювати - X1 позначає O, CH2, CO, NH, CH2O, OCH 2, CH2S, флуорен-1-ільну чи флуорен-4-ільну гр упу, SCH2 чи простий зв’язок, - A позначає C1-6-алкандіїл, необов’язково заміще- X2 та X3 кожен незалежно обирають з CH, N та ний однією чи двома групами, обраними з арилу, sp2-атома карбону, гетероарилу та C3-10-циклоалкілу, оксиген чи прос- R1 позначає гідроген чи C1-4-алкіл, тий зв’язок, - Ar 1 позначає ароматичне кільце, обране з фені- B позначає гідроген, C1-10-алкіл, арил чи гетеролу, нафталенілу, піридинілу, піразинілу, піримідиарил, кожен з яких є необов’язково заміщеним нілу, піридазинілу, триазинілу, триазолілу, імідазогрупою, обраною з галоїду, ціаногрупи, нітрогрупи, лілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, C1-4-алкілоксигрупи, аміногрупи, C1-10піролілу, фуранілу та тієнілу, необов’язково заміалкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10щених одним чи двома замісниками R3, ацилу, C1-10-алкілтіогрупи, C1-10-алкоксикарбонілу, - Ar 2 позначає ароматичне кільце, обране з феніC1-10-алкіламінокарбонілу та ді-(C1-10лу, нафталенілу, піридинілу, піразинілу, піримідиалкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарилнілу, піридазинілу, триазинілу, триазолілу, імідазоC1-10-алкіл, C3-10-циклоалкіл, полігалоїд-C1-6-алкіл, лілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, C3-6-алкеніл, C3-6-алкініл, NR6R7 чи OR8, піролілу, фуранілу та тієнілу, необов’язково замі- R6 та R7 кожен незалежно позначають гідроген, щених одним, двома чи трьома замісниками R4, C1-10-алкіл, арил чи гетероарил, кожен з яких є - кожен з R2 та R3 незалежно обирають з C1-4необов’язково заміщеним групою, обраною з галоалкілу, C1-4-алкілоксигрупи, галоїду та трифтормеїду, ціаногрупи, C1-4-алкілоксигрупи, аміногрупи, тилу, C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, - кожен з R4 незалежно обирають з C1-4-алкілу, C1-4 C1-10-ацилу, C1-10-алкілтіогрупи, C1-10-алкілоксигрупи, галоїду, гідроксигрупи, меркаптоалкіламінокарбонілу та ді-(C1-10групи, ціаногрупи, нітрогрупи, C1-4-алкілтіогрупи чи алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарилполігалоїд-C1-6-алкілу, аміногрупи, C1-4C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, алкіламіногрупи та ді-(C1-4-алкіл)аміногрупи, полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3-8-алкініл, - p1 та p2 кожен дорівнює 0-2, конденсований бензо-C5-8-aциклоалкіл, причому R6 - p3 дорівнює 0-3, та R7 разом з атомом нітрогену, до якого вони - X1 та R4 разом з ароматичними кільцями Ar1 та приєднані, можуть утворювати насичений C4-8Ar2 , до яких вони приєднані, можуть утворювати гетероциклічний радикал, флуорен-1-ільну чи флуорен-4-ільну гр упу, - R8 позначає C1-10-алкіл, арил чи гетероарил, ко- A позначає C1-6-алкандіїл, необов’язково заміщежен з яких є необов’язково заміщеним групою, ний однією чи двома групами, обраними з арилу, обраною з галоїду, ціаногрупи, нітрогрупи, C1-4гетероарилу та C3-10-циклоалкілу, оксиген чи просалкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, тий зв’язок, ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10- B позначає гідроген, C1-10-алкіл, арил чи гетероалкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10 арил, кожен з яких є необов’язково заміщеним -алкіл)амінокарбонілу, арил-C1-10-алкіл, гетерогрупою, обраною з галоїду, ціаногрупи, нітрогрупи, арил-C1-10-алкіл, C3-10-циклоалкіл, C7-10C1-4-алкілоксигрупи, аміногрупи, C1-10поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10алкенілу, C3-8-алкінілу чи конденсований бензо-C5-8 ацилу, C1-10-алкілтіогрупи, C1-10-алкоксикарбонілу, -циклоалкіл, C1-10-алкіламінокарбонілу та ді-(C1-10- якщо X3 позначає CH, A може також позначати алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарилатом нітрогену, заміщений гідрогеном, C1-10C1-10-алкіл, C3-10-циклоалкіл, полігалоїд-C1-6-алкіл, алкілом, арилом, гетероарилом, арил-C1-10C3-6-алкеніл, C3-6-алкініл, NR6R7 чи OR8, алкілом, гетероарил-C1-10-алкілом чи C3-10- R6 та R7 кожен незалежно позначають гідроген, циклоалкілом, C1-10-алкіл, арил чи гетероарил, кожен з яких є 2 2 3 2 2 3 1 1 1 1 2 3 p 4 p 3 11 77946 12 необов’язково заміщеним групою, обраною з гало- кожен з R2 та R3 незалежно обирають з C1-4їду, ціаногрупи, C1-4-алкілоксигрупи, аміногрупи, алкілу, C1-4-алкілоксигрупи, галоїду та трифтормеC1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, тилу, C1-10-ацилу, C1-10-алкілтіогрупи, C1-10- кожен з R4 незалежно обирають з C1-4-алкілу, C1-4 алкіламінокарбонілу та ді-(C1-10-алкілоксигрупи, галоїду, гідроксигрупи, меркаптоалкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарилгрупи, ціаногрупи, нітрогрупи, C1-4-алкілтіогрупи чи C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, полігалоїд-C1-6-алкілу, аміногрупи, C1-4полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3-8-алкініл, алкіламіногрупи та ді-(C1-4-алкіл)аміногрупи, конденсований бензо-C5-8-aциклоалкіл, причому R6 - p1 та p2 кожен дорівнює 0-2, та R7 разом з атомом нітрогену, до якого вони - p3 дорівнює 0-3, приєднані, можуть утворювати насичений C4-8- X1 та R4 разом з ароматичними кільцями Ar1 та гетероциклічний радикал, Ar2 , до яких вони приєднані, можуть утворювати - R8 позначає C1-10-алкіл, арил чи гетероарил, кофлуорен-1-ільну чи флуорен-4-ільну гр упу, жен з яких є необов’язково заміщеним групою, - A позначає C1-6-алкандіїл, необов’язково заміщеобраною з галоїду, ціаногрупи, нітрогрупи, C1-4ний однією чи двома групами, обраними з арилу, алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, гетероарилу та C3-10-циклоалкілу, оксиген чи просді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10тий зв’язок, алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10 - B позначає гідроген, C1-10-алкіл, арил чи гетеро-алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарил, кожен з яких є необов’язково заміщеним арил-C1-10-алкіл, C3-10-циклоалкіл, C7-10групою, обраною з галоїду, ціаногрупи, нітрогрупи, поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8C1-4-алкілоксигрупи, аміногрупи, C1-10алкенілу, C3-8-алкінілу чи конденсований бензо-C5-8 алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, C1-10-циклоалкіл, ацилу, C1-10-алкілтіогрупи, C1-10-алкоксикарбонілу, - якщо X3 позначає CH, A може також позначати C1-10-алкіламінокарбонілу та ді-(C1-10атом нітрогену, заміщений гідрогеном, C1-10алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарилалкілом, арилом, гетероарилом, арил-C1-10C1-10-алкіл, C3-10-циклоалкіл, полігалоїд-C1-6-алкіл, алкілом, гетероарил-C1-10-алкілом чи C3-10C3-6-алкеніл, C3-6-алкініл, NR6R7 чи OR8, циклоалкілом, - R6 та R7 кожен незалежно позначають гідроген, - Y1 та Y3 кожен незалежно обирають з гідроксилу C1-10-алкіл, арил чи гетероарил, кожен з яких є та галоїду, необов’язково заміщеним групою, обраною з гало- Y5 обирають з галоїду, B(OH)2, алкілборонатів та їду, ціаногрупи, C1-4-алкілоксигрупи, аміногрупи, їхні х циклічних аналогів, і C1-10-алкіламіногрупи, ді-(C1-10-алкіл)аміногрупи, - Y6 та Y8 кожен незалежно обирають з брому, йоC1-10-ацилу, C1-10-алкілтіогрупи, C1-10ду та три фторметилсульфонату, алкіламінокарбонілу та ді-(C1-10придатні для використання як проміжні сполуки алкіл)амінокарбонілу, арил-C1-10-алкіл, гетероарилдля одержання поліарилкарбоксамідних сполук за C1-10-алкіл, C3-10-циклоалкіл, C7-10-поліциклоалкіл, будь-яким з пп. 1-4. полігалоїд-C1-6-алкіл, C3-8-алкеніл, C3-8-алкініл, 19. Сполука формули: конденсований бензо-C5-8-aциклоалкіл, причому R6 O Z2 та R7 разом з атомом нітрогену, до якого вони (R2) p1 X3 приєднані, можуть утворювати насичений C4-8X2 B A Y8 O гетероциклічний радикал, Z1 - R8 позначає C1-10-алкіл, арил чи гетероарил, коN Ar 1 жен з яких є необов’язково заміщеним групою, (R 3)p2 обраною з галоїду, ціаногрупи, нітрогрупи, C1-4R1 , (XII) алкілоксигрупи, аміногрупи, C1-10-алкіламіногрупи, у якій: ді-(C1-10-алкіл)аміногрупи, C1-10-ацилу, C1-10- Z1 обирають з (CH2)n, де n дорівнює 1-3, алкілтіогрупи, C1-10-алкіламінокарбонілу та ді-(C1-10 CH2CH2O та OCH2CH2, -алкіл)амінокарбонілу, арил-C1-10-алкіл, гетеро- Z2 позначає (CH2)m, де m дорівнює 1 чи 2, арил-C1-10-алкіл, C3-10-циклоалкіл, C7-10- X1 позначає O, CH2, CO, NH, CH2O, OCH 2, CH2S, поліциклоалкіл, полігалоїд-C1-6-алкіл, C3-8SCH2 чи простий зв’язок, алкенілу, C3-8-алкінілу чи конденсований бензо-C5-8 - X2 та X3 кожен незалежно обирають з CH, N та -циклоалкіл, sp2-атома карбону, - якщо X3 позначає CH, A може також позначати - R1 позначає гідроген чи C1-4-алкіл, атом нітрогену, заміщений гідрогеном, C1-101 - Ar позначає ароматичне кільце, обране з феніалкілом, арилом, гетероарилом, арил-C1-10лу, нафталенілу, піридинілу, піразинілу, піримідиалкілом, гетероарил-C1-10-алкілом чи C3-10нілу, піридазинілу, триазинілу, триазолілу, імідазоциклоалкілом, лілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, - Y1 та Y3 кожен незалежно обирають з гідроксилу піролілу, фуранілу та тієнілу, необов’язково заміта галоїду, щених одним чи двома замісниками R3, - Y5 обирають з галоїду, B(OH)2, алкілборонатів та 2 - Ar позначає ароматичне кільце, обране з феніїхні х циклічних аналогів, і лу, нафталенілу, піридинілу, піразинілу, піриміди- Y6 та Y8 кожен незалежно обирають з брому, йонілу, піридазинілу, триазинілу, триазолілу, імідазоду та три фторметилсульфонату, лілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, придатні для використання як проміжні сполуки піролілу, фуранілу та тієнілу, необов’язково замідля одержання поліарилкарбоксамідних сполук за щених одним, двома чи трьома замісниками R4, будь-яким з пп. 1-4. 13 77946 14 20. Фармацевтична композиція, що включає щомічної хвороби серця, захворювань периферичних найменше один фармацевтично прийнятний носій судин, захворювань судин мозку, гіперхолестерита терапевтично ефективну кількість сполуки за немії, гіпертригліцеридемії, панкреатиту чи захвобудь-яким з пп. 1-4. рювань коронарної артерії, який включає введення 21. Фармацевтична композиція за п.20, яка додатссавцю, що потребує такого лікування, поліарилково включає щонайменше один додатковий ліпікарбоксамідної сполуки за будь-яким з пп. 1-4 у дзнижувальний агент. кількості, достатній для зниження секреції аполі22. Спосіб лікування стану, обраного з гіперліпідепопротеїну B. мії, ожиріння, діабету типу II, атеросклерозу, іше Даний винахід стосується нових поліарилкарбоксамідів, які виявляють інгібуючу активність щодо аполіпопротеїну В та суп утн у ліпідознижувальну активність. Винахід також стосується способів одержання таких сполук, фармацевтичних композицій, що містять зазначені сполуки, а також використання зазначених сполук як лікарського засобу для лікування гіперліпідемії, ожирінні та діабету типу II. Ожиріння є причиною численних серйозних медичних проблем, таких як розвиток діабету та серцевих захворювань у дорослих. Крім того, скидання ваги стає нав'язливою ідеєю серед дедалі більшої частини населення. Причинний зв'язок між гіперхолестеринемією, особливо, асоційованою з підвищеною концентрацією у плазмі ліпопротеїдів низької густини (LDL) (тут та надалі - ЛНГ) і ліпопротеїдів дуже низької густини (VLDL) (тут та надлі - ЛДНГ), та передчасним атеросклерозом та/або серцево-судинними захворюваннями є зараз загальновизнаним. Однак, зараз існує обмежена кількість лікарських засобів для лікування гіперліпідемії. Лікарські засоби, що переважно застосовуються для лікування гіперліпідемії, включають смоли, що утворюють комплекси з жовчною кислотою, такі як холестирамін та колестипол, похідні фібринової кислоти, такі як безафібрат, клофібрат, фенофібрат, ципрофібрат та гемфіброзил, інгібітори синтезу нікотинової кислоти та холестерину, такі як інгібітори ферменту 3-гідрокси-3-метилглутарилу - коферменту A (HMG-CoA) редуктази. Незручность введення (гранульована форма, яка має бути диспергована у воді чи апельсиновому соку) та сильні побічні ефекти (шлунково-кишковий дискомфорт та запор) смол, що зв'язують жовчну кислоту, є великими недоліками. Похідні фібринової кислоти індукують помірне зниження (на 5-25%) холестерину ЛНГ (за винятком гіпертригліцеридемічних пацієнтів, у яких початково низькі рівні мають тенденцію до зростання) і, хоч звичайно добре переносяться, мають небажані побічні ефекти, включаючи потенціювання варфарину, прурит, відчуття втоми, головний біль, безсоння, болючу реверсивну міопатію та заклякання великих груп м'язів, імпотенцію та порушення ниркової функції. Нікотинова кислота є потужним ліпідознижувальним агентом, який приводить до зниження холестерину ЛНГ на 15-40% (і навіть 45-60% у комбінації зі смолою, що зв'язує жовчну кислоту), але має велику частоту випадків тяжких побічних ефектів, зв'язаних з властивою цьому засобу вазодилататорною дією, таких як головний біль, еритема, серцебиття, тахікардія та періодичні непритомність, а також інші побічні ефекти, такі як шлунковокишковий дискомфорт, гіперурикемія та порушення толерантності до глюкози. З сімейства інгібіторів ферменту 3-гідрокси-3-метилглутарилу - коферменту А редуктази, ловастатин та симвастатин є обидва неактивними проліками, що містять лактонове кільце, яке гідролізується у печінці з утворенням відповідного активного похідного оксикислоти. Індукуючі зниження холестерину ЛНГ на 35-45%, вони звичайно добре переносяться і мають низьку частоту випадків незначних побічних ефектів. Однак, залишається потреба у нових ліпідознижувальних агентах з поліпшеною ефективністю та/або таких, що діють за іншими механізмами, відмінними від тих, що описані для вищезгаданих лікарських засобів. Ліпопротеїни плазми є водорозчинними високомолекулярними комплексами, утвореними з ліпідів (холестерин, тригліцерид, фосфоліпіди) та аполіпопротеїнів. П'ять основних класів ліпопротеїдів, що відрізняються часткою ліпідів та типом аполіпопротеїну, які усі утворюються у печінці та/або кишечнику, були визначені відповідно до їхньої густини (виміряної ультрацентрифугуванням). Вони включають ЛНГ, ЛДНГ, ліпопротеїди проміжної густини (тут та надалі ЛПГ), ліпопротеїди високої густини (тут та надалі ЛВГ) та хіломікрони. Було ідентифіковано десять основних типів аполіпопротеїнів плазми людини. ЛДНГ, що секретуються печінкою та містять аполіпопротеїн В (тут та надалі Аро-В), зазнає деградації до ЛНГ, які транспортують від 60 до 70% загального холестерину сироватки. Аро-В є також головним протеїновим компонентом ЛНГ. Підвищений ЛНГхолестерин у сироватці, спричинений надлишковим синтезом чи зниженим метаболізмом, є причинно зв'язаним із атеросклерозом. На відміну від них, ліпопротеїди високої густини (тут та надалі ЛВГ), які містять аполіпопротеїн А1, виявляють захисний ефект і мають зворотну кореляцію з ризиком ішемічної хвороби серця. Таким чином, співвідношення ЛВГ/ЛНГ є зручним методом оцінки атерогенного потенціалу ліпідного профілю плазми пацієнта. Дві ізоформи аполіпопротеїну (аро) В - аро В48 та аро В-100 - є важливими протеїнами у метаболізмі ліпопротеїдів людини. Аро В-48, названий так тому, що він дає розмір плями близько 48% від аро В-100 на поліакриламіднах гелях з домішкою додецилсульфату натрію, синтезується у кишечнику людини. Аро В-48 є необхідним компонентом для складання хіломікронів і тому відіграє обов'язкову роль у кишковому всмоктуванні харчових жирів. Аро В-100, який продукується печінкою люди 15 77946 16 ни, потрібен для синтезу та секреції ЛДНГ. ЛНГ, гліцеридемії, гіперліпідемії, діабету та діабету типу що містять приблизно 2/3 холестерину у плазмі II, який включає введення ссавцю терапевтично людини, є продуктами метаболізму ЛДНГ. Аро Вактивної поліарилкарбоксамідної сполуки. 100 є практично єдиним протеїновим компонентом Даний винахід стосується сімейства нових поЛНГ. Підвищені концентрації аро В-100 та холесліарилкарбоксамідних сполук формули (І) терину ЛНГ у плазмі є визнаними факторами ризику для розвитку атеросклеротичної ішемічної хвороби серця. Велика кількість генетичних та набутих хвороб можуть призвести до гіперліпідемії. Вони можуть бути класифіковані на первинні та вторинні гіперліпідемічні стани. Найпоширенішими причинами вторинних гіперліпідемій є цукровий діабет, зловживання алкоголем, наркотиками, гіпотиреоз, їхні х N-оксидів, фармацевтично прийнятних адитивних солей та стереохімічно ізомерних хронічна ниркова недостатність, нефротичний сиформ, у якій ндром, холестаз та булімія. Первинні гіперліпідемії - Ζ1 обирають з (СН2)n, де n дорівнює 1-3, також були класифіковані на звичайну гіперхолесСН2СН2О та ОСН2СН2, теринемію, сімейну комбіновану гіперліпідемію, сімейну гіперхолестеринемію, залишкову гіперліпі- Ζ2 позначає (СН2)m, де m дорівнює 1 чи 2, - Х1 позначає О, СН2, CO, NH, CH2O, OCH2, демію, хіломікронемічний синдром та сімейну гіCH2S, SCH2 чи простий зв'язок, пертригліцеридемію. - Х2 та Х3 кожен незалежно обирають з СН, N Відомо, що мікросомальний протеїн перенета sp2-aTOMa карбону, сення тригліцеридів (тут та надалі МПТ) каталізує транспорт тригліцериду та складного холестери- R1 позначає гідроген чи С1-4-алкіл, - Аr 1 позначає ароматичне кільце, обране з лового ефіру переважно до фосфоліпідів, таких як фенілу, нафталенілу, піридинілу, піразинілу, пірифосфа тидилхолін. У роботі [D.Sharp et al., Nature мідинілу, піридазинілу, триазинілу, триазолілу, (1993) 365:65] було продемонстровано, що деімідазолілу, піразолілу, тіазолілу, ізотіазолілу, окфект, який спричинює абеталіпопротеїнемію, знаходиться у гені МПТ. Це вказує на те, що МПТ посазолілу, піролілу, фуранілу та тієнiлу, необов'язково заміщеними одним чи двома замісниками R 3, трібен для синтезу Аро В-вмісних ліпопротеїдів, - Аr 2 позначає ароматичне кільце, обране з таких як ЛДНГ, що є прекурсором ЛHГ. Звідси вифенілу, нафталенілу, піридинілу, піразинілу, пірипливає, що інгібітор МПТ повинен інгібувати синмідинілу, піридазинілу, триазинілу, триазолілу, тез ЛДНГ те ЛНГ, тим самим знижуючи рівні ЛДНГ, ЛНГ, холестерину та тригліцеридів у людини. Інгіімідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, піролілу, фуранілу та тієнілу, необов'язбітори МПТ були описані у Канадській патентній ково заміщеними одним, двома чи трьома заміснизаявці №2091102 та у WO 96/26205. Інгібітори ками R4, МПТ, що належать до класу поліарилкарбоксамі- кожен з R2 та R3 незалежно обирають з С 1-4дів, були також описані у патенті США №5760246, а також у WO-96/40640 та WO-98/27979. алкілу, С1-4-алкілоксигруги, галоїду, три фторметилу, Однією з цілей даного винаходу є створення - кожен з R4 незалежно обирають з С 1-4-алкілу, удосконаленого способу лікування пацієнтів, що С1-4-алкілоксигрупи, галоїду, гідроксилу, меркаптостраждають від ожиріння чи атеросклерозу особгрупи, ціаногрупи, нітрогрупи, С1-4-алкілтіогрупи чи ливо коронарного атеросклерозу, і загалом від розладів, зв'язаних з атеросклерозом, таких як полігалоїд-С 1-6-алкілу, аміногрупи, С1-4алкіламіногрупи та ді-(С1-4-алкіл)аміногрупи, ішемічна хвороба серця, захворювання перифери- кожен з р 1 та р2 дорівнює 0-2, чних судин та захворювання мозкових судин. Ін- р3 дорівнює 0-3, шою метою даного винаходу є викликання регресії - Х1 та R4 разом з ароматичними кільцями Аr1 атеросклерозу та інгібування його клінічних наслідків, особливо захворюваності та смертності. та Аr2 , до яких вони приєднані, можуть утворювати флуорен-1-ільну чи флуорен-4-ільну гр упу, Даний винахід оснований на несподіваному - А позначає С1-6-алкандіїл, заміщений однією відкритті, що клас нових поліарилкарбоксамідних чи двома групами, обраними з арилу, гетероарилу сполук діє як селективні інгібітори МПТ, тобто, вота С3-10-циклоалкілу; або якщо Х3 позначає СН, А ни є здатними селективно блокувати МПТ на рівні стінок кишечнику у ссавців, і тому є перспективниможе також позначати атом нітрогену, заміщений гідрогеном, С1-10-алкіл, арил, гетероарил, арил-С1ми кандидатами на лікарський засіб, зокрема, для лікування гіперліпідемії. Даний винахід додатково 10-алкіл, гетероарил-С 1-10-алкіл чи С 3-10-циклоалкіл, - В позначає гідроген; С1-10-алкіл; арил чи гепропонує кілька методів одержання таких поліаритероарил, кожен з яких є необов'язково заміщеним лкарбоксамідних сполук, а також фармацевтичні композиції, що містять такі сполуки. Крім того, вигрупою, обраною з галоїду, ціаногрупи, нітрогрупи, С1-4-алкілоксигрупи, аміногрупи, С1-10нахід пропонує певну кількість нових сполук, що є алкіламіногрупи, ді-(С1-10-алкіл)аміногрупи, С1-10придатними як проміжні речовини для одержання ацилу, С1-10-алкілтіогрупи, С1-10-алкоксикарбонілу, терапевтично активних поліарилкарбоксамідних С1-10-алкіламінокарбонілу та ді-(С1-10сполук, а також способи одержання таких проміжних речовин. Зрештою, винахід пропонує спосіб алкіл)амінокарбонілу; арил-С1-10-алкіл; гетероарилС1-10-алкіл; С3-10-циклоалкіл; полігалоїд-С 1-6-алкіл; лікування стану, обраного з атеросклерозу, панС3-6-алкеніл; С3-6-алкініл; NR6R7; чи ОR8; креатиту, ожиріння, гіперхолестеринемії, гіпертри 17 77946 18 - R6 та R7 кожен незалежно позначають гідроліл, оксазоліл, піроліл, фураніл, тієніл і т.п., вклюген, С1-10-алкіл, арил чи гетероарил, кожен з яких є чаючи усі можливі їхні ізомерні форми, необов'язково заміщеним групою, обраною з гало- С3-6-алкеніл позначає вуглеводневі радикали їду, ціаногрупи, С1-4-алкілоксигрупи, аміногрупи, з лінійним та розгалуженим ланцюгом, які мають С1-10-алкіламіно, ді-(С1-10-алкіл)аміногрупи, С1-10один подвійний зв'язок та містять від 3 до 6 атомів ацилу, С1-10-алкілтіогрупи, С1-10карбону, такі як, наприклад, 2-пропеніл, 3-бутеніл, алкіламінокарбонілу та ді-(С1-102-бутеніл, 2-пентеніл, 3-пгнтеніл, 3-метил-2алкіл)амінокарбонілу; арил-С1-10-алкіл, гетероарилбутеніл, 3-гексеніл, 2-гексеніл і т.п., С1-10-алкіл, С3-10-циклоалкіл, С7-10-поліциклоалкіл, - С3-6-алкініл позначає вуглеводневі радикали полігалоїд-С 1-6-алкіл, С3-8-алкеніл, С3-8-алкініл, з лінійним та розгалуженим ланцюгом, які мають конденсований бензо-С5-8-циклоалкіл, причому R6 один потрійний зв'язок і містять від 3 до 6 атомів та R7 разом з атомом нітрогену, до якого вони карбону, такі як, наприклад, 2-пропініл, 3-бутиніл, приєднані, можуть утворювати С 4-8-насичений ге2-бутиніл, 2-пентиніл, 3-пентиніл, 3-метил-2тероциклічний радикал; і бутиніл, 3-гексиніл, 2-гексиніл і т.п., - R8 позначає С 1-10-алкіл, арил чи гетероарил, - С4-8-циклоалкеніл позначає циклічні вуглевокожен з яких є необов'язково заміщеним групою, дневі радикали, які мають один подвійний зв'язок обраною з галоїду, ціаногрупи, нітрогрупи, С1-4та містять від 4 до 8 атомів карбону, такі як, наприалкілоксигрупи, аміногрупи, С1-10-алкіламіногрупи, клад, циклобутеніл, циклопентеніл, циклогексеніл, ді-(С1-10-алкіл)аміногрупи, С1-10-ацилу, С1-10циклогептеніл, циклооктенiл і т.п., алкілтіогрупи, С1-10-алкіламінокарбонілу та ді-(С1-10 - конденсований бензо-С 5-8-циклоалкіл позна-алкіл)амінокарбонілу; арил-С 1-10-алкіл; гетерочає радикали, такі як, наприклад, інданіл, 1,2,3,4арил-С 1-10-алкіл; С3-10-циклоалкіл; С7-10тетрагідронафталеніл, флуореніл і т.п., поліциклоалкіл; полігалоїд-С1-6-алкіл; С3-8-алкеніл; - С7-10-поліциклоалкіл позначає радикали, які С3-8-алкніл; чи конденсований бензо-С5-8містять від 7 до 10 атомів карбону, такі як, наприциклоалкіл. клад, норборніл, Якщо не визначено інакше, у наведених ви ще - С1-6-алкіламіногрупа позначає радикали первизначеннях та далі: винної аміногрупи, які містять від 1 до 6 атомів - галоїд є родовою назвою для фтору, хлору, карбону, такі як, наприклад, метиламіногрупа, етиброму та йоду; ламіногрупа, пропіламіногрупа, ізопропіламіногру- С1-4-алкіл позначає насичені вуглеводневі па, бутиламіногрупа, ізобутиламіногрупа і т.п., радикали з лінійним та розгалуженим ланцюгом, - ді-(С1-6-алкіл)аміногрупа позначає радикали які мають від 1 до 4 атомів карбону, такі як, напривторинної аміногрупи, що містять від 1 до 6 атомів клад, мeтил, етил, пропіл, н-бутил, 1-метилетил, 2карбону, такі як, наприклад, диметиламіногрупа, метилпропіл, 1,1-диметилетил і т.п.; діетиламіногрупа, дипропіламіногрупа, діізопропі- С1-6-алкіл має включати С 1-4-алкіл (який був ламіногрупа, н-метил-N'-етиламіногрупа, н-етилвизначений вище) та його вищі гомологи, що маN'-пропіламіногрупа і т.п., ють 5 чи 6 атомів карбону, такі як, наприклад, 2- С1-6-алкілтіогрпа позначає С1-6-алкільну гр уметллбутил, н-пентил, диметилпропіл, н-гексил, 2пу, приєднану до атома сульфуру, таку як метилтіметилпентил, 3-метилпентил і т.п.; огрупу, етилтіогр упу, пропілтіогрупу, ізопропілтіог- С1-10-алкіл має включати С 1-6-алкіл (який був рупу, бутилтіогр упу і т.п., визначений вище) та його вищі гомологи, що ма- С1-6-ацил позначає С1-6-алкільну груп у, приють від 7 до 10 атомів карбону, такі як, наприклад, єднану до карбонільної групи, таку як, наприклад, гептил, етилгексил, октил, ноніл, децил і т.п.; ацетил, пропіоніл, бутирил, ізобутирил і т.п. - С3-10-циклоалкіл є родовою назвою циклопПередбачається, що фармацевтично прийнятропілу, циклобутилу, циклопентилу, циклогексилу, ні адитивні солі, які було згадано вище, включають циклогептилу, циклооктилу, циклононілу та циклотерапевтично активні нетоксичні форми кислотнодецилу; адитивних солей, які здатні утворювати сполуки - полігалоїд-С 1-6-алкіл визначається як полігаформули (І) і які можуть бути зручно одержані лоїдзаміщений С 1-6-алкіл, зокрема, С1-6-алкіл (який шляхом обробки основної форми таких сполук був визначений вище), заміщений 2-13 атомами відповідною кислотою. Приклади таких придатних галоген; такий як дифторметил, трифторметил, кислот включають, наприклад, неорганічні кислотрифторетил, октафторпентил і т.п.; ти, такі як галоїдводневі кислоти, наприклад, хло- арил визначається як моно- та поліароматиристоводнева чи бромистоводнева кислота, сірчачні групи, такі як феніл чи нафталеніл, необов'язна кислота, азотна кислота, фосфорна кислота і ково заміщені одним-трьома замісниками, кожен з т.п., або органічні кислоти, такі як, наприклад, оцяких є незалежно обраним з нітрогрупи, азидогрутова, пропанова, оксі оцтова, 2-оксипропанова, 2пи, ціаногрупи, галоїду, гідроксилу, С1-6-алкілу, С3-7 оксопропанова, молочна, піровиноградна, щавле-циклоалкілу, С1-4-алкілоксигрупи, полігалоїд-С 1-6ва (тобто, етандіова), малонова, бурштинова (тобалкілу, аміногрупи, моночи ді-(С1-6то, бутандіова кислота), малеїнова, фумарова, алкіл)аміногрупи; яблучна, винна, лимонна, метансульфонова, ета- гетероарил визначається як моно- та полігенсульфонова, бензолсульфонова, птероароматичні групи, такі як ті, що включають толуолсульфонова, циклогексансульфамінова, один чи більше гетероатомів, обраних з нітрогену, саліцилова (тобто, 2-гідроксибензойна), поксигену, сульфур у та фосфор у, зокрема, піридиаміносаліцилова, памоєва і т.п. Навпаки, сольова ніл, піразиніл, піримідиніл, піридазиніл, триазиніл, форма може бути перетворена шляхом обробки триазоліл, імідазоліл, піразоліл, тіазоліл, ізотіазовідповідним лугом на основну форму. 19 77946 20 Термін фармацевтично прийнятні адитивні сощо розглядається. лі, у тому значенні, що використовується вище, Отже, якщо суміш енантіомерів одержують включає також сольвати, які здатні утворювати будь-яким з таких способів одержання, вона может сполуки формули (І), а також їхні солі, такі як набути розділена методом рідинної хроматографії з приклад, гідрати, алкоголяти і т.п, використанням придатної хіральної стаціонарної Передбачається, що N-оксидні форми сполук фази. Придатними хіральнйми стаціонарними фаформули (І), включають такі сполуки, у яких один зами є, наприклад, полісахариди, зокрема, похідні чи більше атомів нітрогену є окисленим з викорисцелюлози чи амілози. Комерційно доступними хітанням методів перетворення тривалентного нітральними стаціонарними фазами на основі полірогену на його N-оксидну форму, добре відомих сахаридів є ChiralCelÔ СА, ОА, ОВ, ОС, OD, OF, фа хівцям. Вказана реакція N-оксидації може звиOG, OJ та ОК, і ChiralpakÔ AD, AS, ОР(+) та ОТ(+). чайно бути проведена шляхом проведення реакції Відповідні елюенти чи рухомі фази, призначені для сполуки формули (І) з 3-феніл-2використання із зазначеними полісахаридними (фенілсульфоніл)оксазиридином чи з відповідним хіральними стаціонарними фазами включають органічним чи неорганічним пероксидом у щонайгексан і т.п., і є модифікованими спиртом, таким як менше одному придатному розчиннику. Придатні етанол, ізопропанол і т.п. неорганічні пероксиди включають, наприклад, пеТерміни цис та транс використовуються тут рекис водню та пероксиди лужного металу чи лужзгідно з номенклатурою Chemical Abstracts і познаноземельного металу, наприклад, пероксиди начають положення замісників на кільцевому фрагтрію чи калію. Придатні органічні пероксиди менті. можуть включати пероксикислоти, такі як, наприАбсолютна стереохімічна конфігурація поліклад, бензолкарбопероксокислота чи галоїдзаміарилкарбоксамідних сполук формули (І) та проміщена бензолкарбопероксокислота (наприклад, 3жних сполук, що використовуються для їхнього хлорбензолкарбопероксокислота), пероксоалканоодержання, може бути легко визначена фахівцями ві кислоти (наприклад, пероксооцтова кислота) та в цій області з використанням добре відомих меалкілгідропероксиди (наприклад, треттодів, таких як, наприклад, рентгенівська дифракбутилгідропероксид). Придатні розчинники для цієї ція. реакції включають, наприклад, воду, нижчі спирти Крім того, деякі поліарилкарбоксамідні сполуки (наприклад, етанол і т.п.), вугле водні (наприклад, формули (І) та деякі з проміжних сполук, що викотолуол), кетони (наприклад, 2-бутанон), галогенористовуються для їхнього одержання, можуть вивані вуглеводні (наприклад, дихлорметан) та суявляти поліморфізм. Передбачається, що даний міші таких розчинників. винахід охоплює будь-які поліморфні форми, які Поліарилкарбоксамідні сполуки формули (І) мають властивості, придатні для лікування згадаможуть мати щонайменше один хіральний центр у них ви ще станів. групі А та/або групі В та/або циклічній групі, вклюГрупа цікавих сполук складається з таких спочаючи Х2 та Х3. лук формули (І), для яких застосовні одно чи більТермін "стереохімічно ізомерні форми", у тому ше з таких обмежень: значенні, що використовувалось вище, визначає a) R 1 є гідрогеном; усі можливі ізомерні форми, які можуть маги споb) R 2 є гідрогеном чи С 1-4-алкілом; луки формули (І). Якщо не вказано інше, хімічні c) R3 є гідрогеном чи С 1-4-алкілом; назви сполук позначають суміш усіх можливих d) R4 є гідрогеном, С1-4-алкілом чи трифторместереохімічно ізомерних форм, причому вказані тилом; суміші містять усі діастереомери та енантіомери е) р1 дорівнює 1; основної молекулярної структури. Зокрема, стеf) ρ2 дорівнює 1; реогенні центри можуть знаходитись у R- чи Sg) ρ3 дорівнює 1; конфігурації; замісники на двовалентних циклічних h) двовалентний радикал А є С 1-6-алкандіїлом, насичених радикалах можуть мати цис- чи трансзаміщеним однією арильною групою, зокрема, А є конфігурацію. Таке саме визначення є застосовметиленовою групою, заміщеною фенілом; ним до усіх нових проміжних сполук, що описані і) В є С1-4-алкілоксигрупою чи С 1-10тут, які використовуються для одержання поліариалкіламіногрупою. лкарбоксамідних сполук формули (І). Цікавими сполуками є такі сполуки формули Чисті стереоізомерні форми зазначених спо(І), у яких Ζ1 , Ζ 2, Х2 та Х3 разом утворюють шестилук та проміжних сполук визначаються як ізомери, членний гетероцикл. що по суті не містять інших енантіомерних чи діасОсобливими сполуками є такі сполуки формутереомерних форм однієї базової молекулярної ли (І), у яких радикал В є метилоксигрупою чи етиструктури. Зокрема, термін "стереоізомерно числоксигрупою. тий" чи "хірально чистий" стосується сполук чи Іншими особливими сполуками є такі сполуки проміжних сполук, що мають стереоізомерний формули (І), у яких R2 та/або R3 є С1-4-алкілом. надлишок щонайменше 80% (тобто, принаймні Ще іншими особливими сполуками є такі спо90% одного ізомера та не більш ніж 10% іншого луки формули (І), у яких R4 є С1-4-алкілом чи триможливого ізомер а), краще, щонайменше 90%, фторметоксигрупою. ще краще, щонайменше 94%, і найкраще, щонайЩе кращими сполуками є такі конкретні сполуменше 97%. Терміни "енантіомерно чистий" та ки формули (І), у яких Z 1, Z2, Х2 та Х3 разом утво"діастереомерно чистий" слід розуміти аналогічно, рюють піперидинову чи піперазинову гр упу, і X1 по відношенню до енантіомерного надлишку, чи позначає простий зв'язок. відповідно, діастереомерноно надлишку, суміші, Ще кращими сполуками формули (І) є такі 21 77946 сполуки, у яких R2 та R3 є кожен гідрогеном і R4 є гідрогеном, трифторметилом, хлором чи третбутилом. Найкращими сполуками формули (І) є: 22 та їхні стереоізомерні форми, фармацевтично прийнятні кислотно-адитивні солі чи N-оксиди. Однією перевагою даного винаходу є простота, з якою сполуки формули (І) можуть бути виготовлені великою кількістю різних способів. Деякі з таких способів будуть зараз описані детально, без претензії на надання вичерпного переліку способів одержання вказаних сполук. Першим способом одержання поліарилкарбоксамідної сполуки за даним винаходом є спосіб, у якому проміжний феніленамін формули у якій Ζ1, Ζ2 , Χ2, Х3б р1, R 1, R2, А та В мають значення, визначені у формулі (І), вводять у реакцію з поліарилкарбоновою кислотою чи галоїдангідридом формули (ІІІ), 23 77946 24 Α-Υ2 позначає R'5COR5, де R5 та R' 5 мають такі значення, щоб радикал R'5CHR5 підпадав під визначення А у формулі (І), у щонайменше одному інертному щодо реакції розчиннику і, необов'язково, у присутності щонайменше одного придатного активатора нуклеофільного заміщення та/або придатної основи, причому вказаний спосіб далі необов'язково включає перетворення сполуки формули (І) на її адитивну сіль та/або одержання її у якій X1, Аr 1, Аr 2, р2 , р3, R3 та R4 мають знастереохімічно ізомерних форм. Якщо Y2 позначає чення, визначені у формулі (І), a Yi 1 обирають з галоїд, то процедура алкілувального сполучення гідроксилу та галоїду, у щонайменше одному інерможе бути, наприклад, здійснена у присутності тному щодо реакції розчиннику і, необов'язково, у карбонату натрію чи калію або третинного аміну, присутності придатної основи, причому вказаний такого як триетиламін чи діізопропілетиламін, у метод далі необов'язково включає перетворення розчиннику, такому як диметилформамід чи месполуки формули (І) на її адитивн у сіль та/або тилізопропілкетон і, необов'язково, у присутності одержання її стереохімічно ізомерних форм. У каталітичної кількості йодиду калію для сприяння тому випадку, коли Y1 є гідроксилом, може бути нуклеофільному заміщенню. Проміжні сполуки зручним проведення активації біфенілкарбонової формули (IV), у якій Х3 позначає нітроген, можуть кислоти формули (III) шля хом додання ефективної бути також піддані відновному N-алкілуванню за кількості промотора реакції. Необмежуючі прикладопомогою альдегіду чи кетону формули (V), у якій ди таких промоторів реакції включають карбоніл -A-Y2 позначає R'5COR5, з утворенням у такий сподіімідазол, дііміди, такі як Ν,Ν'сіб сполук формули (І). Вказане відновне Nдициклогексилкарбодіімід чи 1-(3алкілування може бути проведене у інертному диметиламінопропіл)-3-етилкарбодіімід, та їхні щодо реакції розчиннику, такому як, наприклад, функціональні похідні. Для цього типу процедури толуол, метанол, тетрагідрофуран чи їхні суміші, і ацилювання краще використовується полярний у присутності відновлювального агента. Необмеапротонний розчинник, такий як, наприклад, метижуючі приклади таких відновлювальних агентів ленхлорид. Придатні основи для здійснення цього включають гідроген та боргідриди, наприклад, борпершого методу включають третинні аміни, такі як гідрид натрію, боргідрид цинку, боргідрид літію, триетиламін, триізопропіламін і т.п. Придатні темціаноборгідрид натрію, триацетоксиборгідрид і т.п. ператури для проведення першого способу за виЯкщо боргідрид використовується як відновлюванаходом типово знаходяться в інтервалі від близьльний агент, то може бути зручним здійснювати Nко 20°С до близько 140°С, у залежності від алкілування у додатковій присутності каталізатора. конкретного розчинника, що використовується, і Необмежуючі приклади таких каталізаторів вклюнайчастіше будуть температурою кипіння вказаночають алкоксиди перехідних металів, наприклад, го розчинника. титан(ІV)ізопропоксид, титан(ІV)-н-бутоксид і т.п., Другий спосіб одержання поліарилкарбоксаміяк описано у [J. Org. Chem., (1990), 55:2552-4]. дних сполук за даним винаходом, у яких Хз познаЯкщо гідроген використовується як відновлювальчає нітроген, є способом, у якому проміж: ту споний агент, то може бути зручним здійснювати Nлуку формули алкілування у додатковій присутності каталізатора. Необмежуючі приклади каталізаторів, придатних для цієї мети, включають благородні метали, нанесені на носії, такі як, наприклад, паладій на вугіллі чи платина на вугіллі. Утворенню основи Шифа на першій стадії вказаної реакції відновлювального N-алкілування може додатково сприяти додаткова присутність придатного реагенту, такого як тербутоксид алюмінію, оксид кальцію, 1 2 3 1 2 гідрид кальцію і т.п. Відповідна каталітична отрута, у якій Z1, Z2, Х1 , Х2, р , р , р , Аr , Аr , R1, R2, R3 наприклад, тіофен, бутантіол, хінолін, сірка і т.п., та R4 мають значення, визначені у формулі (І), і Х3 може також бути додана до реакційної суміші з позначає нітроген, вводять в реакцію з реагентом метою запобігання небажаному гідруванню певних формули (V) функціональних груп реагентів та/або продукту реакції. Перемішування та, необов'язково, підвищена температура та/або тиск можуть додатково збільшувати швидкість такої реакції. у якій А та В мають значення, визначені у формулі (І), і Y2 обирають з галоїду, тозилоксигрупи, мезилоксигрупи, нафтилсульфонілоксигрупи, або Третім способом одержання поліарилкарбоксамідної сполуки за винаходом є спосіб, у якому проміжну сполуку формули 25 77946 26 (І) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм. Інертним щодо реакції розчинником може бути, наприклад, диметилформамід чи метанол, а температурою реакції може бути точка кипіння вказаного розчинника. На відміну від більшості альтернативних способів одержання поліарилкарбоксамідних сполук за даним винаходом, цей четвертий спосіб не потребує присутності каталізатора чи іншого сполучального 1 2 3 1 2 у якій Z1, Z2 , Х1 , Х2, X3, p , p , p , Ar , Ar , R1 , R2 , реагенту для досягнення кількісного вихода цільоR3, R4 та А мають значення, визначені у формулі вої сполуки. До реакційної суміші може бути не(І), і Y3 обирають з галоїду та гідроксилу, вводять в обов'язково додана основа, така як: карбонат нареакцію з реагентом формули ВН, де В позначає трію, карбонат калію, карбонат цезію і т.п. Як NR6R7 чи OR8, і R6, R7 та R8 мають значення, вивизнано у відомому рівні техніки, А краще є a,bзначені у формулі (І), у щонайменше одному інерненасиченою карбонільною сполукою, такою як тному щодо реакції розчиннику та необов'язково у кетон чи складний ефір, b-атом карбону якого є присутності щонайменше одного придатного спосприйнятливим до нуклеофільної атаки. Необмелучального реагенту та/або придатної основи, жуючі приклади групи А, придатні для такої реакції причому вказаний спосіб далі необов'язково вклюприєднання Міхаеля включають, наприклад: чає перетворення сполуки формули (І) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм. У тому випадку, коли Y3 є гідроксилом, може бути зручним активувати карбонову кислоту формули (VI) шляхом додання ефективної кількості промотора реакції. Необмежуючі приклади таких промоторів реакції включають карбонілдіімідазол, П'ятим способом одержання поліарилкарбокдііміди, такі як Ν,Ν'-дициклогексилкарбодіімід чи 1самідної сполуки за даним винаходом є спосіб, у (3-диметиламінопропіл)-3-етилкарбодіімід, та їхні якому проміжну сполуку формули (VIII) функціональні похідні. У випадку використання хірально чистого реагенту формули (V), швидка реакція проміжної сполуки формули (VI) із вказаним реагентом без енантіомеризації продукта може бути проведена у додатковій присутності ефективної кількості сполуки, такої як гідроксибензотриазол, бензотриазолілокситрис(диметиламіно)-фосфонійгексафторфосфа т, гексафторфосфат тетрапіролідинофосфонію, гексафторфосфат бромтрипіролідинофосфонію чи їхнього функціонального похідного, так як описано де Х1, р1, р2 , р3, Аr1, Аr 2, R1, R2, R3 та R4 мають [D.Hudson, J. Org. Chem., (1988), 53:617]. У тому значення, визначені у формулі (І), а Y5 обирають з випадку, коли Y3 є гідроксилом, а В позначає OR8, галоїду, В(ОН)2 , алкілборонатів та їхніх циклічних реакція етерифікації може бути зручно проведена аналогів, вводять у реакцію з реагентом формули у присутності ефективної кількості кислоти, такої (IX) як сірчана кислота і т.п. Четвертим способом одержання поліарилкарбоксамідної сполуки за даним винаходом, у якій Х3 є нітрогеном, і у якій А є гр упою, придатною для проведення реакції приєднання Міхаеля, є спосіб, у якому проміжну сполуку, що має формулу (IV), у якій Х3 є нітрогеном, вводять в реакцію з реагентом формули (VII) де Z1б Z2, Х3 , А та В мають значення, визначені у формулі (І), у щонайменше одному інертному щодо реакції розчиннику і необов'язково у присутності щонайменше одного сполучального реагенту на основі перехідного металу та/або щонайменше одного придатного ліганду, причому вказаний спосіб далі необов'язково включає перетворення сполуки формули (І) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм. Цей тип де В має значення, визначені у формулі (І), a реакції відомий як реакція Бухвальта (Buchwaldt), Y4 та Υ' 4 мають такі значення, щоб радикал а посилання на застосовні металеві сполучальні реагенти та/або придатні ліганди, наприклад, сполуки паладію, такі як паладійтетпідпадав під визначення А у формулі (І), ра(трифенілфосфін), у щонайменше одному інертному щодо реакції трис(дибензиліденацетон)дипаладій, 2,2’розчиннику, причому вказаний спосіб далі необобіс(дифенілфосфіно)-1,1'-бінафтил і т.п., можна в'язково включає перетворення сполуки формули 27 77946 28 знайти, наприклад, у [Tetpahedron Letters, (1996), мають значення, визначені у формулі (І), a Y8 оби37(40), 7181-7184 та J. Am. Chem. Soc, (1996), рають з брому, йоду та трифторметилсульфонату, 118:7216]. Якщо Y5 позначає Β(ΟΗ)2, алкілборонат вводять у реакцію з арилборною кислотою формучи їхній циклічний аналог, то як сполучальний реали (ХІllа) гент, у відповідности до [Tetpahedron Letters, (1998), 39:2933-6], має використовува тися ацетат міді(ll). Шостим способом одержання поліарилкарбоксамідної сполуки за даним винаходом є спосіб, у якому проміжну сполуку формули (X) де р3, Аr2 та R4 мають значення, визначені у формулі (І), або з оловоарильним реагентом формули (ХІllb) де р1, р2, р3, Аr 1, Аr2, Х1, R1, R2, R3 та R4 мають значення, визначені у формулі (І), вводять у реакцію з реагентом формули (XI) де Ζ1, Ζ2, Х3, А та В мають значення, визначені у формулі (І), один з Υ6 та Υ7 обирають з брому, йоду та трифторметилсульфонату, а інший з Υ6 та Υ7 обирають з три-(С1-4-алкіл)олова, В(ОН)2, алкілборонатів та їхніх циклічних аналогів, у щонайменше одному інертному щодо реакції розчиннику та необов'язково у присутності щонайменше одного сполучального реагенту на основі перехідного металу та/або щонайменше одного придатного ліганду, такого як паладій, асоційований з трифенілфосфіном, трифеніларсином і т.п., причому вказаний спосіб далі необов'язково включає перетворення сполуки формули (І) на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм. Цей тип реакції відомий фахівцям як реакція Штілле (Stille) чи реакція Сузукі (Suzuki), а посилання на придатні сполучальні реагенти на основі перехідних металів та/або придатні ліганди можна знайти, наприклад, у [Syn. Letters, (1998) 6,671-5, у Chem. Rev., (1999) 99(6), 1549-1581 та у книзі The Stille Reaction (John Wiley & Sons, Inc.) ISBN 0-471-31273-8]. Сьомим способом одержання поліарилкарбоксамідної сполуки за даним винаходом є спосіб, у якому проміжну сполуку формули (XII) де Z1, Z2 , Х2, Х3, р1, р2, Аr 1, R1, R2 , R3, А та В де R3, R4, Аr 2 та р3 мають значення, визначені у формулі (І), у щонайменше одному інертному щодо реакції розчиннику і, необов'язково, у присутності щонайменше одного сполучального реагенту на основі перехідного металу та/або щонайменше одного придатного ліганду, причому вказаний спосіб далі необов'язково включає перетворення сполуки формули (І) на її адитивн у сіль та/або одержання її стереохімічно ізомерних форм. Цей тип реакції відомий фахівцям як реакція Штілле чи реакція Сузукі, а посилання на придатні сполучальні реагенті ι на основі перехідних металів та/або придатні ліганди можна знайти, наприклад, у вказаній вище літературі. Типовими сполучальними реагентами для цього методу є, наприклад, біс(трифенілфосфін)дихлорпаладій та діацетилпаладій. Прикладами інертних щодо реакції розчинників для цієї реакції є 1,4-діоксан, толуол, диметилформамід, тетрагідрофуран, диметиловий ефір і т.п. Далі, методом одержання поліарилкарбоксамідної сполуки формули (І), у якій В позначає NR6R7, з поліарилкарбоксамідної сполуки формули (І), у якій В позначає OR5, є метод, що включає на першій стадії гідроліз останньої сполуки, і на другій стадії - проведення реакції одержаної відповідної карбонової кислоти з аміном формули HNR6R7 у щонайменше одному інертному щодо реакції розчиннику, і далі необов'язково включає перетворення одержаної сполуки формули (І), у якій В позначає NR6R7, на її адитивну сіль, та/або одержання її стереохімічно ізомерних форм. Перша стадія гідролізу краще здійснюється у кислотному середовищі, такому як висококонцентрована хлористоводнева кислота і, необов'язково, у присутності органічного розчинника, такого як діоксан. Сполука формули (І) може бути також зручно одержана з використанням методу твердофазового синтезу. Загалом, твердофазовий синтез включає проведення реакції проміжної сполуки, що використовується у синтезі, з полімерним носієм. Ця проміжна сполука на полімерному носії може бути потім проведена через ряд стадій синтезу. Після кожної стадії домішки видаляють шляхом фільтрування смоли та багаторазового промивання її різ 29 77946 30 ними розчинниками. На кожній стадії смола може - Аr 1 позначає ароматичне кільце, обране з бути відщеплена для проведення реакції з різними фенілу, нафталенілу, придинілу, піразинілу, пірипроміжними сполуками на наступній стадії, що мідинілу, піридазинілу, триазинілу, триазолілу, дозволяє проводити синтез великої кількості споімідазолілу, піразолілу, тіазолілу, ізотіазолілу, оклук. Після останньої стадії методу смолу обробсазолілу, піролілу, фуранілу та тієнілу, необов'язляють реагентом чи певним методом відщеплюково заміщених одним чи двома замісниками R 3, ють смолу від зразка сполуки. Більш детальне - Аr 2 позначає ароматичне кільце, обране з пояснення методик, що використовуються у тверфенілу, нафталенілу, піридинілу, піразинілу, піридофазовій хімії, наведене, наприклад, у ["The мідинілу, піридазинілу, триазинілу, триазолілу, Combinatorial Index" (B.Bunin, Academic Press) та імідазолілу, піразолілу, тіазолілу, ізотіазолілу, окNovabiochem's 1999 Catalogue & Peptide Synthesis сазолілу, піролілу, фуранілу та тієнілу, необов'язHandbook (Novabicchem AG, Switzerland), які обидково заміщених одним, двома чи трьома замісниві включені сюди за посиланням]. ками R4, Крім того, винахід пропонує сполуки будь-якої - кожен з R2 та R3 незалежно обирають з С 1-4з наведених далі формул (II), (III), (IV), (VI), (VIII), алкілу, С1-4-алкілоксигрупи, галоїду та трифторме(X) та (XII): тилу, - кожен з R4 незалежно обирають з С 1-4-алкілу, С1-4-алкілоксигруп:а, галоїду, гідроксилу, меркаптогрупи, ціаногрупи, нітрогрупи, С1-4-алкілтіогрупи чи полігалоїд-С 1-6-алкілу, аміногрупи, С1-4алкіламіногрупи та ді-(С1-4-алкіл)аміногрупи, - кожен з р 1 та р2 дорівнює 0-2, - р3 дорівнює 0-3, - Х1 та R4 разом з ароматичними кільцями, до яких вони приєднані, можуть утворювати флуорен1-ільну чи флуорен-4-ільну груп у, - А позначає С1-6-алкандіїл, необов'язково заміщений однією чи двома групами, обраними з арилу, гетероарилу та С 3-10-циклоалкілу, оксиген чи простий зв'язок, - В позначає гідроген; С1-10-алкіл; арил чи гетероарил, кожен з яких є необов'язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, С1-4-алкілоксигрупи, аміногрупи, С1-10алкіламіногрупи, ді-(С1-10-алкіл)аміногрупи, С1-10ацилу, С1-10-алкілтіогрупи, С1-10-алкоксикарбонілу, С1-10-алкіламінокарбонілу та ді-(С1-10алкіл)амінокарбонілу; арил-С1-10-алкіл; гетероарилС1-10-алкіл; С3-10-циклоалкіл; полігалоїд-С 1-6-алкіл; С3-6-алкеніл; С3-6-алкініл; NR6R7; чи OR8; - R6 та R7 кожен незалежно позначають гідроген, С1-10-алкіл, арил чи гетероарил, кожен з яких є необов'язково заміщеним групою, обраною з галоїду, ціаногрупи, С1-4-алкілоксигрупи, аміногрупи, С1-10-алкіламіногрупи, ді-(Сі.ю-алкіл)аміногрупи, Сі_ю-ацилу, Сі.ю-алкілтіогрупи, Сі.юалкіламінокарбонілу та ді-(С1-10алкіл)амінокарбонілу; арил-С1-10-алкіл, гетероарилС1-10-алкіл, С3-10-циклоалкіл, С1-10-поліциклоалкіл, полігалоїд-С 1-6-алкіл, С3-6-алкеніл, С3-6-алкініл, конденсований бензо-С5-8-циклоалкіл, причому R6 та R7 разом з атомом нітрогену, до якого вони приєднані, можуть утворювати С 4-8-насичений гетероциклічний радикал; - R8 позначає С 1-10-алкіл, арил чи гетероарил, кожен з яких є необов'язково заміщеним групою, обраною з галоїду, ціаногрупи, нітрогрупи, С1-4у яких: алкілоксигрупи, аміногрупи, С1-10-алкіламіногрупи, - Z1 обирають з (СН2)n, де n дорівнює 1-3, ді-(С1-10-алкіл)амінсирупи, С1-10-ацилу, С1-10СН2СН2О та ОСН 2СН2, алкілтіогрупи, С1-10-алкіламінокарбонілу та ді-(С1- Ζ2 позначає (СН2)m, де m дорівнює 1 чи 2, 10алкіл)амінокарбонілу; арил-С 1-10-алкіл; гетеро- X1 позначає О, СН2, CO, NH, CH2O, OCH2, арил-С 1-10-алкіл; С3-10-циклоалкіл; С7-10CH2S, SCH2 чи простий зв'язок, поліциклоалкіл; полігалоїд-С1-6-алкіл; С3-8-алкеніл; - Х2 та Х3 кожен незалежно обирають з СН, N С3-8-алкініл; чи конденсований бензо-С5-8та sp2-aroMa карбону, циклоалкіл, - R1 позначає гідроген чи С1-4-алкіл, - якщо Х3 позначає СН, то А може також по 31 77946 32 значати атом нітрогену, заміщений гідрогеном, С1ліпідемічні стани. Найпоширенішими причинами арилом, гетероарилом, арил-С1-10вторинних гіперліпідемій є цукровий діабет, зло10-алкілом, алкілом, гетероарил-С1-10-алкілом чи С 3-10вживання алкоголем, наркотиками, гіпотиреоз, циклоалкілом, хронічна ниркова недостатність, нефротичний си- Υ1 та Y3 кожен незалежно обирають з гідрондром, холестаз та булімія. Первинними гіперліпіксилу та галоїду, деміями є звичайна гіперхолестеринемія, сімейна - Υ5 обирають з галоїду, В(ОН)2, алкілборонакомбінована гіперліпідемія, сімейна гіперхолестетів та їхніх циклічних аналогів, і ринемія, залишкова гіперліпідемія, хіломікронеміч- Υ6 та Υ8 кожен незалежно обирають з брому, ний синдром, сімейна гіпертригліцеридимія. Спойоду та трифторметилсульфонату, що є придатлуки за даним винаходом можуть бути також ними як проміжні сполуки для одержання поліаривикористані для профілактики чи лікування пацієнлкарбоксамідих сполук за даним винаходом. У тів, що страждають від ожиріння чи атеросклерозу, свою чергу, даний винахід пропонує способи одеособливо, коронарного атеросклерозу та, більш ржання вищезгаданих сімейств проміжних сполук, узагальнено, розладів, зв'язаних з атеросклеротакі як розкриті у прикладах. зом, таких як ішемічна хвороба серця, захворюПоліарилкарбоксамідні сполуки формули (І), вання периферичних судин, захворювання судин їхні N-оксидні форми, фармацевтично прийнятні мозку. Сполуки за даним винаходом можуть сприсолі та стереоізомерні форми виявляють корисну чинити регресію атеросклерозу та інгібувати клініактивність з інгібування аполіпопротеїну В та супучні наслідки атеросклерозу, особливо захворюватню ліпідознижувальну активність. Тому сполуки ність та смертність. за даним винаходом є придатними для застосуВраховуючи корисність сполук формули (І), вання як лікарський засіб, особливо у способі лікуслід вважати, що даний винахід також пропонує вання пацієнтів, що страждають від гіперліпідемії, спосіб лікування теплокровних тварин, включаючи ожиріння, атеросклерозу чи діабету типу II. Зокрелюдей (які тут загалом називаються пацієнтами), ма, сполуки за даним винаходом можуть бути вищо страждають від розладів, спричинених надликористані для виробництва лікарського засобу для шком ліпопротеїдів дуже низької густини (ЛДНГ) чи лікування розладів, спричинених надлишком ліполіпопротеїдів низької густини (ЛНГ), і особливо протеїдів дуже низької густини (ЛДНГ) чи ліпопророзладів, спричинених холестерином, асоційоватеїдів низької густини (ЛНГ), і особливо розладів, ним з вказаними ЛДНГ та ЛНГ. Отже, пропонуєтьспричинених холестерином, асоційованим з вказася спосіб лікування для полегшення стану пацієнними ЛДНГ та ЛНГ. тів, що страждають від хвороб, таких як, Причинний зв'язок між гіперхолестеринемією наприклад, гіперліпідемія, ожиріння, атеросклероз особливо асоційованою з підвищеними концентчи діабет типу II. раціями у плазмі ліпопротеїдів низької густини Аро В-48, що синтезується кишечником, є по(ЛНГ) та ліпопротеїдів дуже низької густини (ЛДНГ) трібним для складання хіломікронів і тому відіграє - та передчасним атеросклерозом і серцевообов'язкову роль у кишковому всмоктуванні харчосудинними захворюваннями є напевне встановлевих жирів. Даний винахід пропонує поліарилкарбоним. ЛДНГ секретується печінкою і містить аполіксамідні сполуки, що діють як селективні інгібітори попротеїн В (аро-В); ці частинки зазнають деграМПТ на рівні стінки кишечнику. дації у кровотоці до ЛНГ, які транспортують Додатково даний винахід пропонує фармацевблизько 60-70% загального холестерину сироваттичні композиції, які включають щонайменше один ки. Аро-В є також основним протеїновим компонефармацевтично прийнятний носій та терапевтично нтом ЛНГ. Підвищення ЛНГ-холестерину у сироваефективну кількість поліарилкарбоксамідної спотці внаслідок надлишкового синтезу чи зниження луки формули (І). метаболізму, є причинно зв'язаним з атеросклероДля виготовлення фармацевтичної композиції зом. На відміну від нього, ліпопротеїди високої за даним винаходом, ефективну кількість конкретгустини (ЛВГ), що містять аполіпопротеїн А1, виної сполуки, у формі основи чи адитивної солі, що являють захисну дію і мають зворотну кореляцію з використовується як активний інгредієнт, ретельно ризиком ішемічної хвороби серця. Таким чином, змішують з щонайменше одним фармацевтично співвідношення ЛВГ/ЛНГ є зручним способом оцінприйнятним носієм, який може мати різноманітні ки атерогенного потенціалу ліпідного профілю форми в залежності від форми препарату, потрібплазми пацієнта. ної для введення. Ці фармацевтичні композиції Основний механізм дії сполук формули (І), побажано є дозованими лікарськими формами, привидимому, включає інгібування активності МПТ датними, краще, для орального введення, ректа(мікросомальний протеїн перенесення триїліцерильного введення, черезшкірного введення чи падів) у гепатоцитах та епітеліальних клітинах кишерентерального введення. чнику, що приводить до зниження ЛДНГ та продуНаприклад, для виготовлення композиції у викування хіломікронів, відповідно. Це новий та гляді дозованої форми для орального введення, перспективний підхід до гіперліпідемії, що, як очіможе бути використаний будь-який звичайний рідкується, знижатиме рівні холестерину ЛНГ та трикий фармацевтичний носій, такий як, наприклад, гліцеридів за рахунок зниження продукування вода, гліколі, масла, спирти і т.п у випадку рідких ЛДНГ у печінці та кишкового продукування хіломіоральних препаратів, таких як суспензії, сиропи, кронів. еліксири та розчини; чи тверді фармацевтичні ноВелика кількість генетичних та набутих хвороб сії, такі як крохмалі, цукри, каолін, змащувальні може спричинювати гіперліпідемію. Вони можуть речовини, зв'язуючі, розпушувальні агенти і т.п. у бути класифіковані на первинні та вторинні гіпервипадку порошків, пілюль, капсул та таблеток. 33 77946 34 Таблетки та капсули, завдяки простоті їхнього відомими фахівцям. введення, є найкращими дозованими лікарськими Рідкі препарати для орального введення моформами для орального введення, для яких, очежуть мати форму, наприклад, розчинів, сиропів чи видно, використовуються тверді фармацевтичні суспензій, або вони можуть бути виготовлені у носії. У випадку композицій для парентеральних вигляді сухого продукту для змішування з водою ін'єкцій, фармацевтичний носій буде переважно та/або іншим придатним рідким носієм перед завключати стерильну воду, хоч інші інгредієнти мостосуванням. Такі рідкі препарати можуть бути жуть бути включені для поліпшення розчинності виготовлені звичайними способами, необов'язково активного інгредієнта. Розчини для ін'єкцій можуть з іншими фармацевтично прийнятними домішками, бути виго товлені, наприклад, шляхом використантакими як суспендувальні агенти (наприклад, сорня фармацевтичного носія, який включає сольовий бітовий сироп, метилцелюлоза, гідроксипропілмерозчин, розчин глюкози чи їхню суміш. Можуть тилцелюлоза чи гідрогеновані їстивні жири), емубути також виготовлені суспензії для ін'єкцій шляльгувальні агенти (наприклад, лецитин чи хом використання відповідних рідких носіїв, сугуміарабік), неводні носії (наприклад, мигдалева спендувальних агентів і т.п. В композиціях, придаолія, складні ефіри жирних кислот чи етиловий тних для черезшкірного введення, спирт), підсолоджувачі, смакові речовини, агенти фармацевтичний носій може необов'язково вклюдля маскування неприємного смаку та консерванчати агент посилення проникності та/або придати ти (наприклад, метилчи пропіл-пзмочувальний агент, необов'язково у комбінації з гідроксибензоатів чи сорбінова кислота). невеликою кількістю придатних домішок, які не Фармацевтично прийнятні підсолоджувачі, завиявляють значної шкідливої дії на шкіру. Вказані стосовні у фармацевтичних композиціях за винадомішки можуть бути обрані для сприяння проникходом, включають, краще, щонайменше один синенню активного інгредієнта до шкіри та/або для льний підсолоджувач, такий як аспартам, допомоги при виготовленні бажаних композицій. Ці ацесульфам-калій, цикламат натрію, алітат, дигідкомпозиції для місцевого застосування можуть рохальконовий підсолоджувач, монелін, стевіозид вводитись різними шляхами, наприклад, у вигляді сукралоза (4,1’,6’-трихлор-4,1’,6’трансдермального пластиру, місцевого пластиру тридезоксигалактосахароза) чи, краще, сахарин, чи мазі. Адитивні солі сполук формули (І), завдяки натрієва чи кальцієва сіль сахарину, і необов'язкоїхній підвищеній водорозчинності порівняно з відво, щонайменше один фоновий підсолоджувач, повідною основною формою, є очевидно більш такий як сорбіт, маніт, фруктоза, сахароза, мальпридатними для виготовлення водних композицій. тоза, ізомальт, глюкоза, гідрогенований глюкозний Особливо зручно виготовляти фармацевтичні сироп, ксиліт, карамель чи мід. Сильні підсолокомпозиції за винаходом у дозованих лікарських джувачі зручно використовуються у низьких конформах для простоти введення та постійності доз. центраціях. Наприклад, у випадку наїрієвої солі "Дозована лікарська форма" у тому значенні, що сахарину, вказана концентрація може знаходитись використовується тут, стосується фізично дискреу межах від близько 0,04% до 0,1% (мас/об.) від тних одиниць, придатних для використання як раготовой композиції. Фоновий підсолоджувач і ложе зові дози, причому кожна одиниця містить поперебути е фективно використаний у більших концентдньо визначену кількість активного інгредієнта, раціях, що знаходяться у межах від близько 10% розраховану на те, щоб викликати бажаний терадо близько 35%, краще, від близько 10% до 15% певтичний ефект, у поєднанні з потрібним фарма(мас/об.). цевтичн носієм. Прикладами таких дозованих ліФармацевтично прийнятними смаковими рекарських форм є таблетки (включаючи таблетки з човинами, які можуть маскувати інгредієнти з гірнадрізом чи таблетки з покриттям), капели, пілюлі, ким смаком у композиціях з низькими дозами є, порошки у пакетиках, облатки, розчини чи суспенкраще, фруктові смакові речовини, такі як вишнезії для ін'єкція, суспензії для орального введення, ва, малинова, чорносмородинова чи полунична дозовані по 5мл (teaspoonfuls) чи 15мл смакова речовина. Дуже добрі результати може (tablespoonfols) і т.п., та упаковки з кратними дозадати комбінація двох смакових речовин. У компоми. зиціях з високими дозами можуть знадобитися Для орального введення фармацевтичні комсильніші фармацевтично прийнятні смакові речопозиції за даним винаходом можуть мати форму вини, такі як Caramel Chocolate, Mint Cool, Fantasy і твердих дозованих форм, наприклад, таблеток (як т.п. Кожна смакова речовина може входити до для ковтання, так і для жування), капсули чи желакінцевої композиції у концентрації в інтервалі від тинові капсули, виготовлені звичайними засобами близько 0,05% до 1% (мас/об.). Краще використоз фармацевтично прийнятними ексципієнтами та вуються комбінації вказаних сильних смакових носіями, такими як зв'язуючі агенти (наприклад, речовин. Краще використовується смакова речопрежелатинований кукурудзяний крохмаль, полівівина, яка не зазнає ніяких змін чи втрати смаку нілпіролідон, гідроксипропілметилцелюлоза і т.п.), та/або кольору в умовах виго товлення композиції. наповнювачами (наприклад, лактоза, мікрокристаПоліарилкарбоксамідні сполуки за даним вилічна целюлоза, фосфат кальцію і т.п.), змащуванаходом можуть бути виго товлені у формі компольні речовини (наприклад, стеарат магнію, тальк, зицій для парентерального введення шляхом ін'єоксид силіцію і т.п.), розпушувальні агенти (наприкції, зручно, вн утрішньовенної, внутрішньом'язової клад, картопляний крохмаль, натрієва сіль крохчи підшкірної ін'єкції, наприклад, шляхом болюсної мальгліколяту і т.п.), змочувальні агенти (наприін'єкції чи безперервної внутрішньовенної інфузії. клад, лаурилсульфат натрію) і т.п. На такі Композиції для ін'єкції можуть бути представлені у таблетки може бути нанесене покриття методами, дозованій лікарській формі, наприклад, в ампулах 35 77946 36 чи багатодозових ємностях, включаючи доданий тилглутарил-коферменту А з ацетил-коферменту консервант. Вони можуть мати форму суспензій, А та ацетоацетил-коферменту А, що каналізується розчинів чи емульсій у водних чи масляних носіях, ферментом HMG-CoA-синтазою. Таке інгібування і можуть містити агенти для утворення композиції, може бути легко визначене фахівцем в цій області такі як агенти регулювання осмотичного тиску, за допомогою стандартних методів аналізу, тобтj, суспендувальні агенти, стабілізатори та/або дис[Methods of Enzymology (1985) 110:19-26]. Типові пергатори. За іншим варіантом, активний інгредісполуки описані, наприклад, у патенті США єнт може знаходитись у формі порошку, призначе№5120729, який стосується похідних бетаного для змішування з придатним носієм, лактаму, патенті США №5064856, що стосується наприклад, стерильною апірогенною водою, перед похідних спіролактону, та патенті США №4847271, застосуванням. що стосується оксетанових сполук. Поліарилкарбоксамідні сполуки за даним виБудь-який інгібітор експресії гена HMG-CoAнаходом можуть бути також введені у ректальні редуктази може бути використаний як друга сполукомпозиції, такі як супозиторії чи затримуючі клізка у варіанті комбінованої терапії за даним винами, наприклад, такі, що містять звичайні супозитоходом. Ці агенти можуть бути інгібіторами трансрні основи, такі як какаова олія та/або інші гліцекрипції HMG-CoA-редуктази, що блокують риди. транскрипцію DNA, чи інгібіторами трансляції, що Поліарилкарбоксамідні сполуки за даним виперешкоджають трансляції мРНК, яка кодує HMGнаходом моя суть бути використані у сполученні з CoA-редуктазу, у протеїн. Такі інгібітори можуть іншими фармацевтичними агентами зокрема, фавпливати на транскрипцію чи трансляцію безпосермацевтичні композиції за даним винаходом моредньо чи можуть зазнавати біотрансформації у жуть додатково включати щонайменше один досполуки, що мають вищезгадані властивості, за датковий ліпідознижувальний агент, забезпечуючи допомогою одного чи кількох ферментів у шляху таким чином так звану комбіновану ліпідознижувабіосинтезу холестерину, чи можуть приводити до льну терапію. Вказаний додатковий ліпідознижунакопичення метаболіту, що виявляє вищезгадану вальний агент може бути, наприклад, відомим ліактивність. Таке регулювання може бути легко карським засобом, що звичайно використовується визначене фахівцем в цій області з використанням для лікування гіперліпідемії, таким як, наприклад, стандартних методів аналізу, тобто, [Methods of смола-комплексоутворювач для зв'язування жовчEnzymology (1985) 110:9-19]. Типові сполуки опиної кислоти, похідне фібринової кислоти чи нікотисані, наприклад, у патенті США №5041432 та у нова кислота, як було описано вище у відомому [E.I.Mercer, Prog. Lip. Res., (1993) 32:357-416]. рівні техніки за винаходом. Придатні додаткові Будь-який інгібітор СЕТР може бути викорисліпідознижувальні агенти також включають інші таний як друга сполука у варіанті комбінованої інгібітори біосинтезу холестерину та інгібітори терапії за даним винаходом. Термін "інгібітор всмоктування холестерину, особливо інгібітори 3СЕТР" у тому значенні, що використовується тут, гідрокси-3-метилглутарилу - коферменту A (H MGякщо не вказано інше, стосується сполуки, яка CoA) редуктази та інгібітори HMG-CoA-синтази, інгібує транспорт різних холестерилових складних інгібітори експресії гена HMG-CoA-редуктази, інгіефірів та тригліцеридів, що медіюється протеїном бітори СЕТР, інгібітори ацетил-СоАперенесення холестерилових складних ефірів ацилтрансфераз и (ACAT), інгібітори скваленсин(СЕТР), від ЛВГ до ЛНГ та ЛДНГ. Типові сполуки тетази і т.п. описані, наприклад, у патент: США №5512548, у [J. Будь-який інгібітор HMG-CoA-редуктази може Antibiot., (1996) 49(8):815-816 та Bioorg. Med. бути використаний як друга сполука у варіанті Chem. Lett., (1996) 6:1951-1954]. комбінованої терапії за даним винаходом. Термін Будь-який інгібітор АСАТ може бути викорис"інгібітор HMG-CoA-редуктази" у тому значенні, що таний як друга сполука у варіанті комбінованої використовується тут, якщо не вказано інше, стотерапії за даним винаходом. Термін "інгібітор сується сполуки, яка інгібує біотрансформацію АС АТ" у тому значенні, що використовується тут, гідроксиметилглутарил-коферменту А на мевалоякщо не вказано інше, стосується сполуки, яка нову кислоту, що каталізується ферментом HMGінгібує внутрішньоклітинну етерифікацію харчового CoA-редуктазою. Таке інгібування може бути легко холестерину ферментом ацил-СоА:холестеринвизначене фахівцем в цій області за допомогою ацилтрансферазою. Таке інгібування може бути стандартних методів аналізу, тобто, [Methods of легко визначене фахівцем в цій області з викорисEnzymobgy (1981) 71:455-509]. Приклади сполук танням стандартних методів аналізу, тобто, метоописані, наприклад, у патенті США №4231938 (що ду [Heider et al., Journal of Lipid Research, (1983) включає ловастатин), патенті США №4444784 (що 24:1127]. Типові сполуки описані, наприклад, у включає симвастатин), патенті США №4739073 патенті США №5510379, у WO 96/26948 та WO (що включає флувастатин), патенті США 96/10559. №4346227 (що включає правастатин), ЕР-АБудь-який інгібітор скваленсинтетази може бу491226 (що включає ривастатин) та патенті США ти використаний як друга сполука у варіанті комбі№4647576 (що включає аторвастатин). нованої терапії за даним винаходом. Термін "інгібіБудь-який інгібітор HMG-CoA-синтази може тор скваленсинтетази" у тому значенні, що бути використаний як друга сполука у варіанті використовується тут, якщо не вказане інше, стокомбінованої терапії за даним винаходом. Термін сується сполуки, яка інгібує конденсацію двох мо"інгібітор HMG-CoA-синтази" у тому значенні, що лекул фарнезилпірофосфату з утворенням сквавикористовується тут, якщо не вказано інше, столену, що каталізується ферментом сується сполуки, яка інгібує біосинтез гідроксимескваленсинтетазою. Такий інігібітор може бути 37 77946 38 легко визначений фахівцем в цій області з викориОсад відокремлюють на фільтрі та висушують, станням стандартних методів аналізу, тобто, одержуючи 0,04г (±)-метил-4-(4-нітрофеніл)-a[Methods of Enzymology (1985) 110:359-373]. Типові феніл-1-піперазинацетату (проміжна сполука 1, сполуки описані, наприклад, у ЕР-А-567026, у ЕРточка плавлення 92°С). А-645378 та у ЕР-А-645377. Приклад А.2 Фахівці з лікування гіперліпідемії легко визнаСуміш проміжної сполуки (1) (0,026моль) та чать терапевтично ефективну кількість поліарилKОН (0,13моль) у етанолі (150мл) перемішують карбоксамідної сполуки за даним винаходом за при кімнатній температурі протягом 18 годин, нарезультатами тестів, описаних далі. Загалом ввагрівають при 50°С протягом 2,5 годин і охолоджужається, що терапевтично ефективна доза склають до кімнатної температури. Осад відокремлюдатиме від близько 0,001мг/кг до близько 5мг/кг ють на фільтрі, розмішують у 2-пропанолі, ваги тіла, краще, від близько 0,01мг/кг до близько відокремлюють на фільтрі, промивають три рази 0,5мг/кг ваги тіла пацієнта, що отримуватиме курс 2-пропанолом і висушують. Цю фракцію перемілікування. Може виявитися зручним введення тешують та кип'ятять зі зворотним холодильником у рапевтично ефективної дози у формі двох чи бі2-пропанолу. Додають НСІ/2-пропанол 6Н льше субдоз з відповідними інтервалами часу про(19,94мл). Суміш перемішують та кип'ятять зі звотягом дня. Вказані субдози можуть бути ротним холодильником, фільтрують у теплому виготовлені як дозовані лікарські форми, кожна з стані і розмішують у воді (350мл). Осад відокремяких містить, наприклад, від близько 0,1мг до блилюють на фільтрі і висушують, одержуючи 5,94г зько 350мг, краще, від близько 1 до близько 200мг, моногідрату (±)-4-(4-нітрофеніл)-a-феніл-1активного інгредієнта на дозовану лікарську фопіперазиноцтової кислоти (проміжна сполука 2). рму. Приклад А.3 Точне дозування та частота введення залеСуміш проміжної сполуки (1) (0,0136моль) та жить від виду поліарилкарбоксамідної сполуки 1-(3-диметиламінішропіл)-3-етилкарбодііміду формули (І), що використовується, конкретного (0,02моль) у ДХМ (125мл) перемішують протягом стану, що лікується, тяжкості стану, що лікується, двох годин, одержуючи суміш (1). Суміш 2,2,2віку, ваги та загального фізичного стану певного трифторетиламіну (0,014моль) у ДХМ (25мл) пепацієнта, а також інших лікарських засобів (вклюремішують. Додають триетиламін (1,5г) і суміш чаючи вищезгадані додаткові ліпідознижувальні перемішують протягом 5 хвилин, одержуючи суміш агенти), які може приймати пацієнт, як добре відо(2). Суміші (1) та (2) об'єднують. Одержану суміш мо фахівцям в цій області. Крім того, вказана ефеперемішують протягом ночі і промивають водою. ктивна добова доза може бути знижена чи збільОрганічний шар відокремлюють, осушають, фільтшена у залежності від реакції пацієнта, лікування рують і розчинник упарюють. Залишок очищають якого проводиться, та/або у залежності від оцінки хроматографією на колонці із силікагелем (елюлікаря, що призначив поліарилкарбоксамідну споент: СН2СІ2/СН3ОН 98/2). Чисті фракції збирають і луку за даним винаходом. Таким чином, вказані розчинник упарюють. Цю фракцію очищають хровище межі величини ефективної добової кількості матографією на солонці із силікагелем (елюент: є лише орієнтовними. ДХМ/гексан/етилацетат 50/20/30). Чисті фракції В описаних далі методиках використовувалися збирають і розчинник упарюють, одержуючи 2,3г такі скороченія: "АЦН" позначає ацетонітрил; (±)-4-(4-нітрофеніл)-a-феніл-N-(2,2,2"ТГФ" позначає тетрагідрофуран; "ДХМ" позначає трифторетил)-1-піперазинацетаміду (проміжна дихлорметан; "ДІПЕ" позначає діізопропіловий сполука 3). ефір; "ДМФ" позначає Ν,Ν-диметилформамід; Приклад А.4 "ΝΜΡ" позначає N-метил-2-піролідон; "ТФОК" поСуміш проміжної сполуки (3) (0,0054моль) у значає трифтороцтову кислоту; "TIC" позначає метанолі (150мл) гідрують з використанням Pd/C триізопропілсилан; "ДІПЕА" позначає діізопропіле10% (1г) як каталізатора у присутності 4% розчину тиламін; "TMSOTf" позначає триметилсилілтрифтіофену (1мл). Після поглинання водню (2 еквівалат, і "МIK" позначає метилізобутилкетон. ленти), каталізатор відокремлюють на фільтрі і ExtrelutÔ є продуктом виробництва фірми Мerсk фільтрат упарюють. Залишок тритурують у ДІПЕ. KgaA (Дармштадт, Германія), і є короткою колонОсад відокремлюють на фільтрі і висушують, одекою, що містить діатомову землю. ржуючи 1,5г (±)-4-(4-амінофеніл)-a-феніл-N-(2,2,2А. Одержання проміжних сполук трифторетил)-1-піперазинацетаміду (проміжна Приклад А.1 сполука 4, точка плавлення 136°С). a-Бромметиловий складний ефір бензолоцтоПриклад А.5 вої кислоти (0,026моль) додають по краплях до Суміш 4'-(трифторметил)-[1,1’-біфеніл]-2суміші 1-(4-нітрофеніл)піперазину (0,028моль) та карбонілхлориду (0,185моль) у ДХМ (1500мл) та Na2CO3 (0,024моль) у ДМФ (150мл) при перемішутриетиламіні (50мл) перемішують на льодовій бані ванні. Суміш перемішують при кімнатній темперапротягом 5 хвилин. Додають по краплях 4-[4турі протягом 66 годин, виливають у льодяну воду (фенілметил)-1-піперазиніл]-бензоламін (500мл) і перемішують протягом 30 хвилин. Осад (0,37моль) у ДХМ (500мл). Суміш перемішують відокремлюють на фільтрі і розчиняють у ДХМ. протягом 3 годин. Органічний шар відокремлюють, Органічний розчин осушають, фільтрують і розпромивають водою, осушають, фільтрують і розчинник упарюють. Цю фракцію очищають на силічинник упарюють. Залишок тритурують у ДІПЕ. кагелі на скляному фільтрі (елюент: СН2СІ2/СН3ОН Осад відокремлюють на фільтрі та висушують, 99/1). Чисті фракції збирають і розчинник упарюодержуючи 99,8г N-[4-[4-(фенілметил)-1ють. Частину цієї фракції розмішують в етанолі. піперазиніл]феніл]-4'-(трифторметил)-[1,1’ 39 77946 40 біфеніл]-карбоксаміду (проміжна сполука 5, точка і висушують. Частин у (1г) цієї фракції очищають плавлення 180°С). хроматографією на колонці із силікагелем (елюПриклад А.6 ент: СН2СІ2/СН3ОН 99/1). Чисті фракції збирають і Суміш проміжної сполуки (5) (0,19моль) у мерозчинник упарюють. Залишок тритурують у ДІПЕ. танолі (600мл) та ТГФ (600мл) гідрують протягом Осад відокремлюють на фільтрі і висушують, оденочі з Pd/C 10% (3г) як каталізатором. Після поржуючи 0,84г N-[4-[4-(фенілметил)-1-піперазиніл] глинання водню (1 еквівалент), каталізатор відофеніл]-[1,1'-біфеніл]-2-карбоксаміду (проміжна кремлюють на фільтрі і фільтрат упарюють. Залисполука 9, точка плавлення 162°С). шок тритур ують у ДІПЕ. Осад відокремлюють на Приклад А.10 фільтрі, висушують та розчиняють у воді. Суміш Суміш проміжної сполуки (9) (0,1моль) у метапідлуговують Na2CO3, а потім екстрагують ДХМ. нолі (500мл) гідрують протягом двох годин з палаОрганічний шар відокремлюють, осушають, фільтдієм-на-вугіллі (10%) (10г) як каталізатором. Після рують і розчинник упарюють. Залишок тритур ують поглинання водню (1 еквівалент), каталізатор віу ДІПЕ. Осад відокремлюють на фільтрі і висушудокремлюють на фільтрі і фільтрат упарюють. Зають, одержуючи 40г N-[4-(1-піперазиніл)феніл]-4'лишок тритурують у 2-пропанолі. Осад відокрем(трифторметил)-[1,1’-()іфеніл]-2-карбоксамід (пролюють на фільтрі і висушують, одержуючи 29г Nміжна сполука 6). [4-(1-піперазиніл)феніл]-[1,1’-біфеніл]-2Приклад А.7 карбоксаміду (проміжна сполука 10, точка плавСуміш 4'-(трифторметил)-[1,1' -біфеніл]-2лення 176°С). карбонової кислоти (0,09моль) у ДХМ (500мл) та Приклад А.11 ДМФ (5мл) перемішують. Додають по краплях етаa) Суміш 4-(4-бромфеніл)-1-(фенілметил)-4ндіоїлдихлорид (0,09моль). Суміш перемішують піперидинолу (0,23моль) та Сu2О (2г) у водному протягом 1 години, одержуючи суміш (1). Суміш 4розчину аміаку (500мл) перемішують при 180°С [1-(фенілметил)-4-піперидиніл]-бензолаюну протягом дванадцяти годин. Суміш охолоджують, (0,046моль) у ДХМ (500мл) та триетиламіні (20мл) екстрагують ДХМ і промивають водою. Органічний перемішують на льодяній бані. Додають по крапшар осушають, відокремлюють на фільтрі та упалях суміш (1). С уміш перемішують та кип'ятять зі рюють, одержуючи 60г 4-[1,2,3,6-тетрагідро-1зворотним холодильником протягом ночі, потім (фенілметил)-4-піридиніл]бензоламіну. охолоджують і промивають водою. Органічний b) [1,1'-Біфеніл]-2-карбонілхлорид (0,05моль) шар відокремлюють, осушають, фільтрують і роздодають по краплях при перемішуванні до суміші чинник упарюють. Залишок очищають хроматог4-[1,2,3,6-тетрагідро-1-(фенілметил)-4рафією на колонці із силікагелем (елюент: піридиніл]бензоламіну (0,045моль) у ТГФ (300мл) СН2СІ2/СН3ОН 98/2). Чисті фракції збирають і розта триетиламіні (25мл). Суміш перемішують протячинник упарюють. Залишок тритурують у ДІПЕ. гом ночі. Розчинник упарюють. Залишок розчиняОсад відокремлюють на фільтрі і висушують, одеють у ДХМ. Органічний шар відокремлюють, проржуючи 5,6г Ν-[4-[1-(фенілметил)-4мивають, осушають, фільтрують і розчинник піперидиніл]феніл]-4'-трифторметил)-[1,1'упарюють. Залишок тритур ують у ДІПЕ. Осад відобіфеніл]-2-карбоксаміду (проміжна сполука 7, точкремлюють на фільтрі і висушують, одержуючи ка плавлення 134°С). 18,5г N-[4-[1,2,3,6-тетрагідро-1-(фенілметил)-4Приклад А.8 піридиніл]феніл]-[1,1'-біфеніл]-2-карбоксаміду Суміш проміжної сполуки (7) (0,025моль) у ме(проміжна сполука 11, точка плавлення 142°С). танолі (250мл) гідрують при 50°С протягом ночі з Приклад А.12 Pd/C 10% (2г) як каталізатором. Після поглинання Суміш a-феніл-4-піперидинацетонітрилу гідроводню (1 еквівалент), каталізатор відокремлюють хлориду (0,05молі), 1-фтор-4-нітробензолу на фільтрі і фільтрат упарюють. Залишок тритуру(0,06моль) та карбонату калію (0,15моль) у ДМФ ють у ДІПЕ. Осад відокремлюють на фільтрі і ви(200мл) перемішують при 50°С протягом чотирьох сушують. Частину (0,2г) цієї фракції очищають годин. Додають воду та ДІПЕ. Суміш о холоджують. високоефективною рідинною хроматографією на Осад відокремлюють на фільтрі, промивають воRP-18 (елюент: (NH4OAc 0,5%/CH 3CN дою та ДІПЕ і висушують, одержуючи 11,6г (±)-190/10)/CH3OH/CH3CN 75/25/0, 0/50/50, 0/0/100 і (4-нітрофеніл)-a-феніл-4-пiперидинацетонітрилу 75/25/0; колонка: Hyperprep RP 100Å 8мкм). Чисті (проміжна сполука 12, точка плавлення 118°С). фракції збирають і розчинник упарюють, одержуюПриклад А.13 чи 0,119г N-[4-(4-піперидиніл)феніл]-4'Суміш проміжної сполуки (12) (0,036моль) у (трифторметил)-[1,1'-біфеніл]-248% водному розчині бромистого водню (100мл) карбоксамідацетату (1:2) (проміжна сполука 8, перемішують та кип'ятять зі зворотним холодильточка плавлення 150°С). ником протягом трьох годин, охолоджують, вилиПриклад А.9 вають у воду і екстрагують двічі ДХМ. Органічний Перемішують суміш 4-[4-(фенілметил)-1шар відокремлюють, промивають водою, осушапіперазиніл]-бензоламіну (0,12моль) у ТГФ (300мл) ють, фільтрують і розчинник упарюють. Залишок та триетиламіні (50мл). Додають по краплях [1,1’тритур ують з 2-пропанолом. Осад відокремлюють біфеніл]-2-карбонілхлорид (0,12моль). Суміш пена фільтрі і висушують, одержуючи 9,5г (±)-1-(4ремішують протягом ночі. Розчинник упарюють. нітрофеніл)-а-феніл-4-піперидиноцтової кислоти Залишок розчиняють у ДХМ. Органічний шар відо(проміжна сполука 13, точка плавлення 216°С). кремлюють, промивають, осушають, фільтрують і Приклад А.14 розчинник упарюють. Залишок тритур ують у суміші Тіонілхлорид (0,01моль) додають до суміші ДІПЕ/2-пропанол. Осад відокремлюють на фільтрі проміжної сполуки (13) (0,0029моль) у ДХМ (10мл). 41 77946 42 Суміш перемішують протягом однієї хвилини, а суміш стр ушують протягом однієї години при кімпотім залишають на ніч. Розчинник упарюють. Занатній температурі. Додають триацетоксиборгідлишок розчиняють у ДХМ (10мл). Додають метарид (1,187г) і реакційну суміш стр ушують протягом нол (10мл). Суміш залишають постояти на чотири 48 годин при кімнатній температурі. Суміш фільтгодини, потім виливають до розчину NaHCO3 і ексрують, і залишок на фільтрі промивають три рази трагують ДХМ. Органічний шар відокремлюють, ДХМ, три рази (1:1) сумішшю ДХМ та метанолу, осушають, фільтрують і розчинник упарюють. Затричі спочатку метанолом, а потім ДХМ, раз сумілишок тритурують у гексан/ДІПЕ. Осад відокремшшю 10мл ДХМ та 2мл ДІПЕА, тричі спочатку люють на фільтрі і висушують, одержуючи 0,9г (±)ДХМ, а потім метанолом, і потім висушують, одержуючи кількісно смолу з термінальними етиламінометил-1-(4-нітрофеніл)-a-феніл-4групами, позначену як 1-а на схемі 1, яку викориспіперидинацетату (проміжна сполука 14, точка товують на наступній стадії реакції без додаткової плавлення 124°С). Приклад А.15 очистки. Приклад А.17 Суміш проміжної сполуки (14) (0,0022моль) у Проміжну сполуку (13) (0,0056моль) додають метанолі (100мл) гідрують при 50°С з паладієм-надо смоли за Прикладом А.16 (0,00112моль). Довугіллі (10%) (0,1г) як каталізатором у присутності дають розчин комплексу (Т-4)-гексафторфосфат( 14% розчину тіофену (0,1мл). Після поглинання водню (3 еквіваленти), каталізатор відокремлюють ) (1-гідрокси-1Н-бензотриазолато-О)три-1піролідиніл-фосфору(1+) (тут та надалі "РуBOР") на фільтрі та фільтрат упарюють. Залишок триту(2,9г) у ДХМ (15мл) та ДМФ (5мл). Додають трирують у гексані. Осад відокремлюють на фільтрі і етиламін (0,0112моль) і реакційну суміш стр ушувисушують, одержуючи 0,7г (±)-метил-1-(4ють протягом 24 годин при кімнатній температурі, амінофеніл)-a-феніл-4-піперидинацетату (проміжфільтрують та залишок на фільтрі промивають на сполука 15, точка плавлення 125°С). ДМФ (5´20мл), потім п'ять разів (1:1) сумішшю Приклади А.16-А.18 ДХМ та метанолу (20мл), п'ять разів (95:5) сумішДля полегшення розуміння цих прикладів, далі шю ДХМ з оцтовою кислотою (20мл), п'ять разів наведена схема (схема 1) одержання проміжних ДМФ (20мл) і тричі NMP (20мл), одержуючи кількісмол, починаючи з комерційно доступної смоли: сно смолу з термінальними нітрогрупами, познаСхема 1: чену II-а на схемі 1. Приклад А.18 Суміш смоли за Прикладом А. 17 (0,00112моль) та SnCl2·2H2O (0,0224моль) у NMP (20мл) струшують протягом шести днів при 55°С, потім охолоджують, фільтр ують та залишок на фільтрі промивають ДМФ (тричі), сумішшю 10мл ДМФ та 2мл ДІПЕА, після цього тричі спочатку ДХМ, а потім метанолом, і висушують, одержуючи кількісно смолу з термінальними аміногрупами, позначену як ІІІ-а на схемі 1. Приклад А.19 Триізопропіламін (0,011моль) додають смоли за Прикладом А.18 (0,00112моль) у ДХМ (10мл). Додають N,N-диметил-4-піридинамін (0,0003мол) у ДХМ (3мл). Додають розчин о-йодбензоїлхлориду (0,00336моль) у ДХМ (5мл), і реакційну суміш струшують протягом ночі при кімнатній температурі. Суміш фільтрують, залишок промивають три рази ДХМ, один раз сумішшю ДХМ (10мл) та ДІПЕА (2мл), тричі ДХМ, а потім метанолом, і висушують. Одержаний продукт обробляють бензиламіном (1мл) у ДХМ (10мл) та струшують протягом 60 годин при кімнатній температурі. Суміш фільтрують, промивають три рази ДХМ, один раз сумішшю ДХМ/метанол 50/50, тричі ДХМ, а потім метанолом, і висушують, одержуючи 0,00515г (46%) смоли, позначеної як IV-a на схемі 1. Приклад А.20 Повторюють процедуру за Прикладом А.16, замінняючи етиламін на н-пропіламін, одержуючи с a R позначає орто-йодфеніл, a Z позначає гідпри цьому кількісно смолу з термінальними нроксил чи хлор. пропіламіногрупами, позначену як l-b на схемі 1. Приклад А.16 Приклад А.21 Етиламін (0,0056моль; 2,8мл 2М розчину у Повторюють першу експериментальну процеТГФ, тобто Ra=а на схемі 1) додають до комерційдур у за Прикладом А.17, заміняючи смолу за Приної смоли Novabiochem 01-64-0261 (1г) у ДХМ кладом А. 16 на смолу за Прикладом А.20, одер(15мл). Додають ізопропоксид титану(ІV) (1,65мл) і жуючи при цьому кількісно смолу, позначену як ll-b 43 77946 44 на схемі 1. заміняючи смолу за Прикладом А.17 на смолу за Приклад А.22 Прикладом А.33, одержуючи при цьому кількісно Повторюють процедуру за Прикладом А.18, смолу, позначену як lll-е на схемі 1. заміняючи смолу за Прикладом А.17 на смолу за Приклад А.35 Прикладом А.21, одержуючи при цьому кількісно Повторюють процедуру за Прикладом А.19, смолу, позначену як lll-b на схемі 1. заміняючи смолу за Прикладом А.18 на смолу за Приклад А.23 Прикладом А.34, одержуючи при цьому смолу, Повторюють процедуру за Прикладом А.19, позначену як IV-e на схемі 1. заміняючи смолу за Прикладом А. 18 на смолу за Приклади А.36-А.38 Прикладом А.22, одержуючи при цьому смолу, Для того, щоб полегшити розуміння цих припозначену як IV-b на схемі 1. кладів, далі наведена інша схема (схема 2) одерПриклад А.24 жання проміжних смол, починаючи з комерційнo Повторюють процедуру за Прикладом А.16, доступної смоли: заміняючи етиламін на ізопропіламін, одержуючи Схема 2: при цьому кількісно смолу з термінальними ізопропіламіногрупами, позначену як l-е на схемі 1. Приклад А.25 Повторюють першу експериментальну процедур у за Прикладом А.17, заміняючи смолу за Прикладом А. 16 на смолу за Прикладом А.24, і одержуючи при цьому кількісно смолу, позначену як ll-е на схемі 1. Приклад А.26 Повторюють процедуру за Прикладом А.18, заміняючи смолу за Прикладом А.17 на смолу за Прикладом А.25, і одержуючи при цьому кількісно смолу, позначену як lll-с на схемі 1. Приклад А.27 Повторюють процедуру за Прикладом А.19, заміняючи смолу за Прикладом А.18 на смолу за Прикладом А.26, одержуючи при цьому смолу, позначену як IV-c на схемі 1. Приклад А.28 Повторюють процедуру за Прикладом А. 16, заміняючи етиламін на феніламін, одержуючи при Приклад А.36 цьому кількісно смолу з термінальними феніламіСуміш комерційної смоли Novabiochem 01-64ногрупами, позначену як Ι-d на схемі 1. 0261 (25,1г, 0,028моль), 4-броманіліну (24г, Приклад А.29 0,140моль) та ізопропоксиду титан у(ІV) (41мл, Повторюють першу експериментальну проце0,140моль) у ДХМ (400мл) обережно перемішують дур у за Прикладом А.17, заміняючи смолу за Припротягом однієї години при кімнатній температурі. кладом А. 16 на смолу за Прикладом А.28, і одерДодають триацетоксиборгідрид натрію (30г, жуючи при цьому кількісно смолу, позначену як Il-d 0,140моль) і реакційну суміш перемішують протяна схемі 1. гом ночі при кімнатній температурі. Додають метаПриклад А.30 нол (50мл) і суміш перемішують протягом однієї Повторюють процедуру за Прикладом А.18, години, потім фільтрують, промивають один раз заміняючи смолу за Прикладом А.17 на смолу за ДХМ, один раз метанолом, потім один раз ДХМ Прикладом А.29, одержуючи при цьому кількісно (200мл) + ДІПЕА (20мл), промивають тричі спочатсмолу, позначену як Ill-d на схемі 1. ку ДХМ, а потім метанолом, і висушують, одержуПриклад А.31 ючи 29,28г смоли, позначеної як V на схемі 2, яку Повторюють процедуру за Прикладом А.19, використовують на наступній стадії реакції без заміняючи смолу за Прикладом А.18 на смолу за додаткової очистки. Прикладом А.30, одержуючи при цьому смолу, Приклад А.37 позначену як IV-d на схемі 1. 4-Фенілбензойну кислоту (8,3г, 0,042моль) Приклад А.32 розчиняють у ДХМ (100мл). Повторюють процедуру за Прикладом А.16, Додають тіонілхлорид (10г, 0,084моль). Додазаміняючи етиламін на бензиламін, одержуючи ють ДМФ (10 крапель) і суміш перемішують та кипри цьому кількісно смолу з термінальними бензип'ятять зі зворотним холодильником протягом одламіногрупами, позначену як l-е на схемі 1. нієї години. Розчинник упарюють. Додають ДХМ Приклад А.33 (тричі по 50мл). Розчинник упарюють. Залишок Повторюють першу експериментальну процерозчиняють у ДХМ (50мл). Цей розчин додають до дур у за Прикладом А.17, заміняючи смолу за Присуміші смоли за Прикладом А.36 (14,64г, кладом А.16 на смолу за Прикладом А.32, одер0,0133моль), ДІПЕА (24мл, 0,140моль) та 4жуючи при цьому кількісно смолу, позначену як ll-е диметиламінопіридину (тут та надалі DMAP) (0,5г) на схемі 1. у ДХМ (150мл). Реакційну суміш стр ушують протяПриклад А.34 гом ночі при кімнатній температурі, а потім фільтПовторюють процедуру за Прикладом А.18, рують і залишок на фільтрі промивають 100мл 45 77946 46 ДМФ + 20мл ДІПЕА, потім метанолом, водою, зворотним холодильником протягом 1 години у ДХМ, метанолом, ДХМ та метанолом, і висушують, потоці азоту. Розчинник упарюють. Додають двічі одержуючи 15,73г смоли, позначеної як Vl-a на ДХМ (500мл). Розчинник двічі упарюють. Залишок схемі 2. розчиняють у ДХМ (200мл), а потім додають по Приклад А.38 краплях при 0°С до суміші 4-[1-(фенілметил)-44'-(Трифторметил)-2-біфенілкарбонову кислопіперидиніл]бензоламіну (0,25моль) та N-(1ту (14,64г, 0,042моль) розчиняють у ДХМ (100мл). метилетил)-2-пропанаміну (0,75моль) у ДХМ Додають ДМФ (1мл). Додають тіонілхлорид (10г, (800мл). Суміш доводять до кімнатної температу0,084моль) і суміш перемішують та кип'ятять зі ри, а потім перемішують при кімнатній температурі зворотним холодильником протягом однієї години. протягом ночі у потоці азоту. Суміш промивають Розчинник упарюють. Додають ДХМ (двічі по три рази водою (800мл). Органічний шар відокре50мл), а потім розчинник упарюють. Залишок розмлюють, осушають, фільтрують і розчинник упачиняють у ДХМ (50мл). Цей розчин додають до рюють, одержуючи 125г Ν-[4-[1-(фенілметил)-4суміші смоли за Прикладом А.36 (14,64г, піперидиніл]феніл]-[1,1'-біфеніл]-2-карбоксаміду 0,0133моль), ДІПЕА (24мл, 0,140моль) та DMAP (проміжна сполука 18). (0,5г) у ДХМ (150мл). Реакційну суміш стр ушують b) Суміш проміжної сполуки (18) (0,145моль) у протягом чотирьох годин при кімнатній температуметанолі (500мл) гідрують при 50°С протягом 48 рі, а потім фільтрують і залишок на фільтрі промигодин з Pd/C (10%, 3г) як каталізатором. Після повають 100мл ДМФ + 20мл ДІПЕА, потім промиваглинання водню (1 еквівалент), каталізатор відоють тричі спочатку ДХМ, а потім метанолом, і кремлюють на фільтрі та фільтрат упарюють. Зазрештою висушують. Цей продукт реакції ще раз лишок тритурують у ДІПЕ. Осад відокремлюють на вводять у реакцію з половиною вихідної кількості фільтрі і висушують, одержуючи 49г N-[4-(44'-(трифторметил)-2-біфенілкарбонової кислоти, піперидиніл)феніл]-[1,1'-біфеніл]-2-карбоксаміду тіонілхлориду, ДІПЕА та D MAP. Реакційну суміш (проміжна сполука 19). струшують протягом ночі при кімнатній температуПриклад А.41 рі, потім фільтрують, і осад на фільтрі струшують з a) 4'-(Трифторметил)-[1,1'-біфеніл]-2-карбоніл ДМФ + 20мл ДІПЕА, потім метанолом, водою, мехлорид (0,12моль) додають по краплях при перетанолом, ДХМ, метанолом, ДХМ та метанолом, і мішуванні до суміші 4-[1,2,3,6-тетрагідро-1потім висушують, одержуючи 17,48г смоли, позна(фенілметил)-4-піридиніл]бензоламіну (0,095моль) ченої як Vl-b на схемі 2. у ДХМ (300мл) та триетиламіні (50мл). Суміш пеПриклад А.39 ремішують протягом ночі, виливають у воду і потім а) Суміш 4'-(трифторметил)-[1,1'-біфеніл]-2перемішують протягом 30 хвилин. Органічний шар карбонової кислоти (0,09моль) у ДХМ (500мл) та відокремлюють, промивають, осушають, фільтруДМФ (5мл) перемішують. Додають по краплях етають і розчинник упарюють. Залишок тритурують у ндіоїлдихлорид (0,09моль). Суміш перемішують ДІПЕ. Осад відокремлюють на фільтрі і висушупротягом 1 години, одержуючи суміш (1). Суміш 4ють, одержуючи 43г N-[4-[1,2,3,6-тетрагідро-1[1-(фенілметил)-4-піперидиніл]бензоламіну гідро(фенілметил)-4-тридиніл]феніл]-4'хлориду (1:1) (0,046моль) у ДХМ (500мл) та три(трифторметил)-[1,1’-біфеніл]-2-карбоксаміду етиламіні (20мл) перемішують на льодяній бані. (проміжна сполука 20). Додають по краплях суміш (1). Суміш перемішують b) 1-Хлоретилхлорформіат (0,078моль) додата кип'ятять зі зворотним холодильником протягом ють по краплях при перемішуванні до суміші проночі, потім охолоджують і промивають водою. Орміжної сполуки (20) (0,039моль) у 1,2-дихлоретані ганічний шар відокремлюють, осушають, фільтру(500мл). Суміш перемішують протягом 30 хвилин, ють і розчинник упарюють. Залишок очищають а потім перемішують та кип'ятять зі зворотним хроматографією на колонці із силікагелем (елюхолодильником протягом ночі. Розчинник упарюент: СН2СІ2/СН3ОН 98/2). Чисті фракції збирають і ють. Додають метанол (500мл). Суміш перемішурозчинник упарюють. Залишок тритурують у ДІПЕ. ють та кип'ятять зі зворотним холодильником проОсад відокремлюють на фільтрі і висушують, одетягом ночі. Розчинник упарюють. Залишок ржуючи 5,6г N-[4-[1-(фенілметил)-4тритур ують у ДIПE. Осад відокремлюють на фільпіперидиніл]феніл]-4'-(трифторметил)-[1,1'трі і висушують, одержуючи 20,8г N-[4-(1,2,3,6біфеніл]-2-карбоксаміду (проміжна сполука 16, тетрагідро-4-піридиніл)феніл]-4'-(трифторметил)т.пл. 134°С). [1,1’-біфеніл]-2-карбоксаміду (проміжна сполука b) Суміш проміжної сполуки (16) (0,025моль) у 21). метанолі (250мл) гідрують при 50°С протягом ночі Приклад А.42 з Pd/C 10% (2г) як каталізатором. Після поглинанСуміш проміжної сполуки (11) (0,04моль) у 1,2ня водню (1 еквівалент), каталізатор відокремлюдихлоретані (200мл) перемішують на льодяній ють на фільтрі та фільтрат упарюють. Залишок бані. 1-Хлоретилхлорформіат (15мл) додають по тритур ують у ДІПЕ. Осад відокремлюють на фількраплях при температурі нижче 5°С. Суміш перетрі і висушують, одержуючи 7,7г N-[4-(4мішують протягом 1 години, а потім перемішують піперидиніл)феніл]-4'-(трифторметил)-[1,1'та кип'ятять зі зворотним холодильником протягом біфеніл]-2-карбоксаміду (проміжна сполука 17). ночі. Розчинник упарюють. Додають метанол Приклад А.40 (200мл). Суміш перемішують та кип'ятять зі звороа) [1,1'-Біфеніл]-2-карбонову кислоту тним холодильником протягом 2 годин. Розчинник (0,25моль) розчиняють у ДХМ (500мл) та ДМФ упарюють. Залишок тритур ують у ДІПЕ. Осад відо(0,5мл). Додають по краплях тіонілхлорид кремлюють на фільтрі і висушують, одерясуючи (0,51моль). Суміш перемішують та кип'ятять зі 16,7г N-(1,2,3,6-тетрагідро-4-піридиніл)феніл]-[1,1’ 47 77946 48 біфеніл]-2-карбоксаміду (проміжна сполука 22). Приклад А.43 a) Суміш проміжної сполуки (6) (0,0047моль) та ди-трет-бутилдикарбонату (0,0052моль) у ДХМ (50мл) перемішують при кімнатній температурі протягом 2 годин. Додають ДМФ (5мл). Суміш перемішують при кімнатній температурі протягом 3 годин. Розчинник упарюють. Залишок перемішують у ДІПЕ. Осад відокремлюють на фільтрі і висушують під вакуумом при 54°С, одержуючи 2,47г 1,1-диметилетилового складного ефіру 4-[4-[[[4'(трифторметил)[1,1’-біфеніл]-2іл]карбоніл]аміно]феніл]-1-піперазинкарбонової кислоти (проміжна сполука 23, т.пл. 204°С). b) NaH 60% у мінеральному маслі a) Суміш комерційної смоли Novabiochem 01(0,0056моль) обробляють гексаном; перемішують 64-0261 (0,180г, 0,002моль), 4-(1-трету потоці азоту та декантують. До залишку додають бутоксикарбонілпіперазин-4-іл)аніліну сухий ДМФ (25мл). Суспензію перемішують при ((0,001моль), розчинений у ДХМ (2мл)) та ізопрокімнатній температурі у потоці азоту. Додають по поксиду титану(ІV) (0,001моль) у ДХМ (3мл) струкраплях розчин проміжної сполуки (23) шують протягом 2 годин при кімнатній температу(0,00375моль) у сухому ДМФ (25мл). Суміш перері. Додають порціями триацетоксиборгідрид натрію мішують при кімнатній температурі у потоці азоту (0,001моль) і реакційну суміш стр ушують протягом протягом 2,5 годин. Додають по краплях розчин 20 годин при кімнатній температурі. Суміш фільтметилметансульфонату (0,0045моль) у сухому рують та залишок на фільтрі промивають тричі ДМФ (50мл). Суміш перемішують при кімнатній ДХМ (3 рази), метанолом (3 рази), а потім тричі температурі протягом 18 годин. Додають воду ДХМ, і потім висушують, одержуючи смолу (Vll-a). (150мл). Суміш екстрагують двічі ДХМ. Органічний шар відокремлюють, осушають, фільтрують і розчинник упарюють. Залишок перемішують у 60мл суміші гексан/ДІПЕ (3:1). Суміш перемішують та кип'ятять зі зворотним холодильником до утворення прозорого розчину, а потім доводять до кімнатної температури. Осад відокремлюють на фільтрі і висушують, одержуючи 1,6г 1,1-диметилетилового складного ефіру 4-[4-[метил[[4'b) 2-Бром-4-метилбензойну кислоту (трифторметил)[1,1’-біфеніл]-2(0,001моль) у ДХМ (5мл) з тіонілхлоридом іл]карбоніл]аміно]феніл]-1-піперазинкарбонової (0,013моль) перемішують та кип'ятять зі зворотним кислоти (проміжна сполука 24). холодильником протягом однієї години. Суміш с) Розчин трифторацетату (20мл) та ДХМ випаровують до сухого залишку у потоці азоту. (200мл) додають до проміжної сполуки (24) Знов додають ДХМ (5мл) з тіонілхлоридом (0,0024моль) і перемішують протягом 1 години 30 (0,013моль). Реакційну суміш перемішують та кихвилин при кімнатній температурі. Розчинник упап'ятять зі зворотним холодильником протягом одрюють. Додають ДХМ і розчинник знов упарюють, нієї години. Суміш випаровують до сухого залишку одержуючи 1,7г N-метил-N-[4-(1у потоці азоту і тричi додають ДХМ (3мл), а потім піперазиніл)феніл]-4'-(трифторметил)-[1,1’знов упарюють. Залишок розчиняють у ДХМ (3мл), біфеніл]-2-карбоксаміду (проміжна сполука 25). цей розчин додають до розчину смоли (Vll-a) Приклад А.44 (0,0002моль) у ДХМ (1мл). Додають DMAP Проміжні смоли, у яких Х2 та Х3 позначають N, (0,0002моль) у ДХМ (1мл). Додають ДІПЕА а Ζ1 та Ζ2 позначають -СН2СН2-, можуть бути оде(0,002моль) і реакційну суміш стр ушують протягом ржані, як зображено на схемі 3, починаючи з коме20 годин при кімнатній температурі. Реакційну сурційно доступної смоли: міш фільтрують і залишок на фільтрі промивають Схема 3: три рази ДХМ (3 рази), метанолом (3 рази) і потім тричі ДХМ, а потім висушують, одержуючи смолу (Vlll-a). с) Розчин 4-(трифторметил)бензолборонової 49 77946 50 кислоти (0,0016моль) у діоксані (3мл) додають до порціями трет-бутоксинатрій (0,190г). Суміш струсмоли (Vlll-a) (0,0002 моль), яку попередньо прошують протягом 1 години під азотом. Додають мивають діоксаном (5мл). Потім додають KОН Pd2(dba)3 (0,020г) у NMP (1мл) і реакційну суміш (0,0032моль у вигляді 2М розчину) і реакційну суструшують протягом 18 годин при 105°С, потім міш струшують протягом 30 хвилин при кімнатній охолоджують, фільтрують та залишок на фільтрі температурі під атмосферою азоту. Додають промивають тричі (ДМФ, а потім водою), потім РdСІ2(РРh3)2 (0,00004моль) у NMP (0,5мл) і реактричі метанолом, а потім ДХМ, одержуючи смолу ційну суміш струшують протягом 2 годин при 90°С. (XI). Знов додають PdCI2(PPh3)2 (0,00004моль) у NMP (0,5мл) і реакційну суміш струшують протягом 2 годин при 90°С. Суміш охолоджують, фільтрують та залишок на фільтрі промивають ДМФ (3 рази), водою (3 рази), ДМФ (3 рази), метанолом (3 рази), ДХМ (3 рази), метанолом (3 рази) та ДХМ (3 рази), а потім висушують, одержуючи залишок. Вказаний залишок перемішують у розчині TMSTf (1М) та 2,6лутидину (1,5М) у ДХМ (4мл) протягом 2 годин при кімнатній температурі, фільтрують та промивають ДХМ (3 рази) і метанолом (3 рази), та висушують, одержуючи смолу (ІХ-а). Приклад А.45 Смолу (XI) (0,0002моль) промивають ДХМ (4мл), потім відокремлюють на фільтрі, а потім розчиняють у ДХМ (5мл). Додають трихлорметилхлорформіат (0,001моль) і реакційну суміш струшують протягом 4 годин при кімнатній температурі. Суміш фільтрують, промивають три рази ДХМ, а потім висушують, одержуючи смолу (XII). Приклад А.45 а) Суспензію 4-(третбутоксикарбоніламіно)піперидину (15 еквівалентів) у NMP (2мл) додають до смоли (Vl-b) у NMP (1мл). Додають порціями [1,1'-бінафталін]-2,2'діїлбіс[дифеніл-фосфін (BINAP) (0,00011моль). Додають порціями трет-бутоксинатрій (15 еквівалентів). Реакційну суміш струшують протягом однієї години у потоці азоту. Додають Pd2(dba)3 (0,000022моль) у NMP (1мл) і реакційну суміш струшують протягом 18 годин при 105°С. Суміш охолоджують, фільтрують і залишок на фільтрі промивають тричі (ДМФ, а потім водою), а потім тричі метанолом, і потім ДХМ, одержуючи смолу (X). b) Смолу (X) (0,00011моль) струшують у N MP (2мл). Додають бромбензол (0,00165моль) у NMP (1мл). Додають порціями BINAP (0,068г). Додають Приклад А.46 a) 1-Етил-3-(3'диметиламінопропіл)карбодііміду гідрохлорид (EDCI) (0,096моль) додають при кімнатній температурі до суміші етилового складного ефіру 4-(4амінофеніл)-1-піперазинкарбонової кислоти (0,08моль), 2-йодбензойної кислоти (0,096моль) та 1-гідроксибензотриазолу (НОВТ) (0,096моль) у ДХМ (500мл). Суміш перемішують при кімнатній температурі протягом ночі. Додають воду. Суміш екстрагують ДХМ. Органічний шар відокремлюють, осушають, фільтрують і розчинник упарюють. Залишок розводять у ДІПЕ. Осад відокремлюють на фільтрі і висушують, одержуючи 39г етилового складного ефіру 4-[4-((2-йодбензоїл)аміно]феніл]1-піперазинкарбонової кислоти (проміжна сполука 27). b) Суміш проміжної сполуки (27) (0,041моль) та гідроксиду калію (0,41моль) в ізопропанолі (200мл) перемішують та кип'ятять зі зворотним холодильником протягом 3 годин і розчинник упарюють до сухого залишку. Додають воду. С уміш 51 77946 52 екстрагують ДХМ і розчинник упарюють, одержуюФлуорен-4-карбонову кислоту (0,00032моль) у чи 2-йод-N-[4-(1-піперазиніл)феніл]бензамід (про1мл 1/1 суміші ДХМ/N MP додають до РуВОР міжна сполука 28). (0,00064моль) у ДХМ (1мл). Цю суміш залишають стояти на 30 хвилин, а потім додають до смоли за c) Метиловий складний ефір aПрикладом А.34. Додають ДХМ (5мл), а потім ДІбромбензолоцтової кислоти (0,0123моль) додають ПЕА (0,00085моль). Реакційну суміш струшують при кімнатній температурі до суміші проміжної протягом 24 годин при кімнатній температурі, посполуки (28) (0,0123моль) та Na2CO3 (0,0123моль) у ДМФ (50мл). Суміш перемішують при кімнатній тім фільтрують, промивають 3 рази ДХМ, 3 рази метанолом, а потім ДХМ. Додають суміш температурі протягом 2 годин. Додають воду. СуТФОК/ДХМ/ТІС (5/93/2) (4мл) і суміш струшують міш перемішують при кімнатній температурі протяпротягом однієї години при кімнатній температурі. гом 15 хвилин. Осад фільтрують, промивають діеСуміш фільтрують, залишок на фільтрі промиватиловим ефіром і висушують, одержуючи 5,8г метилового складного ефіру 4-[4-[(2ють сумішшю ТФОК/ДХМ/ТІС (5/93/2) (2мл) та ДХМ (2мл). Фільтрат випаровують до сухого залишку йодбензоїл)аміно]феніл]-a-феніл-1при 50°С у слабкому потоці газоподібного азоту, піперазиноцтової кислоти (проміжна сполука 29). розчиняють у ДХМ (5мл) та ДМФ (1мл) та додають d) Суміш проміжної сполуки (29) (0,0036моль), смолу Novabiochem 01-64-0171, перемішуючи сутрибутил-2-фуранілстанану (0,029моль), міш при кімнатній температурі. Згодом, за годину, PdCI2(PPh3)2 (0,0007моль) та Na2CO3 (0,0576моль) додають смолу Argonaut Ρ/Ν 800277 (0,040г). Суу діоксані (30мл) перемішують та кип'ятять зі звоміш перемішують протягом чотирьох годин при ротним холодильником протягом 1 години. Додакімнатній температурі, фільтрують і фільтрат виють воду. Суміш екстрагують етилацетатом. Оргапаровують до сухого залишку при 50°С у потоці нічний шар відокремлюють, осушають, фільтр ують азоту, одержуючи 0,027г сполуки, позначеної №2 у і розчинник упарюють. Залишок очищають хромаТаблиці F-1 нижче. тографією на колонці з силікагелем (елюент: цикСполуки, позначені як №3-№11 у Таблиці F-1 логексан/етилацетат 80/20). Чисті фракції збиранижче, були одержані аналогічно, з використанням ють і розчинник упарюють, одержуючи метиловий такої саме експериментальної методики при заміні складний ефір 4-[4-[[2-(2флуорен-4-карбонової кислоти на відповідну реакфураніл)бензоїл]аміно]феніл]-a-феніл-1ційноздатну кислоту. піперазиноцтової кислоти (проміжна сполука 30, Приклад В.3 т.пл. 90°С). Флуорен-4-карбонову кислоту (0,00028моль) у е) Суміш проміжної сполуки (30) (0,0006моль) 1мл 1/1 суміші ДХМ/N MP додають до РуВОР та гідроксиду калію (0,006моль) н ізопропанолі (0,00028моль) у ДХМ (1мл). Цю суміш залишають (5мл) перемішують при кімнатній температурі пропостояти на 30 хвилин, а потім додають до смоли тягом ночі. Розчинник упарюють. Залишок розчиза Прикладом А.22. Додають ДХМ (5мл), а потім няють у ізопропанолі/НСІ 6Н та перетворюють на триетиламін (0,00057моль). Реакційну суміш струсіль хлористоводневої кислоти. Осад відокремлюшують протягом 20 годин при кімнатній темперають на фільтрі і висушують, одержуючи 0,31г 4-[4турі, потім фільтрують, промивають три рази ДХМ, [[2-(2-фураніл)бензоїл]аміно]феніл]-a-феніл-1і тричі спочатку метанолом, а потім ДХМ. Додають піперазиноцтової кислоти (проміжна сполука 31). 4мл суміші ТФОК/ДХМ/ТІС (5/93/2) та суміш струВ. Одержання поліарилкарбоксамідних сполук шують протягом однієї години при кімнатній темза винаходом пературі. Суміш фільтрують, залишок на фільтрі Приклад В.1 промивають сумішшю ТФОК/ДХМ/ТІС (2мл; 5/93/2) Суміш 4'-(трифторметил)-[1,1’-біфеніл]-2та ДХМ (1мл). Фільтрат випаровують до сухого карбонової кислоти (0,012моль) у ДХМ (100мл) та залишку при 50°С у слабкому потоці азоту. Цю ДМФ (8 крапель) перемішують. Додають етандіоїфракцію очищають високоефективною рідинною лдихлорид (0,012моль). Суміш перемішують прохроматографією на Hyperprep RP-C18 BDS (100г, тягом 2 годин, одержуючи суміш (І). Триетиламін 100Å, 8мкм; елюент: [(0,5% NH4OAc у H 2O)/CH 3CN (8мл) додають до суміші проміжної сполуки (4) 90/10)]/CH3OH/CH3CN - (0 хвилин) 75/25/0, (10 (0,005моль) у ДХМ (100мл). Суміш перемішують хвилин) 0/50/50, (16 хвилин) 0/0/100, (18.10-20.00 на бані з льодом та сіллю, одержуючи суміш (II). хвилин) 75/25/0). Чисті фракції збирають та органіСуміш (І) додають по краплях до суміші (II) і одерчний розчинник упарюють. Водний концентрат жану реакційну суміш перемішують та кип'ятять зі екстрагують сумішшю ДХМ/водний розчин K2СО3, зворотним холодильником протягом двох днів. а потім розділяють на ExtrelutÔ . Органічну фазу Розчинник упарюють. Залишок розчиняють у ДХМ. випаровують до сухого залишку під азотом при Органічний шар відокремлюють, промивають, 50°С. Залишок далі висушують під вакуумом при осушають, фільтрують і розчинник упарюють. За60°С, одержуючи 0,002г сполуки, позначеної №12 лишок очищають хроматографією на колонці із у Таблиці F-1 нижче. силікагелем (елюент: ДХМ/СН3ОН 99/1). Потрібні Сполук, позначені як №13-№20 У Таблиці F-1 фракції збирають і розчинник упарюють. Залишок нижче, були одержані аналогічно, з використанням тритур ують у ДІПЕ. Осад відокремлюють на фільтакої саме експериментальної методики та яри трі і висушують, одержуючи 2,99г N-[4-[4-[2-оксо-1заміні флуорен-4-карбонової кислоти на відповідну феніл-2-[(2,2,2-трифторетил)аміно]етил]-1реакційноздатну кислоту. піперазиніл]феніл]-4'-трифторметил)-[1,1’-біфеніл]Приклад В.4 2-карбоксаміду (точка плавлення 208°С), позначеФлуорен-4-карбонову кислоту (0,00015моль) у ного як сполука №1 у Таблиці F-1 нижче. 1мл 1/1 суміші ДХМ/N MP додають до РуВОР Приклад В.2 53 77946 54 (0,0003моль) у ДХМ (1мл). Цю суміш залишають здатну кислоту. постояти на 30 хвилин, а потім додають до смоли Приклад В.6 за Прикладом А.26. Додають ДХМ (5мл), а потім Суміш комерційної смоли Novabiochem 01-64ДІПЕА (0,00057моль). Реакційну суміш стр ушують 0261 (0,00011моль), проміжної сполуки (15) протягом 24 годин при кімнатній температурі, по(0,00061моль) та ізопропілтитанату (0,18мл) у ДХМ тім фільтрують, промивають три рази ДХМ, тричі (5мл) струшують протягом однієї години при кімнаспочатку метанолом, а потім ДХМ. Додають 4мл тній температурі. Додають триацетоксиборгідрид суміші ТФОК/ДХМ/ТІС (5/93/2) і суміш стр ушують (0,128г) та реакційну суміш струшують протягом 16 протягом однієї години при кімнатній температурі. годин при кімнатній температурі. Додають метанол Суміш фільтрують, залишок на фільтрі промива(1мл) та суміш струшують протягом 5 хвилин, поють 2мл суміші ТФОК/ДХМ/ТІС (5/93/2) та ДХМ тім фільтрують, промивають три рази ДХМ, мета(1мл). Фільтрат випаровують до сухого залишку нолом і висушують під вакуумом, одержуючи запри 50°С у слабкому потоці азоту. Цю фракцію лишок (1). очищають високоефективною рідинною хроматогТіонілхлорид (0,0020моль) додають до 4'рафією на Hyperprep C18 BDS (100г, 100Å, 8мкм; (трифторметил)-[1,1’-біфеніл]-2-карбонової кислоелюент: [(0,5% NH4OAc у H 2O)/CH 3CN ти (0,00055моль) у ДХМ (2мл) і суміш кип'ятять зі 90/10)]/CH3OH/CH3CN (0 хвилин) 75/25/0, (10 хвизворотним холодильником протягом 30 хвилин при лин) 0/50/50, (16 хвилин) 0/0/100, (18.10-20.00 хвиперемішуванні, а потім упарюють розчинник. Залин) 75/25/0). Чисті фракції збирають та органічлишок розчиняють у ДХМ (5мл) і розчин додають ний розчинник упарюють. Водний концентрат до одержаного, як описано вище, залишку (1). Доекстрагують сумішшю ДХМ/водний розчин карбодають ДІПЕА (0,0011моль), а потім N,N-диметил-4піридинамін (0,00008моль). Реакційну суміш струнату калію, а потім розділяють на ExtrelutÔ . Органічну фазу випаровують до сухого залишку під шують протягом 21 годин при кімнатній температурі, потім фільтрують, промивають три рази ДХМ, азотом при 50°С. Залишок висушують далі під вапотім три рази спочатку сумішшю 4% оцтової кискуумом при 60°С, одержуючи 0,002г сполуки, полоти/ДХМ, а потім ДХМ і зрештою тричі спочатку значеної №21 у Таблиці F-1 нижче. Сполуки, поДХМ, а потім метанолом, потім висушують та дозначені як №22-№28 у Таблиці F-1 нижче, були одержані аналогічно з використанням такої саме дають 4мл суміші ТФОК/ДХМ/ТІС (49/49/2). Цю суміш стр ушують протягом однієї години, фільтекспериментальної методики та при заміні флуорують, промивають 2мл суміші ТФОК/ДХМ/ТІС рен-4-карбонової кислоти на відповідну реакційно(49/49/2) та ДХМ (2мл). Фільтрат випаровують до здатну кислоту. сухого залишку азотом при 50°С. Додають ДХМ Приклад В.5 Флуорен-4-карбонову кислоту (0,00023моль) у (5мл), потім видаляють його у потоці азоту при 1мл 1/1 суміші ДХМ/N MP додають до РуВОР 50°С, одержуючи 0,080г метил-a-феніл-1-[4-[[[4'(0,00046моль) у ДХМ (1мл). Цю суміш залишають (трифторметил)-[1,1’-біфеніл]-2постояти на 30 хвилин, а потім додають до смоли іл]карбоніл]аміно]феніл]-4-піперидинацетату триза Прикладом А.30. Додають ДХМ (5мл), а потім фторацетату (1:1), позначеного як сполука №37 у ДІПЕА (0,00057моль). Реакційну суміш стр ушують Тиблиці F-1 нижче. протягом 24 годин при кімнатній температурі, поПриклад В.7 тім фільтрують, промивають три рази ДХМ, три 4'-(Трифторметил)-[1,1’-біфеніл]-2-карбонову рази спочатку метанолом, а потім ДХМ. Додають кислоту (0,00033моль) та РуВОР (0,171г) розчинясуміш ТФОК/ДХМ/ТІС (4мл; 75/23/2) і суміш струють у ДХМ (5мл). Цю суміш додають до смоли за шують протягом однієї години при кімнатній темПрикладом А.22 (0,00066моль). Додають ДІПЕА пературі. Суміш фільтрують, залишок на фільтрі (0,00066моль) та реакційну суміш струшують пропромивають 2мл суміші ТФОК/ДХМ/ТІС (75/23/2) тягом 48 годин при кімнатній температурі, фільтта ДХМ (2мл). Фільтрат випаровують до сухого рують і залишок промивають три рази ДМФ, потім залишку при 50°С у слабкому потоці азоту. Залитричі ДХМ та метанолом, і висушують, одержуючи шок розчиняють у ДХМ (5мл), а потім знов випарозалишок. Вказаний залишок та суміш вують до сухого залишку. Цю фракцію очищають ТФОК/ДХМ/ТІС (5:93:2) (4мл) струшують протягом високоефективною рідинною хроматографією на 30 хвилин при кімнатній температурі, потім фільтHyperprep RP-C18 BDS (100г, 100Å, 8мкм; елюент: рують, промивають сумішшю ТФОК/ДХМ/ТІС [(0,5% NH4OAc у H 2O)/CH 3CN (5/93/2) (2мл) та ДХМ (2мл), а потім фільтрати ви90/10)]/CH3OH/CH3CN (0 хвилин) 75/25/0, (10 хвипаровують до сухого залишку газоподібним азотом лин) 0/50/50, (16 хвилин) 0/0/100, (18.10-20.00 хвипри 50°С і потім далі висушують під вакуумом при лин) 75/25/0). Чисті фракції збирають та органіч60°С, одержуючи 0,030г N-[4-[4[2-oкco-1-феніл-2ний розчинник упарюють. Водний концентрат (пропіламіно)етил]-1-піперидиніл]феніл]-4'екстрагують сумішшю ДХМ/водний розчин карбо(трифторметил)-[1,1’-біфеніл]-2карбоксамідутрифторацетату (1:1), позначеного як нату калію, а потім розділяють на ExtrelutÔ . Оргасполука №38 у Таблиці F-1 нижче. нічну фазу випаровують до сухого залишку під Приклад В.8 азотом при 50°С. Залишок висушують далі під ваДМФ (0,5мл) додають до розчину 4'куумом при 60°С, одержуючи 0,0046г сполуки, по(трифторметил)-[1,1’-біфеніл]-2-карбонової кислозначеної №29 у Таблиці F-1 нижче. Сполуки, поти (0,014моль) у ДХМ (50мл) та тіонілхлориді значені як №30-№36 у Таблиці F-1 нижче, були (0,028моль). Суміш перемішують та кип'ятять зі одержані аналогічно з використанням такої саме зворотним холодильником протягом однієї години. експериментальної методики та при заміні флуоРозчинник упарюють. Двічі додають ДХМ (50мл) і рен-4-карбонової кислоти на відповідну реакційно 55 77946 56 розчинник упарюють. Залишок розчиняють у ДХМ протягом 30 хвилин. Додають етиламін (20мл) і цей розчин додають до суміші проміжної (0,0005моль) і реакційну суміш перемішують просполуки (15) (0,014моль) та ДІПЕА (0,028моль) у тягом ночі при 40°С. Реакційну суміш о холоджуДХМ (80мл). Суміш перемішують при кімнатній ють. Додають воду (2мл) і суміш перемішують протемпературі протягом трьох годин і промивають тягом 15 хвилин, потім фільтрують крізь ExtrelutÔ водою. Органічний шар осушають і розчинник упага бажану сполуку виділяють високоефективною рюють. Залишок кристалізують з 2-пропанолу. рідинною хроматографією, одержуючи 0,046г N-[4Осад відокремлюють на фільтрі і висушують, оде[4-[2-(етиламіно)-2-оксо-1-фенілетил]-1ржуючи 6,2г метил-a-феніл-1-[4-[[[4'піперазиніл|феніл]-4'-(трифторметил)-[1,1’(трифторметил)-[1,1'-біфеніл]-2біфеніл]-2-карбоксаміду (точка плавлення 123°С), іл]карбоніл]аміно]феніл]-4-піперидинацетату (точпозначеного як сполука №54 у Таблиці F-1 нижче. ка плавлення 151°С), позначеного як сполука №39 Сполуки, позначені як №55-№61 у Таблиці F-1 у Таблиці F-1 нижче. нижче були одержані аналогічно з використанням Приклад В.9 такої саме експериментальної методики та три Суміш проміжної сполуки (6) (0,023моль) та заміні етиламіну на відповідний реакційноздатний Na2CO3 (0,023моль) у ДМФ (150мл) перемішують. амін. Приклад В.13 Додають по краплях метил-a-бром-a-фенілацетат (0,023моль). Суміш перемішують протягом ночі. Суміш моногідрохлориду a-феніл-4-[4-[[[4'Розчинник упарюють. Залишок розчиняють у ДХМ. (трифторметил)-[1,1'-біфеніл]-2Органічний шар відокремлюють, промивають, іл]карбоніл]аміно]феніл]-1-піперазиноцтової кислоосушають, фільтрують і розчинник упарюють. Зати (0,011моль) у сірчаній кислоті (10мл) та пропалишок тритурують у ДІПЕ. Осад відокремлюють на нолі (150мл) перемішують та кип'ятять зі зворотним холодильником протягом ночі. Розчинник фільтрі і висушують, одержуючи 11,4г метил-aупарюють. Залишок розчиняють у ДХМ та промифеніл-4-[4-[[[4'-(трифторметил)-[1,1'-біфеніл]-2вають розчином Na2CO3. Органічний шар відокреіл]карбоніл]-аміно]феніл]-1-піперазинацетату, помлюють, промивають, осушають, фільтрують і значеного як сполука №40 у Таблиці F-1 нижче. Приклад В.10 розчинник упарюють. Залишок очищають хроматографією на колонці із силікагелем (елюент: Суміш проміжної сполуки (8) (0,018моль) та СН2СІ2/CH3CN 95/5). Чисті фракції збирають і розNа2СО3 (0,03моль) у ДМФ (100мл) перемішують. чинник упарюють. Залишок тритурують у ДІПЕ. Додають по краплях метил-a-бром-a-фенілацетат Осад відокремлюють на фільтрі і висушують, оде(0,025моль). Суміш перемішують протягом ночі. ржуючи 2,6г пропіл-феніл-4-[4-[[[4'Розчинник упарюють. Залишок розчиняють у ДХМ. (трифтормегил)-[1,1’-біфеніл]-2-іл]карбоніл]Органічний шар відокремлюють, промивають, аміно]феніл]-1-піперазинацетату (точка плавлення осушають, фільтрують і розчинник упарюють. За151°С), позначеного як сполука №62 у Таблиці F-1 лишок очищають хроматографією на колонці з нижче. силікагелем (елюент: СН2СІ2/СН3ОН 99/1). Чисті Приклад В.14 фракції збирають і розчинник упарюють, одержуюСуміш проміжної сполуки (6) (0,017моль) та чи 7,2г метилфеніл-4-[4-[[[4'-трифторметил)-[1,1’етил 2-фенілакрилат (0,017моль) у ДМФ (100мл) біфеніл]-2-іл]карбоніл]аміно]-феніл]-1перемішують протягом двох днів. Додають Na:CO3 піперидинацетату (точка плавлення 138°С), позна(1г). Суміш перемішують протягом двох днів. Розченого як сполука №41 у Таблиці F-1 нижче. чинник упарюють. Залишок розчиняють у ДХМ. Приклад В.11 Органічний шар відокремлюють, промивають, Метил-a-бром-a-фенілацетат (0,1моль) додаосушають, фільтрують і розчинник упарюють. Зають по краплях при перемішуванні до суміші пролишок тритурують у ДІПЕ. Осад відокремлюють на міжної сполуки (10) (0,07моль) та Na2CО3 (13г) у фільтрі і висушують, одержуючи 10,6г етилфенілДМФ (300мл). Суміш перемішують протягом ночі. 4-[4-[[[4'-(трифторметил)-[1,1'-біфеніл]-2Розчинник упарюють. Залишок кристалізують з іл]карбоніл]аміно]феніл]-1-піперазинпропаноату метанолу. Осад відокремлюють на фільтрі і вису(точка плавлення 195°С), позначеного як сполука шують, одержуючи 30,2г метил-4-[4-[([1,1’-біфеніл]№81 у Таблиці F-1 нижче. 2-ілкарбоніл)аміно] феніл]-a-феніл-1Приклад В.15 піперазинацетату (точка плавлення 125°С), познаa) Суміш сполуки №81 (0,016моль) у НСІ (36%) ченого як сполука №52 у Таблиці F-1 нижче. (100мл) перемішують та кип'ятять зі зворотним Приклад В.12 холодильником протягом восьми годин, потім охоа) Суміш сполуки (40) (0,19моль) у НСІ (36%) лоджують та фільтрують. Залишок тритур ують у 2(100мл) перемішують та кип'ятять зі зворотним пропанолі. Осад відокремлюють на фільтрі і висухолодильником протягом п'яти годин, а потім пешують. Частин у (0,2г) цієї фракції очищають висоремішують протягом ночі при кімнатній температукоефективною рідинною хроматографією на RPрі. Осад відокремлюють на фільтрі та тритур ують з 18, елюент: (NH4OAc 0,5%/CH 3CN 2-пропанолом, відокремлюють на фільтрі і вису90/10)/CH3OH/CH3CN 75/25/0, 0/50/50 та 75/25/0; шують, одержуючи 5г проміжної сполуки моногідколонка: HYPERPREP 8мкм). Чисті фракції збирарохлориду a-феніл-4-[4-[[[4'-(трифтормєтил)-[1,1’ють і розчинник упарюють. Залишок тритурують у біфеніл]-2ДІПЕ. Осад відокремлюють на фільтрі і висушуіл]карбоніл]аміно]феніл]піперазиноцтової кислоти. ють, одержуючи 0,12г проміжної сполуки 2-фенілb) Суміш проміжної сполуки, одержаної на 4-[4-[[[4'-(трифторметил)-[1,1'-біфеніл]-2стадії (а) (0,00016моль), РуВОР (0,00032моль) та іл]карбоніл]аміно]феніл]-1-піперазинпропанової триетиламіну (0,1мл) у ДХМ (5мл) перемішують 57 77946 58 кислоти (точка плавлення 202°С). PdCI2(PPh3)2 і реакційну суміш нагрівають протяb) Суміш проміжної сполуки, одержаної на гом 90 хвилин при 98°С. Суміш залишають охолостадії (а) (0,00016моль), РуВОР (0,00032моль) та нути до кімнатної температури, потім фільтрують і триетиламіну (0,1мл) у ДХМ (5мл) перемішують залишок на фільтрі промивають три рази діоксапротягом 30 хвилин. Додають пропіламін ном, тричі водою та тричі метанолом, потім три (0,0004моль) та реакційну суміш перемішують рази ДХМ, а потім метанолом, і зрештою тричі протягом ночі при 40°С. Реакційну суміш о холоДХМ. Додають F (4мл). Суміш струшують протягом джують, промивають водою (2мл), потім фільтру30 хвилин, фільтрують, промивають ТФОК/ДХМ/ТІС (2мл, 5/93/2) та ДХМ (2мл) і фільтють крізь ExtrelutÔ і розчинник з екстрактів упарати випаровують до сухого залишку потоком азорюють. Бажану сполуку виділяють ту. Зали шок очищають високоефективною рідинвисокоефективною рідинною хроматографією на ною хроматографією на Purospher Star RP-18 (20г, Hypеrprep RP-С18 BDS (100г, 100Å, 8мкм; елюент: [(0,5% NH4OAc у H 2O)/CH 3CN 5мкм; елюент: ((0,5% NH4OAc у H 2O)/CH 3CN 90/10)/CH3OH/CH3CN (0хв.) 75/25/0, (10.00хв.) 90/10)]/CH3OH/CH3CN (0хв.) 75/25/0, (10хв.) 0/50/50, (16.00хв.) 0/0/100, (18.10-20хв.) 75/25/0). 0/50/50, (16хв.) 0/0/100, (115.10-20.00хв.) 75/25/0). Потрібні фракції збирають та органічний розчинник Чисті фракції збирають і розчинник упарюють, упарюють. Водний концентрат екстрагують розчиодержуючи N-[4-[4-[3-оксо-2-феніл-3(пропіламіно)пропіл]-1-піперазиніл]феніл]-4'ном CH2CI2/Na2CO3. Екстракт очищають на (трифторметил)-[1,1’-біфеніл]-2-карбоксамід, поExtrelutÔ і органічну фазу випаровують до сухого значений як сполука №63 у Таблиці F-1 нижче. залишку потоком азоту. Залишок висушують під Сполуки, позначені №64-№67 у Таблиці F-1 вакуумом при 60°С, одержуючи 0,008г 2',4'нижче, були одержані аналогічно з використанням дифтор-N-[4-[4-[2-оксо-1-феніл-2такої саме експериментальної методики та при (пропіламіно)етил]-1-піперидиніл]феніл]-[1,1’заміні пропіламіну на відповідний реакційноздатбіфеніл]-2-карбоксаміду, позначеного як сполука ний амін. №84 у Таблиці F-1 нижче. Приклад В. 6 Сполука, позначена №68 у Таблиці F-1 нижче, а) Суміш сполуки №41 (0,012моль) у НСІ (36%) була одержана аг алогічно з використанням такої (100мл) перемішують та кип'ятять зі зворотним саме експериментальної методики. холодильником протягом шести годин, а потім Приклад В.18 перемішують протягом ночі при кімнатній темпераСмолу за Прикладом А.19 (0,0001моль) протурі. Осад відокремлюють на фільтрі та тритурумивають три рази діоксаном. Додають 1,4-діоксан ють з 2-пропанолом. Осад відокремлюють на фі(3мл). Додають 2-метилфенілборонову кислоту льтрі і висушують, одержуючи 6,2г проміжної (0,0008моль) у діоксані (1мл). Додають KОН (2М) (0,8мл). Суміш струшують протягом 30 хвилин під сполуки моногідрохлориду a-феніл-4-[4-[[[4'атмосферою аргону. Додають PdCI2(PPh3)2 (трифторметил)-[1,1'-біфеніл]-2(0,00002моль) у NMP (0,5мл). Суміш стр ушують іл]карбоніл]аміно]феніл]-1-піперидиноцтової киспротягом двох годин при 96°С. Знов додають лоти. РdСІ2(РРh3)2 у 0,5мл NMP і суміш нагрівають проb) Суміш проміжної сполуки, одержаної на тягом двох годин при 96°С. Суміш залишають охостадії (а) (0,00017моль), РуВОР (0,3г) та триетилонути до кімнатної температури, потім фільтруламіну (0,1мл) у ДХМ (5мл) перемішують протягом ють та залишок на фільтрі промивають три рази 30 хвилин. Додають етиламін (0,00017моль). РеаДМФ, тричі Н 2 О, тричі ДМФ, тричі метанолом, тричі кційну суміш перемішують протягом ночі при 40°С, ДХМ, тричі метанолом та тричі метанолом. Додаа потім охолоджують та додають воду (2мл). Сують суміш ТФОК/ДXМ/ТІС (4мл). Суміш струшують міш перемішують протягом однієї години, а потім протягом 60 хвилин при кімнатній температурі, фільтрують крізь ExtrelutÔ і фільтрат упарюють. фільтрують, промивають сумішшю ТФОК/ДХМ/ТІС Залишок очищають хроматографією на колонці із (2мл) та ДХМ (2мл), і фільтрати випаровують до силікагелем (елюент: СН2СІ2/СН3ОН 90/10). Фраксухого залишку потоком азоту. Залишок очищають ції продукту збирають і розчинник упарюють, одевисокоефективною рідинною хроматографією на ржуючи 0,010г N-[4-[1-[2-(етиламіно)-2-оксо-1Purospher Star RP-18 (20г, 5мкм; елюент: ((0,5% фенілетил]-4-піперидиніл]феніл]-4'NH4OAc у H2O)/CH3CN 90/10)/CH3OH/CH3CN (0хв.) (трифтормотил)-[1,1’-біфеніл]-2-карбоксаміду, по75/25/0, (10.00хв.) 0/50/50, (16.00хв.) 0/0/100, значеного як сполука №69 у Таблиці F-1 нижче. (18.10-20хв.) 75/25/0), одержуючи 0,004г N-[4-[4-[2Сполуки, позначені №70-№80 у Таблиці F-1 (етиламіно)-2-оксо-1-фенілетил]-1нижче, були одержані аналогічно з використанням піперидиніл]феніл]-2'-метил-[1,1'-біфеніл]-2такої саме експериментальної методики та при карбоксаміду, позначеного як сполука №85 у Табзаміні етиламіну на відповідний реакційноздатний лиці F-1 нижче. амін. Сполуки, позначені №86-№96 у Таблиці F-1 Приклад В.17 нижче, були одержані аналогічно з використанням Смолу за Прикладом А.23 (0,000045моль) такої саме експериментальної методики. промивають двічі діоксаном. Додають 1,4-діоксан Приклад В.19 (1мл). Додають 2,4-дифторфенілборонову кислоту Газоподібний аргон барботують крізь суміш (0,0004моль) у 1,4-діоксані (1мл). Додають KОН смоли за Прикладом А.23 (0,0001моль) та 3,5(2М) (0,25мл). Суміш струшують протягом 30 хвидихлорбензолборонової кислоти (0,0008моль) у лин під атмосферою аргону. Додають РаСІ2(РРh3)2 K2СО3 (2 М у Н2О) (0,0008моль) та 1,4-діоксані (0,00001моль) у NMP (0,250мл). Суміш перемішу(5мл) протягом п'яти хвилин. Додають ацетат пають протягом 90 хвилин при 98°С. Знов додають 59 77946 60 ладію(II) (0,00001моль) у діоксані (0,5мл) і реакційрат обробляють водним розчином карбонату нану суміш was нагрівають та струшують потягом трію а потім екстрагують ДХМ. Екстракт розділяшістнадцяти годин при 97°С, потім охолоджують, ють на ExtrelutÔ та фільтрати випаровують до фільтрують, промивають ДМФ (тричі), водою (трисухого залишку під азотом при 50°С, одержуючи чі), ДМФ (тричі), а потім три рази спочатку метано0,021г сполуки, позначеної як сполука 119 у Таблом і потім ДХМ. Додають суміш ТФОК/ДХМ/ТІС лиці F-1 нижче. (4мл, 5/93/2) і суміш струшують протягом однієї Сполуки, позначені №120-№128 у Таблиці F-1 години, а потім фільтрують. Додають суміш нижче, були одержані аналогічно, з використанням ТФОК/ДХМ/ТІС (2мл, 5/93/2). Суміш стр ушують такої саме експериментальної методики. протягом 10 хвилин, потім фільтрують, промиваПриклад В.21 ють ДХМ (3мл) та фільтрат випаровують до сухого Суміш проміжної сполуки (17) (0,019моль) та залишку під азотом при 50°С. Залишок очищають Na2CO3 (0,019моль) у ДМФ (125мл) перемішують методом ВЕРХ на Purospher Star RP-18-e (20г, при кімнатній температурі. Додають по краплях 5мкм; елюент: ((0,5% NH4OAc у H 2O)/CH 3CN метил-a-бром-a-фенілацетат (0,01907моль). Су90/10)/CH3OH/CH3CN (0хв.) 75/25/0, (10.00хв.) міш перемішують протягом 3 годин. Розчинник 0/50/50, (16.00хв.) 0/0/100, (18.10-20хв.) 75/25/0) упарюють. Залишок розводять у воді та ДХМ. ВіПотрібні фракції збирають і органічний розчинник докремлений органічний шар висушують, фільтупарюють. Водний концентрат екстрагують сумішрують і розчинник упарюють. Залишок очищають шю СН2СІ2/водний розчин K2СО3. Екстракт очихроматографією на колонці із силікагелем (елющають на ExtrelutÔ і органічну фазу випаровують ент: СН2СІ2/СН3ОН 100/0; 99.5/0,5). Чисті фракції до сухого залишку потоком азоту. Залишок висузбирають і розчинник упарюють, одержуючи залишують під вакуумом при 60°С, одержуючи 0,008г шок, який розділяють на його енантіомери мето3',5'-дихлор-N-|4-[4-[2-оксо-1-феніл-2дом високоефективної рідинної хроматографії на (пропіламіно)етил]-1-піперидиніл] феніл]-[1,1'Chiralpak AD (елюент: гексан/етанол 70/30). Потрібіфеніл]-2-карбоксаміду, позначеного як сполука бні фракції збирають і розчинник упарюють, одер№97 у Таблиці F-1 нижче. жуючи, після кристалізації з 2-пропанолу, сполуку Сполуки, позначені №№ 42-51, 53, 82, 83, та 20 (229), т.пл. 158°С, [a ] D = -28,86° (с=24,95мг/5мл 98-118 у Таблиці F-1 нижче, були одержані аналогічно з використанням такої саме експериментальу СН3ОН); і сполуку (230), т.пл. 160°С, ної методики. 20 [a] D = -27,69° (с=24,95мг/5мл у СН3ОН). Приклад В .20 a) Суспензію 2,2'-біс(дифенілфосфіно)-1,1’Приклад В 22 бінафтилу (0,086г, 0,00014моль) у NMP (1мл) доМетил-a-бром-a-фенілацетат (0,0010моль) у дають до смоли за Прикладом А.38 (0,2г, ΝΜΡ (1мл) додають до смоли (ІХ-а) (0,0002моль) у 0,00014моль) та тербутоксиду натрію (0,242г, ΝΜΡ (3мл). Додають Ν,Ν-діізопропілетиламін 0,00252моль). Додають гомопіперазин (0,126г, (0,0023моль) s реакційну суміш стр ушують протя0,0021моль) у NMP (2мл) і суміш перемішують під гом 48 годин при кімнатній температурі, потім фіаргоном. Додають льтрують та залишок на фільтрі промивають ДМФ трис(дибензиліденацетон)дипаладій (0,026г, (3 рази), водою (3 рази), ДМФ (3 рази), метанолом 0,000028моль) у NMP (1мл) і реакційну суміш (3 рази), ДХМ (3 рази), метанолом (3 рази) та ДХМ струшують протягом 19 годин при 105°С. Суміш (3 рази). Додають суміш ТФОК/ТІС/СН 2СІ2 (49/2/49) охолоджують, фільтрують і залишок на фільтрі (4мл), реакційну суміш струшують протягом 2 гопромивають ДМФ, водою, ДМФ (тричі), Н2О (тричі), дин при кімнатній температурі, потім фільтрують і ДМФ (тричі), СН3ОН (тричі), СН2СІ2 (тричі), СН3ОН знов додають суміш ТФОК/ТІС/СН 2СІ2 (49/2/49) (тричі) і NMP (два рази). Додають NMP (3мл). (4мл). Реакційну суміш стр ушують протягом ще 15 b) Метилбромфенілацетат (0,16г, 0,0007моль) хвилин, потім фільтрують та фільтрати випаровуу N MP (1мл) додають до продукту, одержаного на ють до сухого залишку під азотом. Залишок очистадії (а). Додають ДІПЕА (0,3мл) і суміш струшущають високоефективною рідинною хроматограють протягом 18 годин при кімнатній температурі. фією на Purospher Star RP-18 (20г, 5мкм; елюент: Суміш фільтрують, промивають ДМФ та водою, а ((0,5% NH4OAc у H 2O)/CH 3CN потім ДМФ (тричі), водою (тричі), ДМФ (тричі), ме90/10)/CH3CN/CH3OH (0хв.) 75/25/0, (10.00хв.) танолом (тричі), ДХМ (тричі), метанолом (тричі), 0/50/50, (16.00хв.) 0/0/100, (18.10-20хв.) 75/25/0). ДХМ (тричі). Потрібні фракції збирають та органічний розчинник Додають ТФОК/ТІС/СН 2СІ 2 (49/2/49) (4мл) і суупарюють. Водний концентрат обробляють водним міш струшують протягом однієї години при кімнатрозчином карбонату натрію, а потім екстрагують ній температурі. Суміш фільтрують та додають ще ДХМ. Екстракт розділяють на ExtrelutÔ і фільтрати ТФОК/ТІС/СН 2СІ2 (49/2/49) (1,5мл). Суміш струшувипаровують до сухого залишку під азотом при ють протягом 15 хвилин, фільтрують, промивають 50°С, одержуючи сполуку (184) у Таблиці F-1 нижДХМ (2мл), а потім фільтрати випаровують до суче. хого залишку під азотом. Залишок очищають висоПриклад В.23 коефективною рідинною хроматографією на Диметилаліловий спирт (0,00017моль) додаPurospher Star RP-18 (20г, 5мкм; елюент: ((0,5% ють до суміші моногідрохлориду a-феніл-4-[4-[[[4'NН4ОАс у H2O)/CH3CN 90/10)/CH3CN/CH3OH (0хв.) (трифторметил)-[1,1'-біфеніл]-275/25/0, (10.00хв.) -0/50/50, (16.00хв.) 0/0/100, іл]карбоніл]аміно]феніл]-1-піперидиноцтової кис(18.10-20хв.) 75/25/0). Потрібні фракції збирають і лоти (одержаної згідно з Прикладом В.16.а) органічний розчинник упарюють. Водний концент(0,000084моль) у ДХМ (4мл) та Ν,Ν
ДивитисяДодаткова інформація
Назва патенту англійськоюPolyarylcarboxamides useful as lipid lowering agents
Назва патенту російськоюПолиарилкарбоксамиды, пригодные для применения как липидснижающие агенты
МПК / Мітки
МПК: C07D 211/26, A61P 1/18, A61K 31/495, C07D 211/70, C07D 401/12, A61K 31/4545, C07D 211/82, C07D 295/14, C07D 243/08, C07D 213/56, C07D 295/15, A61K 31/4409, C07D 211/34, A61P 3/04, A61P 9/10, C07D 307/54, C07D 333/24, A61K 31/445, A61P 3/10, A61P 9/14, A61K 31/551, A61P 3/06, C07D 213/40, A61K 31/496, C07D 213/55
Мітки: поліарилкарбоксаміди, ліпідознижуючі, агенти, придатні, застосування
Код посилання
<a href="https://ua.patents.su/40-77946-poliarilkarboksamidi-pridatni-dlya-zastosuvannya-yak-lipidoznizhuyuchi-agenti.html" target="_blank" rel="follow" title="База патентів України">Поліарилкарбоксаміди, придатні для застосування як ліпідознижуючі агенти</a>
Попередній патент: Заміщені бензопірани як селективні агоністи b-рецепторів естрогенів
Наступний патент: Спосіб одержання солей біциклічних дикетонів
Випадковий патент: Спосіб отримання продукту структурованого на основі сиру кисломолочного нежирного












