Фармацевтична композиція та спосіб лікування і профілактики захворювань, спричинених або пов’язаних з віл
Номер патенту: 112842
Опубліковано: 10.11.2016
Формула / Реферат
1. Фармацевтична композиція, яка містить активовану потенційовану форму антитіла кроля до ВІЛ-протеїну, де ВІЛ-протеїн є протеїном р24 або ВІЛ-1 протеазою, що мають антиретровірусну активність, у суміші гомеопатичних розведень - С12, С30 та С50.
2. Фармацевтична композиція згідно з пунктом 1, де ВІЛ-ензим є ВІЛ-1 протеазою.
3. Фармацевтична композиція згідно з пунктом 1, де ВІЛ-протеїн є ВІЛ-капсидним протеїном p24.
4. Фармацевтична композиція згідно з пунктом 1, де активована потенційована форма антитіла до ВІЛ-протеїну знаходиться у формі суміші гомеопатичних розведень С12, С30 та С50, імпрегнованих у твердий носій.
5. Фармацевтична композиція згідно з пунктом 1, де активована потенційована форма антитіла до ВІЛ-протеїну є моноклональним, поліклональним або природним антитілом.
6. Фармацевтична композиція згідно з пунктом 5, де активована потенційована форма антитіла до ВІЛ-протеїну є поліклональним антитілом.
7. Фармацевтична композиція згідно з пунктом 1, де активована потенційована форма антитіла до ВІЛ-протеїну готується шляхом послідовних сотенних розведень у поєднанні зі струшуванням кожного розведення.
8. Метод лікування та профілактики захворювань, спричинених або пов'язаних з ВІЛ-інфекцією, який відрізняється тим, що вказаний метод полягає у застосуванні пацієнтом, за необхідності, активованої потенційованої форми антитіл до ВІЛ-протеїну, де ВІЛ-протеїн є протеїном р24 або ВІЛ-1 протеазою, що мають антиретровірусну активність, у суміші 3-х гомеопатичних розведень - С12, С30 та С50.
9. Метод згідно з пунктом 8, де вказане захворювання, спричинене або пов'язане з ВІЛ-інфекцією, є СНІДом.
10. Метод згідно з пунктом 8 або 9, де активовану потенційовану форму антитіл до ВІЛ-протеїну застосовують у вигляді фармацевтичної композиції у вигляді однієї або двох одиничних лікарських форм, який відрізняється тим, що кожна лікарська форма може прийматися від одного до чотирьох разів на день.
11. Фармацевтична композиція, яка застосовується для лікування ВІЛ-інфікованих пацієнтів, у тому числі пацієнтів зі СНІД, і пацієнтів із захворюваннями, викликаними ВІЛ, яка відрізняється тим, що вказана композиція містить активовану потенційовану форму антитіл до ВІЛ-протеїну, де ВІЛ-протеїн є протеїном р24 або ВІЛ-1 протеазою, що мають антиретровірусну активність, у суміші 3-х гомеопатичних розведень - С12, С30 та С50, приготовлену шляхом послідовного повторюваного розведення та багаторазового струшування кожного отриманого розчину та наступного їх змішування, або шляхом імпрегнування носія вказаним комбінованим розчином або розчинами окремо.
Текст
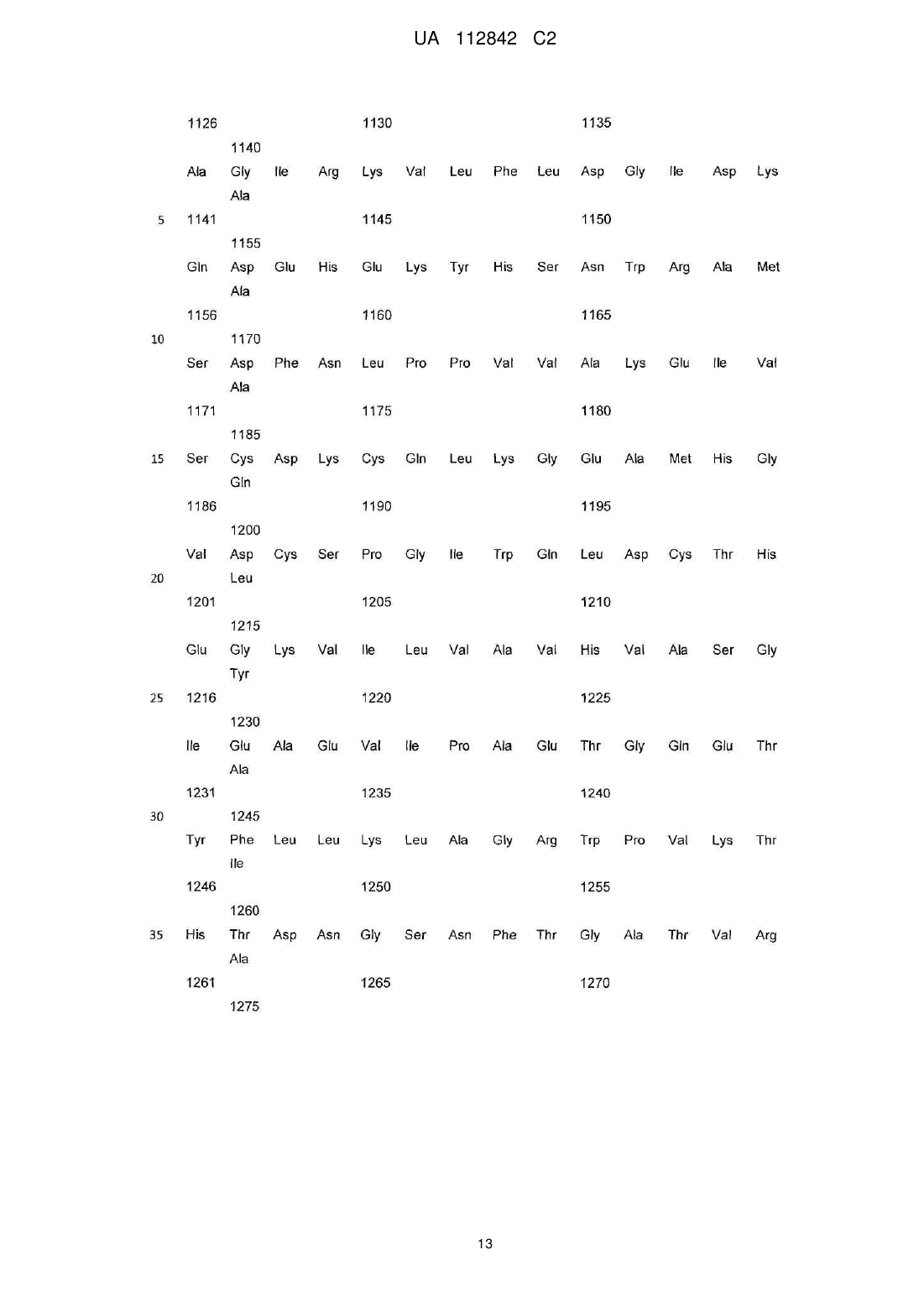
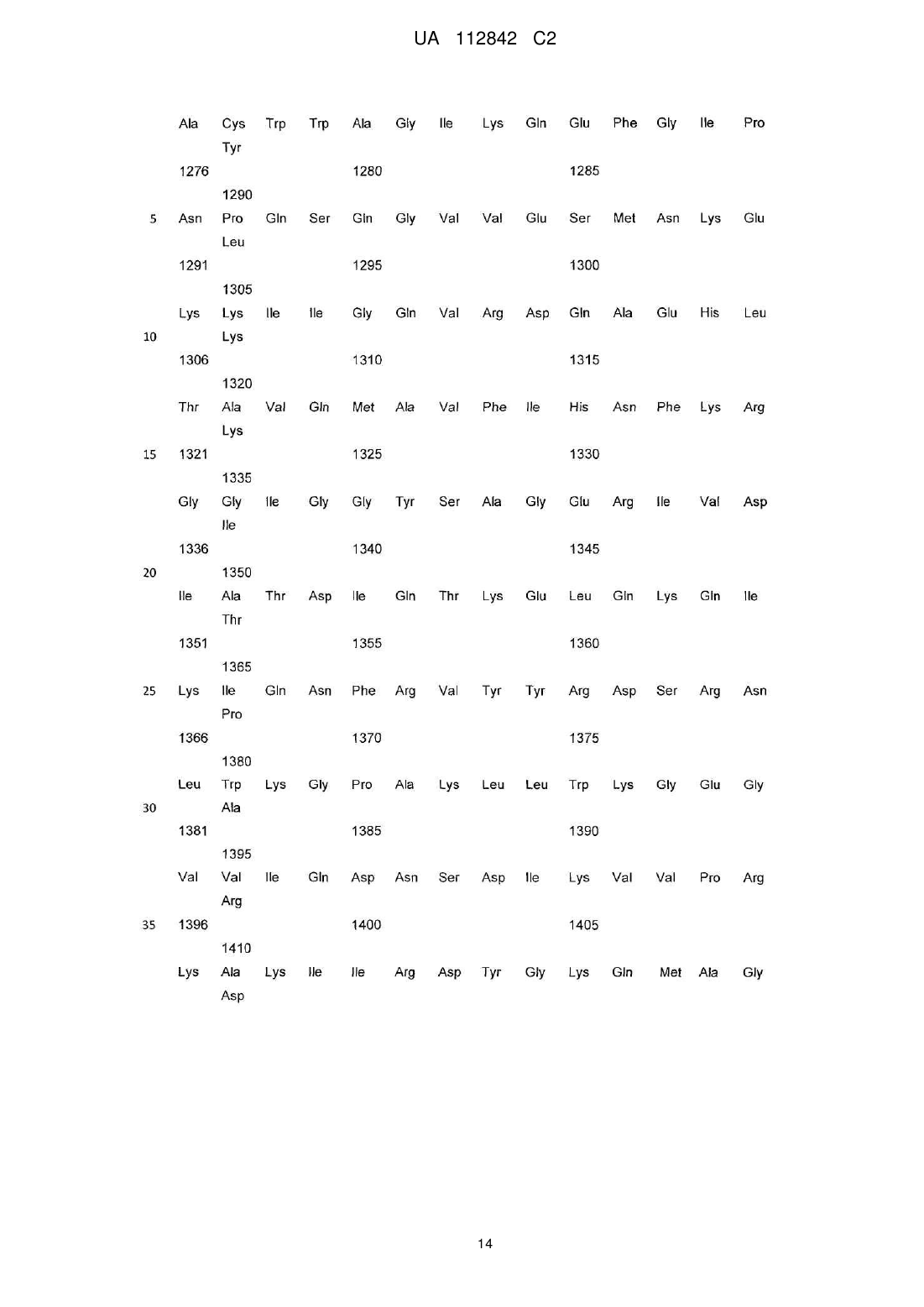
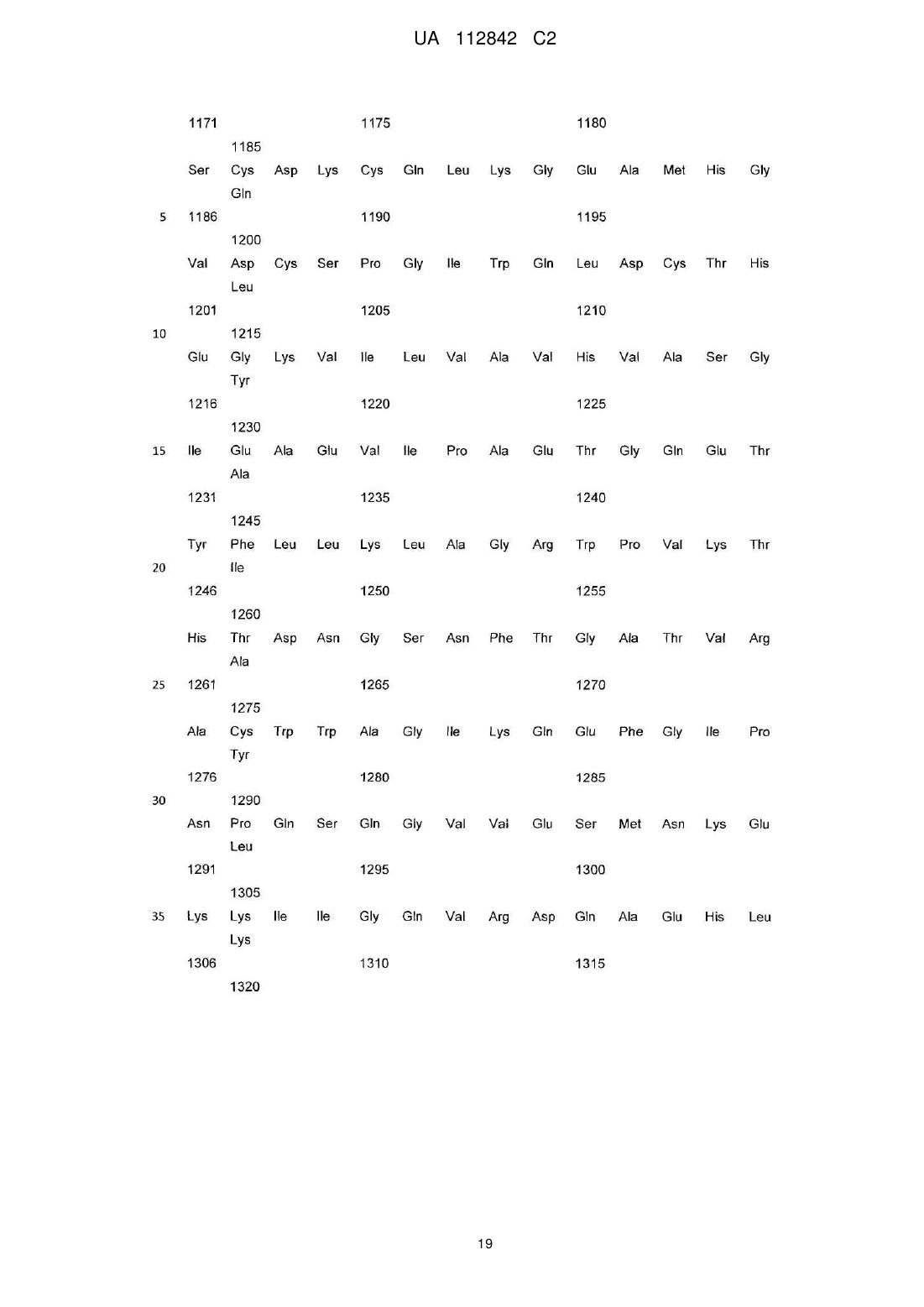
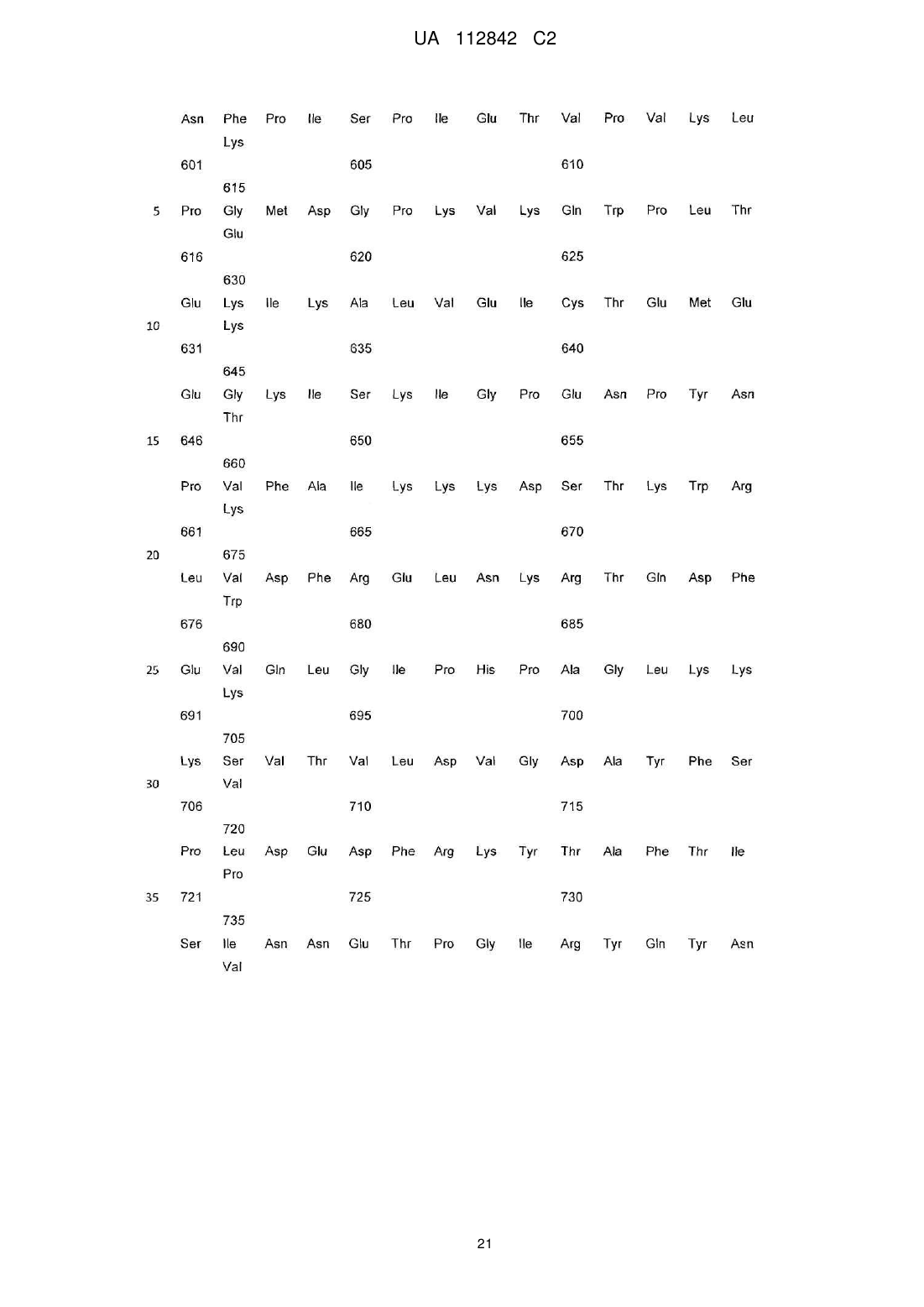
Реферат: Винахід стосується фармацевтичної композиції, яка містить активовану потенційовану форму антитіла до ВІЛ-протеїну, де ВІЛ-протеїн є протеїном р24 або ВІЛ-1 протеазою, що мають антиретровірусну активність, у суміші гомеопатичних розведень - С12, С30 та С50, а також її застосування при лікуванні та профілактиці захворювань, спричинених або пов'язаних з ВІЛінфекцією, включаючи СНІД. UA 112842 C2 (12) UA 112842 C2 UA 112842 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ТЕХНІКИ Даний винахід відноситься до фармацевтичної композиції та методу лікування та профілактики захворювань, спричинених або пов'язаних з ВІЛ. РІВЕНЬ ТЕХНІКИ Винахід відноситься до галузі медицини та використовується для лікування та профілактики захворювань, спричинених або пов'язаних з ВІЛ, включаючи СНІД. Лікування вірусних захворювань на основі наднизьких доз антитіл до інтерферону загальноприйняте в даній області (RU 2192888 C1, A61K39/395, 11/20/2002). Тим не менш, вказаний лікарський препарат може бути не досить ефективним стосовно лікування захворювань, пов'язаних з ВІЛ-інфекцією. Терапевтична дія сильно розведених (або наднизьких доз) антитіл, потенційованих відповідно до гомеопатичної технології (активована потенційована форма), була виявлена д-р Олегом Івановичем Епштейном. Наприклад, патент США № 7582294 представляє лікарський засіб для лікування доброякісної гіперплазії передміхурової залози, або простатиту шляхом використання гомеопатично активованої форми антитіл до простато-специфічного антигену (ПСА). Як виявилося, наднизькі дози антитіл до гамма-інтерферону корисні в лікуванні і профілактичному лікуванні захворювань вірусної етіології. Див. патент США № 7572441, посилання на який вказані в документі. Даний винахід відноситься до фармацевтичної композиції і методів його застосування в лікуванні і профілактиці захворювань, викликаних ВІЛ-інфекцією, або пов'язаних з ВІЛ, включаючи СНІД. Рішення існуючої проблеми представлене у вигляді фармацевтичної композиції для лікування і профілактики (попередження) захворювань або станів, викликаних ВІЛ-інфекцією, або пов'язаних з ВІЛ, яка включає в себе активовану потенційовану форму антитіл до ВІЛпротеїну. СТИСЛЕ ВИКЛАДЕННЯ ВИНАХОДУ Особливість винаходу полягає в його віднесенні до фармацевтичної композиції, яка включає в себе активовану потенційовану форму антитіл до ВІЛ-протеїну. Відповідно до одного аспекту, фармацевтична композиція включає твердий носій, де зазначена активована потенційована форма антитіл до ВІЛ-протеїну імпрегнується у вказаний твердий носій. Згідно з цим варіантом, фармацевтична композиція перебуває у формі таблеток. Відповідно до цього аспекту винаходу, ВІЛ-протеїн представляє собою Гаг-Пол поліпротеїн ВІЛ. Відповідно до іншого варіанту цього аспекту винаходу, ВІЛ-протеїн представляє собою ВІЛензим. Як правило, ВІЛ-ензим є ВІЛ-пептидазою. Передбачається, що ВІЛ-ензим представляє собою ВІЛ-інтегразу (ВІЛ-ендонуклеаза). Передбачається також, що ВІЛ-ензим є ВІЛревертазою. Згідно з іншим варіантом цього аспекту винаходу, ВІЛ-протеїн вважається ВІЛ-капсидним білком P24 (P24-протеїн). Також передбачається, що ВІЛ-протеїн є ВІЛ-матричним білком P17 (P17-протеїн). Як правило, фармацевтична композиція, що включає вказану активовану потенційовану форму антитіл до ВІЛ-протеїну, знаходиться у вигляді суміші гомеопатичних розведень C12, C30, і C200. Крім цього передбачається, що вказана суміш гомеопатичних розведень C12, C30, C200 імпрегнується у твердий носій. Активована потенційована форма антитіл до ВІЛ-протеїну може бути у вигляді моноклональних, поліклональних або природних антитіл. Однак, передбачається, що активована потенційована форма антитіл до ВІЛ-протеїну є поліклональним антитілом. Винахід представляє активовані потенційовані форми антитіл до антигену(ів), який характеризується послідовностями, описаними у специфікації та заявленими у формулі винаходу. Відповідно до одного варіанту, фармацевтична композиція включає в себе активовану потенційовану форму антитіла до ВІЛ-протеїну, яка готується шляхом послідовних сотенних розведень в поєднанні зі струшуванням кожного розведення. Вертикальне струшування розглядається як переважне. Згідно з іншим аспектом, винахід відноситься до методу лікування і профілактики захворювань, викликаних ВІЛ-інфекцією або пов'язаних з ВІЛ, включаючи СНІД, при чому вказаний метод включає введення пацієнту, якщо він цього потребує, активованої потенційованої форми антитіла до ВІЛ-протеїну. Як правило, активована потенційована форма антитіла до ВІЛ-протеїну застосовується у вигляді фармацевтичної композиції. Відповідно до іншого варіанту, фармацевтична композиція приймається у формі твердої лікарської форми для перорального застосування, яка містить фармацевтично прийнятний носій, а вказана активована потенційована форма антитіла до ВІЛ-протеїну імпрегнується на 1 UA 112842 C2 5 10 15 20 25 30 35 40 45 50 55 60 такий носій. У вказаному варіанті, така тверда лікарська форма для перорального застосування знаходиться у вигляді таблетки. Передбачаються інші варіанти та аспекти. У відповідності з аспектом винаходу, фармацевтична композиція може прийматися у дозі від однієї до двох одиничних лікарських форм, кожна з яких застосовується від одного до чотирьох раз на день. Згідно з іншим варіантом, фармацевтичну композицію приймають двічі на день, кожен прийом складається з двох лікарських форм для перорального застосування. У відповідності з іншим варіантом, фармацевтична композиція може прийматися у дозі від однієї до двох одиничних лікарських форм, кожна з яких приймається двічі на день. Всі варіанти, описані в зв'язку з композицією винаходу, можуть використовуватися разом з методами винаходу. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Головна ідея винаходу визначається з посиланням на додані формули винаходу. Що стосується формули винаходу, далі по тексту подається глосарій, в якому пояснюються відповідні визначення. Термін "антитіло" в контексті вказаного документа означає імуноглобулін, який специфічно приєднується до відповідної просторової і полярної структури іншої молекули, і тим самим вважається її доповненням. За визначеннями, вказаними в формулах винаходу, антитіла можуть включати в себе повний імуноглобулін або його фрагмент, можуть бути природними, поліклональними або моноклональними, і можуть включати в себе різні класи і ізотипи, наприклад, IgA, IgD, IgE, IgG1, IgG2a, IgG2b і IgG3, IgM, і т.д. Їх фрагменти можуть включати Fab, Fv і F (аb') 2, Fab', та ін. Однина "антитіло" включає в себе множину "антитіла". Термін "активована-потенційована форма" або "потенційована форма", відповідно, використовується по відношенню до антитіл для позначення продукту гомеопатичного потенціювання будь-якого вихідного розчину антитіл. "Гомеопатичне потенціювання" позначає використання методів гомеопатії для надання вихідному розчину відповідної речовини гомеопатичної потенції. Не обмежуючись наступним, "гомеопатичне потенціювання" може включати в себе багаторазові послідовні розведення у поєднанні із зовнішньою дією, особливо із (механічним) струшуванням. Іншими словами, у відповідності з гомеопатичними методами вихідний розчин антитіл піддається послідовним повторюваним розведенням і багаторазовому вертикальному струшуванню кожного отриманого розчину. Бажана концентрація вихідного розчину антитіл в розчиннику (як правило, це вода або водно-спиртовий розчин), складає від 0,5 до близько 5,0 мг/мл. Переважний порядок підготовки кожного компонента, тобто розчину антитіл, полягає у використанні суміші з трьох водних або водно-спиртових розведень 12 30 первинного матричного розчину (материнська тинктура) антитіл, який розводять 100 , 100 і 200 100 разів, відповідно, що еквівалентно сотенним гомеопатичним розведенням (C12, C30 і C200), або у використанні суміші з трьох водних або водно-спиртових розведень первинного 12 30 50 матричного розчину (материнська тинктура) антитіл, який розводять 100 , 100 і 100 разів, відповідно, що еквівалентно сотенним гомеопатичним розведенням (C12, C30 і C50). Приклади гомеопатичного потенціювання описуються в патентах США № 7572441 та № 7582294, посилання на які в повному обсязі і в зазначених цілях вказуються в цьому документі. В той час як термін "активована потенційована форма" використовується у формулі винаходу, термін "наднизькі дози" застосовується в прикладах. Термін "наднизькі дози" став широко застосовуваним терміном в області дослідження і використання гомеопатичних розведень і потенційованих форм речовин. Термін "наднизька доза" або "наднизькі дози" розглядається, в першу чергу, як термін, що погоджується та асоціюється з терміном "активована потенційована форма", що використовується в формулі винаходу. Іншими словами, антитіло перебуває у "активованій потенційованій" формі за наявності трьох факторів. По-перше, "активована потенційована" форма антитіла являється продуктом підготовчих операцій, загальноприйнятих в гомеопатії. По-друге, "активована потенційована" форма антитіла повинна мати біологічну активність, що визначається загальноприйнятими в сучасній фармакології методами. По-третє, біологічна активність, яка проявляється в "активованій потенційованій" формі антитіла, не може пояснюватися присутністю молекулярної форми антитіла в кінцевому продукті гомеопатичного процесу. Наприклад, активовану потенційовану форму антитіл можна отримати шляхом послідовних багаторазових розведень початкового, ізольованого антитіла в молекулярній формі у поєднанні із зовнішнім впливом, наприклад, механічним струшуванням. Зовнішній вплив на зменшення концентрації також може здійснюватися, наприклад, шляхом ультразвукових, електромагнітних та інших фізичних факторів. В. Швабе "Гомеопатичні лікарські засоби", М., 1967, патенти США № 7229648 та № 4311897, посилання на які містяться в цьому документі в повному обсязі і в заявлених цілях, описує процеси, які в гомеопатії вважаються загальноприйнятими методами 2 UA 112842 C2 5 10 15 20 25 30 35 40 45 50 55 60 гомеопатичного потенціювання. Ця процедура призводить до рівномірного зменшення молекулярної концентрації вихідної молекулярної форми антитіла. Процедуру необхідно повторювати до отримання бажаної гомеопатичної потенції. Що стосується окремих антитіл, необхідна гомеопатична потенція може визначатися шляхом біологічного тестування проміжних розведень в необхідній фармакологічній моделі. Не обмежуючись нижче вказаним, "гомеопатичне потенціювання" може включати, наприклад, повторювані послідовні розведення в поєднанні з зовнішнім впливом, особливо вертикальним (механічним) струшуванням. Іншими словами, у відповідності з гомеопатичними методами вихідний розчин антитіл піддається послідовним повторюваним розведенням і багаторазовому вертикальному струшуванню кожного отриманого розчину. Бажана концентрація вихідного розчину антитіл в розчиннику (як правило, це вода або водно-спиртовий розчин), складає від 0,5 до близько 5,0 мг/мл. Переважний порядок підготовки кожного компонента, тобто розчину антитіл, полягає у використанні суміші з трьох водних або водно-спиртових розведень первинного матричного 12 30 200 розчину (материнська тинктура) антитіл, який розводять 100 , 100 і 100 разів, відповідно, що еквівалентно сотенним гомеопатичним розведенням C12, C30 і C200, або суміші з трьох водних або водно-спиртових розведень первинного матричного розчину (материнська тинктура) 12 30 50 антитіл, який розводять 100 , 100 і 100 разів, відповідно, що еквівалентно сотенним гомеопатичним розведенням C12, C30 і C50. Приклади отримання бажаної потенції описуються в патентах США № 7229648 та № 4311897, посилання на які в повному обсязі і в зазначених цілях вказуються в цьому документі. Процедура, яка застосовується до "активованої потенційованої" форми антитіл, більш детально описується далі в документі. Застосування гомеопатичних препаратів в лікуванні людини породило величезну кількість суперечок. Хоча даний винахід ґрунтується на прийнятих гомеопатичних процесах з отримання "активованої потенційованої" форми антитіл, для простеження його ефективності не слід покладатися виключно на гомеопатію, що застосовується по відношенню до людини. На схваленій фармакологічній моделі дослідником було несподівано виявлено і наочно продемонстровано, що розчинник, отриманий в кінцевому рахунку шляхом декількох послідовних розведень початкової молекулярної форми антитіла, характеризується остаточною активністю, що немає нічого спільного з молекулярною формою антитіла в цільовому розведенні. "Активована потенційована" форма антитіл, представлена в дослідженні, пройшла тестування на біологічну активність у відношенні схвалених фармакологічних моделей активності у відповідних експериментальних умовах, або в природних умовах на відповідних моделях тварин. Експерименти, виконані та описані нижче в документі, представляють докази наявності біологічної активності у таких моделях. Клінічні дослідження, проведені на людині, також описані нижче в документі, зокрема свідчать, що активність, яка спостерігалася в моделі тварини, може застосовуватися в лікуванні людини. Дослідження, проведені на людині, також свідчать про здатність "активованої потенційованої" форми, мова про яку йде в цьому документі, лікувати окремі захворювання або порушення стану людини, які у медицині прийнято вважати патологічними станами; вона пов'язана з більш високою противірусною і, можливо, імунотропною дією, посиленням активації лімфоцитів CD4 і збагаченням кількості рецепторів на поверхні клітин CD4. Таким чином, втрата вірусного навантаження спостерігається в результаті репресії ВІЛ, що проникає в клітини (виявляється в зміні функціональної активності CD4 рецепторів, в результаті чого ВІЛ проникає в клітини); пригнічення реплікації ВІЛ всередині клітин, активація процесу транскрипції мРНК противірусного білка (протеїн кіназа ПКР, олігоаденилат сінтетаза, аденозим дезаміназа), Mx, ГКГ протеїну I і II і т.д.). Таким чином, заявлений лікарський препарат має високу профілактичну ефективність по відношенню до ВІЛ-інфекції, запобігаючи зараженню клітин ВІЛ-інфекцією та її внутрішньоклітинною реплікацією. Він може використовуватися як для ефективного лікування, так і для профілактики хронічних вірусних захворювань, в тому числі для профілактики ВІЛ-інфекції. Крім того, вказана, "активована потенційована" форма антитіла включає в себе лише ті розчини або тверді препарати, біологічна активність яких не пояснюється наявністю молекулярної форми антитіла, що залишилася від первісного, вихідного розчину. Іншими словами, в той час як передбачається, що "активована потенційована" форма антитіла може містити сліди початкової молекулярної форми антитіл, жоден фахівець в даній області не може приписувати біологічну активність, яка спостерігалася в прийнятій фармакологічній моделі, решті молекулярних форм антитіл з будь-яким ступенем достовірності у зв'язку з вкрай низьким рівнем концентрації молекулярних форм антитіл, що залишилися після послідовних розведень. Хоча винахід не обмежується будь-якою конкретною теорією, біологічна активність "активованої потенційованої" форми антитіла цього винаходу не пов'язана з початковою молекулярною 3 UA 112842 C2 5 10 15 20 25 30 35 40 45 50 55 60 формою антитіла. Найкращою є "активована потенційована" форма антитіла в рідкому або твердому вигляді, в якому концентрація вихідної молекулярної форми антитіла нижча межі її виявлення прийнятими аналітичними методами, такими, наприклад, як капілярний електрофорез та високоефективна рідинна хроматографія. Найкращою є "активована потенційована" форма антитіла в рідкому або твердому вигляді, в якому концентрація вихідної молекулярної форми антитіла нижча числа Авогадро. У фармакології молекулярних форм терапевтичних речовин, звичайною практикою є створення кривої залежності дози-відповіді, в якій рівень фармакологічної відповіді вказується напроти концентрації активного препарату, який вводять об'єкту дослідження, або перевіряють в лабораторних умовах. Мінімальна кількість препарату, за якої відчутна будь-яка терапевтична відповідь, відома як порогова доза. Передбачається, що у вказаній біологічній моделі "активована потенційована" форма антитіл містить молекулярне антитіло, якщо воно існує, в концентрації, нижче порогової дози для молекулярної форми антитіла. Даний винахід відноситься до фармацевтичної композиції, яка включає в себе активовану потенційовану форму антитіла до ВІЛ-протеїну, приготовленої відповідно до гомеопатичної технології потенціювання шляхом повторюваних, відповідних розведень і проміжної зовнішньої дії струшування, про що більш докладно говориться нижче в документі. Фармацевтична композиція винаходу особливо корисна для лікування та профілактики захворювань, викликаних ВІЛ-інфекцією або пов'язаних з ВІЛ, включаючи СНІД. Як показано на прикладах, фармацевтична композиція винаходу характеризується несподіваною терапевтичною дією, яка проявляється, зокрема, в терапевтичній ефективності при лікуванні захворювань, викликаних ВІЛ-інфекцією або пов'язаних з ВІЛ. Фармацевтична композиція винаходу розширює вибір препаратів для профілактичного лікування захворювань, викликаних ВІЛ-інфекцією або пов'язаних з ВІЛ, включаючи СНІД. Згідно з цим аспектом винаходу фармацевтична композиція може бути як в рідкому, так і у твердому вигляді. Активована потенційована форма антитіл, включених в фармацевтичну композицію, отримується з початкових молекулярних форм антитіл за допомогою загальноприйнятого в гомеопатії процесу. Початкові антитіла можуть бути моноклональними або поліклональними антитілами, приготовленими у відповідності з відомими методами, про що говориться, наприклад, в Імунологічні методи / Г. Фрімель, М. - "Медицина", 1987. - C. 9-33; "Антитіла людини. Моноклональні і рекомбінантні антитіла, через 30 років" за Лаффлі Є., Содоєр Р. - 2005 - Т. 14. - № 1-2. - С.33-55, посилання на які містяться в документі. Моноклональні антитіла можна отримати, наприклад, шляхом гібридомної технології. Початковий етап процесу включає імунізацію, що ґрунтується на принципах, розроблених в ході підготовки поліклональних імунних сироваток. Подальші етапи робіт пов'язані з отриманням гібридних клітин, які відповідають за створення клонів антитіл з ідентичною специфічністю. Їх ізоляція забезпечується використанням тих же методів, що і у випадку приготування поліклональних імунних сироваток. Поліклональні антитіла можна отримати за допомогою активної імунізації тварин. З цією метою, окремим тваринам (наприклад, кроликам) вводять серії ін'єкцій відповідного антигену (ВІЛ-протеїн). Імунна система тварин генерує відповідні антитіла, які збираються з тварин за відомою методикою. Ця процедура дозволяє приготувати моно специфічну сироватку, багату на антитіла. При бажанні, сироватка, що містить антитіла, очищується, наприклад, з використанням афінної хроматографії, фракціонування з випаданням солі, або іонно-обмінної хроматографії. Сироватка, багата на антитіла, отримана в результаті очищення, може використовуватися в якості вихідного матеріалу для підготовки активованої потенційованої форми антитіл. Бажана концентрація початкового розчину антитіл в розчиннику (переважно це водна або водно-етилспиртова суміш) коливається від 0,5 до 5,0 мг/мл. Переважний порядок підготовки кожного з компонентів комбінації препарату відповідно до цього винаходу полягає у використанні суміші трьох водно-спиртових розведень первинного 12 30 200 матричного розчину антитіл, розведеного 100 , 100 і 100 разів, відповідно, що еквівалентно сотенним гомеопатичним розведенням C12, C30 і C200. Для підготовки твердої лікарської форми, твердий носій обробляється бажаним розведенням, отриманим з допомогою гомеопатичного методу. Для отримання твердої лікарської форми комбінації винаходу, вся маса носія імпрегнується кожним з розведень. Обидва методи імпрегнування підходять для підготовки бажаної лікарської форми комбінації. У кращому варіанті, вихідним матеріалом для підготовки активованої потенційованої форми, що містить фармацевтичну композицію винаходу, є поліклональне антитіло тваринного походження до відповідного антигену, а саме, до ВІЛ-протеїну. Для отримання активованої 4 UA 112842 C2 потенційованої форми поліклональних антитіл до ВІЛ-протеїну, антиген бажано ввести в якості іммуногену в лабораторну тварину, переважно, в кроля. Поліклональні антитіла до ВІЛ-протеїну можна отримати з використанням повної молекули ВІЛ Гаг-Пол полі протеїну наступної послідовності: 5 5 UA 112842 C2 6 UA 112842 C2 7 UA 112842 C2 8 UA 112842 C2 9 UA 112842 C2 10 UA 112842 C2 11 UA 112842 C2 12 UA 112842 C2 13 UA 112842 C2 14 UA 112842 C2 15 UA 112842 C2 16 UA 112842 C2 17 UA 112842 C2 18 UA 112842 C2 19 UA 112842 C2 20 UA 112842 C2 21 UA 112842 C2 22 UA 112842 C2 23 UA 112842 C2 5 10 Приклад порядку підготовки вихідних поліклональних антитіл до ВІЛ-протеїну виглядає наступним чином. За 7-9 днів до забору крові, для підвищення рівня поліклональних антитіл в кровотоці кролям вводять 1-3 внутрішньовенних ін'єкцій бажаного антигену. Після імунізації, зразки крові використовуються для тестування рівня антитіл. Як правило, максимальний рівень імунної реакції розчинного антигену досягається протягом 40-60 днів після першої ін'єкції антигену. На завершення першого циклу імунізації, кроликам відводиться 30-денний реабілітаційний період, після чого з допомогою 1-3 внутрішньовенних ін'єкцій проводиться повторна імунізація. Для отримання антисироватки з вмістом потрібних антитіл, кров імунізованих кролів збирається і поміщається в 50 мл центрифужну пробірку. Згустки, сформовані на краях пробірки, знімаються дерев'яною лопаткою, а стержень поміщають в згусток посередині 24 UA 112842 C2 5 10 15 20 25 30 35 40 45 50 55 пробірки. Після цього кров поміщають в холодильник при температурі близько 40 °C на одну ніч. На наступний день, згусток на лопатці видаляється, а рідина, що залишилася, центрифугується протягом 10 хвилин при 13000 оборотах на хвилину. Супернатант і є цільовою антисироваткою. Зазвичай, отримана анти сироватка жовтого кольору. 20 % NaN3 (вагова концентрація) додаються в антисироватку для отримання остаточної концентрації в 0,02 %, після чого до використання її зберігають в замороженому стані при температурі - 20 °С, або при температурі 70 °С без додавання NaN3. Для виділення цільових антитіл до ВІЛ-протеїну з антисироватки, підходить наступна послідовність твердо фазової абсорбції: 10 мл антисироватки кроля розводять вдвічі з 0,15 М NaCl, після чого додають 6,26 г Na 2SO4, перемішують і витримують протягом 12-16 годин при температурі 4 °С. Осад видаляють центрифугуванням, розводять у 10 мл фосфатного буфера і діалізують у тому ж буфері протягом однієї ночі при кімнатній температурі. Після видалення осаду, розчин наносять на ДЕАЕ-целюлозну колонку, збалансовану фосфатним буфером. Частка антитіла визначається шляхом вимірювання оптичної щільності елюату при 280 нм. Виділені неочищені антитіла очищуються за допомогою афінної хроматографії шляхом приєднання отриманих антитіл до ВІЛ-протеїну, що знаходиться на нерозчинному матриксі хроматографічного середовища, з подальшим елююванням концентрованими водними розчинами солей. Буферний розчин, отриманий в результаті, використовується в якості вихідного розчину для процесу гомеопатичного розведення для отримання активованої потенційованої форми антитіл. Бажана концентрація вихідного розчину матриці з очищеними від антигену поліклональними антитілами кролика до ВІЛ-протеїну становить 0,5-5,0 мг/мл, переважно 2,0-3,0 мг/мл. Активовану потенційовану форму антитіла до ВІЛ-протеїну можна приготувати з вихідного розчину шляхом гомеопатичного потенціювання, використовуючи метод пропорційного зменшення концентрації послідовним розведенням 1 частини кожного попереднього розчину (починаючи з вихідного розчину) в 9 частинах (для десяткових розведень), або в 99 частинах (для сотенних розведень), або в 999 частинах (для тисячних розведень) нейтрального розчинника, починаючи з концентрації вихідного розчину антитіла в розчиннику (як правило, це водна або водно-етилова спиртова суміш) діапазоном від 0,5 до 5,0 мг/мл в поєднанні з зовнішнім впливом. Як правило, під зовнішнім впливом мається на увазі багаторазове вертикальне струшування (динамізація) кожного розведення. Як правило, для кожного подальшого розведення для отримання необхідного рівня активності, або фактору розведення, використовуються окремі контейнери. Цей метод вважається загальноприйнятим в гомеопатії. Див, наприклад, В. Швабе "Гомеопатичні лікарські засоби", М., 1967, C. 14-29, посилання на який містяться в цьому документі. Наприклад, для приготування 12-сотенного розведення (позначається як C12), одна частина вихідного матричного розчину антитіл до ВІЛ-протеїну з концентрацією 3,0 мг/мл розводиться у 99 частинах нейтрального водного або водно-спиртового розчинника (переважно, 15 %етиловий спирт), а потім вертикально струшується багато разів (10 і більше) для отримання першого сотенного розведення (позначається як C1). 2-ге сотенне розведення (C2) отримують з 1-го сотенного розведення C1. Для приготування 12-го сотенного розведення С12 ця процедура повторюється 11 разів. Таким чином, 12-е сотенне розведення С12 представляє собою розчин, отриманий з допомогою 12 послідовних розведень однієї частини вихідного матричного розчину антитіл до гамма-інтерферону з концентрацією 3,0 мг/мл у 99 частинах нейтрального розчинника в різних контейнерах, що еквівалентно сотенному гомеопатичному розведенню С12. Аналогічні процедури з відповідним коефіцієнтом розведення виконуються для отримання розведень C30, С50 і C200. Проміжні розведення можуть застосовуватися на бажаній біологічній моделі для перевірки активності. Кращими активованими потенційованими формами композиції винаходу вважається суміш розведень C12, C30 та С50, або С12, С30 та C200. При використанні суміші різних гомеопатичних розведень (в основному сотенних) активної речовини в якості компонентів біологічно активної рідини, кожен компонент композиції (наприклад, C12, C30, С50, C200) готується окремо, відповідно до описаної вище процедури, до отримання передостаннього розведення (наприклад, до отримання C11, C29 і C199, відповідно), а потім одна частина кожного компонента поміщається в один контейнер, відповідно до складу суміші, і змішується з необхідною кількістю розчинника (наприклад, з 97 частинами для отримання сотенного розведення). Активна речовина може використовуватися як суміш різних гомеопатичних розведень, наприклад, десяткових та/або сотенних (D20, C30, C100 або C12, C30, C50 або С12, С30, С200 і т.д.), ефективність якої визначається експериментально шляхом тестування розведень на 25 UA 112842 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідних біологічних моделях, наприклад, на моделі, наведеній в цьому документі в прикладах. В процесі зниження потенціювання та концентрації, вертикальні струшування можуть замінятися зовнішнім впливом ультразвуку, електромагнітних полів або будь-якими іншими процесами зовнішнього впливу, які використовуються в гомеопатії. Як правило, фармацевтична композиція винаходу знаходиться у вигляді рідини чи твердої лікарської форми. Відповідним носієм у рідкому стані є вода або водно-спиртова суміш. Тверду лікарську форму фармацевтичної композиції винаходу можна отримати шляхом імпрегнування твердого, фармацевтично прийнятного носія сумішшю активованої потенційованої форми водних або водно-спиртових розчинів активних компонентів. Крім того, носія можна імпрегнувати послідовно в кожному відповідному розведенні. Обидва метода імпрегнування вважаються прийнятними. Як правило, фармацевтична композиція в твердій лікарській формі готується з гранул фармацевтично прийнятного носія, попередньо насичених водними або водно-спиртовими розведеннями активованої потенційованої форми антитіл до ВІЛ-протеїну. Тверда лікарська форма може відповідати будь-якій формі, прийнятій у фармацевтичній сфері, в тому числі у вигляді таблеток, капсул, пастилок для розсмоктування та в іншій формі. У якості неактивних фармацевтичних інгредієнтів можна використовувати глюкозу, сахарозу, мальтозу, крохмаль, ізомальтози, ізомальт та інші моно-, оліго- і полісахариди, які застосовуються у виробництві фармацевтичних препаратів, а також технологічні суміші вищевказаних неактивних фармацевтичних інгредієнтів з іншими фармацевтично прийнятними наповнювачами, наприклад з ізомальтом, кросповідоном, цикламатом натрію, натрію сахарином, безводною лимонною кислотою і т.д., включаючи змащувальні, розпушуючі, зв'язуючі речовини і барвники. Найкращими носіями є лактоза і ізомальт. Фармацевтична лікарська форма може додатково включати стандартні фармацевтичні наповнювачі, наприклад, мікрокристалічну целюлозу, стеарат магнію та лимонну кислоту. Для приготування твердих лікарських форм для перорального застосування, 100-300 мкм гранул лактози імпрегнують водними або водно-спиртовими розчинами активованої потенційованої форми антитіл до ВІЛ-протеїну в співвідношенні 1 кг розчину антитіл до 5 або 10 кг лактози (1:5-1:10). Для здійснення імпрегнування, гранули лактози піддаються насиченню та зрошенню в псевдозрідженому киплячому шарі відповідного устаткування (наприклад, "Hüttlin Pilotlab" виробництва Hüttlin GmbH) з наступним просушуванням в потоці повітря, нагрітому при температурі нижче 40 °С. Передбачувану кількість висушених гранул (від 10 до 34 вагових частин), насичених активованою потенційованою формою антитіл, поміщають в змішувач і змішують з 25 до 45 ваговими частинами "ненасиченої" чистої лактози (використовується в цілях скорочення витрат, спрощення і прискорення технологічного процесу без зниження ефективності лікування), разом з 0,1 до 1 вагової частини стеарату магнію, і від 3 до 10 вагових частин мікрокристалічної целюлози. Отримана таблетмаса рівномірно змішується і таблетується шляхом прямого сухого пресування (наприклад, в таблетковому пресі Korsch-XL 400) для отримання круглих таблеток масою від 150 до 500 мг, переважно 300 мг. Після таблетування, отримані 300 мг таблетки насичуються водно-спиртовим розчином (3,0-6,0 мг/таблетку) суміші з активованої потенційованої форми антитіл до ВІЛ-протеїну у формі суміші сотенних гомеопатичних розведень C12, C30 та С50, або суміші сотенних гомеопатичних розведень C12, С30 та C200. Хоча винахід не обмежується будь-якою конкретною теорією, однак, вважається, що активована потенційована форма антитіл, описана в цьому документі, не містить молекулярної форми антитіл в тій кількості, яка необхідна для виявлення такою молекулярною формою біологічної активності. Біологічна активність комбінованого препарату винаходу повністю продемонстрована в наведених прикладах. Як правило, в лікуванні комбінація винаходу застосовується від одного до чотирьох раз на день, або двічі на день, при чому одна або дві одиничні лікарські форми композиції використовуються за прийом. Далі винахід проілюстровано з використанням посилань на вказані приклади. ПРИКЛАДИ Приклад 1 Оцінка антиретровірусної активності наднизьких доз поліклональних антитіл кролика до ВІЛнуклеокапсидного протеїну p24 (P24-протеїн) (суміш гомеопатичних розведень С12 + С30 + С50), була проведена з використанням мононуклеарних клітин периферичної крові людини, інфікованих штамом HIV-1-LAI в експериментальних умовах. Азидотимідин (Sigma-AZ169-100 мг, лот 107 K1578) використовувався в якості препарату порівняння. 26 UA 112842 C2 5 10 15 20 Мононуклеарні клітини периферичної крові людини виділялися з крові серонегативного здорового донора шляхом центрифугування на градієнті щільності Ficoll-Hypaque. Клітини стимулювалися протягом 3 днів з використанням 1 мкг/мл фітогемагглютиніну P і 5 МО/мл рекомбінантного інтерлейкіну-2 людини в середовищі RPMI1640 (DIFCO) з додаванням 10 % ембріональної телячої сироватки (комплемент видалявся шляхом нагрівання протягом 45 хвилин при 56 °C), 1 % розчину антибіотика (PSN Gibco, що містить 50 мкг/мл пеніциліну, 50 мкг/мл стрептоміцину і 100 мкг/мл неоміцину). Для здійснення оцінки антиретровірусної активності продукти були поміщені в лунку за 15-30 хвилин після інфікування клітин штамом HIV-1-LAI в дозі 100 TCID50 (50 мкл інокулуму штаму HIV-1-LAI). Супернатант, який використовувався для оцінки впливу продуктів на інгібування реплікації ВІЛ, збирався на 7 день після інфікування клітин. Перед розміщенням в лунку, в якій містилося 150 мкл клітинної культури, наднизькі дози антитіл до протеїну p24 розводилися RPMI1640 (DIFCO) при 4-кратному розведенні (при 1/4 розведенні) до отримання кінцевого об'єму 50 мкл. Азидотимідин розводився RPMI1640 (DIFCO) з отриманням концентрації 8 нМ. Ефективність продуктів встановлювалася шляхом інгібування реплікації ВІЛ, яка оцінювалася за активністю ВІЛ-ревертази в супернатанті з мононуклеарних клітин периферичної крові людини з використанням набору RT RetroSys, виготовленого INNOVAGEN (Лот 10-059C). Супернатант клітин, які не були інокульовані продуктами дослідження або азидотимідином, використовувався в якості контрольного препарату для розрахунку відсотку інгібування реплікації ВІЛ (Таблиця 1). Таблиця 1 Антиретровірусна активність наднизьких доз антитіл до протеїну p24 з використанням мононуклеарних клітин периферичної крові людини, інфікованих штамом HIV-1-LAI в експериментальних умовах Продукт Коефіцієнт розведення середовища RPMI1640 (DIFCO) Інгібування активності ВІЛревертази (% контрольного препарату) День 7 Надмалі дози антитіл до протеїну р24 Азидотимідин (8 нМ) 25 30 35 40 45 1/4 63±17 58±7 Таким чином, експериментальна модель продемонструвала антиретровірусну активність наднизьких доз поліклональних антитіл кроля до ВІЛ-нуклеокапсидного протеїну p24 (суміш гомеопатичних розведень С12 + С30 + С50). Приклад 2 (макрофаги; ревертаза; режим профілактики) Список абревіатур: TCID50 означає дозу зараження 50 % культури тканини. Оцінка антиретровірусної активності наднизьких доз поліклональних антитіл кролика до ВІЛ нуклеокапсидного протеїну p24 (P24-протеїн) (суміш гомеопатичних розведень С12 + С30 + С50), була проведена з використанням макрофагів, отриманих з мононуклеарних клітин периферичної крові людини та інфікованих штамом HIV-1-Ba-L в експериментальних умовах. Азидотимідин (Sigma-AZ169-100 мг, лот 107 K1578) використовувався в якості препарату порівняння. Макрофаги периферичної крові людини отримувалися з мононуклерних клітин периферичної крові людини, виділених з крові серонегативного здорового донора шляхом центрифугування на градієнті щільності Ficoll-Hypaque. Мононуклеарні клітини периферичної крові людини утворювалися протягом 3 днів в середовищі RPMI1640 (DIFCO) з додаванням 10 % ембріональної телячої сироватки (комплемент видалявся шляхом нагрівання протягом 45 хвилин при 56 °C), 1 % розчину антибіотика (PSN Gibco, що містить 50 мкг/мл пеніциліну, 50 мкг/мл стрептоміцину і 100 мкг/мл неоміцину), 15 нг/мЛ ГМ-КСФ (гранулоцитарномакрофагальний колонієстимулюючий фактор). Потім клітини, які вирощувалися протягом 7 днів разом з 1 нг/мЛ ГМ-КСФ (гранулоцитарно-макрофагальний колонієстимулюючий фактор) і 10 нг/мЛ М-КСФ (макрофагальний колонієстимулюючий фактор), переносилися на культуральний 27 UA 112842 C2 5 10 15 планшет (150000 клітин/лунку в 48-лунковому планшеті), таким чином, що клітини повністю диференціювалися в макрофаги. Для здійснення оцінки антиретровірусної активності продукти були поміщені в лунку за 24 хвилини після інфікування клітин штамом HIV-1-Ba-L в дозі 1000 TCID50 (100 мкл інокулуму штаму HIV-1-Ba-L), а також на 3, 7, 10, 14, 17 день після інфікування. Супернатант, який використовувався для оцінки впливу продуктів на інгібування реплікації ВІЛ, збирався на 3, 7, 10, 14, 17 день після інфікування клітин. Перед розміщенням в лунку, в якій містилося 750 мкл клітинної культури, наднизькі дози антитіл до протеїну p24 розводилися RPMI1640 (DIFCO) при 4-кратному розведенні (при 1/4 розведенні) до отримання кінцевого об'єму 250 мкл. Азидотимідин розводився RPMI1640 (DIFCO) з отриманням концентрації 8 нМ. Ефективність продуктів встановлювалася шляхом інгібування реплікації ВІЛ, яка оцінювалася за активністю ВІЛ-ревертази в супернатанті з макрофагів периферичної крові людини з використанням набору RT RetroSys, виготовленого INNOVAGEN (Лот 10-059C). Супернатант клітин, які не були інокульовані продуктами дослідження або азидотимідином, використовувався в якості контрольного препарату для розрахунку відсотку інгібування реплікації ВІЛ (Таблиця 2). Таблиця 2 Антиретровірусна активність наднизьких доз антитіл до протеїну p24 з використанням макрофагів периферичної крові людини, інфікованих штамом HIV-1-Ba-L в експериментальних умовах Продукт Надмалі дози антитіл до протеїну р24 Азидотимідин (8 нМ) 20 25 30 35 40 45 Коефіцієнт розведення середовища RPMI1640 (DIFCO) Інгібування активності ВІЛревертази (% контрольного препарату) День 14 День 17 День 21 1/4 41±9 27±2 27±5 82±2 54±1 41±1 Таким чином, експериментальна модель продемонструвала антиретровірусну активність наднизьких доз поліклональних антитіл кролика до ВІЛ-нуклеокапсидного протеїну p24 (суміш гомеопатичних розведень С12 + С30 + С50). Приклад 3 Оцінка антиретровірусної активності наднизьких доз поліклональних антитіл кроля до ВІЛ-1 протеази (суміш гомеопатичних розведень С12 + С30 + С50) (далі як "наднизькі дози антитіл до ВІЛ-1 протеази"), була проведена з використанням мононуклеарних клітин периферичної крові людини, інфікованих штамом HIV-1LAI в експериментальних умовах. Азидотимідин (SigmaAZ169-100 мг, лот 107 K1578) використовувався в якості препарату порівняння. Мононуклеарні клітини периферичної крові людини виділялися з крові серонегативного здорового донора шляхом центрифугування на градієнті щільності Ficoll-Hypaque. Клітини стимулювалися протягом 3 днів з використанням 1 мкг/мл фітогемагглютиніну P і 5 МО/мл рекомбінантного інтерлейкіну-2 людини в середовищі RPMI1640 (DIFCO) з додаванням 10 % ембріональної телячої сироватки (комплемент видалявся шляхом нагрівання протягом 45 хвилин при 56 °C), 1 % розчину антибіотика (PSN Gibco, що містить 50 мкг/мл пеніциліну, 50 мкг/мл стрептоміцину і 100 мкг/мл неоміцину). Для здійснення оцінки антиретровірусної активності продукти були поміщені в лунку за 15-30 хвилин після інфікування клітин штамом HIV-1-LAI в дозі 100 TCID50 (50 мкл інокулуму штаму HIV-1-LAI). Супернатант, який використовувався для оцінки впливу продуктів на інгібування реплікації ВІЛ, збирався на 7 день після інфікування клітин. Перед розміщенням в лунку, в якій містилося 150 мкл клітинної культури, наднизькі дози антитіл до ВІЛ-1 протеази розводилися RPMI1640 (DIFCO) при 4-кратному розведенні (при 1/4 розведенні) до отримання кінцевого об'єму 50 мкл. Азидотимідин розводився RPMI1640 (DIFCO) з отриманням концентрації 8 нМ. Ефективність продуктів встановлювалася шляхом інгібування реплікації ВІЛ, яка оцінювалася за активністю ВІЛ-ревертази в супернатанті з мононуклеарних клітин периферичної крові людини з використанням набору RT RetroSys, виготовленого INNOVAGEN (Лот 10-059C). Супернатант клітин, які не були інокульовані продуктами дослідження або 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition and methods of treating and preventing the diseases caused by hiv or associated with hiv
Автори англійськоюEpshtein, Oleg, Iliich, Tarasov, Sergei Alexandrovich
Автори російськоюЭпштейн Олег Ильич, Тарасов Сергей Александрович
МПК / Мітки
МПК: A61K 39/42
Мітки: віл, композиція, лікування, профілактики, захворювань, пов'язаних, фармацевтична, спричинених, спосіб
Код посилання
<a href="https://ua.patents.su/41-112842-farmacevtichna-kompoziciya-ta-sposib-likuvannya-i-profilaktiki-zakhvoryuvan-sprichinenikh-abo-povyazanikh-z-vil.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція та спосіб лікування і профілактики захворювань, спричинених або пов’язаних з віл</a>
Попередній патент: Вектор та послідовність для лікування мукополісахаридозів
Наступний патент: Низьколегована сталь та виготовлені з неї деталі
Випадковий патент: Агрегат для диференційованої термічної обробки прокатних валків