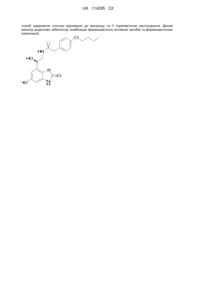
Сполука бензотіазолону
Номер патенту: 114295
Опубліковано: 25.05.2017
Автори: Жоу Джіангуанг, Рібезель Бернд, Ульріх Томас, Грандері Арно, Цяо Юнь, Лустенбергер Філіпп, Ерб Бернхард, Фейрхерст Робін Алек, Хатакеяма Шінджі, Ву Ксіанг, Лаі Ксінжонг, Козічак-Холбро Магдалена, Туфіллі Нікола
Формула / Реферат
1. Сполука формули (І) у вільній формі або у формі фармацевтично прийнятної солі, яка являє собою
 (І).
(І).
2. Сполука за п. 1, яка являє собою (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксіетил)-5-гідроксибензо[d]тіазол-2(3Н)-он у вільній формі.
3. Сполука за п. 1, яка являє собою (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксіетил)-5-гідроксибензо[d]тіазол-2(3Н)-он у формі ацетатної солі.
4. Сполука за п. 1, яка являє собою (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксіетил)-5-гідроксибензо[d]тіазол-2(3Н)-он у формі гліколятної солі.
5. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4 та один або більше фармацевтично прийнятних носіїв.
6. Фармацевтична композиція за п. 5, де одним з фармацевтично прийнятних носіїв є бензиловий спирт.
7. Комбінація, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4 та один або більше терапевтично активних додаткових засобів.
8. Спосіб лікування або профілактики м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії, що включає введення терапевтично ефективної кількості сполуки за будь-яким з пп. 1-4 пацієнту, який цього потребує.
9. Спосіб за п. 8, де сполуку вводять шляхом підшкірної інфузії або ін'єкції.
10. Сполука за будь-яким з пп. 1-4 для застосування як лікарського засобу.
11. Сполука за будь-яким з пп. 1-4 для застосування у лікуванні або профілактиці м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії.
12. Застосування сполуки за будь-яким з пп. 1-4 у одержанні лікарського засобу для лікування або профілактики м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії.
13. Спосіб одержання сполуки формули (І) у вільній формі або у формі фармацевтично прийнятної солі, який включає стадії:
a) реакції сполуки формули (IIа) у вільній формі або у формі фармацевтично прийнятної солі
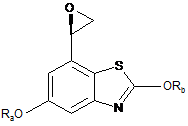 , (IIа)
, (IIа)
у якій Ra та Rb являють собою захисні групи, з 2-(4-бутоксифеніл)-1,1-диметилетиламіном;
b) відщеплення будь-яких присутніх захисних груп;
с) виділення отриманої таким чином сполуки формули (I) у вільній формі або у формі фармацевтично прийнятної солі.
14. Спосіб одержання сполуки формули (І) у вільній формі або у формі фармацевтично прийнятної солі за п. 13, у якому сполуку (IIа) отримують за реакцією сполуки формули (IIIа) у вільній формі або у формі фармацевтично прийнятної солі
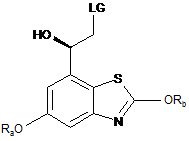 , (IIIa)
, (IIIa)
у якій Ra та Rb являють собою захисні групи та LG являє собою відхідну групу, з основою та необов'язково каталізатором між фазного переносу.
15. Спосіб одержання сполуки формули (І) у вільній формі або у формі фармацевтично прийнятної солі за п. 14, у якому сполуку (IIIа) отримують стереоселективним відновленням сполуки формули (IVa-2) у вільній формі або у формі фармацевтично прийнятної солі
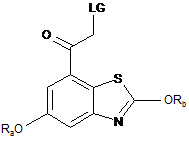 , (IVa-2)
, (IVa-2)
у якій Ra та Rb являють собою захисні групи та LG являє собою відхідну групу.
16. Спосіб за п. 15, де LG являє собою хлор.
17. Спосіб за п. 16, у якому сполуку (IVa'-2) у вільній формі або у формі фармацевтично прийнятної солі
 (IVa'-2)
(IVa'-2)
отримують за реакцією сполуки формули (Va) у вільній формі або у формі фармацевтично прийнятної солі
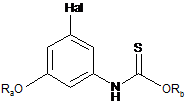 , (Va)
, (Va)
у якій Ra та Rb являють собою захисні групи та Hal являє собою галоген, з 2-хлор-N-метокси-N-метилацетамідом у присутності сильної основи.
Текст
Реферат: Даний винахід забезпечує сполуку формули (І) у вільній формі або у формі фармацевтично прийнятної солі (І) O HN HO S O HO N H , (І) UA 114295 C2 (12) UA 114295 C2 спосіб одержання сполуки відповідно до винаходу та її терапевтичне застосування. Даний винахід додатково забезпечує комбінацію фармацевтично активних засобів та фармацевтичних композицій. O H N H O S O H O N H UA 114295 C2 5 10 15 20 25 30 35 40 Даний винахід відноситься до сполуки бензотіазолону, до її одержання, її медичного застосування як агоністу бета-2 адренорецепторів та до лікарських засобів, фармацевтичних композицій та комбінацій, що містять її. Сполуки бензотіазолону, які є агоністами бета-2-адренорецепторів, описані у WO2004/16601 та WO2006/056471. У WO2005/110990 також описані бензо-конденсовані гетероцикли як бета-2 агоністи. Тоді як бета-2 агоністи давно відомі у відношенні бронходилатуючих властивостей, вони також відомі у відношенні здатності викликати гіпертрофію кістякових м'язів. Багато досліджень спрямовані на терапевтичні застосування анаболічних властивостей бета-2 агоністів у відношенні полегшення м'язової атрофії та покращення функції м'язів. Однак, зазначений клас сполук також асоційований з небажаними побічними ефектами, включаючи підвищений ризик небажаних серцево-судинних ефектів. Отже, застосування бета-2 агоністів при захворюваннях з атрофією м'язів поки було обмежено гіпертрофією серця та потенційно шкідливими впливами на серцево-судинну функцію. Існує необхідність у забезпеченні нових бета-2 агоністів, які є гарними лікарськими засобами - кандидатами. Зокрема, новий бета-2 агоніст повинен ефективно зв'язуватися з бета-2 адренорецепторами, при цьому проявляючи невелику спорідненість до інших рецепторів, таких як, наприклад, бета-1 адренорецептори, альфа-1A адренорецептори або 5HT2С рецептори, та проявляти функціональну активність агоністу. Він повинен бути метаболічно стабільним та мати сприятливі фармакокінетичні властивості. Він повинен бути нетоксичним та демонструвати небагато побічних ефектів, зокрема, менше кардіальних побічних ефектів, ніж відомі на ринку бета-2 агоністи, такі як, наприклад, формотерол. Більше того, ідеальний лікарський засібкандидат повинен існувати у фізичній формі, яка є стабільною, негігроскопічною та такою, що легко формулюється. Сполука відповідно до винаходу являє собою селективний бета-2 агоніст. Зокрема, вона проявляє підвищену спорідненість до бета-2 адренорецепторів, яка перевершує її спорідненість до бета-1 адренорецепторів або альфа-1A адренорецепторів, у порівнянні з відомими бета-2 агоністами, такими як формотерол. Неочікувано, вона також проявляє більш низьку спорідненість до рецепторів серотоніну (5HT 2С) та більш низьку функціональну ефективність у 5HT2С-експресуючих клітинах, ніж її рацемат або її відповідний енантіомер, показуючи, що вона не впливає на рухову активність та споживання їжі, що може викликати зниження маси тіла, потенційно протидіючи гіпертрофії скелетних м'язів, індукованій бета-2 агоністами. Негативні ефекти агоністів рецепторів 5HT2С на споживання енергії та масу тіла описані J. Halford та J. Harrold у Handb Exp Pharmacol. 2012; (209) 349-56. Отже, сполука відповідно до даного винаходу є потенційно застосовною у лікуванні широкого діапазону захворювань, особливо у лікуванні або профілактиці захворювань із атрофією м'язів, таких як м'язова дистрофія, атрофія від бездіяльності, кахексія або саркопенія. Лікування кахексії також є передбачуваним застосуванням. Усі форми кахексії є такими, що потенційно піддаються лікуванню за допомогою сполук відповідно до даного винаходу, включаючи наприклад, ракову кахексію. Отже, у першому аспекті винаходу, забезпечують сполуку формули (I) у вільній формі або формі її фармацевтично прийнятної солі, яка являє собою O HN HO S O HO 45 N H (I). Сполука відповідно до винаходу являє собою (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-он. Далі представлені варіанти здійснення винаходу: Варіант здійснення 1: Сполука відповідно до першого аспекту винаходу. 1 UA 114295 C2 5 10 15 20 25 30 Варіант здійснення 2: Сполука відповідно до варіанту здійснення 1, яке являє собою (R)-7(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)он у вільній формі. Варіант здійснення 3: Сполука відповідно до варіанту здійснення 1, яка являє собою (R)-7(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)он у формі ацетатної солі. Варіант здійснення 4: Сполука відповідно до варіанту здійснення 1, яка являє собою (R)-7(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)он у формі гліколятної солі. Варіант здійснення 5: Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки відповідно до будь-якого з варіантів здійснення 1-4 та один або більше фармацевтично прийнятних носіїв. Варіант здійснення 6: Фармацевтична композиція відповідно до варіанту здійснення 5, де одним з фармацевтично прийнятних носіїв є бензиловий спирт. Варіант здійснення 7: Комбінація, що містить терапевтично ефективну кількість сполуки відповідно до будь-якого з варіантів здійснення 1-4 та один або більше терапевтично активних співагентів. Варіант здійснення 8: Спосіб лікування або профілактики м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії, що включає введення терапевтично ефективної кількості сполуки відповідно до будь-якого з варіантів здійснення 1-4 пацієнту, який цього потребує. Варіант здійснення 9: Спосіб відповідно до варіанту здійснення 8, де сполуку вводять підшкірною інфузією або ін'єкцією. Варіант здійснення 10: Сполука відповідно до будь-якого з варіантів здійснення 1-4 для застосування як лікарський препарат. Варіант здійснення 11: Сполука відповідно до будь-якого з варіантів здійснення 1-4 для застосування у лікуванні або профілактиці м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії. Варіант здійснення 12: Застосування сполуки відповідно до будь-якого з варіантів здійснення 1-4 у одержанні лікарського засобу для лікування або профілактики м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії. Варіант здійснення 13: Спосіб одержання сполуки формули (I) у вільній формі або у формі фармацевтично прийнятної солі, який включає стадії: a) реакції сполуки формули (IIa) у вільній формі або у формі фармацевтично прийнятної солі O S ORb N RaO 35 40 (IIa) у якій Ra та Rb являють собою захисні групи, з 2-(4-бутоксифеніл)-1,1-диметилетиламіном; b) відщеплення необов'язково присутніх захисних груп; c) відновлення отриманої таким чином сполуки формули (I) у вільній формі або формі фармацевтично прийнятної солі. Варіант здійснення 14: Спосіб одержання сполуки формули (I) у вільній формі або формі фармацевтично прийнятної солі у відповідності з варіантом здійснення 13, у якому сполуку (IIa) отримують за реакцією сполуки формули (IIIa) у вільній формі або у формі фармацевтично прийнятної солі 2 UA 114295 C2 LG HO S ORb N RaO 5 10 (IIIa) у якій Ra та Rb являють собою захисні групи, та LG являє собою відхідну групу, з основою та необов'язково каталізатором переходу фаз. Варіант здійснення 15: Спосіб відповідно до варіанту здійснення 14, де основою є карбонат калію. Варіант здійснення 16: Спосіб відповідно до варіанту здійснення 14, де основою є гідроксид натрію. Варіант здійснення 17: Спосіб відповідно до будь-якого з варіантів здійснення 14-16, де каталізатором переходу фаз є йодид тетра-бутиламонію. Варіант здійснення 18: Спосіб одержання сполуки формули (I) у вільній формі або у формі фармацевтично прийнятної солі відповідно до варіантів здійснення 14-17, у якому сполуку (IIIa) отримують стереоселективним відновленням сполуки формули (IVa-2) у вільній формі або у формі фармацевтично прийнятної солі LG O S ORb N RaO (IVa-2) 15 20 у якій Ra та Rb являють собою захисні групи, та LG являє собою відхідну групу. Варіант здійснення 19: Спосіб відповідно до варіанту здійснення 18, де стереоселективне відновлення проводять з [N-[(1S, 2S)-2-(аміно-κN)-1,2-дифенілетил]-4метилбензолсульфонамідато-κN]хлор[(1,2,3,4,5,6-η)-1-метил-4-(1-метилетил)-бензол]рутенієм (RuCI(п-цимол)[(S, S)-Ts-DPEN]). Варіант здійснення 20: Спосіб відповідно до варіанту здійснення 18 або 19, де LG є хлор. Варіант здійснення 21: Спосіб відповідно до варіанту здійснення 20, у якому сполуку (IVa'-2) у вільній формі або у формі фармацевтично прийнятної солі Cl O S ORb N RaO (IVa'-2) 25 отримують за реакцією сполуки формули (Va) у вільній формі або у формі фармацевтично прийнятної солі 3 UA 114295 C2 Hal S Ra O N H ORb (Va) 5 у якій Ra та Rb являють собою захисні групи, та Hal є галогеном, з 2-хлор-N-метокси-Nметилацетамідом у присутності сильної основи. Варіант здійснення 22: Спосіб відповідно до варіанту здійснення 21, де сильною основою є трет-бутиллітій. Варіант здійснення 23: Спосіб одержання сполуки формули (I) у вільній формі або у формі фармацевтично прийнятної солі, який включає стадії: a) реакції сполуки формули (IIIa) у вільній формі або у формі фармацевтично прийнятної солі LG HO S ORb N RaO 10 15 20 (IIIa) у якій Ra та Rb являють собою захисні групи, та LG являє собою відхідну групу, з 2-(4бутоксифеніл)-1,1-диметилетиламіном; b) відщеплення будь-яких все ще присутніх захисних груп; c) відновлення отриманої таким чином сполуки формули (I) у вільній формі або у формі фармацевтично прийнятної солі. Варіант здійснення 24: Спосіб відповідно до варіанту здійснення 23, де LG являє собою хлор або п-толуолсульфоніл. Варіант здійснення 25: Спосіб відповідно до будь-якого з варіантів здійснення 13-24, де Ra являє собою трет-бутил. Варіант здійснення 26: Спосіб відповідно до будь-якого з варіантів здійснення 13-25, де Rb являє собою ізопропіл. Варіант здійснення 27: Сполуку формули (Ia) у вільній формі або у формі фармацевтично прийнятної солі O HN HO S ORb RaO 25 N (Ia) у якій Ra та Rb являють собою захисні групи. Варіант здійснення 28: Сполуку формули (IIa) у вільній формі або у формі фармацевтично прийнятної солі 4 UA 114295 C2 O S ORb N RaO (IIa) у якій Ra та Rb являють собою захисні групи. Варіант здійснення 29: Сполуку формули (IIIa-2) у вільній формі або у формі фармацевтично прийнятної солі Cl HO S ORb N RaO 5 (IIIa-2) у якій Ra та Rb являють собою захисні групи. Варіант здійснення 30: Сполуку формули (IVa-2) фармацевтично прийнятної солі LG у вільній формі або у формі O S ORb N RaO 10 15 20 25 30 (IVa-2) у якій Ra та Rb являють собою захисні групи, та LG являє собою відхідну групу. Варіант здійснення 31: Сполука відповідно до варіанту здійснення 30, де LG являє собою хлор. Варіант здійснення 32: Сполука відповідно до будь-якого з варіантів здійснення 27-31, де Ra являє собою трет-бутил. Варіант здійснення 33: Сполука відповідно до будь-якого з варіантів здійснення 27-32, де Rb являє собою ізопропіл. Короткий опис креслень На фіг.1 показане збільшення скелетно-м'язової маси та маси серця у щурів, яким вводили формотерол у порівнянні зі сполукою A (сполука відповідно до винаходу) - (значення представлені як середнє ± SEM (n=5-6); сукупність скелетних м'язів (ікроножна-камбаловиднавеликогомілкова) нормалізована по вихідній масі тіла; маса серця нормалізована за масою головного мозку. На фіг.2a показане збільшення частоти скорочень виділених синоатріальних вузлів кроликів при використанні формотеролу у порівнянні зі сполукою A (сполука відповідно до винаходу). На фіг.2b показане збільшення активності водія ритму у виділених серцях кролика при використанні формотеролу у порівнянні зі сполукою A (сполука відповідно до винаходу). На фіг.3a та 3b показана зміна частоти серцевих скорочень у щурів після п/к болюсної ін'єкції сполуки A (сполука відповідно до винаходу) або формотеролу, відповідно. На фіг.3c порівнюють середні зміни частоти серцевих скорочень у щурів при введенні формотеролу у порівнянні зі сполукою A (сполука відповідно до винаходу). На фіг.4a та 4b показані зміни частоти серцевих скорочень у макак резус при болюсній п/к ін'єкції сполуки A (сполука відповідно до винаходу) або формотеролу, відповідно. 5 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фіг.5 показана порошкова рентгенівська дифрактограма кристалічної вільної основи сполуки A (сполука відповідно до винаходу). На фіг.6 показана порошкова рентгенівська дифрактограма кристалічної ацетатної солі сполуки A (сполука відповідно до винаходу). На фіг.7 показана порошкова рентгенівська дифрактограма кристалічної гліколятної солі сполуки A (сполука відповідно до винаходу). Якщо не зазначено інше, термін "сполука відповідно до даного винаходу", "сполука відповідно до винаходу" або "сполука A" відноситься до сполуки формули (I), солей сполуки, гідратів або сольватів сполуки або солей, а також таутомерів та сполук, мічених ізотопами (включаючи заміни дейтерію). Сполука відповідно до даного винаходу додатково включає поліморфи сполуки формули (I) та їх солі. Як використовується в даному описі термін "галоген" або "гало" відноситься до фтору, хлору, брому та йоду. Як використовується у даному описі абсолютну стереохімію встановлюють у відповідності з системою Кана-Інгольда-Прелога R-S. Коли сполука є чистим енантіомером, стереохімія на кожному хіральному вуглеці може бути встановлена або R або S. Розчинені сполуки, чия абсолютна конфігурація невідома, можуть бути позначені як (+) або (-) у залежності від напрямку (право- або лівообертальні), у якому вони обертають площину поляризованого світла при довжині хвилі D лінії натрію. Будь-який асиметричний атом (наприклад, вуглець або подібні) сполуки може бути присутнім у рацемічно або енантіомерно збагаченій, наприклад, (R)-, (S)або (R, S)-конфігурації. Рацемічну суміш стереоізомерів 50:50 позначають як (R, S), та енантіомерно збагачені форми по енантіомерному надлишку (R) до (S), відповідно, або (S) до (R) форм. Енантіомерний надлишок представлений звичайно рівнянням ee=((m1m2)/(m1+m2))*100 %, де m1 та m2 являють собою масу відповідних енантіомерних форм R та S. Сполука відповідно до даного винаходу містить один асиметричний центр, який визначають у відношенні абсолютної стереохімії як (R). Її відповідний енантіомер визначають як (S), який є менш активною формою. У певному варіанті здійснення винаходу асиметричний атом має щонайменше 95, 98 або 99 % енантіомерного надлишку у (R)-конфігурації. Отже, у одному варіанті здійснення винаходу забезпечують (R)-7-(2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-он або його фармацевтично прийнятну сіль (наприклад, його ацетатну або гліколятну сіль) у щонайменше 95 % енантіомерному надлишку. У іншому варіанті здійснення винаходу забезпечують (R)-7-(2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-он, або його фармацевтично прийнятну сіль (наприклад, його ацетатну або гліколятну сіль) у щонайменше 98 % енантіомерному надлишку. У ще одному варіанті здійснення винаходу забезпечують (R)-7-(2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-он або його фармацевтично прийнятну сіль (наприклад, його ацетатну або гліколятну сіль) у щонайменше 99 % енантіомерному надлишку. У одному варіанті здійснення винаходу забезпечують фармацевтичну композицію, що містить терапевтично ефективну кількість (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону або його фармацевтично прийнятної солі (наприклад, його ацетатної або гліколятної солі) та один або більше фармацевтично прийнятних носіїв, де (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5гідроксибензо[d]тіазол-2(3H)-он або його фармацевтично прийнятна сіль присутні у щонайменше 95 % енантіомерному надлишку. У іншому варіанті здійснення винаходу забезпечують фармацевтичну композицію, що містить терапевтично ефективну кількість (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону або його фармацевтично прийнятної солі (наприклад, його ацетатну або гліколятну сіль) та один або більше фармацевтично прийнятних носіїв, де (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5гідроксибензо[d]тіазол-2(3H)-он або його фармацевтично прийнятна сіль присутні у щонайменше 98 % енантіомерному надлишку. У ще одному варіанті здійснення винаходу забезпечують фармацевтичну композицію, що містить терапевтично ефективну кількість (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону або його фармацевтично прийнятної солі (наприклад, його ацетатної або гліколятної солі) та один або більше фармацевтично прийнятних носіїв, де (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5 6 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідроксибензо[d]тіазол-2(3H)-он або його фармацевтично прийнятна сіль присутні у щонайменше 99 % енантіомерному надлишку. Сполука відповідно до даного винаходу містить один асиметричний центр, який визначають у відношенні абсолютної стереохімії як (R). Її відповідний енантіомер визначають як (S). В залежності від вибору вихідних матеріалів та методик хімічного синтезу, сполуки можуть бути присутніми у формі одного з можливих ізомерів або їх сумішей, наприклад, у вигляді чистих оптичних ізомерів або сумішей ізомерів, таких як рацемати. Оптично активні (R)- та (S)ізомери можуть бути отримані з використанням хіральних синтонів або хіральних реагентів або відновлені з використанням звичайних методик. Включені всі таутомерні форми сполуки відповідно до даного винаходу. Відповідно, як використовується у даному описі, сполука відповідно до даного винаходу може знаходитися у формі таутомерів або їх сумішей. Будь-які отримані рацемати, або кінцеві продукти, або проміжні продукти синтезу можуть бути відновлені у оптичні антиподи за відомими методами, наприклад, шляхом розділення їх діастереомерних солей, отриманих з оптично активною кислотою або основою, та вивільнення оптично активної кислої або основної сполуки. Зокрема, основна група, отже, може бути використана для відновлення сполуки відповідно до даного винаходу у її оптичні антиподи, наприклад, шляхом фракційної кристалізації солі, отриманої з оптично активною кислотою, наприклад, виннокам'яною кислотою, дибензоїлвиннокам'яною кислотою, діацетилвиннокам'яною кислотою, ди-О, О'-п-толуоїлвиннокам'яною кислотою, мигдальною кислотою, яблучною кислотою або камфор-10-сульфоновою кислотою. Рацемічно або енантіомерно збагачені продукти також можуть бути відновлені хіральною хроматографією, наприклад, високоефективною рідинною хроматографією (ВЕРХ) з використанням хірального адсорбенту. Як використовується у даному описі, терміни "сіль" або "солі" відносяться до адитивної солі кислоти або адитивної солі основи сполуки відповідно до винаходу. "Солі" включають, зокрема, "фармацевтично прийнятні солі". Термін "фармацевтично прийнятні солі" відноситься до солей, які зберігають біологічну ефективність та властивості сполуки відповідно до даного винаходу та які звичайно не є біологічно або іншим чином небажаними. Сполука формули I відповідно до даного винаходу здатна утворювати характерну сіль із певною кислотою у результаті присутності основної аміногрупи у бічному ланцюзі. Вона також здатна утворювати характерні солі з певними основами у результаті присутності двох кислих груп (фенол; тіазолоновий цикл) у гетероциклічному компоненті. Фармацевтично прийнятні адитивні солі кислот можуть бути отримані з неорганічними кислотами та органічними кислотами, наприклад, солі ацетат, аспартат, етилат, бесилат, бромід/гідробромід, бікарбонат/карбонат, бісульфат/сульфат, камфорсульфонат, хлорид/гідрохлорид, хлортеофілонат, цитрат, етандисульфонат, фумарат, глюцептат, глюконат, глюкуронат, гліколят, гіпурат, гідройодид/йодид, ізетіонат, лактат, лактобіонат, лаурилсульфат, малат, малеат, малонат, сіль мигдальної кислоти, мезилат, метилсульфат, нафтоат, напсилат, нікотинат, нітрат, октадеканоат, олеат, оксалат, пальмітат, памоат, фосфат/кислий фосфат/дигідрофосфат, полігалактуронат, пропіонат, стеарат, сукцинат, сульфосаліцилат, тартрат, тозилат та трифторацетат. У одному варіанті здійснення винаходу забезпечують (R)-7-(2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-он у формі солі ацетату, бензоату, камфорату, фумарату, гліколяту, лактату, малонату, мезилату, сукцинату, сульфату, тартрату або ксинафоату. У одному певному варіанті здійснення винаходу забезпечують (R)-7-(2-(1-(4-бутоксифеніл)2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-он у формі ацетатної солі. У іншому певному варіанті здійснення винаходу забезпечують (R)-7-(2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-он у формі гліколятної солі. Неорганічні кислоти, з яких можуть бути отримані солі, включають, наприклад, соляну кислоту, бромистоводневу кислоту, сірчану кислоту, азотну кислоту, фосфорну кислоту та подібні. Органічні кислоти, з яких можуть бути отримані солі, включають, наприклад, оцтову кислоту, пропіонову кислоту, гліколеву кислоту, щавлеву кислоту, малеїнову кислоту, малонову кислоту, бурштинову кислоту, фумарову кислоту, виннокам'яну кислоту, лимонну кислоту, бензойну кислоту, мигдальну кислоту, метансульфонову кислоту, етансульфонову кислоту, толуолсульфонову кислоту, сульфосаліцилову кислоту та подібні. 7 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 Фармацевтично прийнятні адитивні солі основ можуть бути отримані з неорганічними та органічними основами. Неорганічні основи, з яких можуть бути отримані солі, включають, наприклад, солі амонію та металів з колонок I-XII періодичної таблиці. У певних варіантах здійснення солі отримують з натрію, калію, амонію, кальцію, магнію та заліза; особливо підходящі солі включають солі амонію, калію, натрію, кальцію та магнію. Органічні основи, з яких можуть бути отримані солі, включають, наприклад, первинні, вторинні та третинні аміни, заміщені аміни, включаючи природні заміщені аміни, циклічні аміни, лужні іон-обмінні смоли та подібні. Певні органічні аміни включають ізопропіламін, бензатин, холінат, діетаноламін, діетиламін, лізин, меглюмін, піперазин та трометамін. Фармацевтично прийнятні солі відповідно до даного винаходу можуть бути синтезовані з основного або кислого фрагменту за звичайними хімічними способами. Звичайно такі солі можуть бути отримані шляхом реакції вільних кислих форм сполуки із стехіометричною кількістю відповідної основи (такої як гідроксид, карбонат, бікарбонат або подібні Na, Ca, Mg, або K), або шляхом реакції вільних основних форм сполук із стехіометричною кількістю відповідної кислоти. Такі реакції звичайно проводять у воді, або у органічному розчиннику, або у суміші обох. Звичайно за можливості бажаним є застосування неводного середовища, такого як ефір, етилацетат, етанол, ізопропанол або ацетонітрил. Переліки додаткових підходящих солей можуть бути виявлені, наприклад, у "Remington's Pharmaceutical Sciences", 20th ed., Mack Publishing Company, Easton, Pa., (1985); та у "Handbook of Pharmaceutical Salts: Properties, Selection, and Use", Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2nd revised edition, 2011). Більше того, сполука відповідно до даного винаходу, включаючи її солі, також може бути отримана у формі гідратів або містити інші розчинники, використовувані для її кристалізації. Сполука відповідно до даного винаходу може за своєю природою або шляхом модифікації утворювати сольвати з фармацевтично прийнятними розчинниками (включаючи воду); отже, винахід охоплює та сольватовані, та несольватовані форми. Термін "сольват" відноситься до молекулярного комплексу сполуки відповідно до даного винаходу (включаючи її фармацевтично прийнятні солі) з однією або більше молекулами розчиннику. Такими молекулами розчиннику є такі, що звичайно використовувані у фармацевтичній галузі техніки, які відомі як нешкідливі для реципієнта, наприклад, вода, етанол та подібні. Термін "гідрат" відноситься до комплексу, де молекулою розчиннику є вода. Сполука відповідно до даного винаходу, включаючи її солі, гідрати та сольвати, може за своєю природою або шляхом змін утворювати поліморфи. У одному варіанті здійснення винаходу забезпечують (R)-7-(2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-он у кристалічній формі. У іншому варіанті здійснення винаходу забезпечують ацетатну сіль (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону у кристалічній формі. У ще одному варіанті здійснення винаходу забезпечують гліколятну сіль (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону у кристалічній формі. У одному варіанті здійснення винаходу забезпечують кристалічний (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-он у по суті чистій формі. У іншому варіанті здійснення винаходу забезпечують кристалічну ацетатну сіль (R)-7-(2-(1(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону у по суті чистій формі. У ще одному варіанті здійснення винаходу забезпечують кристалічну гліколятну сіль (R)-7(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)ону у по суті чистій формі. Як використовується у даному описі, "по суті чистий" при використанні у відношенні кристалічного (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5гідроксибензо[d]тіазол-2(3H)-ону або його фармацевтично прийнятної солі позначає такий, що має чистоту більше ніж 90 мас. %, включаючи більше ніж 90, 91, 92, 93, 94, 95, 96, 97, 98 та 99 мас. %, та також включаючи рівну або більше приблизно 100 мас. % (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону на основі маси сполуки або її фармацевтично прийнятної солі. 8 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 Наявність домішок реакції та/або виробничих домішок може бути визначена аналітичними методиками, відомими у галузі техніки, такими як, наприклад, хроматографія, ядерна магнітнорезонансна спектроскопія, мас-спектрометрія або інфрачервона спектроскопія. У більш точному аспекті винахід відноситься до кристалічної форми (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону, який має порошкову рентгенівську дифрактограму з щонайменше одним, двома або трьома піками, що мають значення кута рефракції 2 тета (θ), вибрані з 8,5, 13,3, 13,9, 14,4, 15,2, 17,2, 17,5, 18,1, 21,3 та 22,5 при вимірюванні з використанням випромінювання CuKα, точніше, де зазначені значення мають плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону, який має порошкову рентгенівську дифрактограму з піком при значенні кута рефракції 2θ 15,2 при вимірюванні з використанням випромінювання CuKα, зокрема, де зазначене значення становить плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону, яка має порошкову рентгенівську дифрактограму з піком при значенні кута рефракції 2θ 18,1 при вимірюванні з використанням випромінювання CuKα, зокрема, де зазначене значення становить плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону, яка має порошкову рентгенівську дифрактограму з піком при значенні кута рефракції 2θ 22,5 при вимірюванні з використанням випромінювання CuK α, зокрема, де зазначене значення становить плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону, яка має порошкову рентгенівську дифрактограму, по суті таку ж як порошкова рентгенівська дифрактограма, показана на фіг.5, при вимірюванні з використанням випромінювання CuK α. Стосовно подробиць дивись приклад 5. У іншому аспекті винахід відноситься до кристалічної форми ацетатної солі (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону, яка має порошкову рентгенівську дифрактограму з щонайменше одним, двома або трьома піками, що мають значення кута рефракції 2 тета (θ), вибрані з 8,8, 11,5, 16,4, 17,6, 18,2, 19,6, 20,1, 20,8 та 21,1 при вимірюванні з використанням випромінювання CuKα, зокрема, де зазначені значення становлять плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми ацетатної солі (R)7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол2(3H)-ону, яка має порошкову рентгенівську дифрактограму з піком значень кута рефракції 2θ 8,8 при вимірюванні з використанням випромінювання CuKα, зокрема, де зазначене значення становить плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми ацетатної солі (R)7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол2(3H)-ону, яка має порошкову рентгенівську дифрактограму з піком при значеннях кута рефракції 2θ 16,4 при вимірюванні з використанням випромінювання CuKα, зокрема, де зазначене значення становить плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми ацетатної солі (R)7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол2(3H)-ону, яка має порошкову рентгенівську дифрактограму з піком при значенні кута рефракції 2θ 20,8 при вимірюванні з використанням випромінювання CuKα, зокрема, де зазначене значення становить плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми ацетатної солі (R)7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол2(3H)-ону, яка має порошкову рентгенівську дифрактограму, показану на фіг. 6, при вимірюванні з використанням випромінювання CuKα. Стосовно подробиць дивись приклад 6. У ще одному аспекті винахід відноситься до кристалічної форми гліколятної солі (R)-7-(2-(1(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону, яка має порошкову рентгенівську дифрактограму з щонайменше одним, двома або трьома піками, що мають значення кута рефракції 2 тета (θ), вибрані з 8,7, 11,6, 16,1, 18,0, 19,8, 20,7 та 9 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 60 21,1 при вимірюванні з використанням випромінювання CuKα, зокрема, де зазначені значення складають плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми гліколятної солі (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол2(3H)-ону, яка має порошкову рентгенівську дифрактограму з піком значення кута рефракції 2θ 18,0 при вимірюванні з використанням випромінювання CuK α, зокрема, де зазначене значення становить плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми гліколятної солі (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол2(3H)-ону, яка має порошкову рентгенівську дифрактограму з піком при значенні кута рефракції 2θ 19,8 при вимірюванні з використанням випромінювання CuKα, зокрема, де зазначене значення становить плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми гліколятної солі (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол2(3H)-ону, яка має порошкову рентгенівську дифрактограму з піком при значенні кута рефракції 2θ 20,7 при вимірюванні з використанням випромінювання CuKα, зокрема, де зазначене значення становить плюс або мінус 0,2 2θ. У одному варіанті здійснення винахід відноситься до кристалічної форми гліколятної солі (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол2(3H)-ону, яка має порошкову рентгенівську дифрактограму по суті таку ж, як порошкова рентгенівська дифрактограма, показана на фіг.7, при вимірюванні з використанням випромінювання CuKα. Стосовно подробиць дивись приклад 7. Термін "по суті така ж" з посиланням на положення піків порошкової рентгенівської дифрактограми позначає, що беруть до уваги типове положення піку та варіабельність інтенсивності. Наприклад, спеціаліст у даній галузі техніки розуміє, що положення піків (2θ) о показують деяку варіабельність приладів, звичайно таку як 0,2 . Крім того спеціаліст у даній галузі техніки розуміє, що відносні інтенсивності піків показують варіабельність від приладу до приладу, а також варіабельність через ступінь кристалічності, переважної орієнтації, поверхні отриманого зразку та інших факторів, відомих спеціалісту у даній галузі техніки, та повинні прийматися тільки як якісні показники. Спеціаліст у даній галузі техніки також розуміє, що порошкова рентгенівська дифрактограма може бути отримана з похибкою вимірювання, яка залежить від використовуваних умов вимірювання. Зокрема, відомо, що інтенсивність у порошковій рентгенівській дифрактограмі може коливатися в залежності від використовуваних умов вимірювання. Додатково необхідно розуміти, що відносна інтенсивність може також варіюватися в залежності від умов експерименту, та, відповідно, точний порядок інтенсивності не потрібно брати до уваги. Крім того, похибка вимірювання кута дифракції для звичайної порошкової рентгенівської дифрактограми звичайно становить приблизно 5 % або менше, та такий ступінь помилки вимірювання необхідно брати до уваги у відношенні вищезгаданих кутів дифракції. Отже, необхідно розуміти, що кристалічні форми відповідно до даного винаходу не обмежені кристалічною формою, яка забезпечує порошкову рентгенівську дифрактограму, повністю ідентичну такій порошковій рентгенівській дифрактограмі, яка зображена на супутніх кресленнях 5, 6 та 7, описаних у даному описі. Будь-які кристалічні форми, які забезпечують порошкові рентгенівські дифрактограми, по суті ідентичні таким, які описано на супутніх кресленнях 5, 6 та 7, попадають у межі обсягу даного винаходу. Здатність уточнити значну ідентичність порошкових рентгенівських дифрактограм знаходиться у межах умінь звичайного спеціаліста у даній галузі техніки. Фармацевтично прийнятні сольвати у відповідності з винаходом включають такі, де розчинник кристалізації може бути ізотопно заміщений, наприклад, D 2О, d6-ацетон, d6-DMSO. Формула, представлена у даному описі, також призначена представляти немічені форми, а також форми сполуки, мічені ізотопами. Сполуки відповідно до винаходу, мічені ізотопами, мають структуру, зображену формулою, поданою у даному описі, за виключенням того, що один або більше атомів замінені атомом, що мають вибрану атомну масу або масове число. Приклади ізотопів, які можуть бути введені у сполуку відповідно до винаходу, включають ізотопи 2 3 11 13 14 15 18 31 водню, вуглецю, азоту, кисню, фосфору, фтору та хлору, такі як H, H, C, C, C, N, F, P, 32 35 36 125 P, S, Cl, I, відповідно. Винахід включає різні сполуки, мічені ізотопами, як визначено у 3 14 даному описі, наприклад, такі, у які введені радіоактивні ізотопи, такі як H та C, або такі, у 2 13 яких присутні нерадіоактивні ізотопи, такі як H та C. Такі сполуки, мічені ізотопами, є 14 застосовними у метаболічних дослідженнях (з C), дослідженнях кінетики реакції (з, наприклад, 2 3 H або H), методиках визначення або візуалізації, таких як позитронно-емісійна томографія 10 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 60 (PET) або однофотонна емісійна комп'ютерна томографія (SPECT), включаючи дослідження 18 тканинного розподілу субстрату або при променевому лікуванні пацієнтів. Зокрема, F або мічена сполука можуть бути особливо бажані для досліджень PET або SPECT. Сполуки формули (I), мічені ізотопами, можуть, як правило, бути отримані за звичайними методиками, відомими спеціалісту у галузі техніки, або за способами, аналогічними описаним у супутніх прикладах з використанням відповідних реагентів, мічених ізотопами, замість немічених реагентів, використовуваних раніше. 2 Крім того, заміна більш важкими ізотопами, особливо дейтерієм (тобто, H або D), може давати певні терапевтичні переваги у результаті більшої метаболічної стабільності, наприклад, збільшення періоду напівжиття in vivo або зниження дозування або поліпшення терапевтичного індексу. Розуміють, що дейтерій у такому контексті розцінюється як замісник сполуки формули (I). Концентрація такого більш важкого ізотопу, зокрема, дейтерію, може бути визначена за фактором збагачення ізотопом. Термін "фактор збагачення ізотопом", як використовується у даному описі, позначає співвідношення між поширеністю ізотопу та природньою поширеністю даного ізотопу. Якщо замісником у сполуці відповідно до даного винаходу зазначений дейтерій, така сполука має ізотопне збагачення для кожного позначеного атому дейтерію щонайменше 3500 (52,5 % включення дейтерію на кожному позначеному атомі дейтерію), щонайменше 4000 (60 % включення дейтерію), щонайменше 4500 (67,5 % включення дейтерію), щонайменше 5000 (75 % включення дейтерію), щонайменше 5500 (82,5 % включення дейтерію), щонайменше 6000 (90 % включення дейтерію), щонайменше 6333,3 (95 % включення дейтерію), щонайменше 6466,7 (97 % включення дейтерію), щонайменше 6600 (99 % включення дейтерію) або щонайменше 6633,3 (99,5 % включення дейтерію). Сполука відповідно до винаходу може бути здатна утворювати співкристали з підходящими утворювачами співкристалів. Такі співкристали можуть бути отримані зі сполуки формули (I) за допомогою відомих методик утворення співкристалів. Такі методики включають подрібнення, нагрівання, спільну сублімацію, сумісне плавлення або контактування у розчині сполуки формули (I) з утворювачами співкристалів в умовах кристалізації та виділення співкристалів, отриманих таким чином. Підходящі утворювачі співкристалів включають такі, які описані у WO 2004/078163. Отже, винахід додатково забезпечує співкристали, що містять сполуку формули (I). Як використовується в даному описі, термін "фармацевтично прийнятний носій" включає будь-який та всі розчинники, дисперсійні середовища, покриття, поверхнево-активні речовини, антиоксиданти, консерванти (наприклад, антибактеріальні засоби, протигрибкові засоби), ізотонічні засоби, засоби, що уповільнюють абсорбцію, солі, консерванти, стабілізатори лікарських засобів, зв'язуючі речовини, ексципієнти, дезінтегруючі речовини, змащуючі засоби, підсолоджувачі, ароматизатори, барвники та т.п. та їх комбінації, як розуміє спеціаліст у галузі техніки (див., наприклад, Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329). Крім випадків, коли будь-який звичайний носій є несумісним з активним інгредієнтом, передбачається його застосування у терапевтичних або фармацевтичних композиціях. Термін "терапевтично ефективна кількість" сполуки відповідно до даного винаходу відноситься до кількості сполуки відповідно до даного винаходу, яка викликає у пацієнта біологічну або медичну відповідь, наприклад, зниження або пригнічення активності ферменту або білку, або полегшує симптоми, полегшує стани, уповільнює або відкладає прогресування захворювання або запобігає розвитку захворювання та т.д. У одному необмежуючому варіанті здійснення термін "терапевтично ефективна кількість" відноситься до кількості сполуки відповідно до даного винаходу, яка при введенні пацієнту є ефективною для (1) щонайменше часткового полегшення, інгібування, запобігання та/або покращення стану, або розладу, або захворювання, асоційованого з активністю бета-2-адренорецептору, або (2) збільшення або забезпечення активності бета-2-адренорецептору. У іншому необмежуючому варіанті здійснення термін "терапевтично ефективна кількість" відноситься до кількості сполуки відповідно до даного винаходу, яка при введенні у клітину, або тканину, або неклітинний біологічний матеріал, або середовище є ефективною для щонайменше часткового збільшення або забезпечення активності бета-2-адренорецептору. Значення терміну "терапевтично ефективна кількість", як проілюстровано у вищевказаному варіанті здійснення для бета-2-адренорецептору, також має те ж значення відносно будь-яких інших білків/пептидів/ферментів, таких як IGF-1 міметики або блокатори ActRIIB/міостатину та т.п. Як використовується у даному описі, термін "пацієнт" відноситься до тварини. Звичайно твариною є ссавець. Пацієнт також відноситься до, наприклад, приматів (наприклад, людей, 11 UA 114295 C2 5 10 15 20 25 30 чоловіків або жінок), корів, овець, кіз, коней, собак, кішок, кроликів, щурів, мишей, риб, птахів та т.п. У певних варіантах здійснення пацієнтом є примат. У ще одному варіанті здійснення пацієнтом є людина. Як використовується у даному описі, термін "інгібує", "інгібування" або "інгібуючи" відноситься до зниження або пригнічення заданого стану, симптому або розладу, або захворювання або достовірного зниження вихідного рівня біологічної активності або процесу. Як використовується у даному описі, термін "лікувати", "що зазнає лікування" або "лікування" будь-якого захворювання або розладу відноситься у одному варіанті здійснення до полегшення захворювання або розладу (тобто уповільнення, або зупинки, або зменшення розвитку захворювання або щонайменше одного з його клінічних симптомів). У іншому варіанті здійснення "лікувати", "що зазнає лікування" або "лікування" відноситься до полегшення або поліпшення щонайменше одного фізичного параметру, включаючи такі, які можуть не відчуватися пацієнтом. У ще одному варіанті здійснення "лікувати", "зазнає лікування" або "лікування" відносяться до модуляції захворювання або розладу або фізично (наприклад, стабілізація певного симптому), або фізіологічно (наприклад, стабілізація фізичного параметру), або обох. У ще одному варіанті здійснення "лікувати", "що зазнає лікування" або "лікування" відносяться до попередження або відстрочення початку або розвитку або прогресування захворювання або розладу. Як використовується у даному описі, пацієнт "потребує" лікування, якщо такий пацієнт у результаті такого проведеного лікування одержить користь біологічно, з медичної точки зору або у відношенні якості життя. Як використовується у даному описі, термін у однині, використовувані у контексті даного винаходу (особливо у контексті формули винаходу), повинні розцінюватися як такі, що охоплюють і однину, і множину, якщо не зазначено інше у даному описі або чітко не диктується контекстом. Усі методи, описані у даному описі, можуть бути здійснені у будь-якому підходящому порядку, якщо не зазначено інше або іншим способом чітко не диктується контекстом. Застосування будь-якого та всіх прикладів або приблизного виразу (наприклад, "такий як"), забезпечуваних у даному описі, призначене тільки для кращої ілюстрації винаходу та не вносить обмежень у межі обсягу винаходу, якщо не заявлене інакше. Сполука формули (I) може бути отримана у відповідності зі схемою, представленою нижче. Стадії процесу більш детально описані нижче. 12 UA 114295 C2 5 10 15 20 Стадія 1: Сполука формули (VIa), де Hal являє собою галоген, та R a являє собою захисну групу, взаємодіє зі сполукою формули RbOH, де Rb є захисною групою, у присутності підходящої основи, наприклад, триетиламіну, з одержанням сполуки формули (Va), де Hal являє собою галоген, та Ra та Rb являють собою захисні групи. Стадія 2: Сполуку формули (Va) взаємодіє з підходящою сильною основою, наприклад, трет-бутиллітієм, у підходящому розчиннику, наприклад, тетрагідрофурані (THF), у присутності підходящого карбонілюючого засобу, наприклад, підходящого аміду, з одержанням сполуки формули (IVa), де Ra та Rb являють собою захисні групи, та Rc є воднем або будь-яким компонентом, що походить з карбонілюючого засобу. Стадія 3: Сполуку формули (IVa) необов'язково функціоналізують перед стереоселективною конверсією з одержанням сполуки формули (IIIa), де R a та Rb являють собою захисні групи, та LG являє собою відхідну групу. Стадія 4: Сполуку формули (IIIa) обробляють підходящим основою, наприклад, бікарбонатом натрію, з одержанням сполуки формули (IIa), де R a та Rb являють собою захисні групи. Стадія 5: Сполука формули (IIa) або (IIIa) взаємодіє з 2-(4-бутоксифеніл)-1,1диметилетиламіном у підходящому розчиннику, наприклад, толуолі, необов'язково у присутності підходящої основи, наприклад, карбонату калію, з наступним депротектуванням у присутності підходящої кислоти, наприклад, соляної кислоти, з одержанням сполуки формули (I). У додатковому аспекті винахід відноситься до способу одержання сполуки формули (I), у вільній формі або у формі фармацевтично прийнятної солі, що включає: a) реакцію сполуки формули (IIa) у вільній формі або у формі фармацевтично прийнятної солі O S ORb N RaO 25 30 (IIa) у якій Ra та Rb являють собою захисні групи, з 2-(4-бутоксифеніл)-1,1-диметилетиламіном; b) відщеплення будь-яких все ще присутніх захисних груп; c) відновлення отриманої таким чином сполуки формули (I) у вільній формі або у формі фармацевтично прийнятної солі. У додатковому аспекті винахід відноситься до способу одержання сполуки формули (I) у вільній формі або у формі фармацевтично прийнятної солі, який включає стадії: a) реакції сполуки формули (IIIa) у вільній формі або у формі фармацевтично прийнятної солі LG HO S ORb N RaO 35 40 (IIIa) у якій Ra та Rb являють собою захисні групи, та LG являє собою відхідну групу, з 2-(4бутоксифеніл)-1,1-диметилетиламіном; b) відщеплення будь-яких все ще присутніх захисних груп; c) відновлення отриманої таким чином сполуки формули (I) у вільній формі або у формі фармацевтично прийнятної солі. У іншому аспекті винахід відноситься до способу одержання сполуки формули (IIIa), у вільній формі або у формі фармацевтично прийнятної солі, 13 UA 114295 C2 LG HO S ORb N RaO (IIIa) що включає стереоселективне відновлення сполуки формули (IVa-2) у вільній формі або у формі фармацевтично прийнятної солі LG O S ORb N RaO 5 10 15 20 25 (IVa-2) у якій Ra та Rb являють собою захисні групи, та LG являє собою відхідну групу, з одержанням сполуки формули (IIIa) у вільній формі або у формі фармацевтично прийнятної солі. У способах відповідно до винаходу звичайні захисні групи включають ізопропіл, трет-бутил, трет-бутилдиметилсиліл. У способах відповідно до винаходу типові відхідні групи включають хлорид, птолуолсульфоніл, бромід, метансульфоніл, бензолсульфоніл, йодид. Реакції можуть бути здійснені у відповідності зі звичайними методами, наприклад, як описано у прикладах. Обробку реакційних сумішей та очищення сполук, отриманих таким чином, можна проводити у відповідності з відомими методиками. Адитивні солі кислот можуть бути отримані з вільних основ відомим способом та навпаки. Сполука формули (I) також може бути отримана додатковими звичайними способами, наприклад, як описано у прикладах, такі способи є додатковими аспектами винаходу. Використовувані вихідні матеріали є відомими або можуть бути отримані у відповідності зі звичайними методиками, починаючи з відомих сполук, наприклад, як описано у прикладах. Винахід додатково включає будь-який варіант даних способів, у якому проміжний продукт, одержуваний на будь-який стадії, використовують як вихідний матеріал та проводять решту стадій, або у яких вихідні матеріали утворюються in situ в умовах реакції, або у яких компоненти реакції використовують у формі їх солей або оптично чистого матеріалу. Сполука відповідно до винаходу та проміжні продукти також можуть бути перетворені одне у інше у відповідності з методами, звичайно відомими спеціалісту у даній галузі техніки. У додатковому аспекті винахід відноситься до сполуки формули (IIa) у вільній формі або у формі фармацевтично прийнятної солі O S ORb N RaO 30 (IIa) де Ra та Rb являють собою захисні групи. Ra та Rb можуть бути незалежно вибрані з групи, що включає трет-бутил, ізопропіл та третбутилдиметилсиліл. У додатковому аспекті винахід відноситься до сполуки формули (IIIa-2) у вільній формі або у формі фармацевтично прийнятної солі 14 UA 114295 C2 Cl HO S ORb N RaO 5 (IIIa-2) де Ra та Rb являють собою захисні групи. Ra та Rb можуть бути незалежно вибрані з групи, що включає трет-бутил, ізопропіл та третбутилдиметилсиліл. У додатковому аспекті винахід відноситься до сполуки формули (Ia) у вільній формі або у формі фармацевтично прийнятної солі, O HN HO S ORb RaO 10 15 20 25 30 35 N (Ia) де Ra та Rb являють собою захисні групи. Ra та Rb можуть бути незалежно вибрані з групи, що включає трет-бутил, ізопропіл та третбутилдиметилсиліл. У іншому аспекті даний винахід забезпечує фармацевтичну композицію, що містить сполуку відповідно до даного винаходу у вільній формі або у формі фармацевтично прийнятної солі та фармацевтично прийнятний носій. Зокрема, винахід відноситься до фармацевтичної композиції, яка містить терапевтично ефективну кількість сполуки формули (I) у вільній формі та один або більше фармацевтично прийнятних носіїв. У одному варіанті здійснення винахід відноситься до фармацевтичної композиції, яка містить терапевтично ефективну кількість сполуки формули (I) у формі фармацевтично прийнятної солі та один або більше фармацевтично прийнятних носіїв. У іншому варіанті здійснення винахід відноситься до фармацевтичної композиції, яка містить терапевтично ефективну кількість сполуки формули (I) у формі ацетатної солі та один або більше фармацевтично прийнятних носіїв. У ще одному варіанті здійснення винахід відноситься до фармацевтичної композиції, яка містить терапевтично ефективну кількість сполуки формули (I) у формі гліколятної солі та один або більше фармацевтично прийнятних носіїв. Фармацевтична композиція може бути складена для певних шляхів введення, таких як пероральне введення, крізьшкірне введення, парентеральне введення, ректальне введення, підшкірне введення та др. Крім того, фармацевтичні композиції відповідно до даного винаходу можуть бути отримані у твердій формі (включаючи без обмеження капсули, таблетки, пігулки, гранули, порошки або супозиторії), або у рідкій формі (включаючи без обмеження розчини, суспензії або емульсії). Фармацевтичні композиції можуть бути піддані звичайним фармацевтичним діям, таким як стерилізація, та/або можуть містити звичайні інертні розріджувачі, змащуючі речовини або буфери, а також добавки, такі як консерванти, стабілізатори, зволожуючі засоби, емульгатори та буфери та інші. Звичайно фармацевтичні композиції являють собою таблетки або желатинові капсули, що містять активний інгредієнт разом з a) розріджувачами, наприклад, лактозою, декстрозою, сахарозою, манітом, сорбітом, целюлозою та/або гліцином; b) змащующими засобами, наприклад, діоксидом кремнію, тальком, стеариновою кислотою, її сіллю магнію або кальцію та/або поліетиленгліколем; для таблеток також 15 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 c) зв'язуючими засобами, наприклад, алюмосилікатом магнію, крохмальною пастою, желатином, трагакантом, метилцелюлозою, карбоксиметилцелюлозною натрію та/або полівінілпіролідоном; якщо бажано d) дезінтегруючими засобами, наприклад, крохмалями, агаром, альгіновою кислотою або її натрієвою сіллю, або шипучими сумішами; та/або e) абсорбентами, барвниками, ароматизаторами та підсолоджувачами. Таблетки можуть бути або покриті плівковим покриттям, або покриті кишковорозчинимим покриттям у відповідності з методами, відомими у галузі техніки. Підходящі композиції для перорального введення включають ефективну кількість сполуки відповідно до винаходу у формі таблеток, пастилок, водних або масляних суспензій, диспергуємих порошків або гранул, емульсії, твердих або м'яких капсул або сиропів або еліксирів. Композиції, призначені для перорального застосування, отримують у відповідності з будь-яким методом, відомим у галузі техніки для одержання фармацевтичних композицій, та такі композиції можуть містити один або більше засобів, вибраних з групи, що складається з підсолоджувачів, ароматизаторів, барвників та консервантів, з метою забезпечення фармацевтично вдалих та приємних на смак препаратів. Таблетки можуть містити активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними ексципієнтами, які є підходящими для виробництва таблеток. Такі ексципієнти являють собою, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулюючі та дезінтегруючі засоби, наприклад, кукурудзяний крохмаль або альгінова кислота; зв'язуючі засоби, наприклад, крохмаль, желатин або аравійська камедь; та змащуючі засоби, наприклад, стеарат магнію, стеаринова кислота або тальк. Таблетки не мають покриття або забезпечуються покриттям за допомогою відомих методик для уповільнення розкладання та абсорбції у шлунково-кишковому тракті та таким чином забезпечення безперервної дії впродовж більш тривалого періоду. Наприклад, можуть бути використані матеріали для відстрочки часу, такі як гліцерилмоностеарат або гліцерилдистеарат. Склади для перорального застосування можуть бути представлені у вигляді твердих желатинових капсул, де активний інгредієнт змішують із інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, де активний інгредієнт змішують із водним або масляним середовищем, наприклад, арахісовим маслом, рідким парафіном або маслиновим маслом. Сполуку відповідно до винаходу можна вводити перорально доклінічним видам у вигляді рідкої лікарської форми з лікарським засобом у розчині або у суспензійному носії. Носіїрозчинники можуть складатися з поверхнево-активної речовини (наприклад, кремофору або солютолу), розчиннику (наприклад, пропіленгліколю) та буферного засобу (наприклад, цитратного буферу). Склади суспензій можуть містити поверхнево-активну речовину (наприклад, Tween 80), полімерний засіб (наприклад, метилцелюлозу (МЦ)) та буферний засіб (наприклад, фосфат). Приклади сполук розчинів, що підходять для доклінічних досліджень представлені нижче: Інгредієнт (% мас./мас.) Розчин 1 Розчин 2 Кремофор RH40 10 Солютол HS15 10 Цитратний буфер 50 мМ, рН 3 90 90 Одержання: вільну основу або ацетатну сіль (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-она) спочатку розчиняють у поверхневоактивній речовині та перемішують до одержання розчину. Потім додають буфер, та розчин перемішують для забезпечення прозорого розчину. Склади розчинів 1 та 2 здатні підтримувати дозу аж до 10 мг/мл. Обидва склади є хімічно та фізично стабільними після 1 тижня при к.т. Приклади складів суспензій, що підходять для доклінічних досліджень, представлені нижче: Інгредієнт (% мас./мас.) Суспензія 1 Суспензія 2 0,5 % МЦ у 50 мМ рН 6,8 фосфатний буфер 100 99,5 Tween 80 0,5 Одержання: (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5гідроксибензо[d]тіазол-2(3H)-он) диспергують у поверхнево-активній речовині та змішують для гомогенізації суспензії. Потім по краплях додають полімерний розчин та перемішують. Гомогенну суспензію отримують з дрібними частинками. Суспензія є хімічно та фізично стабільною після 1 тижня при к.т. Певними ін'єкційними композиціями є водні ізотонічні розчини або суспензії, та супозиторії переважно отримують з жирних емульсій або суспензій. Зазначені композиції можуть бути стерилізовані та/або містити ад'юванти, такі як консервуючі, стабілізуючі, зволожуючі або 16 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 емульгуючі засоби, стимулятори розчинення, солі для регуляції осмотичного тиску та/або буфери. Крім того, вони також можуть містити інші терапевтично важливі речовини. Зазначені композиції отримують у відповідності зі звичайними методиками змішування, гранулювання або покриття оболонкою, відповідно, та містять приблизно 0,1-75 % або містять приблизно 1-50 % активного інгредієнту. Підходящі композиції для підшкірного введення включають, наприклад, сполуку відповідно до винаходу з 2,5 % полоксамеру 407 у 0,9 % хлориді натрію. Приклади підходящих обладнань для ін'єкційних композицій включають інфузійні помпи, такі як система Insulet's OmniPod. Сполуку відповідно до винаходу також можна вводити шляхом багатодозових підшкірних ін'єкцій з використанням автоінжектору або ручки інжектора. Композиції сполук, що підходять для такої підшкірної ін'єкції, представлені нижче. Компонент Склад 1 Склад 2 Сполука А 1,00 мг 1,00 мг Оцтова кислота 0,60 мг 0,60 мг Маніт 50 мг 50 мг Бензиловий спирт 8,00 мг 10,00 мг 1 н. гідроксид натрію Доведення до рН 5,0 Доведення до рН 5,0 Вода для ін'єкцій Додати до 1,016 г Додати до 1,016 г Було виявлено, що бензиловий спирт (у порівнянні з фенолом або м-крезолом) є особливо підходящим консервантом для складів для підшкірних ін'єкцій. Отже, у одному варіанті здійснення винаходу забезпечують фармацевтичну композицію, що містить терапевтично ефективну кількість сполуки A або її фармацевтично прийнятної солі (наприклад, сполуки A у формі ацетатної солі) та бензиловий спирт. У додатковому варіанті здійснення винаходу забезпечують фармацевтичну композицію, що містить терапевтично ефективну кількість сполуки A або її фармацевтично прийнятної солі (наприклад, сполуки A у формі ацетатної солі) та між 0,1 та 10; 0,1 та 5; 0,5 та 2; 0,5 та 1,5; або 0,9 та 1,1 % (мас./об.) бензилового спирту. Підходящі композиції для трансдермального застосування включають ефективну кількість сполуки відповідно до винаходу з підходящим носієм. Носії, що підходять для трансдермальної доставки, включають усмоктувані фармакологічно прийнятні розчинники для полегшення проходження через шкіру хазяїна. Комбінація PG/OA (пропіленгліколь/олеїловий спирт) являє приклад підходящого розчиннику. Наприклад, трансдермальні пристрої можуть бути у формі пов'язки, що включає основний шар, резервуар, що містить сполуку необов'язково з носіями, необов'язково бар'єр, що контролює швидкість доставки сполуки у шкіру хазяїна з контрольованою та заздалегідь визначеної швидкістю впродовж тривалого періоду часу, та засоби для кріплення пристрою на шкірі. Підходящі композиції для місцевого застосування, наприклад, на шкірі та очах, включають водні розчини, суспензії, мазі, креми, гелі або розпорошувані склади, наприклад, для введення за допомогою аерозолю або подібного. Такі системи для місцевої доставки, зокрема, є підходящими для шкірного застосування. Вони є особливо пристосованими для застосування у місцевих, включаючи косметичні, складах, добре відомих у галузі техніки. Вони можуть містити розчинники, стабілізатори, засоби, що підсилюють тонічність, буфери та консерванти. Як використовується у даному описі, місцеве застосування може також відноситися до інгаляції або до інтраназального застосування. Такі зручно вводити у формі сухого порошку (або окремо, у вигляді суміші, наприклад, сухої суміші з лактозою, або часток змішаних компонентів, наприклад, з фосфоліпідами) з інгалятору сухого порошку або аерозольного спрею з герметичного контейнеру, насосу, розпилювача, пульверизатора або небулайзера з або без використання підходящого пропелента. Даний винахід додатково забезпечує безводні фармацевтичні композиції та лікарські форми, що містять сполуку відповідно до даного винаходу як активний інгредієнт, тому що вода полегшує розкладання певних сполук. Безводні фармацевтичні композиції та лікарські форми відповідно до винаходу можуть бути отримані з використанням безводних інгредієнтів або інгредієнтів з низьким вмістом рідини та умов з низьким вмістом вологи або низкою вологості. Безводна фармацевтична композиція може бути отримана та зберігатися при збереженні її безводної природи. Відповідно, безводні композиції упаковують з використанням матеріалів, відомих як такі, що запобігають впливу води, таким чином, щоб їх можна було включати у підходящі рецептурні набори. Приклади підходящих упакувань включають, але не обмежуються перерахованими, герметично закриті фольгові упакування, пластикові упакування, однодозові контейнери (наприклад, флакони), блістерні упакування та контурні упакування. 17 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід додатково забезпечує фармацевтичні композиції та лікарські форми, які містять один або більше засобів, які знижують швидкість, з якою сполука відповідно до даного винаходу розкладається як активний інгредієнт. Такі засоби, які називають у даному описі як "стабілізатори, " включають, але не обмежуються перерахованими, антиоксиданти, такі як аскорбінова кислота, рН буфери або сольові буфери і т.д. Сполука формули (I) у вільній формі або у формі фармацевтично прийнятної солі проявляє цінні фармакологічні властивості, наприклад, властивості модуляції бета-2-адренорецепторів, наприклад, як показано у дослідженнях in vitro та in vivo, як презентовано у наступних розділах, та, отже, показані для терапії або для застосування як досліджувані хімічні речовини, наприклад, як робочі сполуки. Сполука відповідно до винаходу може бути застосовна у лікуванні показань, вибраних з: м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії. Отже, як додатковий варіант здійснення даний винахід забезпечує сполуку формули (I), як визначено у даному описі, як лікарський засіб. У одному варіанті здійснення даний винахід відноситься до сполуки формули (I) для застосування як лікарський засіб. У додатковому варіанті здійснення даний винахід відноситься до сполуки формули (I) для застосування у лікуванні або профілактиці м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії. Отже, як додатковий варіант здійснення, даний винахід забезпечує застосування сполуки формули (I) у терапії. У додатковому варіанті здійснення терапію вибирають з захворювання, яке можна лікувати активацією бета-2-адренорецепторів. У іншому варіанті здійснення захворювання вибирають з м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії. У іншому варіанті здійснення винахід забезпечує спосіб лікування захворювання, яке лікують активацією бета-2-адренорецепторів, що включає введення терапевтично прийнятної кількості сполуки формули (I). У додатковому варіанті здійснення захворювання вибирають з м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії. Отже, додатковий аспект винаходу відноситься до способу лікування або профілактики м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії, що включає введення терапевтично ефективної кількості сполуки формули (I) у вільній формі або у формі фармацевтично прийнятної солі, пацієнту, який цього потребує. Як додатковий варіант здійснення даний винахід забезпечує застосування сполуки формули (I) для одержання лікарського засобу. У додатковому варіанті здійснення лікарський засіб призначено для лікування захворювання або розладу, яке можна лікувати активацією бета-2 адренорецепторів. У іншому варіанті здійснення захворювання вибирають з вищезгаданого переліку, відповідно, м'язової атрофії, зокрема, м'язової дистрофії, атрофії від бездіяльності, кахексії або саркопенії. Сполуку відповідно до даного винаходу можна вводити або одночасно з, або до, або після одного або більше інших терапевтичних засобів. Сполуку відповідно до даного винаходу можна вводити окремо за допомогою того ж або іншого шляху введення або разом з тією ж фармацевтичною композицією як інші засоби. У одному варіанті здійснення винахід забезпечує продукт, що містить сполуку формули (I) та щонайменше один інший терапевтичний засіб як комбінований препарат для одночасного, окремого або послідовного застосування у лікуванні. У одному варіанті здійснення терапія являє собою лікування захворювання або стану, що модулюється агонізмом до бета-2 адренорецепторів. Продукти, представлені у вигляді комбінованого препарату, включають композицію, що містить сполуку формули (I) та інший терапевтичний засіб(засоби) разом у одній фармацевтичній композиції, або сполуку формули (I) та інший терапевтичний засіб(засоби) у окремій формі, наприклад, у формі набору. У одному варіанті здійснення винахід забезпечує фармацевтичну композицію, що містить сполуку формули (I) та інший терапевтичний засіб(засоби). Необов'язково фармацевтична композиція може містити фармацевтично прийнятний ексципієнт, як описано вище. Отже, додатковий аспект винаходу відноситься до комбінації, яка містить терапевтично ефективну кількість сполуки формули (I) та один або більше терапевтично активних сприяючих засобів. У одному варіанті здійснення винахід забезпечує набір, що включає дві або більше окремих фармацевтичних композицій, щонайменше одна з яких містить сполуку формули (I). У одному варіанті здійснення набір включає засоби для окремого зберігання зазначених композицій, такі як контейнер, розділений бутель або розділений фольговий пакет. Прикладом такого набору є блістерне упакування, яке звичайно використовується для упаковки таблеток, капсул та т.п. Набір відповідно до винаходу може бути використаний для введення різних лікарських форм, наприклад, пероральних та парентеральних, для введення окремих композицій з різними 18 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 60 інтервалами введення, або для титрування окремих композицій однієї відносно іншої. Для сприяння дотриманню режиму лікування набір відповідно до винаходу звичайно включає інструкції щодо застосування. У комбінованій терапії відповідно до винаходу сполуку відповідно до винаходу та інший терапевтичний засіб може виробляти та/або складати один і той же або різні виробники. Більше того, сполука відповідно до винаходу та інший терапевтичний засіб можуть бути об'єднані у комбінованій терапії: (i) перед виписуванням комбінованого продукту лікарем (наприклад, у випадку набору, що включає сполуку відповідно до винаходу та інший терапевтичний засіб); (ii) самим лікарем (або під керівництвом лікаря) безпосередньо перед введенням; (iii) самими пацієнтами, наприклад, під час послідовного введення сполуки відповідно до винаходу та іншого терапевтичного засобу. Відповідно, винахід забезпечує застосування сполуки формули (I) для лікування захворювання або стану, опосередкованого агонізмом до бета-2 адренорецепторів, де лікарський засіб отримують для введення з іншим терапевтичним засобом. Винахід також забезпечує застосування іншого терапевтичного засобу для лікування захворювання або стану, опосередкованого агонізмом до бета-2 адренорецепторів, де лікарський засіб вводять зі сполукою формули (I). Винахід також забезпечує сполуку формули (I) для застосування у способі лікування захворювання або стану, що модулюються агонізмом до бета-2 адренорецепторів, де сполуку формули (I) отримують для введення з іншим терапевтичним засобом. Винахід також забезпечує інший терапевтичний засіб для застосування у способі лікування захворювання або стану, що модулюється агонізмом до бета-2 адренорецепторів, де інше терапевтичний засіб отримують для введення зі сполукою формули (I). Винахід також забезпечує сполуку формули (I) для застосування у способі лікування захворювання або стану, що модулюється агонізмом до бета-2 адренорецепторів, де сполуку формули (I) вводять із іншим терапевтичним засобом. Винахід також забезпечує інший терапевтичний засіб для застосування у способі лікування захворювання або стану, що модулюється агонізмом до бета-2 адренорецепторів, де інший терапевтичний засіб вводять зі сполукою формули (I). Винахід також забезпечує застосування сполуки формули (I) для лікування захворювання або стану, що модулюється бета-2 адренорецепторами, де пацієнта раніше (наприклад, впродовж 24 годин) лікували іншим терапевтичним засобом. Винахід також забезпечує застосування іншого терапевтичного засобу для лікування захворювання або стану, що модулюється бета-2 адренорецепторами, де пацієнта раніше (наприклад, впродовж 24 годин) лікували сполукою формули (I). У одному варіанті здійснення терапевтичний засіб вибирають з тестостерону, агоністів андрогенів або SARM (селективних модуляторів рецепторів андрогенів); IGF-1 міметиків; блокаторів міостатину та його рецептору ActRIIA/B; блокаторів TGFбета та активіну (як засоби проти атрофії); інгібіторів лігази Muf1/MAFbx E3; інгібіторів HDAC або будь-яких онколітичних засобів (наприклад, для ракової кахексії); протизапальних засобів, таких як НПВС, блокаторів TNF або IL-1b; метаболічних модуляторів, таких як агоністи PPAR або міметики IL-15; серцевосудинних засобів, таких як блокатори b(1) (наприклад, небівалол) або ARB (наприклад, для кардіальної кахексії); антисмислових олігонуклеотидів для пропуску екзонів (наприклад, для дистрофії); посилювачів апетиту, таких як грелін, прогестин або антагоністи MC-4; харчових добавок з високим вмістом білку та т.п. Фармацевтична композиція або комбінація відповідно до даного винаходу може знаходитися у стандартному дозуванні приблизно 0,05-1000 мг активного інгредієнту для пацієнта масою приблизно 50-70 кг, або приблизно 0,05-500 мг, або приблизно 0,05-250 мг, або приблизно 0,05150 мг, або приблизно 0,05-100 мг, або приблизно 0,05-50 мг, або приблизно 0,05-10 мг активних інгредієнтів. Терапевтично ефективне дозування сполуки, фармацевтичної композиції або їх комбінації залежить від виду пацієнта, маси тіла, віку та індивідуального стану, захворювання або розладу, що лікують, або його важкості. Звичайний лікар, клініцист або ветеринар може легко визначити ефективну кількість кожного з активних інгредієнтів, необхідну для попередження, лікування або інгібування прогресування розладу або захворювання. Вищезазначені властивості дозувань демонструють у дослідженнях in vitro та in vivo з використанням переважно ссавців, наприклад, мишей, щурів, собак, мавп, або виділених органів, тканин та їх препаратів. Сполуку відповідно до даного винаходу можна застосовувати in vitro у формі розчинів, наприклад, водних розчинів, та in vivo або ентерально, або парентерально, переважно підшкірно, наприклад, у вигляді суспензії або водного розчину. -3 -9 Дозування in vitro може варіюватися між приблизно 10 молярною та 10 молярною концентраціями. Терапевтично ефективна кількість in vivo може варіюватися в залежності від 19 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 60 шляху введення між приблизно 0,01-500 мг/кг, або між приблизно 0,01-100 мг/кг, або між приблизно 0,01-1 мг/кг, або між приблизно 0,01-0,1 мг/кг. Активність сполуки відповідно до даного винаходу може бути оцінена наступним методом in vitro. Крім того, методи in vivo додатково описані у прикладах. Тест 1: функціональний клітинний аналіз in vitro з використанням клітин CHO та клітин скелетних м'язів цАМФ: Людські клітини скелетних м'язів (skMC) отримували від Cambrex (каталожний № CC2561) та культивували у Skeletal Basal Medium (SKBM), отриманій від Cambrex (каталожний № #CC-3161). Відповіді цАМФ вимірювали з використанням цАМФ динамічного 2 порційного набору для HTRF-Assay, отриманого від Cisbio or Cis Competitive Intelligence (каталожний № 62AM4PEC). Клітини skMC культивували впродовж 1 дня у середовищі для культивування клітин SKBM, доповненому 20 % FCS у 384-лункових планшетах при 37C, 5 % CО2. На наступний день клітини промивали двічі за допомогою 50 мкл PBS, та диференціювали впродовж 3 днів у середовищі SKBM без сироватки у присутності 1 мкМ SB431542, інгібітору ALK 4/5, отриманого від Sigma (каталожний № S4317) при 37C, 7,5 % CО2. На 4 день, SKBM без сироватки, доповненого 1 мкМ SB431542, видаляли, клітини промивали двічі за допомогою 50 мкл PBS та додатково диференціювали впродовж 1 дня у SKBM без сироватки без SB431542 (50 мкл на лунку) при 37C, 7,5 % CО2. Щурячі skMC та клітини кардіоміоцитів виділяли у новонароджених щурів стандартним чином та обробляли, як описано вище. Клітини яєчника китайського хом'яка (CHO) стабільно трансфіковані людськими β-адренорецепторами (β1 або β2), отримували у Novartis Institutes for BioMedical Research та культивували, як описано раніше (J Pharmacol Exp Ther. 2006 May; 317(2):762-70). Сполуки отримували у стимулюючому буфері у 2-разовій потрібній концентрації, та серійні розведення у стимуляційному буфері 1:10 отримували у 96-лунковому планшеті (U-form). DMSO контроль нормалізували за вмістом DMSO найвищого розведення, наприклад, 0,1 % DMSO (2) -5 для концентрації 10 M (2) першого розведення сполуки. Дослідження проводили у 384лункових планшетах у 20 мкл стимуляційного об'єму та аналізі кінцевого об'єму 40 мкл на лунку. У день експерименту культуральне середовище видаляли з 384-лункових планшетів для культивування клітин шляхом перегортання та змахування на папір 2-3 рази. У 384-лунковий планшет спочатку додавали 10 мкл свіжого культурального середовища на лунку. Після 10 хвилин інкубації при кімнатній температурі, до клітин додавали робочі розведення сполук 10 мкл на лунку, та інкубували впродовж 30 хвилин при кімнатній температурі у темноті. Впродовж цього часу робочі розчини реагентів отримували шляхом розведення маточного розчину анти cAMP криптату та цАМФ D2 1:20 у лізуючому буфері, що поставляється з набором. Після 30 хвилин інкубації сполуки, 10 мкл cAMP-D2 та 10 мкл анти cAMP криптату послідовно додавали до аналізуємих планшетів. Після 1 години інкубації при кімнатній температурі у темноті проводили вимірювання за допомогою PheraStar (довжина хвилі збудження: 337 нм, довжини хвиль випромінювання: 620 та 665 нм). 2+ Ca : Клітинну лінію людських адренергічних Alpha1A CHO-K1 придбавали у Perkin Elmer (ValiScreen™ стабільна рекомбінантна клітинна лінія GPCR, каталожний № ES-036-C, партія № M1W-C1, Boston, Massachusetts, USA). За день до експерименту заморожені клітини Alpha1A (10 мільйонів на мл та на флакон) відтаювали на водяній бані при 37C. Суспензію клітин центрифугували впродовж 5 хвилин при 1000 об/хвил., та осад клітин ресуспендували у культуральному середовищі для клітин. Клітини висівали у чорні 384-лункові планшети з прозорим дном із щільністю 8000 клітин на лунку у 50 мкл середовища для культивування клітин. Планшети інкубували впродовж приблизно 24 годин при 37C, 5 % CО2. У день експерименту середовище видаляли з використанням промивача клітин (TECAN PW3). Після кінцевого промивання у лунках залишалось 10 мкл. Додавали 40 мкл навантажувального буферу, та клітини завантажували впродовж 60 хвил. при 37C, 5 % CО2. Планшети промивали TECAN PW3 20 мкл решти аналізуємого буферу та інкубували впродовж щонайменше 20 хвилин при КТ перед проведенням експерименту FLIPR. Потім сполуки характеризували за типом агоністу та/або антагоністу. Для підтвердження аналізу той же протокол використовували 2 зі свіжими клітинами. У такому випадку клітини відчіпляли від 150 см колби з використанням 3 мл Трипсин-EDTA, центрифугували та ресуспендували у середовищі для культивування клітин. Клітини стимулювали шляхом додавання 5 мкл сполук (5) з використанням головки FLIPR. Сполуки, що діють як агоністи, індукують транзиторне збільшення внутрішньоклітинного кальцію. Дані записували на системі FLIPR. Вимірювання вихідного сигналу спочатку записували кожну секунду впродовж 2 хвилин перед введенням сполук. Вимірювання кальцію проводили шляхом збудження клітин лазером на іонах аргону при 488 нм при потужності лазера 0,6 Вт, та реєстрували сигнал флуоресценції за допомогою камери CCD (апертура 0,4 сек) 20 UA 114295 C2 5 10 15 20 впродовж 2 хвилин. Нижній контроль (нестимульовані клітини) визначали з додаванням 5 мкл аналізуємого буферу. Верхній контроль визначали з додаванням 5 мкл відомого агоністу у високій концентрації EC100 (A-61603 при 1 мкΜ), та контрольну сполуку агоніст також додавали у кожен планшет. Сполука відповідно до винаходу проявляла активність у тесті 1 з EC 50 менше ніж 10 нМ. Специфічна активність показана у прикладі 10. Додаткові специфічні активності сполуки відповідно до винаходу описані у прикладах 11-15. Наступні приклади призначені для ілюстрації винаходу та не повинні розглядатися як обмежуючі його. Температури подані у градусах Цельсію. Якщо не зазначено інше, всі випарювання проводили при зниженому тиску, звичайно між приблизно 15 мм рт. ст. та 100 мм рт. ст. (=20-133 мбар). Структуру кінцевих продуктів, проміжних сполук та вихідних матеріалів підтверджували стандартними аналітичними методами, наприклад, мікроаналізом та спектроскопічними характеристиками, наприклад, МС, ІЧ, ЯМР. Використовувані скорочення є звичайними у галузі техніки. Все вихідні матеріали, структурних елементів, реагенти, кислоти, основи, дегідратуючі засоби, розчинники та каталізатори, використовувані для синтезу сполуки відповідно до даного винаходу, є або комерційно доступними, або можуть бути отримані за методами органічного синтезу, відомими звичайному спеціалісту у галузі техніки (Houben-Weyl 4th Ed. 1952, Methods of Organic Synthesis, Thieme, Volume 21). Крім того, сполука відповідно до даного винаходу може бути отримана за методами органічного синтезу, відомими звичайному спеціалісту у галузі техніки, як показано у наступних прикладах. Приклади Список скорочень: 1M одно молярний APCI хімічна іонізація при атмосферному тиску Водн. водний AR адренорецептор атм. атмосфера шир. широкий см сантиметри д дуплет дд дуплет дуплетів ддд дуплет дуплетів дуплетів (DHDQ)2PHAL 1,4-фталазинедііловий діефір гідрохінідину DMAC диметилацетамід DMSO диметилсульфоксид DSC диференціальна скануюча калориметрія ee енантіомерний надлишок екв. еквівалент ES електророзпилення г грами год. години ВЕРХ високоефективна рідинна хроматографія HRMS мас-спектроскопія з високим розділенням м мультиплет МЦ метилцелюлоза мбар мілібар MeOH метанол хвил. хвилини мл мілілітри МС мас-спектроскопія MTBE метил трет-бутиловий ефір нм нанометри ЯМР ядерний магнітний резонанс RT час утримання к.т. кімнатна температура с синглет насич. насичений септ. септет т триплет 21 UA 114295 C2 5 10 15 20 25 30 35 40 45 TFA трифтороцтова кислота мкм мікрометри мас/об маса/об'єм XRPD порошкова рентгенівська дифракція Якщо не зазначено інше, спектри ВЕРХ/МС реєстрували на Agilent 1100 серії LC/Agilent MS 6210 Quadrupole. Використовували колонку Waters Symmetry C8 (3,5 мкм; 2,150 мм) (WAT200624). Застосовували наступний метод градієнта (% = відсоток за об'ємом): A = вода + 0,1 % TFA/B = ацетонітрил + 0,1 % TFA; 0,0-2,0 хвил. 90A:10B-5A:95B; 2,0-3,0 хвил. 5A:95B; 3,03,3 хвил. 5A:95B-90A:10B; швидкість потоку 1,0 мл/хвил.; температура колонки 50C. Всі сполуки іонізували за типом APCI. 1 H-ЯМР спектри реєстрували на приладі Varian Mercury (400 МГц) або Bruker Advance (600 МГц). Обертання площини поляризації світла вимірювали на Perkin Elmer Polarimeter 341. РХМС стан для прикладів 2b, 2c, 2d, 2e, 2g: Умови мас-спектра: Agilent 6130 квадруполь РХ/МС з ВЕРХ Agilent 1200; Колонка: Agilent Zorbax SB-C18 (швидке розчинення), 2,1*30 мм, 3,5 мкм; Рухомі фази: B: 0,1 % мурашина кислота у воді; C: 0,1 % мурашина кислота в MeCN; 1,0 хвил. до 6,0 хвил., від 95 % B до 5 % B, та від 5 % C до 95 % C; від 6,0 хвил. до 9,0 хвил., від 5 % B та 95 % C; заключний час: 2,0 хвил.; швидкість потоку: 0,8 мл/хвил.; температура колонки: 30C; УФ-детекція: 210 нм та 254 нм; + МС /МС : 80-1000; метод іонізації: API-ES. Умови HRMS для прикладу 2f: Прилад: Waters Acquity UPLC, з'єднаний з Synapt Q-TOF MS; Колонка: Waters Acquity UPLC BEH C18, 2,1*50 мм, 1,7 мкм, Рухома фаза: A: 0,1 % мурашина кислота у воді, B: 0,1 % мурашина кислота у ацетонітрилі; температура колонки: при кімнатній температурі; УФвизначення: сканування від 190 нм до 400 нм; швидкість потоку: 0,5 мл/хвил.; Умови градієнту: Час (хвил.) Фаза В (%) 0 5 1 5 Початок збору даних 9 95 11 95 Завершення збору даних 11,10 5 14 5 Наступне введення Метод іонізації: ESI+; діапазон сканування МС: 100-1000 m/z. Проміжна сполука A: 2-(4-бутоксифеніл)-1,1-диметилетиламін a) 4-(2-метил-2-нітропропіл)фенол Суміш 4-(гідроксиметил)фенолу (20 г), KOtBu (27,1 г) та DMAC (200 мл) перемішували магнітною мішалкою. 2-Нітропропан (21,5 г) повільно додавали впродовж 20 хвил. Суміш нагрівали до 140C впродовж 5 год. перед охолодженням до к.т. Суміш повільно додавали до прохолодного водного розчину HCl (3,0 %, 600 мл), потім екстрагували MTBE (300 мл*1, 200 мл*1). Органічні шари об'єднували, промивали водою (300 мл*2) та насич. водним розчином NaCl (50 мл*1), потім сушили над безводним Na2SО4. Суміш фільтрували та концентрували у вакуумі з одержанням твердої речовини світло-жовтого кольору (28,5 г), яку використовували на наступній стадії без додаткового очищення. + [M-1] =194,2; RT=5,3 хвилини 1 H-ЯМР (400 MГц, CDCl3) м.ч. 6,96 (д, J=8,5 Гц, 2H), 6,75 (д, J=8,5 Гц, 2H), 3,11 (с, 2H), 1,56 (с, 6H). b) 1-бутокси-4-(2-метил-2-нітропропіл)бензол Суміш 4-(2-метил-2-нітропропіл)фенолу (20,4 г), 1-бромбутану (28,7 г), DMAC (200 мл), K2CО3 (21,6 г), йодиду тетрабутиламонію (38,7 г) перемішували магнітною мішалкою та нагрівали до 85C впродовж 17 год. Суміш охолоджували до 0-10C та додавали воду (700 мл). Суміш екстрагували MTBE (300 мл*1, 200 мл*1). Об'єднані органічні фази промивали водою (250 мл*2), потім концентрували у вакуумі з одержанням масла червоно-коричневого кольору (27,8 г), яке використовували на наступній стадії без додаткового очищення. 1 H-ЯМР (400 MГц, CDCl3) м.ч. 7,0 (д, J=8,8 Гц, 2H), 6,81 (д, J=8,8 Гц, 2H), 3,93 (т, J=6,6 Гц, 2H), 3,12 (с, 2H), 1,74 (м, 2H), 1,56 (с, 6H), 1,48 (м, 2H), 0,97 (т, 3H). c) 2-(4-бутоксифеніл)-1,1-диметилетиламін У гідруючий реактор (1 л) потім додавали розчин 1-бутокси-4-(2-метил-2нітропропіл)бензолу (27,8 г) у AcOH (270 мл) з вологим Raney Ni (7,0 г). Суміш продували H 2 3 рази, потім нагрівали до 60C та продовжували перемішувати при 5,0 атм. впродовж 16 год. 22 UA 114295 C2 5 10 15 20 25 Суміш фільтрували, отриманий фільтрат концентрували у вакуумі. Отриманий залишок розводили водою (150 мл)/н-гептаном (80 мл), водний шар знову промивали н-гептаном (80 мл). Водний шар доводили за допомогою NaOH (~20 %) до pH ~ 11, потім екстрагували MTBE (100 мл*1) та EtOAc (150 мл*2). Шар середовища видаляли. Всі верхні шари об'єднували та промивали насиченим NaHCО3 (100 мл) та насиченим NaCl (100 мл) перед сушкою безводним Na2SО4. Після фільтрації суміш концентрували. Отриманий залишок перемішували та додавали розчин HCl у ізопропіловому спирті (2M, 40 мл). Суспензію нагрівали до 60C та додавали нгептан (120 мл). Суміш охолоджували до 20C, потім фільтрували, осад промивали деякою кількістю н-гептану. Тверду речовину білого кольору сушили на повітрі впродовж 2 днів з одержанням 10 г чистої HCl солі продукту. Вихід: 35,2 %. + [MH] =222,2; RT=5,0 хвилин 1 H-ЯМР (400 MГц, d-DMSO) м.ч. 8,13 (с, 3H), 7,12 (д, J=8,6 Гц, 2H), 6,88 (д, J=8,5 Гц, 2H), 3,93 (т, J=6,4 Гц, 2H), 2,80 (с, 2H), 1,67 (м, 2H), 1,42 (м, 2H), 1,18 (с, 6H), 0,92 (т, 3H). Приклад 1: (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5гідроксибензо[d]тіазол-2(3H)-он a) 1-трет-бутокси-3-фтор-5-ізотіоціанатобензол Додавали тіофосген (33,6 г) у CHCl3 (250 мл) та K2CО3 (64,7 г) у H2О (450 мл) окремо та одночасно по краплям до розчину 3-трет-бутокси-5-фторфеніламіну (42,9 г) у CHCl3 (350 мл) при 0C. Реакційну суміш нагрівали до кімнатної температури впродовж ночі. Органічні шари відділяли та промивали водою (3), сольовим розчином (1), сушили над MgSО4, фільтрували, та розчинник видаляли у вакуумі. Зазначену у заголовку сполуку отримували флешхроматографією (силікагель, елюент дихлорметан/ізогексан 1:3). 1 H ЯМР (CDCl3, 400 MГц); 6,70 (м, 3H), 1,40 (с, 9H). b) O-ізопропіловий ефір (3-трет-бутокси-5-фторфеніл)тіокарбамової кислоти 23 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 1-трет-Бутокси-3-фтор-5-ізотіоціанатобензол (24,0 г) та триетиламін (10,9 г) розчиняли у ізопропанолі (150 мл). Реакційну суміш кип'ятили із зворотним холодильником впродовж 18 годин, та розчинник видаляли вакуумом. Сирий продукт розчиняли у гексані:діетиловому ефірі (19:1). Діетиловий ефір видаляли у вакуумі, та розчин охолоджували до 0C впродовж 3 годин. Розчин фільтрували з одержанням зазначеної у заголовку сполуки. 1 H ЯМР (CDCl3, 400 MГц); 8,10 шир.с, 1H), 6,65 шир.с, 2H), 6,45 (ддд, 1H) 5,60 (септет, 1H), 1,35 (д, 6H), 1,30 (с, 9H). c) 5-трет-бутокси-2-ізопропоксибензотіазол-7-карбальдегід O-Ізопропіловий ефір (3-трет-бутокси-5-фторфеніл)тіокарбамової кислоти (2,2 г) розчиняли у сухому тетрагідрофурані (20 мл). Реакційну суміш охолоджували до -78C та трет-бутиллітій (15,2 мл, 1,5 M розчин) додавали впродовж 20 хвилин. Потім реакційну суміш нагрівали до 10C впродовж 75 хвилин. Потім реакційну суміш повторно охолоджували до -78C, додавали N, N-диметилформамід (1,5 г), та реакційну суміш повільно нагрівали до кімнатної температури, потім перемішували при -10C впродовж 1 години. Реакційну суміш гасили HCl(водн) (5 мл, 2 M розчину), органічні шари розділяли між етилацетатом/водою та видаляли у вакуумі. Зазначену у заголовку сполуку отримували флеш-хроматографією (силікагель, елюент етилацетат/ізогексан 1:9). + МС (ES+) m/e 294 (MH ) d) 5-трет-Бутокси-2-ізопропокси-7-вінілбензотіазол Ph3PMe.Br (5,0 г) розчиняли у сухому тетрагідрофурані (100 мл) у атмосфері аргону. Nбутиллітій (8,8 мл, 1,6 M розчина) додавали при кімнатній температурі впродовж 10 хвилин, та реакційну суміш перемішували впродовж додаткових 30 хвилин. Розчин 5-трет-бутокси-2ізопропоксибензотіазол-7-карбальдегіду (1,25 г) у дихлорметані (40 мл) додавали по краплям до реакційної суміші, та реакційну суміш перемішували впродовж 4,5 годин при кімнатній температурі. Розчинник видаляли у вакуумі, знову розчиняли у етилацетаті, промивали водою (3), сольовим розчином (1), сушили над MgSО4, фільтрували, та розчинник видаляли у вакуумі. Зазначену у заголовку сполуку отримували флеш-хроматографією (силікагель, елюент етилацетат/ізогексан 1:9). + МС (ES+) m/e 292 (MH ) e) (R)-(S-трет-бутокси-2-ізопропоксибензотіазол-7-іл)етан-1,2-діол K3Fe(CN)6 (1,2 г), K2CО3 (0,5 г), (DHQD)2PHAI (19 мг) розчиняли у трет-бутанолі/воді (15 мл, суміш 1:1) у атмосфері аргону та перемішували впродовж 15 хвилин. Реакційну суміш охолоджували до 0C, та потім додавали OsО4 (3,1 мг) з 5-трет-бутокси-2-ізопропокси-7вінілбензотіазолом (0,35 г). Реакційну суміш перемішували впродовж ночі при кімнатній температурі. Реакційну суміш гасили мета-бісульфатом натрію (1 г) та перемішували впродовж 1,5 годин. Додавали етилацетат, органічні шари відділяли, промивали (2) водою, (1) сольовим розчином, сушили над MgSО4, фільтрували, та розчинник видаляли у вакуумі. Зазначену у заголовку сполуку отримували флеш-хроматографією (силікагель, етилацетат/ізогексан 2:5). + МС (ES+) m/e 326 (MH ) f) (R)-2-(5-трет-бутокси-2-ізопропоксибензо[d]тіазол-7-іл)-2-гідроксиетил-4метилбензолсульфонат У 500 мл тригорлу круглодонну колбу, що продули та підтримують у інертній атмосфері азоту, поміщали розчин (R)-1-(5-трет-бутокси-2-ізопропоксибензо[d]тіазол-7-іл)етан-1,2-діолу (20 г, 59,05 ммоль) у піридині (240 мл) та 4Å молекулярні сита (5 г). За цим йшло додавання розчину хлориду толуолсульфонової кислоти (тозилхлорид) (15,3 г, 79,73 ммоль) у піридині (60 мл) по краплям при перемішуванні при 0C. Отриманий розчин перемішували впродовж 4 год. при кімнатній температурі. Потім реакційну суміш гасили додаванням 1000 мл 1 M соляної кислоти. Отриманий розчин екстрагували 2300 мл етилацетату, та органічні шари об'єднували. Органічну фазу промивали 1500 мл 1 M соляної кислоти, 1500 мл 10 % бікарбонату натрію та 300 мл сольового розчину. Суміш сушили над безводним сульфатом натрію та концентрували у вакуумі. Залишок наносили на колонку з силікагелю за допомогою етилацетату/петролейного ефіру (1:10). Це забезпечувало одержання 26 г (87 %) (R)-2-(5-трет-бутокси-2ізопропоксибензо[d]тіазол-7-іл)-2-гідроксиетил-4-метилбензолсульфонату у вигляді масла жовтого кольору. + РХ/МС RT=2,47 хвил.; (m/z): 480 [M+H] 1 H-ЯМР: (400 MГц, DMSO-d6): δ (м.ч.) 7,57 (д, 2H); 7,36 (д, 2H); 7,17 (д, 1H); 6,79 (д, 1H); 6,32 (д, 1H); 5,37-5,26 (м, 1H); 4,97-4,90 (м, 1H); 4,12-4,00 (м, 2H); 2,40 (с, 3H); 1,45-1,38 (м, 6H); 1,32 (с, 9H). 24 UA 114295 C2 5 10 15 20 25 30 35 40 45 q) (R)-1-(5-трет-бутокси-2-ізопропоксибензо[d]тіазол-7-іл)-2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)етанол У 1000-мл 4-горлу круглодонну колбу поміщали розчин (R)-2-(5-трет-бутокси-2ізопропоксибензо[d]тіазол-7-іл)-2-гідроксиетил-4-метилбензолсульфонату (26 г, 51,55 ммоль, 1,00 екв.) у толуолі (320 мл) та 2-(4-бутоксифеніл)-1,1-диметилетиламін (проміжна сполука A) (22 г, 99,47 ммоль, 1,93 екв.). Розчин перемішували впродовж 24 год. при 90C на масляній бані. Отриману суміш концентрували у вакуумі. Залишок наносили на колонку з силікагелю за допомогою етилацетату/петролейного ефіру (1:8). У результаті отримували 16 г (58 %) (R)-1-(5трет-бутокси-2-ізопропоксибензо[d]тіазол-7-іл)-2-(1-(4-бутоксифеніл)-2-метилпропан-2іламіно)етанолу у вигляді масла світло-жовтого кольору. + РХ/МС: RT=2,24 хвил.; (m/z): 529 [M+H] 1 H-ЯМР: (600 MГц, DMSO-d6): δ (м.ч.) 7,12 (с, 1H); 6,83 (д, 2H); 6,77 (с, 1H); 6,63 (д, 2H); 5,80 (шир.с, 1H); 5,38-5,30 (м, 1H); 4,70-4,66 (м, 1H); 3,90 (т, 2H); 2,81-2,61 (м, 2H); 2,50-2,39 (м, 2H); 1,71-1,62 (м, 2H); 1,47-1,41 (м, 2H); 1,41 (д, 6H); 1,22 (с, 9H); 0,91 (кв, 3H); 0,88 (с, 3H); 0,83 (с, 3H). h) (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5гідроксибензо[d]тіазол-2(3H)-он Розчин (R)-1-(5-трет-бутокси-2-ізопропоксибензо[d]тіазол-7-іл)-2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)етанолу (3,5 г) у мурашиній кислоті (40 мл) перемішували впродовж 68 год. при кімнатній температурі. Додавали 50 мл води та отриману суміш випарювали досуха (ротаційний випарник, 15 мбар, 40C) з одержанням 3,8 г сирого продукту. Отриману речовину розподіляли між насиченим водним бікарбонатом натрію (50 мл) та етилацетатом (50 мл) з метою видалення мурашиної кислоти. Водний шар екстрагували 3 етилацетатом (30 мл кожен). Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували та концентрували з одержанням 3 г сирої вільної основи. Отриману речовину піддавали флешхроматографії (силікагель; градієнт 0-60 % метанолу у дихлорметані). Чисті фракції збирали та випарювали досуха з одержанням 1,74 г аморфної напівтвердої речовини. Отриману речовину піддавали хіральної препаративної хроматографії [колонка: Chiralpak IC (20 мкм) 7,6537,5 см; елюент: н-гептан/дихлорметан/етанол/діетиламін 50:30:20 (+0,05 діетиламін); швидкість потоку = 70 мл/хвил.; концентрація: 2,5 г/50 мл елюенту; визначення: УФ, 220 нм] з одержанням чистого енантіомеру (100 % ee). Отриману речовину розчиняли у 45 мл ацетонітрилу при 60C. Розчину дозволяли охолонути до кімнатної температури впродовж 18 год., аж до появи осаду. Суміш розводили за допомогою 5 мл холодного (4C) ацетонітрилу та фільтрували через воронку Бюхнера. Фільтрувальний осад промивали двічі холодним ацетонітрилом. Потім вологу тверду речовину збирали та сушили у вакуумі (0,2 мбар) при кімнатній температурі впродовж ночі з одержанням 1,42 г (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5гідроксибензо[d]тіазол-2(3H)-ону у вигляді безбарвного порошку. + РХ/МС: RT=1,81 хвил. (m/z): 431 [M+H] 1 H-ЯМР: (600 MГц, DMSO-d6): δ (м.ч.) 11,5 (шир.с, 1H); 9,57 (шир.с, 1H); 6,99 (д, 2H); 6,76 (д, 2H); 6,52 (с, 1H); 6,47 (с, 1H); 5,63 (шир.с, 1H); 4,53-4,48 (м, 1H); 3,90 (т, 2H); 2,74-2,63 (м, 2H); 2,54-2,45 (м, 2H); 1,71-1,62 (м, 2H); 1,49-1,40 (м, 2H); 0,93 (кв, 3H); 0,89 (с, 6H). 22 Оптичне обертання: [α]D =-43 (c=1,0 г/100 мл MeOH). Приклад 2: альтернативний шлях одержання (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону 25 UA 114295 C2 5 10 15 20 25 a) 1-трет-бутокси-3-фтор-5-ізотіоціанатобензол 1,1'-Тіокарбонілдіімідазол (423 г, 2,37 моль) розчиняли у дихлорметані (3200 мл). Суміш перемішували у атмосфері N2, тоді як розчин 3-трет-бутокси-5-фтораніліну (435 г, 2,37 моль) у дихлорметані (800 мл) повільно додавали впродовж 2 год. Потім суміш продовжували перемішувати при 20C впродовж 16 год. Суміш розводили водою (3000 мл). Відділену фазу дихлорметану знову промивали водою (3000 мл) перед сушкою безводним Na 2SО4 впродовж 2 год. Суміш фільтрували, та фільтрат концентрували у вакуумі для видалення розчиннику з одержанням 1-трет-бутокси-3-фтор-5-ізотіоціанатобензолу (499 г). 1 H-ЯМР (400 MГц, CDCl3): 6,63-6,68 (м, 3 H), 1,37 (с, 9H). b) O-ізопропіловий ефір (3-трет-бутокси-5-фторфеніл)тіокарбамової кислоти До розчину 1-трет-бутокси-3-фтор-5-ізотіоціанатобензолу (460 г, 2,04 моль) у безводному ізопропіловому спирті (3250 мл) додавали триетиламін (315 г, 3,06 моль). Суміш кип'ятили із зворотним холодильником у атмосфері N2 впродовж 16 год., та температуру охолоджували до 40-50C. Після концентрування отриманий темний залишок розводили н-гептаном (1000 мл) та нагрівали до 60C. Суміш повільно охолоджували до 25C, у той же час додавали зародки. Спостерігали суспензію та повільно перемішували при 25C впродовж 16 год. перед охолодженням до 0-10C впродовж 2 год. Після фільтрації та промивання н-гептаном (200 мл), зібрану тверду речовину сушили у печі у вакуумі при 40-45C впродовж 18 год. з одержанням Oізопропілового ефіру (3-трет-бутокси-5-фторфеніл)тіокарбамової кислоти (453,1 г). + РХМС: [M+H] =286,1; RT=7,2 хвилини 1 H-ЯМР (400 MГц, CDCl3): 8,18 (с, 1H), 6,81 (м, 2H), 6,51 (дт, J=10,2 Гц, 1H), 5,66 (гептет, J=6,3 Гц, 1H), 1,42 (д, J=6,2 Гц, 6H), 1,37 (с, 9H). c) 1-(5-трет-бутокси-2-ізопропоксибензотіазол-7-іл)-2-хлоретанон У атмосфері азоту розчин трет-бутиллітію (481 мл, 737,6 ммоль, 1,6 M) додавали по краплям до розчину O-ізопропілового ефіру (3-трет-бутокси-5-фторфеніл)тіокарбамової кислоти (200 г, 700,83 ммоль) у 2-Me-THF (1600 мл) при температурі нижче -65C. Температуру реакції 26 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 60 підвищували до -35C, та другу частину трет-бутиллітію (388 мл, 737,6 ммоль, 1,9 M) повільно додавали при підтриманні температури нижче -35C. Потім реакційну суміш перемішували при зазначеній температурі впродовж 3 год. та охолоджували до -70C. Розчин N-метил-Nметоксихлорацетаміду (96,4 г, 700,83 ммоль) у 2-MeTHF (300 мл) додавали до реакційного середовища при підтриманні температури нижче -70C. Потім суміш нагрівали до -30 C та перемішували впродовж 45 хвилин. Холодну реакційну суміш гасили додаванням по краплям 30 % HCl у ізопропанолі (240 г) з наступним додаванням 1500 мл води. Органічний шар промивали послідовно 1000 мл води, 1500 мл насиченого водного NaHCO 3 та 1500 мл сольового розчину. Після концентрування отриманий залишок світло-коричневого кольору додавали до ізопропанолу (135 мл). Суміш нагрівали до 50C та повільно охолоджували до 25C. н-Гептан (135 мл) додавали по краплям до розчину, та суміш перемішували впродовж ночі. Суспензію фільтрували, та фільтрувальний осад промивали н-гептаном (40 мл) з наступним додаванням іншої частини н-гептану (20 мл). Осад сушили у вакуумі з одержанням 1(5-трет-бутокси-2-ізопропоксибензотіазол-7-іл)-2-хлоретанону у вигляді порошку не зовсім білого кольору (42,8 г, 17,9 % вихід). 1 H ЯМР (400 MГц, CDCl3): 7,60 (д, J=2,0 Гц, 1H), 7,45 (д, J=2,0 Гц, 1H), 5,40 (гептет, J=6,3 Гц, 1H), 4,77 (с, 2H), 1,47 (д, J=6,3 Гц, 6H), 1,40 (с, 9H). + РХМС: [M+H] =342,1, RT=7,29 хвил. d) (R)-1-(5-трет-бутокси-2-ізопропоксибензотіазол-7-іл)-2-хлоретанол Суспензію 1-(5-трет-бутокси-2-ізопропоксибензо[d]тіазол-7-іл)-2-хлоретанону (70 г, 204,8 ммоль) та RuCl(п-цимол)[(S, S)-Ts-DPEN] (1,954 г, 3,07 ммоль) у метанолі/DMF (1330 мл/70 мл) дегазували та перенаповнювали N2 три рази. Дегазовану раніше отриману суміш мурашиної кислоти (28,3 г) в Et3N (124,3 г) повільно додавали при підтриманні внутрішньої температури від 15 до 20C. Отриману суспензію жовтого кольору нагрівали до 30C. Через 2 год. реакційну суміш охолоджували до 25C, потім у реакційну суміш додавали воду (750 мл) з наступним додаванням оцтової кислоти (56 мл) однією порцією. Суміш концентрували та потім розводили TBME (1000 мл). Водну фазу відділяли та екстрагували TBME (1000 мл). Об'єднані органічні фази промивали послідовно водою та сольовим розчином та потім сушили за допомогою Na2SО4 та концентрували у вакуумі з одержанням (R)-1-(5-трет-бутокси-2ізопропоксибензотіазол-7-іл)-2-хлоретанолу (72 г). + РХМС (метод A): [M+H] =343,1, RT=5,67 хвил. 1 H ЯМР (400 MГц, CDCl3): 7,29 (д, J=2,0 Гц, 1H), 6,83 (д, J=2,0 Гц, 1H), 5,37 (гептет, J=6,3 Гц, 1H), 4,96 (м, 1H), 3,74 (м, 2H), 3,01 (с, 1H), 1,46 (д, J=6,2 Гц, 6H), 1,36 (с, 9H). e) (R)-5-трет-бутокси-2-ізопропокси-7-оксиранілбензотіазол До розчину (R)-1-(5-трет-бутокси-2-ізопропоксибензо[d]тіазол-7-іл)-2-хлоретанолу (140 г, 407,1 ммоль) у TBME (420 мл) додавали по краплям водний розчин NaOH (2 M, 420 мл) з наступним додаванням однією порцією йодиду тетрабутиламонію (7,52 г, 20,36 ммоль). Через 4 год. при 26C, додавали 400 мл TBME, та органічний шар відділяли. Водний шар екстрагували TBME (400 мл). Об'єднані органічні шари промивали водою (400 мл) та сольовим розчином (400 мл) з одержанням (R)-5-трет-бутокси-2-ізопропокси-7-оксиранілбензотіазолу (122 г). + РХМС: [M+H] =308,0, RT=6,80 хвил. 1 H ЯМР (400 MГц, CDCl3) м.ч. 7,28 (д, J=2,0 Гц, 1H), 6,85 (д, J=2,0 Гц, 1H), 5,38 (м, 1H), 3,96 (м, 1H), 3,15 (дд, J=4,3, 5,5 Гц, 1H), 2,94 (дд, J=4,3, 5,5 Гц, 1H), 1,45 (д, J=Гц, 6H), 1,37 (с, 9H). f) (R)-1-(5-трет-бутокси-2-ізопропоксибензо[d]тіазол-7-іл)-2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)етанол (R)-5-трет-Бутокси-2-ізопропокси-7-оксиранілбензотіазол (145 г, 471,7 ммоль) та 2-(4бутоксифеніл)-1,1-диметилетиламін (114,8 г, 518,9 ммоль) розчиняли у DMSO (850 мл). Реакційну суміш нагрівали до 80C та перемішували впродовж 27 год. Потім суміш охолоджували до 25C та додавали до перемішуваної суміші води (1500 мл) та TBME (1500 мл). Водний шар відділяли та екстрагували TBME (1000 мл). Об'єднані органічні шари послідовно промивали водою (1500 мл) та сольовим розчином (1000 мл), сушили над безводним Na2SO4. Після концентрування залишок очищали колонковою хроматографією (елююючи 10 % EtOAc у н-гептані до 33 % EtOAc у н-гептані). Твердий продукт (R)-1-(5-трет-бутокси-2ізопропоксибензо[d]тіазол-7-іл)-2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)етанолу отримували (140 г) у вигляді твердої речовини не зовсім білого кольору. HRMS: [M+1] 529,2996 1 H ЯМР (400 MГц, CDCl3): 7,26 (м, 1H), 7,01 (м, 1H), 6,99 (м, 1H), 6,78-6,80 (м, 3H), 5,39 (м, 1H), 4,65 (дд, J=3,8, 8,8 Гц, 1H), 3,83 (т, J=6,4 Гц, 2H), 2,96 (дд, J=3,8, 12 Гц, 1H), 2,74 (дд, J=8,8, 12 Гц, 1H), 2,60 (дд, J=13,6, 17,6 Гц, 2H), 1,72-1,79 (м, 2H), 1,50 (м, 2H), 1,46 (д, J=2,0 Гц, 3H), 1,45 (д, J=2,0 Гц, 3H), 1,35 (с, 9H), 1,06 (с, 3H), 1,04 (с, 3H), 0,98 (т, J=7,2 Гц, 3H). 27 UA 114295 C2 5 10 15 20 25 30 35 40 45 50 55 60 g) (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5гідроксибензо[d]тіазол-2(3H)-он До (R)-1-(5-трет-бутокси-2-ізопропоксибензо[d]тіазол-7-іл)-2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)етанолу (7,5 г) у ізопропанолі (30 мл) та воді (25 мл) додавали 1 M водний розчин HCl (43 мл). Потім реакційну суміш нагрівали до 60C та перемішували впродовж 2,5 год. Суміш охолоджували до 50C та потім повільно додавали 2M водний розчин NaOH (18 мл) до pH 8,2-8,4. Реакційну суміш потім охолоджували до 30C, з наступною екстракцією TBME (перший раз з 40 мл, другий раз з 25 мл). Два органічних шари об'єднували та промивали водою (38 мл два рази) перед сушкою з безводним Na 2SО4. Після фільтрації фільтрат концентрували та потім розчиняли у MeCN (145 мл). Розчин обробляли активованим вуглецем (0,6 г) та нагрівали до 60C. Після другої фільтрації осад промивали MeCN (10 мл два рази), фільтрат кристалізували при 60C з одержанням (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону (3,8 г). e.e.=97,6 %. + РХМС (метод A): [M+H] =431,2 1 H ЯМР (400 MГц, DMSO-d6): 9,5 (шир.с, 1H), 6,81 (д, J=8,5 Гц, 2H), 6,57 (д, J=8,6 Гц, 2H), 6,33 (д, J=2,2 Гц, 1H), 6,30 (д, J=2,2 Гц, 1H), 4,43 (шир.с, 1H), 3,69 (т, J=6,4Гц, 2H), 2,58-2,59 (м, 2H), 2,24-2,31 (м, 2H), 1,41-1,48 (м, 2H), 1,15-1,25 (м, 2H), 0,78 (с, 6H), 0,70 (т, J=7,4Гц, 3H). Приклад 3: ацетатна сіль (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону 500 мг (1,161 ммоль) вільної основи (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону суспендували у 10,0 мл ацетонітрилу та 0,25 мл води у 50 мл чотиригорлій колбі та лопаттю перемішували при к.т. Суспензію нагрівали при внутрішній температурі 50C (температура кожуха 75C) та додавали 72 мг оцтової кислоти (1,161 ммоль) (утворювався прозорий розчин жовтого кольору). Розчин охолоджували впродовж 30 хвил. при к.т. та додавали 0,15 мл води. Потім у розчин вводили зародки ацетату (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону та перемішували впродовж ночі (16 ч) при к.т. Потім суспензію фільтрували при к.т. через скляний фільтр та промивали три рази за допомогою 1 мл ацетонітрилу. 510 мг фільтрованого осаду сушили досуха у сушильній печі впродовж ночі (16 год.) при к.т… Вихід: 508 мг порошку білого кольору (89,1 %) Одержання зародку ацетату (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону 57,0 мг (0,132 ммоль) вільної основи (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону та 8,03 мг (0,132 ммоль) оцтової кислоти розчиняли в 1,0 мл ацетонітрилу та 0,05 мл води. Розчин перемішували при к.т. за допомогою магнітної мішалки. Осадження мало місце впродовж ночі. Потім розчин фільтрували при к.т. через скляний фільтр та промивали три рази 0,5 мл ацетонітрилу. Вологий фільтрувальний осад сушили досуха у сушильній печі впродовж ночі (16 год.) при к.т… Вихід: 57 мг порошку білого кольору. Приклад 3a: Альтернативна методика одержання ацетатної солі (R)-7-(2-(1-(4бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5-гідрокси-бензо[d]тіазол-2(3H)-ону (R)-1-(5-трет-Бутокси-2-ізопропоксибензо[d]тіазол-7-іл)-2-(1-(4-бутоксифеніл)-2метилпропан-2-іламіно)етанол (1 екв.) суспендували у ізопропанолі. При 50-60, 1 M водний розчин соляної кислоти (3 екв.) додавали впродовж приблизно 30-60 хвил. Після завершення реакції (приблизно 2,5 години при 60C) розчин охолоджували до 20C та поступово додавали гідроксид натрію 2M (3 екв.) при зазначеній температурі. Після повного додавання емульговану вільну основу (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5гідроксибензо[d]тіазол-2(3H)-ону екстрагували у етилацетат, та органічний шар промивали водою. Органічний шар обробляли активованим вуглецем та фільтрували з використанням мікрокристалічної целюлози як допоміжного фільтру. Фільтрувальний осад промивали етилацетатом. Фільтрат, що містить вільну основу (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан2-іламіно)-1-гідроксиетил)-5-гідроксибензо[d]тіазол-2(3H)-ону, обережно концентрували до певного залишкового об'єму шляхом дистиляції при температурі кожуха 55C при зниженому тиску. Потім додавали ізопропілацетат та частково видаляли дистиляцією до певного залишкового об'єму при температурі кожуха 55C при зниженому тиску. Додатковий ізопропілацетат та розчин оцтової кислоти у ізопропілацетаті додавали до теплого залишку дистиляції при 50-55C. Під час додавання оцтової кислоти у партію вводили зародки ацетатної солі (R)-7-(2-(1-(4-бутоксифеніл)-2-метилпропан-2-іламіно)-1-гідроксиетил)-5гідроксибензо[d]тіазол-2(3H)-ону для початку контрольованої кристалізації ацетатної солі раніше при 50-55C. Після поступового охолодження до 0C суспензію продукту фільтрували та 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzothiazolone compound
Автори англійськоюCao, Jun, Erb, Bernhard, Fairhurst, Robin Alec, Grandeury, Arnaud, Hatakeyama, Shinji, Koziczak-Holbro, Magdalena, Lai, Xinzhong, Lustenberger, Philipp, Riebesehl, Bernd, Tufilli, Nicola, Ullrich, Thomas, Wu, Xiang, Zhou, Jianguang
Автори російськоюЦяо Юнь, Эрб Бернхард, Фэйрхерст Робин Алек, Грандери Арно, Хатакеяма Шинджи, Козичак-Холбро Магдалена, Лаи Ксинжонг, Лустенбергер Филипп, Рибезель Бернд, Туфилли Никола, Ульрих Томас, Ву Ксианг, Жоу Джиангуанг
МПК / Мітки
МПК: A61K 31/428, C07D 277/68
Мітки: сполука, бензотіазолону
Код посилання
<a href="https://ua.patents.su/42-114295-spoluka-benzotiazolonu.html" target="_blank" rel="follow" title="База патентів України">Сполука бензотіазолону</a>
Попередній патент: Спосіб керування принаймні частиною насосної станції
Наступний патент: Термоізоляційна композитна система, будівля, яка містить таку систему, і спосіб виготовлення термоізоляційної композитної системи
Випадковий патент: Спосіб одержання 5,11,17,23-тетра(n,n-диметил-n-гідроксіетиламоніум)-метилен-25,26,27,28-тетраалкоксикалікс[4]аренів тетрахлоридів