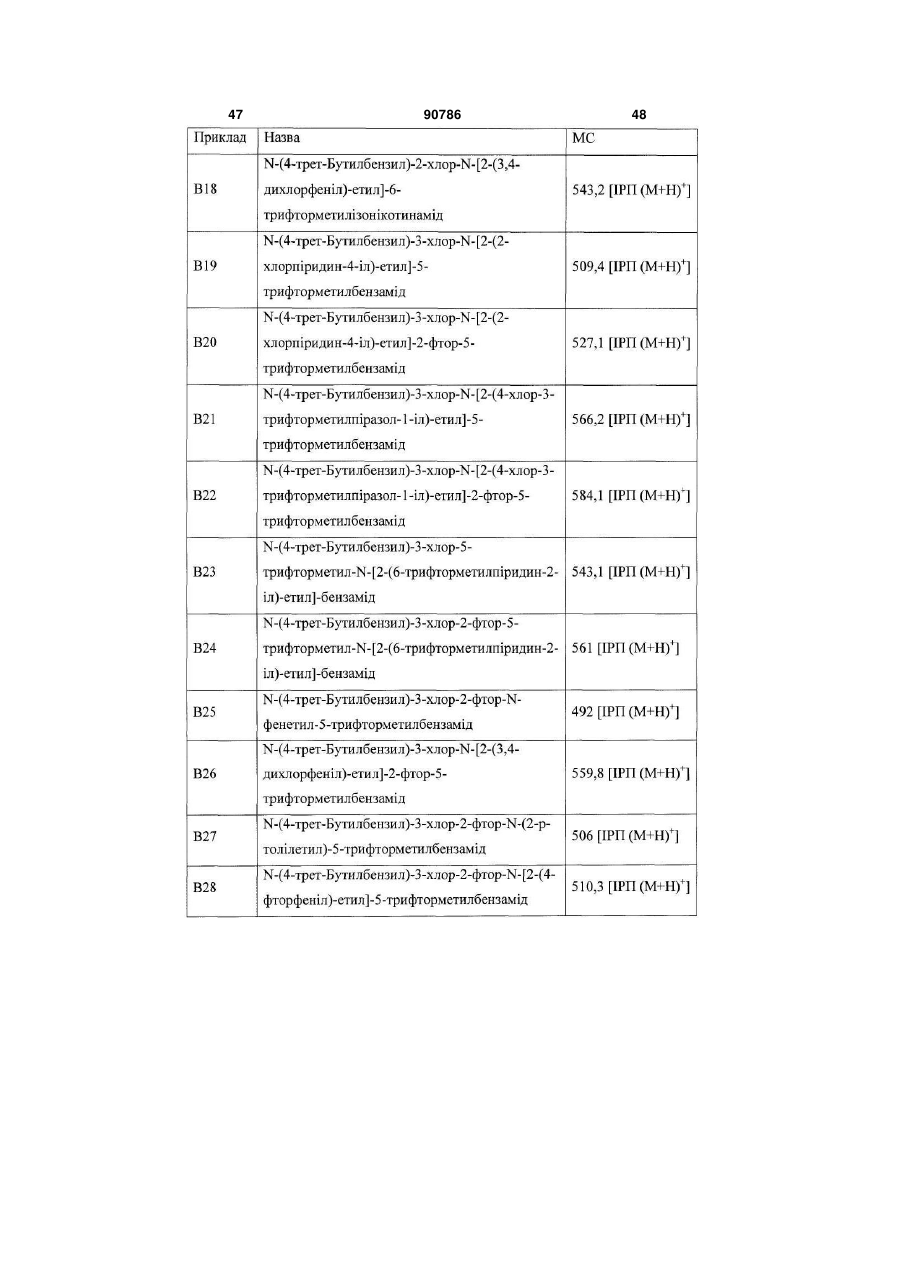
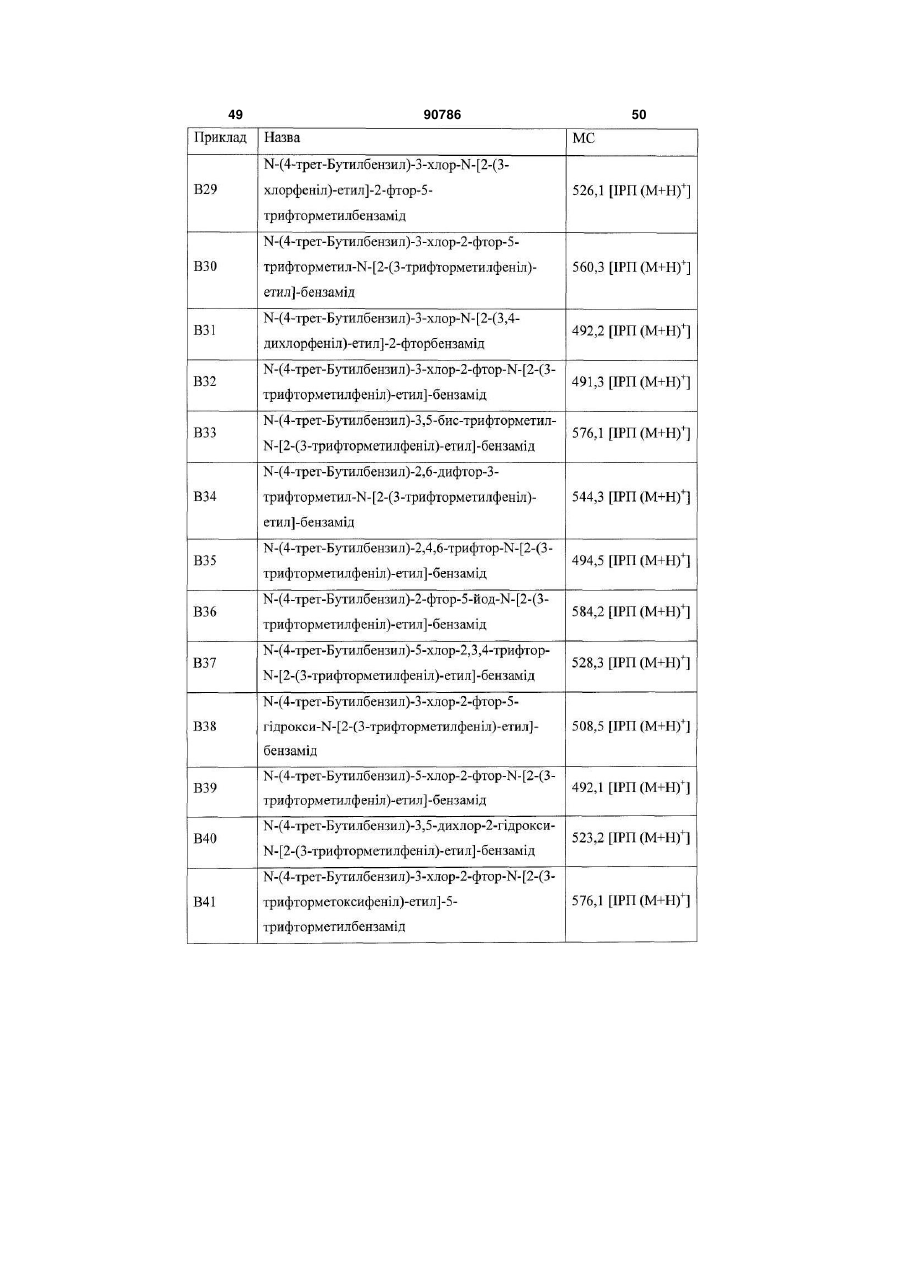
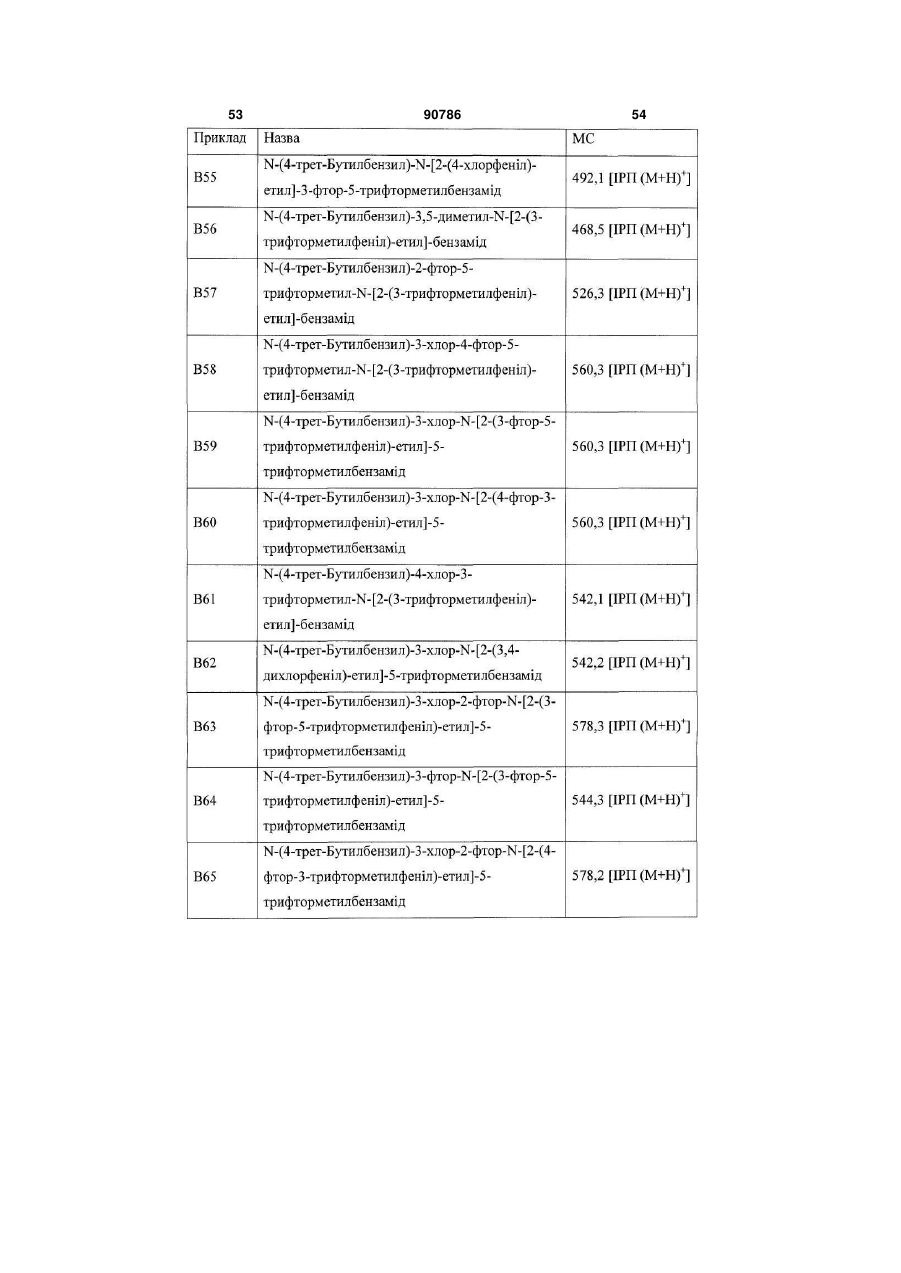
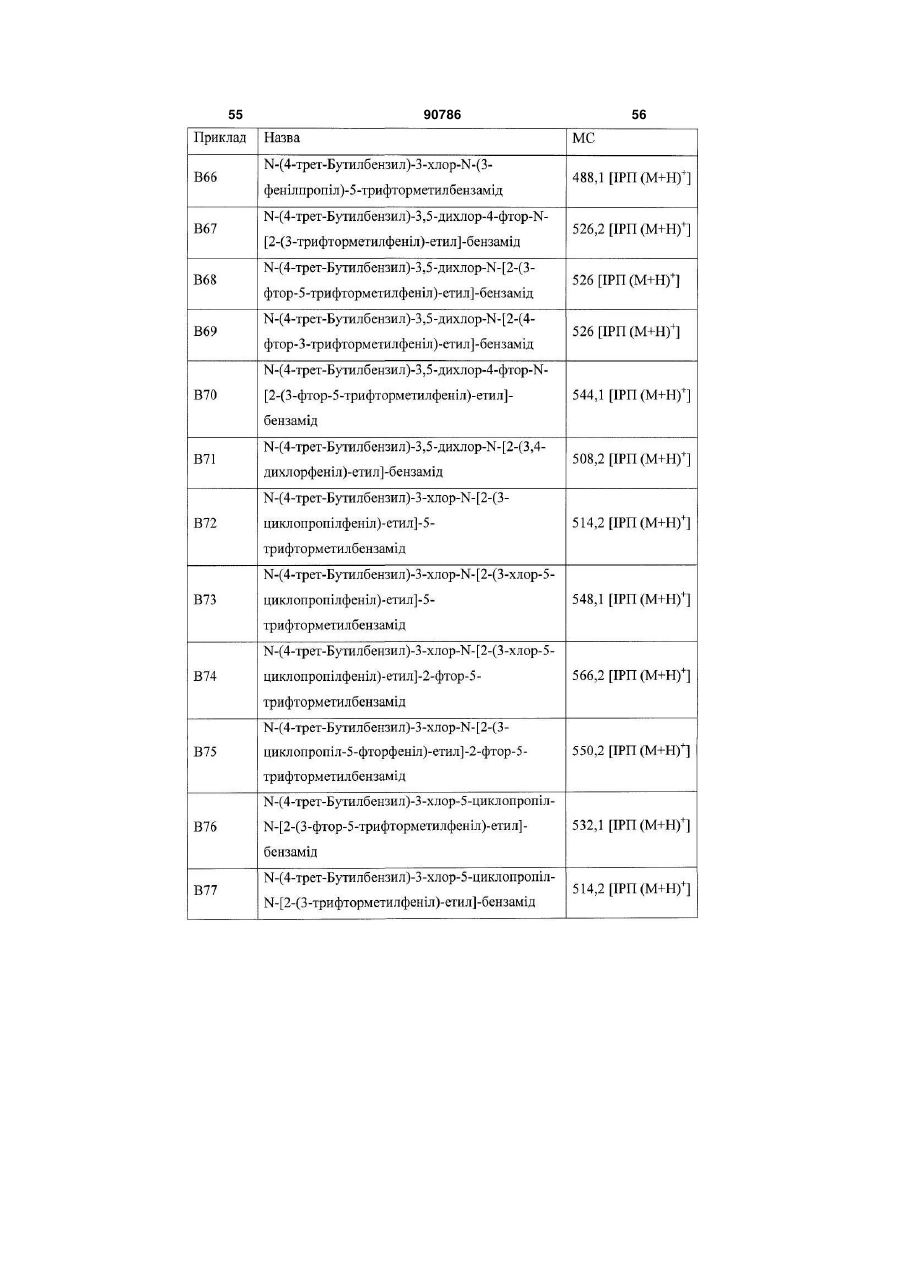
Похідні бензамідів і гетероаренів
Номер патенту: 90786
Опубліковано: 25.05.2010
Автори: Любберс Томас, Маттеі Патріціо, Конте Аурелія, Кюне Хольгер, Пфліже Філіпп, Мюллер Вернер, Може Сірілл
Формула / Реферат
1. Сполука формули І
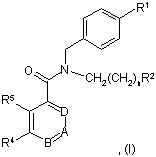
у якій
R1 означає С1-С6алкіл, галоген-С1-С6алкіл, галоген-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоген-С3-С8циклоалкіл або три-С1-С6алкілсиліл;
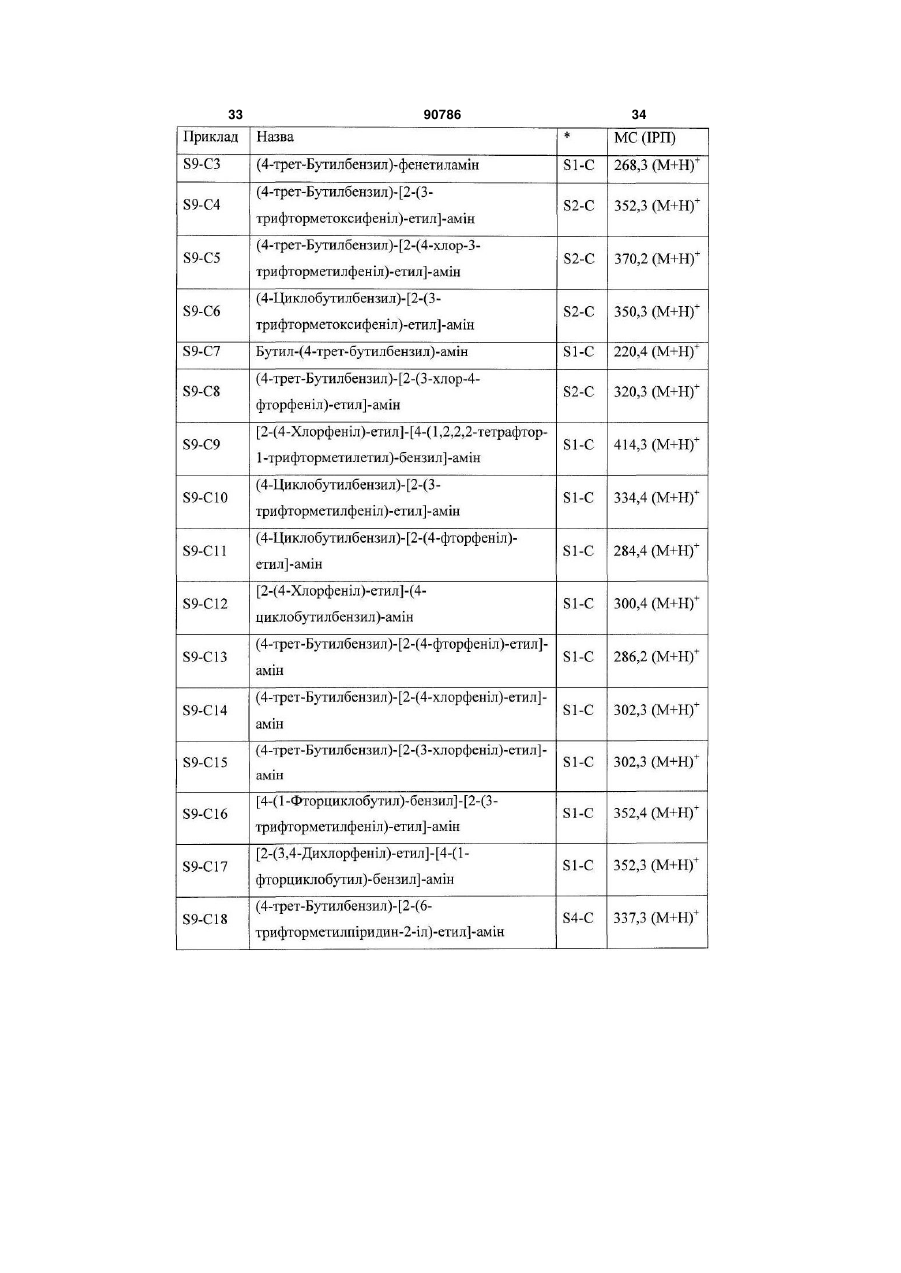
R2 означає водень або групу
 (а) або
(а) або  , (b)
, (b)
у якій
R6 і R7 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R8 і R9 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
X означає CR12 або N;
Y означає СН або N;
у якій X і Y одночасно не означають N;
R12 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R5 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R4 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R5, R10 і R11 не означає водень;
А означає CR10 або N;
В означає CR11 або N;
D означає CR3 або N;
у якій -В=А- і -A=D- не означають -N=N-;
R3 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R10 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R4, R5 і R11 не означає водень;
R11 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні два з R3, R4, R5 і R10 не означають водень;
у якій принаймні два з R3, R4, R5, R10 і R11 не означають водень;
та
n дорівнює 1, 2 або 3;
і її фармацевтично прийнятні солі.
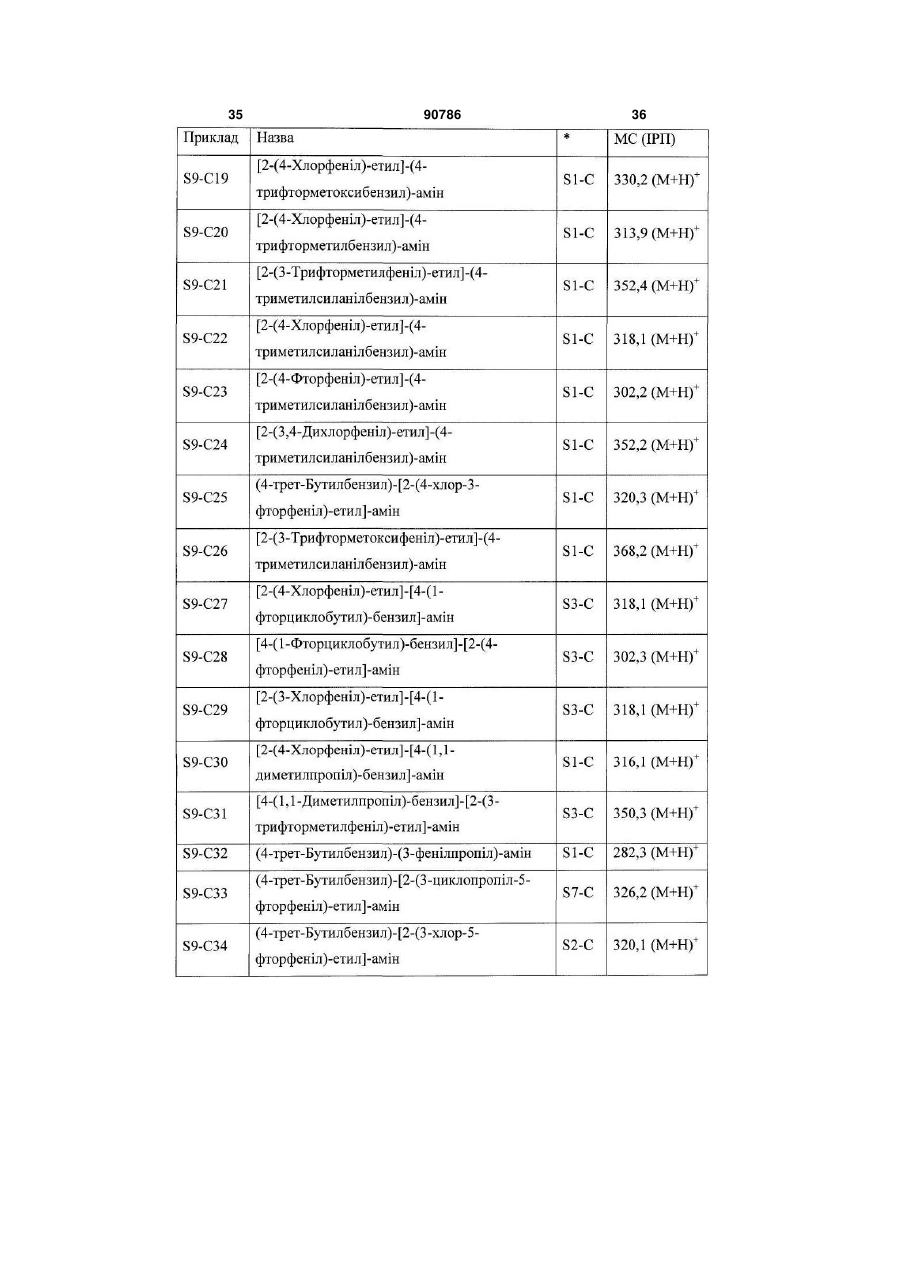
2. Сполука за п. 1, у якій R1 означає С1-С6алкіл, галоген-С1-С6алкіл, С3-С8циклоалкіл, галоген-С3-С8циклоалкіл або три-С1-С6алкілсиліл.
3. Сполука за п. 1, у якій R2 означає групу (а).
4. Сполука за п. 1, у якій R2 означає групу (b).
5. Сполука за п. 1, у якій
R1 означає С1-С6алкіл, галоген-С1-С6алкіл, галоген-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; R2 означає водень або групу
 (а) або
(а) або  , (b)
, (b)
у якій
R6 і R7 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R8 і R9 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
X означає CR12 або N;
Y означає СН або N;
у якій X і Y одночасно не означають N;
R12 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R5 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R4 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R5, R10 і R11 не означає водень;
А означає CR10;
В означає CR11 або N;
D означає CR3 або N;
R3 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R10 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R4, R5 і R11 не означає водень;
R11 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні два з R3, R4, R5 і R10 не означають водень;
у якій принаймнідва з R3, R4, R5, R10 і R11 не означають водень;
та
n дорівнює 1, 2 або 3;
і її фармацевтично прийнятні солі.
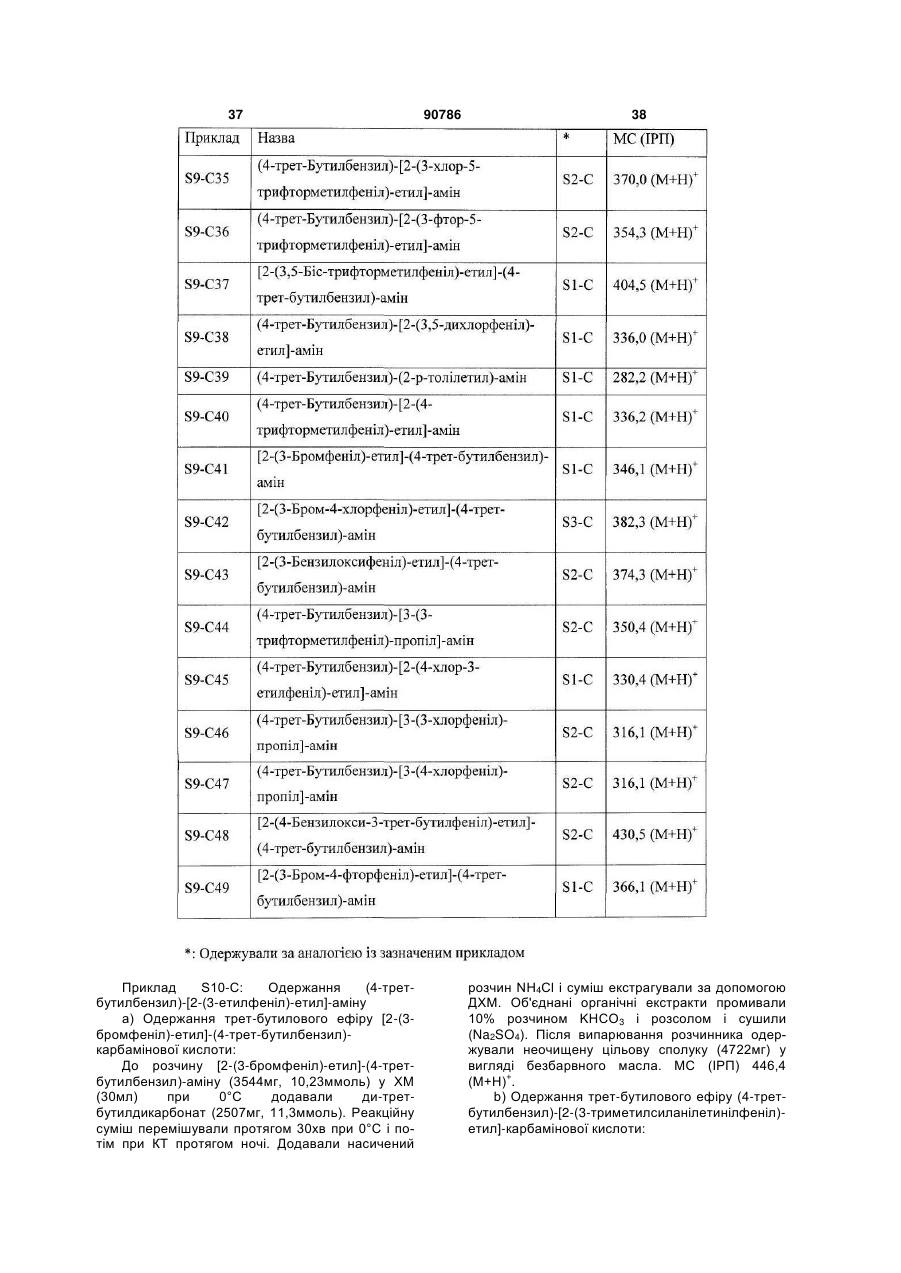
6. Сполука за п. 1, у якій
R1 означає С1-С6алкіл, галоген-С1-С6алкіл, галоген-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоген-С3-С8циклоалкіл або три-С1-С6алкілсиліл;
R2 означає водень або групу
 (а) або
(а) або  , (b)
, (b)
у якій
R6 і R7 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R8 і R9 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
X означає CR12 або N;
Y означає СН або N;
у якій X і Y одночасно не означають N;
R12 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R5 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R4 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R5 і R11 не означає водень;
А означає N;
В означає CR11;
D означає CR3;
R3 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R11 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні два з R3, R4, R5 і R10 не означають водень;
у якій принаймні два з R3, R4, R5, R10 і R11 не означають водень;
та
n дорівнює 1, 2 або 3;
і її фармацевтично прийнятні солі.
7. Сполука за п. 1, у якій
R1 означає С1-С6алкіл, галоген-С1-С6алкіл, галоген-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; R2 означає водень або групу
 (а) або
(а) або  , (b)
, (b)
у якій
R6 і R7 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R8 і R9 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
X означає CR12 або N;
Y означає СН або N;
у якій X і Y одночасно не означають N;
R12 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R5 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R4 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R5, R10 і R11 не означає водень;
А означає CR10;
В означає CR11 або N;
D означає CR3;
R3 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу;
R10 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R4, R5 і R11 не означає водень;
R11 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні два з R3, R4, R5 і R10 не означають водень;
у якій принаймні два з R3, R4, R5, R10 і R11 не означають водень;
та
n дорівнює 1, 2 або 3;
і її фармацевтично прийнятні солі.
8. Сполука за п. 1, у якій R1 означає С1-С6алкіл;
R2 означає групу
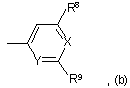
у якій
R8 і R9 незалежно означають водень, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл або галоген-С1-С6алкоксигрупу;
X означає CR12;
Y означає СН;
R12 означає водень, галоген або С3-С8циклоалкіл;
R5 означає водень або галоген;
R4 означає С1-С6алкіл, галоген-С1-С6алкіл або галоген;
А означає CR10;
В означає CR11 або N;
D означає CR3;
R3 означає водень;
R10 означає галоген-С1-С6алкіл або галоген;
R11 означає водень;
та
n дорівнює 1, 2 або 3;
і її фармацевтично прийнятні солі.
9. Сполуки за будь-яким з пп. 1-8 для застосування як терапевтично активних речовин.
10. Сполуки за будь-яким з пп. 1-8 для застосування як терапевтично активних речовин для лікування і/або профілактики захворювань, які опосередковуються за допомогою БПХЕ.
11. Спосіб одержання сполуки формули І за п. 1, в якому здійснюють реакцію похідної кислоти, сполуки формули II
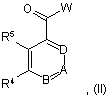
у якій R4, R5, А, В і D мають значення за п. 1 і W означає гідроксигрупу, OLi, ONa, OK або галоген,
з похідною вторинного аміну, сполуки формули III
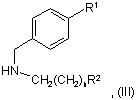
у якій R1, R2 та n мають значення за п. 1, і необов'язкове перетворення одержаної сполуки на фармацевтично прийнятну сіль.
12. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-8, а також фармацевтично прийнятний носій і/або допоміжну речовину.
13. Фармацевтична композиція за п. 12 для лікування і/або профілактики захворювань, які опосередковуються за допомогою БПХЕ (білок-переносник холестерилового ефіру).
14. Спосіб лікування і/або профілактики захворювань, які опосередковуються за допомогою БПХЕ, який включає введення людині або тварині сполуки за будь-яким з пп. 1-8.
15. Застосування сполук за будь-яким з пп. 1-8 для одержання лікарського засобу для лікування і/або профілактики захворювань, які опосередковуються за допомогою БПХЕ.
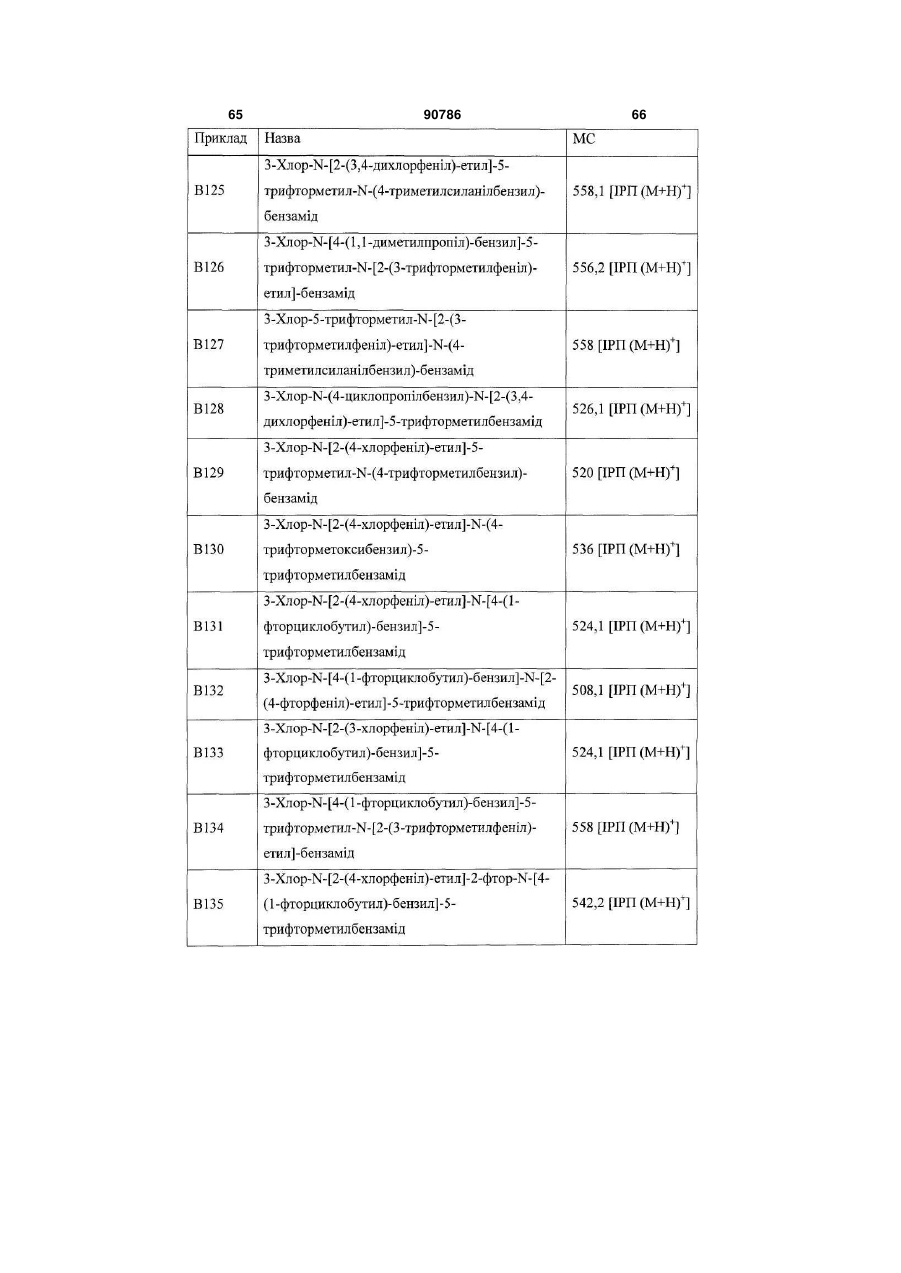
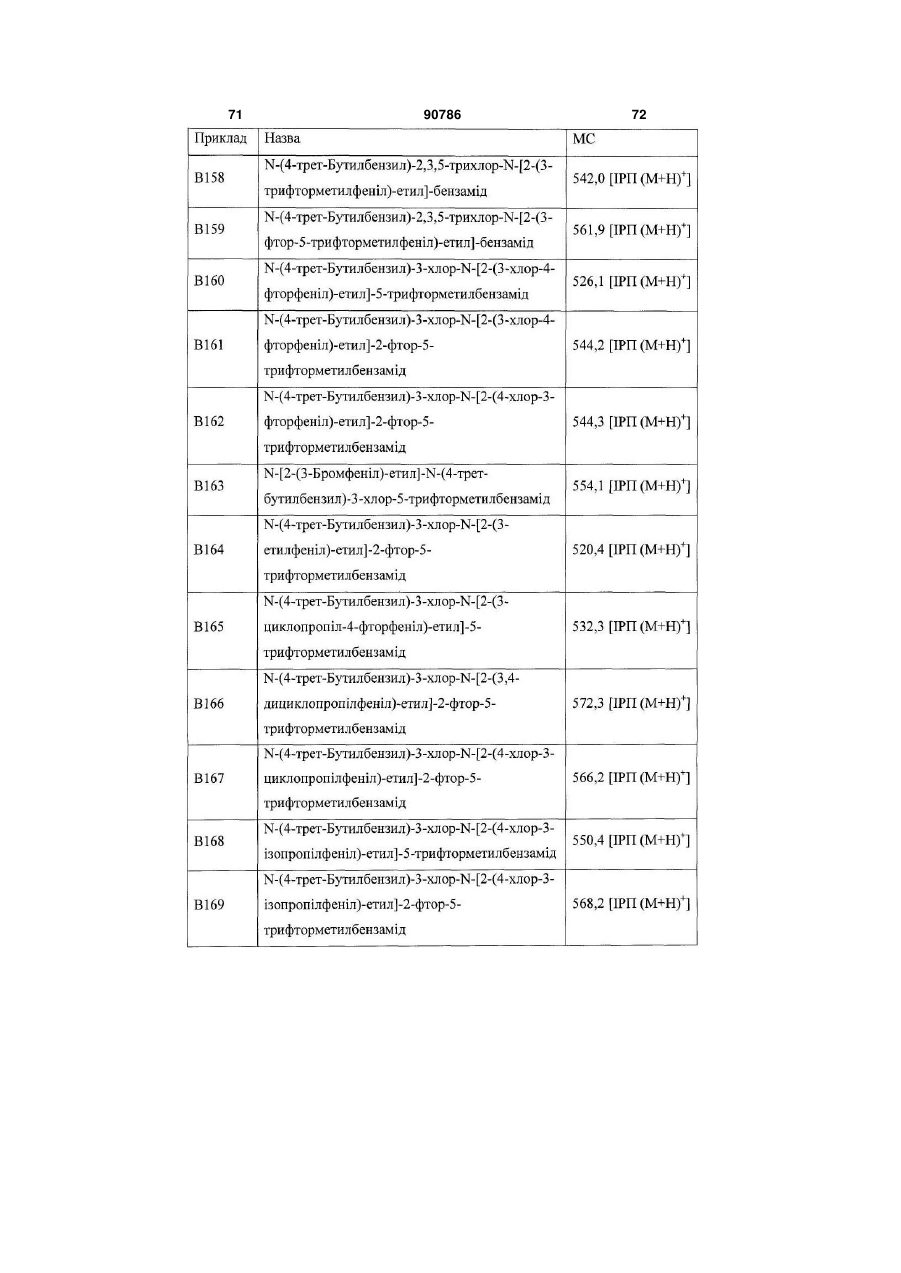
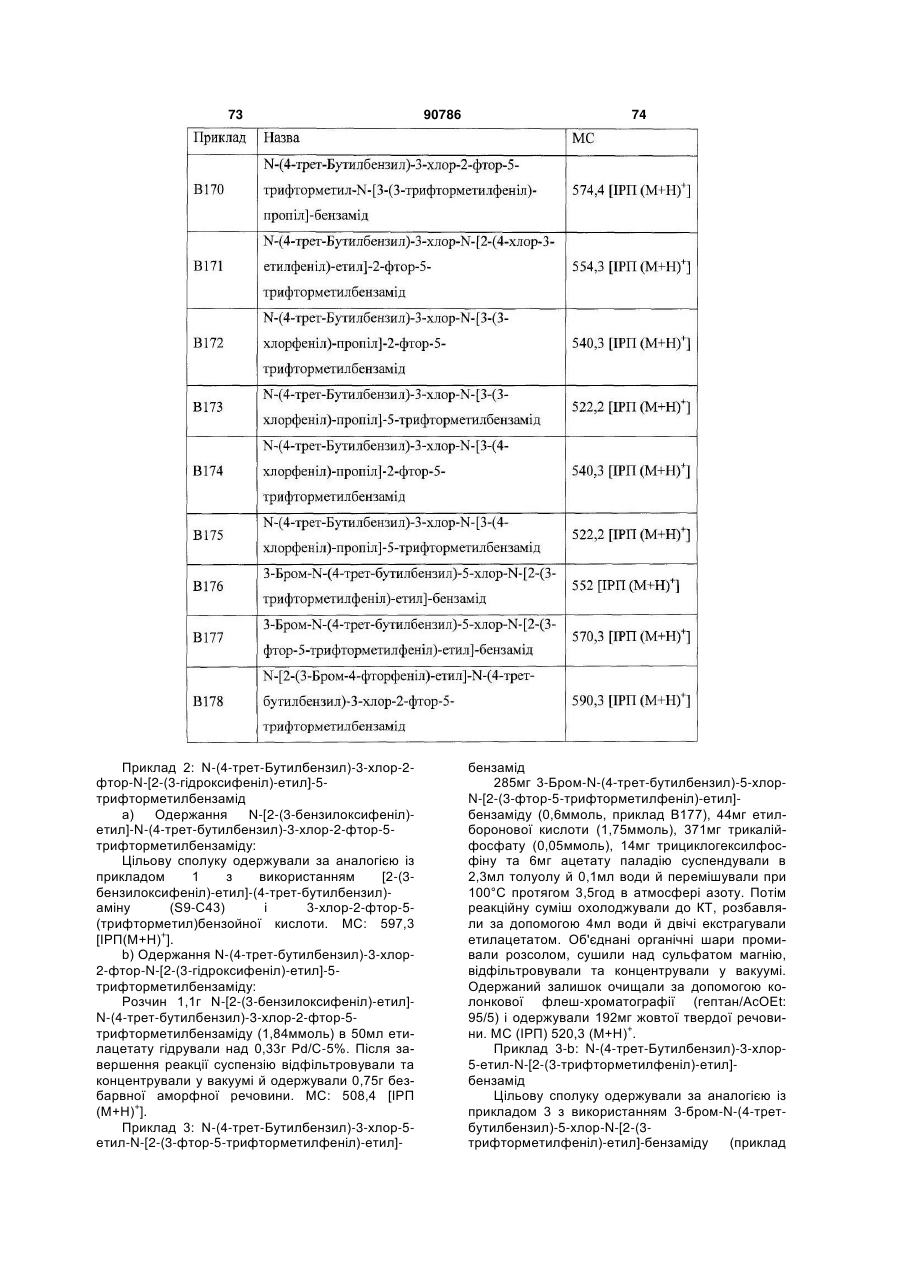
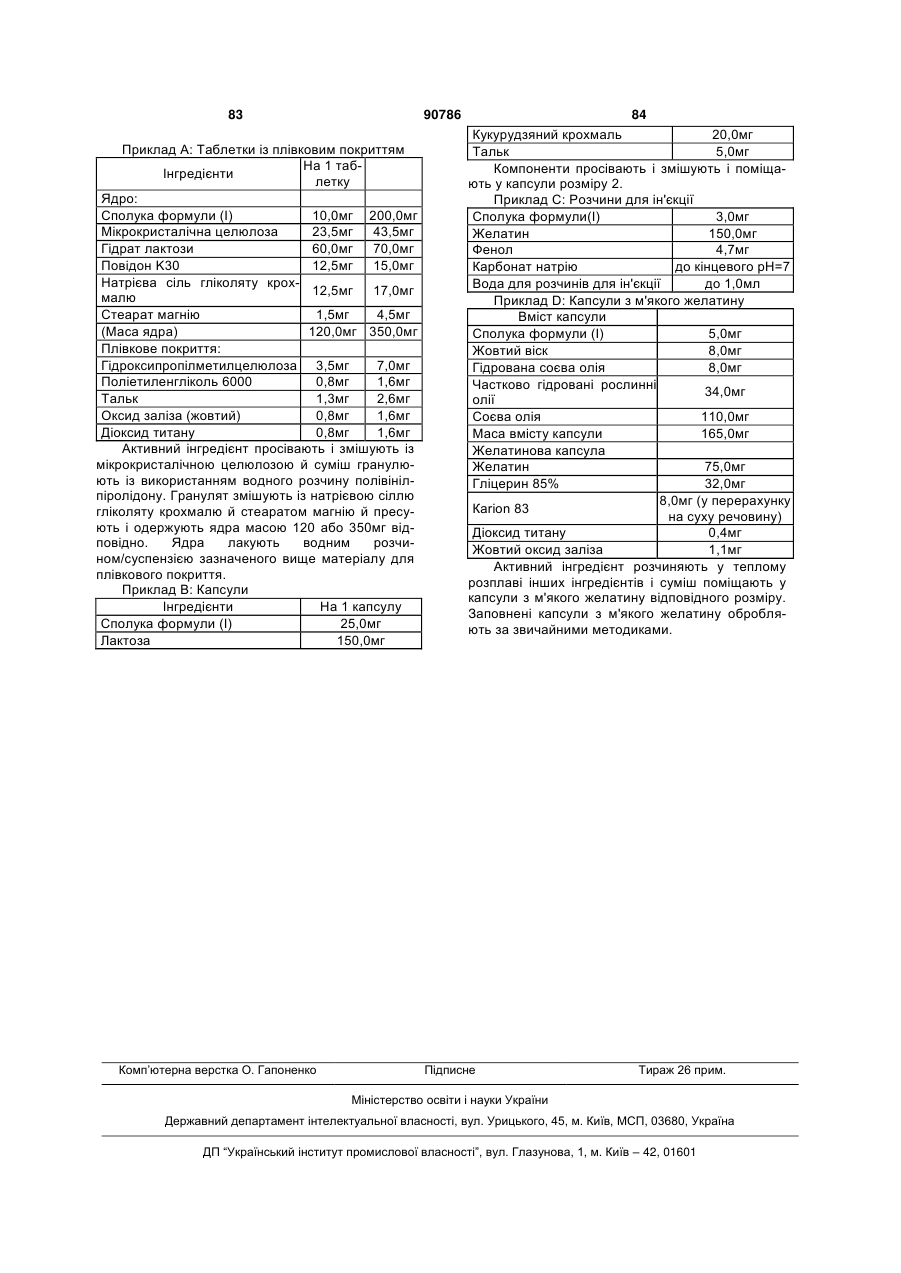
Текст
1. Сполука формули І R1 2 3 90786 4 R10 означає водень або означає С1-С6алкіл, галота ген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або n дорівнює 1, 2 або 3; галоген-С1-С6алкоксигрупу, де принаймні один з і її фармацевтично прийнятні солі. R3, R4, R5 і R11 не означає водень; 6. Сполука за п. 1, у якій R11 означає водень або означає С1-С6алкіл, галоR1 означає С1-С6алкіл, галоген-С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або ген-С1-С6алкоксигрупу, С3-С8циклоалкіл, галогенгалоген-С1-С6алкоксигрупу, де принаймні два з R3, С3-С8циклоалкіл або три-С1-С6алкілсиліл; R4, R5 і R10 не означають водень; R2 означає водень або групу 3 4 5 10 11 у якій принаймні два з R , R , R , R і R не ознаR8 R6 чають водень; N та N X n дорівнює 1, 2 або 3; 7 Y і її фармацевтично прийнятні солі. R 2. Сполука за п. 1, у якій R1 означає С1-С6алкіл, R9 , (a) (а) або , , (b) (b) галоген-С1-С6алкіл, С3-С8циклоалкіл, галоген-С3у якій С8циклоалкіл або три-С1-С6алкілсиліл. R6 і R7 незалежно означають водень, С1-С6алкіл, 3. Сполука за п. 1, у якій R2 означає групу (а). 2 галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН 4. Сполука за п. 1, у якій R означає групу (b). або галоген-С1-С6алкоксигрупу; 5. Сполука за п. 1, у якій 1 R8 і R9 незалежно означають водень, С1-С6алкіл, R означає С1-С6алкіл, галоген-С1-С6алкіл, галогалоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН ген-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоген2 або галоген-С1-С6алкоксигрупу; С3-С8циклоалкіл або три-С1-С6алкілсиліл; R ознаX означає CR12 або N; чає водень або групу Y означає СН або N; R8 R6 у якій X і Y одночасно не означають N; N R12 означає водень, С1-С6алкіл, галоген-С1N X С алкіл, галоген, С -С циклоалкіл, ОН або галоген6 Y R7 , (a) (а) або R9 , , (b) (b) у якій R6 і R7 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; R8 і R9 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; X означає CR12 або N; Y означає СН або N; у якій X і Y одночасно не означають N; R12 означає водень, С1-С6алкіл, галоген-С1С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенС1-С6алкоксигрупу; R5 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1С6алкоксигрупу; R4 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R5, R10 і R11 не означає водень; А означає CR10; В означає CR11 або N; D означає CR3 або N; R3 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1С6алкоксигрупу; R10 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R4, R5 і R11 не означає водень; R11 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні два з R3, R4, R5 і R10 не означають водень; у якій принаймні два з R3, R4, R5, R10 і R11 не означають водень; 3 8 С1-С6алкоксигрупу; R5 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1С6алкоксигрупу; R4 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R5 і R11 не означає водень; А означає N; В означає CR11; D означає CR3; R3 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1С6алкоксигрупу; R11 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні два з R3, R4, R5 і R10 не означають водень; у якій принаймні два з R3, R4, R5, R10 і R11 не означають водень; та n дорівнює 1, 2 або 3; і її фармацевтично прийнятні солі. 7. Сполука за п. 1, у якій R1 означає С1-С6алкіл, галоген-С1-С6алкіл, галоген-С1-С6алкоксигрупу, С3-С8циклоалкіл, галогенС3-С8циклоалкіл або три-С1-С6алкілсиліл; R2 означає водень або групу R8 R6 N N X Y R7 , (a) (а) або R9 , , (b) (b) у якій R6 і R7 незалежно означають водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; 5 90786 6 R8 і R9 незалежно означають водень, С1-С6алкіл, А означає CR10; галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН В означає CR11 або N; або галоген-С1-С6алкоксигрупу; D означає CR3; 12 X означає CR або N; R3 означає водень; Y означає СН або N; R10 означає галоген-С1-С6алкіл або галоген; 11 у якій X і Y одночасно не означають N; R означає водень; 12 R означає водень, С1-С6алкіл, галоген-С1та С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенn дорівнює 1, 2 або 3; С1-С6алкоксигрупу; і її фармацевтично прийнятні солі. R5 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, 9. Сполуки за будь-яким з пп. 1-8 для застосувангалоген, С3-С8циклоалкіл, ОН або галоген-С1ня як терапевтично активних речовин. С6алкоксигрупу; 10. Сполуки за будь-яким з пп. 1-8 для застосуR4 означає водень або означає С1-С6алкіл, галовання як терапевтично активних речовин для лікуген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або вання і/або профілактики захворювань, які опосегалоген-С1-С6алкоксигрупу, де принаймні один з редковуються за допомогою БПХЕ. R3, R5, R10 і R11 не означає водень; 11. Спосіб одержання сполуки формули І за п. 1, в А означає CR10; якому здійснюють реакцію похідної кислоти, споВ означає CR11 або N; луки формули II D означає CR3; W O R3 означає водень, С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1R5 D С6алкоксигрупу; R10 означає водень або означає С1-С6алкіл, галоA ген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або B R4 , (II) галоген-С1-С6алкоксигрупу, де принаймні один з у якій R4, R5, А, В і D мають значення за п. 1 і W R3, R4, R5 і R11 не означає водень; означає гідроксигрупу, OLi, ONa, OK або галоген, R11 означає водень або означає С1-С6алкіл, галоз похідною вторинного аміну, сполуки формули III ген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або R1 галоген-С1-С6алкоксигрупу, де принаймні два з R3, R4, R5 і R10 не означають водень; у якій принаймні два з R3, R4, R5, R10 і R11 не означають водень; та HN CH2(CH2)nR2 n дорівнює 1, 2 або 3; , (III) і її фармацевтично прийнятні солі. у якій R1, R2 та n мають значення за п. 1, і необо8. Сполука за п. 1, у якій R1 означає С1-С6алкіл; в'язкове перетворення одержаної сполуки на фаR2 означає групу рмацевтично прийнятну сіль. R8 12. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-8, а також фармацевтично X прийнятний носій і/або допоміжну речовину. Y 13. Фармацевтична композиція за п. 12 для лікування і/або профілактики захворювань, які опосе9 R , (b) редковуються за допомогою БПХЕ (білоку якій переносник холестерилового ефіру). R8 і R9 незалежно означають водень, галоген-С114. Спосіб лікування і/або профілактики захворюС6алкіл, галоген, С3-С8циклоалкіл або галоген-С1вань, які опосередковуються за допомогою БПХЕ, С6алкоксигрупу; 12 який включає введення людині або тварині сполуX означає CR ; ки за будь-яким з пп. 1-8. Y означає СН; 12 15. Застосування сполук за будь-яким з пп. 1-8 для R означає водень, галоген або С3-С8циклоалкіл; 5 одержання лікарського засобу для лікування і/або R означає водень або галоген; профілактики захворювань, які опосередковуються R4 означає С1-С6алкіл, галоген-С1-С6алкіл або газа допомогою БПХЕ. логен; Даний винахід стосується нових карбоксамідних похідних бензамідів і гетероаренів, способів їх одержання, їх застосування як фармацевтичні засоби, та фармацевтичних композицій, що їх включають. Більш кращим першим об'єктом даного винаходу є сполука формули І 7 90786 8 мають розгалужений і лінійним ланцюг та які містять від 1 до 6 атомів вуглецю, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил, третбутил, ізомерні пентили й ізомерні гексили. Приклади галогену включають фтор, хлор, бром та йод. Приклади галоген-С1-С6алкілу включають С1С6алкільні групи, визначені вище, у яких принаймні один з атомів водню С1-С6алкільної групи замінений на атом галогену, наприклад, фтор або хлор, наприклад, трифторметил, дифторметил, фторметил, 1,2,2,2-тетрафтор-1-трифторметилетил, пену якій тафторетил і хлордифторметил. R1 означає С1-С6алкіл, галоген-С1-С6алкіл, гаПриклади галоген-С1-С6алкоксигрупи включалоген-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоють алкоксигрупи формули О-С1-С6алкіл, у яких ген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; принаймні один з атомів водню алкоксигрупи заміR2 означає водень або групу нений на атом галогену, наприклад, фтор або хлор, наприклад, трифторметокси-, дифторметокси-, фторметокси- і хлордифторметоксигрупа. Приклади С3-С8циклоалкілу включають насичені карбоциклічні групи, що містять від 3 до 8 атомів вуглецю, такі як циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил. Приклади галоген-С3-С8циклоалкілу включау якій ють 1-фторциклобутил. 6 7 R і R незалежно означають водень, С1Приклади три-С1-С6алкілсилілу включають С6алкіл, галоген-С1-С6алкіл, галоген, С 3триметилсиліл. С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; Термін "фармацевтично прийнятні солі" ознаR8 і R9 незалежно означають водень, С1чає такі солі, які зберігають біологічну ефективС6алкіл, галоген-С1-С6алкіл, галоген, С 3ність і характеристики вільних основ або вільних С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; кислот і які не є небажаними в біологічному або 12 X означає CR або N; іншому відношенні. Ці солі утворюються з неоргаΥ означає СН або Ν; нічними кислотами, такими як хлористоводнева у якій X і Υ одночасно не означають Ν; кислота, бромистоводнева кислота, сірчана кисло12 R означає водень, С1-С6алкіл, галоген-С1та, азотна кислота, фосфорна кислота й т.п., пеС6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенреважно - хлористоводнева кислота, і органічними С1-С6алкоксигрупу; кислотами, такими як оцтова кислота, пропіонова R5 означає водень, С1-С6алкіл, галоген-С1кислота, гліколева кислота, піровиноградна кислоС6алкіл, галоген, С3-С8циклоалкіл, ОН або галогента, щавлева кислота, малеїнова кислота, малоноС1-С6алкоксигрупу; ва кислота, саліцилова кислота, бурштинова кис4 R означає водень, або означає С1-С6алкіл, лота, фумарова кислота, винна кислота, лимонна галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН кислота, бензойна кислота, корична кислота, мигабо галоген-С1-С6алкоксигрупу, де принаймні один дальна кислота, метансульфонова кислота, етан3 5 10 11 з R , R , R і R не означає водень; сульфонова кислота, п-толуолсульфонова кислоА означає CR10 або Ν; та, саліцилова кислота, N-ацетилцистеїн і т.п. Крім 11 В означає CR або Ν; того, ці солі можна одержати шляхом додавання 3 D означає CR або Ν; неорганічної основи або органічної основи до віу якій -В=А- та -A=D- не означають -N=N-; льної кислоти. Солі, утворені з неорганічної осно3 R означає водень, С1-С6алкіл, галоген-С1ви, включають, але не обмежуються тільки ними, С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенсолі натрію, калію, літію, амонію, кальцію, магнію й С1-С6алкоксигрупу; т.п. Солі, утворені з органічної основи, включають, 10 R означає водень, або означає С1-С6алкіл, але не обмежуються тільки ними солі первинних, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН вторинних і третинних амінів, заміщених амінів, або галоген-С1-С6алкоксигрупу, де принаймні один включаючи природні заміщені аміни, циклічні аміни з R3, R4, R5 і R11 не означає водень; й основні іонообмінні смоли, такі як ізопропіламін, 11 R означає водень або означає С1-С6алкіл, триметиламін, діетиламін, триетиламін, трипропігалоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН ламін, етаноламін, лізин, аргінін, N-етилпіперидин, або галоген-С1-С6алкоксигрупу, де принаймні два з піперидин, поліімінні смоли й т.п. Сполука форму3 4 5 10 R , R , R і R не означають водень; ли І також може міститися у вигляді цвітеріонів. 3 4 5 10 11 у якій принаймні два з R , R , R , R і R не Особливо кращими фармацевтично прийнятними означають водень; солями сполук формули І є гідрохлориди. та Сполуки формули І також можуть бути сольваn дорівнює 1, 2 або 3; тованими, наприклад, гідратованими. Сольватація і її фармацевтично прийнятні солі. може відбуватися під час приготування або відбуПриклади С1-С6алкілу включають одновалентватися, наприклад, внаслідок гігроскопічності вихіні насичені аліфатичні вуглеводневі радикали, які 9 90786 10 дної безводної сполуки формули І (гідратація). нення даний винахід стосується сполуки формули Термін "фармацевтично прийнятні солі" також І, у якій R2 означає групу (b), у якій R8 означає вовключає фізіологічно прийнятні сольвати. день, СН2СН3, (СН2)2СН3, СН(СН3)2, CF3, Br, Cl, F, "Ізомери" є сполуками, які мають ідентичні моциклопропіл або OCF3. У ще одному варіанті здійлекулярні формули, але розрізняються за прироснення даний винахід стосується сполуки форму2 9 дою або послідовністю зв'язування своїх атомів ли І, у якій R означає групу (b), у якій R означає або за розташуванням своїх атомів у просторі. водень, СІ або F. У ще одному варіанті здійснення Ізомери, які розрізняються за розташуванням своїх даний винахід стосується сполуки формули І, у атомів у просторі, називаються "стереоізомерами". якій R2 означає групу (b), у якій R9 означає водень Стереоізомери, які не є дзеркальними відобраабо F. женнями один одного, називаються "діастереоізоВ іншому варіанті здійснення даний винахід мерами" і стереоізомери, які не є дзеркальними стосується сполуки формули І, у якій R2 означає відображеннями, що накладають одне на одного, групу (b), у якій X означає CR12. У ще одному варіназиваються "енантіомерами", а іноді й оптичними анті здійснення даний винахід стосується сполуки ізомерами. Атом вуглецю, який має чотири різні формули І, у якій R2 означає групу (b), у якій X замісники, називається "хіральним центром". означає CR12, у якій R12 означає водень, С1В одному варіанті здійснення даний винахід С6алкіл, галоген-С1-С6алкіл, галоген або галогенстосується сполуки формули І, у якій R1 означає С1-С6алкоксигрупу. У ще одному варіанті здійсненС1-С6алкіл, галоген-С1-С6алкіл, С3-С8циклоалкіл, ня даний винахід стосується сполуки формули І, у галоген-С3-С8циклоалкіл або три-С1-С6алкілсиліл. якій R2 означає групу (b), у якій X означає CR12, у В іншому варіанті здійснення даний винахід стосуякій R12 означає водень, С1-С6алкіл, галоген-С11 ється сполуки формули І, у якій R означає С1С6алкіл або галоген. У ще одному варіанті здійсС6алкіл. У ще одному варіанті здійснення даний нення даний винахід стосується сполуки формули винахід стосується сполуки формули І, у якій R1 І, у якій R2 означає групу (b), у якій X означає CR12, означає бутил. У ще одному варіанті здійснення у якій R12 означає водень або галоген. У ще одноданий винахід стосується сполуки формули І, у му варіанті здійснення даний винахід стосується якій R1 означає трет-бутил. сполуки формули І, у якій R2 означає групу (b), у В одному варіанті здійснення даний винахід якій X означає CR12, у якій R12 означає водень, СІ 2 стосується сполуки формули І, у якій R означає або F. У ще одному варіанті здійснення даний виводень. нахід стосується сполуки формули І, у якій R2 В іншому варіанті здійснення даний винахід означає групу (b), у якій X означає CR12, у якій R12 2 стосується сполуки формули І, у якій R означає означає водень, С1-С6алкіл, галоген-С1-С6алкіл, групу (а). В іншому варіанті здійснення даний вигалоген, С3-С8циклоалкіл або галоген-С1нахід стосується сполуки формули І, у якій R2 С6алкоксигрупу. У ще одному варіанті здійснення означає групу (а), у якій R6 і R7 незалежно означаданий винахід стосується сполуки формули І, у ють галоген-С1-С6алкіл або галоген. У ще одному якій R2 означає групу (b), у якій X означає CR12, у варіанті здійснення даний винахід стосується споякій R12 означає водень, С1-С6алкіл, галоген-С12 луки формули І, у якій R означає групу (а), у якій С6алкіл, галоген або С3-С8циклоалкіл. У ще одноR6 означає галоген-С1-С6алкіл і R7 означає галому варіанті здійснення даний винахід стосується ген. У ще одному варіанті здійснення даний винасполуки формули І, у якій R2 означає групу (b), у 2 хід стосується сполуки формули І, у якій R ознаякій X означає CR12, у якій R12 означає водень, чає групу (а), у якій R6 означає CF3 і R7 означає СІ. галоген або С3-С8циклоалкіл. У ще одному варіанті В іншому варіанті здійснення даний винахід здійснення даний винахід стосується сполуки фостосується сполуки формули І, у якій R2 означає рмули І, у якій R2 означає групу (b), у якій X ознагрупу (b). В іншому варіанті здійснення даний вичає CR12, у якій R12 означає водень, СІ, F або цик2 нахід стосується сполуки формули І, у якій R лопропіл. означає групу (b), у якій R8 і R9 незалежно означаВ іншому варіанті здійснення даний винахід ють водень, галоген-С1-С6алкіл, галоген, С3стосується сполуки формули І, у якій R2 означає С8циклоалкіл або галоген-С1-С6алкоксигрупу. У ще групу (b), у якій X означає N і Υ означає СН. одному варіанті здійснення даний винахід стосуВ іншому варіанті здійснення даний винахід ється сполуки формули І, у якій R2 означає групу стосується сполуки формули І, у якій R2 означає (b), у якій R8 і R9 незалежно означають водень, групу (b), у якій Υ означає СН. CF3, Cl, F, циклопропіл або OCF3. У ще одному В іншому варіанті здійснення даний винахід варіанті здійснення даний винахід стосується спостосується сполуки формули І, у якій R2 означає луки формули І, у якій R2 означає групу (b), у якій групу (b), у якій Υ означає N і X означає CR12. 8 R означає водень, CF3, Cl, F, циклопропіл або В іншому варіанті здійснення даний винахід OCF3. В іншому варіанті здійснення даний винахід стосується сполуки формули І, у якій А означає стосується сполуки формули І, у якій R2 означає CR10. У ще одному варіанті здійснення даний вигрупу (b), у якій R8 і R9 незалежно означають вонахід стосується сполуки формули І, у якій А озна10 10 день, С1-С6алкіл, галоген- С1-С6алкіл, галоген, С3чає CR , у якій R означає водень, або означає С8циклоалкіл або галоген-С1-С6алкоксигрупу. У ще галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл або одному варіанті здійснення даний винахід стосуОН, де принаймні один з R3, R4, R5 і R11 не означає 2 ється сполуки формули І, у якій R означає групу водень. У ще одному варіанті здійснення даний (b), у якій R8 і R9 незалежно означають водень, винахід стосується сполуки формули І, у якій А СН2СН3, (СН2)2СН3, СН(СН3)2, CF3, Br, СІ, F, цикозначає CR10, у якій R10 означає галоген-С1лопропіл або OCF3. У ще одному варіанті здійсС6алкіл або галоген, де принаймні один з R3, R4, 11 90786 12 R5 і R11 не означає водень. У ще одному варіанті В іншому варіанті здійснення даний винахід здійснення даний винахід стосується сполуки фостосується сполуки формули І, у якій n дорівнює 1. рмули І, у якій А означає CR10, у якій R10 означає В одному варіанті здійснення даний винахід CF3 або СІ, де принаймні один з R3, R4, R5 і R11 не стосується сполуки формули І, у якій означає водень. R1 означає С1-С6алкіл, галоген-С1-С6алкіл, гаВ іншому варіанті здійснення даний винахід логен-С1-С6алкоксигрупу, С3-С8циклоалкіл, галостосується сполуки формули І, у якій А означає N і ген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; В і D не означають N. R2 означає водень; В іншому варіанті здійснення даний винахід R5 означає водень, С1-С6алкіл, галоген-С1стосується сполуки формули І, у якій В означає С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенCR11. В іншому варіанті здійснення даний винахід С1-С6алкоксигрупу; стосується сполуки формули І, у якій В означає R4 означає водень, або означає С1-С6алкіл, CR11, у якій R11 означає водень або означає галогалоген- С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН ген, де принаймні два з R3, R4, R5 і R10 не означаабо галоген-С1-С6алкоксигрупу, де принаймні один ють водень. В іншому варіанті здійснення даний з R3, R5, R10 і R11 не означає водень; винахід стосується сполуки формули І, у якій В А означає CR10 або Ν; 11 11 означає CR , у якій R означає водень або ознаВ означає CR11 або N; чає F або СІ, де принаймні два з R3, R4, R5 і R10 не D означає CR3 або N; означають водень. У ще одному варіанті здійснену якій -В=А- і -A=D- не означають -N=N-; ня даний винахід стосується сполуки формули І, у R3 означає водень, С1-С6алкіл, галоген-С111 11 якій В означає CR , у якій R означає водень. С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенВ іншому варіанті здійснення даний винахід С1-С6алкоксигрупу; стосується сполуки формули І, у якій В означає N і R10 означає водень, або означає С1-С6алкіл, А не означає N. галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН В іншому варіанті здійснення даний винахід або галоген-С1-С6алкоксигрупу, де принаймні один стосується сполуки формули І, у якій D означає з R3, R4, R5 і R11 не означає водень; 3 CR . У ще одному варіанті здійснення даний винаR11 означає водень або означає С1-С6алкіл, хід стосується сполуки формули І, у якій D означає галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН CR3, у якій R3 означає водень. або галоген-С1-С6алкоксигрупу, де принаймні два з В іншому варіанті здійснення даний винахід R3, R4, R5 і R10 не означають водень; стосується сполуки формули І, у якій D означає N. у якій принаймні два з R3, R4, R5, R10 і R11 не В іншому варіанті здійснення даний винахід означають водень; 5 стосується сполуки формули І, у якій R означає та водень, галоген-С1-С6алкіл, галоген або ОН. У ще n дорівнює 1, 2 або 3; одному варіанті здійснення даний винахід стосуі її фармацевтично прийнятних солей. ється сполуки формули І, у якій R5 означає водень, В одному варіанті здійснення даний винахід галоген-С1-С6алкіл або галоген. У ще одному варістосується сполуки формули І, у якій анті здійснення даний винахід стосується сполуки R1 означає С1-С6алкіл, галоген-С1-С6алкіл, га5 формули І, у якій R означає водень або галоген. У логен-С1-С6aлкоксигрупу, С3-С8циклоалкіл, галоще одному варіанті здійснення даний винахід стоген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; сується сполуки формули І, у якій R5 означає воR2 означає групу день або F. В іншому варіанті здійснення даний винахід стосується сполуки формули І, у якій R4 означає водень, або означає С1-С6алкіл, галоген-С1С6алкіл або галоген, де принаймні один з R3, R5, R10 і R11 не означає водень. У ще одному варіанті здійснення даний винахід стосується сполуки формули І, у якій R4 означає галоген-С1-С6алкіл або у якій R6 і R7 незалежно означають водень, С13 5 10 11 галоген і принаймні один з R , R , R і R не С6алкіл, галоген-С1-С6алкіл, галоген, 3означає водень. У ще одному варіанті здійснення С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; даний винахід стосується сполуки формули І, у R5 означає водень, С1-С6алкіл, галоген-С14 3 якій R означає CF3 або СІ і принаймні один з R , С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенR5, R10 і R11 не означає водень. У ще одному варіС1-С6алкоксигрупу; анті здійснення даний винахід стосується сполуки R4 означає водень, або означає С1-С6алкіл, 4 формули І, у якій R означає С1-С6алкіл, галогенгалоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН С1-С6алкіл або галоген і принаймні один з R3, R5, або галоген-С1-С6алкоксигрупу, де принаймні один R10 і R11 не означає водень. У ще одному варіанті з R3, R5, R10 і R11 не означає водень; здійснення даний винахід стосується сполуки фоА означає CR10 або N; 4 11 рмули І, у якій R означає CH2CH3, CF3 або СІ і В означає CR або N; 3 5 10 11 принаймні один з R , R , R і R не означає воD означає CR3 або N; день. у якій -В=А- і -A=D- не означають -N=N-; Даний винахід стосується сполук формули І, у R3 означає водень, С1-С6алкіл, галоген-С1якій принаймні два з R3, R4, R5, R10 і R11 не ознаС6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенчають водень. С1-С6алкоксигрупу; 13 90786 14 R10 означає водень, або означає С1-С6алкіл, R1 означає С1-С6алкіл, галоген-С1-С6алкіл, гагалоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН логен-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоабо галоген-С1-С6алкоксигрупу, де принаймні один ген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; з R3, R4, R5 і R11 не означає водень; R2 означає водень або групу 11 R означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні два з R3, R4, R5 і R10 не означають водень; у якій принаймні два з R3, R4, R5, R10 і R11 не означають водень; та n дорівнює 1, 2 або 3; і її фармацевтично прийнятних солей. у якій В одному варіанті здійснення даний винахід R6 і R7 незалежно означають водень, С1стосується сполуки формули І, у якій С6алкіл, галоген-С1-С6алкіл, галоген, С3R1 означає С1-С6алкіл, галоген-С1-С6алкіл, гаС8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; логен-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоR8 і R9 незалежно означають водень, С1ген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; С6алкіл, галоген-С1-С6алкіл, галоген, С3R2 означає групу С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; X означає CR12 або Ν; Υ означає СН або Ν; у якій X і Υ одночасно не означають Ν; R12 означає водень, С1-С6алкіл, галоген-С1С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенС1-С6алкоксигрупу; R5 означає водень, С1-С6алкіл, галоген-С1С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенС1-С6алкоксигрупу; у якій R4 означає водень, або означає С1-С6алкіл, R8 і R9 незалежно означають водень, С1галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН С6алкіл, галоген-С1-С6алкіл, галоген, С 3або галоген-С1-С6алкоксигрупу, де принаймні один С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; з R3, R5, R і R11 не означає водень; X означає CR12 або N; 10 А означає CR ; Υ означає СН або Ν; В означає CR11 або N; у якій X і Υ одночасно не означають Ν; 12 D означає CR3 або N; R означає водень, С1-С6алкіл, галоген-С1R3 означає водень, С1-С6алкіл, галоген-С1С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенС6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенС1-С6алкоксигрупу; С1-С6алкоксигрупу; R5 означає водень, С1-С6алкіл, галоген-С1R10 означає водень, або означає С1-С6алкіл, С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенгалоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН С1-С6алкоксигрупу; або галоген-С1-С6алкоксигрупу, де принаймні один R4 означає водень, або означає С1-С6алкіл, з R3, R4, R5 і R11 не означає водень; галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН R11 означає водень або означає С1-С6алкіл, або галоген-С1-С6алкоксигрупу, де принаймні один 3 5 10 11 галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН з R , R , R і R не означає водень; або галоген-С1-С6алкоксигрупу, де принаймні два з А означає CR10 або Ν; R3, R4, R5 і R10 не означають водень; В означає CR11 або Ν; 3 у якій принаймні два з R3, R4, R5, R10 і R11 не D означає CR або Ν; означають водень; у якій -В=А- і -A=D- не означають -N=N-; та R3 означає водень, С1-С6алкіл, галоген-С1n дорівнює 1, 2 або 3; С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогені її фармацевтично прийнятних солей. С1-С6алкоксигрупу; В одному варіанті здійснення даний винахід R10 означає водень, або означає С1-С6алкіл, стосується сполуки формули І, у якій галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН R1 означає С1-С6алкіл, галоген-С1-С6алкіл, гаабо галоген-С1-С6алкоксигрупу, де принаймні один 3 4 5 11 логен-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоз R , R , R і R не означає водень; ген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; R11 означає водень або означає С1-С6алкіл, R2 означає водень або групу галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні два з R3, R4, R5 і R10 не означають водень; 3 4 5 10 11 у якій принаймні два з R , R , R , R і R не означають водень; та n дорівнює 1,2 або 3; і її фармацевтично прийнятних солей. В одному варіанті здійснення даний винахід стосується сполуки формули І, у якій у якій 15 90786 16 R6 і R7 незалежно означають водень, С1або галоген-С1-С6алкоксигрупу, де принаймні один С6алкіл, галоген-С1-С6алкіл, галоген, С 3з R3, R5, R10 і R11 не означає водень; С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; А означає CR10; 8 9 R і R незалежно означають водень, С1В означає CR11 або N; С6алкіл, галоген-С1-С6алкіл, галоген, С 3D означає CR3; 3 С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; R означає водень, С1-С6алкіл, галоген-С112 X означає CR або Ν; С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенΥ означає СН або Ν; С1-С6алкоксигрупу; у якій X і Υ одночасно не означають Ν; R10 означає водень, або означає С1-С6алкіл, 12 R означає водень, С1-С6алкіл, галоген-С1галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенабо галоген-С1-С6алкоксигрупу, де принаймні один С1-С6алкоксигрупу; з R3, R4, R5 і R11 не означає водень; R5 означає водень, С1-С6алкіл, галоген-С1R11 означає водень або означає С1-С6алкіл, С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенгалоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН С1-С6алкоксигрупу; або галоген-С1-С6алкоксигрупу, де принаймні два з R4 означає водень, або означає С1-С6алкіл, R3, R4, R5 і R10 не означають водень; галоген- С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН у якій принаймні два з R3, R4, R5, R10 і R11 не або галоген-С1-С6алкоксигрупу, де принаймні один означають водень; з R3, R5 і R11 не означає водень; та А означає N; n дорівнює 1, 2 або 3; В означає CR11; і її фармацевтично прийнятних солей. D означає CR3; В одному варіанті здійснення даний винахід R3 означає водень, С1-С6алкіл, галоген-С1стосується сполуки формули І, у якій С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенR1 означає С1-С6алкіл; R2 означає групу С1-С6алкоксигрупу; R11 означає водень або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні два з R3, R4, R5 і R10 не означають водень; у якій принаймні два з R3, R4, R5, R10 і R11 не означають водень; та у якій n дорівнює 1, 2 або 3; R8 і R9 незалежно означають водень, галогені її фармацевтично прийнятних солей. С1-С6алкіл, галоген, С3-С8циклоалкіл або галогенВ одному варіанті здійснення даний винахід С1-С6алкоксигрупу; стосується сполуки формули І, у якій X означає CR12; R1 означає С1-С6алкіл, галоген-С1-С6алкіл, гаΥ означає СН; логен-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоR12 означає водень або галоген; ген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; 2 R5 означає водень або галоген; R означає водень або групу R4 означає галоген-С1-С6алкіл або галоген; А означає CR10; В означає CR11 або N; D означає CR3; R3 означає водень; R10 означає галоген-С1-С6алкіл або галоген; R11 означає водень; та n дорівнює 1, 2 або 3; у якій 6 7 і її фармацевтично прийнятних солей. R і R незалежно означають водень, С1В одному варіанті здійснення даний винахід С6алкіл, галоген-С1-С6алкіл, галоген, С 3стосується сполуки формули І, у якій С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; R1 означає С1-С6алкіл; R8 і R9 незалежно означають водень, С1R2 означає групу С6алкіл, галоген-С1-С6алкіл, галоген, С 3С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; X означає CR12 або N; Υ означає СН або Ν; у якій X і Υ одночасно не означають Ν; R12 означає водень, С1-С6алкіл, галоген-С1С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенС1-С6алкоксигрупу; R5 означає водень, С1-С6алкіл, галоген-С1у якій С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенR8 і R9 незалежно означають водень, галогенС1-С6алкоксигрупу; 4 С1-С6алкіл, галоген, С3-С8циклоалкіл або галогенR означає водень, або означає С1-С6алкіл, С1-С6алкоксигрупу; галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН 17 90786 18 X означає CR12; В означає CR11 або N; Υ означає СН; D означає CR3 або N; 12 R означає водень, галоген або С3у якій -В=А- і -A=D- не означають -N=N-; С8циклоалкіл; R10 означає водень, або означає С1-С6алкіл, 5 R означає водень або галоген; галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН 4 R означає С1-С6алкіл, галоген-С1-С6алкіл або або галоген-С1-С6алкоксигрупу, де принаймні один галоген; з R3, R4, R5 і R11 не означає водень; 10 А означає CR ; R11 означає водень або означає С1-С6алкіл, 11 В означає CR або Ν; галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН D означає CR3; або галоген-С1-С6алкоксигрупу, де принаймні два з R3 означає водень; R3, R4, R5 і R10 не означають водень; 10 R означає галоген-С1-С6алкіл або галоген; у якій принаймні два з R3, R4, R5, R10 і R11 не R11 означає водень; означають водень; та та n дорівнює 1, 2 або 3; n дорівнює 1, 2 або 3; і її фармацевтично прийнятних солей. спосіб включає реакцію похідної кислоти, споНа додаток до зазначеного вище даний виналуки формули II хід також стосується способу одержання сполуки формули І у якій R4, R5, А, В і D мають зазначені вище значення й W означає гідроксигрупу, OLi, ONa, OK або галоген, наприклад, СІ, з похідною вторинного аміну, сполукою формули III у якій R1 означає С1-С6алкіл, галоген-С1-С6алкіл, галоген-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; R2 означає водень або групу у якій R6 і R7 незалежно означають водень, С1С6алкіл, галоген-С1-С6алкіл, галоген, С 3С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; R8 і R9 незалежно означають водень, С1С6алкіл, галоген-С1-С6алкіл, галоген, С 3С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; X означає CR12 або Ν; Υ означає СН або Ν; у якій X і Υ одночасно не означають Ν; R12 означає водень, С1-С6алкіл, галоген-С1С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенС1-С6алкоксигрупу; R3 і R5 незалежно означають водень, С1С6алкіл, галоген-С1-С6алкіл, галоген, С 3С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; R4 означає водень, або означає С1-С6алкіл, галоген-С1-С6алкіл, галоген, С3-С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу, де принаймні один з R3, R5, R10 і R11 не означає водень; А означає CR10 або N; у якій R1, R2 та n мають зазначені вище значення. Якщо в цьому способі використовують карбонові кислоти (W=OH) або карбоксилати (W=OLi, ONa, OK) формули II, то для активації кислоти перед проведенням реакції сполучення можна використовувати стандартні реагенти, які застосовуються в реакціях сполучення пептидів. Звичайно похідну кислоти II (R=OH, OLi, ONa, OK) змішують з реагентом реакції сполучення, таким як ЕДХ (етилендихлорид) або ЕДХ·HCl, ДЦК (дициклогексилкарбодіімід), HBTU (О-(безотриазол-1-іл)N,N,N',N'-тетраметилуронійгексафторфосфат) або TBTU (О-(безотриазол-1-іл)-N,N,N',N'тетраметилуронійтетрафторборат), в інертному розчиннику, такому як Ν,Ν-диметилформамід, диметилацетамід (ДМА) або дихлорметан (ДХМ), разом з відповідною похідною вторинного аміну III. Необов'язково можна додати основу (наприклад, N,N-діізопропілетиламін, триетиламін, Nметилморфолін) і/або 1-гідроксибензотриазол (ГОБТ). Реакційну суміш перемішують протягом 124год при температурі, що дорівнює від приблизно -30°С до приблизно 70°С (наприклад, при температурі навколишнього середовища). Альтернативно, хлорангідриди кислот (W=CI) можна ввести в реакцію з похідними вторинного 19 90786 20 аміну III і за стандартними методиками одержати Вторинні аміни III альтернативно можна синтесполуки формули (І). зувати з похідних амідів, сполук формули VII Похідні кислот формули II є у продажу або їх можна одержати так, як це описано в розділі, присвяченому прикладам. Вторинні аміни загальної формули III можна синтезувати за стандартними методиками. Їх можна синтезувати так, як це описано нижче. Сполуки формули III у якій R1, R2 та n є такими, як визначено вище. Похідні амідів, сполуки формули VII, можна одержати за реакцією сполучення похідних бензойної кислоти, сполук формули VI у якій R1 означає С1-С6алкіл, галоген-С1-С6алкіл, галоген-С1-С6алкоксигрупу, С3-С8циклоалкіл, галоген-С3-С8циклоалкіл або три-С1-С6алкілсиліл; R2 означає водень або групу у якій R6 і R7 незалежно означають водень, С1С6алкіл, галоген-С1-С6алкіл, галоген, С 3С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; R8 і R9 незалежно означають водень, С1С6алкіл, галоген-С1-С6алкіл, галоген, С 3С8циклоалкіл, ОН або галоген-С1-С6алкоксигрупу; X означає CR12 або N; Υ означає СН або Ν; у якій X і Υ одночасно не означають Ν; R12 означає водень, С1-С6алкіл, галоген-С1С6алкіл, галоген, С3-С8циклоалкіл, ОН або галогенС1-С6алкоксигрупу; і n дорівнює 1,2 або 3; можна одержати шляхом відновного амінування похідної бензальдегіду, сполуки формули IV у якій R1 є таким, як визначено вище, з аміном, сполукою формули V у якій R2 та n є такими, як визначено вище. Необхідні вихідні аміни й альдегіди є у продажу або їх синтезують за стандартними методиками, як це, наприклад, описано в розділі, присвяченому прикладам. у якій R1 є таким, як визначено вище, з сполукою формули V. Необхідні вихідні бензойні кислоти є у продажу або їх можна синтезувати за стандартними методиками, як це, наприклад, описано в розділі, присвяченому прикладам. Використовуються наступні абревіатури: КТ: кімнатна температура; ТГФ: тетрагідрофуран; ДМФ: Ν,Ν-диметилформамід; ДХМ: дихлорметан, (aq) - водний розчин. Звичайно номенклатура, яка використовується в даній заявці, заснована на комп'ютерній системі AUTONOM v.4.0, розробленій в Beilstein Institute для утворення систематичної номенклатури ІЮПАК. Альдегіди (кислоти) (сполуки формули IV і VI): Приклад S1-Α: Одержання 4циклопропілбензальдегіду: До розчину 1-бром-4-циклопропілбензолу [синтезували за методикою, що аналогічна описаній в публікації J.Org.Chem. 1976, 41, 2262-2266] (1,58г, 8,04ммоль), у ТГФ при -78°С додавали H-BuLi (5,08мл, 1,6Μ розчину в гексані, 8,11ммоль) ї реакційну суміш перемішували при -78°С протягом 10хв. Потім додавали ДМФ (1,25мл, 16,08ммоль) і реакційну суміш перемішували при -78°С протягом 15хв. Потім реакційну суміш повільно нагрівали до 0°С (протягом 2год) і перемішували при 0°С протягом 1год. Реакцію зупиняли насиченим розчином NH4Cl (aq) і водну фазу екстрагували ефіром. Органічний шар промивали розсолом, сушили (MgSO4), фільтрували та концентрували у вакуумі й одержували залишок, який очищали за допомогою колонкової флеш-хроматографії (1:9 діетиловий ефір/пентан) і одержували 4циклопропілбензальдегід (1,10г, 94%) у вигляді безбарвного масла. 1Н ЯМР (CDCl3, 300МГц): 9,94 (s, 1Н), 7,76 (d, J=8,5Гц, 2Н), 7,19 (d, J=8,5Гц, 2Н), 1,97 (m, 1H), 1,13-1,06 (m, 2H), 0,84-0,78 (m, 2H). Приклад S2-A: Одержання 4циклобутилбензальдегіду: а) Одержання 1-(4-бромфеніл)-циклобутанолу: 21 90786 22 До розчину 1, 4-дибромбензолу (1,00г, щали за допомогою колонкової флеш4,24ммоль) при -78°С в ефірі (20мл) додавали Hхроматографії (100% пентан) і одержували 1BuLi (2,65мл, 1,6Μ розчину в гексані, 4,24ммоль) і бром-4-(1-фторциклобутил)-бензол (3,66г, 64%) у реакційну суміш перемішували при -78°С протягом вигляді безбарвної рідини. 30хв. Потім додавали циклобутанон (348мкл, b) Одержання 4-(1-фторциклобутил)4,66ммоль) і реакційну суміш перемішували при бензальдегіду: 78°С протягом 15хв. Потім реакційну суміш повіЦільову сполуку синтезували за аналогією з 4льно (протягом 2год) нагрівали до 0°С і перемішуциклопропілбензальдегідом (описано в прикладі вали протягом ще 1год. Додавали воду, а потім S1-Α) з використанням 1,64г 1-бром-4-(1насичений розчин NH4Cl і реакційну суміш екстрафторциклобутил)-бензолу (7,16ммоль), 4,92мл гували ефіром. Органічний шар промивали розсо1,6Μ розчину н-BuLi у гексані (7,87ммоль) і 1,1мл лом, сушили (MgSO4), фільтрували та концентруДМФ (14,32ммоль). 4-(1-Фторциклобутил)вали у вакуумі й одержували залишок, який бензальдегід виділяли у вигляді неочищеного очищали за допомогою колонкової флешпродукту у вигляді світло-жовтої рідини (1,23г, хроматографії (1:4 ефір/пентан) і одержували 1-(496%). 1Н ЯМР (CDCl3, 300МГц): 1,84 (m, 1Н), 2,15 бромфеніл)-циклобутанол (330мг, 34%) у вигляді (m, 1H), 2,49-2,81 (m, 5H), 7,63 (d, J=8Гц, 2Н), 7,92 безбарвного масла. 1Н ЯМР (CDCl3, 300МГц): (d, J=8Гц, 2H), 10,03 (s, 1H). 7,50 (d, J=8,5Гц, 2H), 7,38 (d, J=8,5Гц, 2H), 2,57Приклад S4-A: Одержання 4-(1,2,2,22,48 (m, 2H), 2,41-2,31 (m, 2H), 2,02 (m, 1Н), 1,69 тетрафтор-1-трифторметилетил)-бензальдегіду (m, 1Н). Розчин 3,5г 4-(гептафторізопропіл)-толуолу b) Одержання і-бром-4-циклобутилбензолу: (13,4ммоль) в 100мл тетрахлорметану кип'ятили зі До розчину 1,37г 1-(4-бромфеніл)зворотним холодильником. Потім невеликими циклобутанолу (6ммоль) в 15мл ДХМ додавали порціями додавали 2,63г N-бромсукциніміду 1,15мл триетилсилану (7,2ммоль) і суміш охоло(14,8ммоль) і 326мг дибензоїлпероксиду джували до -78°С. Потім додавали 1,15мл діети(1,34ммоль). Через 5год суміш охолоджували до лефірату трифториду бору й реакційну суміш на0°С, фільтрували й розчинник випарювали. Одергрівали до -40°С і перемішували протягом 8год. жаний залишок розчиняли в 15мл етанолу й додаПотім реакцію зупиняли шляхом додавання 10% вали до суспензії, яку одержували шляхом додаводного розчину KНСО3 і суміш тричі екстрагували вання 2-нітропропану (1,4мл, 15,5ммоль) до за допомогою ДХМ. Об'єднані екстракти промиварозчину 340мг натрію (14,8ммоль) в етанолі. Цю ли розсолом, сушили над сульфатом магнію й суміш перемішували протягом 3 днів. Потім її фіконцентрували. Одержаний залишок очищали за льтрували, розчинник видаляли й одержаний задопомогою колонкової хроматографії (силікагель; лишок розчиняли в EtOAc і промивали 1н. розчициклогексан) і одержували 0,84г (66%) 1-бром-4ном гідроксиду натрію, 1н. розчином HCl, циклобутилбензолу у вигляді безбарвної рідини. насиченим розчином NaHCO3 і розсолом. Потім 1 шар, що містить EtOAc, сушили над сульфатом Н ЯМР (CDCl3, 300МГц): 1,85 (m, 1Н), 1,92-2,18 магнію, фільтрували та концентрували. Очищення (m, 3H), 2,33 (m, 2H), 3,49 (квінтет, J=8,5Гц, 1Н), залишку (силікагель; циклогексан/EtOAc 10:1) да7,08 (d, J=8,5Гц, 2Н), 7,40 (d, J=8,5Гц, 2Н). вало 1,1г (30%) 4-(1,2,2,2-тетрафтор-1c) Одержання 4-циклобутилбензальдегіду: трифторметилетил)-бензальдегіду у вигляді світЦільову сполуку синтезували за аналогією з 4циклопропілбензальдегідом (описано в прикладі ло-жовтого масла. 1Н ЯМР (CDCl3, 300МГц: 7,82 S1-Α) з використанням 830мг 1-бром-4(d, J=8Гц, 2H), 8,03 (d, J=8Гц, 2H), 10,11 (s, 1Н). циклобутилбензолу (3,93ммоль), 2,7мл 1,6Μ розПриклад S5-A: Одержання 4чину н-BuLi у гексані (4,32ммоль) і 605мкл ДМФ пентафторетилбензойної кислоти (7,86ммоль). Виділений залишок очищали за доa) Одержання 4-пентафторетилбензонітрилу: помогою колонкової флеш-хроматографії (5:95 Суміш 4-йодбензонітрилу (10,0г, 43,7ммоль), EtOAc/циклогексан) і одержували 422мг 4пентафторпропіонату натрію (15,4г, 82,9ммоль) і циклобутилбензальдегіду (67%) у вигляді безбарйодиду міді(I) (16,6г, 87,3ммоль), ДМФ (160мл), і 1 толуолу (60мл) нагрівали при 160°С протягом вної рідини. Н ЯМР (CDCl3, 300МГц): 1,89 (m, 16год, дозволяючи відігнатися більшій частині то1H), 1,97-2,26 (m, 3H), 2,40 (m, 2H), 3,63 (квінтет, луолу. Після охолодження додавали етилацетат J=8,5Гц, 1Н), 7,36 (d, J=8,0Гц, 2Н), 7,81 (d, J=8,0Гц, (200мл) і суміш фільтрували через діатомову зем2H), 9,97 (s, 1H). лю й фільтрат піддавали розподіленню між суміПриклад S3-A: Одержання 4-(1шшю етилацетат/гептан і водою. Органічний шар фторциклобутил)-бензальдегіду: промивали розсолом, сушили (MgSO4) і випарюa) Одержання 1-бром-4-(1-фторциклобутил)вали. Хроматографія (SiO2, гептан-етилацетат, бензолу: градієнтний режим) давала цільову сполуку (5,05г До розчину 5,66г 1-(4-бромфеніл)52%). Жовте масло, МС (мас-спектроскопія) (ЕУ циклобутанолу (24,92ммоль, описаний у прикладі іонізація електронним ударом) 221,1 (М+). S2-A) в 70мл ДХМ при 0°С додавали 4,23г (діетиb) Одержання 4-пентафторетилбензойної кисламіно)трифториду сірки (95%, 24,92ммоль). Реалоти кційну суміш перемішували при 0°С протягом 35хв, Суміш 4-пентафторетилбензонітрилу (2,98г, потім додавали насичений розчин NaHCO3 і одер13,5ммоль) і гідроксиду калію (3,03г, 54,0ммоль) у жану сумішекстрагували за допомогою ДХМ. воді (40мл) і етанолі (20мл) кип'ятили зі зворотним Об'єднані органічні екстракти промивали розсохолодильником протягом 16год. Після охолодженлом, сушили (MgSO4), фільтрували та концентруня розчин піддавали розподіленню між 1Μ водним вали у вакуумі й одержували залишок, який очи 23 90786 24 розчином хлористоводневої кислоти й етилацетагували за допомогою ДХМ. Об'єднані органічні том. Органічний шар промивали розсолом, сушили фази потім промивали водою, сушили над суль(MgSO4) і випарювали. Хроматографія (SiO2, гепфатом магнію, фільтрували та концентрували у тан-етилацетат, градієнтний режим) давала цільовакуумі й одержували 4,44г безбарвного масла. ву сполуку (2,76г, 85%). Біла тверда речовина, МС Його розчиняли в 100мл діетилового ефіру, обро(ІРП - іонне розпилення з позитивною іонізацією) бляли за допомогою 9мл 2,6н. HCl у діетиловому ефірі, перемішували при КТ протягом ще 30хв, 238,9 (М-Н) . фільтрували та сушили у високому вакуумі й одеПриклад S6-A: Одержання 4ржували 4,6г білої твердої речовини (72%). МС триметилсиланілбензальдегіду (ІРП) 207,1 (М+Н)+. 1-Бром-4-(триметилсиліл)бензол (1,15г, Приклад S2-B: Одержання 2-(4-хлор-35ммоль) розчиняли в ТГФ (30мл) і охолоджували трифторметилфеніл)-етиламінгідрохлориду до -78°С. В атмосфері аргону по краплях додавали а) Одержання (4-хлор-3-трифторметилфеніл)1,6Μ розчин н-бутиллітію в гексані (3,13мл, ацетонітрилу: 5ммоль), підтримуючи температуру нижче -70°С. 3,94г 4-Бромметил-1-хлор-2Прозорий безбарвний розчин перемішували при трифторметилбензолу (14,4ммоль) і 1,06г ціаніду 78°С протягом 15хв і швидко додавали ДМФ натрію (21,6ммоль) суспендували в 12мл ДМСО (1,156мл, 15ммоль). Температуру реакційній сумі(диметилсульфоксид) в атмосфері аргону й протяші знижували до -68°С. Реакційну суміш перемішугом 1год перемішували при 50°С. Потім реакційну вали протягом ще 15хв при -78°С, реакцію зупинясуміш виливали в суміш вода/лід і 4 рази екстрагули 1н. водним розчином хлориду водню й двічі вали за допомогою ДХМ. Об'єднані органічні фази екстрагували діетиловим ефіром. Об'єднані оргапромивали водою, сушили над сульфатом магнію, нічні шари двічі промивали водою й один раз нафільтрували та концентрували у вакуумі й одерсиченим водним розчином хлориду натрію, сушижували 3,188г (4-хлор-3-трифторметил феніл)ли над сульфатом натрію, фільтрували й ацетонітрилу у вигляді темно-червоного масла, розчинник випарювали й одержували продукт у яке без обробки використовували на наступній вигляді безбарвного масла (920мг, 100%). Продукт стадії. був досить чистим, щоб його можна було без обb) Одержання 2-(4-хлор-3робки використовувати на наступній стадії. МС трифторметилфеніл)-етиламінгідрохлориду: (ІРП) 179,2 (М+Н+). 1Н ЯМР (CDCl3, 300МГц): Цільову сполуку синтезували за аналогією з 210,02 (s, 1H) 7,84 (d, 2H), 7,69 (d, 2H), 0,31 (s, 9H). (3-фтор-5-трифторметилфеніл)Приклад S7-A: Одержання 4-(1,1етиламінгідрохлоридом (описано в прикладі S1-В) диметилпропіл)-бензальдегіду з 3,188г неочищеного (4-хлор-3Цільову сполуку синтезували за аналогією із трифторметилфеніл)-ацетонітрилу (14,5ммоль) і прикладом S1-Α з використанням 1-бром-4-(1,176мл 1Μ розчину комплексу боран-ТГФ у ТГФ диметилпропіл)-бензолу (синтезували за методи(76ммоль). Продукт одержували у вигляді білої кою, яка аналогічна описаній в публікації J.Chem. твердої речовини (1,52г, 40%). МС (ІРП) 224,1 Res. Miniprint., 1997, 12, 2701-2733) (250мг, (М+Н)+. 1,10ммоль), н-BuLi (825мкл, 1,6Μ розчину в гексаПриклад S3-B: Одержання 2-(4-хлор-3ні, 1,32ммоль) і ДМФ (427мкл, 5,50ммоль). Виділефторфеніл)-етиламіну (S3-B1) ний залишок очищали за допомогою колонкової a) Одержання 1-хлор-2-фтор-4-(2-нітровініл)флеш-хроматографії (1:9 ефір:пентан) і одержувабензолу: ли 4-(1,1-диметилпропіл)-бензальдегід (175мг, 4-Хлор-3-фторбензальдегід (13г, 82ммоль) і 90%) у вигляді безбарвного масла. 1Н ЯМР (CDCl3, ацетат амонію (14,6г, 189ммоль) розчиняли в оц300МГц): 9,99 (s, 1Н), 7,82 (d, J=8,5Гц, 2H), 7,50 (d, товій кислоті (150мл) і додавали нітрометан J=8,5Гц, 2H), 1,69 (q, J=7,5Гц, 2H), 1,32 (s, 6H), (12,6мл, 234ммоль). Розчин кип'ятили зі зворотним 0,68 (t, J=7,5Гц, 3Н). холодильником протягом 1,5год. Після охолоПервинні аміни (сполуки формули V): дження до КТ додавали воду (120мл). Осаджували Приклад S1-В: Одержання 2-(3-фтор-5тверду речовину. Реакційну суміш тричі екстрагутрифторметилфеніл)-етиламінгідрохлориду вали метиленхлоридом. Об'єднані органічні шари 5,45г (3-Фтор-5-трифторметилфеніл)промивали водою й насиченим водним розчином ацетонітрилу (26,3ммоль) розчиняли в 45мл ТГФ і NaCl, сушили над сульфатом магнію, фільтрували охолоджували до 0°С в атмосфері азоту. Потім й розчинник видаляли у вакуумі. Залишок очищапротягом 20хв по краплях додавали 138мл 1Μ ли за допомогою колонкової флеш-хроматографії комплексу боран-тетрагідрофуран (138ммоль), (етилацетат/циклогексан: 1/4). Неочищений пропідтримуючи температуру на рівні 0-2°С. Після дукт суспендували в гептані, фільтрували та судодавання реакційну суміш перемішували при КТ шили й одержували 1-хлор-2-фтор-4-(2-нітровініл)протягом ще 45хв і кип'ятили зі зворотним холодибензол (10,9г, 66%) у вигляді світло-жовтої твердої льником протягом 17год. Потім реакційну суміш речовини. 1Н ЯМР (CDCl3, 300МГц): 7,29 (d, охолоджували до 0°С і при температурі від 2 до J=7,8Гц, 1H), 7,33 (d, J=9,3Гц, 1H), 7,50 (t, J=7,5 5°С обробляли за допомогою 33мл метанолу проH7, 1H), 7,54 (d, J=13,6Гц, 1H), 7,92 (d, J=13,6Гц, тягом 45хв. Після 1год кип'ятіння зі зворотним хо1Н). лодильником реакційну суміш концентрували, заb) Одержання 2-(4-хлор-3-фторфеніл)лишок розчиняли в ДХМ і амін двічі екстрагували етиламіну: 1н. водним розчином HCl. Потім об'єднані водні Борогідрид літію (2,16г, 99ммоль) суспендувафази обробляли концентрованим NaOH, щоб доли в ТГФ (50мл). По краплях додавали триметилхвести значення рН до 12, і після цього двічі екстра 25 90786 26 лорсилан (21,6г, 198ммоль). По краплях додавали ного розчину NH4OH 4:1) і одержували 2-(4-хлор-3розчин 1-хлор-2-фтор-4-(2-нітровініл)-бензол (5,0г, фторфеніл)-етиламін (3,1г, 73%) у вигляді білої 24,8ммоль) у ТГФ (20мл). Спостерігалося бурхлитвердої речовини. МС (ІРП) 174,1 (М+Н)+. 1Н ЯМР ве виділення газу й спінення. Білу суспензію пере(ДМСО-d6, 300МГц): 2,92 (t, J=4,8Гц, 2Н), 3,02 (t, мішували при КТ протягом 3 днів. Обережно додаJ=6,3Гц, 2Н), 7,15 (dd, J=6,0 і 1,2Гц, 1Н), 7,38 (dd, вали МеОН (80мл). Розчинники видаляли у J=1,2 і 7,8Гц), 7,53 (t, J=6,3Гц, 1H), 7,93 (br, 2H). вакуумі й залишок очищали за допомогою колонкової флеш-хроматографії (СН2Сl2/МеOН+5% вод Приклад S4-B: Одержання 2-(3-бром-4хлорфеніл)-етиламіну: a) Одержання (3-бром-4-хлорфеніл)ацетонітрилу: Цільову сполуку синтезували за аналогією із прикладом S2-B з використанням 2-бром-4бромметил-1-хлорбензолу (одержували за методикою, що аналогічна описаній в публікації J.Med.Chem.; 2003; 46(20), 4232-4235) (570мг, 2,00ммоль) і ціаніду натрію (147мг, 3,00ммоль) і одержували цільовий продукт у вигляді темночервоного масла, яке вводили в реакцію без додаткового очищення. b) Одержання 2-(3-бром-4-хлорфеніл)етиламіну: Цільову сполуку синтезували за аналогією із прикладом S1-В з використанням неочищеного (3бром-4-хлорфеніл)-ацетонітрилу (475мг, 2,06ммоль) і 1Μ комплексу боран-ТГФ (4,12мл, 4,12ммоль). Продукт одержували у вигляді безбарвного масла (300мг, 62%). МС (ІРП) 236,0 (М+Н)+. Приклад S5-B: Одержання 2-(4-хлор-3етилфеніл)-етиламінгідрохлориду a) Одержання 4-хлор-3-етилбензальдегіду: До розчину 4,319г 4-бром-1-хлор-2етилбензолу (20ммоль) в 50мл діетилового ефіру, охолодженого до 0°С, по краплях додавали 12,3мл 1,6Μ н-BuLi у гексані. Після 30хв перемішування при 0°С і 2год при КТ по краплях додавали розчин 2,43мл ДМФ (31ммоль) в 10мл діетилового ефіру (температура підвищувалася від 20 до 28°С). Після ще 1год перемішування при КТ реакційну суміш підкисляли за допомогою 2н. HCl, розбавляли за допомогою 150мл води й екстрагували діетиловим ефіром. Об'єднані органічні шари промивали розсолом, сушили над сульфатом магнію, відфільтровували та концентрували у вакуумі. Залишок очищали за допомогою колонкової флешхроматографії (гептан/AcOEt: 95/5) і одержували 2,1г безбарвного масла. МС (ІРП) 168,1 (М+Н)+. b) Одержання 2-(4-хлор-3-етилфеніл)етиламінгідрохлориду: Цільову сполуку одержували з 4-хлор-3етилбензальдегіду за аналогією із прикладом S3B1, стадії а) і b). МС (ІРП) 184,1 (М+Н)+. Приклад S6-B: Одержання 2-(4-бензилокси-3трет-бутилфеніл)-етиламінгідрохлориду a) 1 -Бензилокси-2-трет-бутил-4-метилбензол: 8г 2-трет-Бутил-4-метилфенолу (49ммоль) і 16,36г карбонату калію (58ммоль) перемішували в 120мл ДМФ до утворення суспензії. Потім по краплях додавали 6,74мл бензилхлориду й реакційну суміш перемішували протягом 24год при КТ. Після 2год нагрівання при 60°С реакційну суміш охолоджували до КТ, відфільтровували, розбавляли етилацетатом і промивали водою, потім розсолом. 27 90786 28 Органічну фазу сушили над сульфатом магнію, лом, сушили над сульфатом магнію, відфільтровувідфільтровували та концентрували у вакуумі. Завали та концентрували у вакуумі. Залишок очищалишок очищали за допомогою колонкової флешли за допомогою колонкової хроматографії (40г хроматографії (гептан/AcOEt 98/2) і одержували силікагелю; EtOAc/гептан 1:4 потім 1:2) і одержу8,647г безбарвної рідини. МС (ІРП) 255,3 (М+Н)+. вали 784мг світло-жовтого масла (90%). МС (ІРП) + b) Одержання 4-бензилокси-3-трет354,3 (М+Н) . бутилбензальдегіду: Приклад S3-C: Одержання (4Розчин 6,985г 1-бензилокси-2-трет-бутил-4циклопропілбензил)-[2-(3,4-дихлорфеніл)-етил]метилбензол (27ммоль) і 115г амонійаміну церій(IV)нітрату в 1000мл оцтової кислоти Суміш 4-циклопропілбензальдегіду (219мг, (50%об./об.) перемішували при 90°С протягом 1,50ммоль), 2-(3,4-дихлорфеніл)-етиламіну (284мг, 1год. Після охолодження до КТ реакційну суміш 1,50ммоль) і молекулярних сит (500мг, 4Å) у діеекстрагували сумішшю AcOEt/гептан 1:9, сушили тиловому ефірі (5мл) перемішували при КТ протянад сульфатом магнію, відфільтровували та конгом ночі. Суміш фільтрували через целіт і концецентрували у вакуумі. Залишок очищали за допонтрували у вакуумі й одержували відповідний імін, могою колонкової флеш-хроматографії (гепякий розчиняли в метанолі. Додавали борогідрид тан/AcOEt від 95/5 до 90/10) і одержували 3,48г натрію (85мг, 2,25ммоль) і реакційну суміш пережовтогарячої твердої речовини. МС (ІРП) 269,3 мішували при КТ протягом 4год. Потім реакцію (М+Н)+. зупиняли за допомогою 0,1н. NaOH (aq) і суміш рос) Одержання 2-(4-бензилокси-3-третзбавляли за допомогою EtOAc і промивали розсобутилфеніл)-етиламінгідрохлориду: лом. Органічну фазу сушили (MgSO4), фільтруваЦільову сполуку одержували з 4-бензилокси-3ли та концентрували у вакуумі й без додаткового трет-бутилбензальдегіду за аналогією із приклаочищення одержували цільовий (4дом S3-B1, стадії а) і b). МС (ІРП) 284,2 (М+Н)+. циклопропілбензил)-[2-(3,4-дихлорфеніл)-етил]Вторинні аміни (сполуки формули III): амін (317мг, 75%) у вигляді безбарвного масла. Приклад S1-С: Одержання (4-третМС (ІРП) 320,2 (М+Н)+. бутилбензил)-[2-(3,4-дихлорфеніл)-етил]-аміну Приклад S4-C: Одержання (4-трет0,38мл 4-Трет-бутилбензальдегіду бутилбензил)-[2-(2-хлорпіридин-4-іл)-етил]-аміну (2,25ммоль) і 0,227мл 2-(3,4-дихлорфеніл)a) Одержання 2-хлор-4етиламіну (1,5ммоль) розчиняли в 4,5мл метанолу триметилсиланілетинілпіридину: при КТ і після перемішування протягом 30хв при Суміш 2,5г 4-бром-2-хлорпіридину КТ кип'ятили зі зворотним холодильником протя(12,6ммоль), 2,2мл (триметилсиліл)ацетилену гом 2год. Після охолодження до КТ додавали 85мг (15,1ммоль), 153мг йодиду міді(І) (0,79ммоль) і (2,25ммоль) борогідриду натрію й після перемішу287мг біс(трифенілфосфін)паладій(II)хлориду вання протягом 5хв при КТ реакційну суміш кип'я(0,41ммоль) у триетиламіні (15мл) перемішували тили зі зворотним холодильником протягом 2год. при КТ протягом 1год. Потім триетиламін видаляПісля охолодження до КТ реакційну суміш обробли у вакуумі, додавали воду й суміш екстрагували ляли 4 краплями 1н. HCl і концентрували у вакуудіетиловим ефіром. Потім об'єднані органічні екстмі. Залишок розбавляли сумішшю вода/EtOAc. ракти промивали водою й розсолом, сушили Після відділення органічної фази водну фазу екст(Na2SO4), фільтрували та концентрували у вакуумі рагували за допомогою EtOAc і об'єднані органічні й одержували залишок, який очищали за допомофази промивали розсолом, сушили над сульфагою колонкової хроматографії (гептан/EtOAc від том магнію, відфільтровували та концентрували у 100:0 до 98:2) і одержували 2-хлор-4вакуумі. Залишок очищали за допомогою колонкотриметилсиланілетинілпіридин (2,394г, 91%) у вивої хроматографії (40г силікагелю; EtOАс/гептан гляді світло-жовтої рідини. МС (ІРП) 210,1 (М+Н)+. 1:2) і одержували 515мг безбарвного в'язкого масb) Одержання 2-хлор-4-етинілпіридину: ла (97%). МС (ІРП) 336,2 (М+Н)+. До розчину 2,389г 2-хлор-4Приклад S2-C: Одержання (4-треттриметилсиланілетинілпіридину (11,39ммоль) у бутилбензил)-[2-(4-фтор-3-трифторметилфеніл)ТГФ (90мл) при -78°С додавали 11,39 мл 1Μ розетил]-аміну чину ТБАФ (тетрабутиламонійфторид) у ТГФ і реа0,62мл 4-Трет-бутилбензальдегіду кційну суміш перемішували протягом 45хв при 0°С. (3,69ммоль), 600мг 2-(4-фтор-3-трифторПотім додавали насичений розчин NH4Cl і ТГФ метилфеніл)-етиламінгідрохлориду (2,46ммоль) і видаляли при зниженому тиску. Водну суміш екст340мг карбонату калію (2,46ммоль) суспендували рагували діетиловим ефіром і об'єднані органічні в 7мл метанолу при КТ і після перемішування проекстракти промивали водою й розсолом, сушили тягом 30хв при КТ кип'ятили зі зворотним холоди(Na2SO4), фільтрували та концентрували у вакуумі. льником протягом 2год. Після охолодження до КТ Одержаний залишок очищали за допомогою колододавали 140мг (3,69ммоль) борогідриду натрію й нкової хроматографії (пентан/діетиловий ефір від після перемішування протягом 5хв при КТ реакцій100:0 до 4:1) і одержували 2-хлор-4-етинілпіридин ну суміш кип'ятили зі зворотним холодильником (1,427г, 91%) у вигляді майже білої твердої речопротягом 3год. Після охолодження до КТ реакційну вини. 1Н ЯМР (CDCl3, 300МГц: 3,36 (s, 1Н), 7,27 суміш обробляли за допомогою 0,5мл 1н. HCl і (dd, J=5 і 1Гц, 2H), 7,40 (br s, 1Н), 8,37 (d, J=8Гц, концентрували у вакуумі. Залишок розбавляли 2Н). сумішшю вода/EtOAc. Після відділення органічної с) Одержання (4-трет-бутилбензил)-[2-(2фази водну фазу екстрагували за допомогою хлорпіридин-4-іл)-етил]-аміну: EtOAc і об'єднані органічні фази промивали розсо 29 90786 30 Суміш 1,386г 2-хлор-4-етинілпіридину (640мг, 76%) у вигляді майже білої твердої речо(10,07ммоль), 2,65мл 4-трет-бутилбензиламіну вини. МС (ІРП) 287,0 (M+NH4)+. (15,11ммоль), 0,58мл оцтової кислоти d) Одержання (4-трет-бутилбензил)-[2-(4-хлор(10,07ммоль) і 666мг ціаноборогідриду натрію (чи3-трифторметилпіразол-1-іл)-етил]-аміну й (4-третстота 95%, 10,07ммоль) в етанолі (12мл) протягом бутилбензил)-[2-(4-хлор-5-трифторметилпіразол2 днів нагрівали при 105°С у герметичній пробірці. 1-іл)-етил]-аміну: Реакційній суміші давали охолонути до КТ, її розДо суспензії NaH (67мг, 1,67ммоль) у ТГФ бавляли 3н. розчином NaOH і екстрагували за до(10мл) при 0°С по краплях додавали розчин 4помогою ДХМ. Об'єднані органічні екстракти прохлор-3-трифторметил-1H-піразолу (190мг, мивали насиченим розчином NaHCO3 і розсолом, 1,11ммоль) у ТГФ (5мл). Реакційну суміш перемісушили (Na2SO4), фільтрували та концентрували у шували при 0°С протягом 30хв і потім порціями вакуумі. Після колонкової хроматографії (гепдодавали 3-(4-трет-бутилбензил)тан/EtOAc від 100:0 до 0:100) 1,688г (55%) цільової [1,2,3]оксатіазолідин-2,2-діоксид (300мг, сполуки виділяли у вигляді коричневої рідини. МС 1,11ммоль). Реакційну суміш нагрівали до КТ і пе(ІРП) 303,2 (М+Н)+. ремішували протягом ще 3год, потім реакцію зупиПриклад S5-C: Одержання (4-третняли за допомогою 5мл 20% (об./об.) H2SO4. Реакбутилбензил)-[2-(4-хлор-3-трифторметилпіразолційну суміш нагрівали до 60°С протягом ночі й 1-іл)-етил]-аміну і (4-трет-бутилбензил)-[2-(4-хлорпотім охолоджували до КТ і виливали у воду. Вод5-трифторметилпіразол-1-іл)-етил]-аміну ну фазу підлуговували за допомогою 1н. NaOH і a) Одержання 4-хлор-3-трифторметил-1Нпотім екстрагували етилацетатом. Органічні шари піразолу: поєднували, промивали розсолом, сушили над До розчину 3-трифторметил-1Н-піразолу MgSO4, фільтрували та концентрували у вакуумі й (500мг, 3,67ммоль) у льодяній оцтовій кислоті одержували 4:1 суміш регіоізомерів (4-трет(5мл) додавали 10% водний розчин гіпохлориту бутилбензил)-[2-(4-хлор-3-трифторметилпіразолнатрію (2188мкл, 3,67ммоль). Реакційну суміш 1-іл)-етил]-аміну (210мг, 52%) МС (ІРП) 360,1 перемішували при КТ протягом ночі й потім нейт(М+Н)+ і (4-трет-бутилбензил)-[2-(4-хлор-5ралізували насиченим розчином карбонату натрію трифторметилпіразол-1-іл)-етил]-аміну (50мг, 13%) й екстрагували за допомогою ДХМ. Органічні шари МС (ΙΡΠ) 360,1 (М+Н)+ відповідно, яку розділяли за поєднували, промивали розсолом, сушили допомогою колонкової флеш-хроматографії. (MgSO4), фільтрували та концентрували у вакуумі Приклад S6-C: Одержання (4-третй одержували цільовий продукт (480мг, 77%) у бутилбензил)-[2-(3-циклопропілфеніл)-етил]-аміну вигляді білої твердої речовини, яка не потребуваДо розчину м-бромфенілциклопропану (синтезували, як описано в публікації J.Org.Chem. 1976, ла додаткового очищення. МС (ІРП) 169,0 (М-Н) . 41, 2262-2266) (100мг, 0,51ммоль) у сухому ТГФ b) Одержання 2-(4-трет-бутилбензиламіно)(3мл) при -78°С по краплях додавали H-BuLi етанолу: (317мкл, 1,6Μ розчину в гексані, 0,51ммоль). РеаЦільову сполуку синтезували за аналогією із кційну суміш перемішували при -78°С протягом прикладом S3-C з використанням 4-трет10хв і потім по краплях додавали розчин 3-(4-третбутилбензальдегіду (1000мг, 6,17ммоль), етанобутилбензил)-[1,2,3]оксатіазолідин-2,2-діоксиду ламіну (371мкл, 6,17ммоль) і борогідриду натрію (109мг, 0,41ммоль) у ТГФ (1мл). Реакційну суміш (350мг, 9,25ммоль). Цільовий продукт (1190мг, нагрівали при 0°С протягом 3год і потім реакцію 93%) виділяли без додаткового очищення у виглязупиняли за допомогою 5мл 20% (об./об.) H2SO4. ді безбарвного масла. МС (ІРП) 208,3 (М+Н)+. Реакційну суміш нагрівали при 60°С протягом ночі c) Одержання 3-(4-трет-бутилбензил)й потім охолоджували до КТ і виливали у воду. [1,2,3]оксатіазолідин-2,2-діоксиду: Водну фазу підлуговували за допомогою 1н. NaOH До розчину 2-(4-трет-бутилбензиламіно)і потім екстрагували етилацетатом. Органічні шари етанолу (1190мг, 5,74ммоль) і триетиламіну поєднували, промивали розсолом, сушили над (3200мкл, 22,96ммоль) у ХМ (15мл) при -15°С проMgSO4, фільтрували та концентрували у вакуумі й тягом 10хв додавали розчин тіонілхлориду одержували неочищений залишок, який очищали (544мкл, 7,46ммоль) у ХМ (4мл). Реакційну суміш за допомогою колонкової флеш-хроматографії й перемішували при -10°С протягом 30хв, фільтруодержували (4-трет-бутилбензил)[2-(3вали й фільтрат концентрували у вакуумі. Залишок циклопропілфеніл)-етил]-амін (72мг, 58%) у вигляочищали за допомогою колонкової флешді безбарвного масла. МС (ІРП) 308,4 (М+Н)+. хроматографії й одержували цільову сполуку Приклад S7-C: Одержання (4-трет(790мг, 54%) у вигляді білої твердої речовини. До бутилбензил)-[2-(3-хлор-5-циклопропілфеніл)суміші 3-(4-трет-бутилбензил)етил]-аміну [1,2,3]оксатіазолідин-2-оксиду (790мг, 3,12ммоль) у а) Одержання 1-бром-3-хлор-5ХМ (20мл), ацетонітрилу (8мл) і води (8мл), при циклопропілбензолу: 0°С додавали NaIO4 (867мг, 4,05ммоль), а потім До розчину 1,3-дибром-5-хлорбензолу (500мг, RuO2 (2мг). Реакційну суміш перемішували при 1,85ммоль) у ТГФ (1мл) у герметичній пробірці 0°С протягом 2год. Додавали воду й фази роздідодавали циклопропілмагнійбромід (3698мкл, ляли та водну фазу екстрагували етилацетатом. 0,5Μ розчин у ТГФ, 1,85ммоль) і реакційну суміш Органічні шари поєднували, промивали розсолом, протягом 5хв дегазували аргоном, а потім додавасушили (MgSO4) і концентрували у вакуумі. Потім ли тетракіс(трифенілфосфін)паладій(0) (107мг, залишок очищали за допомогою колонкової флеш0,09ммоль). Одержаний розчин нагрівали при 70°С хроматографії й одержували цільовий продукт протягом ночі, охолоджували до КТ і потім реакцію 31 90786 32 зупиняли насиченим розчином NH4Cl і екстрагуважували залишок, який очищали за допомогою коли пентаном. Органічні фази поєднували, промилонкової флеш-хроматографії (100% пентан) і вали водою й розсолом, сушили над MgSO4 і фіодержували цільовий 2-циклопропіл-1-фтор-4льтрували через тонкий шар силікагелю й йодбензол (262мг, 72%) у вигляді безбарвного одержували цільовий продукт (272мг, 64%), яка не масла. 1Н ЯМР (CDCl3, 300МГц): 7,40 (m, 1Н), 7,17 1 потребувала додаткового очищення. Н ЯМР (m, 1Н), 6,76 (m, 1Н), 2,02 (m, 1Н), 1,03-0,96 (m, (CDCl3, 300МГц): 7,28 (aptt, J=2,0Гц, 1H), 7,08 (aptt, 2H), 0,74-0,68 (m, 2H). J=1,5Гц, 1H), 6,97 (aptt, J=1,5Гц, 1H), 1,83 (m, 1H), с) Одержання (4-трет-бутилбензил)-[2-(31,04-0,97 (m, 2H), 0,72-0,67 (m, 2H). циклопропіл-4-фторфеніл)-етил]-аміну: b) Одержання (4-трет-бутилбензил)-[2-(3-хлорЦільову сполуку синтезували за аналогією із 5-циклопропілфеніл)-етил]-аміну: прикладом S6-C з використанням 2-циклопропіл-1Цільову сполуку синтезували за аналогією із фтор-4-йодбензолу (100мг, 0,38ммоль) і 3-(4-третприкладом S6-C з використанням 1-бром-3-хлор-5бутилбензил)-[1,2,3]оксатіазолідин-2,2-діоксиду циклопропілбензолу (96мг, 0,71ммоль) і 3-(4-трет(103мг, 0,38ммоль). Залишок очищали за допомобутилбензил)-[1,2,3]оксатіазолідин-2,2-діоксиду гою колонкової флеш-хроматографії й одержували (36мг, 0,89ммоль). Залишок очищали за допомоцільовий продукт (35мг, 28%) у вигляді безбарвногою колонкової флеш-хроматографії й одержували го масла. МС (ІРП) 326,3 (М+Н)+. цільовий продукт (155мг, 39%) у вигляді безбарвПриклад S9-C: Одержання [2-(4-фторфеніл)ного масла. МС (ІРП) 342,2 (М+Н)+. етил]-(4-пентафторетилбензил)-аміну (S9-C1) Приклад S8-C: Одержання (4-третa) Одержання N-[2-(4-фторфеніл)-етил]-4бутилбензил)-[2-(3-циклопропіл-4-фторфеніл)пентафторетилбензаміду етил]-аміну Розчин 4-пентафторетилбензойної кислоти a) Одержання 3-циклопропіл-4(500мг, 2,08ммоль), 2-(4-фторфеніл)етиламіну фторфеніламіну: (319мг, 2,29ммоль), 4-метилморфоліну (632мг, До розчину 3-бром-4-фторфеніламіну (синте6,24ммоль), і HBTU (1,19г, 3,12ммоль) у ДМФ зували, як описано в публікації J.Org.Chem. 1981, (38мл) перемішували при КТ протягом 16год, потім 46, 2280-2286) (415мг, 2,18ммоль), циклопропілреакційну суміш піддавали розподіленню між воборонової кислоти (244мг, 2,84ммоль), фосфату дою й етилацетатом. Органічний шар промивали калію (1,62г, 7,64ммоль) і трициклогексилфосфіну розсолом, сушили (MgSO4) і випарювали. Хрома(61мг, 0,22ммоль) у толуолі (10мл) і воді (0,5мл) тографія (SiO2, гептан-етилацетат, градієнтний додавали ацетат паладію (25мг, 0,11ммоль) і реарежим) давала цільову сполуку (746мг, 99%). Біла кційну суміш нагрівали при 100°С протягом ночі. тверда речовина, МС (ІРП) 362,2 (М+Н)+. Потім суміш охолоджували до КТ, розбавляли воb) Одержання [2-(4-фторфеніл)-етил]-(4дою й екстрагували ефіром. Органічні фази поєдпентафторетилбензил)-аміну нували, промивали розсолом, сушили (MgSO4), Розчин комплексу Боран-тетрагідрофуран (1Μ фільтрували та концентрували у вакуумі й одеру ТГФ, 6,5мл, 6,5ммоль) при 0°С додавали до розжували залишок, який очищали за допомогою кочину N-[2-(4-фторфеніл)-етил]-4лонкової флеш-хроматографії й одержували 3пентафторетилбензаміду (740мг, 2,04ммоль) у циклопропіл-4-фторфеніламін (210мг, 64%). МС ТГФ (8мл) і гомогенний розчин кип'ятили зі зворот(ІРП) 152,2 (М+Н)+. ним холодильником протягом 3год. Після охолоb) Одержання 2-циклопропіл-1-фтор-4дження надлишок реагенту руйнували шляхом йодбензолу: обережного додавання метанолу при 0°С. Летку До розчину 3-циклопропіл-4-фторфеніламіну речовину видаляли відгонкою, потім залишок роз(210мг, 1,39ммоль) у ДМЕ (1,5мл) додавали йодид чиняли в 5% етанольному розчині сірчаної кислоти цезію (360мг, 1,39ммоль), йодид міді(І) (82мг, (5мл). Розчин кип'ятили зі зворотним холодильни0,43ммоль), йод (176мг, 0,70ммоль) і ізоамілнітрит ком протягом 90хв, потім піддавали розподіленню (1,11мл, 8,34ммоль). Реакційну суміш нагрівали між 2Μ водним розчином гідроксиду натрію й етипри 60°С протягом 2год. Реакційну суміш охололацетатом. Органічний шар промивали розсолом, джували до КТ і піддавали розподіленню між пенсушили (MgSO4) і випарювали. Хроматографія таном і насиченим розчином NH4Cl. Органічний (SiO2, ДХМ/метанол/NH4ОН 95:5:0,1) давала цішар відокремлювали, промивали 5% розчином льову сполуку (652мг, 92%). Безбарвне масло, МС тіосульфіту натрію й розсолом, сушили (MgSO4), (ІРП) 348,2 (М+Н)+. фільтрували та концентрували у вакуумі й одер 33 90786 34 35 90786 36 37 Приклад S10-C: Одержання (4-третбутилбензил)-[2-(3-етилфеніл)-етил]-аміну a) Одержання трет-бутилового ефіру [2-(3бромфеніл)-етил]-(4-трет-бутилбензил)карбамінової кислоти: До розчину [2-(3-бромфеніл)-етил]-(4-третбутилбензил)-аміну (3544мг, 10,23ммоль) у ХМ (30мл) при 0°С додавали ди-третбутилдикарбонат (2507мг, 11,3ммоль). Реакційну суміш перемішували протягом 30хв при 0°С і потім при КТ протягом ночі. Додавали насичений 90786 38 розчин NH4Cl і суміш екстрагували за допомогою ДХМ. Об'єднані органічні екстракти промивали 10% розчином KНСО3 і розсолом і сушили (Na2SO4). Після випарювання розчинника одержували неочищену цільову сполуку (4722мг) у вигляді безбарвного масла. МС (ІРП) 446,4 (М+Н)+. b) Одержання трет-бутилового ефіру (4-третбутилбензил)-[2-(3-триметилсиланілетинілфеніл)етил]-карбамінової кислоти: 39 90786 40 Суміш неочищеного трет-бутилового ефіру хлорфеніл)-етил]-(4-трет-бутилбензил)-аміну [2-(3-бромфеніл)-етил]-(4-трет-бутилбензил)(128мг, 0,34ммоль) і циклопропілборонової кискарбамінової кислоти (515мг, 1,154ммоль), лоти (72мг, 0,84ммоль). Залишок очищали за біс(трифенілфосфін)паладій(II)хлориду (32мг, допомогою колонкової флеш-хроматографії й 0,0461ммоль), Cul (11мг, 0,0577ммоль) і (тримеодержували нездатну до розділення 1:4 суміш тилсиліл)ацетилену (251мкл, 1,73ммоль) у триепродуктів, (4-трет-бутилбензил)-[2-(4-хлор-3тиламіні (3,4мл) нагрівали в герметичній пробірці циклопропілфеніл)-етил]-аміну (13мг, 11%), МС при 105°С протягом ночі. Потім суміш охолоджу(ІРП) 342,2 (М+Н)+ і (4-трет-бутилбензил)-[2-(3,4вали до КТ, розбавляли насиченим розчином дициклопропілфеніл)-етил]-аміну (55мг, 47%), МС NaHCO3 і тричі екстрагували етилацетатом. По(ІРП) 348,4 (М+Н)+, яку вводили в реакцію без тім об'єднані етил ацетатні шари промивали вододаткового очищення. дою й розсолом і сушили (Na2SO4) і випарювали. Приклад S12-C: Одержання (4-третОдержаний залишок очищали за допомогою хробутилбензил)-[2-(4-хлор-3-ізопропілфеніл)-етил]матографії (гептан/EtOAc від 100:0 до 95:5) і одеаміну ржували цільову сполуку у вигляді жовтої смоли а) Одержання 2-(5-бром-2-хлорфеніл)(441мг, 82%). МС (ІРП) 464,4 (М+Н)+. пропан-2-олу: c) Одержання трет-бутилового ефіру (4-третДо розчину метилового ефіру 5-бром-2бутилбензил)-[2-(3-етинілфеніл)-етил]хлорбензойної кислоти (1г, 4ммоль, 1екв.) у ТГФ карбамінової кислоти: (20мл) при -78°С по краплях додавали 3Μ розчин До розчину трет-бутилового ефіру (4-третметилмагнійброміду (4мл, 12ммоль, 3екв.) у ТГФ. бутилбензил)-[2-(3-триметилсиланілетинілфеніл)Потім реакційну суміш нагрівали до КТ і переміетил]-карбамінової кислоти (440мг, 0,949ммоль) у шували протягом ночі. Суміш виливали в насичеТГФ (7,6мл) при -78°С додавали 1Μ розчин ТБАФ ний розчин хлориду амонію й екстрагували ефіу ТГФ (949мкл, 0,949ммоль). Після 15хв витримуром. Органічні шари поєднували, промивали вання при -78°С розчину протягом 30хв давали розсолом, сушили (MgSO4), фільтрували та коннагріватися до 0°С. Потім додавали розсіл і суцентрували у вакуумі й одержували залишок, міш екстрагували ефіром. Об'єднані ефірні шари який очищали за допомогою колонкової флешсушили (Na2SO4) та випарювали й одержаний хроматографії (від 0 до 20% ефіру в пентані) і залишок очищали за допомогою хроматографії одержували цільовий продукт у вигляді безбарв(пентан/ефір від 100:0 до 90:10) і одержували ного масла (980мг, 98%). цільову сполуку у вигляді безбарвного масла b) Одержання 4-бром-1-хлор-2(314мг, 84%). МС (ІРП) 392,3 (М+Н)+. ізопропенілбензолу: d) Одержання трет-бутилового ефіру (4-третДо розчину 2-(5-бром-2-хлорфеніл)-пропан-2бутилбензил)-[2-(3-етилфеніл)-етил]олу (500мг, 2ммоль, 1екв.) у толуолі (5мл) додакарбамінової кислоти: вали каталітичну кількість п-толуолсульфонової Розчин трет-бутилового ефіру (4-треткислоти (38мг, 0,2ммоль, 0,1екв.) і розчин протябутилбензил)-[2-(3-етинілфеніл)-етил]гом ночі кип'ятили зі зворотним холодильником у карбамінової кислоти (149мг, 0,381ммоль) у меприладі для відділення Н2О Діна-Штарка. Реактанолі (12мл) протягом 2 днів перемішували при ційній суміші давали охолонути до КТ і її розбавКТ в атмосфері водню в присутності каталітичної ляли ефіром. Суміш промивали насиченим розкількості паладію на деревному вугіллі (5%). Почином NaHCO3 і розсолом, сушили (MgSO4), тім реакційну суміш фільтрували та випарювали фільтрували та концентрували у вакуумі й одерй одержаний залишок очищали за допомогою жували цільовий продукт (357мг, 77%) у вигляді хроматографії (гептан/EtOAc від 100:0 до 95:5) і безбарвного масла, яке не потребувало додаткоодержували цільову сполуку у вигляді безбарвнового очищення. го масла (73мг, 48%). МС (ІРП) 396,4 (М+Н)+. c) Одержання 4-бром-1-хлор-2e) Одержання (4-трет-бутилбензил)-[2-(3ізопропілбензолу: етилфеніл)-етил]-аміну: Суміш 4-бром-1-хлор-2-ізопропенілбензолу До розчину трет-бутилового ефіру (4-трет(357мг, 1,54ммоль, 1екв.) і PtO2 (35мг, 0,15ммоль, бутилбензил)-[2-(3-етилфеніл)-етил]0,1екв.) в 4мл толуолу перемішували в атмосфекарбамінової кислоти (66мг, 0,166ммоль) у ХМ рі водню при КТ протягом ночі. Потім реакційну (1мл) при 0°С додавали трифтороцтову кислоту суміш фільтрували через целіт і фільтрат випа(128мкл, 1,668ммоль). Реакційній суміші давали рювали досуха й одержували цільовий продукт нагрітися до КТ і перемішували протягом ночі. (260мг, 72%), 1Н ЯМР (CDCl3, 300МГц): 7,39 (d, Потім суміш підлуговували за допомогою 1н. J=2Гц, 1Н), 7,26-7,16 (m, 2Н), 3,35 (септет, J=7Гц, NaOH і екстрагували за допомогою ДХМ. Об'єд1Н), 1,23 (d, J=7Гц, 6Н). нані екстракти сушили (Na2SO4) та випарювали й d) Одержання (4-трет-бутилбензил)-[2-(4одержували цільову сполуку у вигляді безбарвної хлор-3-ізопропілфеніл)-етил]-аміну: смоли (45мг, 92%). МС (ІРП) 296,5 (М+Н)+. Цільову сполуку синтезували за аналогією із Приклад S11-С: Одержання (4-третприкладом S6-C з використанням 4-бром-1-хлорбутилбензил)-[2-(4-хлор-3-циклопропілфеніл)2-ізопропілбензолу (120мг, 0,51ммоль), і 3-(4етил]-аміну й (4-трет-бутилбензил)-[2-(3,4трет-бутилбензил)-[1,2,3]оксатіазолідин-2,2дициклопропілфеніл)-етил]-аміну діоксиду (138мг, 0,51ммоль). Залишок очищали Цільову сполуку синтезували за аналогією з за допомогою колонкової флеш-хроматографії й 3-циклопропіл-4-фторфеніламіном (стадія а, приодержували цільовий продукт (74мг, 42%) у виклад S8-C) з використанням [2-(3-бром-4 41 90786 42 гляді світло-жовтого масла. МС (ІРП) 344,3 концентрували у вакуумі, одержаний залишок (М+Н)+. обробляли 2М водним розчином HCl і одержану Кислоти (сполуки формули II): суміш екстрагували діетиловим ефіром. Об'єднаПриклад S1-D: Одержання 2-хлор-6ні органічні фази промивали водою й потім ексттрифторметилізонікотинової кислоти рагували насиченим розчином NaHCO3. Потім а) Одержання 6-хлор-3-йод-2водну фазу підкисляли концентрованою HCl, двічі трифторметилпіридину: екстрагували діетиловим ефіром і об'єднані оргаПри перемішуванні до розчину 7,1мл H-BuLi нічні фази промивали розсолом, сушили над су(1,6Μ у гексані, 11,3ммоль) в 7мл ТГФ в атмосльфатом магнію, фільтрували та концентрували у фері аргону при -73°С протягом 8хв додавали вакуумі. Одержаний залишок перекристалізову1,6мл діізопропіламіну (11,3ммоль) в 3мл ТГФ. вали з 12мл гарячого н-гексану й одержували Після 10хв перемішування при такій же темпера0,459г (56%) 2-хлор-6турі протягом 15хв додавали розчин 1г 2-хлор-6трифторметилізонікотинової кислоти у вигляді (трифторметил)-піридину (5,51ммоль) в 5мл ТГФ майже білої твердої речовини. МС: 224,0 (М-Н) . (температура від -76 до -75°С). ТемноПриклад S2-D: Одержання 3-хлор-4-фтор-5коричневий розчин перемішували при -75°С протрифторметилбензойної кислоти тягом 1год 15хв. На закінчення протягом 25хв при При перемішуванні до розчину 2,03мл втор-75°С додавали розчин 1,4г йоду (5,51ммоль) в BuLi (1,3М у циклогексані, 2,64ммоль) і 0,4мл 10мл ТГФ. Після перемішування протягом ще ТМЕДА в атмосфері аргону при -90°С протягом 45хв при такій же температурі протягом 2хв до20хв додавали розчин 0,25г 4-фтор-3давали 12мл 2Μ водного розчину HCl (температрифторметилбензойної кислоти (1,2ммоль) в тура підвищувалася від -78 до -50°С). Потім охо8мл ТГФ (температуру підтримували у діапазоні лодний пристрій видаляли, реакційну суміш від -92°С до -88°С). Після 30хв перемішування розбавляли діетиловим ефіром. Після відділення при такій же температурі спочатку світлоорганічної фази водну фазу повторно екстрагужовтогаряча суспензія ставала коричневою. Повали діетиловим ефіром. Об'єднані органічні фатім протягом 2хв додавали розчин 1,14г гексахзи послідовно промивали за допомогою 10мл 1Μ лоретану (4,82ммоль) в 10мл ТГФ (температура тіосульфату натрію, насиченим розчином підвищувалася до -62°С). Потім реакційній суміші NaHCO3 і розсолом, сушили над сульфатом магдавали повільно нагрітися до КТ (1год) і обережнію, відфільтровували та концентрували у вакууно обробляли за допомогою 2мл води. Потім ремі й одержували 1,54 (69%) 6-хлор-3-йод-2акційну суміш концентрували у вакуумі, розбавтрифторметилпіридину у вигляді коричневого ляли водою й екстрагували діетиловим ефіром. напіврідкого залишку. МС: 307,0. Потім водну фазу підкисляли концентрованою b) Одержання 2-хлор-4-йод-6HCl і двічі екстрагували етилацетатом. Об'єднані трифторметилпіридину: етилацетатні фази послідовно промивали водою При перемішуванні до розчину 3,05мл н-BuLi (3х) і розсолом (1х), сушили над сульфатом маг(1,6Μ у гексані, 4,88ммоль) в атмосфері аргону нію, фільтрували та концентрували у вакуумі й при -75°С протягом 5хв додавали 0,69мл діізоподержували 0,28г залишку, який очищали за доропіламіну (4,88ммоль) в 2,5мл ТГФ (температупомогою хроматографії на силікагелі (елюент: ра від -72 до -75°С). Через 10хв при -75°С протягептан/AcOEt від 90:10 до 75:25) і одержували гом 20хв при такій же температурі по краплях 22мг 3-хлор-4-фтор-5-трифторметилбензойної додавали розчин 1,5г 6-хлор-3-йод-2кислоти у вигляді світло-жовтої твердої речовини. трифторметилпіридину (4,88ммоль) в 3,5мл ТГФ. МС: 241,1 (М-Н) . Після 1,5год перемішування при -75°С додавали Приклад S3-D: Одержання 3-хлор-56мл 2Μ водного розчину HCl (температурі давали циклопропілбензойної кислоти: підвищитися до КТ). Потім суміш розбавляли воДо розчину 1-бром-3-хлор-5дою, екстрагували діетиловим ефіром і об'єднані циклопропілбензолу (300мг, 1,30ммоль) при органічні фази послідовно промивали насиченим 78°С у ТГФ (5мл) по краплях додавали H-BuLi розчином NaHCO3 і розсолом, сушили над суль(890мкл, 1,6Μ розчин у гексані, 1,43ммоль). Одефатом магнію, відфільтровували та концентруваржаний розчин перемішували при -78°С протягом ли у вакуумі. Залишок очищали за допомогою 10хв, потім додавали твердий діоксид вуглецю й хроматографії на силікагелі (елюент: гепреакційну суміш нагрівали при КТ протягом 3год. тан/AcOEt 95:5) і одержували 1,145г (69%) 2Реакцію зупиняли водою й потім екстрагували хлор-4-йод-6-трифторметилпіридину у вигляді ефіром. Потім водну фазу підкисляли за допомобілої порошкоподібної речовини. МС: 307,0. гою 1н. HCl і потім екстрагували етилацетатом. c) Одержання 2-хлор-6Органічні фази поєднували, промивали розсотрифторметилізонікотинової кислоти: лом, сушили (MgSO4), фільтрували та концентруПри перемішуванні до розчину 1,1г 2-хлор-4вали у вакуумі й одержували цільовий продукт, 3йод-6-трифторметилпіридину (3,58ммоль) в 15мл хлор-5-циклопропілбензойну кислоту (178мг, ТГФ в атмосфері аргону при -75°С протягом 15хв 70%), яка не потребувала додаткового очищення. додавали 2,2мл H-BuLi (1,6Μ у гексані) (темпераМС (ІРП) 195,1 (М-Н) . туру підтримували у діапазоні від -72 до -75°С). Приклад S4-D: Одержання 6-хлор-4Після ще 5хв перемішування при -75°С реакційну трифторметилпіридин-2-карбонової кислоти: суміш виливали в надлишкову кількість свіжоподДо розчину 300мг 2-хлор-6-метил-4рібненого твердого діоксиду вуглецю й перемішу(трифторметил)-піридину (1,49ммоль) у піридині вали до встановлення КТ. Потім реакційну суміш (5мл) додавали розчин 1,61г тетрабутиламоній 43 90786 44 перманганату (4,46ммоль) у піридині (4,5мл) і етилового ефіру 6-метил-2реакційну суміш перемішували при 80°С протятрифторметилпіримідин-4-карбонової кислоти. гом 3год. Потім реакційну суміш виливали в суb) Одержання 6-метил-2міш води з льодом і потім додавали розчин трифторметилпіримідин-4-карбонової кислоти: NaHSO3 (40% у воді), поки забарвлення не ста1,3г (5,551ммоль) Етилового ефіру 6-метилвало світло-жовтим. Потім суміш підкисляли 2-трифторметилпіримідин-4-карбонової кислоти шляхом додавання 2н. HCl і екстрагували етиларозчиняли в 30мл діоксану й обробляли за допоцетатом. Потім об'єднані органічні шари промимогою 11,1мл (11,1ммоль) 1н. NaOH і перемішували за допомогою 1н. HCl і розсолом, сушили вали протягом 2год при КТ. Потім реакційну су(Na2SO4), фільтрували та концентрували. Одерміш обробляли за допомогою 11,1мл (11,1ммоль) жаний залишок очищали за допомогою хроматог1н. HCl і концентрували у вакуумі. Потім одержарафії (ДХМ/МеОН від 100:0 до 90:10) і одержуваний твердий залишок суспендували в суміші ли 224мг (67%) сірої рідини. МС (ІРП) 224,3 (МДХМ-метанол, відфільтровували, промивали додатковою кількістю суміші ДХМ-метанол і об'єдН) . нані органічні фази потім концентрували у вакууПриклад S5-D: Одержання 6-метил-2мі й одержували 1,1г (96%) 6-метил-2трифторметилпіримідин-4-карбонової кислоти трифторметилпіримідин-4-карбонової кислоти. a) Одержання етилового ефіру 6-метил-2трифторметилпіримідин-4-карбонової кислоти: МС: 205,1 (М-Н) . 2,241г (20ммоль) 2,2,2-Трифторацетамідину Сполуки формули І: розчиняли в 80мл етанолу й обробляли за допоПриклад 1: Одержання N-(4-третмогою 3,163г (20ммоль) етилового ефіру 2,4бутилбензил)-3-хлор-N-[2-(4-хлорфеніл)-етил]-2діоксопентанової кислоти. Одержаний розчин фтор-5-трифторметилбензаміду (В1) охолоджували до 0-5°С і обробляли за допомоДо розчину 50мг 3-хлор-2-фтор-5гою 120мл насиченого етанольного розчину HCl. трифторметилбензойної кислоти (0,206ммоль) і Реакційній суміші давали нагрітися до КТ і її пе68мг (0,225ммоль) (4-трет-бутилбензил)-[2-(4ремішували протягом ще 3год. Потім суміш при хлорфеніл)-етил]-аміну в 3мл ДМФ додавали охолодженні по краплях додавали до 800мл на117мг HBTU (0,31ммоль) і 0,063мл (0,62ммоль) 4сиченого розчину NaНСО3. Потім одержану суміш метилморфоліну. Після перемішування реакційдвічі екстрагували за допомогою 300мл ДХМ і ної суміші протягом ночі при КТ її виливали в суоб'єднані органічні фази сушили над сульфатом міш 15мл розсолу й 15мл води та екстрагували магнію, фільтрували та концентрували у вакуумі етилацетатом. Об'єднані органічні фази промий одержували 3,1г жовтого масла. Потім цей завали розсолом, сушили над сульфатом магнію, лишок очищали за допомогою хроматографії на фільтрували та концентрували у вакуумі. Залисилікагелі (елюент: гептан/етилацетат від 100:0 шок очищали за допомогою колонкової хроматогдо 30:70) і одержували безбарвне масло, яке рафії (силікагель; гептан/EtOAc 95:5) і одержувамимовільно кристалізувалося, і одержували 1,3г ли 76мг (70%) світло-жовтої аморфної речовини. МС (ІРП) 526,0 (М+Н)+. 45 90786 46 47 90786 48 49 90786 50 51 90786 52 53 90786 54 55 90786 56 57 90786 58 59 90786 60
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzamide and heteroarene derivatives
Автори англійськоюConte Aurelia, Kuehne Holger, Luebbers Thomas, Mattei Patrizio, Maugeais Cyrille, Mueller Werner, Pflieger Philippe
Назва патенту російськоюПроизводные бензамидов и гетероаренов
Автори російськоюКонте Аурелия, Кюне Хольгер, Любберс Томас, Маттеи Патрицио, Может Сирилл, Мюллер Вернер, Пфлиже Филипп
МПК / Мітки
МПК: A61K 31/4402, C07F 7/08, A61K 31/166, A61K 31/506, C07C 233/65, A61K 31/455, C07C 239/00, C07C 233/66, C07C 213/00, A61K 31/4409, C07C 233/73, C07C 231/00
Мітки: бензамідів, гетероаренів, похідні
Код посилання
<a href="https://ua.patents.su/42-90786-pokhidni-benzamidiv-i-geteroareniv.html" target="_blank" rel="follow" title="База патентів України">Похідні бензамідів і гетероаренів</a>
Попередній патент: Спосіб одержання оцтової кислоти
Наступний патент: Спосіб багатодіапазонного вимірювання параметрів імпедансу
Випадковий патент: Спосіб прогнозування перебігу гострої лейкемії