Солі похідних біцикло-заміщеного азопіразолону, спосіб їх одержання та застосування
Номер патенту: 107353
Опубліковано: 25.12.2014
Автори: Фей Хонгбо, Танг Пенг Чо, Чен Їкян, Лю Хеджун
Формула / Реферат
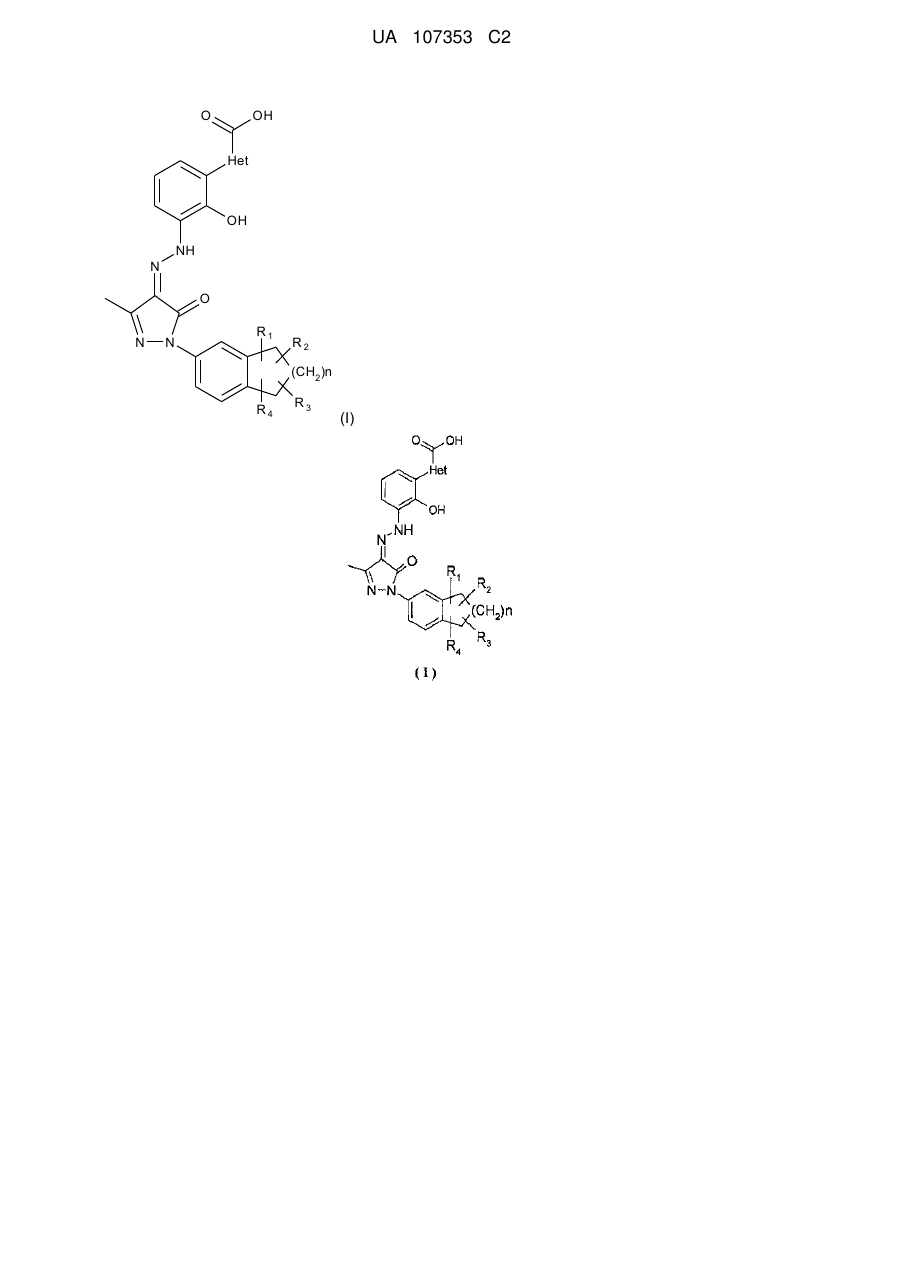
1. Фармацевтично прийнятні солі сполуки формули (І):
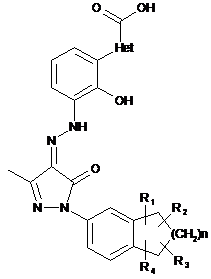 , (І)
, (І)
де:
Het вибирають з групи, що містить феніл, фурил і тієніл;
R1, R2, R3 і R4 кожен незалежно вибирають з групи, що містить водень і алкіл;
n є 0, 1 або 2; і
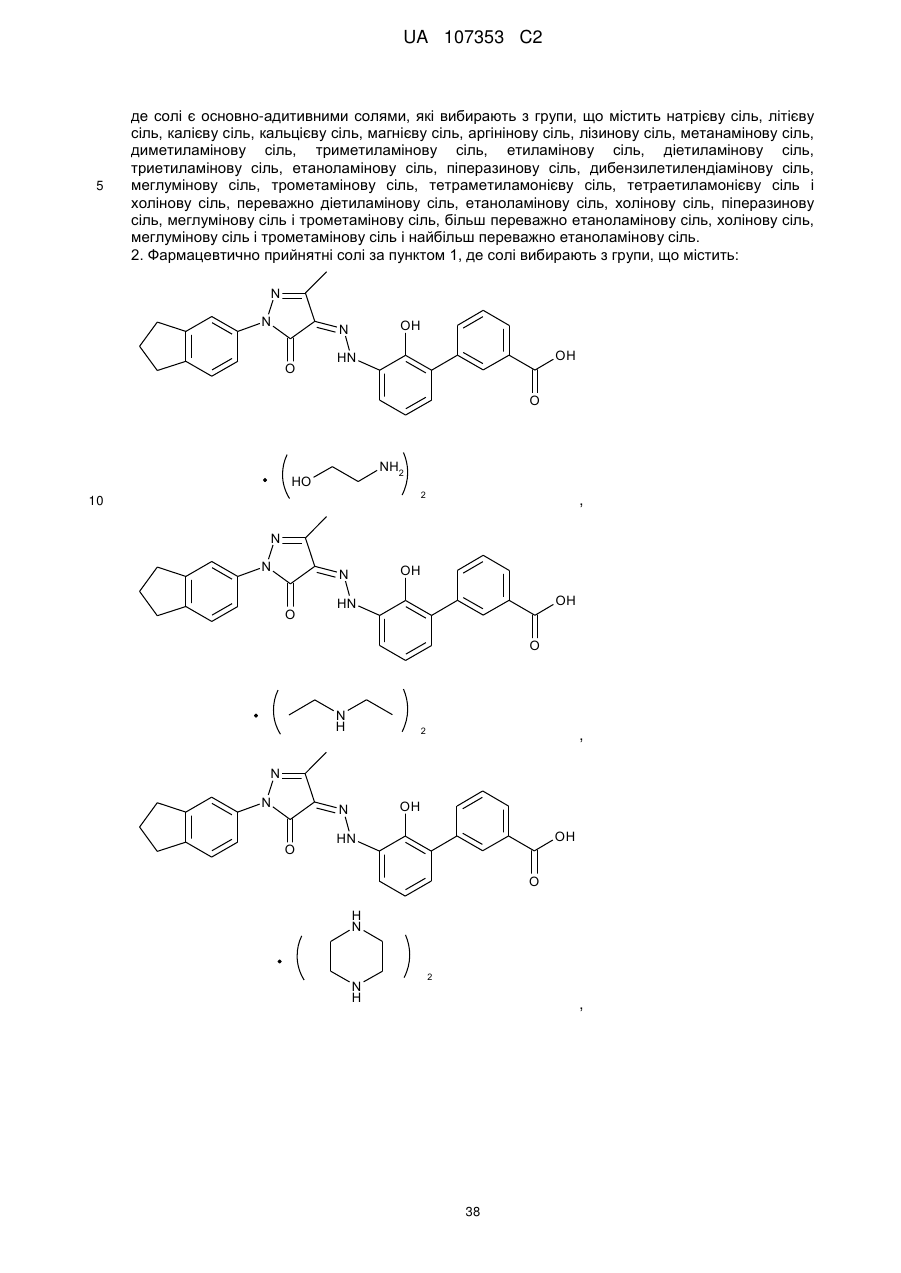
де солі є основно-адитивними солями, які вибирають з групи, що містить натрієву сіль, літієву сіль, калієву сіль, кальцієву сіль, магнієву сіль, аргінінову сіль, лізинову сіль, метанамінову сіль, диметиламінову сіль, триметиламінову сіль, етиламінову сіль, діетиламінову сіль, триетиламінову сіль, етаноламінову сіль, піперазинову сіль, дибензилетилендіамінову сіль, меглумінову сіль, трометамінову сіль, тетраметиламонієву сіль, тетраетиламонієву сіль і холінову сіль, переважно діетиламінову сіль, етаноламінову сіль, холінову сіль, піперазинову сіль, меглумінову сіль і трометамінову сіль, більш переважно етаноламінову сіль, холінову сіль, меглумінову сіль і трометамінову сіль і найбільш переважно етаноламінову сіль.
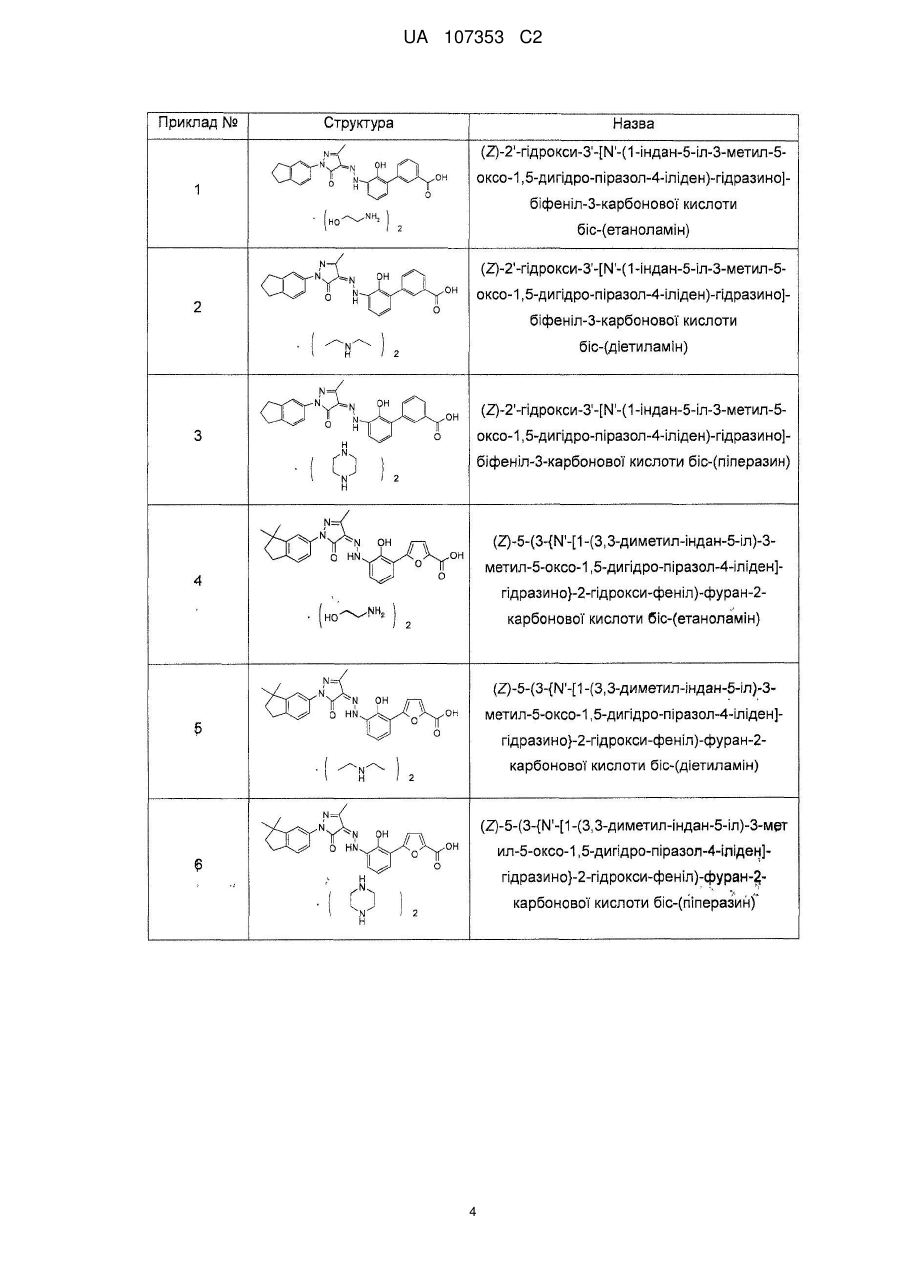
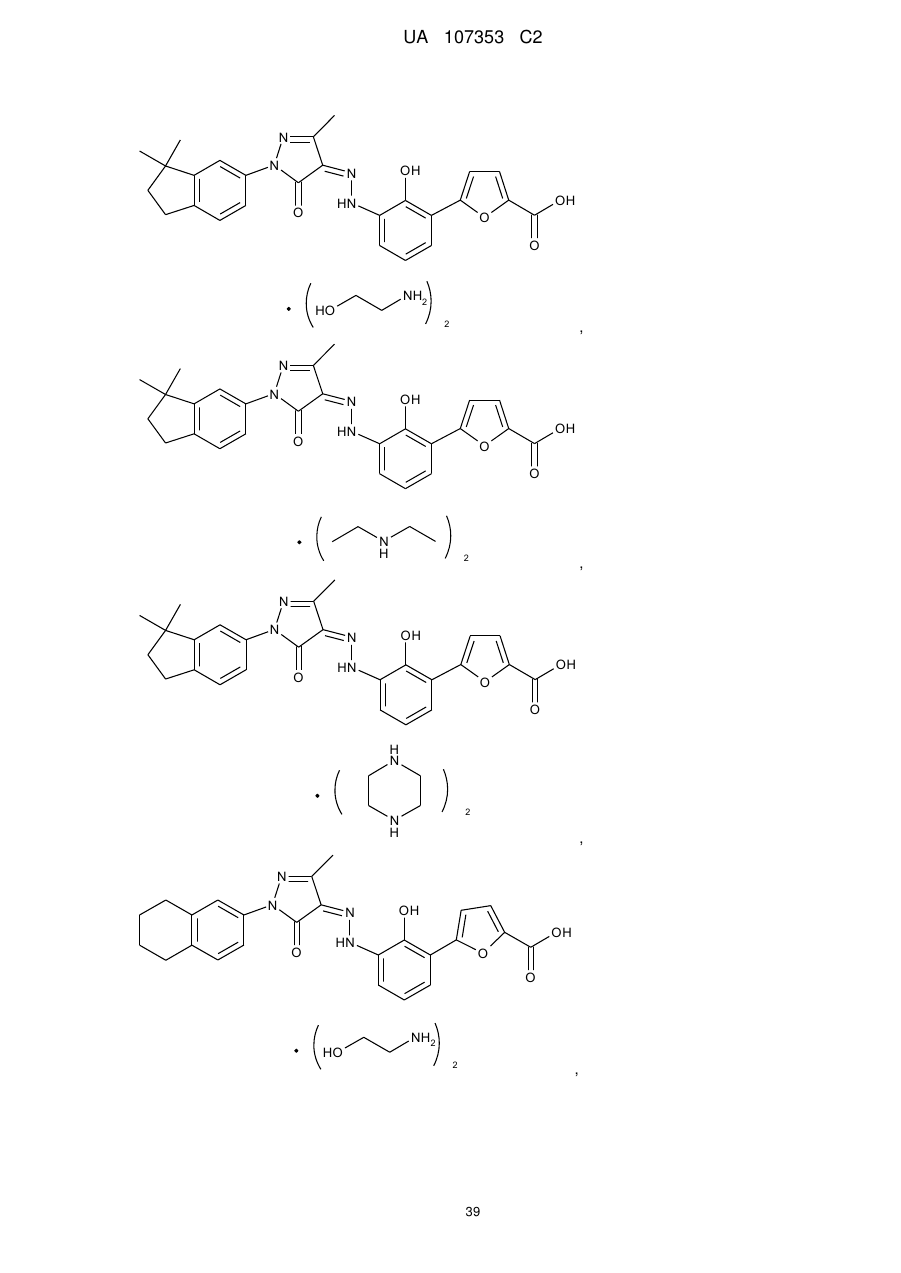
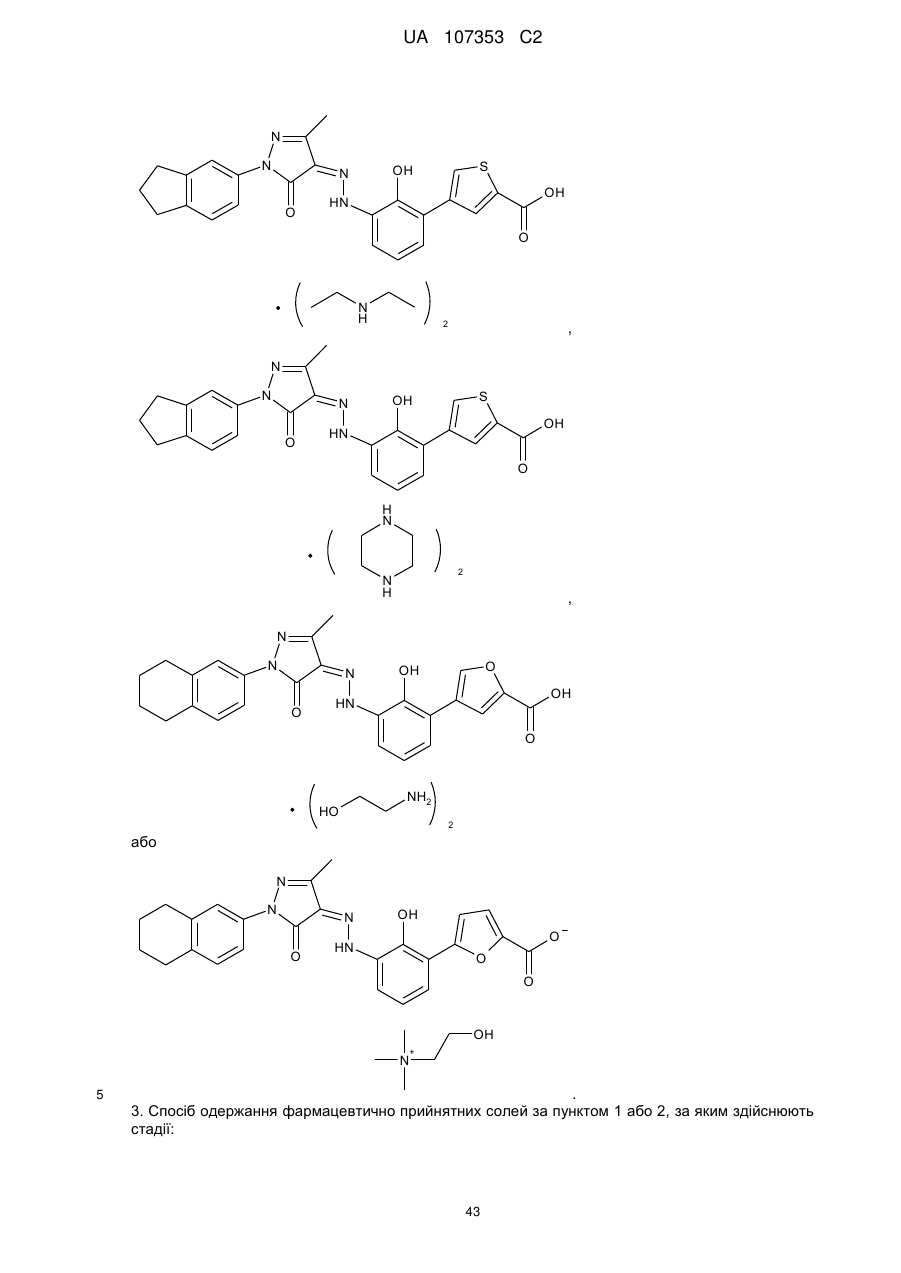
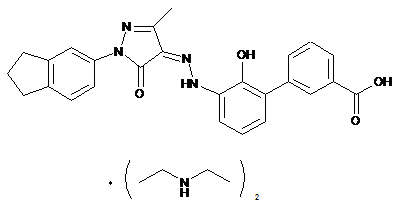
2. Фармацевтично прийнятні солі за пунктом 1, де солі вибирають з групи, що містить:
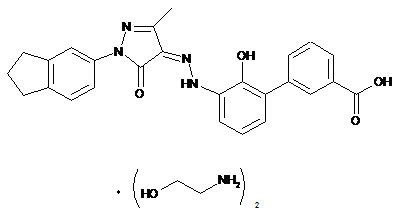 ,
,
 ,
,
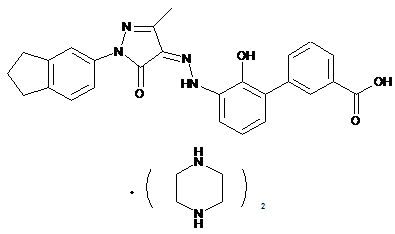 ,
,
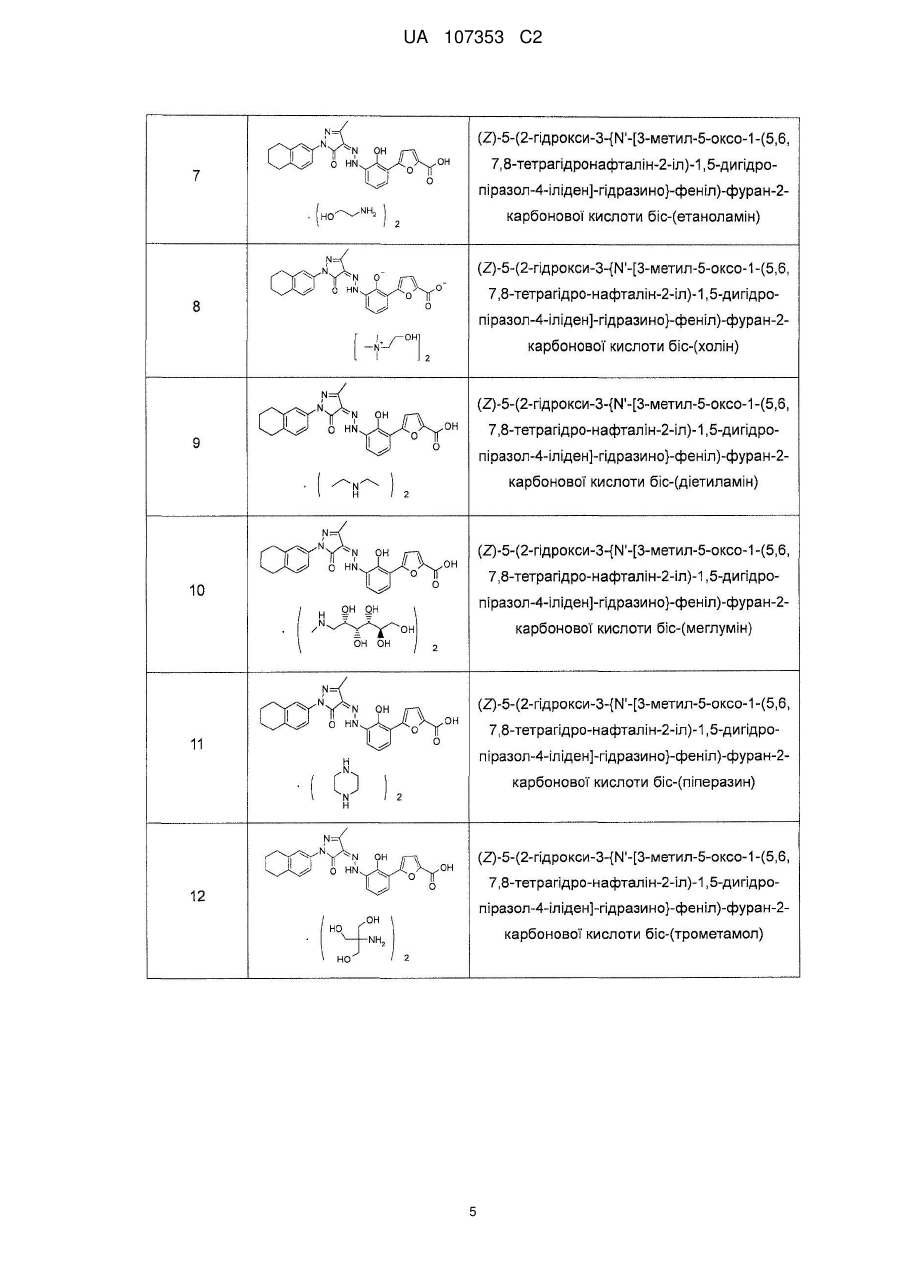
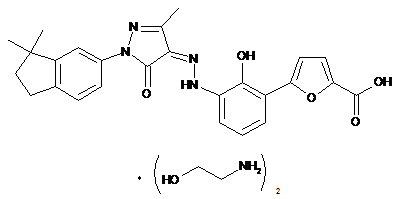 ,
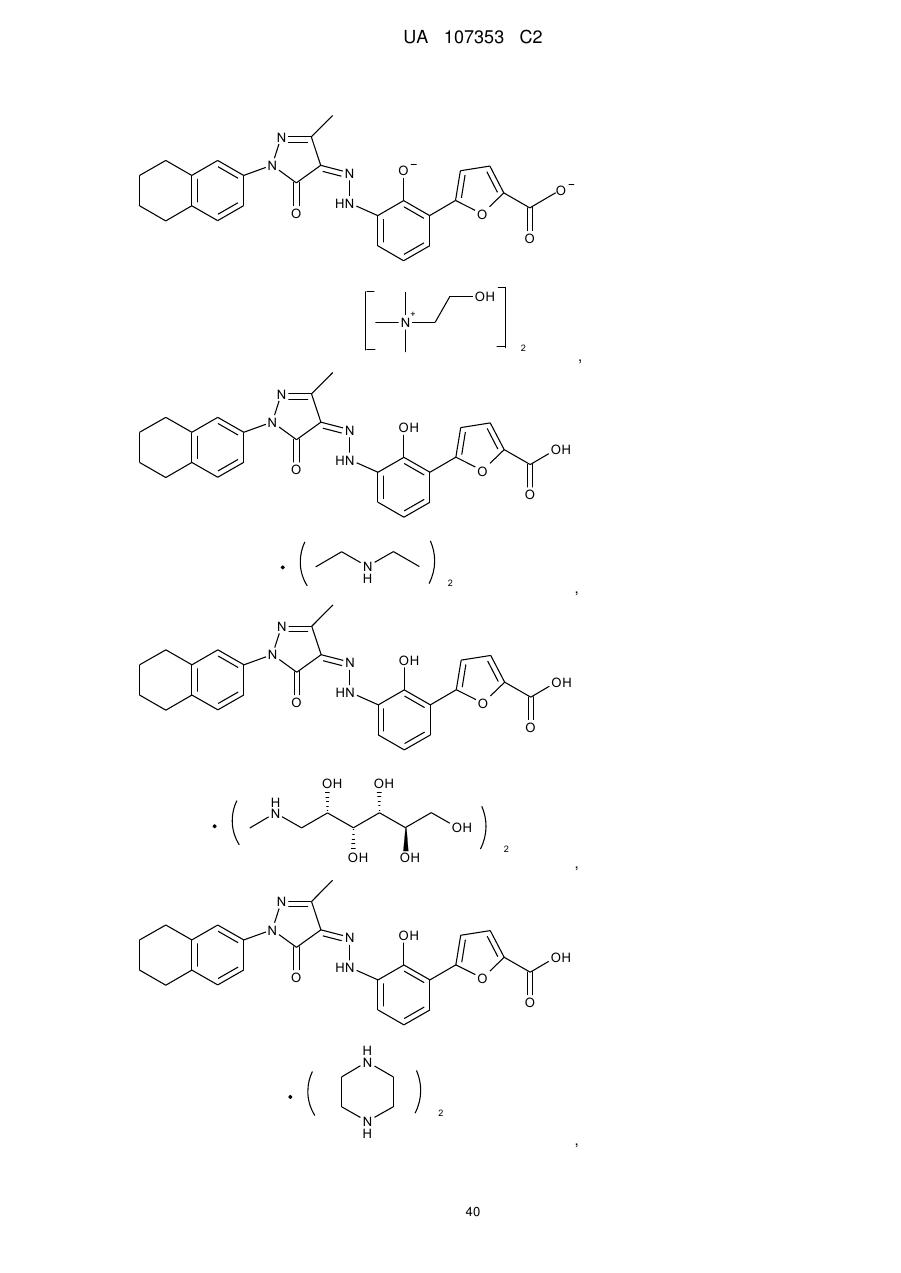
,
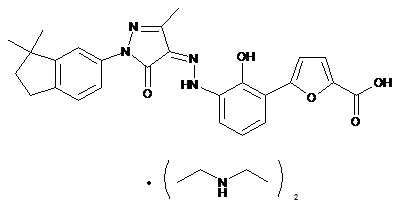 ,
,
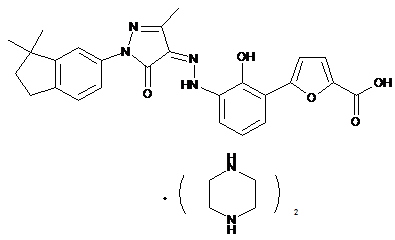 ,
,
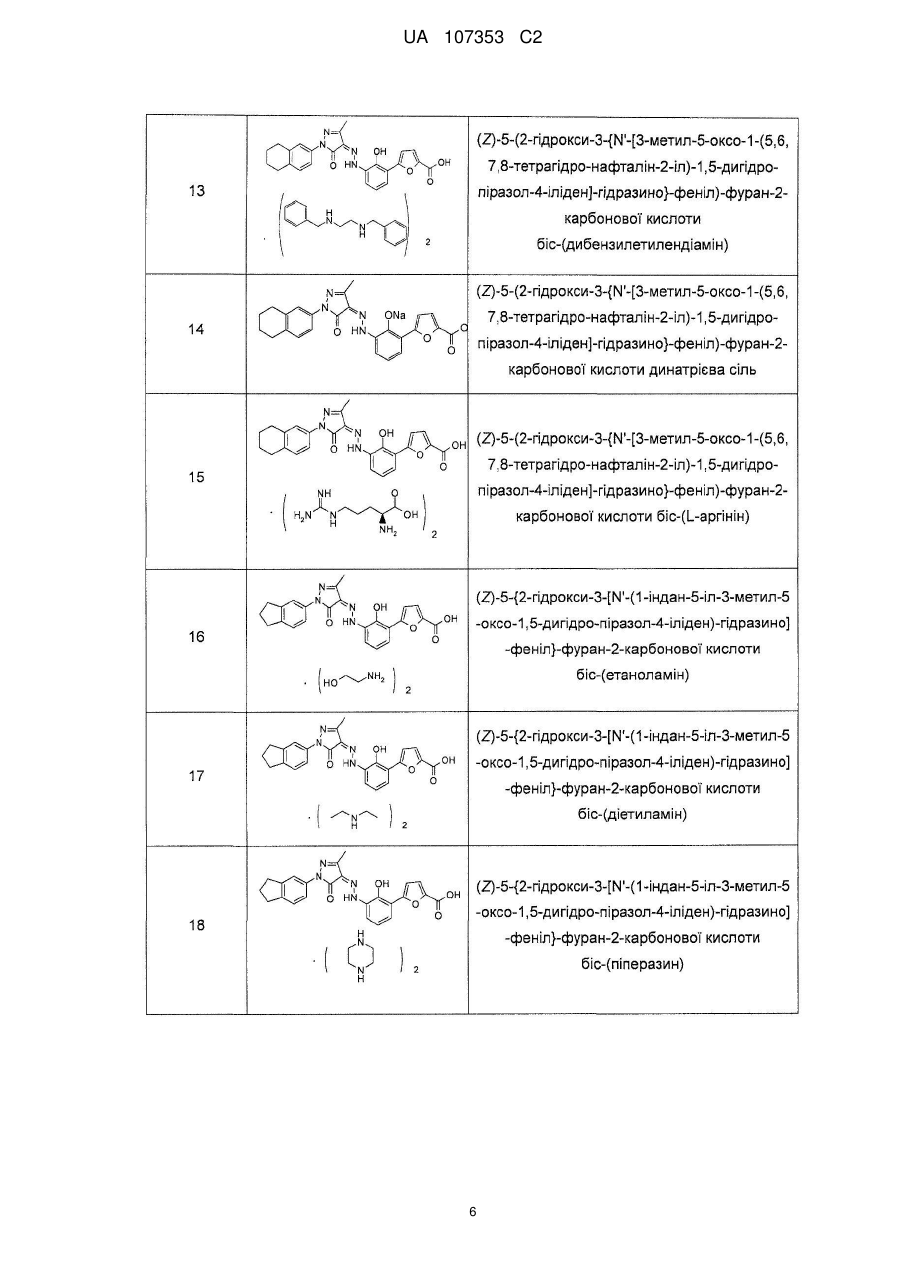
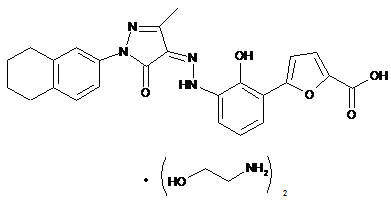 ,
,
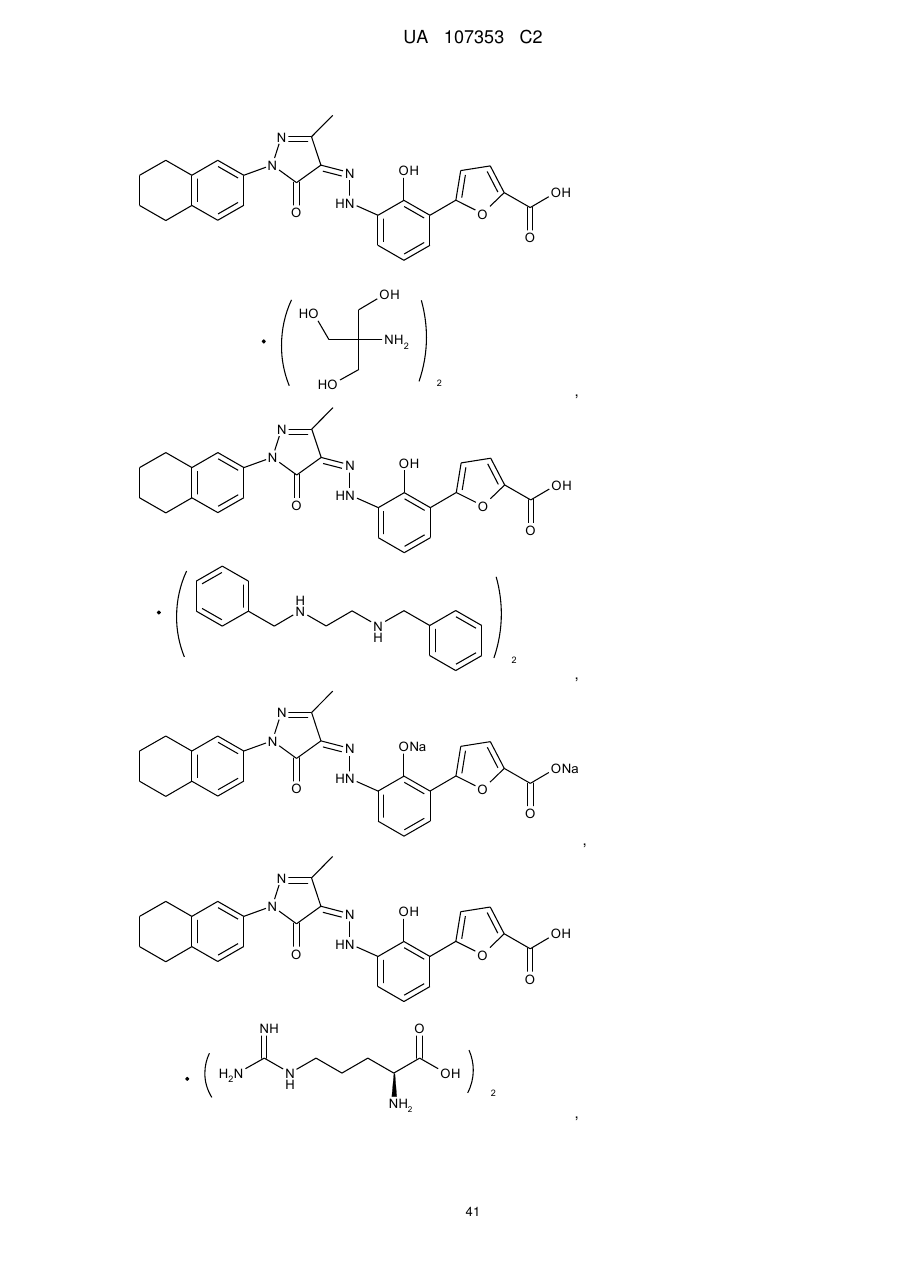
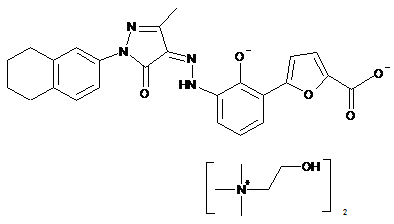 ,
,
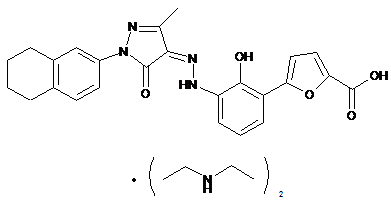 ,
,
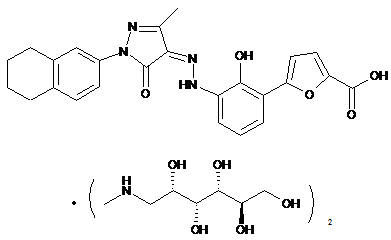 ,
,
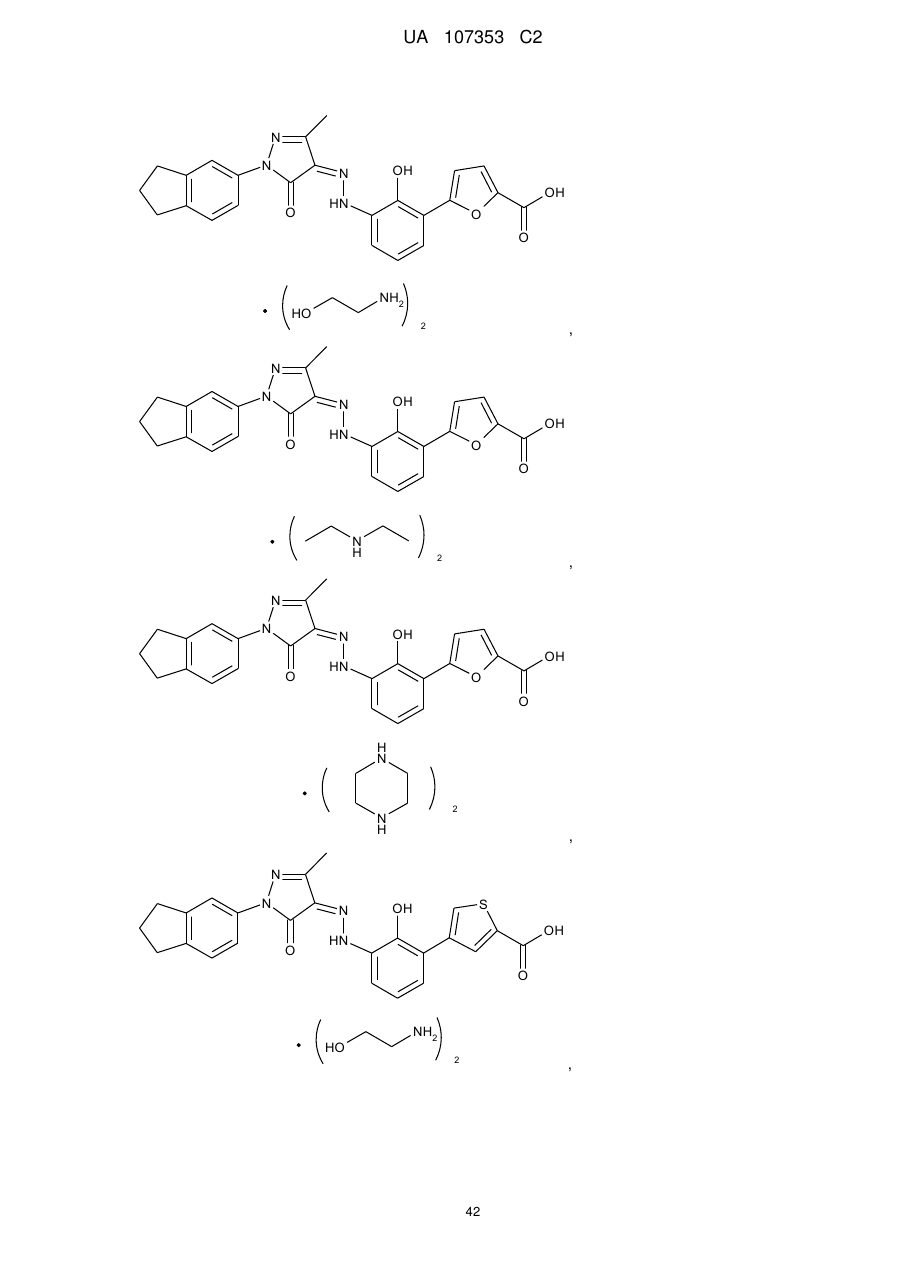
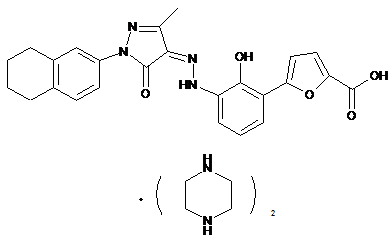 ,
,
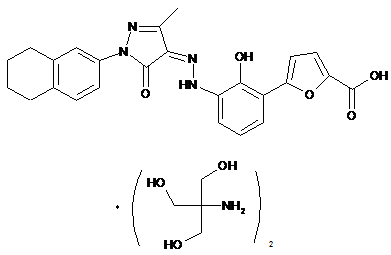 ,
,
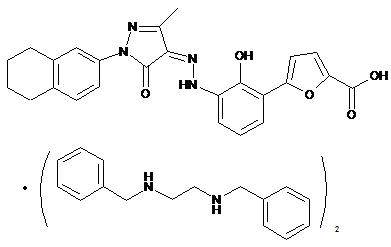 ,
,
 ,
,
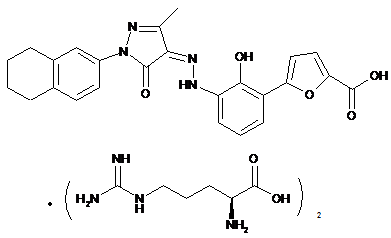 ,
,
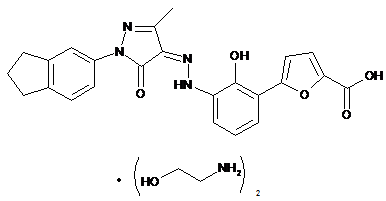 ,
,
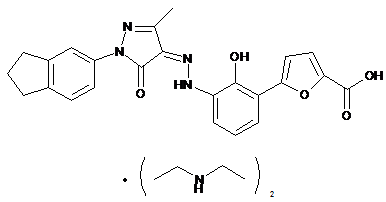 ,
,
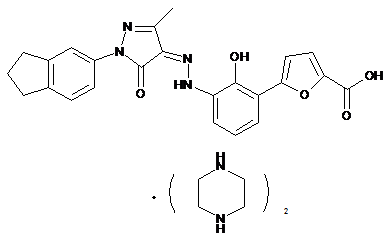 ,
,
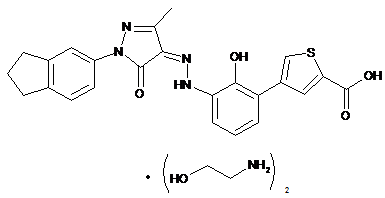 ,
,
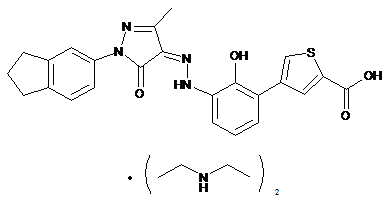 ,
,
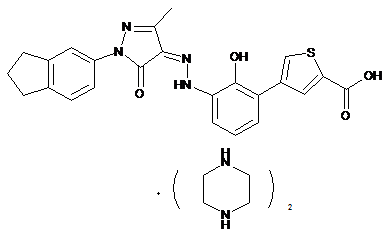 ,
,
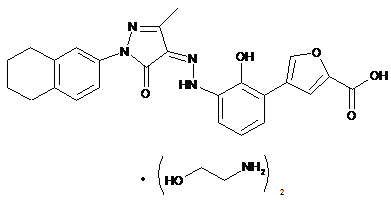
або
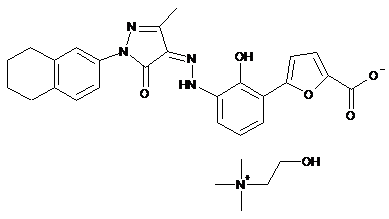 .
.
3. Спосіб одержання фармацевтично прийнятних солей за пунктом 1 або 2, за яким здійснюють стадії:
(a) розчинення або суспендування сполуки формули (І) в органічному розчиннику, де органічний розчинник вибирають з групи, що містить метанол, етанол, ацетон, етилацетат і тетрагідрофуран, переважно тетрагідрофуран;
(b) додавання до суміші при перемішуванні основи, яку вибирають з групи, що містить гідроксид натрію, гідроксид літію, гідроксид калію, гідроксид кальцію, гідроксид магнію, лізин, аргінін, метанамін, диметиламін, триметиламін, етиламін, діетиламін, триетиламін, етаноламін, піперазин, дибензилетилендіамін, меглумін, трометамін, тетраметиламоній, тетраетиламоній і гідроксид холіну, переважно діетиламін, етаноламін, гідроксид холіну, піперазин, меглумін і трометамін, більш переважно етаноламін, гідроксид холіну, меглумін і трометамін, найбільш переважно етаноламін;
(c) одержання фармацевтично прийнятної солі сполуки формули (І).
4. Спосіб за пунктом 3, де співвідношення сполуки формули (І) і основи становить 1:5~5:1, переважно 1:1~1:3 і більш переважно 1:1~1:2.
5. Фармацевтична композиція, що містить терапевтично ефективну кількість фармацевтично прийнятних солей за будь-яким з пунктів 1 або 2 і фармацевтично прийнятні носії або розріджувачі.
6. Фармацевтична композиція за пунктом 5, де композиція необов’язково додатково містить лікарський засіб, який вибирають групи, що містить: колонієстимулюючий фактор, цитокін, хемокін, інтерлейкін і агоніст рецептора цитокіну.
7. Спосіб одержання композиції за пунктом 5, за яким здійснюють стадію комбінування сполуки за пунктом 1 або 2 з фармацевтично прийнятними носіями або розріджувачами.
8. Застосування фармацевтично прийнятних солей сполуки формули (І) за пунктом 1 або 2 при одержанні агоніста рецептора тромбопоетину.
9. Застосування фармацевтично прийнятних солей сполуки формули (І) за пунктом 1 або 2 при одержанні медикаменту для лікування тромбоцитопенії.
10. Застосування за пунктом 9, де медикамент є у формі оральної дозованої форми.
11. Застосування за пунктом 9, де медикамент є у формі парентеральної дозованої форми.
12. Спосіб лікування тромбоцитопенії, за яким суб’єкту вводять фармацевтично прийнятні солі сполуки формули (І) за пунктом 1 або 2.
13. Спосіб за пунктом 12, де фармацевтично прийнятні солі сполуки формули (І) за пунктом 1 або 2 вводять разом з лікарським засобом, який вибирають з групи, що містить колонієстимулюючий фактор, цитокін, хемокін, агоніст або антагоніст рецептора інтерлейкіну або цитокіну, розчинний рецептор, рецептор агоніста або антагоніста антитіла або один або більше пептидів, або низькомолекулярні сполуки, що мають такий же самий механізм, як і лікарський засіб.
Текст
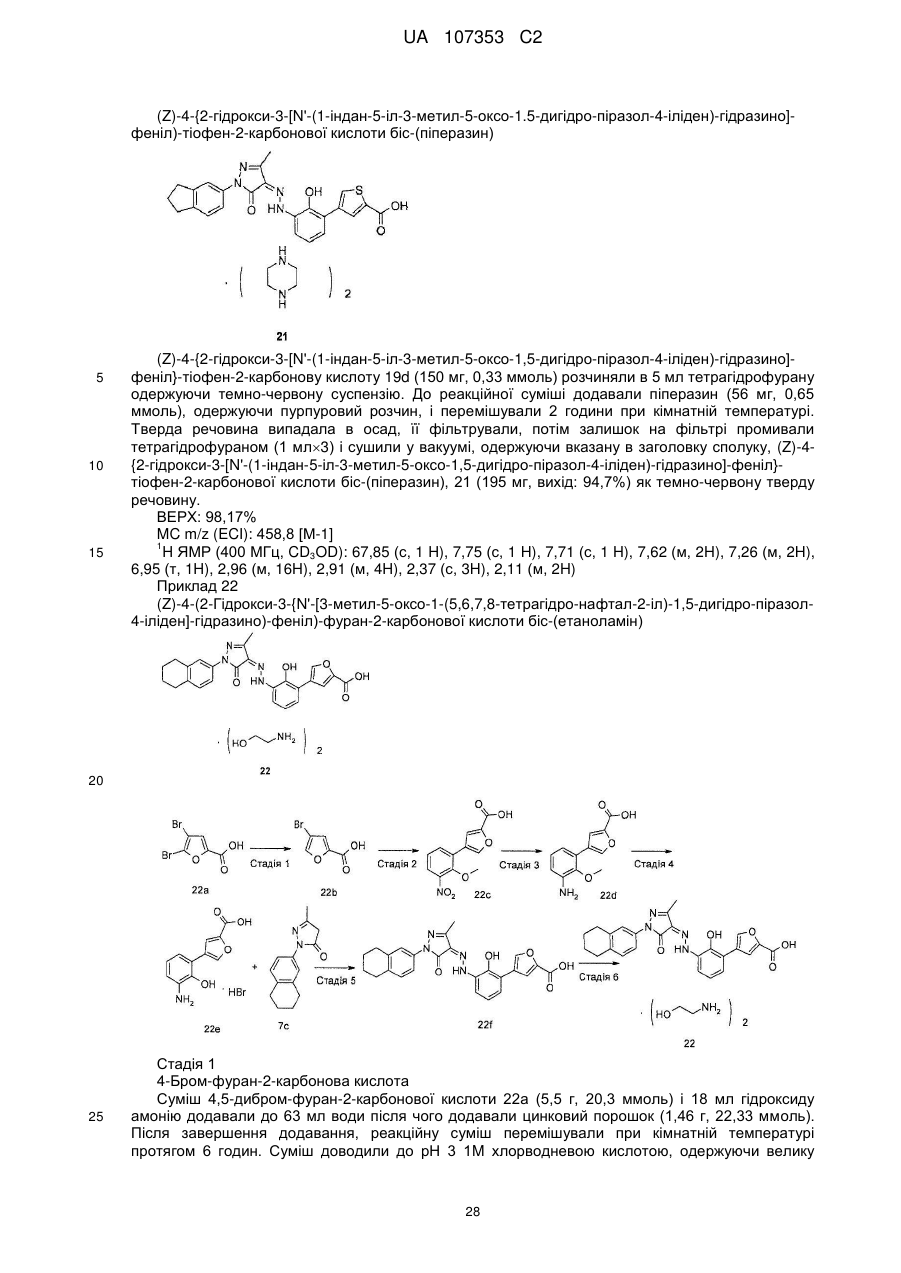
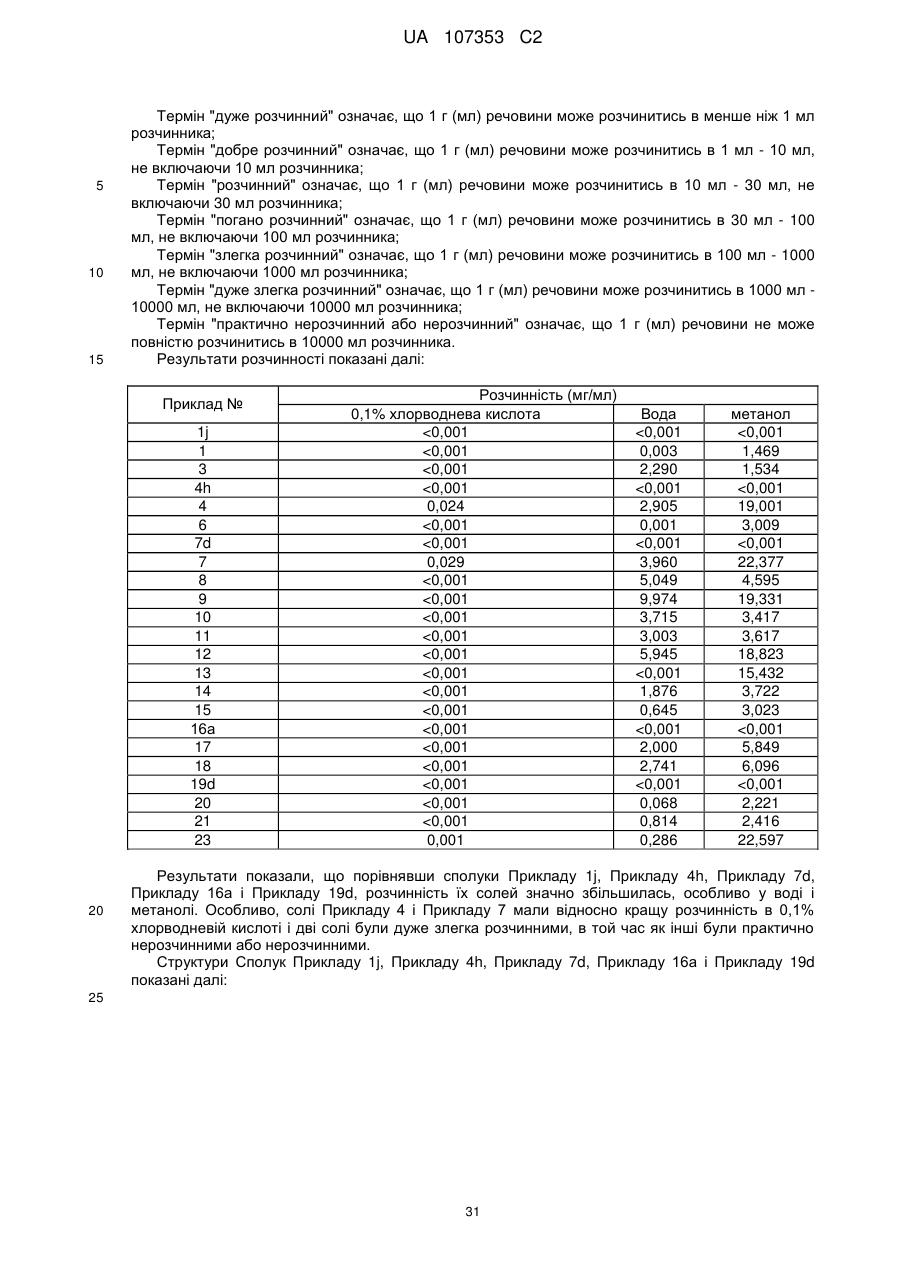
Реферат: Описуються фармацевтично прийнятні солі похідних біциклозаміщеного азопіразолону загальної формули (І), способи їх одержання, фармацевтичні композиції, що їх містять, і їх застосування як терапевтичного агента, особливо як міметиків тромбопоетину (ТРО), і їх застосування як агоністів рецептора тромбопоетину. Визначення замісників в загальній формулі (І) є таким же самим, як в описі. UA 107353 C2 (12) UA 107353 C2 OH O Het OH NH N O N N R1 R2 (CH2 )n R4 R3 (І) UA 107353 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Цей опис стосується фармацевтично прийнятних солей нових похідних біцикло-заміщеного азопіразолону, способів їх одержання, фармацевтичних композицій, що їх містять і їх застосування як терапевтичного агента, зокрема, як міметиків тромбопоетину (TPO) і агоністів рецептора тромбопоетину. Передумови створення винаходу Тромбопоетин (TPO), також має назву фактор розвитку і росту мегакаріоциту (MGDF), стимулюючий фактор тромбоцитопоезу (TSF), ліганд с-мієлопроліферативної лейкемії (с-МрІ), mpl ліганд або мегапоетин, є глікопротеїном, що як повідомлялось, регулює продукування тромбоцитів. Дивись Wendling, F., et. al., Biotherapy 10(4): 269-77 (1998); Kuter D.J. et al., The Oncologist, 1: 98-106 (1996); Metcalf, Nature 369: 519-520 (1994). За деяких обставин, активність TPO є наслідком зв'язування TPO з рецептором TPO (також низивається MpI). TPO рецептор був клонований і описана його амінокислотна послідовність. Дивись Vigon et al., Proc. Nat. Acad. Sci., 89: 5640-5644 (1992). TPO є 332-аміноиклсотним глікозильованим поліпептидом, що відіграє ключову роль в регулюванні мегокаріоцитопоезу, в процесі якого продукуються тромбоцити мегакаріоцитами кісткового мозку. Дивись Kuter et al., Proc. Nat. Acad. Sci. USA 91: 11104-11108 (1994); Barley et al., Cell 77:1117-1124 (1994); Kaushansky et al., Nature 369:568-571 (1994); Wendling et al., Nature 369: 571-574 (1994); і Sauvage et al., Nature 369: 533-538 (1994). TPO продукується в печінці, але функціонує в основному в кістковому мозку, де він стимулює диференціацію стволових клітин в попередниках мегакаріоцитів і стимулює проліферацію мегаріоцитів, поліплоідизацію і, в кінці кінців, виводить циркулюючі тромбоцити в тіло. TPO також є первинним регулятором в ситуаціях, що включають тромбоцитопенію і в ряді досліджень, що включають збільшення кількості тромбоцитів, розміру тромбоциту і включення ізотопів в тромбоцити реціпієнтних тварин. Дивись, Metcalf Nature 369: 519-520 (1994). Специфічно, вважається, що TPO впливає на мегокаріоцитопоез декількома шляхами: (1) він викликає збільшення розміру і кількості мегакаріоциту; (2) він збільшує вміст ДНК, утворення поліплоїду і ряду мегакаріоцитів; (3) він збільшує ендомітоз мегакаріоциту; (4) він збільшує кількість зрілих мегакаріоцитів; (5) він збільшує відсоток клітин попередників, кількість малих ацетилхолінестеразапозитивних клітин, кількість клітин кісткового мозку. Тромбоцити необхідні для згортання крові. Коли кількість тромбоцитів дуже низька, пацієнт має ризик загинути від катастрофічної втрати крові. Таким чином, TPO використовується для діагностики і лікування різних гематологічних розладів, наприклад, захворювань викликах недостатністю тромбоцитів. Більш того, TPO може бути корисний для лікування тромбоцитопенічних станів, особливо тих, що є наслідком хіміотерапії, радіаційного опромінення або трансплантації кісткового мозку при лікуванні раку або лімфоми. Повільне відновлення рівнів тромбоцитів у пацієнтів, що страждають на тромбоцитопенію є серйозною проблемою, бажано одержати сполуку для лікування тромбоцитопенії діючи як міметик TPO. Ці пептиди призначені для зв'язування і активації TPO рецептора (TPO-R), але не мають гомології послідовності природному TPO. В останні роки було описано ряд активних низькомолекулярних міметиків TPO, включаючи похідні поліаміну (WO00/28987), тіазол-2-ілбензаміди (WO01/07423, WO01/53267), азоарильні похідні (WO00/35446, WO01/17349), 2-арилнафтімідазоли (WO01/39773, WO01/53267) і семікарбазонові похідні (WO01/34585). В клітинних системах, всі з цих молекул можуть активувати шляхи сигнальної трансдукції, що залежать від присутності TPO рецептора на клітинній мембрані. Деякі типи сполук можуть безпосередньо діяти на сам TPO рецептор. Деякі з більшості переважних сполук цієї серії стимулюють проліферацію і диференціацію ТРО-чутливих ліній клітин людини і TPO в культурах кісткового мозку людини, що мають концентрацію нижче 100 нМ. Деякі патенти передані GlaxoSmithKline описують аналог тромбопоетину, елтромбопаг (WO2003098992/WO-01089457), з доброю активністю. Представлений винахід забезпечує ряд фармацевтично прийнятних солей похідних біциклозаміщеного азопіразолону, які є більш ефективними міметиками TPO і агоністами рецептора TPO. Міжнародна заявка № PCT/CN2009/000001 подана заявником представленого винаходу 4 січня 2009 описує нові біцикло-заміщені похідні азопіразолону і їх застосування як міметиків тромбопоетину (TPO) і агоністів рецептора тромбопоетину. В міжнародній заявці описано шість прикладів сполук (Приклад 1, Приклад 9, Приклад 15, Приклад 28, Приклад 43 і Приклад 52), а саме: 2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідропіразол-4-іліден)-гідразино]-біфеніл3-карбонова кислота, 1 UA 107353 C2 5 10 15 20 25 30 35 5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонова кислота, 5-(2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідронафталін-2-іл)-1,5-дигідропі-разол-4іліден]-гідразино}-феніл)-фуран-2-карбонова кислота, 4-(2-гідрокси-3-[N'-(3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідро-піразол-4іліден)-гідразино]біфеніл-фуран-2-карбонова кислота, 5-(3-{N'-[1-(3,3-диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідропіразол-4-іліден]-гідразино}-2гідрокси-феніл)-фуран-2-карбонова кислота, 4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-тіофен-2-карбонова кислота, і її естери. Для цих сполук встановлена добра агоністична активність стосовно TPO рецептора. Крім того, ця міжнародна заявка повністю включена сюди через посилання. Однак, міжнародна заявка № PCT/CN2009/000001 не описує фармацевтично прийнятні солі сполук. Винахідник винаходу зазначив, що вільна кислота похідних біцикло-заміщеного азопіразолону погано розчинна в звичайних розчинниках і, таким чином, незручно одержувати медичні дозовані форми, що обмежує її in vivo біодоступність. Тому, необхідно одержати нові форми похідних біцикло-заміщеного азопіразолону для поліпшення їх розчинності і фармакокінетичної абсорбції, що можуть бути використані при звичайному одержанні дозованих форм. Короткий опис суті винаходу Для того щоб подолати недоліки рівня техніки, представлений винахід забезпечує фармацевтично прийнятні солі нових похідних біцикло-заміщеного азопіразолону, способи їх одержання, фармацевтичні композиції, що їх містять, і їх застосування як терапевтичного агента, особливо як міметиків тромбопоетину (TPO) і агоністів рецептора тромбопоетину. Солі мають добру активність для лікування тромбоцитопенії, поліпшену розчинність, добру in vivo активність, кращу біодоступність, низьку токсичність і є добрими кандидатами на одержання медикаменту для лікування тромбоцитопенії. Терміни "сполуки представленого опису" і "солі представленого опису" є рівноцінними, і обидва з яких є фармацевтично прийнятними солями похідних біцикло-заміщеного азопіразолону представлених формулою (І). Де: Het вибирають з групи, що містить феніл, фурил і тієніл; R1, R2, R3 і R4 кожен незалежно вибирають з групи, що містить водень і алкіл; n є 0, 1 або 2; солями є основно-адитивні солі. Крім того, представлений опис стосується солей сполук формули (IA). 2 UA 107353 C2 5 10 15 20 25 де: Het вибирають з групи, що містить феніл, фурил і тієніл; R1, R2, R3 і R4 кожен незалежно вибирають з групи, що містить водень і алкіл; M вибирають з групи, що містить іон металу, іон амонію і основну амінокислоту; m є 1 або 2; n є 0, 1 або 2; солями є основно-адитивні солі. Термін "вільна кислота" стосується похідних біцикло-заміщеного азопіразолону формули (І). Еквівалент стосується тих таутомерів сполук формули (І), які добре відомі середньому фахівцю в цій галузі. Таутомерии сполук формули (І) включають наступну формулу (II) і формулу (III), але не обмежуються ними: Всі таутомери сполук формули (І) включені в рамки представленого опису і всі з них включені у визначення сполук формули (І). Термін "фармацевтично прийнятна сіль" в представленому описі стосується фармацевтично нетоксичних основно-адитивних солей. Солями є сполуки утворенні сполуками формули (І) і прийнятними основами, такими як гідроксид лужного металу, основна амінокислота, амін або четвертинний амоній, включаючи натрієву сіль, літієву сіль, калієву сіль, кальцієву сіль, магнієву сіль, аргінінову сіль, лізинову сіль, метанамінову сіль, диметиламінову сіль, триметиламінову сіль, етиламінову сіль, діетиламінову сіль, триетиламінову сіль, етаноламінову сіль, піперазинову сіль, дибензилетилендіамінову сіль, меглумінову сіль, трометамінову сіль, тетраметиламонієву сіль, тетраетиламонієву сіль і холінову сіль, переважно діетиламінову сіль, етаноламінову сіль, холінову сіль, піперазинову сіль, меглумінову сіль і трометамінову сіль, більш переважно етаноламінову сіль, холінову сіль, меглумінову сіль і трометамінову сіль, і найбільш переважно етаноламінову сіль. Фармацевтично прийнятні солі сполук формули (І) представленого опису переважно включають, але не обмежуються ними: 3 UA 107353 C2 4 UA 107353 C2 5 UA 107353 C2 6 UA 107353 C2 5 10 15 Представлений опис стосується способу одержання фармацевтично прийнятних солей сполук формули (1), що включає стадії: (a) розчинення або суспендування вільної кислоти представленого опису (сполука формули (I)) в органічному розчиннику, де органічний розчинник вибирають з групи, що містить метанол, етанол, ацетон, етилацетат і тетрагідрофуран, переважно тетрагідрофуран; (b) додавання основи до суміші при перемішуванні, де основа може бути органічною або неорганічною основою, такою як гідроксид лужного металу або гідроксид лужноземельного металу, основна амінокислота, амін або четвертинний амоній; (с) одержання фармацевтично прийнятні солі сполуки формули (І), де неорганічні основи включають гідроксиди лужних металів, які вибирають з групи, що містить гідроксид натрію, гідроксид літію, гідроксид калію, гідроксид кальцію, гідроксид магнію; основні амінокислоти вибирають з групи, що містить лізин і аргінін; аміни вибирають з групи, що містить метанамін, диметиламін, триметиламін, етиламін, діетиламін, триетиламін, етаноламін, піперазин, дибензил етилендіамін, меглумін і трометамін; і четвертинні амонії вибирають з групи, що містить тетраметиламоній, тетраетиламоній, гідроксид холіну, переважно діетиламін, етаноламін, гідроксид холіну, піперазин, меглумін і трометамін, більш переважно етаноламін, гідроксид холіну, меглумін і трометамін, найбільш переважно етаноламін. 7 UA 107353 C2 5 10 15 20 25 30 35 40 45 50 55 60 На стадії (b), співвідношення вільної кислоти і гідроксиду лужної основи, основної амінокислоти, аміну і четвертинного амонію було переважно 1:5~5:1, більш переважно 1:1~1:3 і найбільш переважно 1:1-1:2. На стадії (с), відокремлення солей переважно включає безпосередню фільтрацію з реакційної суміші, концентрування з реакційної суміші і перекристалізацію з органічного розчинника. Солі висушують за таких умов, як вакуумна сушка або висушування в потоці гарячого повітря. Реакції з утворення солей зазвичай проводять за умов охолодження, при кімнатній температурі або нагріванні. Однак, слід відмітити, що температура реакції залежить від утворюваної солі, і це добре відомо середньому фахівцю в цій галузі. Інтервал температур реакцій представленого опису становить від кімнатної температури до температури кипіння розчинника реакції, переважно 0~40°С. Фахівець в цій галузі може легко визначити найбільш переважну температуру реакції утворення солі, використовуючи звичайні методики. Представлений опис стосується застосування фармацевтично прийнятних солей сполуки формули (І) при одержанні агоніста рецептора тромбопоетину. Представлений опис стосується застосування фармацевтично прийнятні солі сполуки формули (І) при одержанні медикаменту для лікування тромбоцитопенії, де медикамент спільно вводять з лікарським засобом з групи, що містить колоній стимулюючий фактор, цитокін, хемокін, агоніст або антагоніст рецептора інтерлейкіну або цитокіну, розчинний рецептор, рецептор агоніста або антагоніста антитіла або один або більше пептидів або низькомолекулярні сполуки, що мають такий же самий механізм як і лікарський засіб. Представлений опис стосується фармацевтично прийнятних солей сполук формули (І), для використання як медикаменту для лікування тромбоцитопенії, де медикамент спільно вводять з лікарським засобом з групи, що містить колоній стимулюючий фактор, цитокін, хемокін, агоніст або антагоніст рецептора інтерлейкіну або цитокіну, розчинний рецептор, рецептор агоніста або антагоніста антитіла або один або більше пептидів або низькомолекулярні сполуки, що мають такий же самий механізм як і лікарський засіб, де медикамент є у формі оральної дозованої форми або медикамент є у формі парентеральної дозованої форми. Представлений опис стосується способу лікування тромбоцитопенії, що включає стадію введення суб'єктові, що цього потребує, терапевтично ефективної кількості фармацевтично прийнятної солі сполуки формули (І), де фармацевтично прийнятну сіль спільно вводять з лікарським засобом з групи, що містить колоній стимулюючий фактор, цитокін, хемокін, агоніст або антагоніст рецептора інтерлейкіну або цитокіну, розчинний рецептор, рецептор агоніста або антагоніста антитіла або один або більше пептидів або низькомолекулярні сполуки, що мають такий же самий механізм як і лікарський засіб, де фармацевтично прийнятна сіль є у формі оральної дозованої форми або фармацевтично прийнятна сіль є у формі парентеральної дозованої форми. Представлений опис стосується фармацевтичних композицій, що містять терапевтично ефективну кількість фармацевтично прийнятної солі сполуки формули (І) і фармацевтично прийнятні носії або розріджувачі, де композицію спільно вводять з лікарським засобом з групи, що містить колоній стимулюючий фактор, цитокін, хемокін, інтерлейкін і агоніст рецептора цитокіну. Представлений опис також стосується застосування композицій при одержанні медикаменту для лікування тромбоцитопенії, де спільне введення включає введення лікарських засобів представленого опису одночасно або послідовно. Представлений опис стосується способу одержання фармацевтичних композицій, що містять терапевтично ефективну кількість фармацевтично прийнятної солі сполуки формули (І) і фармацевтично прийнятні носії або розріджувачі, де спосіб включає стадію комбінування сполук формули (І) з фармацевтично прийнятними носіями або розріджувачами. В способі одержанні фармацевтичних композицій, важливим для одержання лікарського засобу в прийнятній формі, що звичайно застосовується і використовується, яка є не тільки з огляду комерційної доступності одержання, але також з огляду одержання фармацевтичних дозованих форм, що містять активні сполуки. В іншому аспекті, важливим є надійність, відтворюваність і постійна крива концентрації лікарського засобу в плазмі після введення суб'єктові в ході одержання фармацевтичних композицій. Іншими важливими факторами є хімічна стійкість, стабільність в твердому стані і строк придатності активного інгредієнта. Лікарські засоби, що містяться в їх композиції, можуть переважно зберігатись відносно довго без значних змін фізичних і хімічних характеристик їх активних компонентів, таких як хімічний склад, густина, гігроскопічність і розчинність. Також важливо забезпечити хімічну чистоту лікарського засобу, як це можливо. 8 UA 107353 C2 5 10 15 20 25 30 35 40 45 50 55 60 Типово, лікарський засіб може надавати наступні переваги: зручне лікування, одержання прийнятних дозованих форм лікарського засобу і надійна розчинність, якщо лікарський засіб можна одержати в стабільній формі, такій як стабільна кристалічна форма, яка добре відома фахівцю в цій галузі. Ефективна кількість активного інгредієнта в фармацевтичній дозованій одиниці, як описано вище, буде нетоксичною, переважно, що вибирається з інтервалу 0,001~100 мг/кг від загальної маси, більш переважно 0,001~50 мг/кг. Коли лікування суб'єкта потребує TPO міметиків, вибрана доза вводиться орально або парентерально. Переважними парентеральними формами є місцева, ректальна, трансдермальна форми, ін'єкція і інфузія. Оральні дозовані одиниці для введення людині переважно містять від 0,05 до 3500 мг активного інгредієнта, найбільш переважно від 0,5 до 1000 мг активного інгредієнта. Переважним є оральне введення, яке використовує нижчу дозу. Парентеральне введення, з вищими дозами, однак, також може бути використано, коли це безпечно і зручно для пацієнта. Приведені вище дози стосуються переважної кількості активного інгредієнта у вигляді вільної кислоти. Середньому фахівцю в цій галузі повинно бути зрозуміло, що оптимальна кількість і інтервал окремих доз активного інгредієнту буде залежати від природи і ступеня стану, що лікується, форми, шляху і місця введення, особи пацієнта, що лікується, і такі оптимальні значення можуть бути визначенні за допомогою звичайних методик. Також середньому фахівцю повинен бути зрозумілий і оптимальний курс лікування, тобто, кількість доз активного інгредієнту, що вводиться протягом дня за визначену кількість днів, або може бути встановлений фахівцем в цій галузі використовуючи звичайний порядок дій в ході тестів. Сполуки представленого опису можуть вводитись орально або парентерально, де сполуки можна одержати у формі таблеток, пігулок, порошку і гранул, що вводяться за допомогою різних шляхів. У згаданих вище твердих дозованих формах, активні компоненти змішують з принаймні одним видом інертного розріджувача. Згідно із звичайною практикою, оральні дозовані форми також включають інші речовини, такі як лубриканти, гліданти і антиоксиданти, окрім інертного розріджувача. Якщо одержують капсули, таблетки і пігулки, дозовані форми містять буферувальні агенти. Таблетки і пігулки можна одержати у формі дозованих форм тривалого вивільнення. Хоча можуть бути використані неводні емульсії, парентеральні дозовані форми представленого опису містять стерильний водний розчин ί ці дозованіформи також містять ад'юванти, наприклад, антисептики, зволожувальні агенти, змочувальні агенти, буфери, емульгатори і дисперганти. Для стерилізації можуть використовуватись фільтри, що затримують бактерії, і стерилізувальні агенти додаються до композицій, які опромінюють або нагрівають для стерилізації. Порівняно з вільними кислотами, солі представленого опису мають наступні переваги: (1) Солі представленого опису легко розчиняються у звичайних розчинниках, таких як вода, метанол, 0,1 % хлорводнева кислота і адаптуються для одержання звичайних дозованих форм, де розчинність етаноламінових солей очевидно поліпшується в 0,1% хлорводневій кислоті. (2) Солі представленого опису мають поліпшену стабільність. (3) Солі представленого опису мають кращу біологічну активність in vitro. (4) Солі представленого опису мають кращі фармакокінетичні характеристики in vivo, кращу абсорбцію, вищу біодоступність і кращу фармакокінетичну криву, де етаноламінова сіль, холінова сіль, піперазинова сіль, меглумінова сіль і трометамінова сіль мають кращі фармакокінетичні характеристики, переважно етаноламінова сіль. (5) Спосіб одержання солей представленого опису має переваги, що обумовлено високим виходом, високою чистотою, швидкістю, зручністю і дешевизно, де етаноламінова сіль, холінова сіль, діетиламінова сіль і піперазинова сіль є найбільш переважними на стадіях способу, і вони можуть бути кристалізовані безпосередньо. Порівняно з вільними кислотами, солі представленого опису мають кращі характеристики розчинності, стабільності, біологічної активності in vitro і фармакокінетичні властивості, переважно діетиламінова сіль, етаноламінова сіль, холінова сіль, піперазинова сіль, меглумінова сіль і трометамінова сіль, більш переважно етаноламінова сіль, холінова сіль, меглумінова сіль і трометамінова сіль, найбільш переважно етаноламінова сіль. Детальний опис Якщо не вказано інше, наступні терміни, що використовували в описі і формулі винаходу, мають значення описані нижче. Термін "етаноламін" стосується "2-аміноетанолу". Термін "холін" стосується "(2-гідроксиетил)триметиламіну". Термін "меглумін" стосується "N-метил-D-меглуміну". 9 UA 107353 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "фармацевтична композиція" стосується суміші однієї або більше фармацевтично прийнятних солей сполуки описаної тут або її проліків, з іншими хімічними компонентами, такими як фізіологічно/фармацевтично прийнятні носії. Ціллю фармацевтичної композиції є полегшення введення сполуки в організм. Термін "стабільність" стосується хімічної стабільності і стабільності зберігання. Термін "хімічна стабільність" стосується зберігання сполук представленого опису включаючи виділені форми або дозовані форми змішані з фармацевтично прийнятними носіями або розріджувачами (наприклад, оральна дозована форма, така як таблетки, капсули і т.і.) за стандартних умов з незначною хімічною деградацією або хімічним розкладанням. Термін "стабільність зберігання" стосується зберігання сполук представленого опису включаючи виділені тверді форми або дозовані форми змішані з фармацевтично прийнятними носіями або розріджувачами у твердій формі (наприклад, оральна дозована форма, така як таблетки, капсули і т.і.) за стандартних умов з незначною трансформацією твердого стану (наприклад, кристалізація, перекристалізація, зміну твердотільної фази, гідратацію, дегідратацію, сольватацію або видалення розчинника). Приклади терміну "зберігання за стандартних умов" включають інтервал температур від 80°C до +50°С (переважно від 0°C до 40°C, більш переважно при кімнатній температурі, такій як 15°С~30°С), тиску в інтервалі від 0,1 Па до 2 Па (переважно при атмосферному тиску), відносній вологості в інтервалі від 5% до 95% (переважно 10%~60%) і/або опроміненні 460 люкс УФ/видимим світлом протягом тривалого часу (довше ніж або еквівалентно шести місяцям). Термін "парентеральне введення" включає внутрішньовенне, внутіршьом'язове, підшкірне, інтраназальне, інтратекальне, інтравагінальне або інтраперітонеальне введення, переважно, оральне введення. Термін фармацевтично "гігроскопічний" стосується характеристики, що характеризує здатність або ступінь абсорбування сполукою води при деякій температурі і вологості. Тестовані зразки є твердими інгредієнтами, що задовольняють Стандартам контролю якості лікарських засобів. Умови пакування лікарського засобу і зберігання можуть визначатись за результатами згаданих вище тестів. Спосіб синтезу сполук опису Для того щоб досягти цілей опису, опис використовує наступні технічні рішення: Спосіб синтезу сполука формули (І) стосується прикладу 1, прикладу 9, прикладу 15, прикладу 28, прикладу 43 і прикладу 52 міжнародної заявки № PCT/CN2009/000001 поданої 4 січня 2009. Заявка була включена сюди повністю через посилання. Спосіб одержання фармацевтично прийнятних солей сполук формули (І) включає стадії: (а) розчинення або суспендування вільної кислоти представленого опису (сполука формули (I)) в органічному розчиннику, де органічний розчинник вибирають з групи, що містить метанол, етанол, ацетон, етилацетат і тетрагідрофуран, переважно тетрагідрофуран; (b) додавання основи до суміші при перемішуванні, де основа може бути органічною або неорганічною основою, такою як гідроксид лужного металу або гідроксид лужноземельного металу, основна амінокислота, амін або четвертинний амоній; (d) одержання фармацевтично прийнятні солі сполуки формули (І), де неорганічні основи включають гідроксиди лужних металів, які вибирають з групи, що містить гідроксид натрію, гідроксид літію, гідроксид калію, гідроксид кальцію, гідроксид магнію; основні амінокислоти вибирають з групи, що містить лізин і аргінін; аміни вибирають з групи, що містить метанамін, диметиламін, триметиламін, етиламін, діетиламін, триетиламін, етаноламін, піперазин, дибензил етилендіамін, меглумін і трометамін; і четвертинні амонії вибирають з групи, що містить тетраметиламоній, тетраетиламоній, гідроксид холіну, переважно діетиламін, етаноламін, гідроксид холіну, піперазин, меглумін і трометамін, більш переважно етаноламін, гідроксид холіну, меглумін і трометамін, найбільш переважно етаноламін. На стадії (b), співвідношення вільної кислоти і основи переважно 1:5~5:1, більш переважно 1:1~1:3 і найбільш переважно 1:1-1:2. На стадії (с), відокремлення солей переважно включає безпосередню фільтрацію з реакційної суміші, концентрування з реакційної суміші і перекристалізацію з органічного розчинника. Солі висушують за таких умов, як вакуумна сушка або висушування в потоці гарячого повітря. Реакції з утворення солей зазвичай проводять за умов охолодження, при кімнатній температурі або нагріванні. Однак, слід відмітити, що температура реакції залежить від утворюваної солі і це добре відомо середньому фахівцю в цій галузі. Інтервал температур реакцій представленого опису становить від кімнатної температури до температури кипіння 10 UA 107353 C2 5 10 15 20 25 30 35 40 45 розчинника реакції, переважно 0~40°С. Фахівець в цій галузі може легко визначити найбільш переважну температуру реакції утворення солі використовуючи звичайні методики. Представлений опис далі описується за допомогою наступних Прикладів, які не призначені для обмеження рамок опису. ПРИКЛАДИ Структуру сполук підтверджували за допомогою спектрів ядерного магнітного резонансу 1 ( НЯМР) або масспектроскопії (MC). ЯМР знімали на спектрометрі Bruker AVANCE-400. Прийнятними розчинниками є дейтерований-метанол (CD3OD), дейтерований-хлороформ (CDCI3) і дейтерованийдиметилсульфоксид (ДМСО-d6) з тетраметилсиланом (TMC), як внутрішній стандарт, і хімічні -6 зсуви виражали як м.ч. (10 ). MC визначали використовуючи масспектрометр FINNIGAN LCQAd (ECI) (виробник: Thermo, тип: Finnigan LCQ advantage MAX).. ЕС50 визначали на NovoStar ELIASA (BMG Co. German). Використовували пластинки з силікагелем для тонкошарової хроматографії Yantai Huanghai HSGF254 або Qingdao GF254. Пластинками використовуваними в ТШХ були 0,15 мм~0,2 мм і пластинками використовуваними при очищенні продуктів були 0,4 мм~0,5 мм. Для колонкової хроматографії зазвичай використовували силікагель Yantai Huanghai 200300 меш, як носій. ВЕРХ проводили на спектрометрі для високоефективної рідинної хроматографії Agilent 1200DAD (хроматографічна колонка Sunfire C18 150x4,6 мм) і на спектрометрі для високоефективної рідинної хроматографії Waters 2695-2996 (хроматографічна колонка Gimini C18 150x4,6 мм). Реакції при тиску водню проводили використовуючи гідрогенатор Парра 3916EKX і генератор водню QL. Реакції при мікрохвильовому опроміненні проводили використовуючи мікрохвильовий реактор CEM Discover-S 908860. В реакціях гідрування, реакційну систему зазвичай вакуумували і наповнювали воднем, повторювали операцію три рази. Відомі вихідні матеріали винаходу можуть бути одержані використовуючи звичайний спосіб синтезу або одержати від ABCR GmbH & Со. КГ, Acros Organics, Aldrich Chemical Company, Accela ChemBio lnc, Darui Finechemical Co., Ltd і t.L Якщо не вказано інше, наступні реакції проводили в атмосфері азоту. "Атмосфера азоту" означає, що реакційна колба устаткована кулькою з азотом приблизно 1 л. "Атмосфера водню" означає, що реакційна колба устаткована кулькою з воднем приблизно 1 л. Якщо не вказано інше, розчин використовуваний в наступних реакціях стосується водного розчину. Термін "TШX" стосується тонкошарової хроматографії. Термін "ВЕРХ" стосується високоефективної рідинної хроматографії. Умови ВЕРХ тесту: час: 30 хв, температура колонки: 30°С PDA:230 нм, рухома фаза: ацетонітрил:вода (0,1% трифтороцтова кислота) = 25:75, швидкість потоку: 1,0 мл/хвилину. Хроматографічна колонка: С18, 150*4,6 мм Gemini. Приклад 1 (Z)-2'-гiдpoкcи-3'-[N'-(1-iндaн-5-iл-3-мeтил-5-oкco-1,5-диriдpo-пipaзoл-4-iлiдeн)-riдpaзинo]бiфеніл-3-карбонової кислоти біс-(етаноламін) 11 UA 107353 C2 5 10 15 20 25 30 35 Стадія 1 2-Бром-6-нітро-фенол Розчин 60 мл концентрованої сірчаної кислоти розведеної 186 мл води, охолоджували до кімнатної температури. Додавали до розчину нітрит натрію (79,2 г, 0,93 моль). Краплями додавали 2-бром-фенол 1а (60 мл, 0,52 моль) з такою швидкістю, що температура реакції була нижче 25 °С. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Осад розчиняли в 320 мл етилацетату. Суміш промивали водою і насиченим розсолом, сушили над безводним сульфатом магнію, фільтрували і фільтрат концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, 2-бром-6-нітро-фенол, 1b (48,2 г, вихід 42,8%) як жовту тверду речовину. MC m/z (ECI): 218 [М+1] 1 H ЯМР (400 МГц, CDCI3): 11,18 (с, 1Н), 8,12-8,15 (м, 1Н), 7,89-7,91 (м, 1Н), 6,88-7,02 (м, 1Н) Стадія 2 1-Бром-2-метокси-3-нітро-бензол 2-Бром-6-нітро-фенол 1b (46,55 г, 0,214 моль) розчиняли в 500 мл ацетону після чого додавали карбонат калію (35,36 г, 0,26 моль) і йодметан (20,1 мл, 0,32 моль). Реакційну суміш нагрівали із зворотнім холодильником при 70 °С протягом 40 годин. Реакційну суміш концентрували при пониженому тиску і розводили 1300 мл етилацетату і 500 мл води. Водний шар екстрагували етилацетатом (300 мл2). Об'єднані органічні екстракти промивали 4 M хлорводневою кислотою і насиченим розчином бікарбонату натрію і потім сушили над безводним сульфатом магнію, фільтрували і фільтрат концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, 1-бром-2-метокси-3-нітро-бензол, 1с (44,59 г, вихід 90,0%) як коричневу тверду речовину. MC m/z (ECI): 234 [М+1] Стадія 3 2'-Метокси-3'-нітро-біфеніл-3-карбонова кислота 1-Бром-2-метокси-3-нітро-бензол 1с (23,25 г, 0,10 моль), 3-карбоксифенілборну кислоту (19,5 г, 117 ммоль) і тетракіс(трифенілфосфін)паладій (8,86 г, 7,7 моль) розчиняли в суміші розчинників 100 мл 2 M розчину карбонату натрію і 500 мл 1,4-діоксану. Реакційну суміш нагрівали із зворотнім холодильником при 105 °С протягом 43 годин. Суміш концентрували при пониженому тиску і потім додавали 300 мл 6 N хлорводневої кислоти і 400 мл етилацетату. Водний шар екстрагували етилацетатом (200 мл2). Об'єднані органічні екстракти сушили над безводним сульфатом магнію, фільтрували і фільтрат концентрували при пониженому тиску, 12 UA 107353 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержуючи вказану в заголовку сполуку, 2'-метокси-3'-нітро-біфеніл-3-карбонову кислоту, 1d (53,93 г) як світло-жовту тверду речовину. MC m/z (ECI): 272 [М-1] 1 H ЯМР (400 МГц, CDCI3): 8,11 (с, 1Н), 8,02 (д, J=8,0 Гц, 1H), 7,90-7,92 (м, 1H), 7,82-7,84 (м, 1H), 7,21-7,75 (м, 1H), 7,63-7,67 (м, 1H), 7,42-7,46 (м, 1H), 3,45 (с, 3H) Стадія 4 2'-Метокси-3'-аміно-біфеніл-3-карбонова кислота 2'-Метокси-3'-нітро-біфеніл-3-карбонову кислоту 1d (0,48 г, 1,74 ммоль) розчиняли в 60 мл етанолу після чого додавали 0,5 г паладію на вугіллі (10%) і форміат амонію (1,1 г, 17,4 ммоль). Реакційну суміш нагрівали із зворотнім холодильником при 80°C протягом 20 хвилин. Суміш фільтрували і фільтрат концентрували при пониженому тиску і сушили, одержуючи вказану в заголовку сполуку, 2'-метокси-3'-аміно-біфеніл-3-карбонову кислоту, 1е (0,42 г, вихід 93,3%) як білу тверду речовину. MC m/z (ECI): 242 [М-1] Стадія 5 3'-Аміно-2'-гідрокси-біфеніл-3-карбонової кислоти гідробромід Використовували відому методику описану в заявці WO0189457: 2'-Метокси-3'-амінобіфеніл-3-карбонову кислоту 1е (2,5 г, 10,3 ммоль) розчиняли в 100 мл бромводневої кислоти (40%). Реакційну суміш нагрівали із зворотнім холодильником при 120 °С протягом ночі. Суміш концентрували при пониженому тиску і одержаний залишок очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, 3'-аміно-2'-гідроксибіфеніл-3-карбонової кислоти гідробромід, 1f (2,4 г, 88,8% ) як тверду речовину кольору хакі. MC m/z (ECI): 230 [М+1] Стадія 6 Індан-5-іл-гідразин Індан-5-іламін 1д (3,59 г, 27,0 ммоль) розчиняли в 20 мл концентрованої хлорводневої кислоти при охолодженні на бані лід-вода і суміш перемішували 10 хвилин. Краплями додавали 10 мл розчину нітриту натрію (1,86 г, 27,0 ммоль) і суміш перемішували ще 15 хвилин і використовували в наступній реакції. При охолодженні на бані лід-вода, дигідрат хлориду олова (24,4 г, 108,0 ммоль) розчиняли в 10 мл концентрованої хлорводневої кислоти після чого додавали згадану вище суміш. Реакційну суміш нагрівали до кімнатної температури і витримували 1,5 годин. Потім суміш доводили до рН 9 40% розчином гідроксиду натрію при охолодженні на бані лід-вода. Суміш екстрагували 400 мл етилацетату і об'єднані органічні екстракти концентрували при пониженому тиску і сушили, одержуючи вказану в заголовку сполуку, індан-5-іл-гідразин, 1h (2,05 г, вихід 51,3%) як руду тверду речовину. MC m/z (ECI): 149 [М+1] Стадія 7 2-Індан-5-іл-5-метил-2,4-дигідро-піразол-3-он Індан-5-іл-гідразин 1h (2,05 г, 13,8 ммоль) розчиняли в 50 мл оцтової кислоти після чого додавали етилацетоацетат (1,76 мл, 13,8 ммоль). Реакційну суміш нагрівали при 100 °С протягом ночі. Суміш концентрували при пониженому тиску і одержаний залишок очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, 2-індан-5-іл5-метил-2,4-дигідро-піразол-3-он, 1і (1,84 г, вихід 62,3%) як жовту тверду речовину. MC m/z (ECI): 215 [М+1] 1 H ЯМР (400 МГц, CDCI3): 7,69 (с, 1Н), 7,60 (д, J = 8,0 Гц, 1Н), 7,24 (д, J = 8 Гц, 1Н), 3,44 (с, 2H), 2,90-2,97 (м, 4H), 3,21 (с, 3H), 2,07-2,14 (м, 2H) Стадія 8 (Z)-2'-Гідрокси-3'-[Н'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонова кислота При охолодженні на бані лід-вода, 3'-аміно-2'-гідрокси-біфеніл-3-карбонової кислоти гідробромід 1f (267 мг, 1,16 ммоль) розчиняли в 10 мл 1М хлорводневої кислоти після чого краплями додавали 10 мл розчину нітриту натрію (88 мг, 1,28 ммоль) і 2-індан-5-іл-5-метил-2,4дигідро-піразол-3-он 1і (249 мг, 1,16 ммоль). Суміш доводили до рН 8 насиченим розчином бікарбонату натрію, після чого додавали 10 мл етанолу. Реакційну суміш нагрівали до кімнатної температури протягом ночі. Суміш фільтрували, сушили і перекристалізували з метанолу одержуючи вказану в заголовку сполуку, (Z)-2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-карбоніл1,5-дигідро-піразол-4-іліден)-гідразино]-біфеніл-3-карбонову кислоту, 1j (60 мг, вихід 11,4%) як жовту тверду речовину. MC m/z (ECI): 453 [М-1] 13 UA 107353 C2 H ЯМР (400 МГц, ДМСО-d6): 13,76 (ш с, 1Н), 13,03 (ш с, 1Н), 9,66 (ш с, 1Н), 8,13 (с, 1Н), 7,96-7,98 (д, J= 8,1 Гц, 1Н), 7,60-7,82 (м, 5Н), 7,28-7,30 (д, J = 8,1 Гц, 1Н), 7,13-7,17 (м, 2Н), 2,862,93 (м, 4Н), 2,34 (с, 3H), 2,03-2,10 (м, 2Н) Стадія 9 (Z)-2'-Гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонової кислоти біс-(етаноламін) (Z)-2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-карбоніл-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонову кислоту 1j (454 мг, 1,0 ммоль) розчиняли в 16 мл тетрагідрофурану. До реакційної суміші додавали етаноламін (143 мг, 2,35 ммоль) і перемішували 3 години. Суміш фільтрували, залишок на фільтрі промивали тетрагідрофураном (2 мл3), і тверду речовину сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-2'-гідрокси-3'-[N'-(1-індан-5-іл-3метил-5-карбоніл-1,5-дигідро-піразол-4-іліден)-гідразино]-біфеніл-3-карбонової кислоти біс(етаноламін), 1 (553 мг, вихід: 96,0%) як темно-червону тверду речовину. MC m/z (ECI): 453 [М-1] 1 H ЯМР (400 МГц, CD3OD): 8,13 (с, 1Н), 7,92 (д, J=7,6 Гц, 1H), 7,69 (м, 3H), 7,61 (д, J=8,0 Гц, 1H), 7,45 (т, J=7,6 Гц, 1H), 7,25 (д, J=8,0 Гц, 1H), 7,17 (д, J=8,0 Гц, 1H), 6,98 (т, J=8,0 Гц, 1H), 3,65 (т, J=5,2 Гц, 4H), 2,95 (м, 4H), 2,86 (т, J=5,2 Гц, 4H), 2,41 (с, 3Н), 2,12 (м, 2H) Приклад 2 (Z)-2'-гiдpoкcи-3'-[N'-(1-iндaн-5-iл-3-мeтил-5-oкco-1,5-дигiдpo-пipaзoл-4-iлiдeн)-гiдpaзино]біфеніл-3-карбонової кислоти біс-(діетиламін) 1 5 10 15 20 25 30 35 40 (Z)-2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-карбоніл-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонову кислоту 1j (150 мг, 0,33 ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червоний розчин. До розчину краплями додавали діетиламін (48 мг, 0,66 ммоль), одержуючи пурпуровий розчин, і перемішували 2 години. Тверда речовина випадала в осад з розчину. Суміш фільтрували, залишок на фільтрі промивали тетрагідрофураном (1 мл3) і тверду речовину сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-2'-гідрокси-3'[N'-(1-індан-5-іл-3-метил-5-карбоніл-1,5-дигідро-піразол-4-іліден)-гідразино]-біфеніл-3карбонової кислоти біс-(діетиламін), 2 (132 мг, вихід: 66,7%) як червону тверду речовину. ВЕРХ: 99,2% MC m/z (ECI): 452,9 [М-1] 1 H ЯМР (400 МГц, CD3OD): 8,08 (м, 1Н), 7,94 (д, J=7,6 Гц, 1Н), 7,72 (м, 2Н), 7,62 (м, 2Н), 7,55 (м, 1Н), 7,25 (д, J=8,4 Гц, 1Н), 7,14 (д, J=8,4 Гц, 1Н), 7,07 (м, 1Н), 2,89-2,98 (м, 12Н), 2,38 (с, 3H), 2,09-2,14 (м, 2Н), 1,34 (м, 12Н) Приклад 3 (Z)-2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонової кислоти біс-(піперазин) (Z)-2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-карбоніл-1,5-дигідро-піразол-4-іліден)-гідразино]біфеніл-3-карбонову кислоту 1j (150 мг, 0,33 ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші додавали піперазин (57 мг, 0,66 ммоль), одержуючи пурпуровий розчин і перемішували при кімнатній температурі протягом 2 годин. Тверда речовина випадала в осад з розчину, її фільтрували, потім залишок на фільтрі 14 UA 107353 C2 5 10 15 20 25 промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-2'-гідрокси-3'-[N'-(1-індан-5-іл-3-метил-5-карбоніл-1,5-дигідро-піразол-4-іліден)гідразино]-біфеніл-3-карбонової кислоти біс-(піперазин), 3 (130 мг, вихід: 62,8%) як темночервону тверду речовину. ВЕРХ: 98,5% MC m/z (ECI): 452,8 [М-1] 1 H ЯМР (400 МГц, CD3OD): 8,10 (с, 1Н), 7,92 (д, J=7,6 Гц, 1H), 7,68 (м, 3H), 7,61 (м, 1H), 7,43 (м, 1H), 7,24 (д, J=8,0 Гц, 1H), 7,15 (м, 1H), 7,00 (м, 1H), 2,89-2,95 (м, 4H), 2,84 (с, 16H), 2,39 (с, 3H), 2,09-2,12 (м, 2H) Приклад 4 (Z)-5-(3-{N'-[1-(3,3-диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2-гідрокси-феніл)-фуран-2-карбонової кислоти біс-(етаноламін) Стадія 1 Ди-трет-бутил 1-(3,3-диметил-інден-5-іл)гідразин-1,2-дикарбоксилат 6-Бром-1,1-диметил-індан (одержували викорстовуючи добре відому методику: заявка WO2Q05066115) 4а (4,32 г, 19,27 ммоль) розчиняли в 40 мл тетрагідрофурану і потім краплями при -78 °С додавали бутиллітій (15,67 мл, 1,6 M, 25,05 ммоль). Після реагування реакційної суміші 40 хвилин, додавали розчин ди-трет-бутилазодикарбоксилату (5,32 г, 23,12 ммоль) в 30 мл тетрагідрофурану. Реакційна суміш реагувала ще 3 години при -78 °C. До реакційної суміші додавали 5 мл метанолу, потім нагрівали до кімнатної температури і фільтрували через силікагель. Фільтрат концентрували при пониженому тиску і одержаний залишок очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, ди-третбутил 1-(3,3-диметил-1H-інден-5-іл)гідразин-1,2-дикарбоксилат, 4b (2,70 г, вихід 37,2%) як жовту тверду речовину. Стадія 2 2-(3,3-Диметил-індан-5-іл)-5-метил-2,4-дигідро-піразол-3-он Ди-трет-бутил 1-(3,3-диметил-1H-інден-5-іл)гідразин-1,2-дикарбоксилат 4b (2,70 г, 7,18 ммоль) розчиняли в 100 мл оцтової кислоти після чого додавали 20 мл трифтороцтової кислоти. 15 UA 107353 C2 5 10 15 20 25 30 35 40 45 50 55 60 Після реагування суміші при кімнатній температурі протягом 2 годин, додавали етилацетоацетат (0,98 г, 7,54 ммоль). Потім суміш нагрівали до 100 °C і вона реагувала 2 години. Суміш охолоджували до кімнатної температури і концентрували при пониженому тиску видаляючи оцтову кислоту. Реакційну суміш нейтралізували насиченим розчином бікарбонату натрію і потім екстрагували етилацетатом. Об'єднані органічні екстракти промивали насиченим розсолом, сушили над безводним сульфатом натрію, фільтрували і концентрували при пониженому тиску. Одержаний залишок очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, 2-(3,3-диметил-індан-5-іл)-5-метил-2,4-дигідро-піразол3-он, 4с (1,0 г, вихід 47,7%) як світло-коричневу тверду речовину. MC m/z (ECl): 243 [M+1] Стадія 3 2-(2-Метокси-3-нітро-феніл)-4,4,5,5-тетраметил-[1,3,2]діоксаборолан 1-Бром-2-метокси-3~нітро-бензол 1с (67 г, 289 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі1,3,2-діоксаборолан (110 г, 433 ммоль), тетракіс(трифенілфосфін)паладій (11,80 г, 14,44 ммоль) і ацетат калію (71 г, 724 ммоль) розчиняли в 600 мл диметилового естеру щавлевої кислоти. Суміш нагрівали із зворотнім холодильником протягом 17 годин. Суміш концентрували при пониженому тиску і одержаний залишок очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, 2-(2-метокси-3-нітро-феніл)-4,4,5,5-тетраметил[1,3,2]діоксаборолан, 4d (50,5 г, 61,9% ) як жовті кристали. Стадія 4 5-(2-Метокси-3-нітро-феніл)фуран-2-карбонова кислота 2-(2-Метокси-3-нітро-феніл)-4,4,5,5-тетраметил-[1,3,2]діоксаборолан 4d (10 г, 35,85 ммоль), 5-бромфуран-2-карбонову кислоту (5,47 г, 28,66 ммоль), тетракіс(трифенілфосфін)паладій (2,07 г, 1,79 ммоль) і карбонат натрію (7,60 г, 71,66 ммоль) розчиняли в суміші розчинників 200 мл 1,4-діоксану і 30 мл води. Реакційну суміш нагрівали із зворотнім холодильником протягом 2,5 годин. Суміш фільтрували і фільтрат концентрували при пониженому тиску. Залишок розводили 150 мл води і коригували рН до 3 використовуючи 1 M хлорводневу кислоту. Потім суміш фільтрували і залишок на фільтрі промивали 50 мл суміші розчинників н-гексан/етилацетат (о/о = 1:1). Залишок сушили, одержуючи вказану в заголовку сполуку, 5-(2-метокси-3-нітро-феніл) фуран-2-карбонову кислоту, 4е (4,23 г, вихід 56,1%) як сіру тверду речовину. MC m/z (ECl): 262 [М-1] Стадія 5 5-(3-Аміно-2-метокси-феніл)-фуран-2-карбонова кислота 5-(2-метокси-3-нітро-феніл)фуран-2-карбонову кислоту 4е (4,23 г, 16,09 ммоль) розчиняли в 125 мл етилацетату після чого додавали 423 мг паладію на вугіллі (10%) і форміат амонію (4,054 г, 64,35 ммоль). Реакційну суміш нагрівали із зворотнім холодильником протягом 3,5 годин. Суміш концентрували при пониженому тиску і одержаний залишок очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, 5-(3-аміно-2-метоксифеніл)-фуран-2-карбонову кислоту, 4f (2,79 г, вихід 74,4%) як світло-зелену тверду речовину. MC m/z (ECI): 232 [М-1 ] Стадія 6 5-(3-Аміно-2-гідрокси-феніл)-фуран-2-карбонової кислоти гідробромід 5-(3-Аміно-2-метокси-феніл)-фуран-2-карбонову кислоту 4f (2,79 г, 11,97 ммоль) розчиняли в 25 мл дихлорметану після чого краплями додавали трибромід бору (23,9 мл, 2.0 M). Реакційна суміш реагувала при кімнатній температурі протягом 1 години. Суміш концентрували при пониженому тиску після додавання 5 мл метанолу. Залишок розводили 100 мл етилацетату і перемішували 1 годину. Потім суміш фільтрували і залишок на фільтрі сушили, одержуючи вказану в заголовку сполуку, 5-(3-аміно-2-гідрокси-феніл)-фуран-2-карбонової кислоти гідробромід, 4g (1,24 г, вихід 47,2%) як жовту тверду речовину. MC m/z (ECI): 218 [М-1] Стадія 7 (Z)-5-(3-{N'-[1-(3,3-диметі/іл-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2-гідрокси-феніл)-фуран-2-карбонова кислота (Z)-5-(3-Аміно-2-гідрокси-феніл)-фуран-2-карбонової кислоти гідробромід 4g (333 мг, 1,1 ммоль) розчиняли в хлорводневій кислоті (3,7 мл, 1 M) при охолодженні на бані лід-вода, після чого краплями додавали 1,5 мл розчину нітриту натрію (85 мг, 1,22 ммоль). Після реагування суміші 20 хвилин, послідовно додавали 2-(3,3-диметил-індан-5-іл)-5-метил-2,4-дигідро-піразол3-он 4с (242 мг, 1,0 ммоль), бікарбонат натрію (1,4 г, 16,67 ммоль) і 3 мл етанолу. Реакційна суміш реагувала протягом ночі при кімнатній температурі. Суміш фільтрували і до залишку на фільтрі додавали 20 мл води. Суміш доводили до рН 3~4 концентрованою хлорводневою 16 UA 107353 C2 5 10 15 20 25 30 35 40 кислотою. Суміш фільтрували і залишок на фільтрі сушили і очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, (Ζ)-5-(3-{Ν'-[1-(3,3диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]-гідразино}-2-гідрокси-феніл)фуран-2-карбонову кислоту, 4h (190 мг, вихід 40,3%) як червону тверду речовину. MC m/z (ECI): 470,9 [М-1] 1 H ЯМР (400 МГц, ДМСО-d6): 13,74(ш с, 1Н), 13,15(ш с, 1Н), 9,99 (ш с, 1Н), 7,71 (м, 3H), 7,55 (д, J=6,8 Гц, 1Н), 7,37 (д, J=3,6 Гц, 1Н), 7,20 (м, 2H), 7,15 (м, 1H), 2,86 (т, J=7,2 Гц, 2Н), 2,33 (с, 3H), 1,92 (т, J=7,2 Гц, 2H), 1,26 (с, 6Н) Стадія 8 (Z)-5-(3-{N'-[1-(3,3-диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2-гідрокси-феніл)-фуран-2-карбонової кислоти біс-(етаноламін) (Z-5-(3-{N'-[1-(3,3-диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2-гідрокси-феніл)-фуран-2-карбонову кислоту 4h (2,3 г, 4,87 ммоль) розчиняли в 20 мл тетрагідрофурану. До розчину додавали етаноламін (594 мг, 9,75 ммоль) і перемішували 1 годину при кімнатній температурі. Суміш фільтрували, залишок на фільтрі промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5(3-{N'-[1-(3,3-диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]-гідразино}-2гідрокси-феніл)-фуран-2-карбонової кислоти біс-(етаноламін) 4 (2,5 г, вихід: 86,4%) як чорну тверду речовину. MC m/z (ECI): 470,8 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,57 (м, 4Н), 7,19 (м, 1Н), 7,03 (д, J=3,6 Гц, 1Н), 6,95 (д, J=3,6 Гц, 1Н), 6,71 (т, J=8,0 Гц, 1H), 3,73 (т, J=5,2 Гц, 4H), 2,98 (м, 4H), 2,88 (т, J=7,2 Гц, 2Н), 2,36 (с, 3H), 1,96 (т, J=7,2 Гц, 2H), 1,29 (с, 6Н) Приклад 5 (Z)-5-(3-{Н'-[1-(3,3-диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино)-2-гідрокси-феніл)-фуран-2-карбонової кислоти біс-(діетиламін) (Z)-5-(3-{N'-[1-(3,3-диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2-гідрокси-феніл)-фуран-2-карбонову кислоту 4h (150 мг, 0,32 ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші додавали діетиламін (46 мг, 0,63 ммоль), одержуючи пурпуровий розчин і перемішували при кімнатній температурі протягом ночі. Розчин концентрували при пониженому тиску, одержаний залишок очищали колонковою хроматографією на силікагелі, (гексан: етилацетат = 10:1) і тверду речовину сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5-(3-{N'-[1-(3,3-диметиліндан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]-гідразино}-2-гідрокси-феніл)-фуран-2карбонової кислоти біс-(діетиламін) 5 (170 мг, вихід: 86,7%) як темно-червону тверду речовину. ВЕРХ: 94,6% MC m/z (ECI): 471,9 [M-1] 1 H ЯМР (400 МГц, CD3OD): 7,60 (м, 4H), 7,19 (м, 1H), 7,04 (м, 1H), 6,87 (м, 2H), 2,98 (к, J=7,2 Гц, 8H), 2,89 (т, J=7,2 Гц, 2H), 2,36 (с, 3H), 1,96 (т, J=7,2 Гц, 2H), 1,27 (т, J=7,2 Гц, 12H), 1,25 (с, 6H) Приклад 6 (Z)-5-(3-{N'-[1-(3,3-диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино)-2-гідрокси-феніл)-фуран-2-кар6онової кислоти біс-(піперазин) 17 UA 107353 C2 5 10 15 20 25 (Z)-5-(3-{N'-[1-(3,3-диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден]гідразино}-2-гідрокси-феніл)-фуран-2-карбонову кислоту 4h (150 мг, 0,32 ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші додавали піперазин (55 мг, 0,64 ммоль), одержуючи пурпуровий розчин, і перемішували при кімнатній температурі протягом ночі. Суміш фільтрували, залишок на фільтрі промивали тетрагідрофураном (1 мл3), і тверду речовину сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5-(3-{N'-[1-(3,3-диметил-індан-5-іл)-3-метил-5-оксо-1,5-дигідро-піразол-4іліден]-гідразино}-2-гідрокси-феніл)-фуран-2-карбонової кислоти біс-(піперазин), 6 (158 мг, вихід: 77,1%) як червону тверду речовину. ВЕРХ: 99,28% MC m/z (ECI): 471,8 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,64-7,66 (м, 3H), 7,55 (д, J=8,0 Гц, 1Н), 7,21 (д, J=8,0 Гц, 1Н), 7,04 (м, 1Н), 6,87-6,88 (м, 2Н), 3,01 (с, 16Н), 2,90 (т, J=7,2 Гц, 2H), 2,38 (с, 3Н), 1,97 (т, J=7,2 Гц, 2Н), 1,29 (с, 6H) Приклад 7 (Z)-5-{2-гідрокси-3-({N'-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідро-піразол4-іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти біс-(етаноламін) Стадія 1 (5,6,7,8-Тетрагідро-нафталін-2-іл)-гідразин 5,6,7,8-Тетрагідро-нафталін-2-іламін 7а (3,68 г, 25,0 ммоль) розчиняли в 20 мл концентрованої хлорводневої кислоти і суміш перемішували 10 хвилин при охолодженні на бані лід-вода. Краплями додавали 10 мл розчину нітриту натрію (1,72 г, 25,0 ммоль) і суміш перемішували ще 15 хвилин і використовували в наступній реакції. При охолодженні на бані лід-вода, дигідрат хлориду олова (22,6 г, 100 ммоль) розчиняли в 10 мл концентрованої хлорводневої кислоти після чого додавали до згаданої вище суміші. Реакційну суміш нагрівали до кімнатної температури і вона реагувала 1,5 годин. Потім суміш 18 UA 107353 C2 5 10 15 20 25 30 35 40 45 50 доводили до рН 9 40% розчином гідроксиду натрію. Суміш екстрагували 400 мл етилацетату, потім об'єднані органічні екстракти концентрували при пониженому тиску і сушили, одержуючи вказану в заголовку сполуку, (5,6,7,8-тетрагідро-нафталін-2-іл)-гідразин, 7b (2,19 г, вихід 53,7%) як жовте масло. MC m/z (ECI): 163 [М+1] Стадія 2 5-Метил-2-(5,6,7,8-тетрагідро-нафталін-2-іл)-2,4-дигідро-піразол-3-он (5,6,7,8-Тетрагідро-нафталін-2-іл)-гідразин 7b (2,0 г, 12,3 ммоль) розчиняли в 50 мл оцтової кислоти після чого додавали етилацетоацетат (1,57 мл, 12,3 ммоль). Реакційну суміш нагрівали при 100 °С протягом ночі. Суміш концентрували при пониженому тиску і одержаний залишок очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, 5метил-2-(5,6,7,8-тетрагідро-нафталін-2-іл)-2,4-дигідро-піразол-3-он, 7с (1,58 г, вихід 56,2%) як безбарвне масло. MC m/z (ECI): 457 [2М+1] 1 H ЯМР (CDCI3): 7,54-7,58 (м, 2Н), 7,09 (д, J=8 Гц, 1Н), 3,43 (с, 2Н), 2,77-2,81 (м, 4Н), 2,21 (с, 3Н), 1,80-1,83 (м, 4Н). Стадія 3 (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонова кислота 5-(3-Аміно-2-гідрокси-феніл)-фуран-2-карбонової кислоти гідробромід 4д (292 мг, 0,98 ммоль) розчиняли в 3,3 мл 1М хлорводневої кислоти при охолодженні на бані лід-вода, після чого краплями додавали 1,3 мл розчину нітриту натрію (74 мг, 1,07 ммоль). Після перемішування суміші протягом 20 хвилин, додавали 5-метил-2-(5,6,7,8-тетрагідро-нафталін-2іл)-2,4-дигідро-піразол-3-он 7с (200 мг, 0,88 ммоль). Суміш доводили до рН 8-9 додаючи порцію розчину бікарбонату натрію (1,226 г, 14,6 ммоль). Кипіння гасили 2 мл етанолу. Реакційну суміш нагрівали до кімнатної температури і вона реагувала протягом ночі. Суміш фільтрували і залишок на фільтрі розчиняли в 20 мл води. Після перемішування, суміш доводили до рН 3~4 концентрованою хлорводневою кислотою, фільтрували і сушили. Неочищений продукт очищали ВЕРХ одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8тетрагідро-нафталін-2-іл)-1,5-дигідро-піразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонову кислоту, 7d (160 мг, вихід 39,8%) як червону тверду речовину. MC m/z (ECI): 457 [М-1] 1 H ЯМР (400 МГц, ДМСО-d6): 7,71 (д, J=8,4 Гц, 1Н), 7,63 (м, 2Н), 7,56 (д, J=7,6 Гц, 1 H), 7,37 (д, J=3,2 Гц, 1 H), 7,22 (т, J=8,0 Гц, 1 H), 7,13 (м, 2H), 2,75 (м, 4H), 2,33 (с, 3Н),1,76 (м, 4H) Стадія 4 (Z)-5-{2-гiдpoкcи-3-{N'-[3-мeтил-5-oкco-1-(5,6,7,8-тeтpaгiдpo-нaфтaлiн-2-iл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти біс-(етаноламін) (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонову кислоту 7d (3,3 г, 7,2 ммоль) розчиняли в 15 мл тетрагідрофурану. До реакційного розчину повільно краплями додавали етаноламін (0,88 г, 13 ммоль) і перемішували 1,5 годин при 15-20°C. З розчину в осад випадала велика кількість осаду, його фільтрували, потім залишок на фільтрі промивали тетрагідрофураном (10 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-{N'-[3-метил-5оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідро-піразол-4-іліден]-гідразино}-феніл)-фуран2-карбонової кислоти біс-(етаноламін), 7 (3 г, вихід: 74%) як темно-червону тверду речовину. ВЕРХ: 99,3% MC m/z (ECI): 456,8 [М-1] 1 H ЯМР (400 МГц, CH3OD): 67,51 (д, J=8,0 Гц, 1Н), 7,44-7,46 (м, 3H), 6,93-6,98 (м, 2Н), 6,88 (д, J=3,6 Гц, 1Н), 6,67 (т, J=8,0 Гц, 1H), 3,61 (т, J=5,2 Гц, 4H), 2,86 (т, J=5,2 Гц, 4Н), 2,65-2,70 (м, 4H), 2,24 (с, 3Н), 1,70-1,72 (с, 3H) Приклад 8 (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти біс-(холін) 19 UA 107353 C2 5 10 15 20 25 30 35 (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонову кислоту 7d (100 мг, 0,22 ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші додавали 45% розчин гідроксиду холіну в метанолі (45 мг, 0,44 ммоль), одержуючи пурпуровий розчин, і перемішували 1 годину при кімнатній температурі. Тверда речовина випадала в осад, фільтрували, потім залишок на фільтрі промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідро-піразол-4-іліден]-гідразино}-феніл)-фуран-2карбонової кислоти біс-(холін), 8 (140 мг, вихід: 96,6%) як темно-червону тверду речовину. ВЕРХ: 98,82% MC m/z (ECI): 457,8 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,74 (д, J=8,0 Гц, 1Н), 7,60 (м, 3Н), 7,08 (м, 3Н), 6,91 (т, J=8,0 Гц, 1Н), 3,96 (м, 4H), 3,45 (т, J=4,8 Гц, 4H), 3,18 (с, 18Н), 2,80 (м, 4H), 2,38 (с, 3Н),1,84 (м, 4H) Приклад 9 (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти біс-(діетиламін) (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонову кислоту 7d (100 мг, 0,22ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші краплями додавали діетиламін (32 мг, 0,44 ммоль), одержуючи пурпуровий розчин, і перемішували при кімнатній температурі протягом ночі. Тверда речовина випадала в осад, фільтрували, і залишок на фільтрі промивали тетрагідрофураном (1 мл3), тверду речовину сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-{N'-[3-метил-5оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідро-піразол-4-іліден]-гідразино}-феніл)-фуран2-карбонової кислоти біс-(діетиламін), 9 (77 мг, вихід: 58,3%) як темно-червону тверду речовину. ВЕРХ: 99,1% MC m/z (ECI): 457,9 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,59 (м, 4Н), 7,08 (д, J=8,0 Гц, 1H), 7,04 (д, J=3,6 Гц, 1Н), 6,94 (д, J=3,6 Гц, 1H), 6,82 (т, J=8,0 Гц, 1H), 2,99 (к, J=7,2 Гц, 8H), 2,79 (м, 4H), 2,36 (с, 3H), 1,82 (т, J=3,2 Гц, 4H), 1,27 (т, J=7,2 Гц, 12Н) Приклад 10 (Z)-5-{2-гідрокси-3-(N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти біс-(меглумін) 20 UA 107353 C2 5 10 15 20 25 30 35 (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонову кислоту 7d (100 мг, 0,22 ммоль) суспендували в 5 мл тетрагідрофурану, одержуючи темно-червону суспензію. До реакційної суміші додавали меглумін (85 мг, 0,44 ммоль) і перемішували при кімнатній температурі протягом ночі. До одержаного розчину додавали 4 мл метанолу і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-{N'-[3-метил-5оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідро-піразол-4-іліден]-гідразино}-феніл)-фуран2-карбонової кислоти біс-(меглумін), 10 (168 мг, вихід: 90,8%) як темно-червону тверду речовину. ВЕРХ: 97,7% MC m/z (ECI): 457,8 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,56 (м, 4Н), 7,06 (м, 2Н), 6,98 (д, J=3,2 Гц, 1Н), 6,75 (т, J=7,6 Гц, 1H), 4,08 (м, 2H), 3,81 (м, 2H), 3,77 (м, 2H), 3,63 (м, 6H), 3,11 (м, 4H), 2,76 (м, 4H), 2,64 (с, 6H), 2,33 (с, 3H), 1,79 (м, 4H) Приклад 11 (Z)-5-{2-гiдpoкcи-3-{N'-[3-мeтил-5-oкco-1-(5,6,7,8-тeтpariдpo-нaфтaлiн-2-iл)-1,5-дигiдpопіразол-4-іліден]-гідразино)-феніл)-фуран-2-карбонової кислоти біс-(піперазин) (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонову кислоту 7d (100 мг, 0,22 ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші додавали піперазин (37 мг, 0,44 ммоль), одержуючи пурпуровий розчин, і перемішували 2 годин при кімнатній температурі. Тверда речовина випадала в осад, фільтрували, потім залишок на фільтрі промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)1,5-дигідро-піразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти біс-(піперазин), 11 (120 мг, вихід: 87,6%) як темно-червону тверду речовину. ВЕРХ: 98,8% MC m/z (ECI): 457,8 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,59 (м, 4Н), 7,08 (д, J=8,0 Гц, 1Н), 7,04 (д, J=3,2 Гц, 1Н), 6,87 (д, J=3,2 Гц, 1 H), 6,82 (т, J=8,0 Гц, 1 H), 3,00 (с, 16H), 2,78 (м, 4H), 2,36 (с, 3H), 1,81(м, 4H) Приклад 12 (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти біс-(трометамол) 21 UA 107353 C2 5 10 15 20 25 30 (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонову кислоту 7d (100 мг, 0,22 ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші додавали трометамол (53 мг, 0,44 ммоль), одержуючи коричневий розчин, і перемішували при кімнатній температурі протягом ночі. Тверда речовина випадала в осад, фільтрували, потім залишок на фільтрі промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідронафталін-2-іл)-1,5-дигідро-піразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти біс(трометамол), 12 (142 мг, вихід: 92,8%) як темну тверду речовину. ВЕРХ: 94,0% MC m/z (ECI): 457,8 [М-1] 1 H ЯМР (400М Гц, CD3OD): 7,58 (м, 4Н), 7,05 (м, 2Н), 6,96 (д, J=3,6 Гц, 1Н), 6,90 (т, J=8,0 Гц, 1H), 3,65 (C, 12Н), 2,76 (м, 4H), 2,33 (с, 3H),1,80 (м, 4H) Приклад 13 (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино)-феніл)-фуран-2-карбонової кислоти біс-(дибензилетилендіамін) (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонову кислоту 7d (100 мг, 0,22 ммоль) розчиняли в 5 мл тетрагідрофурану, одержуючи темно-червону суспензію. До реакційної суміші додавали дибензилетилендіамін (104 мг, 0,44 ммоль), одержуючи коричневий розчин, і перемішували 2 години при кімнатній температурі. До одержаного розчину додавали 4 мл метанолу і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, (Z)-5{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідро-піразол-4іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти біс-(дибензилетилендіамін), 13 (167 мг, вихід: 81,8%) як темну тверду речовину. ВЕРХ: 96,8% MC m/z (ECI): 457,8 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,52-7,54 (м, 3H), 7,39 (д, J=7,2 Гц, 1Н), 7,24-7,28 (м, 20Н), 7,017,04 (м, 2Н), 6,65-6,72 (м, 1Н), 3,89 (с, 8Н), 3,01 (с, 8Н), 2,73 (м, 4Н), 2,32 (с, 3H), 1,78 (м, 4Н) Приклад 14 (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти динатрієва сіль 22 UA 107353 C2 5 10 15 20 25 30 35 (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонову кислоту 7d (110 мг, 0,24 ммоль) розчиняли в 4 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші краплями додавали 1 M розчин гідроксиду натрію (0,4 мл, 0,44 ммоль), перемішували 2 години при кімнатній температурі. Реакційну суміш фільтрували, потім до фільтрату додавали 4 мл метанолу і концентрували при пониженому тиску. Одержану тверду речовину промивали гексаном одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідро-піразол-4-іліден]-гідразино}-феніл)-фуран-2карбонової кислоти динатрієву сіль, 14 (115 мг, вихід: 81,8%) як темну тверду речовину. ВЕРХ: 96,8% MC m/z (ECI): 457,8 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,79 (дд, J=7,6 Гц, J2=1,2 Гц, 1Н), 7,52 (м, 3H), 7,18 (д, J=3,6 Гц, 1Н), 7,05 (м, 2Н), 6,70 (м, 1Н), 2,78 (м, 4Н), 2,41 (с, 3Н), 1,82 (м, 4Н) Приклад 15 (Z)-5-{2-гiдpoкcи-3-(N'-[3-мeтил-5-oкco-1-(5,6,7,8-тeтpaгiдpo-нaфтaлiн-2-iл)-1,5-дигiдpопіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонової кислоти біс-(L-аргінін) (Z)-5-{2-гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідропіразол-4-іліден]-гідразино}-феніл)-фуран-2-карбонову кислоту 7d (100 мг, 0,22 ммоль) розчиняли в 5 мл 1 тетрагідрофурану, одержуючи темно-червону суспензію. До реакційної суміші додавали L-аргінін (76 мг, 0,44 ммоль) і 2 мл води, перемішували 2 години при кімнатній температурі. Реакційний розчин концентрували при пониженому тиску, додавали 5 мл етилацетату. Тверда речовина випадала в осад з розчину, її фільтрували, потім залишок на фільтрі сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-{N'-[3метил-5-оксо-1-(5,6,7,8-тетрагідро-нафталін-2-іл)-1,5-дигідро-піразол-4-іліден]-гідразино}феніл)-фуран-2-карбонової кислоти біс-(L-аргінін), 15 (168 мг, вихід: 95,5%) як темну тверду речовину. ВЕРХ: 97,5% MC m/z (ECI): 457,9 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,59 (м, 4Н), 7,06 (м, 2Н), 6,98 (д, J=3,6 Гц, 1Н), 6,92 (т, J=8,0 Гц, 1H), 3,57 (т, J=6,4 Гц, 2H), 3,19 (м, 4H), 2,78 (м, 4H), 2,36 (с, 3H),1,83 (м, 8H), 1,73 (м, 4H) Приклад 16 (Z)-5-{2-гiдpoкcи-3-[N'-(1-індaн-5-iл-3-мeтил-5-oкco-1,5-дигiдpo-пipaзoл-4-iлiдeн)-гiдpазино1феніл)-фуран-2-карбонової кислоти біс-(етаноламін) 23 UA 107353 C2 5 10 15 20 25 30 35 Стадія 1 (Z)-5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонова кислота 5-(3-Аміно-2-гідрокси-феніл)-фуран-2-карбонової кислоти гідробромід 4g (300 мг, 1,0 ммоль) розчиняли в хлорводневій кислоті (3,4 мл, 1 M) після чого краплями додавали 1,2 мл розчину нітриту натрію (73 мг, 1,05 ммоль) при охолодженні на бані лід-вода. Після реагування суміші протягом 10 хвилин, послідовно додавали 2-індан-5-іл-5-метил-2,4-дигідро-піразол-3-он 1і (193 мг, 0,9 ммоль), бікарбонат натрію (1,26 г, 15 ммоль) і 4,4 мл етанолу. Суміш реагувала при кімнатній температурі протягом 24 годин. Суміш фільтрували і залишок на фільтрі промивали 20 мл води і потім розчиняли в 20 мл води. При охолодженні на бані лід-вода, суміш доводили до рН < 5 використовуючи концентровану хлорводневу кислоту, фільтрували і сушили, одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонову кислоту, 16а (287 мг, вихід 71,8%) як жовту тверду речовину. MC m/z (ECI): 443 [М-1] 1 H ЯМР (400 МГц, ДМСО-d6): 13,73 (ш с, 1 H), 9,97 (ш c, 1 H), 7,78 (с, 1 H), 7,70 (м, 2Н), 7,57 (м, 1Н), 7,36 (д, J=3,6 Гц, 1Н), 7,29 (д, J=8,0 Гц, 1Н), 7,22 (т, J=8,0 Гц, 1H), 7,15 (м, 1H), 2,89 (м, 4H), 2,32 (с, 3H),2,03 (м, 2H) Стадія 2 (Z)-5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонової кислоти біс-(етаноламін) (Z)-5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонову кислоту 16а (1,825 г, 4,11 ммоль) розчиняли в 20 мл тетрагідрофурану. До реакційної суміші додавали етаноламін (501 мг, 8,22 ммоль) і перемішували 2 години при кімнатній температурі. Тверда речовина випадала в осад, її фільтрували, потім залишок на фільтрі промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]-феніл}-фуран-2-карбонової кислоти біс(етаноламін), 16 (1,615 г, вихід: 69,4%) як темно-червону тверду речовину. MC m/z (ECI): 443 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,67(с, 1H), 7,53 (м, 3H), 7,21 (д, J=8,0 Гц, 1H), 7,02 (м, 1H), 6,97 (д, J=3,2 Гц, 1H), 6,70 (м, 1H), 3,70 (м, 4H), 2,92 (м, 4H), 2,88 (м, 4H), 2,35 (с, 3H), 2,08 (м, 2H) Приклад 17 (Z)-5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонової кислоти біс-(діетиламін) 24 UA 107353 C2 5 10 15 20 25 30 35 (Z)-5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонову кислоту 16а (150 мг, 0,38 ммоль) суспендували в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші краплями додавали діетиламін (49 мг, 0,67 ммоль), одержуючи пурпуровий розчин, і його перемішували 2 години при кімнатній температурі. Тверда речовина випадала в осад, її фільтрували, потім залишок на фільтрі промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідропіразол-4-іліден)-гідразино]-феніл}-фуран-2-карбонової кислоти біс-(діетиламін), 17 (163 мг, вихід: 81,9%) як темно-червону тверду речовину. ВЕРХ: 99,18% MC m/z (ECI): 442,7 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,71 (с, 1Н), 7,60 (м, 3H), 7,24 (д, J=8,0 Гц, 1Н), 7,04 (д, J=8,0 Гц, 1H), 6,95 (д, J=8,0 Гц, 1H), 6,82 (м, 1H), 3,73 (м, 2H), 2,95 (м, 8H), 2,37 (с, 3H), 2,13 (м, 2H), 1,87 (м, 2H), 1,28 (м, 12H) Приклад 18 (Z)-5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонової кислоти біс-(піперазин) (Z)-5-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-фуран-2-карбонову кислоту 16а (150 мг, 0,38 ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші додавали піперазин (58 мг, 0,68 ммоль), одержуючи пурпуровий розчин і перемішували 3 години при кімнатній температурі. Тверда речовина випадала в осад, її фільтрували, потім залишок на фільтрі промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-5{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]-феніл}фуран-2-карбонової кислоти біс-(піперазин), 18 (185 мг, вихід: 88,9%) як темно-червону тверду речовину. ВЕРХ: 96,52% MC m/z (ECI): 443,2 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,73 (с, 1Н), 7,61-7,64 (м, 2Н), 7,55 (д, J=8,4 Гц, 1Н), 7,23 (д, J=8,4 Гц, 1H), 7,05 (д, J=8,8 Гц, 1H), 6,78-6,90 (м, 2H), 3,03 (с, 16H), 2,89-2,95 (м, 4H), 2,35 (с, 3H), 2,12 (т, J=7,2 Гц, 4H) Приклад 19 (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-тіофен-2-карбонової кислоти біс-(етаноламін) 25 UA 107353 C2 5 10 15 20 25 30 35 Стадія 1 4-(3-Нітро-2-метокси-феніл)-тіофен-2-карбонова кислота 2-(2-Метокси-3-нітро-феніл)-4,4,5,5-тетраметил-1,3,2-діоксаборолан 4d (0,81 г, 2,9 ммоль), 4бром-тіофен-2-карбонову кислоту (0,3 г, 1,45 ммоль), тетракіс(трифенілфосфін)паладій (80 мг, 0,073 ммоль) і карбонат натрію (0,31 г, 2,9 ммоль) розчиняли в суміші розчинників 20 мл 1,4діоксану і 10 мл води. Реакцію нагрівали із зворотнім холодильником протягом 0,5 годин. Суміш доводили до рН 3 1N хлорводневою кислотою і екстрагували етилацетатом (20 мл3). Об'єднані органічні екстракти концентрували при пониженому тиску і залишок очищали колонковою хроматографією на силікагелі, одержуючи вказану в заголовку сполуку, 4-(3-нітро-2-метоксифеніл)-тіофен-2-карбонову кислоту, 19а (0,54 г) як коричневе масло, яке безпосередньо використовували на наступній стадії. MC m/z (ECI): 277,6 [М-1] Стадія 2 4-(3-Аміно-2-метокси-феніл)-тіофен-2-карбоновакислота 4-(3-Нітро-2-метокси-феніл)-тіофен-2-карбонову кислоту 19а (400 мг, 1,45 ммоль) розчиняли в 30 мл етилацетату після чого додавали 100 мг паладію на вугіллі (10%) і форміат амонію (360 мг, 5,8 ммоль). Суміш нагрівали із зворотнім холодильником протягом 3 годин. Суміш фільтрували і концентрували при пониженому тиску одержуючи вказану в заголовку сполуку, 4(3-аміно-2-метокси-феніл)-тіофен-2-карбонову кислоту, 19b (410 мг) як коричневе масло, яке безпосередньо використовували на наступній стадії. MC m/z (ECI): 247,8 [М-1] Стадія 3 4-(3-Аміно-2-гідрокси-феніл)-тіофен-2-карбонової кислоти гідробромід 4-(3-Аміно-2-метокси-феніл)-тіофен-2-карбонової кислоти гідробромід 19b (360 мг, 1,45 ммоль) розчиняли в 5 мл дихлорметану після чого краплями додавали трибромід бору (2,8 мл, 5,6 ммоль). Реакційну суміш реагувала при кімнатній температурі протягом 4,5 годин. До реакційної суміші додавали 5 мл метанолу і концентрували при пониженому тиску. Залишок розводили 10 мл етилацетату і перемішували 0,5 годин. Суміш фільтрували і залишок на фільтрі сушили, одержуючи вказану в заголовку сполуку, 4-(3-аміно-2-гідрокси-феніл)-тіофен-2карбонової кислоти гідробромід, 19с (80 мг, вихід 17,5%) як сіру тверду речовину. MC m/z (ECI): 236,1 [М+1] Стадія 4 (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-тіофен-2-карбонова кислота 4-(3-Аміно-2-гідрокси-феніл)-тіофен-2-карбонової кислоти гідробромід 19с (120 мг, 0,38 ммоль) розчиняли в 2,7 мл 1M хлорводневої кислоти при охолодженні на бані лід-вода, після чого краплями додавали 0,45 мл розчину нітриту натрію (29 мг, 0,42 ммоль). Після реагування 26 UA 107353 C2 5 10 15 20 25 30 35 40 45 суміші 20 хвилин, додавали 2-індан-5-іл-5-метил-2,4-дигідро-піразол-3-он 1і (73 мг, 0,34 ммоль). Суміш доводили до рН 8 насиченим розчином бікарбонату натрію після чого додавали 2 мл етанолу. Реакційна суміш реагувала протягом ночі при кімнатній температурі. Суміш фільтрували і залишок на фільтрі додавали до 20 мл води. Суміш доводили до рН 3~4 концентрованою хлорводневою кислотою і фільтрували. Потім до залишку на фільтрі додавали 5 мл етилацетату і суміш перемішували 1 годину. Суміш фільтрували і залишок на фільтрі сушили, одержуючи вказану в заголовку сполуку, (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5оксо-1,5-дигідро-піразол-4-іліден)-гідразино]-феніл}-тіофен-2-карбонову кислоту, 19d (45 мг, вихід 28,7%) як жовту тверду речовину. MC m/z (ECI): 458,8 [М-1] 1 H ЯМР (400 МГц, ДМСО-d6): 13,79 (ш с, 1Н), 9,68 (ш с, 1Н), 8,13 (д, J=1,2 Гц, 1Н), 8,05 (д, J=1,6 Гц, 1Н), 7,78 (с, 1Н), 7,67 (м, 2Н), 7,32 (м, 2Н), 7,13 (т, J=8,0 Гц, 1Н), 2,87 (м, 4Н), 2,32 (с, 3H), 2,05 (м, 2Н) Стадія 5 (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-тіофен-2-карбонової кислоти біс-(етаноламін) (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-тіофен-2-карбонову кислоту 19d (1,3 г, 2,83 ммоль) розчиняли в 40 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші додавали етаноламін (344 мг, 5,65 ммоль), одержуючи пурпуровий розчин, і перемішували 2 години при кімнатній температурі. Більша частка твердої речовини випадала в осад з розчину, її фільтрували, потім залишок на фільтрі промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4іліден)-гідразино]-феніл}-тіофен-2-карбонової кислоти біс-(етаноламін), 19 (1,513 г, вихід: 92,0%) як темно-червону тверду речовину. ВЕРХ: 98,65% MC m/z (ECI): 458,7 [M-1] 1 H ЯМР (400 МГц, CD3OD): 7,94 (с, 1H), 7,88 (с, 1H), 7,68 (с, 1H), 7,55-7,59 (м, 2H), 7,28-7,30 (м, 1H), 7,22 (д, J=8,4 Гц, 1H), 6,83 (т, J=8,0 Гц, 3H), 3,65-3,68 (м, 4H), 2,88-2,92 (м, 8H), 2,38 (с, 3H), 2,06-2,14 (м, 2H) Приклад 20 (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)гідразино]феніл)-тіофен-2-карбонової кислоти біс-(діетиламін) (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-тіофен-2-карбонову кислоту 19d (150 мг, 0,33 ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші краплями додавали діетиламін (49 мг, 0,66 ммоль), одержуючи пурпуровий розчин, і перемішували 2 години при кімнатній температурі. Тверда речовина випадала в осад, її фільтрували, потім залишок на фільтрі промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)гідразино]-феніл}-тіофен-2-карбонової кислоти біс-(діетиламін), 20 (157 мг, як темно-червону тверду речовину). Вихід: 79,3%. ВЕРХ: 98,98% MC m/z (ECI): 458,8 [М-1] 1 H ЯМР (400 МГц, CD3OD): 7,81 (с, 1Н), 7,73 (с, 1H), 7,68-7,70 (м, 2H), 7,62 (д, J=8,8 Гц, 1H), 7,22-7,26 (м, 2H), 7,06 (т, J=8,0 Гц, 1H), 3,03 (к, J=7,2 Гц, 8H), 2,90-2,97 (м, 4H), 2,37 (с, 3H), 2,072,15 (м, 2H), 1,29 (т, J=7,2 Гц, 12H) Приклад 21 27 UA 107353 C2 (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1.5-дигідро-піразол-4-іліден)-гідразино]феніл)-тіофен-2-карбонової кислоти біс-(піперазин) 5 10 15 (Z)-4-{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]феніл}-тіофен-2-карбонову кислоту 19d (150 мг, 0,33 ммоль) розчиняли в 5 мл тетрагідрофурану одержуючи темно-червону суспензію. До реакційної суміші додавали піперазин (56 мг, 0,65 ммоль), одержуючи пурпуровий розчин, і перемішували 2 години при кімнатній температурі. Тверда речовина випадала в осад, її фільтрували, потім залишок на фільтрі промивали тетрагідрофураном (1 мл3) і сушили у вакуумі, одержуючи вказану в заголовку сполуку, (Z)-4{2-гідрокси-3-[N'-(1-індан-5-іл-3-метил-5-оксо-1,5-дигідро-піразол-4-іліден)-гідразино]-феніл}тіофен-2-карбонової кислоти біс-(піперазин), 21 (195 мг, вихід: 94,7%) як темно-червону тверду речовину. ВЕРХ: 98,17% MC m/z (ECI): 458,8 [М-1] 1 H ЯМР (400 МГц, CD3OD): 67,85 (с, 1 H), 7,75 (с, 1 H), 7,71 (с, 1 H), 7,62 (м, 2H), 7,26 (м, 2H), 6,95 (т, 1H), 2,96 (м, 16H), 2,91 (м, 4H), 2,37 (с, 3H), 2,11 (м, 2H) Приклад 22 (Z)-4-(2-Гідрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагідро-нафтал-2-іл)-1,5-дигідро-піразол4-іліден]-гідразино)-феніл)-фуран-2-карбонової кислоти біс-(етаноламін) 20 25 Стадія 1 4-Бром-фуран-2-карбонова кислота Суміш 4,5-дибром-фуран-2-карбонової кислоти 22а (5,5 г, 20,3 ммоль) і 18 мл гідроксиду амонію додавали до 63 мл води після чого додавали цинковий порошок (1,46 г, 22,33 ммоль). Після завершення додавання, реакційну суміш перемішували при кімнатній температурі протягом 6 годин. Суміш доводили до рН 3 1M хлорводневою кислотою, одержуючи велику 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSalts of bicyclo-substituted pyrazolon azo derivatives, preparation method and use thereof
Автори англійськоюTang, Peng Cho, Lu, Hejun, Fei, Hongbo, Chen, Yiqian
Автори російськоюТанг Пенг Чо, Лю Хеджун, Фей Хонгбо, Чен Йикян
МПК / Мітки
МПК: C07D 409/12, A61P 7/00, A61P 7/04, C07D 405/12, A61K 31/655, C07D 231/46
Мітки: солі, біцикло-заміщеного, азопіразолону, спосіб, застосування, одержання, похідних
Код посилання
<a href="https://ua.patents.su/46-107353-soli-pokhidnikh-biciklo-zamishhenogo-azopirazolonu-sposib-kh-oderzhannya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Солі похідних біцикло-заміщеного азопіразолону, спосіб їх одержання та застосування</a>
Попередній патент: Спосіб виготовлення сухого солодового напою
Наступний патент: Пакувальний матеріал, який містить намагнічувані ділянки
Випадковий патент: Установка для виробництва енергоносіїв з органічних відходів