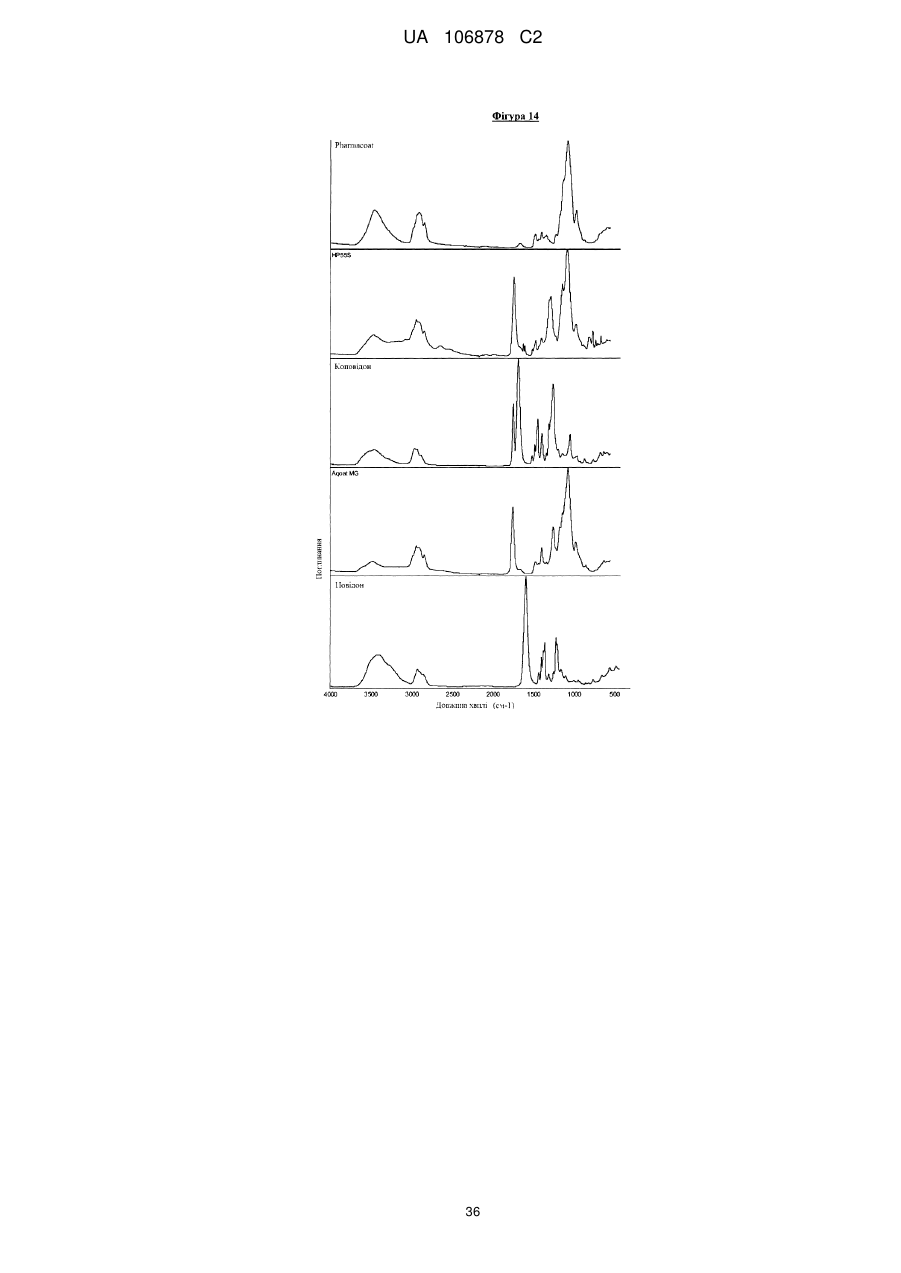
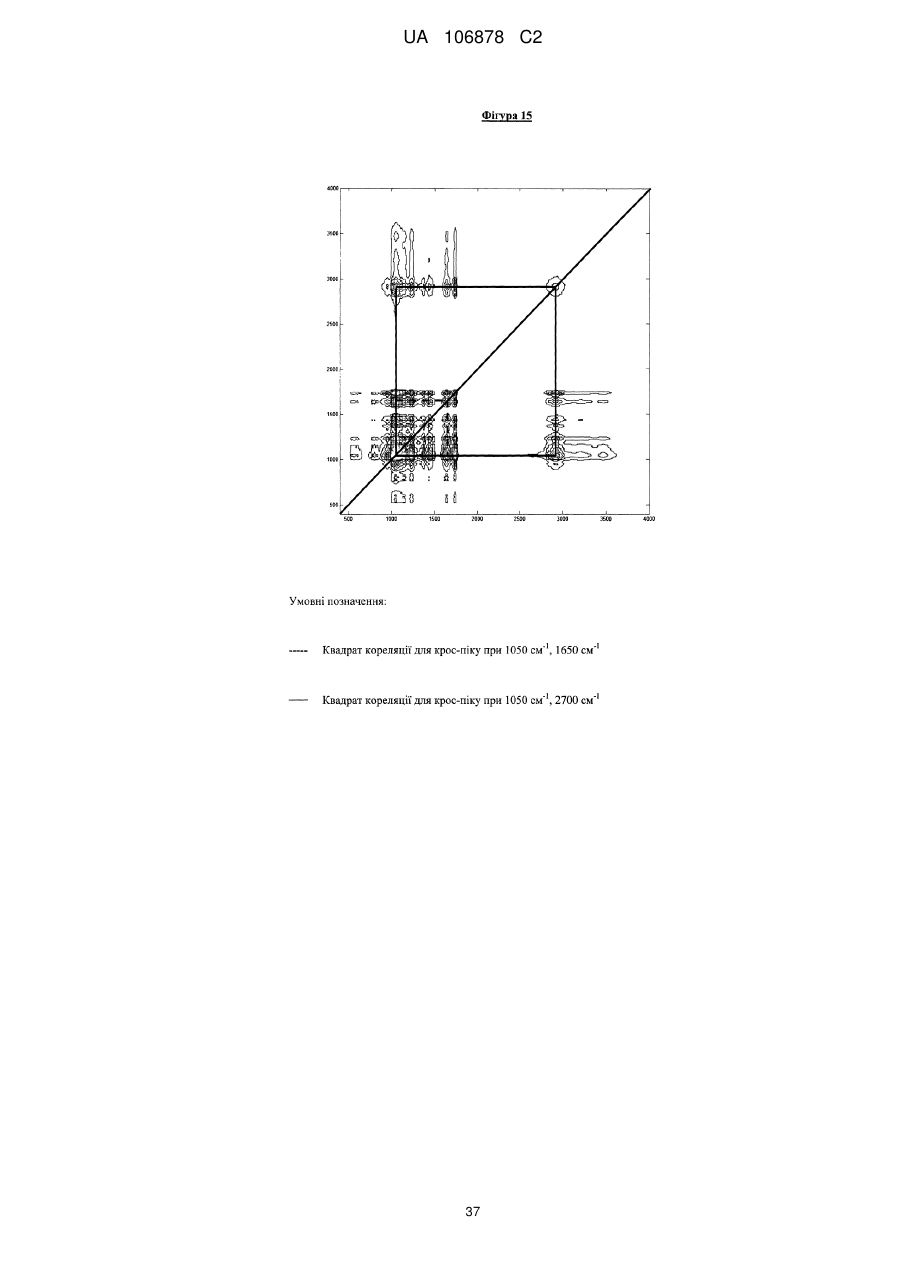
Фармацевтична композиція, що містить 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фторбензил]-2н-фталазин-1-он або його сіль, або сольват, у твердій дисперсії з матричним полімером коповідоном
Номер патенту: 106878
Опубліковано: 27.10.2014
Автори: Леннон Кіран Джеймс, Фастнахт Катя Марен, Кахілл Джулі Кей, Пакхойзер Клаудіа Беттіна, Бехтольд Міхаель Карл, Ліпольд Бернд Харальд, Штайц Бенедікт
Формула / Реферат
1. Фармацевтична композиція, що включає активну речовину в твердій дисперсії з матричним полімером, у якій активна речовина являє собою 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фторбензил]-2Н-фталазин-1-он або його сіль, або сольват, та матричний полімер, який являє собою коповідон, що має низьку гігроскопічність та високу температуру розм'якшення, та у якій співвідношення активна речовина : матричний полімер за масою становить від 1:0,25 до 1:10, низька гігроскопічність означає наявність рівноважного вмісту води менше ніж 10 % при 50 % відносній вологості, а висока температура розм'якшення означає, що температура склування (Tg) або плавлення (Тm) більше ніж 100 °С.
2. Композиція за п. 1, у якій активна речовина знаходиться в стабільній аморфній формі.
3. Композиція за п. 2, у якій щонайменше 90 % активної речовини знаходиться в аморфній формі.
4. Композиція за будь-яким з пп. 1-3, у якій коповідон являє собою співполімер 1-вініл-2-піролідону та вінілацетату в співвідношенні 6:4 за масою.
5. Композиція за п. 4, у якій співвідношення активна речовина : матричний полімер за масою становить від 1: ≥2 до 1:10.
6. Композиція за будь-яким з пп. 1-5, у якій кількість активної речовини на одиницю дози становить щонайменше 20 %.
7. Композиція за п. 4, у якій співвідношення активна речовина : матричний полімер за масою становить від 1:2 до 1:4 та у якій кількість активної речовини становить від 20 % до 30 %.
8. Композиція за будь-яким з пп. 1-6, у якій тверда дисперсія містить поверхнево-активну речовину та/або пластифікатор.
9. Композиція за п. 8, у якій поверхнево-активна речовина вибрана з групи, що включає: натрію додецилсульфат (натрію лаурилсульфат); натрію докузат; цетрімід; бензетонійхлорид; цетилпіридинійхлорид; лауринову кислоту; поліоксіетиленалкілові ефіри; ефіри поліоксіетиленсорбітану та жирних кислот, наприклад полісорбати 20, 40, 60 та 80; поліоксіетиленові похідні касторової олії, наприклад Кремофор RH40™; поліоксіетиленстеарати та полоксамери.
10. Композиція за п. 1, у якій співвідношення активна речовина : матричний полімер за масою становить 1:2,3, та у якій кількість активної речовини за масою становить 25 %, також містить 1,8 % за масою колоїдного діоксиду кремнію, 14,7 % за масою маніту та 1 % за масою натрію стеарилфумарату.
11. Композиція за будь-яким з пп. 1-10, яка призначена для введення через слизову оболонку.
12. Композиція за будь-яким з пп. 1-11, у якій тверда дисперсія отримана шляхом випаровування розчиннику або екструзії розплаву.
13. Композиція за п. 12, у якій тверда дисперсія отримана шляхом екструзії розплаву.
14. Спосіб одержання твердої аморфної дисперсії 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фторбензил]-2Н-фталазин-1-ону, у якому:
(і) змішують підходящу кількість 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фторбензил]-2Н-фталазин-1-ону або його фармацевтично прийнятної солі, або сольвату з бажаною кількістю щонайменше одного матричного полімеру, де матричний полімер являє собою коповідон, який має низьку гігроскопічність та високу температуру розм'якшення, та у якій співвідношення активна речовина : матричний полімер за масою становить від 1:0,25 до 1:10;
(іі) підвищують температуру суміші для одержання розплаву, та
(ііі) екструдують розплав з одержанням твердого продукту.
15. Спосіб за п. 14, у якому на стадії (ііі) розплав екструдують в одну або кілька форм.
Текст
Реферат: Винахід стосується фармацевтичної композиції, що включає активну речовину 4-[3-(4циклопропанкарбонілпіперазин-1-карбоніл)-4-фторбензил]-2Н-фталазин-1-он у твердій дисперсії з матричним полімером, який має низьку гігроскопічність та високу температуру розм'якшення, таким як коповідон. Винахід також стосується способу одержання вказаної фармацевтичної композиції. UA 106878 C2 (12) UA 106878 C2 UA 106878 C2 5 10 15 Деякі варіанти винаходу, описані авторами, були зроблені в межах спільної угоди на дослідження між Abbott GMBH & Co.KG та AstraZeneca UK Ltd. Даний винахід стосується нових фармацевтичних композицій з покращеною біодоступністю та/або стабільністю та/або завантаженням активної речовини, способів одержання цих нових фармацевтичних композицій та їх застосування в лікуванні раку, або як монотерапію або в комбінації з іншими препаратами. Зокрема, даний винахід стосується фармацевтичної композиції, що включає 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он в твердій дисперсії з матричним полімером, який має низьку гігроскопічність та високу температуру розм’якшення. Особливо підходящим матричним полімером є коповідон. Винахід також стосується добової фармацевтичної дози 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону, що надається такою композицією. Крім того, винахід стосується використання коповідону в композиції твердої дисперсії з 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-оном для збільшення біодоступності та/або стабільності 4-[3-(4-циклопропанкарбоніл-піперазин-1карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону, або для лікування раку у пацієнта. 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он (сполука 1), що має наступну структуру: O NH N O N F 20 25 30 35 40 45 50 55 N O розкривається та приводиться в прикладах в публікації міжнародної патентної заявки № WO 2004/080976 (сполука 168). Це інгібітор полі(АДФ-рибозо)-полімерази (PARP), з яким наразі проводяться клінічні випробування для лікування видів рака, таких як рак молочної залози та рак яєчників. У відповідності з WO2005/012524 та WO2005/053662, сполуки PARP інгібітору, такі як 4- [3(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он, особливо ефективні в лікуванні видів раку, клітини яких мають дефекти в залежному від гомологічної рекомбінації (HR) шляху репарації дволанцюгових розривів ДНК (DSB). BRCA1 (NM_007295) та BRCA 2 (NM_000059) спадкові гени раку молочної залози/яєчників тільки 2 з багатьох білків в HR залежному шляху репарації DSB ДНК. Інші члени HR залежного шляху репарації DSB ДНК включають в себе: ATM (NM_000051), ATR (NM_001184), DSS1 (U41515), RPA 1 (NM_002945.2), RPA 2 (NM_00294.6), RPA 3 (NM_002974.3), RPA 4 (NM_013347.1), Chk1 (NM_001274.2), Chk2 (096017 GI:6685284), RAD51 (NM_002875), RAD51L1 (NM_002877), RAD51c (NM_002876), RAD51L3 (NM_002878), DMC1 (NM_007068), XRCC2 (NM_005431), XRCC3 (NM_05432), RAD52 (NM_002879), RAD54L (NM_003579), RAD54B (NM_012415), RAD50 (NM_005732), MRE11A (NM_005590) та NBS1 (NM_002485). Таким чином, наприклад, рак молочної залози або яєчників, який являє собою BRCA1+ та/або BRCA2+, може бути набагато більш сприйнятливим до лікування сполукою інгібітору PARP, ніж рак без дефектів в залежному від гомологічної рекомбінації (HR) шляху репарації дволанцюгових розривів ДНК (DSB); що потенційно дозволяє проводити ефективне монотерапевтичне лікування та/або лікування при більш низьких дозах з супутніми меншими побічними ефектами. 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он (сполука 1) являє собою слабко кислу сполуку з рКа біля 12,5 (залишок фталазинoну). По суті, є нейтральним в фізіологічному діапазоні рН. Розчинність у воді у рівноважному стані Сполуки 1, згідно вимірюванням, становить біля 0,10 мг/мл в цілому ряді водних буферів (рН 1-9); ця розчинність збільшується до 0,12-0,20 мг/мл на реальних та модельних шлункових середовищах, причому найбільш висока розчинність становить 0,20 мг/мл в модельній кишковій рідині в ситому стані (див. Приклад 1.1). Сполука 1, як визначено, є помірно проникною, у порівнянні з маркером високої проникності пропранололом при дослідженні за допомогою клітинної лінії Како-2. Значення Папп Како-2 становило 3,67x10-6 см/сек., що відповідає значенню Peff людини, рівному 1,4 х 10-4 см/сек. Сполука 1 знаходиться в межах погано розчинного в умовах лікарської форми приблизно класу 4 (при дозах вище 25 мг) за системою біофармацевтичної класифікації (BCS) на основі цих значень розчинності та проникності (див. Приклад 1). Прогноз біодоступності Сполуки 1, зроблений на основі вимірювань розчинності та проникності, свідчить про те, що для Сполуки 1 будуть придатні таблетки з негайним вивільненням (НВ). Дійсно, сполуки з аналогічною розчинністю, проникністю та діапазоном доз 1 UA 106878 C2 5 10 15 20 25 30 35 40 45 50 55 60 успішно готують у вигляді таблеток з НВ (див., наприклад, Kasim et al. "Molecular properties of WHO essential drugs and provision of biopharmaceutics classification." Molecular Pharmaceutics. 1(1):85-96, 2004). Однак, при проведенні дослідження на собаках експозиція після введення звичайних таблеток з НВ була значно нижче, ніж очікувалось (див. Приклад 6; Фігура 13). Пероральна біодоступність 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фторбензил]-2Н-фталазин-1-ону для пацієнта залежить у певній мірі від швидкості розчинення та розчинності препарату у шлунково-кишковому тракті. Біодоступність 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону для серії композицій можна оцінити шляхом визначення площі під кривою (AUC) графіку концентрації 4[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону у плазмі від часу, що пройшов після введення 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4фтор-бензил]-2Н-фталазин-1-ону. Винахідники змогли вирішити проблему поганої біодоступності таблетки із НВ Сполуки 1 шляхом створення ліпідної композиції (Gelucire™ 44-14), та ця композиція була використана в рамках клінічних випробувань Фази I і II. Однак, при високому завантаженні активної сполуки (> 10%), у випадку ліпідної композиції відмічалося зниження експозиції (див. приклад 6 та фігуру 30). Потенційна проблема ліпідної композиції з gelucire, таким чином, реалізується тільки під час досліджень з ескалацією дози, направлених на визначення максимально переносимої дози і, таким образом, прогнозування потенційної терапевтичної дози. Зв’язувалося, що якщо терапевтична доза становила 400 мг, композиція Gelucire™ 44-14 із 10% завантаженням активної речовини повинна бути введена у вигляді 16 капсул розміру 0. Це не тільки впливає на питання слідування пацієнтом режиму терапії, але також буде мати комерційні наслідки, наприклад, збільшення витрат на виробництво, упакування і транспортних витрат і т.д. У випадку, якщо 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Нфталазин-1-он необхідний у добовій дозі більше 50 мг або 100 мг (насправді такі дози як 400 мг два рази на добу проходять випробування в клінічних дослідженнях), було б бажано знайти композицію 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1ону з підвищеною біодоступністю й таку, яка дозволила б досягнути достатнього завантаження активної речовини таким чином, щоб її можна було б вводити за допомогою контрольованої кількості одиниць (наприклад, менше, ніж 4 на добу). Така підвищена біодоступність може бути корисною в забезпеченні зниження добової дози 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону, необхідної для досягнення порівняного біологічного впливу, який відмічається при звичайній композиції, наприклад, звичайній таблетці з НВ 4-[3-(4-циклопропанкарбоніл-піперазин-1карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону. Тому є бажання знайти композицію 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4фтор-бензил]-2Н-фталазин-1-ону з покращеною біодоступністю та завантаженням активної речовини по відношенню до звичайної композиції таблетки з НВ, в ідеалі композиції з цільовою біодоступністю біля 90% (у порівнянні з внутрівенним розчином), та композицію, що дозволяє досягнути достатнього завантаження активної речовини для зменшення кількості одиниць, які повинні бути прийняті у будь-який момент часу, наприклад, менше 4, а в ідеалі до однієї або двох одиниць. Даний винахід покликаний забезпечити композицію 4-[3-(4-циклопропанкарбоніл-піперазин1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону, яка зводить до мінімуму розмір та/ або кількість таблеток або капсул, необхідних для терапевтично ефективної дози, в ідеалі до менше ніж 4 одиниць, бажано тільки одна або дві одиниці. С метою підвищення терапевтичного потенціалу 4-[3-(4-циклопропанкарбоніл-піперазин-1карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону, винахідники прагнули збільшити терапевтичний потенціал шляхом збільшення біодоступності 4-[3-(4-циклопропанкарбоніл-піперазин-1карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону у композиції, яка дозволила б досягти достатньо високого завантаження активної речовини (наприклад, більше 10%). В різних варіантах завантаження активної речовини буде становити не менше 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55% або 60%. Слід мати на увазі, що чим більше завантаження активної речовини, тим більше вірогідність нестабільності, таким чином, що, хоча створення композиції з 60% завантаженням активної речовини може бути можливе, при цьому можливо краще прийняти більш низьке завантаження активної речовини для збереження стабільності. З доступних різних підходів до створення композиції, винахідники виявили, що композиції твердих дисперсій з окремими типами полімерів були засобами рішення однієї або декількох з перерахованих цілей. Крім того, неочікувано було знайдено, що композиції твердих дисперсій винаходу збільшили біодоступність Сполуки 1 у порівнянні з ліпідною композицією gelucire. 2 UA 106878 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахідники тепер неочікувано виявили, що терапевтичний потенціал 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону може бути збільшений шляхом формулювання 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фторбензил]-2Н-фталазин-1-ону у твердій дисперсії з матричним полімером, який має низьку гігроскопічність та високу температуру розм’якшення. Матричний полімер коповідон, як виявилось, особливо підходить, так як його можна використовувати в екструзії гарячого розплаву без необхідності додавання пластифікатору, та це забезпечує одержання продукту з прийнятною стабільністю, навіть при 30% завантаженні активної речовини в кінцевому продукті (наприклад, таблетці). Було б бажано додатково визначити підходящий матричний полімер, який може бути сформульований в твердій дисперсії з препаратом за допомогою будь-якого з доступних способів твердої дисперсії без необхідності в додаткових ПАВ/пластифікаторах, так як, за оцінками, наявність певних сторонніх допоміжних речовин може поставити під загрозу стабільність Сполуки 1 (наприклад, здатність залишатися в аморфній формі). Таким чином, в одному з варіантів композиція твердої дисперсії винаходу не містить ПАВ/пластифікатору. Згідно першого аспекту винаходу пропонується фармацевтична композиція, що містить активну речовину у твердій дисперсії з матричним полімером, в якій активна речовину являє собою 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он або його сіль або сольвату, а матричний полімер має низьку гігроскопічність та високу температуру розм’якшення. В одному з варіантів винаходу активна речовина присутня в композиції в стабільній аморфній формі. Якщо активна речовина присутня в композиції в стабільній аморфній формі, композиція може стабілізувати активний агент в композиції в аморфній формі та може знизити конверсію або повернення до інших форм. В деяких варіантах винаходу буде бажано, щоб сіль або сольват Сполуки 1 являли собою фармацевтично прийнятну сіль або сольват. Використовуваний авторами термін "полімер" означає макромолекулу, яка складається з структурних одиниць, що повторюються, пов’язаних ковалентними хімічними зв’язками. Термін охоплює лінійні та розгалужені полімери, циклічні полімери, такі як циклічні олігосахариди (в тому числі циклодекстрини), гомо- та сополімери природного, синтетичного або напівсинтетичного походження. Використовуваний авторами термін "матричний полімер" означає матеріал, який має низьку гігроскопічність та високу температуру розм’якшення, що містить полімер або суміш двох або декількох полімерів. Використовуваний авторами термін "низька гігроскопічність" означає наявність рівноважного вмісту води 100 °C, як визначається методом диференційної скануючої калориметрії (ДСК). Спеціалістам в даній галузі зрозуміло, що Tg – параметр вимірювання, що підходить для полімерів, які знаходяться в аморфному стані або формі, а Tm - параметр вимірювання, який підходить для полімерів, які знаходяться в кристалічному стані або формі. Підходящі матричні полімери для використання у винаході, включають: коповідон, гіпромелози фталат (гідроксипропілметилцелюлози фталат, HPMCP), гіпромелози ацетат сукцинат (гідроксипропілметилцелюлози ацетат сукцинат, HPMCAS), 2-гідроксипропіл-βциклодекстрин (HPBCD), гіпромелоза (гідроксипропілметилцелюлоза, HPMC), поліметакрилати (полі(метакрилова кислота, метилметакрилат 1:1; полі(метакрилова кислота, етилакрилат) 1:1), гідроксипропілцелюлозу (HPC), та целюлози ацетат фталат (CAP). Коповідон являє собою синтетичний, лінійний, статистичний сополімер N-вініл-2-піролідону (ВП) та вінілацетату (ВА) з хімічною формулою (C 6H9NO)m (C4H6O2)n, де вміст ВА номінально становить 40% (але може варіюватися, наприклад, від 35 до 41%). Крім того, додавання вінілацетату у полімерний ланцюг вінілпіролідону знижує гігроскопічність та температуру склування (Tg) полімеру відносно повідону (полівінілпіролідону, ПВП гомополімеру). Значення коефіцієнту К для коповідону становить від 25 до 31, й так як К-значення розраховується на основі кінематичної в’язкості 1% водного розчину, воно пов’язане із середньою молекулярною масою полімеру. Середня молекулярна маса (Mw) коливається від ~ 24000 до 30000. 3 UA 106878 C2 5 10 15 20 25 30 35 40 45 50 55 60 Згідно одного аспекту винаходу пропонується фармацевтична композиція, що містить 4-[3(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он в твердій дисперсії з коповідоном. В одному з варіантів винаходу фармацевтична композиція підходить для введення пацієнту через слизову оболонку. Зокрема, шлях введення через слизову оболонку є пероральним, наприклад, таблетки або капсули, і тому подібне. Винахід також пропонує добову фармацевтичну дозу 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону, доза якого включає терапевтично ефективну кількість 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Нфталазин-1-ону в твердій дисперсії з матричним полімером, який має низьку гігроскопічність та високу температуру розм’якшення. В одному з варіантів винаходу матричний полімер являє собою коповідон. В наступному варіанті фармацевтична композиція вводиться пацієнту через слизову оболонку. В особливому варіанті, терапевтично ефективна кількість 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону знаходиться в діапазоні від 10 до 1000 мг, в ще одному варіанті доза становить від 25 до 400 мг 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону. У відповідності з іншим аспектом винаходу пропонується фармацевтична композиція, що містить 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он у твердій дисперсії з коповідоном, та що включає одну або декілька додаткових сполук, використовуваних в лікуванні раку. В одному з варіантів здійснення винаходу фармацевтична композиція призначена для введення пацієнту через слизову оболонку. У відповідності з іншим аспектом винаходу пропонується пероральний фармацевтичний склад, що містить тверду аморфну дисперсію, що містить активну речовину та щонайменше один матричний полімер, в якому матричний полімер має низьку гігроскопічність та високу температуру розм’якшення та в якій активна речовина являє собою 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он або його фармацевтично прийнятну сіль або сольват. Подальші аспекти винаходу стосуються використання матричного полімеру, який має низьку гігроскопічність та високу температуру розм’якшення, такого як коповідон, в твердій дисперсії з 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-оном або його фармацевтично прийнятною сіллю або сольватом, у виробництві лікарського засобу, особливо для лікування раку, а також, способу лікування раку, що включає введення пацієнту, який потребує такого лікування, терапевтично ефективної кількості композиції, що містить 4-[3(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он або його фармацевтично прийнятну сіль або сольват, в твердій дисперсії з матричним полімером, який має низьку гігроскопічність та високу температуру розм’якшення, таким як коповідон. В таких аспектах, ліки можуть містити від 10 до 1500 мг Сполуки 1, наприклад, від 10 до 1000 мг та 25 400 мг. Подальші аспекти винаходу стосуються: способу підвищення біодоступності препарату 4-[3(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону у пацієнта, що потребує вказаної активної речовини, що включає введення вказаному пацієнту композиції, що містить 4-[3-(4-циклопропанкарбоніл піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1он в твердій дисперсії з матричним полімером, який має низьку гігроскопічність та високу температуру розм’якшення, та, добову фармацевтичну дозу 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону для лікування раку у пацієнта, причому доза становить від 10 до 1000 мг 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4фтор-бензил]-2Н-фталазин-1-ону в твердій дисперсії з матричним полімером, який має низьку гігроскопічність та високу температуру розм’якшення. В особливому варіанті цих аспектів матричний полімер являє собою коповідон. У відповідності з іншим аспектом винаходу пропонується спосіб одержання твердої аморфної дисперсії 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Нфталазин-1-ону, що включає: (I) змішування підходящої кількості 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4фтор-бензил]-2Н-фталазин-1-ону або його фармацевтично прийнятної солі або сольвату з бажаною кількістю щонайменше одного матричного полімеру, причому матричний полімер має низьку гігроскопічність та високу температуру розм’якшення; (II) підвищення температури суміші для одержання розплаву, а також (III) екструзію розплаву для одержання твердого продукту. На етапі (III) розплав може бути екструдований у вигляді твердого стрижня, який потім може бути додатково оброблений, наприклад, шляхом розмелювання, для одержання порошку, який 4 UA 106878 C2 5 10 15 20 25 30 35 40 45 50 55 підходить для використання у фармацевтичній композиції. Крім того, розплав може екструдуватися в одну або декілька форм. Такі форми можуть, наприклад, забезпечуватися для продуктів певної форми, таких як еліптична форма або форма таблетки. На етапі (II) розплав може бути зроблений шляхом застосування теплового та/або механічного тиску. У відповідності з різними аспектами винаходу особливе співвідношення 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он: матричний полімер за масою становить від 1:0,25 до 1:10. Більш краще нижня межа діапазону становить 1: ≥ 4, 1:5 або 1:7. Переважно, верхня межа цього діапазону становить 1: ≤ 2, 1:1, 1:0,5 або 1:0,3. Підходящі співвідношення становлять 1:2, 1:3 і 1:4. В одному з варіантів здійснення винаходу, діапазон становить від 1: ≥ 2 до 1:10. В іншому варіанті, тверда дисперсія включає поверхневоактивну речовину та/або пластифікатор. Подальше обговорення поверхнево-активних речовин та пластифікаторів приводиться нижче. Використовувана авторами фраза "терапевтично ефективна кількість" означає дозу препарату, яка забезпечує специфічну фармакологічну відповідь, для якої препарат вводять значній кількості пацієнтів, що потребують такого лікування. Підкреслюється, що терапевтично ефективна кількість препарату, яку вводять певному пацієнту в конкретному випадку, не завжди буде ефективною при лікуванні станів/захворювань, описаних авторами, навіть якщо такі дози вважаються спеціалістами в даній галузі терапевтично ефективною кількістю. Наприклад, терапевтично ефективна кількість 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фторбензил]-2Н-фталазин-1-ону може становити 25 мг, 50 мг, 100 мг, 150 мг , 200 мг, 250 мг, 300 мг, 400 мг, 500 мг, 600 мг або 750 мг один або два рази на добу. Композиції твердої дисперсії винаходу мають підвищену біодоступність і потенціал завантаження активної речовини і, таким чином, ймовірно, знадобиться менше дозованих одиниць у порівнянні зі звичайними/з негайним вивільненням композиціями 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону. Один з аспектів винаходу пропонує добову фармацевтичну дозу 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону для лікування раку в пацієнтів, причому доза становить від 10 до 1500 мг 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону у твердій дисперсії з матричним полімером, який має низьку гігроскопічність і високу температуру розм’якшення, таким як коповідон. В одному з варіантів фармацевтична доза вводиться пацієнтові через слизову оболонку. В іншому варіанті доза становить від 25 до 600 мг 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону. У різних варіантах здійснення винаходу, доза становить 1500, 1250, 1000, 800, 700, 600, 500, 450, 400, 300, 250, 225, 200, 175, 150, 125, 100, 75, 50, 25, 15 або 10 мг 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону. Зокрема варіанти, в яких доза становить 25, 50, 100, 200 або 400 мг 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону. У композицію або дозу можуть бути включені додаткові допоміжні речовини. Наприклад, композиція або доза може включати один або кілька наповнювачів, зв'язувальних речовин, розпушувачів та/або мастильних матеріалів. До підходящих наповнювачів відносяться, наприклад, лактоза, цукор, крохмаль, модифікований крохмаль, маніт, сорбіт, неорганічні солі, похідні целюлози (наприклад, мікрокристалічна целюлоза, целюлоза), сульфат кальцію, ксиліт і лактит. До підходящих зв'язувальних речовин відносяться, наприклад, лактоза, крохмаль, модифікований крохмаль, цукор, акацієва камедь, трагакантова камедь, гуарова камедь, пектини, воскоподібні зв'язувальні речовини, мікрокристалічна целюлоза, метилцелюлоза, карбоксиметилцелюлоза, гідроксипропілметилцелюлоза, гідроксиетилцелюлоза, гідроксипропілцелюлоза, кополівідон, желатин, полівінілпіролідон (ПВП) і альгінат натрію. До підходящих розпушувачів відносяться, наприклад, кроскармелоза натрію, кросповідон, полівінілпіролідон, крохмальний гліколят натрію, кукурудзяний крохмаль, мікрокристалічна целюлоза, гідроксипропілметилцелюлоза та гідроксипропілцелюлоза. До підходящих мастильних матеріалів відносяться, наприклад, стеарат магнію, стеарат лаурилсульфат магнію, стеарилфумарат натрію, стеаринова кислота, стеарат кальцію, стеарат цинку, бензоат калію, бензоат натрію, міристинова кислота, пальмітинова кислота, мінеральні масла, гідрогенізована касторова олія, середньоланцюгові тригліцериди, полоксамер, поліетиленгліколь і тальк. 5 UA 106878 C2 5 10 15 20 25 30 35 40 45 50 55 60 Додаткові стандартні допоміжні речовини, які можуть бути додані, включають консерванти, стабілізатори, антиоксиданти, кремнеземні кондиціонери потоку, речовини, що перешкоджають злипанню, або гліданти. Інші підходящі наповнювачі, зв'язувальні речовини, розпушувачі, мастильні матеріали та додаткові допоміжні речовини, які можуть бути використані, описані в Handbook of Pharmaceutical Excipients, 5th Edition (2006); The Theory and Practice of Industrial Pharmacy, 3rd Edition 1986; Pharmaceutical Dosage Forms 1998; Modern Pharmaceutics, 3rd Edition 1995; Remington's Pharmaceutical Sciences 20th Edition 2000. У деяких варіантах здійснення 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фторбензил]-2Н-фталазин-1-он буде присутній у кількості від 10 до 70%, і, бажано, від 15 до 50% (більш переважно від 20 до 30 % або від 25 до 35 %) від маси твердої дисперсії. У деяких варіантах здійснення один або кілька наповнювачів будуть присутні в кількості від 1 до 70 % від маси композиції або дози. У деяких варіантах здійснення одна або кілька зв’язуючих речовин будуть присутні в кількості від 2 до 40 % від маси композиції або дози. У деяких варіантах здійснення один або кілька розпушувачів будуть присутні в кількості від 1 до 20 %, і особливо від 4 до 10 % від маси композиції або дози. Варто мати на увазі, що певна допоміжна речовина може діяти і як зв'язувальна речовина і як наповнювач, або як зв'язувальна речовина, наповнювач та розпушувач. Звичайно, загальна кількість наповнювача, зв'язувальної речовини та розпушувача становить, наприклад, від 1 до 90% від маси композиції або дози. У деяких варіантах здійснення, один або кілька мастильних матеріалів будуть представлені в кількості від 0,5 до 3%, і особливо від 1 до 2% від маси композиції або дози. У деяких варіантах здійснення винаходу одна або кілька поверхнево-активних речовин будуть присутні у твердій дисперсії в кількості від 0,1 до 50%, переважно ≤ 5% (наприклад, від 1 до 2%), від маси твердої дисперсії. Присутність поверхнево-активної речовини забезпечує подальше збільшення терапевтичного потенціалу, досягнутого з даним винаходом. Приклади підходящих поверхнево-активних речовин включають: аніонні поверхнево-активні речовини, такі як додецилсульфат натрію (натрію лаурилсульфат); докузат натрію; катіонні поверхнево-активні речовини, такі як цетрімід, бензетонійхлорид, цетилпіридинійхлорид і лауринова кислота; неіонні поверхнево-активні речовини, такі як поліоксиетиленалкілові ефіри, ефіри поліоксиетиленсорбіту та жирних кислот, наприклад, полісорбати 20, 40, 60 і 80; похідні поліоксиетилену та касторової олії, наприклад, Кремофор RH40, поліоксиетиленстеарати та полоксамери. У деяких варіантах здійснення винаходу один або кілька пластифікаторів будуть присутні у твердій дисперсії в кількості від 0,1% до 50%, переважно ≤ 5% (наприклад, від 1 до 2%) від маси твердої дисперсії. Наявність пластифікатору може підвищити технологічність твердої дисперсії, наприклад, при використанні процесу екструзії розплаву. Приклади підходящих пластифікаторів включають: ацетилтрибутилцитрат, ацетилтриетилцитрат, бензилбензоат, хлорбутанол, декстрин, дибутилфталат, диетилфталат, диметилфталат, гліцерин, гліцерину моностеарат, маніт, мінеральне масло, ланолінові спирти, пальмітинову кислоту, поліетиленгліколь, полівінілацетату фталат, пропіленгліколь, 2-піролідон, сорбіт, стеаринову кислоту, триацетин, трибутилцитрат, триетаноламін і триетилцитрат. Термін "тверда дисперсія", використовуваний авторами, означає системи, у яких активна речовина розсіюється в носії - допоміжній речовині. Що стосується стану активної речовини в системах, тверді дисперсії в цьому контексті можуть включати композиції, у яких активна речовина розсіяна у вигляді дискретних доменів кристалічної або аморфної активної речовини, або у вигляді окремих молекул всередині носія - допоміжної речовини. Що стосується повного композиту активної речовини - допоміжної речовини, тверді дисперсії можуть являти собою відносно великі тверді маси, такі як гранули, таблетки, плівки або нитки, або вони можуть існувати у вигляді сипучих порошків, що складаються із первинних часток мікро- або нанорозмірів або їх агрегатів. Об'ємний стан композиції твердої дисперсії багато в чому залежить від режиму обробки (Miller, D. A., McGinty, J. W., Williams III, R. O. Solid Dispersion Technologies. Microencapsulation of Oil-in-Water Emulsions 172 (2008) pp 451-491). У даному винаході визначення твердої дисперсії не охоплює фізичні суміші з операцій сухого або вологого змішування або сухого змішування. Способи одержання твердих дисперсій відомі в даній галузі та, як правило, включають стадії розчинення активної речовини і полімеру в спільному розчиннику та випаровування розчинника. Розчинник може рутинно вибиратися залежно від використовуваного полімеру. Приклади розчинників включають: ацетон, ацетон/дихлорметан, метанол/дихлорметан, ацетон/вода, 6 UA 106878 C2 5 10 15 20 25 30 35 40 45 50 55 60 ацетон/метанол, ацетон/етанол, дихлорметан/етанол або етанол/вода. Методи для випаровування розчинника включають роторний випарник, розпилювальну сушку, ліофілізацію та випаровування тонких плівок. Крім того, видалення розчинника можна досягнути шляхом кріогенного заморожування після ліофілізації. Можуть бути використані інші способи, такі як екструзія розплаву, контрольоване осадження розчинника, рН контрольоване осадження, надкритична флюїдна технологія та кріогенне розмелювання. Цей винахід також розкриває спосіб одержання твердої дисперсії 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он:коповідон. Такий спосіб включає (i) розчинення підходящої кількості 4-[3-(4-циклопропанкарбоніл-піперазин-1карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону та матричного полімеру у спільному розчиннику та (ii) видалення розчинника. Фармацевтичні склади, що містять дисперсії, можуть бути отримані, наприклад, шляхом додавання таких матеріалів, як стабілізатори та/або додаткові допоміжні речовини, за необхідності. У окремому варіанті здійснення винаходу розчинник видаляють шляхом сушки розпиленням. Відповідно до іншого аспекту винаходу тверда дисперсія 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он: коповідон виготовляється шляхом екструзії розплаву. Такий спосіб включає додавання 4-[3-(4-циклопропанкарбоніл-піперазин-1карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону, або його фармацевтично прийнятної солі або сольвату, і полімеру коповідону, та будь-яких додаткових необов'язкових допоміжних речовин, у тому числі пластифікаторів, в апарат для екструзії розплаву, суміш потім нагрівають з перемішуванням і, нарешті, видавлюють продукт твердої дисперсії. Екструдер нагріває суміш до температури, досить високої, щоб розплавити суміш, але досить низької, щоб не розклалися складові. Відповідно до іншого аспекту винаходу пропонується спосіб одержання твердої аморфної дисперсії 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1ону, що включає одночасно піддавання 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4фтор-бензил]-2Н-фталазин-1-ону або його фармацевтично прийнятної солі або сольвату і, принаймні, одного матричного полімеру, де матричний полімер має низьку гігроскопічність і високу температуру розм’якшення, екструзії гарячого розплаву. Відповідно до іншого аспекту винаходу пропонується спосіб одержання продукту твердої дисперсії 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1ону, що включає: (а) надання порошкоподібного або гранульованого преміксу, що включає: (i) 5-60% за масою 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Нфталазин-1-ону, і, (ii) 40-95% коповідону; (б) плавлення преміксу, без додавання розчинника, у мішалці або екструдері для одержання однорідного розплаву, і (в) формування та застигання розплаву для одержання продукту твердої дисперсії. В одному з варіантів здійснення винаходу продукт твердої дисперсії формується в підходящу дозовану форму, готову для перорального прийому. В іншому варіанті здійснення винаходу продукт твердої дисперсії перемелюють, змішують з одним або декількома додатковими допоміжними речовинами та інгредієнтами, і таблетують або інкапсулюють у підходящу дозовану форму. Коли мова йде про тверду дисперсію, ми не виключаємо можливості того, що частка 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону може бути розчинена в матричному полімері, точна пропорція, за наявності, буде залежати від конкретного вибраного полімеру. У композиціях винаходу, принаймні, деякі з 4-[3-(4-циклопропанкарбоніл-піперазин-1карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону можуть бути присутніми в аморфній формі у твердій дисперсії з матричним полімером. Забезпечення 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону в аморфній формі додатково вигідно, тому що це додатково збільшує розчинність і швидкість розчинення 4-[3-(4циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону, тим самим підвищуючи збільшення терапевтичного потенціалу, досягнутого за допомогою даного винаходу. Чи присутня активна речовина в аморфній формі може бути визначено шляхом стандартного термічного аналізу або рентгенівської дифракції. В одному з варіантів здійснення принаймні 25% 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Нфталазин-1-ону в композиції знаходиться в аморфній формі, що визначається за допомогою XRPD. Більш бажано, ця кількість становить не менше 30%, 40%, 50%, 75%, 90%, 95%, що 7 UA 106878 C2 5 10 15 20 25 30 35 40 45 50 55 60 визначається за допомогою XRPD. Найбільш кращий варіант здійснення винаходу, у якому 100% 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону в композиції знаходиться в аморфній формі. У дійсності наявні інструменти XRPD і методи можуть виявити > 5% кристалічної форми, а, отже, неможливість виявлення кристалічної форми може означати, що зразок аморфний на 95% - 100%. XRPD може бути доповнений новими нанометодами: парна функція розподілу (перетворення картини рентгенівської дифракції в нормовану функцію розсіювання) може сприяти виявленню нанокристалічності; дослідження спін-протонової дифузії ЯМР твердого тіла можуть бути використані для виявлення поділу фаз, а також атомно-силова мікроскопія та нанотермальний аналіз. Такі способи є порівняльними, а не абсолютними, але корисними інструментами у розвитку та оптимізації фармацевтичних композицій твердої дисперсії. В іншому варіанті здійснення винаходу активна речовина знаходиться в стабільній аморфній формі, для якої мають на увазі, що стабільність (здатність залишатися в аморфній формі та протистояти перетворенню в кристалічну форму) аморфного стану Сполуки 1 поширюється в композиції твердої дисперсії винаходу відносно стабільності аморфного стану Сполуки 1 окремо. У кращому варіанті здійснення винаходу композиції та дози вводять через слизову, тобто вводять в слизові оболонки для поглинання через них. Для цього бажані способи їх введення включають введення шляхом інгаляції, а також пероральне, інтраназальне та ректальне введення. Пероральне введення особливо бажане. Таблетки, капсули або інші форми композиції вибираються кваліфікованим фахівцем відповідно до шляхів введення. Однак не можна виключити інші шляхи введення, наприклад, парентеральний. 4-[3-(4-циклопропанкарбоніл-піперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он корисний для забезпечення інгібіторного ефекту на полі-АДФ-рибоза полімеразу (ПАРА). Цей ефект використовується для лікування раку, наприклад, раку молочної залози або раку яєчників, і, зокрема видів раку, які мають дефект у залежному від гомологічної рекомбінації (HR) шляху репарації дволанцюгових розривів ДНК (DSB), таких як рак BRCA1+ та/або BRCA2 + ve. Інший аспект винаходу стосується композиції 4-[3-(4-циклопропанкарбоніл-піперазин-1карбоніл)-4-фтор-бензил]-2Н-фталазин-1-ону, що включає 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фтор-бензил]-2Н-фталазин-1-он у твердій дисперсії з коповідоном, та що включає одну або кілька додаткових сполук, використовуваних у лікуванні раку. Зокрема, корисні "додаткові" протиракові сполуки включають засоби, що сприяють пошкодженню ДНК. Агент, що сприяє пошкодженню ДНК, являє собою сполуку (таку, як невелика органічна молекула, пептид або нуклеїнова кислота), яка збільшує кількість пошкоджень ДНК у клітині, прямо або побічно, наприклад, шляхом інгібування репарації ДНК. Агент, що сприяє пошкодженню ДНК, часто являє собою органічну сполуку - невелику молекулу. Підходящі агенти, що сприяють пошкодженню ДНК, включають агенти, які пошкоджують ДНК у клітині (тобто агенти, що пошкоджують ДНК), наприклад, алкілуючі агенти, такі як метилметансульфонат (MMS), темозоломід, дакарбазин (DTIC), цисплатин, оксаліплатин, карбоплатин, цисплатин-доксорубіцин-циклофосфамід, карбоплатин-паклітаксел, циклофосфамід, азотистий іприт, мелфалан, хлорамбуцил, бусульфан, етопозид, теніпозид, aмсaкрин, іринотекан, топотекан і рубітекан та нітрозосечовини, інгібітори топоізомерази-1, такі як топотекан, іринотекан, рубітекан, ексатекан, луртотекан, гіметекан, дифломотекан (гoмoкaмптoтецини); а також 7-заміщені несілатекани; 7-сілілкaмптoтецини, BNP 1350; і не камптотецинові інгібітори топоізомерази-I, такі як індолокарбазоли, інгібітори топоізомерази II, такі як доксорубіцин, данорубіцин, та інші рубіцини, акридини (амсaкрин, m-AMSA), мітоксантрон, етопозид, теніпозид і AQ4, подвійні інгібітори топоізомерази-I і II, такі як бензофеназини, XR 11576/MLN 576 і бензoпіридoіндоли, і антиметаболіти, такі як гемцитабин, антифолати, такі як фторпіримідини, такі як 5-фторурацил і тегафур, рaлтітрексед, метотрексат, цитозинарабінозид, і гідроксисечовини, та триоксид миш'яку. Пацієнт може являти собою людину, наприклад, дорослого або дитину, але також розглядається лікування інших ссавців. Аспекти даного винаходу будуть проілюстровані з посиланням на супровідні фігури, описані нижче, і експериментальні приклади, які наведені як приклади, але не обмежують галузь винаходу. Інші аспекти та варіанти здійснення винаходи будуть очевидні для фахівця в даній галузі. Фігура 1 представляє проникність Сполуки 1 у моношари Како-2 (N = 3, ± s.d.). Фігура 2 представляє розчинення in vitro різних композицій Сполуки 1. Фігура 3 представляє термограму твердої дисперсії, що показує перехід розплаву у зв'язку з наявністю кристалічної Сполуки 1. 8 UA 106878 C2 5 10 15 20 25 30 35 40 45 Фігура 4 представляє зображення таблетки, яка зображує монокристал Сполуки 1 у способі високотемпературної мікроскопії. Фігура 5 представляє PDF спектри для твердих дисперсій Сполуки 1 і коповідону за різних завантажень активної речовини. Фігура 6 представляє порівняння PDF спектрів для твердих дисперсій Сполуки 1 і коповідону з імітованими спектрами для фізичних сумішей за різних завантажень активної речовини. Фігура 7 представляє TM-AFM топографічне (висота) зображення, зображення відхилення кінця (погрішність) і фази (механічні властивості) з 50 мкм х 50 мкм і 10 мкм х 10 мкм сканів для твердих дисперсій Сполуки 1 і коповідону при 10% завантаженні активної речовини. Фігура 8 представляє TM-AFM топографічне (висота) зображення, зображення відхилення кінця (погрішність) і фази (механічні властивості) з 50 мкм х 50 мкм і 10 мкм х 10 мкм сканів для твердих дисперсій Сполуки 1 і коповідону при 30% завантаженні активної речовини. Фігура 9 представляє TM-AFM топографічне (висота) зображення, зображення відхилення кінця (погрішність) і фази (механічні властивості) з 50 мкм х 50 мкм і 10 мкм х 10 мкм сканів для твердих дисперсій Сполуки 1 і коповідону при 40% завантаженні активної речовини. На Фігурі 10 представлена XRPD дифрактограма для форми H Сполуки 1. На Фігурі 11 представлений типовий DSC слід для форми H Сполуки 1. На Фігурі 12 представлена XRPD дифрактограма для Opadry. На Фігурі 13 представлений інфрачервоний спектр Сполуки 1. На Фігурі 14 представлені інфрачервоні спектри Aqoat MG, HP55S, Pharmacoat, повідону та коповідону. На Фігурі 15 представлений синхронний спектр Aqoat MG, анотований квадратами кореляції. На Фігурі 16 представлений асинхронний спектр Aqoat MG. На Фігурі 17 представлений синхронний спектр HP55S. На Фігурі 18 представлений асинхронний спектр HP55S. На Фігурі 19 представлений синхронний спектр HP55S (висока чутливість). На Фігурі 20 представлений синхронний спектр Pharmacoat. На Фігурі 21 представлений асинхронний спектр Pharmacoat. На Фігурі 22 представлений асинхронний спектр Pharmacoat (висока чутливість). На Фігурі 23 представлений синхронний спектр повідону. На Фігурі 24 представлений синхронний спектр повідону (висока чутливість). На Фігурі 25 представлений асинхронний спектр повідону. На Фігурі 26 представлений синхронний спектр коповідону. На Фігурі 27 представлений синхронний спектр коповідону (висока чутливість). На Фігурі 28 представлений асинхронний спектр коповідону. На Фігурі 29 представлений асинхронний спектр коповідону (висока чутливість). На Фігурі 30 представлений графік залежності концентрації в плазмі від часу для різних композицій Сполуки 1. Приклад 1. Характеристики Сполуки 1 1.1 Розчинність Розчинність кристалічної форми А Сполуки 1 вимірювали у воді та діапазоні рН буферних розчинів, що представляють фізіологічний діапазон рН. Фізична форма будь-якої нерозчиненої (або осадженої) Сполуки 1 не оцінювалася за допомогою XRPD після визначення розчинності. Зазначені розчинності наведено в Таблиці 1. Кристалічна форма А Сполуки 1 представлена в WO2008/047082. Таблиця 1 Розчинність кристалічної Сполуки 1 (Форма А) -1 у діапазоні буферів, що представляють фізіологічний діапазон рН (мг.мл ) Середовища Вода 0,1 M HCl pH 3 цитратний буфер pH 6,8 фосфатний буфер pH 9 буфер 0,1M NaOH 1 год 0,124 0,128 0,124 0,111 0,116 0,650 9 pH 5,6 1,2 2,9 6,9 8,9 12,5 24 год 0,109 0,114 0,112 0,096 0,102 0,599 pH 6,0 1,2 2,9 6,9 8,8 12,4 UA 106878 C2 Розчинність Сполуки 1 також вимірювалася в реальних і модельних шлунково-кишкових середовищах (Таблиця 2). Розчинність в HIF і FeSSIF була помітно вищою, ніж розчинності в буферах, представлені в Таблиці 1. Таблиця 2. Розчинність кристалічної Сполуки 1 (Форма А) у реальних та модельованих шлунково-кишкових середовищах Рівноважна розчинність -1 (мг.мл ), 24 години 0,12 0,15 0,2 0,13 0,17 Середовища 1 Модельний шлунковий сік (SGF) 2 Людський шлунковий сік (HGF) 3 Модельна кишкова рідина в ситому стані (FeSSIF) 3 Модельна кишкова рідина натщесерце (FeSSIF) 2 Людська кишкова рідина (HIF) 1 SGF містить 3,2 г пепсину, 2,0 г хлориду натрію, та 7,0 мл соляної кислоти на літр. Взято від здорових добровольців, наданих університетом Упсала, п/я 256, 751 05 Uppsala, Швеція 3 Marques, M. Dissolution media simulating fasted and fed states. Dissolution Technologies (May 2004) pp 16. 2 5 10 1.2 Проникність Сполука 1, за визначеннями, є помірно проникною у порівнянні з маркером високої проникності пропранололом, що досліджувалося за допомогою провалідованої клітинної лінії Како-2, результати наведено в Таблиці 3 і на Фігурі 1. Сполука 1, як показано, має схильність до витікання через P-gp при низьких концентраціях (10 мкм), що інгібується селективним інгібітором P-gp Elacridar (GF120918; GG918, N-(4-[2-(1,2,3,4-тетрагідро-6,7-диметокси-2ізохіноліл)етил]феніл)-9,10-дигідро-5-метокси-9-оксо-4-акридинкарбоксамід, гідрохлорид. Таблиця 3 Проникність Сполуки 1 у моношарах Како-2 (n = 3, ± стандартне відхилення), у порівнянні з маркером високої проникності пропранололом і маркером витікання дигоксином -1 Концентрація (мкM) 10 10 з Elacridar 260 700 Пропанолол Дигоксин Papp (cм.сeк ) A- до-B B- до -A 3,67±0,34 23,70±2,84 10,34±1,38 14,29±0,93 7,75±0,88 17,75±1,19 8,4±0,41 15,06±1,42 19,97±2,57 21,48±0,33 1,34±0,03 12,22±1,37 Умовні позначки: А = апікальний; B = базолатеральний Див. Фігуру 1. 15 Приклад 2. Полімерні характеристики 10 Співвідношення витікання 6,5 1,4 2,3 1,8 1,1 9,1 UA 106878 C2 Таблиця 4 Характеристики полімерів, використовуваних у фармацевтичних композиціях твердої дисперсії Полімер Клас Постачальник Коповідон Kollidon VA64 Kollidon 17PF Повідон Kollidon 25 Kollidon 30 Гіпромелози фталат HP55S (HPMCP) HP55 Aqoat LF Гіпромелози ацетат Aqoat LG сукцинат (HPMCAS) Aqoat MG 2-гідроксипропіл-βКлептоза HP циклодекстрин (HPBCD) Гіпромелоза (HPMC) Полі(метакрилова кислота, етилакрилат) 1:1 Полі(метакрилова кислота, метилметакрилат) 1:1 Полі(бутилметакрилат, (2-диметиламіноетил) метакрилат, метилметакрилат) 1:2:1 кислота, етилакрилат) 1:1 Полі(метакрилова кислота, метилметакрилат) 1:2 Поліетиленгліколь (PEG) Полоксамер BASF SE Shin-Etsu Chemical Co., Ltd Гігроскопічність a (% мас/мас) 5 16 4 4 Точка b розм'якшення Tg (C) Tm (C) 106 н/з 136 н/з 155 н/з 168 н/з 145 н/з 145 н/з 120 н/з 120 н/з 130 н/з Roquette Freres 7 278 н/з Shin-Etsu Chemical Co., Ltd 4 175 н/з Eudragit L100-55 4 115 н/з Eudragit L100 6 160 # н/з Eudragit E100 1 48 н/з Eudragit S100 11 160 н/з Fluka AG 2 н/з 55-63 н/з 52-57 BASF SE 2 н/з 52-57 Pharmacoat 606 Evonik Degussa Gmbh PEG 6000 Pluronic (Lutrol) F68 Pluronic (Lutrol) F127 Гідроксипропілцелюлоза Klucel EF (HPC) Целюлози ацетат Aquacoat CPD фталат (CAP) # Hercules, Inc. 5 130 н/з FMC Biopolymer 6 176 н/з Умовні позначки: н/з = не застосовується а Рівноважний вміст води при 50% відносній вологості (літературні значення) b Температура розм'якшення у вигляді температури склування (Tg) або плавлення (Tm) - дані постачальників # Точне визначення не можливе внаслідок хімічного розкладання Приклад 3. Скринінгове дослідження - полімерні дисперсії 3.1 Протокол 5 11 UA 106878 C2 Таблиця 5 Протокол для скринінгового дослідження твердих дисперсій Сполуки 1 Полімер Система розчинників Завантаження активної речовини (% мас/мас) Добавка (% мас/мас) PEG 6000 Полоксамер F68 Полоксамер F127 PVP K25 PVP K30 HPMC 606 HPMC Фталат Eudragit L100-55 Eudragit E100 Клептоза HPC Коповідон Поліакрилова кислота c Клептоза/PVP K25 d Клептоза/ HPMC606 а Полоксамер F127, PVP K30, гідроксипропілцелюлоза, коповідон та поліакрилова кислота не оцінювалися в DCM/MeOH b Тільки PVP K25, HPMC Фталат та Клептоза оцінювалися без добавки при 33% завантаженні с Суміш Клептоза/PVP K25 оцінювали за допомогою системи розчинників ацетон/метанол тільки в співвідношенні 5:70 і 10:65 при 25% завантаженні активної речовини та у співвідношенні 5:45 і 10:40 при 50% завантаженні активної речовини, без добавки d Суміш Клептоза/HPMC606 оцінювали, як описано вище для суміші Клептоза/PVP K25 5 10 15 3.2 Методологія Серії розчинів 4% мас/мас, що включають бінарні суміші Сполуки 1 і кожного з полімерів у пропорціях, зазначених у протоколі, були підготовлені шляхом зважування в 1,8-мл флаконах і розчинення в зазначеній системі розчинників. Далі розчини, що містять потрійні суміші Сполуки 1, полімеру і поверхнево-активної речовини, були підготовлені в такий же спосіб. Розчинник видаляли шляхом випарювання при 40 ºС в атмосфері азоту (потік 10 мл/хв., тиск 0,7 бар) протягом 15 хвилин з наступним сушінням протягом ночі в повному вакуумі для одержання твердої дисперсії. Отримані зразки оцінювалися за допомогою XRPD (дифрактометр Bruker GADDS, збір даних при кімнатній температурі з використанням випромінювання CuKα в області 2θ між 1,5 до 41,5), відразу ж після підготовки та після зберігання протягом до 1 місяця при 30 °C і 60% відносній вологості. 3.3 Результати Таблиця 6 Результати скринінгового дослідження твердої дисперсії Сполуки 1 Полімер PEG6000 PEG6000 PEG6000 PEG6000 PEG6000 PEG6000 Система розчинників DCM/MeOH DCM/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Актив. речовина (% мас/мас) 25 50 25 50 33 33 12 Добавка Відс. Відс. Відс. Відс. SLS Твін 80 XRPD (кристалічна сполука 1) Після 30C/60%RH приг. 1 тиждень 1 місяць N/D Присутня N/T N/D Присутня N/T N/D Присутня N/T N/D Присутня N/T N/D N/T Присутня N/D N/T Присутня UA 106878 C2 Продовження таблиці 6 PEG6000 Полоксамер F68 Полоксамер F68 Полоксамер F68 Полоксамер F68 Полоксамер F68 Полоксамер F68 Полоксамер F68 Полоксамер F127 Полоксамер F127 PVP K25 PVP K25 PVP K25 PVP K25 PVP K25 PVP K25 PVP K25 PVP K25 PVP K30 PVP K30 HPMC-606 HPMC-606 HPMC-606 HPMC-606 HPMC-606 HPMC-606 HPMC-606 HPMC Фталат HPMC Фталат HPMC Фталат HPMC Фталат HPMC Фталат HPMC Фталат HPMC Фталат Eudragit L100-55 Eudragit L100-55 Eudragit L100-55 Eudragit L100-55 Eudragit L100-55 Eudragit L100-55 Eudragit L100-55 Eudragit E100 Eudragit E100 Eudragit E100 Eudragit E100 Eudragit E100 Eudragit E100 Eudragit E100 Клептоза HP Клептоза HP Клептоза HP Клептоза HP Ацетон/MeOH DCM/MeOH DCM/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH 33 25 50 25 50 33 33 33 Doc. Na Відс. Відс. Відс. Відс. SLS Твін 80 Doc. Na N/D N/D N/D N/D N/D N/D N/D N/D N/T Присутня Присутня Присутня N/D N/T N/T N/T Присутня N/T N/T N/T N/T Присутня Присутня Присутня Ацетон/MeOH 25 Відс. N/D Присутня N/T Ацетон/MeOH 50 Відс. N/D Присутня N/T DCM/MeOH DCM/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH DCM/MeOH DCM/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH DCM/MeOH DCM/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH DCM/MeOH DCM/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH DCM/MeOH DCM/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH DCM/MeOH DCM/MeOH Ацетон/MeOH Ацетон/MeOH 25 50 25 33 50 33 33 33 25 50 25 50 25 50 33 33 33 25 50 33 33 33 33 33 25 50 25 50 33 33 33 25 50 25 50 33 33 33 25 50 25 33 Відс. N/D Відс. N/D Відс. Відс. N/D Відс. SLS N/D Твін 80 N/D Doc. Na N/D Відс. N/D Відс. N/D Відс. N/D Відс. N/D Відс. Відс. SLS N/D Твін 80 N/D Doc. Na N/D Відс. N/D Відс. N/D Відс. Відс. SLS N/D Твін 80 Doc. Na N/D Відс. N/D Відс. N/D Відс. N/D Відс. N/D SLS N/D Твін 80 N/D Doc. Na N/D Відс. N/D Відс. N/D Відс. N/D 1 Відс. Присутня SLS N/D Твін 80 N/D Doc. Na N/D Відс. N/D Відс. N/D Відс. N/D Відс. N/D 13 N/D N/T N/D N/T Не збирали N/D N/T Не збирали N/T N/D N/T N/D N/T N/D N/D N/T N/D N/T N/D N/T N/D N/T Не збирали Не збирали N/T N/D N/T N/D N/T N/D N/D N/T N/D N/T Не збирали Не збирали N/T N/D Не збирали N/T N/D Присутня N/T Присутня N/T N/D N/T N/D N/T N/T N/D N/T N/D N/T N/D N/D N/T N/D N/T N/D N/T 1 N/T Присутня N/T N/D N/T N/D N/T N/D N/D N/T N/D N/T N/D N/T N/T N/D UA 106878 C2 Продовження таблиці 6 Клептоза HP Клептоза HP Клептоза HP Клептоза HP HPC HPC Коповідон Коповідон Клептоза / PVP K25 (70:5) Клептоза / PVP K25 (45:5) Клептоза / PVP K25 (65:10) Клептоза / PVP K25 (40:10) Клептоза / HPMC-606 (70:5) Клептоза / HPMC-606 (45:5) Клептоза / HPMC-606 (65:10) Клептоза / HPMC-606 (40:10) Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH Ацетон/MeOH 50 33 33 33 25 50 25 50 Відс. Відс. Відс. Відс. Відс. Відс. Відс. Відс. N/D N/D N/D N/D N/D N/D N/D Присутня N/D N/T N/T N/T N/D N/D N/D Присутня N/T N/D N/D N/D N/T N/T N/T N/T Ацетон/MeOH 25 Відс. N/D N/T N/D Ацетон/MeOH 50 Відс. N/D N/T N/D Ацетон/MeOH 25 Відс. N/D N/T N/D Ацетон/MeOH 50 Відс. N/D N/T N/D Ацетон/MeOH 25 Відс. N/D N/D N/T Ацетон/MeOH 50 Відс. N/D N/D N/T Ацетон/MeOH 25 Відс. N/D N/D N/T Ацетон/MeOH 50 Відс. N/D N/D N/T Умовні позначки: N/D = не виявлено N/T = не випробовувалося 1 Тест проводився в рамках окремого дослідження на підставі інших даних Eudragit E100 5 10 15 20 Результати скринінгового дослідження показують, що підготовка аморфних твердих дисперсій була можливою для всіх полімерів, які оцінювалися. Однак, тверді дисперсії, отримані з використанням легкоплавких полоксамерів та поліетиленгліколю, були вкрай нестабільними, що приводило до формування кристалів активної речовини протягом 1 місяця при зберіганні при 30 °C/60% відносна вологість. Не проводилося ніякої додаткової оцінки цих полімерів. Тверді дисперсії, отримані з Eudragit E100 при 25% завантаженні активної речовини, виявилися аморфними та стабільними, однак кристалізація стала очевидною при 50% завантаженні активної речовини. Звіти в літературі вказують, що дисперсії, отримані з Eudragit E, можуть виявляти значну кристалічність (див., наприклад, Qi et al. Int. J. Pharm. 354:158-167, 2008), і, у порівняльному дослідженні, можуть бути менш хімічно стабільні, ніж тверді дисперсії, отримані з використанням повідону К25 (Dargel, E., Mielck, J.B. Acta Pharm. Technol. 35(4):197-209. 1989). Не проводилося ніякої додаткової оцінки Eudragit E100. Тверді дисперсії, отримані з Eudragit L100-55 з використанням системи розчинників DCM/MeOH, демонструють кристалізацію через 1 тиждень при температурі 30 °C/60% відносна вологість, але отримані з використанням системи розчинників ацетон/ метанол були стабільними. Ми виявили, що тверді дисперсії, отримані з коповідоном при 50% завантаженні активної речовини, показують деяку кристалізацію через 1 тиждень при температурі 30 °C/60% відносна вологість, але отримані при 25% завантаженні активної речовини були стабільними. Приклад 4. Композиції Сполуки 1 4.1 Таблетка з негайним вивільненням 4.1.1 Склад 14 UA 106878 C2 Таблиця 7 Склад таблетки з негайним вивільненням Інгредієнт Сполука 1 Лактоза Мікрокристалічна целюлоза Кроскармелоза Na Лаурилсульфат натрію Магнію стеарат Маса ядра таблетки 5 10 15 20 мг/таблетку 100,00 238,00 40,00 16,00 2,00 4,00 400,00 % маси ядра 25,00 59,50 10,00 4,00 0,50 1,00 Функція Активна речовина Наповнювач Наповнювач Дезинтегрант ПАР Змащувальна речовина 4.1.2 Спосіб виготовлення Стандартні таблетки з негайним вивільненням були виготовлені з використанням процесу прямого таблетування. Кристалічну Сполуку 1 і лактозу, мікрокристалічну целюлозу, кроскармелозу натрію та лаурилсульфат натрію зважили та помістили в скляний флакон, що зайняло близько 75% об'єму флакону, а потім змішали в барабанній мішалці протягом 30 хвилин. Змішаний матеріал просіяли через сито з 40 отворами (425 мкм), потім змішували в барабанній мішалці протягом ще 15хвилин. Потім додали стеарат магнію та суміш струшували вручну протягом 20 секунд. Отриману суміш потім розлили по 400 мг і спресували в таблеткові ядра за допомогою ручного преса, оснащеного 10-мм інструментом і з цільовою силою стискання в 0,5 тонни. 4.2 Мікросуспензія 4.2.1 Спосіб виготовлення Близько 1 г кристалічної Сполуки 1 зважили та помістили в 10-мл мірну колбу та до об'єму додали 0,5% розчин HPMC (гідроксипропілметилцелюлози або гіпромелози, USP заміна типу 2910 з номінальною очевидною в'язкістю 4000cР, така як DOW Methocel E4M або еквівалент). Суміш перемішували протягом ночі, потім кількісно розбавили до 100 мл за допомогою 0,5% розчину HPMC для одержання мікросуспензії з концентрацією 10 мг/мл. Середній об'ємний діаметр Сполуки 1 згідно з визначеннями становив 4,54 мкм за допомогою лазерної дифракції з використанням аналізатора розміру часток SYMPATEC (SYMPATEC GmbH). 4.3 Капсули Gelucire 4.3.1 Композиція Таблиця 8 Кількісний склад Сполуки 1, капсули по 50 мг Компонент Вміст капсули Сполука 1 Лауроїл макроголгліцерид (Лауроїл a поліоксилгліцерид) Капсула Гіпромелоза оболонка b капсули Діоксид титану Чорне чорнило Opacode (S1-7822/S-1-7823) а b Кількість в одній Кількість капсулі (мг) (% мас/мас) 50,0 10,0 450,0 90,0 розмір 0 1,84 0,0332 Кожна одиниця Кожна одиниця Кожна одиниця Постачається як Gelucire класу 44/14. Постачається як кришки капсули Capsugel V 25 15 Функція Стандарт Активна Допоміжна речовина, фармацевтична добавка Astrazeneca Вид лікарської форми USP, Ph Eur Заглушувач Pheur (Nfc) UA 106878 C2 5 10 15 4.3.2 Спосіб виготовлення Лауроїл макроголгліцерид (лауроїл поліоксилгліцерид) розплавили при 50 - 70ºС, зважили та помістили в посудину з нержавіючої сталі. Додали кристалічну сполука 1 і вміст перемішували до одержання однорідної суспензії. Змішування тривало, у той час як суміш розливали в капсулах до маси заповнення по 500 мг на капсулу з використанням термостатично контрольованої автоматизованої машини для наповнення капсул. 4.4 Розчинення іn vitro препаратів Сполуки 1 4.4.1 Спосіб випробування Розчинення виконували відповідно до загальної процедури для Апарату I Фармакопеї США (кошик) (APPARATUS I (BASKET)). Кількість матеріалу, що містила близько 100 мг Сполуки 1, точно зважили, потім перенесли в посудину для розчинення, що містила 500 мл тріс-буферу (0,05 М розчину тріс(гідроксиметил)амінометану, доведеного до рН 7,2 соляною кислотою) при температурі 37 °C і перемішували при 100 об/хв. Через 15, 30, 45 і 60 хвилин брали зразки по 10 мл та відфільтровували через 0,2-мкм фільтр PVDF. Концентрацію Сполуки 1 у фільтраті визначали ультрафіолетовою спектроскопією при довжині хвилі 278 нм. 4.4.2 Результати Таблиця 9 Розчинення іn vitro препаратів Сполуки 1 Зразок Тільки активна речовина Таблетка Мікросуспензія Капсули Gelucire (10% завантаження активної речовини) 20 25 30 35 40 45 15 хв. 15 72 70 37 Розчинення (% вивільнення) 30 хв. 45 хв. 60 хв. 75 хв. 90 хв. 105 хв. 120 хв. 28 43 51 58 62 68 71 81 85 87 89 90 91 92 75 77 78 79 79 80 80 92 97 99 99 100 100 100 Див. Фігуру 2. 4.5 Наносуспензія 4.5.1 Спосіб виготовлення Сполуку 1 змішали з декількома краплями носія (0,5% HPMC/0,1% Твін 80) у скляному флаконі та перемішували на «вихровій» мішалці протягом 1 хвилини, змочили та диспергували сполуку і сформували сипучу суспензію. Далі в суспензію додали певний об'єм носія для одержання концентрації активної речовини 50 мг/мл і отриману суспензію потім перемішували на «вихровій» мішалці протягом приблизно 1 хвилини. Суспензію з концентрацією активної речовини50 мг/мл перенесли в цирконієвий млин. Цирконієві кульки для млина (0,6-0,8 мм у діаметрі) додали в ємність млина до однакового рівня кульок і суспензії. Потім ємність запечатали тефлоновим кільцем і кришкою (діоксид цирконію) і розмістили на планетарному млині Fritsch P7. Другу ємність (як противагу) помістили на млин. Ємності обертали на млині при 800 об./хв. протягом 4 х 30 хвилин циклів (по 10 хвилин між кожним циклом). Потім ємності охолоджували протягом ще 15 хвилин і зразок з отриманої розмеленої кульками суспензії був взятий для аналізу. Наносуспензію відокремили від кульок млина, і розбавили до концентрації 10 мг/мл, готової для дозування. Розмір часток наносуспензії вимірювали за допомогою волоконно-оптичного квазіпружного розсіювання світла (FOQUELS) на інструментах Brookhaven – довжина хвилі лазера 635 нм. Визначався середній ефективний діаметр 692 +/- 8 нм. Рентгеноструктурний аналіз підтвердив, що активна речовина була по суті кристалічною. 4.6 Тверда дисперсія 4.6.1 Приготування шляхом процесу випаровування розчинників Тверді дисперсії зі співвідношенням 1:3 за масою сполука 1: полімер одержували в такий спосіб: 0,75 г Сполуки 1, підготовленої відповідно до прикладу 9 [сполука 168] в WO 2004/080976, і 2,25 г полімеру зважували прямо в 250-мл круглодонну колбу та розчиняли в 75 мл суміші метанол:дихлорметан (1:1). Розчинник видаляли на роторному випарнику. Композицію поміщали у вакуумну піч і сушили у високому вакуумі при температурі 40 °C протягом ночі. Композицію відбирали з колби та мололи в сухому вигляді, за необхідності використовуючи товкачик та ступку. Потім композицію зберігали у вакуумному ексикаторі до необхідності. 16 UA 106878 C2 5 10 15 20 25 Для того щоб одержати композиції, що мають інше співвідношення, ніж 1:3, маси та об'єми в процесі були скоректовані пропорційно описаним вище. 4.6.2 Приготування шляхом процесу екструзії розплаву Сполуку 1 змішували з полімером і глідантом у пропорціях, визначених у виробничій формулі. Суміш екструдували в двошнековому екструдері. Під час екструзії встановили вакуум в екструдері для дегазації розплаву. Екструдат каландрували шляхом пропускання через два каландерних валика, які оберталися в протилежних напрямках, а потім охолоджували перед перемелюванням. 4.6.3 Дослідження стабільності 4.6.3.1 Протокол Тверді дисперсії одержували з використанням процесу випаровування розчинника, описаного раніше (див. 4.6.1), і аморфну Сполуку 1 одержували відповідно до прикладу 9 [сполука 168] в WO 2004/080976. Зразки зберігалися в закритих HDPE пляшках з поліетиленовими вкладишами, з осушувачем, протягом 3 місяців у холодильнику (2-8 °C), довгострокових умовах (25 °C/60 % відносна вологість) і прискорених умовах (40 °C/75% відносна вологість). Крім того, зразки зберігалися протягом 1 місяця у відкритій чашці Петрі при 40 °C/75% відносна вологість. Зразки були випробувані до закладки, через 1 місяць, а для зразків у закритих контейнерах тільки при довгострокових та прискорених умовах через 3 місяця. 4.6.3.2 Методологія Розчинення Розчинення виконували відповідно до загальної процедури Фармакопеї Сполучених Штатів за допомогою Апарату II (лопатевий метод). Кількість твердої дисперсії, що містить близько 100 мг Сполуки 1, точно зважили, а потім помістили в 500-мл фосфатного буферу з pH 6,5 при температурі 37 °C і швидкості перемішування 75 об./хв. Через 5, 10, 20 і 45 хвилин було взято 2 мл зразка і вміст Сполуки 1 визначали за допомогою ВЕРХ. Таблиця 10 Умови хроматографування для тесту розчинення in vitro Апарат Колонка Елюенти Програма градієнта Швидкість потоку Температура Довжина хвилі Об'єм ін'єкції Час виконання Час утримання Сполуки 1 30 Рідинний хроматограф з УФ-Детектором Waters Sunfire C18, 4,6 мм x 50 мм (3,5 мкм або еквівалент) Елюент A: 0.1% TFA у воді Елюент B: 0.1% TFA в ацетонітрилі Час (хв) %A %B 0 65 35 0,8 65 35 0,81 5 95 1,8 5 95 1,81 65 35 3,5 65 35 1 мл/хв. прибл. 35 °C 276 нм 10 мкл 3,5 хв. 1 хв. прибл. Визначення кристалічності методом диференціальної скануючої калориметрії Зразок нагрівали в диференціальному скануючому калориметрі (TA Instruments Q1000) за допомогою програми, призначеної для відгону присутньої води та/або розчинника до охолодження зразка та нагрівання з постійною швидкістю в діапазоні температур, який охоплює перехід плавлення будь-якого кристалічного матеріалу, що може бути присутнім (Сполука 1 TM = 210° C) (див. Фігуру 3). 35 17 UA 106878 C2 Таблиця 11 Параметри для диференціальної скануючої калориметрії Загальні параметри Маса зразка (мг) Тарілчастого типу Атмосфера 2 – 10 Алюміній, проколотий Азот, 20-30 мл/хв Програма температур Урівноважують (30 хвилин) Охолоджують до Нагрівають при 5 °C/хв. Охолоджують Нагрівають при 5 °C/хв. Охолоджують 30 °C 0 °C 120 °C 0 °C 235 °C 4.6.3.3 Результати Таблиця 12 Результати дослідження стабільності полімерних дисперсій Сполуки 1 Композиція Клептоза 1:3 PVP 1:3 Аморфна сполука 1 Клептоза 1:2 PVP 1:2 HPMCP 1:3 HPMCP 1:2 2-8C 25C / 60% RH 40C / 75% RH Закритий Закритий Закритий Відкритий 1 місяць 1 місяць 3 місяця 1 місяць 3 місяця 1 місяць Diss DSC Diss DSC Diss DSC Diss DSC Diss DSC Diss DSC Diss DSC 90 N/D 88 N/D 91 N/D 92 N/D 87 N/D 84 N/D NT N/D 92 N/D 91 N/D 91 N/D 94 N/D 90 N/D 66 X NT X Початок NT N/D NT X NT X NT X NT X NT X NT X 81 81 99 97 NT N/D N/D N/D 82 81 91 98 N/D N/D N/D N/D 82 77 90 97 N/D N/D N/D N/D X 86 87 92 N/D N/D N/D N/D 76 85 87 91 N/D N/D N/D N/D 66 55 83 89 N/D N/D N/D N/D 81 NT 91 92 N/D X N/D N/D Умовні позначки: N/D = не виявлено N/T = не випробовувалося Diss = розчинення (сукупне вивільнення) за 45 хвилин, % DSC = Кристалічність, обумовлена методом диференціальної скануючої калориметрії RH = відносна вологість 5 10 Результати дослідження стабільності показують, що тверді дисперсії, отримані з використанням відносно гігроскопічного полімеру повідону, мають тенденцію до кристалізації при зберіганні при температурі 40 °C/75% відносна вологість, що приводить до зниження швидкості розчинення. Тверді дисперсії, отримані з використанням 2-гідроксипропіл-βциклодекстрину та гіпромелози фталату були стабільними за будь-яких умов випробування. 4.7. Тверда дисперсія коповідону (композиція таблетки без оболонки) 4.7.1 Композиція 18 UA 106878 C2 Таблиця 13 Склад таблетки без оболонки твердої дисперсії Сполука 1/коповідон Компоненти 15 20 200,00 25,00 Коповідон Колоїдний діоксид кремнію Маніт Натрію стеарилфумарат Маса ядра таблетки 10 Кількість (%) Сполука 1 5 Кількість (мг) Функція Стандарт Активний фармацевтичний Astrazeneca інгредієнт Полімерний носій NF і Ph Eur 460,00 57,50 14,64 1,83 Глідант NF і Ph Eur 117,36 14,67 Розчинний наповнювач NF і Ph Eur 8,00 1,00 Мастильний матеріал NF і Ph Eur 800,00 4.7.2 Спосіб приготування Тверді дисперсії Сполуки 1 та коповідону були отримані з використанням процесу екструзії розплаву, описаного в 4.6.2. Розмелений екструдат змішували з зовнішніми допоміжними речовинами та пресували у форму таблетки за допомогою одноштампувального ручного пресу для досягнення твердості в діапазоні 80-100 Н. 4.7.3 Дослідження стабільності – таблетки без оболонки 4.7.3.1 Протокол Таблетки без оболонки, отримані як описано в 4.7.2, зберігали в закритих HDPE пляшках з поліетиленовими вкладишами, з осушувачем, протягом 4 місяців при довгострокових умовах (25 °C/60% відносна вологість) і прискорених умовах (40 °C/ 75% відносна вологість). Зразки випробовували до закладки, а потім через 1, 3 і 4 місяця. 4.7.3.2 In Vitro оцінка Кристалічність визначалася за допомогою DSC, як описано в 4.6.3.2. Випробування на розчинність Спосіб розчинення був адаптований з описаного раніше для композицій твердої дисперсії (див. 4.6.3.2). Розчинення виконували відповідно до загальної процедури Фармакопеї Сполучених Штатів за допомогою Апарату II (лопатевий метод). Окремі дозовані одиниці були поміщені в 1000 мл фосфатного буферу при рH 6,5 при температурі 37 °C і швидкості перемішування 75 об/хв. Через 15, 30, 60, 90, 120 і 180 хвилин відібрали 1 мл зразку та вміст Сполуки 1 визначали за допомогою ВЕРХ: Таблиця 14 Умови хроматографування тесту розчинення in vitro для таблетки твердої дисперсії Сполука 1/ коповідон Хроматографічні умови Апарат Колонка Елюенти Програма градієнта Швидкість потоку Температура Довжина хвилі Об'єм інжекції Час виконання Час утримання Сполуки 1 Рідинний хроматограф з УФ-Детектором Waters Sunfire C18, 4,6 мм x 50 мм (3,5 мкм або еквівалент) Елюент A: 0,1% TFA у воді Елюент В: 0,1% TFA в ацетонітрилі Час (хв) %A %B 0 75 25 3,0 55 45 3,5 0 100 4,0 0 100 7,0 75 25 1 мл/хв. прибл. 40 °C 276 нм 10 мкл 7 хв. 2,9 хв. прибл. 19 UA 106878 C2 5 Кількісне визначення Сполуки 1 і домішок методом ВЕРХ Сполуку 1 і загальний вміст домішок визначали за допомогою високоефективної рідинної хроматографії (ВЕРХ). Був підготовлений дослідний розчин, що містив приблизно 0,4 мг/мл Сполуки 1, з використанням суміші 50:50 об/об ацетонітрил/вода як розчинника. Дослідний розчин відфільтрували через 0,2-мкм PVDF фільтр до аналізу. Ввели 10 мкл зразку в рухому фазу, що включала 0,05 % трифтороцтової кислоти (TFA) у воді (Елюент А) / 0,05% TFA в ацетонітрилі (Елюент B), як визначено програмою градієнту в таблиці 15 нижче. Таблиця 15 Програма градієнта – кількісне визначення Сполуки 1 і домішок Програма градієнту Час (хв) 0 20 28 30 30.1 36 %A 90 60 5 5 90 90 %B 10 40 95 95 10 10 10 15 20 Рухома фаза починається, як це визначено в нульовий момент часу, потім склад змінюють шляхом зміни частки Елюентів А і B поступово та у лінійній залежності від складу в кожному наступному моменті часу. Розділення домішок проводили з використанням колонки довжиною 15 см х внутрішній діаметр 4,6 мм, завантаженою стаціонарною фазою Waters Sunfire C18 з розміром часток 3,5 мкм. Швидкість потоку рухомої фази становила 1,0 мл/хв, а температура була на рівні 30 °C, концентрація домішки визначалася шляхом порівняння поглинання при 276 нм, вимірюваного за допомогою змінної довжини хвилі УФ-детектору, і такого для зовнішнього еталонного стандарту Сполуки 1. Вміст води визначали шляхом кулонометричного титрування за Карлом Фішером Вміст води визначали кулонометричним титруванням за Карлом Фішером з використанням кулонометру Metrohm 684. Зразки розмололи кульками до аналізу та вимірювання проводилися на зразку з розміром 200 мг. 4.7.3.3 Результати 25 Таблиця 16 Результати дослідження стабільності для таблетки твердої дисперсії Сполука 1/коповідон (200 мг, без оболонки) Початковий Кристалічність за допомогою DSC (Момент часу) (15 хв) (30 хв) Розчинення (60 хв) (90 хв) (120 хв) (180 хв) Вміст води (% мас/мас) Кількісне визначення (%) Домішки (%) 1 2 N/D 1 X 14 32 60 77 84 87 N/D 2 S 1.3 99.6 0.44 25 °C/60% 40 °C/75% відносна вологість відносна вологість 1 місяць 3 місяці 4 місяці 1 місяць 3 місяці 4 місяці 3 5 8 5 2 1 1 N/D 2 X S 15 2 33 3 62 4 82 8 89 6 91 4 1,3 98,6 0,44 Х - середній % вивільнення (n = 3) S - стандартне відхилення (n = 3) 20 1 N/D 2 1 N/D 2 X S X S 19 7 20 5 41 15 45 10 68 13 81 15 85 6 96 7 92 3 100 4 93 1 NT 1,6 1,3 101,1 98,1 0,44 0,43 1 N/D 2 X S 17 2 38 2 70 2 88 3 93 5 95 4 1,4 100,4 0,44 1 N/D 2 X S 14 1 33 3 62 7 80 7 88 5 91 4 1,7 100,5 0,44 1 2 X S 17 2 37 4 68 5 85 2 91 2 94 1 1,8 100,1 0,44 UA 106878 C2 4.8. Тверда дисперсія коповідону (композиція таблетки, покритої плівковою оболонкою) 4.8.1 Композиція Таблиця 17 Склад таблетки твердої дисперсії сполука 1/коповідон Компоненти Ядро таблетки Таблетка по 25 мг Таблетка по 100 мг Кількість (мг/таблетку) Функція Кількість (% маса ядра) Сполука 1 25,00 100,00 25,00 Коповідон Колоїдний діоксид кремнію Маніт Натрію стеарил фумарат Маса ядра таблетки 57,50 230,00 57,50 Активний фармацевтичний інгредієнт Полімерний носій 1,83 7,33 1,83 Глідант 14,67 58,67 14,67 Розчинний наповнювач 1,00 4,00 1,00 Змащувальна речовина 100,00 400,00 Оболонка таблетки Гіпромелоза (HPMC 2910) Діоксид титану (E171) Макрогол/ PEG 400 Оксид заліза жовтий (E172) Оксид заліза чорний (E172) Кількість (мг/таблетку) Кількість Функція (% маса оболонки) 2,19 8,75 62,5 Плівкоутворювач 0,88 3,51 25,05 Глушитель 0,22 0,88 6,25 Пластифікатор 0,16 0,64 4,55 Барвник 0,06 0,23 1,65 Барвник % маси ядра Номінальна оболонки 5 10 15 20 25 маса 3,50 14,00 3,50 4.8.2 Спосіб приготування Сполуку 1 змішували з полімером і глідантом у пропорціях, визначених у виробничій формулі. Суміш екструдували двошнековим екструдером. Під час екструзії встановили вакуум в екструдері для дегазації розплаву. Екструдат каландрували шляхом пропускання через два календорих вальця, які оберталися в протилежних напрямках, а потім остудили до перемелювання. Екструдат перемололи, а потім змішали з зовнішніми допоміжними речовинами. Порошкову суміш стиснули в таблеткові ядра за допомогою роторного пресу (Korsch XL 100 з 10 пуансонами), щоб досягнути достатньої твердості (мінімум 25 Н). Таблеткові ядра покрили оболонкою з використанням приладу для нанесення покриттів Driacoater Driam 600 з Opadry зелений (Colorcon 03B21726, 130 г/кг водний розчин). Загальна кількість розчину для нанесення оболонки відповідає 35 г Opadry на кг ядер таблеток. 4.8.3 Дослідження стабільності - таблетки, покриті плівковою оболонкою 4.8.3.1 Протокол Таблетки, покриті плівковою оболонкою, отримані як описано в 4.8.2, зберігалися в закритих HDPE пляшках з поліетиленовими вкладишами, з осушувачем, протягом 4 місяців при довгострокових умовах (25° C/60% відносна вологість) і прискорених умовах (40° C/75% відносна вологість). Зразки були випробувані до закладки, потім через 1 місяць, 3 і 4 місяця. 4.8.3.2 In Vitro оцінка Вміст води, активної речовини та домішок визначали з використанням способів, описаних у розділі 4.7.3.2. Визначення кристалічності шляхом високотемпературної мікроскопії 21 UA 106878 C2 5 10 Розмелені таблетки досліджували шляхом оптичної мікроскопії в поперечно-поляризаційних умовах при поступовому нагріванні по всьому спектру плавлення допоміжних речовин і Сполуки 1 для виявлення присутності кристалів активної речовини. Будь-які частки, видимі як двопроменезаломлюючі між 180 °C і 190 °C, які згодом розплавилися при приблизно 210 °C, були класифіковані як Сполука 1. Див. Фігуру 4 для прикладу кристалу активної речовини, видимого під мікроскопом. Випробування на розчинність Метод розчинення був адаптований з описаного раніше для композицій таблеток без оболонки (див. 4.7.3.2). Розчинення проводили відповідно до загальної процедури Фармакопеї Сполучених Штатів за допомогою Апарату I (метод кошика). Окремі дозовані одиниці були поміщені в 900 мл 0,3% SDS при температурі 37 °C і швидкості перемішування 100 об/хв. Через 15, 30, 45, 60 і 90 хвилин відібрали зразок і вміст Сполуки 1 визначили за допомогою ВЕРХ: Таблиця 18 Умови хроматографування тесту розчинення in vitro для таблетки твердої дисперсії Сполуки 1/ коповідону Апарат Колонка Елюенти Програма градієнту Швидкість потоку Температура Довжина хвилі Об'єм інжекції Час виконання Час утримання Сполуки 1 15 Умови хроматографування Рідинний хроматограф з УФ-детектором Waters Symmetry C18, 4,6 мм x 75 мм x 3,5 мкм Елюент A: 0,1% TFA у воді Елюент B: 0,1% TFA в ацетонітрилі Час (хв) %A %B 0 75 25 3.0 55 45 3.5 0 100 7.0 75 25 1 мл/хв. прибл. 40 °C 276 нм 10 мкл 7 хв 2,9 хв. прибл. 4.8.3.3 Результати Таблиця 19 Результати дослідження стабільності для таблетки твердої дисперсії Сполука 1/коповідон (25 мг), покритої плівковою оболонкою 25 °C/60% відносна 40 °C/75% відносна вологість вологість Початковий 13 26 13 26 4 тижні 4 тижні тижнів тижнів тижнів тижнів Кристалічність: Високотемпературна мікроскопія Ширококутне рентгенівське розсіювання (Момент часу) (15 хв.) (30 хв.) Розчинення (45 хв.) (60 хв.) (90 хв.) Вміст води (% мас/мас) Кількісний вміст (%) D (+) N/D 1 2 N/D N/T 1 D (++) N/D 2 X S X S 41 3,6 38 3,2 77 5,2 78 6,2 98 3,9 99 3,5 104 1,4 104 1,9 104 1,1 104 1,4 2,3 2,1 104,0 104,3 22 1 2 X S 41 3,8 78 4,8 99 3,4 104 1,0 104 1,0 2,2 103,5 D (+++) N/D 1 2 X S 41 2,9 81 4,5 102 2,3 105 1,3 105 1,5 2,0 102,5 N/D N/T 1 D (++) N/D 2 X S 39 2,8 77 3,7 98 3,9 103 4,8 103 4,5 1,9 102,0 1 2 X S 41 2,1 78 2,1 98 1,4 101 0,5 101 0,4 2,1 104,1 D (+++) N/D 1 2 X S 39 3,5 78 5,4 101 2,4 106 1,3 106 1,0 2,2 106,0 UA 106878 C2 Продовження таблиці 19 Домішки (%) 0,52 0,51 0,50 0,50 0,50 0,50 0,53 Умовні позначки: N/D = не виявлено D = виявлено; (+) 1-5 двопроменезаломлюючих плям (+ +); 5-30 двопроменезаломлюючих плям (+++); більше 30 двопроменезаломлюючих плям N/T = не випробовувалося 1 Х – середній % вивільнення (n = 3) 2 S – стандартне відхилення (n = 3) Таблиця 20 Результати дослідження стабільності для таблетки твердої дисперсії Сполука 1/коповідон (100 мг), покритої плівковою оболонкою 25 °C/60% 40 °C/75% відносна вологість відносна вологість Початковий 13 26 13 26 4 тижні 4 тижні тижнів тижнів тижнів тижнів Кристалічність: Високотемпературна мікроскопія Ширококутне рентгенівське розсіювання (Момент часу) (15 хв.) (30 хв.) Розчинення (45 хв.) (60 хв.) (90 хв.) Вміст води (% мас/мас) Кількісний вміст (%) Домішки (%) D (+) N/D 1 2 N/D N/T 1 D (+++) D (+++) N/D N/D 2 X S X S 24 0,5 24 1,0 55 1,0 54 1,3 80 1,6 80 1,6 97 1,0 97 1,1 101 0,8 101 0,5 2,0 1,7 102,5 100,5 0,50 0,49 1 2 X S 25 1,9 56 2,3 81 1,9 98 1,7 102 0,8 2,5 102,8 0,50 1 2 X S 26 1,1 60 1,6 87 1,5 102 0,5 104 0,8 1,6 102,2 0,50 D (+) N/T 1 2 X S 25 1,8 57 2,8 83 3,1 99 2,1 102 1,0 1,8 103,6 0,51 D (+) N/D 1 2 X S 25 1,2 56 2,1 81 2,1 97 2,1 101 0,8 2,2 100,8 0,49 D (++) N/D 1 2 X S 24 1,2 56 1,9 83 2,1 99 1,2 102 0,5 1,5 102,1 0,50 Умовні позначки: N/D = не виявлено D = виявлено; (+) 1-5 двопроменезаломлюючих плям (+ +); 5-30 двопроменезаломлюючих плям (+++); більше 30 двопроменезаломлюючих плям N/T = не випробовувалося 1 Х – середній %вивільнення (n = 3) 2 S – стандартне відхилення (n = 3) 5 10 15 Приклад 5 Дослідження характеристик нанометрового масштабу 5.1 Твердотільне ЯМР дослідження Тверді дисперсії Сполуки 1 і коповідону, підготовлені з завантаженнями активної речовини 10, 25, 35 і 40 % за допомогою процесу екструзії розплаву, описаного в 4.6.2, були оцінені за допомогою спектроскопії ядерного магнітного резонансу у твердому стані (SSNMR) з використанням методології, розкритої в Asano, A; Takegoshi, K.; Hikichi, K. Polymer (1994), 13 35(26), 5630-6. С крос-поляризаційні спектри SSNMR з обертанням під магічним кутом були записані на частоті 100 МГц зі швидкістю спіну 9 кГц за допомогою Bruker Avance 400WB з 4-мм зондом HFX MAS. Для кожного зразка за різних завантажень активної речовини була отримана серія спектрів з різними інтервалами контакту від 500 мкс до 10 мс. Були виміряні площі піку з різних спектральних областей. Ці площі були вибрані таким чином, щоб вони містили піки, що відповідають Сполуці 1 або коповідону. Зі збільшенням часу контакту збільшується площа піку до максимального значення, а потім розпадається через процес, відомий як протон-спінова дифузія. Цей розпад характеризується постійною T 1ρ, яка являє собою протонну спін-решітчасту релаксацію в обертовій системі відліку. Для системи з розділом фаз на масштабі більшому, ніж 23 UA 106878 C2 5 масштаб довжини спінової дифузії, швидкості релаксації для цього процесу розпаду ідентичні тим, які спостерігалися для окремих компонентів. Для змішаної системи, окреме значення T 1ρ спостерігається як середньозважене значення окремих компонентів. Для зразків із завантаженням Сполуки 1 від 10 до 40 % кожний розпад намагніченості може бути встановлений на окремій експонентній функції з дуже схожими значеннями T 1ρ. Це дозволяє припустити аналогічний шлях релаксації для активної речовини та полімеру та наводить на наявність однієї фази. Таблиця 21 Результати твердотільного ЯМР дослідження Завантаження Сполуки 1 40 % 35 % 25 % 10 % 10 15 20 25 30 35 45 Піки коповідону (167,0 – 183,0 ppm) 9,7 9,4 8,6 9,4 5.2 Дослідження парної функції розподілу Тверді дисперсії Сполуки 1 і коповідону, підготовлені із завантаженням активної речовини 10, 25, 35 і 40 % за допомогою процесу екструзії розплаву, описаного в 4.6.2, були оцінені з використанням рентгенівської порошкової дифракції, і парні функції розподілу (PDF) були отримані для кожного зразку. 5.2.1 Збір даних Дані рентгенівської порошкової дифракції були зібрані на дифрактометрі Bruker D8, який має мідне джерело генерації рентгенівського випромінювання з довжиною хвилі 1,5418Å (використовуються дзеркала Гебеля для забезпечення паралельної оптики пучка, щоб видалити kβ, залишаючи пучок з середньою довжиною хвилі kα1 і kα2) з використанням напруги в 40 кВ та термоелектронної емісії 40 мА. Зразки були виміряні в режимі відбивання та були зібрані зразки дифракції за допомогою скануючого позиційно-чутливого детектору. Була отримана дифрактограма нульового фону у вакуумі. Відважували по 50 мг (+ - 5 мг) кожної проби та диспергували на тримачі нульового фону, забезпечуючи практично повне покриття. Зразок додали в камеру ТТК, яку потім помістили під вакуумом до тиску
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical formulation 514
Автори російськоюBechtold, Michael, Karl, Packhaeuser, Claudia, Bettina, Cahill, Julie, Kay, Fastnacht, Katja,Maren, Liepold, Bernd, Harald, Lennon, Kieran, James, Stietz, Benedirt
МПК / Мітки
МПК: A61K 47/36, A61K 31/502, A61K 31/496, A61K 47/30, A61K 9/10
Мітки: твердий, сіль, дисперсії, фармацевтична, полімером, матричним, 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фторбензил]-2н-фталазин-1-он, сольват, композиція, містить, коповідоном
Код посилання
<a href="https://ua.patents.su/47-106878-farmacevtichna-kompoziciya-shho-mistit-4-3-4-ciklopropankarbonilpiperazin-1-karbonil-4-ftorbenzil-2n-ftalazin-1-on-abo-jjogo-sil-abo-solvat-u-tverdijj-dispersi-z-matrichnim-polimer.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить 4-[3-(4-циклопропанкарбонілпіперазин-1-карбоніл)-4-фторбензил]-2н-фталазин-1-он або його сіль, або сольват, у твердій дисперсії з матричним полімером коповідоном</a>
Попередній патент: Фармацевтична композиція ентакапону або його солей пролонгованого вивільнення
Наступний патент: Пачка для курильних виробів
Випадковий патент: Спосіб адаптації стискального зусилля інтелектуального робота та ідентифікації напрямку проковзування об'єкта маніпулювання