Кон’югат поліпептиду і синтетично сульфатованого пентасахариду, фармацевтична композиція на його основі
Номер патенту: 96916
Опубліковано: 26.12.2011
Автори: Сміт Мертінус Йан, ван Бекель Констант Адріаан Антон, Де Корт Мартін, Бос Ебо Сібрен
Формула / Реферат
1. Кон'югат поліпептиду і олігосахариду, в якому поліпептид кон'юговано до щонайменше одного залишку пентасахаридної прокладки, поліпептид має молекулярну масу приблизно 0,3-50 кДа, а олігосахарид є синтетично сульфатованим пентасахаридом і, як такий, має спорідненість до антитромбіну III, причому прокладка є зв'язком або суттєво фармакологічно неактивним гнучким зв'язувальним залишком, або фармацевтично прийнятна сіль цього кон'югату.
2. Кон'югат за п. 1, який має рівень циркуляційної плазми, що є нижчим або дорівнює 50 нМ.
3. Кон'югат за п. 1 або 2, в якому пентасахарид, як такий, має антикоагуляційну активність субтерапевтичного рівня порівняно з фармакологічною активністю поліпептиду як такого.
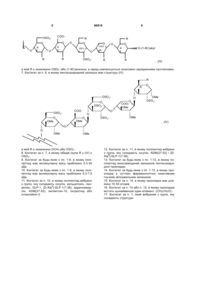
4. Кон'югат за будь-яким з пп. 1-3, в якому залишок пентасахаридної прокладки має структуру (І)
в якій присутнім є один суттєво фармакологічно неактивний гнучкий зв'язувальний залишок,
R є незалежно OSO3-, (1-8С)алкокси або суттєво фармакологічно неактивним гнучким зв'язувальним залишком,
Ra є незалежно OSO3-, (1-8С)алкокси, суттєво фармакологічно неактивним гнучким зв'язувальним залишком або олігосахаридним залишком, який містить 1-13 моносахаридних одиниць, і
Rb є незалежно (1-8С)алкокси, суттєво фармакологічно неактивним гнучким зв'язувальним залишком або олігосахаридним залишком, який містить 1-13 моносахаридних одиниць, а заряд компенсується позитивно зарядженими протиіонами.
5. Кон'югат за будь-яким з пп. 1-4, в якому залишок пентасахаридної прокладки має структуру (ІІ)
в якій присутнім є один суттєво фармакологічно неактивний гнучкий зв'язувальний залишок, a R є незалежно OSO3-, (1-8С)алкокси або суттєво фармакологічно неактивним гнучким зв'язувальним залишком, причому заряд компенсується позитивно зарядженими протиіонами.
6. Кон'югат за п. 5, в якому залишок пентасахаридної прокладки має структуру (III)
в якій R є незалежно OSO3- або (1-8С)алкокси, а заряд компенсується позитивно зарядженими протиіонами.
7. Кон'югат за п. 6, в якому пентасахаридний залишок має структуру (IV)
в якій R є незалежно ОСН3 або OSO3-.
8. Кон'югат за п. 7, в якому обидві групи R у (IV) є OSO3-.
9. Кон'югат за будь-яким з пп. 1-8, в якому поліпептид має молекулярну масу приблизно 0,3-20 кДа.
10. Кон'югат за будь-яким з пп. 1-9, в якому поліпептид має молекулярну масу приблизно 0,3-7,5 кДа.
11. Кон'югат за п. 10, в якому поліпептид вибрано з групи, яку складають інсулін, кальцитонін, ганірелікс, GLP-1, [D-Ala8]-GLP-1(7-36), адреномедулін, ADM(27-52), киспептин-10, октреотид або інтерлейкін-2.
12. Кон'югат за п. 11, в якому поліпептид вибрано з групи, яку складають інсулін, ADM(27-52) і [D-Аlа8]-GLP-1(7-36).
13. Кон'югат за будь-яким з пп. 1-12, в якому поліпептид монозаміщений залишком пентасахаридної прокладки.
14. Кон'югат за будь-яким з пп. 1-13, в якому прокладка є суттєво фармакологічно неактивним гнучким зв'язувальним залишком.
15. Кон'югат за п. 14, в якому прокладка має довжину 10-50 атомів.
16. Кон'югат за п. 14 або п. 15, в якому прокладка містить щонайменше один елемент -(СН2СН2О)-.
17. Кон'югат за п. 1, який вибраний з групи, яку складають структури
,
a Y вибрано з групи, яку складають структури А, В, С і D
18. Кон'югат за п. 17, в якому Y вибрано з групи, яку складають структури А і В.
19. Кон'югат за п. 1, який має структуру:
20. Кон'югат за п. 1, який має структуру:
21. Фармацевтична композиція, яка містить кон'югат за будь-яким з пп. 1-20 і фармацевтично придатні допоміжні інгредієнти.
22. Кон'югат за будь-яким з пп. 1-21, призначений для застосування у терапії.
Текст
1. Кон'югат поліпептиду і олігосахариду, в якому поліпептид кон'юговано до щонайменше одного залишку пентасахаридної прокладки, поліпептид має молекулярну масу приблизно 0,3-50 кДа, а олігосахарид є синтетично сульфатованим пентасахаридом і, як такий, має спорідненість до антитромбіну III, причому прокладка є зв'язком або суттєво фармакологічно неактивним гнучким зв'язувальним залишком, або фармацевтично прийнятна сіль цього кон'югату. 2. Кон'югат за п. 1, який має рівень циркуляційної плазми, що є нижчим або дорівнює 50 нМ. 3. Кон'югат за п. 1 або 2, в якому пентасахарид, як такий, має антикоагуляційну активність субтерапевтичного рівня порівняно з фармакологічною активністю поліпептиду як такого. 4. Кон'югат за будь-яким з пп. 1-3, в якому залишок пентасахаридної прокладки має структуру (І) COO O O COO O COOO O R R R R R R R O в якій присутнім є один суттєво фармакологічно неактивний гнучкий зв'язувальний залишок, a R є незалежно OSO3 , (1-8С)алкокси або суттєво фармакологічно неактивним гнучким зв'язувальним , (I) R O R Rb Rb є незалежно (1-8С)алкокси, суттєво фармакологічно неактивним гнучким зв'язувальним залишком або олігосахаридним залишком, який містить 1-13 моносахаридних одиниць, а заряд компенсується позитивно зарядженими протиіонами. 5. Кон'югат за будь-яким з пп. 1-4, в якому залишок пентасахаридної прокладки має структуру (ІІ) OSO3 O R O O R OSO3 в якій присутнім є один суттєво фармакологічно неактивний гнучкий зв'язувальний залишок, R є незалежно OSO3 , (1-8С)алкокси або суттєво фармакологічно неактивним гнучким зв'язувальним залишком, Ra є незалежно OSO3 , (1-8С)алкокси, суттєво фармакологічно неактивним гнучким зв'язувальним залишком або олігосахаридним залишком, який містить 1-13 моносахаридних одиниць, і OSO2 4 O COO O OSO3 R O O R R R R , (II) залишком, причому заряд компенсується позитивно зарядженими протиіонами. 6. Кон'югат за п. 5, в якому залишок пентасахаридної прокладки має структуру (III) 5 96916 COO OSO2 O O O R O R O R R O COO OSO3 O R R 6 O O-(1-8C)akyl R R OSO3 O O R R , (III) в якій R є незалежно OSO3 або (1-8С)алкокси, а заряд компенсується позитивно зарядженими протиіонами. 7. Кон'югат за п. 6, в якому пентасахаридний залишок має структуру (IV) R R OSO3 COO OSO3 OMe O OMe OSO3 O O O OMe O O COOOMe O OSO3 O OSO3 OMe , (IV) O O OMe OMe в якій R є незалежно ОСН3 або OSO3 . 8. Кон'югат за п. 7, в якому обидві групи R у (IV) є OSO3 . 9. Кон'югат за будь-яким з пп. 1-8, в якому поліпептид має молекулярну масу приблизно 0,3-20 кДа. 10. Кон'югат за будь-яким з пп. 1-9, в якому поліпептид має молекулярну масу приблизно 0,3-7,5 кДа. 11. Кон'югат за п. 10, в якому поліпептид вибрано з групи, яку складають інсулін, кальцитонін, гані8 релікс, GLP-1, [D-Ala ]-GLP-1(7-36), адреномедулін, ADM(27-52), киспептин-10, октреотид або інтерлейкін-2. 12. Кон'югат за п. 11, в якому поліпептид вибрано з групи, яку складають інсулін, ADM(27-52) і [D8 Аlа ]-GLP-1(7-36). 13. Кон'югат за будь-яким з пп. 1-12, в якому поліпептид монозаміщений залишком пентасахаридної прокладки. 14. Кон'югат за будь-яким з пп. 1-13, в якому прокладка є суттєво фармакологічно неактивним гнучким зв'язувальним залишком. 15. Кон'югат за п. 14, в якому прокладка має довжину 10-50 атомів. 16. Кон'югат за п. 14 або п. 15, в якому прокладка містить щонайменше один елемент -(СН2СН2О)-. 17. Кон'югат за п. 1, який вибраний з групи, яку складають структури 7 96916 8 , a Y вибрано з групи, яку складають структури А, В, С і D 18. Кон'югат за п. 17, в якому Y вибрано з групи, яку складають структури А і В. 19. Кон'югат за п. 1, який має структуру: 9 96916 10 20. Кон'югат за п. 1, який має структуру: 21. Фармацевтична композиція, яка містить кон'югат за будь-яким з пп. 1-20 і фармацевтично придатні допоміжні інгредієнти. 22. Кон'югат за будь-яким з пп. 1-21, призначений для застосування у терапії. Винахід стосується нових кон'югатів поліпептиду і олігосахариду, способу їх приготування, фармацевтичних композицій, що містять ці сполуки як активні інгредієнти, а також їх застосування у виготовленні медикаментів. Сучасні процедури, пов'язані з рекомбінант ною ДНК, і удосконалені методи синтезу пептидів дозволяють промислове виготовлення медично корисних кількостей терапевтичних поліпептидів. Однак, коротке напівжиття багатьох терапевтичних поліпептидів завжди створювало проблеми, пов'язані з введенням цих сполук пацієнту. Існують де 11 кілька важливих сучасних базованих на поліпептидах ліків, для яких сприятливим було б збільшення напівжиття. Прикладами є ритропойетин, інсулін, інтерферон -2b, інтерферон , інтерферон , фактор стимуляції колонії гранулоцитів, людський гормон росту, фактор стимуляції колонії гранулоцитних макрофагів, релаксин, урокіназа, стрептокіназа, активатор тканинного плазміногену, кальцитонін, інтерлейкін-2 і фактор некрозу пухлини з напівжиттям (значно) меншим декількох годин. Інсулін, наприклад, має напівжиття тривалістю лише приблизно 12 хвил. у людині. Інші приклади поліпептидів, які можуть бути потенційними терапевтичними агентвми, але мають коротке напівжиття, є адреномедулін, глюкагеноподібний пептид (GLP-1) і киспептин (мета-стин). Подовження напівжиття терапевтичних поліпептидів може поліпшити існуючі методи лікування і знизити дози і частоту введення цих ліків пацієнту (Curr. Opin. Drug Disc. Dev. 2005, 8,590-600). Були проведені дослідження багатьох протеїнів з метою збільшенні їх напівжиття in vivo, наприклад, адаптацією PEG-улюванням (тобто кон'югацією з поліетиленгліколевим компонентом з ~130 кДа (Drug Discovery Today 2005,70,1451-1458). Наприклад, є PEG-ульовані аналоги інсуліну з продовженим напівжиття. Окрім зниженої швидкості виведення важливою властивістю останніх похідних інсуліну є знижена імуногенність (див., наприклад, US 4 179 337) і підвищена розчинність. Подальше вивчення PEG-ульованого інсуліну дозволило отримати кон'югати, фізично і протеолітично більш стабільнії за первісний інсулін (див., наприклад WO 2004/091494, WO 2002/098232, US 2005/0152848). PEG-ульований еритропойетин з довгим напівжиттям у сироватці, наприклад, описано у WO 2004/022577. У подальшому було виявлено, що, змінюючи гліколізацію еритропойетину, можна збільшити напівжиття. Крім того, гіпергліколізовані аналоги еритропойетину, як було відзначено, мають вищу активність in vivo (WO 2000/24893). Іншими прикладами PEG-ульованих (полі)пептидів з більш тривалою активністю є глюкагоноподібний пептид-1 (GLP-1) (WO 2005/058954, WO 2004/093823; Bioconjucate Chem. 2005, 16, 377382; Biomaterials, 2005, 26, 3597-3606), глюкозозалежний інсулінотропічний поліпептид (GIP) (Bioorg. Med. Chem. Lett, 2005,75,4114-4117), кальцитонін (Pharm. Dev. Technol. 1999, 4, 269-275) і остреотид (Pharm. Res. 2005, 22,743-749). Однак, застосування PEG має певні обмеження. PEG отримують хімічним синтезом, і, подібно до усіх синтетичних полімерів, він є полідисперсним. Це означає, що частина PEG містить молекули з різними кількостями мономерів, що призводить до гаусівського розподілення молекулярних мас. PEG-улювання поліпептиду дає набір кон'югатів, які можуть мати різні біологічні властивості, зокрема, різні напівжиття і імуногенність. Отже, відтворюваність фармакологічної активності PEGульованих поліпептидів може бути серйозною вадою методів. Крім того, відомо, що PEG-улювання протеїнів часто супроводжується втратою біологічної активності, а використання PEG може створи 96916 12 ти проблеми з екскрецією з організму. Високомолекулярні PEG можуть накопичуватись у печінці, викликаючи макромолекулярний синдром. Тому PEG-улювання ліків слід проводити дуже обережно. Результати, подібні тим, що дає PEGулювання, можна отримати дериватизацією поліпептидів полісахаридами, зокрема, ланцюгами полісіалової кислот (див. WO 92/22331 і WO 2001/87922). У JP 02/231077 описано кон'югати гепарин дисмутаза супероксиду (SOD). Бажано, щоб кількість молекул гепарину, приєднаних до SOD, утворювала кон'югати з довшим напівжиттям, ніж первісна SOD і з збереженням приблизно 90% ензимної активності. Прикладами інших кон'югатів поліпептидів з подовженим напівжиттям є кон'юговані похідні інсуліну (WO 2003/013573, WO 05/012346) або GLP-1 (Bioorg. Med. Chem. Lett. 2004,14, 4395-4398), які приєднуються до циркулюючого альбуміну сироватки. Зв'язування з альбуміном сироватки у цих сполуках базується, зокрема, на гідрофобній взаємодії зв'язуючого компонента кон'югату з людським альбуміном сироватки. Чим вищою є гідрофобність цього компонента, тим сильнішою є зв'язувальна активність відносно людського альбуміну сироватки. Хоча придатними є численні зв'язуючі компоненти, вадою таких кон'югатів є низька спорідненість і селективність взаємодії кон'югату з людським альбуміном сироватки і, як результат, погана прогнозованість фармакодинамічної поведінки. Крім того, злиття гену людського інсуліну безпосередньо з геном людського альбуміну сироватки породжує довгодіючу форму інсуліну, активну у зниженні рівнів глюкози крові на тривалий час після підшкірного введення (Duttaroy et al Dibetes 2005, 54, 251-258). Однак, у цьому випадку біозасвоюваність злитого поліпептиду, а також зв'язувальна спорідненість до рецептора об'єкту знижується. У WO 2000/40253 описано кон'югати, наприклад, пептиду і, зокрема, глікозаміногліканових ланцюгів, які розглядаються як синтетичні протеоглікани. У цих кон'югатах фармакологічна активність кон'югованого глікозаміноглікану суттєво впливає на терапевтичну активність кон'югату. Крім того, олігосахариди, приєднані до фармацевтично активних сполук, підвищують їх розчинність (WO 2004/03971). Винахід стосується нових кон'югатів поліпептидів і олігосахаридів з підвищеним напівжиттям, в яких поліпептид кон'югований з щонайменше одним синтетичним сульфатованим залишком олігосахаридної прокладки, причому олігосахарид містить 4-18 моносахаридних одиниць і безпосередньо має спорідненість до антитромбіну III (AТIII), а прокладка є зв'язком або фармакологічно суттєво неактивним зв'язувальним залишком, або його фармацевтично прийнятною сіллю. Бажані олігосахариди складаються з 4-6 моносахаридних одиниць і є, зокрема, пентасахаридами. Кон'югати винаходу мають поліпшені фармакокінетичні властивості порівняно з вихідними поліпептидами (тобто тими, що відповідають некон'югованим поліпептидам як таким). 13 Винахід також стосується нової технології, базованої на процесі приготування терапевтично активного кон'югату, що містить поліпептид і має незначну антитромботичну активність, який включає операцію, якою синтетичний сульфатований олігосахарид, зокрема, пентасахарид з природною спорідненістю до антитромбіну III (ATIII) ковалентно приєднується до поліпептид через зв'язок або фармакологічно суттєво неактивний гнучкий зв'язувальний залишок. ATIII є інгібітором серинової протеази, яка присутня у плазмі крові і перериває коагуляційний каскад, утворюючи зворотний зв'язок. Напівжиття сульфатованого пентасахариду суттєво базується на спорідненості до ATIII (див. F. Paolucci et al. Clin. Pharmacokinet. 2002; 41 Suppl. 2: 11-18). У кон'югатах згідно з винаходом напівжиття сироватки перевищує напівжиття вихідного поліпептиду внаслідок того, що напівжиття пентасахариду суттєво визначає напівжиття кон'югату. Крім того, кон'югати винаходу не лише мають довше напівжиття, але й мають регульовані фармакокінетичні властивості, базовані на специфічній взаємодії між пентасахаридної частиною кон'югу і ATIII (див., наприклад, Westerduin et. al Bioorg. Med. Chem. 1994, 1267-1280; van Amsterdam et al, Arterioscler Thromb Vase Biol. 1995;15:495-503). У втіленні винаходу олігосахарид-поліпептидний кон'югат (олігосахарид, який, зокрема, містить 4-6 моносахаридних одиниць і переважно є пентасахаридом) має рівень циркулюючої плазми 100%). H ЯМР (MeOD): 3,67 (s, 2Н), 3,17 (t, 2Н), 2,29 (t, 2Н), 1,66-1,33 (m, 6Н). Приклад 2. 2,5-діоксопіролідин-1-іловий естер (3)6-(2-йодоацетиламіно)-гексанової кислоти До розчину 6-(2-йодоацетиламіно)-гексанової кислоти (2) (0,20 г, 0,67 ммоль) у ТГФ (10 мл) додають N-гідроксисукцинімід (85 мг, 0,74 ммоль) і 33 N,N'-дициклогексилкарбодіімід (0,21 г, 1,0 ммоль). Реакційну суміш перемішують у темряві 16 год. Після того, як аналіз ТШХ (EtOAc/Hep/AcOH, 80/20/1, об'єм/об'єм/об'єм) покаже повне перетворення в активований естер 3, додають 7 крапель оцтової кислоти. Суміш витримують у морозильнику протягом ночі (-20C), сиру суміш фільтрують і фільтрат концентрують in vacuo. Сирий продукт очищають колонною хроматографією (ЕtOАс/Нер/АсОН, 40/60/5 -> 20/80/5, об'єм/об'єм/об'єм) і концентрація належних фракції дає похідну N-гідроксисукцинімідного естеру 3 1 (0,18 г, 67%). H ЯМР (MeOD): 3,67 (s, 2H), 3,18 (t, 2Н), 2,82 (s, 4Н), 2,63 (t, 2H), 2,0-1,0 (m, 6Н). Приклад 3. Сполука 4 До суспензії інсуліну recH (50 мг, 8,6 мкмоль) у ДМФ (15 мл) додають H2O (9,0 мл) до прозорості розчину. Розчин перемішують 15 хвил. до досягнення кімнатної температури. рН розчин коригують до 10 доданням краплями 0,1 M NaOH у H2O. Потім реакційну колбу огортають фольгою і протягом 1 хвил. краплями додають розчин 3 (5,0 мг, 8,6 мкмоль) у ДМФ (1,0 мл). Реакційну суміш перемішують магнітним перемішувальним стриж 96916 34 нем і підтримують рН 10. Через 30 хвил. додають надлишок 0,1% ТФК у H2O (5,0 мл) для гасіння реакції. Додають H2O (200 мл) і реакційну суміш ліофілізують, отримуючи 4 (60 мг, >100%, max. 8,6 мкмоль). Аналіз PXBE (Shimadzu, зворотнофазний), починаючи з 80% елюенту А (0,1% ТФК у H2O) і 20% елюенту В (ACN) протягом 5 хвил., потім з градієнтом до 20% елюенту А і 80% елюенту В за 30 хвил., виявляє наявність 45% монозаміщеного продукту (інсулін recH Rt 12,84 хвил.; сполука 4: Rt 13,54 хвил.; В29/А1 дизаміщений продукт: Rt 14,16 хвил.). Сирий продукт використовують без очищення у наступній реакції. Приклад 4. Сполука 6 Сиру сполуку 4 (60 мг) розчиняють у дегезованому (пропусканням N2) 0,05М розчині NH2OH у буфері 0,1 M Na2HPO4 (25 мл, рН 7,0). Реакційну суміш перемішують магнітним перемішувальним стрижнем і дегазують протягом 30 хвил. (пропускаючи N2). Потім як тверду речовину додають пентасахаридну прокладку 5 (95 мг, 43 мкмоль), приготовлену, як це описано у Angew. Chem. Intl. Ed. (1996), 35, 331-333, і реакційну суміш перемішують в атмосфері нітрогену протягом 16 год. 35 96916 36 37 Очищення пентасахаридно-інсулінового кон'югату 6. З реакційної суміші попереднього розділу монозаміщений пентасахаридно-інсуліновий кон'югат 6 очищають до майже гомогенності аніонообмінною хроматографією (операція захоплення) і хроматографією з вилученням за розміром (завершальна операція). Кон'югатовмісний розчин вносять на колонку Q-Sepharose FF, еквілібровану у 20 ммоль/л натрійфосфатному буфері з PH 8,0. Після проходження через колонку незатриманої протеїнової фракції проводять інтенсивне промивання еквілібраційним буфером до повернення А280 до базового рівня. Зв'язаний інсулін, що не прореагував, елюють 0,4 моль/л NaCI і монозаміщеним пентасахаридно-інсуліновим кон'югатом при 0,7 моль/л NaCI згідно аналітичним XBEBP на Superdex 30 і MALDI-TOF-MS. Кон'югатну фракцію концентру 96916 38 ють ультрафільтрацією або аніонообмінною хроматографією, використовуючи 2 моль/л NaCI як елюєнтний буфер і вносять на препаративну колонку Superdex 30, еквілібровану у буферованому фосфатом розсолі. Фракції, що містять чистий монокон'югат (згідно з XBEBP і MALDI-MS) об'єднують, кінцевий продукт зберігають при -70C після швидкого заморожування у суміші етанол/сухий лід. Концентрацію кон'югату оцінюють вимірюванням А280 з коефіцієнтом абсорбції 0,8 для 1 мг/мл. Характеризація сполуки 6 Ідентичність очищеного пентасахаридноінсулінового кон'югату 6 визначають аналізом ELISA для інсуліну і аналізом на біомолекулярну взаємодію (BIA) з використанням рецептора людського інсуліну і людського АТІІІ як аналітів. Чистоту і мономерність оцінюють XBEBP на Superdex 30 і MALDI-MS. 39 Як показано на фіг. 1, дві порції пентасахаридно-інсулінового кон'югату 6 розпізнаються інсуліно-специфічним аналізом ELISA, який показує присутність імунореактивного інсулінового компонента. З експериментів BIA у Biacore можна дійти висновку, що кон'югований пентасахаридом інсулін може зв'язуватись з рецептором людського інсуліну (Фіг. 2А). У цих експериментах MoAb (клон М3222213, 10-130, група 223, Fitzgerald Industries International) для людського інсуліну іммобілізується на сенсорному уламку СМ5 з використанням стандартного аміносполучення. HBS-EP (Biacore, кат. No. 22-0512-44) використовують як текучий буфер з потоком 5 мкл/хвил. Ін'єкція інсулінового кон'югату забезпечує зв'язування кон'югату з іммобілізованим антитілом. Імунно-зв'язаний інсуліновий кон'югат може реагувати з рецептором людського інсуліну, а також з АТІІІ, який вказує на ковалентне приєднання пентасахариду (Фіг. 2В). Спектр MALDI-TOF пентасахаридноінсулінового кон'югату 6 отримано згідно з Матеріалами і Методами. До аналізу зразки були звільнені від солей і концентровані на uC18-ZipTips (Millipore Corporation, Billerica MA, USA). Елюювання проводили безпосередньо на плату MALDI з нержавіючої сталі у 1 мкл розчину, що містив 10 г/л альфа-ціано у 500 мл/л ACN/1 мл/л ТФК. Фіг. 3 містить типовий MC профіль MALDI-TOF монозаміщеного пентасахаридно-інсулінового кон'югату з піками поблизу m/z 6700 і 7400. Гетерогенність викликано індукованою лазером десульфатацією пентасахаридного компоненту, що призвело до втрати 80 Да. Дизаміщений пентасахаридноінсуліновий кон'югат не був виявлений в аналізі MALDI-TOF, оскільки не було виявлено піків поблизу характеристики m/z 9400 дизаміщеного інсуліну. Слід відзначити відсутність піків, які відповідають інсуліну, що не прореагував (m/z 5808). Аналіз XBEBP (Фіг. 4) показує головний пік з часом утримання 22 хвил. Оцінка чистоти - 97%. (Інсуліну, що не прореагував і дизаміщений кон'югат відсутні). Приклад 5. Сполука 11 Пентасахарид 7 (46 мг) [який можна отримати сполученням дериватизованого моносахариду 5, описаного у WO 2001/42262, з тетрасахаридом, отриманим за процедурою синтезу для тетрасахариду 30, описаною у Bioorg. Med. Chem. (1994), 2, 1267-1280, в якій відновлювальний кінець моносахаридного будівельного блоку 12 заміщується метил 2,3-ди-О-бензил-6-O-метил--Oглюкозою методами, подібними описаним у цих публікаціях, включаючи зняття захисту і сульфатування] і похідну гліколю 10 (18 мг, 1,6 екв.) розчиняють у ДМФ (5 мл) в атмосфері нітрогену. 96916 40 Додають NMM (61 мкл, 5 екв.) і реакційну суміш перемішують протягом ночі при зовнішній температурі. Розчинник випарюють in vacuo і залишок очищають препаративною аніонообмінною хроматографією. Відповідні фракції об'єднують і звільняють від солей на препаративній колонці G25. Об'єднані фракції ліофілізують, отримуючи 11 (29 мг, 57%) як білий порошок. Чистота - >98% (ана1 літичний аніонообмін, УФ210 нм) - H ЯМР (D2O, 400 МГц, HH-COSY): 5,31 (d, 4Н), 5,23 (m, 1Н), 4,91 (m, 1Н), 4,45-4,35 (m, 1Н), 4,48-3,93 (m, 11Н), 3,87-3,62 (m, 9Н), 3,60-3,45 (m, 39Н), 3,41-3,34 (m, 15Н), 3,33-3,23 (m, 7Н), 3,18-3,08 (m, 2Н), 2,97 (t, 2Н), 2,23 (s, 3Н). Приклад 6. Сполука 12 Пентасахарид 8 (0,2 г), приготовлений, як описано у WO 2001/42262 і похідну гліколю 10 (53 мг, 1,3 екв.), приготовлену, як описано у Angew. Chent. Intl. Ed. (1996), 35, 331-333, розчиняють у ДМФ (5,0 мл). Додають NMM (61 мкл, 5 екв.) і реакційну суміш перемішують протягом ночі при зовнішній температурі. Розчинник випарюють in vacuo і залишок очищають препаративною аніонообмінною хроматографією. Відповідні фракції об'єднують і звільняють від солей на препаративній колонці G25. Об'єднані фракції ліофілізують, отримуючи 12 (0,13 г, 55%) як білий порошок. Чистота - >95% (аналітичний аніонообмін, УФ210 1 нм) - H ЯМР (D2O, 400 МГц, HH-COSY): 5,12 (d, 1Н), 5,03 (d, 1Н), 4,70 (d, 1Н), 4,34-4,18 (m, 2Н), 4,09-4,03 (m, 1Н), 3,98-3,90 (m, 5H), 3,85-3,74 (m, 6Н), 3,66-3,48 (m, 7Н), 3,43-3,24 (m, 41Н), 3,233,15 (m, 13Н), 3,12 (m, 2Н), 3,10-3,01 (m, 7Н), 2,99-2,88 (m, 3Н), 2,78 (t, 2H), 2,04 (s, 3H). Приклад 7. Сполука 14 Пентасахарид 9 (100 мг) [який можна отримати сполученням дериватизованого моносахариду 5, описаного у WO 01/42262, з тетрасахаридом 48, описаним у US 2004/0024197, методами, подібними описаним у цих заявках, включаючи звільнення від солей і сульфатування] і сполукою 13 (18 мг, 1,5 екв.) розчиняють у ДМФ. Додають NMM (15 мкл, 2,5 екв.) і реакційну суміш перемішують протягом ночі при зовнішній температурі. Розчинник випарюють in vacuo і залишок очищають на препаративній колонці G25. Відповідні фракції об'єднують і ліофілізують, отримуючи 14 (84 мг, 79%) як білий порошок. Чистота: >95% 1 (аналітичний аніонообмін, УФ210 нм). H ЯМР (D2O, 400 МГц, HH-COSY): 5,12 (d, 1H), 5,09 (d, 1Н), 4,82 (d, 1H), 4,40-4,26 (m, 1Н), 4,10-3,87 (m, 8Н), 3,82-3,73 (m, 4H), 3,67-3,43 (m, 11Н), 3,41-3,35 (m, 14H), 3,31-326 (m, 13Н), 3,24-3,15 (m, 8H), 3,143,02 (m, 5H), 3,01-2,87 (m, 3Н), 2,08 (s, 3Н). 41 Приклад 8. Сполука 15 Інсулін recH (779 мг) розчиняють у безводному ДМСО (25 мл) і AcOH (465 мкл). Додають BoC2O (73 мг, 2,5 екв.) і отриману суміш перемішують 5 год. при зовнішній температурі. Реакцію гасять доданням 0,1% ТФК у H2O/ACN (9/1, об'єм/об'єм, 150 мл) і розчин ліофілізують 4 рази. Залишок розчиняють у 0,1% ТФК у H2O/ACN (9/1)/ACN (3:1) і головний продукт ізолюють препаративною РХВЕ. Відповідні фракції об'єднують і ліофілізують, отримуючи А1,В1-диВос-інсулін 15 (200 мг, 26%) як білий порошок. Чистота: 98% (аналітична РХВЕ). MC: обчислено для C267H399N65O81S6 - 6008, отримано на MALDI-TOF - 6008 (використовуючи інсулін recH як внутрішній стандарт). Приклад 9. Сполука 16 Інсулін recH (752 мг) розчиняють у безводному ДМСО (20 мл) і TEA (0,75 мл). Додають BoC2O (66 мг, 2,5 екв.) у ДМСО (5 мл) і реакцію перемішують при зовнішній температурі 1,5 год. і потім гасять доданням 0,1% ТФК у H2O/ACN (9/1, об'єм/об'єм, 150 мл) і суміш ліофілізують тричі. Отриманий залишок розчиняють у 0,1% ТФК у H2O/ACN (9/1) і піддають препаративній РХВЕ. Відповідні фракції об'єднують і (9/1) і піддають препаративній РХВЕ. Відповідні фракції об'єднують і ліофілізують, отримуючи А1,В29-диВосінсулін 16 як білий порошок (332 мг, 43%). Чистота - >98% (аналітична РХВЕ). MC: обчислено для C267H399N65O81S6 - 6008, отримано на MALDI-TOF 96916 42 - 6008 (використовуючи інсулін recH як внутрішній стандарт). Приклад 10. Сполука 17 А1,В1-диВос-інсулін 15 (200 мг) розчиняють у безводному ДМСО (5 мл) і додають триетиламін (145 мкл). Додають GMBS (45 мг, 5 екв.) і реакційну суміш перемішують 30 хвил. при зовнішній температурі. Реакційну суміш гасять доданням of 0,1% ТФК у H2O/ACN (9/1, об'єм/об'єм, 150 мл) і отриману суміш ліофілізують, отримуючи А1,В1диВос-В29-СМВ-інсулін 17 (0,5 г, сирий), який використовують без очищення. Приклад 11. Сполука 18 А1,В29-диВос-інсулін 16 (330 мг) розчиняють у безводному ДМСО (5 мл) і TEA (332 мкл). Додають GMBS (230 мг, 15 екв.) і реакційну суміш перемішують 30 хвил. при зовнішній температурі. Реакційну суміш гасять доданням 0,1% ТФК у H2O/ACN (9/1, об'єм/об'єм, 150 мл) і отриманий розчин ліофілізують, отримуючи А1,В29-диВосВ1-GMB-інсулін 18 (0,6 г, сирий), який використовують без очищення. Приклад 12. Сполука 19 А1,В1-диВос-В29-СМВ-інсулін 17 (0,5 г, сирий) розчиняють у ТФК (5 мл) і перемішують 10 хвил. при зовнішній температурі. ТФК видаляють під зниженим тиском, залишок розчиняють у 0,1% ТФК у H2O/ACN (2/1, об'єм/об'єм) і розчин негайно піддають препаративній РХВЕ. Відповідні фракції об'єднують і ліофілізують, отримуючи B29-GMB-інсулін 19 як білий порошок (93 мг, 43 47%). Чистота - >99% (аналітична РХВЕ). Приклад 13. Сполука 20 А1,В29-диВос-В1-СМВ-інсулін 18 (0,6 г, сир) розчиняють у ТФК (5 мл) і суміш перемішують 10 хвил. при зовнішній температурі. ТФК випарюють in vacuo, сирий продукт розчиняють у 0,1% ТФК у H2O/ACN (9/2, об'єм/об'єм) і отриманий розчин негайно піддають препаративній РХВЕ. Відповідні фракції об'єднують і ліофілізують, отримуючи B1-GMB-інсулін 20 як білий порошок (127 мг, 40%). Чистота - >99% (аналітична РХВЕ). MC: обчислено для C267H399N65O81S6 - 5973, отримано на MALDI-TOF - 5973 з використанням інсуліну recH як внутрішнього стандарту). Приклади 14-19 Загальна процедура кон'югації GMB-інсуліну з пентасахаридом GMB-інсулін 19 або 20 (25 мг) розчиняють у 0,1 M буфері Na2HPO4 (12 мл, рН 7,0, дегазованому пропусканням N2 через розчин). Розчин перемішують магнітним перемішувальним стрижнем і дегазують ще 30 хвил. Додають твердий пентасахарид 5, 11, 12 або 14 (23 мг, 2,5 екв.), і потім додають NH2OH (50 мкл, 0,05М). Реакційну суміш перемішують в атмосфері нітрогену при зовнішній температурі. Через 16 год. реакційну суміш піддають препаративній XBEBP (S75). Відповідні фракції об'єднують і ліофілізують, отримуючи інсулін-пентакон'югат 24, 25, 26, 27, 28, 29 як білий порошок з типовим виходом 30%-50%. Виходи визначають вимірюваннями A280 з тим же молярним коефіцієнтом послаблення, як для інсуліну recH. Приклад 14. Сполука 24 В29-GМВ-інсулін 19 (25 мг) кон'югують до пентасахариду 5 (23 мг) за загальною процедурою, отримуючи В29-пентасахаридно-інсулінову похідну 24 (15 мг, 45%). ESI-MC: обчислено для C320H487N67O137S14 - 7913, отримано на Q-TOF 3+ 4+ 5+ 6+ 2638,7 M ; 1979,2 M ; 1583,6 M , 1319,8 M . Чистота: >98% (аналітична HPSEC, аналітичний аніонообмін). 96916 44 Приклад 15. Сполука 25 B1-GMB-інсулін 20 (25 мг) кон'югують до пентасахариду 5 (23 мг) за загальною процедурою, отримуючи В1-пентасахаридно-інсулінову похідну 25 (16 мг, 47%). ESI-MC: обчислено для C32OH467N67O137S14 - 7913, отримано на Q-TOF 3+ 4+ 5+ 2637 M ; 1978 M ; 1583 M . Чистота: >95% (аналітична ХВЕВР), >98% (аналітичний аніонообмін). Приклад 16. Сполука 26 B29-GMB-інсулін 19 (13 мг) кон'югують до пентасахариду 14 (12 мг) за загальною процедурою, отримуючи В29-пентасахаридно-інсулінову похідну 26 (5 мг, 31%). ESI-MC: обчислено для C312H471N67O133S14 - 7737, отримано на Q-TOF 3+ 4+ 2578 M ; 1934 M . Чистота: >98% (аналітична HP- SEC). Приклад 17. Сполука 27 B1-GMB-інсулін 20 (15 мг) кон'югують до пентасахариду 14 (13 мг) за загальною процедурою, отримуючи В1-пентасахаридно-інсулінову похідну 27 (8 мг, 40%). ESI-MC: обчислено для С312H471N67O133S14 - 7737, отримано на Q-TOF 3+ 4+ 2578 M ; 1934 M . Чистота: >98% (аналітична HP- SEC). Приклад 18. Сполука 28 B29-GMB-інсулін 19 (15 мг) кон'югують до пентасахариду 12 (13 мг) за загальною процедурою, отримуючи В29-пентасахаридно-інсулінову похідну 28 (6 мг, 30%). ESI-MC: обчислено для C321H489N67O134S13 - 7847, отримано на Q-TOF 4+ 5+ 6+ 1962 M ; 1570 M ; 1308 M . ХВЕВР - чистота >98%. Приклад 19. Сполука 29 В29-СМВ-інсулін 19 (15 мг) кон'югують до пентасахариду 11 (13 мг) за загальною процедурою, отримуючи В29-пентасахаридно-інсулінову похідну 29 (7 мг, 33%). ESI-MC: обчислено для C322H491N67O131S12 - 7782, отримано на Q-TOF 3+ 4+ 5+ 2593 M ; 1945 M ; 1556 M . Чистота: >98% (аналітична ХВЕВР). 45 96916 46 47 96916 Характеризація Аналітична хроматографія з відбором за розміром Сполуки 24-29 піддають аналітичній XBEBP 48 на колонці Superdex 75 26/10. Елюювання проводять 50 мМ ацетатом амонію з потоком 1,0 мл/хвил. Таблиця 1 Аналізи XBEBP інсулінових кон'югатів 24-29 Сполука 24 25 26 27 28 29 інсулін recH Всі кон'югати спостерігали як одиночні піки (чистота щонайменше >95%), що підтверджує відсутність агрегованих форм інсулінпентасахариду. Аналіз N-термінальної послідовності Інсулін-пентасахаридний кон'югат 24-29 і відповідні попередники 15, 16, 19 і 20 були піддані аналізу N-термінальної послідовності (розкладання Едмана). У кожному з виконаних циклів В29 заміщені похідні інсуліну 15, 19, 24, 26, 28 і 29 давали еквімолярні кількості обох А- і Вланцюгів амінокислот на рівні, близькому до рівнів початкових кількостей кон'югату. Це вказує на повну доступність обох терміналів і, отже, на відсутність кон'югованих компонентів, обмежених позицією В29. На відміну від цього лише амінокислотні ланцюги були виявлені під час встановлення послідовності N-терміналів В1-заміщених похідних інсуліну 16, 20, 25 і 27, що підтверджує кон'югацію у В1-позиції і, як наслідок, пригнічення розкладання Едмана на N-терміналі В-ланцюга. Порівняльний аналіз на зв'язування hATIII з застосуванням аналізу біомолекулярної взаємодії Принцип і мета тесту: Аналіз біомолекулярної взаємодії (ВІА) досліджує взаємодію між (біо)молекулами ковалентною іммобілізацією одного з взаємодіючих компонентів на поверхні сенсорного уламка і ін'єкцією іншого компонента у безперервний буферний потік через цю поверхню. Зв'язування реєструється як зміна коефіцієнта рефракції на цій поверхні і є пропорційним молекулярній масі взаємодіючих компонентів. Для визначення взаємодії між hАТТІІІ і пентасахаридним кон'югатом сполуку 9 ковалентно приєднують до поверхні сенсорного уламка. Зв'язування hATIII до пентасахарид генерує сильний сигнал, що утворюється внаслідок різниці між молекулярними масами пентасахаридного ліганду і (великим) аналітом hATIII. Попередньо інкубовані зразки з постійною концентрацією hATIII і змінною концентрацією вільного пентасахариду XBEBP (Superdex 75) Rt 12,7 хвил. 12,5 хвил. 12,7 хвил. 12,5 хвил. 12,7 хвил. 12,8 хвил. 15,0 хвил. Чистота >98% >95% >98% >98% >98% >98% >98% або кон'югату ін'єкцією подають на поверхню. Зв'язування пентасахариду або кон'югату з АТІІІ під час попередньої інкубації викликає зниження зв'язування ATIII з іммобілізованим пентасахаридом. Порівняльний аналіз на зв'язування дозволяє визначити значення ІК50 для кожного пентасахаридного кон'югату. Експериментальна процедура: Сполуку 9 ковалентно приєднують до сенсорного уламка СМ5 амінним сполученням при рН 8,5. Сенсорний уламок активують EDC/NHS протягом 15 хвил. і сполуку 9 вводять ін'єкцією при концентрації 100 нг/мл. Гідроксисукцинімідна група, що не прореагувала, реагує з етаноламіном протягом 7 хвил. Поверхню регенерують трьома короткими ін'єкціями по 5 скл 5 моль/л NaCI, при потоці 25 мкл/хвил. Іммобілізація пентасахариду не може бути виявлена, однак, зв'язування з hATIII з поверхнею, обробленою, як було описано, було знайдено специфічним, що підтверджує присутність пентасахариду на поверхні. Були випробування ряду концентрацій hATIII для оцінювання чутливої концентрації для пригнічення (при 80% максимального зв'язування). При потоці 20 мкл/хвил. на бланкову і іммобілізовану прверхні були зроблені послідовно три хвилинні ін'єкції при 25°С. Точки посилання генеруються на 170-й сек. Поверхню регенерували 12-сек. ін'єкцією 5 моль/л NaCI. Зразки були випробувані при постійній концентрації hATIII (тобто 15 нмоль/л) і концентраціях пентасахаридного кон'югату у межах 0,78-100 нМ. Ін'єкція hATIII або точка посилання без пентасахаридного кон'югату встановлюють при 100%-му зв'язуванні. Було використане відносне (у %) зв'язування пентасахаридів і кон'югатів відносно максимального зв'язування для отримання сигмоїдної кривої (з змінною крутизною) нанесенням log [концентрації] % звязування як функції, з якого отримують значення ІК50. 49 96916 50 Таблиця 2 Значення ІК50, відповідають потенціалу зв'язування АТІІІ у порівняльному аналізі на зв'язування (ΒΙΑ) Сполука 7 (еталон) 8 (еталон) 9 (еталон) 24 25 26 27 28 29 ІК50 96 нМ 58 нМ 5,5 нМ 8,5 нМ 9,1 нМ 4,5 нМ 15 нМ 96 нМ 68 нМ ΒΙΑ (конкурентне зв'язування АТІІІ) 95%-й довірчий інтервал 53,1-173 нМ 33,7-99,1 нМ 5,1-5,8 нМ 7,9-9,3 нМ 8,2-10,0 нМ 4,2-4,7 нМ 13,3-17,0 нМ 50,6-183 нМ 33,9-137 нМ Висновок: різниця між ІК50 еталонних носіїв пентасахаридів 7-9 (Фіг. 5, Табл. 2) підтверджує, що їх конкурентний потенціал здатності зв'язуватись з АТІІІ, тобто міра зв'язувальної спорідненості до АТІІІ може бути коригована зміною кількості сульфатних груп у цих молекулах. (Конкурентний) зв'язувальний потенціал (ІК50) всіх відповідних інсулін-пентасахаридних кон'югатів (24-29) з hATIII лежить у тих же межах порівняно з вихідними еталонними пентасахаридами 7-9 (Фіг. 6, Табл. 2). Ці дані вказують, що фармакокінетичні властивості кон'югатів можна змінити, використовуючи інші пентасахариди-носії з різними зв'язувальними спорідненостями до АТІІІ. Мас-спектрометрія Типовий мас-спектрометричний аналіз пентасахаридних кон'югатів ілюструється фіг. 7. Наприклад, сполука 24 брутто-формули C320H487N67O137S14 і обчислена моноізотопічна маса 7913 були аналізовані системою ESI-QTOF. У ESI-MC-спектрі множинні заряджені іони при відношеннях m/z 1319,8 (6+), 1583,6 (5+), 1979,2 (4+), 2638,7 (3+) відповідають розподіленню зарядів для інсуліну recН. Крім того, розподілення ізотопів рандомізовано вибраних множинних заряджених піків (наприклад, 5+) для C320H487N67O137S14 (сполука 24) узгоджуються з теоретично обчисленим розподіленням ізотопів програмою Iso-pro (пунктирні лінії на Фіг. 7А). Загальна процедура для кон'югації декапептидів, антагоністичних до GnRH, з пентасахаридом (Приклади 20, 21, 24, 25) Ганірелікс-похідну 30 або 35 (70 мг) розчиняють у ДМФ (20 мл) в атмосфері нітрогену. Додають ТБТУ (14 мг, 1,05 екв.) і NMM (25 мкл, 5 екв.) і суміш перемішують протягом 1 год. при зовнішній температурі. Пентасахарид 8 або 9 (88 мг, 1,1 екв.) розчиняють у ДМФ (10 мл) і отримують суспензію, яку додають до реакційної суміші і суміш перемішують 16 год. при зовнішній температурі, потім розріджують водою (200 мл) і ліофілізують. Отриманий залишок очищають на зворотнофазному кремнеземі (С18) з 0,01 Μ ацетатом амонію (рН 7) і градієнтом від 10 до 50% ACN у блокелююваннях. Відповідні фракції об'єднують і ліофілізують, отримуючи ганірелікс-пентасахаридні кон'югати 31, 32, 36 або 37 як білий порошок. Аналітичну РХВЕ проводять з градієнтним елюювання, починаючи з 90% елюенту А (0.01М ацетат амонію) і 10% елюенту В (ACN) протягом 5 хвил., і потім з градієнтом до 100% елюент В протягом 30 хвил. Приклад 20. Сполука 31 Ганірелікс-похідну 30 (70 мг), приготовлену твердофазним пептидним синтезом згідно з J. Med. Chem. 1992, 55, 3942-3948, кон'югують до пентасахариду 8 (88 мг) за загальною процедурою, отримуючи 31 (16 мг, 40%). Чистота - 96% (аналітична РХВЕ), 97% (аналітичний аніонообмін). ESI-MC: обчислено для C126H191CIN18O62S6 43175,0359, отримано 792,7390 [M-4H] , 1057, 33- 1 3258 [М-3Н] , 1062,9883 [M+NH3-3H] Н ЯМР (D2O, 400 МГц, HH-COSY): 8,56 (m, 1H), 8,53 (m, 1H), 8,10 (m, 1H), 7,76 (m, 2H), 7,68 (m, 2H), 7,47 (m, 1Н), 7,39 (m, 2H), 7,16 (m, 3Н), 7,04 (m, 2H), 6,95 (m, 2H), 6,63 (m, 2H), 5,35-5,25 (m, 2H), 4,95 (m, 1Н), 4,68-4,61 (m, 1H), 4,61-4,51 (m, 2H), 4,504,38 (m, 2H), 4,38-4,25 (m, 3Н), 424-3,96 (m, 15H), 3,90-3,84 (m, 1H), 3,84-3,67 (m, 8H), 3,67-320 (m, 53Н), 3,19-3,09 (m, 4Н), 3,09-2,98 (m, 12Н), 2,982,84 (m, 8H), 2,77 (m, 2H), 2,13 (m, 1Н), 1,96-1,72 (m, 5Н), 1,68-1,42 (m, 5H), 1,42-1,20 (m, 7H), 1,180,89 (m, 13Н), 0,85-0,71 (m, 5Н). Приклад 21. Сполука 32 Ганірелікс-похідну 30 (70 мг) кон'югують до пентасахариду 9 (88 мг) за загальною процедурою, отримуючи 32 (52 мг, 35%). MC: обчислено для C125H189CIN18O65S7 - 3240,9770; отримано на 43ESI-QTOF 809,2219 [М-4Н] , 1079,2994 [М-3Н] , 33- 1 1084,9739 [M+NH3] , 1090,6340, [M+2NH3-3H] . H ЯМР (D2O, 400 МГц, HH-COSY): 8,45 (m, 1H), 8,38 (m, 1Н), 7,90 (m, 1H), 7,78 (d, 1Н), 7,73 (m, 2H), 7,59 (m, 1Н), 7,50 (m, 1H), 7,43 (m, 2Н), 7,20 (m, 3Н), 7,05 (d, 2H), 6,97 (m, 2Н), 6,66 (m, 2H), 5,405,30 (m, 2H), 5,09 (d, 1H), 4,67-1,48 (m, 2H), 4,403,92 (m, 18Н), 3,92-3,75 (m, 7H), 3,77-3,17 (m, 56Н), 3,12-3,02 (m, 11Н), 3,02-2,98 (m, 8Н), 2,972,83 (m, 4H), 2,81-2,75 (m, 2H), 2,14 (m, 1Н), 1,991,86 (m, 5H), 1,82-1,23 (m, 12Н), 122-0,90 (m, 13Н), 0,87-0,72 (m, 5Н). Чистота: 95% (аналітична РХВЕ), 97% (аналітичний аніонообмін). Приклад 22. Сполука 34 Сполуку 30 (100 мг) розчиняють у ДМФ. ТБТУ (36 мг, 2 екв.) і додають NMM (60 мкл, 10 екв.) і 51 реакційну суміш перемішують 1 год. при зовнішній температурі. Додають сполуку 33 (34 мг, 2 екв.), приготовлену, як описано у WO 2005090382, і реакційну суміш перемішують 16 год. при зовнішній температурі. Розчинник видаляють in vacuo і залишок розчиняють у воді/CAN, отриманий розчин піддають препаративній РХВЕ (градієнт: 80% елюенту А (0,1% ТФК у H2O) і 20% елюент В (ACN) до 20% елюент і 80% елюент В за 45 хвил.). Відповідні фракції об'єднують, отримуючи після ліофілізації сполуку 34 (60 мг, 60%) як білий порошок. Аналітичну РХВЕ проводять з градієнтом, починаючи з 75% елюенту А (0,1% ТФК у H2O) і до 25% елюенту В (CH3CN) до 20% елюенту А і 80% елюент В за 15 хвил. MC: обчислено для C94H139CIN18O19 - 1859, отримано на MALDI-TOF + + 1860 [М+Н] і 1882 [M+Na] . Чистота: >90% (аналітична РХВЕ). Приклад 23. Сполука 35 Сполуку 34 (60 мг) розчиняють у Н2О/ТФК/ACN (7 мл, 5:1:1) і перемішують 2 год. при зовнішній температурі. Додають ТФК (2,5 мл) і реакційну суміш перемішують ще 22 год. ТФК випарюють in vacuo і розчин ліофілізують, отри 96916 52 муючи 35 (45 мг, 77%) як білий порошок. MC: обчислено для C90H131CIN18O19 - 1803, отримано на + + MALDI-TOF 1804 [М+Н] і 1826 [M+Na] . Чистота: >95% (аналітичні РХВЕ). Приклад 24. Сполука 36 Ганірелікс-похідну 35 (17 мг) кон'югують до пентасахариду 8 (19 мг) за загальною процедурою. Додаткове очищення проводять препаративною РХВЕ (градієнт: 90% елюенту А (0,01 M ацетат амонію) і 10% елюенту В (CH3CN) протягом 5 хвил., потім до 100% В за 50 хвил.). Відповідні фракції об'єднують і ліофілізують, отримуючи 36 (2 мг, 6%). Чистота: 94% (аналітична РХВЕ), >98% (аналітичний аніонообмін). Приклад 25. Сполука 37 Ганірелікс-похідну 35 (17 мг) кон'югують до пентасахариду 9 (19 мг) за загальною процедурою. Додаткове очищення проводять препаративною РХВЕ, як це описано для сполуки 36. Відповідні фракції об'єднують і ліофілізують, отримуючи 37 (1,16 мг, 3%). Чистота: 88% (аналітична РХВЕ). Аналітичний аніонообмін - чистота: >95%. 53 Висновок: різниці конкурентних потенціалів зв'язування з АТІІІ між кон'югатами 31 і 32 і кон'югатами 36 і 37 (Fig 8) показують, що, незалежно від довжини зв'язувального залишку, спорідненість до АТІІІ може бути коригована зміною кількості сульфатних груп у цих молекулах. Ці дані також вказують, що in-vivo фармакокінетичні властивості цих кон'югатів можуть бути змінені вибором пентасахариду (див. фармакокінетичне дослідження нижче). Крім того, зв'язування кон'югату з АТІІІ є специфічним, оскільки некон'югований вихідний пептид ганірелікс не виявляє зв'язування з АТІІІ. Приклад 24. Сполука 39 Сполуку 38 (26,5 мг, 8,4 мкмоль) від NeoMPS (Strasbourg, France) розчиняють у дегазованих 96916 54 0,1М Nа2НРO4/NаН2РO4-буферах (16 мл, рН 7,0). Додають пентасахарид 5 (45,5 мг, 21 мкмоль, 2,5 екв.) в атмосфері нітрогену і отриману суміш перемішують приблизно 10 хвил. Додають водний розчин NH2OH (50% (за масою), 69 мкл) і реакційну суміш перемішують 16 год. Продукт очищають на колонці Q-Sepharose (2М NaCI(aq)/H2O/ACN, 10/40/1 -> 40/10/1, об'єм/об'єм/об'єм). Очищення від солей відповідних фракцій виконують хроматографією на Sephadex G25, як описано вище, і отримують сполуку 39 (15,7 мг, 35%). Вихід визначають вимірюванням A280, використовуючи теоретичну абсорбцію 0,48 для розчину 1 мг/мл. МС: обчислено для C196H309N41O101S8 - 5108,8; 3+ отримано на ESI-Q-TOF - 1740,6 [M+5Na] , 4+ 5+ 1311,2 [M-1H+6Na] , 1053,5 [M-2H+7Na] . 55 Висновок згідно з Фіг. 9, конкурентний потенціал зв'язування з AIII кон'югату 39 є консервативним порівняно з вихідним залишком пентасахаридної прокладки (Фіг. 5, сполука 9). Ці дані показують, що значного збільшення in-vivo напівжиття пептиду можна досягти кон'югацією до пентасахариду-носія, що зв'язує АТІІІ (див. фармакокінетичне дослідження нижче). Крім того, зв'язування кон'югату з АТІІІ є специфічним, оскільки некон'югований вихідний пептид ADM(27-52) не виявляє зв'язування з АТІІІ. Приклад 25. Сполука 41 Сполуку 40 (15 мг, 4,2 мкмоль) від NeoMPS (Strasbourg, France) розчиняють у дегазованому 0,1М Na2HPO4/NaH2PO4-буфері (8 мл, рН 7,0). Додають пентасахарид 5 (22,7 мг, 10,4 мкмоль, 2,5 екв.) в атмосфері нітрогену і суміш перемішу 96916 56 ють приблизно 10 хвил. Додають водний розчин NH2OH (50% (за масою), 0,14 мл) і реакційну суміш перемішують 16 год. Продукт очищають, як це описано для сполуки 39, і отримують сполуку 41 (1,38 мг, 6%). Вихід визначають вимірюванням A280 з використанням теоретичної абсорбції 1,22 для розчину 1 мг/мл. MC: обчислено для C218H342N44O106S8 - 5528; отримано на ESI Q-TOF 3+ 4+ 5+ - 1843,7 [М+3Н] , 1383,0 [М+4Н] , 1107 [М+5Н] . Висновок: конкурентний потенціал зв'язування з AIII кон'югату 41 є консервативним порівняно з вихідним залишком пентасахаридної прокладки сполуки 9. Ці дані показують, що значного збільшення in-vivo напівжиття пептиду можна досягти кон'югацією до пентасахариду-носія, що зв'язує АТІІІ (див. фармакокінетичне дослідження нижче). 57 Приклад 26. Сполука 44 Октреотид (сполука 42, 50 мг, 0,04 ммоль) від Bachem (Weil am Rhein, Germany) розчиняють у ДМСО (5 мл). Додають AcOH (7 мкл) для отримання дещо кислотного розчину. Потім додають GMBS (11,2 мг, 0,04 ммоль, 1,0 екв.) і отриманий розчин перемішують під нітрогеном 1 год. Аналіз PX-MC показує майже повне перетворення в октреотид GMB 43, де компонент GMB регіоселективно додано до N-терміналу залишку Phe. Реакцію охолоджують до прибл. 5C, після чого додають розчин NaH2PO4/Na2HPO4 (20 мл, рН 7,0). Через 10 хвил. суміш залишають нагрітись до кімнатної температури і через розчин протягом 10 хвил. пропускають N2. Додають твердий пентасахарид 96916 58 5 (21,8 мг, 0,01 ммоль, 0,25 екв.) в атмосфері нітрогену і потім водний розчин NH2OH (0,11 мл, 50 % (за масою)) і реакційну суміш перемішують 16 год. Продукт очищають інообмінною хроматографією, як це описано вище, і отримують сполуку 44 (6,3 мг, 19%). MC: обчислено для C112H170N12O70S10 - 3122,7; отримано на ESI-Q2+ 3+ 1 TOF - 1562,3 [М+2Н] , 1041,9 [М+3Н] . R ЯМР (D2O, 400 МГц, HH-COSY): 7,52-7,29 (m, 10Н), 7,26-7,14 (m, 4Н), 7,03 (s, 1Н), 5,44 (m, 1Н), 5,37 (m, 1Н), 5,14 (m, 1Н), 5,12-4,89 (m, 2Н), 4,77-4,60 (m, 3Н), 4,45-3,97 (m, 18Н), 3,95-3,76 (m, 13Н) 3,75-3,35 (m, 57Н), 3,33-2,59 (m, 18Н), 2,22-1,16 (m, 2Н), 1,85-1,76 (m, 3Н), 1,71-1,38 (m, 3Н), 1,321,15 (m, 7Н), 0,81-0,61 (М, 2Н). 59 Висновок: конкурентний потенціал зв'язування з AIII кон'югату 44 є консервативним порівняно з вихідним залишком пентасахаридної прокладки сполуки 9 (фіг. 11). Ці дані показують, що значного збільшення in-vivo напівжиття пептиду можна досягти кон'югацією до пентасахариду-носія, що зв'язує АТІІІ. Приклад 27. Сполука 46 Пентасахарид 9 (100 мг) і GMBS (22 мг, 1,5 екв.) розчиняють у ДМФ (10 мл). Додають DiPEA (18 мкл, 2 екв.) і реакційну суміш перемішують протягом ночі при зовнішній температурі. Розчинник випарюють in vacuo і залишок очищають на препаративній колонці G25. Об'єднані фракції ліофілізують, отримуючи 46 (50 мг, 46%) як білий порошок. ESI-MC: обчислено для C53H77N2O55S7Na9 - 2052; отримано на ESI-Q-TOF 2+ = 1027 M . Приклад 28. Сполука 47 Малеїмідну похідну 46 пентасахариду кон'ю 96916 60 125 гують до вільної Cys природного recH-ІL2 (системи R&D, 202-EL/CF). До кон'югації recH-ІL2 аналізують ХВЕВР, SDC-PAGE і MALDI-TOF MC, які вказують на переважно мономерну композицію. RecH-IL2 (1 мг, 800 мкл, 1,26 мг/мл у PBS, що містить 0,5% ДЦН) обробляють протягом ночі при кімнатній температурі ролику з надлишком сполуки 46 (59 мкл водного розчину 10 мг/мл, 5 екв.) до повного перетворення вихідного матеріалу. Малеїмід 46, що не прореагував, блокують 5-разовим надлишком цистеаміну (16 мкл, 10 мг/мл) протягом 3 год. Реакційну суміш діалізують (зріз на 6-8 кДа) з 0,5% SDS у PBS для видалення надлишку цистеаміну і 46. Кінцева кількість продукту згідно з визначенням A280 становить 0,69 мг. Кінцевий кон'югат 47 характеризують аналізами SDS-PAGE (4-12%) і Western blot (Фіг. 12). З смуг 3 і 4 можна дійти висновку, що сполука 47 має вищу мол. масу порівняно з recH-IL2 (відпо
ДивитисяДодаткова інформація
Назва патенту англійськоюConjugate of a polypeptide and synthetic sulfated oligosaccharide, pharmaceutical composition based thereon
Автори англійськоюBos Ebo Sybren, De Kort Martin, Smit Meertinus Jan, Van Boeckel Constant Adriaan Anton
Назва патенту російськоюКонъюгат полипептида и синтетически сульфатованого пентасахарида, фармацевтическая композиция на его основе
Автори російськоюБос Эбо Сибрен, Де Корт Мартин, Смит Мертинус Йан, ван Бекель Констант Адриаан Антон
МПК / Мітки
МПК: A61P 3/00, A61K 47/48, A61K 38/16, A61K 31/702
Мітки: синтетичної, фармацевтична, кон'югат, композиція, пентасахариду, поліпептиду, основі, сульфатованого
Код посилання
<a href="https://ua.patents.su/47-96916-konyugat-polipeptidu-i-sintetichno-sulfatovanogo-pentasakharidu-farmacevtichna-kompoziciya-na-jjogo-osnovi.html" target="_blank" rel="follow" title="База патентів України">Кон’югат поліпептиду і синтетично сульфатованого пентасахариду, фармацевтична композиція на його основі</a>
Попередній патент: Литий матеріал стільникової структури з крізними порами
Наступний патент: Антитіла, спрямовані проти пептиду бета-амілоїду, та способи їх застосування
Випадковий патент: Спосіб виробництва столового напівсухого рожевого вина "кримське напівсухе"