Інгібітор дипептидилпептидази iv, фармацевтична композиція на його основі
Формула / Реферат
1. Сполука, вибрана з похідних формули 1, їх таутомерів і стереоізомерів, і фармацевтично прийнятних солей зазначених похідних, таутомерів і ізомерів
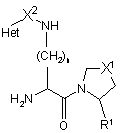 , 1
, 1
в якій:
R1 є або атомом водню, або нітрильною групою;
X1 вибирають з атома сірки, атома кисню, сульфонільної групи і метиленової групи;
X2 є карбонільною групою, метиленовою групою або ковалентним зв'язком;
Het є ароматичним гетероциклом, який містить азот, вибраним з піридилу, піридазинілу, піримідинілу, піразинілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, ізоксазолілу і їх бензоконденсованих аналогів, всі з яких можуть, необов'язково, бути заміщеними по одному або більшій кількості атомів вуглецю, і де замісники вибрані з С1-С6 алкільної групи, гідрокси, С1-С6 алкілокси, аміно, С1-С6 алкіламіно, ді(С1-С6 алкіл)аміно груп, фтору, хлору, брому, трифторметильної групи, нітро, ціано, карбоксигруп і С1-С6 алкілоксикарбонільної групи; і n є 1-5.
2. Сполука за пунктом 1, де R1 є нітрильною групою.
3. Сполука за пунктом 1 або 2, де стереохімія нітрильної групи показана у формулі 2
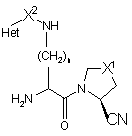 2.
2.
4. Сполука за пунктом 1 або 2, де стереохімічний центр, який розташований поруч з первинним аміном, має S-конфігурацію, як показано у формулі 3
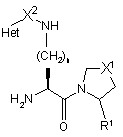 3.
3.
5. Сполука за пунктом 4, де R1 є нітрильною групою і стереохімія нітрильної групи показана у формулі 4
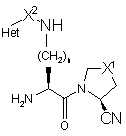 4.
4.
6. Сполука за будь-яким з попередніх пунктів, в якій X1 вибирають з атома сірки і метиленової групи.
7. Сполука за будь-яким з попередніх пунктів, в якій n є 3 або 4.
8. Сполука за будь-яким з попередніх пунктів, вибрана з:
(2S)-1-[Nw-(пipaзинiл-2-кapбoнiл)-L-opнiтинiл]пipoлiдин-2-кapбoнiтpилy,
(2S)-1-[Nw-(піразиніл-2-карбоніл)-L-лізиніл]піролідин-2-карбонітрилу,
(2S)-1-[(2'S)-2'-амiнo-4'-(пipaзинiл-2''-кapбoнiлaмiнo)бyтaнoїл]пipoлiдин-2-карбонітрилу,
(4R)-3-[Nw-(піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4-карбонітрилу,
1-[Nw-(піразиніл-2-карбоніл)-L-орнітиніл]піролідину,
3-[Nw-(2-хлорпіридил-3-карбоніл)-L-орнітиніл]тіазолідину,
1-[Nw-(2-хлорпіридил-3-карбоніл)-L-орнітиніл]піролідину,
(2S)-1-[Nw-(2-хлopпipидил-3-кapбoнiл)-L-opнiтинiл]пipoлiдин-2-кapбoнiтpилy,
3-[Nw-(пipaзинiл-2-кapбoнiл)-L-opнiтинiл]тiaзoлiдинy,
3-[Nw-(5-цiaнo-2-пipидил)-L-лiзинiл]тiaзoлiдинy,
(2S)-1-[Nw-(5-цiaнo-2-пipидил)-L-лiзинiл]пipoлiдин-2-кapбoнiтpилy,
(2S)-1-[Nw-(5-тpифтopмeтил-2-пipидил)-L-opнiтиніл]пipoлiдин-2-кapбoнiтpилy,
3-[Nw-(2-хiнoлiнiлмeтил)-L-лiзинiл]тiaзoлiдинy,
3-[Nw-(2-хiнoлiнiлмeтил)-L-opнiтинiл]тiaзoлiдинy,
3-[Nw-(2-хіноксалоїл)-L-лізиніл]тіазолідину,
3-[Nw-(2-хіноксалоїл)-L-орнітиніл]тіазолідину,
(2S)-1-[Nw-(2-хіноксалоїл)-L-орнітиніл]піролідин-2-кapбoнiтpилy,
3-[Nw-(6-мeтилпipaзинiл-2-кapбoнiл)-L-opнiтинiл]тiaзoлiдинy,
3-[Nw-(ізoxiнoлiн-3-кapбoнiл)-L-opнiтинiл]тiaзoлiдинy і
3-[Nw-(6-трифторметилнікотиноїл)-L-орнітиніл]тіазолідину.
9. Фармацевтична композиція для застосування у лікуванні людини, яка містить принаймні одну сполуку за будь-яким з попередніх пунктів.
10. Композиція за пунктом 9 для лікування діабету типу 2 або зменшеної толерантності до глюкози.
11. Композиція за пунктом 9 для лікування браку гормону росту або полікістозу яєчників.
12. Композиція за пунктом 9 для лікування аутоімунних або запальних захворювань.
13. Спосіб лікування принаймні одного з захворювань: діабет типу 2, зменшена толерантність до глюкози, брак гормону росту, полікістоз яєчників, аутоімунні і запальні захворювання, який включає призначення пацієнту, якому необхідне таке лікування, терапевтично ефективної кількості сполуки за будь-яким з пунктів 1-8.
Текст
Даний винахід стосується ряду нових сполук, які є інгібіторами ензиму дипетидилпептидаза IV, фармацевтичних композицій, які включають ці інгібітори, а також застосування композицій у лікуванні захворювань у людини. Ензим дипептидилпептидаза IV, для якого вживається тут скорочення ДП-IV (та у деяких місцях ДАП-IV або ДПП-IV), та який відомий за класифікацією як ЕС.3.4.14.5, є серинпротеазою, яка відрізає N-термінальний дипептид від пептидів, які починаються послідовністю Н-Хаа-Рrо (в якій Хаа є будь-якою амінокислотою, хоча переважною є ліпофільна, і Pro є проліном). Він також буде прийматись як субстратні пептиди, які починаються послідовністю Н-Хаа-АІа (в якій Аlа є аланіном). ДП-IV спочатку виявили як мембран-зв'язаний протеїн. Нещодавно виявили його розчинну форму. Спочатку інтерес до ДП-IV фокусувався на її ролі у активації Т лімфоцитів. ДП-IV ідентична протеїну Тклітин CD26. Була висун ута думка, що інгібітори ДП-IV здатні модулювати здатність до відповіді Т-клітин, і тому можуть бути розроблені в якості нових імуномодуляторів. Також було припущено, що CD26 є необхідним співрецептором при ВІЛ, і тому інгібітори ДП-IV можуть бути корисними у лікуванні СНІДу. Увагу приділили ролі ДП-IV поза межами імунної системи. Було визнано, що ДП-IV виконує провідну роль в деградації декількох пептидних гормонів, включаючи гормон, що вивільнює гормон росту (ГВГР), глюкагонподібний пептид-1 і -2 (ГПП-1 і ГПП-2). Через те, що відомо, що ГПП-1 підсилює дію інсуліну при регулюванні рівню глюкози у крові після прийому їжі, зрозуміло, що інгібітори ДП-IV повинні бути також корисними у лікуванні діабету типу II і зменшеної толерантності до глюкози. Принаймні два інгібітори ДП-IV проходять зараз клінічні дослідження, направленні на вивчення їх можливостей. Деякі групи описали інгібітори ДП-IV. В той час як деякі результати були одержані використовуючи програми випадкового скринінгу, основна частина роботи у цьому напрямку була направлена на дослідження субстратни х аналогів. Інгібітори ДП-IV, які є субстратними аналогами, описані, наприклад, в US 5,462,928, US 5,543,396, W095/15309 (відповідає US 5,939,560 і ЕР 0731789), W098/19998 (відповідає US 6,011,155), W099/46272 і W099/61431. Найбільш ймовірними інгібіторами є аміноакрилпіролідинборні кислоти, але вони не є стабільними і схильні до циклізації, в той час як більш стабільні похідні піролідину і тіазолідину менш подібні до ензиму, і тому у лікуванні слід використовувати більші дози. Піролідиннітрили є гарним компромісом через їх високу спорідненість до ензиму та достатньо довгий час напіврозкладу у розчині у вигляді вільної основи. Але, однак, залишається необхідність у інгібіторах ДП-IV з покращеними властивостями. Даний винахід стосується ряду інгібіторів ДП-IV з підвищеною спорідненістю до ензиму. Сполуки можуть застосовуватись у лікуванні ряду хвороб людини, включно зі зменшеною толерантністю до глюкози та діабетом типу II. Відповідно, винахід також стосується застосування сполук для одержання фармацевтичних композицій, власне до таких композицій, та до застосування таких композицій у лікуванні людей. Сполуки згідно з даним винаходом описані загальною формулою 1. В загальній формулі 1, R1 є або Н, або CN, X1 є S, О, SO 2 або СН2, X2 є карбонільною групою, СН2, або відсутній, n є 1-5, і Het є, необов'язково, заміщеним ароматичним гетероциклом, що містить азот. У першому втіленні даний винахід включає ряд нових сполук, які є інгібіторами ферменту ДП-IV і є корисними у лікуванні певних захворювань людини. Сполуки описані загальною формулою 1. У цій загальній формулі R1 представляє або атом водню, або нітрильну групу (-CºN). X1 представляє атом сірки, атом кисню, сульфонільну груп у (-SO 2-), або метиленову гр упу (-СН2-). X2 представляє або карбонільну груп у (>С=О ), метиленову груп у (-СН2-), або ковалентний зв'язок. Змінна n може мати значення будь-якого цілого числа від 1 до 5. Het представляє ароматичний гетероцикл, який містить азот, вибирають з піридилу, піридиазинілу, піримідинілу, піразинілу, імідазолілу, піразолілу, тіазолілу, ізотіазолілу, оксазолілу, ізоксазолілу і їх бензоконденсованих аналогів, таких як хінолініл, ізохінолініл, цинолініл, фталазиніл, хіназолініл, хіноксалініл, бензімідазоліл, індазоліл, бензотіазоліл, бензізотіазоліл, бензоксазоліл і бензізоксазоліл. Цей гетероцикл може, необов'язково, бути заміщеним по одному або більшій кількості атомів вуглецю. Придатними замісниками є нижча алкільна група, гідрокси, нижча алкілокси група, аміно, нижча алкіламіно, ді(нижча алкіл)аміно групи, фтор, хлор, бром, нітрогрупа, трифторметильна група, ціано, карбокси і нижча алкілоксикарбонільна групи. У контексті даного опису, термін "нижчий алкіл", або так як він є, або у таких комбінаціях як нижчий алококси, вжити для позначення лінійних, розгалужених і циклічних насичених вуглеводневих груп, які містять 1-6 атомів вуглецю. Прикладами груп нижчого алкілу є, але не обмежуються ними, метил, етил, ізопропіл, mpem-бутил, неопентил, циклогексил, циклопентилметил, 2-(циклопропіл)етил, 3,3-диметилциклобутил і біцикло[3.1.0]гексил. Сполуки загальної формули 1 мають принаймні один стереогенний центр, і тому можуть проявляти оптичний ізомеризм. Усі такі ізомери, включно з енантіомерами, діастереомерами і епімерами, включені у об'єм даного винаходу. Крім того, винахід включає такі сполуки як окремі ізомери та суміші, включно з рацематами. Деякі сполуки загальної формули 1, включаючи ті, в яких Het група несе гідрокси або аміно замісник, можуть існувати у вигляді та утомерів. Ці та утомери, або окремо, або у вигляді сумішей, також включені до об'єму даного винаходу. Сполуки загальної формули 1 мають принаймні одну основну функціональну групу. Вони тому можуть утворювати адитивні солі з кислотами. Такі адитивні солі, одержані з фармацевтично прийнятними кислотами, включені до об'єму даного винаходу. Прикладами придатних кислот є оцтова кислота, трифтороцтова кислота, лимонна кислота, фумарова кислота, бензойна кислота, памоїнова кислота, метансульфонова кислота, соляна кислота, азотна кислота, сірчана кислота, фосфорна кислота і тому подібні. Деякі сполуки загальної формули 1 мають кислотну груп у, тому можуть утворювати солі з основами. Прикладами таких солей є солі натрію, калію та кальцію, одержані шляхом взаємодії кислоти з відповідним гідроксидом, оксидом, карбонатом, або бікарбонатом металу. Таким же чином, солі тетраалкіламонію можуть бути одержані шляхом взаємодії кислоти з гідроксидом тетраалкіламонію. Первинні, вторинні і третинні аміни, такі як триетиламін, можуть утворювати адитивні солі з кислотою. Окремим прикладом може бути вн утрішня адитивна сіль, одержана між кислотною групою та групою первинного аміну однієї молекули, яка також називається цвітер-іон. Через те, що вони є фармацевтично прийнятними, всі ці солі включені до об'єму цього винаходу. У переважному втіленні цього винаходу R1 є нітрильною групою. У цьому втіленні є переважним, щоб стереохімія нітрильної групи відповідала наведеній у загальній формулі 2. Згідно з стандартною термінологією, це S конфігурація, якщо X1 є метиленом, і R конфігурація, якщо X1 є сіркою, киснем, сульфінілом або сульфонілом. В іншому переважному втіленні, стереохімічний центр, розташований поруч з первинним аміном, є S конфігурацією, показаною у загальній формулі 3. У цьому втіленні є більш переважним коли R1 є нітрильною групою, і ще більш переважним коли він має абсолютну конфігурацію, показану у загальній формулі 4. В іншому переважному втіленні винаходу X1 є атомом сірки або метиленовою групою. В іншому переважному втіленні винаходу n є 3 або 4. Особливо переважними сполуками згідно з даним винаходом є: (2S)-1-[Nw -(Піразиніл-2-карбоніл)-L-орнітиніл]піролідин-2-карбонітрил, (2S)-1-[Nw -(Піразиніл-2-карбоніл)-L-лізиніл]піролідин-2-карбонітрил, (2S)-1-[(2'S)-2'-Аміно-4’-(піразиніл-2"-карбоніламіно)бутаноїл]піролідин-2-карбонітрил, (4R)-3-[N w -(Піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4-карбонітрил, 1-[N w -(Піразиніл-2-карбоніл)-L-орнітиніл]піролідин, 3-[N w -(2-Хлорпіридил-3-карбоніл)-L-орнітиніл]тіазолідин, 1-[N w -(2-Хлорпіридил-3-карбоніл)-L-орнітиніл]піролідин, (2S)-1-[Nw -(2-Хлорпіридил-3-карбоніл)-L-орнітиніл]піролідин-2-карбонітрил, 3-[N w -(Піразиніл-2-карбоніл)-L-орнітиніл]тіазолідин, 3-[N w -(5-Ціано-2-піридил)-L-лізиніл]тіазолідин, (2S)-1-[Nw -(5-Ціано-2-піридил)-L-лізиніл]піролідин-2-карбонітрил, (2S)-1-[Nw -(5-Трифторметил-2-піридил)-L-орнітиніл]піролідин-2-карбонітрил, 3-[N w -(2-Хінолінілметил)-L-лізиніл]тіазолідин, 3-[N w -(2-Хінолінілметил)-L-орнітиніл]тіазолідин, 3-[N w -(2-Хіноксалоїл)-L-лізиніл]тіазолідин, 3-[N w -(2-Хіноксалоїл)-L-орнітиніл]тіазолідин, (2S)-1-[Nw -(2-Хіноксалоїл)-L-орнітиніл]піролідин-2-карбонітрил, 3-[N w -(6-Метилпіразиніл-2-карбоніл)-L-орнітиніл]тіазолідин, 3-[N w -(Ізохінолін-3-карбоніл)-L-орнітиніл]тіазолідин, і 3-[N w -(6-Трифторметилнікотиноїл)-L-орнітиніл]тіазолідин. У другому втіленні даний винахід включає фармацевтичну композицію для лікування людини. Композиція відрізняється тим, що вона включає в якості активного агента принаймні одну із зазначених вище сполук. Така композиція корисна у лікуванні хвороб людини. Загалом композиція включає один або два додаткових компоненти, вибрані з фармацевтично активних екципієнтів і фармацевтично активних агентів, відмінних від агентів даного винаходу. Композиція може бути представлена у вигляді твердої або рідкої рецептури, залежно від певного шляху введення. Прикладами твердих рецептур є пілюлі, таблетки, капсули та порошки для перорального призначення, супозиторії для ректального або вагінального призначення, порошки для назального або пульмонарного призначення, та пластирі для трансдермального або трансмукозального (такого як букальне) призначення. Прикладами рідких рецептур є розчини та суспензії для внутрішньовенних, підшкірних або внутрішньом'язових ін'єкцій, та перорального, назального та пульмонарного призначення. Особливо переважною формою є таблетки для перорального призначення. Іншою переважною формою, особливо для швидкої та термінової допомоги, є стерильні розчини для внутрішньовенних ін'єкцій. Композиція включає принаймні одну сполуку згідно з даним винаходом. Композиція може включати більше ніж одну сполуку, але загалом є переважним, коли вона містить лише одну. Кількість сполуки, яка використовується у композиції, буде такою, щоб загальна денна доза активного агента могла бути призначена 1-4 зручними дозами. Наприклад, композиція може бути у формі таблетки, яка містить кількість сполуки, яка відповідає загальній необхідній денній дозі, така таблетка приймається один раз на день. Альтернативно, таблетка може містити половину (або одну третю, або одну четверту) денної дози, тоді вона приймається двічі (тричі, або чотири рази) на день. На такій таблетці може бути зроблена зарубка для полегшення розподілення дози, таким чином, наприклад, таблетка, яка включає повністю денну дозу, може бути розламана навпіл і прийматися двома прийомами. Переважно, таблетка, або інша форма дозування, буде містити між 0.1мг і 1г активної сполуки. Більш переважно, вона буде містити між 1мг і 250мг. Композиція загалом включає один або більшу кількість екципієнтів, вибраних з ти х, які визнані фармацевтично прийнятними. Придатними екципієнтами є, але не обмежуються ними, наповнювачі, зв'язуючи агенти, розріджувачі, розчинники, консерванти та ароматизатори. Агенти, які змінюють характеристики вивільнення композиції, такі як полімери, які селективно розчиняються у кишечнику ("покриття, що руйнуються в кишковому тракті") також беруться до ува ги в контексті даного винаходу як придатні екципієнти. Композиція може включати, окрім сполуки згідно з даним винаходом, другий фармацевтично активний агент. Наприклад, сполука може включати антидіабетичний агент, протизапальний агент, або противірусний агент. Однак, загалом є переважним, коли композиція включає лише активний агент. У третьому втіленні винахід стосується застосування описаних ви ще сполук і композицій для лікування захворювань людини. Це втілення може відповідно розглядатись як таке, що включає спосіб лікування таких захворювань. Захворювання, які піддаються лікуванню, є такими, в яких інгібування ДП-IV або CD26 надає клінічні переваги або безпосередньо, або опосередковано. Безпосередньою дією є блокування активації Т лімфоцитів. Опосередкована дія полягає в потенціації пептидого гормону шляхом запобігання деградації цих гормонів. Прикладами хвороб є, але не обмежуються ними, аутоімунні і протизапальні захворювання, такі як запалення кишки і ревматоїдний артрит, брак гормону росту, що спричинює малий зріст, полікістоз яєчників, зменшена толерантність до глюкози і діабет типу 2. Особливо переважним є застосування сполук і композицій для лікування зменшеної толерантності до глюкози і діабету тип у 2, та, відповідно, спосіб лікування цих захворювань шляхом призначення ефективної кількості сполуки або композиції як описано вище. Безпосередньо лікування, включаючи режим дозування, визначається лікарем, беручи до уваги загальні відомості про пацієнта та ступінь захворювання. Для таких захворювань як запалення кишок, які після періодів спокою загострюються, лікар може вибрати відносно великі дози під час гострої фази і нижчі дози для підтримання стану під час періоду спокою. Для хронічних захворювань, таких як діабет типу 2 та зменшена толерантність до глюкози, дози повинні підтримуватись на однаковому рівні упродовж тривалого періоду. Графік дозування від однієї до чотирьох таблеток на день, кожна з яких містить між 0.1мг і 1г (і переважно між 1мг і 250мг) активної сполуки, може бути типовим у такому випадку. Сполуки згідно з даним винаходом можуть бути одержані методами, відомими фахівцям у цій галузі. Вибраний шлях буде залежати від особливої природи замісників, присутніх на цільових молекулах. Початковим матеріалом звичайно буде похідна a,w-діамінокислоти 5. PG1 і PG2 є "ортогональними" захисними групами - групами, які захищають активні аміногрупи, і кожна з яких може бути селективно видалена у присутності іншої. Придатні групі широко описані у літературі. Похідні діамінокислот загальної формули 5 є або комерційно доступними, або описані у літературі, для усіх значень n у межах від 1 до 5 і для обох R і S стереоізомерів. Для деяких методик синтезу переважно розпочати з естеру вищенаведеної діамінокислоти, такого як бензиловий, метиловий, або mpem-бутиловий естер. Естер вибирається таким чином, що такий естер не гідролізується реагентами, які можуть відрізати PG1 або PG2 . Виходячи з 5, необхідно трансформувати кислотну функціональну групу в похідн у піролідинаміду цільової молекули, і трансформувати w-амінну функціональну груп у у бажану похідну гетероарилу. Порядок, в якому проходять ці дві стадії не є вкрай важливим. Похідна діамінокислоти 5 може взаємодіяти з похідною піролідину 6 з одержанням аміду 7. Умови проходження реакції для досягнення цього перетворення відомі у літературі. Придатними реагентами є карбодііміди, фосфорні реагенти і алкілхлорформіати, і реакцію звичайно каталізують третинним аміном, таким як триетиламін або диметиламінопіридин. Реакція, зображена на Схемі А, є придатною для усі х комбінацій R1 і X1. Однак, у випадку, якщо R1 є нітрильною групою, або якщо X1 є сульфонільною групою, може бути переважним змінити стратегію як зображено на Схемах В і С. На Схемі В R1 групу вводили як первинний амід і потім перетворювали у нітрил шляхом взаємодії з дегідратуючим агентом, таким як ангідрид трифтороцтової кислоти. На Схемі С X1 гр упу вводили як тіоетер і потім перетворювали в сульфон шляхом взаємодії з окиснюючим агентом, таким як перйодат натрію. На Схемі D, сполука 5D є похідною діамінокислоти 5 після видалення w-захисної групи. Y може представляти ОН, але звичайно представляє піролідинове кільце, або О-алкільну групу естеру. Вільна амінна група взаємодіє з гетероарилкарбонілхлоридом з одержанням аміду 11, який об'єднує функціональні групи сполук згідно з даним винаходом, в яких X2 є карбонільною групою. Гетероарилкарбонілхлориди легко одержують з відповідних карбонових кислот, які є відомими сполуками. Реакція Схеми D звичайно придатна для усі х варіантів гр уп Het за умови, що деякі замісники Het можуть потребувати захисту. Такі групи та відповідний захист загалом є очевидні фахівцям у цій галузі. Якщо X2 є ковалентним зв'язком, все ж можливо одержати цільову функціональну групу з аміну 5D шляхом безпосередньої взаємодії гетероарилхориду або фториду. У деяких випадках, гетероарилхлорид або фторид не є легкодоступним, або не є достатньо активним, і в таких випадках обов'язково застосовувати альтернативний шлях, такий як відновне амінування. Він наведений на Схемі Е. Відновне амінування є також альтернативним методом, коли X2 є метиленовою групою. У цьому випадку існує два варіанти, наведені на Схемі F. Після трансформації усіх груп видаляється кінцева захисна група і продукт відділяють і очищають за допомогою стандартних методик. Ці загальні методики ілюстровані наступними прикладами, які не обмежують об'єм винаходу. ПРИКЛАДИ Абревіації Були вжиті наступні абревіації. ДМФ год. N,N-Диметилформамід Година(и) ВЕРХ Вискоефективна рідкісна хроматографія хв. Хвилина(и) пет. ефір фракція петролейного ефіру, що кипить при 60-80°С (Бензотріазол-1РуВОРâ ілокси)трипіролідинфосфонію гескафторфосфат Бромтрипіролідинофосфонію РуВrоРâ гескафторфосфат ТФО Трифтороцтова кислота ПРИКЛАД 1 (2S)-1-[Nw -(Піразиніл-2-кпрбоніл)-L-орнітиніл]піролідин-2-карбонітрилу трифторацетат А. N-(2-Нітробензолсульфеніл)-L-пролін L-Пролін (25г, 217ммоль) розчиняли в 2М NaOH (110мл, 220ммоль) і діоксані (120мл). Повільно додавали розчин 2-нітробензолсульфенілхлорду (42г, 222ммоль) в діоксані (60мл) одночасно з 2М NaOH (110мл, 220ммоль). Через 2год. при кімнатній температурі реакційну суміш виливали у воду (500мл) і тверду речовину відфільтровували. Рівень pH фільтрату доводили до рН3 2М НСІ і розчин екстрагували етилацетатом (3х500мл). Об'єднані органічні екстракти промивали водою (4х200мл) і розчином солі (1х200мл), сушили (Na2SO4) і випарювали in vacuo з одержанням оранжевої твердої речовини, визначеної як N-(2нітробензолсульфеніл)-L-пролін (58.1г, 217ммоль, 100%). В. N-(2-Нітробензолсульфеніл)-L-проліну сукцинімідиловий естер N-(2-Нітробензолсульфеніл)-L-пролін (57.9г, 216ммоль) розчиняли в СН 2СІ2/ДМФ (9:1, 500мл). Додавали N-гідроксисукцинімід (37.3г, 324ммоль) і розчинний у воді карбодіімід (51.8г, 260ммоль). Через 18год. при кімнатній температурі розчинник видаляли in vacuo і залишок переносили в етилацетат (1000мл). Розчин промивали водою (4х200мл) і розчином солі (1х200мл), сушили (Na2SO4) і випарювали in vacuo з одержанням жовтої твердої речовини, визначеної як N-(2-нітробензолсульфеніл)-L-проліну сукцинімідиловий естер (78.9г, 216ммоль, 100%). С. N-(2-Нітробензолсульфеніл)-L-пролінамід N-(2-Нітробензолсульфеніл)-L-проліну сукцинімідиловий естер (78.5г, 215ммоль) розчиняли в діоксані (500мл). Додавали аміак (35%, 100мл). Після перемішування при кімнатній температурі протягом 2год. реакційну суміш виливали у воду (700мл). Осад відфільтровували, промивали водою (200мл), сушили над Р2О5 і перекристалізовували з етилацетат/пет. ефір з одержанням жовтої твердої речовини, визначеної як N(2-нітробензолсульфеніл)-L-пролінамід (49.6г, 185ммоль, 86%). D. (2S)-N-(2-Нітробензолсульфеніл)піролідин-2-карбонітрил N-(2-Нітробензолсульфеніл)-L-пролінамід (49г, 183ммоль) розчиняли в сухому ТГФ (300мл). Розчин охолоджували до 0°С, додавали триетиламін (36.7г, 367ммоль) з наступним повільним додаванням ангідриду трифтороцтової кислоти (77г, 367ммоль). Рівень pH доводили до рН9 триетиламіном. Через 30хв. реакційну суміш розводили етилацетатом (500мл), промивали водою (1х200мл) і розчином солі (1х200мл), сушили (Na2SO4) і випарювали in vacuo з одержанням оранжевого масла, яке очищали за допомогою флеш хроматографії (елюент: 80% пет. ефір, 20% етилацетат) з одержанням жовтої твердої речовини, визначеної як (2S)-N-(2-нітробензолсульфеніл)піролідин-2-карбонітрил (38.9г, 150ммоль, 82%). Е. (2S)-Піролідин-2-карбонітрилу гідрохлорид (2S)-N-(2-Нітробензолсульфеніл)піролідин-2-карбонітрил (38.5г, 149ммоль) розчиняли в діетиловому етері (200мл). Повільно додавали 4M НСІ/діоксан (150мл, 600ммоль). Через 2год. при кімнатній температурі реакційну суміш виливали у діетиловий етер (1000мл). Тверду речовину відфільтровували, промивали діетиловим етером (500мл) і перекристалізовували з суміші метанол/діетиловий етер з одержанням білої твердої речовини, визначеної як (2S)-піролідин-2-карбонітрилу гідрохлорид (18.9г, 142.5ммоль, 96%). F. (2S)-1-[Nw -(mреm-Бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-орнітиніл]-піролідин-2-карбонітрил Na-(mреm-Бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-орнітин (2.5г, 7.4ммоль) розчиняли в СН2СІ2 (50мл). Цей розчин охолоджували до 0°С, додавали (2S)-піролідин-2-карбонітрилу гідрохлорид (1.2г, 9.1ммоль) і РуВОРâ(4.3г, 8.23ммоль), і рівень pH доводили до рН9 триетиламіном. Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacua і залишок переносили в етилацетат (200мл). Цей розчин промивали 0.3М KHSO4 (2х50мл), насич. NaHCO3 (2х50мл), водою (2х50мл) і розчином солі (1х50мл), сушили (Na2SO4) і випарювали in vacuo з одержанням жовтого масла. Його очищали за допомогою флеш хроматографії (елюент 80% етилацетат, 20% пет. ефір) з одержанням безбарвного масла, визначеного як (2S)-1-[Na-(mреm-бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-орнітиніл]піролідин-2карбонітрил (2.98г, 7.16ммоль, 97%). G. (2S)-1-[Nw -(піразиніл-2-карбоніл)-L-орнітиніл]піролідин-2-карбонітрилу трифторацетат (2S)-1-[Na-mреm-Бутилоксикарбоніл-Nw -(піразиніл-2-карбоніл)-L-орнітиніл]піролідин-2-карбонітрил (2.8г, 6.7ммоль) розчиняли в трифтороцтовій кислоті (5мл). Через 1год. при кімнатній температурі розчинник видаляли in vacuo. Залишок очищали за допомогою препаративної ВЕРХ (Vydac C18, 5-50% 0.1% ТФО/ацетонітрил в 0.1% ТФО/вода більше ніж 40хв. при 3мл/хв.). Фракції, які містили продукт, ліофілізували з одержанням безбарвного масла, визначеного як (2S)-1-[Nw -(піразиніл-2-карбоніл)-L-орнітиніл]піролідин-2карбонітрилу трифторацетат (1.5г, 3.48ммоль, 52%). [М+Н]+=317.3 ПРИКЛАД 2 (2S)-1-[Nw -(Піразиніл-2-карбоніл)-L-лізиніл]піролідин-2-карбонітрилу трифторацетат А. (Na-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-лізиніл)-L-пролінамід Na-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-лізин (5г, 10.7ммоль) розчиняли в СН2СІ2 (100мл). Розчин охолоджували до 0°С, додавали L-пролінамід (1.78г, 11.7ммоль) і РуВОРâ (6.7г, 12.8ммоль), і рівень pH доводили до рН9 триетиламіном. Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (200мл). Розчин промивали 0.3М KHSO 4 (2 х50мл), насич. NaHCO3 (2х50мл), водою (2х50мл) і розчином солі (1х50мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 2% метанол, 98% хлороформ) з одержанням безбарвного масла, визначеного як (Na-(mреm-бутилоксикарбоніл)-Nw -(9фторенілметилоксикарбоніл)-L-лізиніл)-L-пролінамід (4.05г, 7.2ммоль, 67%). В. (2S)-1-(N a-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-лізиніл)-піролідин-2карбонітрил (Na-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-лізиніл)-L-пролінамід (3.95г, 7.02ммоль) розчиняли в сухому ТГФ (100мл). Розчин охолоджували до 0°С, додавали триетиламін (1.4г, 14ммоль) з наступним повільним додаванням ангідриду трифтороцтової кислоти (2.97г, 14.1ммоль). Рівень pH доводили до рН9 триетиламіном. Через 30хв. реакційну суміш розводили етилацетатом (100мл), промивали водою (1х50мл) і розчином солі (1х50мл), сушили (Na2SO4) і випарювали in vacuo з одержанням оранжевого масла. Залишок очищали за допомогою флеш хроматографії (елюент: 60% пет. ефір, 40% етилацетат) з одержанням безбарвного масла, визначеного як (2S)-1-(Na-(mреm-бутилоксикарбоніл)-Nw -(9фторенілметилоксикарбоніл)-L-лізиніл)піролідин-2-карбонітрил (3.3г, 6.11ммоль, 87%). С. (2S)-1-(N w -(mреm-Бутилоксикарбоніл)-L-лізиніл)піролідин-2-карбонітрил (2S)-1-(N a-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-лізиніл)піролідин-2карбонітрил (3.1г, 5.7ммоль) розчиняли в ТГФ (80мл). Додавали діетиламін (20мл). Через 2год. при кімнатній температурі розчинник видаляли in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 90% хлороформ, 7% метанол, 3% триетиламін) з одержанням безбарвного масла, визначеного як (2S)-1-(Na(mреm-бутилоксикарбоніл)-L-лізиніл)піролідин-2-карбонітрил (1.63г, 5.03ммоль, 89%). D. (2S)-1-(N a-(mреm-Бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-лізиніл)піролідин-2-карбонітрил (2S)-1-(N a-(mреm-Бутилоксикарбоніл)-L-лізиніл)піролідин-2-карбонітрил (100мг, 0.31ммоль) розчиняли в СН2СІ2/ДМФ (9:1, 20мл). До цього розчину при 0°С додавали гідрат 1-гідроксибензотриазолу (84мг, 0.62ммоль), розчинний у воді карбодіімід (76мг, 0.38ммоль), 2-піразинкарбонову кислоту (43мг, 0.35ммоль) і триетиламін (65мг, 0.65ммоль). Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (70мл). Цей розчин промивали 0.3М KHSO4 (2х20мл). насич. NaHCO3 (2х20мл). водою (2х20мл) і розчином солі (1х20мл), сушили (Na2SO4) і випарювали in vacuo з одержанням жовтого масла. Залишок очищали за допомогою флеш хроматографії (елюент: 2% метанол, 98% хлороформ) з одержанням безбарвного масла, визначеного як (2S)-1-(Na-(mреm-бутилоксикарбоніл)-Nw (піразиніл-2-карбоніл)-L-лізиніл)піролідин-2-карбонітрил (124мг, 0.29ммоль, 93%). Е. (2S)-1-[N w -(Піразиніл-2-карбоніл)-L-лізиніл]піролідин-2-карбонітрилу трифторацетат (2S)-1-(N a-(mреm-Бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-лізиніл)піролідин-2-карбонітрил (110мг, 0.26ммоль) розчиняли в трифтороцтовій кислоті (5мл). Через 1год. при кімнатній температурі розчинник видаляли in vacuo. Залишок очищали за допомогою препаративної ВЕРХ (Vydac C18, 5-50% 0.1% ТФО/ацетонітрил в 0.1% ТФО/вода більше ніж 40хв. при 3мл/хв.). Фракції, які містили продукт, ліофілізували з одержанням безбарвного масла, визначеного як (2S)-1-[Nw -(піразиніл-2-карбоніл)-L-лізиніл]піролідин-2карбонітрилу трифторацетат (66мг). [М+Н]+=331.1 ПРИКЛАД 3 (4R)-3-[N w -(Піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4-карбонітрилу трифторацетат А. (4R)-3-(mреm-Бутилоксикарбоніл)тіазолідин-4-карбоксамід (4R)-3-(mреm-Бутилоксикарбоніл)тіазолідин-4-карбонову кислоту (12.5г, 54.1ммоль) розчиняли в СН2СІ2/ДМФ (9:1, 150мл). До цього розчину при 0°С додавали гідрат 1-гідроксибензотриазолу (14.6г, 108ммоль) і розчинний у воді карбодіімід (13.0г, 65ммоль). Через 1год. при 0°С додавали аміак (35%, 50мл). Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (500мл). Розчин промивали 0.3М KHSO4 (2х100мл), насич. NaHCO3 (2х100мл), водою (2х100мл) і розчином солі (1х100мл), сушили (Na2SO4) і випарювали in vacuo з одержанням жовтого масла. Залишок очищали за допомогою флеш хроматографії (елюент: 2% метанол, 98% хлороформ) з одержанням безбарвного масла, визначеного як (4R)-3-(mреm-бутилоксикарбоніл)тіазолідин-4-карбоксамід (8.9г, 38.4ммоль, 71 %). B. (4R)-Тіазолідин-4-карбоксаміду гідрохлорид (4S)-3-(mреm-Бутилоксикарбоніл)тіазолідин-4-карбоксамід (8.6г, 37.1ммоль) розчиняли в 4M НСІ/діоксан (50мл). Через 1год. при кімнатній температурі розчинник випарювали in vacuo з одержанням білої твердої речовини, визначеної як (4R)-тіазолідин-4-карбоксаміду гідрохлорид (6.2г, 36.8ммоль, 99%). C. (4R)-3-[N a-(mреm-Бутилоксикарбонт)-Nw -(9-фторентметилоксикарбонт)-L-лізиніл]-тіазолідин-4карбоксамід Na-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-лізин (5г, 10.7ммоль) розчиняли в СН2СІ2 (100мл). Цей розчин охолоджували до 0°С, додавали (4R)-тіазолідин-4-карбоксаміду гідрохлорид (1.78г, 11.7ммоль) і РуВОРâ (6.7г, 12.8ммоль), і рівень pH доводили до рН9 триетиламіном. Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (200мл). Розчин промивали 0.3М KHSO4 (2х50мл), насич. NaHCO3 (2х50мл), водою (2х50мл) і розчином солі (1х50мл), сушили (Na2SO4) і випарювали in vacuo з одержанням жовтого масла. Залишок очищали за допомогою флеш хроматографії (елюент: 2% метанол, 98% хлороформ) з одержанням безбарвного масла, визначеного як (4R)-3-[Na-(mреm-бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)L-лізиніл]тіазолідин-4-карбоксамід (2.81г, 4.8ммоль, 44%). D. (4R)-3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-лізиніл]-тіазолідин-4карбонітрил (4R)-3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-лізиніл]тіазолідин-4карбоксамід (2.7г, 4.7ммоль) розчиняли в сухому ТГФ (100мл). Розчин охолоджували до 0°С, додавали триетиламін (1.0г, 10ммоль) з наступним повільним додаванням ангідриду трифтороцтової кислоти (2.0г, 9.5ммоль). Рівень pH доводили до рН9 триетиламіном. Через 30хв. реакційну суміш розводили етилацетатом (100мл), промивали водою (1х50мл) і розчином солі (1х50мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 60% пет. ефір, 40% етилацетат) з одержанням безбарвного масла, визначеного як (4R)-3-[Nw -(mреm-бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)L-лізиніл]тіазолідин-4-карбонітрил (2.14г, 3.81ммоль, 82%). E. (4R)-3-[N a-(mреm-Бутилоксикарбоніл)-L-лізиніл]тіазолідин-4-карбонітрил (4R)-3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-лізиніл]тіазолідин-4карбонітрил (1.9г, 3.4ммоль) розчиняли в ТГФ (40мл). Додавали діетиламін (10мл). Через 2год. при кімнатній температурі розчинник видаляли in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 90% хлороформ, 7% метанол, 3% триетиламін) з одержанням безбарвного масла, визначеного як (4R)-3-[Na(mреm-бутилоксикарбоніл)-L-лізиніл]тіазолідин-4-карбонітрил (863мг, 2.5ммоль, 75%). F. (4R)-3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4-карбонітрил (4R)-3-[N a-(mреm-Бутилоксикарбоніл)-L-лізиніл]тіазолідин-4-карбонітрил (100мг, 0.29ммоль) розчиняли в СН2СІ2 (20мл). До цього розчину при 0°С додавали 2-піразинкарбонову кислоту (43мг, 0.35ммоль) і РуВОРâ (170мг, 0.33ммоль), і рівень pH доводили до рН9 триетиламіном. Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (70мл). Розчин промивали 0.3М KHSO4 (2х20мл), насич. NaHCO3 (2х20мл), водою (2х20мл) і розчином солі (1х20мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент 2% метанол, 98% хлороформ) з одержанням безбарвного масла, визначеного як (4R)-3-[Na-(mреm-бутилоксикарбоніл)-Nw (піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4-карбонітрил (112мг, 0.25ммоль, 86%). G. (4R)-3-[N w -(Піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4-карбонітрилу трифторацетат (4R)-3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4-карбонітрил (110мг, 0.26ммоль) розчиняли в трифтороцтовій кислоті (5мл). Через 1год. при кімнатній температурі розчинник видаляли in vacuo. Залишок очищали за допомогою препаративної ВЕРХ (Vydac C18, 5-50% 0.1% ТФО/ацетонітрил в 0.1% ТФО/вода більше ніж 40хв. при 3мл/хв.). Фракції, які містили продукт, ліофілізували з одержанням безбарвного масла, визначеного як (4R)-3-[Nw -(піразиніл-2-карбоніл)-L-лізиніл]тіазолідин-4карбонітрилу трифторацетат (57мг). [М+Н]+=349.1 ПРИКЛАД 4 1-[N w -Піразиніл-2-карбоніл)-L-орнітиніліпіролідину трифторацетат А. 1-[N w -(Бензилоксикарбоніл)-Nw -(mреm-бутилоксикарбоніл)-L-орнітиніл]піролідин Nw -(Бензилоксикарбоніл)-Na-(mреm-бутилоксикарбоніл)-L-орнітин (5.49г, 15ммоль) розчиняли в СН2СІ2/ДМФ (9:1, 100мл). До цього розчину при 0°С додавали гідрат 1-гідроксибензотриазолу (3.37г, 22ммоль), розчинний у воді карбодіімід (3.46г, 18ммоль), піролідин (1.28г, 18ммоль) і триетиламін (200мг, 20ммоль). Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (200мл). Розчин промивали 0.3М KHSO4 (2 х50мл), насич. NaHCO3 (2х50мл), водою (2х50мл) і розчином солі (1х50мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 90% етилацетат, 10% пет. ефір) з одержанням безбарвного масла, визначеного як 1-[Nw -(бензилоксикарбоніл)-Na-(mpem-бутилоксикарбоніл)-L-орнітиніл]піролідин (5.15г, 12.3ммоль, 82%). B. 1-[N a-(mреm-Бутилоксикарбоніл)-L-oрнітиніл]піролідин 1-[N w -(Бензилоксикарбоніл)-Na-(mреm-бутилоксикарбоніл)-L-орнітиніл]піролідин (2.15г, 5.13ммоль) розчиняли в метанолі (80мл). Цей розчин гідрували над 10% Pd/C (400мг). Через 2год. каталізатор відфільтровували і промивали метанолом (50мл). Об'єднані фільтрати випарювали in vacuo з одержанням майже білої твердої речовини, визначеної як 1-[Na-(mреm-бутилоксикарбоніл)-L-орнітиніл]піролідин (1.35г, 4.74ммоль, 94%). C. 1-[N a-(mреm-Бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-орнітиніл]піролідин 1-[N a-(mреm-Бутилоксикарбоніл)-L-орнітиніл]піролідин (100мг, 0.35ммоль) розчиняли в СН2СІ2 (20мл). До цього розчину при 0°С додавали РуВrоРâ (195мг, 0.4ммоль), 2-піразинкарбонову кислоту (50мг, 0.4ммоль) і триетиламін (100мг, 1.0ммоль). Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (70мл). Розчин промивали 0.3М KHSO4 (2х20мл), насич. NaHCO3 (2х20мл), водою (2х20мл) і розчином солі (1х20мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент 3% метанол, 97% хлороформ) з одержанням липкої білої твердої речовини, визначеної як 1-[Na-(mреm-бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-Lорнітиніл]піролідин (90мг, 0.25ммоль, 66%). D. 1-[N w -(Піразиніл-2-карбоніл)-L-орнітиніл]піролідину трифторацетат 1-[N a-(mреm-Бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-орнітиніл]піролідин (90мг, 0.23ммоль) розчиняли в 4M НСІ/діоксан (15мл). Через 45хв. при кімнатній температурі розчинник видаляли in vacuo. Залишок очищали за допомогою препаративної ВЕРХ (Vydac C18, 5-50% 0.1% ТФО/ацетонітрил в 0.1% ТФО/вода більше ніж 40хв. при 3мл/хв.). Фракції, які містили продукт, ліофілізували з одержанням безбарвного масла, визначеного як 1-[Nw -(піразиніл-2-карбоніл)-L-орнітиніл]піролідину трифторацетат (51мг). [М+Н]+=292.1 ПРИКЛАД 5 3-[N w -(Пipазинiл-2-карбоніл)-L-oрнітиніл]тіазолідину трифторацетат А. 3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-орнітиніл]тіазолідин Na-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-орнітин (2.73г, 6ммоль) розчиняли в СН2СІ2/ДМФ (9:1, 100мл). До цього розчину при 0°С додавали гідрат 1-гідроксибензотриазолу (1.53г, 10ммоль), розчинний у воді карбодіімід (1.34г, 7ммоль), тіазолідин (1.28г, 18ммоль) і триетиламін (80мг, 8ммоль). Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (100мл). Розчин промивали 0.3М KHSO4 (2х25мл), насич. NaHCO3 (2х25мл), водою (2х25мл) і розчином солі (1х25мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 75% етилацетат, 25% пет. ефір) з одержанням білої твердої речовини, визначеної як 3-[N a-(mреm-бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-орнітиніл]тіазолідин (2.55г, 4.85ммоль, 81%). В. 3-Na-(mреm-Бутилоксикарбоніл)-L-(орнітинілітіазолідин 3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(9-фторенілметилоксикарбоніл)-L-орнітиніл]тіазолідин (1.15г, 2.13ммоль) розчиняли в ацетонітрилі (20мл). Додавали діетиламін (5мл). Через 90хв. при кімнатній температурі розчинник видаляли in vacuo і залишок очищали за допомогою флеш хроматографії (елюент: 90% хлороформ, 7% метанол, 3% триетиламін) з одержанням блідо-жовтого масла, визначеного як 3-[Na-(mреmбутилоксикарбоніл)-L-орнітиніл]тіазолідин (530мг, 1.67ммоль, 78%). С 3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-орнітиніл]тіазолідин 3-[N a-(mреm-Бутилоксикарбоніл)-L-орнітиніл]тіазолідин (80мг, 0.27ммоль) розчиняли в СН 2СІ2 (20мл). До цього розчину при 0°С додавали РуВrоРâ (146мг, 0.3ммоль), 2-піразинкарбонову кислоту (37мг, 0.3ммоль) і триетиламін (90мг, 0.9ммоль). Після 18год. відстоювання при від 0°С до кімнатної температури розчинник видаляли in vacuo і залишок переносили в етилацетат (70мл). Розчин промивали 0.3М KHSO4 (2х20мл), насич. NaHCO3 (2х20мл), водою (2х20мл) і розчином солі (1х20мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 3% метанол, 97% хлороформ) з одержанням липкої білої твердої речовини, визначеної як 3-[Na-(mреm-бутилоксикарбоніл)-Nw -(піразиніл-2-карбонілу-Lорнітиніл]тіазолідин (45мг, 0.11ммоль, 41%). D. 3-[N w -(Піразиніл-2-карбоніл)-L-орнітиніл]тіазолідину трифторацетат 3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(піразиніл-2-карбоніл)-L-орнітиніл]тіазолідин (45мг, 0.11ммоль) розчиняли в 4M НСІ/діоксан (10мл). Через 45.хв. при кімнатній температурі розчинник видаляли in vacuo. Залишок очищали за допомогою препаративної ВЕРХ (Vydac C18, 5-50% 0.1% ТФО/ацетонітрил в 0.1% ТФО/вода більше ніж 40хв. при 3мл/хв.). Фракції, які містили продукт, ліофілізували з одержанням безбарвного масла, визначеного як 3-[Nw -(піразиніл-2-карбоніл)-L-орнітиніл]тіазолідину три фторацетат (14мг). [М+Н]+=310.0 ПРИКЛАД 6 (2S)-1-[Nw -(2-Хлорпіридил-3-карбоніл)-L-орнітиніл]піролідин-2-карбонітрилу трифторацетат А. (2S)-1-(N a-(mреm-Бутилоксикарбоніл)-L-орнітил)піролідин-2-карбонітрил (2S)-1-(N a-(mреm-Бутилоксикарбоніл)-L-орнітиніл)піролідин-2-карбонітрил одержували методом, описаним для похідної лізину у Прикладі 2. В. (2S)-1-(N a-(mреm-Бутилоксикарбоніл)-Nw -(2-хлорпіридил-3-карбоніл)-L-орнітил)-піролідин-2-карбонітрил (2S)-1-(N a-(mреm-Бутилоксикарбоніл)-L-орнітил)піролідин-2-карбонітрил (80мг, 0.26ммоль) розчиняли в СН2СІ2 (20мл). До цього розчину додавали 2-хлорпіридин-3-карбонілхлорид (55мг, 0.32ммоль) і рівень pH доводили до рН9 триетиламіном. Через 18год. при кімнатній температурі розчинник видаляли in vacuo і залишок переносили в етилацетат (70мл). Розчин промивали 0.3М KHSO4 (2х20мл), насич. NaHCO3 (2х20мл), водою (2х20мл) і розчином солі (1х20мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 95% етилацетат, 5% пет. ефір) з одержанням безбарвного масла, визначеного як (2S)-1-(Na-(mpem-бутилоксикарбоніл)-Nw -(2-хлорпіридил-3-карбоніл)-L-орнітил)піролідин-2карбонітрил (60мг, 0.14ммоль, 53%). С. (2S)-1-[Nw -(2-Хлорпіридил-3-карбоніл)-L-орнітиніл]піролідин-2-карбонітрилу трифторацетат (2S)-1-[Na-(mpem-Бутилоксикарбоніл)-Nw -(2-хлорпіридил-3-карбоніл)-L-орнітиніл]піролідин-2-карбонітрил (60мг, 0.14ммоль) розчиняли в трифтороцтовій кислоті (5мл). Через 1год. при кімнатній температурі розчинник видаляли in vacuo. Залишок очищали за допомогою препаративної ВЕРХ (Vydac C18, 5-50% 0.1% ТФО/ацетонітрил в 0.1% ТФО/вода більше ніж 40хв. при 3мл/хв.). Фракції, які містили продукт, ліофілізували з одержанням білої твердої речовини, визначеної як (2S)-1-[Nw -(2-хлорпіридил-3-карбоніл)-L-орнітиніл]піролідин2-карбонітрилу трифторацетат (52мг). [М+Н]+=350.1 ПРИКЛАД 7 1-[N w -(2-Хлорпіридил-3-карбоніл)-L-орнітиніл]піролідину гідрохлорид A. 1-(N a-(mреm-Бутилоксикарбоніл)-Nw -(2-хлорпіридил-3-карбоніл)-L-орнітил)-піролідин 1-(Na-(mреm-Бутилоксикарбоніл)-L-орнітил)піролідин (20мг, 0.069ммоль) розчиняли в СН 2СІ2 (5мл). До цього розчину додавали 2-хлорпіридин-З-карбонілхлорид (14мг, 0.076ммоль) і рівень pH доводили до рН9 триетиламіном. Через 1год. при кімнатній температурі розчинник видаляли in vacuo і залишок переносили в етилацетат (70мл). Розчин промивали 0.3М KHSO4 (2х20мл), насич. NaHCO3 (2х20мл), водою (2х20мл) і розчином солі (1х20мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент 10% метанол, 90% дихлорметан) з одержанням безбарвного масла, визначеного як 1(Na-(mpem-бутилоксикарбоніл)-Nw -хлорпіридил-3-карбоніл)-L-орнітил)піролідин (19мг, 0.045ммоль, 63%). B. 1-[N w -Хлорпіридил-3-карбоніл)-L-орнітиніл]піролідину гідрохлорид 1-[N a-(mреm-Бутилоксикарбоніл)-Nw -(2-хлорпіридил-3-карбоніл)-L-орнітиніл]піролідин (19мг, 0.045ммоль) розчиняли в 4M НСІ/діоксан (10мл). Через 45хв. при кімнатній температурі розчинник видаляли in vacuo з одержанням білої твердої речовини, визначеної як 1-[Nw -(2-хлорпіридил-3-карбоніл)-L-орнітиніл]піролідину гідрохлорид (15мг). [М+Н]+=325.1 ПРИКЛАД 8 3-[N w -Хлорпіридил-3-карбоніл)-L-орнітиніл]тіазолідину гідрохлорид A. 3-(N a-(mреm-Бутилоксикарбоніл)-Nw -хлорпіридил-3-карбоніл)-L-орнітил)-тіазолідин 3-(Na-(mреm-Бутилоксикарбоніл)-L-орнітил)тіазолідин (136мг, 0.45ммоль) розчиняли в СН 2СІ2 (10мл). До цього розчину додавали 2-хлорпіридин-3-карбонілхлорид (88мг, 0.5ммоль) і рівень pH доводили до рН9 триетиламіном. Через 1год. при кімнатній температурі розчинник видаляли in vacuo і залишок переносили в етилацетат (70мл). Розчин промивали 0.3М KHSO4 (2х20мл), насич. NaHCO3 (2х20мл), водою (2х20мл) і розчином солі (1х20мл), сушили (Na2SO4) і випарювали in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 1.5% метанол, 98.5% дихлорметан) з одержанням безбарвного масла, визначеного як 3-(Na-(mpem-бутилоксикарбоніл)-Nw -(2-хлорпіридил-3-карбоніл)-L-орнітил)тіазолідин (30мг, 0.068ммоль, 15%). B. 3-[N w -(2-Хлорпіридил-3-карбоніл)-L-орнітиніл]тіазолідину гідрохлорид 3-[N a-(mpem-Бутилоксикарбоніл)-Nw -(2-хлорпіридил-3-карбоніл)-L-орнітиніл]тіазолідин (30мг, 0.068ммоль) розчиняли в 4M НСІ/діоксан (10мл). Через 45хв. при кімнатній температурі розчинник видаляли in vacuo з одержанням білої твердої речовини, визначеної як 1-[Nw -(2-хлорпіридил-3-карбоніл)-L-орнітиніл]тіазолідину гідрохлорид (25мг). [М+Н]+=342.1 ПРИКЛАД 9 3-[N w -(5-Ціано-2-піридил)-L-лізиніл]тіазолідину гідрохлорид A. 3-(N a-(mpem-Бутилоксикарбоніл)лізиніл)тіазолідин 3-(Na-(mpem-Бутилоксикарбоніл)лізиніл)тіазолідин одержували у дві стадії згідно з методом, описаним для відповідної похідної орнітину у Прикладі 5. B. 3-[N a-(mpem-Бутилоксикарбоніл)-Nw -(5-ціано-2-піридил)-L-лізиніл]тіазолідин 3-(Na-(mpem-Бутилоксикарбонил)лізиніл)тіазолідин (52мг, 0.165ммоль) розчиняли в ДМФ (10мл). Додавали 6-хлорнікотинонітрил (22.8мг, 0.165ммоль) і карбонат калію (45.8мг, 0.5ммоль). Реакційну суміш перемішували при 70°С протягом 18 годин і розчинник видаляли in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 97% хлороформ, 3% метанол) з одержанням безбарвного масла, визначеного як 3-[N a-(mpem-бутилоксикарбоніл)-Nw -(5-ціано-2-піридил))-L-лізиніл]тіазолідин (30мг, 0.067ммоль, 43%). C. 3-[N w -(5-Ціано-2-піридил)-L-лізиніл]тіазолідину гідрохлорид 3-[N a-(mpem-Бутилоксикарбоніл)-Nw -(5-ціано-2-піридил))-L-лізиніл]тіазолідин (30мг, 0.067ммоль) розчиняли в 4 M НСІ/діоксан (20мл). Через 1 годину при кімнатній температурі розчинник видаляли in vacuo з одержанням білої твердої речовини, визначеної як 3-[Nw -(5-ціано-2-піридил))-L-лізиніл]тіазолідину гідрохлорид (24мг,0.067ммоль, 100%). [М+Н]+=348.2 ПРИКЛАД 10 (2S)-1-[Nw -(5-Ціано-2-піридил)-L-лізиніл]піролідин-2-карбонітрилу трифторацетат A. (2S)-1-[N a-(mpem-Бутилоксикарбоніл)-Nw -(5-ціано-2-піридил)-L-лізиніл]піролідин-2-карбонітрил (2S)-1-(N a-(mpem-Бутилоксикарбоніл)лізиніл)піролідин-2-карбонітрил (150мг, 0.46ммоль) розчиняли в ДМФ (10мл). Додавали 6-хлорнікотинонітрил (70мг, 0.51ммоль) і карбонат калію (130мг, 0.94ммоль). Реакційну суміш перемішували при 70°С протягом 18 годин і розчинник видаляли in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 97% хлороформ, 3% :метанол) з одержанням безбарвного масла, визначеного як (2S)-1-[N a-(mpem-бутилоксикарбоніл)-Nw -(5-ціано-2-піридил))-L-лізиніл]піролідин-2-карбонітрил (71мг, 0.17ммоль, 37%). B. (2S)-1-[N w -(5-Ціано-2-піридил)-L-лізиніл]піролідин-2-карбонітрилу три фторацетат (2S)-1-[Na-(mреm-Бутилоксикарбоніл)-Nw -(5-ціано-2-піридил))-L-лізиніл]піролідин-2-карбонітрил (71мг, 0.17ммоль) розчиняли в 4M НСІ/діоксан (20мл). Через 1 годину при кімнатній температурі розчинник видаляли in vacuo з одержанням білої твердої речовини, визначеної як (2S)-1-[Nw -(5-ціано-2-піридил))-Lлізиніл]піролідин-2-карбонітрилу гідрохлорид (62мг, 0.17ммоль, 100%). [М+Н]+=327.1 ПРИКЛАД 11 (2S)-1-[Nw -(5-Трифторметил-2-піридил)-L-орнітиніл]піролідин-2-карбонітрилу трифторацетат A. (2S)-1-[Na-(mреm-Бутилоксикарбоніл)-Nw -(5-трифторметил-2-піридил)-L-орнітиніл]-піролідин-2карбонітрил (2S)-1-[Na-(mpem-Бутилоксикарбоніл)орнітиніл]піролідин-2-карбонітрил (140мг, 0.45ммоль) розчиняли в ДМФ (10мл). Додавали 2-хлор-5-(трифторметил)піридин (90мг, 0.49ммоль) і карбонат калію (130мг, 0.92ммоль). Реакційну суміш перемішували при 70°С протягом 18 годин і розчинник видаляли in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 97% хлороформ, 3% метанол) з одержанням безбарвного масла, визначеного як (2S)-1-[Na-(mpem-бутилоксикарбоніл)-Nw -(5-трифторметил-2-піридил))-Lорнітиніл]-піролідин-2-карбонітрил (58мг, 0.13ммоль, 28%). B. (2S)-1-[N w -(5-Трифторметил-2-піридил))-L-орнітиніл]піролідин-2-карбонітрилу три фторацетат (2S)-1-[Na-(mреm-Бутилоксикарбоніл)-[Nw -(5-трифторметил-2-піридил)-L-орнітиніл]піролідин-2-карбонітрил (58мг, 13ммоль) розчиняли в 4M НСІ/діоксан (20мл). Через 1 годину при кімнатній температурі розчинник видаляли in vacuo з одержанням білої твердої речовини, визначеної як (2S)-1-[Nw -(5-трифторметил-2піридил))-L-орнітиніл]піролідин-2-карбонітрилу гідрохлорид (51мг, 0.13ммоль, 100%). [М+Н]+=356.2 ПРИКЛАД 12 3-[N w -(2-Хінолінілметил)-L-лізиніл]тіазолідину гідрохлорид A. 3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(2-хінолінілметил)-L-лізинілітіазолідин 3-[N a-(mреm-Бутилоксикарбоніл]лізин]тіазолідин (100мг, 0.32ммоль) розчиняли в метанолі (10мл). Додавали 2-хінолінкарбоксальдегід (61мг, 0.39ммоль). Через 1 годину додавали ацетоксиборгідрид натрію (138мг, 0.65ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 18 годин і розчинник видаляли in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 93% хлороформ, 7% метанол) з одержанням безбарвного масла, визначеного як 3-[Na-(mреm-бутилоксикарбоніл)-Nw -(2хінолінілметил)-L-лізиніл]тіазолідин (38мг, 0.083ммоль, 26%). B. 3-[N w -(2-Хінолінілметил)-L-лізиніл]тіазолідину гідрохлорид 3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(2-хінолінілметил)-L-лізиніл]тіазолідин (38мг, 0,083ммоль) розчиняли в 4 M НСІ/діоксан (20мл). Через 1 годину при кімнатній температурі розчинник видаляли in vacuo з одержанням білої твердої речовини, визначеної як 3-[Nw -(2-хінолінілметил)-L-лізиніл]тіазолідину гідрохлорид (31мг, 0.078ммоль, 94%). [М+Н]+=358.2 ПРИКЛАД 13 3-[N w -(2-Хінолінілметил)-L-орнітиніл]тіазолідину гідрохлорид A. 3-[N a-(mpem-Бутилоксикарбоніл)-Nw -(2-хінолінілметил)-L-орнітиніл]тіазолідин 3-[N a-(mpem-Бутилоксикарбоніл)орнітиніл]тіазолідин (98мг, 0.33ммоль) розчиняли в метанолі (10мл). Додавали 2-хінолінкарбоксальдегід (52мг, 0.33ммоль). Через 1 годину додавали ацетоксиборгідрид натрію (119мг, 0.56ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 18 годин і розчинник видаляли in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 93% хлороформ, 7% метанол) з одержанням безбарвного масла, визначеного як 3-[Na-(mреm-бутилоксикарбоніл)-Nw -(2хінолінілметил)-L-орнітиніл]тіазолідин (45мг, 0.10ммоль, 36%). B. 3-[N w -(2-Хінолінілметил)-L-орнітиніл]тіазолідину гідрохлорид 3-(Na-(mpem-Бутилоксикарбоніл)-Nw -(2-хінолінілметил)-L-орнітиніл]тіазолідин (45мг, 0.1ммоль) розчиняли в 4 M НСІ/діоксан (20мл). Через 1 годину при кімнатній температурі розчинник видаляли in vacuo з одержанням білої твердої речовини, визначеної як 3-[Nw -(2-хінолінілметил)-L-орнітиніл]тіазолідину гідрохлорид (38мг, 0.098ммоль, 98%). [М+Н]+=345.2 ПРИКЛАД 14 3-[N w -(2-Хіноксалоїл)-L-лізиніл]тіазолідину гідрохлорид A. 3-[N a-(mреm-Бутилоксикарбоніл)-Nw -(2-хіноксалоїл)-L-лізиніл]тіазолідин 3-[N a-(mpem-Бутилоксикарбоніл)лізиніл]тіазолідин (128мг, 0.4ммоль) розчиняли в СН 2СІ2 (10мл). Додавали 2-хіноксалоїлхлорид (85мг, 0.44ммоль) і карбонат калію (45.8мг, 0.3ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 18 годин і розчинник видаляли in vacuo. Залишок очищали за допомогою флеш хроматографії (елюент: 99.5% хлороформ. 0.5% метанол) з одержанням безбарвного масла, визначеного як 3-[Na-(mpem-бутилоксикарбоніл)-Nw -(2-хіноксалоїл)-L-лізиніл]тіазолідин (140мг, 0.296ммоль, 74%). B. 3-[N w -(2-Хіноксалоїл)-L-лізиніл]тіазолідину гідрохлорид 3-[N a-(mpem-Бутилоксикарбоніл)-Nw -(2-хіноксалоїл)-L-лізиніл]тіазол ідин (140мг, 0.296ммоль) розчиняли в 4M НСІ/діоксан (20мл). Через 1 годину при кімнатній температурі розчинник видаляли in vacuo з одержанням білої твердої речовини, визначеної як 3-[Nw -(2-хіноксалоїл)-L-лізиніл]тіазолідину гідрохлорид (128мг, 0.296ммоль, 100%). [М+Н]+=374.2 Приклади, наведені у наступних таблицях бути одержані методами, аналогічними викладеним вище. ПРИКЛАД 121 Визначення активності in vitro Сполуки досліджувались як інгібітори ДП-IV відповідно до методів, описаних в W095/15309. Всі сполуки, описані у вищенаведених прикладах, були інгібіторами ДП-IV, які порівнювали, із значенням Кі менше ніж 300нМ. ПРИКЛАД 122 Визначення активності in vivo Антидіабетичну дію вибраних сполук демонстрували на товстих пацюках Цукера, застосовуючи стандартний тест на толерантність до глюкози із пероральним шляхом введення. Контрольним пацюками перорально давали розчин глюкози і визначали рівень глюкози у плазмі. У цих пацюків спостерігали значну гіперглікемію. Сполуки згідно з даним винаходом розчиняли в розчині глюкози у різних концентраціях таким чином, що пацюкам давали різні дози сполуки одночасно з викликом глюкози. Пперглікемічне відхилення зменшувалось у залежності від дози у тварин, які одержали від 0.1 до 100мг/кг інгібітора ДП-IV. ПРИКЛАД 123 Фармацевтична рецептура Таблетки, які містили 100мг сполуки Прикладу 1 у якості активного агента одержували з наступних компонентів: Сполука Прикладу 1 200.0г Кукур удзяний крохмаль 71.0г Гідроксипропілцелюлоза 18.0г Кабоксиметилцелюлоза кальцію 13.0г Стеарат магнію 3.0г Лактоза 195.0г Разом 500.0г Матеріали змішували і потім запресовували з одержанням 2000 таблеток 250мг, кожна містила 100мг сполуки Прикладу 1. Вищенаведене показує, що сполуки згідно з даним винаходом є інгібіторами ДП-IV і очікується, що вони будуть корисними у якості терапевтичних агентів для лікування зменшеної толерантності до глюкози, діабету типу II, та інши х за хворювань, при яких інгібування цього ензиму приведе до покращення стану при існуючій патології, або зменшення симптомів. Даний винахід визначений у наступній формулі.
ДивитисяДодаткова інформація
Назва патенту англійськоюDipeptidilpeptidasa iv inhibitor, pharmaceutical composition on its base
Назва патенту російськоюИнгибитор дипептидилпептидазы iv, фармацевтическая композиция на его основе
Автори російськоюEvans, David, Michael
МПК / Мітки
МПК: A61P 29/00, A61K 31/506, A61K 31/4725, A61P 37/02, C07D 213/82, A61K 31/497, C07D 277/20, C07D 403/12, A61P 3/10, C07D 413/12, C07D 401/12, C07D 277/56, C07D 417/12, A61K 31/4439, A61K 31/422, A61K 31/427, A61K 31/498, A61K 31/4709, A61P 3/00, A61P 5/06, A61P 43/00, C07D 241/24, A61P 5/02, A61P 15/08
Мітки: інгібітор, фармацевтична, композиція, дипептидилпептидази, основі
Код посилання
<a href="https://ua.patents.su/16-73166-ingibitor-dipeptidilpeptidazi-iv-farmacevtichna-kompoziciya-na-jjogo-osnovi.html" target="_blank" rel="follow" title="База патентів України">Інгібітор дипептидилпептидази iv, фармацевтична композиція на його основі</a>
Попередній патент: Спосіб очищення розбавлених водних розчинів від іонів кольорових металів
Наступний патент: Зовнішня теплоізолююча стіна будинку
Випадковий патент: Спосіб визначення параметрів нелінійної дисипативної коливної системи












