Гідровані азотвмісні гетероциклічні сполуки, похідні піперидину, фармацевтична композиція та спосіб пригнічення активності речовини р в організмі
Формула / Реферат
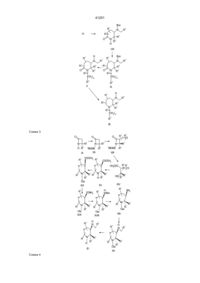
1. Гидрированные азотсодержащие гетероциклические соединения формулы (I):
m - целое число от 0 до 6, причем любая из одинарных связей "углерод-углерод" группы (СН2)m может быть заменена необязательно двойной или тройной связью "углерод-углерод", а любой из атомов углерода в группе (СН2)m может быть замещен необязательно радикалом R8;
R1 - водород или (С1-С6)алкил, необязательно замещенный гидрокси- или алкокси-группами или фтором;
R2 - радикал, выбранный из группы, включающей водород, метил, трет -бутил, (C5-С6)циклоалкил, бензил, бензгидрил, нафтил, тиенил, фуранил, инданил или фенил, который может быть необязательно замещен трифторметилом, одним или двумя атомами галогена, алкокси, (С1-С3)гидроксиалкилом, фенилом или -NН(С1-С3)алкилом;
R3 - фенил, который может быть замещен одним, двумя или тремя заместителями, выбранными из метила, (С1-С4)алкоксила, галогена, трифторметила, диалкиламина;
тиенил или 2-метоксинафтил;
R4 - водород, метил, метокси, галоген;
R5-водород;
или R2 и R5 вместе с атомом углерода кольца могут образовывать спиро-кольцо:
где p -1 или 2;
R6- водород, фенил, гидроксил, фенокси, амино, циано, карбокси, карбоэтокси, ацетамидо, бензамидо, бензоил, 4-фторбензоил, а-оксибензил, а-окси-4-фторбензил, оксиминобензил, 4,4' -дифторбензгидрил, карбоксамидо, М-метилкарбоксамидо, п-толилсульфонамидо, тиофенил, 2-нафтамидо- или нафтил-2-метиламино;
R7-водород;
R8 - водород или гидроксил;
или их фармацевтически приемлемые кислотно-аддитивные соли, проявляющие антагонистическую активность в отношении вещества Р .
2. Соединения по п. 1, где R1, R4, R5, R8 и R7 представляют собой водород, R2 -фенил, R3 - 2-метоксифенил, и где фенильная часть молекулы может быть необязательно замещена хлором, фтором, (С1- С4)алкоксигруппой или трифторметилом, и m равно нулю.
3. Производные пиперидина общей формулы:
где R1-R5 и R7 имеют значения, определенные для гидрированного азотсодержащего гетероциклического соединения формулы (I), в качестве промежуточных соединений при получении гидрированных азотсодержащих гетероциклических соединений формулы (I).
4. Соединение по п.1, представляющее собой З-амино-2-фенилпиперидин.
5. Соединение по п.4, представляющее собой (28, 38)-3-амино-2-фенилпиперидин.
6. Фармацевтическая композиция, проявляющая антагонистическое действие в отношении вещества Р, содержащая активное начало и фармацевтически приемлемые целевые добавки, отличающаяся тем, что в качестве активного начала она содержит эффективное количество гидрированного азотсодержащего гетероциклического соединения формулы (I).
7. Фармацевтическая композиция по п.6, отличающаяся тем, что она содержит активное начало в количестве 5,0-1500 мг.
8. Способ подавления активности вещества Р в организме введением антагониста вещества Р, отличающийся тем, что в качестве антагониста вещества Р используют эффективное количество гидрированного азотсодержащего гетероциклического соединения формулы (I).
9. Способ по п. 8, отличающийся тем, что соединение формулы (I) используют в дозе 5,0-1500 мг в день.
Текст
41251 Настоящее изобретение относится к новым производным 3-аминопиперидина и родственным соединениям, фармацевтическим композициям, содержащим такие соединения, и к использованию таких соединений при лечении и предупреждении воспалительных процессов и расстройств центральной нервной системы, а также некоторых других нарушений. Фармацевтически активные соединения настоящего изобретения являются антагонистами вещества Р. Настоящее изобретение относится также к новым интермедиатам, используемым при синтезе таких антагонистов вещества Р. Вещество Р является встречающимся в природе ундекапептидам, принадлежащим к тахикининовому семейству пептидов, причем последние называются так из-за их быстрого стимулирующего действия на ткани гладкой мышцы. Точнее, вещество Р является фармакологически активным нейропептидом, который получается у млекопитающих (первоначально было выделено из кишки) и обладает характерной аминокислотной последовательностью, которая показывается Вебером и др. (D.F. Veber et аl.) в патенте США № 4680283. Широкое вовлечение вещества Р и других тахикининов в патофизиологию разнообразных заболеваний продемонстрировано в достаточной степени в данной области. Например, вещество Р, как было недавно показано, вовлекается в передачу боли или мигрени (Сэндберг и др. - В.Е. Sandberg et al., Journal of Medicinal Chemistry, 25, 1009 (1982)), а также при расстройствах центральной нервной системы, таких как тревога и шизофрения, при респираторных и воспалительных заболеваниях, таких как астма и ревматоидный артрит, соответственно, при ревматических заболеваниях, таких как фиброз, и при желудочно-кишечных нарушениях и заболеваниях желудочно-кишечного тракта, таких как неспецифический язвенный колит и болезнь Кроуна, и так далее ((Д. Реголи в "Общие направления в "гистаминовой" головной боли (мигрени)", изданном под ред. Сикутери и др. (D. Regoli in "Trends in Cluster Headache" edited by F. Sicuteri et al., Elsevier Scientific Publishers, Amsterdam, p.p. 85-95 (1987)). В недалеком прошлом были принятые некоторые попытки выработать антагонисты для вещества Р и других тахикининовых пептидов для того, чтобы более эффективно вылечивать разнообразные нарушения и болезни, перечисленные выше. Несколько таких антагонистов, до сих пор описанных, являются в большинстве случаев пептидо-подобными по природе и поэтому являются слишком лабильными (неустойчивыми) с точки зрения метаболизма, чтобы быть полезными в качестве практически используемых терапевтических средств при лечении болезни. С другой стороны, не пептидные антагонисты настоящего изобретения не обладают таким недостатком, являясь намного более стабильными с точки зрения метаболизма, чем упомянутые выше средства. Настоящее изобретение относится к соединениям общей формулы (I): R R R 4 1 N 7 R 8 N R R 3 2 5 R (CH2) m 6 R (I) m представляет собой целое число от 0 до 6, и любая углерод-углеродная простая связь группы (СН2)m необязательно может быть заменена на углерод-углеродную, двойную связь или углерод-углеродную тройную связь, и любой один из углеродных атомов группы (СН2)m необязательно может быть замещен радикалом R8; R1 представляет собой водород или (C1C6)-алкил, необязательно замещенный гидрокси-, алкокси-группой или фтором, R2 представляет собой радикал, выбранный из водорода, метила, трет-бутила, (C5-C6)-циклоалкила, бензила, бензгидрила, нафтила, тиенила, фуранила, индонила или фенила, который необязательно может быть замещен трифторметилом, одним или двумя атомами галогена, алкоксигруппой, (C1-C3)гидроксиалкилом, фенилом или -NH(С1-С3)алкилом; R3 представляет собой фенил, который необязательно может быть замещен одним, двумя или тремя заместителями, выбранными из галогена, метила, (С1-С4)-алкокси-, трифторметила и диалкиламина;тиенил или 2-метоксинафтил; R4 представляет водород, метил, метокси, галоген; R5 представляет водород; или R2 и R5 вместе с атомом углерода кольца могут образовывать спиро-кольцо (CH 2)p , где р равно 1 или 2; R6 представляет собой водород, фенил, гидрокси, фенокси, амино, циано, карбокси, карбоэтокси, ацетамидо, бензамидо, бензоил, 4-фторбензил, a-оксибензил, a-окси-4-фтор-бензил, оксиминобензил, 4,41-дифтopбeнзгидpил, карбоксамидо, N-метилкарбоксамидо, n-толилсульфона-мидо, тиофенил, 2нафтамидо- или нафтил-2-метиламино; R7 представляет водород, R8 представляет водород или гидроксил. 41251 Настоящее изобретение относится также к фармацевтически приемлемым кислотно-аддитив-ным солям соединений формулы I. Кислоты, которые используются, чтобы получить фармацевтически приемлемые кислотно-аддитивные соли соединений настоящего изобретения, являются такими, которые образуют нетоксичные соли при присоединении кислот, т.е. соли, содержащие фармакологически приемлемые анионы, такие как хлористоводородные, бромистоводородные, иодистоводородные, нитраты, сульфаты, бисульфаты, фосфаты, кислые фосфаты, ацетаты, лактаты, цитраты, кислые цитраты, тартраты, битартраты, сукцинаты, малеаты, фумараты, глюконаты, сахараты, бензоаты, метансульфонаты, этансульфонаты, бенолсульфонаты, паратолуолсульфонаты и памоаты (т.е. 1,1'-метилен-бис-(2-гидрокси-З-нафтоатная соль). Настоящее изобретение относится также к производным пиперидина формулы VII; R R R 4 N 7 O 1 R R 3 2 N H R 5 , (VII) в которой R , R , R , R , R и R являются такими, как определено для соединений формулы I. Соединения формулы VII являются новыми промежуточными, используемыми при синтезе соединений формулы 1. Настоящее изобретение относится также к соединению 3-амино-2-фенилпиперидина. Настоящее изобретение относится также к фармацевтической композиции для лечения или предупреждения состояния, выбираемого из группы, состоящей из воспалительных заболеваний (например, артрит, псориаз, астма и воспалительное кишечное заболевание), страха (тревоги), депрессивных или дистимических расстройств, колита, психоза, боли, аллергий, таких как экзема и ринит, хронического обструктивного заболевания дыхательных путей, аллергических (повышенной чувствительности) нарушений, таких как вызванных ядовитым растением poison ivy, вазоспастических заболеваний, таких как ангина, мигрень и болезнь Рейнауда, фиброзных и коллагеновых болезней, таких как склеродермия и эозинофильный фасциолез, рефлекторно-симпатической дистрофии, такой как плечевой синдром, хронических (наркотических) нарушений, таких как алкоголизм, соматических расстройств, связанных со стрессом, периферической невропатии, невралгии, невропатологических расстройств, таких как болезнь Алцгеймера, слабоумие, связанное со СПИДом, диабетическая невропатия и множественный склероз, нарушений, связанных с иммунным усилением или угнетением (супрессией), таких как системная красная волчанка, и ревматических заболеваний, таких как фиброз у млекопитающих, включая человека, включающей количество соединения формулы 1, или фармацевтически приемлемую соль его, эффективное при лечении или предупреждении такого состояния, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу лечения или предупреждения состояния, выбираемого из группы, состоящей из воспалительных заболеваний (например, артрит, псориаз, астма и воспалительное кишечное заболевание), страха (тревоги), депрессивных или дистимических расстройств, колита, психоза, боли, аллергий, таких как экзема и ринит, хронического обструктивного заболеваний дыхательных путей, аллергических (повышенной чувствительности) нарушений, таких как ядовитый плющ, вазоспастических заболеваний, таких как ангина, мигрень и болезнь Рейнауда, фиброзных и коллагеновых болезней, таких как склеродермия и эозинофильный фасциолез, рефлекторно-симпатической дистрофии, такой как плечевой синдром, хронических нарушений, таких как алкоголизм, соматических расстройств, связанных со стрессом, периферической невропатии, невралгии, невропатологических расстройств, таких как болезнь Алцгеймера, слабоумие, связанное со СПИДом, диабетическая невропатия и множественный склероз, нарушений, связанных с иммунным усилением или угнетением (супрессией), таких как системная красная волчанка, и ревматических заболеваний, таких как фиброз у млекопитающих, включая человека, включающему введение указанному млекопитающему количества соединения формулы 1, или фармацевтически приемлемой соли его, эффективного при лечении или предупреждении такого состояния. Настоящее изобретение относится также к фармацевтической композиции для антагонизирования действий вещества Р у млекопитающих, включая человека, включающей антагонизирующее для вещества Р количество соединения формулы 1, или фармацевтически приемлемой соли его, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу антагонизирования действий вещества Р у млекопитающих, включая человека, включающему введение указанному млекопитающему антагонизирующее-вещество Р - количество соединения формулы 1, или фармацевтически приемлемой соли его. Настоящее изобретение относится также к фармацевтической композиции для лечения или предупреждения расстройства у млекопитающего, включая человека, происходящего в результате действия избытка вещества Р, включающей антагонизирующее вещество Р количество соединения формулы 1, или фармацевтически приемлемой соли его, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу лечения или предупреждения расстройства у млекопитающих, включая человека, происходящего в результате действия избытка вещества Р, включающему введение указанному млекопитающему антагонизирующее вещество Р количество соединения формулы 1, или фармацевтически приемлемой соли его. 1 2 3 4 5 7 41251 Настоящее изобретение относится также к фармацевтической композиции для лечения или предупреждения состояния, выбираемого из группы, состоящей из воспалительных заболеваний (например, артрита, псориаза, астмы и воспалительного кишечного заболеваний), страха (тревоги), депрессивных или дистимических расстройств, колита, психоза, боли, аллергий, таких как экзема и ринит, хронического обструктивного заболевания дыхательных путей, аллергических нарушений, таких как ядовитый плющ, вазоспастических заболеваний, таких как ангина, мигрень и болезнь Рейнауда, фиброзных и коллагеновых болезней, таких как склеродермия и эозинофильный фасциолез, рефлекторносимпатической дистрофии, такой как плечевой синдром, хронических нарушений, таких как алкоголизм, соматических расстройств, связанных со стрессом, периферической невропатии, невралгии, невропатологических расстройств, таких как болезнь Алцгеймера, слабоумие, связанное со СПИДом, диабетическая невропатия и множественный склероз, нарушений, связанных с иммунным усилением или угнетением (супрессией), таких как системная красная волчанка, и ревматических заболеваний, таких как фиброз у млекопитающих, включая человека, включающей количество соединения формулы 1, или фармацевтически приемлемой соли его, эффективное при антагонизировании действия вещества Р на его клеточный рецептор, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу лечения или предупреждения состояния, выбираемого из группы, состоящей из воспалительных заболеваний (например, артрита, псориаза, астмы и воспалительного кишечного заболевания), страха (тревоги), депрессивных или дистимических расстройств, колита, психоза, боли, аллергий, таких как экзема и ринит, хронического обструктивного заболевания дыхательных путей, аллергических нарушений, таких как ядовитый плющ, вазоспастических заболеваний, таких как ангина, мигрень и болезнь Рейнауда, фиброзных и коллагеновых болезней, таких как склеродермия и эозинофильный фасциолез, рефлекторно-симпатической дистрофии, такой как плечевой синдром, хронических нарушений, таких как алкоголизм, соматических расстройств, связанных со стрессом, периферической невропатии, невралгии, невропатологических расстройств, таких как болезнь Альцгеймера, слабоумие, связанное со СПИДом, диабетическая невралгия и множественный склероз, нарушений, связанных с иммунным усилением или угнетением (супрессией), таких как системная красная волчанка, и ревматических заболеваний, таких как фиброз у млекопитающих, включая человека, включающему введение указанному млекопитающему количества соединения формулы 1, или фармацевтически приемлемой соли его, эффективного при антагонизировании действия вещества Р на его клеточный рецептор. Настоящее изобретение относится также к фармацевтической композиции для лечения или предупреждения нарушений у млекопитающих, включая человека, лечение или предупреждение которого осуществляется или облегчается уменьшением нейротрансмиссии, связанной с веществом Р, включающей количество соединения формулы 1, или фармацевтически приемлемой соли его, эффективное при антагонизировании действия вещества Р на его клеточный рецептор, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу лечения или предупреждения расстройства у млекопитающих, включая человека, лечение или предупреждение которого осуществляется или облегчается уменьшением нейротрансмиссии, связанной с веществом Р, включающему введение указанному млекопитающему количества соединения формулы 1, или фармацевтически приемлемой соли его, эффективного при антагонизировании действия вещества Р на его клеточный рецептор. Настоящее изобретение относится также к фармацевтической композиции для лечения или предупреждения расстройства у млекопитающих, включая человека, лечения или предупреждения которых осуществляется или облегчается уменьшением нейротрансмиссии, связанной с веществом Р, включающей количество соединения формулы 1, или фармацевтически приемлемой соли его, эффективное при лечении или предупреждении такого расстройства, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу лечения или предупреждения расстройства у млекопитающих, включая человека, лечение или предупреждение которых осуществляется или облегчается уменьшением нейротрансмиссии, связанной с веществом Р, включающему введение указанному млекопитающему количества соединения формулы 1, или фармацевтически приемлемой соли его, эффективного при лечении или предупреждении такого расстройства. Соединения формулы 1 имеют хиральные центры и поэтому существуют в различных эн-зитиомерных формах. Настоящее изобретением относится ко всем оптическим изомерам и всем стереоизомерам соединений формулы 1, и смесям их. Формулы 1 и VII, представленные выше, включают соединения, идентичные описанным соединениям, но в которых один или более атомов водорода или углерода заменяются на их радиоактивные изотопы. Такие соединения, меченные радиоактивными атомами, являются полезными в качестве исследовательских и диагностических инструментов (средств) при фармокинетических исследованиях метаболизма и при анализах связывания. Специфические применения при исследовании включают испытания связывания с использованием радиоактивного лиганда, исследования ауторадиографии и исследования ин виво связывания, тогда как специфические применения в диагностической области включают исследования рецептора вещества Р в мозге при ин виво связывании в соответствующих тканях для воспаления, например, клетки иммунного типа или клетках, которые непосредственно вовлекаются в воспалительные кишечные расстройства и тому подобные. Включенными среди радиоактивно-меченных форм соединений формул 1 и VII являются их соединения с тритием и изотопами С14. Соединения формулы 1 могут быть получены как это описано в следующих схемах реакций и в обсуждении. Каждая из формул, обозначенных 1А, 1В, 1С и 1Д, представляет различную группу 41251 соединений, имеющих общую формулу 1. Если не оговорено особо, R1, R2, R3, R4, R5, R6, R7, R8, V, n и m в схемах реакций и в обсуждении, которое следует за ними, определяются так, как это описано выше. Схема 1 OH R 4 R R NO2 7 R O O 4 O R N CH3 R H II R 7 R R 3 R R R 2 N H VI R R R N R 5 R (CH2)m R 2 R 3 R 4 R 2 O 1 N R 3 7 O N H R R 2 5 6 IB VII R R R 4 1 N R 7 N H IC Схема 2 R 3 R R 2 5 4 R R 5 2 3 NH2 7 N H V R N R 5 H 4 8 N 7 O 5 7 R N H IV 4 IA R O H R N H 2 N 7 III 4 N R 5 H R R NO2 7 4 R R 5 2 41251 Boc R VI R 4 3 N R 7 2 O R N 5 R H VIII R R H 4 N 7 R R 2 R O R 8 N R Boc 4 3 N 7 R 2 R O 5 (CH2) R 3 R 8 N 5 R (CH2) m m 6 R X 6 R IX R R H 4 3 R N 7 2 R N R 5 R 8 (CH2) m R 6 IB Схема 3 O 2 N R 5 XI CO CH3 O 4 R 4 2 H2N R5 R XIV 4 R H NBoc 4 R C NH2 O 2 R 5 R Cbz XVII H N 4 R 2 5 Cbz XVIII R 7 N 7 R R R N 3 4 R Y H 3 N R Y 7 R N 5 H ID Схема 4 2 R R 7 R N 2 5 R Cbz XX 2 5 R Cbz XIX R N2 H Y Y N 4 R R7 Y Cl C 3O C H O 2 2 R R R7 N 5 R R H Cbz XV XVI Y 7 C C3 OO H 5 4 R XIII Y R R 5 TBO MS N 7 R 7 R Y Cl 2 N R R Y R 2 N TBO MS R5 XII H R 4 R O O R R 41251 R R 7 COOC2H5 4 R N 2 C6H5 XXI R R 4 COOC2H5 7 R N 2 H Схема 3 R R H 4 N 7 N R R 3 2 H ID Схема 1 показывает получение соединений формул 1А, 1В и 1С. Формула 1А представляет соединения формулы 1,в которой каждый из R1 и R6 является водородом, m является 0, а n является 3, при условии, что R2 не является бензгидрилом, и ни R4, ни R7 не присоединяются к положению "6" пиперидинового цикла. Формула 1В представляет соединения формулы 1, в которой R1 является водородом, а n является 3, при условии, что R2 не является бензгидрилом и ни R4, ни R7 не присоединяются в положение "6" пиперидинового цикла. Формула 1С представляет соединения формулы 1, в которой ни R4, ни R7 не присоединяются к положению "6" пиперидинового цикла. Ссылаясь на схему 1, соединение формулы II подвергается реакции с соединением формулы R5-CO-R2 в присутствии ацетата аммония, в полярном растворителе, таком как этанол, уксусная кислота или диметилсульфоксид. Этанол является предпочтительным растворителем. Температуры примерно от комнатной температуры до примерно 150°С являются пригодными, причем температура кипения растворителя с обратным холодильником является предпочтительной. Эта реакция дает, по реакции межмолекулярной конденсации, соединение формулы III (Vol. M. Mahl-stadt and В. Schulze. J. Prakt. Chem. 317, 919 (1975)). Продукт реакции конденсации формулы III превращается затем, по реакции Нефа, в оксим формулы IV. Эта реакция может быть проведена, используя реагенты, такие как водный хлористый Ti(III), перманганат калия, пиридин-гексаметилфо-сфороамидный комплекс пятиокиси молибдена, трибутилфосфин-дифенил-дисульфид или озон в присутствии основания. Подходящие температуры варьируют в пределах примерно от -100°С до около 0°С. Предпочтительно, реакция осуществляется пробулькиванием озона через реакционную смесь в присутствии трет-бутоксида калия примерно при -78°С, а затем гашением реакционной смеси солянокислым гидроксиламином при температуре окружающей среды. Оксим формулы IV восстанавливают затем, чтобы получить как цис-, так и транс-изомеры соединения формулы V. Подходящие восстанавливающие агенты включают никель Ренея/водород, 10% палладия на угле - водород, и амальгаму алюминия. Предпочтительно, восстановление проводится с использованием никеля Ренея в этаноле под давлением водорода (газа) примерно 3 атм и при температуре примерно 25°С. Температуры примерно от 10°С до около 60°С и давления примерно от 1 до около 10 атмосфер также являются подходящими. Восстановительное аминирование смеси цис- и транс-изомеров соединения формулы V из вышеуказанной стадии с помощью цианоборгидрида натрия или триацетоксиборгидрида натрия вместе с соединением формулы R3CHO дает смесь цис- и транс-изомеров соединения формулы VI. Эта реакция обычно проводится в полярном растворителе, таком как уксусная кислота или низший алкиловый спирт, при температуре примерно от 0°С до около 50°С. Метанол является предпочтительным растворителем и примерно 25°С является предпочтительной температурой. Предпочитается также, чтобы рН реакционной смеси составлял примерно от 4 до около 5, Цис- и транс-изомеры соединения формулы VI, образуемые таким образом, могут быть легко разделены путем использования флэш-хроматографии на силикагеле, элюируя с помощью 3%-ного метанола в хлористом метилене. 41251 Восстановление либо цис-, либо транс-изомера соединения формулы VI, или смеси их, дает соединение формулы 1А, имеющее ту же самую стереохимию. Подходящие восстанавливающие агенты включают боран-диметилсульфид-ный комплекс с тетрагидрофуране ("ТГФ"), литийалюминийгидрид, боран в ТГФ и боргидрид натрия -хлористый титан(IV). Лучшие результаты получаются при использовании боран-диметил-сульфидного комплекса в ТГФ. Реакция может быть проведена при температуре примерно от комнатной температуры до около 150°С, и предпочтительно проводится при температуре кипения растворителя с обратным холодильником. Соединение формулы 1А, образующееся таким образом, может быть превращено в соединение формулы 1В, имеющее ту же самую стереохимию, как это показывается в схеме 1, путем вза-имодействия его с соединением формулы R6-(CH2)m-X, в которой Х является галогеном, в которой одна из углеродуглеродных простых связей указанного (CH2)m необязательно может быть заменена на углерод-углеродную двойную связь, и в которой один из углеродов указанного (CH2)m необязательно может быть замещен радикалом R8. Эта реакция обычно проводится в присутствии основания, такого как триэтиламин или третбутилат калия, и полярном растворителе, таком как хлористый метилен или дихлорэтан, и при температуре примерно от комнатной температуры до около 150°С. Предпочтительно, реакция проводится при температуре кипения с обратным холодильником в хлористом метилене в присутствии триэтиламина. Соединения формулы 1С могут быть получены так, как это показано в схеме 1 и описано ниже. Соединение формулы VI подвергается реакции с соединением формулы R1X, в которой Х является галогеном, чтобы получить соединение формулы VII, имеющее ту же самую стереохимию (например, цис-, транс-или их смесь). Эта реакция обычно проводится в присутствии основания, такого как триэтиламин или трет-бутилат калия в полярном растворителе, таком как хлористый метилен или дихлорэтан, при температуре примерно от комнатной температуры до около 150°С. Предпочтительно, реакция проводится примерно при температуре кипения с обратным холодильником в хлористом метилене в присутствии триэтиламина. Восстановление соединения формулы VII, образующегося таким образом, дает соединение формулы 1С, имеющее ту же самую стереохимию. Примерами подходящих восстанавливающих агентов являются линийалюминийгидрид, боран-диметилсульфидный комплекс в ТГФ, боран в ТГФ и боргидрид натрия хлористый титан (IV). Лучшие результаты получаются при использовании боран-диметилсульфидного комплекса в ТГФ. Реакция может быть проведена при температурах примерно от комнатной температуры до около 150°С, и предпочтительно проводится при температуре кипения растворителя с обратным холодильником. Схема 2 показывает альтернативный метод получения соединений формулы 1В. Исходным соединением для этого метода является соединение формулы VI, которое показывается в схеме 1. В первой стадии этого метода, основный азот исходного соединения защищается группой, такой как третбутоксикарбонил (Вос), трифторацетил, карбобензилокси или карбоэтокси, путем взаимодействия его, соответственно, с ди-трет-бутил дикарбонатом, ангидридом трифторуксусной кислоты, бензиловым эфиром хлормуравьиной кислоты или этиловым эфиром хлор-муравьиной кислоты. Предпочтительная защитная группа, трет-бутокси-карбонил, показывается в схеме 2. Реакция исходного соединения с ди-трет-бутилдикарбонатом (ди-трет-бутиловым эфиром угольной кислоты) обычно проводится в полярном растворителе, таком как ТГФ, хлористый метилен или хлороформ, при температуре примерно от 0°С до около 100°С. Предпочтительным растворителем является хлористый метилен, а предпочтительной температурой является комнатная температура. Реакция в большинстве случаев проводится в течение примерно от 0,5 до 72 часов. Эта реакция дает соединение формулы VIII, имеющее ту же стереохимию, что и исходное соединение. Соединение формулы VIII, образуемое таким образом, подвергается затем реакции с соединением формулы X-(CH2)m-R6, в которой Х является галогеном, или CH3SO2-O-(CH2)m -R6, чтобы образовать соединение формулы IX, имеющее ту же самую стереохимию. В каждом из X-(CH2)m-R6 и CH3SO2-O-(CH2)mR6, один из углеродов указанного радикала (СН2)m необязательно может быть замещенным радикалом R8 и одна из углерод-углеродных простых связей указанного (CH2)m необязательно может быть заменена углерод-углеродной двойной связью или углерод-углеродной тройной связью. Эта реакция в большинстве случаев проводится в присутствии основания, такого как гидроокись калия, трет-бутилат калия, диизопропиламин-литий или метилат натрия, в полярном растворителе, таком как трет-бутанол или ДМФА, в течение примерно от 0,5 до около 24 часов. Предпочтительным основанием является трет-бутилат калия, а предпочтительным растворителем является трет-бутанол. Температуры реакции в большинстве случаев варьируют от -25°С до около 150°С. Предпочтительной температурой в большинстве случаев является температура кипения растворителя с обратным холодильником. Защитная группа удаляется затем из соединения формулы IX путем взаимодействием его с кислотой, такой как хлористо-водородная кислота, трифторуксусная кислота или хлорная кислота, чтобы получить соединение формулы X, имеющее ту же самую стереохимию. Соответствующими растворителями для этой реакции являются полярные растворители, такие как хлористый метилен, диоксан, простой эфир или ТГФ, предпочтительно диоксан. Реакция обычно проводится при температуре примерно от -10°С до около 50°С, предпочтительно примерно при 25°С, в течение примерно от 0,5 до около 24 часов. Восстановление соединения формулы X, образующегося таким образом, дает соединение формулы 1В, имеющее ту же самую стереохимию. Эта реакция проводится таким же образом, что и описанная выше при обсуждении схемы 1 для получения соединений формулы 1А из соединений формулы IV, и для получения соединений формулы 1С из соединений формулы VII. 41251 Схема 3 показывает метод получения соединений формулы 1Д. Формула 1Д представляет соединения формулы 1, в которой каждый из R1 и R6 является водородом, m является 0, а n является 2, 3 или 4. Эта группа соединений включает соединения формулы 1А. Метод схемы 3 может быть использован для получения чистого 2S, 3S-энантиомера, чистого 2R, ЗR-энантиомера или рацемической смеси соединения формулы 1Д, в зависимости от того, является ли исходное соединение, соответственно, Rэнантиомером, S- энан-тиомером или рацемической смесью исходного соединения формулы XI. Кроме того, так как формула 1Д включает соединения формулы 1А, метод схемы 3 может быть использован для получения соединений формулы 1А, в которой R4 присоединяется к положению "6" азотсодержащего цикла. Метод схемы 3 может быть использован также для получения соединений формулы 1Д, в которой R2 является бензгидрилом. Ссылаясь на схему 3, соединения формулы 1Д могут быть получены следующим образом. Чистый Rэтантиомер, S-энантиомер или рацемическая смесь соединения формулы XI подвергается реакции с азотсодержащим реагентом, таким как хлористый трет-бутилдиметилсилил (ТВДМS-Сl), трифлат (трифторацетат) трет-бутилдимети-лсилила (ТВДМЗ-OTf) или бензилбромид, трет-бутоксид, предпочтительно ТВДМS-С1, чтобы получить соединение формулы ХII. Эта реакция обычно проводится в полярном растворителе, таком как ДМФА или триэтиламин, предпочтительно в триэтиламине, при температуре примерно от 0°С до около 140°С. Комнатная температура является предпочтительной. Вышеуказанная реакция осуществляется путем стереоспецифического алкилирования соединения ХII, чтобы образовать транс-стереоизомер соединения формулы ХIII. Сначала соединение формулы ХII подвергается реакции с диэтиламидом лития в полярном растворителе, таком как простой эфир или ТГФ, предпочтительно ТГФ, при температуре примерно от -100°С до около комнатной температуры, предпочтительно примерно при -78° С. Затем, соединение формулы: 4 7 R R Cl B4 Y добавляется к реакционной смеси, чтобы получить транс-изомер соединения формулы ХIII. Одновременное удаление ТВДМS группы и расщепление b-лактама, используя концентрированную серную или хлорную кислоту, предпочтительно серную кислоту, в полярном растворителе, таком как метанол или этанол, предпочтительно метаноле, дает соединение формулы ХIV. Эта реакция обычно проводится при температуре примерно от комнатной температуры до около 150°С, предпочтительно примерно при температуре кипения растворителя с обратным холодильником, в течение примерно от 0,5 до около 16 часов. Циклизация соединения формулы ХIV, чтобы получить соединение формулы ХV, выполняется нагреванием сырого продукта формулы ХIV из вышеприведенной реакции при температуре примерно от 80°С до около 140°С, предпочтительно примерно при 100°С, в течение примерно от 5 минут до около 2 дней, предпочтительно в течение примерно 15 минут, в высококипящем растворителе, таком как ДМФА или толуол, предпочтительно в ДМФА. В большинстве случаев эта реакция проводится в присутствии йодистого натрия и бикарбоната натрия. В соединении формулы ХV, получаемом по этой реакции, R2 и – COOCH3 находятся в цис-положениях относительно друг друга. Соединение формулы ХV обрабатывается затем бензиловым эфиром хлормуравьиной кислоты в полярном растворителе, таком как вода, вода/ацетон, хлороформ, дихлорэтан или этил-ацетат, в присутствии основания, такого как триэтиламин или бикарбонат натрия, чтобы получить Nкарбобензилокси-пиперидин (N-Cbz пиперидин) формулы ХVI, имеющий ту же самую стереохимию (т.е., в котором R2 и –COOCH3 находятся в цис-конфигурации). Эта реакция может быть проведена при температурах примерно от 0°С до 100°С, предпочтительно примерно при 25°С, и в течение примерно от 5 минут до 18 часов. Обработка соединения формулы ХVI, образуемого таким образом, с примерно 5-ю эквивалентами каждого триметилалюминия и хлористого аммония в неполярном растворителе, таком как бензол или толуол, в течение примерно от 0,5 до около 16 часов дает соединение формулы ХVII, имеющее ту же самую стереохимию. Температуры реакции могут варьировать в пределах примерно от комнатной температуры до около 100°С, причем примерно 50°С является предпочтительной температурой. Превращение карбоксамидной группы соединения формулы ХVII для образования соединения формулы ХVIII, имеющего ту же самую стереохимию, может быть осуществлено по реакции деградации Гофмана, используя реагенты, такие как бром/метилат натрия в метаноле, тетраацетат свинца в третбутиловом спирте, хлористое олово (IV), бис(трифторацетат) йодобензола в водном ацетонитриле, бромистый натрий или трехбромистый бензилтриметиламмоний. Предпочтительно, соединение формулы ХVII обрабатывается тетраацетатом свинца в трет-бутаноле. Эта реакция обычно проводится при температуре примерно от комнатной температуры до температуры кипения растворителя с обратным холодильником, предпочтительно при температуре кипения с обратным холодильником, в течение примерно от 15 минут до около 10 часов, предпочтительно в течение примерно от 3 до около 5 часов. Реакция соединения формулы ХVIII с кислотой, такой как хлористо-водородная кислота, трифторуксусная кислота или хлорная кислота, дает соединение формулы XIX, имеющее ту же самую стереохимию. Растворителем обычно является полярный растворитель, такой как хлористый метилен, диоксан, простой эфир или ТГФ, предпочтительно диоксан. Эта реакция обычно проводится при температуре примерно от 10°С до около 50°С, предпочтительно примерно при 25°С, в течение примерно от 0,5 до около 24 часов. Восстановительное аминирование соединения формулы XIX из вышеуказанной стадии с помощью цианоборогидрида натрия или триацетоксиборгидрида натрия вместе с соединением формулы R3CHO дает соединение формулы XX, имеющее ту же самую стереохимию. Эта реакция в большинстве случаев 41251 проводится в полярном растворителе, таком как уксусная кислота или низший алкиловый спирт, при температуре примерно от 0°С до около 50°С. Метанол является предпочтительным растворителем и примерно 25°С является предпочтительной. рН реакционной смеси предпочтительна примерно от 4 до около 5. Соединение формулы XX превращают в соединение формулы 1Д, в которой R2 и амино-группа находятся в цис-положении друг к другу, путем взаимодействия его с муравьинокислым аммонием в присутствии палладия на древесном угле (например, 10% палладия на древесном угле). Обычно, полярный растворитель, такой как этилацетат или низший алкиловый спирт, используется, а реакция проводится при температуре примерно от комнатной температуры до около 150°С в течение примерно от 0,5 до около 24 часов. Предпочтительно, реакция проводится в этаноле при комнатной температуре в течение примерно от 3 до около 24 часов. Транс-изомер соединения формулы 1Д (т.е., соединение, в котором амино-группа и R2 находятся в транс-положении относительно друг друга) может быть получен по той же методике, что и описанная выше для получения цис-изомера, со следующей модификацией. Чтобы получить транс-изомер, или соединение формулы ХV, или соединение формулы ХVI, после его образования, как это описано выше, обрабатывается трет-бутоксидом калия или диалкиламидом лития. Растворителем для этой реакции является в большинстве случаев полярный растворитель, такой как ТГФ или простой эфир, а реакцию проводят в большинстве случаев при температуре примерно от -78°С до комнатной температуры, предпочтительно примерно при 0°С, в течение примерно от 5 минут до около 10 часов. Альтернативный метод получения соединений формулы 1Д, где R2 является бензгидрилом, описывается в примерах 21-26. Схема 4 показывает предпочтительный метод получения соединений формулы 1Д, в которой n является 2. Согласно этому методу, соединение формулы XXI обрабатывают газообразным водородом в присутствии металлического катализатора, такого как палладий на древесном угле, платина на древесном угле или двуокись платины, предпочтительно палладий на древесном угле, и в присутствии кислоты, такой как трифторуксусная кислота или хлористоводородная кислота, чтобы получить соединение формулы ХХII. В большинстве случаев используют полярный инертный растворитель. Предпочтительным растворителем является этанол. Эта реакция обычно проводится примерно от 1,5 атм до примерно 5 атм, предпочтительно примерно при 3,0 атм, при температуре примерно 0°С-60°С, предпочтительно примерно при 25°С. Соединение формулы ХХII, образуемое таким образом, превращают затем в соединение формулы 1Д по методике, показанной в схеме 3 и описанной выше. Энантиомерно чистые соединения формулы 1С (т.е., соединения формулы 1Д, в которой R1 является (С1-С6)-алкилом, а не водородом) могут быть получены следующим образом. Соединение формулы XX, полученное как это описано выше, алкилируется путем взаимодействия его с соединением формулы R1X, в которой Х является галогеном. Эта реакция обычно проводится в присутствии основания, такого как триэтиламин или трет-бутилат калия, в полярном растворителе, таком как хлористый метилен или дихлорэтан, и при температуре примерно от комнатной температуры до около 200°С. Предпочтительно, реакцию проводят при температуре кипения с обратным холодильником в хлористом метилене в присутствии триэтиламина. Алкилированный продукт реакции, который имеет ту же самую стереохимию, что и исходное соединение формулы XX, превращают затем в соединение формулы 1С, имеющее ту же самую стереохимию, путем взаимодействия его с муравьинокислым аммонием в присутствии палладия на древесном угле (например, 10% палладий на древесном угле). Обычно используют полярный растворитель, такой как этилацетат или низший алкиловый спирт, а реакцию проводят при температуре примерно от комнатной температуры до около 80°С в течение примерно от 3 до около 24 часов. Реакцию предпочтительно проводят в этаноле при температуре примерно от 0,5 до около 24 часов. Энантиомерно чистые соединения формулы 1В могут быть получены путем взаимодействия аналогичного соединения формулы 1Д, имеющего ту же самую стереохимию, с соединением формулы R6(CH2)m-X, в которой Х является галогеном или мезилатом (метансульфонатной группой). В каждом из соединений X-(CH2)m-R6 и СН3SО2-О-(СН2)m-R6 один из углеродов указанного (СН2)m необязательно может быть замещен радикалом R8, а одна из углерод-углеродных простых связей указанного (CH2)m необязательно может быть заменена углерод-углеродной двойной связью. Реакцию осуществляют таким же образом, что и описанная выше для превращения соединений формулы 1А в соединения формулы 1В. Соединения, имеющие формулу 1А, в которой R4, R5 и R7 каждый является водородом, a R2 является фенилом, могут быть получены, дополнительно, путем восстановительного аминирования З-амино-2фенилпиперидина, используя соответствующий альдегид формулы R3CHO, как это описано для превращения соединений формулы V в соответствующие соединения формулы VI. Исходное соединение для этой реакции, З-амино-2-фенил-пиперидин, может быть получено путем гидрогенолиза 3-(2метоксибензиламино)-2-фенил пиперидина. Реакцию гидрогенолиза обычно проводят с использованием катализатора, такого как палладий на угле или гидроокись палладия, в инертном растворителе, таком как уксусная кислота или спиртовой растворитель, при температуре примерно от 0°С до около 50°С. Она предпочтительно проводится примерно при комнатной температуре в метанол/этанольном растворителе. Предпочитается также проводить эту реакцию в присутствии неорганической кислоты, такой как хлористоводородная или серная кислота. Вышеуказанный двухстадийный способ получения соединений формулы 1А, в которой R4, R5 и R7 каждый является водородом, a R2 является фенилом, из 3-(2-метоксибензиламино)-2-фенил -пиперидина сохраняет стереохимию при положениях "2" и "3" пиперидинового цикла. Он может быть поэтому использован для получения либо чистого энантиомера, либо рацемической смеси продукта формулы 1A 41251 из, к примеру, 3-(2-метоксибензиламино)-2-фенилпиперидина, имею-щего такую же стереохимию. В общем, первая стадия указанного выше процесса может быть использована для получения либо чистого энантиомера либо рацемической смеси З-амино-2-фенилпиперидина. Альтернативный метод получения рацемического З-амино-2-фенилпиперидина состоит в восстановлении З-амино-2-фенилпиперидина. Это восстановление в большинстве случаев осуществляется с использованием либо натрия в спирте, литийоалюминий-гидрид/треххлористого алюминия, электролитического восстановления, либо водорода в присутствии металлического катализатора. Восстановление с помощью натрия проводят в большинстве случаев в кипящем спирте, предпочтительно бутаноле, при температуре примерно от 20°С до около температуры кипения растворителя с обратным холодильником, предпочтительно примерно при 120°С. Восстановление с помощью литийоалюминий-гидрид треххлористого алюминия обычно проводят в простом эфире, ТГФ или диметоксиэтане, предпочтительно в простом эфире; при температуре примерно от 25°С до около 100°С, предпочтительно примерно при комнатной температуре. Электролитическое восстановление проводит, предпочтительно, при комнат-ной температуре, но температуры примерно от 10°С до около 60°С также являются приемле-мыми. Гидрирование в присутствии металлического катализатора является предпочтительным методом восстановления. Подходящие катализаторы гидрирования включают палладий, платину, никель и родий. Предпочтительным катализатором для гидрирования является окись платины. Температуру реакции можно варьировать в пределах примерно от 10°С до около 50°С, причем примерно 25°С является предпочтительной температурой. Гидрирование в большинстве случаев проводят при давлении примерно от 1,5 до около 4 атмосфер, предпочтительно примерно при давлении 3,0 атмосфер. Соединения формулы 1А, в которой R4, R5 и R7 каждый является водородом, а R2 является фенилом, могут быть получены также по следующему методу. Согласно этому методу, 3-амино-2-фенилпиридин сначала превращают в пиридиновый аналог целевого пиперидина формулы 1А путем взаимодействия его с соответствующим соединением формулы R3CHO или R3CH2X, в которой Х является уходящей группой (например, хлором, бромом, йодом, мезилатом или тозилатом). Реакцию З-амино-2-фенилпиридина с соединением формулы R3CHO для получения пиридинового аналога пиперидина формулы 1А обычно производят в присутствии восстанавливающего агента, такого как цианоборогидрид натрия, триацетоксиборогидрид натрия, борогидрид натрия, водород и металлический катализатор, цинк и хлористоводородная кислота, или муравьиная кислота, при температуре примерно от -60°С до около 50°С. Подходящие инертные в реакции растворители для этой реакции включают низшие спирты (например, метанол, этанол и изопропанол), уксусная кислота и ТГФ. Предпочтительно, растворителем является метанол, температурой является температура примерно 25°С, а восстанавливающим агентом является циано-борогидрид натрия. Дополнительно, реакция З-амино-2-фенилпи-ридина с соединением формулы R3CHO может быть проведена в присутствии осушителя или, используя аппарат, предназначенный для удаления азеотропно образующейся воды, чтобы получить имин формулы: N N R R 3 2 который затем подвергают реакции с восстанавливающим агентом, как это описано выше, предпочтительно с триацетоксиборогидридом натрия, примерно при комнатной температуре. Получение имина в большинстве случаев проводят в инертном для реакции растворителе, таком как бензол, ксилол или толуол, предпочтительно, толуоле, при температуре примерно от 25°С до около 110°С, предпочтительно примерно при температуре кипения растворителя с обратным холодильником. Подходящие системы осушителя-растворителя включают четыреххлористый титан/хлористый метилен и молекулярные сита/ТГФ. Четыреххлористый титан/хлористый метилен является предпочтительной системой. Реакцию З-амино-2-фенилпиридина с соединением формулы R3CH2X проводят обычно в инертном для реакции растворителе, таком как хлористый метилен или ТГФ, предпочтительно в хлористом метилене, при температуре примерно от 0°С до около -60°С, предпочтительно примерно 25°С. Образуемый таким образом пиридин восстанавливают затем для образования целевого пиперидина формулы 1А по методике, описанной выше для восстановления З-амино-2-фенилпири-дина. Соединения формулы 1В могут быть получены, в дополнение к методу, показанному в схеме 1 и описанному выше, из других соединений формулы 1В модификацией R6- и R8-содержащей боковой цепи. Соответствующие модификации могут быть осуществлены с использованием методов, хорошо известных специалистам, сведущим в данной области техники. Некоторые из этих модификаций описываются в примерах 93-104. Получение других соединений формулы 1, не описанных особо в предшествующей экспериментальной части, может быть выполнено с использованием сочетаний реакций, описанных выше и которые будут очевидными специалистам, сведущим в данной области техники. В каждой из реакций, рассмотренных или показанных в вышеприведенных схемах от 1 до 4, давление не является решающим параметром, если не указано особо. Давление примерно от 0,5 атмосфер до около 5 атмосфер в большинстве случаев является приемлемым', а давление окружающей среды, т.е. примерно 1 атмосфера, является предпочтительным из-за удобства. 41251 Новые соединения формулы 1 и их фармацевтически приемлемые соли являются полезными в качестве антагонистов вещества Р, т.е. они обладают способностью противодействовать действиям вещества Р на его клеточный рецептор у млекопитающих, и поэтому они способны функционировать в качестве терапевтических средств при лечении вышеупомянутых нарушений и болезней у страдающих млекопитающих. Соединения формулы 1, которые являются основными по природе, способны образовывать широкий ряд различных солей с разнообразными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, часто желательно на практике вначале выделить соединение формулы 1 из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнее обратно в свободное основное соединение обработкой щелочным реагентом и затем перевести последнее свободное основание в фармацевтически-приемлемую соль присоединения кислоты. Соли присоединения кислот основных соединений настоящего изобретения легко получаются обработкой основного соединения, в основном, с эквивалентным количеством выбранной неорганической или органической кислоты в водной среде растворителя или в подходящем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя легко получается целевая твердая соль. Соединения формулы 1 и их фармацевтически приемлемые соли проявляют рецептор-связывающую активность для вещества Р и поэтому являются ценными при лечении и предупреждении широкого ряда клинических состояний, лечение и предупреждение которых осуществляются с веществом Р. Такие состояния включают воспалительные заболевания (например, артрит, псориаз, астму и воспалительное кишечное заболевание), страх (тревогу), депрессивные или дистимические расстройства, колит, психоз, боль, аллергии, такие как экзема и ринит, хроническое обструктивное заболевание дыхательных путей, аллергические нарушения, такие как ядовитый плющ, вазоспастические заболевания, такие как ангина, мигрень и болезнь Рейнауда, фиброзные и коллагеновые болезни, такие как склеродермия и эозинофильный фасциолез, рефлекторно-сим-патическую дистрофию, такую как плечевой синдром, хронические расстройства, связанные со стрессом, периферическую невропатию, невралгию, невропатологические расстройства, такие как болезнь Альцгеймера, слабоумие, связанное со СПИДом, диабетическая невропатия и множественный склероз, нарушения, связанные с иммунным усилением или угнетением (супрессией), такие как системная красная волчанка, и ревматические заболевания, такие как фиброз. Следовательно, эти соединения легко приспосабливаются к терапевтическому использованию в качестве антагонистов для вещества Р при контроле и/или лечении любого из вышеуказанных клинических состояний у млекопитающих, включая людей. Соединения формулы 1 и их фармацевтически приемлемые соли могут быть введены либо перорально, либо парентерально, либо наружным путем. Вообще эти соединения наиболее желательно вводятся при дозировках, варьируемых в пределах примерно от 5,0 мг вплоть до примерно 1500 мг в день, хотя неизбежно встречаются вариации, зависящие от веса и состояния субъекта, который вылечивается, и определенного пути введения средства. Однако, наиболее желательно применяется уровень дозировки, который находится в пределах примерно от 0,07 мг до около 21 мг на кг живого веса в день. Тем не менее, могут происходить изменения, зависящие от вида животного, которое вылечивается, и его индивидуальной реакции на указанное лекарственное средство, а также от типа фармацевтического состава, выбранного при этом, и от периода времени и интервала, при котором такое введение проводится. В некоторых случаях, уровни дозировок ниже низшего предела от вышеуказанного предела могут быть более, чем достаточными, тогда как в других случаях все еще большие дозы могут быть применены, не вызывая какого-либо вредного побочного действия, при условии, что такие большие дозы сначала разделяются на несколько малых доз для введения в течение всего дня. Соединения изобретения могут быть введены индивидуально или в сочетании с фармацевтически приемлемыми носителями или разбавителями любым из трех ранее указанных путей, и такое введение может быть проведено в разовых или кратных дозах. Более конкретно, новые терапевтические средства настоящего изобретения могут быть введены в широком разнообразии различных лекарственных форм, т.е. они могут быть смешаны с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок, жестких леденцов, порошков, распыляемых растворов (аэрозолей), кремов, целебных мазей, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий, инъецируемых растворов, эликсиров, сиропов и тому подобных. Такие носители включают твердые разбавители или наполнители, стерилизованные водные среды и разнообразные нетоксичные органические растворители и т.п. Кроме того, пероральные фармацевтические композиции могут подходящим образом подслащиваться и/или ароматизироваться. Вообще, терапевтически эффективные соединения настоящего изобретения представляются в таких лекарственных формах при уровнях концентраций, варьируемых в пределах примерно от 5,0% до около 70 вес.%. Для перорального приема, таблетки, содержащие разнообразные наполнители, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикальций-фосфат и глицин, могут быть применены вместе с разнообразными дезинтеграторами (веществами, вызывающими распадаемость лекарственной формы), такими как крахмал (и предпочтительно кукурузный, или картофельный крахмал или крахмал из тапиоки), альгиновая кислота и некоторые сложные силикаты, вместе со связывающими веществами для гранулирования, подобно поливинил-пирролидону, сахарозе, желатину и акации. Дополнительно, смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк, часто являются весьма полезными для целей таблетирования. Твердые композиции подобного типа могут быть также применены в качестве наполнителей в желатиновых капсулах, предпочтительными веществами в 41251 этой связи являются также лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда водные суспензии и/или эликсиры являются желательными для перорального приема, действующий ингредиент может быть смешан с разнообразными подслащивателями или веществами, придающими вкус или аромат, красящими веществами или красителями, и, если настолько необходимо, эмульгаторами и/или суспендирующими веществами, с таким же успехом, вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и различные подобные сочетания их. Для парентерального приема могут быть применены растворы лечебного соединения настоящего изобретения либо в масле кунжута или земляного ореха, либо в водном пропиленгликоле. Водные растворители должны быть подходящим образом подвергнуты действию буфера (предпочтительно рН выше, чем 8), если это необходимо, и жидкий разбавитель сначала делается изотоническим. Эти водные растворы являются подходящими для целей внутривенного инъецирования. Масляные растворы являются подходящими для интраартикулярного (внутрисуставного), внутримышечного и подкожного инъецирований. Приготовление всех этих растворов при стерильных условиях легко осуществляется с помощью стандартных фармацевтических способов, хорошо известных специалистам, сведущим в данной области техники. Дополнительно, возможным является также нанесение соединений настоящего изобретения наружно, когда вылечиваются воспалительные состояния кожи, и это можно предпоположительно осуществить с помощью кремов, желе, гелей, паст, мазей и тому подобных, в соответствии со стандартной фармацевтической практикой. Активность соединений настоящего изобретения в качестве антагонистов вещества Р определяется по их способности ингибировать связывание вещества Р на его клеточном рецепторе в тканях бычьего хвоста, применяя радиоактивные лиганды, чтобы визуализировать тахикининовые рецепторы посредством ауторадиографии. Антагонизирующая активность вещества Р описанных здесь соединений может быть оценена с использованием стандартной методики анализа, описанной Каскиери и др. (M.A. Cascieri et al.), как это сообщено в Journal of Biological Chemistry, vol. 258, p. 5158 (1988). Этот метод включает по существу определение концентрации индивидуального соединения, требуемой для понижения на 50% количества лигандов вещества Р, меченых радиоактивными атомами, на их клеточных рецепторах в указанных выделенных коровьих тканях, тем самым предоставляя характерные величины IC50 (концентрация для ингибирования активностей на 50%) для каждого испытуемого соединения. В этой методике, ткань бычьего хвоста вынимают из холодильника при -70°С и гомогенизируют в 50-ти объемах (вес/объем) охлажденного льдом 50 мМ трис- (т.е., триметамина, который является 2-амино-2гидроксиметил-1,3-пропанди-олом)-хлор-гидратного буфера, имеющего рН 7,7. Гомогенат подвергается центрифугированию при 30.000 х G в течение 20-ти минутного периода времени. Осадок в пробирке после центрифугирования заново суспендируется при 30.000 х G в течение дополнительных 20-ти минут. Осадок в пробирке повторно суспендируется затем в 40 объемах охлажденного льдом 50 мМ трис-буфера (рН 7,7), содержащего 2 мМ хлористого кальция, в 2 мМ хлористого магния, 40 г/мл бацитрацина, 4 мкг/мл лейпептина, 2 мкг хивостатина и 200 г/мл бычьего сывороточного альбумина. Эта стадия завершает получение тканевого препарата. Методика радиолигандного связывания проводится затем следующим образом, а именно, путем инициирования реакции через добавление 100 мкл испытуемого соединения, доведением до концентрации 1 мкМ, за которым следует добавление 100 мкл радиоактивного лиганда, доведением до конечной концентрации 0,5 мМ, а затем, наконец, добавлением 800 мкл тканевого препарата, полученного как это описано выше. Конечный объем составляет таким образом, 1,0 мл, и реакционная смесь затем подвергается завихрению и инкубируется при комнатной температуре (приблизительно 20°С) в течение 20 минут. Содержимое пробирок затем фильтруется, используя сборник клеток, и стекловолоконные фильтры (Ватман GF/B) промываются четыре раза с 50 мМ Трис-буфера (рН 7,7), с фильтрами, предварительно перепропитанными в течение двух часов до процесса фильтрации. Затем определяется радиоактивность в счетчике Бета-частиц при 53%-ной эффективности отсчета, а величины IC50 вычисляются путем использования стандартных статистических методов. Ниже представлены результаты испытаний. Способность соединений связывать рецептор вещества Р Соединение примера lC50 Соединение примера lC50 Соединение примера lC50 Соединение примера lC50 1) 2) 3) 0,5 15,9* 9,3 24) 25) 26) 260* 47) 48) 49) 1000* 81* 320* 70) 71) 72) 59* 4) 17,6 27) 260* 50) 73) 190* 28) 29) 30) 31) 280* 1700* 350* 890* 51) 52) 53) 54) 285* 72* 370* 74) 75) 76) 77) 600* 36* 3,3 5) 6) 7) 8) * 15 62* 14* 16* 41251 9) 10) 11) 12) 13) 14) 15) 16) 3,3 16* 66* 86* 32) 33) 34) 35) 36) 37) 38) 39) 46* 350* 9* 31* 46* 69* 7* 100* 55) 56) 57) 58) 59) 60) 61) 62) 17) 24* 40) 13* 63) 18) 19) 20) 21) * 21 11* 1500* 41) 42) 43) 44) 46* 59* 220* 64) 65) 66) 67) 22) 2600* 45) 310* 68) 23) 92) 93) 94) 95) 210* 1,5 2,8 61 7,6 46) 109) 110) 111) 112) 555* 43 2,4 57 17 69) 126) 127) 128) 129) 310* 270* 130* 1000* 920* см. пример 1 0,2 390* Дубликат примера 27 260* 44 11 1,6 15* 78) 79) 80) 81) 82) 83) 84) 85) 190* 540* 238 241 2,2 86) 87) 88) 89) 90) 2,0 4,4 91) 2,2 143) 144) 145) 146) 1,4 8,1 Способность соединений связывать рецептор вещества Р Соединение примера lC50 Соединение примера Соединение примера lC50 Соединение примера lC50 96) 97) 113) 114) 98) 115) 99) 100) 101) 66 0,36 116) 117) 118) 100 3,5 Дубликат примера 143 31 19 30 130) 131) 18* 49* 147) 148) 79 140 132) 370 149) 140 133) 134) 135) 20 150) 151) 152) 1,1 136) 110 153) 1,2 2,0 7,2 12 4,5 137) 138) 139) 140) 141) 142) 88 0,33 0,56 1,4 1,6 154) 155) 156) 157) 158) 159) 54 150 mp изомер: 1,6* lp изомер: 10* 24 24 84 0,23 102) 0,58 119) 103) 104) 105) 106) 107) 108) 2,4 52* 2,3 2,8 5,8 120) 121) 122) 123) 124) 125) lC50 Данные представляют значение к1 (нМ). Данные со звездочкой представляют значения lC50 (нМ) по отношению (3Н)-вещества Р или [125І] BoltonHunter вещества Р . Анти-психотическая активность соединений настоящего изобретения в качестве нейролептических средств или борьбы с (регулирования) различными психотическими расстройствами определяется главным образом исследованием их способности подавлять у морских свинок гиперподвижность индуцированную веществом Р или агонистом вещества Р. Это исследование проводилось сначала введением морским свинкам контрольных соединений или соответствующих испытуемых соединений настоящего изобретения, затем инъецированием морских свинок веществом Р или агонистом вещества Р путем антрацеребрального введения через канюлю и после этого измерением их индивидуальной опорно-двигательной реакции на указанный стимул. 41251 Ниже представлены данные, показывающие противорвотную активность (2S,3S)-2,-фенил-З-(2метоксибензиламино) пиперидина, соединения формулы 1, испытанного на животной модели хорька. Противорвотная активность, определенная на модели хорька. Взрослых хорьков-самцов (фермы Маршалла, от 800 до 1200 г) не менее чем за 48 часов перед экспериментом помещали индивидуально в обстановку, контролируемую по температуре, свету и влажности. Животным давали стандартную гранулированную пищу и воду по потребности. Перед введением цис-платины животных лишали пищи на ночь. Определенными дозами давали NK' селективные антагонисты вещества Р либо перед, либо после введения цис-платины на основе ранее проведенных исследований по определению оптимального времени введения лекарства. CP) 99,9941 (3,0 или 10 мг/кг) давали в виде разовой пероральной дозы через 30 минут после введения цисплатины (10 мг/кг внутрибрюшинно). Цис-платина (II) диамминдихлорид (цис-платина) была приобретена у фирмы Сигма Кемикал Компани, Сейнт-Луис, Миссури, США. Вслед за дачей цис-платины хорьки наблюдались непрерывно в индивидуальных поликарбонатных клетках в течение не менее 120 минут. Время и количество наблюдавшихся позывов на рвоту и выбросов рвотных масс записывались для каждого животного. Позывы на рвоту количественно определялись путем подсчета ритмических сокращений живота. Выбросом рвотных масс считалось каждое оральное исторжение жидкого или твердого содержимого верхнего желудочно-кишечного тракта. Каждое животное испытывалось лишь один раз. Результаты представлены в виде диаграм. 1) СР-99,994 - это (2S, 3S)-2-фенил-З-(2-метоксибензил-амино)-пиперидин 41251 Настоящее изобретение поясняется следующими примерами. Однако, должно быть понятным, что изобретение не ограничивается конкретными деталями этих примеров. Пример 1 Цис-3-(2-метоксибензиламино)-2-фенилпипе-ридин А. 2-Oксо-5-оксимино-6-фенилпиперидин К перемешиваемому раствору транс-5-нитро-2-оксо-6-фенил-пиперидина (27,0 г, 122,6 ммолей) в 1:1 смеси хлористого метилена: метанола добавляют трет-бутилат калия (135 ммолей, 15,1 г) при 25°С. Эту реакционную смесь охлаждают до -78°С и газообразный озон пробулькивается до тех пор, пока (3 часа) ТСХ (10%-ный метанол в хлористом метилене) не будет показывать исходного вещества. Реакционную смесь продувают затем азотом, чтобы удалить избыток озона, а затем обрабатывают диметилсульфидом (60 мл) при -78ºС. После подогревания до комнатной температуры в течение 30 мин, ее обрабатывают водным раствором гидроксиламина. (85,2 г, 1,22 моля) и ацетата натрия (50,3 г, 613 ммолей) в воде (220 мл). После перемешивания, в течение 16 часов, легкотекучие вещества удаляют используя роторный испаритель. Остаток выливают в 1,2 литра холодной воды и перемешивают в течение 30 мин. Выпадающее в осадок твердое вещество фильтруют, чтобы получить 2-оксо-З-оксимино-6-фенил-пиперидин (14,0 г, 56,0%). Т.пл. 178°С. 41251 1 Н ЯМР (ДМСО-d6, 300 Мгц) d: 2,04-2,22 (2Н, мультиплет), 2,4-2,42 (1Н, мультиплет), 2,71 (1Н, дублет и триплет, J=8 и 16 Гц), 5,02 (1Н, дублет, J=4 Гц), 7,28-7,41 (5Н, мультиплет), 8,35 (1H, дублет, J=4 Гц), 10,99 (1H, синглет).ТСХ:(90:10 смесь хлористого метилена:метанола) Rf=0,54. В.Цис-5-(2-метоксибензиламино)-2-оксо-6-фе-нилпиперидин: 2-0ксо-5-оксимино-б-фенилпиперидин (28,2 г, 138 ммолей) растворяют (нагревание на паровой бане является необходимым, чтобы получить прозрачный раствор) в этаноле (500 мл), содержащем метанол (50 мл). Добавляют нейтральный никель Ренея (80 г) и смесь встряхивают на трясучке Парра в атмосфере водорода (40 psi=2,81 кг/см2). После 18 часов реакционную смесь фильтруют через диатомовую землю (Целит (торговая марка)), которую тщательно промывают метанолом. Органические растворители удаляют, используя роторный испаритель, чтобы получить масло, которое затвердевает при стоянии (26,2 г, 100%). 1 Н-ЯМР показывает, что продукт реакции является 3:1 смесью цис-5-амино-2-оксо-6-фенилпиперидина и транс-5-амино-2-оксо-6-фенилпипери-дина, соответственно. Эту смесь растворяют в метаноле (345 мл) и рН доводят до 5 с помощью насыщенного метанольного раствора хлористоводородной кислоты. К системе добавляют сита 4 Å (55 г), цианоборогидрид натрия (138 ммолей) и орто-метокси-бензальдегид (22,5 г, 165 ммолей). Перемешивание продолжают (4 часа) до тех пор, пока реакция не завершится, как это показывается с помощью ТСХ. Реакционную смесь фильтруют через диатомовую землю (Целит (торговая марка)) и фильтрат концентрируют, используя роторный выпариватель. Остаток суспендируют в воде и рН делают основным. Водную фазу экстрагируют хлористым метиленом (4 х 200 мл), промывают водой, рассолом, а затем высушивают (безводным сульфатом магния) и концентрируют, чтобы получить масло (47,0 г), которое подвергается флеш-хроматографии. Элюирование с помощью 3%-ного метанола в хлористом метилене дает белое твердое вещество (19,6 г, т.пл. 122°С). 1H-ЯMP (СДСl3) d: 1,81-1,96 (1Н, мультиплет), 2,0-2,18 (1Н, мультиплет), 2,4 (1Н, дублет и триплет, J=4,5 и 16 Гц), 2,75 (1Н, три дублета, J=6,5, 10,5 и 16 Гц), 3,48 (ЗН, синглет), 3,54 (1Н, два дублета, J=13,8 Гц), 3,76 (1Н, два дублета, J=13,8 Гц), 4,72 (1Н, дублет, J=4 Гц), 5,72 (1Н, уширенный синглет), 6,71 (1Н, дублет, J=8 Гц), 6,8 (1Н, триплет, J=6,8 Гц), 7,04 (1Н, два дублета, J=1,8 и 7,2 Гц), 7,17 (1Н, дублет и триплет,J=1,6 и 8,2 Гц), 7,2-7,44 (5Н, мультиплет). HRMS: Вычислено для С19Н22N2O2: 310, 1682. Найдено: 10, 1649. ТСХ: (90:10 смесь хлористого метилена:метанола) Rf=0,47. С. Цис-3-(2-метоксибензиламино)-2- фенилпи-перидин Боран-диметилсульфидный комплекс в тетрагидрофуране (2М, 158 мл, 315 ммолей) добавляют к раствору цис-5-(2-метоксибензиламино)-2-оксо-6-фенилпиперидина (19,6 г, 63,0 ммолей) в тетрагидрофуране (500 мл) в атмосфере азота и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 18 часов. К концу этого периода реакционную смесь охлаждают и избыток боран-диметилсульфидного комплекса осторожно разлагают добавлением по каплям метанола. Содержимое реакционной смеси концентрируют затем под вакуумом. Этанол (500 мл) и порошкообразный карбонат калия (17,5 г, 126 ммолей) добавляют к остатку и реакционную смесь нагревают при температуре кипения с обратным холодильником (18 часов). Затем реакционную смесь концентрируют под вакуумом и остаток экстрагируют хлористым метиленом (4 х 250 мл) и высушивают (безводным сульфатом магния). Органические растворители удаляют под вакуумом, чтобы получить остаток, который растворяют в минимальном количестве хлористого метилена. К этому раствору добавляют избыток раствора хлористоводородной кислоты в простом эфире, таким образом дигидрохлоридную соль цис-3-(2метоксибензиламино)-2-фенилпиперидина, которую выделяют фильтрацией. Эту соль нагревают при температуре кипния с обратным холодильником в хлороформе (400 мл) в течение 3 часов и фильтруют, чтобы получить по существу чистую хлористоводородную соль названного выше соединения (22,4 г, т.пл. 245°С, 96%), которую кристаллизуют из смеси горячего метанола-этанола, чтобы получить белое кристаллическое твердое вещество (19,2 г, 83%). Т.пл. 255°С (соль НСl). 1H-ЯМР (СДСl, свободное основание) d: 7,1-7,3 (6Н, мультиплет), 6,97 (1Н, два дублета, J=1,7 и 7,4 Гц), 6,79 (1Н, уширенный триплет, J=7,4 Гц), 6,66 (1Н, дублет, J=8,2 Гц), 3,87 (1Н, дублет, J=2,3 Гц), 3,67 (1Н, дублет, J=11,4 Гц), 3,44 (ЗН, синглет), 3,4 (1Н, дублет, J=14 Гц), 3,22-3,3 (1Н, уширенный дублет, J=2,2 Гц), 2,72-2,86 (2Н, мультиплет), 2,09-2,19 (1H, уширенный дублет, J=13,7 Гц), 1,84-2,01 (1H, дублет и триплет, J=4,0 и 13,0 Гц), 1,53-1,7 (1H, дублет и триплет, J=3,5 и 13,4 Гц), 1,33-1,45 (1H, уширенный дублет, J=12,5 Гц). 13 С-ЯМР (СДСl3, свободное основание) d: 157,6, 142,5, 129,6, 128,3, 128,2, 127,8, 126,5, 126,3, 120,0, 109,8, 64,0, 54,8, 54,7, 47,8, 46,7, 28,2, 20,4. HRMS: вычислено для C19H24N2O: 296, 1886 найдено: 296, 1904: ТСХ: (90:10 смесь хлористого метилена:метанола) Rf=0,39. Пример 2 Цис-1-аллил-З-(2-метоксибензиламино)-2-фенилпиперидин. В атмосфере азота, в круглодонной колбе, помещают 60 мг (0,2 ммоля) названного выше соединения примера 1 и 0,2 мл хлористого метилена. 41251 К этой системе добавляют 28 мкл (0,2 ммоля) триэтиламина и 17,5 мкл (0,2 ммоля) бромистого аллила, и реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь разделяют на слои между хлористым метиленом и насыщенным водным раствором бикарбоната натрия, слои разделяют, и водную фазу экстрагируют тремя порциями хлористого ме тилена. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют с помощью роторного испарителя. Сырое вещество очищают с помощью флеш-хроматографии, чтобы получить 26 мг названного выше соединения. 1 H-ЯМР (СДСl3) d: 7,20 (мультиплет, 5Н), 7,03 (триплет, 1Н, J=6 Гц), 6,79 (дублет, 1Н, J=6 Гц), 6,88 (триплет, 1H, J=6 Гц), 6,57 (дублет, 1Н, J=6 Гц), 5,78 (мультиплет, 1Н), 4,95 (мультиплет, 2Н), 3,62 (дублет, 1Н, J=12 Гц), 3,40 (синглет, ЗН), 3,32 (дублет, 1Н, J=12 Гц), 3,26 (дублет, 1Н, J=2 Гц), 3,18 (мультиплет, 1Н), 2,56 (мультиплет, 1Н), 2,36 (мультиплет, 1Н), 1,98 (мультиплет, ЗН), 1,68 (мультиплет, 1Н), 1,38 (мультиплет, 2Н). HRMS: вычислено для C22H28N2O: 336, 2202. найдено: 336, 2216. Пример 3 Цис-1-этил-З-(2-метоксибензиламино)-2-фени-лпиперидин. А. Цис-5-(N-трет-бутоксикарбонил-метоксибен-зиламино)-2-оксо-6-фенилпиперидин. В атмосфере азота в круглодонную колбу помещают 2,0 г (6,4 ммоля) цис-5-(2- метоксибензи-ла-мино)2-оксо-6-фенилпиперидина, 7 мл хлорис-того метилена и 14,1 г (64,5 молей) ди-трет-бутил-дикарбоната. Реакционную смесь перемешивают при комнатной температуре в течение 4 дней, выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют двумя порциями хлористого метилена. Объединенные органические фракции промывают водой, высушивают (сульфатом натрия) и концентрируют с помощью роторного испарителя, чтобы получить 16 г масла. Сырое вещество очищают флеш-колоночной хроматографией, чтобы получить 2,4 (91%-ный выход) цис-5-(N-трет-бутоксикарбонил-2метоксибензиламино)-2 -оксо-6-фенилпиперидина в виде белого твердого вещества. 1 H-ЯМР (СДСl3) d: 7,34 (мультиплет, ЗН), 7,14 (мультиплет, 2Н), 7,04 (мультиплет, 1Н), 6,92 (дублет, 1Н, J=7 Гц), 6,79 (триплет, 1Н, J=7 Гц), 6,62 (дублет, J=7 Гц), 5,00 и 4,86 (2 мультиплета, 1Н), 4,68 и 4,46 (2 мультиплета, 1Н), 4,00 и 3,78 (2 дублета, 1Н, J=18 Гц), 3,58 (синглет, ЗН), 2,82 (дублет, 1Н, J=18 Гц), 2,20 (мультиплет, 2Н), 1,80 (мультиплет, 1Н), 1,44 (мультиплет, 1Н), 1,53 и 1,36 (2 синглета, ЗН). В. Цис-N-этил-5-(2-метоксибензиламино)-2-оксо-6-фенил-пиперидин В атмосфере азота в круглодонную колбу помещают 50 мг (0,12 ммоля) цис-5-(N-третбутоксикарбонил-2-метоксибензил-амино)-2-оксо-6-фенилпиперидина и 0,2 мл ТГФ. К этой системе добавляют 13,5 мг (0,12 ммоля) трет-бутилата калия и 20 мкл (0,24 ммоля) йодистого этила. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов (во время этого периода времени к системе добавляют дополнительное количество трет-бутилата калия (13,5 мг) и йодистого этила (20 мкл). Смесь разделяют на слои между хлористым метиленом и водным раствором бикарбоната натрия, слои разделяют и водную фазу экстрагируют тремя порциями хлористого метилена. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют с помощью роторного испарителя. Сырое вещество очищают флеш-колоночной хроматографией, используя 3:97 смесь метанола/хлороформа в качестве элюента, чтобы получить 42 мг цис-N-этил-5-(2-метоксибензиламино)-2оксо-6-фенилпиперидина. 1 H-ЯМР (СДСl3) d: 7,36 (мультиплет, ЗН), 7,10 (мультиплет, ЗН), 6,92 (дублет, 1Н, J=6,0 Гц), 6,80 (триплет, 1Н, J=6 Гц), 6,63 (дублет, 1Н, J=6 Гц), 4,97 и 4,82 (2 мультиплета, 1Н), 4,60 и 4,40 (2 мультиплета, 1Н), 4,00 (мультиплет, 1Н), 3,80 (мультиплет, 1Н, J=18 Гц), 3,58 (синглет, ЗН), 2,80 (дублет, 1Н, J=18 Гц), 2,50 (мультиплет, ЗН), 1,80 (мультиплет, 1Н), 1,56 и 1,38 (2 синглета, 9Н), 1,06 (триплет, ЗН, J=7 Гц). Масс-спектр м/е 438 (сигнал, соответствующий недиссоциированной молекуле). С. Цис-1-этил-З-(2-метоксибензиламино)-2-ок-со-6-фенилпиперидин. В круглодонную колбу помещают 173 мг (0,39 ммоля)цис-N-этил-5-(N-трет-бутоксикарбонил-2метоксибензиламино)-2-оксо-6-фенилпипе-ридина и 0,5 мл диоксана. К этой системе добавляют 5 мл диоксана, насыщенного хлористым водородом. Реакционную смесь перемешивают при комнатной температуре в течение 2,5 часов и концентрируют с помощью роторного испарителя. Остаток разделяют на части между насыщенным водным раствором бикарбоната натрия и хлороформом и экстрагируют тремя порциями хлороформа. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 84 мг цис-1-этил-З-(2-метоксибензиламино)-2-оксо-6-фенилпиперидина, который используют немедленно без дальнейшей очистки. 1 H-ЯМР (CДСl3) d: 7,28 (мультиплет, 7Н), 6,90 (триплет, 1Н, J=6 Гц), 6,81 (дублет, 1Н, J=6 Гц), 4,68 (дублет, 1Н, J=2 Гц), 3,88 (мультиплет, ЗН), 3,74 (синглет, ЗН), 3,14 (мультиплет, 1Н), 2,56 (мультиплет, ЗН), 1,76 (мультиплет, 1Н), 1,54 (мультиплет, 1Н), 1,04 (триплет, ЗН, J=6 Гц). D. Цис-1-этил-З-(2-метоксибензиламино)-2-фенилпиперидин. В атмосфере азота в круглодонную колбу помещают 80 мг (0,24 ммоля) амина, полученного выше, и 5 мл ТГФ. К этой системе добавляют 0,59 мл (1,18 ммоля), 2,0 М боран-диметил- суль-фидного комплекса в ТГФ, и реакционную смесь нагревают в течение ночи при 60°С. Смесь охлаждают, к системе осторожно добавляют приблизительно 2 мл метанола и смесь перемешивают в течение 1 часа и концентрируют с помощью роторного испарителя. К системе добавляют 66 мг (0,48 ммоля) карбоната калия в 2 мл этанола и смесь нагревают при температуре кипения с обратным холодильником в течение 2,5 часов, охлаждают и концентрируют. Остаток разделяют на части между водой и хлористым метиленом, слои разделяют и 41251 водную фазу экстрагируют тремя порциями хлористого метилена. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 64 мг желтого масла. Это масло растворяют в хлористом метилене, а затем к раствору добавляют эфир, насыщенный хлористым водородом. Полученное твердое вещество собирают, получая 60 мг хлористоводородной соли названного выше соединения. 1 H-ЯМР (свободное основание, CДСl3) d: 7,22 (мультиплет, 5Н), 7,03 (триплет, 1Н, J=6 Гц), 6,78 (дублет, 1Н, J=6,0 Гц), 6,68 (триплет, 1Н, J=6 Гц), 6,56 (дублет, 1Н, J=6 Гц), 3,62 (дублет, 1Н, J=12 Гц), 3,39 (синглет, ЗН), 3,31 (дублет, 1Н, J=12 Гц), 3,25 (дублет, 1Н J=2 Гц), 3,16 (мультиплет, 1Н), 2,55 (мультиплет, 2Н), 1,99 (мультиплет, 2Н), 1,86 (мультиплет, 2Н), 1,40 (мультиплет, 2Н), 0,90 (триплет, ЗН, J=6 Гц). HRMS: вычислено для С21Н28N2О: 324, 2201. найдено: 324, 2193. Названные выше соединения примеров 4-14 получают по методике, подобно описанной в примере 2. Пример 4 Цис-3-(2-метоксибензиламино)-2-фенил-1-(проп-1-ил)-пиперидин. Т.пл. 223-225°С. 1 H-ЯМР (CДСl3) d: 7,28 (мультиплет, 5Н), 7,10 (триплет, 1Н, J=6 Гц), 6,87 (дублет, 1Н, J=6 Гц), 6,74 (триплет, 1Н, J=6 Гц), 6,60 (дублет,1Н,J=6 Гц), 3,86 (дублет, 1Н, J=12 Гц), 3,46 (дублет, 1Н, J=12 Гц), 3,40 (синглет, ЗН), 3/29 (мультиплет, 1Н), 2,64 (мультиплет, 1Н), 2,50 (мультиплет, 1Н), 2,02 (мультиплет, 4Н), 1,46 (мультиплет, 4Н), 0,72 (триплет, ЗН, J=7 Гц). Масс-спектр м/е 338 (сигнал, соответствующий недиссоциированной молекуле). Пример 5. Цис-1-бутил-З-(2-метоксибензиламино)-2-фе-нилпиперидин. Т.пл. 139-140°С (соль, НСl). 1 H-ЯМР (CДСl3) d: 7,20 (мультиплет, 5Н), 7,02 (триплет, 1Н, J=6 Гц), 6,77 (дублет, 1Н, J=6 Гц), 6,66 (триплет, 1Н, J=6 Гц), 6,55 (дублет, 1Н, J=6 Гц), 3,60 (дублет, J=14 Гц), 3,37 (синглет, 1Н), 3,30 (дублет, 1Н, J=14 Гц), 3,22 (дублет, 1Н, J=2 Гц), 3,16 (мультиплет, 1Н), 2,48 (мультиплет, 2Н), 1,98 (мультиплет, ЗН), 1,36 (мультиплет, ЗН), 1,08 (мультиплет, ЗН), 0,71 (триплет, ЗН, J=9 Гц). Масс-спектр м/е 352 (сигнал, соответствующий недиссоциированной молекуле). Пример 6 Цис-3-(2-метоксибензиламино)-2-фенил-1-(2-фенилэт-1-ил)-пиперидин. 1 Н-ЯМР (CДСl3) d: 7,18 (мультиплет, 10Н), 6,92 (дублет, 1Н, J=6 Гц), 6,82 (дублет, 1Н, J=6 Гц), 6.71 (триплет, 1Н, J=6 Гц), 6,00 (дублет, 1Н, J=6 Гц), 3,66 (дублет, 1Н, J=15 Гц), 3,44 (синглет, ЗН), 3,35 (мультиплет, 2Н), 2,72 (мультиплет, ЗН), 2,60 (мультиплет, 1Н), 2,12 (мультиплет, 4Н), 1,68 (мультиплет, 1Н), 1,44 (мультиплет, 2Н). HRMS: вычислено для C27H32N2O: 400, 2515. Найдено: 400, 2521. Пример 7 Цис-3-(2-метоксибензиламино)-2-фенил-1-про-паргил-пиперидин. Т.пл. 147-149°С (соль НСl, разл.). 1 H-ЯMP (CДСl3) d: 7,22 (мультиплет, 5Н), 7,02 (триплет, 1Н, J=7 Гц), 6,82 (дублет, 1Н, J=7 Гц), 6,68 (триплет, 1Н, J=7 Гц), 6,56 (дублет, 1Н, J=7 Гц), 3,62 (дублет, 1Н, J=12 Гц), 3,47 (дублет, 1Н, J=2 Гц), 3,38 (мультиплет, 4Н), 3,30 (дублет, 1Н, J=12 Гц), 3,21 (дублет, 1Н, J=2 Гц), 3,15 (дублет, 1Н, J=2 Гц), 2,94 (мультиплет, 1Н), 2,55 (мультиплет, 2Н), 2,06 (мультиплет, ЗН), 1,40 (мультиплет, 1Н). Масс-спектр м/е 334 (сигнал, соответствующий недиссоциированной молекуле). Вычислено для C22H26N2O x 2HCl x 2,75H2O:C 57,83, Н 7,39. N 6,13 Найдено: С 57,81, Н 7,58, N 5,91. Пример 8 Цис-3-(2-метоксибензиламино)-2-фенил-1-(3-фенилпроп-1-ил)пиперидин. Т.пл. 120-125°С (соль СНl, разл.). 1 H-ЯМР (CДСl3) d: 7,14 (мультиплет, 1Н), 6,80 (дублет, 1Н, J=6 Гц), 6,68 (триплет, 1Н, J=6 Гц), 6,58 (дублет, 1Н, J=8 Гц), 3,62 (дублет, 1Н, J=14 Гц), 3,40 (синглет, ЗН), 3,32 (дублет, 1Н, J=14-Гц), 3,26 (дублет, 1Н, J=2 Гц), 3,18 (мультиплет, 1Н), 2,52 (мультиплет, 2Н), 2,35 (мультиплет, 1Н), 2,00 (мультиплет, ЗН), 1,76 (мультиплет, 4Н), 1,42 (мультиплет, 2Н). Масс-спектр м/е 414 (сигнал, соответствующий недиссоциированной молекуле). Вычислено для C28H34ON2 x 2НСl x 2,75 Н2О: С 62,62, Н 7,69, N 5,22. Пример 9 Цис-1-(карбоксамидометил)-3-Р-метоксибен-зиламино)-2-фенилпиперидин. Т.пл. 235°С (соль СНl). 1 H-ЯМР (CДСl3) d: 7,20 (мультиплет, 5Н), 7,05 (триплет, 1Н, J=7 Гц), 6,82 (дублет, 1Н, J=7 Гц), 6,68 (триплет, 1Н, J=7 Гц), 6,56 (дублет, 1Н, J=7 Гц), 3,64 (дублет, 1Н, J=16 Гц), 3,39 (дублет, J=2 Гц), 3,30 (синглет, ЗН), 3,29 (дублет, 1Н, J=16 Гц), 3,20 (дублет, 1Н, J=18 Гц), 3,06 (мультиплет, 1Н), 2,57 (мультиплет, 1Н), 2,36 (дублет, 1Н, J=18 Гц), 2,06 (мультиплет, ЗН), 1,41 (мультиплет, 2Н), Масс-спектр м/е 353 (сигнал, соответствующий недиссоциированной молекуле). Пример 10 Цис-1-карбоксиметил-З-(2-метоксибензилами-но)-2-фенил-пиперидин. Т.пл. 58°С (соль НСl, очень гигроскопична). 41251 1 H-ЯМР (СД3ОД) d: 1 7,72 (мультиплет, 2Н), 7,62 (мультиплет, ЗН), 7,36 (триплет, 1Н, J=7 Гц), 7,28 (дублет, 1Н, J=7 Гц), 6,96 (мультиплет, 2Н), 5,14 (мультиплет, 1Н), 4,18 (мультиплет, 2Н), 4,00 (мультиплет, 1Н), 3,66 (мультиплет, ЗН), 3,40 (мультиплет, 1Н), 2,34 (мультиплет, 5Н), 2,07 (мультиплет, 1Н). Массспектр м/е (сигнал, соответствующий недиссоциированной молекуле). Пример 11 Цис-3-(2-метоксибензиламино)-2-фенил-1-(5-фенилпант-1-ил)-пиперидин. Т.пл. 109°С (соль, НСl, разл.). 1 H-ЯМР (CДСl3) d: 7,14 (мультиплет, 11Н), 6,78 (дублет, 1Н, J=6 Гц), 6,68 (триплет, 1Н, J=6 Гц), 6,56(дублет, 1Н, J=6 Гц), 3,62(дублет, 1Н,J=14 Гц), 3,40 (синглет, ЗН), 3,32 (дублет, 1Н, J=14 Гц), *2,50 (мультиплет, 4Н), 2,00 (мультиплет, 4Н), 1,76 (мультиплет, 1Н), *3,24 (дублет, 1Н, J=2 Гц), 3,16 (мультиплет, 1Н),* 1,42 (мультиплет, 5Н), 1,14 (мультиплет, 2Н). Масс-спектр м/е 442 (сигнал, соответствующий недиссоциированной молекуле). Пример 12 Цис-(2-метоксибензиламино)-2-фенил-1 -(4-фенил-бут-1-ил)-пиперидин. Т.пл. 65-70°С (cоль СНl). 1 H-ЯMP (CДСl3) d: 7,20 (мультиплет, 11Н), 6,84 (дублет, 1Н, J=7 Гц), 6,73 (триплет, 1H, J=7 Гц), 6,62 (дублет, 1Н, J=7 Гц), 3,68 (дублет, 1Н, J=12 Гц), 3,44 (синглет, ЗН), 3,38 (дублет, 1Н, J=12 Гц), 3,30 (дублет, 1Н, J=3 Гц), 3,18 (мультиплет, 1Н), 2,34 (мультиплет, 4Н), 2,02 (мультиплет, ЗН), 1,80 (мультиплет, 1Н), 1,47 (мультиплет, 6Н), Масс-спектр м/е 428 (сигнал, соответствующий недиссоциированной молекуле). Пример 13 Цис-3-(2-метоксибензиламино)-2-фенил-1-(3-фенил-проп-2-ен-1-ил)-пиперидин Т.пл. 54-58°С (соль, НСl, разл.). 1 H-ЯMP (CДСl3) d: 7,20 (мультиплет, 11Н), 6,84 (дублет, 1Н, J=6 Гц), 6,72 (триплет, 1Н, J=6 Гц), 6,60 (дублет, 1Н, J=6 Гц), 6,28 (мультиплет, 2Н), 3,76 (дублет, 1Н, J=12 Гц), 3,40 (мультиплет, 5Н), 3,20 (мультиплет, 1Н), 2,56 (мультиплет, 2Н), 2,04 (мультиплет, 4Н), 1,44 (мультиплет, 1Н). Масс-спектр м/е 412 (сигнал, соответствующий недиссоциированной молекуле). Пример 14 Цис-3-(2-метоксибензиламино)-1-(2-фенокси-этил-1-ил)-2-фенилпиперидин. 1 H-ЯМР (CДСl3) d: 7,26 (мультиплет, 7Н), 7,08 (триплет, 1Н, J=6 Гц), 6,80 (мультиплет, 5Н), 6,61 (дублет, 1Н, J=6 Гц), 4,04 (мультиплет, 1Н), 3,68 (дублет, 1Н, J=14 Гц), 3,42 (синглет, ЗН), 3,37(дублет, 1Н, J=14 Гц), 2,97 (мультиплет, 1Н), 2,60 (мультиплет, 1Н), 2,28 (мультиплет, 2Н), 2,06 (мультиплет, ЗН), 1,47 (мультиплет, 1Н), 1,26 (мультиплет, ЗН). Масс-спектр м/е 323 (сигнал, соответствующий недиссоциированной молекуле). Названные выше соединения примеров 15-17 получают по методике, подобно описанной в примере 3. Пример 15 Цис-3-(2-метоксибензиламино)-1-метил-2-фе-нилпиперидин. Т.пл. 58°С (соль НСl, очень гидроскопична, разл.) 1 H-ЯМР (CДСl3) d: 7,22 (мультиплет, 5Н), 7,04 (триплет, 1Н, J=6 Гц), 6,82 (дублет, 1Н, J=6,0 Гц), 6,78 (триплет, 1Н, J=6 Гц), 6,58 (дублет, 1Н, J=6 Гц), 3,62 (дублет, 1Н, J=12 Гц), 3,42 (синглет, ЗН), 3,32 (дублет, 1Н, J=12 Гц), 3,02 (мультиплет, 2Н), 2,56 (мультиплет, 1Н), 2,04 (мультиплет, ЗН), 2,02 (синглет, ЗН), 2,38 (мультиплет, 2Н). Масс-спектр м/е 310 (сигнал, соответствующий недиссоциированной молекуле). Пример 16 Цис-1-бензил-З-(2-метоксибензиламино)-2-фе-нилпиперидин. Т.пл. 68-70°С (соль НСl, разл.). 1 H-ЯМР (CДСl3) d: 7,28 (мультиплет, 11Н), 6,83 (дублет, 1Н, J=6 Гц), 6,70 (триплет, 1Н, J=6 Гц), 6,61 (дублет, 1Н, J=6 Гц), 3,85 (дублет, 1Н, J=14 Гц), 3,64 (дублет, 1Н, J=14 Гц), 3,47 (синглет, ЗН), 3,35 (мультиплет, 2Н), 2,96 мультиплет, 1Н), 2,79 (дублет, 1Н, J=14 Гц), 2,62 (мультиплет, 1Н), 1,96 (мультиплет, ЗН), 1,38 (мультиплет, 2Н). Масс-спектр м/е 386 (сигнал, соответствующий недиссоциированной молекуле). Пример 17 Цис-1-(2-гидроксиэт-1-ил)-3-(2-метоксибензи-ламино)-2-фенилпиперидин. Т.пл. 148-149°С (соль НСl, разл.) 1 H-ЯМР (CДСl3) d: 7,28 (мультиплет, 5Н), 7,12 (триплет, 1Н, J=7 Гц), 6,88 (дублет, 1Н, J=7 Гц), 6,75 (триплет, 1Н, J=7 Гц), 6,63 (дублет, 1Н, J=7Гц), 3,70 (мультиплет, ЗН), 3,44 (мультиплет, 5Н), 3,26 (мультиплет, 1Н), 2,85 (мультиплет, 1Н), 2,64 (мультиплет, 1Н), 2,06 (мультиплет, ЗН), 1,88 (мультиплет, 1Н), 1,30 (мультиплет, 2Н). Вычислено для: C21H28N2O3: 340, 2150. Найдено: 340, 2142. Вычислено для С21Н28О2N2 x 2HCl x 2,6H2O: С 54,81, Н 7,71, N 6,08. Найдено: С 54,816, Н 8,02, N 5,82. Пример 18 Цис-3-(2-метоксибензиламино)-2-фенилпирро-лидин. 1-Бензил-3-карбоэтокси-2-фенил-2,3-дидегидропирролидин, полученный по методике, описанной Селерьером и др. (Celerier et al, Tetrahedron Lett., 28, 6597 (1987)) (2,0 г, 6,5 ммолей) растворяют в 70 мл этанола. К этому раствору добавляют 1 мл концентрированного водного раствора хлористого водорода и 2,0 г 5% палладия на угле. Смесь помещают в аппарат Парра (40 psi=2,81 кг/см2 водорода) в течение 1 часа. Смесь фильтруют через диатомовую землю (Целит (торговая марка)) и фильтрат концентрируют с 41251 помощью роторного испарителя. К остатку добавляют насыщенный водный раствор бикарбоната натрия до тех пор, пока жидкость не станет основной (рН 8), и вещество экстрагируют тремя порциями хлористого метилена. Объединенные органические фракции высушивают сульфатом натрия и концентрируют (роторным испарителем), чтобы получить 1,1 г масла. Это вещество суспендируют в 10 мл 10%-ного водного раствора бикарбоната натрия и смесь охлаждают в ледяной бане. К смеси добавляют 0,65 мл (4,6 ммолей) бензилового эфира хлормуравьиной кислоты, холодная баня удаляется и смесь перемешивают в течение 30 минут. Затем добавляют эфир, слои отделяют и эфирную фазу промывают водой, высушивают (сульфатом натрия) и концентрируют с помощью роторного испарителя. Сырое вещество очищают с помощью флеш-колоночной хроматографии (80 г силикагеля), используя 1:3 смесь этилацетата/гексана в качестве элюента, чтобы получить 940 мг чистого 1-бензил-3-карбоэтокси-2-фенилпирролидина. 1 H-ЯМР (CДСl3) d: 7,16.(мультиплет,9Н),6,76 (мультиплет,1Н),5,02(мультиплет,ЗН),3,78 (мультиплет,1Н), 3,54 (мультиплет, 1H), 3,34 (мультиплет, 1Н), 2,40 (мультиплет, 1Н), 2,02 (мультиплет, 1Н), 1,94 (триплет, ЗН, J=6 Гц). Масс-спектр м/е 353 (сигнал, соответствующий недиссоциированной молекуле). Это вещество превращают в названное выше соединение по методике, подобно описанной в примере 63 E-G. 1Н-ЯМР (CДСl3) d: 7,26 (мультиплет, 5Н), 7,12 (триплет, 1Н, J=7 Гц), 6,98 (дублет, 1Н, J=7 Гц), 6,80 (триплет, 1Н, J=7 Гц), 6,70 (дублет, 1Н, J=6 Гц), 4,11 (дублет, 1Н, J=4 Гц), 3,86 (дублет, 1Н, J=12 Гц), 3,52 (синглет, ЗН), 3,42 (дублет, 1Н, J=12 Гц), 3,34 (мультиплет, 1Н), 3,25 (мультиплет, 1Н), 2,98 (мультиплет, 1Н), 1,9 (мультиплет, 2Н). Пример 19 Цис-3-(N,N-метил-2-метоксибензиламино)-2-фенилпиперидин. В атмосфере азота в круглодонную колбу помещают 75 мг (0,24 ммоля) лактама5-(2- метоксибензиламино)-2-оксо-6-фенилпиперидина,0,036мл (0,48 ммоля) йодистого метила, 0,066 мл (0,48 ммоля) триэтиламина и 0,2 мл ТГФ. Реакционную смесь перемешивают при комнатной температуре в течение 5 часов и выливают в насыщенный водный раствор бикарбоната натрия. Эту смесь экстрагируют тремя порциями хлористого метилена. Метиленхлоридные экстракты высушивают (сульфатом натpия) и концентрируют с помощью роторного испарителя. Остаток повторно подвергают воздействию вышеуказанных-условий, применяя следующие количества реагентов: 0,11 мл (1,4 ммоля) йодистого метила и 0,066 мл (0,48 ммоля) триэтиламина. Смесь перемешивают при комнатной температуре в течение 7,5 часов, и во время этого периода времени к системе добавляют дополнительное количество йодистого метила (0,11 мл).Реакционную смесь обрабатывают так, как это описано выше, чтобы получить 70 мг прозрачного бесцветного масла. Сырое вещество очищают с помощью флеш-колоночной хроматографии (7 силикагеля), используя 3:97 смесь метанола/хлороформа в качестве элюента, чтобы получить 44 мг цис-3-(N,N-метил-2-метокси-бензиламино)-2-фенилпиперидин-6-она. 1 H-ЯМР (СДСІ3) d: 1,86 (мультиплет, 5Н), 2,52 (мультиплет, 1Н), 2,70 (мультиплет, 1Н), 3,34 (мультиплет, 1Н), 3,52 (дублет, 1Н, J=14 Гц), 3,74 (дублет, 1Н, J=14 Гц), 3,84 (синглет, ЗН), 4,68 (мультиплет, 1Н), 6,90 (мультиплет, 2Н), 7,80 (мультиплет, 7Н). HRMS: Вычислено для C20H24N2O2: 324, 1838. Найдено: 324, 1884. В атмосфере азота в круглодонную колбу помещают 54 мг (0,17 ммоля) цис-3-(N,N-метил-(2-метокси)бензиламино)-2-фенилпиперидин-6-она и 2,5 мл ТГФ. К системе добавляют медленно 0,43 мл (0,86 ммоля) 2,0 М боран-диметилсульфидного комплекса в ТГФ, и реакционную смесь нагревают при 60°С в течение ночи. Реакционную смесь охлаждают до комнатной температуры, к системе медленно добавляют метанол и смесь перемешивают при комнатной температуре в течение 30 мин и концентрируют с помощью роторного испарителя. Затем добавляют 2 мл этанола и 48 мг (0,35 ммоля) карбоната калия и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 4 часов и охлаждают до комнатной температуры. Растворитель удаляют с помощью роторного испарителя. Остаток разделяют на части между хлороформом и водой, слои разделяют и водную фазу экстрагируют хлороформом. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 75 мл масла. Это масло растворяют в минимальном объеме хлористого метилена и к раствору добавляют эфир, насыщенный хлористым водородом. К системе добавляют воду и смесь промывают двумя порциями хлористого метилена. Водную фазу подщелачивают водой гидроокисью натрия и экстрагируют четырьмя порциями хлористого метилена. Эти объединенные фракции высушивают и концентрируют, чтобы получить 20 мг названного выше соединения в виде масла. 1 Н-ЯМР (CДСl3) d: 7,62 (дублет, 2Н, J=6 Гц), 7,22 (мультиплет, 1Н), 7,06 (триплет, 1Н, J=7 Гц), 6,82 (дублет, 1Н, J=6 Гц), 6,70 (мультиплет, 2Н), 4,06 (дублет, 1Н, J=2 Гц), 3,71 (синглет, ЗН), 3,62 (дублет, 1Н, J=12 Гц), 3,44 (дублет, 1Н, J=12 Гц), 3,11 (мультиплет, 1Н), 2,81 (мультиплет, 2Н), 2,19 (синглет, ЗН), 1,73 (мультиплет, 4Н), Масс-спектр м/е 310 (сигнал, соответствующий недиссоцииро-ванной молекуле). Пример 20. Цис-2,4-дифенил-З-(2-метоксибензиламино)-пиперидин. В атмосфере азота в круглодонную колбу, снабженную обратным холодильником, помещают 21,1 г (89 ммолей) этилового эфира 4-нитро-З-фенилмасляной кислоты (Mс Murray, J. E. et al. / Syn Comm., 8, 53 (1978)) и 90 мл этанола. К смеси добавляют 9,04 мл (89 ммолей) бензальдегида и 13,7 г (180 ммолей) ацетата аммония и реакционную смесь нагревают при 70°С в течение ночи. Реакционную смесь охлаждают, добавляют незначительный объем этанола и суспензию фильтруют. Собранное твердое вещество промывают малым объемом этанола, за которым следует эфир, чтобы получить 22,7 г 4,6дифенил-5-нитро-2-оксо-пиперидина. 41251 1 Н-ЯМР (ДМСО) d:2,53 (два дублета, 1Н, J=6 и 18 Гц), 2,82 (мультиплет, 1Н), 3,88 (мультиплет, 1Н), 4,80 (дублет, 1Н, J=8 Гц), 5,47 (триплет, 1Н, J=8 Гц), 7,3 (мультиплет, 10Н). Масс-спектр м/е 296 (сигнал, соответствующий недиссоциирован -ной молекуле). В круглодонную колбу помещают 15 г (50,6 ммолей) нитро-лактама 4,6-дифенил-5-нитро-2-оксопиперидина и 85 мл хлористого метилена. Добавляют трет-бутилат калия (5,72 г, 50,6 ммолей) и смесь перемешивают в течение 15 мин. К этой системе добавляют 85 мл метанола. Смесь перемешивают в течение 15 мин и систему охлаждают до -78°С. Озон пробулькивают через реакционную смесь в течение 4 часов, через смесь пробулькивают азот, добавляют 10 мл диметилсульфида и азот пробулькивают через смесь в течение ночи. К системе добавляют смесь воды и хлористого метилена и получают твердое вещество (8,8 г смеси нитро-лактама 4,6-дифенил-5-нит-ро-2-оксо-пиперидина и 2,5- диоксо-4,6 –дифенилпиперидина), которое собирают фильтрацией путем отсасывания. Фильтрат концентрируют с помощью роторного испарителя и остаток разделяют на части между слоями хлористого метилена и воды. Слои разледяют и водную фазу экстрагируют двумя порциями хлористого метилена. Объединенные органические фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 5,14 г сырого 2,5-диоксо-4,6-дифенилпипери-дина, который используют немедленно без дальнейшей очистки. В атмосфере азота в круглодон-ную колбу помещают 2,5-диоксо-4,6-дифенилпиперидин (5,14 г, 19 ммолей) и 75 мл этанола. Раствор 3,96 г (57 ммолей) соля-нокислого гидроксиламина и 7,74 г (95 ммолей) ацетата натрия в 25 мл воды добавляют и реакционную смесь перемешивают при комнатной температуре. Реакционную смесь концентрируют примерно до 1/2 от ее первоначального объема и получающийся осадок собирают фильтрацией путем отсасывания. Этот осадок (1,5 г) промывают насыщенным водным раствором бикарбоната натрия, водой и эфиром, чтобы получить 722 мг 4,6дифенил-5-оксимино-2-оксопиперидина в виде белого твердого вещества. 1 Н-ЯМР (ДМСО) d: 2,52 (мультиплет, 2Н), 2,76 (мультиплет, 1H), 4,12 (мультиплет, 1H), 5,80 (мультиплет, 1Н), 7,30 (мультиплет, 10Н), 8,24 (мультиплет,1Н). Масс-спектр м/е=280 (сигнал, соответствующий недиссоциированной молекуле). К раствору 4,6-дифенил-5-оксимино-2-оксо-пиперидина (700 мг, 2,5 ммоля) добавляют приблизительно 2 г влажного никеля Ренея, который промыт водой (до тех пор, пока промывные воды не будут иметь нейтральную рН), за которым следует этанол, и смесь помещают в атмосферу водорода (40 psi=2,81 кг/см2, в аппарате Парра) на ночь. Смесь фильтруют через заполненный слой диатомовой земли (Целит (торговая марка)) и отжатый осадок на фильтре промывают хорошо с помощью этанола. Фильтрат концентрируют, чтобы получить 500 мг 5-амино-4,6-дифенил-2-оксо-пиперидина в виде пенообразного вещества. 1 Н-ЯМР (CДСl3) d: 2,96 (мультиплет, 4Н), 4,12 и 4,5 (мультиплет, 1H), 7,2 (мультиплет, 10Н), Массспектр: м/е 266 (сигнал, соответствующий недиссоциированной молекуле). В атмосфере азота в круглодонную колбу помещают 500 мг (1,9 ммоля) 5-амино-4,6-дифенил-2-оксопиперидина и 5 мл метанола. К системе добавляют 1 г молекулярных сит 3 Å и рН смеси доводят до 4,5, используя метанол, насыщенный хлористым водородом. К этой системе добавляют 284 мг (2,1 ммоля) 2метоксибензальдегида и смесь перемешивают при комнатной температуре в течение ночи. Смесь фильтруют через диатомовую землю (Целит (торговая марка)), отжатый на фильтре осадок тщательно промывают метанолом и фильтрат концентрируют с помощью роторного испарителя. Остаток разделяют на части между слоями насыщенного водного раствора бикарбоната натрия и хлороформа, слои разделяют и водную фазу экстрагируют тремя порциями хлороформа. Объединенные хлороформные экстракты высушивают (сульфатом натрия) и концентрируют и остаток подвергают флеш-колоночной хроматографии (30 г силикагеля), используя 3:97 смеси метанол /хлороформ в качестве элюента, чтобы получить 115 мг 4,6-дифенил-5-(2-метокси-бензиламино)-2-оксо-пиперидина. 1 Н-ЯМР (CДСl3) d: 2,36 (два дублета, 1Н, J=6 и 18 Гц), 2,99 (мультиплет, 2Н), 3,30 (мультиплет, 1Н), 3,35 (синглет, ЗН), 3,62 (дублет, 1Н, J=16 Гц), 3,74 (дублет, 1Н, J=16 Гц), 4,22 (мультиплет, 1Н), 6,62 (дублет, 1Н, J=6 Гц), 6,80 (триплет, 1Н, J=6 Гц), 6,96 (мультиплет, ЗН), 7,18 (мультиплет, 10Н). Масс-спектр: м/е 386 (сигнал, соответствующий недиссоциированной молекуле). В атмосфере азота в круглодонную колбу помещают 115 мг (0,3 ммоля) амина 4,6-дифенил-5-(2метоксибензиламино)-2-оксо-пиперидина и 5 мл ТГФ. К системе добавляют 0,74 мл (1,5 ммоля), 2,0 М боран/ метилсульфидного комплекса в ТГФ, и реакционную смесь нагревают при 60°С в течение ночи. Смесь охлаждают до комнатной температуры и к системе осторожно добавляют метанол. Смесь перемешивают в течение 2 часов и концентрируют с помощью роторного испарителя. К этой системе добавляют 83 мг (0,6 ммоля) карбоната калия и приблизительно 3 мл этанола, и смесь нагревают при 85°С в течение 3 часов. Смесь охлаждают до комнатной температуры, концентрируют, разделяют на части по слоям между хлористым метиленом и насыщенным водным раствором бикарбоната натрия и экстрагируют тремя порциями хлористого метилена. Объединенные метиленхлоридные фракции высушивают (сульфатом натрия) и концентрируют, чтобы получить 109 мг масла. Это сырое вещество подвергают флеш-хроматографии на колонке (5 мг силикагеля), используя 1:19 смесь метанол/хлороформ в качестве элюента, чтобы получить 56 мг названного выше соединения. Гидрохлоридная соль этого вещества получается обработкой мети-ленхлоридного раствора продукта реакции эфиром, насыщенным хлористым водородом, концентрированием, растиранием в порошок с помощью эфира, царапанием в эфире и повторением концентрирования из эфира. Т.пл. 176-178°С (соль НСl, разл.). 41251 1 H-ЯМР (CДСl3) d: 7,18 (мультиплет, 11Н), 6,92 (дублет, 1Н, J=6 Гц), 6,76 (триплет, 1Н, J=6 Гц), 6,61 (дублет, 1Н, J=6 Гц), 4,01 (дублет, 1Н, J=2 Гц), 3,66 (дублет, 1Н, J=12 Гц), 3,53 (дублет, 1Н, J=12 Гц), 3,38 (синглет, ЗН). 3,30 (мультиплет, 1Н), 3,12 (мультиплет, ЗН), 2,12 (мультиплет, 2Н). Вычислено для С25Н28N2O: 372, 2202. Найдено: 372, 2193. Соединения примеров 21-26 имеют следующую общую формулу X ( )n Ph N Ph H и получаются по следующей методике А. Метиловый эфир 4-гидрокси-5-нитро-6,6-дифенил-гексановой кислоты. Раствор 2,2-дифенил-нитроэтан (42,6 г, 187 ммолей) и трет-бутилата калия (3,15 г, 28 ммолей) перемешивают в смеси тетрагидрофурана и трет-бутанола (1,5:1 смесь, 320 мл) при -78°С и добавляют метиловый эфир 3-формил-пропионовой кислоты (24,0 г, 206 ммолей). Затем реакционную смесь оставляют подогреваться до 10°С в течение 1 часа, после которого ее гасят уксусной кислотой (1,8 мл). Смесь концентрируют под вакуумом, разбавляют буфером рН 7 (400 мл) и экстрагируют хлористым метиленом (3 х 400 мл). Объединенные экстракты высушивают (сульфатом магния), фильтруют и концентрируют, чтобы получить оранжевое масло, которое при растирании в порошок с помощью эфира дает метиловый эфир 4-гидрокси-5-нитро-6,6-дифенил-гексановой кислоты (29,94 г). Фильтрат концентрируют и подвергают флеш-хроматографии. Элюирование с помощью 10%-ного этилацетата в гексане дает дополнительно 20,66 г метилового эфира 4-гидрокси-5-нитро-6,6-дифенил-гексановой кислоты. Общий выход (79%). 1 H-ЯМР (CДСl3) d: 7,2-7,4 (10Н, мультиплет), 5,3 (1Н, два дублета, J=2,5 и 12 Гц), 4,9 (1Н, дублет, J=12 Гц), 3,6 (ЗН, синглет), 2,6 (1Н, мультиплет), 2,45 (2Н, триплет, J=7 Гц), 1,7-2,0 (1Н, мультиплет), 1,6-1,7 (1Н, мультиплет). В. 2-Oксо-5-гидрокси-6-бензгидрилпиперидин. К перемешиваемому раствору метилового эфира 4-гидрокси -5-нитро-6,6- дифенил-гексано-вой кислоты (50,5 г, 147 ммолей) в этаноле (200 мл) при 25°С добавляют нейтрализованный никель Ренея (50 г). Реакционную смесь встряхивают на трясучке Парра под давлением водорода (30 psi=2,11 кг/см2). После 18 часов реакционную смесь фильтруют через диатомовую землю (Целит (торговая марка)), которая тщательно промывается этанолом (400 мл) и хлористым метиленом (600 мл). Органические фазы объединяют и концентрируют под вакуумом до желтого масла (40,25 г), которое при растирании в порошок с помощью холодного эфира дает 2-оксо-5-гидрокси-6-бензгидрил-пиперидин (18,5 г, т.пл. 208°С, 45%). Выпаривание меточника дает маслянистый остаток при обработке трет-бутилатом калия в тетрагидрофуране при комнатной температуре в течение 6 часов. Экстракты с помощью хлористого метилена и растирание в порошок с помощью эфира дает дополнительно 2,55 г 2-оксо-5-гидрокси-6бензгидрил-пиперидина (общий выход 51%). ИК (чистый, макс 3380 и 1640 см-1). 1 Н-ЯМР (CДСl3) d: 7,17-7,4 (10Н, мультиплет), 5,49 (1Н, уширенный синглет), 4,18 (2Н, синглет), 3,86 (1Н, уширенный синглет), 2,54-2,7 (1Н, мультиплет), 2,3-2,42 (1Н, мультиплет), 1,8-2,08 (2Н, мультиплет). вычислено для C18H20N2O: 282, 1495. найдено: 282, 1495. С. 2,5-Диоксо-6-бензгидрилпиперидин. К перемешиваемому раствору 2-оксо-5-гидро-кси-6-бензгидрилпиперидин (18,15 г, 64,5 ммолей) в ацетоне (150 мл) при -5°С добавляют реагент Джонса (2,67 М, 94 ммолей), и реакционную смесь дополнительно перемешивают в течение 4 часов. К концу этого периода времени избыток реагента разлагают 2-пропанолом и раствор концентрируют под вакуумом до половины его объема. Содержимое колбы разбавляют затем водой (1000 мл) и экстрагируют хлористым метиленом (3 х 1000 мл). Объединенные органические фазы высушивают (безводным сульфатом магния) и хлористый метилен удаляют под вакуумом, чтобы получить 2,5-диоксо-6бензгидрилпиперидин(15,35 г, 85%). 1 Н-ЯМР (CДСl3) d: 7,18-7,4 (10Н, мультиплет), 4,8 (1Н, дублет, J=4 Гц), 4,7 (1Н, 2 дублета, J=4 и 1,6 Гц), 2,38-2,6 (2Н, мультиплет), 2,16-2,3 (2Н, мультиплет), 1,9-2,01 (1Н, мультиплет). D. 2-Оксо-5-оксимино-6-бензгидрилпиперидин. К перемешиваемому раствору 2,5-диоксо-6-бензгидрилпиперидина (15,35 г, 55 ммолей) в пиридине (150 мл) добавляют солянокислый гидроксиламин (10,63 г, 165 ммолей) и реакционную смесь перемешивают в течение 15 мин. Реакционную смесь концентрируют под вакуумом и содержимое выливают в 1 NHCl (250 мл). Водную фазу экстрагируют хлористым метиленом (2 х 300 мл) и высушивают (безводным сульфатом магния). Хлористый метилен удаляют под вакуумом, чтобы получить 2-оксо-5оксимино-6-бензгид-рилпиперидин (10,62 г, 65%). 41251 1 Н-ЯМР (CДСl3) d: 7,18-7,4 (10Н, мультиплет), 5,96 (1Н, уширенный дублет), 5,59 (1Н, уширенный синглет), 4,8 (1Н, мультиплет), 3,8 (1Н, дублет, J=10 Гц), 2,98-3,09 (1Н, мультиплет), 2,05-2,42 (ЗН, мультиплет). Названные соединения примеров 21-26 получают из названного выше соединения "1" по методике, подобно описанной в примерах 1(В) и 1(С). Пример 21 Цис-З-бензиламино-2-бенгидрилпиперидин (Х=Н, n=1) Т.пл. 117°С. 1 H-ЯМР (CДСl3) d: 7,0-7,4 (15Н, мультиплет), 4,39 (1Н, дублет, J=10 Гц), 3,76 (1Н, дублет, J=12 Гц), 3,4 (1Н, дублет, J=12 Гц), 3,28 (1Н, дублет, J=10 Гц), 2,94 (1Н, мультиплет), 2,54 (1Н, мультиплет), 2,0 (2H, мультиплет), 1,7 (1Н мультиплет), 1,22 (1Н мультиплет). HRMS: Вычислено для С25Н28N2: 356, 2253. Найдено: 356, 2256. Пример 22 Транс-З-бензиламино-2-бензгидрилпиперидин (Х=Н, n =1) Т.пл. 186°С (соль НСl). 1 H-ЯМР (CДСl3) d: 7,1-7,6 (15Н, мультиплет), 4,57 (1Н, дублет,J=10 Гц),3,82(1Н,дублет,J=14 Гц), 3,65 (1Н, дублет, J=14 Гц), 3,46 (1Н, уширенный триплет), 2,9 (1Н, мультиплет), 2,5 (ЗН, мультиплет), 2,05 (1Н, мультиплет), 1,72 (1Н, мультиплет), 1,45 (1Н, мультиплет). HRMS: Вычислено для C25H28N2: 356, 2253. Найдено: 356, 2269. Пример 23 Цис-3-(2-метоксибензиламино)-2-бензгидрил-пиперидин (Х=2-ОМе, n=1). Т.пл. 258°С (разл. соль НСl). 1 H-ЯМР (CДСl3) d: 6,7-7,4 (14Н, мультиплет), 4,4 (1Н, дублет, J=10 Гц), 3,8 (ЗН, синглет), 3,75 (2Н, два дублета, J=12 Гц), 3,45 (1Н, уширенный дублет), 3,39 (1Н, дублет, J=10 Гц), 3,0 (1Н, уширенный дублет), 2,62 (2Н, мультиплет), 2,08 (1Н, мультиплет), 1,7 (1Н, мультиплет), 1,4 (1Н, мультиплет), 1,2 (1Н, мультиплет). HRMS: Вычислено для C26H30N2O: 386, 2358. Найдено 386, 2358. Пример 24 Транс-3-(2-метоксибензиламино)-2-бензгид-рилпиперидин (Х=2-ОМе, n=1) Масло, 1H-ЯМР (CДСl3) d: 6,7-7,4 (14Н, мультиплет), 4,55 (1Н, дублет, J=10 Гц), 3,8 (ЗН, синглет), 3,81 (1Н, дублет, J=14 Гц), 3,6 (1Н, дублет, J=14 Гц), 3,4 (1Н, мультиплет), 2,9 (1Н, мультиплет), 2,54 (2Н, мультиплет), 2,0 (2Н, мультиплет), 1,53 (1Н, мультиплет), 1,45 (1Н, мультиплет). HRMS: Вычислено для C26H30N2O: 386, 2358 Найдено: 386, 2318. Пример 25 Цис-З-бензиламино-2-бензгидрилазепин (Х=Н, n=2) Т.пл. 111-112°С. 1H-ЯМР (CДСl3) d: 6,94-7,45 (15Н, мультиплет), 4,33 (1Н, дублет, J=10 Гц), 3,52 (1Н, дублет, J=12 Гц), 3,34 (1H, дублет, J=12 Гц), 3,21 (1H, два дублета, J=2,1 и 10 Гц), 3,16 (1H, уширенный дублет), 2,4-2,58 (2Н, мультиплет), 1,8 (1H, мультиплет), 1,56 (ЗН, мультиплет), 1,32 (2Н, мультиплет). Пример 26 Транс-З-бензиламино-2-бензгидрилазепин (Х=Н, n=2). Т.пл. 186-187°С (соль HCl). 1H-ЯМР (CДСl3) d: 7,0-7,5 (15Н, мультиплет), 3,88 (1H, дублет, J=11 Гц), 3,45-3,6 (2Н, мультиплет), 3,22 (1H, дублет, J=12 Гц), 3,0 (1H, дублет, J=12 Гц), 2,45-2,62 (2Н, мультиплет), 1,75 (1H, мультиплет), 1,5 (2Н, мультиплет), 1,08-1,25 (ЗН, мультиплет). HRMS: Вычислено для C26H31N2: 371, 2487. Найдено: 371, 2495. Названные соединения примеров 27-33 имеют следующую общую формулу и получают по методике, подобно описанной в примере 1. H N N R Ph H Пример 27 Цис-З-бензиламино-2-фенилпиперидин (R=Н). Т.пл. 250°С (соль НСl). 1H-ЯМР (CДСl3) d: 6,94-7,0 (10Н, мультиплет), 3,89 (1Н, дублет, J=2,3 Гц), 3,52 (1Н, дублет, J=13 Гц), 3,32 (1Н, дублет, J=13 Гц), 3,25 (1Н, уширенный дублет, J=12 Гц), 2,88 (1Н, дублет, J=2,5 Гц), 2,78 (1Н, дублет и триплет, J=12 и 3 Гц), 2,4 (1Н, дублет, J=12 Гц), 1,8-1,98 (1Н, мультиплет), 1,6 (1Н, 2 триплет, J=12 и 2,5 Гц), 1,42 (1Н, дублет, J=12 Гц). Пример 28 Цис-3- (2-фторбензиламино)-2- фенилпипери-дин (R=2F). 41251 Т.пл. > 260°С (разл., соль HCl). 1H-ЯМР (СДСl) d: 7,31-7,2 (5Н, мультиплет), 7,15-7,07 (1Н, мультиплет), 6,97-6,85 (ЗН, мультиплет), 3,88 (1Н, дублет, J=3 Гц), 3,64 (1Н, дублет, J=14 Гц), 3,50 (1Н, дублет, J=14 Гц), 3,36-3,2 (1Н, мультиплет), 2,87-2,73 (ЗН, мультиплет), 2,07 (1Н, уширенный дублет, J=13 Гц), 1,88 (1Н, квартет и триплет, J=13 и 4 Гц), 1,67-1,58 (1Н, мультиплет), 1,43 (1Н, уширенный дублет, J=13 Гц), 13 С-ЯМР (CДСl3) d: 162,6, 159,4, 142,6, 130, 129,8, 128,2, 128, 127, 127,8, 127,6, 126,8, 126,4, 123,73, 123,7, 115, 114,7, 64,3, 55,5, 47,8, 44,5, 44,4, 29,1, 29,4. HRMS: Вычислено для C18H21N2F: 284, 1689. Найдено 284, 1701. Пример 29 Цис-3-(2,6-дифторбензиламино)-2-фенилпипе-ридин (R=2,6-диF). Т.пл. > 260°С (разл., соль НСl). 1H-ЯМР (CДСl3) d: 7,33-7,02 (6Н, мультиплет), 6,7 (2Н, триплет, J=8 Гц), 3,86 (1Н, дублет, J=2 Гц), 3,63 (1Н, дублет, J=14 Гц), 3,52 (1Н, дублет, J=14 Гц), 3,24 (1Н, уширенный дублет, J=10 Гц), 2,83-2,74 (1Н, мультиплет), 2,09 (1Н, уширенный дублет, J=13 Гц), 1,9 (1Н, квартет и триплет, J=14 и 4 Гц), 1,63 (1Н, 2 триплета, J=14 и 4 Гц), 1,4 (1Н, уширенный дублет, J=12 Гц). 13 С-ЯМР (CДСl3) d: 142,1, 128,3, 126,7, 126, 111,1, 110,8, 110,7, 63,8, 55,2, 47,7, 38,5, 28,9, 20,4. HRMS: Вычислено для: 302, 1595. Найдено: 302, 1607. Пример 30 Цис-3-(2-метилбензиламино)-2-фенилпипери-дин (R=2-СН3) Т.пл. 254°С (разл., соль НСl), 1H-ЯМР (CДСl3) d: 7,31-7,21 (4Н, мультиплет), 7,09-6,96 (4Н, мультиплет), 3,9 (1Н, дублет, J=2 Гц), 3,54 (1Н, дублет, J=14 Гц), 3,28 (1Н, дублет, J=14 Гц), 3,22-3,14 (1Н, мультиплет, 2,91-2,87 (1Н, мультиплет), 2,79 (1Н., триплет и дублет, J=8 и 4 Гц), 2,14 (1Н, уширенный дублет, J=9 Гц), 1,98 (ЗН, синглет), 1,97-1,75 (1Н, мультиплет), 1,7-1,48 (ЗН, мультиплет), 13C-ЯMP (CДСl3) d: 142,7, 138,6, 136,4, 130, 128,4, 128,2, 126,7, 126,6, 125,5, 63,3, 56,2, 49,7, 29,3, 20,5, 18,5. HRMS: Вычислено для С19Н24N2: 280, 1939. Найдено: 280, 1952. Пример 31 Цис-3- (2- трифторметилбензиламино) -2-фе-нилпиперидин (R=2-СF3). Т.пл. 249°С (разл., соль НСl). 1H-ЯМР (CДСl3) d: 7,49 (1Н, дублет, J=8 Гц), 7,49-7,16 (8Н, мультиплет), 3,89 (1Н, дублет, J=2 Гц), 3,7 (1Н, дублет, J=15 Гц), 3,57 (1Н, дублет, J=15 Гц), 3,25 (1Н, уширенный дублет, J=12 Гц), 2,86-2,74 (2Н, мультиплет), 2,08 (1Н, уширенный дублет, J=12 Гц), 1,93-1,8 (1Н, мультиплет), 1,671,55 (2Н, мультиплет), 1,44 (уширенный дублет, J=14 Гц). 13 С-ЯМР (CДСl3) d: 142,7, 139,8, 131,95, 129,7, 128,2, 126,8, 126,5, 126,2, 125,4, 64,6, 56,2, 47,8, 47,0, 29, 20,5. HRMS: Вычислено для С19Н21N2F3: 334, 1657. Найдено: 334, 1665. Пример 32 Цис-3-(2-хлорбензиламино)-2-фенилпипери-дин (R=2-Cl). Т.пл. 256°С (разл., соль НСl). 1H-ЯМР (CДСl3) d: 7,31-6,97 (9Н, мультиплет), 3,88 (1Н, дублет, J=2 Гц), 3,63 (1Н, дублет, J=15 Гц), 3,48 (1Н, дублет, J=15 Гц), 3,25 (1Н, уширенный дублет, J=10 Гц), 2,87-2,74 (2Н, мультиплет), 2,09 (1Н, уширенный дублет, J=15 Гц), 1,9 (1Н, квартет и триплет, J=13 и 4 Гц), 1,68-1,57 (1Н, мультиплет), 1,43 (1Н, уширенный дублет, J=13 Гц). 13 C-ЯМP (CДСl3) d: 142,5, 138,1, 133,6, 129,7, 129,1, 128,3, 127,7, 126,8, 126,4, 64,3, 55,6, 48,7, 47,8, 29, 20,4. HRMS: Вычислено для C18H21N2Cl: 300, 1394. Найдено: 300, 1394. Пример 33 Цис-3- (3-трифторметилбензиламино)-2-фе-нилпиперидин (R=32СF3). Т.пл. 240°С (разл., соль НСl) 1H-ЯMP (CДСl3) d: 7,41-7,14 (9Н, мультиплет), 3,88 (1Н, дублет, J=2 Гц), 3,55 (1Н, дублет, J=14 Гц), 3,38 (1Н, дублет, J=14 Гц), 3,22 (1Н, уширенный дублет, J=14 Гц), 2,84-2,74 (2Н, мультиплет), 2,01 (1Н, уширенный дублет, J=14 Гц), 1,85 (1Н, квартет и триплет, J=12 и 4 Гц), 1,63-1,54 (1Н, мультиплет), 1,45 (1Н, уширенный дублет, J=13 Гц). 13 C-ЯМР (CДСl3) d: 142,8, 142,1, 131,1, 128,4, 128,3, 127, 126,4, 124,5, 123,3, 64,5, 55,8, 51, 47,7, 29,4, 20,4. HRMS: Вычислено для С19Н21N2F3: 334, 1657. Найдено: 334, 1663. Названные соединения примеров 34-35 имеют следующую общую формулу и получают по методике, подобной описанной в примере 1. 41251 Me H O N N H X Пример 34 Цис-3-(2-метоксибензиламино)-2-(2-фторфе-нил)-пиперидин (Х=2-F). Т.пл. 253°С (соль НСl). 1H-ЯМР (СДСl3) d: 8,03 (1Н, триплет, J=7 Гц), 7,62-7,54 (1Н, мультиплет), 7,477,35 (2Н, мультиплет), 7,27-7,19 (2Н, мультиплет), 6,94 (2Н, 2 дублета, J=9 и 2 Гц), 5,25 (1Н, дублет, J=4 Гц), 5,25 (1Н, дублет, J=13 Гц), 4,03-4,00 (1Н, мультиплет), 3,87 (1Н, дублет, J=13 Гц), 3,75 (ЗН, синглет), 3,67 (1Н, уширенный дублет, J=13 Гц), 3,42-3,37 (2Н, мультиплет), 2,6-2,42 (2Н, мультиплет), 2,38-2,3 (1Н, мультиплет), 2,08-1,96 (1Н, мультиплет). HRMS: Вычислено для C19H23N2OF: 314, 1795. Найдено: 314, 1778. Пример 35 Цис-3-(2-метоксибензиламино)-2- (2-хлорфе-нил)-пиперидин (Х=2-Cl). Т.пл. 264°С (соль НСl). 1H-ЯMР (CДСl3) d: 8,15 (1Н, дублет, J=6 Гц), 7,66-7,5 (1Н, мультиплет), 7,39 (1Н, триплет, J=8 Гц), 7,15 (1Н, дублет, J=6 Гц), 6,94 (2Н, триплет, J=8 Гц), 5,21 (1Н, дублет, J=3 Гц), 4,19-4,1 (2Н, мультиплет), 3,27 (1Н, дублет, J=12 Гц), 3,78 (ЗН, синглет), 3,76-3,64 (1Н, мультиплет), 3,52-3,4 (1Н, мультиплет), 2,64-2,44 (2Н, мультиплет), 2,38-2,26 (1Н, мультиплет), 2,16-1,96 (1Н, мультиплет). HRMS: Вычислено для С19Н23N2OCl: 330, 1499. Найдено: 330, 1412. Пример 36 Цис-3-(2-метоксибензиламино)-2-(2-метилфе-нил)пиперидин (X=2-СН3). Т.пл. 260°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,97 (1Н, уширенный дублет, J=8 Гц), 7,49-7,32 (4Н, мультиплет), 7,08 (1Н, дублет, J=6 Гц), 6,95-6-88 (2Н, мультиплет), 5,04(1Н, дублет, J=3 Гц), 4,1 (1Н, дублет, J=14 Гц), 3,88-3,8 (2Н, мультиплет), 3,68 (ЗН, синглет), 3,49-3,36 (1Н, мультиплет), 2,59-2,27 (4Н, мультиплет), 2,25 (ЗН, синглет), 2,0 (1Н, уширенный дублет, J=10 Гц). HRMS: Вычислено для С20Н26N2O: 310, 2045. Найдено: 310, 2080. Вычислено: С 62,66, Н 7,36, N 7,31. Найдено: С 62,75, Н 7,46, N 7,2. Пример 37 Цис-3-(2-метоксибензиламино)-2-(3-трифтор-метилфенил)-пиперидин (X=3-CF3). Т.пл. 268°С (соль НСl). 1H-ЯМР (CДСl3) d: 8,03-7,94 (2Н, мультиплет), 7,84 (1Н, дублет, J=8 Гц), 7,77 (1Н, триплет, J=8 Гц), 7,37 (1Н, триплет, J=8 Гц), 7,16 (1Н, дублет, J=8 Гц), 6,93 (2Н, триплет, J=7 Гц), 5,05 (1Н, дублет, J=2 Гц), 4,14 (1Н, дублет, J=13 Гц), 3,86 (1Н, дублет, J=13 Гц), 3,72 (ЗН, синглет), 3,7-3,62 (1Н, мультиплет), 3,3-3,2 (1Н, мультиплет), 2,49-2,34 (2Н, мультиплет), 2,3-2,18 (1Н, мультиплет), 2,01 (1Н, уширенный дублет, J=14 Гц). Пример 38 Цис-3-(2-метоксибензиламино)-2-(3-фторфе-нил)-пиперидин (Х=3-F). Т.пл. 264°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,62-7,5 (ЗН, мультиплет), 7,38 (1Н, триплет, J=7 Гц), 7,3-7,21 (2Н, мультиплет), 6,93 (2Н, триплет, J=8 Гц), 5,03 (1Н, дублет, J=3 Гц), 4,16 (1Н, дублет, J=15 Гц), 4,06-3,96 (1Н, мультиплет), 3,85 (1Н, дублет, J=13 Гц), 3,75 (ЗН, синглет), 3,66 (1Н, уширенный дублет, J=12 Гц), 2,742,40 (2Н, мультиплет), 2,30-2,15 (1Н, мультиплет), 2,06-1,92 (1Н, мультиплет). HRMS: Вычислено для С19Н23N2OF: 314, 1795. Найдено: 314, 1790. Пример 39 Цис-3- (2-метоксибензиламино) -2-(3-хлорфе-нил)-пиперидин (Х=3-Сl). Т.пл. 258-260°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,72 (1Н, уширенный синглет), 7,7-7,58 (1Н, мультиплет), 7,54 (2Н, дублет, J=4 Гц), 7,4 (1Н, триплет, J=8 Гц), 7,2 (1Н, дублет, J=7 Гц), 6,97-6,92 (2Н, мультиплет), 5,01 (1Н, дублет, J=4 Гц), 4,17 (1H, дублет, J=13 Гц), 3,99 (1H, уширенный синглет), 3,8 (1H, дублет, J=13 Гц), 3,75 (2Н, синглет), 3,69-3,54 (1H, мультиплет), 3,17-3,14 (1H, мультиплет), 2,49-2,4 (2Н, мультиплет), 2,32,16 (1H, мультиплет), 2,05-1,94 (1H, мультиплет). HRMS: Вычислено для С19Н23N2OCl: 330, 1499. Найдено: 330, 1508. Пример 40 Цис-3-(2-метоксибензиламино)-2-(3-метокси-фенил)-пиперидин (X=3-ОМе). Т.пл. 252°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,49-7,34 (2Н, мультиплет), 7,28-7,16 (ЗН, мультиплет), 7,07 (1H, дублет, J=6 Гц), 6,96-6,91 (2Н, мультиплет), 4,94 (1H, дублет, J=4 Гц), 4,15 (1H, дублет, J=13 Гц), 3,96 (1H, уширенный синглет), 3,86 (1H, дублет, J=13 Гц), 3,83 (ЗН, синглет), 3,69 (ЗН, синглет), 3,68-3,6 (1H, 41251 мультиплет), 3,28-3,22 (1H, мультиплет), 2,49-2,35 (2Н, мультиплет), 2,32-2,16 (1H, мультиплет), 2,06-1,94 (1H, мультиплет). HRMS: Вычислено для С20Н26N2O2: 326, 1994. Найдено: 326, 1983. Вычислено: С 60,15, Н 7,07, N 7,01. Найдено: С 59,78, Н 6,75, N 7,01. Пример 41 Цис-3-(2-метоксибензиламино)-2-(З-метил-фе-нил)-пиперидин (Х=3-СН3). Т.пл. 243°С (соль НСl). 1H-ЯMP (СДСl) d: 7,15 (2Н, два дублета, J=8,7 Гц), 7,07-6,94 (4Н, мультиплет), 6,79 (1Н, триплет, J=7 Гц), 6,67 (1Н, дублет, J=8 Гц), 3,83 (1Н, дублет, J=2 Гц), 3,68 (1Н, дублет, J=14 Гц), 3,44 (ЗН, синглет), 3,4 (1Н, дублет,=14 Гц), 3,26 (1Н, уширенный дублет, J=12 Гц), 2,85-2,73 (1Н, мультиплет), 2,3 (ЗН, синглет), 2,12 (1Н, уширенный дублет, J=14 Гц), 1,92 (1Н, квартет и триплет, J=13 и 4 Гц), 1,58 (1Н, два триплета, J=14 Гц), 1,38 (1Н, уширенный дублет, J=13 Гц). HRMS: Вычислено для С20Н26N2O: 310, 2045. Найдено: 310, 2069. Вычислено: С 62,66, Н 7,36, N 7,31. Найдено: С 62,61, Н 7,44, N 7,24. Пример 42 Цис-3-(2-метоксибензиламино)-2-(4-фенилфе-нил)-пиперидин (X=4-Ph). Т.пл. 255°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,77-7,7 (4Н, мультиплет), 7,63-7,44 (ЗН, мультиплет), 7,41 (2Н, триплет, J=2 Гц), 7,39-7,31 (2Н, мультиплет), 7,15 (1Н, два дублета, J=6 и 2 Гц), 6,92 (1Н, триплет, J=7 Гц), 6,79 (1Н, дублет, J=8 Гц), 5,03 (1Н, уширенный синглет), 4,13 (1Н, дублет, J=13 Гц), 3,87 (2Н, дублет, J=13 Гц), 3,6 (4Н, синглет), 3,34-3,3 (2Н, уширенный синглет), 2,58-2,1 (ЗН, мультиплет), 2,00-1,89 (1Н, мультиплет). HRMS: Вычислено для С25Н28N2O: 372, 2202. Найдено: 373, 2220. Пример 43 Цис-3-(2-метоксибензиламино)-2-(4-фторфе-нил)-пиперидин (X=4-F). Т.пл. 252°С (соль НСl). ИК(КВч) макс: 3280, 2600, 1605, 1520, 1240: 1020 см-1. 1 H-ЯМР (CДСl3) d: 7,25-7,12 (ЗН, мультиплет), 6,99-6,94 (ЗН, мультиплет), 6,8 (1Н, триплет, J=6 Гц), 6,68 (1Н, дублет, J=8 Гц), 3,83 (1Н, уширенный синглет), 3,67 (1Н, дублет, J=14 Гц), 3,49 (ЗН, синглет), 3,38 (1Н, дублет, J=14 Гц), 3,26-3,2 (1Н, мультиплет), 2,82-2,71 (2Н, мультиплет), 2,11 (1Н, уширенный дублет, J=13 Гц), 1,97-1,83 (1Н, мультиплет), 1,63-1,52 (1Н, мультиплет), 1,38 (1Н, уширенный дублет, J=13 Гц). 13 С-ЯМР (CДСl3) d: 157,6, 138,3, 129,6, 128,3, 127,9, 127,8, 120, 114,9, 114,6, 109,8, 63,4, 54,8, 54,6, 47,8, 46,7, 28,2, 20,3. HRMS: Вычислено для С19Н23N2OF: 314, 1795. Найдено: 314, 1802. Пример 44 Цис-3-(2-метоксибензиламино)-2-(4-метилфе-нил)-пиперидин (X=4-СН3). Т.пл. 233°С (соль НСl). ИК(КВч) макс: 3400, 2700, 1610, 1570, 1460, 1260, 1040 см-1. 1 H-ЯМР (CДСl3) d: 7,18-7,11 (5Н, мультиплет), 5,97 (1Н, два дублета, J=7 и 2 Гц), 6,79 (1Н, триплет, J=8 Гц), 6,67 (1Н, дублет, J=8 Гц), 3,84 (1Н, дублет, J=2 Гц), 3,67 (1Н, дублет, J=14 Гц), 3,45 (ЗН, синглет), 3,4 (1Н, дублет, J=14 Гц), 3,25 (1Н, уширенный дублет, J=8 Гц), 2,82-2,73 (2Н, мультиплет), 2,31 (ЗН, синглет), 2,11 (1Н, уширенный дублет, J=13 Гц), 1,91 (1Н, квартет и триплет, J=9 и 4 Гц), 1,57 (1Н, два триплета, J=14 и 4 Гц), 1,37 (1Н, уширенный дублет, J=13 Гц) 13 С-ЯМР (CДСl3) d: 157,6, 139,4, 135,9, 129,6, 128,8, 128,4, 127,7, 126,2, 120, 109,8, 63,7, 54,8, 54,7, 47,8, 46,7, 28,2, 21,0, 20,4. HRMS: Вычислено для С20Н26N2O: 310, 2045. Найдено: 310, 2043. Пример 45 Цис-3-(2-метоксибензиламино)- 2-(4-хлорфе-нил)-пиперидин (X=4-Сl). Т.пл. 247°С (соль НСl). ИК (КВч) макс: 2950, 2640,1610, 1570, 1500, 1450, 1250 см-1. 1 H-ЯМР (CДСl3) d: 7,26-7,13 (5Н, мультиплет), 6,97 (1Н, два дублета, J=7 и 2 Гц), 6,81 (1Н, триплет, J=8 Гц), 6,68 (1Н, дублет, J=8 Гц), 3,84 (1Н, дублет, J=9 Гц), 3,7 (1Н, дублет, J=14 Гц), 3,48 (ЗН, синглет), 3,37 (1Н, дублет, J=14 Гц), 3,26 (1Н, уширенный дублет, J=8 Гц), 2,83-2,72 (2Н, мультиплет), 2,12 (1Н, уширенный дублет, J=9 Гц), 1,91 (1Н, квартет и триплет, J=13 и 4 Гц), 1,58 (1Н, два триплета, J=13 и 4 Гц), 3,83 (1Н, уширенный дублет, J=13 Гц). 13 С-ЯМР (CДСl3) d: 157,6, 140,96, 132,4, 129,7, 128,2, 128, 127,7, 120, 109,9, 63,3, 54,8, 54,5, 47,7, 46,8, 28,20. HRMS: Вычислено для С19Н23N2OCl: 330, 1498. Найдено: 330, 1489. Вычислено: С 56,52, Н 6,24, N 6,94. Найдено: С 56,52, Н 6,2 N 6,86. Пример 46 Цис-3-(2-метоксибензиламино)-2-(4-метоксифенил)-пиперидин (X=4-ОМе). Т.пл. 245°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,14 (ЗН, триплет, J=8 Гц), 6,97 (1Н, два дублета, J=7 и 2 Гц), 6,84-6,77 (ЗН, мультиплет), 6,67 (1Н, дублет, J=8 Гц), 3,81 (1Н, дублет, J=2 Гц), 3,78 (1Н, синглет), 3,67 (1Н, 41251 дублет, J=14 Гц), 3,47 (ЗН, синглет), 3,4 (1Н, дублет, J=14 Гц), 3,24 (1Н, уширенный дублет, J=10 Гц), 2,812,72 (2Н, мультиплет), 2,1 (1Н, уширенный дублет, J=14 Гц), 1,9 (1Н, квартет и триплет, J=14 и 4 Гц), 1,56 (1Н, два триплета, J=14 и 4 Гц), 1,36 (1Н, уширенный дублет, J=14 Гц). 13 С-ЯМР (CДСl3) d: 158,3, 157,6, 134,6, 129,6, 128,4, 127,7, 127,3, 120, 113,5, 109,8, 63,4, 55,2, 54,8, 54,7, 47,8, 46,7, 28,2, 20,3. HRMS: Вычислено для С20Н26N2O2: 326, 1996. Найдено: 326, 1968. Вычислено: С 60,15, Н 7,07, N 7,01. Найдено: С 59,36, Н 6,79, N 6,82. Пример 47 Цис-3-(2-метоксибензиламино)-2-(4-трифтор-метилфенил)-пиперидин (Х=4-СF3). Т.пл. 250°С (разл., соль НСl). 1H-ЯМР (CДСl3) d: 7,51 (2Н, дублет, J=8 Гц), 7,33 (2Н, дублет, J=8 Гц), 7,13 (1Н, триплет, J=8 Гц), 6,98 (1Н, дублет, J=8 Гц), 6,77 (1Н, триплет, J=8 Гц), 6,63 (1Н, дублет, J=8 Гц), 3,89 (1Н, синглет), 3,67 (1Н, дублет, J=14 Гц), 3,39 (ЗН, синглет), 3,33 (1Н, дублет, J=14 Гц), 3,24 (1Н, уширенный дублет, J=12 Гц), 2,82-2,74 (2Н, мультиплет), 2,13 (1Н, уширенный дублет, J=14 Гц), 1,98-1,78 (1Н, мультиплет), 1,64-1,46 (1Н, мультиплет), 1,38 (1Н, уширенный дублет, J=14 Гц). 13 С-ЯМР (CДСl3) d: 157,4, 146,5, 129,5, 127,8, 126,5, 124,8, 124,7, 119,8, 109,7, 63,6,54,4, 54,3, 47,5, 46,6, 28,10. HRMS: Вычислено для С20Н23N2OF3: 364, 1762. Найдено: 364, 1710. Пример 48 Цис-3-(2-метоксибензиламино)-2-(4-бромфе-нил)-пиперидин (X=4-Br). Т.пл. 250°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,36 (2Н, дублет, J=8 Гц), 7,14-7,05 (ЗН, мультиплет), 6,95 (1Н, два дублета, J=8 и 2 Гц), 6,79 (1Н, триплет, J=8 Гц), 6,67 (1Н, дублет, J=8 Гц), 3,79 (1Н, дублет, J=2 Гц), 3,66 (1Н, дублет, J=14 Гц), 3,48 (ЗН, синглет), 3,34 (1Н, дублет, J=14 Гц), 3,22 (1H, уширенный дублет, J=14 Гц), 2,78-2,68 (2Н, мультиплет), 2,17 (1H, уширенный дублет, J=14 Гц), 1,96-1,78 (1H, мультиплет), 1,56 (1H, два триплета, J=14 Гц и 4 Гц), 1,38 (1H, уширенный дублет, J=14 Гц). 13 C-ЯMP (CДСl3) d: 157,6, 141,4, 131,1, 129,7, 128,1, 128, 127,9, 120,4, 120, 109,8, 63,4, 54,8, 54,4, 47,6, 46,8, 28,1, 20,2. HRMS: Вычислено для С18Н23N2OBr: 374, 0980. Найдено: 374, 0926. Вычислено: С 50,91, Н 5,62, N 6,25. Найдено: С 51,41, Н 5,48 N 6,23. Пример 49 Цис-3-(2-метоксибензиламино)-2-(4-гидрокси-метил-фенил)-пиперидин (Х=4-СН2OН). Т.пл. 248°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,2-7,04 (5Н, мультиплет), 6,95 (1H, два дублета, J=8 и 2 Гц), 6,7 (1H, триплет, J=8 Гц), 6,64 (1H, дублет, J=8 Гц), 4,6 (2Н, синглет), 3,82 (1H, дублет, J=2 Гц), 3,62 (1H, дублет, J=14 Гц), 3,43 (ЗН, синглет), 3,37 (1H, дублет, J=14 Гц), 3,24 (1H, уширенный дублет, J=8 Гц), 2,82,68 (2Н, мультиплет), 1,96-1,8 (1H, мультиплет), 1,56 (1H, два триплета, J=14 и 4 Гц), 1,36 (1H, уширенный дублет,J=8 Гц). HRMS: Вычислено для С20Н26N2O2: 326, 1994. Найдено: 326, 1979. Вычислено: С 60,15, Н 7,07, N 7,02. Найдено: С 60,04, Н 6,93, N 6,83. Пример 50 Цис-3-(2-метоксибензиламино)-2-(З-фтор-4-метоксифенил)-пиперидин (X=3-F, 4-OMe). Т.пл. 250°С (разл., соль НСl). 1H-ЯМР (CДСl3) d: 7,15 (1Н, дублет и триплет, J=8 и 2 Гц), 7,01-6,93 (ЗН, мультиплет), 6,89-6,78 (2Н, мультиплет), 6,7 (1Н, дублет, J=8 Гц), 3,87 (ЗН, синглет), 3,78 (1Н, дублет, J=2 Гц), 3,68 (1Н, дублет, J=14 Гц), 3,52 (ЗН, синглет), 3,38 (1Н, дублет, J=14 Гц), 3,22 (1Н, уширенный.дублет, J=9 Гц), 2,75 (2Н, триплет и дублет, J=13 и 3 Гц), 2,1 (1Н, уширенный дублет, J=13 Гц), 1,86 (1Н, квартет и триплет, J=13 и 4 Гц), 1,56 (1Н, два триплета, J=13 и 3 Гц), 1,35 (1Н, уширенный дублет, J=13 Гц). 13 С-ЯМР (CДСl3) d: 157,6, 135,8, 129,7, 128,2, 128, 121,8, 121,7, 120, 114,3, 114,1, 113, 109,8, 63, 56,3, 54,7, 54,5, 47,7, 46,8, 28,2, 20,3. Пример 51 Цис-3-(2-метоксибензиламино)-2-(2,3-дифтор-фенил)-пиперидин (Х=2,3-ди-F). Т.пл. 243°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,21-7,12 (2Н, мультиплет), 7,09-7,01 (1Н, мультиплет), 6,98 (1Н, два дублета, J=7,2 Гц), 6,81 (1Н, триплет, J=7 Гц), 6,69 (1Н, дублет, J=8 Гц), 4,17 (1Н, синглет), 3,61 (1Н, дублет, J=14 Гц), 3,54 (ЗН, синглет), 3,36 (1H, дублет, J=14 Гц), 3,23 (1H, дублет, J=14 Гц), 2,89 (1H, уширенный синглет), 2,79 (1H, триплет и дублет, J=12 и 3 Гц), 2,03 (1H, уширенный дублет, J=13 Гц), 1,85 (1H, квартет и триплет, J=13 и 4 Гц), 1,68-1,56 (1H, мультиплет), 1,41 (1H, уширенный дублет, J=14 Гц). 13 C-ЯMP (CДСl3) d: 157,5, 132,6, 132,4, 129,5, 128,3, 127,9, 123,6, 122,8, 120,2, 115,3, 115,1, 109,9, 58,3, 54,8, 53,2, 47,1, 28,6, 20,4. Пример 52 Цис-3-(2-метоксибензиламино)-2-(2,3-дихлор-фенил)-пиперидин (Х=2,3-ди-Сl). 41251 Т.пл. 249°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,42 (1H, дублет, J=8 Гц), 7,35 (1H, дублет, J=8 Гц), 7,19 (1H, триплет, J=8 Гц), 7,14 (1H, триплет, J=8 Гц), 6,91 (1H, дублет, J=8 Гц), 6,79 (1H, триплет, J=8 Гц), 6,68 (1H, дублет, J=8 Гц), 4,19 (1H, дублет, J=2 Гц), 3,55 (1H, дублет, J=12 Гц), 3,53 (ЗН, синглет), 3,32 (1H, дублет, J=14 Гц), 3,23 (1H, уширенный дублет, J=12 Гц), 3,03-2,98 (1H, мультиплет), 2,81 (1H, триплет и дублет, J=13 и 3 Гц), 2,01 (1H, уширенный дублет, J=13 Гц), 1,97-1,75 (1H, мультиплет), 1,7-1,62 (1H, мультиплет), 1,42 (1H, уширенный дублет, J=12 Гц). Пример 53 Цис-3-(2-метоксибензиламино)-2-(4-этилами-нофенил)-пиперидин (X=4-NEt) Т.пл. 241°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,14 (1Н, триплет, J=8 Гц), 7,08-6,94 (ЗН, мультиплет), 6,78 (1Н, триплет, J=8 Гц), 6,67-(1Н, дублет, J=8 Гц), 6,52 (2Н, дублет, J=8 Гц), 3,77 (1Н, уширенный синглет), 3,69 (1Н, дублет, J=14 Гц), 3,5 (ЗН, синглет), 3,43 (1Н, дублет, J=14 Гц), 3,33 (1Н, уширенный дублет, J=2 Гц), 3,12 (1Н, квартет, J=8 Гц), 2,84-2,68 (1Н, мультиплет), 2,09 (1Н, уширенный дублет, J=4 Гц), 1,96-1,49 (1Н, мультиплет), 1,61-1,49 (1Н, мультиплет), 1,35 (1Н, уширенный дублет, J=14 Гц), 1,25 (ЗН, триплет, J=8 Гц). Пример 54 Цис-3-(2-метоксибензиламино)-2-(З-метил-4-метоксифенил)-пиперидин (Х=3-Ме, 4-ОМе). Т.пл. 248°С (соль НСl). ИК (КВч) макс.: 3540, 2600, 1610, 1560, 1460, 1270, 1030 см-1. 1 H-ЯМР (CДСl3) d: 7,13 (1Н, триплет, J=8 Гц), 7,02 (1Н, дублет, J=8 Гц), 6,94-6,9 (2Н, мультиплет), 6,74 (1Н, триплет, J=8 Гц), 6,7 (1Н, дублет, J=8 Гц), 6,64 (1Н, дублет, J=8 Гц), 3,79 (ЗН, синглет), 3,78 (1Н, синглет), 3,67 (1Н, дублет, J=1 Гц), 3,43 (ЗН, синглет), 3,38 (1Н, дублет, J=14 Гц), 3,21 (1Н, уширенный дублет, J=14 Гц), 2,14 (ЗН, синглет), 2,11-2,07 (1Н, мультиплет), 1,93-1,74 (1Н, мультиплет), 1,59-1,53 (1Н, мультиплет), 1,38-1,33 (1Н, мультиплет). 13 C-ЯMP (CДСl3) d: 157,6, 156,5, 134,1, 129,6, 128,6, 128,4, 127,7, 126,1, 124,4, 119,9, 109,7, 109,6, 63,3, 55,4, 54,7, 53,4, 47,8, 46,6, 28,1, 20,4, 16,3. HRMS: Вычислено для С21Н28N2O2: 340, 2151. Найдено: 340, 2172. Пример 55 Цис- 3- (2-метоксибензиламино) -2-(2-фтор-6-хлорфенил) пиперидин (X=2-F, 6-Cl). Т.пл. 245-246°С (НСl соль). ИК (КВч) макс.: 3280, 2700, 1610, 1580,1500,1450,1260, 1010 см-1. 1 H-ЯМР (CДСl3) d: 7,16-7,1 (ЗН, мультиплет), 6,99-6,92 (2Н, мультиплет), 6,79 (1Н, триплет, J=8 Гц), 6,68 (1Н, дублет, J=8 Гц), 4,37 (1Н, дублет, J=2 Гц), 3,68 (1Н, дублет, J=14 Гц), 3,55 (1Н, синглет), 3,47 (1Н, дублет, J=14 Гц), 3,2 (1Н, уширенный дублет, J=14 Гц), 2,87-2,78 (1Н, мультиплет), 2,7 (1Н, триплет, J=14 Гц), 2,4-2,0 (1Н, мультиплет), 1,84-1,6 (2Н, мультиплет), 1,36 (1Н, уширенный дублет, J=14 Гц). 13 С-ЯМР (CДСl3) d: 157,4, 129,3 128,3, 128,2, 127,8, 125,7, 125,6, 120,3, 115,4, 115, 109,9, 62,8, 62,8, 54,9, 53, 47,9, 28,6, 20,8. HRMS: Вычисленодля С19Н22N2OClF: 348, 1405. Найдено: 348, 1369. Названные соединения примеров 56-60 имеют следующую общую формулу и получают по методике, H X N N H O подобно описанной в примере 1. Пример 56 3-(2-Метоксибензиламино)-пиперидин (Х=Н).Т.пл. 198°С (соль НСl). 1H-ЯМР (соль НСl в СД3ОН) d: 7,48 (2Н, триплет, J=6 Гц), 7,12 (1Н, дублет, J=6 Гц), 7,04 (1Н, триплет, J=8 Гц), 4,33 (2Н, дублет, J=4 Гц), 3,95 (ЗН, синглет), 3,8 (1Н, уширенный дублет, J=9 Гц), 3,7-3,54 (1Н, мультиплет), 3,41 (уширенный дублет, 1Н, J=9 Гц), 3,25 (1Н, триплет, J=12 Гц), 3,18-3,01 (1Н, мультиплет), 2,48-2,4 (1Н, мультиплет), 2,24-2,1 (1Н, мультиплет), 2,01-1,79 (1Н, мультиплет). HRMS: Вычислено для С13Н22N2O: 220, 1576. Найдено: 220, 1587. Пример 57 Цис-3-(2-метоксибензиламино)-2-(5-инданил)-пиперидин (X=5-индан). Т.пл. 243°С (соль НСl). 1H-ЯМР (CДСl3) d: 7,24-7,11 (ЗН, мультиплет), 6,97 (2Н, триплет, J=8 Гц), 6,79 (1Н, триплет, J=8 Гц), 6,65 (1Н, дублет, J=8 Гц), 3,83 (1Н, уширенный синглет), 3,68 (1Н, дублет, J=14 Гц), 3,43 (ЗН, синглет), 3,39 (1Н, дублет, J=14 Гц), 2,23 (1Н, уширенный дублет, J=14 Гц), 2,88-2,72 (6Н, мультиплет), 2,13-1,86 (5Н, мультиплет), 1,56 (1Н, два триплета, J=13 и 4 Гц), 1,37 (1Н, уширенный дублет, J=14 Гц). Пример 58 Цис-3-(2-метоксибензиламино)-2-(1-нафтил)-пиперидин (Х=1-нафтил). Т.пл. 251°С (соль НСl). 1H-ЯМР (соль НСl в СД3ОН) d: 8,16 (1Н, дублет, J=6 Гц), 8,08 (1Н, дублет, J=7 Гц), 8,04-7,98 (1Н, мультиплет), 7,94-7,86 (1Н, мультиплет), 7,71 (1Н, триплет, J=8 Гц), 7,64-7,61 (1Н, мультиплет), 7,17 (1Н, триплет, J=8 Гц), 6,84 (1Н, дублет, J=6 Гц), 6,66 (1Н, триплет, J=8 Гц), 5,73 (1Н, 41251 уширенный синглет), 4,06-3,99 (1Н, мультиплет), 3,8-3,74 (2Н, мультиплет), 3,49-3,4 (4Н, мультиплет), 2,722,44 (ЗН, мультиплет), 6,84 (1Н, уширенный дублет, J=8 Гц). HRMS: Вычислено для С23Н26N2O: 346, 2045. Найдено: 346, 2062. Пример 59 Цис-3-(2-метоксибензиламино)-2-(2-нафтил)-пиперидин (X=2-нафтил). Т.пл. > 250°С (разл., соль НСl). 1H-ЯМР (CДСl3) d: 7,87-7,78 (ЗН, мультиплет), 7,69 (1Н, дублет, J=8 Гц), 7,5-7,39 (2Н, мультиплет), 7,14 (1Н, дублет, J=8 Гц), 7,1 (1Н, триплет, J=8 Гц), 6,92 (1Н, дублет, J=8 Гц), 6,75 (1Н, триплет, J=8 Гц), 6,47 (1Н, дублет, J=8 Гц), 4,02 (1Н, дублет, J=2 Гц), 3,66 (1Н, дублет, J=14 Гц), 3,373,2 (2Н, мультиплет), 2,97 (ЗН, синглет), 2,89 (1Н, уширенный синглет), 2,88-2,79 (1Н, мультиплет), 2,16 (1Н, уширенный дублет, J=14 Гц), 1,98 (1Н, квартет, триплет, J=8 и 3 Гц), 1,63 (1H, два триплета, J=4 и 12 Гц), 1,43 (1H, уширенный дублет, J=13 Гц). Пример 60 Цис-3-(2-метоксибензиламино)-2-циклопентил-пиперидин (X=циклопентил). Т.пл. 161°С (соль НСl). ИК (КВч) макс.: 3480, 3420, 2960, 1610, 1500, 1260, 1020 см-1. 1 H-ЯМР (CДCl3) d: 7,48 (1H, дублет, J=8 Гц), 7,17 (1H, триплет, J=8 Гц), 6,9 (1H, триплет, J=8 Гц), 6,8 (1H, дублет, J=8 Гц), 3,78 (ЗН, синглет), 3,67 (1H, дублет, J=13 Гц), 3,57 (1H, дублет, J=13 Гц), 2,97 (1H, уширенный дублет, J=13 Гц), 2,69-2,64 (2Н, мультиплет), 2,47 (1H, триплет, J=9 Гц), 2,3-2,2 (2Н, мультиплет), 1,75 (1H, уширенный дублет, J=9 Гц), 1,6-1,16 (7Н, мультиплет), 1,0-0,9 (1H, мультиплет). 13 С-ЯМР (CДСl3) d: 157,9, 130,6, 128,5, 127,5, 120,2, 110, 61,3, 59,2, 55,1, 47,9, 47,2, 39, 29,2, 27,3, 26,2, 25,8, 24,1, 23,1. HRMS: Вычислено для С18Н28N2O 288, 2201. Найдено: 288, 2172. Названные соединения примеров 61-62 имеют следующую общую формулу и получают по методике, подобной описанной в примере 1. O N H N H (CH2)n Пример 61 5-(2-Метоксибензиламино)-1-аза-спиро-(5,5)-ундеккан (n=2). Т.пл. 257°С (соль НСl). ИК (КВч) макс.: 2940, 1605, 1580, 1500, 1460, 1250, 1020 см-1. 1 Н-ЯМР (CДСl3) d: 7,27-7,18 (2Н, мультиплет), 6,89 (1H, триплет, J=8 Гц), 6,84 (1H, дублет, J=8 Гц), 3,86 (1H, дублет, J=14 Гц), 3,82 (ЗН, синглет), 3,68 (1H, дублет, J=14 Гц), 2,74-2,68 (2Н, мультиплет), 2,25-2,08 (1H, мультиплет), 1,81-1,25 (13Н, мультиплет). HRMS: Вычислено для С18Н28N2O: 288, 2202. Найдено: 288, 2182. ПРИМЕР 62. 10-(2-Метоксибензиламино)-6-аза-спиро-[4,5]-декан (n=1). Т.пл. 247°С (соль НСl). ИК (КВч) макс.: 2960, 2700, 1605, 1580, 1500, 1480, 1260, 1030 см-1. 1 H-ЯМР (CДСl3) d: 7,23-7,18 (2Н, мультиплет), 6,89 (1Н, триплет, J=8 Гц), 6,84 (1Н, дублет, J=8 Гц), 3,89 (1Н, дублет, J=13 Гц), 3,83 (ЗН, синглет), 3,66 (1Н, дублет, J=14 Гц), 2,76-2,7 (2Н, мультиплет), 2,31 (1Н, два дублета, J=8 и 3 Гц), 1,81-1,24 (12Н, мультиплет). HRMS: Вычислено для С17Н26N2O: 274, 2085. Найдено: 274, 2057. Пример 63 Цис-3-(2-метоксибензиламино)-2-фенилпипе-ридин. А. 4-Фенил-1-(трет-бутилдиметилсилил)азети-дин-2-он. 4-Фенилазетидин-2-он (10,4 г, 71,0 ммолей) (Graf Chem. Ber. 111 (1963), Durst et al., J. Org. Chem. 35, 2043 (1970)) растворяют в ДМФА (200 мл) и обрабатывают хлористым трет-бутил-диметилсилилом (12,8 г, 85 ммолей) и триэтиламином (11,8 мл, 85 ммолей). Смесь перемешивают при комнатной температуре в течение 16 часов и переносят в эфир (500 мл). Эфирный раствор промывают 1 N раствором соляной кислоты (1 х 100 мл), водой (2 х 50 мл) и рассолом (1 х 50 мл). После этого раствор высушивают (безводным сульфатом магния) и выпаривают, остаток подвергают флеш-хроматографии на силикагельной колонке. Элюирование с помощью 15%-ного этилацетата в гекса-не дает 4-фенил-1-(третбутилдиметилсилил)-азетидин-2-он (18,4 г, 99%) в виде масла, которое затвердевает при стоянии. 1 Н-ЯМР (CДСl3) d: 7,37-7,29 (5Н, мультиплет), 4,51 (1Н, два дублета, J=6 и 3 Гц), 3,5 (1Н, два дублета, J=16 и 6 Гц), 2,93 (1Н, два дублета, J=16 и 3 Гц), 0,9 (ЗН, синглет), 0,89 (9Н, синглет), 0,19 (ЗН, синглет). В. 3-(3'-Хлорпропил)-4-фенил-1-(трет-бутилди-метилсилил)-азатидин-2-он. К перемешиваемому раствору 4-фенил-1-(трет-бутилдиметилсилил) азатидин-2-она (9,75 г, 37 ммолей) в ТГФ (100 мл) при -50°С в атмосфере азота быстро добавляют свежеприготовленный раствор диэтиламида лития (1 М в ТГФ, 44 мл, 45 ммолей). Реакционную смесь перемешивают в течение 15 минут 41251 при -50°С, а затем добавляют раствор 1-бром-З-хлорпропана (7,4 мл, 75 ммолей) в ТГФ (20 мл). Получающийся раствор перемешивают в течение 15 мин при -50°С, после чего добавляют хлористый аммоний (насыщенный водный раствор). После этого смесь обрабатывают эфиром (2 х 300 мл) и промывают насыщенным водным раствором хлористого натрия. Эфирный раствор высушивают (сульфатом магния) и концентрируют, а остаток (17,0 г) хроматографируют на силикагелевой колонке. Элюирование 5%-ным этилацетатом в гексане дает 3-(3-хлорпропил)-4-фенил-1-(трет-бутилдиметилсилил) азатидин-1-он в виде масла (7,6 г, 58%). 1 H-ЯМР (CДСl3) d: 7,2-7,4 (1Н, мультиплет), 4,18 (1Н, дублет, J=2,5 Гц), 3,5 (2Н, триплет, J=5 Гц), 3,04 (1Н, дублет и триплет, J=2,5 и 7,5 Гц), 1,7-2,05 (4Н, мультиплет), 0,9 (9Н, синглет), 0,2 (ЗН, синглет). С. Цис-Метил-2-фенилпиперидин-З-карбокси-лат (Метиловый эфир кислоты). 3-(3'-Хлорпропил)-4-фенил-1-(трет-бутилдиме-тилсилил)-азетидин-2-он (3,07 г, 9,0 ммолей) растворяют в 10%-ном метанольном растворе серной кислоты и кипятят с обратным холодильником в течение 16 часов. К концу этого периода времени реакционную смесь охлаждают, серную кислоту нейтрализуют бикарбонатом натрия и смесь обрабатывают эфиром (2 х 200 мл), Эфирный раствор промывают водой (2 х 50 мл) и высушивают (безводным сульфатом магния). Выпаривание дает в основном чистый 5-хлор-2карбометокси-1-фенил-пент-1-иламин в виде масла (2,11 г). Полученный таким образом 5-хлор-2карбометок-си-1-фенил-пент-1-ил-амин растворяют в диметилформамиде ("ДМФА") (20 мл) и добавляют йодистый натрий (2,11 г) и бикарбонат натрия (2,11 г). Получающуюся смесь кипятят с обратным холодильником в течение 15 мин. К концу этого периода времени реакционную смесь охлаждают и обрабатывают эфиром (200 мл). Эфирный раствор промывают водой (2 х 50 мл) и высушивают (безводным сульфатом магния). Выпаривание эфира дает хроматографически чистый метиловый эфир цис-2-фенилпипе-ридин-3-карбоновой кислоты в виде масла (1,54 г, 78%). 1H-ЯМР (CДСl3) d: 7,31-7,5 (5Н, мультиплет), 3,95 (2Н, дублет, J=3,5 Гц), 3,42 (ЗН, синглет), 3,39-3,30 (1Н, мультиплет), 3,01-2,93 (1Н, мультиплет), 2,84-2,74 (1Н, мультиплет), 2,22-2,11 (1Н, мультиплет), 1,90-1,66 (ЗН, мультиплет), 1,53-1,46 (1Н, мультиплет). D. Метиловый эфир цис-2-фенилпиперидин-1-(бензилоксикарбонил)-3-карбоновой кислоты. Метиловый эфир цис-2-фенилпиперидин-З-карбоновой кислоты (1,54 г, 7,0 ммоля), триэтиламин (1,5 мл, 11,0 ммолей) и бензиловый эфир хлормуравьиной кислоты (1,5 мл, 11,0 ммолей) смешивают в хлористом метилене (45 мл) при 25°С перемешивают в течение 15 часов. К концу этого периода времени реакционную смесь обрабатывают эфиром (100 мл), эфирный раствор промывают водой (2 х 50 мл) и высушивают (безводным сульфатом магния). Растворитель удаляют при пониженном давлении, чтобы получить остаток, который хроматографируют на флеш-силикагелевой колонке. Элюирование 1:1 смесью этилацетат /гексан дает метиловый эфир цис-2-фенилпиперидин-1-(бензилоксикарбонил)-3-карбо-новой кислоты в виде масла (1,91 г, 77%). 1 H-ЯМР (CДСl3) d: 7,34-7,12 (10Н, мультиплет), 5,97 (1Н, уширенный дублет), 5,30-5,1 (1Н, мультиплет), 5,17 (1Н, синглет), 4,15-3,90 (1Н, мультиплет), 3,59 (ЗН, синглет), 2,98-2,91 (1Н, мультиплет), 2,75 (1Н, уширенный триплет, J=12 Гц), 2,14-2,00 (2Н, мультиплет), 1,85-1,48 (2Н, мультиплет), 13С-ЯМР (CДСl3) d: 172,9, 138,3, 126,7, 128,5, 128,0, 127,9, 127,3, 67,4, 54,6, 51/8, 39,7, 25,1, 21,5. Е. Цис-2-фенилпиперидин-1-(бензилоксикар-бонил)-3-карбоксамид. К суспензии хлористого аммония (1,66 г, 31 ммолей) в бензоле (60 мл) при -5°С медленно добавляют 2 М раствор (15,6 мл, 31 ммолей) триметилалюминия в гексане. После завершения добавления реакционной смеси позволяют подогреваться до комнатной температуры и ее перемешивают до тех пор, пока (1 час) не прекратится выделение газа. Раствор метилового эфира цис-2-фенил-пиперидин-1-(бензилоксикарбонил)3-карбоновой кислоты (2,2 г, 6,2 ммолей) в бензоле (10 мл) добавляют к смеси и раствор поддерживают при 50°С в течение 10 часов. Реакционную смесь охлаждают до комнатной температуры и осторожно гасят с помощью 5%-ного НСl. Получающуюся смесь фильтруют через диатомовую землю (Целит (торговая марка)) и остаток промывают хлористым метиленом (200 мл). Органический слой разделяют, в то время как водный слой подщелачивают и экстрагируют хлористым метиленом (200 мл). Органические экстракты объединяют, высушивают (безводным сульфатом магния) и концентрируют в вакууме, чтобы получить остаток, который суспендируют в 1:1 смеси эфир пентан, чтобы получить цис-2-фенилпиперидин-1-(бензилоксикарбонил)-3-карбоксамид (амид кислоты) в виде белого твердого вещества(1,4 г, 66%). Т.пл. 171°С. 1 Н-ЯMP (CДСl3) d: 7,35-7,28 (10Н, мультиплет), 5,86 (1Н, дублет, J=4,9 Гц), 5,66-5,58 (1Н, мультиплет), 5,48-5,37 (1Н, мультиплет), 5,21 (1Н, дублет, J=12 Гц), 5,13 (1Н, дублет, J=12 Гц), 4,02 (1Н, уширенный дублет, J=13 Гц), 2,9-2,74 (2Н, мультиплет), 2,11-1,98 (2Н, мультиплет), 1,86-1,76 (1Н, мультиплет), 1,66-1,5 (1Н, мультиплет). HRMS: Вычислено для С20Н22N2O3: 338, 1630. Найдено: 338, 1634. F. Цис-1-(бензилоксикарбонил)-З- амино-2-фе-нилпиперидин. Цис-2-фенилпиперидин-1 -(бензилоксикарбо-нил)-3-карбоксамид (1,4 г, 4,1 ммоля) растворяют в сухом трет-бутаноле (40 мл) при 50°С и добавляют тетрацетат свинца (1,9 г, 4,3 ммоля). Получившуюся коричневую реакционную смесь кипятят с обратным холодильником в течение 0,5 часа. В течение 1 часа добавляют дополнительное количество тетрацетата свинца (1,9 г, 4,3 ммоля). К концу этого периода времени реакционную смесь выливают в холодную 1 N соляную кислоту и фильтруют через диатомовую землю (Целит (торговая марка)). Водную фазу экстрагируют этилацетатом (3 х 100 мл) и объединенные органические слои промывают последовательно, водой, 5%-ной водной гидроокисью натрия, водой и рассолом, а затем высушивают (безводным сульфатом магния). Выпаривание растворителя при пониженном давлении дает остаток, который хроматографируют на колонке с силикагелем. Элюирование
ДивитисяДодаткова інформація
Назва патенту англійськоюHydrogenated nitrogen-containing heterocyclic substances, piperidine derivatives, pharmaceutical composition and method for inhibiting activity of p substance
Автори англійськоюDESAI MANOJ C, ROSEN TERRY J
Назва патенту російськоюГидрированные азотсодержащие гетероциклические соединения, производные пиперидина, фармацевтическая композиция и способ угнетения активности вещества р в организме
Автори російськоюДесай Манодж С., Росен Терри Дж.
МПК / Мітки
МПК: A61K 31/445, C07D 211/56
Мітки: спосіб, азотвмісні, гідровані, речовини, гетероциклічні, похідні, піперидину, пригнічення, організмі, композиція, сполуки, фармацевтична, активності
Код посилання
<a href="https://ua.patents.su/48-41251-gidrovani-azotvmisni-geterociklichni-spoluki-pokhidni-piperidinu-farmacevtichna-kompoziciya-ta-sposib-prignichennya-aktivnosti-rechovini-r-v-organizmi.html" target="_blank" rel="follow" title="База патентів України">Гідровані азотвмісні гетероциклічні сполуки, похідні піперидину, фармацевтична композиція та спосіб пригнічення активності речовини р в організмі</a>
Попередній патент: Потужний руйнівний інструмент
Наступний патент: Похідні та аналоги 2-дезокси-2,3-дидегідро-n-ацетилнеурамінової кислоти, спосіб їх одержання, фармацевтична композиція, спосіб лікування вірусних інфекцій
Випадковий патент: Спосіб багатоступеневого дроблення агломерату в одновалковій зубчастій дробарці