Застосування імуногенної композиції streptococcus pneumoniae
Номер патенту: 99703
Опубліковано: 25.09.2012
Автори: Біманс Ральф Леон, арсон Наталі Марі-Джозеф, ван Мехелен Марселль Полетт, Полман Ян, Герман Філіпп Вінсент
Формула / Реферат
1. Застосування імуногенної композиції Streptococcus pneumoniae, що включає 9 або більше, 10 або більше, 11 або більше, 13 або більше, або 14 або більше капсулярних сахаридів з різних серотипів S. pneumoniae, кон'югованих з 2 або більше різними білками носія, де композиція включає капсулярний сахарид серотипу 19F, кон'югований з токсоїдом дифтерії (DT), але не включає капсулярного сахариду із серотипу 19А, у виробництві лікарського засобу для лікування або запобігання захворюванням, спричиненим інфекцією штамами серотипу 19А Streptococcus pneumoniae.
2. Застосування імуногенної композиції за пунктом 1, де 19F капсулярний сахарид є безпосередньо кон'югованим з білком носія.
3. Застосування імуногенної композиції за пунктом 1, де 19F капсулярний сахарид є кон'югованим з білком носія через лінкер.
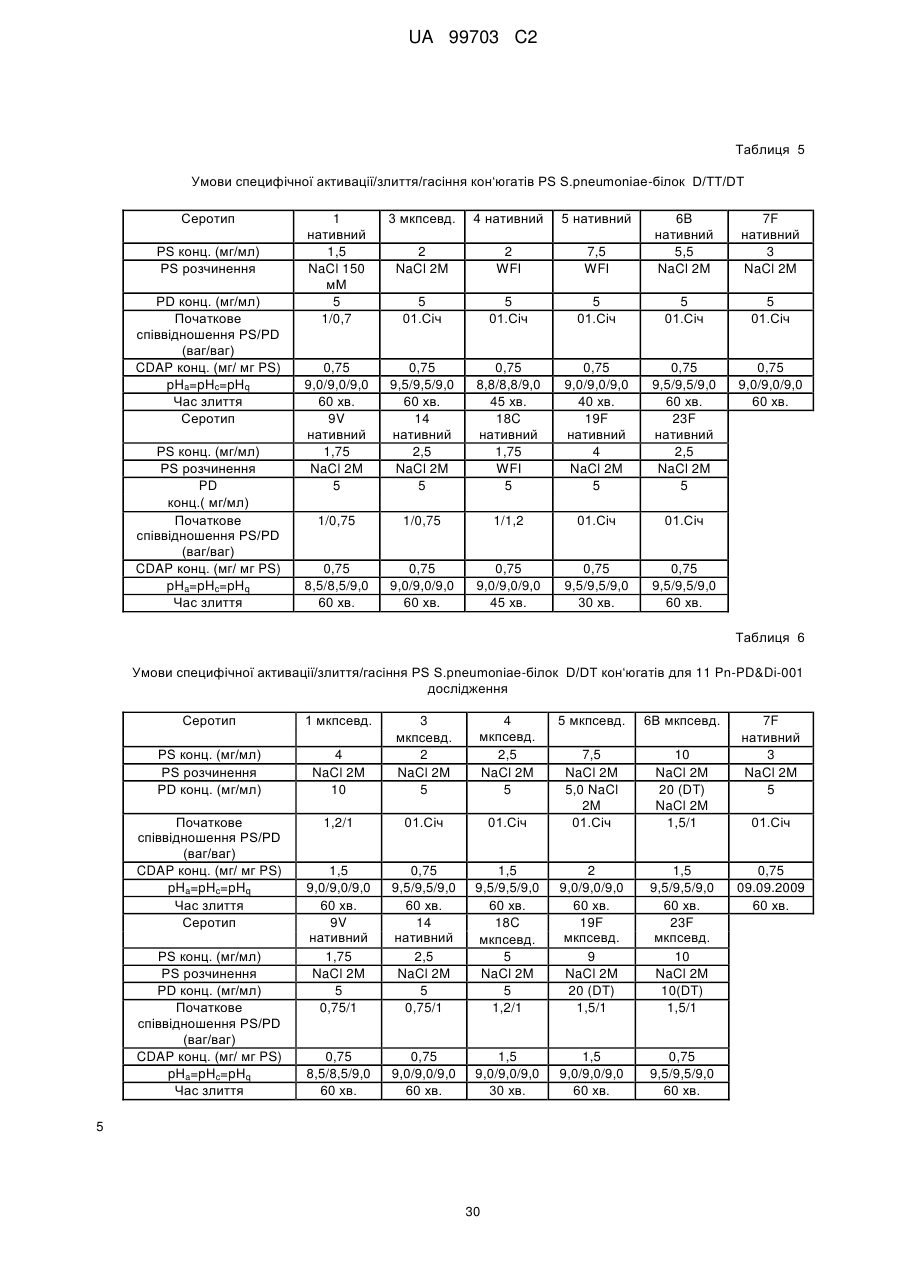
4. Застосування імуногенної композиції згідно з будь-яким з попередніх пунктів, де 19F сахарид є кон'югованим з білком носія або з лінкером при використанні методики CDAP.
5. Застосування імуногенної композиції за будь-яким з попередніх пунктів, де співвідношення білка носія та 19F сахариду складає від 5:1 до 1:5, від 4:1 до 1:1 або від 2:1 до 1:1, або від 1,5:1 до 1,4:1 (ваг./ваг.).
6. Застосування імуногенної композиції за будь-яким з попередніх пунктів, де середній розмір (Mw) 19F сахариду є більшим за 100 кДа.
7. Застосування імуногенної композиції за будь-яким з попередніх пунктів, де доза 19F сахаридного кон'югату складає від 1 до 10 мкг, від 1 до 5 мкг або від 1 до 3 мкг сахариду.
8. Застосування імуногенної композиції за будь-яким з попередніх пунктів, що включає 2, 3, 4, 5 або 6 різних білків носія.
9. Застосування імуногенної композиції за будь-яким з попередніх пунктів, де один або більше, або усі білки носія вибрані з групи, яка складається з DT, CRM 197, ТТ, фрагменту С, dPIy, PhtA, PhyB, PhtD, PhtE, PhtDE, OmpC, PorB та білка D Haemophilus influenzae.
10. Застосування імуногенної композиції за будь-яким з попередніх пунктів, де композиція включає капсулярний сахарид 18С, кон'югований з ТТ, де 18С необов'язково є єдиним сахаридом у композиції, кон'югованим з токсоїдом правця (ТТ).
11. Застосування імуногенної композиції за будь-яким з пунктів 1-10 у виробництві лікарського засобу для лікування або запобігання захворюванням, спричиненим інфекцією Streptococcus pneumoniae.
12. Застосування імуногенної композиції Streptococcus pneumoniae, що включає 9 або більше, 10 або більше, 11 або більше, 13 або більше, або 14 або більше капсулярних сахаридів з різних серотипів S. pneumoniae, кон'югованих з 2 або більше різними білками носія, де композиція включає капсулярний сахарид серотипу 19F, кон'югований з токсоїдом дифтерії (DT) або CRM197, але не включає капсулярного сахариду із серотипу 19А, де 19F є безпосередньо кон'югованим з білком носія або є кон'югованим з білком носія через лінкер, та де 19F сахарид є кон'югованим з білком носія або з лінкером при використанні методики CDAP, у виробництві лікарського засобу для лікування або запобігання захворюванням, спричиненим інфекцією штамами серотипу 19А Streptococcus pneumoniae.
13. Застосування імуногенної композиції за пунктом 12, де серотип 19F є кон'югованим з дифтерійним токсоїдом.
14. Застосування імуногенної композиції за будь-яким з пунктів 12 або 13, де співвідношення білка носія та 19F сахариду складає від 5:1 до 1:5, від 4:1 до 1:1 або від 2:1 до 1:1, або від 1,5:1 до 1,4:1 (ваг./ваг.).
15. Застосування імуногенної композиції згідно з будь-яким з пунктів 12-14, де середній розмір (Mw) 19F сахариду є більшим за 100 кДа.
16. Застосування імуногенної композиції за будь-яким з пунктів 12-15, де доза 19F сахаридного кон'югату складає від 1 до 10 мкг, від 1 до 5 мкг або від 1 до 3 мкг сахариду.
17. Застосування імуногенної композиції згідно з будь-яким з пунктів 12-16, що включає 2, 3, 4, 5 або 6 різних білків носія.
18. Застосування імуногенної композиції згідно з будь-яким з пунктів 12-17, де один або більше, або усі білки носія вибрані з групи, яка складається з DT, CRM 197, ТТ, фрагменту С, dPly, PhtA, PhyB, PhtD, PhtE, PhtDE, OmpC, PorB та білка D Haemophilus influenzae.
19. Застосування імуногенної композиції за будь-яким з пунктів 12-18, де композиція включає капсулярний сахарид 18С, кон'югований з ТТ, де 18С є необов'язково єдиним сахаридом у композиції, кон'югованим з токсоїдом правця (ТТ).
20. Застосування імуногенної композиції за будь-яким з пунктів 12-19 у виробництві лікарського засобу для лікування або запобігання захворюванням, спричиненим інфекцією Streptococcus pneumoniae.
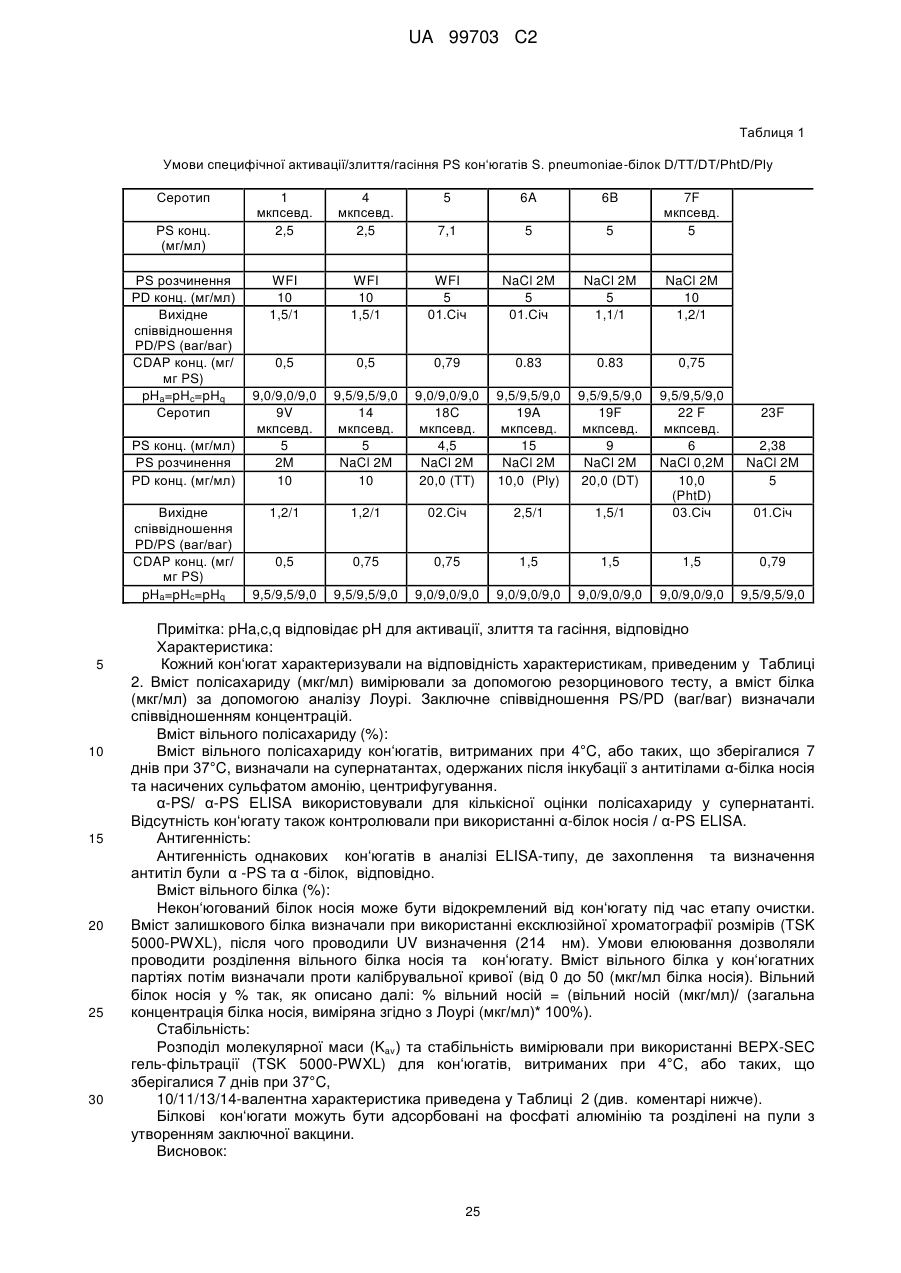
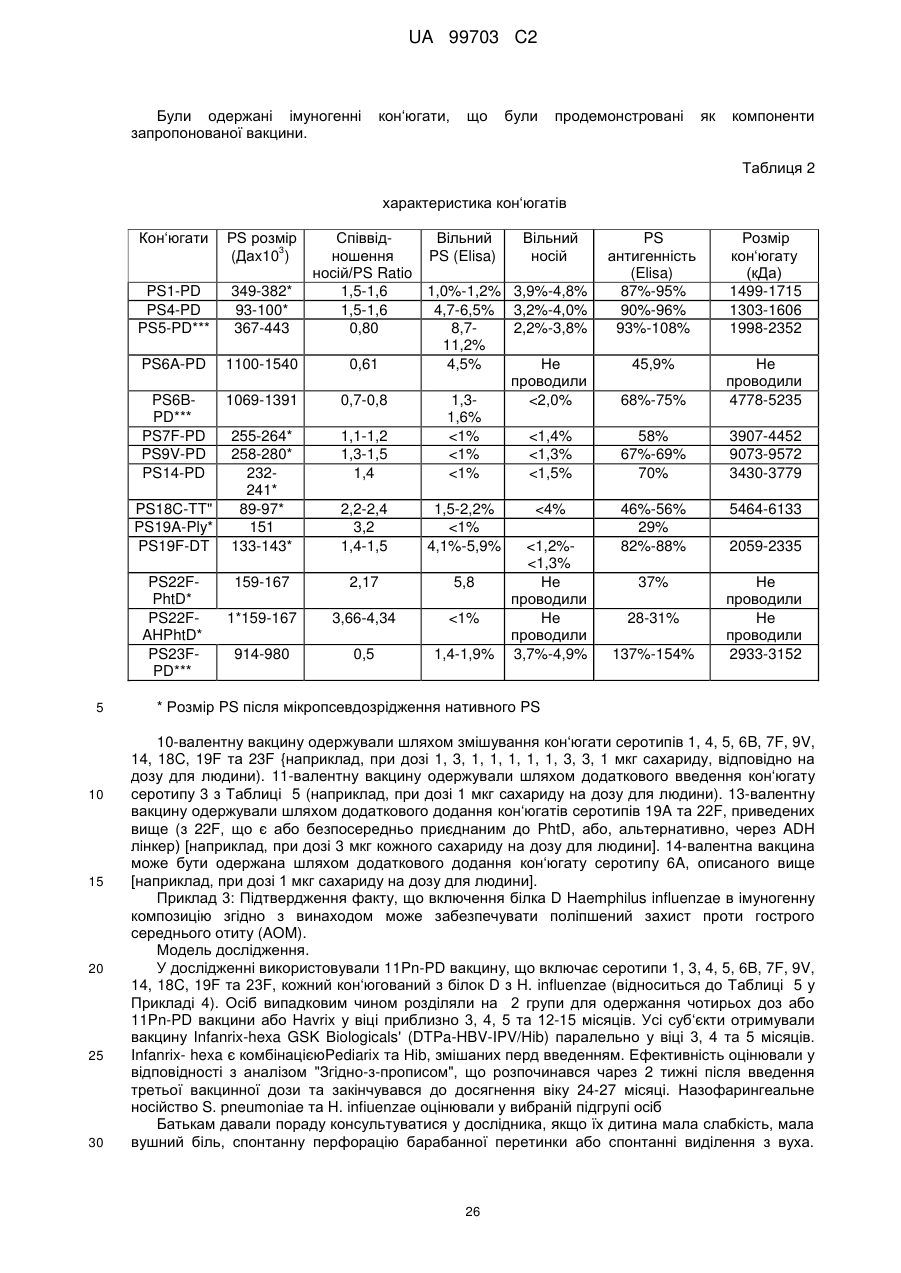
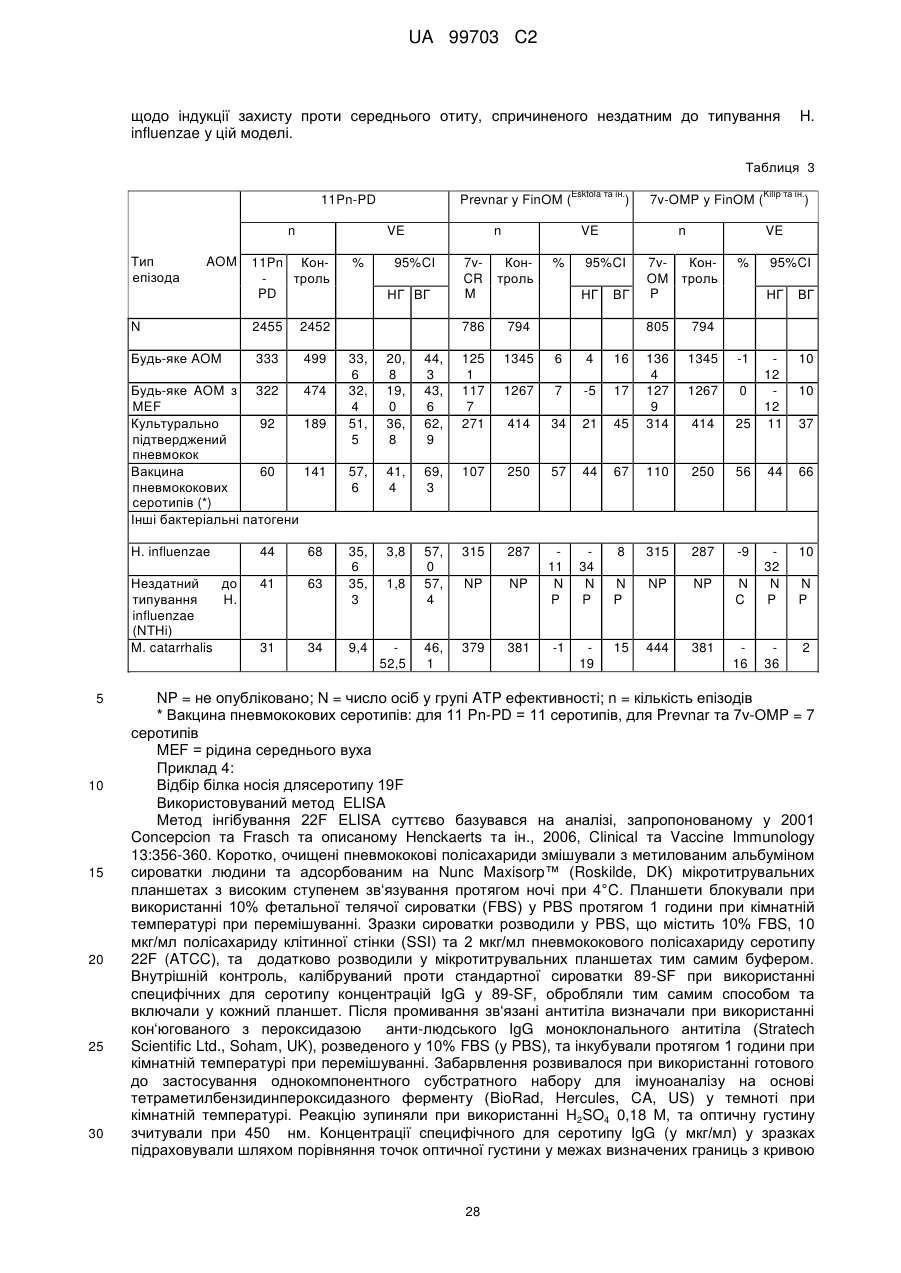
Текст
Реферат: Винахід належить до застосування імуногенної композиції Streptococcus pneumoniae, що включає 9 або більше, 10 або більше, 11 або більше, 13 або більше, або 14 або більше капсулярних сахаридів з різних серотипів S. pneumoniae, кон'югованих з 2 або більше різними білками носія, де композиція включає капсулярний сахарид серотипу 19F, кон'югований з UA 99703 C2 (12) UA 99703 C2 токсоїдом дифтерії (DT), але не включає капсулярного сахариду із серотипу 19А, у виробництві лікарського засобу для лікування або запобігання захворюванням, спричиненим інфекцією штамами серотипу 19А Streptococcus pneumoniae. UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Даний винахід відноситься до поліпшеної вакцини на основі Streptococcus pneumoniaе. Передумови створення винаходу Діти у віці двох років не дають імунної відповіді на більшість полісахаридних вакцин, таким чином, є необхідним надати полісахаридам імуногенності за допомогою хімічної кон„югації з білком носія. Злиття полісахариду, Т-незалежного антигену, з білком, Т-залежним антигеном, надає полісахаридам властивостей Т-залежності, включаючи зміни ізотипів, афінне дозрівання та індукцію пам„яті. Проте, можуть існувати підходи, що базуються на повторюваному введенні полісахаридбілкових кон„югатів, або на комбінації полісахарид-білкових кон„югатів з утворенням мультивалентних вакцин. Наприклад, було повідомлено, що полісахаридна типу b вакцина Haemophilus influenzae (PRP), що використовує токсоїд правця (ТТ) як білок носія, була проаналізована в інтервалі доз при одночасній імунізації за допомогою (вільного) ТТ та кон„югатної вакцини, що містить пневмококовий полісахарид та ТТ згідно зі стандартною процедурою для вакцинації немовлят. Оскільки доза пневмококової вакцини була підвищена, то імунна відповідь на PRP полісахаридну частину Hib кон„югатної вакцини була зменшена, що свідчить про імунну інтерференцію полісахариду, можливо, за рахунок застосування того самого білка носія (Dagan та ін., Infect. Immunol (1998); 66 2093-2098). Ефект дозування білка носія на гуморальну відповідь на білок саму по собі також був продемонстрований як багатофакторний у немовлят. Було повідомлено, що підвищення дозування тетравалентного кон„югату токсоїду правця приводить до зниження відповіді на носій правця (Dagan та ін., вище). Класичний аналіз цих ефектів комбінації вакцин був описаний як індукована носієм епітопна супресія, яка не є зрозумілою до кінця, але, як передбачається, походить від надлишкової кількості білка носія (Fattom, Vaccine XV 126 (1999)). Як виявляється, це приводить до конкуренції за Th-клітини між В-клітинами до білка носія та В-клітинами до полісахариду. Якщо В-клітини з білком носія переважають, то не вистачає доступних Th-клітин для забезпечення необхідної допомоги для В-клітин, специфічних до полісахариду. Проте ці імунологічні ефекти, які спостерігають, були суперечливими, із загальною кількістю білка носія у деяких випадках, що підвищувала імунну відповідь, та іншими випадками зниження імунної відповіді. Згідно з цим залишаються технічні складності у поєднані багаточисельних полісахаридних кон„югатів у єдину, ефективну вакцинну композицію. Streptococcus pneumoniae являє собою Грам-позитивну бактерію, що є відповідальною за значний рівень захворюваності та смертності (зокрема, у молодих людей та людей похилого віку), спричинюючи інвазивні захворювання, такі, як пневмонія, бактеріємія та менінгіт, та захворювання, асоційовані з колонізацією, такі, як середній отит. Процент пневмококової пневмонії у США для осіб, старших 60 років оцінюється у межах 3-8% на 100000. У 20% випадків це приводить до бактеріємії та інших проявів, таких, як менінгіт, з процентом смертності , що наближається до 30% навіть при лікуванні антибіотиками.Pneumococcus має капсулу, що складається хімічно зв„язаного полісахариду, який забезпечує сероспецифічність. Існує 90 відомих серотипів пневмококу, капсула являє собою основну детермінанту вірулентності для пневмококу, оскільки капсула не тільки захищає внутрішню поверхню бактерії від комплементу, але й сама по собі є імуногенною. Полісахариди являють собою Т-незалежні антигени, та можуть не піддаватися процесингу або не представлятися на молекулах МНС для взаємодії з Т-клітинами. Проте вони можуть стимулювати імунну систему за допомогою альтернативного механізму, який втягує перехресне зв„язування поверхневих рецепторів на Вклітинах. Було показано у деяких експериментах, що захист проти інвазивного пневмококового захворювання корелює найбільш сильно зі специфічністю антитіла до капсули, а захист є специфічним для серотипу. Streptococcus pneumoniae є найбільш загальною причиною інвазивного бактеріального захворювання та середнього отиту у немовлят та дітей молодшого віку. Крім того, особи похилого віку мають слабкі відповіді на пневмококові вакцини (Roghmann та ін., (1987), J.Gerontol. 42, 265-270), тому існує підвищена частота виникнення бактеріальної пневмонії у цій популяції [Verghese and Berk, (1983) Medicine (Baltimore) 62:271-285]. Основні клінічні синдроми, спричинені S. pneumoniae, є широко відомими та обговорюються у стандартних медичних підручниках (Fedson DS, Muscher DM. In: Plotkin SA, Orenstein WA, editors. Vaccines. 4rth edition. PhiladelphiaWB Saunders Co, 2004a: 529-588). Наприклад, інвазивне пневмококове захворювання (IPD) визначається як будь-яка інфекція, при якій ізоллють S. pneumoniae з крові та інших у нормі стерильних місць (Musher DM. Streptococcus pneumoniae. In Mandell GL, Bennett JE, Dolin R (eds). Principles and Practice of Infectious diseases 1 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 (5th ed). New York, Churchill Livingstone, 2001, p2128-2147). Хронічне обструктивне захворювання легень (COPD) визнається як таке, що охоплює декілька станів (порушення дихання, хронічний бронхіт, капілярний бронхіт або захворювання верхніх дихальних шляхів та емфізема), що часто співіснують. Пацієнти страждають від загострення їх стану, що часто асоціюється з посиленням порушення дихання, та часто мають посилений кашель з виділенням мокротинням або гнійного слизу (Wilson, Eur Respir J 2001 17:995-1007). COPD визначається фізіологічно приступністю незворотної або частково незворотної обструкції дихальних шляхів у пацієнтів з хронічним бронхітом та/або емфіземою (Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease. American Thoracic Society. Am J Respir Crit Care Med. 1995 Nov;152(5 Pt 2):S77-121). Загострення COPD часто спричинюються бактеріальною інфекцією (наприклад, пневмококовою) (Sethi S, Murphy TF. Bacterial infection in chronic obstructive pulmonary disease in 2000: a state-of-the-art review. Clin Microbiol Rev. 2001 Apr;14(2):336-63). Таким чином, задачею даного винаходу є розробка поліпшеної композиції полісахаридної кон„югатної вакцини Streptococcus pneumoniae різноманітних серотипів. Короткий опис фігур Фігура 1. Стовпчикова діаграма, що показує імуногенність 11-валентного кон„югату у старих мавп резус. Світліші стовпчики представляють GMC після двох інокуляцій 11-валентним кон„югатом в ад„юванті. Більш темні стовпчики представляють GMC після двох інокуляцій 11валентного кон„югату в ад„юванті С. Фігура 2. Стовпчикова діаграма, що показує В-клітини пам„яті для PS3 після інокуляції 11валентного кон„югату в ад„юванті С або ад„юванті на основі фосфату алюмінію. Фігура 3. Стовпчикова діаграма, що показує імуногенність антитіла до полісахариду 19F у Balb/C мишей для 4-валентних чистих полісахаридів та 4-валентного dPly кон„югатів. Фігура 4. Стовпчикова діаграма, що показує імуногенність антитіла до полісахариду 22F у Balb/C мишей для 4-валентних чистих полісахаридів та 4-валентного PhtD кон„югатів. Фігура 5. Стовпчикова діаграма, що показує анти-22F IgG відповідь у Balb/C мишей. Фігура 6. Стовпчикова діаграма, що показує анти-22F опсонофагоцитарні титри у Balb/C мишей. Фігура 7. Стовпчикова діаграма, яка порівнює відповіді IgG, індуковані у молодих С57В1 мишей після імунізації 13-валентною кон„югатною вакциною, що рецептована з різними ад„ювантами. Фігура 8. Стовпчикова діаграма, що показує протективну ефективність різних вакцинних комбінацій у моделі пневмонії мавп. Фігура 9. Стовпчикова діаграма, що показує анти-PhtD IgG відповідь у Balb/C мишей після імунізації за допомогою 22F- PhtD або 22F-FY-PMD кон„югатами. Фігура 10. Захист проти контрольного зараження пневмококом типу 4 у мишей після імунізації за допомогою 22F- PhtD або 22F-FY-PMD. Опис винаходу Даний винахід забезпечує поліпшену вакцину Streptococcus pneumoniae, що включає 10 або більше (наприклад, 11, 12, 13, 14 або15 або більше) капсулярних сахаридів з різних серотипів S. pneumoniae, кон„югованих з 2 або більше білками носія, де вакцина включає капсулярний сахарид серотиу 19F, кон„югований з токсоїдом дифтерії або CRM197, та де вакцина необов„язково додатково включає білок D з Haemophilus influenzae як вільний білок або як додатковий білок носія або як обидва. Для цілей даного винаходу “імунізація людини хазяїна проти загострень COPD” або “лікування або запобігання загострень COPD” або “зниження тяжкості загострень COPD” відноситься до зниження частоти виникнення або проценту загострень COPD (наприклад, зниження проценту на 0,1, 0,5, 1, 2, 5, 10, 20% або більше) або зниження тяжкості загострень COPD як визначено вище, наприклад, у межах групи пацієнтів, імунізованих за допомогою композицій або вакцин згідно з винаходом. Типово, вакцина Streptococcus pneumoniae згідно з даним винаходом буде включати антигени капсулярних сахаридів (бажано кон„югованих), де сахариди походять принаймні з 10 серотипів S. pneumoniae. Кількість капсулярних сахаридів S. pneumoniae може коливатися від 10 різних серотипів (або "V", валентностей) до 23 різних серотипів (23V). В одному втіленні існує 10, 11, 12, 13, 14 або 15 різних серотипів. В іншому втіленні згідно з винаходом вакцина може включати кон„юговані сахариди S. pneumoniae та некон„юговані сахариди S. pneumoniae. Бажано, загальна кількість сахаридних серотипів є меншою або рівною 23. Наприклад, винахід може включати 10 кон„югованих серотипів та 13 некон„югованих сахаридів. Подібним чином, 2 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 вакцина може включати 11, 12, 13, 14, 15 або 16 кон„югованих сахаридів та 12, 11, 10, 9, 8 або 7, відповідно, некон„югованих сахаридів. В одному втіленні мультивалентна пневмококова вакцина згідно з винаходом буде вибиратися з наступних серотипів: 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F та 33F, хоча є очевидним, що один або два інші серотипи можуть замінюватися в залежності від віку реципієнта, що одержує вакцину та географічного розміщення місця, де буде використовуватися вакцина, наприклад, серотип 6A може бути включений в один список. Наприклад, 10-валентна вакцина може включати полісахариди із серотипів: 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F та 23F. 11-валентна вакцина може також включати сахариди із серотипів: 3. A 12 або 13-валентна педіатрична (для немовлят) вакцина може також включати 10- або 11- валентну композицію, доповнену серотипами 6A та 19A або 6A та 22F або19A та 22F або 6A та 15B або19A та 15B або 22F та 15B, у той час, як 13-валентна вакцина для людей похилого віку може включати 11-валентну композицію, доповнену серотипами 19A та 22F, 8 та 12F або 8 та 15B або 8 та 19A, або 8 та 22F, або 12F та 15B, або 12F та 19A або12F та 22F, або 15B та 19A або15B та 22F. 14-валентна педіатрична вакцина може включати 10валентну композицію, описану вище, доповнену серотипами 3, 6A, 19A та 22F; серотипами 6A, 8, 19A та 22F; серотипами 6A, 12F, 19A та 22F; серотипами 6A, 15B, 19A та 22F; серотипами 3, 8, 19A та 22F; серотипами 3, 12F, 19A та 22F; серотипами 3, 15B, 19A та 22F; серотипами 3, 6A, 8 та 22F; серотипами 3, 6A, 12F та 22F; або серотипами 3, 6A, 15B та 22F. Композиція в одному втіленні включає капсулярні сахариди, що походять від серотипів 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F та 23F (бажано кон„юговані). У додатковому втіленні згідно з винаходом включаються принаймні 11 сахаридних антигенів (бажано кон„юговані), наприклад капсулярні сахариди , що походять від серотипів 1, 3, 4, 5, 6B, 7F, 9V, 14, 18C, 19F та 23F. У додатковому втіленні згідно з винаходом включаються принаймні 12 або 13 сахаридних антигенів, наприклад вакцина може включати капсулярні сахариди, що походять від серотипів 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F та 23F, або капсулярні сахариди, що походять від серотипів 3, 4, 5, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F та 23F, хоча винаходом також передбачаються додаткові сахаридні антигени, наприклад, 23-валентна композиція (що містить такі серотипи, як 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F та 33F), також передбачається винаходом. Вакцина згідно з даним винаходом може включати білок D (PD) з Haemophilus influenzae (див. наприклад, EP 0594610). Haemophilus influenzae є ключовим організмом, що спричинює середній отит, та та автори згідно з даним виназодом показали, що включаючи цей білок у вакцину Streptococcus pneumoniae, буде забезпечуватися рівень захисту проти Haemophilus influenzae, пов„язаний з середнім отитом (посилання на POET публікацію). В одному втіленні вакцинна композиція включає білок D. В одному аспекті PD є присутнім як білок носія для одного або більше сахаридів. В іншому аспекті білок D буде присутнім у вакцинній композиції як вільний білок. У додатковому аспекті білок D є присутнім як білок носія, так і як вільний білок. Білок D може використовуватися як білок повної довжини або aяк фрагмент (WO0056360). У додатковому аспекті білок D є присутнім як білок носія для більшості сахаридів, наприклад 6, 7, 8, 9 або більше сахаридів можуть бути кон„югованими з білком D. У цьому аспекті білок D може такоє бути присутнім як вільний білок. Вакцина згідно з даним винаходом включає два або більше різних типів білка носія. Кожний тип білка носія може діяти як носій для більше одного сахариду, де сахариди можуть бути однаковими або різними. Наприклад, серотипи 3 та 4 можуть бути кон„югованими з тим самим білком носія, або з тією самою молекулою білка носія або з різними молекулами того самого білка носія. В одному втіленні два або більше різні сахариди можуть бути кон„югованими з тим самим білком носія, або з тією самою молекулою білка носія або з різними молекулами того самого білка носія. Кожний капсулярний сахарид Streptococcus pneumoniae може бути кон„югованим з білком носія, незалежно вибраним з групи, яка складається з TT, DT, CRM197, фрагменту C TT, PhtD, PhtDE злитими білками (зокрема з тими, що є описаними у WO 01/98334 та WO 03/54007), знешкодженим пневмолізином та білком D, сахаридами, відмінними від таких із серотипу 19F, який завжди є кон„югованим з DT або CRM 197, бажано DT. Більш повний список білків носіїв, що можуть використовуватися у кон„югатах згідно з винаходом, представлений нижче. Якщо білок носія є таким самим для 2 або більше сахаридів у композиції, то сахариди можуть бути кон„югованими з тією самою молекулою білка носія (молекула, що має більш 2 різних сахаридів, кон„югованих з нею) [див., наприклад, WO 04/083251]. Aльтернативно, сахариди можуть кожний бути окремо кон„югованим з різними молекулами білка носія (кожна молекула білка носія має тільки один тип сахариду, що є кон„югованим з нею). 3 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 Білок носія, кон„югований з одним або більше капсулярними сахаридами S. pneumoniae у кон„югатах, що є присутніми в імуногенних композиціях згідно з винаходом, є необов„язково членом білків родини полігістидинових триад (Pht), їх фрагментів або здитих білків PhtA, PhtB, PhtD або PhtE білки можуть мати аімнокислотну послідовність, що є на 80%, 85%, 90%, 95%, 98%, 99% або 100% ідентичною послідовності, розкритій в WO 00/37105 або WO 00/39299 (наприклад, з амінокислотною послідовністю 1-838 або 21-838 SEQ ID NO: 4 згідно з WO 00/37105 для PhtD). Наприклад, злиті білки складаються з послідовностей повної довжини або фрагментів 2, 3 або 4 PhtA, PhtB, PhtD, PhtE. Приклади злитих білків являють собою PhtA/B, PhtA/D, PhtA/E, PhtB/A, PhtB/D, PhtB/E. PhtD/A. PhtD/B, PhtD/E, PhtE/A, PhtE/B та PhtE/D, де ці білки є зв„язаними з першим згаданим на N-термінальному кінці (див. наприклад, WO01/98334). Коли використовуються фрагменти Pht білків (окремо або як частина злитого білка), кожний фрагмент необов„язково містить один або більше фрагментів гістидинових триад та/або ділянки подвійної спіралі таких поліпептидів. фрагмент гістидинових триад являє собою частину поліпептиду, що має послідовність HxxHxH де H являє собою гістидин, та x є амінокислотою, відмінною від гістидину. Ділянка подвійної спіралі є ділянкою, яка передбачається як "Сoils" алгоритм Lupus, A та ін. (1991) Science 252; 1162-1164. В одному втіленні цей або кожний фрагмент включає один або більше мотивів гістидинових триад, а також принаймні одну ділянку з подвійною спіраллю. В одному втіленні цей або кожний фрагмент містить точно або принаймні 2, 3, 4 або 5 мотиви гістидинових триад (необов„язково, з нативною послідовністю Pht між 2 або більше триадами або інтратриадну послідовність, що є більше, ніж на 50, 60, 70, 80, 90 або 100 % ідентичною нативній пневмококовій інтратриадній Pht послідовності - наприклад, інтратриадній послідовності, показаній у SEQ ID NO: 4 WO 00/37105 для PhtD). В одному втіленні цей або кожний фрагмент містить точно або принаймні 2, 3 або 4 ділянки з подвійною спіраллю. В одному втіленні Pht білок, розкритий в даній заявці, включає білок повної довжини з приєднаною сигнальною послідовністю, зрілий білок повної довжини з видаленим сигнальним пептидом (наприклад, 20 амінокислот на N-термінальному кінці), існуючі в природі варіанти Pht білка та імуногенні фрагменти Pht білка (наприклад, фрагменти, як описано вище, або поліпептиди, що включають принаймні 15 або 20 суміжних амінокислот з амінокислотної послідовності у WO00/37105 або WO00/39299, де вказаний поліпептид є здатним викликати імунну відповідь, специфічну для даної амінокислотної послідовності у WO00/37105 або WO00/39299). Зокрема, термін "PhtD", як використовується в даній заявці, включає білок повної довжини з приєднаною сигнальною послідовністю, зрілий білок повної довжини з видаленим сигнальним пептидом (наприклад, 20 амінокислот на N-термінальному кінці), існуючі в природі варіанти PhtD білка та імуногенні фрагменти PhtD білка (наприклад, фрагменти, як описано вище, або поліпептиди, що включають принаймні 15 або 20 суміжних амінокислот з амінокислотної послідовності PhtD у WO00/37105 або WO00/39299, де вказаний поліпептид є здатним викликати імунну відповідь, специфічну для даної амінокислотної послідовності у WO00/37105 або WO00/39299 (наприклад, SEQ ID NO: 4 WO 00/37105 для PhtD). Якщо білок носія є таким самим для 2 або більше сахаридів у композиції, сахариди можуть бути кон„югованими з тією самою молекулою білка носія (молекули носія, що мають більше 2 різних сахаридів, кон„югованих з нею) [див. наприклад, WO 04/083251]. Альтернативно, сахариди можуть кожний бути окремо кон„югованим з різними молекулами білка носія (кожна молекула білка носія, що має тільки один тип сахариду кон„югованого з нею). Приклади білків носія, які можуть використовуватися в даному винаході, являють собою DT (дифтерійний токсоїд), TT (токсоїд правця) або фрагмент C TT, DT CRM197 (DT мутант) інші точкові мутанти DT, такі як CRM176, CRM228, CRM 45 (Uchida та ін. J. Biol. Chem. 218; 38383844, 1973); CRM 9, CRM 45, CRM102, CRM 103 та CRM107 та інші мутації, описані Nicholls та Youle у Genetically Engineered Toxins, Ed: Frankel, Maecel Dekker Inc, 1992; делеції та мутації Glu-148 на Asp, Gln або Ser та/або Ala 158 на Gly та інші мутації, розкриті в US 4709017 або US 4950740; мутацію принаймні одного або більше залишків Lys 516, Lys 526, Phe 530 та/або Lys 534 та інші мутації, розкриті в US 5917017 або US 6455673; або фрагмент розкритий в US 5843711, пневмококовий пневмолізин (Kuo та ін. (1995) Infect Immun 63; 2706-13) включаючи ply, знешкоджений певним чином, наприклад dPLY-GMBS (WO 04081515, PCT/EP2005/010258) або dPLY-формол, PhtX, включаючи PhtA, PhtB, PhtD, PhtE та злиті Pht білки, наприклад PhtDE злиті білки, PhtBE злиті білки (WO 01/98334 та WO 03/54007), (Pht A-E є описаними більш детально нижче) OMPC (менінгококовий зовнішній білок, що звичайно екстрагується з N. meningitidis серогрупи B - EP0372501), PorB (з N. meningitidis), PD (білок D Haemophilus influenzae - див. , наприклад, EP 0 594 610 B) або їх імунологічно функціональні еквіваленти, синтетичні пептиди (EP0378881, EP0427347), білки теплового шоку (WO 93/17712, WO 4 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 94/03208), білки коклюшу (WO 98/58668, EP0471177), цитокіни, лімфокіни, ростові фактори або гормони (WO 91/01146), штучні білки, що включають численні CD4+ T-клітинні епітопи, що походять від антигенів різноманітних патогенів (Falugi та ін. (2001) Eur J Immunol 31; 3816-3824), такі, як N19 білок (Baraldoi та ін. (2004) Infect Immun 72; 4884-7), пневмококові поверхневі білки PspA (WO 02/091998), білки поглинання заліза (WO 01/72337), токсин A або B C. difficile (WO 00/61761). Nurkka та ін. Pediatric Infectious Disease Journal. 23(11): 1008-14, 2004 Nov. описали 11валентну пневмококову вакцину з усіма серотипами, кон„югованими з PD. Проте автори даного винаходу показали, що опсонофагоцитарна активність може бути поліпшена для антитіл, індукованих при використанні кон„югатів, що містять 19F, кон„югований з DT, у порівнянні з 19F, кон„югованим з PD. Крім того, автори даного винаходу показали, що більша реактивність до 19A спостерігається з 19F, кон„югованим з DT. Таким чином ознакою композиції згідно з даним винаходом є те, що серотип 19F є кон„югованим з DT або CRM 197. В одному аспекті серотип 19F є кон„югованим з DT. Інші сахаридні серотипи імуногенної композиції можуть усі бути кон„югованими з один або більше білками носія, які не являють собою DT (тобто тільки 19F є кон„югованим з DT) або можуть бути розділені одним або більше білками носія, які не є DT та DT самі по собі. В одному втіленні 19F є кон„югованим з DT або CRM 197, а усі інші серотипи є кон„югованими з PD. У додатковому втіленні 19F є кон„югованим з DT або CRM 197, та інші серотипи є розділеними між PD та TT або DT, або CRM 197. У додатковому втіленні 19F є кон„югованим з DT або CRM 197 та не більше, ніж один сахарид є кон„югованим з TT. В одному аспекті цього втілення, вказаний один сахарид являє собою18C або 12F. У додатковому втіленні 19F є кон„югованим з DT або CRM 197 та не більше ніж два сахариди є кон„югованими з TT. У додатковому втіленні 19F є кон„югованим з DT або CRM 197, та інші серотипи є розділеними між PD, TT та DT або CRM 197. У додатковому втіленні 19F є кон„югованим з DT або CRM 197, а інші серотипи є розділеними між PD, TT та пневмолізином. У додатковому втіленні 19F є кон„югованим з DT або CRM 197, а інші серотипи є розділеними між PD, TT та CRM 197. У додатковому втіленні 19F є кон„югованим з DT або CRM197, та інші серотипи є розділеними між PD, TT, пневмолізином та необов„язково PhtD або PhtD/E злитим білком. У додатковому втіленні 19F є кон„югованим з DT або CRM197, 19A є кон„югованим з пневмолізином або TT, один (два або три) додатковий(і) сахарид(и) є кон„югованим(и) з TT, один додатковий сахарид є кон„югованим з PhtD або PhtD/E, та усі додаткові сахариди є кон„югованими з PD. У додатковому втіленні 19F є кон„югованим з DT або CRM197, 19A є кон„югованим з пневмолізином, один (два або три) додатковий(і) сахарид(и) є кон„югованим(и) з TT, один додатковий сахарид є кон„югованим з пневмолізином, 2 додаткові сахариди є кон„югованими з PhtD або PhtD/E, та усі додаткові сахариди є кон„югованими з PD. В одному втіленні імуногенна композиція згідно з винаходом включає білок D з Haemophilus influenzae. У цьому втіленні, якщо PD не є одним з білків носія, що використовуються для кон„югації будб-якого сахариду, відмінного від 19F, наприклад 19F, є кон„югованим з DT, у той час інші серотипи є кон„югованими з один або більше різними білками носія, які не є PD, то PD буде пристунім у вакцинній композиції як вільний білок. Якщо PD є одним з білків носія, що використовуються для кон„югації будб-якого сахариду, відмінного від 19F, то PD може необов„язково бути присутнім у вакцинній композиції як вільний білок . Термін "сахарид" у даному описі може позначати полісахарид або олігосахарид та включає обидва. Полісахариди ізолюють з бактерії, вони можуть до деякої міри бути зменшені за розмірами за допомогою відомих способів (див., наприклад, EP497524 та EP497525) та бажано шляхом мікропсевдозрідження. Полісахариди можуть бути зменшені за розмірами для того, щоб знизити в„язкість у полісахаридних зразках та/або для поліпшення здатності до фільтрації кон„югованих продуктів. Олігосахариди мають нижчу кількість повторюваних одиниць (типово 530 повторюваних одиниць) та представляють собою типово гідролізовані полісахариди. Капсулярні полісахариди Streptococcus pneumoniae включають повторювані олігосахаридні одиниці, які можуть містити аж до 8 цукрових залишків. Для огляду олігосахаридних одиниць для ключових серотипів Streptococcus pneumoniae див. JONES, Christopher. Vaccines based on the cell surface carbohydrates of pathogenic bacteria. An. Acad. Bras. Cienc, June 2005, vol. 77, no.2, p.293-324. ISSN 0001-3765. В одному втіленні капсулярний сахаридний антиген може бути полісахаридом повної довжини, проте в інших він може бути однією олігосахаридною одиницею або мати коротший за сахарид нативної довжини ланцюг повторюваних олігосахаридних одиниць. В одному втіленні усі сахариди, що є присутніми у вакцині, являють собою полісахариди. Полісахариди повної довжини можуть бути "калібровані (зменшені за розмірами)", тобто їх розмір може бути зменшений за допомогою різних способів, таких як гідролізна обробка, обробка пероксидом водню, калібрування за розмірами при використанні 5 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 Еmulsiflex®, після чого проводять обробку пероксидом водню для одержання олігосахаридних фрагментів або мікропсевдозрідження. Автор також помітили, що область техніки було сфокусовано на застосуванні олігосахаридів для полегшення одержання кон„югатів. Автори також виявили, що при використанні нативних або трохи зменшених за розмірами полісахаридних кон„югатів, може бути реалізована одна або більше наступних переваг: 1) кон„югат, що має високу імуногенність є здатним до фільтрації, 2) співвідношення полісахариду до білка in the conjugate може бути зміненим так, що полісахариду до білка (ваг/ваг) у кон„югаті може бути підвищене (що має вплив на ефект супресії носія), 3) імуногенні кон„югати, схильні до гідролізу, можуть бути стабілізовані при використанні більш великих сахаридів для кон„югації. Застосування більш великих полісахаридів може приводити до посиленого поперечного зв„язування з носієм кон„югату та може знижувати вивільнення вільного сахариду з кон„югату. Кон„югатні вакцини, описані в області техніки, як правило піддають деполімеризації полісахаридів перед кон„югацією для того, щоб поліпшити кон„югацію. Автори даного винаходу виявили, що сахаридні кон„югатні вакцини, що зберігають більш великий розмір сахариду, можуть забезпечувати кращу імунну відповідь проти пневмококового захворювання. Імуногенна композиція згідно з винаходом може, таким чином, включаюти один або більше сахаридних кон„югатів де середній розмір (наприклад, середня молекулярна вага; Mw) кожного сахариду до кон„югації складає більше 80 кДа, 100 кДа, 200 кДа, 300 кДа, 400 кДа, 500 кДа або 1000 кДа. В одному втіленні один або більше сахаридних кон„югатів згідно з винаходом будуть мати середній розмір сахариду до кон„югації 50-1600, 80-1400, 100-1000, 150-500 або 200-400 кДа (слід зазначити, що де середній розмір являє собою Mw, „кДа' одиниці будуть замінюватися 3 у даній заявці на 'x10 '). В одному втіленні кон„югат після кон„югації буде легко фільтруватися через фільтр 0,2 мікрона, так, що після фільтрації одержують вихід 50, 60, 70, 80, 90 або 95% у порівнянні із зразком до фільтрації. Для цілей даного винаходу "нативний полісахарид" відноситься до сахариду, який не піддавався процесу (наприклад, подальшій очистці), метою якого є зменшити розмір сахариду. Полісахарид може бути трохи зменшеним за розмірами під час звичайних процедур очистки. Такий сахарид все ще залишається нативним. Тільки якщо полісахарид піддавався процедурам зміни розміру, тоді полісахарид не буде вважатися нативним. Для цілей даного винаходу "калібрований за розміром з коефіцієнтом аж до x2" означає, що сахарид піддається процесу, призначеному для зменшення розміру полісахариду, але зберігається розмір, більший, ніж половина розміру нативного полісахариду. X3, х4, тощо інтерпретуються таким самим чином, тобто сахарид піддається процесу, призначеному для зменшення розміру полісахариду, але зберігається розмір, більший, ніж третина, четверта частина розміру нативного полісахариду. В аспекті згідно з винаходом імуногенна композиція включає сахариди Streptococcus pneumoniae з принаймні 10 серотипів, кон„югованих з білком носія, де принаймні 1, 2, 3, 4, 5, 6, 7, 8, 9 або кожний сахарид S. pneumoniae є нативним полісахаридом. В одному аспекті згідно з винаходом імуногенна композиція включає сахариди Streptococcus pneumoniae з принаймні 10 серотипів, кон„югованих з білком носія, де принаймні 1, 2, 3, 4, 5, 6, 7, 8, 9 або кожний сахарид S. pneumoniae є каліброваним за розміром з коефіцієнтом x2, x3, x4, x5, x6, x7, x8, x9 або x10. В одному втіленні цього аспекту більшість сахаридів, наприклад, 6, 7, 8 або більше сахаридів є каліброваними за розміром з коефіцієнтом аж до x2, x3, x4, x5, x6, x7, x8, x9 або x 10. Молекулярна вага та середня молекулярна вага (або розмір) сахариду в даній заявці відноситься до середньовагової молекулярної маси (Mw) сахариду, що вимірюється до кон„югації та вимірюється за допомогою MALLS. MALLS технологія є добре відомою в області техніки та її типово проводять так, як описано у Прикладі 2. Для MALLS аналізу пневмококових сахаридів можуть використовуватися дві колонки (TSKG6000 та 5000PWxl) у комбінації, а сахариди вимиваються у воді. Сахариди визначають при використанні детектора розсіювання світла (наприклад, Wyatt Dawn DSP, оснащеного 10 mW аргоновим лазером 488 нм) та інтерферометричного рефрактометра (наприклад, Wyatt Otilab DSP, оснащеного P100 камерою та червоним фільтром 498 нм). В одному втіленні сахариди S. pneumoniae є нативними полісахаридами або нативними полісахаридами, які можуть бути зменшеними за розмірами під час нормального процесу екстракції. В одному втіленні сахариди S. pneumoniae є каліброваними за розмірами при використанні механічного розщеплення, наприклад, за допомогою мікропсевдозрідження або обробки ультразвуком. Мікропсевдозрідження та обробка ультразвуком мають перевагу у зменшенні 6 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 розміру більш великих нативних полісахаридів у достатній мірі для того, щоб забезпечити одержання здатного до фільтрації кон„югату. Калібрування за розміром є таким, що має коефіцієнт, не більший за x20, x10, x8, x6, x5, x4, x3 або x2. В одному втіленні імуногенна композиція включає кон„югати S. pneumonia, які є приготовленими із суміші нативних полісахаридів та сахаридів, що є каліброваними за розмірами з коефіцієнтом не більше х20. В одному аспекті більшість сахаридів, наприклад, 6, 7, 8 або більше сахаридів є каліброваними за розміром з коефіцієнтом аж до х2, х3, х4, х5 або х6. В одному втіленні сахарид Streptococcus pneumoniae є кон„югованим з білком носія через лінкер, наприклад, біфункціональний лінкер. Лінкер є необов„язково гетерофункціональним або гомофункціональним, та має, наприклад, реактивну аміногрупу та реактивну групу карбонової кислоти, 2 реактивні аміногрупи або дві реактивні групи карбонової кислоти. Лінкер містить, наприклад, від 4 до 20, від 4 до 12, від 5 до 10 атомів вуглецю. Можливий лінкер являє собою ADH. Інші лінкери включають B-пропіонамідо (WO 00/10599), нітрофенілетиламін (Gever та ін. (1979) Med. Microbiol. Immunol. 165; 171-288), галоалкілгаліди (US4057685), глікозидні зв„язки (US4673574, US4808700), гександіамін та 6-амінокапронову кислоту (US4459286). В одному втіленні ADH використовується як лінкер для кон„югації сахариду серотипу 18C. В одному втіленні ADH використовується як лінкер для кон„югації сахариду серотипу 22F. Сахаридні кон„югати, присутні в імуногенних композиціях згідно з винаходом, можуть бути одержані за допомогою відомих методик злиття. Спосіб кон„югації може базуватися на активації сахариду за допомогою 1-ціано-4-диметиламіно піридинію тетрафторборату (CDAP) з утворенням ціанатного естеру. Активований сахарид може, таким чином, сполучатися безпосередньо або через спейсерну (лінкерну) групу з аміногрупою на білку носія. Наприклад, спейсер може являти собою цистамін або цистеамін, що забезпечує утворення тіолованого полісахариду, який може бути злитий з носієм через тіоефірний зв„язок, який одержують в результаті реакції з малеїмід-активованим білком носія (наприклад, при використанні GMBS) або з гомоацетилованим білком носія (наприклад, при використанні йодацетаміду [наприклад, етилйодацетаміду HCI] або N-сукцинімідилбромацетатбромацетату або SIAB або SIA або SBAP). Бажано, коли ціанатний естер (необов„язково, одержаний за допомогою хімічної реакції при використанні CDAP хімії) сполучають з гександіаміном або ADH, та амінодериватизований сахарид кон„югують з білком носія при використанні хімічного зв„язку карбодііміду (наприклад, EDAC або EDC) за допомогою карбоксильної групи на білковому носії. Такі кон„югати описуються в опублікованій заявці PCT WO 93/15760 Uniformed Services University, WO 95/08348 та WO 96/29094. Інші прийнятні методики використовують карбіініди, гідразиди, активні естери, норборан, пнітробензойну кислоту, N-гідроксисукцинімід. Багато з них є описаними в WO 98/42721. Кон„югація може втягувати карбонільний лінкер, який може утворюватися шляхом реакції вільної гідроксильної групи сахариду з CDI (Bethell та ін. J. Biol. Chem. 1979, 254; 2572-4, Hearn та ін. J. Chromatogr. 1981. 218; 509-18), після чого проводять реакцію з білком для одержання карбаматного зв„язку. Це може передбачати відновлення аномерного кінця до первинної гідроксильної групи, необов„язкову реакцію захисту/зняття захисту з первинної гідроксильної групи за допомогою CDI з утворенням CDI карбаматної проміжної сполуки та злиттям CDI карбаматної проміжної сполуки з аміногрупою на білку. Кон„югати можуть також бути одержані при використанні методик безпосереднього відновного амінування, як описано в US 4365170 (Jennings) та US 4673574 (Anderson). Інші способи є описаними в EP-0-161-188, EP-208375 та EP-0-477508. Додатковий спосіб втягує злиття активованого за допомогою ціаногенброміду (або CDAP) сахариду, дериватизованого при використанні гідразиду адипінової кислоти (ADH), з білком носія шляхом карбодіімідної конденсації (Chu C. та ін. Infect. Immunity, 1983 245 256), наприклад, при використанні EDAC. В одному втіленні гідроксильна група (необов„язково активована гідроксильна група, наприклад, гідроксильна група, активована ціанатним естером) на сахариді зв„язується з аміногрупою або карбоксильною групою на білку, або безпосередньо або опосередковано (за допомогою лінкера). Коли є наявним лінкер, то гідроксильна група на сахариді необов„язково зв„язується з аміногрупою на лінкері, наприклад, за допомогою CDAP кон„югації. Додаткова аміногрупа у лінкері (наприклад, ADH) може бути кон„югована з групою карбонової кислоти на білку, наприклад, при використанні карбодіімідного зв„язку, наприклад, при використанні EDAC. В одному втіленні Hib або капсулярний(і) сахарид(и) N. meningitidis (або сахарид взагалі) кон„югують з лінкером перед тим, як лінкер кон„югують з білком носія. Альтернативно, лінкер може бути кон„югованим з носієм перед кон„югацією з сахаридом. 60 7 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 В загальному випадку для злиття/кон„югації можуть використовуватися наступні типи хімічних груп на білку носія: A) Карбоксильна група (наприклад, через аспарагінову або глутамінову кислоту). В одному втіленні ця група зв„язується з аміногрупами на сахаридах безпосередньо або з аміногрупою на лінкері за допомогою карбодіімідного зв„язку, наприклад, при використанні EDAC. B) Аміногрупа (наприклад, через лізин). В одному втіленні ця група зв„язується з карбоксильними групами на сахаридах безпосередньо або з карбоксильною групою на лінкері за допомогою карбодіімідного зв„язку, наприклад, при використанні EDAC. В іншому втіленні ця група зв„язується з гідроксильними групами, активованими за допомогою CDAP або CNBr, на сахаридах безпосередньо або з такими групами на лінкері; з сахаридами або лінкерами, які мають альдегідну групу; з сахаридами або лінкерами, що мають групу сукцинімідного естеру. C) Сульфгідрильна група (наприклад, через цистеїн). В одному втіленні ця група зв„язується з бром- або хлорацетилованими сахаридами або лінкером за допомогою малеїмідного зв„язку. В одному втіленні цю групу активують/модифікують при використанні біс-діазобензидину. D) Гідроксильна група (наприклад, через тирозин). В одному втіленні цю групу активують/модифікують при використанні біс-діазобензидину. E) Імідазолільна група (наприклад, через гістидин). В одному втіленні цю групу активують/модифікують при використанні біс-діазобензидину. F) Гуанідильна група (наприклад, через аргінін). G) Iндолільна група (наприклад, через триптофан). В загальному випадку, наступні групи на сахариді можуть використовуватися для злиття: OH, COOH або NH2. Альдегідні групи можуть бути одержані після різноманітних способів обробки, відомих в області техніки, а саме: перйодат, кислотний гідроліз, пероксид водню, тощо Підходи прямого злиття: Сахарид-OH + CNBr або CDAP -----> ціанатний естер + NH2-білок ----> кон„югат Сахарид-альдегід + NH2-білок ----> Основа Шиффа + NaCNBH3 ----> кон„югат Сахарид-COOH + NH2-білок + EDAC ----> кон„югат Сахарид-NH2 + COOH-білок + EDAC ----> кон„югат Підходи опосередкованого злиття через спейсер (лінкер): Сахарид-OH + CNBr або CDAP ---> ціанатний естер + NH2----NH2 ----> сахарид----NH2 + COOH-білок + EDAC -----> кон„югат Сахарид-OH + CNBr або CDAP ----> ціанатний естер + NH2-----SH -----> сахарид----SH + SHбілок (нативний білок з незахищеним цистеїном або одержаний після модифікації аміногруп білка, наприклад, за допомогою SPDP) -----> сахарид-S-S-білок Сахарид-OH + CNBr або CDAP ---> ціанатний естер + NH2----SH -------> сахарид----SH + малеїмід-білок(модифікація аміногруп) ----> кон„югат Сахарид-COOH + EDAC + NH2-----NH2 ---> сахарид------NH2 + EDAC + COOH-білок ----> кон„югат Сахарид-COOH + EDAC+ NH2----SH -----> сахарид----SH + SH-білок (нативний білок з незахищеним цистеїном або одержаний після модифікації аміногруп білка, наприклад, за допомогою SPDP) -----> сахарид-S-S-білок Сахарид-COOH + EDAC+ NH2----SH -----> сахарид----SH + малеїмід-білок (модифікація аміногруп) ----> кон„югат Сахарид-Альдегід + NH2-----NH2 ----> сахарид---NH2 + EDAC + COOH-білок ----> кон„югат Примітка: замість EDAC, як описано вище, можна застосовувати будь-який прийнятний карбодіімід. Підсумовуючи зазначене вище, можна сказати, що типи хімічної групи білка носія, які можуть в загальному випадку використовуватися для злиття з сахаридом, являють собою аміногрупи (наприклад, на залишках лізину), COOH групи (наприклад, на залишках аспарагінової та глутамінової кислоти) та SH групи (якщо це доступно) (наприклад, на цистеїнових залишках). Бажано, коли співвідношення білка носія та сахариду S. pneumoniae знаходиться в межах від 1:5 до 5:1; наприклад, в межах 1:0,5-4:1, 1:1-3,5:1, 1,2:1-3:1, 1,5:1-2,5:1; наприклад, від 1:2 до 2,5:1; від 1:1 до 2:1 (ваг/ваг). В одному втіленні більшість кон„югатів, наприклад 6, 7, 8, 9 або більше кон„югатів мають співвідношення білка носія та сахариду, що є більшим за 1:1, наприклад 1,1:1, 1,2:1, 1,3:1, 1,4:1, 1,5:1 або 1,6:1. В одному втіленні принаймні один сахарид S. pneumoniae є кон„югованим з білком носія через лінкер при використанні CDAP та EDAC. Наприклад, 18C або 22F можуть бути кон„югованих з білком через лінкер (наприклад, такого, що має дві групи гідразино на своїх кінцях, такого, як ADH) при використанні CDAP та EDAC, як описано вище. Коли використовується лінкер, то CDAP використовується для кон„югації сахариду до лінкера, а 8 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 EDAC використовується для кон„югації лінкера до білка, або альтернативно EDAC може використовуватися спочатку для кон„югації лінкера до білка, після чого CDAP може використовуватися для кон„югації лінкера до сахариду. В загальному випадку імуногенна композиція згідно з винаходом може включати дозу кожного сахаридного кон„югату в межаї від 0,1 до 20 мкг, від 1 до 10 мкг або від 1 до 3 мкг сахариду. В одному втіленні імуногенна композиція згідно з винаходом містить кожний капсулярний сахарид S. pneumoniae при дозі в межах 0,1-20 мкг; 0,5-10 мкг; 0,5- 5 мкг або 1-3 мкг сахариду. В одному втіленні капсулярні сахариди можуть бути присутніми при різних дозуваннях, наприклад, деякі капсулярні сахариди можуть бути присутніми при дозі точно 1 мкг або деякі капсулярні сахариди можуть бути присутніми при дозі точно 3 мкг. В одному втіленні сахариди із серотипів 3, 18C та 19F (або 4, 18C та 19F) є присутніми при більш високих дозах, ніж інші сахариди. В одному аспекті цього втілення серотипи 3, 18C та 19F (або 4, 18C та 19F) є присутніми при дозах приблизно або точно 3 мкг, у той час як інші сахариди в імуногенній композиції є присутніми при дозах приблизно або точно 1 мкг. "Близько" або "приблизно" визначаються у межах 10% більше або менше данної цифри для цілей даного винаходу . В одному втіленні принаймні один з капсулярних сахаридів S. pneumoniae є безпосередньо кон„югованим з білком носія (наприклад, при використанні одного зі зв„язків, описаних вище). Бажано, коли принаймні один з капсулярних сахаридів S. pneumoniae є безпосередньо кон„югованим за допомогою CDAP. В одному втіленні більшість капсулярних сахаридів, наприклад 5, 6, 7, 8, 9 або більше є безпосередньо зв„язаними з білком носія шляхом CDAP (див. WO 95/08348 та WO 96/29094) Імуногенна композиція може включати білки Streptococcus pneumoniae, які в даній заявці називаються як білки Streptococcus pneumoniae згідно з винаходом. Такі білки може використовуватися як білки носія або можуть бути присутніми як вільні білки, або можуть бути присутніми і як білки носія, і як вільні білки. Білки Streptococcus pneumoniae згідно з винаходом є або поверхневими білками, принаймні протягом частини життєвого циклу пневмококу, або є білками, які секретуються або виділяються пневмококом. Бажано, коли білки згідно з винаходом є вибраними з наступних категорій, таких, як білки, що мають мотив LXXC сигнальної послідовності типу II (де X є будь-якою амінокислотою, наприклад з родини полігістидинових триад (PhtX)), холінзв„язувальні білки (CbpX), білки, що мають мотив сигнальної послідовності типу I (наприклад, Sp101), білки, що мають LPXTG мотив (де X є будь-якою амінокислотою, наприклад, Sp128, Sp130) та токсини (наприклад, Ply). Бажані приклади цих категорій (або мотивів) являють собою наступні білки або їх імунологічно функціональні еквіваленти. В одному втіленні імуногенна композиція згідно з винаходом включає принаймні 1 білок, вибраний з групи, яка складається з родини полігістидинових триад (PhtX), родини холінзв„язувального білка (CbpX), вкорочених варіантів CbpX, родини LytX, вкорочених варіантів LytX, химерних білків вкорочений варіант CbpX - вкорочений варіант LytX (або злиті білки), пневмолізину (Ply), PspA, PsaA, Sp128, Sp101, Sp130, Sp125 та Sp133. У додатковому втіленні імуногенна композиція включає 2 або більше білки, вибрані з групи, яка складається з родини полігістидинових триад (PhtX), родини холінзв„язувального білка (CbpX), вкорочених варіантів CbpX, родини LytX, вкорочених варіантів LytX, химерних білків вкорочений варіант CbpX - вкорочений варіант LytX (або злиті білки), пневмолізину (Ply), Sp128. Pht (полігістидинові триади) родина включає білки PhtA, PhtB, PhtD та PhtE. Родина характеризується ліпідизацією послідовності, двома доменами, відокремленими ділянкою, багатою на пролін та декількома гістидиновими триадами, що можливо є втягненими у зв„язування металів та нуклеозидів або ферментативну активність, (3-5) ділянками подвійної спірали, консервативним N-термінальним кінцем та гетерологічним C-термінальним кінцем. Вона є присутньою в усіх штамах досліджених пневмококів. Гомологічні білки також були виявлені в інших Streptococci та Neisseria. В одному втіленні згідно з винаходом Pht білок згідно з винаходом являє собою PhtD. Проте при цьому є зрозумілим, що терміни Pht A, B, D та E відносяться до білків, що мають послідовності, розкриті у посилання, наведених нижче, а також в існуючих у природі (або виготовлених людиною) їх варіантах, які мають гомологію послідовності, так, що вона є принаймні на 90% ідентичною згаданим білкам. Бажано, коли вона є принаймні на 95% ідентичною та найбільш бажано, коли вона є на 97% ідентичною. Стосовно PhtX білків, то PhtA є розкритим в WO 98/18930, та також згадується як Sp36. Як зазначено вище, цей білок з родини полігістидинових триад, що має мотив сигнальної послідовності типу II LXXC. PhtD є розкритим в WO 00/37105, та та також згадується як SpO36D. Як зазначено вище, цей білок з родини полігістидинових триад, що має мотив сигнальної 9 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності типу II LXXC. PhtB є розкритим в WO 00/37105, а також згадується як Sp036B. Інший член родини PhtB являє собою C3-розкладаючий поліпептид, як розкрито в WO 00/17370. Цей білок також належить до родини полігістидинових триад та має мотив сигнальної послідовності типу II LXXC. Переважний імунологічно функціональний еквівалент являє собою білок Sp42, розкритий в WO 98/18930. Вкорочений варіант PhtB (approximately 79 кДа) є розкритим в WO99/15675, та також вважається членом родини PhtX. PhtE є розкритим в WO00/30299 та згадується, як BVH-3. Якщо в даній заявці згадується будь-який білок Pht, то це означає, що можуть використовуватися усі імуногенні фрагменти або злиті білки Pht білка. Наприклад, посилання на PhtX включає його імуногенні фрагменти або злиті білки з будь-якого Pht білка. Посилання на PhtD або PhtB є також посиланням на PhtDE або PhtBE злитих білків, як описано, наприклад, у WO0198334. Пневмолізин являє собою мультифункціональний токсин з чіткою цитолітично (хемолітичною) активністю та активністю активації комлементу (Rubins та ін., Am . Respi. Cit Care Med, 153:1339-1346 (1996)). Цей токсин не секретується пневмококом, але він вивільняється при лізисі пневмококу під впливом аитолізину. Його ефекти включають, наприклад, стимуляцію продукції запальних цитокінів людськими моноцитами, інгібування руху війок на респіраторному епітелії людини та зниження бактеріальної активності та міграції нейтрофілів. Найбільш очевидний ефект пневмолізину полягає у лізисі клітин крові, що втягує зв„язування холестерину. Оскільки він представляє собою токсин, він потребує знешкодження (тобто нетоксичний для людини, коли забезпечується у дозуванні, прийнятному для захисту) перед введенням in vivo. Експресія та клонування пневмолізину дикого типу або нативного є відомим в області техніки. Див., наприклад, Walker та ін. (Infect Immun, 55:1184-1189 (1987)), Mitchell та ін. (Biochim Biophys Acta, 1007:67-72 (1989) та Mitchell та ін. (NAR, 18:4010 (1990)). Знешкодження ply може бути проведена хімічними методами, наприклад, шляхом піддання обробці формаліном або глутаральдегідо або шляхом комбінації обох (WO 04081515, PCT/EP2005/010258). Такі методи є добре відомими в області техніки для різних токсинів. Альтернативно, ply може бути знешкоджений генетично. Таким чином, винахід охоплює похідні пневмококового білка, які можуть бути, наприклад, мутованими білками. Термін "мутований" використовується в даній заявці для позначення молекули, яка піддається делеції, доданню або заміні однієї або більше амінокислот при використанні добре відомих методик для сайтнаправленого мутагенезу або будь-якого іншого традиційного способу. Наприклад, як описано вище, мутантний ply білок може бути змінений так, що він є біологічно неактивний, у той час, як він все ще підтримує свої імуногенні епітопи, див., наприклад, WO90/06951, Berry та ін. (Infect Immun, 67:981-985 (1999)) та WO99/03884. Як використовується в даній заявці, зрозуміло, що термін "Ply" відноситься до мутованого або знешкодженого пневмолізину, прийнятного для медичного застосування (тобто нетоксичного). Стосовно родини холінзв„зувального білка (CbpX) можна сказати, що члени цієї родини були спочатку ідентифіковані як пневмококові білки, що можуть бути очищені за допомогою холінафінної хроматографії. Усі холінзв„язувальні білки є нековалентно зв„язаними з фосфорилхоліновими залишками тейхоєвої кислоти та асоційованої з мембраною ліпотейхоєвої кислоти клітинної стінки. Структурно вони містять декілька ділянок, що є спільними для всієї родини, незважаючи на те, що точка природа цих білків (амінокислотна послідовність, довжина, тощо.) може варіювати. В загальному випадку холінзв„язувальні білки включають N-термінальну ділянку (N), ділянки консервативних повторів (R1 та/або R2), багату на пролін ділянку (P) та a консервативну ділянку зв„язування холіну (C), що складається з численних повторів та включає приблизно половину цього білка. Як використовується у заявці, термін "родина холінзв„язувального білка (CbpX)" є вибраним з групи, яка складається з холінзв„язувальних білків, як ідентифіковано у WO97/41151, PbcA, SpsA, PspC, CbpA, CbpD та CbpG. CbpA є розкритим в WO97/41151. CbpD та CbpG є розкритими в WO00/29434. PspC є розкритим в WO97/09994. PbcA є розкритим в WO98/21337.SpsA являє собою холінзв„язувальний білок, розкритий в WO 98/39450. Переважно холінзв„язувальні білки є вибраними з групи, яка складається з CbpA, PbcA, SpsA та PspC. Інше переважне втілення являє собою CbpX вкорочені варіанти, де "CbpX" визначається вище, а "вкорочений варіант" відноситься до CbpX білків, в яких відсутні 50% або більше холізв„язувальної ділянки (C). Бажано, коли у таких білках повністю відсутня холінзв„язувальна ділянка. Більш бажано, коли такий вкорочений білок не містить (i) холінзв„язувальної ділянки та (ii) частини N-термінальної половини білка, а також ще зберігає принаймні одну повторювану ділянку (R1 або R2). Більш бажано, коли вкорочений варіант містить 2 повторювані ділянки (R1 10 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 та R2). Приклади таких переважних втілень являють собою NR1xR2 та R1xR2, як проілюстровано в WO99/51266 або WO99/51188, проте інші холінзв„язувальні білки, в яких відсутня подібна холінзв„язувальна ділянка, також передбачаються об„ємом даного винаходу. Родина LytX являє собою асоційовані з мембраною білки, що пов„язані з лізисом клітин. Nтермінальний домен включає холінзв„язувальний домен(и), проте родина LytX усіх ознак, які виявлені у родині CbpA, зазначеній вище, таким чином, для даного винаходу LytX родина вважається такою, що відрізняється від родини CbpX. На відміну від родини CbpX, Cтермінальний домен містить каталітичний домен родини LytX білка. Родина включає LytA, B та C. Стосовно родини LytX слід сказати, що LytA є розкритим в Ronda та ін., Eur J Biochem, 164:621-624 (1987). LytB є розкритим в WO 98/18930, що також згадується як Sp46. LytC є також розкритим в WO 98/18930, він також називається Sp91. Бажаний член цієї родини являє собою LytC. Інше переважне втілення являє собою LytX вкорочені варіанти, де "LytX" є визначений вище, а "вкорочений варіант" відноситься до LytX білків, в яких відсутні 50% або більше холізв„язувальної ділянки. Бажано, коли у таких білках повністю відсутня холінзв„язувальна ділянка. Ще одне переважне втілення даного винаходу являє собою химерні білки вкорочений варіант CbpX-вкорочений варіант LytX (або злиті білки ). Бажано такі включають NR1xR2 (або R1xR2) CbpX та C-термінальну частину (Cterm, тобто таку, що не містить холінзв„язувальних доменів) LytX (наприклад, LytCCterm або Sp91Cterm). Більш бажано, коли CbpX є вибраним з групи, яка складається з CbpA, PbcA, SpsA та PspC. Більш бажано такий являє собою CbpA. Бажано, коли LytX являє собою LytC (що також згадується як Sp91). Інше втілення згідно з даним винаходом являє собою PspA або PsaA вкорочені варіанти, що не містять холінзв„язувального домену (C) та експресуються як злитий білок з LytX. Бажано, коли LytX являє собою LytC. Стосовно PsaA та PspA, то слід зазначити, що вони обидва є відомими з рівня техніки. Наприклад, PsaA та його трансмембранний варіант були описані Berry & Paton, Infect Immun 1996 Dec; 64(12):5255-62. PspA та його трансмембранні делеційні варіанти були розкриті, наприклад, в US 5804193, WO 92/14488 та WO 99/53940. Sp128 та Sp130 є розкритими в WO00/76540. Sp125 являє собою приклад пневмококового поверхневого білка із закріпленим на клітинній стінці фрагментом LPXTG (де X є будь-якою амінокислотою). Будь-який білок у межах цього класу пневмококового поверхневого білка з цим фрагментом був виявленим корисним у межах контексту даного винаходу, та таким чином, вважається додатковим білком згідно з винаходом. Sp125 сам по собі є розкритим в WO 98/18930, та є також відомим як ZmpB - цинкова металопротеїназа. Sp101 є розкритим в WO 98/06734 (де він мав позначення # y85993). Він характеризується сигнальною послідовністю типу I. Sp133 є розкритим в WO 98/06734 (де він мав позначення # y85992). Він також характеризується сигнальною послідовністю типу I. Приклади бажаних білкових антигенів Moraxella catarrhalis, які можуть включатися у комбінаційну вакцину (зокрема, для запобігання середнього отиту), являють собою: OMP106 [WO 97/41731 (Antex) та WO 96/34960 (PMC)]; OMP21 або його фрагменти (WO 0018910); LbpA та/або LbpB [WO 98/55606 (PMC)]; TbpA та/або TbpB [WO 97/13785 та WO 97/32980 (PMC)]; CopB [Helminen ME, та ін. (1993) Infect. Immun. 61:2003-2010]; UspA1 та/або UspA2 [WO 93/03761 (University of Texas)]; OmpCD; HasR (PCT/EP99/03824); PilQ (PCT/EP99/03823); OMP85 (PCT/EP00/01468); Iipo06 (GB 9917977,2); Iipo10 (GB 9918208,1); Iipo11 (GB 9918302,2); Iipo18 (GB 9918038,2); P6 (PCT/EP99/03038); D15 (PCT/EP99/03822); OmplAI (PCT/EP99/06781); Hly3 (PCT/EP99/03257); та OmpE. Приклади нетипованих антигенів Haemophilus influenzae або їх фрагментів, які можуть включатися у комбінаційну вакцину (зокрема, для запобігання середнього отиту), включають: фімбриновий білок [(US 5766608 - Ohio State Research Foundation)] та злиті білки, що включає його пептиди [наприклад, злиті білки LB1(f) пептиду; US 5843464 (OSU) або WO 99/64067]; OMP26 [WO 97/01638 (Cortecs)]; P6 [EP 281673 (State University of New York)]; TbpA та/або TbpB; Hia; Hsf; Hin47; Hif; Hmw1; Hmw2; Hmw3; Hmw4; Hap; D15 (WO 94/12641); P2 та P5 (WO 94/26304). Білки згідно з винаходом можуть також бути вигідним чином поєднані. Під поєднанням розуміють, що імуногенна композиція включає білки з наступних комбінацій, або як білки носія, або як вільні білки або суміш цих двох. Наприклад, у комбінації двох білків, як представлено в даній заявці нижче, обидва білки можуть використовуватися як білки носія або обидва білки можуть бути присутніми як вільні білки, або обидва можуть бути присутніми як носій та як вільний білок, або один може бути присутнім як білок носія та вільний білок, у той час, як інший є присутнім тільки як білок носія або тільки як вільний білок, або один може бути присутнім як білок носія, а інший - як вільний білок. Коли представлена комбінація трьох білків, то існують 11 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 подібні можливості. Бажані комбінації включають, але не обмежені такими, як PhtD + NR1xR2, PhtD + NR1xR2-Sp91Cterm химерні або злиті білки, PhtD + Ply, PhtD + Sp128, PhtD + PsaA, PhtD + PspA, PhtA + NR1xR2, PhtA + NR1xR2-Sp91Cterm химерні або злиті білки, PhtA + Ply, PhtA + Sp128, PhtA + PsaA, PhtA + PspA, NR1xR2 + LytC, NR1xR2 + PspA, NR1xR2 + PsaA, NR1xR2 + Sp128, R1xR2 + LytC, R1xR2 + PspA, R1xR2 + PsaA, R1xR2 + Sp128, R1xR2 + PhtD, R1xR2 + PhtA. Бажано, коли NR1xR2 (або R1xR2) є таким з CbpA або PspC. Більш бажано, коли такий являє собою CbpA. Інші комбінації включають 3 білки, такі, як PhtD + NR1xR2 + Ply та PhtA + NR1xR2 + PhtD. В одному втіленні вакцинна композиція включає знешкоджений пневмолізин та PhtD або PhtDE як білки носія. У додатковому втіленні вакцинна композиція включає знешкоджений пневмолізин та PhtD або PhtDE як вільні білки. Даний винахід додатково забезпечує вакцину, що містить імуногенні композиції згідно з винаходом та фармацевтично прийнятний наповнювач. Вакцини згідно з даним винаходом можуть містити ад„ювант, зокрема, коли призначеня для застосування у популяції людей похилого віку, але також і для застосування у популяції немовлят. Прийнятні ад„юванти включають солі алюмінію, такі, як гель гідроокису алюмінію або фосфат алюмінію або галуни, але можуть також бути представлені кальцієм, магнієм, залізом або цинком або можуть бути нерозчинною суспензією ацилованого тирозину або ацилованих цукрів, катіонно або аніонно дериватизованими сахаридами, або поліфосфазенами. Є бажаним, коли ад„ювант був вибраним як такий, що є переважним індуктором відповіді TH1 типу. Такі високі рівні цитокінів Th1-типу мають тенденцію до сприятливої індукції опосередкованих клітинами відповідей на данний антиген, у той час, як високі рівні цитокінів Th2-типу мають тенденцію до сприятливої індукції гуморальних імунних відповідей на антиген. Відмінність імунної відповіді Th1 та Th2-типу не є абсолютною. На практиці індивідуум буде підтримувати імунну відповідь, яка описується як така, що є переважно Th1 або переважно Th2. Проте часто є зручним розглядати родини цитокінів стосовно того, як вони описані у мишачих CD4 +ve клонах T-клітин Mosmann та Coffman (Mosmann, T.R. та Coffman, R.L. (1989) TH1 та TH2 клітини: різні моелі секреції цитокінів приводять до різних функціональних властивостей. (Annual Review of Immunology, 7, p145-173). Традиційно відповіді Th1-типу є асоційованими з продукцією INF-y та IL-2 цитокінів T-лімфоцитами. Інші цитокіни, що часто безпосередньо асоціюються з імунними відповідями Th1-типу, не продукуються T-клітинами, такими, як IL-12. На відміну від цього відповіді Th2-типу асоціюються із секрецією IL4, IL-5, IL-6, IL-10.Прийнятні ад„ювантні системи, які сприяють переважній Th1 відповіді, включають: монофосфорил ліпід A або його похідні, зокрема, 3-де-O-ацилований монофосфорил ліпід A (3D-MPL) (для його приготування див. GB 2220211 A); та комбінацію монофосфорил ліпіду A, бажано 3-де-Oацилований монофосфорил ліпід A, або разом із сіллю алюмінію (наприклад, фосфатом алюмінію або гідроокислом алюмінію) або з емульсією олію-у-воді. У таких комбінаціях антиген та 3D-MPL містяться у тих самих окремих структурах, що дозволяє проводити більш ефективну доставку антигенних та імуностимуляторних сигналів. Дослідження показали, що 3D-MPL є здатним до додаткового підвищення імуногенності адсорбованого на алюмінію антигену [Thoelen та ін. Vaccine (1998) 16:708-14; EP689454-B1]. Поліпшена система втягує комбінацію монофосфорил ліпіду A та похідної сапоніну, зокрема, комбінацію QS21 та 3D-MPL, як розкрито в WO 94/00153, або менш реактогенну композицію, де QS21 пригнічується холестерином, як розкрито в WO 96/33739. Зокрема, потужна ад„ювантна композиція, яка включає QS21, 3D-MPL татокоферол в емульсії масло-у-воді, описується у WO 95/17210. В одному втіленні імуногенна композиція додатково включає сапонін, який може являти собою QS21. Композиція може також включати емульсію масло-у-воді та токоферол (WO 95/17210). Олігонуклеотиди, що містять неметилований CpG (WO 96/02555), та інші імуномодуляторні олігонуклеотиди (WO0226757 та WO03507822) є також бажаними індукторами TH1 відповіді та є прийнятними для застосування у даному винаході. Особливими ад„ювантами є ті, що вибрані з групи солей металів, емульсій масло-у-воді, агоністів Toll-подібних рецепторів, (зокрема, агоніст Toll-подібного рецептора 2, агоніст Tollподібного рецептора 3, агоніст Toll-подібного рецептора 4, агоніст Toll-подібного рецептора 7, агоніст Toll-подібного рецептора 8 та агоніст Toll-подібного рецептора 9), сапонінів та їх комбінацій. Ад„ювант, що може використовуватися з вакцинними композиціями згідно з винаходом є блеб або препарати везикул зовнішньої мембрани з Грам-негативних бактеріальних штамів, такі, як описані у WO02/09746, зокрема, блеби N. meningitidis. Ад„ювантні властивості блебів можуть бути поліпшені шляхом збереження LOS (ліпополісахаридівe) на їх поверхні (наприклад, за допомогою екстракції при використанні низьких концентрацій детергенту [наприклад, 0-0,1% дезоксихолат]). LOS можуть бути знешкоджені шляхом msbB(-) або htrB(-) мутацій, що 12 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 обговорюються у WO02/09746. Ад„ювантні властивості можуть бути також поліпшені шляхом збереження PorB (та необов„язково шляхом видалення PorA) з менінгококових блебів. Ад„ювантні властивості можуть також бути поліпшені шляхом вкорочення структури зовнішнього каркасного сахариду LOS на менінгококових блебах, наприклад за допомогою IgtB(-) мутації, що обговорюється у WO2004/014417. Альтернативно, згадані вище LOS (наприклад, ізольовані з msbB(-) та/або IgtB(-) штаму) можуть бути очищені та використані як ад„ювант у композиціях згідно з винаходом. Додатковий ад„ювант, який може використовуватися з композиціями згідно з винаходом, може бути вибраним з групи: сапонін, ліпід A або його похідні, імуностимуляторний олігонуклеотид, алкілглюкозамінідфосфат, емульсія масло-у-воді або їх комбінації. Додатковий бажаний ад„ювант являє собою сіль металу у комбінації з іншим ад„ювантом. Є бажаним, коли ад„ювант є агоністом Toll-подібного рецептора, зокрема, агоністом Toll-подібного рецептора 2, 3, 4, 7, 8 або 9, або сапонін, зокрема, Qs21. Такоє є бажаним, коли ад„ювантна система включає два або більше ад„юванти з приведеного вище списку. Зокрема, комбінації бажано містять сапоніновий (зокрема, Qs21) ад„ювант та/або агоніст Toll-подібного рецептора 9, такий, як CpG, що містить імуностимуляторний олігонуклеотид. Інші переважні комбінації включають сапонін (зокрема, QS21) та агоніст Toll-подібного рецептора 4, такий, як монофосфорил ліпід A або його 3 деациловану похідну, 3D- MPL або сапонін (зокрема, QS21) та ліганд Toll-подібного рецептора 4, такий, як алкілглюкозамінідфосфат. Зокрема, бажаними ад„ювантами є комбінації 3D-MPL та QS21 (EP 0 671 948 B1), емульсії масло-у-воді, що включають 3D-MPL та QS21 (WO 95/17210, WO 98/56414) або 3D-MPL, рецептований з іншими носіями (EP 0 689 454 B1). інші бажані ад„ювантні системи включають комбінацію 3D-MPL, QS21 та CpG олігонуклеотиду, як описано в US6558670, US6544518. В одному втіленні ад„ювант являє собою (або включає) ліганд Toll-подібного рецептора (TLR) 4, бажано агоніст, такий, як похідна ліпіду A, зокрема, монофосфорил ліпід A або більш бажано 3-деацилований монофосфорил ліпід A (3D- MPL). 3D-MPL є доступним від GlaxoSmithKline Biologicals North America та в першу чергу поліпшує CD4+ T-клітинні відповіді з IFN-g (Th1) фенотипом. Він може бути одержаний згідно зі способами, розкритими в GB 2 220 211 A. Хімічно це є сумішшю 3-деацилованого монофосфорил ліпіду A з 3, 4, 5 або 6 ацилованими ланцюгами. Бажано використовувати у композиціях згідно з даним винаходом маленькі частинки 3D- MPL. Маленькі частинки 3D-MPL мають такий розмір частинок, що вони можуть стерильно фільтруватися через фільтр 0,22 мкм. Такі препарати є описаними у міжнародній патентній заявці WO 94/21292. Синтетичні похідні ліпіду A є відомими та, як передбачається, є TLR 4 агоністами. Такі включають, але без обмеження: OM174 (2-дезокси-6-o-[2-дезокси-2-[(R)-3-додеканоїлокситетра-деканоїламіно]-4-oфосфоно-β-D-глюкопіранозил]-2-[(R)-3-гідрокситетрадеканоїламіно]-α-Dглюкопіранозилдигідрофосфат), (WO 95/14026) OM 294 DP (3S,9R) -3-[(R)-додеканоїлокситетрадеканоїламіно]-4-оксо-5-аза-9(R)-[(R)-3гідрокситетрадеканоїламіно]декан-1,10-діол,1,10-біс{дигідроoфосфат) (WO99 /64301 та WO 00/0462 ) OM 197 MP-Ac DP (3S-,9R)-3-[(R)-додеканоїлокситетрадеканоїламіно]-4-оксо-5-аза-9-[(R)-3гідрокситетрадеканоїламіно]декан-1,10-діол,1-дигідроoфосфат 10-(6-аміногексаноат) (WO 01/46127) Інші TLR4 ліганди, які можуть використовуватися, являють собою алкілглюкозамінідфосфати (AGP), такі, як ті, що розкриті в WO9850399 або US6303347 (способи для одержання AGP є також розкритими) або ѐфармацевтично прийнятні солі AGP, як розкрито в US6764840. Деякі AGP є TLR4 агоністами, та деякі є TLR4 антагоністами. Обидва, як передбачається, є корисними як ад„юванти. Інший бажаний імуностимулятор для застосування в даному винаході являє собою Quil A та його похідні. Quil A є препаратом сапоніну, ізольованим з південно-американського дерева Quilaja Saponaria Molina, та був вперше описаний як такий, що володіє ад„ювантною активністю Dalsgaard та ін. у 1974 ("Saponin adjuvants", Archiv. fur die gesamte Virusforschung, Vol. 44, Springer Verlag, Berlin, p243-254). Очищені фрагменти Quil A були ізольовані шляхом ВЕРХ , що зберігає ад„ювантну активність без токсичності, асоційованої з Quil A (EP 0 362 278), наприклад, QS7 та QS21 (що є також відомими як QA7 та QA21). QS-21 є природним сапоніном, що одержаний з кори Quillaja saponaria Molina, він індукує CD8+ цитотоксичність T клітин (CTL), Th1 кілтин та переважну відповідь ІgG2a антитіла, а також є переважним сапоніном у контексті даного винаходу. 13 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 Були описані окремі композиції QS21, які, зокрема, додатково включають стерин (WO96/33739). Сапоніни, що утворюють частину згідно з даним винаходом, можуть бути відокремлені у формі міцел, змішаних міцел, (переважно, але не виключно з солями жовчних кислот) або можуть бути у формі ISCOM матриць (EP 0 109 942 B1), ліпосоми або споріднені колоїдні структури, такі, як червоподібні або кільцеподібні мультимерні комплекси або ліпідні/шаруваті структури та ламели, коли рецептуються з холестерином та ліпідом, або у формі емульсії масло-у-воді (наприклад, як у WO 95/17210). Сапоніни можуть бажано бути асоційовані із солями металів, такими, як гідроокис алюмінію або фосфат алюмінію (WO 98/15287). Бажано, коли сапонін є представлений у формі ліпосоми, ISCOM або емульсії масло-у-воді. Поліпшена система втягує комбінацію монофосфорил ліпіду A (або знешкодженого ліпіду A) та похідної сапоніну, зокрема, комбінацію QS21 та 3D-MPL, як розкрито в WO 94/00153, або менш реактогенну композицію, в якій QS21 пригнічується холестерином, як розкрито в WO 96/33739. Зокрема, потужна ад„ювантна композиція, що включає токоферол з або без QS21 та/або 3D-MPL в емульсії масло-у-воді, є описаною в WO 95/17210. В одному втіленні імуногенна композиція додатково включає сапонін, який може являти собою QS21. Імуностимуляторні олігонуклеотиди або будь-які інші агоністи Toll-подібного рецептора (TLR) 9 можуть також використовувтаися. Бажані олігонуклеотиди для застосування в ад„ювантах або вакцинах згідно з даним винаходом являють собою CpG вмісні олігонуклеотиди, бажано такі, що містять два або більше динуклеотид CpG фрагментів, відокремлених принаймні трьома, більш бажано принаймні шістьома або більше нуклеотидами. CpG фрагмент являє собою цитозиновий нуклеотид, після якого йде гуаніновий нуклеотид. CpG олігонуклеотиди згідно з даним винаходом являють собою типово дезоксинуклеотиди. У бажаному втіленні інтерrнуклеотид у олігонуклеотиді являє собою фосфородитіоат, або більше бажано фосфородитіоатний зв„язок, хоча фосфодіестер та інші інтернуклеотидні зв„язки bonds також передбачаються в об„ємі даного винаходу. Також в об„єм даного винаходу включаються олігонуклеотиди зі змішаними інтернуклеотидними зв„язками. Способи одержання фосфородитіоатних олігонуклеотидів або фосфородитіоату є описаними у US5,666,153, US5,278,302 та WO95/26204. Приклади бажаних олігонуклеотидів мають наступні послідовності. Послідовністі бажано містять фосфородитіоатний модифікований інтернуклеотидний зв„язок. ОЛІГО 1(SEQ ID NO:1): TCC ATG ACG TTC CTG ACG TT (CpG 1826) ОЛІГО 2 (SEQ ID NO:2): TCT CCC AGC GTG CGC CAT (CpG 1758) ОЛІГО 3(SEQ ID NO:3): ACC GAT GAC GTC GCC GGT GAC GGC ACC ACG ОЛІГО 4 (SEQ ID NO;4): TCG TCG TTT TGT CGT TTT GTC GTT (CpG 2006) ОЛІГО 5 (SEQ ID NO:5): TCC ATG ACG TTC CTG ATG CT (CpG 1668) ОЛІГО 6 (SEQ ID NO:6): TCG ACG TTT TCG GCG CGC GCC G (CpG 5456) Альтернативні CpG олігонуклеотиди можуть включати бажані послідовності, приведені вище, в яких вони мають несуттєві делеції або доповнення. CpG олігонуклеотиди, що використовуються в даному винаході, можуть бути синтезовані у відповідності з будь-якими способами, відомими в області техніки (наприклад, див. EP 468520). Так, ці олігонуклеотиди можуть бути синтезовані при використанні автоматичного синтезатора. Ад„ювант може бути емульсією масло-у-воді або може включати емульсію в комбінації з іншими ад„ювантами. Масляна фаза емульсійної системи бажано включає здатне до метаболізації масло. Значення терміну “здатне до метаболізації масло” є добре відомим в області техніки. Здатне до метаболізації може бути визначене “здатне до трансформації th шляхом метаболізму (Dorland's Illustrated Medical Dictionary, W.B. Sanders Company, 25 edition (1974)). Масло може бути будь-якої рослинною олією, риб„ячою маслом, тваринним або синтетичним маслом, яке не є токсичним для реципієнта та є здатним трасформуватися шляхом метаболізму. Горіхи, насіння та зерно є загальновідомими джерелами рослинних олій. Синтетичні масла також є частиною даного винаходу та можуть влючати комерційно доступні масла, такі, як NEOBEE® та інші. Сквален (2,6,10,15,19,23-гексаметилl-2,6,10,14,18,22тетракозагексаєн) є ненасиченим маслом, яке знаходиться у великій кількості у маслі, одержаному з печінки акули, та у більш низьких кількостях в оливковій олії, олії зародків пшениці, рисовій олії та дріжджах, та є, зокрема, бажаним маслом для застосування у даному винаході. Сквален являє собою здатну до метаболізації олію з урахуванням того факту, що він th являє собою проміжну сполуку у біосинтезі холестерину (Merck index, 10 Edition, entry no.8619). Токоли (наприклад, вітамін E) також часто використовуються в ад„ювантах на основі масляних емульсій (EP 0 382 271 B1; US5667784; WO 95/17210). Токоли, що використовуються у масляних емульсіях (бажано в емульсіях масло-у-воді) згідно з винаходом, можуть бути 14 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 рецептовані так, як описано в EP 0 382 271 B1, з цієї причини токоли можуть бути дисперсіями токолових крапель, що необов„язково включають емульгатор, з розміром крапель менше 1 мікрона у діаметрі. Альтернативно, токоли можуть використовуватися у комбінації з іншими маслами, з утворенням масляної фази масляної емульсії. Приклади масляних емульсій, що можуть використовуватися у комбінації з токолом, є описаними у даній заявці вони можуть являти собою здатне до метаболізації масло, як описано вище. Ад„юванти на основі емульсії масло-у-воді самі по собі були запропоновані як корисні для ад„ювантних композицій (EP 0 399 843B), крім того, комбінації емульсій масло-у-воді та інших активних агентів були описані як ад„юванти для вакцин (WO 95/17210; WO 98/56414; WO 99/12565; WO 99/11241). Інші ад„юванти на основі емульсії масло-у-воді були описані, наприклад такі емульсії, як вода-у-маслі (US 5,422,109;EP 0 480 982 B2) та вода-у-маслі у водних емульсіях (US 5,424,067;EP 0 480 981 B). Усі вони утворюють бажані маслні емульсійні системи (зокрема, при введенні токолів) з утворенням ад„ювантів та композицій згідно з даним винаходом. Найбільш бажано, коли масляна емульсія (наприклад емульсії масло-у-воді) додатково включає емульгатор такий, як TWEEN 80 та/або стерин, такий, як холестерин. Переважна масляна емульсія (бажано емульсія масло-у-воді) включає здатне до метаболіхації нетоксичне масло, таке, як сквалан, сквален або токоферол, такий, як альфа-токоферол (та бажано обидва: сквален та токоферол) та необов„язково емульгатор (або поверхнево-активну сполуку), такий, як Tween 80. Може також бути включений стерин (бажано холестерин). Спосіб одержання емульсії масло-у-воді є добре відомим спеціалісту в даній області техніки. В загальному випадку спосіб включає змішування токолвмісної масляної фази з поверхнево-активною речовиною, такиою, як розчин PBS/TWEEN80™, після чого проводять гомогенізацію при використанні гомогенізатора, спеціалістові в даній області техніки буде зрозумілим, що спосіб, який включає пропускання суміші двічі через голку шприца, буде прийнятним для гомогенізації невеликих об„ємів рідини. У тій самій мірі процес емульгування у мікропсевдозріджувальному пристрої (M110S Microfluidics machine, максимум 50 пропускань, протягом 2 звилин при максимальному тиску на вході 6 бар (тиск на виході 850 бар)) можуть бути адаптовані спеціалістом в даній області техніки для одержання більших або менших об„ємів емульсії. Пристосування можуть бути досягнені шляхом простого експерименту, що включає вимірювання одержаної емульсії, поки не буде досягнуто одержання емульсії з необхідним діаметром крапель. В емульсії масло-у-воді масло та емульгатор будуть знаходитися у водному носії. Водний носій може являти собою, наприклад, забуферений фосфатом фізіологічний розчин. Розмір масляних крапель, що знаходяться у стабільній емульсії масло-у-воді є бажано меншим 1 мікрона, може бути в інтервалі суттєво 30-600 нм, бажано суттєво близько 30-500 нм у діаметрі, та найбільш бажано суттєво 150-500 нм у діаметрі, та зокрема, приблизно 150 нм у діаметрі, як вимірюється методом фотон кореляційної спектроскопії. Так, 80% числа масляних крапель буде знаходитися у межах бажаних інтервалів, більш бажано більше 90%, та найбільш бажано більше 95% oчисла масляних крапель знаходяться у межах визначених інтервалів розміру. Кількість компонентів, що є присутніми у масляних емульсіях згідно з даним винаходом, традиційно знаходиться в межах від 0,5 до 20% або від 2 до 10% масла (об„єму загальної дози), такого, як сквален; та у разі присутності від 2 до 10% альфа-токоферолу; та від 0,3 до 3% поверхнево-актвиної сполуки, такої, як поліoксиетиленсорбіт моноалеат. Бажано, коли співвідношення масло (бажано сквален): токол (бажано альфа-токоферол) є рівним або меншим 1, оскільки це забезпечує більш стабільну емульсію. Емульгатор, такий, як Tween80 або Span 85, може також бути присутнім на рівні приблизно 1%. У деяких випадках може бути бажаним, коли вакцини згідно з даним винаходом будуть додатково містити стабілізатор. Приклади бажаних емульсійних систем є описаними у WO 95/17210, WO 99/11241 та WO 99/12565, які розкривають емульсійні ад„юванти, на основі сквалену, альфа-токоферолу та TWEEN 80, необов„язково рецептовані з імуностимуляторами QS21 та/або 3D-MPL. Таким чином в особливо бажаному втіленні даного винаходу, ад„ювант згідно з винаходом може додатково включаюти додаткові імуностимулятори, такі, як LPS або його похідні та/або сапоніни. Приклади додаткових імуностимуляторів є описаними в даній заявці та у "Vaccine Design - The Subunit та Addjuvant Approach" 1995, Pharmaceutical Biotechnology, Volume 6, Eds. Powell, M.F., та Newman, M.J., Plenum Press, New York та London, ISBN 0-306-44867-X. У бажаному аспекті ад„ювант та імуногенні композиції згідно з винаходом включають сапонін (бажано QS21) та/або LPS похідну (бажано 3D-MPL) у масляній емульсії, описаній вище, необов„язково зі стерином (бажано холестерином). Додатково масляна емульсія (бажано 15 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 емульсія масло-у-воді) може містити span 85 та/або лецитин та/або трикаприлін. Ад„юванти, що включають емульсію масло-у-воді, стерин та сапонін, є описаними у WO 99/12565. Типово, для введення людині сапонін (бажано QS21) та/або LPS похідна (бажано 3D-MPL) буде міститися у дозі імуногенної композиції для людини в інтервалі in 1 мкг - 200 мкг, наприклад, 10-100 мкг, бажано 10 мкг-50 мкг на дозу. Типово, масляна емульсія (бажано емульсія масло-у-воді) буде включати від 2 до 10% здатої до метадолізації олії. Бажано вона буде включати від 2 до 10% сквалену, від 2 до 10% альфа-токоферолу та від 0,3 до 3% (бажано 0,4 - 2%) емульгатора (бажано tween 80 [поліoксиетиленсорбіт моноолеат]). Коли є присутніми сквален та альфа-токоферол, бажано співвідношення сквален : альфа-токоферол є рівним або меншим 1, оскільки це забезпечує більш стабільну емульсію. Span 85 (сорбіттриолеат) може також бути пристунім на рівні від 0,5 до 1% в емульсії, що використовується у винаході. У деяких випадках може бути бажаним, коли імуногенні композиції та вакцини згідно з даним винаходом будуть додатково містити стабілізатор, наприклад, інші емульгатори/поверхневоth активні речовини, включаючи каприлову кислоту (merck index 10 Edition, entry no. 1739), де трикаприлін є особливо бажаним. Коли включаються сквален та сапонін (бажано QS21), також є вигідним також додавати стерин (бажано холестерин) до композиції, оскільки це дозволяє знизити загальний рівень масла в емульсії. Це приводить до зниження витрат на виробництво, поліпшення загального комфорту вакцинації, а також до кількісних та якісних поліпшень одержаних імунних відповідей, таких, як поліпшена продукція IFN-γ. Таким чином, ад„ювантна система згідно з даним винаходом типово включає співвідношення здатного до метаболізації масла та сапоніну сапонін (ваг/ваг) у межах від 200:1 до 300:1, крім того, даний винахід може використовуватися форму "низького масла" бажаний інтервал для якої складає від 1:1 до 200:1, бажано від 20:1 до 100:1, та найбільш бажано суттєво 48:1, ця вакцина зберігає сприятливі ад„ювантні властивості усіх компонентів зі значно зниженим профілем реактогенності. Згідно з цим особливо бажані втілення мають співвідношення сквален:QS21 (ваг/ваг) в інтервалі від 1:1 до 250:1, також бажаний інтервал складає від 20:1 до 200:1, бажано від 20:1 до 100:1, та найбільш бажано суттєво 48:1. Бажано, коли стерин (найбільш бажано холестерин) також включається, та співвідношення сапонін:стерин є таким, як описано в даній заявці. Емульсійні системи згідно з даним винаходом бажано мають невеликий розмір крапель у субмікронному діапазоні. Найбільш бажано, коли розміри крапель будуть в інтервалі від 120 до 750 нм, та найбільш бажано від 120 до 600 нм у діаметрі. Зокрема, потужна ад„ювантна композиція (для заключної комбінації з AIPO4 в імуногенних композиціях згідно з винаходом) містить сапонін (бажано QS21), LPS похідну (бажано 3D-MPL) та масляну емульсію (бажано сквален та альфа-токоферол в емульсії масло-у-воді)СРМ , як описано у WO 95/17210 або у WO 99/12565 (зокрема, ад„ювантна композиція 11 у Прикладі 2, Taблиця 1). Приклади TLR 2 агоніста включають пептидоглікан або ліпопротеїн. Iмідазохіноліни, такі, як іміквімод та резиквімод є відомими TLR7 агоністами. Одноланцюгова РНК є також відомим TLR агоністом (TLR8 у людей та TLR7 мишей), де одноланцюгова РНК та полі IC (поліінозиноваполіцитидилова кислота - комерційний синтетичний міметик вірусної РНК) є прикладами TLR 3 агоністів. 3D-MPL є прикладом TLR4 агоніста, у той час, як CPG являє собою приклад TLR9 агоніста. Імуногенна композиція може включати антиген та імуностимулятор, адсорбований на солі металу. Вакциннні композиції на основі алюмінію, де антиген та імуностимулятор 3-де-Oацилований монофосфорил ліпід A (3D-MPL), є адсорбованими на одній тій самій частинці, є описаними у EP 0 576 478 B1, EP 0 689 454 B1, та EP 0 633 784 B1. У цих випадках антиген спочатку адсорбують на солі алюмінію, після чого здійснюють адсорбцію імуностимулятора 3DMPL на ті самі частинки солі алюмінію. Такі процеси спочатку передбачають приготування суспензії 3D-MPL шляхом обробки ультразвуком у водяній бані до тих пір, поки частинки не досягнуть розміру від 80 до 500 нм. Антиген типово адсорбують на солі алюмінію протягом 1 години при кімнатній температурі при перемішуванні. 3D-MPL суспензію потім додають до адсорбованого антигену та композицію інкубують при кімнатній температурі протягом 1 години, o а потім витримують при температурі 4 C до використання. В іншому процесі імуностимулятор та антиген знаходяться на різних частинках металу, як описано у EP 1126876. Удосконалений процес включає адсорбцію імуностимулятора, на частинці металу, після чого проводять адсорбцію антигену на інших частинках солі металу, після цього перемішують дискретні частинки металу з утворенням вакцини. Ад„ювант для запстосування в даному винаході може являти собою ад„ювантну композицію, що включає імуностимулятор, адсорбований на частинці металу, що характеризується тим, що частинка 16 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 солі металу є суттєво вільною від іншого антигену. Крім того, вакцини, що забезпечуються даним винаходом, характеризуються тим, що імуностимулятор є адсорбованим на частинках солі металу, які є суттєво вільними від іншого антигену, та тим, що частинки металічної солі, які є адсорбованими з антигеном, є суттєво вільними від іншого імуностимулятора. Згідно з цим даний винахід забезпечує ад„ювантну композицію, що включає імуностимулятор, який був адсорбований на частинці солі металу, та який характеризується тим, що композиція є суттєво вільною від іншого антигену. Крім того, ця ад„ювантна композиція може являти собою проміжний продукт, яка, якщо використовується такий ад„ювант, необхідний для виробництва вакцини. Згідно з цим забезпечується спосіб для виробництва вакцини, що включає змішування ад„ювантної композиції, яка містить один або більше імуностимуляторів, адсорбованих на частинці металу з антигенм. Бажано, коли антиген був попередньо адсорбований на солі металу. Вказана сіль металу може бути ідентичною або подібною до солі металу, на якій адсорбований імуностимулятор. Бажано, коли сіль металу являє собою сіль алюмінію, наприклад, фосфат алюмінію або гідроокис алюмінію. Даний винахід також забезпечує вакцинну композицію, що включає імуностимулятор, адсорбований на першій частинці солі металу, та антиген, адсорбований на солі металу, що характеризується тим, що перша та друга частинки солі металу є окремими частинками. LPS або LOS похідні або мутації, або похідні ліпіду A, описані в даній заявці, сконструйовані так, що є менш токсичними (наприклад, 3D-MPL), ніж нативні ліпополісахариди та є почерговими еквівалентами стосовно будь-якого застосування таких залишків, описаних в даній заявці. Вони можуть бути TLR4 лігандами, як описано вище. Інші такі похідні є описаними у WO020786737, WO9850399, WO0134617, WO0212258, WO03065806. В одному втіленні ад„ювант, що використовується для композицій згідно з винаходом включає ліпосомний носій (виготовлений за допомогою відомих методик з фосфоліпідів (таких, як діолeoїлфосфатидил холін [DOPC]) та необов„язково стерину [такого, як холестерин]). Такі ліпосомні носії можуть нести похідні ліпіду A [таку, як 3D-MPL - див. вище] та/або сапоніни (такі, як QS21 - див. вище). В одному втіленні ад„ювант включає (на 0,5 мл дози) 0,1-10 мг, 0,2-7, 0,35, 0,4-2 або 0,5-1 мг (наприклад, 0,4-0,6, 0,9-1,1, 0,5 або 1 мг) фосфоліпіду (наприклад DOPC), 0,025-2,5, 0,05-1,5, 0,075-0,75, 0,1-0,3 або 0,125-0,25 мг (наприклад, 0,2-0,3, 0,1-0,15, 0,25 або 0,125 мг) стерину (наприклад холестерину), 5-60, 10-50 або 20-30 мкг (наприклад, 5-15, 40-50, 10, 20, 30, 40 або 50 мкг) похідної ліпіду A (наприклад, 3D-MPL) та 5-60, 10-50 або20-30 мкг (наприклад, 5-15, 40-50, 10, 20, 30, 40 або 50 мкг) сапоніну (наприклад, QS21). Цей ад„ювант є, зокрема, прийнятним для вакцинних композицій для людей похилого віку. В одному втіленні вакцинна композиція, що включає цей ад„ювант, містить сахаридні кон„югати, які походять принаймні з усіх наступних серотипів: 4, 6B, 9V, 14, 18C, 19F, 23F, 1, 5, 7F (та можуть також включати один або більше із серотипів 3, 6A, 19A, та 22F), де титри GMC антитіла, індуковані проти одного або більше (або усіх) вакцинних компонентів 4, 6B, 9V, 14, 18C, 19F та 23F не є значно нижчими за ті, що індуковані вакциною Prevnar® у вакцинованих людей. В одному втіленні ад„ювант, що використовується для композицій згідно з винаходом включає емульсію масло-у-воді, виготовлену зі здатного до метаболізації масла (такого, як сквален), емульгатора (такого, як Tween 80) та необов„язково токолу (такого, як альфатокоферол). В одному втіленні ад„ювант включає (на 0,5 мл дози) 0,5-15, 1-13, 2-11, 4-8 або 5-6 мг (наприклад, 2-3, 5-6 або 10-11 мг) здатного до метаболізації масла (такого, як сквален), 0,110, 0,3-8, 0,6-6, 0,9-5, 1-4 або 2-3 мг (наприклад, 0,9-1,1, 2-3 або 4-5 мг) емульгатора (такого, як Tween 80) та необов„язково 0,5-20, 1-15, 2-12, 4-10, 5-7 мг (наприклад, 11-13, 5-6 або 2-3 мг) токолу (такого, як альфа-токоферол). Цей ад„ювант може необов„язково додатково включаюти 5-60, 10-50 або 20-30 мкг (наприклад, 5-15, 40-50, 10, 20, 30, 40 або 50 мкг) похідної ліпіду A (наприклад, 3D-MPL). Ці ад„юванти є, зокрема, прийнятними для вакцинних композицій для немовлят та людей похилого віку. В одному втіленні вакцинна композиція, що включає цей ад„ювант включає сахаридні кон„югати, одержані з принаймні усіх наступних серотипів: 4, 6B, 9V, 14, 18C, 19F, 23F, 1, 5, 7F (та можуть також включати один або більше із серотипів 3, 6A, 19A, та 22F), де титри GMC антитіла, індуковані проти одного або більше (або усіх) вакцинних компонентів 4, 6B, 9V, 14, 18C, 19F та 23F не є значно нижчими за ті, що індуковані вакциною Prevnar® у вакцинованих людей. Цей ад„ювант може необов„язково містити 0,025-2,5, 0,05-1,5, 0,075-0,75, 0,1-0,3 або 0,1250,25 мг (наприклад, 0,2-0,3, 0,1-0,15, 0,25 або 0,125 мг) стерину (наприклад, холестерину), 560, 10-50 або 20-30 мкг (наприклад, 5-15, 40-50, 10, 20, 30, 40 або 50 мкг) похідної ліпіду А 17 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 (наприклад, 3D-MPL), та 5-60, 10-50 або 20-30 мкг (наприклад, 5-15, 40-50, 10, 20, 30, 40 або 50 мкг) сапоніну (наприклад, QS21). Цей ад„ювант є, зокрема, прийнятними для вакцинних композицій для немовлят та людей похилого віку. В одному втіленні вакцинна композиція, що включає цей ад„ювант включає сахаридні кон„югати, одержані з принаймні усіх наступних серотипів: 4, 6B, 9V, 14, 18C, 19F, 23F, 1, 5, 7F (та можуть також включати один або більше із серотипів 3, 6A, 19A, та 22F), де титри GMC антитіла, індуковані проти одного або більше (або усіх) вакцинних компонентів 4, 6B, 9V, 14, 18C, 19F та 23F не є значно нижчими за ті, що індуковані вакциною Prevnar® у вакцинованих людей. В одному втіленні ад„ювант, що використовується для композицій згідно з винаходом включає фосфат алюмінію та похідну ліпіду А (таку, як 3D-MPL). Цей ад„ювант може включати (на 0,5 мл дози) 100-750, 200-500 або 300-400 мкг Al у вигляді фосфату алюмінію, та 5-60, 1050 або 20-30 мкг (наприклад, 5-15, 40-50, 10, 20, 30, 40 або 50 мкг) похідної ліпіду А (наприклад, 3D-MPL). Цей ад„ювант є, зокрема, прийнятними для вакцинних композицій для немовлят та людей похилого віку. В одному втіленні вакцинна композиція, що включає цей ад„ювант включає сахаридні кон„югати, одержані з принаймні усіх наступних серотипів: 4, 6B, 9V, 14, 18C, 19F, 23F, 1, 5, 7F (та можуть також включати один або більше із серотипів 3, 6A, 19A, та 22F), де титри GMC антитіла, індуковані проти одного або більше (або усіх) вакцинних компонентів 4, 6B, 9V, 14, 18C, 19F та 23F не є значно нижчими за ті, що індуковані вакциною Prevnar® у вакцинованих людей. Такі вакцинні препарати, що містять імуногенні композиції згідно з даним винаходом, можуть використовуватися для захисту або лікування ссавця, чутливого до інфекції, за допомогою введення вказаної вакцини системним шляхом, або через слизові оболонки. Ці введення можуть включати інкцію шляхом внутрішньом„язового, інтраперитонеального, інтрадермального або підшкірного введення, або введення через слизову оболонку до орального/травного, респіраторного, сечостатевого трактів. Інтраназальне введення вакцин для лікування пневмонії або середнього отиту є переважним (оскільки назофарингеальне носійство пневмококів може більш ефективно запобігатися, послаблюючи, таким чином, інфекцію на ранній стадії). Незважаючи на те, що вакцина згідно з винаходом може вводитися як одинична доза, її компоненти можуть також сумісно вводитися одночасно або в різні моменти часу (наприклад, пневмококові сахаридні кон„югати можуть вводитися окремо, у той самий час або через 1-2 тижні після введення будь-якого компоненту бактеріального білка для оптимальної координації імунних відповідей стосовно кожної іншої). Для сумісного введення оптимальний Th1 ад„ювант можуе бути присутнім у будь-якій або усіх різних введеннях. На доповнення до одного шляху введення можуть використовуватися 2 різні шляхи введення. Наприклад, сахариди або сахаридні кон„югати можуть вводитися IM (або ID), а бактеріальні білки можуть вводитися IN (або ID). На доповнення до цього, вакцини згідно з винаходом можуть вводитися IM для примуючих дозувань, а IN дози для бустерних ін„єкцій. Вміст білкових антигенів у вакцині бути типово знаходитися у межах 1-100 мкг, бажано 5-50 мкг, найбільш типово в інтервалі 5 - 25 мкг. Після початкової вакцинації, особи можуть одержувати одну або декілька бустерних імунізацій, розділених проміжком часу. Вакцинний препарат є в загальному вигляді описаним у Vaccine Design ("The subunit та аdjuvant approach" (eds Powell M.F. & Newman M.J.) (1995) Plenum Press New York). Енкапсуляція у ліпосоми є описаною Fullerton, патент США № 4,235,877. Вакцини згідно з даним винаходом можуть зберігатися у розчині або у ліофілізований формі. Бажано, коли розчин піддають ліофілізації у пристуності цукру, такого, як цукроза або лактоза. Також є бажаним, коли вони піддаються ліофілізації та відновлюються перед застосуванням. Ліофілізація може приводити до одержання більш стабільної композиції (вакцини) та, можливо, може приводити до більш високих титрів антитіла у присутності 3D-MPL та при відсутності ад„юванту на основі алюмінію. В одному аспекті згідно з винаходом забезпечується вакцинний набір, що включає пробірку, яка містить вакцинну композицію згідно з винаходом, необов„язково у ліофілізованій формі, та додатково включає пробірку, яка містить ад„ювант, як описано в даній заявці. Є очевидним, що у цьому аспекті згідно з винаходом ад„ювант ад„ювант буде використовуватися для відновлення ліофілізованої імуногенної композиції. Незважаючи на те, що вакцини згідно з даним винаходом можуть вводитися будь-яким шляхом, введення описаних вакцин у шкіру (ID) утворює одне втілення згідно з даним винаходом. Шкіра людини включає зовнішню "рогову" кутикулу, що називається роговим шаром, що покриває епідерму. Внизу цієї епідерми є шар, який називається дерма, який, у свою чергу, 18 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 60 покриває підшкірну тканину. Дослідники показали, що ін„єкція вакцини у шкіру, та зокрема, дерму, sстимулює імунну відповідь, що може бути асоційовано з рядом додаткових переваг. Інстрадермальна вакцинація з використанням вакцин, описаних в даній заявці утворює бажану ознаку згідно з даним винаходом. Традиційна методика для інтрадерманоїх ін„єкції, "процедура манту", включає етапи очищення шкіри, та потім натягування однією рукою, та за допомогою голки зі скошеним краєм з вузьким каналом (калібр 26-31) скошений край голки вводять під кутом 10-15°. Як тільки скос голка введений, тіло голки вводять нижче у шкіру та далі просувають при слабкому тиску до послаблення її під шкірою. Потім рідину вводять дуже повільно, формуючи, таким чином пухирець або шишку на шкірній поверхні, після чого повільно витягають голку. Нещодавно були описані спеціально розроблені пристрої для введення рідких агентів у або через шкіру, наприклад, пристрої, описані у WO 99/34850 та EP 1092444, а також пристрої для впорскування струменем описані, наприклад у WO 01/13977; US 5,480,381, US 5,599,302, US 5,334,144, US 5,993,412, US 5,649,912, US 5,569,189, US 5,704,911, US 5,383,851, US 5,893,397, US 5,466,220, US 5,339,163, US 5,312,335, US 5,503,627, US 5,064,413, US 5,520, 639, US 4,596,556, US 4,790,824, US 4,941,880, US 4,940,460, WO 97/37705 та WO 97/13537. Альтернативні способи для інтардермального введення вакциних препаратів можуть включати традиційні шприци та голки, або пристрої, призначені для балістичної доставки твердих вакцин (WO 99/27961) або трансдермальні пластирі (WO 97/48440; WO 98/28037); або такі, що застосовуються до поверхні шкіри (трансдермальна або трансшкірна доставка WO 98/20734 ; WO 98/28037). Коли вакцини згідно з даним винаходом вводяться у шкіру, або зокрема, у дерму, вакцина знаходиться у малому о„ємі рідини, зокрема, об„єм складає від приблизно 0,05 мл до 0,2 мл. Вміст антигенів у шкірних або інтрадермальних вакцинах згідно з даним винаходом може бути подібним до традиційних доз, як це є у внутрішньом„язових вакцинах (див. вище). Проте ознакою шкірних та інтрадермальних вакцин є те, що композиції можуть бути у “низькій дозі” . Відповідно до цього білкові антигени у вакцинах "низької дози" є бажано присутніми у дозі від 0,1 до 10 мкг, бажано у дозі від 0,1 до 5 мкг на дозу; сахаридні (бажано кон„юговані) антигени можуть бути присутніми у межах 0,01 -1 мкг, та бажано від 0,01 до 0,5 мкг сахариду на дозу. Як використовується в даній заявці, термін "інтрадермальна доставка" означає доставку вакцини у район дерми у шкірі. Проте вакцина не буде з необхідністю розташовуватися у дермі. Дерма є шаром у шкірі, який розміщений між приблизно 1,0 та приблизно 2,0 мм від поверхні шкіри людини, проте існує деяка кількість варіацій між індивідуумами та у різних частинах тіла. В загальному випадку, слід очікувати досягнення дерми шляхом проходження 1,5 мм нижче поверхні шкіри. Дерма розміщена між роговим шаром та епідермою на поверхні та підшкірним шаром, розміщеним нижче. У залежності від способу доставки вакцина може в основному розміщуватися виключно або в основному у межах епідерми та дерми. Даний винахід також забезпечує поліпшену вакцина для запобігання або пом„якшення середнього отиту, спричиненого Haemophilus influenzae, шляхом додання білків Haemophilus influenzae, наприклад, білка D у вільній або кон„югованій формі. Крім того, даний винахід також забезпечує поліпшену вакцина для запобігання або пом„якшення пневмококової інфекції у немовлят (наприклад, середнього отиту), шляхом додання одного або двох пневмококових білків у вільній формі або як кон„югованих білків до кон„югатних композицій S. pneumoniae згідно з винаходом. Вказані пневмококові вільні білки можуть бути такими самими або різними з будь-якими білками S. pneumoniae, що використовуються як білки носія. Один або більше білкових антигенів Moraxella catarrhalis можуть також включатися у комбінаційну вакцину у вільній або кон„югованій формі. Tаким чином, даний винахід представляє собою поліпшений спосіб для встановлення (протективної) імунної відповіді проти середнього отиту у немовлят. В іншому втіленні даний винахід забезпечує поліпшений спосіб для встановлення (протективної) імунної відповіді проти середнього отиту у немовлят (у контексті даного винаходу визначається, як вік 0-2 роки) шляхом введення безпечної та ефективної кількості вакцини згідно з винаходом [педіатрична вакцина]. Додаткові втілення згідно з даним винаходом включають забезпечення антигенних кон„югатних композицій S. pneumoniae згідно з винаходом для застосування у медицині та застосування кон„югатів S. pneumoniae згідно з винаходом у виробництві лікарського засобу для запобігання (або лікування) пневмококового захворювання. Ще в одному втіленні даний винахід являє собою поліпшений спосіб для встановлення (протективної) імунної відповіді у популяції людей похилого віку (у контексті даного винаходу пацієнт вважається таким похилого віку, якщо його вік складає 50 років та більше, типово більше 55 років, та у більш загальному випадку більше 60 років) шляхом введення безпечної та ефективної кількості вакцини згідно з винаходом, бажано у поєднанні з одним або більше 19 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 білками S. pneumoniae, що є присутніми як вільні або кон„юговані білки, де вільні білки S. pneumoniae можуть бути такими самими або різними з будь-якими білками S. pneumoniae, що використовуються як білки носія. Додатковий аспект згідно з винаходом являє собою спосіб імунізації людського хазяйського організму проти захворюванння, спричиненого інфекцією S. pneumoniae та необов„язково Haemophilus influenzae, що включає введення хазяїну імунопротективної дози імуногенної композиції або вакцини, або набору згідно з винаходом. Додатковий аспект згідно з винаходом являє собою імуногенну композицію згідно з винаходом для застосування у лікуванні або запобіганні захворювання, спричиненого інфекцією S.pneumoniae та необов„язково Haemophilus influenzae. Додатковий аспект згідно з винаходом являє собою застосування імуногенної композиції або вакцини, або набору згідно з винаходом у виробництві лікарського засобу для лікування або запобігання захворювань, спричинених інфекцією S. pneumoniae та необов„язково Haemophilus influenzae. Терміни «такий, що включає», «включають» та «включає» в даній заявці призначені винахідниками для необов„язкової заміни термінів «такий, що складається», «складаються з» «складається з», відповідно у будь-якому випадку. Втілення в даній заявці, що відносяться до "вакцинних композицій" згідно з винаходом, є також застосовуваними до втілень, що відносяться до "імуногенних композицій" згідно з винаходом, та навпаки. Усі посилання або патентні заявки, що цитуються в даному описі, введені в дану заявку як посилання. Для кращого розуміння даного винаходу представлені наступні приклади. Приклади представлені тільки з метою ілюстрації та не вважаються такими, що обмежують об„єм даного винаходу будь-яким чином. ПРИКЛАДИ Приклад 1: Експресія білка D Білок D Haemophilus influenzae Генетична конструкція для експресії білка D Початкові матеріали ДНК, що кодує білок D Білок D є високо консервативним серед усіх серотипів та нездатних до типпування H. influenzae. Вектор pHIC348, що містить послідовність ДНК, що кодує цільний білок гену D одержували від доктора A. Forsgren, Department of Medical Microbiology, University of Lund, Malmo General Hospital, Malmo, Sweden. Послідовність ДНК білка D була опублікована Janson та ін. (1991) Infect. Immun. 59: 119-125. Експресійний вектор pМG1 Експресійний вектор pМG1 являє собою похідну pBR322 (Gross та ін., 1985), в яку введені контрольні елементи для транскрипції та трансляції чужерідних вбудованих генів елементів, де вказані елементи походять від бактеріофагу (Shatzman та ін., 1983). Крім того, ген стійкості до ампіциліну був замінений на ген стійкості до канаміцину. Штам E. coli AR58 E. coli штам AR58 був одержаний шляхом трансдукції N99 за допомогою P1 вихідного фагу, вирощеного на SA500 похідній (galE::TN10, lambdaKil cІ857 AH1). N99 та SA500 являють собою E. coli K12 штами, які одержані з лабораторії доктора. Martin Rosenberg при National Institute of Health. Експресійний вектор pМG 1 Для одержання білка D, ДНК, що кодує білок, була клонована у експресійний вектор pMG1. Ця плазміда використовує сигнали з ДНК фага лямбда для спрямовування транскрипції та трансляції вбудованих чужерідних генів. Вектор містить промотор PL, оператор OL та сайти утилізації (NutL та NutR) для сприяння ефектам транскрипційної полярності, коли забезпечується N білок (Gross та ін., 1985). Вектори, що містять PL промотор, вводять у E. coli лізогенного хазяїна для стабілізації плазмідної ДНК. Лізогенні хазяйські штами містять дефектну по реплікації ДНК фага лямбда, інтегровану у геном (Shatzman та ін., 1983). Хромосомна ДНК фага лямбда направляє синтез білка-репресора cl, який зв„язується з OL репресором вектора та запобігає зв„язуванню РНК полімерази з PL промотором та, таким чином, транскрипції вбудованого гена. cl ген експресійного штама AR58 містить чутливий до температури мутант для того, щоб PL направлена транскрипція мала змогу регулюватися температурним зсувом, тобто підвищення температури культури інактивує репресор та ініціюється синтез чужерідного 20 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 білка. Ця експресійна система дозволяє здійснювати контрольований синтез чужерідних білків, особливо тих, що можуть бути токсичними для клітини (Shimataka & Rosenberg, 1981). Штам E. coli AR58 AR58 лізогенний штам E. coli, що використовується для одержання білка носія D, є похідною стандартного NIH E. coli K12 штаму N99 (P su- galK2, lacZ thr ). Він містить дефектний лізогенний фаг лямбда (galE::TN10, lambdaKil cl857 ΔH1). Kil фенотип запобігає вимикання хазяйського макромолекулярного синтезу. cl857 мутація забезпечує чутливе до температури пошкодження cl репресора. ΔH1 делеція видаляє правий операн фага лямбда та хазяйські локуси bio, uvr3 та chlA l. AR58 штам був одержаний шляхом трансдукції N99 початковим фагом P1 перед вирощуванням на SA500 похідній (galE::TN10, lambdaKil cl857 ΔH1). Введення дефектного лізогену у N99 відбирали за допомогою тетрацикліну при використанні пристуності TN10 транспазону, що кодує резистентність у сусідньому galE гені. Конструювання вектора pМGMDPPrD pMG1 вектор, який містить ген, що кодує неструктурний S1 білок вірусу грипу (pМGNSI) використовували для конструювання pМgMDPPrD. Ген білка D ампліфікували за допомогою ПЛР з вектора pHIC348 (Janson та ін. 1991 Infect. Immun. 59:119-125) при використанні праймерів ПЛР, що містять Ncol та Xbal рестрикційні сайти на 5' та 3' кінцях, відповідно. Ncol/Xbal фрагмент потім вводили у pМGNSI між Ncol та Xbal, створюючи таким чином, злитий білок, що містить N-термінальні 81 амінокислоту NS1 білка, після яких йде PD білок. Цей вектор позначали, як pМGNSI PrD. Базуючись на конструкції, описаній вище, створювали заключну конструкцію для експресії білка D. BamHI/BamHI фрагмент видаляли з pМGNSIPrD. Гідроліз цієї ДНК видаляв кодуючу ділянку NS1, за винятком перших трьох N-термінальних залишків. При повторному лігуванні вектора одержували ген, який кодує злитий білок з наступною N-термінальною амінокислотною послідовністю: ----MDP SSHSS НМANT----NS1 Білок D Білок D не містить лідерного пептиду або N-термінально цистеїну, до якого у нормі приєднуються ліпідні ланцюги. Білок, таким чином, не виділяється у периплазму та не піддається ліпідуванню та залишається у цитоплазмі у розчинній формі.. Заключну конструкцію pМG-MDPPrD вводили у AR58 хазяйський штам за допомогою теплового шоку при 37°C. Бакетрію, що містить плазміду, піддавали селекції к пристуності канаміцину. Присутність вставки ДНК, що кодує білок D, було продемонстровано шляхом перетравлювання ізольованої плазмідної ДНК з вибраними ендонуклеазами. Рекомбінантний штам E. coli штам називається ECD4. Експресія білка D знаходиться під контролем промотора фаза лямбда PL / оператора фага лямбда OL. Хазяйський штам AR58 містить чутливий до температури ген cl у геномі, який блокує експресію з PL фага лямбда при низькій температурі шляхом зв„язування з OL. При підвищенні температури cl вивільняється з OL, та білок D піддається експресії. Приготування у невеликих об„ємах Наприкінці процесу ферментації клітини концентрували та заморожували. Екстракцію із зібраних клітин та очитску білка D проводили так, як описано нижче. Заморожений осад кілтин розморожували та ресуспендували у розчині для дезінтеграції клітин (цитратний буфер pH 6,0) до заключного значення OD650 = 60. Суспензію пропускали двічі через гомогенізатор з високим тиском при P = 1000 бар. Гомогенат культури клітин освітлювали шляхом центрифугування, та клітинний дебрис видаляли за допомогою фільтрації. На першому етапі очистки відфільтрований лізат пропускали через катіонообмінну хроматографічну колонку (SP Sepharose Fast Flow). PD зв„язується з гелевим матриксом за допомогою іонної взаємодії та вимивається на етапі підвищення іонної сили буфера для елюювання. На другому етапі очистки забруднюючі речовини затримувалися аніонообмінним матриксом (Q Sepharose Fast Flow). PD не зв„язується з гелем та може збиратися у потоці, що проходить через колонку. На обох етапах колонкової хроматографії зібрані фракції піддавали моніторингу при використанні OD. Потік, що пройшов через аніонообмінну хроматографічну колонку та містить очищений білок D, піддавали концентрації шляхом ультрафільтрації. Ультрафільтраційний ретентат, що містить білок D на завершення пропускали через 0,2 мкм мембрану. Приготування у великих об„ємах 21 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 Екстракцію зібраних клітин та очистку білка D проводили так, як описано нижче. Зібраний бульйон охолоджували та безпосередньо двічі пропускали через гомогенізатор високого тиску при тиску близько 800 бар. На першому етапі очистки гомогенат культури клітин розводили та пропускали через катіонообмінну хроматографічну колонку (SP Sepharose Big beads). PD зв„язується з гелевим матриксом за допомогою іонної взаємодії та вимивається на етапі підвищення іонної сили буфера для елюювання та фільтрується. На другому етапі очистки забруднюючі речовини затримувалися аніонообмінним матриксом (Q Sepharose Fast Flow). PD не зв„язується з гелем та може збиратися у потоці, що проходить через колонку. На обох етапах колонкової хроматографії зібрані фракції піддавали моніторингу при використанні OD. Потік, що пройшов через аніонообмінну хроматографічну колонку та містить очищений білок D, піддавали концентрації та діафільтрації шляхом ультрафільтрації. Ультрафільтраційний ретентат, що містить білок D на завершення пропускали через 0,2 мкм мембрану. Приклад 1b: ЕКСПРЕСІЯ PhtD PhtD білок є членом родини білків пневмококових гістидинових триади (Pht), що характеризується, що характеризується пристуністю гістидинових триад (HXXHXH мотив). PhtD являє собою молекулу, що містить 838 амінокислот та несе 5 гістидинових триад (див. Medlmmune WO00/37105 SEQ ID NO: 4 для амінокислотної послідовності та SEQ ID NO: 5 дляДНК послідовності). PhtD також містить багату на пролін ділянку у середині (амінокислотні положення 348-380). PhtD має 20 амінокислот N-термінальної сигнальної послідовності з мотивом LXXC. Генетична конструкція Послідовність гена зрілого Medlmmune білка PhtD (від аа 21 до aa 838) переносили рекомбінантно до E. coli при використанні виготовленого на фірмі вектора pTCMP14, що несе pX промотор. Хазяйський штам E. coli являє собою AR58, що несе cl857 термочутливий репресор, що дозволяє проводити теплову індукцію промотора. Проводили полімеразну ланцюгову реакцію для ампліфікації phtD гена з плазміди Medlmmune (яка несе phtD ген з штаму Streptococcus pnewnoniae Norway 4 (серотип 4) - SEQ ID NO: 5, як описано у WO 00/37105). Праймери, спеицфічні для phtD гену використовували тільки для ампліфікації phtD гена у двох фрагментах. Праймери несли або NdeІ та KpnІ, або KpnІ та XbaІ рестрикційні сайти. Ці праймери не гібридизувалися із жодним нуклеотидом з вектора, але тільки з phtD специфічними генними послідовностями. Штучний ATG стартовий кодон вбудовували при використанні першого праймера, що несе NdeІ рестрикційний сайт. Одержані ПЛР продукти потім вбудовувли у pGEM-T клонуючий вектор (Promega), та послідовність ДНК підтверджували. Субклонування фрагментів у TCMP14 експресійний вектор потім проводили при використанні стандартних методик, та вектор трансформували у E. coli AR58. Очистка PhtD Очистку PhtD проводили так, як описано нижче: - Вирощування клітин E.coli у присутності канаміцину: ріст протягом 30 годин при 30°C, потім індукція протягом 18 годин при 39,5°C - Руйнування клітин E.coli з цільної культури приOD ±115 у присутності ЕДТА 5 мM та PMSF 2 мМ як інгібіторів протеази: Rannie, 2 пасажі, 1000 бар. - Захоплення антигену та видалення клітинного дебрису при використанні Streamline Q XL хроматогарфії при кімнатній температурі (20°C); колонку промивали NaCl150 мМ + Empigen 0,25% pH 6,5 та та елюювали при використанні NaCl400 мМ + Empigen 0,25% у 25 мМ буфера на основі фосфату калію pH 7,4. - Фільтрування на Sartobran 150 картриджі (0,45 + 0,2 мкм) ++ - Зв„язування антигену при використанні хроматографії на Zn хелатній сефарозі FF IMAC при pH 7,4 у присутності 5 мМ імідазолу при 4°C; колонку промивали імідазолом 5 мМ та Empigen 1% та елюювали при використанні 50 мМ імідазолу, обидва рази буфер на основі 25 мМ фосфату калію pH 8,0. - Слабка аніонообмінна хроматографія у позитивному режимі на Fractogel EMD DEAE при pH 8,0 (25 мМ фосфат калію) при 4°C; колонку промивали 140 мМ NaClта елюювали при 200 мМ NaCl, у той час, як забруднюючі речовини (білки та ДНК) залишалися адсорбованими на обміннику. - Концентрація та ультрафільтрація з використанням 2 мМ Na/K фосфату pH 7,15 на мембрані 50 кДа. 22 UA 99703 C2 5 10 15 20 25 30 35 40 45 50 55 - Стерилізуюча фільтрація очищеної партії на фільтрувальному картриджі Millipak-20 0,2 мкм. Приклад 1c: ЕКСПРЕСІЯ ПНЕВМОЛІЗИНУ Пневмококовий пневмолізин готували та знешкоджували так, як описано у W02004/081515 та WO2006/032499. Приклад 2: Одержання кон„югатів В області техніки є добре відомим, як приготувати очищені пневмококові полісахариди. Для цілей цих прикладів полісахариди готували суттєво так, як описано у EP072513 або спорідненими з ними способами. Перед проведенням кон„югації полісахариди можуть бути калібровані за розміром шляхом мікропсевдозрідження, як описано нижче. Активація та злиття є специфічними для кожного полісахариду. Дані приведені у Таблиці 1. Калібрований за розміром полісахарид (виняток для PS5, 6B та 23F) розчиняли у NaCl2M, NaCl0,2M або у воді для ін„єкцій (WFI). Оптимальну концентрацію полісахариду оцінювали для усіх серотипів. Усі серотипи за винятком серотипу 18C, були кон„юговані безпосередньо до білка носія, як детально описано нижче. Одержували два альтернативні кон„югати серотипу 22F; один - кон„югований безпосередньо, один - через ADH лінкер. З 100 мг/мл маткового розчину в ацетонітрилі або у суміші ацетонітрил/вода 50%/50%, CDAP (CDAP/PS співвідношення 0,5-1,5 мг/ мг PS) додавали до розчину полісахариду. Через 1,5 хвилину, додавали 0,2M-0,3M NaOH для одержання специфічної активації pH. Активацію полісахариду проводили при цьому значенні pH протягом 3 хвили при 25 °C. Очищений білок (білок D, PhtD, пневмолізин або DT) (кількість залежить від початкового співвідношення PS/білок носія) додавали до активованого полісахариду та реакцію злиття проводили при характерному значенні pH протягом 2 годин (у залежності від серотипу) при регульованому значенні pH. Для того, щоб погасити групи ціанатного естеру, що не прореагували, потім до суміші додавали 2M розчин гліцину. Значення pH доводили до pH 9,0. Розчин перемішували проятгом 30 хвилин при 25 °C, а потім протягом ночі при 2-8 °C при постійному повільному перемішуванні. Одержання 18C: 18C зв„язували з білком носія через лінкер - дигідразид адипінової кислоти (ADH). Полісахарид серотипу 18C піддавали мікропсевдозрідженню перед кон„югацією. Дериватизація токсоїду правця при використанні EDAC Для дериватизації токсоїду правця очищений TT розводили при концентрації 25 мг/мл у 0,2M NaClта додавали ADH спейсер для того, щоб досягти заключної концентрації 0,2M. Коли розчинення спейсера завершувалося, значення pH доводили до 6,2. EDAC (1-етил-3-(3диметиламінопропіл) карбодіїмід) потім додавали до досягнення заключної концентрації 0,02M, та суміш перемішували протягом 1 години при регуляції значення pH. Реакцію конденсації зупиняли шляхом підвищення значення pH аж до 9,0 протягом принаймні 30 хвилин при 25°C. Дериватизований TT потім піддавали діафільтрації (10 кДа CO мембрана) для того, щоб видалити залишкові ADH та EDAC реагенти. TTah на завершення стерильно фільтрували перед етапом злиття та зберігали при -70°C. Хімічне злиття TTAh з PS 18C Деталі параметрів кон„югації можуть бути знайдені у Таблиці 1. 2 грами мікропсевдозрідженого PS розводили при визначеній концентрації у воді та доводили до концентрації 2M NaClдоданням порошка NaCl. Додавали CDAP розчин (свіжо приготовлений розчин 100 мг/мл у 50/50 об/об ацетонітрил/WFI) до досягнення прийнятного співвідношення CDAP/PS. Значення pH підвищували до активації pH 9,0 шляхом додання 0,3M NaOH та стабілізували на цьому значення pH до додання TTAH. Через 3 хвилини додавали дериватизований TTAH (20 мг/мл у 0,2 M NaCl) до досягнення співвідношення TTAH /PS 2; значення pH регулювали до досягнення pH 9,0. Розчин залишали на одну годину стояти при умовах регуляції pH. Для погашення додавали 2M розчин гліцину, до суміші PS/TTAH/CDAP. Значення pH доводили до погашення значення pH (pH 9,0). Розчин перемішували протягом 30 хвилин при 25°C, та потім залишали стояти протягом ночі при 2-8°C при постійному повільному перемішуванні. PS22FAH-PhtD кон„югат У другому способі кон„югації для цього сахариду (перший є безпосереднім способом PS22PMD кон„югації, метод представлений у Таблиці 1), 22F зв„язували з білком носія через лінкер 23 UA 99703 C2 5 10 15 20 25 30 35 40 дигідразид адипінової кислоти (ADH). Полісахарид серотипу 22F піддавали мікропсевдозрідженню перед кон„югацією. Дериватизація PS 22F Активацію та злиття проводили при 25°C при постійному перемішуванні на водяній бані з контрольованою температурою. Мікропсевдозріджений PS22F розводили з одержанням заключної концентрації PS 6 мг/мл у 0,2M NaClта розчин доводили при pH 6,05 ± 0,2 за допомогою 0,1 N HCL. Розчин CDAP (100 мг/мл свіжо приготовленого у суміші ацетонітрил/WFI, 50/50) додавали до досягнення прийнятного співвідношення CDAP/PS (1,5/1 ваг/ваг). Значення pH підвищували до активації pH 9,00 ± 0,05 шляхом додання 0,5M NaOH та стабілізували на цьому значення pH до додання ADH. Через 3 хвилини додавали ADH до досягнення прийнятного співвідношення ADH/PS (8,9/1 ваг/ваг); значення pH регулювали до зв„язування pH 9,0. Розчин залишали на одну годину стояти при умовах регуляції pH. PSAH похідну концентрували та піддавали діафільтрації. Злиття PhtD при концентрації 10 мг/мл у 0,2M NaClдодавали до PS22FAH похідної для того, щоб досягти співвідношення PhtD/PS22FAH 4/1 (ваг/ваг). Значення pH доводили до 5,0 ± 0,05 за допомогою HCl. Розчин EDAC (20 мг/мл у 0,1 M Tрис-HCL pH 7,5) додавали у ручному режимі протягом 10 хвилин (250 мкл / min) до одержання 1 мг EDAC/ мг PS22FAH. Одержаний розчин інкубували протягом 150 хвилин (хоча також використовували 60 хвилин) при 25°C при перемішуванні та регуляції pH. Розчин нейтралізували шляхом додання 1M Tрис-HCL pH 7,5 (1/10 заключного об„єму) та залишали на 30 хвилин при 25X. Перед елююванням на Sephacryl S400HR кон„югат просвітлювали при використанні фільтру 5 мкм Minisart. Одержаний кон„югат мав заключне співвідношення PhtD/PS 4,1 (ваг/ваг), вміст вільного PS нижче 1% та антигенність (α-PS/α-PS) 36,3% та анти-PhtD антигенність 7,4%. Очистка кон„югатів: Кон„югати очищали шляхом гель-фільтрації при використанні Sephacryl S400HR гельфільтраційної колонки, урівноваженої 0,15M NaCl(S500HR для 18C) для видалення невеликих молекул (включаючи DMAP) та некон„югованих PS та білка. На основі різних молекулярних розмірів реакційних компонентів, PS-PD, PS-TT, PS-PhtD, PS-пневмолізину або PS-DT, кон„югати елюювалися першими, після цього елюювався вільний PS, потім вільний PD або вільний DT та на завершення DMAP та інші солі (NaCl, гліцин). Фракції, що містять кон„югати, визначали шляхом UV280 нм. Фракції розділяли на пули згідно з їх Kd, стерильно фільтрували (0,22 мкм) та зберігали при +2-8°. Визначали співвідношення PS/білок у кон„югатних препаратах. Умови специфічної активації/злиття/гасіння кон„югатів PS S. pneumoniae-білок D/TT/DT/PhtD/Ply Коли “мкпсевд.” міститься у назві стовпчика, то це показує, що сахарид був калібрований за разміром шляхом мікропсевдозрідження перед кон„югацією. Розміри сахаридів після мікропсевдозрідження приведені у Таблиці 2. 24 UA 99703 C2 Таблиця 1 Умови специфічної активації/злиття/гасіння PS кон„югатів S. pneumoniae-білок D/TT/DT/PhtD/Ply Серотип PS конц. (мг/мл) PS розчинення PD конц. (мг/мл) Вихідне співвідношення PD/PS (ваг/ваг) CDAP конц. (мг/ мг PS) pHa=pHс=pHq Серотип PS конц. (мг/мл) PS розчинення PD конц. (мг/мл) Вихідне співвідношення PD/PS (ваг/ваг) CDAP конц. (мг/ мг PS) pHa=pHс=pHq 5 10 15 20 25 30 1 мкпсевд. 2,5 4 мкпсевд. 2,5 5 6A 6B 7,1 5 5 7F мкпсевд. 5 WFI 10 1,5/1 WFI 10 1,5/1 WFI 5 01.Січ NaCl 2M 5 01.Січ NaCl 2M 5 1,1/1 NaCl 2M 10 1,2/1 0,5 0,5 0,79 0.83 0.83 0,75 9,0/9,0/9,0 9V мкпсевд. 5 2M 10 9,5/9,5/9,0 14 мкпсевд. 5 NaCl 2M 10 9,0/9,0/9,0 18C мкпсевд. 4,5 NaCl 2M 20,0 (TT) 9,5/9,5/9,0 19A мкпсевд. 15 NaCl 2M 10,0 (Ply) 9,5/9,5/9,0 19F мкпсевд. 9 NaCl 2M 20,0 (DT) 1,2/1 1,2/1 02.Січ 2,5/1 1,5/1 9,5/9,5/9,0 22 F мкпсевд. 6 NaCl 0,2M 10,0 (PhtD) 03.Січ 0,5 0,75 0,75 1,5 1,5 1,5 0,79 9,5/9,5/9,0 9,5/9,5/9,0 9,0/9,0/9,0 9,0/9,0/9,0 9,0/9,0/9,0 9,0/9,0/9,0 9,5/9,5/9,0 23F 2,38 NaCl 2M 5 01.Січ Примітка: pHa,c,q відповідає pH для активації, злиття та гасіння, відповідно Характеристика: Кожний кон„югат характеризували на відповідність характеристикам, приведеним у Таблиці 2. Вміст полісахариду (мкг/мл) вимірювали за допомогою резорцинового тесту, а вміст білка (мкг/мл) за допомогою аналізу Лоурі. Заключне співвідношення PS/PD (ваг/ваг) визначали співвідношенням концентрацій. Вміст вільного полісахариду (%): Вміст вільного полісахариду кон„югатів, витриманих при 4°C, або таких, що зберігалися 7 днів при 37°C, визначали на супернатантах, одержаних після інкубації з антитілами α-білка носія та насичених сульфатом амонію, центрифугування. α-PS/ α-PS ELISA використовували для кількісної оцінки полісахариду у супернатанті. Відсутність кон„югату також контролювали при використанні α-білок носія / α-PS ELISA. Антигенність: Антигенність однакових кон„югатів в аналізі ELISA-типу, де захоплення та визначення антитіл були α -PS та α -білок, відповідно. Вміст вільного білка (%): Некон„югований білок носія може бути відокремлений від кон„югату під час етапу очистки. Вміст залишкового білка визначали при використанні ексклюзійної хроматографії розмірів (TSK 5000-PWXL), після чого проводили UV визначення (214 нм). Умови елюювання дозволяли проводити розділення вільного білка носія та кон„югату. Вміст вільного білка у кон„югатних партіях потім визначали проти калібрувальної кривої (від 0 до 50 (мкг/мл білка носія). Вільний білок носія у % так, як описано далі: % вільний носій = (вільний носій (мкг/мл)/ (загальна концентрація білка носія, виміряна згідно з Лоурі (мкг/мл)* 100%). Стабільність: Розподіл молекулярної маси (Kav) та стабільність вимірювали при використанні ВЕРХ-SEC гель-фільтрації (TSK 5000-PWXL) для кон„югатів, витриманих при 4°C, або таких, що зберігалися 7 днів при 37°C, 10/11/13/14-валентна характеристика приведена у Таблиці 2 (див. коментарі нижче). Білкові кон„югати можуть бути адсорбовані на фосфаті алюмінію та розділені на пули з утворенням заключної вакцини. Висновок: 25 UA 99703 C2 Були одержані імуногенні запропонованої вакцини. кон„югати, що були продемонстровані як компоненти Таблиця 2 характеристика кон„югатів Кон„югати СпіввідВільний Вільний ношення PS (Elisa) носій носій/PS Ratio PS1-PD 349-382* 1,5-1,6 1,0%-1,2% 3,9%-4,8% PS4-PD 93-100* 1,5-1,6 4,7-6,5% 3,2%-4,0% PS5-PD*** 367-443 0,80 8,72,2%-3,8% 11,2% PS6A-PD 1100-1540 0,61 4,5% Не проводили PS6B1069-1391 0,7-0,8 1,3
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of streptococcus pneumoniae immunogenic composition
Автори англійськоюBiemans Ralph Leon, Garcon Nathalie Marie-Josephe, Hermand Philippe Vincent, Poolman Jan, Van Mechelen Marcelle Paulette
Назва патенту російськоюПрименение иммуногенной композиции streptococcus pneumoniae
Автори російськоюБиманс Ральф Леон, Гарсон Натали Мари-Джозеф, Герман Филипп Винсент, Полман Ян, ван Мехелен Марсель Полетт
МПК / Мітки
МПК: A61K 39/09
Мітки: композиції, застосування, streptococcus, імуногенної, pneumoniae
Код посилання
<a href="https://ua.patents.su/48-99703-zastosuvannya-imunogenno-kompozici-streptococcus-pneumoniae.html" target="_blank" rel="follow" title="База патентів України">Застосування імуногенної композиції streptococcus pneumoniae</a>
Попередній патент: Спосіб одержання езетимібу й проміжних продуктів, використовуваних у цьому способі
Наступний патент: Спосіб скринінгу рослин, що проявляють зменшене знебарвлення поверхні, спричинене пораненням
Випадковий патент: Обертовий барабан