Інгібітори nedd8-активуючого ферменту
Номер патенту: 114894
Опубліковано: 28.08.2017
Автори: Селлс Тодд Б., МакКаррон Ешлі Сью, Стірлінг Меттью, Страуд Стефен Г.
Формула / Реферат
1. Сполука, яка являє собою {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамат формули I-216
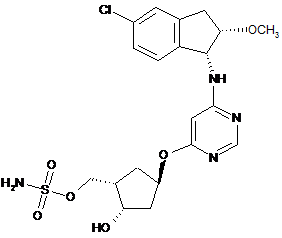 , I-216
, I-216
її фармацевтично прийнятна сіль або фармацевтично прийнятний гідрат вказаної сполуки або солі.
2. Сполука за п. 1, де фармацевтично прийнятна сіль являє собою гідрохлоридну сіль.
3. Сполука за п. 1, де фармацевтично прийнятний гідрат являє собою моногідрат гідрохлоридної солі {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату.
4. Гідрохлоридна сіль {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату по суті в кристалічній формі, що являє собою Форму І, яка характеризується порошковою дифракційною рентгенограмою (XRPD), що містить піки при наступних значеннях кута 2q: 4,5°, 15,2°, 21,3°, 21,8° і 24,0°, де кожне значення кута 2q визначено з точністю ±0,2°.
5. Кристалічна форма за п. 4, щонайменше 70 % якої відповідає кристалічній Формі І.
6. Кристалічна форма за п. 4, щонайменше 80 % якої відповідає кристалічній Формі І.
7. Кристалічна форма за п. 4, щонайменше 90 % якої відповідає кристалічній Формі І.
8. Кристалічна форма за п. 4, щонайменше 95 % якої відповідає кристалічній Формі І.
9. Кристалічна форма за будь-яким з пп. 4-8, де кристалічна Форма І характеризується порошковою дифракційною рентгенограмою (XRPD), що містить піки при наступних значеннях кута 2q: 4,5°, 7,5°, 14,4°, 14,6°, 15,2°, 15,9°, 19,5°, 21,3°, 21,8°, 22,4°, 22,7°, 24,0° і 24,8°, де кожне значення кута 2q визначено з точністю ±0,2°.
10. Кристалічна форма за п. 9, де кристалічна Форма І характеризується порошковою дифракційною рентгенограмою (XRPD), що містить піки при наступних значеннях кута 2q: 4,5°, 7,5°, 8,9°, 9,8°, 13,3°, 14,4°, 14,6°, 15,2°, 15,9°, 17,2°, 19,5°, 20,0°, 21,3°, 21,8°, 22,4°, 22,7°, 24,0°, 24,8°, 25,7° і 26,4°, де кожне значення кута 2q визначено з точністю ±0,2°.
11. Кристалічна форма за будь-яким з пп. 4-8, де кристалічна Форма І характеризується порошковою дифракційною рентгенограмою (XRPD), що містить референсний пік при значені кута 2q 4,5±0,3° і містить піки при наступних значеннях кута 2q: 10,7°, 16,8°, 17,3° і 19,5° відносно референсного піка.
12. Кристалічна форма за будь-яким з пп. 4-8, де кристалічна Форма І характеризується порошковою дифракційною рентгенограмою (XRPD), що містить референсний пік при значені кута 2q 4,5±0,3° і містить піки при наступних значеннях кута 2q: 3,0°, 9,9°, 10,1°, 10,7°, 11,4°, 15,0°, 16,8°, 17,3°, 17,9°, 18,2°, 19,5° і 20,3° відносно референсного піка.
13. Кристалічна форма за будь-яким з пп. 4-8, де кристалічна Форма І характеризується порошковою дифракційною рентгенограмою (XRPD), що містить референсний пік при значені кута 2q 4,5±0,3° і містить піки при наступних значеннях кута 2q: 3,0°, 4,4°, 5,3°, 8,8°, 9,9°, 10,1°, 10,7°, 11,4°, 12,7°, 15,0°, 15,5°, 16,8°, 17,3°, 17,9°, 18,2°, 19,5°, 20,3°, 21,2° і 21,9° відносно референсного піка.
14. Кристалічна форма за будь-яким з пп. 4-8, де кристалічна Форма І характеризується порошковою дифракційною рентгенограмою (XRPD), по суті такою ж, як показано на Фіг. 4.
15. Кристалічна форма за будь-яким з пп. 4-8, де кристалічна Форма І характеризується термограмою диференціальної скануючої калориметрії (DSC) з ендотермою приблизно при 135,7 °C і переходом приблизно при 129,6 °C.
16. Кристалічна форма за будь-яким з пп. 4-8, де кристалічна Форма І характеризуется DSC-термограмою, по суті такою ж, як показано на Фіг. 5.
17. Кристалічна форма за будь-яким з пп. 4-8, де кристалічна Форма І характеризуется термограмою термогравіометричного аналізу (TGA), де втрата маси становить приблизно 3,7 % від приблизно 100 °C до приблизно 150 °C.
18. Кристалічна форма за будь-яким з пп. 4-8, де кристалічна Форма І характеризуется TGA-термограмою, по суті такою ж, як показано на Фіг. 6.
19. Гідрохлоридна сіль {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату по суті в кристалічній формі, яка являє собою Форму II, що характеризується порошковою дифракційною рентгенограмою (XRPD), що містить піки при наступних значеннях кута 2q: 8,7°, 15,2°, 15,7°, 19,6° і 24,2°, де кожне значення кута 2q визначено з точністю ±0,2°.
20. Кристалічна форма за п. 19, щонайменше 70 % якої відповідає кристалічній Формі II.
21. Кристалічна форма за п. 19, щонайменше 80 % якої відповідає кристалічній Формі II.
22. Кристалічна форма за п. 19, щонайменше 90 % якої відповідає кристалічній Формі II.
23. Кристалічна форма за п. 19, щонайменше 95 % якої відповідає кристалічній Формі II.
24. Кристалічна форма за будь-яким з пп. 19-23, де кристалічна Форма II характеризується порошковою дифракційною рентгенограмою (XRPD), що містить піки при наступних значеннях кута 2q: 4,3°, 8,7°, 15,2°, 15,7°, 19,6°, 20,0°, 20,8°, 22,5°, 23,1° і 24,2°, де кожне значення кута 2q визначено з точністю ±0,2°.
25. Кристалічна форма за п. 24, де кристаллическая Форма II характеризується порошковою дифракційною рентгенограмою (XRPD), що містить піки при наступних значеннях кута 2q: 4,3°, 8,7°, 12,4°, 14,5°, 15,2°, 15,7°, 17,3°, 18,2°, 18,5°, 19,6°, 20,0°, 20,8°, 22,0°, 22,5°, 23,1°, 24,2°, 24,7°, 25,7°, 28,2° і 29,4, де кожне значення кута 2q визначено з точністю ±0,2°.
26. Кристалічна форма за будь-яким з пп. 19-23, де кристалічна Форма II характеризується порошковою дифракційною рентгенограмою (XRPD), що містить референсний пік при значенні кута 2q 8,7±0,3° і містить піки при наступних значеннях кута 2q: -4,4°, 6,5°, 7,0°, 10,9°, 11,3°, 12,1°, 13,8°, 14,4° і 15,5° відносно референсного піка.
27. Кристалічна форма за будь-яким з пп. 19-23, де кристалічна Форма II характеризується порошковою дифракційною рентгенограмою (XRPD), що містить референсний пік при значенні кута 2q 8,7±0,3° і містить піки при наступних значеннях кута 2q: -4,4°, 3,7°, 5,8°, 6,5°, 7,0°, 8,6°, 9,5°, 9,8°, 10,9°, 11,3°, 13,3°, 13,8°, 14,4°, 15,5°, 16,0°, 17,0°, 19,5° і 20,7° відносно референсного піка.
28. Кристалічна форма за будь-яким з пп. 19-23, де кристалічна Форма II характеризується порошковою дифракційною рентгенограмою (XRPD), по суті такою ж, як показано на Фіг. 10.
29. Композиція, яка містить сполуку за п. 1, її фармацевтично прийнятну сіль або фармацевтично прийнятний гідрат вказаної сполуки або солі і фармацевтично прийнятний носій.
30. Композиція за п. 29, придатна для перорального введення.
31. Спосіб лікування раку, що включає введення суб’єкту, який потребує цього, сполуки за п. 1, її фармацевтично прийнятної солі або фармацевтично прийнятного гідрату вказаної сполуки або солі.
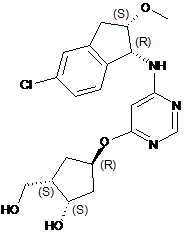
32. Спосіб одержання {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату формули I-216
 I-216
I-216
або його гідрохлоридної солі, необов’язково в кристалічній Формі І,
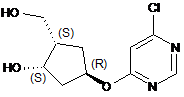
який включає сульфаматування первинної спиртової групи в сполуці формули (27)
 (27)
(27)
з одержанням {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату.
33. Спосіб за п. 32, який додатково включає обробку {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату хлористоводневою кислотою з одержанням гідрохлоридної солі {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату.
34. Спосіб за п. 33, який додатково включає обробку гідрохлоридної солі {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату антирозчинником з утворенням Форми І гідрохлоридної солі {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату.
35. Спосіб за п. 32, де сполуку формули (27) одержано шляхом взаємодії сполуки формули (26)
 (26)
(26)
з сполукою формули (20)
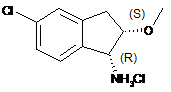 (20).
(20).
36. Спосіб одержання {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату формули I-216
 I-216
I-216
або його гідрохлоридної солі,
що включає сульфаматування сполуки формули (16)
 (16)
(16)
і депротектування в кислотних умовах з утворенням {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату.
37. Спосіб за п. 36, що додатково включає обробку {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату хлористоводневою кислотою з одержанням гідрохлоридної солі {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метилсульфамату.
38. Спосіб за п. 36, де сполука формули (16) одержана взаємодією сполуки формули (15)
 (15)
(15)
з сполукою формули (8)
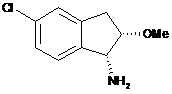 (8).
(8).
Текст
Реферат: Описані хімічні речовини, які є інгібіторами Need8-активуючого ферменту (NAE), а саме сполука {(1S,2S,4R)-4-[(6-{[(1R,2S)-5-хлор-2-метокси-2,3-дигідро-1Н-інден-1-іл]аміно}піримідин-4-іл)окси]2-гідроксициклопентил}метилсульфамат і її фармацевтично прийнятні солі; їх тверді форми і їх проліки. Також описані способи застосування цих хімічних речовин для лікування розладів, таких як рак. UA 114894 C2 (12) UA 114894 C2 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 ІНГІБІТОРИ NEDD8-АКТИВУЮЧОГО ФЕРМЕНТУ ГАЛУЗЬ ТЕХНІКИ [001] ЦейЦей винахід належить до сполук, композицій і способів лікування різних розладів, особливо розладів клітинної проліферації, включаючи ракові захворювання і запальні розлади. Зокрема, у цьому винаході представлені сполуки, які інгібують активність NEDD8-активуючого ферменту. РІВЕНЬ ТЕХНІКИ [002] Посттрансляційна модифікація білків убіквітин-подібних молекул (убпм) єє важливим внутрішньоклітинним регуляторним процесом, що відіграє ключові ролі в регулюванні багатьох біологічних процесів, включаючи розподіл клітин, клітинну сигналізацію й імунну реакцію. Убпм є невеликими білками, ковалентно приєднаними до лізину на білку-мішені за рахунок ізопептидного зв'язку з С-кінцевим гліцином убпм. Убіквітин-подібна молекула змінює молекулярну поверхню білка-мішені й може впливати на такі властивості як білок-білкові взаємодії, ферментативна активність, стабільність і клітинна локалізація мішені. [003] Убіквітин і інші убпм активуються специфічним ферментом Е1, який каталізує утворення ацил-аденілатної проміжної сполуки із С-кінцевим гліцином убпм. Потім активована убп молекула переноситься на каталітичний залишок цистеїна ферменту Е1 за рахунок утворення проміжного тіоефірного зв'язку. Проміжна сполука Е1-убпм і Е2 зв'язуються, у результаті чого відбувається тіоефірний обмін, де убпм переноситься на активний сайт цистеїна Е2. Потім убпм прямо або в сполученні з лігазою Е3 спрягається з білком-мішенню за рахунок утворення ізопептидного зв'язку з аміногрупою бічного ланцюга лізина білка-мішені. [004] Біологічна послідовність модифікації убпм залежить від розглянутої мішені. Убіквітин є найкраще описаним убпм, і послідовність модифікації під дією убіквітина полягає в розкладанні полі-убіквітинільованих білків протеасомою 26S. Убіквітин сполучений з його білками-мішенями за допомогою ферментативного каскаду, що включає специфічний Е1-активуючий фермент, Uba1 (убіквітин-активуючий фермент, UAE), кон'югуючий фермент із сімейства Е2s і убіквітинлігазу із класів RING або HECT Е3s. Дивися Huang et al., Oncogene, 23:1958- 71 (2004). Специфічність до мішені контролюється певною комбінацією білка Е2 і Е3, в цей час відомо >40 E2s і >100 E3s. Крім убіквітина, існує, щонайменше, 10 убіквітин-подібних білків, які, як передбачається, активуються специфічним Е1-активуючим ферментом і переробляються подібним, але окремим шляхам спряження в нисхідному напрямку. Інші убпм, для яких були ідентифіковані Е1-активуючі ферменти, включають Nedd8 (APPBP-1 Uba3), ISG15 (UBE1L) і сімейство SUMO (Aos-1 Uba2). [005] Убпм Nedd8 активується гетеродимерним Nedd8-активуючим ферментом (APPBP-1 Uba3) (NAE) і переноситься на один E2 (Ubc12), в остаточному підсумку приводячи до легування з куліновими білками. Функція недилювання полягає в активації основаних на куліні убіквітинових кіназ, що приймають участь в убіквітуванні, і, отже, у відновленні багатьох клітинних циклів і клітинних сигнальних білків, включаючи p27 і I- κB. Дивися Pan et al., Oncogene. 23:1985- 97 (2004). Убпм SUMO активується гетеродимерним SUMO- активуючим ферментом (Aos-1 Uba2) (SAE) і переноситься на один E2 (Ubc9), з наступною координацією з декількома лігазами Е3, що в остаточному підсумку приводить до сумоілювання білків-мішеней. Sumo-модифікація може впливати на клітинну локалізацію білків-мішеней, і білки, модифіковані членами сімейства SUMO, беруть участь в нуклеарному транспорті, сигнальній трансдукції й стресовій реакції. Дивися Seeler and Dejean, Nat Rev Mol Cell Biol. 4:690- 9, (2003). Функція сумоілювання включає активацію клітинних сигнальних шляхів (наприклад, передачу сигналів цитокінами, WNT, факторами росту й стероїдними гормонами), що приймають участь в регуляції транскрипції; а також шляхів, що приймають участь у контролюванні геномної цілісності (наприклад, реплікація ДНК, реакція на ушкодження ДНК, рекомбінація й репарація). Дивися Muller et al, Oncogene. 23:1998- 2006, (2004). Існують інші убпм (наприклад, ISG15, FAT10, Apg12p), біологічні функції яких ще вивчаються. [006] Особливо важливим шляхом, який регулюється активністю Е1-активуючого ферменту єє убіквітин-протеасомний шлях (UPP). Як розглянуто вище, ферменти UAE і NAE регулюють UPP надвох різних стадіях каскаду убіквітинілювання. UAE активує убіквітин на першій стадії цього каскаду, тоді як NAE, за допомогою активації Nedd8, відповідає за активацію основаних на куліні лігаз, які, у свою чергу, необхідні для остаточного переносу убіквітина до певних білокмішеней. Функціональний шлях UPP необхідний для збереження нормальної клітини. UPP відіграє центральну роль у кругообігу багатьох ключових регуляторних білків, що приймають участь у транскрипції, розвитку клітинного циклу й апоптозі, які важливі при хворобливих станів, включаючи ракові клітини. Дивися, наприклад, King et al., Science 274: 1652- 1659 (1996); Vorhees et al., Clin. Cancer Res., 9: 6316- 6325 (2003); і Adams et al., Nat. Rev. Cancer, 4: 349- 360 1 UA 114894 C2 5 10 15 20 25 30 35 (2004). Проліферуючі клітини особливо сприйнятливі до інгібування UPP. Дивися Drexler, Proc. Natl. Acad. Sci., USA 94: 855- 860 (1977). Роль UPP шляху в онкогенезі обумовила дослідження протеасомного інгібування як потенційної протиракової терапії. Наприклад, доведено, що модулювання шляху UPP за рахунок інгібування протеасоми 26S дією VELCADE® (бортезоміб) є ефективним лікуванням деяких видів раку, і воно схвалене для лікування пацієнтів, що страждають від множинної мієломи й лімфоми мантійних клітин, які до цього пройшли, щонайменше, одне лікування. Приклади білків, рівні яких контролюються заснованими на куліні убіквітин-лігазами, які перебувають у нисхідному напрямку активності NAE і UAE, включають CDK інгібітор p27Kip1 і інгібітор NFκB, IκB. Дивися Podust et al., Proc. Natl. Acad. Sci., 97: 45794584 (2000), і Read et al., Mol. Cell Biol., 20: 2326- 2333 (2000). Інгібування розкладання p27, як допускають, зупиняє розвиток клітин на фазах G1 і S клітинного циклу. Втручання за рахунок розкладання IκB повинно запобігати нуклеарній локалізації NF-κB, транскрипції різних NF-κBзалежних генів, зв'язаних із злоякісним фенотипом, і резистентність до стандартних цитотоксичних терапій. Крім того, NF-κB відіграє ключову роль в експресії ряду прозапальних медіаторів, означаючи роль таких інгібіторів у запальних захворюваннях. Більше того, інгібування UPP є придатною мішенню для додаткових терапевтичних показань, таких як запальні розлади, включаючи, наприклад, ревматоїдний артрит, астму, розсіяний склероз, псоріаз і реперфузійне ушкодження; нейродегенеративні розлади, включаючи, наприклад, хворобу Паркінсона, хворобу Альцгеймера, розлади триплетних повторів; невропатичний біль; ішемічні розлади, наприклад, інсульт, інфаркт, розлади нирок; і кахексію. Дивися, наприклад, Elliott and Ross, Am. J. Clin. Pathol., 116:637- 46 (2001); Elliott et al., J. Mol. Med., 81:235- 45 (2003); Tarlac and Storey, J. Neurosci. Res. 74: 406- 416 (2003); Mori et al., Neuropath. Appl. Neurobiol., 31:53- 61 (2005); Manning, Curr. Pain Headache Rep., 8: 192- 8 (2004); Dawson and Dawson, Science, 302: 819- 822 (2003); Kukan, J. Physiol. Pharmacol., 55:3- 15 (2004); Wojcik and Dinapoli, Stroke, 35:1506- 18 (2004); Lazarus et al., Am J Physiol., 27:E332- 41 (1999). [007] Спрямована дія Е1-активуючих ферментів дає унікальну можливість втручання в різні біохімічні шляхи, важливі для підтримки працездатності розподілу клітин і клітинної сигналізації. Е1-активуючі ферменти діють на першій стадії спряження убпм; тому інгібування Е1активуючого ферменту буде специфічно модулювати наступні біологічні послідовності модифікації убпм. Отже, інгібування цих активованих ферментів і, як результат, інгібування наступних ефектів убпм-спряження, є способом втручання в працездатність розподілу клітин, клітинної сигналізації й деяких аспектів клітинної фізіології, які є важливими для механізмів захворювання. Таким чином, ферменти Е1, такі як UAE, NAE і SAE, як регулятори різних клітинних функцій, є потенційно важливими терапевтичними мішенями для визначення нових підходів до лікування захворювань і розладів. [008] У заявці на патент Сполучених Штатів Америки № 11/346469 (поданої 2 лютого 2006 року, публікація № US 2006/0189636) і в заявці на Міжнародний патент № PCT/US06/04637 (поданої 2 лютого 2006 року, публікація № WO 2006/084281) (узагальнено, "Critchley et al.") описані різні інгібітори ферменту Е1 формули: R4 O O S X R4 R5 Y A m R3c 3a R H2N 40 R5' R3b R3d , де: Rk R R j N R1 R1 N N N A-i N N N R2 A-ii , 2 R1 N N N Ає Rk j N R2 , A-iii R2 , UA 114894 C2 Rj Rk R R j N N j R1 R1 R N N N j R1 N N N Rk R1 N N N Rh Rh Rh R2 Rh A-vi аб A-vii о У цих заявках не описані хімічні сполуки, розглянуті в дійсній заявці. [009] У заявці на патент Сполучених Штатів Америки № 11/700614 (поданої 31 січня 2007 року, публікація № US 2007/0191293) і в заявці на Міжнародний патент № PCT/US07/02560 (поданої 31 січня 2007 року, публікація № WO 2007/092213) (узагальнено, "Langston et al.") описані різні інгібітори ферменту Е1 формули: A-v A-iv 5 R2 N A Rf Re R Y Re' * * O m O S X Rc Ra b R Rd H2N , f де: Rk R R j N Rk j Rg Rg N N N N N R Rj Rh A-i N R k N R Rg N A-iv R Rh , A-v R Rg N N h Rj g N N N R Rh , Rk j N Rh A-iii , N N 10 N Rh A-ii , Rj Rg N N N Aє Rg N h N Rh h A-vi , о аб A-vii . У цих заявках не описані хімічні сполуки, розглянуті в дійсній заявці. [010] У заявці на патент Сполучених Штатів Америки № 11/890338 (поданої 6 серпня 2007 року, публікація № US 2008/0051404) і в заявці на Міжнародний патент № PCT/US07/17463 (поданої 6 серпня 2007 року, публікація № WO 2008/019124) (узагальнено, "Claiborne et al.") описані різні інгібітори ферменту Е1 формули: 3 UA 114894 C2 Rf Re W R Y Re' O m O S X Rc Ra b H2N R Rd A f , де: 5 10 15 20 25 30 35 40 45 50 Кільце A є 6-членним азотвмісним гетероарильним кільцем, необов'язково конденсованим з 5- або 6-членним арильним, гетероарильним, циклоаліфатичним або гетероциклічним кільцем; і 1 1 1 W є -CH2-, -CHF-, -CF2-, -CH(R )-, -CF(R )-, -NH-, -N(R )-, -O-, -S- або -NHC(O)-. У цих заявках не описані хімічні сполуки, розглянуті в дійсній заявці. [011] У той же час державними органами охорони здоров'я не був схвалений жоден інгібітор Е1-активуючого ферменту як лікарський засіб. Зберігається потреба в інгібіторах Е1-активуючих ферментах, таких як NAE. КОРОТКИЙ ОПИС ВИНАХОДУ [012] В одному аспекті цей винахід належить до хімічних речовин, які є сполукою {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4-іл)окси]-2гідроксициклопентил}метил сульфаматом (I-216) і її фармацевтично прийнятні солі й проліки. [013] В одному аспекті цей винахід належить до композицій, що містять хімічну речовину, яка є сполукою {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфаматом (I-216) або її фармацевтично прийнятну сіль, або її проліки, і один або більше фармацевтично прийнятних носіїв. [014] В одному аспекті цей винахід належить до твердих форм сполуки {(1S, 2S, 4R)-4-[(6{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4-іл)окси]-2гідроксициклопентил}метил сульфамата (I-216) або її фармацевтично прийнятної солі. [015] В одному аспекті цей винахід належить до способів лікування раку, що включають введення пацієнту, що потребує такого лікування, хімічної речовини, яка є сполукою {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4-іл)окси]-2гідроксициклопентил}метил сульфаматом (I-216), або її фармацевтично прийнятної солі або її проліків. КОРОТКИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ [016] Фігура 1 ілюструє фармакодинамічні й фармакокінетичні параметри {(1S, 2S, 4R)-2гідрокси-4-[(6-{[(1R, 2S)-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4іл)окси]циклопентил}метил сульфамата (I-115) у самок "голих" мишей Ncr із ксенотрансплантатами пухлини HCT116 після однократного підшкірного введення при 30 мг/кг. [017] Фігура 2 ілюструє фармакодинамічні й фармакокінетичні параметри {(1S, 2S, 4R)-4-[(6{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4-іл)окси-2гідроксициклопентил}метил сульфамата (I-216) у самок "голих" мишей Ncr із ксенотрансплантатами пухлини HCT116 після однократного підшкірного введення при 10 мг/кг. [018] Фігура 3 ілюструє фармакодинамічні й фармакокінетичні параметри {(1S, 2S, 4R)-4-[(6{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4-іл)окси-2гідроксициклопентил}метил сульфамата (I-216) у самок "голих" мишей Ncr із ксенотрансплантатами пухлини HCT116 після однократного підшкірного введення при 30 мг/кг. [019] Фігура 4 ілюструє діаграму рентгенівської порошкової дифракції (РПД) для кристалічної Форми I {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин4-іл)окси]-2-гідроксициклопентил}метил сульфамата (I-216) гідрохлорида. [020] Фігура 5 ілюструє термограму диференціальної скануючої калориметрії (ДСК) для кристалічної Форми I {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфамата (I-216) гідрохлорида. [021] Фігура 6 ілюструє термограму термогравіметричного аналізу (ТГА) для кристалічної Форми I {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин4-іл)окси]-2-гідроксициклопентил}метил сульфамата (I-216) гідрохлорида. [022] Фігура 7 ілюструє діаграму рентгенівської порошкової дифракції (РПД) для кристалічної Форми I {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин4-іл)окси]-2-гідроксициклопентил}метил сульфамата (I-216) гідрохлорида, отриманого в Прикладі 2, нижче. 4 UA 114894 C2 5 10 15 [023] Фігура 8 ілюструє термограму диференціальної скануючої калориметрії (ДСК) для кристалічної Форми I {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфамата (I-216) гідрохлорида, отриманого в Прикладі 2, нижче. [024] Фігура 9 ілюструє термограму термогравіметричного аналізу (ТГА) для кристалічної Форми I {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин4-іл)окси]-2-гідроксициклопентил}метил сульфамата (I-216) гідрохлорида, отриманого в Прикладі 2, нижче. [025] Фігура 10 ілюструє діаграму рентгенівської порошкової дифракції (РПД) для кристалічної Форми II {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфамата (I-216) гідрохлорида, отриманого в Прикладі 9, нижче. ОПИС [026] Представлені хімічні сполуки, які є ефективними як інгібітори Nedd8-активуючого ферменту (NAE). Ці хімічні сполуки застосовують для інгібування активності NAE in vitro та in vivo і придатні для лікування розладів клітинної проліферації, зокрема, раку, і інших розладів, пов'язаних з активністю NAE. Ці хімічні речовини є {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфаматом (що згадується в цьому документі як "I-216"). 20 Cl OCH3 NH N O O H2N S O O HO 25 30 N ; і нековалентно зв'язаними молекулярними сполуками. Таким чином, хімічна речовина, що містить сполуку I-216, включає, наприклад, вільну сполуку I-216, фармацевтично прийнятні солі I-216, фармацевтично прийнятні сольвати I-216 і фармацевтично прийнятні сольвати фармацевтично прийнятних солей I-216. У деяких варіантах реалізації, хімічна речовина є вільною сполукою I-216 або її фармацевтично прийнятною сіллю. У деяких варіантах реалізації, хімічна сполука є фармацевтично прийнятною сіллю I-216. У деяких варіантах реалізації, хімічна речовина є вільною сполукою I-216 або її фармацевтично прийнятним сольватом. У деяких варіантах реалізації, хімічна сполука є фармацевтично прийнятним сольватом фармацевтично прийнятної солі I-216. [027] У публікації Claiborne et al. описані різні інгібітори ферментів E1, включаючи NAE. Наприклад, учені Claiborne et al. описують, що сполуки в наступній Таблиці 1 демонструють значення IC50 менші або рівні 500 нМ в аналізі NAE (Приклад 137 у публікації Claiborne). Таблиця 1 I-1 I-2 I-3 I-5 I-6 I-8 {(1R, 2R, 3S, 4R)-4-[(6-{[(1S)-4-фтор-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4-іл)аміно]2,3-дигідроксициклопентил}метил сульфамат; {(1R, 2R, 3S, 4R)-2,3-дигідрокси-4-[(6-{[(1R, 2S)-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}піримідин-4-іл)аміно]циклопентил}метил сульфамат; [(1R, 2R, 3S, 4R)-2,3-дигідрокси-4-(9H-пурин-6-іламіно)циклопентил]метил сульфамат; [(1S, 2S, 4R)-4-({6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]піримідин-4-іл}аміно)-2гідроксициклопентил]метил сульфамат; {(1R, 2R, 3S, 4R)-4-[(6-{[(1S)-4,7-дифтор-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4іл)аміно]-2,3-дигідроксициклопентил}метил сульфамат; [(1R, 2R, 3S, 4R)-4-({6-[(1R)-2,3-дигідро-1H-інден-1-іламіно]піримідин-4-іл}аміно)-2,3дигідроксициклопентил]метил сульфамат; 5 UA 114894 C2 Таблиця 1 I-9 I-10 I-11 I-12 I-14 I-15 I-17 I-18 I-19 I-21 I-24 I-25 I-26 I-27 I-29 I-32 I-34 I-37 I-38 I-39 I-40 I-41 I-42 I-43 I-45 I-46 I-47 I-49 {(1R, 2R, 3S, 4R)-2,3-дигідрокси-4-[(8-феніл-9H-пурин-6-іл)аміно]циклопентил}метил сульфамат; [(1R, 2R, 3S, 4R)-2,3-дигідрокси-4-({2-[(3-метил-2,3-дигідро-1H-інден-1-іл)аміно]піримідин4-іл}аміно)циклопентил]метил сульфамат; [(1S, 2R, 3S, 4R)-4-({6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]піримідин-4-іл}аміно)-2,3дигідроксициклопентил]метил сульфамат; [(1R, 2R, 3S, 4R)-2,3-дигідрокси-4-({6-[(1S)-1,2,3,4-тетрагідронафталін-1іламіно]піримідин-4-іл}аміно)циклопентил]метил сульфамат; [(1R, 2R, 3S, 4R)-4-({6-[(циклогексилметил)аміно]піримідин-4-іл}аміно)-2,3дигідроксициклопентил]метил сульфамат; {(1R, 2R, 3S, 4R)-4-[(2-{[(1S)-3,3-диметил-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4іл)аміно]-2,3-дигідроксициклопентил}метил сульфамат; {(1R, 2R, 3S, 4R)-4-[(6-{[(1S)-5,6-дифтор-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4іл)аміно]-2,3-дигідроксициклопентил}метил сульфамат; [(1R, 2R, 3S, 4R)-4-({6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]-2-метилпіримідин-4-іл}аміно)2,3-дигідроксициклопентил]метил сульфамат; {(1R, 2R, 3S, 4R)-4-[(6-{[(1S)-5-хлор-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4-іл)аміно]2,3-дигідроксициклопентил}метил сульфамат; {(1R, 2R, 3S, 4R)-4-[(6-{[(1S)-3,3-диметил-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4іл)аміно]-2,3-дигідроксициклопентил}метил сульфамат; {(1R, 2R, 3S, 4R)-4-[(6-{[(1S)-4-хлор-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4-іл)аміно]2,3-дигідроксициклопентил}метил сульфамат; [(1R, 2S, 4R)-4-({6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]піримідин-4-іл}аміно)-2гідроксициклопентил]метил сульфамат; [(1R, 2R, 3S, 4R)-4-({4-[(1S)-2,3-дигідро-1H-інден-1-іламіно]-1,3,5-триазин-2-іл}аміно)-2,3дигідроксициклопентил]метил сульфамат; ((1R, 2R, 3S, 4R)-4-{[6-(бензиламіно)піримідин-4-іл]аміно}-2,3дигідроксициклопентил)метил сульфамат; [(1R, 2R, 3S, 4R)-4-({6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]піримідин-4-іл}аміно)-2,3дигідроксициклопентил]метил сульфамат; [(1S, 2S, 4R)-4-({6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]-5-метилпіримідин-4-іл}окси)-2гідроксициклопентил]метил сульфамат; ((1S, 2S, 4R)-4-{[8-(2-хлорфеніл)-9H-пурин-6-іл]аміно}-2-гідроксициклопентил)метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[8-(2-феноксифеніл)-9H-пурин-6-іл]аміно}циклопентил)метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(6-феніл-7H-пирроло[2,3-d]піримідин-4іл)аміно]циклопентил}метил сульфамат; {(1S, 2S, 4R)-4-[(8-дибензо[b, d]фуран-4-іл-9H-пурин-6-іл)аміно]-2гідроксициклопентил}метил сульфамат; [(1S, 2S, 4R)-2-гідрокси-4-({6-[(1S)-1,2,3,4-тетрагідронафталін-1-іламіно]піримідин-4іл}окси)циклопентил]метил сульфамат; ((1S, 2S, 4R)-4-{[8-(2,3-дигідро-1,4-бензодиоксин-5-іл)-9H-пурин-6-іл]аміно}-2гідроксициклопентил)метил сульфамат; [(1S, 2S, 4R)-2-гідрокси-4-({6-[(1-нафтилметил)аміно]піримідин-4іл}окси)циклопентил]метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1S, 2S)-2-метил-2,3-дигідро-1H-інден-1-іл]аміно}піримідин4-іл)окси]циклопентил}метил сульфамат; [(1R, 2R, 3S, 4R)-4-({4-[(1S)-2,3-дигідро-1H-інден-1-іламіно]-6-метил-1,3,5-триазин-2іл}аміно)-2,3-дигідроксициклопентил]метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{метил[8-(1-нафтил)-9H-пурин-6-іл]аміно}циклопентил)метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1R, 2S)-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}піримідин-4-іл)аміно]циклопентил}метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[8-(1-нафтил)-9H-пурин-6-іл]аміно}циклопентил)метил сульфамат; 6 UA 114894 C2 Таблиця 1 I-55 I-56 I-60 I-62 I-63 I-64 I-65 I-67 I-68 I-69 I-71 I-73 I-74 I-82 I-83 I-84 I-87 I-88 I-90 I-93 I-99 I-100 I-101 I-102 I-103 I-105 I-106 I-107 I-108 I-109 {(1R, 2R, 3S, 4R)-2,3-дигідрокси-4-[(4-{[(1R, 2S)-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}-1,3,5-триазин-2-іл)аміно]циклопентил}метил сульфамат; ((1S, 2S, 4R)-4-{[6-хлор-2-(1-нафтил)-3H-имидазо[4,5-b]піридин-7-іл]аміно}-2гідроксициклопентил)метил сульфамат; ((1S, 2S, 4R)-4-{[8-(3-хлорфеніл)-9H-пурин-6-іл]аміно}-2-гідроксициклопентил)метил сульфамат; [(1S, 2S, 4R)-2-гідрокси-4-({8-[2-(трифторметокси)феніл]-9H-пурин-6іл}аміно)циклопентил]метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(8-феніл-9H-пурин-6-іл)окси]циклопентил}метил сульфамат; [(1S, 2S, 4R)-4-({8-[4-(диметиламіно)-1-нафтил]-9H-пурин-6-іл}аміно)-2гідроксициклопентил]метил сульфамат; {(1S, 2S, 4R)-4-[(6-{[(1S)-3,3-диметил-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4іл)аміно]-2-гідроксициклопентил}метил сульфамат; ((1S, 2S, 4R)-4-{[8-(2,3-диметоксифеніл)-9H-пурин-6-іл]аміно}-2гідроксициклопентил)метил сульфамат; [(1S, 2S, 4R)-4-({8-[2-(бензилокси)феніл]-9H-пурин-6-іл}аміно)-2гідроксициклопентил]метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(8-феніл-9H-пурин-6-іл)аміно]циклопентил}метил сульфамат; {(1S, 2S, 4R)-4-[(6-{[(1S)-3,3-диметил-2,3-дигідро-1H-інден-1-іл]аміно}-5-фторпіримідин-4іл)аміно]-2-гідроксициклопентил}метил сульфамат; ((1S, 2S, 4R)-4-{[8-(7-хлорхінолін-4-іл)-7H-пурин-6-іл]окси}-2-гідроксициклопентил)метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[6-(1-нафтил)-7H-пирроло[2,3-d]піримідин-4іл]аміно}циклопентил)метил сульфамат; N-({(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1R, 2S)-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}піримідин-4-іл)окси]циклопентил}метил)сульфамід {(1S, 2S, 4R)-4-[(5-фтор-6-{[(1R, 2S)-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}піримідин4-іл)окси]-2-гідроксициклопентил}метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(8-хінолін-8-іл-7H-пурин-6-іл)аміно]циклопентил}метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[8-(1-нафтил)-9H-пурин-6-іл]окси}циклопентил)метил сульфамат; {(1S, 2S, 4R)-4-[(8-бензил-9H-пурин-6-іл)аміно]-2-гідроксициклопентил}метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(2-феніл[1,3]оксазоло[5,4-d]піримідин-7іл)аміно]циклопентил}метил сульфамат; ((1S, 2S, 4R)-4-{[8-(2,6-диметоксифеніл)-9H-пурин-6-іл]аміно}-2гідроксициклопентил)метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[8-(3-метоксифеніл)-9H-пурин-6-іл]аміно}циклопентил)метил сульфамат; ((1S, 2S, 4R)-4-{[8-(2,2-диметил-2,3-дигідро-1-бензофуран-7-іл)-9H-пурин-6-іл]аміно}-2гідроксициклопентил)метил сульфамат; [(1S, 2S, 4R)-2-гідрокси-4-({8-[(3-метилфеніл)сульфоніл]-9H-пурин-6іл}окси)циклопентил]метил сульфамат; [(1S, 2S, 4R)-4-({8-[4-(бензилокси)феніл]-7H-пурин-6-іл}аміно)-2гідроксициклопентил]метил сульфамат; [(1S, 2S, 4R)-4-({8-[4-(диметиламіно)-1-нафтил]-7H-пурин-6-іл}окси)-2гідроксициклопентил]метил сульфамат; {(1S, 2S, 4R)-4-[(8-біфеніл-3-іл-9H-пурин-6-іл)аміно]-2-гідроксициклопентил}метил сульфамат; {(1R, 2R, 3S, 4R)-4-[{6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]піримідин-4-іл}(метил)аміно]2,3-дигідроксициклопентил}метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[8-(2-метилфеніл)-9H-пурин-6-іл]аміно}циклопентил)метил сульфамат; ((1R, 2R, 3S, 4R)-2,3-дигідрокси-4-{[6-(фенілэтинил)піримідин-4іл]аміно}циклопентил)метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[2-(1-нафтил)-3H-имидазо[4,5-b]піридин-7іл]окси}циклопентил)метил сульфамат; 7 UA 114894 C2 Таблиця 1 I-111 I-112 I-115 I-117 I-118 I-121 I-122 I-124 I-125 I-126 I-128 I-129 I-130 I-131 I-133 I-134 I-136 I-137 I-139 I-140 I-142 I-143 I-146 I-147 I-150 I-151 I-153 ((1S, 2S, 4R)-4-{[8-(4-хлорфеніл)-9H-пурин-6-іл]аміно}-2-гідроксициклопентил)метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(8-изохінолін-4-іл-7H-пурин-6-іл)окси]циклопентил}метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1R, 2S)-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}піримідин-4-іл)окси]циклопентил}метил сульфамат; ((1S, 2S, 4R)-4-{[8-(2,3-дигідро-1-бензофуран-7-іл)-7H-пурин-6-іл]аміно}-2гідроксициклопентил)метил сульфамат; ((1R, 2R, 3S, 4R)-2,3-дигідрокси-4-{[6-(5,6,7,8-тетрагідронафталін-1-іламіно)піримідин-4іл]аміно}циклопентил)метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[8-(1,2,3,4-тетрагідронафталін-1-іл)-9H-пурин-6іл]аміно}циклопентил)метил сульфамат; [(1S, 2S, 4R)-2-гідрокси-4-({8-[2-(трифторметил)феніл]-9H-пурин-6іл}аміно)циклопентил]метил сульфамат; {(1S, 2S, 4R)-4-[(6-{[(1S)-3,3-диметил-2,3-дигідро-1H-інден-1-іл]аміно}піримідин-4-іл)окси]2-гідроксициклопентил}метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(4-{[(1R, 2S)-2-метокси-2,3-дигідро-1H-інден-1-іл]аміно}-1,3,5триазин-2-іл)аміно]циклопентил}метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[8-(5,6,7,8-тетрагідронафталін-1-іл)-9H-пурин-6іл]аміно}циклопентил)метил сульфамат; {(1S, 2S, 4R)-4-[(8-циклогексил-9H-пурин-6-іл)аміно]-2-гідроксициклопентил}метил сульфамат; ((1S, 2S, 4R)-4-{[8-(1-бензил-1H-пиразол-4-іл)-7H-пурин-6-іл]окси}-2гідроксициклопентил)метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(9-метил-8-феніл-9H-пурин-6-іл)аміно]циклопентил}метил сульфамат; {(1S, 2S, 4R)-4-[(8-трет-бутил-9H-пурин-6-іл)аміно]-2-гідроксициклопентил}метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[8-(2-метоксифеніл)-9H-пурин-6-іл]аміно}циклопентил)метил сульфамат; {(1S, 2S, 4R)-4-[(4-{[(1S)-3,3-диметил-2,3-дигідро-1H-інден-1-іл]аміно}-1,3,5-триазин-2іл)аміно]-2-гідроксициклопентил}метил сульфамат; [(1S, 2S, 4R)-2-гідрокси-4-({8-[(3-метилфеніл)сульфанил]-7H-пурин-6іл}окси)циклопентил]метил сульфамат; [(1S, 2S, 4R)-4-({8-[2-(диметиламіно)феніл]-9H-пурин-6-іл}аміно)-2гідроксициклопентил]метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[8-(4-пирролидин-1-іл-1-нафтил)-7H-пурин-6іл]окси}циклопентил)метил сульфамат; ((1S, 2S, 4R)-2-гідрокси-4-{[8-(1H-индол-3-іл)-7H-пурин-6-іл]окси}циклопентил)метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1R, 2S)-2-метокси-1,2,3,4-тетрагідронафталін-1іл]аміно}піримідин-4-іл)окси]циклопентил}метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1S, 2R)-2-метокси-1,2,3,4-тетрагідронафталін-1іл]аміно}піримідин-4-іл)окси]циклопентил}метил сульфамат; ((1S, 2S, 4R)-4-{4-[(1S)-2,3-дигідро-1H-інден-1-іламіно]-5,6-дигідро-7H-пирроло[2,3d]піримідин-7-іл}-2-гідроксициклопентил)метил сульфамат; {(1S, 2S, 4R)-4-[(4-{[(1R)-2,2-дифтор-2,3-дигідро-1H-інден-1-іл]аміно}-1,3,5-триазин-2іл)аміно]-2-гідроксициклопентил}метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1R, 2S)-2-метокси-4,4-диметил-1,2,3,4тетрагідронафталін-1-іл]аміно}піримідин-4-іл)окси]циклопентил}метил сульфамат; {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1S, 2R)-2-метокси-4,4-диметил-1,2,3,4тетрагідронафталін-1-іл]аміно}піримідин-4-іл)окси]циклопентил}метил сульфамат; и [(1S, 2S, 4R)-4-({4-[(1S)-2,3-дигідро-1H-інден-1-іламіно]-1,3,5-триазин-2-іл}аміно)-2гідроксициклопентил]метил сульфамат. [028] Учені Claiborne et al. далі описують, що сполуки в наступній Таблиці 2 демонструють значення IC50 більше 500 нМ і менше 10 мкМ в аналізі NAE (Приклад 137 у публікації 8 UA 114894 C2 Claiborne). Таблиця 2 I-4 I-7 I-16 I-28 I-33 I-35 I-36 I-48 I-53 I-54 I-66 I-77 I-79 I-80 I-81 I-86 I-92 I-94 I-96 I-98 I-110 I-113 I-114 I-119 I-120 I-123 I-127 I-132 I-138 [(1R, 2R, 3S, 4R)-4-({2-[(циклогексилметил)аміно]піримідин-4-іл}аміно)-2,3дигідроксициклопентил]метил сульфамат ((1R, 2R, 3S, 4R)-4-{[2-(бензиламіно)піримідин-4-іл]аміно}-2,3дигідроксициклопентил)метил сульфамат {(1R, 2R, 3S, 4R)-2,3-дигідрокси-4-[(піридин-3-ілкарбоніл)аміно]циклопентил}метил сульфамат [(1R, 2R, 3S, 4R)-2,3-дигідрокси-4-(изонікотиноиламіно)циклопентил]метил сульфамат [(1S, 2S, 4S)-4-({6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]піримідин-4-іл}метил)-2гідроксициклопентил]метил сульфамат {(1S, 2S, 4R)-4-[(2-{[(1S)-5-хлор-3,3-диметил-2,3-дигідро-1H-інден-1-іл]аміно}піридин-4іл)окси]-2-гідроксициклопентил}метил сульфамат {(1S, 2S, 4R)-2-гідрокси-4-[(7-метил-8-феніл-7H-пурин-6-іл)аміно]циклопентил}метил сульфамат {(1S, 2S, 4R)-4-[(8-біфеніл-2-іл-9H-пурин-6-іл)аміно]-2-гідроксициклопентил}метил сульфамат ((1S, 2S, 4R)-4-{[6-({(1S, 2R)-2-[(диметиламіно)метил]-2,3-дигідро-1H-інден-1іл}аміно)піримідин-4-іл]окси}-2-гідроксициклопентил)метил сульфамат [(1S, 2S, 4R)-4-({6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]-2-оксо-2,3-дигідропіримідин-4іл}аміно)-2-гідроксициклопентил]метил сульфамат ((1S, 2S, 4R)-4-{[6-({(1S, 2S)-2-[(диметиламіно)карбоніл]-2,3-дигідро-1H-інден-1іл}аміно)піримідин-4-іл]окси}-2-гідроксициклопентил)метил сульфамат {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1S, 2R)-1-метокси-2,3-дигідро-1H-інден-2іл]окси}піримідин-4-іл)окси]циклопентил}метил сульфамат {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1R, 2S)-1-метокси-2,3-дигідро-1H-інден-2іл]окси}піримідин-4-іл)окси]циклопентил}метил сульфамат {(1S, 2S, 4R)-4-[(9-бензил-9H-пурин-6-іл)окси]-2-гідроксициклопентил}метил сульфамат ((1S, 2S, 4R)-2-гідрокси-4-{[6-(2-фенілетил)піримідин-4-іл]аміно}циклопентил)метил сульфамат ((1R, 2R, 3S, 4R)-2,3-дигідрокси-4-{[6-(2-фенілетил)піримідин-4іл]аміно}циклопентил)метил сульфамат {(1R, 2R, 3S, 4R)-4-[(6-{[(1S, 2S)-2-(бензилокси)циклопентил]аміно}піримідин-4-іл)аміно]2,3-дигідроксициклопентил}метил сульфамат [(1S, 2S, 4R)-4-({2-[(1S)-2,3-дигідро-1H-інден-1-іламіно]піридин-4-іл}окси)-2гідроксициклопентил]метил сульфамат {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1R, 2S)-2-метокси-2,3-дигідро-1H-інден-1іл]окси}піримідин-4-іл)окси]циклопентил}метил сульфамат {(1S, 2S, 4R)-2-гідрокси-4-[(6-{[(1S, 2R)-2-метокси-2,3-дигідро-1H-інден-1іл]окси}піримідин-4-іл)окси]циклопентил}метил сульфамат (1S, 2S, 4R)-2-(гідроксиметил)-4-{[8-(5,6,7,8-тетрагідронафталін-1-іл)-9H-пурин-6іл]аміно}циклопентанол [(1R, 2R, 3S, 4R)-4-({2-[(1S)-2,3-дигідро-1H-інден-1-іламіно]-5-фторпіримідин-4-іл}аміно)2,3-дигідроксициклопентил]метил сульфамат {(1S, 2S, 4R)-2-гідрокси-4-[(6-фенілпіримідин-4-іл)окси]циклопентил}метил сульфамат ((1S, 2S, 4R)-2-гідрокси-4-{[6-(1-нафтилметокси)піримідин-4-іл]окси}циклопентил)метил сульфамат ((1S, 2S, 4R)-4-{[6-(1,3-дигідро-2H-ізоіндол-2-іл)піримідин-4-іл]окси}-2гідроксициклопентил)метил сульфамат {(1S, 2S, 4R)-2-гідрокси-4-[метил(9-метил-8-феніл-9H-пурин-6іл)аміно]циклопентил}метил сульфамат ((1S, 2S, 4R)-4-{[6-(циклопентиламіно)піримідин-4-іл]окси}-2-гідроксициклопентил)метил сульфамат {(1S, 2S, 4R)-4-[(6-бензилпіримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфамат (1S, 2S, 4R)-4-{[8-(2,3-дигідро-1,4-бензодиоксин-5-іл)-9H-пурин-6-іл]аміно}-2(гідроксиметил)циклопентанол 9 UA 114894 C2 Таблиця 2 I-141 I-148 I-149 I-152 ((1S, 2S, 4R)-2-гідрокси-4-{[6-(2-нафтилметокси)піримідин-4-іл]окси}циклопентил)метил сульфамат {(1S, 2S, 4R)-4-[(6-{[(1S, 2R)-2,7-диметокси-1,2,3,4-тетрагідронафталін-1іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфамат {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-2,7-диметокси-1,2,3,4-тетрагідронафталін-1іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфамат ((1S, 3S)-3-{[8-(1-нафтил)-9H-пурин-6-іл]окси}циклопентил)метил сульфамат [029] Учені Claiborne et al. описують також, що сполуки в наступній Таблиці 3 демонструють значення IC50 більше 10 мкМ в аналізі NAE (Приклад 137 у публікації Claiborne). Таблиця 3 I-13 I-20 I-22 I-23 I-30 I-31 I-58 I-61 I-76 I-85 I-89 I-97 I-144 I-145 {(1R, 2R, 3S, 4R)-4-[(6-аміно-2-метилпіримідин-4-іл)аміно]-2,3дигідроксициклопентил}метил сульфамат [(1R, 2R, 3S, 4R)-4-({2-[бензил(метил)аміно]піримідин-4-іл}аміно)-2,3дигідроксициклопентил]метил сульфамат [(1R, 2R, 3S, 4R)-4-({6-[бензил(метил)аміно]піримідин-4-іл}аміно)-2,3дигідроксициклопентил]метил сульфамат {(1R, 2R, 3S, 4R)-2,3-дигідрокси-4-[(піридин-2-ілкарбоніл)аміно]циклопентил}метил сульфамат ((1R, 2R, 3S, 4R)-4-{[6-(бензиламіно)-2-метилпіримідин-4-іл] аміно}-2,3дигідроксициклопентил)метил сульфамат [(1S, 2S, 4R)-4-({6-[(1S)-2,3-Дигідро-1H-інден-1-іламіно]піримідин-4-іл}окси)-2гідроксициклопентил]метил сульфамат [(1R, 3R, 4R)-3-({6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]піримідин-4-іл}аміно)-4гідроксициклопентил]метил сульфамат ((1S, 2S, 4R)-4-{[6-(3,4-дигідроизохінолін-2(1H)-іл)піримідин-4-іл]окси}-2гідроксициклопентил)метил сульфамат [(1S, 3R, 4R)-3-({6-[(1S)-2,3-дигідро-1H-інден-1-іламіно]піримідин-4-іл}аміно)-4гідроксициклопентил]метил сульфамат {(1R, 2R, 3S, 4R)-4-[(6-{[(1R, 2R)-2-(бензилокси)циклопентил]аміно}піримідин-4-іл)аміно]2,3-дигідроксициклопентил}метил сульфамат [(1S, 2S, 4R)-4-({6-[(4-хлорбензил)окси]піримідин-4-іл}окси)-2-гідроксициклопентил]метил сульфамат [(1S, 2S, 4R)-2-гідрокси-4-(піримідин-4-ілокси)циклопентил]метил сульфамат {(1R, 2R, 3S, 4R)-4-[(2-{[(1S)-2,3-дигідро-1H-інден-1-іламіно]карбоніл}піридин-4-іл)аміно]2,3-дигідроксициклопентил}метил сульфамат ((1R, 2R, 3S, 4R)-4-{[2-(2,3-дигідро-1H-индол-1-ілкарбоніл)піридин-4-іл]аміно}-2,3дигідроксициклопентил)метил сульфамат 5 10 15 20 [030] Учені Claiborne et al. описують також HTRF аналізи sumo-активуючого ферменту (SAE) і убіквітин-активуючого ферменту (UAE) у Прикладі 137. Однак значення IC50 не зазначені. [031] Як показано на Фігурах, площа під кривою залежності концентрації в плазмі від часу для I-216, введеного при 10 мг/кг (Фігура 1) порівняна із цим же показником для I-115, введеного при 30 мг/кг (Фігура 2) і становить приблизно половину площі під кривою залежності концентрації від часу, що спостерігається для I-216, введеного при 30 мг/кг (Фігура 3). Отже, можна очікувати, що сполука I-216 є в 2-3 рази більш ефективним інгібітором NAE, ніж I-115. [032] Термін "біля" використовується в цьому документі для позначення приблизного значення, у діапазоні, грубо або близько. При використанні терміна "біля" у комбінації із числовим діапазоном, він модифікує цей діапазон, розширюючи границі вище й нижче зазначених числових значень. Якщо не зазначене інше, термін "біля" використовується в цьому документі для модифікації числового значення вище й нижче зазначеного значення на різницю 10 %. [033] Якщо не зазначене інше, терміни "включає" і "включаючи" і тому подібні не є обмежуючими. Наприклад, "включаючи" означає включаючи, але не обмежуючись цим, якщо не зазначене інше. [034] У сполуках, описаних у цьому документі, у яких визначена відносна стереохімія, 10 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 діастереомерна чистота сполуки, переважно, становить, щонайменше, 80 %, більш переважно, щонайменше, 90 %, ще більш переважно, щонайменше, 95 % і найбільше переважно, щонайменше, 99 %. При використанні в цьому документі, термін "діастереомерна чистота" належить до кількості сполуки, що має зображену відносну стереохімію, виражену у відсотках від загальної кількості всіх присутніх діастереомерів. [035] Бажано, енантіомерна чистота сполуки становить, щонайменше, 80 %, бажаніше, щонайменше, 90 %, ще бажаніше, щонайменше, 95 % і найбажаніше, щонайменше, 99 %. При використанні в цьому документі, термін "енантіомерна чистота" належить до кількості сполуки, що має зображену абсолютну стереохімію, виражену у відсотках від загальної кількості зображеної сполуки і її енантіомера. [036] Способи визначення діастереомерної і енантіомерної чистоти добре відомі в даній галузі. Діастереомерна чистота може бути визначена будь-яким аналітичним методом, здатним кількісно розрізняти сполуку і її діастереомери. Приклади придатних аналітичних методів включають, без обмеження, спектроскопію ядерного магнітного резонансу (ЯМР), газову хроматографію (ГХ) і високоефективну рідинну хроматографію (ВЕРХ). Точно так само, енантіомерна чистота може бути визначена будь-яким аналітичним методом, здатним кількісно розрізняти сполуку і її енантіомер. Приклади придатних аналітичних способів включають, без обмеження, ГХ або ВЕРХ із використанням хірального матеріалу для упакування стовпчика. Енантіомери можуть бути розрізнені по ЯМР, якщо вони спочатку були дериватизовані оптично збагаченим дериватизуючим агентом, наприклад, кислотою Мошера. [037] Термін "кристалічний", що використовують у цьому документі, належить до твердої речовини, у якій атоми, молекули або іони, що утворюють структуру, упаковані симетрично впорядкованим, повторюваним тривимірним способом, мають високо симетричну хімічну структуру. Зокрема, кристалічна сіль може бути отримана у вигляді однієї або більше кристалічних форм. Для цілей дійсної заявки терміни "кристалічна форма" і "поліморф" є синонімами; ці терміни визначають відмінності між кристалами, що мають різні властивості (наприклад, різні діаграми РПД, різні результати сканування ДСК). Псевдополіморфи звичайно є різними сольватами матеріалу, тому їх властивості відрізняються один від одного. Так, у цьому документі передбачається, що кожний окремий поліморф і псевдополіморф є окремою кристалічною формою. [038] Термін "в основному, кристалічний" належить до солей, що містять, щонайменше, певний ваговий відсоток кристалічної речовини. Певні вагові відсотки включають 50 %, 60 %, 70 %, 75 %, 80 %, 85 %, 87 %, 88 %, 89 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 %, 99,5 % і 99,9 %. У деяких варіантах реалізації, "в основному, кристалічний" належить до солей, що містять, щонайменше, 70 % кристалічної речовини. У деяких варіантах реалізації, "в основному, кристалічний" належить до солей, що містять, щонайменше, 80 % кристалічної речовини. У деяких варіантах реалізації, "в основному, кристалічний" належить до солей, що містять, щонайменше, 85 % кристалічної речовини. У деяких варіантах реалізації, "в основному, кристалічний" належить до солей, що містять, щонайменше, 90 % кристалічної речовини. У деяких варіантах реалізації, "в основному, кристалічний" належить до солей, що містять, щонайменше, 95 % кристалічної речовини. [039] Термін "сольват або сольватований" означає фізичний зв'язок сполуки цього винаходу з однією або більше молекулами розчинника. Цей фізичний зв'язок включає водневий зв'язок. У деяких випадках сольват можна виділити, наприклад, якщо одна або більше молекул розчинника включена в кристалічну решітку твердої кристалічної речовини. "Сольват або сольватований" включає фазу розчину і розчинники, що піддаються виділенню. Типові сольвати включають, наприклад, гідрати, етанолати й метанолати. [040] Термін "гідрат" належить до сольвату, у якому молекула розчинника представляє собою H2O, яка присутня в певній стехіометричній кількості й включає, наприклад, гемігідрати, моногідрати, дигідрати й тригідрати. [041] Термін "суміш" належить до змішаних компонентів суміші, не залежно від фазового стану цієї комбінації (наприклад, рідина або рідина/кристалічна речовина). [042] Термін "затравка" належить до додавання кристалічного матеріалу до розчину або суміші для ініціації кристалізації. [043] Деякі варіанти реалізації цього винаходу належать до солянокислої солі I-216, у якій, щонайменше, певний ваговий відсоток солянокислої солі є кристалічною речовиною. У деяких варіантах реалізації, солянокисла сіль є, в основному, кристалічною. Приклади кристалічної або, в основному, кристалічної солянокислої солі, включають кристалічну форму солянокислої солі або суміш різних кристалічних форм. Деякі варіанти реалізації цього винаходу належать до солянокислої солі, у якій, щонайменше, певний ваговий відсоток солянокислої солі є 11 UA 114894 C2 5 10 15 20 25 30 кристалічною речовиною. Певний ваговий відсоток включає 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 75 %, 80 %, 85 %, 87 %, 88 %, 89 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 %, 99,5 % і 99,9 %. Якщо певний ваговий відсоток солянокислої солі є кристалічною речовиною, інша частина солянокислої солі є аморфною формою солянокислої солі. [044] Деякі варіанти реалізації цього винаходу належать до солянокислої солі I-216 у кристалічній формі або, в основному, у кристалічній формі. Кристалічна форма може являти собою певний ваговий відсоток кристалічної солянокислої солі. Певний ваговий відсоток включає 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 75 %, 80 %, 85 %, 87 %, 88 %, 89 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 %, 99,5 % і 99,9 %. Якщо певний ваговий відсоток солянокислої солі є певною кристалічною формою, то інша частина солянокислої солі є якоюсь комбінацією аморфної солі солянокислої солі й однієї або більше кристалічних форм солянокислої солі, крім зазначеної кристалічної форми. У деяких варіантах реалізації, солянокисла сіль є кристалічною формою, щонайменше, на 90 % по вазі. У деяких варіантах реалізації, солянокисла сіль є кристалічну форму, щонайменше, на 95 % по вазі. У деяких варіантах реалізації, солянокисла сіль є кристалічною формою, щонайменше, на 80 % по вазі. У деяких варіантах реалізації, солянокисла сіль є кристалічною формою, щонайменше, на 85 % по вазі. [045] Якщо не зазначене інше, при визначенні кристалічної форми солянокислої солі за допомогою одного або більш піків РПД, представлених у кутах 2θ, кожне зі значень 2θ слід розуміти як дане значення ± 0,2 градуса. [046] В описі й формулі винаходу, при визначенні кристалічної форми солянокислої солі за допомогою однієї або більше температур кривої ДСК (наприклад, початок ендотермічного переходу, плавлення й таке інше), кожне з температурних значень варто розуміти як дане значення ± 2 °C. ТВЕРДІ СТАНИ [047] У цьому документі представлений набір інформації, що характеризує опис кристалічної форми 1 (Форми 1) солянокислої солі I-216. [048] Фігура 4 ілюструє діаграму порошкової рентгенівської дифракції (РПД) Форми I солянокислої солі I- 216, отриманої за допомогою випромінювання CuKα. Піки, зазначені на Фігурі 4, включають піки, перераховані в таблиці 4. Таблиця 4 Кут 2-тета° 4,491 7,506 8,89 9,847 13,274 14,418 14,613 15,176 15,874 17,012 17,205 17,847 18,241 18,49 19,177 19,454 20,045 21,31 21,771 22,206 22,35 22,707 23,045 23,528 24,032 Інтенсивність % 63,1 58,9 24,7 41,6 29,2 59,1 58 100 58,1 16,7 42,1 28,4 32,2 21,7 33,9 53,6 35,4 67,6 83,5 34,2 55,6 58,9 27,4 34,4 69,3 12 UA 114894 C2 Таблиця 4 Кут 2-тета° 24,803 25,654 26,407 26,694 26,932 27,978 28,36 29,066 5 10 15 20 25 30 35 40 45 Інтенсивність % 53,6 41,1 40,9 34,5 33,1 17 16,7 21,4 [049] У деяких варіантах реалізації, Форма I характеризується діаграмою РПД, що має піки при кутах 2θ 4,5°, 15,2°, 21,3°, 21,8° і 24,0°. У деяких варіантах реалізації, Форма I характеризується діаграмою РПД, що має піки при кутах 2θ 4,5°, 7,5°, 14,4°, 14,6°, 15,2°, 15,9°, 19,5°, 21,3°, 21,8°, 22,4°, 22,7°, 24,0° і 24,8°. У деяких варіантах реалізації, Форма I характеризується діаграмою РПД, що має піки при кутах 2θ 4,5°, 7,5°, 8,9°, 9,8°, 13,3°, 14,4°, 14,6°, 15,2°, 15,9°, 17,2°, 19,5°, 20,0°, 21,3°, 21,8°, 22,4°, 22,7°, 24,0°, 24,8°, 25,7° і 26,4°. У деяких варіантах реалізації, Форма I характеризується діаграмою РПД, представленою на Фігурі 4. [050] У деяких варіантах реалізації, Форма I характеризується діаграмою РПД, що має еталонний пік з кутом 2θ 4,5±0,3º і що й має піки при кутах 2θ 10,7º, 16,8º, 17,3º і 19,5º щодо цього еталонного піка. Термін "еталонний пік" належить до піка на РПД дифрактограмі, який фахівці в даній галузі розглядають як такий, що інформує про поліморфну форму матеріалу, тобто диференційований від апаратурного шуму. Під "відносним" розуміють, що кут, за яким спостерігають, 2θ кожного піка є сумою кута 2θ еталонного піка й відносного кута 2θ цього піка. Наприклад, якщо еталонний пік має кут 2θ 4,4º, то відносні піки мають кути 2θ 15,1°, 21,2°, 21,7° і 23,9°; якщо еталонний пік має кут 2θ 4,5º, то відносні піки мають кути 2θ 15,2°, 21,3°, 21,8° і 24,0°, якщо еталонний пік має кут 2θ 4,6º, то відносні піки мають кути 2θ 15,3°, 21,4°, 21,9° і 24,1°; і так далі. У деяких варіантах реалізації, Форма I характеризується діаграмою РПД, що має еталонний пік з кутом 2θ 4,5±0,3º і що має піки з кутами 2θ 3,0º, 9,9º, 10,1º, 10,7º, 11,4º, 15,0º, 16,8º, 17,3º, 17,9º, 18,2º, 19,5º і 20,3º відносного цього еталонного піка. У деяких варіантах реалізації, Форма I характеризується діаграмою РПД, що має еталонний пік з кутом 2θ 4,5±0,3º і що має піки з кутами 2θ 3,0º, 4,4º, 5,3º, 8,8º, 9,9º, 10,1º, 10,7º, 11,4º, 12,7º, 15,0º, 15,5º, 16,8º, 17,3º, 17,9º, 18,2º, 19,5º, 20,3º, 21,2º і 21,9º щодо цього еталонного піка. Кожний з піків, які розглядаються фахівцями в даній галузі, як такі, що інформують про поліморфну форму матеріалу, може служити як еталонний пік, а потім можуть бути розраховані відносні піки. Наприклад, якщо еталонний пік має кут 2θ 24.0º, то відносні піки мають кути 2θ -19,5º, -8,8º, -2,7º і -2,2º щодо цього еталонного піка. Фігура 5 ілюструє профіль диференціальної скануючої калориметрії (ДСК) Форми I. Термограма ДСКзображує графік залежності теплового потоку від температури зразка, швидкість зміни температури становить близько 10 °C/хв. У деяких варіантах реалізації, Форма I характеризується, в основному, таким же профілем ДСК, як показано на Фігурі 5. Фігура 5 ілюструє ендотермічну подію з початком при температурі близько 129,8 °C і пік при температурі близько 135,6 °C, відповідний до втрати води, пов'язаної із плавленням. Спостерігається також широка ендотерма з початком при температурі близько 181,6 °C і піком при температурі близько 195,5 °C, і вузька ендотерма з початком при температурі близько 275,3 °C і піком при температурі близько 275,5 °C. [051] Фігура 6 ілюструє профіль термогравіметричного аналізу (ТГА) Форми I солянокислої солі I-216. Термограма ТГА зображує графік залежності процентної втрати маси зразка від температури, швидкість зміни температури становить близько 10 °C/хв. Фігура 6 ілюструє приблизно 3,7 % зниження маси між 100 °C і 150 °C, дозволяючи допустити, що I-216 HCl Форма I є моногідрат. У деяких варіантах реалізації, I-216 HCl Форма I характеризується, в основному, таким же профілем ТГА, як показано на Фігурі 6. Вимірювання Карла Фішера демонструють вміст води близько 3,5 %, додатково підтверджуючи, що зниження маси, що спостерігається на профілі ТГА, обумовлене втратою води, вказуючи, що Форма I є моногідрат. [052] Фігура 10 ілюструє діаграму порошкової рентгенівської дифракції (РПД) Форми II солянокислої солі I- 216, отриманої за допомогою випромінювання CuKα. Піки, зазначені на Фігурі 10, включають піки, перераховані в таблиці 5. 13 UA 114894 C2 Таблиця 5 Кут 2-тета° 3,261 4,269 6,85 8,693 11,1 11,252 12,426 13,115 13,522 14,529 15,176 15,708 16,574 17,253 18,202 18,495 19,579 20,014 20,813 22,004 22,456 23,128 24,234 24,728 25,737 28,163 29,403 5 10 15 20 25 Інтенсивність % 8,4 24,9 5,1 81,3 2,6 3,8 18,4 3,3 3,6 13 37,4 100 6,9 11,3 12 11,8 37,2 27,6 20,1 18,4 23 29 50,4 18 16,5 9,6 11 [053] У деяких варіантах реалізації, Форма II характеризується діаграмою РПД, що має піки при кутах 2θ 8,7°, 15,2°, 15,7°, 19,6° і 24,2°. У деяких варіантах реалізації, Форма II характеризується діаграмою РПД, що має піки при кутах 2θ 4,3°, 8,7°, 15,2°, 15,7°, 19,6°, 20,0°, 20,8°, 22,5°, 23,1° і 24,2°. У деяких варіантах реалізації, Форма II характеризується діаграмою РПД, що має піки при кутах 2θ 4,3°, 8,7°, 12,4°, 14,5°, 15,2°, 15,7°, 17,3°, 18,2°, 18,5°, 19,6°, 20,0°, 20,8°, 22,0°, 22,5°, 23,1°, 24,2°, 24,7°, 25,7°, 28,2° і 29,4°. У деяких варіантах реалізації, Форма II характеризується практично такою ж діаграмою РПД, як показано на Фігурі 10. [054] У деяких варіантах реалізації, Форма II характеризується діаграмою РПД, що має еталонний пік з кутом 2θ 8,7±0,3° і що має піки при кутах 2θ 6,5°, 7,0°, 10,9° і 15,5° щодо цього еталонного піка. Терміни "еталонний пік" і "відносно" мають такі ж значення, як описано раніше. У деяких варіантах реалізації, Форма II характеризується діаграмою РПД, що має еталонний пік з кутом 2θ 8,7±0,3° і що має піки при кутах 2θ -4,4°, 6,5°, 7,0°, 10,9°, 11,3°, 12,1°, 13,8°, 14,4° і 15,5° відносно цього еталонного піка. У деяких варіантах реалізації, Форма II характеризується діаграмою РПД, що має еталонний пік з кутом 2θ 8,7±0,3°, і такий, що має піки з кутами 2θ -4,4°, 3,7°, 5,8°, 6,5°, 7,0°, 8,6°, 9,5°, 9,8°, 10,9°, 11,3°, 13,3°, 13,8°, 14,4°, 15,5°, 16,0°, 17,0°, 19,5° і 20,7° щодо цього еталонного піка. Кожний з піків, які розглядаються фахівцями в даній галузі, що як такі, що інформують про поліморфну форму матеріалу, може служити в якості еталонного піка, а потім можуть бути розраховані відносні піки. Наприклад, якщо еталонний пік має кут 2θ 24.2°, то відносні піки мають кути 2θ -15,5°, -9,0°, -8,5° і -4,6° щодо цього еталонного піка. СИНТЕТИЧНІ СПОСОБИ [055] Сполука I-216 може бути отримана по способах, відомих фахівцях у даній галузі, і/або з посиланням на схеми, представлені нижче і наступні приклади. Приклади синтетичних шляхів представлені далі на Схемах 1-4 нижче, а також у наступних Прикладах. Схема 1 14 UA 114894 C2 5 10 [056] На Схемі 1 описаний синтез (1R, 2S)-5-хлор-2-метоксиііндан-1-аміна (8), який додатково ілюстрований нижче в Прикладі 1. 6-хлор-1Н-інден (1) епоксидували за допомогою каталізатора Якобсена для отримання оксирена (2), який обробили сірчаною кислотою, що димить, в ацетонітрилі, у результаті чого, після додавання води й нагрівання, отримали Rel-(1R, 2S)-1-аміно-5-хлоріндан-2-ол (3). Rel-(1R, 2S)-1-аміно-5-хлоріндан-2-ол (3) хірально розділили за допомогою D-(-)-мигдальної кислоти для отримання (1R, 2S)-1-аміно-5-хлоріндан-2-ола (5) після видалення хіральної допоміжної речовини. Захист первинного аміну в сполуці (5) виконали за допомогою фталевого ангідриду, одержавши сполуку (6). Метилювання гідроксильної групи метилйодидом дало сполуку (7), з якої потім зняли захист за допомогою гідразину для отримання заданого (1R, 2S)-5-хлор-2-метоксиіндан-1-амінаміна (8). Схема 2 15 UA 114894 C2 5 10 15 [057] На схемі 2 показаний синтез {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро1Н-інден-1-іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфамата HCl Форми 1, який додатково ілюстрований нижче в Прикладі 2. Виконали захист первинного спирту рацемічної сполуки (9) у вигляді трет-бутилдиметилсилілового ефіру з утворенням сполуки (10), яку ферментативно розділили за допомогою Candida Antartica на акриловій смолі з утвореннм сполуки (11) з енантіомерним надлишком більше 99 %. Потім виконали захист вторинного спирту в сполуці (11) у вигляді його трет-бутилдиметилсилілового ефіру, з утворенням (12). Сполуку (12) обробили катехолбораном у присутності каталізатора Вілкінсона для отримання (13), яка потім взаємодіяла з 4,6-дихлорпіримідином з утворенням сполуки (14). З первинного спирту (14) селективно зняли захист, а потім встановили інданову частину молекули шляхом взаємодії (15) з (1R, 2S)-5-хлор-2-метоксиіндан-1-аміном (8) з утворенням сполуки (16). I-216 отримали взаємодією сполуки (16) із хлорсульфонамідом, з наступним зняттям захисту вторинного спирту в кислотних умовах. I-216 обробили хлористоводневою кислотою в ацетонітрилі для отримання Форми I солянокислої солі I-216. Схема 3 16 UA 114894 C2 5 10 [058] На Схемі 3 описано отримання (1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1амінаміна гідрохлорида (20), який додатково ілюстровано нижче в Прикладі 4. 5-хлор-2,3дигідро-1H-інден-1-он (17) взаємодіяв із триметилортоформіатом у кислотних умовах, потім виконали обробку реагентом Козера [PhI(OH)(OTs)] для отримання 5-хлор-2-метокси-2,3дигідро-1H-інден-1-она (18). Інденон обробили (R)-трет-бутил сульфінамідом у присутності тетраетоксида титану для отримання відповідного сульфінаміда (19). Реакцію виконували доти, поки не залишилося менше 5 % небажаного діастереомера, що виявляється по ВЕРХ. Неочищений сульфінамід відновили за допомогою NaBH4 для отримання первинного аміну, який обробили хлористоводневою кислотою для отримання (1R, 2S)-5-хлор-2-метокси-2,3дигідро-1H-інден-1-амінаміна гідрохлорида (20). Схема 4 [059] Схема 4 ілюструє спосіб отримання Форми I гідрохлоридної солі I-216, який додатково 17 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 ілюстрований нижче в Прикладі 5. Епоксидне кільце в (1S, 2R, 3S, 5R)-3-(бензилокси)-2(бензилоксиметил)-6-оксабіцикло[3.1.0]гексані (21) відкрили обробкою діізопропіламідом літію, і отриманий аніон вловили обробкою триметилсилілхлоридом для отримання (22). Подвійний зв'язок відновили за допомогою водню й каталізатора Pd/BaSO4, а триметилсилілову захисну групу зняли для отримання вторинного спирту (23). Вторинний спирт (23) мезилювали, а потім обробили тетрабутиламонія ацетатом, потім гідроксидом натрію для отримання сполуки (24), яка взаємодіяла з гідридом натрію й 4,6-дихлорпіримідином з утворенням проміжної сполуки (25). Видалення бензилових захисних груп за допомогою трихлорида бору для отримання (26), з наступною взаємодією з (1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-амінаміна гідрохлоридом (20) при 130 °C і 50 psi привело до утворення ((1S, 2S, 4R)-4-(6-((1R, 2S)-5-хлор2-метокси-2,3-дигідро-1H-інден-1-іламіно)піримідин-4-ілокси)-2-гідроксициклопентил)метил сульфамата (27). Первинний спирт у сполуці (27) піддавали сульфуванню для отримання I-216. Форму I солянокислої солі I-216 отримали обробкою I-216 в ізопропіловому спирті 6 М хлористоводневою кислотою з наступним додаванням ізопропілацетату як анти-розчинника. ЗАСТОСУВАННЯ [060] Хімічні сполуки цього винаходу є придатні інгібітори активності ферменту Е1. Зокрема, зазначені хімічні сполуки створені як інгібітори NAE. Поняття інгібіторів включає хімічні сполуки, які знижують промотуючу дію ферментів Е1 у сполученні убпм (зокрема, Nedd8) з білкамимішенями (наприклад, зниження убіквітинілювання, недилювання), зменшують міжклітинну сигналізацію, опосередковану сполученням убпм (зокрема, Nedd8), і/або знижують протеоліз, опосередкований сполученням убпм (зокрема, Nedd8) (наприклад, інгібування кулін-залежного убіквітинілювання й протеолізу (наприклад, убіквітин-протеасомний шлях)). Так, хімічні сполуки цьогоцього винаходу можуть бути оцінено на їх здатність інгібувати фермент Е1 in vitro або in vivo, або в клітинах, або у тваринних моделях у відповідності зі способами, докладно представленими далі в цьому документі, або зі способами, відомими в даній галузі. Хімічні сполуки можуть бути оцінені на їх здатність зв'язувати або прямо опосередковувати активність ферменту Е1. Альтернативно, активність хімічних сполук може бути перевірена непрямими клітинними аналізами або аналізами, що вимірюють нисхідні ефекти активації Е1 для оцінки інгібування нисхідних ефектів інгібування Е1 (наприклад, інгібування кулін-залежного убіквітинілювання й протеолізу). Наприклад, активність може бути оцінена визначенням убпмзлитих субстратів (наприклад, убпм-злитих Е2, недильованих кулінів, убіквітинільованих субстратів); визначенням стабілізації нисхідних білкових субстратів (наприклад, стабілізація р27, стабілізація IκB); визначенням інгібування активності UPP; визначенням спадних ефектів інгібування білка Е1 і стабілізації субстрату (наприклад, репортерні аналізи, наприклад, аналіз по гену-репортеру NFκB, аналіз по гену-репортеру p27). Аналізи для оцінки активності описані нижче в Експериментальному розділі й/або відомі в даній області. [061] Слід розуміти, що хімічні сполуки цього винаходу можуть бути дериватизовані по функціональних групах для отримання похідних проліків, які можуть перетворюватися назад у вихідні хімічні сполуки in vivo. Приклади таких проліків включають фізіологічно прийнятні й метаболічно лабільні похідні. Більш конкретно, проліки хімічної сполуки цього винаходу є карбамат або амід групи -NH- хімічної речовини, або прості або складні ефіри групи -OH хімічної речовини. [062] Такі карбаматні проліки групи -NH- хімічної сполуки включають наступні карбамати: 9флуоренілметил, 9-(2-сульфо)флуоренілметил, 9-(2,7-дибром)флуоренілметил, 17тетрабензо[a, c,g, i]флуоренілметил, 2-хлор-3-інденілметил, бенз[f]інден-3-ілметил, 2,7,ди-третбутил-[9-(10,10-діоксо-10,10,10,10-тетрагідротіоксантил)]метил, 1,1-діоксобензо[b]тіофен-2-ілметил, 2,2,2-трихлоретил, 2-триметилсилілетил, 2-фенілетил, 1-(1-адамантил)-1-метилетил, 2хлоретил, 1,1-диметил-2-галоетил, 1,1-диметил-2,2-диброметил, 1,1-диметил-2,2,2трихлоретил, 1-метил-1-(4-біфенілил)етил, 1-(3,5-ди-трет-бутилфеніл)-1-метилетил, 2-(2’- та 4’піриділ)етил, 2,2-біс(4’-нітрофеніл)етил, N-2-пивалоїламіно)-1,1-диметилетил, 2-[(2нітрофеніл)дитіо]-1-фенілетил, 2-(N, N-дициклогексилкарбоксамідо)етил, трет-бутил, 1адамантил, 2-адамантил, вініл, аліл, 1-ізопропілаліл, цинаміл, 4-нітроцинаміл, 3-(3’піриділ)проп-2-еніл, 8-хіноліл, N-гідроксипіперидиніл, алкілдитіо, бензил, пара-метоксибензил, пара-нітробензил, пара-бромбензил, пара-хлорбензил, 2,4-дихлорбензил, 4метилсульфінілбензил, 9-антрилметил, дифенілметил, фенотіазиніл-(10)-карбоніл, N’-паратолуолсульфоніламінокарбоніл і N’-феніламінотіокарбоніл. [063] Такі амідні проліки групи -NH- хімічної сполуки включають наступні аміди: N-форміл, Nацетил, N-хлорацетил, N-трихлорацетил, N-трифторацетил, N-фенілацетил, N-3фенілпропіоніл, N-4-пентеноїл, N-піколіноїл, N-3-піриділкарбоксамідо, N-бензоїлфенілаланил, N-бензоїл і N-пара-фенілбензоїл. 18 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 [064] Такі ефірні проліки групи -OH хімічної сполуки включають наступні прості ефіри: метил, метоксиметил, метилтіометил, (фенілдиметилсиліл)метоксиметил, бензилоксиметил, параметоксибензилоксиметил, пара-нітробензилоксиметил, орто-нітробензилоксиметил, (4метоксифенокси)метил, гваяколметил, трет-бутоксиметил, 4-пентенілоксиметил, силоксиметил, 2-метоксиетоксиметил, 2,2,2-трихлоретоксиметил, біс(2-хлоретокси)метил, 2(триметилсиліл)етоксиметил, ментоксиметил, тетрагідропіраніл, 3-бромтетрагідропіраніл, тетрагідротіопіраніл, 1-метоксициклогексил, 4-метокситетрагідропіраніл, 4метокситетрагідротіопіраніл, 4-метокситетрагідротіопіраніла S, S-діоксид, 1-[(2-хлор-4метил)феніл]-4-метоксипіперидин-4-іл, 1-(2-фторфеніл)-4-метоксипіперидин-4-іл, 1,4-діоксан-2іл, тетрагідрофураніл, тетрагідротіофураніл, 2,3,3a, 4,5,6,7,7a-октагідро-7,8,8,-триметил-4,7метанобензофуран-2-іл, 1-етоксиетил, 1-(2-хлоретокси)етил, 1-[2-(триметилсиліл)етокси]етил, 1-метил-1-метоксиетил, 1-метил-1-бензилоксиетил, 1-метил-1-бензилокси-2-фторетил, 1-метил1-феноксиетил, 2,2,2,-трихлоретил, 1,1-діанісил-2,2,2,-трихлоретил, 1,1,1,3,3,3-гексафтор-2фенілізопропіл, 2-триметилсилілетил, 2-(бензилтіо)етил, 2-(фенілселеніл)етил, трет-бутил, аліл, пропаргіл, пара-хлорфеніл, пара-метоксифеніл, пара-нітрофеніл, 2,4-динітрофеніл, 2,3,5,6тетрафтор-4-трифторметил)феніл, бензил, пара-метоксибензил, 3,4-диметоксибензил, ортонітробензил, пара-нітробензил, пара-галобензил, 2,6-дихлорбензил, пара-ціанобензил, парафенілбензил, 2,6-дифторбензил, пара-ациламінобензил, пара-азидобензил, 4-азидо-3хлорбензил, 2-трифторметилбензил, пара-(метилсульфініл)бензил, 2-піколіл, 4-піколіл, 3метил-2-піколіл N-оксидо, 2-хінолінилметил, 1-піренілметил, дифенілметил, p, p’динітробензгідрил, 5-дибензосуберил, трифенілметил, альфа-нафтилдифенілметил, параметоксифенілдифенілметил, ди(пара-метоксифеніл)фенілметил, три(пара-метоксифеніл)метил, 4-(4’-бромфенацилокси)фенілдифенілметил, 4,4",4’’-трис(4,5-дихлорфталімідофеніл)метил, 4,4",4’’-три(левулиноїлоксифеніл)метил, 4,4",4’’-три(бензоїлоксифеніл)метил, 4,4’-диметокси-3’’[N-(імідазолілметил)тритил, 4,4’-диметокси-3’’[N-імідазолілетил]карбамоїл]тритил, 1,1-біс(4метоксифеніл)-1’-піренілметил, 4-(17-тетрабензо[a, c,g, i]флуоренілметил)-4,4’’диметокситритил, 9-антрил, 9-(9-феніл)ксантеніл, 9-(9-феніл-10-оксо)антрил, 1,3-бензодитіолан2-іл, бинзізотіазоліл S, S-діоксидо, триметилсиліл, триетилсиліл, триізопропілсиліл, диметилізопропілсиліл, діетилізопропілсиліл, диметилгексилсиліл, трет-бутилдиметилсиліл, трет-бутилдифенілсиліл, трибензилсиліл, три-пара-ксилілсиліл, трифенілсиліл, дифенілметилсиліл, ди-трет-бутилметилсиліл, трис(триметилсиліл)силіл, (2гідроксистирил)диметилсиліл, (2-гідроксистирил)діізопропілсиліл, трет-бутилметоксифенілсиліл і трет-бутоксидифенілсиліл. [065] Такі складноефірні проліки групи -OH хімічної сполуки включають наступні складні ефіри: форміат, бензоїлформіат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трифторацетат, метоксиацетат, трифенілметоксиацетат, феноксиацетат, парахлорфеноксиацетат, фенілацетат, пара-P-фенілацетат, дифенілацетат, нікотинат, 3фенілпропіонат, 4-пентеноат, 4-оксопентаноат, 4,4-(етилендитіо)пентаноат, 5-[3-біс(4метоксифеніл)гідроксиметилфенокси]левулинат, півалоат, 1-адамантоат, кротонат, 4метоксикротонат, бензоат, пара-фенілбензоат і 2,4,6-триметилбензоат. Додатково, у рамки цього винаходу входять будь-які фізіологічно прийнятні еквіваленти представлених хімічних сполук, аналогічні метаболично лабільним простим, складним ефірам групи -OH, або карбаматам або амідам групи -NH-, які можуть давати вихідні хімічні сполуки, описані в цьому документі, in vivo. Дивися, наприклад, Greene and Wuts, Protective Groups in Organic Synthesis, 3rd вид. John Wiley & Sons, Inc. (1999). [066] Деякі варіанти реалізації цього винаходу належать до композиції, що містить хімічну сполуку цього винаходу й фармацевтично прийнятний носій. Деякі варіанти реалізації цього винаходу належать до композиції, що містить проліки хімічної сполуки цього винаходу й фармацевтично прийнятний носій. [067] Якщо фармацевтично прийнятна сіль є хімічну сполуку цього винаходу, що використовується в цих композиціях, то ця сіль, бажано, отримана з неорганічних або органічних кислот і основ. Огляди відповідних солей представлені, наприклад, у публікаціях Berge et al, J. Pharm. Sci. 66:1-19 (1977) і Remington: The Science and Practice of Pharmacy, 20е вид., A. Gennaro (ed.), Lippincott Williams & Wilkins (2000) ("Remington's"). [068] Приклади відповідних солей приєднання кислот включають наступні: ацетат, адипінат, альгінат, аспартат, бензоат, бензолсульфонат, бісульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропіонат, диглюконат, додецилсульфат, етансульфонат, фумарат, глюкогептаноат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, 2-гідроксиетансульфонат, лактат, малеат, метансульфонат, 2нафталінсульфонат, нікотинат, оксалат, памоат, пектинат, персульфат, 3-фенілпропіонат, 19 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 пікрат, півалат, пропіонат, сукцинат, тартрат, тіоцианат, тозилат і ундеканоат. [069] Відповідні солі приєднання основ включають солі амонію, солі лужних металів, такі як солі натрію й калію, солі лужноземельних металів, такі як солі кальцію й магнію, солі з органічними основами, такі як солі дициклогексиламіну, N-метил-D-глюкаміну, і солі з амінокислотами, такими як аргінін, лізин і так далі. [070] Також, основні азотвмісні групи можуть бути кватернізовані такими агентами як нижчі алкілгалогеніди, такі як метил, етил, пропіл і бутил хлориди, броміди і йодиди; диалкілсульфати, такі як диметил, діетил, дибутил і діаміл сульфати, довголанцюгові галогеніди, такі як децил, лаурил, міристил і стеарил хлориди, броміди і йодиди, аралкіл галогеніди, такі як бензил і фенетил броміди, і інші. У такий спосіб одержують водо- або маслорозчинні або продукти, що диспергуються. [071] Фармацевтичні композиції цього винаходу бажано перебувають у формі, придатній для введення суб'єкту, бажано ссавцю, бажаніше людині. Термін "фармацевтично прийнятний носій" використовується в цьому документі для позначення матеріалу, сумісного з організмом реципієнта й придатного для доставки активного агента до сайту-мішені без припинення активності агента. Токсичність або можливі побічні ефекти, обумовлені носієм, бажано є співрозмірними за розміром з доцільним співвідношенням ризику/користі для призначеного використання активного агента. У даній галузі відомі багато такі фармацевтично прийнятні носії. Дивися, наприклад, Remington; Handbook of Pharmaceutical Excipients, 6е вид., R.C. Rowe et al. (ред.), Pharmaceutical Press (2009). [072] Фармацевтичні композиції цього винаходу можуть випускатися способами, добре відомими у даній галузі, серед яких такі традиційні способи як гранулювання, змішування, розчинення, виробництво капсул, ліофілізація або емульгування. Композиції можуть випускатися в різних формах, включаючи гранули, осади або частки, порошки, включаючи заморожені обезводнені порошки, висушені в ротаційному випарнику або висушені розпилювальним сушінням, аморфні порошки, таблетки, капсули, сиропи, супозиторії, ін'єкції, емульсії, еліксири, суспензії або розчини. Композиції можуть необов'язково містити стабілізатори, модифікатори рН, поверхнево-активні речовини, солюбілізатори, модифікатори біодоступності і їх комбінації. [073] Фармацевтично прийнятні наповнювачі, які можуть використовуватися в цих композиціях, включають іонообмінники, оксид алюмінію, стеарат алюмінію, лецитин, білки сироватки, такі як альбумін сироватки людини, буферні речовини, такі як фосфати або карбонати, гліцин, сорбінову кислоту, сорбат калію, суміші неповних гліцеридів насичених рослинних жирних кислот, воду, солі або електроліти, такі як протаміну сульфат, динатрія гідрофосфат, калію гідрофосфат, натрію хлорид, солі цинку, колоїдний діоксид кремнію, трисилікат магнію, полівінілпіролідон, речовини на основі целюлози, поліетиленгліколь, натрію карбоксиметилцелюлозу, поліакрилати, воски, поліетилен-поліоксипропіленові блок-полімери, поліетиленгліколь і ланолін. [074] Відповідно до кращого варіанту реалізації, композиції цього винаходу створюють для фармацевтичного введення ссавцям, бажано людині. Такі фармацевтичні композиції цього винаходу можуть бути введені перорально, парентерально, інгаляцією спрея, локально, ректально, назально, трансбуккально, вагінально або через імплантований резервуар. Термін "парентеральний", що використовують у цьому документі, включає підшкірний, внутрішньовенний, внутрішньочеревний, внутрішньом'язовий, внутрішньосуглобний, внутрішньосиновіальний, внутрішньостернальний, внутрішньотекальний, внутрішньопечінковий, внутрішньотканевий та внутрішньочерепний спосіб введення ін'єкцій або інфузій. Бажано, композиції вводять перорально, внутрішньосудинно або підшкірно. Композиції цього винаходу можуть бути створені як препарати швидкого вивільнення, короткострокової або довгострокової дії. Крім того, сполуки можуть бути введені локально, а не системно, наприклад, введенням (наприклад, ін'єкцією) у осередок пухлини. [075] Фармацевтичні композиції можуть бути отримані у вигляді рідких суспензій або розчинів з використанням рідин, таких як масло, вода, спирт або їх комбінацій. Можуть бути включені солюбілізуючі агенти, такі як циклодекстрини. Для перорального або парентерального введення можуть бути додані фармацевтично прийнятні поверхнево-активні речовини, суспендуючі агенти або емульгатори. Суспензії можуть містити масла, такі як арахісове масло, кунжутне масло, бавовняне масло, кукурудзяне масло й оливкове масло. Препарати у вигляді суспензій також можуть містити складні ефіри жирних кислот, такі як етилолеат, ізопропілміристат, гліцериди жирних кислот і ацетильовані гліцериди жирних кислот. Композиції у вигляді суспензій можуть містити спирти, такі як етанол, ізопропіловий спирт, гексадециловий спирт, гліцерин і пропіленгліколь. У композиціях у вигляді суспензій можуть також бути 20 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 використані прості ефіри, такі як полі(етиленгліколь), нафтові вуглеводні, такі як мінеральне масло й петролатум; а також вода. [076] Стерильні форми для ін'єкцій композицій цього винаходу можуть бути водними або масляними суспензіями. Ці суспензії можуть бути утворені відповідно до методик, відомих у даній галузі, за допомогою придатних диспергуючих або зволожуючих агентів і суспендуючих агентів. Стерильні композиції для ін'єкцій можуть також бути стерильним розчином або суспензією для ін'єкцій у нетоксичному, прийнятному для парентерального введення розріджувачі або розчиннику, наприклад, розчином в 1,3-бутандіолі. Серед прийнятних середовищ і розчинників, які можна використовувати, - вода, розчин Рінгера й ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендуюче середовище звичайно використовують стерильні нелеткі масла. Для цієї мети можуть бути використані будь-які позбавлені смаку жирні масла, включаючи синтетичні моно- або дигліцериди. Жирні кислоти, такі як олеїнова кислота і її гліцеридні похідні, є придатними у виробництві препаратів для ін'єкцій, як і природні фармацевтично прийнятні масла, такі як оливкове масло або касторове масло, зокрема, в їх поліоксиетильованих формах. Ці масляні розчини або суспензії можуть також містити довголанцюговий спиртовий розріджувач або диспергатор, такий як карбоксиметилцелюлоза або аналогічні диспергуючі агенти, що звичайно використовуються в приготуванні фармацевтично прийнятних лікарських форм, включаючи емульсії й суспензії. Інші поверхнево-активні речовини, що широко застосовуються, такі як Твіни, Спани й інші емульгуючі агенти або добавки, що поліпшують біодоступність, які звичайно використовуються у виробництві фармацевтично прийнятних твердих, рідких або інших лікарських форм, також можуть бути використані для складання композицій. Сполуки можуть входити в сполуки для парентерального введення шляхом ін'єкцій, таких як ін'єкція ударної дози, або безперервної інфузії. Одиничні лікарські форми для ін'єкції можуть бути у вигляді ампул або упакування лікарських засобів для багаторазового застосування. [077] Фармацевтичні композиції цього винаходу можуть бути введені перорально в будь-якій лікарській формі, прийнятній для перорального введення, включаючи капсули, таблетки, водні суспензії або розчини. При необхідності перорального використання водних суспензій, активний компонент комбінують із емульгуючими й суспендуючими агентами. При бажанні також можуть бути додані певні підсолоджувачі, смакові добавки або барвники. У таких твердих лікарських формах активну хімічну сполуку змішують, щонайменше, з одним інертним фармацевтично прийнятним формотворним засобом або носієм, таким як цитрат натрію або фосфат дикальцію й/або а) наповнювачами або сухими розріджувачами, такими як крохмалі, лактоза, сахароза, глюкоза, маніт, мікрокристалічна целюлоза й кремнієва кислота, b) сполучними агентами, такими як, наприклад, карбоксиметилцелюлоза, альгінати, желатин, сахароза й гуміарабік, с) зволожувачами, такими як гліцерин, d) засобами для поліпшення розпаду таблеток, такими як агар-агар, карбонат кальцію, полівінілпіролідон, кроскармелоза, натрію крохмальгліколят, картопляний або тапіоковий крохмаль, альгінова кислота, деякі силікати й карбонат натрію, e) інгібіторами розчинення, такими як парафін, f) прискорювачами абсорбції, такими як четвертинні амонієві сполуки, g) змочувальними агентами, такими як, наприклад, цетиловий спирт і гліцерину моностеарат, h) абсорбентами, такими як каолін і бентонітова глина, і i) змащувальними агентами, такими як тальк, стеарат кальцію, стеарат магнію, натрію стеарилфумарат, тверді поліетиленгліколі, натрію лаурилсульфат, діоксид кремнію, і їх сумішами. У випадку капсул, таблеток і пігулок лікарська форма може також містити буферні агенти. [078] Активна хімічна сполука також може бути в мікроінкапсульованій формі з одним або декількома з вищезгаданих формотворних засобів. Тверді лікарські форми таблеток, драже, капсул, пігулок і гранул також можуть бути приготовлені з покриттями й оболонками, такими як ентеросолюбільні покриття, покриття для контролювання вивільнення й інші покриття, добре відомі в галузі складання фармацевтичних композицій. У таких твердих лікарських формах активна сполука може бути змішана, щонайменше, з одним інертним розріджувачем, таким як сахароза, лактоза або крохмаль. Такі лікарські форми можуть також містити, що є звичайною практикою, додаткові речовини, відмінні від інертних розріджувачів, наприклад, таблетуючі змащувальні речовини й інші таблетуючі добавки, такі як стеарат магнію й мікрокристалічна целюлоза. У випадку капсул, таблеток і пігулок лікарські форми можуть також містити буферні агенти. Вони можуть необов'язково містити контрастні агенти, і також можуть мати таку сполуку, що активний компонент(и) вивільняється тільки, або бажано, у певній частині кишкового тракту, необов'язково, уповільненим чином. Приклади залитих композицій, які можуть бути використані, включають полімерні речовини й воски. [079] Альтернативно, фармацевтичні композиції цього винаходу можуть бути введені у 21 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 формі супозиторіїв для ректального введення. Вони можуть бути отримані змішанням агента з підходящим не дратівливим наповнювачем, який є твердим при кімнатній температурі й рідким при ректальній температурі, і тому плавиться в прямій кишці, вивільняючи ліки. Такі матеріали включають какао-масло, бджолиний віск і поліетиленгліколі. [080] Фармацевтичні композиції цього винаходу також можуть бути введені локально, особливо якщо ціль лікування включає області або органи, легко доступні для локального нанесення, включаючи захворювання очей, шкіри або нижньої частини кишкового тракту. Відповідні локальні композиції легко виготовляють для кожної із цих областей або органів. [081] Локальне введення в нижній частині кишкового тракту може здійснюватися у вигляді композицій ректальних супозиторіїв (дивися вище) або у формі підходящої композиції клізми. Можуть бути використані також локальні трансдермальні пластирі. Фармацевтичні композиції для локального застосування можуть бути складені у вигляді підходящої мазі, що містить активний компонент, суспендований або розчинений в одному або більше носіях. Носії для локального введення сполук цього винаходу включають мінеральне масло, рідкий петролатум, білий петролатум, пропіленгліколь, поліоксиетилен, поліоксипропіленові сполуки, емульгуючий віск і воду. Альтернативно, фармацевтичні композиції можуть бути складені у вигляді підходящого лосьона або крему, що містить активний компонент, суспендований або розчинений в одному або більше фармацевтично прийнятних носіях. Прийнятні носії включають мінеральне масло, сорбітмоностеарат, полісорбат 60, воски складних цетилових ефірів, цетеариловий спирт, 2-октилдодеканол, бензиловий спирт і воду. [082] Фармацевтичні композиції для офтальмічного застосування можуть бути складені у вигляді мікронізованих суспензій в ізотонічному стерильному фізрозчині з вивіреним рН або, бажано, у вигляді розчину в ізотонічному стерильному фізрозчині з вивіреним рН, з використанням або без використання консерванту, такого як хлорид бензалконію. Альтернативно, фармацевтичні композиції для офтальмічного застосування можуть бути складені у формі мазі, такої як петролатум. [083] Фармацевтичні композиції цього винаходу також можуть бути введені у вигляді назального аерозолю або розчину для інгаляції. Такі композиції готують у відповідності з методиками, добре відомими в галузі складання фармацевтичних композицій, і вони можуть бути отримані у вигляді розчинів у фізрозчині, з використанням бензилового спирту або інших придатних консервантів, прискорювачів абсорбції для поліпшення біодоступності, фторвуглеводів і/або інших стандартних солюбілізуючих або диспергуючих агентів. [084] Фармацевтичні композиції цього винаходу особливо придатні для використання для терапевтичних застосувань, пов'язаних з порушеннями, описаними в цьому документі (наприклад, порушення проліферації, наприклад, ракові захворювання, запалення, нейродегенеративні захворювання). Термін "суб'єкт", що використовується у цьому документі, означає тварину, бажано, ссавця, більш бажано людину. Термін "пацієнт", що використовується у цьому документі, означає людину. Бажано, композиція складається для введення пацієнту або суб'єкту, у якого спостерігається або існує ризик розвитку або рецидиву захворювання, що підлягає лікуванню. Кращими фармацевтичними композиціями цього винаходу є композиції для перорального, внутрішньовенного або підшкірного введення. Проте, кожна із представлених вище лікарських форм, що містить терапевтично ефективну кількість хімічної сполуки цього винаходу, добре вписується в рамки звичайних експериментів, і тому входить у рамки цього винаходу. У деяких варіантах реалізації, фармацевтична композиція цього винаходу може додатково містити інший лікарський засіб. Бажано, інший лікарський засіб є засіб, що звичайно вводиться пацієнтам з розладами, захворюваннями або станами, що підлягають лікуванню. [085] Термін "терапевтично ефективна кількість" означає таку кількість хімічної сполуки або композиції, якої досить, при однократному або багаторазовому введенні дози, для помітного зниження активності ферменту Е1 і/або ступеню розладу або хворобливого стану, що підлягає лікуванню. Термін "терапевтично ефективна кількість" включає також таку кількість, якої досить для лікування клітини, відстрочки або запобігання розвитку розладу або хворобливого стану, що підлягає лікуванню (наприклад, запобігання додаткового росту ракової пухлини, запобігання додаткової запальної реакції), поліпшення, полегшення або зниження симптомів пацієнта, що страждає розладом, у порівнянні зі станом, очікуваним у відсутності такого лікування. Необхідна кількість інгібітору ферменту Е1 залежить від конкретної сполуки в даній композиції, типу розладу, що підлягає лікуванню, способу введення й заданої тривалості лікування цього розладу. Слід також розуміти, що індивідуальна доза й режим лікування для будь-якого конкретного пацієнта залежить від різних факторів, включаючи активність конкретної хімічної сполуки, що використовується, вік, вага тіла, загальний стан здоров'я, стать й раціон пацієнта, час введення, швидкість екскреції, комбінація ліків, оцінку лікаря й ступінь конкретного 22 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання, що підлягає лікуванню. У деяких аспектах, у яких інгібітор вводять у комбінації з іншим агентом, кількість додаткового терапевтичного засобу, що присутній в композиції цього винаходу, звичайно не більша, ніж кількість, що звичайно вводиться в складі композиції, що включає цей терапевтичний засіб як єдиного активного агента. Бажано, кількість додаткового терапевтичного засобу становить від близько 50 % до близько 100 % від кількості, звичайно присутньої в композиції, що включає цей засіб як єдиний активний агент. [086] У деяких варіантах реалізації, цей винахід належить до способу інгібування або зменшення активності ферменту Е1 у зразку, що включає контакт зазначеного зразка з хімічною сполукою цього винаходу або композицією, що містить хімічну сполуку цього винаходу. Зразок, при використанні в цьому документі, включає зразок, що містить очищений або частково очищений фермент Е1, вирощені клітини або екстракти клітинних культур; біопсійні клітини або рідину, отримані зі ссавця, або їх екстракти; і рідина організму (наприклад, кров, плазму, слину, сечу, кал, сперму, сльози) або їх екстракти. Інгібування активності ферменту Е1 у зразку може вбути здійснене in vitro або in vivo, in cellulo, або in situ. [087] У деяких варіантах реалізації, у цьому винаході представлений спосіб лікування пацієнта, у якого спостерігається розлад, симптом розладу, ризик розвитку або рецидив розладу, що включає введення зазначеному пацієнту хімічної сполуки або фармацевтичної композиції згідно з дійсним винаходом. Лікування може бути спрямоване на зцілення, пом'якшення, полегшення, ослаблення, зменшення, зміну, усунення, поліпшення або вплив на розлад, симптоми розладу або схильність до розладу. Не обмежуючись теорією, передбачається, що лікування обумовлює вповільнення росту, руйнування або загибель клітин або тканин in vitro або in vivo, або інакше, знижує здатність клітини або тканини (наприклад, аберантної клітини, ураженої тканини) поширювати захворювання, наприклад, розлад, що описаний в цьому документі (наприклад, проліферативний розлад, наприклад, рак, запальний розлад). Термін, що використовується у цьому документі "інгібуюче зростання" або "інгібування росту" клітини або тканини (наприклад, проліферативної клітини, пухлинної тканини) належить до вповільнення, припинення, блокування або зупинки її росту й метастазів і необов'язково вказує на загальне виключення росту. [088] Лікування захворювань включає такі розлади, у яких інгібування активності ферменту Е1 є згубним для виживання й/або поширення уражених клітин або тканин (наприклад, клітини є чутливими до інгібування Е1; інгібування активності Е1 руйнує механізм захворювання; зниження активності Е1 стабілізує білки, які є інгібіторами механізму захворювання; зниження активності Е1 приводить до інгібування білків, які є активаторами механізмів захворювання). Передбачається, що лікування захворювань включає також будь-який розлад, захворювання або стан, для якого необхідна ефективна активність куліна й/або убіквітинілювання, яка може регулюватися зниженням активності ферменту Е1 (наприклад, активності NAE). [089] Наприклад, способи цього винаходу придатні для лікування розладів, що стосуються клітинної проліферації, включаючи розлади, для яких необхідні ефективні шляхи кулінзалежного убіквітинілювання й протеолізу (наприклад, убіквітин-протеасомний шлях) для збереження й/або розвитку стану захворювання. Способи цього винаходу можуть застосовуватися для лікування захворювань, опосередкованих білками (наприклад, активація NFκB, активація p27Kip, активація p21WAF/CIP1, активація p53), які регулюються активністю Е1 (наприклад, активністю NAE). Відповідні захворювання включають проліферативні розлади, у першу чергу, ракові захворювання й запальні порушення (наприклад, ревматоїдний артрит, запальна хвороба кишечнику, астма, хронічна обструктивна хвороба легенів (ХОХЛ), остеоартрит, дерматоз (наприклад, атопічний дерматит, псоріаз), судинні проліферативні розлади (наприклад, атеросклероз, рестеноз), аутоімунні захворювання (наприклад, розсіяний склероз, відторгнення тканин і органів)); а також запалення, пов'язані з інфекцією (наприклад, імунні реакції), нейродегенеративні розлади (наприклад, хвороба Альцгеймера, хвороба Паркінсона, захворювання рухових нейронів, невропатичний біль, порушення повторюваних триплетів, астроцитома й нейродегенерація в результаті алкогольної хвороби печінки), ішемічне ушкодження (наприклад, інсульт) і кахексія (наприклад, прискорене руйнування м'язового білка, яке супроводжує різні фізіологічні й патологічні стани (наприклад, ушкодження нерва, голодування, лихоманка, ацидоз, ВІЛ-інфекція, рак і деякі ендокринопатії)). [090] Сполуки й фармацевтичні композиції цього винаходу особливо придатні для лікування раку. Термін, "рак", що використовується у цьому документі належить до клітинного розладу, що характеризується неконтрольованим або неупорядкованим розростанням клітин, зниженим клітинним диференціюванням, недоречною здатністю вторгатися в навколишні тканини й/або здатністю утворювати новоутворення в ектопічних ділянках. Термін "рак" включає солідні пухлини і пухлини, що передаються із кров'ю. Термін "рак" включає захворювання шкіри, тканин, 23 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 органів, кісток, хрящів, крові й судин. Термін "рак" додатково включає первинні й метастатичні ракові захворювання. [091] У деяких варіантах реалізації, рак є солідною пухлиною. Приклади солідних пухлин, які можна лікувати за допомогою способів цього винаходу, включають рак підшлункової залози; рак сечового міхура; колоректальний рак; рак молочної залози, у тому числі метастатичний рак молочної залози; рак простати, у тому числі андроген-залежний і андроген-незалежний рак простати; рак нирок, у тому числі, наприклад, метастатичну карциному клітин ниркового епітелію; гепатоцеллюлярний рак; рак легенів, у тому числі, наприклад, недрібноклітинний рак легенів (НДРЛ), дрібноклітинний рак легенів, бронхіолоальвеолярну карциному (БАК) і аденокарциному легенів; рак яєчників, у тому числі, наприклад, прогресивний епітеліальний або первинний перитонеальний рак; рак шийки матки; рак шлунку; рак стравоходу; рак голови й шиї, у тому числі, наприклад, плоскоклітинний рак голови й шиї; меланому; нейроендокринний рак, у тому числі, метастатичні нейроендокринні пухлини; пухлини головного мозку, у тому числі, наприклад, гліому, анапластичну олігодендрогліому, мультиформну гліобластому дорослих і анапластичну астроцитому дорослих; рак кісток; і саркому м'яких тканин. [092] У деяких варіантах реалізації, рак є гематологічним злоякісним захворюванням. Приклади гематологічних злоякісних захворювань включають гострий мієлоїдний лейкоз (ГМЛ), хронічний мієлогенний лейкоз (ХМЛ), у тому числі прискорений ХМЛ і бластний криз ХМЛ (БКХМЛ); гострий лімфобластний лейкоз (ГЛЛ), хронічний лімфоцитарний лейкоз (ХЛЛ); хворобу Ходжкина (ХХ), лімфому Неходжкина (ЛНХ), у тому числі фолікулярну лімфому й лімфому клітин мантійної зони; лімфому В-клітин; лімфому Т-клітин; множинну мієлому (ММ); макроглобулінемію Вальденстрема; мієлодиспластичний синдром (МДС), у тому числі рефрактерну анемію (РА), рефрактерну анемію з кільцевими сідеробластами (РАКС), рефрактерну анемію з надлишком бластів (РАНБ) і РАНБ у трансформації (РАНБ-T); і мієлопроліферативні синдроми. [093] Залежно від конкретного розладу або стану, що підлягає лікуванню, у деяких варіантах реалізації цього винаходу інгібітор ферменту Е1 вводять у комбінації з додатковим лікарським агентом або агентами. У деяких варіантах реалізації, додатковий лікарський агент(и) є агент, що звичайно вводиться пацієнтам з розладом або станом, що підлягають лікуванню. При використанні в цьому документі, додатковий терапевтичний агент(и), який звичайно вводять для лікування конкретного розладу або стану, відомим як "відповідні для зазначеного розладу або стану, що підлягає лікуванню". [094] Інгібітор Е1 цього винаходу може бути введений з іншим терапевтичним агентом в одній лікарській формі або у вигляді окремої лікарської форми. При введенні в окремій лікарській формі, інший терапевтичний агент може бути введений до, під час або після введення інгібітору Е1 цього винаходу. [095] У деяких варіантах реалізації, інгібітор ферменту Е1 цього винаходу вводять у комбінації з терапевтичним агентом, обраним із цитотоксичних агентів, променевої терапії й імунотерапії, придатної для лікування проліферативних розладів і раку. Приклади цитотоксичних агентів, придатних для застосування в комбінації з інгібіторами ферменту Е1 цього винаходу, включають: антиметаболіти, в тому числі, наприклад, капецитибін, гемцитабін, 5-фторурацил або 5-фторурацил/лейковорин, флударабін, цитарабін, меркаптопурин, тіогуанін, пентостатин і метотрексат; інгібітори топізомерази,в тому числі, наприклад, етопозид, теніпозид, камптотецин, топотекан, іринотекан, доксорубіцин та даунорубіцин; алкалоїди барвінка, в тому числі, наприклад, вінкристин і вінбластин; таксани, в тому числі, наприклад, паклітаксел і доцетаксел; платинові агенти, в тому числі, наприклад, цисплатин, карбоплатин і оксаліплатин; антибіотики, в тому числі, наприклад, актиноміцин D, блеоміцин, мітоміцин С, адріаміцин, даунорубіцин, ідарубіцин, доксорубіцин і пегільований липосомальний доксорубіцин; алкілюючі агенти, такі як мелфалан, хлорамбуцил, бусульфан, тіотепа, іфосфамід, кармустин, ломустин, семустин, стрептозоцин, декарбазин і циклофосфамід; включаючи, наприклад, CC-5013 та CC-4047; інгібітори протеїн-тірозинкінази, включаючи, наприклад, іматиніб мезилат і гефітиніб; інгібітори протеасом, в тому числі, наприклад, бортезоміб; талідомід і родинні аналоги; антитіла, в тому числі, наприклад, трастузумаб, ритуксімаб, цетуксімаб та бевацизумаб; митоксантрон; дексаметазон; преднізон; і темозоломід [096] Інші приклади агентів, з якими можуть бути об'єднані інгібітори цього винаходу, включають протизапальні агенти, такі як кортикостероїди, блокатори TNF, Il-1 RA, азатиопрін, циклофосфамід і сульфасалазин; імуномодулюючі й імуноподавляючі агенти, такі як циклоспорин, такролімус, рапаміцин, мікофенолят мофетил, інтерферони, кортикостероїди, циклофосфамід, азатіоприн, метотрексат і сульфасалазин; антибактеріальні й противірусні агенти; і агенти для лікування хвороби Альцгеймера, такі як донепезил, галантамін, мемантин і 24 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 ривастигмін. [097] Для більш повного розуміння цього винаходу, далі представлені наступні препаративні й дослідні приклади. Ці приклади представлені лише для мети ілюстрації, і їх не слід тлумачити як обмеження рамок цього винаходу будь-яким чином. ПРИКЛАДИ Скорочення AcOH оцтова кислота ACN ацетонітрил DABCO триетилендіамін ДХМ дихлорметан DCP 4,6-дихлорпіримідин ДЕА діетиламін DIPEA N, N-діізопропілетиламін ДМСО диметилсульфоксид Et2O діетиловий ефір EtOAc етилацетат EtOH етанол Et3N триетиламін МК мурашина кислота H2O вода год. години IPA ізопропіловий спирт IPAc ізопропілацетат РХ/МС рідинний хромато-мас-спектр LDA літію діізопропіламід МТБЭ метил-трет-бутиловий ефір MeOH метанол хв. хвилини МС мас-спектр NMP N-метил-2-піролідон rt кімнатна температура P3NO 4-фенілпропілпіридин-N-оксид TBS трет-бутилдиметилсиліл ТФК трифтороцтова кислота ТГФ тетрагідрофуран ТШХ тонкошарова хроматографія TMS триметилсиліл Загальні способи [098] Порошкова рентгенівська дифракція. РПД виконали за допомогою рентгенівського дифрактометра Bruker AXS D8 Advance. Близько 100 мг зразка обережно спресували у кварцовій кюветі для зразків діаметром 50 мм для порошкових вимірювань. Зразок безупинно сканували від 2,9 до 29,6°2θ, використовуючи фіксовані спарені кути 2θ/θ. Кожний інтервал кутів склав 0,05°2θ, а дані зібрали за 2 секунди. Сканування зразка виконували при кімнатних умовах, а аналіз усіх даних виконали за допомогою програми EVA версії 9.0. [099] Термічний аналіз. Термічні події аналізували за допомогою диференціальної скануючої калориметрії (ДСК) і термогравіметричного аналізу (ТГА). Для дослідження всіх зразків використовували прилади для термічного аналізу DSC Q200 і TGA Q500. Термограми аналізували за допомогою програми Thermal Advantage для Q-Серій. [0100] Диференціальна скануюча калориметрія. Зразок (1-2 мг) в алюмінієвому тиглі закрили кришкою. Зразок нагрівали зі швидкістю 10 °C/хв. з 25° до 400 °C, постійно продуваючи зразок азотом при 50 мл/хв. [0101] Термогравіметричний аналіз. Зразки (5-10 мг) випробовували у відкритому платиновому тиглі. Зразок нагрівали зі швидкістю 10 °C/хв. до 400 °C, продуваючи зразок азотом при 60 мл/хв. Приклад 1. Синтез (1R, 2S)-5-хлор-2-метоксиіндан-1-амінаміна (8) [0102] Стадія 1: rel-(1aR, 6aS)-4-хлор-6,6а-дигідро-1аН-індено[1,2-b]оксирен (2). [0103] До перемішаного розчину 4-фенілпропілпіридин-N-оксида (278 мг, 1,31 ммоль) у метиленхлориді (20 мл) додали каталізатор (R, R)-Якобсена (237,0 мг, 0,3732 ммоль) і розчин гіпохлориту натрію (2,0 М у воді; 16 мл, 32 ммоль) при 0 °C. Отриману коричневу суспензію перемішували при 0 °C протягом 15 хвилин, потім через шприц додали розчин 6-хлор-1Н-індена 25 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 (1) (2,81 г, 18,6 ммоль) у метиленхлориді (20 мл) з одночасним додаванням додаткової кількості гіпохлорита натрію (2,0 М у воді; 16 мл, 32 ммоль). Реакційну суміш перемішували при 0 °C протягом однієї години, потім забрали крижану баню, а реакційну суміш перемішували при кімнатній температурі протягом 1 години. Взяли аліквоту, і дані ТСХ на діоксиді кремнію (гексани) показали, що весь вихідний матеріал витрачений. Реакційну суміш вилили в насичений сольовий розчин і екстрагували метиленхлоридом. Об'єднані екстракти промили сольовим розчином, потім висушили над сульфатом натрію, відфільтрували й випарили під зниженим тиском для отримання в залишку неочищеного продукту, який затвердів під високим вакуумом. Вихід ~3,7 г коричневої твердої речовини. 1H ЯМР (400 МГц, ДМСО) δ 7.55 (d, J=7.6 Гц, 1H), 7.32 (s, 1H), 7.23 (d, J=7.3 Гц, 1H), 4.36 (s, 1H), 4.16 (s, 1H), 3.03 (dd, J=45.8, 18.2 Гц, 2H). [0104] Стадія 2: rel-(1R, 2S)-1-аміно-5-хлориіндан-2-ол (3). [0105] До охолодженої до -40 °C суміші димлячої сірчаної кислоти (4,098 мл, 44,06 ммоль) в ацетонітрилі (30 мл, 500 ммоль) по краплях додали суспензію rel-(1aR, 6aS)-4-хлор-6,6aдигідро-1aH-інденo[1,2-b]оксирена (2) (2,94 г, 17,6 ммоль) в ацетонітрилі (70 мл) і гексані (40 мл). Потім двофазну суміш залишили нагріватися до кімнатної температури й перемішували ще одну годину, у результаті чого отримали мутну суміш іржаво-червоного кольору. Обережно додали воду (30 мл) (тверді речовини повністю розчинилися з утворенням червоно-коричневого розчину), і отриманий розчин перемішували протягом 30 хвилин. Потім додали додаткову кількість води (70 мл) і перемішували реакційну суміш протягом ночі під атмосферою азоту при кімнатній температурі. До реакційної суміші додали воду (50 мл), приєднали дистиляційну голівку, суміш довели до дефлегмації й переганяли до досягнення температури дефлегматора 100 °C. Дистиляційну головку від'єднали й приєднали зворотний холодильник, і нагрівали реакційну суміш при дефлегмації протягом 1 години для отримання прозорого жовтогарячого розчину з невеликою кількістю темної смолянистої речовини по краях. Реакційну суміш трохи остудили, потім гарячий розчин декантували зі смолянистої речовини в 500 мл круглодонну колбу. Розчин перемішали й залишили остигати до кімнатної температури, потім додали основи (рН 12), додаючи по краплях 50 % водяний розчин NaOH. Додали метиленхлорид; суміш добре перемішали, а потім перенесли в ділильну лійку. Органічний шар відокремили, а водний шар повторно екстрагували додатковою кількістю метиленхлориду (доти, поки аналіз ТСХ не показав, що з водного шару екстрагований увесь продукт). Органічні екстракти об'єднали, промили сольовим розчином, висушили над сульфатом натрію, відфільтрували й випарили in vacuo, одержавши 2,53 г неочищеного продукту у вигляді світло-коричневого порошку. ЖХМС: мурашина кислота, [M+H+ + Na+] = 208; 1H ЯМР (400 МГц, ДМСО) δ 7.31 (d, J=7.8 Гц, 1H), 7.24 – 7.15 (m, 2H), 4.79 (s, 1H), 4.20 (s, 1H), 4.01 (s, 1H), 2.92 (d, J=15.3 Гц, 1H), 2.73 (d, J=16.2 Гц, 1H), 2.15 – 1.43 (s, 2H). Хіральна ВЕРХ (стовпчик Chiralpak AD 4,6 × 250, елюювали 95/5/0,1 % гексан/ EtOH/ДЕА при 2,0 мл/хв. – 45 хв. аналіз) показала е.н. 80 %. [0106] Стадії 3 і 4: Хіральний поділ (1R, 2S)-1-аміно-5-хлоріндан-2-ола (5). [0107] У колбу, що містить розчин rel-(1R, 2S)-1-аміно-5-хлоріндан-2-ола (3) (2,53 г, 13,8 ммоль) у метанолі (100 мл), при дефлегмації додали (D)-(-)-мигдальну кислоту (2,09 г, 13,8 ммоль) при перемішуванні. Після дефлегмації протягом ~15 хвилин, колбонагрівач прибрали, а розчин залишили остигати до кімнатної температури при перемішуванні. Тверда речовина почала осаджуватися через ~15 хвилин після того, як забрали джерело нагрівання. Отриману суміш перемішували протягом ночі при кімнатній температурі. Потім суміш відфільтрували, промили метанолом (10 мл), потім діетиловим ефіром (15 мл) і висушили in vacuo для отримання 2,50 г проміжної солі. Фільтрат концентрували до ~1/3 об'єму й заморожували протягом ночі, за цей час в осад випала додаткова кількість продукту. Суміш знову відфільтрували й промили метанолом (7,5 мл), потім діетиловим ефіром (10 мл) висушили in vacuo для отримання додатково 0,60 г проміжної солі. У цілому зібрали 3,1 г. [0108] Проміжну сіль перемішували в суміші етилацетату (50 мл) і водного NaOH (0,2 М, 60 мл) до завершення розчинення. Суміш перенесли в ділильну лійку й відокремили органічний шар. Водний шар додатково екстрагували етилацетатом (3 × 50 мл). Об'єднані органічні шари промивали сольовим розчином до нейтральної реакції промивних розчинів, потім висушили над сульфатом натрію, відфільтрували й випарили, одержавши світло-коричневу тверду речовину. У результаті додаткового висушування під високим вакуумом отримали 1,42 г (вихід 56 %) зазначеної в заголовку сполуки у вигляді світло-коричневого порошку. Аналітичні дані для зазначеної в заголовку сполуки: 1H ЯМР (400 МГц, ДМСО) δ 7.31 (d, J=7.9 Гц, 1H), 7.24 – 7.15 (m, 2H), 4.83 (s, 1H), 4.20 (t, J=3.9 Гц, 1H), 4.00 (d, J=4.5 Гц, 1H), 2.92 (dd, J=16.2, 4.9 Гц, 1H), 2.73 (d, J=15.2 Гц, 1H), 1.85 (s, 2H). Хіральна ВЕРХ (стовпчик Chiralpak AD 4,6 × 250, елюювали 95/5/0,1 % гексан/EtOH/ДЭА при 2,0 мл/хв. – 45 хв. аналіз) показала е.н. >99 %. [0109] Стадія 5: 2-[(1R, 2S)-5-хлор-2-гідрокси-2,3-дигідро-1H-інден-1-іл]-1H-ізоіндол-1,3(2H) 26 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 діон (6). [0110] В 1 л круглодонній колбі, N, N-діізопропілетиламін (15,2 мл, 0,0871 моль) додали до суспензії (1S, 2R)-1-аміно-5-хлоріндан-2-ола (16,0 г, 0,0871 моль) і фталевого ангідриду (14,2 г, 0,0958 моль) у толуолі (473 мол, 4,44 ммоль) і нагрівали реакційну суміш при дефлегмації протягом 18 годин. Реакційну суміш остудили до кімнатної температури, і в цей час в осад випала велика кількість твердої речовини. Тверду речовину, яка являла собою заданий продукт, відфільтрували, промили EtOAc і зібрали. Фільтрат остудили до 0 °C, відфільтрували, а тверду речовину промили EtOAc і змішали з першою партією. Фільтрат перенесли в ділильну лійку й розбавили H2O (200 мл). Шари розділили, а водний шар екстрагували EtOAc (3 × 200 мл). Об'єднані органічні шари промили 1 х насиченим сольовим розчином (100 мл), висушили над MgSO4, відфільтрували й концентрували in vacuo. Отриману бруднувато-білу тверду речовину суспендували в EtOAc, великі шматки зруйнували ультразвуковою обробкою й остудили суспензію до 0 °C. Тверду речовину відфільтрували й об'єднали з попередніми 2 партіями. Фільтрат концентрували in vacuo, а отриману білу тверду речовину суспендували останній раз в Et2O (100 мл), відфільтрували й об'єднали з попередніми 3 партіями. Загальний вихід для всіх чотирьох партій твердої речовини склав 25,3 г (92 %). ЖХМС: (МК) ES+ молекулярний іон 314, основна іонізація 167; 1H ЯМР (400 МГц, ДМСО) δ 7.83 (s, 4H), 7.33 (s, 1H), 7.27 (d, J=8.2, 1H), 7.19 (dd, J=2.0, 8.1, 1H), 5.52 (d, J=7.4, 1H), 5.34 (d, J=5.2, 1H), 4.64 (dt, J=6.9, 12.7, 1H), 3.21 (dd, J=7.4, 16.1, 1H), 3.02 (dd, J=6.1, 16.1, 1H). [0111] Стадія 6: 2-[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]-1H-ізоіндол-1,3(2H)діон (7) [0112] До розчину 2-[(1R, 2S)-5-хлор-2-гідрокси-2,3-дигідро-1H-інден-1-іл]-1H-ізоіндол1,3(2H)-діона (25,8 г, 0,0822 моль) у тетрагідрофурані (186 мл, 2,29 моль) додали метилйодид (20,5 мл, 0,329 моль) і перемішували розчин при 0 °C. До цього розчину через краплинну лійку по краплях додали 1,00 М трет-бутоксид калію в тетрагідрофурані (90,4 мл, 0,0904 моль) за 1 годину. Реакцію погасили додаванням 0,1 н. HCl (250 мл) і перенесли в ділильну лійку, що містить EtOAc (600 мл). Шари розділили, а органічний шар промили 1 н. NaOH (2 × 100 мл кожний) і насиченим сольовим розчином (100 мл). Органічний шар висушили над Na2SO4, відфільтрували й концентрували для отримання 2-[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1Hінден-1-іл]-1H-ізоіндол-1,3(2H)-діона (25,8 г, 96 %), який використовували без додаткового очищення на наступній стадії. [0113] Стадія 7: (1R, 2S)-5-хлор-2-метоксиіндан-1-амін (8) [0114] До суспензії 2-[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1-іл]-1H-ізоіндол1,3(2H)-діона (7) (25,8 г, 0,0787 моль) в етанолі (260 мл, 4,4 моль) додали гідразин (4,94 мл, 0,157 моль), і приєднали до колби зворотний холодильник і нагрівали до температури бані 90 °C. Через кілька хвилин перемішування почав утворюватися осад, а через 1 годину нагрівання суміш стала густою суспензією/твердою речовиною. Реакційну суміш остудили до кімнатної температури, а тверді побічні продукти реакції відфільтрували й промили CH2Cl2 (~300 мл). Леткі речовини вилучили з фільтрату in vacuo, а залишок суспендували в CH2Cl2 (250 мл), і в цей час тверді побічні продукти знову вилучили фільтрацією. Леткі речовини вилучили in vacuo, а залишок знову суспендували в CH2Cl2 (~50 мл). Тверді побічні продукти останній раз вилучили фільтрацією для отримання (1R, 2S)-5-хлор-2-метоксиіндан-1-аміну (15,5 г, 99 %) у вигляді червоно-помаранчевої воскоподібної речовини. ЖХМС: (МК) ES+ молекулярний іон 198, основна іонізація 181; 1H ЯМР (400 МГц, ДМСО) δ 7.30 (d, J=7.9, 1H), 7.25 – 7.16 (m, 2H), 4.14 (d, J=4.9, 1H), 3.89 (td, J=2.8, 4.9, 1H), 3.29 (s, 3H), 2.89 (ddd, J=3.8, 16.4, 21.3, 2H), 2.04 (s, 2H). Хіральна ВЕРХ (стовпчик Chiralpak AD 4,6 × 250, елюювали 95/5/0,1 % гексан/EtOH/ДЕА при 1,0 мл/хв. – 30 хв. аналіз) показала е.н. >99 %. Приклад 2. Синтез {(1S, 2S, 4R)-4-[(6-{[(1R, 2S)-5-хлор-2-метокси-2,3-дигідро-1H-інден-1іл]аміно}піримідин-4-іл)окси]-2-гідроксициклопентил}метил сульфамата (I-216) [0115] Стадія 1: rel-(1R, 5R)-5-({[трет-бутил(диметил)силіл]окси}метил)циклопент-2-ен-1-ол (10). [0116] До розчину rel-(1R, 5R)-5-(гідроксиметил)циклопент-2-ен-1-ола (47,20 г, 0,4135 моль), N, N-диметиламінопіридина (2,52 г, 0,0207 моль) і 1 1Н-імідазола (30,97 г, 0,4549 моль) у метиленхлориді (800 мл, 10 моль) при 0 °C під атмосферою азоту додали третбутилдиметилсиліл хлорид (28,0 г, 0,186 моль). Реакційну суміш перемішували при 0 °C протягом 2,5 годин, і в цей час додали трет-бутилдиметилсиліл хлорид (28,0 г, 0,186 моль). Реакційну суміш перемішували ще 2 години. Реакцію погасили додаванням насиченого водяного розчину NaCl (200 мл) і води (200 мл). Шари розділили, а органічний шар промили водою (3 × 200 мл) і насиченим сольовим розчином (1 × 200 мл), висушили над Na2SO4, відфільтрували й концентрували in vacuo. Цей матеріал використовували без додаткового 27 UA 114894 C2 5 10 15 20 25 30 35 40 45 50 55 60 очищення на наступній стадії. [0117] Стадія 2: (1S, 5S)-5-({[трет-бутил(диметил)силіл]окси}метил)циклопент-2-ен-1-ол (11) [0118] До суспензії rel-(1R, 5R)-5-({[трет-бутил(диметил)силіл]окси}метил)-циклопент-2-ен-1ола (неочищена сполука (10) з попередньої стадії) і Candida Antarctica на акриловій смолі (24,9 г; 10800 одиниць/г) у метил-трет-бутиловому ефірі (1500 мл, 10 моль) додали етеніловий ефір оцтової кислоти (190 мл, 2,05 моль) і перемішували реакційну суміш протягом ночі. Тверді речовини вилучили фільтрацією, а летучі речовини вилучили in vacuo для отримання безбарвної маслянистої речовини (143 грама), яку очистили колоночною хроматографією (1 кг силікагелевий стовпчик, елюєнт 0-30 % Et2O:гексани) для отримання заданого (1S, 5S)-5({[трет-бутил(диметил)силіл]окси}метил)циклопент-2-ен-1-ола (37,5 грам, 79,5 %). Хіральна ВЕРХ; стовпчик Chiral Technologies Chiralpak AS RH (4,6 × 150 мм) 5 мікрон, елюєнт - 55 % (0,1 % мурашиної кислоти в 99:1 H2O/CH3CN), 45 % (0,1 % мурашиної кислоти в 95:5 CH3CN/H2O) показала е.н. >99 %. 1H ЯМР (400 МГц, CDCl3) δ 5.96 – 5.91 (m, 1H), 5.86 – 5.80 (m, 1H), 4.87 (dd, J=2.3, 4.9, 1H), 3.87 (dd, J=4.7, 10.1, 1H), 3.79 (dd, J=7.7, 10.1, 1H), 2.50 – 2.40 (m, 1H), 2.35 (ddt, J=2.0, 8.4, 16.8, 1H), 2.23 – 2.14 (m, 1H), 0.90 (s, 9H), 0.08 (s, 3H), 0.07 (s, 3H). Небажаний енантіомер виділили у вигляді відповідного ацетату з виходом 81,6 %. [0119] Стадія 3: трет-бутил[((1S, 2S)-2-{[трет-бутил(диметил)силіл]окси}циклопент-3-ен-1іл)метокси]диметилсилан (12) [0120] У висушеній у печі 2 л двугорлій колбі, охолодженій під азотом, до розчину (1S, 5S)-5({[трет-бутил(диметил)силіл]окси}метил)циклопент-2-ен-1-ола (11) (98,07 г, 0,3864 моль) у метиленхлориді (500 мл, 8 моль) додали 1Н-імідазол (31,57 г, 0,4637 моль). До отриманого жовтого розчину додали розчин трет-бутилдиметилсиліл хлориду (58,2 г, 0,386 моль) у метиленхлориді (300 мл, 5 моль) через краплинну лійку за ~30 хвилин. Суміш механічно перемішували протягом 18 годин. Реакцію погасили додаванням води (500 мл) і розділили шари. Органічний шар промили водою (2 × 500 мл), висушили над MgSO4, відфільтрували й концентрували in vacuo для отримання трет-бутил[((1S, 2S)-2-{[третбутил(диметил)силіл]окси}циклопент-3-ен-1-іл)метокси]диметилсилана (143,3 г) у вигляді неочищеного залишку, який використовували без додаткового очищення. [0121] Стадія 4: (1R, 3S, 4S)-3-{[трет-бутил(диметил)силіл]окси}-4-({[трет-бутил(диметил)силіл]окси}метил)циклопентанол (13) [0122] В 2 л круглодонній колбі, трет-бутил[((1S, 2S)-2-{ [трет-бутил(диметил)силіл]окси} ен1-мул)метокси]диметилсилан (12) (12,08 г неочищеного залишку) три рази перегнали азеотропною перегонкою з толуолом, висушили під вакуумом протягом 30 хвилин і розчинили в безводному тетрагідрофурані (402,7 мл) під атмосферою аргону. До цього розчину по краплях додали катехолборан у тетрагідрофурані (1,00 М, 88,1 мл, 0,0881 моль). Потім протягом 20 хвилин продували аргон для дезоксигенування реакційного розчину. Потім додали трис(трифенілфосфин)родія (I) хлорид (3,26 г, 0,00352 моль) і перемішували реакційну суміш протягом 18 годин при кімнатній температурі під аргоном. До реакційної суміші додали 1,00 М гідроксид натрію у воді (528,8 мл, 0,5288 моль), потім обережно додали розчин пероксиду водню (35 ваг. % у воді, 30,79 мл, 0,3525 моль) і перемішували суміш протягом 4 годин при кімнатній температурі. Реакцію погасили додаванням насиченого розчину Na2S2O3 (500 мл), шари розділили, а водний шар екстрагували EtOAc (2 × 300 мл). Об'єднані органічні частини промили насиченим сольовим розчином, висушили над Na2SO4, відфільтрували й концентрували in vacuo. Коричневу маслянисту речовину очистили колоночною хроматографією (елюєнт від 0 % до 20 % ефіру в гексанах) для отримання (1R, 3S, 4S)-3-{[третбутил(диметил)силіл]окси}-4-({[трет-бутил(ди-метил)силіл]окси}метил)циклопентанола (7,78 г, вихід за 2 стадії = 66 %). 1H ЯМР (400 МГц, Cdcl3) δ 4.50 (d, J=4.3, 1H), 4.34 (td, J=2.7, 4.8, 1H), 3.71 (dd, J=7.0, 10.0, 1H), 3.53 (dd, J=7.0, 10.0, 1H), 2.32 – 2.20 (m, 1H), 2.04 (ddd, J=2.6, 6.7, 13.9, 1H), 1.85 (ddd, J=7.1, 10.3, 13.5, 1H), 1.73 (dt, J=4.8, 13.9, 1H), 1.63 (ddd, J=2.1, 7.9, 13.5, 1H), 1.35 (s, 1H), 0.88 (s, 9H), 0.86 (s, 9H), 0.04 (s, 3H), 0.03 (s, 9H). [0123] Стадія 5: 4-{[(1R, 3S, 4S)-3-{[трет-бутил(диметил)силіл]окси}-4-({[третбутил(диметил)силіл]окси}метил)циклопентил]окси}-6-хлорпіримідин (14) [0124] У висушену на полум'ї 50 мл круглодонну колбу завантажили гідрид натрію (0,322 г, 0,008 моль) і тетрагідрофуран (20 мл, 0,3 моль), і отриману суспензію остудили до 0 °C під атмосферою азоту. До цієї суспензії по краплях додали розчин (1R, 3S, 4S)-3-{[третбутил(диметил)силіл]окси}-4-({[трет-бутил(диметил)силіл]окси}метил)циклопентанола (13) (1,45 г, 0,004 моль) в 0,5 мл ТГФ при 0 °C. Суміш перемішували при 0 °C протягом 10 хвилин, і в цей час додали 4,6-дихлорпіримідин (0,659 г, 0,004 моль) і залишили суміш нагріватися до кімнатної температури, і перемішували протягом 18 годин. Реакцію погасили додаванням насиченого водяного розчином NH4Cl (25 мл) і перенесли в ділильну лійку. Шари розділили, а водний шар 28
ДивитисяДодаткова інформація
Назва патенту англійськоюInhibitors of nedd8-activating enzyme
Автори англійськоюMcCarron, Ashley, Sue, Sells, Todd, B., Stirling, Matthew, Stroud, Stephen, G.
Автори російськоюМакКаррон Эшли Сью, Селлс Тодд Б., Стирлинг Мэттью, Страуд Стефен Г.
МПК / Мітки
МПК: A61K 31/505, C07D 487/04, C07D 487/02, A61K 31/519
Мітки: інгібітори, nedd8-активуючого, ферменту
Код посилання
<a href="https://ua.patents.su/49-114894-ingibitori-nedd8-aktivuyuchogo-fermentu.html" target="_blank" rel="follow" title="База патентів України">Інгібітори nedd8-активуючого ферменту</a>