Інгібітори р38 мар-кіназ
Номер патенту: 104731
Опубліковано: 11.03.2014
Автори: Херст Саймон Крістофер, Мюррей Пітер Джон, Таддеі Девід Мішель Адрієн, Оніонс Стюарт Томас, Уільямс Джонатан Гарет, Рейппорт Уільям Гарт, Чаррон Кетрін Елізабет, Кінг-Андервуд Джон, Іто Казухіро, Стронг Пітер
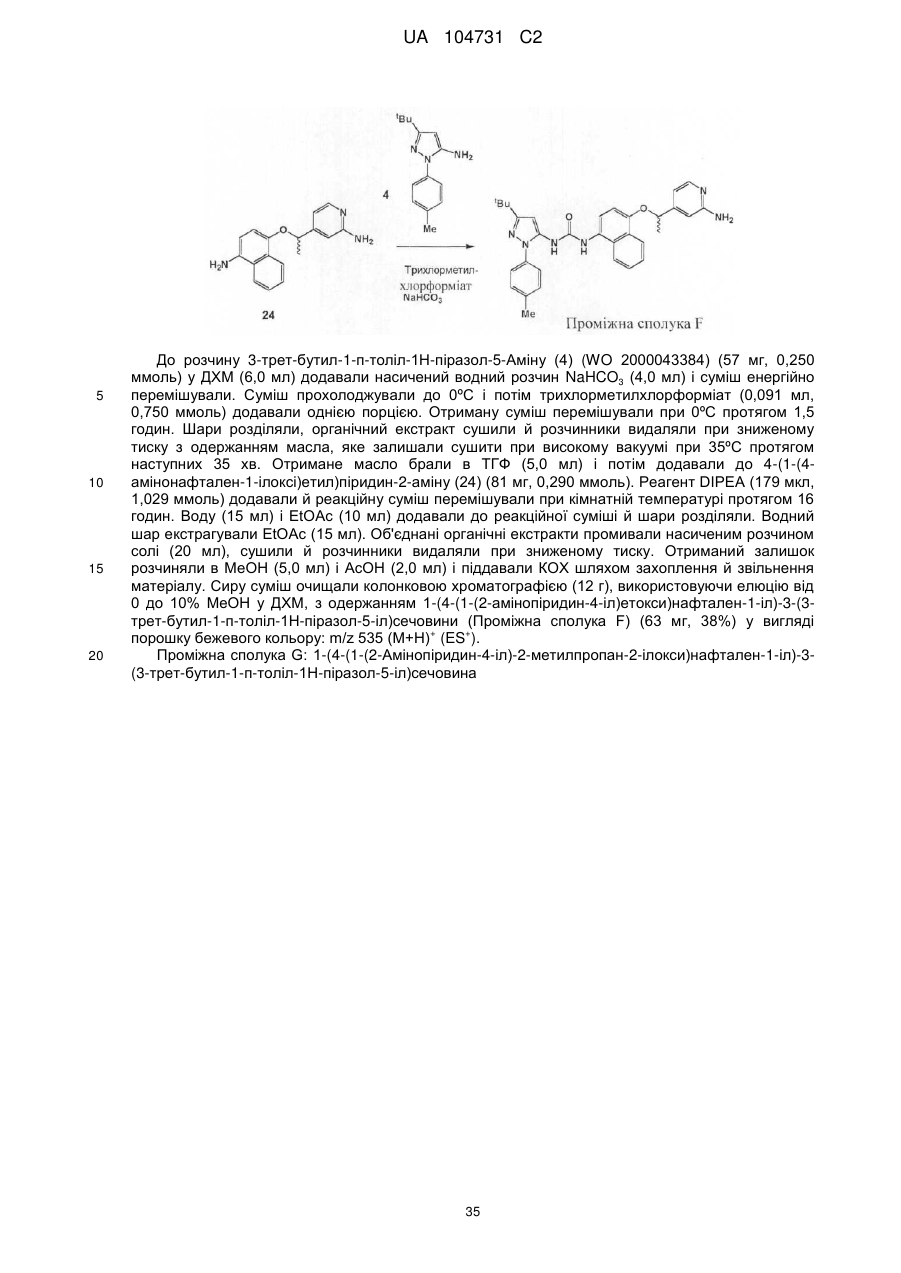
Формула / Реферат
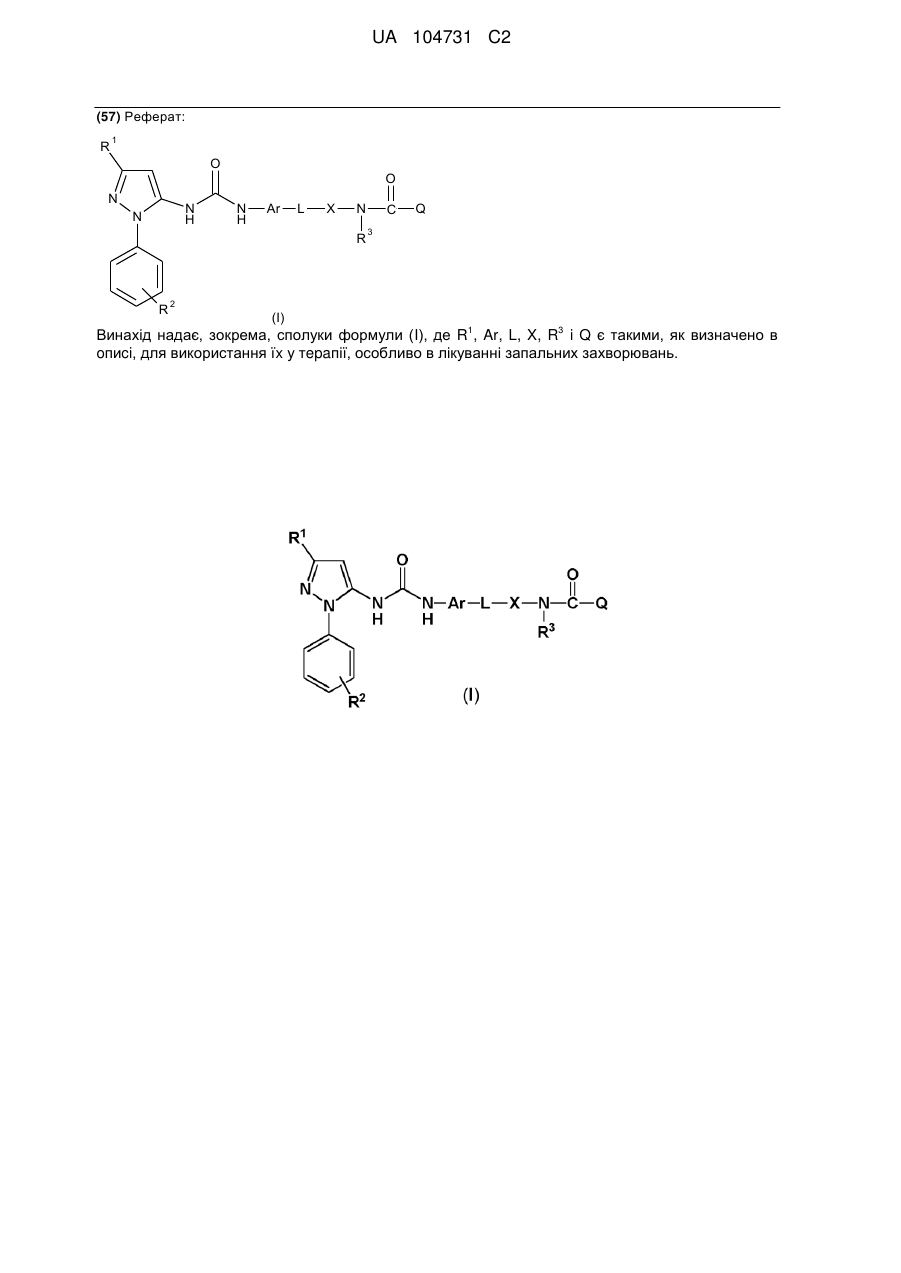
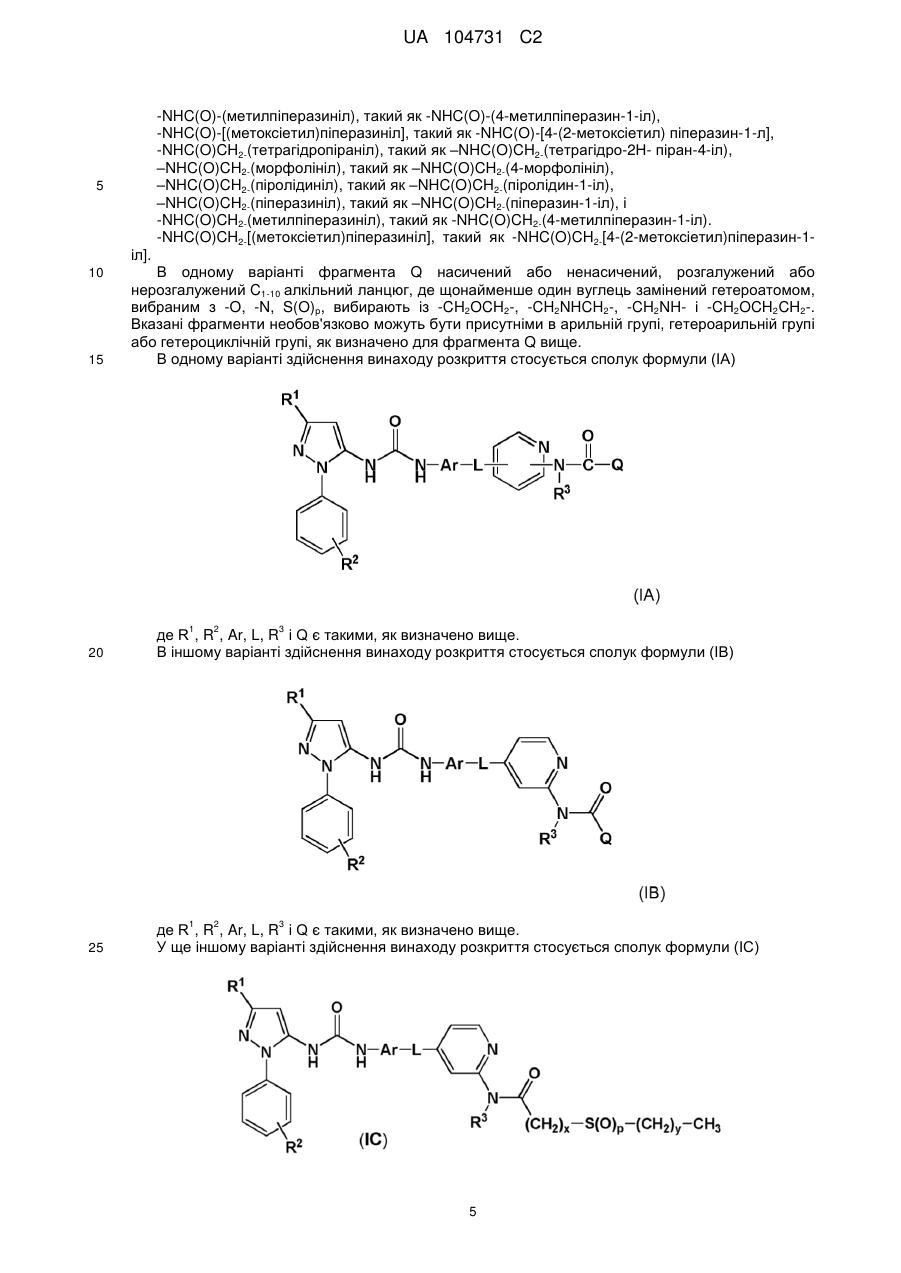
1. Сполука формули (І)
 ,
,
де R1 означає С1-6алкіл, необов'язково заміщений гідроксильною групою;
R2 означає Н або C1-6алкіл, необов'язково заміщений гідроксильною групою;
R3 означає Н, С1-6алкіл або С0-3алкілС3-6, циклоалкіл;
Ar означає нафтильне або фенільне кільце, кожне з яких може бути необов'язково заміщене однією або більше групами, незалежно вибраними з C1-6алкілу, С1-6алкокси, аміно, С1-4моно- або діалкіламіно:
L є насиченим або ненасиченим, розгалуженим або нерозгалуженим C1-8aлкіленовим ланцюгом, де один або більше атомів вуглецю необов'язково замінені -О-, i ланцюг необов'язково заміщений одним або більше атомами галогену;
X є 5- або 6-членною гетероарильною групою, що містить щонайменше один атом азоту i необов'язково включає 1 або 2 додаткових гетероатоми, вибрані з О, S i N;
Q вибирають iз
а) насиченого або ненасиченого, розгалуженого або нерозгалуженого С1-10алкільного ланцюга, де щонайменше один вуглець (наприклад, 1, 2 або 3 вуглеці) замщений гетероатомом, вибраним з О, N, S(O)р, де вказаний ланцюг необов'язково заміщений однією або більше групами, незалежно вибраними з оксо, галогену, арильної групи, гетероарильної групи або гетероциклічної групи,
де кожна арильна, гетероарильна або гетероциклічна група, несе від 0 до 3 замісників, вибраних з галогену, С1-6алкілу, C1-6алкокси. С1-6галогеналкілу, аміно, С1-4моно- або діалкіламіно,
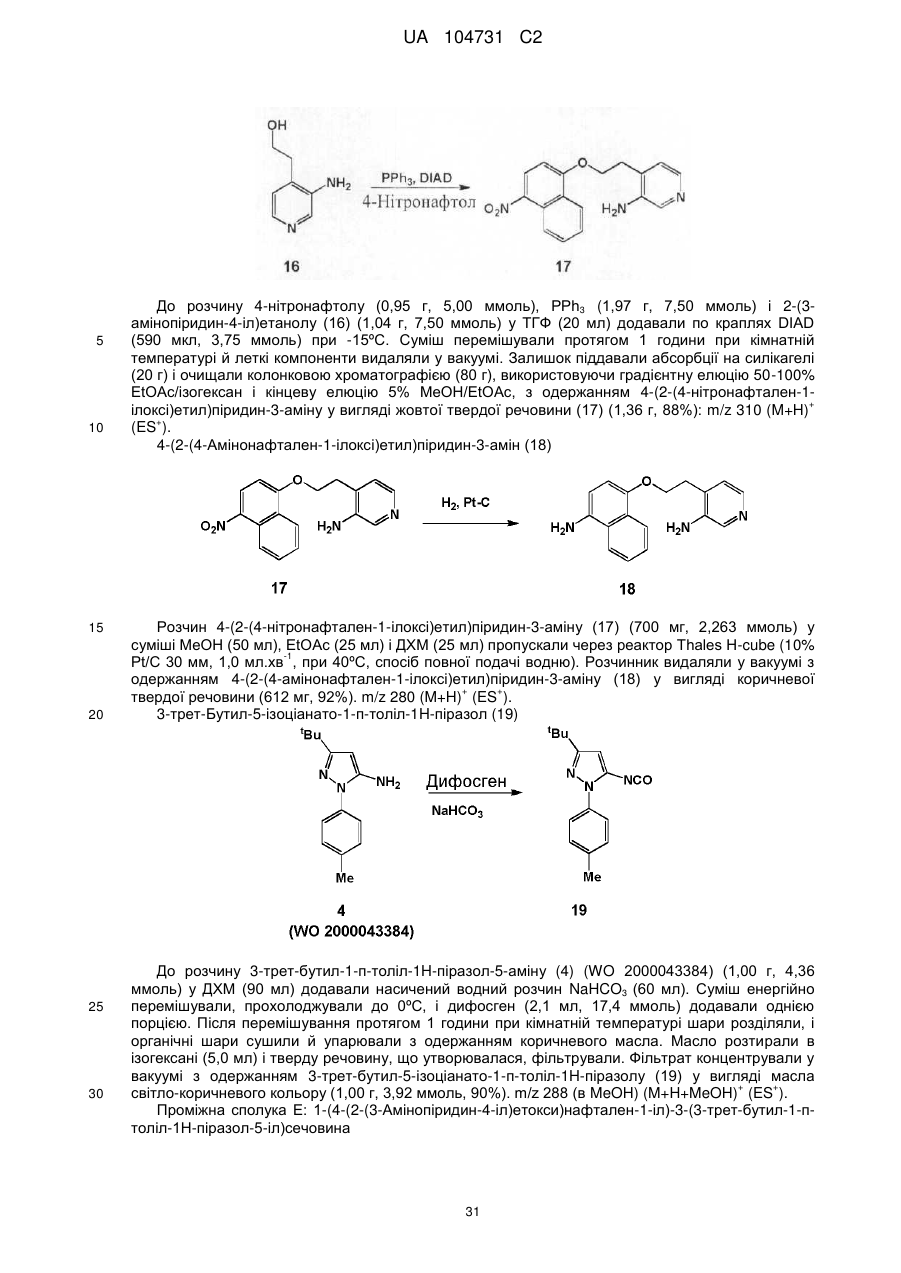
за умови, що атом, безпосередньо зв'язаний з карбонілом в -NR3С(О)-, не є атомом кисню або сірки; i
b) C0-8алкілС5-6гетероциклілу, де вказана гетероциклічна група містить щонайменше один гетероатом, вибраний з О, N і S, і необов'язково заміщена однією або двома або трьома групами, незалежно вибраними з галогену, С1-6алкілу, С1-6алкокси, С1-6галогеналкілу, аміно, С1-4моно- і діалкіламіно; і
р дорівнює 0, 1 або 2;
або її фармацевтично прийнятна сіль або сольват, включаючи всі її стереоізомери її тауіомери.
2. Сполука формули (І) за п. 1, де Ar означає нафтил.
3. Сполука формули (1) за п. 1 або 2, де R1 означає трет-бутил.
4. Сполука формули (І) за будь-яким одним із пп. 1-3, де R2 означає метил.
5. Сполука формули (1) за будь-яким одним із пп. 1-4, де R2 знаходиться в пара-положенні.
6. Сполука формули (I) за будь-яким одним із пп. 1-5, де L являє собою -(СН2)nО(СН2)m-, де n і m незалежно дорівнюють 0, 1, 2, 3, 4, 5, 6 або 7, за умови, що n+m дорівнює нулю або цілому числу від 1 до 7.
7. Сполука формули (І) за будь-яким із пп. 1-6, де R3 є Н.
8. Сполука формули (І) за будь-яким із пп. 1-7, де Q вибирають із -NR3C(O)CH2OC1-6алкілу, -NR3C(O)CH2O(CH2)2ОСН3, -NR3C(O)CH(СH3)ОСН3, -NR3C(O)CH2NHCH3, -NR3C(O)CH2NHCH2CH2OCH3, -NR3C(O)CH2SCH3, -NR3C(O)NH2, -NR3C(O)CH2S(O)2CH3, -NR3C(O)NHC1-7алкілу, -NR3C(O)N(C1-4алкіл)С1-5алкілу і -NR3С(О)СНN[(СН2)2ОСН3]2.
9. Сполука формули (І) за п. 8, де Q вибирають із -NHС(O)СН2ОСН3, -NHC(O)CH2O(CH2)2OCH3, -NHC(O)CH(CH3)OCH3, -NHC(O)CH2NHCH3, -NHC(O)CH2NH(CH2)2OCH3, -NHC(O)CH2SCH3, -NHC(O)NH2, -NHC(O)CH2S(O)2CH3, -NHC(O)NHCH3, -NHC(O)N(CH3)2 і -NHC(O)CHN[(CH2)2OCH3]2.
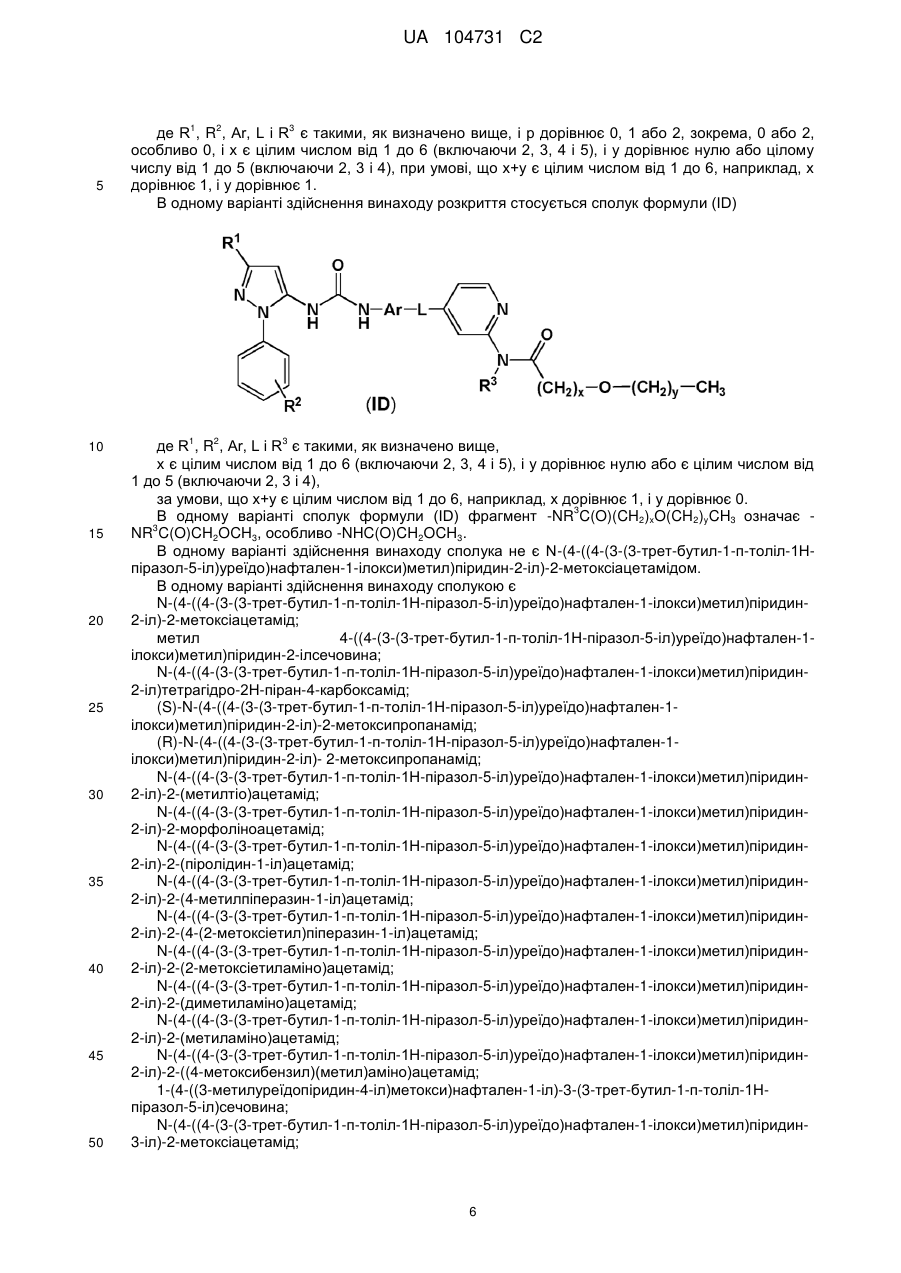
10. Сполука формули (І) за п. 1, де сполука представлена формулою (ІА)
 , (IA)
, (IA)
або її фармацевтично прийнятна сіль або сольват, включаючи всі її стереоізомери й таутомери.
11. Сполука формули (І) за п. 10, де сполука представлена формулою (IB)
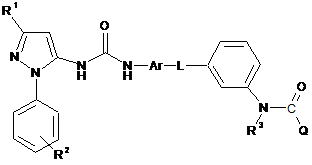 , (IB)
, (IB)
або її фармацевтично прийнятна сіль або сольват, включаючи всі її стереоізомери й таутомерії.
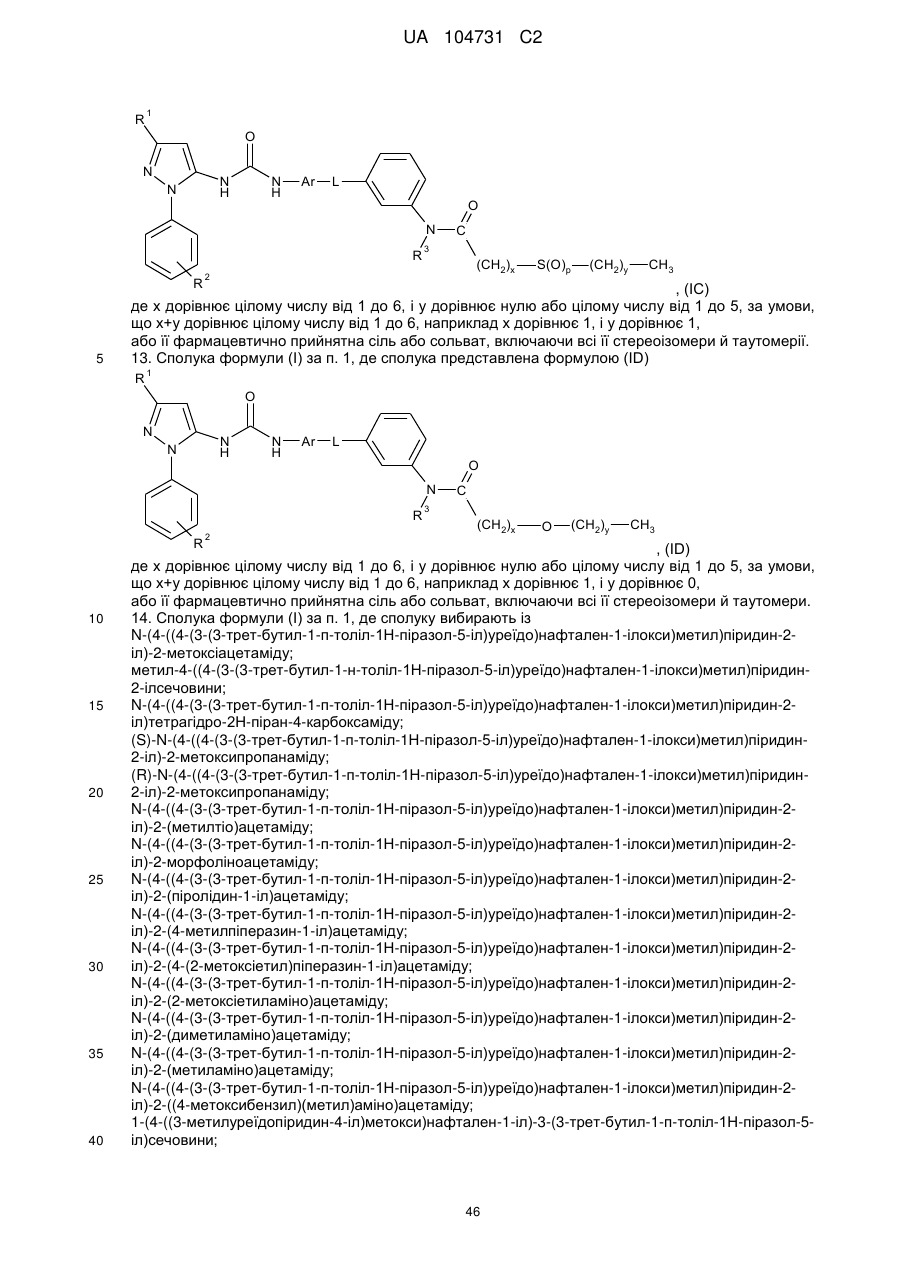
12. Сполука формули (І) за п. 1, де сполука представлена формулою (ІС)
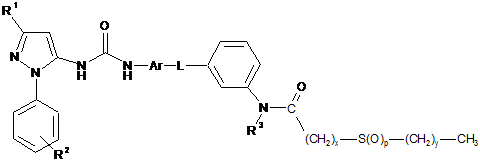 , (ІС)
, (ІС)
де х дорівнює цілому числу від 1 до 6, і у дорівнює нулю або цілому числу від 1 до 5, за умови, що х+у дорівнює цілому числу від 1 до 6, наприклад х дорівнює 1, і у дорівнює 1,
або її фармацевтично прийнятна сіль або сольват, включаючи всі її стереоізомери й таутомерії.
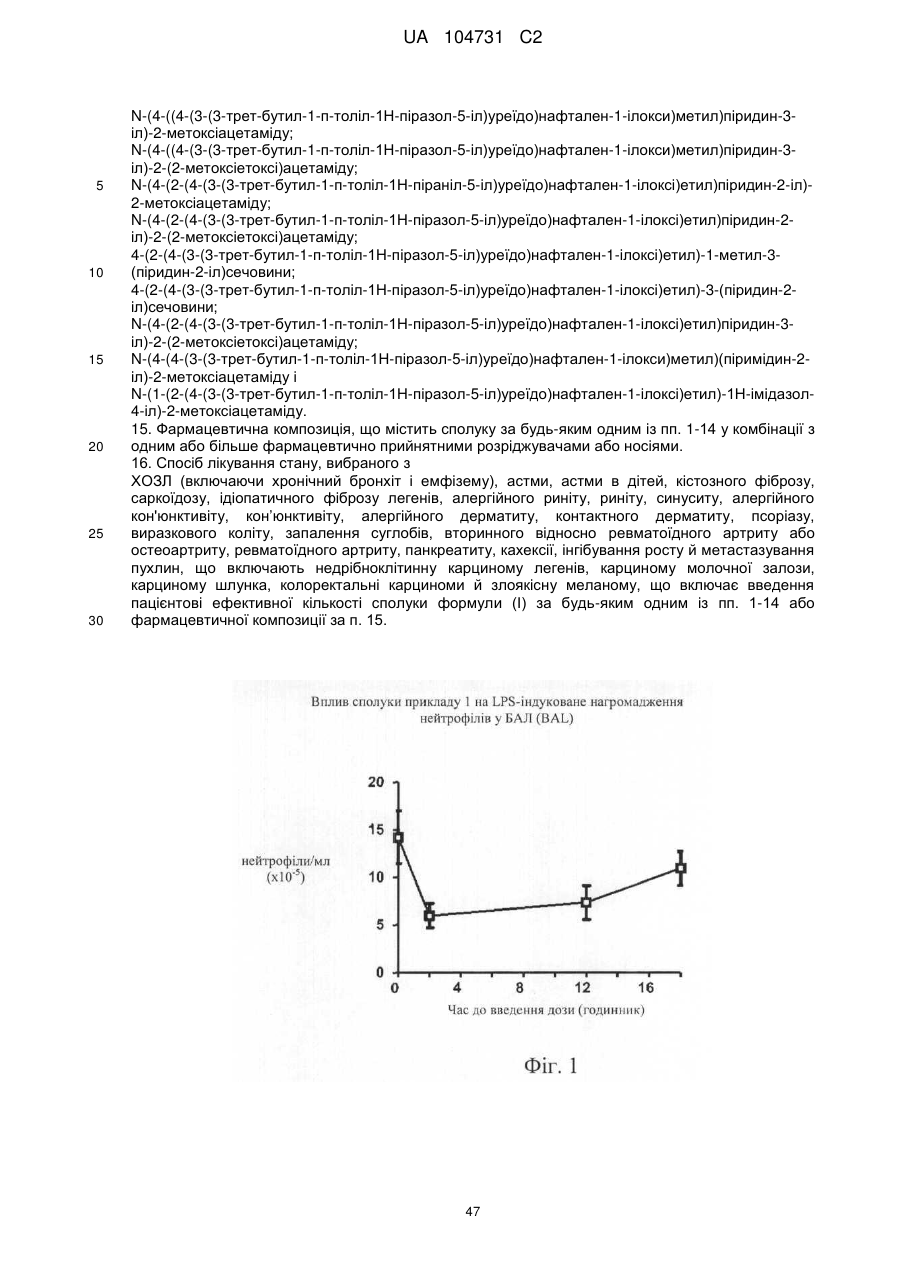
13. Сполука формули (І) за п. 1, де сполука представлена формулою (ID)
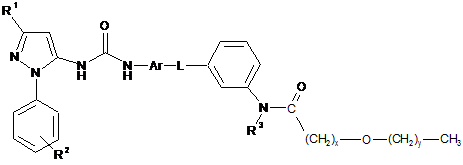 , (ІD)
, (ІD)
де x дорівнює цілому числу від 1 до 6, і у дорівнює нулю або цілому числу від 1 до 5, за умови, що х+у дорівнює цілому числу від 1 до 6, наприклад х дорівнює 1, і у дорівнює 0,
або її фармацевтично прийнятна сіль або сольват, включаючи всі її стереоізомери й таутомери.
14. Сполука формули (І) за п. 1, де сполуку вибирають із
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-метоксіацетаміду;
метил-4-((4-(3-(3-трет-бутил-1-н-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-ілсечовини;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)тетрагідро-2Н-піран-4-карбоксаміду;
(S)-N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-метоксипропанаміду;
(R)-N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-метоксипропанаміду;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-(метилтіо)ацетаміду;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-морфоліноацетаміду;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-(піролідин-1-іл)ацетаміду;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-(4-метилпіперазин-1-іл)ацетаміду;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-(4-(2-метоксіетил)піперазин-1-іл)ацетаміду;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-(2-метоксіетиламіно)ацетаміду;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-пiразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-(диметиламіно)ацетаміду;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-(метиламіно)ацетаміду;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)пipидин-2-iл)-2-((4-мeтoкcибeнзил)(мeтил)aмінo)aцетaмiдy;
1-(4-((3-метилуреїдопіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)сечовини;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-3-іл)-2-метоксіацетаміду;
N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-3-іл)-2-(2-метоксіетоксі)ацетаміду;
N-(4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піраніл-5-іл)уреїдо)нафтален-1-ілоксі)етил)піридин-2-іл)-2-метоксіацетаміду;
N-(4-(2-(4-(3-(3-трет-бутил-l-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)піридин-2-іл)-2-(2-метоксіетоксі)ацетаміду;
4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)-1-метил-3-(піридин-2-іл)сечовини;
4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)-3-(піридин-2-іл)сечовини;
N-(4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)піридин-3-іл)-2-(2-метоксіетоксі)ацетаміду;
N-(4-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)(піримідин-2-іл)-2-метоксіацетаміду і
N-(1-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)-1Н-імідазол-4-іл)-2-метоксіацетаміду.
15. Фармацевтична композиція, що містить сполуку за будь-яким одним із пп. 1-14 у комбінації з одним або більше фармацевтично прийнятними розріджувачами або носіями.
16. Спосіб лікування стану, вибраного з
ХОЗЛ (включаючи хронічний бронхіт і емфізему), астми, астми в дітей, кістозного фіброзу, саркоїдозу, ідіопатичного фіброзу легенів, алергійного риніту, риніту, синуситу, алергійного кон'юнктивіту, кон’юнктивіту, алергійного дерматиту, контактного дерматиту, псоріазу, виразкового коліту, запалення суглобів, вторинного відносно ревматоїдного артриту або остеоартриту, ревматоїдного артриту, панкреатиту, кахексії, інгібування росту й метастазування пухлин, що включають недрібноклітинну карциному легенів, карциному молочної залози, карциному шлунка, колоректальні карциноми й злоякісну меланому, що включає введення пацієнтові ефективної кількості сполуки формули (І) за будь-яким одним із пп. 1-14 або фармацевтичної композиції за п. 15.
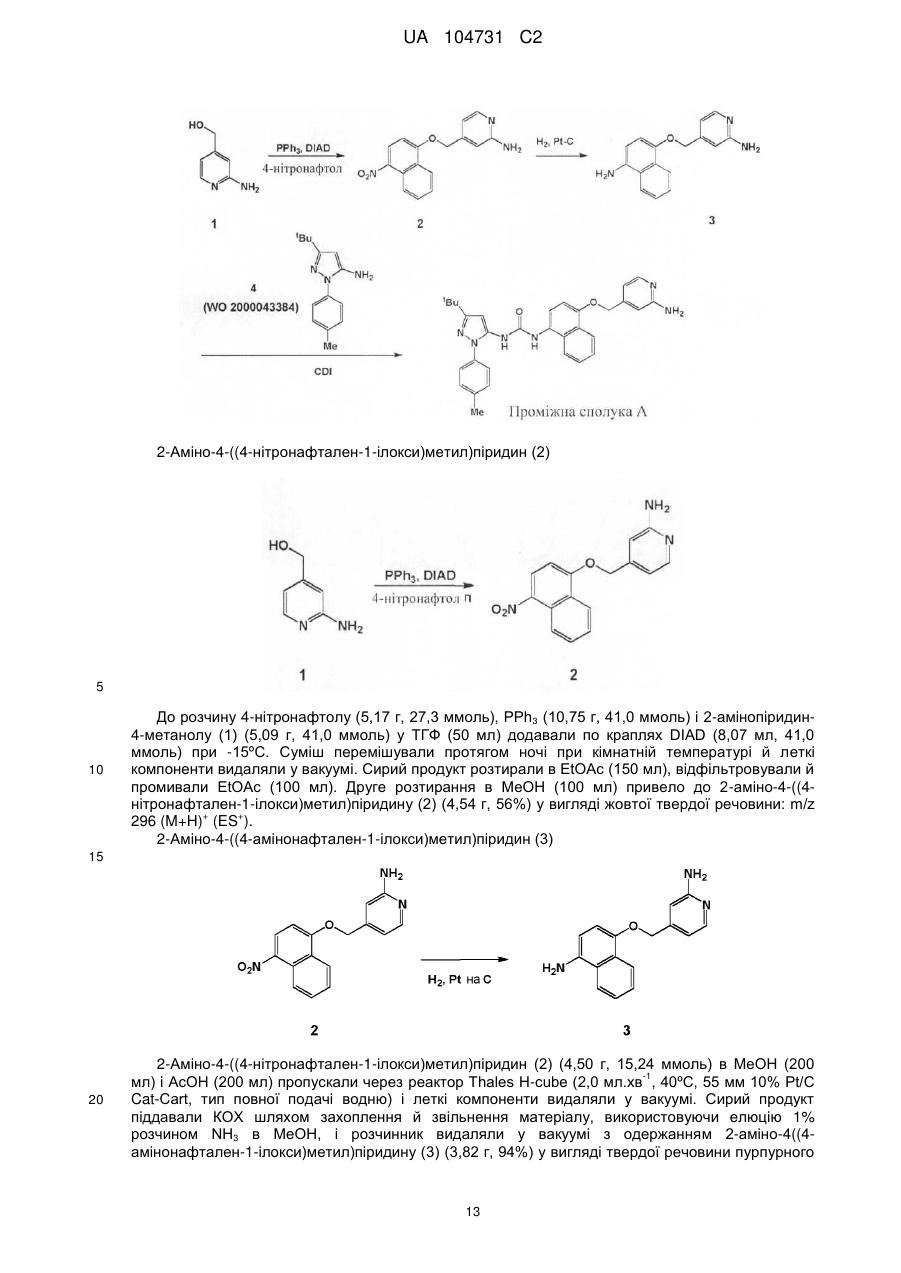
Текст
Реферат: R 1 O N N H N O N H Ar L X N R R C Q 3 2 (I) 1 3 Винахід надає, зокрема, сполуки формули (I), де R , Ar, L, X, R i Q є такими, як визначено в oпиci, для використання їx у тepaпії, особливо в лікуванні запальних захворювань. UA 104731 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Винахід стосується сполук, які є інгібіторами міоген-активованих ферментів протеїнкіназ р38 (названими в описі інгібіторами р38 МАР-кіназ), особливо інгібіторами підтипів кіназ альфа й гамма, і застосування сполук у терапії, включаючи фармацевтичні комбінації, особливо в лікуванні запальних захворювань, що включають запальні захворювання легенів, такі як ХОЗЛ (хронічне обструктивне захворювання легенів). Попередній рівень техніки в даній галузі Чотири ізоформи МАРК р38 (альфа, бета, гамма й дельта, відповідно) ідентифіковані, кожна, що має тканиноспецифічну картину експресії. Альфа- і бета-ізоформи протеїнкінази р38 МАРК експресуються по всьому організму й виявляються в багатьох різних типах клітин. Альфаі бета-ізоформи протеїнкінази р38 МАРК інгібуються деякими відомими низькомолекулярними інгібіторами р38 МАРК. Отримані раніше сполуки були високотоксичними через повсюдний розподіл експресії вказаних вище ізоформ і відсуті спрямованої дії сполук. Більш пізні інгібітори є поліпшеними високовибірковими інгібіторами альфа- і бета-ізоформ р38 МАРК й мають більш широку межу безпеки. Менш відомими є гамма- і дельта-ізоформи р38 МАРК. Вказані ізоформи експресуються в специфічних тканинах/клітинах (на відміну від альфа р38 і бета р38 ізоформ). Дельта-ізоформа р38 МАРК експресується найбільше в підшлунковій залозі, яєчках, легені, тонкому кишечнику й нирці. Вказана ізоформа також є в надлишку в макрофагах (Smith, S. J. (2006) Br. J. Pharmacol. 149:393-404) і визначається в нейтрофілах, CD4+ T-клітинах і ендотеліальних клітинах і www.genecard.org, Karin, K. (1999) J. Immunol.). Досить небагато відомо про експресію гаммаізоформи p38 MAPK, але найбільше вказана ізоформа експресується в головному мозку й серці, а також у лімфоцитах і макрофагах (www.genecard.org). У даний час селективні низькомолекулярні інгібітори гамма- і дельта-ізоформ p38 MAPK недоступні, але одна наявна сполука, BIRB 796, як відомо, проявляє спільну для всіх ізоформ інгібіторну активність. Інгібування гамма- і дельта-ізоформ р38 спостерігається при більш високих концентраціях сполуки, ніж потрібно для інгібування альфа- і бета-ізоформ р38 (Kuma, Y. (2005) J. Biol. Chem. 280:19472-19479). Сполука BIRB 796 також зменшує фосфорилування протеїнкіназ p38 MAPK або кіназ JNK, що здійснюється за допомогою кінази МКК6 або МКК4, що стоїть вище в каскаді реакцій. Дослідник Kuma висловив припущення, що конформаційна зміна, викликана зв'язуванням інгібітору з МАРК, може порушувати структуру як ділянки фосфорилування, так і ділянки зв'язування для активатора, що стоїть вище, тим самим погіршуючи фосфорилування протеїнкіназ р38 МАРК або кіназ JNK. Вважають, що р38 МАР-кіназа відіграє провідну роль у багатьох шляхах передачі сигналу, які беруть участь в ініціації й підтримці хронічного, стійкого запалення при захворюванні людини, наприклад, тяжкій астмі й ХОЗЛ (хронічного обструктивного захворювання легенів). У даний час є численні літературні дані, які свідчать про те, що р38 МАР-кіназа активується рядом прозапальних цитокінів, і що її активація приводить до поповнення й вивільнення інших прозапальних цитокінів. Дійсно, дані деяких клінічних досліджень демонструють сприятливі зміни в активності захворювання у хворих у процесі лікування інгібіторами р38 МАР-кінази. Наприклад, Smith, S. J. (2006) Br. J. Pharmacol. 149:393-404 описує вплив інгібування інгібіторів р38 МАР-кінази на вивільнення цитокіну з макрофагів людини. Пропонується застосування інгібіторів р38 МАР-кінази в лікуванні хронічного обструктивного захворювання легенів (ХОЗЛ). Було показано, що низькомолекулярні інгібітори, спрямовані на кіназу р38 МАРКα/β, виявилися ефективними інгібіторами, що знижують різні параметри запалення в клітинах і тканинах хворих ХОЗЛ, які, у більшості випадків, не проявляли чутливості до кортикостероїду (Smith, S. J. (2006) Br. J. Pharmacol. 149:393-404), і вказані інгібітори були ефективними in vivo на тваринних моделях (Underwood, D. C. et al. (2000) 279:895-902; Nath, P. et al. (2006) Eur. J. Pharmacol. 544:160-167). Дослідник Irusen і колеги також припустили можливість залучення кінази р38 МАРКα/β під час відсуті чутливості до кортикостероїду через зниження зв’язувального спорідненості глюкокортикоїдного рецептора (GR) у ядрах (Irusen, E. et al., (2002) J. Allergy Clin. Immunol., 109:649-657). Клінічний досвід з рядом інгібіторів р38 МАР-кінази, що включають AMG548, BIRB 796, VX702, SCIO469 і SCIO323, описаний у публікації Lee et al. (2005) Current Med. Chem. 12:2979-2994. ХОЗЛ є станом, при якому основне запалення, як було показано, у значній мірі проявляє стійкість до протизапальної дії інгальованих кортикостероїдів. Тому ефективна стратегія для лікування ХОЗЛ може полягати в досягненні такого впливу, який проявляє як характерні протизапальні ефекти, так і здатний підвищити чутливість тканин легенів хворого ХОЗЛ до інгальованих кортикостероїдів. Недавня публікація Mercado et al. (2007; American Thoracic Society Abstract A56) продемонструвала, що сайленсинг гамма-ізоформи р38 здатний до 1 UA 104731 C2 5 10 15 20 25 30 35 40 45 50 відновлення чутливості до кортикостероїдів. Таким чином, може здійснюватися “подвійна” користь від використання інгібітору р38 МАР-кінази при лікуванні ХОЗЛ. Однак основною перешкодою, що утрудняють застосування інгібіторів р38 МАР-кінази в лікуванні хронічних запальних захворювань людини, була токсичність, що спостерігалася у хворих. Ця обставина була досить серйозною причиною, щоб відмовитися від клінічної розробки багатьох поліпшених сполук, що включають усі сполуки, особливо згадані вище. Дотепер зберігається потреба в ідентифікації й розробці нових сполук, терапевтично використовуваних як інгібітори р38 МАР-кінази, які мають поліпшену терапевтичну здатність, зокрема, які є більш ефективними, довше дію визначеної для підтипів специфічністю, які проявляють хорошу протизапальну здатність. Суть винаходу Винахід надає сполуку формули (I) 1 де R означає C1-6 алкіл, необов'язково заміщений гідроксильною групою; 2 R означає H або C1-6 алкіл, необов'язково заміщений гідроксильною групою; 3 R означає H, C1-6 алкіл або C0-3 алкілC3-6 циклоалкіл; Ar означає нафтильне або фенільне кільце, кожне з яких може бути необов'язково заміщене однією або більше групами, незалежно вибраними з C 1-6 алкілу, C1-6 алкокси, аміно, C1-4 моноабо діалкіламіно; L є насиченим або ненасиченим, розгалуженим або нерозгалуженим C 1-8 алкіленовим ланцюгом, де один або більше вуглеців необов'язково замінені -O-, і ланцюг необов'язково заміщений одним або більше атомами галогену; X є 5- або 6-членною гетероарильною групою, що містить щонайменше один атом азоту, що й необов'язково включає 1 або 2 додаткових гетероатома, вибраних з O, S і N; Q вибирають із a) насиченого або ненасиченого, розгалуженого або нерозгалуженого C 1-10 алкільного ланцюга, де щонайменше один вуглець (наприклад, 1, 2 або 3 вуглеці, більш прийнятно, 1 або 2, зокрема, 1) замінений гетероатомом, вибраним з O, N, S(O) p, де вказаний вище ланцюг необов'язково заміщений однією або більше групами, незалежно вибраними з оксо, галогену, арильної групи, гетероарильної групи або гетероциклічної групи, де кожна арильна, гетероарильна або гетероциклічна група несе від 0 до 3 замісників, вибраних з галогену, C1-6 алкілу, C1-6 алкокси, C1-6 галогеналкілу, аміно, C1-4 моно- або діалкіламіно, 3 за умови, що атом, безпосередньо зв'язаний з карбонілом в -NR C(O)-, не є атомом кисню або сірки; і b) C0-8алкілC5-6 гетероциклілу, де вказана гетероциклічна група, що містить щонайменше один гетероатом (наприклад, 1, 2 або 3, більш прийнятно, 1 або 2, зокрема, 1 гетероатом), вибраний з O, N і S, і необов'язково заміщена однією або двома або трьома групами, незалежно вибраними з галогену, C1-6 алкілу, C1-6 алкокси, C1-6 галогеналкілу, аміно, C1-4 моно- і діалкіламіно; і p дорівнює 0, 1 або 2; або її фармацевтично прийнятна сіль або сольват, включаючи всі її стереоізомери й таутомери. Короткий опис фігур На фіг. 1 представлений графік залежності числа нейтрофілів у БАЛ (BALF) від часу до введення препарату для сполуки прикладу 1 у тесті нагромадження нейтрофілів, індукованому LPS. На фіг. 2 представлений графік залежності % інгібування нейтрофілезу від часу до введення 2 UA 104731 C2 5 10 15 20 25 30 35 40 45 50 55 60 дози для сполуки прикладу 1 у тесті нагромадження нейтрофілів, індукованому LPS. Докладний опис винаходу Алкіл, як використовують в описі, належить до прямого ланцюга або розгалуженого алкільного ланцюга, такого як, без обмеження, метил, етил, пропіл, ізопропіл, бутил і третбутил. В одному варіанті здійснення винаходу алкіл належить до прямого алкільного ланцюга. Алкокси, як використовують в описі, належить до прямого або розгалуженого алкоксиланцюга, наприклад, метокси, етокси, пропокси, бутокси. Алкокси, як використовують в описі, також поширюється на варіанти здійснення винаходу, у яких атом кисню локалізований в алкільний ланцюг, наприклад, -CH2CH2OCH3 або -CH2OCH3. В одному варіанті здійснення винаходу алкокси зв'язується через кисень із іншою частиною молекули. В одному варіанті здійснення винаходу розкриттям винаходу є прямий ланцюг алкокси. 1 В одному варіанті здійснення винаходу опис надає сполуки формули (I), де R означає метил, етил, пропіл, ізопропіл, бутил або трет-бутил, зокрема трет-бутил. 1 В одному варіанті здійснення винаходу R означає –C(CH3)2CH2OH. 2 В одному варіанті здійснення винаходу R означає метил, етил, пропіл, ізопропіл, бутил або трет-бутил, зокрема, метил. 2 В одному варіанті здійснення винаходу R є –CH2OH. 2 В одному варіанті здійснення винаходу R розташовано в 2, 3 або 4 положенні (тобто, орто-, мета- або пара-положенні), зокрема, пара-положенні (4). В одному варіанті здійснення винаходу Ar є нафтилом. В одному варіанті здійснення винаходу Ar не заміщений необов'язковими замісниками. В одному варіанті здійснення винаходу Ar заміщено 1 або 2 групами. В одному варіанті здійснення винаходу L є лінкером із прямим ланцюгом, наприклад: –(CH2)n-, де n дорівнює 1, 2, 3, 4, 5, 6, 7 або 8; або –(CH2)nО(CH2)m–, де n і m незалежно дорівнюють 0, 1, 2, 3, 4, 5, 6 або 7, за умови, що n+m дорівнює нулю або цілому числу від 1 до 7, наприклад, де n дорівнює 0, і m дорівнює 1 або 2, або альтернативно, наприклад, де n дорівнює 1 або 2, і m дорівнює 0. a В одному варіанті здійснення винаходу L є лінкером з розгалуженим ланцюгом R О(CH2)m, a де m дорівнює нулю або цілому числу 1, 2, 3, 4 або 5, і R є C2-7 розгалуженим алкілом, за a умови, що число вуглеців в R + m дорівнює цілому числу від 2 до 7, особливо де m дорівнює 0, зокрема –CH(CH3)O-. b В одному варіанті здійснення винаходу L є лінкером з розгалуженим ланцюгом (CH 2)nОR , b де n дорівнює нулю або цілому числу 1, 2, 3, 4 або 5, і R є C2-7 розгалуженим алкілом, за умови, b що число вуглеців в R + n дорівнює цілому числу від 2 до 7, зокрема -OCH(CH3)- або OC(CH3)2CH2-. a b В одному варіанті здійснення винаходу L є лінкером з розгалуженим ланцюгом R ОR , де a b групи R і R незалежно вибирають із C2-7 розгалуженого алкілену, за умови, що число вуглеців a b в R + R дорівнює цілому числу від 4 до 7. 3 В одному варіанті здійснення винаходу R означає H. 3 В одному варіанті здійснення винаходу R означає метил, етил, пропіл або ізопропіл. Галоген включає фтор, хлор, бром або йод, зокрема, фтор, хлор або бром, особливо, фтор або хлор. В одному варіанті здійснення винаходу ланцюг L включає замісники 1, 2 або 3 атома галогену, незалежно вибрані із фтору, хлору й брому, наприклад, вуглець алкілену може нести один або два атоми хлору або фтору, і кінцева метильна група може нести один, два або три атоми фтору або один, два або три атоми хлору з утворенням групи, такої як трифторметил або трихлорметил. В одному варіанті здійснення винаходу X вибирають із піролу, оксазолу, тіазолу, ізотіазолу, імідазолу, піразолу, ізоксазолу, оксадіазолу, піридазину, піримідину, піразину або 1,2,3- і 1,2,4триазолу, зокрема, піримідину, імідазолу або піридину, і особливо піридину. В одному варіанті здійснення винаходу фрагментом Q є C 1-10 алкільний ланцюг, де щонайменше один вуглець (наприклад, 1, 2 або 3 вуглеці, зокрема 1 або 2 вуглеці) замінений гетероатомом, вибраним з O, N, S(O)p, де вказаний ланцюг необов'язково заміщений однією або більше групами, вибраними з оксо, галогену, арильної групи, гетероарильної групи або гетероциклічної групи, кожна арильна, гетероарильна або гетероциклічна група несе від 0 до 3 замісників, вибраних з галогену, C1-6 алкілу, C1-6 алкокси, C1-6 галогеналкілу, аміно, C1-4 моноабо діалкіламіно. В одному варіанті здійснення винаходу Q означає насичений або ненасичений, розгалужений або нерозгалужений C1-8 алкільний ланцюг або C1-6 алкільний ланцюг, де щонайменше один вуглець замінений гетероатомом, вибраним з -O, -N, S(O)p. 3 UA 104731 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті здійснення винаходу гетероатом(и), що заміняє вуглець(і) в алкільному ланцюзі фрагмента Q, вибирають із N і O. В одному варіанті здійснення винаходу алкільний ланцюг фрагмента Q не несе будь-які необов'язкові замісники. В одному варіанті здійснення винаходу алкільний ланцюг фрагмента Q несе 1, 2 або 3, наприклад, 1 або 2, зокрема, 1 необов'язковий замісник. Фахівцям у даній галузі буде зрозуміло, що гетероатом може замінювати первинний, вторинний або третинний вуглець, тобто, -CH3-, -CH2- або –CH–групу, як технічно можливий. В одному варіанті здійснення винаходу p дорівнює 0 або 2. В одному варіанті здійснення винаходу описані сполуки включають такі, у яких фрагмент 3 NR C(O)Q у формулі I являє собою 3 3 -NR C(O)CH2OC1-6 алкіл, зокрема, -NR C(O)CH2OCH3, особливо -NHC(O)CH2OCH3; 3 -NR C(O)CH2O(CH2)2OCH3, зокрема, -NHC(O)CH2O(CH2)2OCH3; 3 -NR C(O)CH(CH3)OCH3, зокрема, -NHC(O)CH(CH3)OCH3; 3 -NR C(O)CH2NHCH3, зокрема, -NHC(O)CH2NHCH3; 3 -NR C(O)CH2NHCH2CH2OCH3, зокрема, -NHC(O)CH2NH(CH2)2OCH3; 3 -NR C(O)CH2SCH3, зокрема, -NHC(O)CH2SCH3; 3 -NR C(O)CH2S(O)2CH3, зокрема, -NHC(O)CH2S(O)2CH3; 3 –NR C(O)NH2, зокрема, –NHC(O)NH2; 3 –NR C(O)NHC1-7 алкіл, зокрема, –NHC(O)NHCH3; 3 –NR C(O)N(C1-4 алкіл)C1-5 алкіл, зокрема, –NHC(O)N(CH3)2; або 3 -NR C(O)CHN[(CH2)2OCH3]2, зокрема, -NHC(O)CHN[(CH2)2OCH3]2 Таким чином, в одному варіанті здійснення винаходу атом азоту в алкільному ланцюзі 3 безпосередньо зв'язаний з карбонілом фрагмента -NR C(O) і, крім того, може, наприклад, 3 3 входити до складу кінцевої аміногрупи, відповідно -NR C(O)N(CH3)2 або –NR C(O)NHCH3. В одному варіанті здійснення винаходу Q означає насичений або ненасичений, розгалужений або нерозгалужений C1-10 алкільний ланцюг, де щонайменше один вуглець замінений гетероатомом, вибраним з O, N і S(O)p, де вказаний ланцюг заміщений арильною групою, що несе від 0 до 3 замісників, наприклад, 1, 2 або 3 замісника, такі як 1 або 2 замісника, незалежно вибраних з галогену, C1-6 алкілу, C1-6 алкокси, C1-6 галогеналкілу, аміно й C1-4 моноабо діалкіламіно. В одному варіанті здійснення винаходу вказаною арильною групою є феніл, наприклад, заміщений феніл або незаміщений феніл. 3 Приклади фрагмента -NR C(O)Q, де Q містить заміщений феніл, включають 3 3 –NR C(O)CH2NHCH2C6H5(OCH3) і –NR C(O)CH2N(CH3)CH2C6H5(OCH3). В одному варіанті здійснення винаходу Q означає насичений або ненасичений, розгалужений або нерозгалужений C1-10 алкільний ланцюг, де щонайменше один вуглець замінений гетероатомом, вибраним з O, N і S(O)p, де вказаний ланцюг заміщений гетероарильною групою, що несе від 0 до 3 замісників, наприклад, 1, 2 або 3 замісника, такі як 1 або 2 замісника, вибраних з галогену, C1-6 алкілу, C1-6 алкокси, C1-6 алкіламіно, C1-4 моно- або діалкіламіно. В одному варіанті здійснення винаходу вказану гетероарильну групу вибирають із тіофену, оксазолу, тіазолу, ізотіазолу, імідазолу, піразолу, ізоксазолу, ізотіазолу, оксадіазолу, 1,2,3- або 1,2,4-триазолу, піридину, піридазину, піримідину, піразину й, зокрема, піридину й піримідину, особливо, піридину. В одному варіанті здійснення винаходу Q означає насичений або ненасичений, розгалужений або нерозгалужений C1-10 алкільний ланцюг, де щонайменше один вуглець замінений гетероатомом, вибраним з O, N і S(O)p, де вказаний ланцюг заміщений гетероциклічною групою, що несе від 0 до 3 замісників, наприклад, 1, 2 або 3 замісника, такі як 1 або 2 замісника, вибраних з галогену, C1-6 алкілу, C1-6 алкокси, C1-6 галогеналкіламіно, C1-4 моноабо діалкіламіно. В одному варіанті здійснення винаходу вказаний вище гетероцикліл вибирають із 5- або 6членної насиченої або частково ненасиченої кільцевої системи, що містить один або більше (наприклад, 1, 2 або 3, більш прийнятно, 1 або 2, зокрема, 1) гетероатоми, незалежно вибрані з O, N і S, наприклад, піролідин, тетрагідрофуран, тетрагідротіофен, піперидин, піперазин, морфолін і 1,4-діоксан. В одному варіанті здійснення винаходу розкриті сполуки включають сполуки формули (I), у 3 яких фрагмент -NR C(O)C0-8алкілгетероцикліл являє собою -NHC(O)-(тетрагідропіраніл), такий як -NHC(O)-(тетрагідро-2Н-піран-4-іл), –NHC(O)-(морфолініл), такий як –NHC(O)-(4-морфолініл), –NHC(O)-(піролідиніл), такий як –NHC(O)-(піролідин-1-іл), -NHC(O)-(піперазиніл), такий як -NHC(O)-(піперазин-1-іл), 4 UA 104731 C2 5 іл]. 10 15 -NHC(O)-(метилпіперазиніл), такий як -NHC(O)-(4-метилпіперазин-1-іл), -NHC(O)-[(метоксіетил)піперазиніл], такий як -NHC(O)-[4-(2-метоксіетил) піперазин-1-л], -NHC(O)CH2-(тетрагідропіраніл), такий як –NHC(O)CH2-(тетрагідро-2Н- піран-4-іл), –NHC(O)CH2-(морфолініл), такий як –NHC(O)CH2-(4-морфолініл), –NHC(O)CH2-(піролідиніл), такий як –NHC(O)CH2-(піролідин-1-іл), –NHC(O)CH2-(піперазиніл), такий як –NHC(O)CH2-(піперазин-1-іл), і -NHC(O)CH2-(метилпіперазиніл), такий як -NHC(O)CH2-(4-метилпіперазин-1-іл). -NHC(O)CH2-[(метоксіетил)піперазиніл], такий як -NHC(O)CH2-[4-(2-метоксіетил)піперазин-1 В одному варіанті фрагмента Q насичений або ненасичений, розгалужений або нерозгалужений C1-10 алкільний ланцюг, де щонайменше один вуглець замінений гетероатомом, вибраним з -O, -N, S(O)p, вибирають із -CH2OCH2-, -CH2NHCH2-, -CH2NH- і -CH2OCH2CH2-. Вказані фрагменти необов'язково можуть бути присутніми в арильній групі, гетероарильній групі або гетероциклічній групі, як визначено для фрагмента Q вище. В одному варіанті здійснення винаходу розкриття стосується сполук формули (IA) 1 2 3 1 2 3 20 де R , R , Ar, L, R і Q є такими, як визначено вище. В іншому варіанті здійснення винаходу розкриття стосується сполук формули (IB) 25 де R , R , Ar, L, R і Q є такими, як визначено вище. У ще іншому варіанті здійснення винаходу розкриття стосується сполук формули (IC) 5 UA 104731 C2 1 5 10 15 20 25 30 35 40 45 50 2 1 2 3 де R , R , Ar, L і R є такими, як визначено вище, і p дорівнює 0, 1 або 2, зокрема, 0 або 2, особливо 0, і x є цілим числом від 1 до 6 (включаючи 2, 3, 4 і 5), і y дорівнює нулю або цілому числу від 1 до 5 (включаючи 2, 3 і 4), при умові, що x+y є цілим числом від 1 до 6, наприклад, x дорівнює 1, і y дорівнює 1. В одному варіанті здійснення винаходу розкриття стосується сполук формули (ID) 3 де R , R , Ar, L і R є такими, як визначено вище, x єцілим числом від 1 до 6 (включаючи 2, 3, 4 і 5), і y дорівнює нулю або є цілим числом від 1 до 5 (включаючи 2, 3 і 4), за умови, що x+y є цілим числом від 1 до 6, наприклад, x дорівнює 1, і y дорівнює 0. 3 В одному варіанті сполук формули (ID) фрагмент -NR C(O)(CH2)xO(CH2)yCH3 означає 3 NR C(O)CH2OCH3, особливо -NHC(O)CH2OCH3. В одному варіанті здійснення винаходу сполука не є N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Нпіразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-метоксіацетамідом. В одному варіанті здійснення винаходу сполукою є N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-метоксіацетамід; метил 4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілокси)метил)піридин-2-ілсечовина; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)тетрагідро-2Н-піран-4-карбоксамід; (S)-N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілокси)метил)піридин-2-іл)-2-метоксипропанамід; (R)-N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілокси)метил)піридин-2-іл)- 2-метоксипропанамід; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-(метилтіо)ацетамід; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-морфолінoацетамід; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-(піролідин-1-іл)ацетамід; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-(4-метилпіперазин-1-іл)ацетамід; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-(4-(2-метоксіетил)піперазин-1-іл)ацетамід; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-(2-метоксіетиламіно)ацетамід; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-(диметиламіно)ацетамід; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-(метиламіно)ацетамід; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-((4-метоксибензил)(метил)аміно)ацетамід; 1-(4-((3-метилуреїдопіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Нпіразол-5-іл)сечовина; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин3-іл)-2-метоксіацетамід; 6 UA 104731 C2 5 10 15 20 25 30 N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин3-іл)-2-(2-метоксіетоксі)ацетамід; N-(4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)піридин2-іл)-2-метоксіацетамід; N-(4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)піридин2-іл)-2-(2-метоксіетоксі)ацетамід; 4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)-1-метил-3(піридин-2-іл)сечовина; 4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)-3-(піридин2-іл)сечовина; N-(4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)піридин3-іл)-2-(2-метоксіетоксі)ацетамід; N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілокси)метил)піримідин-2-іл)-2-метоксіацетамід; або N-(1-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)-1Німідазол-4-іл)-2-метоксіацетамід. Приклади солей сполуки (I) включають усі фармацевтично прийнятні солі, такі як, без обмеження, кислотно-адитивні солі сильних мінеральних кислот, такі як HСl- і HВr-солі, і кислотно-адитивні солі сильних органічних кислот, такі як сіль метансульфокислоти. Приклади сольватів включають гідрати. Сполуки, представлені в описі, можуть включати один або більше хіральних центрів, і опис призначений включити рацемати, енантіомери й стереоізомери вказаних сполук. В одному варіанті здійснення винаходу одна енантіомерна форма присутня в значно очищеному вигляді, яка практично не має відповідної енантіомерної форми. Розкриття також поширюється на всі поліморфні форми сполук, представлених в описі. Сполуки формули I можуть бути отримані способом, що включають взаємодію сполук формули (II): 3 де Ar, L, X і R є такими, як визначено вище для сполук формули (I), зі сполукою формули (III): 35 40 де Q є групою, визначеної вище для сполук формули (I), і LG 1 є відхідною групою, наприклад, галогеном, таким як хлор. Реакцію прийнятним чином здійснюють у присутності основи (наприклад, діізопропілетиламіну). Реакцію прийнятним чином здійснюють в апротонному розчиннику або суміші розчинників, наприклад, ДХМ і ДМФ. Сполуки формули (II) можуть бути отримані шляхом взаємодії сполуки формули (IV) 7 UA 104731 C2 1 2 де R і R є такими, як визначено вище для сполук формули (I), зі сполукою формули (V): 5 3 де Ar, L, X і R є такими, як визначено вище для сполук формули (I), і сполукою формули (VI): 10 15 20 25 30 де групи LG2 і LG3, кожна незалежно, являють собою відхідні групи (наприклад, LG2 і LG3, обидві, являють собою імідазоліл або галоген, такий як хлор). Реакцію прийнятним чином здійснюють в апротонному розчиннику (наприклад, дихлорметані), використовуючи відповідні захисні групи для хімічно чутливих груп. Сполука формули (V) може бути отримана відновленням сполуки формули (VII) 3 де Ar, L, X і R є такими, як визначено вище для сполук формули (I), наприклад, шляхом гідрування в присутності каталізатора, такого як платина, нанесена на вуглець. Реакцію прийнятним чином здійснюють у полярному протонному розчиннику або в суміші розчинників (наприклад, метанол і оцтова кислота). b Сполука формули (VII), де L являє собою –(CH2)nО(CH2)m або(CH2)nOR , як визначено вище, де n дорівнює нулю, може бути отримане взаємодією сполуки формули (VІІІa) або (VІІІb) або її аналогів, де алкіленовий ланцюг заміщений, наприклад, одним або більш атомами галогену, і де група Х є такою, як визначено вище для сполук формули (I), зі сполукою формули (IX) або (X) 8 UA 104731 C2 5 10 15 20 25 30 35 40 45 50 де сполуки (IX) і (X) можуть нести необов'язкові замісники, як визначено вище для сполук формули (I). Реакція може бути здійснена в умовах реакції Міцунобу, таких як у присутності трифенілфосфіну й діізопропілазодикарбоксилату. Реакцію прийнятним чином здійснюють у полярному апротонному розчиннику (наприклад, тетрагідрофурані, зокрема, безводному тетрагідрофурані). Сполуки формул (III), (IV), (VI), (VІІІa), (VІІІb), (IX) і (X) є або комерційно доступними, або є відомими, або є новими й можуть бути легко отримані звичайними способами. Див., наприклад, публікацію Regan, J. et al., J. Med. Chem., 2003, 46, 4676-4686, WO00/043384, WO2007/087448 і WO2007/089512. Захисні групи можуть знадобитися для захисту хімічно чутливих груп протягом однієї або більше реакцій, описаних вище, для впевненості в ефективності способу. Таким чином, якщо бажано або необхідно, проміжні сполуки можуть бути захищені шляхом використання стандартних захисних груп. Захисні групи й засоби для їхнього видалення описані в “Protective Groups in Organic Synthesis”, Theodora W. Greene and Peter G.M. Wuts, published by John Wiley & th Sons Inc.; 4 Rev Ed., 2006, ISBN-10: 0471697540. Нові проміжні сполуки заявлені як аспект винаходу. В одному аспекті сполуки придатні в лікуванні, наприклад, ХОЗЛ і/або астми. Сполуки, розроблені до теперішнього часу, призначені для перорального введення. Така стратегія включає оптимізацію сполук, які досягають тривалості дії за допомогою відповідного фармакокінетичного профілю. Даний фармакокінетичний профіль підтверджує, що існує достатня концентрація, установлена й підтримувана після й між дозами для досягнення клінічного ефекту. Неминучим результатом даного підходу є те, що всі тканини організму, особливо печінка й кишка, імовірно, піддаються впливу терапевтично активних концентрацій лікарського засобу, чи здійснюють вони чи ні негативний вплив на захворювання, що піддається лікуванню. Альтернативна стратегія полягає в розробці терапевтичних підходів, у яких лікарський засіб безпосередньо доставляють до запаленого органа (місцева терапія). Хоча даний підхід не годиться для всіх хронічних запальних захворювань, він широко використовується при легеневих захворюваннях (астма, ХОЗЛ), шкірних захворюваннях (атопічний дерматит і псоріаз), назальних захворюваннях (алергійний риніт) і шлунково-кишкових захворюваннях (виразковий коліт). При місцевій терапії ефективність може бути досягнута (i) при гарантії того, що лікарський засіб виявляє пролонговану дію й зберігається в даному органі для зниження ризику системної токсичності, або (ii) шляхом приготування препарату, який утворює “депо” активного лікарського засобу, доступне для підтримки бажаних ефектів лікарського засобу. Прикладом підходу (i) є антихолінергічний лікарський засіб тіотропіум (Spiriva), який вводять місцево до легенів як лікування ХОЗЛ, і який має винятково високу спорідненість до рецептора-мішені, що приводить до вповільнення швидкості і отримуваної у результаті пролонгованої дії. В одному аспекті розкриття описані сполуки є особливо прийнятними для місцевої доставки, такий як місцева доставка до легенів, зокрема, для лікування ХОЗЛ. В одному аспекті сполуки виявляють більш тривалу дію, ніж BIRB 796. В одному варіанті здійснення винаходу сполуки є прийнятними для хворих, чутливих до лікування кортикостероїдом. Описані сполуки також можуть бути придатними для лікування ревматоїдного артриту. Крім того, даний винахід надає фармацевтичну композицію, що містить сполуку відповідно до розкриття суті винаходу в комбінації з одним або більше фармацевтично прийнятними розріджувачами або носіями. Розріджувачі й носії можуть включати такі засоби, які є прийнятними для парентерального, перорального, місцевого, мукозального й ректального введення. Як описано вище, такі сполуки можуть бути отримані, наприклад, для парентерального, 9 UA 104731 C2 5 10 15 20 25 30 35 40 45 50 55 60 підшкірного, внутрішньом'язового, внутрішньовенного, внутрішньосуглобного або навколосуглобового введення, зокрема, у вигляді рідких розчинів або суспензій; для перорального введення, зокрема, у вигляді таблеток або капсул; для місцевого, наприклад, легеневого або інтраназального введення, зокрема, у вигляді порошків, крапель в ніс або аерозолів і трансдермального введення; для мукозального введення, наприклад, до слизуватої рота, під язик або слизуватої піхви, і для ректального введення, наприклад, у вигляді супозиторію. Композиції можуть бути прийнятним чином уведені в стандартній лікарській формі й можуть бути приготовлені кожним зі способів, добре відомих у фармацевтичній галузі, наприклад, як описано в публікації Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA., (1985). Препарати для парентерального введення можуть містити як наповнювачі стерилізовану воду або фізіологічний розчин, алкіленові гліколі, такі як пропіленгліколь, поліалкіленгліколі, такі як поліетиленгліколь, олії рослинного походження, гідрогенізовані нафталени й тому подібне. Препарати для назального введення можуть бути твердими й можуть містити наповнювачі, наприклад, лактозу або декстран, або можуть бути водними або масляними розчинами для використання у вигляді крапель у ніс або дозованого розчину, що розпиляється. Для трансбукального введення типові наповнювачі включають цукру, стеарат кальцію, стеарат магнію, прежелатинізований крохмаль і тому подібне. Композиції, прийнятні для перорального введення, можуть містити один або більше фізіологічно сумісних носіїв і/або наповнювачів і можуть бути у твердому або рідкому вигляді. Таблетки й капсули можуть бути виготовлені з використанням зв’язувальних засобів, наприклад, сиропу, камеді, желатину, сорбіту, трагаканту або полівінілпіролідону; наповнювачів, таких як лактоза, сахароза, кукурудзяний крохмаль, фосфат кальцію, сорбіт або гліцин; змащувальних засобів, таких як стеарат магнію, тальк, поліетиленгліколь або діоксид кремнію; і поверхневоактивних речовин, таких як лаурилсульфат натрію. Рідкі композиції можуть містити звичайні добавки, такі як суспендуючі засоби, наприклад, сорбітовий сироп, метилцелюлоза, цукровий сироп, желатин, карбоксиметилцелюлоза або харчові жири; емульгуючі засоби, такі як лецитин або аравійська камедь; рослинні олії, такі як мигдальна олія, кокосова олія, риб'ячий жир або арахісове масло; консерванти, такі як бутильований гідроксіанізол (ВНА) і бутильований гідрокситолуол (ВНТ). Рідкі композиції можуть бути капсульовані, наприклад, у желатинові капсули для надання стандартної лікарської форми. Тверді пероральні дозовані форми включають таблетки, тверді капсули, що складаються із двох частин, й м'які еластичні желатинові (SEG) капсули. До складу сухої оболонки звичайно входить желатин з концентрацією приблизно від 40% до 60%, пластифікатор з концентрацією приблизно від 20% до 30% (такий як гліцерин, сорбіт або пропіленгліколь) і вода з концентрацією приблизно від 30% до 40%. Інші матеріали, такі як консерванти, барвники, замутнювачі й ароматизатори також можуть бути присутніми. Рідкий наповнювач включає твердий лікарський засіб, який розчинений, солюбілізований або диспергований (із суспендуючими засобами, такими як бджолиний віск, гідрогенізована рицинова олія або поліетиленгліколь 4000) або рідкий лікарський засіб у носіях або в комбінації носіїв, таких як мінеральне масло, рослинні олії, триглицериди, гліколі, багатоатомні спирти й поверхнево-активні речовини. Переважно, коли сполуку формули (I) уводять місцево до легенів. Тому автори винаходу надають згідно з винаходом фармацевтичну композицію, що містить описану сполуку необов'язково в комбінації з одним або більше місцево припустимими розріджувачами або носіями. Місцеве введення до легенів може бути досягнуто при використанні аерозольного препарату. Аерозольні препарати звичайно включають активний інгредієнт, суспендований або розчинений у більш прийнятному аерозольному пропеланті, такому як хлорфторвуглець (CFC) або гідрофторвуглець (HFC). Прийнятні CFC-пропеланти включають трихлормонофторметан (пропелант 11), дихлортетрафторметан (пропелант 114) і дихлордифторметан (пропелант 12). Прийнятні HFC-пропеланти включають тетрафторетан (HFC-134а) і гептафторпропан (HFC227). Пропелант звичайно містить від 40% до 99,5%, наприклад, від 40% до 90% мас. загальної композиції для інгаляції. Препарат може містити наповнювачі, що включають співрозчинники (наприклад, етанол) і поверхнево-активні речовини (наприклад, лецитин, сорбітантриолеат і тому подібне). Аерозольні препарати упаковані в контейнери і прийнятна доза доставляється за допомогою дозуючого клапана (наприклад, як подається обладнанням Bespak, Valois або 3M). Місцеве введення до легенів також може бути досягнуто при використанні препарату, що не перебуває під тиском, такого як водний розчин або суспензія. Такий препарат може бути введений за допомогою небулайзера. Місцеве введення до легенів також може бути досягнуто при використанні препарату у вигляді сухого порошку. Сухий порошкоподібний препарат буде 10 UA 104731 C2 5 10 15 20 25 30 35 40 містити описану сполуку в тонкоподрібненому вигляді, звичайно із середнім діаметром частинок (MMAD) 1-10 мікрон. Препарат звичайно містить припустимий для місцевого введення розріджувач, такий як лактоза, звичайно великого розміру частинки, наприклад, середній діаметр частинки (MMAD) 100 мкм або більше. Приклади систем доставки сухого порошку включають SPINHALER, DISKHALER, TURBOHALER, DISKUS and CLICKHALER. Сполуки згідно з розкриттям суті винаходи призначено проявляти терапевтичну активність. В іншому аспекті даний винахід надає сполуку згідно з розкриттям суті винаходу для використання його як лікарського засобу. Сполуки згідно з розкриттям суті винаходи також можуть бути придатні в лікуванні респіраторних порушень, що включають ХОЗЛ (включаючи хронічний бронхіт і емфізему), астму, астму в дітей, кістозний фіброз, саркоїдоз, ідіопатичний фіброз легенів, алергійний риніт, риніт, синусит, особливо астму, хронічний бронхіт і ХОЗЛ. Сполуки згідно з розкриттям суті винаходу також можуть знову зробити чутливим стан хворого до лікування кортикостероїдом, коли стан хворого не піддається лікуванню кортикостероїдом. Сполуки згідно з розкриттям суті винаходу також передбачається застосовувати для лікування деяких станів, які можна лікувати за допомогою місцевої або локальної терапії, що включають алергійний кон’юнктивіт, кон’юнктивіт, алергійний дерматит, контактний дерматит, псоріаз, виразковий коліт, запалення суглобів, вторинне стосовно ревматоїдного артриту або остеоартриту. Сполуки згідно з розкриттям суті винаходу також передбачається застосовувати для лікування деяких інших станів, що включають ревматоїдний артрит, панкреатит, кахексію, інгібування росту й метастазування пухлин, що включають недрібноклітинну карциному легенів, карциному молочної залози, карциному шлунку, колоректальні карциноми й злоякісну меланому. Таким чином, в іншому аспекті даний винахід надає сполуку, представлене в описі, для застосування в лікуванні вказаних вище станів. В іншому аспекті даний винахід належить до використання сполуки, представленого в описі, для одержання лікарського засобу для лікування вказаних вище станів. В іншому аспекті даний винахід надає спосіб лікування вказаних вище станів, що включає введення пацієнтові ефективної кількості сполуки згідно з розкриттям суті винаходу або його фармацевтичної композиції. Слово “лікування” призначено охопити профілактичне, а також терапевтичне лікування. Сполука згідно з розкриттям суті винаходу також може бути введена в комбінації з одним або більше іншими активними інгредієнтами, наприклад, активними інгредієнтами, прийнятних для лікування вказаних вище станів. Наприклад, можливі комбінації для лікування респіраторних порушень включають комбінації зі стероїдами (наприклад, будесонід, беклометазону дипропіонат, флутиказону пропіонат, мометазону фуроат, флутиказону фуроат), бета-агоністами (наприклад, тербуталін, сальбутамол, салметерол, формотерол) і/або ксантинами (наприклад, теофілін). Скорочення AcОН Крижана оцтова кислота aq Водний Ac Ацетил ATP Аденозин-5'-трифосфат BALF Рідина бронхоальвеолярного лаважа (БАЛ) br Уширений BSA Бичачий сироватковий альбумін CatСart® Каталітичний картридж CDI 1, 1-карбонілдіімідазол COPD Хронічне обструктивне захворювання легенів (ХОЗЛ) d Дуплет ДХМ Дихлорметан (ДХМ) DIAD Діізопропілазадикарбоксилат DIBAL-H Діізобутилалюмінійгідрид DIPEA N, N-Діізопропілетиламін ДМФ N, N-Диметилформамід (ДМФ) DMSO Диметилсульфоксид (ДМСО) EtOAc Етилацетат FCS Фетальна теляча сироватка 11 UA 104731 C2 5 10 15 20 25 30 35 hr Година(и) HRP Пероксидаза хріну JNK c-Jun N-кінцева кіназа MAPK Мітоген-активована протеїнкіназа MeОН Метанол хв Хвилина(и) MTT 3-(4,5-диметилтіазол-2-іл)-2,5-дифенілтетразолію бромід PBS Забуферений фосфатом фізіологічний розчин PРh3 Трифенілфосфін RT Кімнатна температура (кт) RP HPLC Високоефективна рідинна хроматографія з оберненою фазою s Синглет SCX Катіонообмінна хроматографія (КОХ) на твердому сорбенті SDS Додецилсульфат натрію t Триплет TFA Трифтороцтова кислота (ТФО) ТГФ Тетрагідрофуран (ТГФ) TMB 3,3’,5,5’-тетраметилбензидин TNFα Фактор альфа некрозу пухлини Загальні методики Усі вихідні матеріали й розчинники або були отримані з комерційних джерел, або приготовлені згідно з даними літератури. Гідрування здійснювали в проточному реакторі Thales H-cube у встановлених умовах. Органічні розчини сушили, як прийнято, над сульфатом магнію. Колонки КОХ придбали в компанії Supelco, і сорбент обробляли 1М водним розчином HСl до використання. Реакційну суміш, що піддають очищенню, спочатку розбавляли МеОН і підкисляли декількома краплями AcОН. Отриманий розчин прямо наносили на колонку КОХ і промивали МеОН. Потім бажаний матеріал елюювали шляхом промивання розчином 1% NH 3 в MeOH. Колонкову хроматографію здійснювали на попередньо укомплектованих картриджах із силікагелем компанії Silicycle (230-400 меш, 40-63 мкМ), використовуючи вказану кількість. Препаративна високоефективна рідинна хроматографія з оберненою фазою: Колонка C18 Agilent Scalar, 5 мкм (21,2×50 мм), швидкість потоку 28 мл/хв, елюювання градієнтом суміші H2O-MeСN, що містить 0,1% об./об. мурашиної кислоти, протягом 10 хв із використанням УФ-детекції при 215 і 254 нм. Умови градієнта: 0,0–0,5 хв: 95% H2O - 5% MeСN; 0,5-7,0 хв; лінійна зміна від 95% H2O - 5% MeСN до 5% H2O - 95% MeСN; 7,0–7,9 хв: підтримування при 5% H2O - 95% MeСN; 7,9–8,0 хв: повернення до 95% H2O - 5% MeСN; 8,0– 10,0 хв: підтримування при 95% H2O - 5% MeСN. Аналітичні методи Високоефективна рідинна хроматографія з оберненою фазою: Колонка C18 Agilent Scalar, 5 мкм (4,6×50 мм) або колонка Waters Xbridge C18, 5 мкм (4,6×50 мм), швидкість потоку 2,5 мл/хв, елюція градієнтом суміші H 2O-MeСN, що містить 0,1% об./об. мурашиної кислоти, протягом 7 хв із використанням УФ-детекції при 215 і 254 нм. Умови градієнта: 0,0–0,1 хв: 95% H2O - 5% MeСN; 0,1-5,0 хв; лінійна зміна від 95% H2O - 5% MeСN до 5% H2O - 95% MeСN; 5,0–5,5 хв: підтримування при 5% H2O - 95% MeСN; 5,5–5,6 хв: підтримування при 5% H2O - 95% MeСN, швидкість потоку збільшилася до 3,5 мл/хв; 5,6–6,6 хв: підтримування при 5% H2O - 95% MeСN, швидкість потоку 3,5 мл/хв; 6,6–6,75 хв: повернення до 95% H2O - 5% MeСN, швидкість потоку 3,5 мл/хв; 6,75–6,9 хв: підтримування при 95% H2O - 5% MeСN, швидкість потоку 3,5 мл/хв; 6,9–7,0 хв: підтримування при 95% H2O - 5% MeСN, швидкість потоку знизилася до 2,5 мл/хв. 1 H ЯМР спектроскопія: Cпектрометр Bruker Avance III 400 МГц із використанням залишкового недейтерованого розчинника як еталона. Проміжна сполука A: 1-(4-((2-амінопіридин-4-іл)метокси)нафтален-4-іл)метокси)нафтален-1іл)-3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)сечовина 12 UA 104731 C2 2-Аміно-4-((4-нітронафтален-1-ілокси)метил)піридин (2) 5 10 До розчину 4-нітронафтолу (5,17 г, 27,3 ммоль), PРh3 (10,75 г, 41,0 ммоль) і 2-амінопіридин4-метанолу (1) (5,09 г, 41,0 ммоль) у ТГФ (50 мл) додавали по краплях DIAD (8,07 мл, 41,0 ммоль) при -15ºC. Суміш перемішували протягом ночі при кімнатній температурі й леткі компоненти видаляли у вакуумі. Сирий продукт розтирали в EtOAc (150 мл), відфільтровували й промивали EtOAc (100 мл). Друге розтирання в MeOH (100 мл) привело до 2-аміно-4-((4нітронафтален-1-ілокси)метил)піридину (2) (4,54 г, 56%) у вигляді жовтої твердої речовини: m/z + + 296 (M+H) (ES ). 2-Аміно-4-((4-амінонафтален-1-ілокси)метил)піридин (3) 15 20 2-Аміно-4-((4-нітронафтален-1-ілокси)метил)піридин (2) (4,50 г, 15,24 ммоль) в MeOH (200 -1 мл) і AcОН (200 мл) пропускали через реактор Thales H-cube (2,0 мл.хв , 40ºC, 55 мм 10% Pt/C Cat-Cart, тип повної подачі водню) і леткі компоненти видаляли у вакуумі. Сирий продукт піддавали КОХ шляхом захоплення й звільнення матеріалу, використовуючи елюцію 1% розчином NH3 в MeOH, і розчинник видаляли у вакуумі з одержанням 2-аміно-4((4амінонафтален-1-ілокси)метил)піридину (3) (3,82 г, 94%) у вигляді твердої речовини пурпурного 13 UA 104731 C2 + + кольору: m/z 266 (M+H) (ES ). (Проміжна сполука A): 1-(4-((2-Амінопіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1п-толіл-1Н-піразол-5-іл)сечовина 5 10 15 До розчину CDI (4,18 г, 25,8 ммоль) у ДХМ (15 мл) додавали по краплях в атмосфері азоту розчин 3-трет-бутил-1-п-толіл-1Н-піразол-5-аміну (4) (WO 2000043384) (5,91 г, 25,8 ммоль) у ДХМ (15 мл) протягом 40 хв. Розчин, що утворився, перемішували при кімнатній температурі протягом 1 години, потім додавали по краплях в атмосфері азоту до розчину 2-аміно-4-((4амінонафтален-1-ілокси)метил)піридину (3) (3,80 г, 12,9 ммоль). Суміш перемішували протягом ночі й леткі компоненти видаляли у вакуумі. Сирий матеріал очищали колонковою хроматографією (120 г); елюція від 0 до 6% MeOH у ДХМ із одержанням 1-(4-((2-амінопіридин-4іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)сечовини (Проміжна + + сполука A) у вигляді не зовсім білої твердої речовини (4,27 г, 63%): m/z 521 (M+H) (ES ). Приклад 1: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-метоксіацетамід 20 25 30 35 До суміші 1-(4-((2-амінопіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Нпіразол-5-іл)сечовини (Проміжна сполука A) (526 мг, 0,96 ммоль) і DIPEA (184 мкл, 1,06 ммоль) у суміші ДХМ/ДМФ (10:1, 11 мл) додавали метоксіацетилхлорид (92 мкл, 1,01 ммоль). Після перемішування протягом 1 години при кімнатній температурі додаткові кількості DIPEA (184 мкл, 1,06 ммоль) і метоксіацетилхлориду (92 мкл, 1,01 ммоль) додавали послідовно й перемішування продовжували протягом 1 години. Після додавання 1% розчину NH 3 в MeOH (40 мл), суміш перемішували протягом 15 хв і упарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (40 г); елюція від 0 до 6% MeOH у ДХМ привела до одержання N(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)+ 2-метоксіацетаміду (Приклад 1) у вигляді білої твердої речовини (286 мг, 49%): m/z 593 (M+H) + (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,39 (3H, с), 3,32 (3H, с), 4,08 (2H, с), 5,39 (2H, с), 6,36 (1H, с), 7,03 (1H, д), 7,28 (1H, дд), 7,36 (2H, м), 7,44 (2H, м), 7,56-7,64 (3H, м), 7,93 (1H, м), 8,30-8,35 (3H, м), 8,58 (1H, с), 8,79 (1H, с), 10,02 (1H, с). Приклад 2: Метил 4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-ілсечовина 14 UA 104731 C2 5 10 До розчину 1-(4-((2-амінопіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Нпіразол-5-іл)сечовини (Проміжна сполука A) (70 мг, 0,13 ммоль) у безводному піридині (1,5 мл) додавали метилізоціанат (14 мкл, 0,24 ммоль) і суміш залишали перемішувати при кімнатній температурі протягом 72 годин. Піридин видаляли у вакуумі й залишок розтирали в ДХМ (3,0 мл). Фільтрування привело до одержання не зовсім білого порошку, метил 4-((4-(3-(3-третбутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-ілсечовини (Приклад + + 2) (36 мг, 45%): m/z 578 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,39 (3H, с), 2,74 (3H, д), 5,30 (2H, с), 6,36 (1H, с), 6,99 (1H, д), 7,05 (д, 1H), 7,35 (2H, д), 7,44 (2H, д), 7,54-7,64 (4H, м), 7,93 (1H, д), 8,19 (1H, д), 8,23 (1H, ушир. с), 8,35 (1H, д), 8,58 (1H, с), 8,79 (1H, с), 9,36 (1H, с). Приклад 3: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)тетрагідро-2Н-піран-4-карбоксамід 15 20 25 30 ДМФ (2 краплі) додавали до перемішуваного розчину, тетрагідропіран- 2Н-4-карбонової кислоти й оксалілхлориду (21 мкл, 0,25 ммоль) у ДХМ (1,0 мл) і отриманий розчин перемішували при кімнатній температурі протягом 1 години. Розчин упарювали у вакуумі з одержанням безбарвного масла, яке знову розчиняли в ДХМ (1,0 мл) і додавали по краплях до перемішуваної суміші 1-(4-((2-амінопіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-птоліл-1Н-піразол-5-іл)сечовини (Проміжна сполука A) (50 мг, 0,10 ммоль) і DIPEA (84 мкл, 0,50 ммоль) у ДХМ (1,0 мл). Перемішування продовжували протягом 18 годин. Реакційну суміш перемішували в 1% розчині NH3 в MeOH (20 мл) протягом 30 хв, упарювали у вакуумі, попередньо адсорбували на силікагелі й очищали колонковою хроматографією (12 г, 0-5% MeOH у ДХМ, градієнтна елюція) з одержанням N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5іл)уреїдо) нафтален-1-ілокси)метил)піридин-2-іл)тетрагідро-2Н-піран-4-карбоксаміду (Приклад + + 3) у вигляді світло-коричневої твердої речовини (18 мг, 28%): m/z 633 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,26 (9H, с), 1,57-1,72 (4H, м), 2,38 (3H, с), 2,75 (1H, м), 3,283,33 (2H, м), 3,88 (2H, м), 5,35 (2H, с), 6,34 (1H, с), 6,99 (1H, д), 7,24 (1H, дд), 7,35 (2H, м), 7,43 (2H, м), 7,55-7,64 (3H, м), 7,92 (1H, м), 8,27-8,33 (3H, м), 8,58 (1H, с), 8,78 (1H, с), 10,50 (1H, с). Приклад 4: (S)-N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-метоксипропанамід 35 15 UA 104731 C2 5 10 15 1-Хлор-N,N-диметилетенамід (50 мкл, 0,48 ммоль) додавали до перемішуваного розчину (S)-2-метоксипропіонової кислоти (50 мг, 0,48 ммоль) у ДХМ (1,0 мл) і отриманий жовтий розчин перемішували при кімнатній температурі протягом 1 години. Розчин додавали по краплях до переміщуваної суміші 1-(4-((2-амінопіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-птоліл-1Н-піразол-5-іл)сечовини (Проміжна сполука A) (50 мг, 0,10 ммоль) і DIPEA (167 мкл, 0,96 ммоль) у ДХМ (1,0 мл). Перемішування продовжували протягом ночі. Реакційну суміш перемішували в 1% розчині NH3 в MeOH (20 мл), упарювали у вакуумі, попередньо адсорбували на діоксиді кремнію й очищали колонковою хроматографією (12 г, 10-50% EtOAc в ізогексані, градієнтна елюція) з одержанням (S)-N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-метоксипропанаміду (Приклад 4) у вигляді + + безбарвної твердої речовини (18 мг, 30%): m/z 607 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, д), 1,31 (3H, с), 2,38 (3H, с), 3,30 (3H, с), 4,02 (1H, кв.), 5,39 (2H, с), 6,37 (1H, с), 7,00 (1H, д), 7,29 (1H, дд), 7,35 (2H, м), 7,45 (2H, м), 7,56-7,64 (3H, м), 7,93 (1H, м), 8,30-8,37 (3H, м), 8,58 (1H, с), 8,79 (1H, с), 10,06 (1H, с). Приклад 5: (R)-N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-метоксипропанамід 20 25 30 35 1-Хлор-N,N-диметилетенамін (38 мкл, 0,36 ммоль) додавали до перемішуваного розчину (R)- 2-метоксипропіонової кислоти (37 мг, 0,36 ммоль) у ДХМ (1,0 мл), і отриманий розчин перемішували при кімнатній температурі протягом 1 години. Розчин додавали по краплях до переміщуваної суміші 1-(4-((2-амінопіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-птоліл-1Н-піразол-5-іл)сечовини (Проміжна сполука A) (75 мг, 0,14 ммоль) і DIPEA (75 мкл, 0,43 ммоль) у ДХМ (2,0 мл) при 0ºC. Перемішування продовжували протягом додаткових 48 годин. Суміш виливали в 1% розчин NH3 в MeOH (20 мл) і перемішували протягом 1 години й упарювали у вакуумі з одержанням жовтого залишку. Колонковою хроматографією (12 г, 20-50% EtOAc в ізогексані) одержували (R)-N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-метоксипропанамід (Приклад 5) у вигляді + + твердої речовини світло-рожевого кольору (39 мг, 43%): m/z 607 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, д), 1,30 (3H, с), 2,39 (3H, с), 3,31 (3H, с), 4,02 (1H, кв.), 5,39 (2H, с), 6,35 (1H, с), 7,02 (1H, д), 7,29 (1H, дд), 7,35 (2H, м), 7,45 (2H, м), 7,56-7,64 (3H, м), 7,93 (1H, м), 8,30-8,37 (3H, м), 8,58 (1H, с), 8,79 (1H, с), 10,09 (1H, с). Проміжна сполука B: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілокси)метил)піридин-2-іл)-2-хлорацетамід 16 UA 104731 C2 5 10 15 До розчину DIPEA (1,37 мл, 7,68 ммоль) і 1-(4-((2-амінопіриди-4-іл)метокси)нафтален-1-іл)-3(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)сечовини (Проміжна сполука A) (2,00 г, 3,84 ммоль) у ДХМ (40 мл) і ДМФ (8,0 мл) додавали хлорацетилхлорид (0,61 мл, 7,68 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 1 години. РХ-МС виявлено, що вихідний матеріал витратився повністю. Додаткову порцію хлорацетилхлориду (100 мкл, 1,25 ммоль) додавали. Після перемішування протягом 1 години при кімнатній температурі реакційну суміш розподіляли між ДХМ (40 мл) і насиченим водним розчином NaHCO3 (40 мл). Органічну фазу концентрували у вакуумі й очищали колонковою хроматографією (80 г, 0-10% MeOH у ДХМ, градієнтна елюція). Фракції продукту концентрували у вакуумі, і залишок розтирали в діетиловому ефірі (20 мл) і ізогексані (20 мл). Тверду речовину збирали фільтруванням з одержанням N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілокси)метил)піридин-2-іл)-2-хлорацетаміду (Проміжна сполука B) у вигляді твердої речовини + + світло-пурпурного кольору (1,07 г, 42%): m/z 597, 599 (M+H) (ES ). Приклад 6: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-(метилтіо)ацетамід 20 25 30 35 N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин2-іл)-2-хлорацетамід (Проміжна сполука B) (100 мг, 0,17 ммоль) додавали порціями до перемішуваної суміші тіометоксиду натрію (35 мг, 0,50 ммоль) в MeOH (5,0 мл) і отриману суміш перемішували протягом 1 години при кімнатній температурі. Суміш упарювали у вакуумі й розподіляли між насиченим розчином солі (20 мл) і ДХМ (30 мл). Органічний шар концентрували у вакуумі, залишок попередньо адсорбували на діоксиді кремнію й очищали колонковою хроматографією (12 г, 10-100% EtOAc в ізогексані, градієнтна елюція). Фракції продукту упарювали у вакуумі з одержанням N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-(метилтіо)ацетаміду (Приклад 6) у вигляді + + твердої речовини світло-жовтого кольору (28 мг, 26%): m/z 610 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,16 (3H, с), 2,39 (3H, с), 3,53 (2H, с), 5,37 (2H, с), 6,35 (1H, с), 7,01 (1H, д), 7,26 (1H, дд), 7,35 (2H, м), 7,44 (2H, м), 7,55-7,64 (3H, м), 7,92 (1H, м), 8,30-8,35 (3H, м), 8,58 (1H, с), 8,78 (1H, с), 10,60 (1H, с). Приклад 7: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-морфоліноацетамід 17 UA 104731 C2 5 10 15 20 25 30 35 40 45 До розчину N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-хлорацетаміду (проміжна сполука B) (50 мг, 0,08 ммоль) у ДХМ (1,0 мл), ДМФ (0,1 мл) і DIPEA (21,9 мкл, 0,13 ммоль) додавали морфолін (11,0 мкл, 0,13 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 3 годин. РХ-МС виявлено, що 20% вихідного матеріалу перетворилося в продукт. Реакційну суміш нагрівали до 40ºC і перемішували протягом 12 годин. РХ-МС виявлено, що 87% вихідного матеріалу перетворилося в продукт. Додаткову порцію морфоліну (11,0 мкл, 0,13 ммоль) додавали й реакційну суміш перемішували при 40ºC протягом 5 годин. РХ-МС виявлено, що 94% вихідного матеріалу перетворилося в продукт. Сиру реакційну суміш очищали колонковою хроматографією (12 г, 010% MeOH у ДХМ, градієнтна елюція). Фракції продукту концентрували у вакуумі, і залишок розтирали в MeOH (5,0 мл). Тверду речовину збирали фільтруванням з одержанням N-(4-((4-(3(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2морфоліноацетаміду (Приклад 7) у вигляді твердої речовини світло-жовтого кольору (11 мг, + + 20%): m/z 648 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,39 (3H, с), 2,54 (4H, м), 3,20 (2H, с), 3,63 (4H, м), 5,39 (2H, с), 6,35 (1H, с), 7,01 (1H, д), 7,28 (1H, д), 7,35 (2H, д), 7,43 (2H, д), 7,63-7,56 (3H, м), 7,92 (1H, д), 8,37-8,29 (3H, м), 8,58 (1H, с), 8,79 (1H, с), 10,01 (1H, с). Приклад 8: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-(піролідин-1-іл)ацетамід До розчину N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-хлорацетаміду (Проміжна сполука B) (50 мг, 0,08 ммоль) у ДХМ (1,0 мл), ДМФ (0,1 мл) і DIPEA (22 мкл, 0,13 ммоль) додавали піролідин (7,0 мкл, 0,08 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 3 годин. РХ-МС виявлено, що 50% вихідного матеріалу перетворилося в продукт. Реакційну суміш нагрівали до 40ºC і перемішували протягом 12 годин. РХ-МС виявлено, що 95% вихідного матеріалу перетворилося в продукт. Додаткову порцію піролідину (7,0 мкл, 0,08 ммоль) додавали й реакційну суміш продовжували перемішувати при 40ºC протягом 5 годин. Дані РХ-МС указали на повне перетворення вихідного матеріалу в продукт. Сиру реакційну суміш очищали колонковою хроматографією (12 г, 0-10% MeOH у ДХМ, градієнтна елюція) з одержанням N-(4-((4-(3-(3-третбутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-(піролідин-1іл)ацетаміду (Приклад 8) у вигляді твердої речовини світло-жовтогарячого кольору (17 мг, 32%): + + m/z 632 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 1,76 (4H, м), 2,39 (3H, с), 2,62 (4H, м), 5,39 (2H, с), 6,35 (1H, с), 7,01 (1H, д), 7,28 (1H, д), 7,34 (2H, д), 7,44 (2H, д), 7,65-7,55 (3H, м), 7,92 (1H, д), 8,36-8,29 (3H, м), 8,58 (1H, с), 8,79 (1H, с), 9,93 (1H, с). Приклад 9: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-(4-метилпіперазин-1-іл)ацетамід До розчину N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-хлорацетаміду (Проміжна сполука B) (50 мг, 0,08 ммоль) у ДХМ (1,0 18 UA 104731 C2 5 10 15 мл), ДМФ (0,1 мл) і DIPEA (22 мкл, 0,13 ммоль) додавали N-метилпіперазин (9,3 мкл, 0,08 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 3 годин. РХ-МС виявлено, що 20% вихідного матеріалу перетворилося в продукт. Реакційну суміш нагрівали до 40ºC і перемішували протягом 12 годин. РХ-МС виявлено, що 91% вихідного матеріалу перетворився в продукт. Додаткову порцію N-метилпіперазину (9,0 мкл, 0,08 ммоль) додавали й реакційну суміш продовжували перемішувати при 40ºC протягом 5 годин. РХ-МС виявлено, що 98% вихідного матеріалу перетворилося в продукт. Сиру реакційну суміш очищали колонковою хроматографією (12 г, 0-10% MeOH у ДХМ, градієнтна елюція). Фракції продукту концентрували у вакуумі й залишок розтирали в суміші діетилового ефіру, ДХМ і ізогексану (2:1:2, 5,0 мл) з одержанням N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілокси)метил)піридин-2-іл)-2-(4-метилпіперазин-1-іл)ацетаміду (Приклад 9) у вигляді твердої + + речовини світло-жовтогарячого кольору (26 мг, 47%): m/z 661 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,39 (3H, с), 2,69-2,60 (3H, ушир. м), 2,88-2,73 (3H, ушир. м), 3,17-2,95 (4H, ушир. м), 5,39 (2H, с), 6,34 (1H, с), 7,00 (1H, д), 7,29 (1H, д), 7,35 (2H, д), 7,45 (2H, д), 7,66-7,56 (3H, м), 7,98 (1H, д), 8,37-8,28 (3H, м), 8,73 (1H, с), 8,91 (1H, с), 10,12 (1H, с). Приклад 10: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-(4-(2-метоксіетил)піперазин-1-іл)ацетамід 20 25 30 35 40 45 До розчину N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-хлорацетаміду (Проміжна сполука B) (50 мг, 0,08 ммоль) у ДХМ (1,0 мл), ДМФ (0,1 мл) і DIPEA (22 мкл, 0,13 ммоль) додавали N-метоксіетилпіперазин (12,5 мкл, 0,08 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 3 годин. РХ-МС виявлено, що 20% вихідного матеріалу перетворилося в продукт. Реакційну суміш нагрівали до 40ºC і перемішували протягом 12 годин. РХ-МС виявлено, що 78% вихідного матеріалу перетворилося в продукт. Додаткову порцію N-метоксіетилпіперазину (12,5 мкл, 0,08 ммоль) додавали й реакційну суміш продовжували перемішувати при 40ºC протягом 5 годин. РХ-МС виявлено, що 89% вихідного матеріалу перетворилося в продукт. Сиру реакційну суміш очищали колонковою хроматографією (12 г, 0-10% MeOH у ДХМ, градієнтна елюція) з одержанням N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілокси)метил)піридин-2-іл)-2-(4-(2-метоксіетил)піперазин-1-іл)ацетаміду (Приклад 10) у вигляді + + твердої речовини світло-жовтогарячого кольору (45 мг, 73%): m/z 705 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО) δ: 1,27 (9H, с), 2,39 (3H, с), 2,46-2,48 (3H, м, закритий через ДМСО), 2,57-2,50 (4H, м), 3,17 (2H, с), 3,23 (3H, с), 3,42 (2H, т), 5,39 (2H, с), 6,35 (1H, с), 7,01 (1H, д), 7,29 (1H, д), 7,35 (2H, д), 7,43 (2H, д), 7,65-7,55 (3H, м), 7,93 (1H, д), 8,36-8,30 (3H, м), 8,58 (1H, с), 8,79 (1H, с), 9,92 (1H, с). Приклад 11: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-(2-метоксіетиламіно)ацетамід До розчину N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-хлорацетаміду (Проміжна сполука B) (50 мг, 0,08 ммоль) у ДХМ (1,0 мл), ДМФ (0,1 мл) і DIPEA (17 мкл, 0,10 ммоль) додавали 2-метоксіетиламін (7,0 мкл, 0,08 19 UA 104731 C2 5 10 15 20 25 ммоль). Реакційну суміш нагрівали до 40ºC і перемішували протягом 12 годин. Сиру реакційну суміш очищали колонковою хроматографією (12 г, 0-10% MeOH у ДХМ, градієнтна елюція). Фракції продукту концентрували у вакуумі, і залишок розтирали в суміші діетилового ефіру, ДХМ і ізогексану (2:1:2, 5,0 мл) з одержанням N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-(2-метоксіетиламіно)ацетаміду (Приклад 11) + + у вигляді не зовсім білої твердої речовини (6 мг, 11%): m/z 637 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,39 (3H, с), 2,71 (2H, т), 3,24 (3H, с), 3,33 (2H, м (закритий через DHO)), 3,40 (2H, т), 5,38 (2H, с), 6,35 (1H, с), 7,01 (1H, д), 7,27 (1H, д), 7,36 (2H, д), 7,43 (2H, д), 7,64-7,57 (3H, м), 7,92 (1H, м), 8,36-8,30 (3H, м), 8,59 (1H, с), 8,79 (1H, с). Приклад 12: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-(диметиламіно)ацетамід До розчину N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-хлорацетаміду (Проміжна сполука B) (50 мг, 0,08 ммоль) у ДХМ (1,0 мл), ДМФ (0,1 мл) і DIPEA (17 мкл, 0,1 ммоль) додавали диметиламін (2,0 M розчин у ТГФ) (41 мкл, 0,08 ммоль). Реакційну суміш нагрівали до 40ºC і перемішували протягом 12 годин. Сиру реакційну суміш очищали колонковою хроматографією (12 г діоксиду кремнію, 0-10% MeOH у ДХМ, градієнтна елюція). Фракції продукту концентрували у вакуумі й залишок розтирали в суміші діетилового ефіру, ДХМ і ізогексану (2:1:2, 5,0 мл) з одержанням N-(4-((4-(3-(3-третбутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2(диметиламіно)ацетаміду (Приклад 12) у вигляді жовтогарячої твердої речовини (18 мг, 35%): + + m/z 607 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,31 (6H, с), 2,39 (3H, с), 3,14 (2H, с), 5,39 (2H, с), 6,35 (1H, с), 7,01 (1H, д), 7,29 (1H, д), 7,35 (2H, д), 7,44 (2H, д), 7,65-7,55 (3H, м), 7,94 (1H, м), 8,38-8,28 (3H, м), 8,59 (1H, с), 8,79 (1H, с), 9,93 (1H, с). Приклад 13: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-(метиламіно)ацетамід 30 35 40 45 До розчину N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-хлорацетаміду (Проміжна сполука B) (50 мг, 0,08 ммоль) у ДХМ (1,0 мл), ДМФ (0,2 мл) і DIPEA (17 мкл, 0,10 ммоль) додавали метиламін (2,0 M розчин у ТГФ) (41 мкл, 0,08 ммоль). Реакційну суміш нагрівали до 40ºC і перемішували протягом 12 годин. Сиру реакційну суміш очищали колонковою хроматографією (12 г, 0-10% MeOH у ДХМ, градієнтна елюція). Фракції продукту були забруднені домішкою; сирий матеріал знову піддавали очищенню колонковою хроматографією (12 г, 0-10% MeOH у ДХМ, градієнтна елюція) з одержанням N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілокси)метил)піридин-2-іл)-2-(метиламіно)ацетаміду (Приклад 13) у вигляді твердої речовини + + світло-коричневого кольору (6 мг, 12%): m/z 593 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,32 (3H, с), 2,39 (3H, с), 3,28 (2H, с), 5,39 (2H, с), 6,35 (1H, с), 7,01 (1H, д), 7,27 (1H, д), 7,35 (2H, д), 7,44 (2H, д), 7,63-7,55 (3H, м), 7,93 (1H, м), 8,37-8,30 (3H, м), 8,59 (1H, с), 8,80 (1H, с). Приклад 14: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1 20 UA 104731 C2 ілокси)метил)піридин-2-іл)-2-((4-метоксибензил)(метил)аміно)ацетамід 5 10 15 До розчину N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-2-іл)-2-хлорацетаміду (Проміжна сполука B) (50 мг, 0,08 ммоль) у ДХМ (1,0 мл), ДМФ (0,2 мл) і DIPEA (17,5 мкл, 0,1 ммоль) додавали N-(4-метоксибензил)-N-метиламін (15,5 мкл, 0,09 ммоль). Реакційну суміш перемішували при 55ºC протягом 12 годин. Сиру реакційну суміш очищали колонковою хроматографією (12 г, 0-10% MeOH у ДХМ, градієнтна елюція). Фракції продукту концентрували у вакуумі й залишок розтирали в суміші діетилового ефіру, ДХМ і ізогексану (2:1:2, 5,0 мл) з одержанням N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Нпіразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-2-іл)-2-((4метоксибензил)(метил)аміно)ацетаміду (Приклад 14) у вигляді білої твердої речовини (7 мг, + + 11%): m/z 713 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,25 (3H, с), 2,39 (3H, с), 3,22 (2H, с), 3,59 (2H, с), 3,72 (3H, с), 5,38 (2H, с), 6,35 (1H, с), 6,90 (2H, м), 7,01 (1H, м), 7,27 (3H, м), 7,35 (2H, м), 7,43 (2H, м), 7,64-7,55 (3H, м), 7,94 (1H, м), 8,37-8,28 (3H, м), 8,58 (1H, с), 8,79 (1H, с), 9,97 (1H, с). Проміжна сполука C: 1-(4-((3-Амінопіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-птоліл-1Н-піразол-5-іл)сечовина 20 4-((4-Нітронафтален-1-ілокси)метил)піридин-3-амін (6) 25 21 UA 104731 C2 5 10 15 До розчину (3-амінопіридин-4-іл)метанолу (5) (4,00 г, 32,2 ммоль) у безводному TГФ (160 мл) при 0ºС додавали гідрид натрію (1,55 г, 38,7 ммоль, 60% мас.). Після перемішування протягом 20 хв 1-фтор-4-нітронафтален (6,16 г, 32,2 ммоль) додавали, баню з льодом відставляли, і реакційну суміш залишали нагрівати до кімнатної температури й перемішували протягом 12 годин. Реакційну суміш розподіляли між EtOAc (200 мл) і насиченим водним розчином NaНСО 3 (150 мл). Тверду жовту речовину, що залишилася, збирали фільтруванням і промивали послідовно водою (50 мл), MeOH (50 мл) і діетиловим ефіром (100 мл), і вона було 1 ідентифіковано як бажаний продукт за допомогою РХ-МС і H ЯМР. Фільтрат повертали до ділильної лійки; органічну фазу збирали й промивали насиченим розчином солі (100 мл), сушили й концентрували у вакуумі з одержанням жовтогарячого залишку. Розтирання жовтогарячого залишку в MeOH (200 мл) привело до одержання жовтогарячої твердої 1 речовини, яку промивали діетиловим ефіром (200 мл). Дані РХ-МС і H ЯМР жовтогарячої твердої речовини були ідентичні даним, що спостерігалися для нерозчинної твердої речовини, отриманої раніше. Два продукти поєднували з одержанням 4-((4-нітронафтален-1+ + ілокси)метил)піридин-3-аміну (6) (7,80 г, 77%): m/z 296 (M+H) (ES ). Ди-трет-бутил 4-((4-нітронафтален-1-ілокси)метил)піридин-3-ілімінодикарбонат (7) 20 25 30 До суспензії 4-((4-нітронафтален-1-ілокси)метил)піридин-3-аміну (6) (3,00 г, 10,2 ммоль) і DMAP (0,25 г, 2,03 ммоль) в TГФ (30 мл) додавали розчин ди-трет-бутилдикарбонату (2,33 г, 10,7 ммоль) в TГФ (15 мл). Через 2-3 хв розчин був отриманий. Реакційну суміш перемішували при кімнатній температурі протягом 12 годин, після чого додаткова кількість ди-третбутилдикарбонату (2,33 г, 10,7 ммоль) додавали й реакційну суміш перемішували при кімнатній температурі протягом 12 годин. Реакційну суміш розподіляли між EtOAc (100 мл) і насиченим водним розчином NaHCO3 (50 мл). Органічний шар збирали, сушили й концентрували у вакуумі з одержанням жовтогарячого масла. Масло очищали колонковою хроматографією (0-50% EtOAc в ізогексані, градієнтна елюція) з одержанням ди-трет-бутил 4-((4-нітронафтален-1ілокси)метил)піридин-3-ілімінодикарбонату (7) у вигляді жовтогарячого масла, яке + + кристалізувалося при стоянні (2,33 г, 43%): m/z 496 (M+H) (ES ). Ди-трет-бутил 4-((4-амінонафтален-1-ілокси)метил)піридин-3-ілімінодикарбонат (8) 35 40 Розчин ди-трет-бутил 4-((4-нітронафтален-1-ілокси)метил)піридин-3-ілімінодикарбонату (7) (2,30 г, 4,64 ммоль) в MeOH (100 мл) і AcОН (20 мл) пропускали через реактор Thales H-cube -1 (1,0 мл.хв , 25ºC, 55 мм 10% Pt/C Cat-Cart, тип повної подачі водню), і леткі компоненти видаляли у вакуумі з одержанням ди-трет-бутил 4-((4-амінонафтален-1-ілокси)метил)піридин-3+ + ілімінодикарбонату (8) у вигляді коричневого масла (2,12 г, 82%): m/z 466 (M+H) (ES ). Ди-трет-бутил 4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-3-ілімінодикарбонат (9) 22 UA 104731 C2 5 10 15 20 25 30 Розчин 3-трет-бутил-1-п-толіл-1Н-піразол-5-аміну (4) (WO 2000043384) (1,55 г, 6,77 ммоль) у ДХМ (4,0 мл) додавали по краплях протягом 25 хв до суспензії CDI (1,10 г, 6,77 ммоль) у ДХМ (4,0 мл) при кімнатній температурі. Реакційну суміш перемішували протягом 80 хв при кімнатній температурі й розчин ди-трет-бутил 4-((4-aмінoнафтален-1-ілокси)метил)піридин-3ілімінодикарбонату (8) (2,10 г, 4,51 ммоль) у ДХМ (10 мл) додавали до реакційної суміші однією порцією й перемішували протягом 12 годин. Реакційну суміш розподіляли між насиченим водним розчином NaHCO3 (20 мл) і ДХМ (20 мл). Органічний шар збирали, сушили й концентрували у вакуумі з одержанням залишку пурпурного кольору. Сирий матеріал очищали колонковою хроматографією (80 г, 0-100% EtOAc в ізогексані, градієнтна елюція,) з одержанням ди-трет-бутил 4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілокси)метил)піридин-3-ілімінодикарбонату (9) у вигляді твердої речовини пурпурного кольору + + (1,77 г, 53%): m/z 721 (M+H) (ES ). Проміжна сполука C: 1-(4-((3-aмінoпіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-птоліл-1Н-піразол-5-іл)сечовина TФО (2,0 мл) додавали до розчину ди-трет-бутил 4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-3-ілімінодикарбонату (9) (1,70 г, 2,36 ммоль) у ДХМ (10 мл). Після перемішування протягом 1 години при кімнатній температурі, додаткова кількість ТФО (2,0 мл) додавали й реакційну суміш перемішували протягом 12 годин при кімнатній температурі. Розчинники видаляли у вакуумі й продукт очищали КОХ шляхом захоплення й звільнення з наступним розтиранням у ДХМ (20 мл) з одержанням 1-(4-((3aмфінoпіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)сечовини (Проміжна сполука C) у вигляді твердої речовини блідо-коричневого кольору (0,96 г, 77%): m/z + + 521 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6)δ: 1,27 (9H, с), 2,39 (3H, с), 5,16 (2H, с), 5,38 (2H, с), 6,35 (1H, с), 7,05 (1H, д), 7,32 (1H, д), 7,35 (2H, д), 7,43 (2H, м), 7,64-7,51 (2H, м), 7,63 (1H, д), 7,82 (1H, д), 7,91 (1H, м), 8,03 (1H, с), 8,29 (1H, м), 8,57 (1H, с), 8,78 (1H, с). Приклад 15: 1-(4-((3-Метилуреїопіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-птоліл-1Н-піразол-5-іл)сечовина 23 UA 104731 C2 5 10 15 Метилізоціанат (8,5 мкл, 0,14 ммоль) додавали до розчину 1-(4-((3-aмінoпіридин-4іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)сечовини (Проміжна сполука C) (50 мг, 0,10 ммоль) у піридині (1,0 мл). Реакційну суміш перемішували протягом 2 годин при кімнатній температурі, і іншу порцію метилізоціанату (8,5 мкл, 0,14 ммоль) додавали, і перемішування продовжували протягом 72 годин при кімнатній температурі. Розчинник видаляли у вакуумі й сирий продукт очищали колонковою хроматографією (4 г, 10-25% MeOH у ДХМ, градієнтна елюція). Фракції сирого продукту поєднували й розтирали в ДХМ (20 мл). Тверду речовину відфільтровували з одержанням 1-(4-((3-метилуреїдопіридин-4іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)сечовини (Приклад 15) (8 + + мг, 14%): m/z 578 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,39 (3H, с), 2,68 (3H, д), 5,27 (2H, с), 6,35 (1H, с), 6,53 (1H, м), 6,98 (1H, д), 7,35 (2H, д), 7,45 (2H, д), 7,65-7,52 (4H, м), 7,92 (1H, д), 8,16 (1H, с), 8,28 (2H, м), 8,61 (1H, с), 8,82 (1H, с), 8,88 (1H, с). Приклад 16: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-3-іл)-2-метоксіацетамід 20 25 30 35 40 До розчину 1-(4-((3-aмінoпіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Нпіразол-5-іл)сечовини (Проміжна сполука C) (50 мг, 0,10 ммоль) і DIPEA (33,5 мкл, 0,19 ммоль) у безводному ДХМ (1,0 мл) і безводному ДМФ (0,1 мл) додавали метоксіацетилхлорид (10 мкл, 0,11 ммоль). Реакційну суміш перемішували протягом 12 годин при кімнатній температурі. РХМС виявлене, що 50% вихідного матеріалу перетворилося в бажаний продукт. Метоксіацетилхлорид (10 мкл, 0,11 ммоль) додавали й реакційну суміш перемішували при кімнатній температурі протягом додаткових 5 годин; дані РХ-МС показали, що реакція наближається до завершення. Іншу порцію метоксіацетилхлориду (8 мкл, 0,09 ммоль) додавали, і через 2 години дані РХ-МС показали, що реакція досягала завершення. Розчин 1% NH3 в MeOH (10 мл) додавали й реакційну суміш перемішували протягом 20 хв при кімнатній температурі. Розчинники видаляли у вакуумі з одержанням твердої маслянистої речовини пурпурного кольору. Речовину розчиняли в MeOH (2,0 мл), і 3 краплі AcОН додавали. Розчин піддавали КОХ шляхом захоплення й звільнення продукту, елююючи розчином 1% NH 3 в MeOH. Розчинник видаляли у вакуумі, і залишок розтирали в діетиловому ефірі (10 мл) з одержанням N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілокси)метил)піридин-3іл)-2-метоксіацетаміду (Приклад 16) у вигляді твердої речовини світло-пурпурового кольору (24 + + мг, 41%) m/z 593 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,39 (3H, с), 3,31 (3H, з (закритий піком DHO)), 4,06 (2H, с), 5,34 (2H, с), 6,35 (1H, с), 6,96 (1H, д), 7,35 (2H, д), 7,43 (2H, д), 7,64-7,54 (4H, м), 7,93 (1H, д), 8,29 (1H, дд), 8,45 (1H, д), 8,58 (1H, с), 8,70 (1H, с), 8,79 (1H, с), 9,76 (1H, с). Приклад 17: N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілокси)метил)піридин-3-іл)-2-(2-метоксіетоксі)ацетамід 24 UA 104731 C2 5 10 15 20 До розчину 1-(4-((3-aмінoпіридин-4-іл)метокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Нпіразол-5-іл)сечовини (Проміжна сполука C) (50 мг, 0,10 ммоль) і DIPEA (33,5 мкл, 0,19 ммоль) у безводному ДХМ (1,0 мл) і безводному ДМФ (0,2 мл) додавали 2-(2-метоксіетоксі)ацетилхлорид (15 мкл, 0,11 ммоль). Реакційну суміш перемішували протягом 12 годин при кімнатній температурі. РХ-МС виявлено, що 50% вихідного матеріалу перетворилося в бажаний продукт. 2-(2-метоксіетоксі)ацетилхлорид (15 мкл, 0,11 ммоль) додавали й реакційну суміш перемішували при кімнатній температурі. Через 6 годин дані РХ-МС показали, що реакція йшла до завершення. MeOH (2,0 мл) і AcОН (5 крапля) додавали й реакційну суміш піддавали КОХ шляхом захоплення й звільнення продукту, елююючи розчином 1% NH 3 в MeOH. Розчинник видаляли у вакуумі й сирий матеріал очищали колонковою хроматографією (4 г, 0-10% MeOH в EtOAc, градієнтна елюція) з одержанням N-(4-((4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5іл)уреїдо)нафтален-1-ілокси)метил)піридин-3-іл)-2-(2-метоксіетоксі)ацетаміду (Приклад 17) у + + вигляді білої твердої речовини (27 мг, 43%): m/z 637 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,27 (9H, с), 2,39 (3H, с), 3,18 (3H, с), 3,36 (2H, м), 3,61 (2H, м), 4,14 (2H, с), 5,33 (2H, с), 6,35 (1H, с), 6,97 (1H, д), 7,35 (2H, д), 7,43 (2H, д), 7,67-7,55 (4H, м), 7,92 (1H, д), 8,27 (1H, д), 8,46 (1H, д), 8,58 (1H, с), 8,74 (1H, с), 8,80 (1H, с), 9,65 (1H, с). Проміжна сполука D: 1-(4-(2-((2-Aмінoпіридин-4-іл)етокси)нафтален-1-іл)-3-(3-трет-бутил-1-птоліл-1Н-піразол-5-іл)сечовина трет-бутил 4-(2-гідроксіетил)піридин-2-ілкарбамат (11) 25 25 UA 104731 C2 5 10 До розчину 2-(2-(трет-бутоксикарбонілaмінo)піридин-4-іл)ацетату (10) (WO 2007089512) (10,0 г, 35,7 ммоль) в атмосфері азоту в ТГФ (100 мл), при -78ºC, додавали DIBAL (1M розчин у ТГФ, 71,3 мл, 71,3 ммоль) протягом 1 години. Реакційну суміш перемішували при температурі від -78 до -60ºC протягом 40 хв і потім нагрівали до -15ºC протягом 1 години. Розчин знову прохолоджували до -78ºC і обробляли додатковою кількістю DIBAL (1M розчин у ТГФ, 35 мл, 35,7 ммоль). Суміш залишали нагрівати до -40ºC і перемішували протягом 1 години. Воду (10 мл) обережно додавали, щоб погасити реакцію, з наступним додаванням MgSO 4 (20 г), і тверді частинки видаляли фільтрацією. Фільтрат концентрували досуха при зниженому тиску й залишок піддавали колонковій хроматографії (330 г), елююючи 65% EtOAc у гексанах з одержанням трет-бутил 4-(2-гідроксіетил)піридин-2-ілкарбамату (11) (6,00 г, 64%) у вигляді + + твердої речовини жовтого кольору: m/z 239 (M+H) (ES ). трет-бутил 4-(2-(4-нітронафтален-1-ілоксі)етил)піридин-2-ілкарбамат (12) 15 20 25 До розчину трет-бутил 4-(2-гідроксіетил)піридин-2-ілкарбамату (11) (6,00 г, 25,2 ммоль) у ТГФ (70 мл) додавали гідрид натрію (2,52 г, 63,0 ммоль, 60% мас.) при 0ºC. Суспензію яскравожовтого кольору перемішували протягом 20 хв при 0ºc до додавання 1-фтор-4-нітронафталену (4,81 г, 25,2 ммоль) в одну порцію. Після перемішування при кімнатній температурі протягом 2 годин, воду (100 мл) додавали з наступним додаванням EtOAc (100 мл). Тверду речовину, утворену між шарами, збирали фільтрацією, і органічну фазу промивали насиченим водним розчином NaHCO3 (100 мл), насиченим розчином солі (100 мл) і сушили. Леткі компоненти видаляли з одержанням твердої речовини жовтогарячого кольору. Тверді частинки поєднували й розтирали в MeOH (50 мл) з одержанням трет-бутил 4-(2-((4-нітронафтален-1ілоксі)етил)піридин-2-ілкарбамату (12) у вигляді твердої речовини жовтого кольору (11,0 г, 98%): + + m/z 410 (M+H) (ES ). трет-бутил 4-(2-(4-aмінoнафтален-1-ілоксі)етил)піридин-2-ілкарбамат (13) 30 35 трет-бутил 4-(2-((4-нітронафтален-1-ілоксі)етил)піридин-2-ілкарбамат (11) (5,20 г, 12,7 ммоль) і залізну сітку (4,30 г, 76 ммоль) суспендували в суміші AcОН і EtОН (1:2, 120 мл). Суспензію поміщали в попередньо нагріту масляну баню при 60°C і швидко перемішували до завершення реакції, як оцінювали за допомогою РХ-МС. Суміш прохолоджували до кімнатної 26 UA 104731 C2 5 температури, обережно виливали в насичений водний розчин (1000 мл) і екстрагували EtOAc (500 мл × 2). Об'єднані органічні шари промивали також насиченим водним розчином NaHCO3 (1000 мл), водою (1000 мл), насиченим розчином солі (1000 мл) і сушили. Розчин фільтрували й упарювали з одержанням трет-бутил 4-(2-((4-aмінoнафтален-1-ілоксі)етил)піридин-2+ + ілкарбамату (13) у вигляді жовтого масла (5,00 г, 95%): m/z 380 (M+H) (ES ). трет-бутил-4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілоксі)етил)піридин-2-ілкарбамат (14) 10 15 20 25 30 До суспензії CDI (3,00 г, 18,18 ммоль) у ДХМ (15 мл) додавали розчин 3-трет-бутил-1-птоліл-1-піразол-5-аміну (4) (WO 2000043384) (4,17 г, 18,18 ммоль) у ДХМ (40 мл) протягом 1,5 годин. Після перемішування при кімнатній температурі протягом 2 годин розчин трет-бутил 4-(2((4-aмінoнафтален-1-ілоксі)етил) піридин-2-ілкарбамату (13) (3,00 г, 7,91 ммоль) у ДХМ (15 мл) додавали. Після перемішування протягом ночі розчин розбавляли MeOH (10 мл) і піддавали абсорбції на силікагелі (30 г) і колонковій хроматографії (330 г), елююючи розчином від 30% до 100% EtOAc в ізогексані й потім від 0% до 6% MeOH в EtOAc з одержанням трет-бутил-4-(2-(4(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)піридин-2-ілкарбамату + + (13) у вигляді твердої речовини бежевого кольору (4,20 г, 80%): m/z 635 (M+H) (ES ). Проміжна сполука D: 1-(4-(2-(2-Aмінoпіридин-4-іл)етокси)нафтален-1-іл)-3-(3-трет-бутил-1-птоліл-1Н-піразол-5-іл)сечовина До суспензії третбутил-4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо)нафтален-1ілоксі)етил)піридин-2-ілкарбамату (14) (1,35 г, 2,20 ммоль) у ДХМ (10 мл) додавали ТФО (10 мл). Після перемішування при кімнатній температурі протягом 2 годин леткі компоненти упарювали, і залишок брали в EtOAc (50 мл) і екстрагували насиченим водним розчином NaHCO3 (50 мл). Шари розділяли; органічний шар промивали насиченим розчином солі (50 мл), сушили й упарювали з одержанням 1-(4-(2-(2-амінопіридин-4-іл)етокси)нафтален-1-іл)-3-(3-трет-бутил-1п-толіл-1Н-піразол-5-іл)сечовини (Проміжна сполука D) у вигляді твердої речовини блідо+ + рожевого кольору (1,20 г, 100%): m/z 535 (M+H) (ES ). Приклад 18: N-(4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілоксі)етил)піридин-2-іл)-2-метоксіацетамід 35 27 UA 104731 C2 5 10 15 До суспензії 1-(4-(2-(2-амінопіридин-4-іл)етокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл-1Нпіразол-5-іл)сечовини (Проміжна сполука D) (35 мг, 0,065 ммоль) у ДХМ (0,5 мл) додавали DIPEA (23 мкл, 0,131 ммоль) і метоксіацетилхлорид (7 мкл, 0,072 ммоль). Суміш перемішували при кімнатній температурі доти, доки реакція не завершувалася, як оцінювали за допомогою РХМС; розбавляли насиченим водним розчином NaHCO3 (1,5 мл) і шари розділяли за допомогою елемента поділу фаз. Органічні шари збирали, упарювали при зниженому тиску й залишок піддавали КОХ шляхом захоплення й звільнення матеріалу. Отриманий після КОХ залишок далі очищали препаративною ОФ-ВЕРХ із одержанням N-(4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Нпіразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)піридин-2-іл)-2-метоксіацетаміду (Приклад 18) у + + вигляді білої твердої речовини (5 мг, 13%): m/z 607 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,26 (9H, с), 2,37 (3H, с), 3,20 (2H, т), 3,37 (3H, с), 4,06 (2H, с), 4,38 (2H, т), 6,33 (1H, с), 6,95 (1H, д), 7,19 (1H, дд), 7,33 (2H, м), 7,42-7,47 (3H, м), 7,54 (1H, м), 7,59 (1H, д), 7,87 (1H, д), 8,12 (1H, д), 8,18 (1H, ушир. с), 8,23 (1H, д), 8,67 (1H, с), 8,84 (1H, с), 9,89 (1H, с). Приклад 19: N-(4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілоксі)етил)піридин-2-іл)-2-( 2-метоксіетоксі)ацетамід 20 25 30 35 До суспензії 1-(4-(2-(2-амінопіридин-4-іл)етокси)нафтален-1-іл)-3-(3-трет-бутил-1-п-толіл1Н-піразол-5-іл)сечовини (Проміжна сполука D) (35 мг, 0,065 ммоль) у ДХМ (0,5 мл) додавали DIPEA (23 мкл, 0,131 ммоль) і 2-(2-метоксі)етоксіацетилхлорид (11 мг, 0,072 ммоль). Суміш перемішували при кімнатній температурі доти, доки реакція не завершувалася, як оцінювали РХ-МС; розбавляли насиченим водним розчином NaHCO3 (1,5 мл) і шари розділяли за допомогою елемента поділу фаз. Органічні шари збирали, упарювали при зниженому тиску й залишок піддавали КОХ шляхом захоплення й звільнення матеріалу. Отриманий після КОХ залишок, далі очищали препаративною ОФ-ВЕРХ із одержанням N-(4-(2-(4-(3-(3-трет-бутил-1-птоліл-1Н-піразол-5-іл)уреїдо)нафтален-1-ілоксі)етил)піридин-2-іл)-2-(2-метоксіетоксі)ацетаміду + + (Приклад 19) у вигляді не зовсім білої твердої речовини (13 мг, 31%): m/z 651 (M+H) (ES ). 1 H ЯМР (400 МГц, ДМСО-d6) δ: 1,26 (9H, с), 2,38 (3H, с), 3,21 (2H, т), 3,28 (3H, с), 3,49-3,51 (2H, м), 3,66-3,68 (2H, м), 4,13 (2H, с), 4,38 (2H, т), 6,34 (1H, с), 6,95 (1H, д), 7,19 (1H, дд), 7,34 (2H, м), 7,41-7,48 (3H, м), 7,51-7,56 (1H, м), 7,59 (1H, д), 7,87 (1H, д), 8,11-8,14 (1H, дд), 8,20 (1H, ушир. с), 8,23-8,25 (1H, дд), 8,55 (1H, с), 8,75 (1H, с), 9,83 (1H, с). Приклад 20: 4-(2-(4-(3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо) нафтален-1ілоксі)етил)-1-метил-3-(піридин-2-іл)сечовина 28
ДивитисяДодаткова інформація
Назва патенту англійськоюP38 map kinase inhibitors
Автори російськоюIto, Kazuhiro, Strong, Peter, Rapeport, William, Garth, Murray, Peter, John, King-Underwood, John, Williams, Jonathan, Gareth, Onions, Stuart, Thomas, Hirst, Simon, Christopher, Taddei, David, Michel, Adrien, Charron, Catherine, Elizabeth
МПК / Мітки
МПК: A61K 31/415, C07D 401/12, C07D 403/12, A61P 11/00, A61P 29/00
Мітки: мар-кіназ, інгібітори
Код посилання
<a href="https://ua.patents.su/50-104731-ingibitori-r38-mar-kinaz.html" target="_blank" rel="follow" title="База патентів України">Інгібітори р38 мар-кіназ</a>
Попередній патент: Похідні ізохінолінону як антагоністи nk3
Наступний патент: Наклейка, зокрема, для тари багаторазового використання
Випадковий патент: Пристрій для визначення дискримінаційної чутливості кінцівки людини