Транспортувальні сполуки – похідні купредоксину і способи їх застосування
Номер патенту: 97466
Опубліковано: 27.02.2012
Автори: Дас Гупта Тапас, Чакрабарті Ананда, Фіало Арсеніо, Ямада Тохру
Формула / Реферат
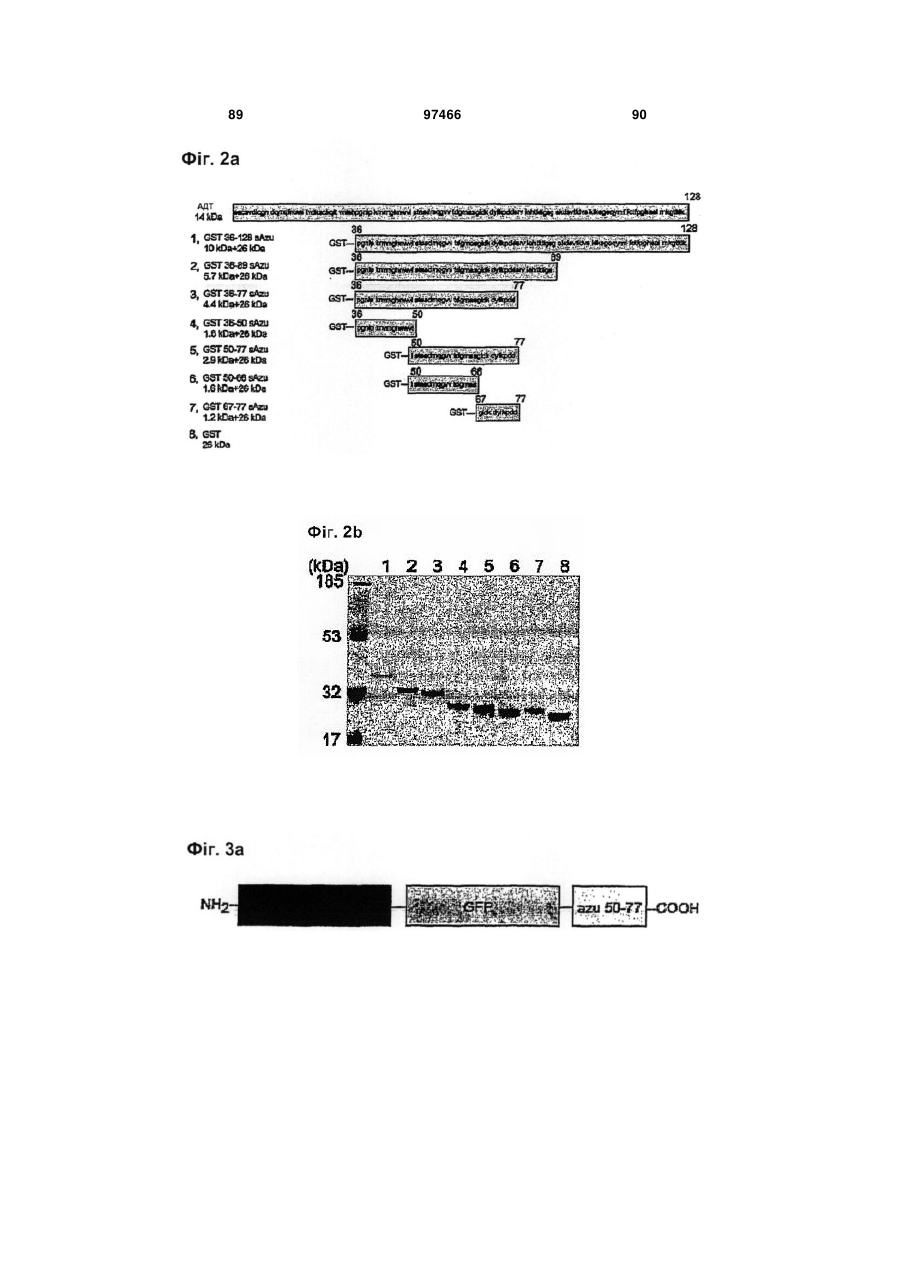
1. Пептид, що складається з послідовності, яка являє собою фрагмент купредоксину дикого типу, вибраного з групи, що включає SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 36 і SEQ ID NO: 43, який прискорює проникнення зв'язаної молекули в ракові клітини ссавців.
2. Пептид за п. 1, що має довжину від щонайменше приблизно 10 залишків до не більше ніж приблизно 50 залишків.
3. Пептид за п. 1, що містить послідовність, яка має амінокислотну послідовність щонайменше на 90% ідентичну послідовності, вибраної із групи, яка включає SEQ ІD NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46 і SEQ ID NO: 47.
4. Пептид за п. 3, що містить послідовність, вибрану із групи, яка включає SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46 і SEQ ID NO: 47.
5. Пептид за п. 3, що складається з послідовності, вибраної із групи, яка включає SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46 і SEQ ID NO: 47.
6. Пептид, що містить амінокислотну послідовність, вибрану із групи, що включає
DGXXXXXDXXYXKXXD та DGXXXXDXXYXKXXD;
у якій D – аспарагінова кислота, G – гліцин, Y – тирозин, K – лізин і X – будь-яка амінокислота, який прискорює проникнення зв'язаної молекули в ракові клітини ссавців.
7. Комплекс, що містить сполуку, що транспортується, і пептид за п. 1, де пептид зв'язаний із сполукою, що транспортується, і де пептид прискорює проникнення сполуки, що транспортується, у ракові клітини ссавців.
8. Комплекс за п. 7, в якому сполуку, що транспортується, вибирають із групи, яка включає білки, ліпопротеїди, поліпептиди, пептиди, полісахариди, нуклеїнові кислоти, барвники, мікрочастинки, наночастинки, токсини і лікарські препарати.
9. Комплекс за п. 8, в якому сполуку, що транспортується, вибирають із групи, що включає білок і поліпептид, і в якому пептид зв'язаний із транспортованою сполукою і утворює гібридний білок.
10. Комплекс за п. 7 , в якому сполука, що транспортується, є токсином.
11. Комплекс за п. 10, в якому токсином є екзотоксин А Pseudomonas aeruginosa або його фрагмент.
12. Комплекс за п. 7, в якому сполука, що транспортується, є речовиною для детектування.
13. Комплекс за п. 12, в якому речовину для детектування визначають за допомогою методу, вибраного з групи, що включає флуорометрію, мікроскопію, рентгенівську комп'ютерну томографію, магнітно-резонансну інтроскопію і ультразвук.
14. Фармацевтична композиція, що включає комплекс за п. 7 з фармацевтично прийнятним носієм.
15. Спосіб доставки сполуки, що транспортується, в клітину, що включає контактування клітини або клітин з комплексом за п. 7.
16. Спосіб за п. 15, в якому клітину або клітини беруть у пацієнта хворого на рак і який додатково включає введення клітини або клітин назад в організм пацієнта.
17. Спосіб за п. 15, в якому клітина є раковою клітиною.
18. Спосіб за п. 17, в якому клітина є раковою клітиною, вибраною із групи, що включає клітини остеосаркоми, ракові клітини легенів, ракові клітини товстого кишечнику, лімфоїдні клітини, лейкозні клітини, пухлинні клітини м'яких тканин, ракові клітини молочної залози, ракові клітини печінки, ракові клітини сечового міхура, клітини меланоми, пухлинні клітини мозку і ракові клітини простати.
19. Спосіб лікування пацієнта, хворого на рак, в якому пацієнтові вводять комплекс за п. 7 в терапевтично ефективній кількості.
20. Спосіб за п. 19, у якому комплекс вводять за допомогою способу, вибраного із групи, що включає внутрішньовенне, місцеве, підшкірне, внутрішньом′язове введення або введення в пухлину.
21. Спосіб за п. 19, у якому комплекс вводять у поєднанні з іншими засобами для лікування раку.
22. Спосіб візуалізації раку в організмі пацієнта, у якому комплекс за п. 12 вводять пацієнтові і детектують місце розташування транспортованої сполуки.
23. Спосіб за п. 22, у якому транспортована сполука є рентгеноконтрастною речовиною, місце розташування якої визначають за допомогою методу рентгенівської комп'ютерної томографії.
24. Спосіб за п. 22, у якому транспортована сполука є магніторезонансно контрастною речовиною, і місце розташування транспортованої сполуки визначають за допомогою методу магнітно-резонансної інтроскопії.
25. Спосіб за п. 22, у якому транспортована сполука є ультразвуковою контрастною речовиною, і місце розташування транспортованої сполуки визначають за допомогою ультразвукової візуалізації.
26. Спосіб діагностування раку, у якому клітину вводять у контакт з комплексом за п. 12 і визначають знаходження транспортованої сполуки.
27. Набір, що містить реагент, який включає комплекс за п. 7.
28. Набір за п. 27, який також містить реагент, що включає фармацевтично прийнятний активатор або наповнювач.
29. Набір за п. 27, який також включає пристрій для введення реагенту.
30. Пептид за п. 1, в якому структура пептиду модифікована з метою подовження або оптимізації періоду напіврозкладання пептиду в кровотоці.
31. Молекула нуклеїнової кислоти, що кодує пептид за одним пп. 1-6 або комплекс за п. 9.
Текст
1. Пептид, що складається з послідовності, яка являє собою фрагмент купредоксину дикого типу, вибраного з групи, що включає SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 36 і SEQ ID NO: 43, який прискорює проникнення зв'язаної молекули в ракові клітини ссавців. 2. Пептид за п. 1, що має довжину від щонайменше приблизно 10 залишків до не більше ніж приблизно 50 залишків. 3. Пептид за п. 1, що містить послідовність, яка має амінокислотну послідовність щонайменше на 90% ідентичну послідовності, вибраної із групи, яка включає SEQ ІD NO: 5, SEQ ID NO: 6, SEQ ID 2 (19) 1 3 97466 4 пію, рентгенівську комп'ютерну томографію, магнітно-резонансну інтроскопію і ультразвук. 14. Фармацевтична композиція, що включає комплекс за п. 7 з фармацевтично прийнятним носієм. 15. Спосіб доставки сполуки, що транспортується, в клітину, що включає контактування клітини або клітин з комплексом за п. 7. 16. Спосіб за п. 15, в якому клітину або клітини беруть у пацієнта хворого на рак і який додатково включає введення клітини або клітин назад в організм пацієнта. 17. Спосіб за п. 15, в якому клітина є раковою клітиною. 18. Спосіб за п. 17, в якому клітина є раковою клітиною, вибраною із групи, що включає клітини остеосаркоми, ракові клітини легенів, ракові клітини товстого кишечнику, лімфоїдні клітини, лейкозні клітини, пухлинні клітини м'яких тканин, ракові клітини молочної залози, ракові клітини печінки, ракові клітини сечового міхура, клітини меланоми, пухлинні клітини мозку і ракові клітини простати. 19. Спосіб лікування пацієнта, хворого на рак, в якому пацієнтові вводять комплекс за п. 7 в терапевтично ефективній кількості. 20. Спосіб за п. 19, у якому комплекс вводять за допомогою способу, вибраного із групи, що включає внутрішньовенне, місцеве, підшкірне, внутрішньом′язове введення або введення в пухлину. 21. Спосіб за п. 19, у якому комплекс вводять у поєднанні з іншими засобами для лікування раку. 22. Спосіб візуалізації раку в організмі пацієнта, у якому комплекс за п. 12 вводять пацієнтові і детек тують місце розташування транспортованої сполуки. 23. Спосіб за п. 22, у якому транспортована сполука є рентгеноконтрастною речовиною, місце розташування якої визначають за допомогою методу рентгенівської комп'ютерної томографії. 24. Спосіб за п. 22, у якому транспортована сполука є магніторезонансно контрастною речовиною, і місце розташування транспортованої сполуки визначають за допомогою методу магнітнорезонансної інтроскопії. 25. Спосіб за п. 22, у якому транспортована сполука є ультразвуковою контрастною речовиною, і місце розташування транспортованої сполуки визначають за допомогою ультразвукової візуалізації. 26. Спосіб діагностування раку, у якому клітину вводять у контакт з комплексом за п. 12 і визначають знаходження транспортованої сполуки. 27. Набір, що містить реагент, який включає комплекс за п. 7. 28. Набір за п. 27, який також містить реагент, що включає фармацевтично прийнятний активатор або наповнювач. 29. Набір за п. 27, який також включає пристрій для введення реагенту. 30. Пептид за п. 1, в якому структура пептиду модифікована з метою подовження або оптимізації періоду напіврозкладання пептиду в кровотоці. 31. Молекула нуклеїнової кислоти, що кодує пептид за одним пп. 1-6 або комплекс за п. 9. За даною заявкою заявляється пріоритет на підставі тимчасової заявки на патент США № 60/616,782, поданої 7 жовтня 2004, тимчасової заявки на патент США № 60/680,500, поданої 13 травня 2005 і тимчасової заявки на патент США № 60/700,297, поданої 19 липня 2005. Повний зміст зазначених тимчасових заявок повністю включений в цей документ посиланням. При розробці предмета даної заявки Національним інститутом проблем здоров'я, м. Бетезда, шт. Меріленд, США, була надана фінансова підтримка у вигляді дослідницького гранта (номер гранта ES 04050-18). Уряд може мати певні права на даний винахід. Надходження білка до клітини ссавця нерідко обумовлено невеликим сегментом білка, що звичайно називають «доменом білка-переносника» (ДБП). Зазначений сегмент може бути використаний як сигнал, прикріплений до чужорідного білка з метою прискорення транспорту такого білка до клітини ссавця. Наприклад, амфіпатичні пептиди використовують для прискорення поглинання металопорфіринів, що розщеплюють ДНК, як потенційні протипухлинні лікарські препарати у HS68 фібробластах людини або в мишачих клітинах L1210 лімфолейкозу (Chaloin, L. і інші Bioconjugate Chem. 12:691-700, (2001)). Пептиди, що називають проникаючими в клітини пептидами, наприклад, пенетратин, транспортан, Тат (амінокислоти 47-57 або 48-60) і модельний амфіпатичний пептид (МАР) використовували як засоби доставки для транспортування фармакологічно важливих речовин, таких як антисмислові олігонуклеотиди, білки й пептиди (Hallbrink, M. і інші Biochim. Biophys. Acta 1515:101-109 (2001); Lindgren, M., і інші Trends Pharmacol. Sci. 21:99-103(2000)). Такі пептиди, зокрема, гомеодомен Antennapedia, що зв'язує ДНК, фактор транскрипції Drosophila або Рер-1 носія 21 залишкового пептиду інтерналізуються багатьма типами клітин у культурі, такими як HS68 людини або мишачі фібробласти NIH-3T3, або при 37° С, або при 4°С. Відсутність впливу температурного зсуву вказує на те, що механізм проникнення відрізняється від механізму класичного ендоцитозу (Morris, Μ.С. і інші Nature Biotechnol. 19:1173-1176 (2001)), для якого потрібні хіральні рецепторні білки. Одним з найбільш широко використовуваних пептидів для транспортування фармакологічно активних сполук у клітинах ссавців є домен білка-переносника, який складається з одинадцяти амінокислот і збагачений аргініном, Tat трансактиваторного білка вірусу імунодефіциту людини типу 1 (HIV-I) (Schwarze, S.R. і інші Science 285:1569-1572 (1999), Schwarze, S.R. і інші Trends Cell Biol. 10:290-295 (2000)). Внутрішньочеревинна ін'єкція 120 kDa бета 5 галактозидази/Tat гібридного білка приводить до трансклітинного переносу гібридного білка практично в усі тканини в мишей, включаючи проходження гематоенцефалічного бар'єра. Було продемонстровано, що зазначений короткий пептидний домен ВІЛ-1 Тат сприяє клітинній інтерналізації великих молекул або частинок, включаючи магнітні наночастинки, вектори фага, ліпосоми та ДНК плазміду. У протилежність іншим клітиннопроникним пептидам, про які мова йшла вище, інтерналізація пептидів, що транспортуються за допомогою Тат (тирозинамінотрансферази) повної довжини або її домену з 11 амінокислот-переносників у значній мірі утруднюється при 4 °С (Liu, Υ. і інші Nat. Med. 6:1380-1387 (2000), Suzuki, Т. і інші J. Biol. Chem. 277:2437-2443 (2002)) і для неї необхідна взаємодія з рецепторами, такими як ланцюги гепаран-сульфату протеогліканів гепаран-сульфату клітинної мембрани. Більшість доменів білків-переносників, ідентифікованих на сьогоднішній день, були отримані з вірусних джерел і джерел, що відносяться до ссавців. Інші джерела доменів білків-переносників були б бажаними з метою конструювання різних експериментальних послідовностей, а також для розробок процедур лікування та профілактики тварин і людини. Одним альтернативним джерелом доменів білків-переносників є бактеріальні клітини. Хоча, як відомо, бактеріальні білки, такі як холероген, проникають у цитозоль клітин ссавців (Sofer, A. and Futerman, A.H. J. Biol. Chem. 270: 12117-12122 (1995)), цитотоксичність таких білків обмежила використання бактеріальних білків або доменів білків-переносників, отриманих з них, для транспортування фармакологічно важливих сполук, що транспортуються у клітини ссавців. Однією характерною ознакою даного винаходу є пептид, що має амінокислотну послідовність, щонайменше, на 90% ідентичну купредоксину дикого типу менш повної довжини або білку зовнішньої мембрани Н.8, що прискорює проникнення зв'язаних молекул, які транспортуються у ракові клітини ссавців. У ряді прикладів здійснення даного винаходу пептид має амінокислотну послідовність, щонайменше, на 90% ідентичну азурину менш повної довжини, пластоціаніну, рустиціаніну, пвсевдоазурину, аураціаніну або азурин-подібному білку, або SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 36 і SEQ ID NO: 43. У ряді прикладів здійснення винаходу пептид одержують із Pseudomonas aeruginosa, Phormidium laminosum, Thiobacillus ferrooxidans, Achromobacter cycloclastes, Pseudomonas syringa, Neisseria meningitidis, Vibrio parahaemolyticus, Bordetella bronchiseptica, Bordetella pertussis, Chloroflexus aurantiacus і Neisseria gonorrhoeae. В інших прикладах здійснення винаходу пептид являє собою, щонайменше, 10 залишків і не більше 50 залишків по довжині. У ряді прикладів здійснення винаходу пептид включає послідовність, що має амінокислотну послідовність, щонайменше, на 90% ідентичну SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 97466 6 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 47 або SEQ ID NO: 47. В інших прикладах здійснення винаходу пептид включає або складається з SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 47 або SEQ ID NO: 47. У ряді прикладів здійснення винаходу пептид включає амінокислотну послідовність DGXXXXXDXXYXKXXD і DGXXXXDXXYXKXXD, де D - аспаргінова кислота, G - гліцин, Υ - тирозин, K лізин і X - будь-яка амінокислота. Нарешті, у ряді прикладів здійснення винаходу пептид має суттєву структурну гомологію по відношенню до області амінокислоти 50-77 азурину Pseudomonas aeruginosa. Додатковою характерною рисою винаходу є комплекс, що містить транспортну сполуку і амінокислотну послідовність, у якій амінокислотна послідовність, щонайменше, приблизно на 90% ідентична купредоксину або його фрагменту, амінокислотна послідовність або її фрагмент пов'язані з транспортованою сполукою і амінокислотна послідовність прискорює проникнення транспортованої сполуки, у ракову клітину ссавця. У ряді прикладів здійснення винаходу амінокислотна послідовність зазначеного комплексу, має амінокислотну послідовність, щонайменше, на 90% ідентичну купредоксину дикого типу менш повної довжини або білку зовнішньої мембрани Н.8. В інших прикладах здійснення винаходу транспортована сполука є білком, ліпопротеїдом, пептидом, полісахаридом, нуклеїновою кислотою, барвником, мікрочастинкою, наночастинкою, токсином і лікарським препаратом. У конкретних прикладах здійснення винаходу транспортована сполука є білком або поліпептидом, що зв'язаний з амінокислотною послідовністю та утворює гібридний білок В інших конкретних прикладах здійснення винаходу транспортована сполука є токсином, зокрема, екзотоксином А Pseudomonas aeruginosa. В інших прикладах здійснення винаходу транспортована сполука є речовиною для детектування, зокрема, речовиною, визначеня якої забезпечується за допомогою флуорометрії, мікроскопії, рентгенівської комп'ютерної томографії, магнітно-резонансної інтроскопи та ультразвуку. Нарешті, винахід також охоплює комплекс у фармацевтично прийнятному носії. Інша характерна риса даного винаходу полягає в створенні способу доставки транспортованої сполуки у клітину. В одному прикладі здійснення винаходу спосіб згідно з винаходом включає контактування клітини або клітин з вищезгаданим комплексом. В інших прикладах здійснення винаходу клітину або клітини одержують від пацієнта, що хворіє раком і реінтродукують у пацієнта. В інших прикладах здійснення винаходу клітини є раковими клітинами, зокрема, клітинами остеосаркоми, раковими клітинами легенів, раковими клітинами товстого кишечнику, лімфоїдними клітинами, лейкозними клітинами, пухлинними клітинами м'яких тканин, раковими клітинами молочних залоз, 7 раковими клітинами печінки, раковими клітинами сечового міхура або раковими клітинами простати. В інших прикладах здійснення винаходу комплекс вводять пацієнтові в терапевтично ефективній кількості. В інших прикладах здійснення винаходу комплекс вводять внутрішньовенно, місцево, підшкірно, внутрішньом'язово або в пухлину. В інших прикладах здійснення винаходу комплекс вводять у поєднанні з іншими засобами для лікування раку. Додатковою характерною рисою даного винаходу є спосіб діагностування раку. У ряді прикладів здійснення винаходу комплекс з транспортованою сполукою, який представляє собою речовину для детектування, вводять пацієнтові, що хворіє раком, і визначають місце знаходження транспортованої сполуки. У конкретних прикладах здійснення винаходу транспортована сполука є рентгеноконтрастною речовиною, яку визначають за допомогою методу рентгенівської комп'ютерної томографії, транспортована сполука є магніторезонансною контрастною речовиною, яку визначають за допомогою методу магнітно-резонансної інтроскопи, і транспортована сполука є ультразвуковою контрастною речовиною, яку визначають за допомогою ультразвуку. В інших прикладах здійснення винаходу клітина або клітини вступають у контакт із комплексом, що містить речовину яку визначають, завдяки чому забезпечується визначення місця знаходження транспортованої сполуки. Додатковою характерною рисою даного винаходу є набір, що містить будь-який з вищевказаних комплексів. У ряді прикладів здійснення винаходу набір додатково містить ад'ювант або наповнювач. В інших прикладах здійснення винаходу набір додатково містить засіб для введення реагенту. SEQ ID NO: 1 - амінокислотна послідовність азурину дикого типу (АДТ) з Pseudomonas aeruginosa. SEQ ID NO: 2 - амінокислотна послідовність пластоціаніну з Phormidium laminosum. SEQ ID NO: 3 - амінокислотна послідовність рустиціаніну з Thiobacillus ferrooxidans. SEQ ID NO: 4 - амінокислотна послідовність псевдоазурину з Achromobacter cycloclastes. SEQ ID NO: 5 - амінокислотна послідовність амінокислотного фрагмента послідовності 36-128 азурину дикого типу (АДТ) з Pseudomonas aeruginosa. SEQ ID NO: 6 - амінокислотна послідовність амінокислотного фрагмента послідовності 36-89 азурину дикого типу (АДТ) з Pseudomonas aeruginosa. SEQ ID NO: 7 - амінокислотна послідовність амінокислотного фрагмента послідовності 36-77 азурину дикого типу (АДТ) з Pseudomonas aeruginosa. SEQ ID NO: 8 - амінокислотна послідовність амінокислотного фрагмента послідовності 36-50 азурину дикого типу (АДТ) з Pseudomonas aeruginosa. SEQ ID NO: 9 - амінокислотна послідовність амінокислотного фрагмента послідовності 50-77 азурину дикого типу (АДТ) з Pseudomonas aeruginosa. 97466 8 SEQ ID NO: 10 - амінокислотна послідовність амінокислотного фрагмента послідовності 50-66 азурину дикого типу (АДТ) з Pseudomonas aeruginosa. SEQ ID NO: 11 - амінокислотна послідовність амінокислотного фрагмента послідовності azu 6777 азурину дикого типу (АДТ) з Pseudomonas aeruginosa. SEQ ID NO: 12 - амінокислотна послідовність прямого праймера для pGST-azu 36-128. SEQ ID NO: 13 - амінокислотна послідовність зворотного праймера для pGST-azu 36-128. SEQ ID NO: 14 - амінокислотна послідовність прямого праймера для pGST-azu 36-50. SEQ ID NO: - амінокислотна послідовність зворотного праймера для pGST-azu 36-50. SEQ ID NO: 16 - амінокислотна послідовність прямого праймера для pGST-azu 36-77. SEQ ID NO: 17 - амінокислотна послідовність зворотного праймера для pGST-azu 36-77. SEQ ID NO: 18 - амінокислотна послідовність прямого праймера для pGST-azu 36-89. SEQ ID NO: 19 - амінокислотна послідовність зворотного праймера для pGST-azu 36-89. SEQ ID NO: 20 - амінокислотна послідовність прямого праймера для pGST-azu 50-77. SEQ ID NO: 21 - амінокислотна послідовність прямого праймера для pGST-azu 67-77. SEQ ID NO: 22 - амінокислотна послідовність зворотного праймера для pGST-azu 50-77 і pGSTazu 67-77. SEQ ID NO: 23 - амінокислотна послідовність прямого праймера для pGST-azu 50-66. SEQ ID NO: 24 - амінокислотна послідовність зворотного праймера для pGST-azu 50-66. SEQ ID NO: 25 - амінокислотна послідовність прямого праймера для гена білка, що флюоресцируює зеленим кольором. SEQ ID NO: 26 - амінокислотна послідовність зворотного праймера для гена білка, флюоресцируює зеленим кольором. SEQ ID NO: 27 - амінокислотна послідовність прямого праймера для gst-gfp-azu 50-77. SEQ ID NO: 28 - амінокислотна послідовність зворотного праймера для gst-gfp-azu 50-77. SEQ ID NO: 29 - амінокислотна послідовність азурину з Pseudomonas syringae. SEQ ID NO: 30 - амінокислотна послідовність білка зовнішньої мембрани азурину/Н.8 з Neisseria meningitides. SEQ ID NO: 31 - амінокислотна послідовність азурину з Vibrio parahaemolyticus. SEQ ID NO: 32 амінокислотна послідовність азурину з Bordetella bronchiseptica. SEQ ID NO: 33 - амінокислотна послідовність аураціаніну А з Chlorofiexus aurantiacus SEQ ID NO: 34 - амінокислотна послідовність аураціаніну В з Chlorofiexus aurantiacus. SEQ ID NO: 35 - штучна амінокислотна послідовність, що представляє консервативні залишки в домені проникнення купредоксину, де D - аспаргінова кислота, G - гліцин, Υ - тирозин, K - лізин і X - будь-яка амінокислота. SEQ ID NO: 36- амінокислотна послідовність Laz білка Neisseria gonorrhoeae. 9 SEQ ID NO: 37 - амінокислотна послідовність амінокислотного фрагмента послідовності 50-67 азурину дикого типу (АДТ) з Pseudomonas aeruginosa. SEQ ID NO: 38 - амінокислотна послідовність амінокислотного фрагмента послідовності 57-89 аураціаніну В Chlorofiexus aurantiacus. SEQ ID NO: 39 - амінокислотна послідовність амінокислотного фрагмента послідовності 50-77 азурину з Bordetella pertussis. SEQ ID NO: 40 - амінокислотна послідовність амінокислотного фрагмента послідовності 106-132 Laz білка з Neisseria meningitidis. SEQ ID NO: 41 - амінокислотна послідовність амінокислотного фрагмента послідовності 53-70 азурину з P. aeruginosa. SEQ ID NO: 42 - амінокислотна послідовність амінокислотного фрагмента послідовності 53-64 азурину з P. aeruginosa. SEQ ID NO: 43 - амінокислотна послідовність азурину з Bordetella pertussis. SEQ ID NO: 44 - амінокислотна послідовність амінокислотного фрагмента послідовності 51-77 азурину з P. aeruginosa. SEQ ID NO: 45 - амінокислотна послідовність амінокислотного фрагмента послідовності 51-77 азурину з Pseudomonas syringae. SEQ ID NO: 46 - амінокислотна послідовність амінокислотного фрагмента послідовності 52-78 азурину з Vibrio parahaemolyticus. SEQ ID NO: 47 - амінокислотна послідовність амінокислотного фрагмента послідовності 51-77 азурину з Bordetella bronchiseptica. SEQ ID NO: 48 - штучна амінокислотна послідовність, яка представляє собою консервативні залишки в домені проникнення купредоксину, де D - аспаргінова кислота, G - гліцин, Υ - тирозин, K лізин і X - будь-яка амінокислота. Фіг. 1 (а) і (b). На діаграмах показано, що проникнення азурину корелюється із цитотоксичністью. (а) Були проведені МТТ аналізи по визначенню цитотоксичності, викликаної азурином дикого типу (АДТ) по відношенню до J774, UISOMel-2 і фібробластовим клітинам, (b) аналіз прогресії клітинного циклу в нормальних фібробластових клітинах людини, що пройшли лікування мутантним азурином М44KМ64Е. Фібробластові клітини інкубували з використанням 0 (контроль), 0,5 або 1,0 мг/мл мутантного азурину протягом 24 годин. Наприкінці строку лікування вміст ДНК у клітинах визначали за допомогою проточної цитометрії. Фіг. 2 (а) і (b). (а) Схематичне подання різних конструкцій процесованого азурину і їх профілів очищення. Різні фрагменти azu гена були злиті в 3'-кінці gst гена в рамці, (b) GST-azu гібридні білки очищали після завершення клітинного росту та лізису, завантажували на SDS-PAGE і візуалізували за допомогою забарвлення Coomassie Blue барвником. Фіг. 3 (а), (b) і (с). (а) На графіку показана конструкція гібридного білка GST- GFP-azu 50-77. gfp ген вводили на 3' -кінці gst гена (для GST-GFP), і далі фрагмент azu 50-77 лігували на 3'-кінці gfp гена в рамці з метою одержання гібридного білка GST-GFP-azu 50-77. GST- GFP-azu 50-77 очищали 97466 10 у вигляді одиничного гібридного білка від клітинних лізатів. Очищений білок аналізували на SDS-PAGE і визначали за допомогою забарвлення барвником Coomassie Blue (9(b)) і також за допомогою методу вестерн-блоттування з використанням антитіла антиазурину (9(с)). Фіг. 4 (а), (b) і (с). На графіку показане кінетичне дослідження з інтерналізації GST-білка, який флюоресціює зеленим кольором (GFP) і GST-GFPазурин гібридних білків. Флюоресценцію зеленого кольру аналізували в клітинах J774, які піддавали лікуванню з використанням різних концентрацій GST-GFP (10(а)) або GST-GFP-azu 50-77 (10(b)) при 37°С протягом 1 години. За допомогою проточної цитометрії було проаналізовано десять тисяч клітин, (с) Залежність інтерналізації GST-GFP-azu 50-77 від часу. J774 клітини інкубували з використанням 200 мкг/мл GST-GFP-azu 50-77 протягом заданих періодів часу при 37°С і аналізували з використанням проточної цитометрії. Фіг. 5 (а), (b) і (с). (а) На графіку показаний домен III екзотоксину А (амінокислоти 405-613), а також частина домену ІЬ (амінокислоти 381-404), злитого з GST (GST-PEDIII), як описувалося вище по відношенню до злиття GST-GFP. Далі лігували фрагмент azu 50-77 до карбоксильного кінця GSTPEDIII (GST-PEDIII- azu 50-77) з використанням полімеразної ланцюгової реакції (ПЛР). (b) Гібридні білки очищали гель-фільтраційною хроматографією на глутатіоноій колонці Sepharose 4B та аналізували на SDS- PAGE з метою визначення розміру, (с) На графіку показана дія гібридного білка GST-PEDIII-azu 50-77 у ракових клітинах UISO-Mel-2 і в нормальних фібробластових клітинах (FBT), як визначено за допомогою PEDIIIопосередкованої цитотоксичності. Як вказувалося, GST-PEDIII і GST-PEDIII-azu 50-77 були інкубовані при різній концентрації за допомогою клітин UISOМеІ-2 і FBT протягом 24 годин, після чого з використанням МТТ аналізу визначали життєздатність клітин. Фіг. 6. На графіку показана локалізація αспіралі в азурині дикого типу (АДТ), а також у домені білка-носія азурину 50-77 дикого типу. Зазначено заміну трьох амінокислот у домені азурину 50-77 залишками проліну. Фіг. 7. Графік PEDIII-опосередкованої токсичності гібридного білка GST-PEDIII-рустиціаніну по відношенню до ракових UISO-Mel-2 клітин і FBT клітин. Як зазначено, GST-PEDIII і GST-PEDIII-azu 50-77 були інкубовані при різних концентраціях за допомогою UISO-Mel-2 і FBT клітин протягом 24 годин, після чого за допомогою МТТ аналізу визначали життєздатність клітин. Фіг. 8(а) і (b). (а) На графіку показане структурне суміщення азурину з іншими купредоксинами відповідно до розрахунку на основі алгоритму VAST. На рисунку опущені N-термінальні подовжені частини аураціаніну В і рустиціаніну, що відсутні в азурині. Сірими ділянками зазначені області азурину, які можуть бути накладені на залишки від кожної сусіднього сполуки. Проміжки чорного кольору є несуміщеними областями. Домен білканосія азурину (PTD), амінокислоти азурину 50-77, у якому відсутнє суміщення з рустиціаніном, виділе 11 ний вертикальними пунктирними лініями. Цифри в дужках після назв купредоксинів є інвентарними номерами бази даних білків. (b). Суміщення кратної амінокислотної послідовності залишків, що містять середню частину в ряді відомих бактеріальних азуринів. Рід і види бактерій позначені наступними абревіатурами: Psae, Pseudomonas aeruginosa (SEQ ID NO: 44); Pssy, Pseudomonas syringae (SEQ ID NO: 45); Neme, Neisseria meningitidis (SEQ ID NO: 40); Vipa, Vibrio parahaemolyticus (SEQ ID NO: 46); Bobr, Bordetella bronchiseptica (SEQ ID NO: 47). У круглих дужках дані значення проміжних амінокислот. Для одержання зазначеного суміщення кратної послідовності було використано програмне забезпечення CLUSTAL X (Higgins and Sharp, Gene 101:64276432 (1988)). Фіг. 9. На Фіг. 9 показаний графік Laz білка з Neisseria meningitidis і білка азурину з Pseudomonas aeruginosa. Термін ліворуч від смуги вказує на назву білка. Термін над смугами вказує назву області білка безпосередньо нижче лінії. Значення нижче смуги вказують амінокислотний номер з'єднання областей білка. Фіг. 10. На Фіг. 10 показані конструкції ряду гібридних білків азурину. Термін ліворуч від смуги вказує на назву конструкції, при цьому зазначений продукт плазміда та білок. Термін над смугою вказує на область білка, позначеного безпосередньо під смугою. Позначення "N. Sp" вказує на сигнальний пептид Neisseria gonorrhoeae; "Η.8" - область Η.8 Neisseria gonorrhoeae; "N.Azu" - азурин Neisseria gonorrhoeae; "P. Sp" - сигнальний пептид Pseudomonas aeruginosa; і "P.Azu" - сигнальний пептид P. aeruginosa. Даний винахід стосується способів і матеріалів для доставки транспортованої сполуки у клітину. Відповідно до даного винаходу доставка транспортованої сполуки, здійснюється за рахунок використання прийнятного транспортуючого поліпептиду. В одному прикладі здійснення винаходу транспортована сполука пов'язане із транспортуючим поліпептидом. Прийнятні транспортуючі пептиди включають купредоксин або фрагмент купредоксину, що містить «домен проникнення купредоксину». Термін «домен проникнення купредоксину» стосується фрагмента купредоксину, що включає амінокислотну послідовність, необхідну для проникнення купредоксину в ракову клітину ссавця. Транспортована сполука що доставляється відповідно до даного винаходу, включає без обмеження, білки, ліпопротеїди, поліпептиди, пептиди, полісахариди, нуклеїнові кислоти, включаючи антисмислові нуклеїнові кислоти, барвники, флуоресцентні та радіоактивні мітки, мікрочастинки або наночастинки, токсини, неорганічні та органічні молекули, легкі молекули та лікарські препарати. У ряді прикладів здійснення винаходу лікарські препарати та токсини знищують пухлинні клітини. В одному прикладі здійснення винаходу купредоксин є азурином, наприклад, азурином дикого типу з Pseudomonas aeruginosa. «Азурин дикого типу» (АДТ) стосується азурину дикого типу з P. aeruginosa. Аналогічним образом, термін «домен впровадження азурину дикого типу» стосується 97466 12 фрагмента азурину дикого типу, що включає амінокислотну послідовність, необхідну для проникнення азурину дикого типу в клітину. В інших прикладах здійснення винаходу купредоксин, зокрема, є пластоціаніном, рустиціаніном або псевдоазурином. У конкретних прикладах здійснення винаходу азурин, зокрема, отриманий з Pseudomonas aeruginosa, Pseudomonas syringa, Neisseria meningitides, Neisseria gonorrhoeae, Vibrio parahaemoiyticus or Bordetella bronchiseptica. В одному прикладі здійснення винаходу транспортовану сполуку доставляють для усунення або уповільнення розвитку клітинного циклу в клітині, наприклад, у раковій клітині. Наприклад, така ракова клітина може бути, зокрема, клітиною остеосаркоми, клітиною раку легенів, клітиною раку товстої кишки, лімфоїдною клітиною, лейкозною клітиною, клітиною пухлини м'якої тканини, клітиною раку молочної залози, клітиною раку печінки, клітиною раку сечового міхура або клітиною раку простати. Наприклад транспортована сполука може являти собою, зокрема, білок контролю клітинного циклу, наприклад, р53; інгібітор кинази, що залежить від цикліну, наприклад, p16, р21 або р27; суїцидний білок, наприклад, тимідин кіназа або нітроредуктаза; цитокін або інший імуномодуляторний білок, наприклад, інтерлейкін 1, інтерлейкін 2 або фактор, що стимулює колонію гранулоцитів макрофагів (GM-CSF); або токсин, наприклад, екзотоксин A Pseudomonas aeruginosa. В інших прикладах здійснення винаходу забезпечується доставка біологічно активного фрагмента одного з перерахованих вище класів. В іншому прикладі здійснення винаходу транспортовану сполуку доставляють із метою генерування зображення цільової тканини. Наприклад, цільова тканина може бути раковою, транспортована сполука може бути одною тих сполук, які зазвичай використовують з метою генерування зображення, яке може бути визначене за допомогою рентгенівської комп'ютерної томографії, магнітно-резонансної інтроскопі!' й ультразвуку. У зазначених прикладах здійснення винаходу транспортована сполука є радіоізотопом, що випромінює гамма-промені або позитрони, магніторезонансною контрастною речовиною, рентгеноконтрастною речовиною або ультразвуковою контрастною речовиною. Купредоксини «Купредоксини» - низькомолекулярні мідьвмісні білки блакитного забарвлення, що мають властивості переносу електрона (10-20 кДа), і беруть участь, наприклад, у бактеріальних ланцюгах або фотосинтезі. Іон міді зв'язаний тільки протеїновою матрицею. Особлива перекручена планарна тригональна геометрія із двох лігандів гістидину й одного ліганда цистеїнату навколо атома міді створює винятково специфічні електронні властивості центра зв'язування металу й обумовлює інтенсивне блакитне забарвлення. Ряд купредоксинів був кристалографічно охарактеризований з роздільною здатністю від середньої до високої. Купредоксини включають азурини, пластоціаніни, рустиціаніни, псевдоазурини, аураціаніни й азуринподібні білки. Термін «купредоксин» у відповідності зі значенням, використовуваним у даному до 13 кументі, включає білкову форму без атома міді, а також мідьвмісний білок. Азурини Азурини є мідьвмісними білками, які містять 128 амінокислотних залишків, які належать до родини купредоксинів, і беруть участь у реакціях переносу електрона в деяких рослинах і бактеріях. Азурини включають купредоксини з P. aeruginosa (PA) (SEQ ID NO: 1) («азурин дикого типу»), A. xylosoxidans і A. denitrificans. (Murphy, L. Μ. і інші, J. Моl. Biol., 315: 859-71 (2002). Незважаючи на те, що послідовна гомологія між азуринуми змінюється в межах 60-90%, структурна гомологія між цими молекулами є високою. Всі азурини мають характерний бета-сендвіч із так званим мотивом Greek key, і єдиний атом міді завжди розташований у одному й тому ж місці білка. Крім того, азурини мають в основному нейтральний гідрофобний «петч», що оточує центр зв'язування міді (Murphy і інші). Пластоціаніни Пластоціаніни є купредоксинами, що містяться в еукаріотичних рослинах і ціанобактериях. Вони містять один атом міді на молекулу, і в оксидованій формі мають блакитне забарвлення. Вони втримуються в хлоропласті, у якому вони виконують функцію носіїв електронів. Із часу визначення структури пластоціаніну тополі в 1978 р. структура водорослевих (Scenedesmus, Enteromorpha, Chlamydomonas) і рослинних (квасоля звичайна) пластоціанінів була визначена з використанням або кристалографічного методу, або методу ядерно-магнітного резонансу, і структура тополі була поліпшена до роздільної здатності 1,33 A. SEQ ID NO: 2 демонструє амінокислотну послідовність пластоціаніну із ціанобактерії Phormidium laminosum. Незважаючи на розбіжність послідовності серед пластоціанінів водоростей і судинних рослин (наприклад, 62% ідентичність послідовності між протеїнами Chlamydomonas і тополі), тривимірні структури зберігаються (наприклад, середньоквадратичне відхилення 0,76 Ǻ положень С альфа між протеїнами Chlamydomonas і Poplar). Структурні характеристики включають деформоване тетраедричне місце зв'язування міді на одному кінці антипаралельного восьмитяжевого бета-циліндра, яскраво виражений негативний «петч» і плоску гідрофобну поверхню. Центр сполуки атома міді оптимізований для виконання його функцій переносу електрона, і передбачається, що негативний і гідрофобний «петчі» беруть участь у розпізнаванні партнерів, які вступають у фізіологічну реакцію. Хімічна модифікація, крос-зшивка й експерименти з сайт-специфічного мутагенезу підтвердили важливість негативних і гідрофобних «петчів» у взаємодіях зв'язування із цитохромом f i підтвердили модель двох функціонально істотних шляхів переносу електрона в пластоціаніні. Один передбачуваний шлях переносу електрона є відносно коротким (приблизно 4 Ǻ) і включає ліганд міді, під впливом розчинника His-87 у гідрофобному «петчі», у той час як другий шлях є набагато довшим (приблизно 12-15 Ǻ) і включає майже консервативний залишок Туr-83 у негативному «петчі» 97466 14 (Redinbo і інші, J. Bioenerg. Biomembr., т. 26 (1):4966 (1994). Рустиціаніни Рустиціаніни є мідьвмісними одноланцюговими поліпептидами блакитного забарвлення, отриманими з тіобацил. Рентгенівська кристалічна структура оксидованої форми рустиціаніну - вкрай стабільного купредоксину з високою окисною дією, виділеного з Thiobacillus ferrooxidans (SEQ ID NO: 3) була визначена шляхом багатохвильової аномальної дифракції при роздільній здатності 1,9 Ǻ. Рустиціаніни складаються із центральної бетасендвіч складки, що складається із шести- та семитяжевого бета-листа. Як і інші купредоксини, іон міді скоординований кластером з чотирьох консервативних залишків (His 85, Cys 138, His 143, Met 148), структурованих у вигляді деформованого тетраедра. (Walter, R. L. і інші, J. Моl. ВіоІ., т. 263:730-51 (1996). Аураціаніни Три низькомолекулярних мідьвмісних білка блакитного забарвлення, позначені як аураціанін А, аураціанін В 1 і аураціанін В-2, були виділені з термофільної зеленої ковзної фотосинтезуючої бактерії Chloroflexus aurantiacus. Дві В форми мають практично ідентичні властивості по відношенню одна до одної, але їх властивості повністю відрізняються від властивостей форми А. Електрофорез натрієвого додецилсульфатполіакриламідного гелю дозволяє продемонструвати очевидні молекулярні маси мономерів, такі як 14 (А), 18 (В-2) і 22 (В-І) kDa. Була визначена амінокислотна послідовність аураціаніну А, що показала, що аураціанін А є поліпептидом, що складається з 139 залишків (Van Dreissche et al, Protein Science 8:947-957 (1999). His58, Cysl23, HisI28 і Metl32 розташовані на відстані один від іншого таким чином, що вони як би являють собою еволюційні ліганди металу, як і у відомих низькомолекулярних мідьвмісних білках пластоціаніні й азурині. Прогноз вторинної структури також вказує на те, що ауроціанін має загальну структуру бета-циліндра, аналогічну структурі азурину з Pseudomonas aeruginosa і пластоціаніну з листя тополі. Проте, очевидно аураціанін має послідовність характерну для обох класів послідовностей низькомолекулярних мідьвмісних білків. Загальна схожість із консенсусною типовою послідовністю азурину приблизно така ж, як і з консенсусною типовою послідовністю пластоціаніна, а саме, 30,5%. Область 1-18 N-термінальної послідовності аураціаніну є винятково багатою на гліцин і гідроксиамінокислоти. Id. Див. ілюстративну амінокислотну послідовність SEQ ID NO: 33 відносно ланцюга А аураціаніну з Chloroflexus aurantiacus (NCBI Protein Data Bank Accession No. AAM12874). Молекула аураціаніну В має стандартну складку купредоксину. Була досліджена кристалічна структура аураціаніну В з Chloroflexus aurantiacus (Bond et al, J. Mo. Biol. 306:47-67 (2001).) За винятком додаткового N-термінального тяжа молекула винятково ідентична молекулі бактеріального купредоксину - азурину. Як і в інших купредоксинах один з лігандов Сu перебуває на 4 тяжі поліпепти 15 ду, і три інших розташованих уздовж великої петлі між тяжами 7 і 8. Розглядається структура розташування атома міді з посиланням на амінокислотний просторовий розподіл між останніми трьома лігандами. Кристалографічно охарактеризований Cu-з'єднувальний домен аураціаніну В, імовірно, прив'язаний до періплазмічної сторони цитоплазматичної мембрани за допомогою N-термінальної хвостової частини, що проявляє істотну послідовну ідентичність із відомими зв'язками в ряді протеїнів - носіїв електронів, пов'язаних з мембранами. Амінокислотні послідовності В форм представлені в McManus і інші (J. Biol. Chem. 267:6531-6540 (1992).). Див. Ілюстративну амінокислотну послідовність SEQ ID NO: 34 для ланцюга А аураціаніну В з Chloroflexus aurantiacus (NCBI Protein Data Bank Accession No. IQHQA). Псевдоазурини Псевдоазурини являють собою сімейство мідьвмісних одноланцюгових поліпептидів блакитного забарвлення. Амінокислотна послідовність псевдоазурину, отримана з Achrorraobacter cycloclastes, проілюстрована в SEQ ID NO: 4. Рентгенографічний структурний аналіз псевдоазурину показує, що він має структуру аналогічну структурі азуринів, хоча існує низька гомологія послідовності між цими білками. Між загальною структурою псевдоазуринів і азуринів є два істотних розходження. Стосовно азурину у псевдоазуринах є карбокситермінальне подовження, що складається із двох альфа-спіралей. У міжпептидній області азурин містить подовжену петлю (ця петля вкорочена в псевдоазуринах), що формує клапанний фрагмент, що містить коротку альфа-спіраль. Єдине істотне розходження в сайті атома міді полягає в конформації MET бічного ланцюга й довжини зв'язку Met-S міді, що є істотно коротшим в псевдоазурині, ніж в азурині. Цитотоксична активність купредоксинів Проводили глибоке дослідження властивостей переносу електронів (редокс-властивостей) купредоксинами, але донедавна не було виявлено, що вони проявляють цитотоксичний вплив. Даний винахід ґрунтується на неочікуваному відкритті винахідників, яке полягає в тому, що купредоксини, а також редокс-білок цитохром с551, що містить залізо (гем), викликають або апоптоз, або інгібують прогресію клітинного циклу в мікрофагових пухлинних клітинах J774 миші й у ракових клітинах людини. Редокс-активність купредоксинів не є значимою для їх цитотоксичної активності. Наприклад, купредоксини, які не містять атом міді, нерідко проявляють значно більш низьку редоксактивність у порівнянні з купредоксинами, що містять атом міді, але, проте, демонструють значну цитотоксичну активність. У порівнянні з їхньою активністю в ракових клітинах купредоксини викликають винятково низький рівень апоптозу in vivo у нормальних тканинах у мишей, що мають пухлину й пройшли лікування купредоксином. Цитотоксична активність купредоксинів описана в заявці на патент США, яка одночасно знаходиться на розгляді, порядковий номер 10/047,710, поданій 15 січня 2002 р. і в заявці на патент США, яка одночасно знаходиться на розгляді, порядко 97466 16 вий номер 10/720,603, поданої 24 листопада 2003 р. Зазначені попередні заявки наведено тут за допомогою посилання. Винахідники продемонстрували, що селективна дія купредоксинів на ракові клітини пов'язано зі здатністю купредоксинів проникати в зазначені клітини. У прикладі 5 винахідники продемонстрували, що купредоксини проникають у клітини J774. Дані клітини є формами асциту ретикулоклітинной саркоми миші з мікрофагподібними властивостями. У прикладах 18 і 19 винахідники продемонстрували, що азуринподібний білок, зовнішня мембрана Н.8 з Neisseria, також відома як Laz мають здатність, зокрема, проникати в ракові клітини мозку При порівнянні купредоксини демонструють винятково низьку швидкість проникнення в нормальні клітини. В одному прикладі здійснення винаходу даний винахід стосується «комплексу», який містить купредоксин або фрагмент купредоксину, зв'язаний із «транспортованою сполукою», для введення у клітину. Транспортована сполука може бути зв'язаною або ковалентно, або нековалентно для утворення комплексу. Фахівцям у даній галузі техніки повинні бути добре відомі способи виготовлення такого комплексу. Наприклад, якщо транспортована сполука є білком або поліпептидом, комплекс може утворюватись у вигляді гібридного білка. В інших прикладах здійснення винаходу транспортована сполука може бути ковалентно зв'язаною з купредоксином чи фрагментом купредоксину або безпосередньо, або через молекулу-лінкер за допомогою, наприклад, дисульфідного або естерного зв'язку. Домен проникнення купредоксину Даний винахід забезпечує домен білка-носія, який дозволяє транспортувати зв'язаної транспортованої сполуки у ракові клітини ссавця, але не в доброякісні клітини. Було виявлено, що білки купредоксину включають домен білка-носія, домен проникнення купредоксину, що прискорює проникнення зв'язаної транспортованої сполуки у ракові клітини ссавця. У ряді прикладів здійснення винаходу весь білок купредоксину може бути використаний для селективного транспортування зв'язаної транспортованої сполуки у ракові клітини. В інших прикладах здійснення винаходу частина купредоксину може бути використана для транспортування зв'язаної транспортованої сполуки у ракові клітини. У ряді прикладів здійснення винаходу домен проникнення купредоксину складається з області купредоксину, що є меншою за білок дикого типу повної довжини (непроцесований). У ряді прикладів здійснення винаходу домен проникнення купредоксину складається з більш ніж приблизно 10 залишків, приблизно 15 залишків або приблизно 20 залишків купредоксину. У ряді прикладів здійснення винаходу домен проникнення купредоксину складається з не більш ніж приблизно 50 залишків, приблизно 40 залишків або приблизно 30 залишків купредоксину. У ряді прикладів здійснення винаходу домен проникнення купредоксину має амінокислотну послідовність, щонайменше приблизно на 90%, щонайменше приблизно на 95% або що 17 найменше приблизно на 99% ідентичну купредоксину. Термін «поліпептид», «пептид» і «білок» використовуються тут взаємозамінно для іменування полімерних амінокислотних залишків. «Поліпептид», «пептид» або «білок» можуть бути синтезовані всередині клітини й виділені з інших білків або клітинних компонентів. В інших прикладах здійснення винаходу «поліпептид», «пептид» або «білок» можуть бути штучно синтезовані у відповідності зі способами, добре відомими фахівцям у даній галузі техніки й, отже, також можуть не містити інші білки. Терміни, які застосовують до амінокислотних полімерів, у яких один або кілька амінокислотних залишків є штучним хімічним аналогом відповідної утвореної природним шляхом амінокислоти. Терміни також застосовують до амінокислотних полімерів, що утворюються природно. Терміни «поліпептид», «пептид» і «білок» також застосовують до модифікацій, що включають без обмежень глікозилювання, ліпідне приєднання, сульфатування, гама-карбоксилювання залишків глутамінової кислоти, гідроксилювання й ADP-рибозилювання. Фахівцям у даній галузі техніки повинне бути очевидно, що поліпептиди не завжди є повністю лінійними. Наприклад, поліпептиди можуть бути розгалуженими в результаті убіквітинізації, або кільцевими (з відгалуженням або без нього), у цілому в результаті посттрансляційних подій, включаючи подію природного процесингу й подій, що виникли в результаті маніпуляції людини, і не відбуваються природним шляхом. Кільцеві, розгалужені, й кільцеві розгалужені поліпептиди можуть бути синтезовані шляхом нетрансляційного природного процесу, а також шляхом цілком синтетичних способів. У прикладах описаний спосіб ідентифікації фрагментів азурину дикого типу P. aeruginosa, що є прийнятним для використання в даному винаході. Такий спосіб також може бути використаний для ідентифікації інших купредоксинів. У прикладах 1 і 2 наведений опис конструкції серії злиттів глутатіон S-трансферази ("GST") азурину дикого типу, процесованого на обох N- і С-кінцях. У цих прикладах також описується очищення продуктів гібридних білків. У прикладі 9 проілюстрована інтерналізація таких злиттів у клітинах J774 при 37° С У той час як азурин дикого типу був інтерналізований, GST залишався на периферії клітин і не був інтерналізований. Azu 36-128 (SEQ ID NO: 5) і azu 36-89 (SEQ ID NO: 6) були інтерналізовані так само як і azu 36-77 (SEQ ID NO: 7). Подальше процесування показує, що, на відміну від інтерналізації azu 50-77 (SEQ ID NO: 9), інтерналізація azu 36-50 (SEQ ID NO: 8) є винятково неефективною. Подальше процесування azu 50-77 (SEQ ID NO: 9) та azu 50-66 (SEQ ID NO: 10) і azu 67-77 (SEQ ID NO: 11) демонструє винятково обмежену інтерналізацію, що вказує на те, що ефективна інтерналізація потребує невтручання в послідовність при позиціях 6667 або поруч з ними. Із практичної точки зору експериментальні дані підтверджують використання амінокислот 50-77 для ефективного транспорту. 97466 18 У ряді прикладів здійснення винаходу домен проникнення купредоксину є доменом проникнення азурину дикого типу. В одному прикладі здійснення даного винаходу домен проникнення азурину дикого типу містить, щонайменше, амінокислоти 50-77 азурину дикого типу (SEQ ID NO: 9). В іншому прикладі здійснення винаходу домен проникнення азурину дикого типу містить, щонайменше, амінокислоти 36-77 азурину дикого типу (SEQ ID NO: 7). В іншому прикладі здійснення винаходу домен проникнення азурину дикого типу містить, щонайменше, амінокислоти 36-89 азурину дикого типу (SEQ ID NO: 6). В іншому прикладі здійснення винаходу домен проникнення азурину дикого типу містить, щонайменше, амінокислоти 36-128 азурину дикого типу (SEQ ID NO: 5). Ще в одному прикладі здійснення винаходу домен проникнення азурину дикого типу містить, щонайменше, амінокислоти 50-67 азурину дикого типу (SEQ ID NO: 37). В іншому прикладі здійснення винаходу домен проникнення азурину дикого типу містить, щонайменше, амінокислоти 53-70 азурину дикого типу (SEQ ID NO: 41). Ще в одному прикладі здійснення винаходу домен проникнення азурину дикого типу містить, щонайменше, амінокислоти 53-64 азурину дикого типу (SEQ ID NO: 42). В іншому прикладі здійснення винаходу домен проникнення купредоксину є доменом проникнення іншого ніж азурин купредоксину P. aeruginosa. У різних прикладах здійснення винаходу домен проникнення купредоксину може бути фрагментом пластоціаніну із ціанобактерії Phormidium laminosum (SEQ ID NO: 2), рустиціаніну з Thiobacillus ferrooxidans (SEQ ID NO: 3); псевдоазурину з Achromobacter cycloclastes (SEQ ID NO: 4), азурину з Pseudomonas syringae (SEQ ID NO: 29), азурину з Neisseria meningitidis (SEQ ID NO: ЗО), азурину з Neisseria gonnorhoeae (SEQ ID NO: 36), азурину з Vibrio parahaemolyticus (SEQ ID NO: 31), азурину з Bordetella bronchiseptica (SEQ ID NO: 32), азурину з Bordetella pertussis (SEQ ID NO: 43) або аураціаніну з Chloroflexus aurantiacus (SEQ ID NO: 33 і 34). В іншому прикладі здійснення винаходу домен проникнення купредоксину містить, щонайменше, амінокислоти 57-89 аураціаніну В Chloroflexus aurantiacus (SEQ ID NO: 38). В іншому прикладі здійснення винаходу домен проникнення купредоксину містить, щонайменше, амінокислоти 50-77 Bordetella pertussis (SEQ ID NO: 39). В іншому прикладі здійснення винаходу домен проникнення купредоксину містить, щонайменше, амінокислоти 106-132 N. meningitidis (SEQ ID NO: 40). В іншому прикладі здійснення винаходу домен проникнення купредоксину містить, щонайменше, амінокислоти 51-77 азурину Pseudomonas syringae (SEQ ID NO: 45). В іншому прикладі здійснення винаходу домен проникнення купредоксину містить, щонайменше, амінокислоти 89-115 Neisseria meningitidis Laz (SEQ ID NO: 40). В іншому прикладі здійснення винаходу домен проникнення купредоксину містить, щонайменше, амінокислоти 52-78 азурину Vibrio parahaemolyticus (SEQ ID NO: 46). В іншому прикладі здійснення винаходу домен проникнення купредоксину містить, щонайменше, амінокислоти 19 51-77 азурину Bordetella bronchiseptica (SEQ ID NO: 47). Модифікація домену проникнення купредоксину В іншому прикладі здійснення винаходу домен проникнення купредоксину є хімічно модифікованим або генетично зміненим з метою одержання варіантів, що зберігають здатність транспортувати транспортовану сполуку у клітину. Наприклад, у прикладі 14 показано, що азурин дикого типу, що має залишки проліну впроваджений в позицій 54, 61 і 70, зберігає свою здатність проникати в UISOMel-2 клітини. В іншому прикладі здійснення винаходу домен проникнення купредоксину містить консервативну амінокислотну послідовність DGXXXXXDXXYXKXXD (SEQ ID NO: 35) або DGXXXXDXXYXKXXD (SEQ ID NO: 48), де D - аспарагінова кислота, G - гліцин, Υ -тирозин, K -лізин і X - будь-яка амінокислота. Див. приклад 17. Варіанти домену проникнення купредоксину можуть бути синтезовані з використанням стандартних способів. Похідні являють собою амінокислотні послідовності, сформовані з нативних сполук безпосередньо або шляхом модифікації або шляхом часткового заміщення. Аналоги являють собою амінокислотні послідовності, що мають структуру аналогічну, але не ідентичну нативній сполуці, але відрізняються за рахунок певних компонентів або бічних ланцюгів. Аналоги можуть бути синтезовані або можуть мати різне еволюційне походження. Варіанти можуть мати повну або неповну довжину, якщо похідне або аналог містять модифіковану амінокислоту. Варіанти домену проникнення купредоксину включають без обмеження молекули, що містять області, які, в основному, є подібними домену проникнення купредоксину щонайменше приблизно на 65%, 70%, 75%, 85%, 90%, 95%, 98% або 99% ідентичності до амінокислотної послідовності ідентичного розміру або порівняно зі суміщеною послідовністю, у якій суміщення реалізується по гомологічному алгоритму. Термін «відсоток (%) ідентичності амінокислотної послідовності» між доменом проникнення купредоксину й варіантною послідовністю визначається як відсоток амінокислотних залишків у домені проникнення купредоксину, що є ідентичними амінокислотним залишкам у варіантній послідовності при суміщенні двох послідовностей. З метою визначення % амінокислотної ідентичності послідовності сполучаються й, при необхідності, вводяться інтервали для досягнення максимального % ідентичності послідовності; консервативні 97466 20 заміни не розглядаються як частина ідентичності послідовності. Процедури суміщення амінокислотних послідовностей з метою визначення відсотка ідентичності добре відомі фахівцям у даній галузі техніки. Для суміщення пептидних послідовностей нерідко використовується доступне програмне забезпечення, таке як BLAST, BLAST2, ALIGN2 або Megaiign (DNASTAR). При суміщенні амінокислотних послідовностей % ідентичності даної амінокислотної послідовності А відносно даної амінокислотної послідовності В, (що в альтернативному випадку можна сформулювати як дана амінокислотна послідовність А має або містить певний % ідентичності амінокислотних послідовностей відносно даної амінокислотної послідовності В) можна розрахувати як: % ідентичності амінокислотної послідовності = Χ/Υ × 100 де X - число амінокислотних залишків, кількісно підрахованих у вигляді ідентичних подібностей, за допомогою програми суміщення послідовностей або алгоритма суміщення А та В; і Υ - загальне число амінокислотних залишків у В. Якщо довжина амінокислотної послідовності А не дорівнює довжині амінокислотної послідовності В, то % ідентичності амінокислотної послідовності А відносно В не буде дорівнювати % ідентичності амінокислотної послідовності В відносно А. В домені проникнення купредоксину можуть бути проведені зміни, що викликають варіації в амінокислотних послідовностях домену проникнення купредоксину, і все-таки нівелють здатність домену проникнення купредоксину транспортувати транспортовану сполуку у клітину. Залишок «замінної» амінокислоти є залишком, що може бути змінений у послідовності домену проникнення купредоксину без нівелювання його здатності транспортувати транспортовану сполуку у клітину, у той час як залишок «незамінної» амінокислоти є необхідним для такої активності. Амінокислоти, для яких можуть бути зроблені «консервативні» заміщення, добре відомі в даній галузі техніки. Ефективні консервативні заміщення наведені в таблиці 1 «Переважні заміщення». Консервативні заміщення, що забезпечують заміну амінокислоти одного класу іншою амінокислотою того ж типу, підпадають під обсяг винаходу доти, поки заміщення істотно не змінює активність домену проникнення купредоксину. Такі обміни, що ведуть до зміни активності домену проникнення купредоксину, є частиною винаходу доти, доки така активність є істотною. 21 97466 Таблиця 1 Переважні заміщення Вихідний залишок Ala (A) Arg (R) Asn(N) Asp (D) Cys (C) Gln (Q) Glu (E) Gly (G) His (H) lle (1) Leu (L) Lys (K) Met (M) Phe (F) Pro (P) Ser (S) Thr (T) Trp (W) Tyr (Y) Val (V) Ілюстративні заміщення Val, Leu, lle Lys, Gln, Asn Gln, His, Lys, Arg Glu Ser Asn Asp Pro, Ala Asn, Gln, Lys, Arg Leu, Val, Met, Ala, Phe, Norleucine Norleucine Val, Met, Ala, Pue Phe Arg, Gln, Asn Leu, Phe, lie Leu, Val, lle, Ala, Tyr Ala Thr Ser Tyr, Phe Trp, Phe, Thr, Ser lle, Leu, Met, Phe, Ala, Leu Norleucine Переважні заміщення Val Lys Gln Glu Ser Asn Asp Ala Arg Leu lle Arg Leu Leu Ala Thr Ser Tyr Phe Leu Неконсервативні заміщення, що впливають на (1) структуру головного ланцюга поліпептиду, таку як β-лист або α-спіральну конформацію, (2) заряд, (3) гідрофобність або (4) більшу частину бічного ланцюга цільового сайту, можуть модифікувати функцію домену проникнення купредоксину. Залишки розділені на групи, виходячи із загальних властивостей бічного ланцюга, як показано в таблиці 2. Неконсервативні заміщення приводять до заміни одного представника цих класів на інший клас. Неконсервативні заміщення, що забезпечують заміну амінокислоти одного класу іншою амінокислотою відмінного класу, підпадають під обсяг винаходу доти, поки заміщення істотно не змінює активність домену проникнення купредоксину. Такі обміни, що ведуть до зміни активності домену проникнення купредоксину, передбачаються як частина винаходу доти, поки така активність є істотною. Таблиця 2 Класи амінокислот Клас Гідрофобний Амінокислоти Norleucine, Met, Ala, Val, Leu, lle Нейтральний гідрофі- Cys, Ser, Thr льний Кислий Asp, Glu Основний Asn, Gln, His, Lys, Arg 22 Конформація розірваного ланцюга Ароматичний Gly, Pro Trp, Tyr, Phe В іншому прикладі здійснення винаходу варіанти домену проникнення купредоксину мають істотну структурну схожість із залишками 50-77 азурину P.Aeruginosa. Приклади досліджень, на підставі яких визначена суттєва структурна гомологія між купредоксинами й іншими білками, включають Toth і інші (Developmental Cell 1:82-92(2001)). Зокрема, суттєва структурна гомологія між варіантом домену проникнення купредоксину й залишками 50-77 азурину P.aeruginosa визначена з використанням алгоритму VAST (Gibrat et al, Curr Opin Struct Biol 6:377-385 (1996); Madej et al, Proteins 23:356-3690 (1995)). У конкретних прикладах здійснення винаходу значення VAST p зі структурного порівняння варіанта домену проникнення купредоксину й залишків 50-77 азурину 3 P.aeruginosa становить менш ніж приблизно 10" , -5 менш ніж приблизно 10 або менш ніж приблизно -7 10 . В інших прикладах здійснення винаходу суттєва структурна гомологія між варіантом домену проникнення купредоксину й залишками 50-77 азурину P.aeruginosa може бути визначена з використанням алгоритму DALI (Holm & Sander, J Mo Biol.233:123-138 (1993)). У конкретних прикладах здійснення винаходу кількісний підрахунок DALI Z для парного структурного порівняння становить, щонайменше, приблизно 3,5, щонайменше, приблизно 7,0 або, щонайменше, приблизно 10,0. Модифікації домену проникнення купредоксину можуть бути виготовлені із застосуванням відомих у даній галузі техніки способів, таких як олігонукпеотид-опосередкований (сайт-специфічний) мутагенез, аланінове сканування й ПЛР мутагенез. Сайт-специфічний мутагенез (Carter, Biochem J., 237:1-7 (1986); Zoller та Smith, Methods Enzymol., 154:329-50 (1987)), касетний мутагенез, мутагенез рестрикційного вибору (Wells і інші, Gene, 34:31523 (1985)) або інші відомі способи можуть бути застосовані для обробки клонованої ДНК з метою одержання амінокислоти варіанта домену проникнення купредоксину. Крім того, домени проникнення, що кодують нуклеотиди, зі структурою подібною до структури доменів проникнення купредоксину можуть бути синтезовані із застосуванням способів добре відомих у даній галузі техніки. Далі, молекули білка, що є молекулами дикого типу, або варіанти доменів проникнення купредоксину, можуть бути синтезовані із застосуванням способів добре відомих у даній галузі техніки. Кодування нуклеїнових кислот для домену проникнення купредоксину та комплексу домену проникнення купредоксину, пов'язаних із транспорованою сполукою Інша характерна ознака даного винаходу передбачає молекулу нуклеїнової кислоти, яка кодує гібридний білок, який включає домен проникнення купредоксину, зв'язаний із транспорованою сполукою де транспортована сполука є білком або пептидом. Молекула нуклеїнової кислоти відповідно 23 до винаходу може бути отримана шляхом поєднання відомих у даній галузі техніки способів. Наприклад, послідовності нуклеїнової кислоти для домену проникнення купредоксину та транспортованої сполуки можуть бути окремо одержані шляхом хімічного синтезу або клонування. Далі послідовності нуклеїнової кислоти лігують у порядку з лігазою з метою одержання молекули нуклеїнової кислоти, що представляє інтерес. Способи доставки транспортованої сполуки з використанням домену проникнення купредоксину Відомо, що багато багатих на аргінін пептидів проходять крізь мембрани клітин ссавців і переносять білкові транспортовані сполуки всередину таких клітин. Suzuki, Т. та інші J. ВіоІ. Chem.277:2437-43 (2002). Наприклад, короткий сегмент з 11 амінокислот, збагачений аргініном (амінокислоти 47-57) білка ΗIV Tat дозволяє транспортувати білки у клітини ссавців. Schwarze, SR., і інші Trends Cell Biol.10:290-95 (2000). Як було показано, синтетичні домени проникнення, що забезпечують зміцнення альфа-спірального вмісту та оптимізацію розміщення залишків аргініну, мають підвищений потенціал як домени білка-носія. Но, Α., і інші Cancer Res.61:474-77 (2001). При порівнянні азурин дикого типу має один залишок аргініну. Таким чином вважається, але не підтверджується даним винаходом, що його спосіб проникнення відрізняється від способу проникнення білка Tat. Даний винахід охоплює використання фрагментів купредоксину, що забезпечують прискорення проникнення транспортованої сполуки у клітину. Такі фрагменти можуть бути визначені за допомогою будь-якого способу, що дозволяє ідентифікувати фрагменти необхідні для проникнення в клітину. В одному такому способі після зв'язування фрагменту купредоксину з речовиною-маркером проводять тест з метою визначення проникнення фрагмента купредоксину в клітину. Такі способи можуть бути використані для ідентифікації придатних фрагментів купредоксинів, розглянутих вище. У різних прикладах здійснення даного винаходу транспортована сполука є приєднаною до купредоксину, наприклад, азурину з P.aeruginosa (SEQ ID NO: 1) ("азурин дикого типу"); пластоціаніну із ціанобактерії Phormidium laminosum (SEQ ID NO: 2); рустиціаніну з Thiobacillus ferrooxidans (SEQ ID NO: 3); або псевдоазурину з Achromobacter cycloclastes (SEQ ID NO: 4), азурину з Pseudomonas syringa (SEQ ID NO: 29), Neisseria meningitidis (SEQ ID NO: 30), Vibrio parahaemolyticus (SEQ ID NO: 31), Bordetella bronchiseptica (SEQ ID NO: 32), аураціаніну А і В з Chloroflexus aurantiacus (SEQ ID NO: 33 і 34) або Neisseria gonorrhoeae (SEQ ID NO: 36), зокрема, азурину та азуриноподібних білків. В інших прикладах здійснення винаходу транспортована сполука зв'язана з доменом проникнення купредоксину. У різних прикладах здійснення даного винаходу домен проникнення купредоксину доставляє транспортовану сполуку у клітину in vitro, ex vivo або in vivo. Наприклад, доставка може бути здійснена in vitro шляхом додавання комплексу домену проникнення купредоксину та транспортованої 97466 24 сполуки до клітинної культури, такої як мазок Папаніколау. В інших прикладах здійснення винаходу доставка може бути здійснена ех vivo шляхом додавання комплексу до проби, отриманої від пацієнта, такої, наприклад, як кров, тканина або кістковий мозок, і введення обробленої проби назад в організм пацієнта. Доставка також може бути здійснена шляхом безпосереднього введення комплексу пацієнтові. Способи даного винаходу можуть бути використані для терапевтичних, профілактичних, діагностичних або науково-дослідних цілей. Транспортовані сполуки, які доставляють відповідно до даного винаходу, включають без обмежень білки, ліпопротеїди, поліпептиди, пептиди, полісахариди, нуклеїнові кислоти, включаючи антисмислові нуклеїнові кислоти, барвники, мікрочастинки або наночастинки, токсини, органічні та неорганічні молекули, легкі молекули та лікарські препарати. В одному прикладі здійснення винаходу, речовину для детектування, наприклад, флуоресцентну речовину, таку як зелений флуоресцентний білок; люмінесцентна речовина; фермент, такий як β-галактозидаза; або мічений радіоактивним ізотопом або біотинільований білок доставляють у клітину для введення у клітину фенотипу, який підлягає детектуванню. Аналогічним чином, можуть бути доставлені мікрочастинки або наночастинки, мічені речовиною для детектування, такою як флуоресцентна речовина. Один приклад прийнятних наночастинок наведений в патенті США № 6,383,500, виданому 7 травня 2002 p., який насьогодні явно інкорпорований шляхом посилання. Багато таких обумовлених речовин відомі фахівцям у даній галузі техніки. У ряді прикладів здійснення винаходу транспортована сполука є речовиною для детектування що прийнятна для рентгенівської комп'ютерної томографії, магнітно-резонансної інтроскопі!', ультразвукової візуалізації або радіоізотопного сканування. У зазначених прикладах здійснення винаходу транспортовану сполуку вводять пацієнтові з метою проведення діагностики. Контрастну речовину вводять у вигляді транспортованої сполуки з метою покращення зображення, одержаного методом рентгенівської комп'ютерної томографії, магнітно-резонансної інтроскопи або ультразвукового дослідження. Введення радіоізотопної транспортованої сполуки, що націлено на пухлинну тканину через домен проникнення купредоксину, може бути використане при радіоізотопному скануванні. У ряді прикладів здійснення винаходу домен проникнення купредоксину може містити радіонуклід з транспортованою сполукою, або без неї. В інших прикладах здійснення винаходу транспортована сполука є радіоізотопом, що випромінює гамма-промені або позитрони, магніторезонансною контрастною речовиною, рентгеноконтрастною речовиною або речовиною для ультразвукового детектування. Речовини для ультразвукового детектування прийнятні для використання як транспортовані сполуки, включають без обмежень мікробульбашки біосумісного газу, рідкий носій і мікросферу поверхнево-активної речовини, і також необов'яково 25 можуть містити довільну зв'язувальну групу Ln між бажаними групами і мікробульбашкою. У даному контексті термін «рідкий носій» означає водяний розчин і термін «поверхнево-активна речовина» означає амфіфільний матеріал, що забезпечує зниження міжфазного натягу в розчині. Перелік прийнятних поверхнево-активних речовин для формування поверхнево-активних мікросфер розкритий в документі ЕР0727225А2, який включений у даний документ за допомогою посилання. Термін «поверхнево-активна мікросфера» включає наносфери, ліпосоми, везікули і т.п. Біосумісний газ може являти собою повітря або фторовуглець, такий як С3-С5 перфторалкан, що забезпечує розходження ехогенності та, таким чином, контраст ультразвукового зображення. Домен проникнення купредоксину є приєднаним, необов'язково через з'єднувальну групу, до мікросфери, в якій міститься або утримується газ. Приєднання може бути ковалентним, іонним або на основі сил Ван-дерВаальса. Конкретні приклади таких контрастних речовин включають ліпідні інкапсулювання перфторвуглеців з множиною пептидів, поліпептидів або пептидоміметиков, що зв'язують рецептори реваскуляризації пухлини. Рентгеноконтрастні речовини, прийнятні для використання як транспортовані сполуки, включають без обмеження одну або декілька рентгенопоглинаючих, або «важких» атомів з атомним числом 20 або більше, і також необов'яково можуть містити довільну зв'язувальну групу Ln між доменом проникнення купредоксину і рентгенопоглинаючими атомами. Часто використовуваним важким атомом у рентгеноконтрастних речовинах є йод. Останнім часом були розкриті рентгеноконтрастні речовини, що складаються з хелатів металів (наприклад, Патент США № 5,417,959), і поліхелатів, що складаються з декількох іонів металу (наприклад, Патент США № 5,679,810). Зовсім недавно були описані багатоядерні кластеры комплекси в якості рентгеноконтрастних речовин (наприклад, Патент США № 5,804,161, РСТ WO 91/14460, та PCT WO 92/17215). Контрастні речовини для магнітно-резонансної інтроскопії, прийнятні для використання як транспортовані сполуки, включають без обмежень один або декілька парамагнітних іонів металу, і також необов'яково можуть містити довільну зв'язувальну групу Ln між доменом проникнення купредоксину й парамагнітними іонами металу. Парамагнітні іони металу присутні у формі металевих комплексів або металлооксидних частинок. У патентах U.S. Pat. №№ 5,412,148 і 5,760,191, описані приклади комплексонов для парамагнітних іонів металу з метою використання в контрастних речовинах для магнітно-резонансної інтроскопії. У патентах Патент США № 5,801,228, Патент США № 5,567,411 і Патент США № 5,281,704 описуються приклади полихелантов, застосовних для комплексообразования більше одного парамагнітного іона металу для використання в MRI контрастних речовинах. У патенті Патент США № 5,520,904 описані склади твердих частинок, що складаються з парамагнітних іонів металу для використання в 97466 26 якості контрастних речовин для магнітнорезонансної інтроскопії. В іншому прикладі здійснення винаходу транспортовану сполуку доставляють для усунення або уповільнення прогресії клітинного циклу в клітині, наприклад, у раковій клітині. Такою раковою клітиною може бути, наприклад, клітина остеосаркоми, ракова клітина легені, ракова клітина товстої кишки, лімфоїдна клітина, лейкозна клітина, пухлинна клітина м'якої тканини або ракова клітина молочної залози, ракова клітина печінки, ракова клітина сечового міхура або ракова клітина простати. Наприклад, транспортована сполука може являти собою, зокрема, білок контролю клітинного циклу, наприклад, р53; інгібітор циклін-залежної кинази, наприклад, p16, р21 або р27; суїцидний білок, наприклад, тимідинкіназа або нітроредуктаза; цитокін або інший імуномодуляторний білок, наприклад, інтерлейкін 1, інтерлейкін 2 або фактор, що стимулює колонію гранулоцитів макрофагів (GMCSF); або токсин, наприклад, екзотоксин A Pseudomonas aeruginosa. В інших прикладах здійснення винаходу забезпечується доставка біологічно активного фрагмента одного з перерахованих вище класів. Ще в одному прикладі винаходу транспортована сполука є нуклеїновою кислотою, що кодує один з перерахованих вище класів сполук. В іншому прикладі здійснення винаходу транспортована сполука є лікарським препаратом, використовуваним для лікування раку. Такі лікарські препарати включають, наприклад, 5-фторурацил; інтерферон α; метотрексат; тамоксифен; і вінкристин. Вищенаведені приклади призначені винятково в ілюстративних цілях, і багато інших таких сполук відомі фахівцям у даній галузі техніки. Транспортовані сполуки прийнятні для лікування раку, включають без обмежень алкілуючі речовини, такі як азотисті іприти, алкілсульфонати, нітрозосечовину, етиленіміни й триазини; антиметаболіти, такі як антагоністи фолата, аналоги пурину й аналоги піримідину; антибіотики, такі як антрацикліни, блеоміцини, мітоміцин, дактиноміцин і плікаміцин; ферменти, такі як L - аспарагіназа; інгібітори трансферази фарнезил-білка; інгібітори 5а-редуктази; інгібітори 17β-гідроксистероїддегідрогенази 3 типу; гормональні речовини, такі як глюкокортикоїди, естрогени/антиестрогени, андрогени/антиандрогени, прогестини, антагоністи рилізинг-фактора лютеїнізуючого гормону, октреотид ацетат; речовини, що руйнують мікротрубочки, такі як ектеїнасцидини або їх аналоги i похідні; речовини, що стабілізують мікротрубочки, такі як таксани, наприклад, паклітаксель (ТахоІ™), доцетаксель (Taxotere™) і їх аналоги, і епотилони, такі як епотилони A-F і їх аналоги; продукти рослинного походження, такі як алкалоїди барвінку, епіподофілотоксини, таксани; і інгібітори топіозомерази; інгібітори трансферази преніл-білка; і різні речовини, такі як гідроксисечовина, прокарбазин, мітотан, гексаметилмеламін; платинові координаційні комплекси, такі як цисплатин і карбоплатин; і інші речовини, які використовують в якості протиракових і цитотоксичних речовин, такі як модифікатори біо 27 логічної реакції, фактори росту, імуномодулятори й моноклональні антитіла. Репрезентативні приклади зазначених класів протиракових і цитотоксичних речовин включають без обмеження мехлоретаміну гідрохлорид, циклофосфомід, хлорамбуцил, мелфалан, іфосфамід, бусульфан, кармустин, ломустин, семустин, стрептозоцин, тіотепа, дакарбазин, метотрексат, тіогуанін, меркаптопурин, флударабін, пентастатин, кладрибін, цитарабін, фторурацил, доксорубіцин гідрохлорид, даунорубіцин, ідарубіцин, блеоміцину сульфат, мітоміцин С, актиноміцин D, сафрацини, сафраміцини, хінокарцини, дискодермоліди, вінкристин, вінбластин, вінорелбін тартрат, етопозид, етопозиду фосфат, теніпозид, паклітаксель, тамоксифен, естрамустин, естрамустину натрію фосфат, флутамід, бузерелін, лейпролід, птеридини, диінеси, левамізол, афлакон, інтерферон, інтерлейкіни, алдеслейкін, філграстим, сарграмостим, ритуксимаб, BCG, третиноїн, іринотекану гідрохлорид, бетаметозон, гемцитабіну гідрохлорид, альтретамін, і топотека та будь-які їх аналоги і похідні. Переважні члени зазначених класів включають без обмеження паклітаксел, цисплатин, карбоплатин, доксорубіцин, карміноміцин, даунорубіцин, аміноптерин, метотрексат, метоптерин, митоміцин 3, естеїнасцидин 743 або пофіроміцин, 5фторурацил, 6-меркаптопурин, гемцитабін, цитозину арабінозид, подофілотоксин або похідні подофілотоксину, такі як етопозид, етопозиду фосфат або теніпозид, мелфалан, вінбластин, вінкристин, леурозидин, віндезин і леурозин. Приклади протиракових і інших цитотоксичних речовин, які застосовують як транспортовані сполуки, включають наступні: похідні епотилону, як описано в патенті Німеччини №. 4138042.8; WO 97/19086, WO 98/22461, WO 98/25929, WO 98/38192, WO 99/01124, WO 99/02224, WO 99/02514, WO 99/03848, WO 99/07692, WO 99/27890, WO 99/28324, WO 99/43653, WO 99/54330, WO 99/54318, WO 99/54319, WO 99/65913, WO 99/67252, WO 99/67253 і WO 00/00485; інгібітор циклін-залежної кинази, як описано в WO 99/24416 (див. також Патент США № 6,040,321); і інгібітори трансферази преніл-білка, як описано в WO 97/30992 і WO 98/54966; і речовини, такі як описані загалом й зокрема в патенті США № 6,011,029 (сполуки по патенту США можуть бути використані в поєднанні з будь-якими модуляторами NHR (включаючи без обмежень модулятори даного винаходу), такі як AR модулятори, ER модулятори, з LHRH модуляторами або з хірургічною кастрацією, зокрема при лікуванні раку). Вищевказані інші терапевтичні речовини при їх використанні як транспортовані сполуки в поєднанні із сполуками даного винаходу можуть бути використані в кількостях, зазначених в Physicians' Desk Reference (PDR) або іншим способом фахівцями в даній галузі техніки. Фармацевтичні композиції, що містять домен проникнення купредоксину Фармацевтичні композиції, що включають комплекс домену проникнення купредоксину зв'я 97466 28 заного із транспортованою сполукою можуть бути виготовлені з використанням будь-яких відомих технологій, наприклад, з використанням технологій змішування, розчинення, гранулювання, дражирування, емульгування, інкапсулювання, поглинання або ліофілізації. Комплекс може бути включений у фармацевтично прийнятний носій, добре відомий у даній галузі техніки. Такі носії дозволяють виготовити препарат у вигляді таблетки, пігулки, драже, капсули, рідини, гелю, сиропу, зависі, суспензії й т.п. Прийнятні наповнювачі також можуть включати, наприклад, добавки й препарати целюлози. Інші наповнювачі можуть включати, наприклад, ароматизатори, барвники, розпушувачі, загущувачі й інші прийнятні добавки, активатори або зв'язувальні речовини. Такі композиції можуть бути використані, наприклад, при визначенні або відображенні типу клітин або при лікуванні захворювань, пов'язаних із загибеллю клітин, або при їх профілактиці. Композиції можуть бути призначені в кількості достатній для профілактики або лікування захворювання, пов'язаного зі стійкістю до загибелі клітин. Відповідно до використовуваного в даному описі значенням, термін «захворювання, пов'язане зі стійкістю до загибелі клітин» стосується захворювання, стану або хвороби, що характеризуються, щонайменше, тенденцією до тривалого життя клітин у порівнянні зі здоровими клітинами аналогічного типу відповідно до визначення, даного об'єктивним, кваліфікованим лікарем або клініцистом. Звичайно організм-хазяїн є ссавцем, таким як людина або тварина. Введення композицій, що містять домен проникнення купредоксину Композиції, що містять домен проникнення купредоксину, можуть бути введені шляхом використання будь-якого прийнятного способу, наприклад, орально, букально, інгаляційно, під'язиково, ректально, вагінально, трансуретрально, назально, місцево, крізьшкірно, тобто, трансдермально або парентерально (включаючи внутрішньовенне, внутрим'язове, підшкірне й внутрішньокоронарне введення). Композиції і їх фармацевтичні лікарські форми можуть бути призначені в будь-якій кількості, ефективній для досягнення поставленої мети. Композиція вводиться в терапевтично ефективній кількості при призначенні для лікування хвороб, пов'язаних зі стійкістю до загибелі клітин. Термін «терапевтично ефективна кількість» означає кількість, що є ефективною для профілактики розвитку або пом'якшення наявних симптомів у пацієнта, який проходить лікування. Визначення терапевтично ефективної кількості перебуває в компетенції фахівців у даній галузі техніки. У різних прикладах здійснення винаходу композиція включає носії й наповнювачі (включаючи буферні розчини, вуглеводи, манітол, білки, поліпептиди або амінокислоти, такі як гліцин, антиоксиданти, бактеріостати, хелатні добавки, суспендуючі агенти, загущувачі й (або) консерванти, але не обмежені ними), воду, масла, сольові розчини, водяні розчини декстрози й гліцерину, інші фармацевтично прийнятні додаткові речовини з метою відповідності фізіологічному стану, такі як буферні 29 речовини, речовини, що регулюють тонус, що змочувальні речовини і т.д. Варто визнати, що, незважаючи на те, що будь-який прийнятний носій, відомий фахівцям у даній галузі техніки, може бути використаний для призначення композицій відповідно до даного винаходу, тип носія буде залежати від способу введення. Сполуки також можуть бути інкапсульовані всередині ліпосом на основі використання добре відомих технологій. Як носії для композицій відповідно до даного винаходу також можуть бути застосовуватись мікросфери, які підлягають біорозкладанню. Опис прийнятних мікросфер, які підлягають біорозкладанню викладено, наприклад, у патентах США №№ 4,897,268; 5,075,109; 5,928,647; 5,811,128; 5,820,883; 5,853,763; 5,814,344 і 5,942,252. «Сполуки», які використовують в даному документі, включають пептиди, амінокислотні послідовності, транспортовані сполуки й комплекси відповідно до даного винаходу. Період напіврозкладання композицій відповідно до даного винаходу в кровотоку може бути подовжений або оптимізований за рахунок застосування ряду способів добре відомих фахівцям у даній галузі техніки, що включають без обмежень циркуляризовані пептиди (Monk et al, BioDrugs 19(4):261-78, (2005); DeFreest et al, J. Pept. Res. 63(5):409-19 (2004)), D,L- пептиди (діастереомер), (Futaki et al, J. Biol. Chem. Feb 23;276(8):5836-40 (2001); Papo et al, Cancer Res. 64(16):5779-86 (2004); Miller et al, Biochem. Pharmacol. 36(1): 16976, (1987)); пептиди, що містять рідкі амінокислоти (Lee et al, J. Pept. Res. 63(2):69-84 (2004)), і Ν- і Стермінальні модифікації (Labile et al, Clin. Invest. Med. 13(5):275-8, (1990)). Винятковий інтерес представляють d-ізомеризація (заміщення) і модифікація стабільності пептидів шляхом Dзаміщення або L-амінокислотного заміщення. Композиції відповідно до даного винаходу можуть бути стерилізовані з використанням відомих способів стерилізації або можуть бути піддані стерильної фільтрації. Отримані водні розчини можуть бути впаковані для застосування у вихідному виді або можуть бути ліофілізували, при цьому ліофілізований препарат комбінують зі стерильним розчином до його введення. Композиції відповідно до даного винаходу можуть вводити різними способами, включаючи ін'єкційний (наприклад, інтрадермально, підшкірно, внутрішньом'язово, інтраперитонеально й т.д.), інгаляційний, місцевий, супозитарний, з використанням крізьшкірного пластиру або орально. При ін'єкційному введенні композиція може бути приготовлена у водяних розчинах, переважно у фізіологічно сумісних буферних розчинах, таких як розчин Хенкса, розчин Рінґера або фізіологічний сольовий буферний розчин. Розчин може містити рецептурні речовини, такі як суспендуючі, що стабілізують і (або) диспергуючі речовини. Як варіант, композиція може мати порошкоподібну форму для включення до її складу прийнятного розчинника, наприклад, стерильної апірогенної води до її застосування. При інгаляційному введенні композиція може вводитися у вигляді аерозольного спрея з балон 97466 30 чика або аерозольного апарата із застосуванням прийнятного газа-витиснювача, наприклад, дихлордифторметану, трихлорфторметана, двоокису вуглецю або іншого прийнятного газу. У випадку аерозолю, що подається під тиском, одиниця дози може бути визначена за допомогою клапана для подачі дозованої кількості аерозолю. Можуть бути приготовлені, наприклад, желатинові капсули або ампули, що містять порошкову суміш білків і прийнятної порошкової основи, такої як лактоза або крохмаль для застосування в інгаляторах або інсуфляторах. При місцевому введенні композиція може бути приготовлена у вигляді розчинів, гелів, мазей, кремів, суспензій і т.д., які добре відомі в даній галузі техніки. У ряді прикладів здійснення введення відбувається за допомогою крізьшкірного пластиру. При супозитарному введенні (наприклад, ректально або вагінально) композиція може бути також приготовлена в композиціях, що містять відомі супозитарні основи. При оральному введенні композиція може бути приготовлена шляхом змішування з фармацевтично прийнятними носіями добре відомими в даній галузі техніки. Може бути використаний твердий носій, такий як манітол, лактоза, стеарат магнію й т.д.; такі носії забезпечують одержання хемотаксину у вигляді таблеток, пігулок, драже, капсул, рідини, гелів, сиропів, суспензій, зависі і т.п. для їх прийому всередину пацієнтом, якому призначене таке лікування. Для оральних твердих лікарських форм, наприклад, таких як порошки, капсули й таблетки, прийнятні наповнювачі включають добавки, такі як цукор, препарати целюлози, гранулюючі та зв'язувальні агенти. Інші зручні носії, добре відомі в даній галузі техніки, також включають полівалентні носії, такі як бактеріальний капсулярний полісахарид, декстран або генно-інженерний вектор. Крім того, рецептури з уповільненим вивільненням, які включають композицію, забезпечують вивільнення композиції протягом тривалого періоду часу таким чином, щоб за відсутності рецептури з уповільненим вивільненням композиція була виведена з організму пацієнта й (або) зруйнована, наприклад, протеазами або шляхом проведення простого гідролізу до прояву або підвищення терапевтичного ефекту. Точний рецептурний склад, спосіб введення й дозування визначаються лікарем з урахуванням стану пацієнта. Доза й інтервал часу між прийомами можуть регулюватися індивідуально з метою забезпечення рівнів комплексу в плазмі, що є достатніми для підтримки терапевтичного ефекту. У цілому необхідна композиція вводиться в суміші з фармацевтичним носієм, обраним залежно від необхідного способу введення й стандартної фармацевтичної практики. Безумовно, що відповідна доза змінюється залежно від, наприклад, сполуки, що містить використовуваний домен проникнення купредоксину, пацієнта, способу введення й характеру й важкості захворювань, у відношенні яких проводиться лікування або діагностування. Проте, в одному прикладі здійснення способів відповідно до даного ви 31 находу задовільні результати лікування пацієнтів вказують на те, що вони були досягнуті при щоденних дозах сполуки, що містить домен проникнення купредоксину, від приблизно 0,001 до приблизно 20 мг/кг ваги тіла. В одному прикладі здійснення винаходу зазначене щоденне дозування для лікування пацієнтів може перебувати в межах від приблизно 0,7 мг до приблизно 1400 мг сполуки, що містить домен проникнення купредоксину, яку вводить, наприклад, у кількості щоденної дози, тижневої дози, місячної дози й (або) безперервної дози. Щоденні дози можуть являти собою дискретні дозування від 1 до 12 разів у день. Як варіант, дози можуть призначати через день, через два дні, через три дні, через чотири дні, через п'ять днів, через тиждень і аналогічним чином зі збільшенням строку на день аж до 31 дня. Дозування може бути безперервним, переривчастим або у вигляді одиничної дози з використання будьякої придатної форми дозування, яка включає таблетки, пластирі, внутрішньовенне введення й т.п. Зокрема, композиція вводиться в терапевтично ефективній кількості. У конкретних прикладах здійснення винаходу терапевтично ефективна кількість становить від приблизно 0,01до 20 мг/кг ваги тіла. У конкретних прикладах здійснення рівень дози становить приблизно 10 мг/кг/день, приблизно 15 мг/кг/день, приблизно 20 мг/кг/день, приблизно 25 мг/кг/день, приблизно 30 мг/кг/день, приблизно 35 мг/кг/день, приблизно 40 мг/кг/день, приблизно 45 мг/кг/день або приблизно 50 мг/кг/день. У ряді прикладів здійснення винаходу спосіб введення пацієнтам сполук, які містять домен проникнення купредоксину, являє собою введення сумісно з іншими лікарськими препаратами, призначеними для лікування раку. Такі способи добре відомі в даній галузі техніки. У конкретному прикладі здійснення винаходу сполуки, що містять домен проникнення купредоксину, є частиною суміші або входять до складу дозування, що містить інші лікарські препарати, застосовувані для лікування раку. Такі лікарські препарати включають перераховані в даному документі препарати, зокрема, 5фторурацил; інтерферон α; метотрексат; тамоксифен; і вінкристин. Вищенаведені приклади призначені винятково в ілюстративних цілях, і багато інших таких сполук відомі фахівцям у даній галузі техніки. Інші лікарські препарати, прийнятні для лікування раку, включають без обмежень алкілуючі агенти, такі як азотисті іприти, алкілсульфонати, нітрозосечовину, етиленіміни й триазини; антиметаболіти, такі як антагоністи фолата, аналоги пурину й аналоги піримідину; антибіотики, такі як антрацикліни, блеоміцини, мітоміцин, дактиноміцин і плікаміцин; ферменти, такі як L- аспарагіназа; інгібітори трансферази фарнезил-білка; інгібітори 5α-редуктази; інгібітори 17β-гідроксистероїддегідрогенази 3 типу; гормональні речовини, такі як глюкокортикоїди, естрогени/антиестрогени, андрогени/антиандрогени, прогестини, антагоністи рилізинг-фактора лютеїнізуючого гормону, октеротид ацетат; речовини, що руйнують мікротрубочки, такі як ектеїнасцидини або їх аналоги й похідні; 97466 32 речовини, що стабілізують мікротрубочки, такі як таксани, наприклад, паклітаксель (ТахоІ™), доцетаксель (Taxotere™) і їх аналоги, і епотилони, такі як епотилони A-F і їх аналоги; продукти рослинного походження, такі як алкалоїди барвінку, епіподофілотоксини, таксани; і інгібітори топіозомерази; інгібітори трансферази преніл-білка; і інші речовини, такі як гідроксисечовина, прокарбазин, мітотан, гексаметилмеламін; платинові координаційні комплекси, такі як цисплатин і карбоплатин; і інші речовини, використовувані в якості протиракових і цитотоксичних речовин, такі як модифікатори біологічної реакції, фактори росту, імунні модулятори й моноклональні антитіла. Сполуки відповідно до винаходу можуть також використатися в поєднанні з рентгенотерапією й хірургією. Репрезентативні приклади зазначених класів протиракових і цитотоксичних речовин включають без обмеження мехлоретамін гідрохлорид, циклофосфомід, хлорамбуцил, мелфалан, іфосфамід, бусульфан, кармустин, ломустин, семустин, стрептозоцин, тіотепа, дакарбазин, метотрексат, тіогуанін, меркаптопурин, флударабін, пентастатин, кладрибін, цитарабін, фторурацил, доксорубіцин гідрохлорид, даунорубіцин, идарубіцин, блеоміцину сульфат, мітоміцин С, актиноміцин D, сафрацини, сафраміцини, хінокарцинм, дискодермоліди, вінкристин, вінбластин, вінорелбін татрат, етопозид, етопозиду фосфат, тенипозид, паклитаксель, тамоксифен, естрамустин, естрамустина фосфат натрію, флутамід, бузерелін, лейпролід, птеридини, диінеси, левамізол, афлакон, інтерферон, інтерлейкіни, алдеслейкин, філграстим, сарграмостим, ритуксимаб, BCG, третиноїн, іринотекану гідрохлорид, бетаметозон, гемцитабіну гідрохлорид, альтретамін, і топотека і його аналоги й похідні. Переважні члени зазначених класів включають без обмеження паклітаксел, цисплатин, карбоплатин, доксорубіцин, карміноміцин, даунорубіцин, аміноптерин, метотрексат, метоптерин, митоміцин 3, естеїнасцидин 743 або пофіроміцин, '5фторурацил, 6-меркаптопурин, гемцитабін, цитозину арабінозид, подофілотоксин або похідні подофілотоксину, такі як етопозид, етопозиду фосфат або теніпозид, мелфалан, вінбластин, вінкристин, леурозидин, віндезин і леурозин. Приклади протиракових і інших цитотоксичних речовин, які застосовують для спільного введення з композиціями відповідно до винаходу, включають наступне: похідні епотилону, як описано в патенті Німеччини No. 4138042.8; WO 97/19086, WO 98/22461, WO 98/25929, WO 98/38192, WO 99/01124, WO 99/02224, WO 99/02514, WO 99/03848, WO 99/07692, WO 99/27890, WO 99/28324, WO 99/43653, WO 99/54330, WO 99/54318, WO 99/54319, WO 99/65913, WO 99/67252, WO 99/67253 і WO 00/00485; інгібітор циклін-залежної кинази, як описано в WO 99/24416 (див. також Патент США № 6,040,321); і інгібітори трансферази преніл-білка, як описано в WO 97/30992 і WO 98/54966; і речовини, такі як описані загалом й зокрема в патенті США № 6,011,029 (сполуки по патенту США можуть бути використані в поєднанні з будь-якими модуляторами NHR 33 (включаючи без обмежень модулятори даного винаходу), такі як AR модулятори, ER модулятори, з LHRH модуляторами або з хірургічними методами, зокрема при лікуванні раку). Фармацевтичні композиції, використовувані відповідно до даного винаходу, можуть бути приготовлені відомими способами із застосуванням одного або декількох фізіологічно прийнятних носіїв, що включають наповнювачі й допоміжні речовини, які полегшують обробку композиції, активних речовин для інгібування або стимулювання секреції композиції або її сумішей у препаратах для терапевтичного застосування. Молекули нуклеїнової кислоти, що кодують домен проникнення купредоксину або гібридний білок, що з'єднує домен проникнення й транспортовану сполука можуть бути вставлені у вектори й використані як вектори генної терапії. Вектори генної терапії можуть бути введені пацієнтові, наприклад, шляхом внутрішньовенної ін'єкції, місцево (Nabel і інші, Патент США №. 5,328,470 1994. США) або шляхом стереотаксичної ін'єкції (Chen і інші, Proc Natl Acad Sci USA, т. 91, стор. 3054-7 (1994). Фармацевтичний препарат вектора генної терапії може включати прийнятний розчинник або матрицю з уповільненим вивільненням лікарської речовини, у яку впроваджений носій для доставки гена. В альтернативному випадку, коли повний вектор для доставки гена може бути отриманий неушкодженим з рекомбінантних клітин, наприклад, ретровірусні вектори, фармацевтичний препарат може включати одну або кілька клітин, що виробляють систему для доставки гена. В одному прикладі здійснення винаходу доставка композиції здійснюється у вигляді ДНК таким чином, щоб комплекс вироблявся in situ. В одному прикладі здійснення ДНК є «безоболонковою», як описано, наприклад, в Ulmer і інші, Science, 259:1745-49 (1993) і згадано у Cohen, Science, 259 1691-92 (1993). Засвоєння безоболонкової ДНК може бути підвищене шляхом нанесення ДНК на носій, наприклад, сферичні частки, що підпадають біо розкладанню, які ефективно переносяться в клітини. При застосуванні таких способів ДНК може бути присутнім усередині кожної із широкого діапазону систем доставки, відомих фахівцям у даній галузі техніки, включаючи системи експресії нуклеїнових кислот і системи експресії бактерій і вірусів. Способи для включення ДНК у такі системи експресії добре відомі фахівцям у даній галузі техніки. (Див., наприклад, WO 90/11092, WO 93/24640, WO 93/17706 і патент США № 5,736,524). Вектори, використовувані для човникового транспортування генетичного матеріалу від організму до організму, можуть бути розділені на два основних класи: клонуючі вектори відтворюють плазміду або бактеріофаг з областями, що є несуттєвими для поширення у відповідній клітиніхазяїні й у які може бути введена чужорідна ДНК; чужорідна ДНК відтворюється й поширюється, так якби вона була компонентом вектора. Вектор експресії (такий як плазміда, дріжджі й геном вірусу тварин) використовується для введення чужорідного генетичного матеріалу в клітину-хазяїн або 97466 34 тканину з метою транскрипції або трансляції чужорідної ДНК, такої як ДНК композиції. У векторах експресії введена ДНК функціонально пов'язана з елементами, такими як промотори, що сигналізують клітині-хазяїну транскрибувати вставлену ДНК. Деякі промотори є винятково корисними, оскільки індукують промотори, які регулюють транскрипцію гена у відповідь на специфічні фактори. Функціональне зв'язування полінуклеотиду композиції з індукованим промотором дозволяє регулювати експресію поліпептиду композиції домену проникнення азурину дикого типу або фрагментів. Приклади класичних індукованих промоторів включають промотори, які реагують на αінтерферон, тепловий удар, іони важких металів і стероїди, такі як глюкокортикоїди (Kaufman, Methods Enzymol. 185:487-511 (1990)) і тетрациклін. Інші необхідні індуковані промотори включають промотори, що не є ендогенними для клітин, у які вводиться конструкція, але проте, реагують у тих клітинах, коли їх екзогенно піддають дії стимулюючої речовини. У цілому, ефективними векторами експресії часто є плазміди. Проте, розглядаються інші форми векторів експресії, такі як вірусні вектори (наприклад, відтворення дефектних ретровірусів, аденовірусів і аденоасоційованих вірусів). Вибір вектора обумовлюється використовуваним організмом або клітинами й бажаним призначенням вектора. У цілому, вектори включають одиничні послідовності, області початку реплікації, маркерні гени, елементи енхансера, промотори й послідовності, термінуючі транскрипцію. Набори, що включають домен проникнення купредоксину - комплекс транспортованої сполуки В іншому прикладі здійснення винаходу пропонується набір, що містить один або декілька наступних компонентів, що перебувають в упаковці або тарі: (1) реагент, що включає комплекс домену проникнення купредоксину, зв'язаного із транспортованою сполукою; (2) реагент, що містить фармацевтично прийнятний активатор або наповнювач; (3) апарат для введення, такий як шприц; (4) інструкції із введення. Також розглядаються приклади здійснення, у яких два або кілька компонентів (1) - (4) перебувають в одній і тій же тарі. При поставці набору різні компоненти композиції можуть бути упаковані в окрему тару й змішуються безпосередньо перед вживанням. Роздільне пакування компонентів забезпечує їхнє тривале зберігання без втрати функцій активних компонентів. Реагенти, включені в набір, можуть поставлятися в тарі будь-якого виду таким чином, щоб зберігався строк придатності різних компонентів і щоб вони не були адсорбовані або змінені матеріалом тари. Наприклад, герметичні скляні ампули можуть містити ліофілізований поліпептид, або полінуклеотид, або буферні розчини, які були впаковані в нейтральній атмосфері нейтрального інертного газу, такого як азот. Ампули можуть бути виготовлені з будь-якого прийнятного матеріалу, такого як стекло, органічні полімери, наприклад, полікарбонат, полістирол і т.д., кераміка, метал або будьякий інший матеріал, звичайно використовуваний 35 для зберігання аналогічних реагентів. Інші приклади прийнятної тари включають прості пляшки, які можуть бути виготовлені з аналогічних речовин, як і ампули, і м'яке пакування, що має внутрішнє покриття з фольги, наприклад, з алюмінію або сплаву. Інші види тари включають пробірки, пляшечки, флакони, пляшки, шприці й т.д. Тара може бути із стерильним вхідним отвором, і у вигляді пляшки із пробкою, яку можна проколоти голкою шприца для підшкірних упорскувань. Інші види тари можуть мати два відділення, бути розділені мембраною, що легко видаляється, після видалення якої забезпечується змішування компонентів. Мембрани, що видаляють, можуть бути виготовлені зі скла, пластику, гуми й т.д. Набори також можуть мати інструкції. Інструкції можуть бути видрукувані на папері або іншому носії й (або) можуть поставлятися у вигляді зчитуваного носія, такого к гнучкий диск, CD-ROM, DVDROM, Zip диск, відеоплівка, аудюплівка, пристрій флеш-пам'яті й т.д. Детальні інструкції можуть не знаходитись фізично разом з набором; замість цього користувачеві може бути дана вказівка звернутися до веб-сайту в Інтернеті, зазначеному виробником або дистриб'ютором наборів, або інструкції можуть направлятися по електронній пошті. Більш повне розуміння даного винаходу може бути отримане з посиланням на нижчеподані конкретні приклади. Приклади описуються винятково в ілюстративних цілях і не обмежують обсягу винаходу. Зміни форми й заміна еквівалентів розглядаються залежно від обставин або доцільності. Незважаючи на те, що в даному описі використалися конкретні терміни, такі терміни є описовими й не використовуються з метою обмежень. Можуть бути запропоновані зміни й варіанти даного винаходу, що не виходять за межі суті й обсягу винаходу, і, таким чином, можуть бути введені тільки ті обмеження, які визначені в прикладених прикладах здійснення винаходу. ПРИКЛАДИ Приклад 1 - Конструкції плазмід Плазміди, експресуючі похідні S-трансфераза (СSТ)-процесованного азурину дикого типу (azu) гібридних глутатіонів були побудовані шляхом полімеразної ланцюгової реакції з використанням полімерази ДНК із виправленням помилок. На Фіг. 6 схематично представлені різні конструкції процесованного азурину дикого типу. Для pGST-azu 36-128 ампліфікованний фрагмент ПЛР був уведений у сайти ВаmНІ і EcoRI pGEXSX вектора експресії комерційного GST (Amersham Biosciences, Piscataway, NJ 08855). Фрагмент ампліфікували за допомогою рUС19-ази у вигляді матриці і праймерів 5'-CGGGATCC CCG GCA АСС TGC CGA AGA ACG ТСА TGG GC-3'(SEQ ID NO: 12) і 5'CGGAATTC GCA TCA CTT CAG GGT CAG GG-3' (SEQ ID NO: 13), де додатково введені сайти ВаmНІ і EcoRI відповідно підкреслені. Карбоксилктермінальне процесування гена azu було сукупно виконане шляхом введення термінуючого кодона з використанням набору сайт-специфічного мутагенезу QuickChanget (Stratagene, La Jolla, CA 92037). Для pGST-azu 36-50, pGST-azu 36-77 і pGSTazu 36-89 терминируючі кодони були введені від 97466 36 повідно в Ser51, Ser78 і Gly90. У якості матричної ДНК використовували плазміду, що несе pGST-azu 36-128. Нижче наведені три набора олігонуклеотидів для сайт-специфічних мутагенезів. Для pGSTazu 36-50: 5-GGC CAC AAC TGG GTA CTG TGA АСС GCC GCC GAC ATG CAG-3' (SEQ ID NO: 14) і 5'-CTG CAT GTC GGC GGC GGT TCA CAG TAC CCA GTT GTG GCC-3' (SEQ ID NO: 15). Для pGSTazu 36-77: 5'-CCT GAA GCC CGA CGA CTG ACG TGT CAT CGC CCA CAC C-3' (SEQ ID NO: 16) і 5'GGT GTG GGC GAT GAC ACG TCA GTC GTC GGG CTT CAG G-3' (SEQ ID NO: 17). Для pGSTazu 36-89: 5'-CCA AGC TGA TCG GCT CGT GAG AGAAGG ACT CGG TGA CC-3' (SEQ ID NO: 18) і 5'-GGT CAC CGA GTC CTT CTC TCA CGA GCC GAT CAG CTT GG-3 (SEQ ID NO: 19). Плазміди pGST-azu 50-77 і pGST-azu 67-77 були отримані шляхом ПЛР з використанням pGST-azu 36-77 у якості матричної ДНК, Ампліфіковані ПЛР фрагменти, azu 50-77 і azu 67-77 були отримані з використанням прямих праймерів 5'-CGGGATCC TGA GCA CCG CCG CCG АСА TGC AGG G-3' (SEQ ID NO: 20) і 5'CGGGATCC CCG GCC TGG АСА AGG ATT ACC TGA AGC CCG-3 (SEQ ID NO: 21), де додатково введений сайт BamUl зазначений підкресленням. Зворотний праймер 5'-CGGAATTj GCA TCA CTT 1 CAG GGT CAG GG-3 (SEQ ID NO: 22) був використаний в обох випадках. Для одержання pGST-azu 50- 66 використовували плазміду, що несе gst-azu 50-77, шляхом введення термінуючого кодона в Gly67 з використанням олігонуклеотидів у такий спосіб: 5'-GAC GGC ATG GCT ТСС TGA CTG GAC AAG GAT ТАС С -3' (SEQ ID NO: 23) і 5'-GGT ААТ ССТ TGT CCA GTC AGG AAG CCA TGC CGTC-3' (SEQ ID NO: 24). Ген білка, який флуоресціює зеленим кольором (gfp), який кодує білок, який флуоресціює зеленим кольором, був ампліфікований шляхом полімеразної ланцюгової реакції. Використані прямі й зворотні праймери являли собою 5'-CGGGATCC CCA TGG TGA GCA AGGGCG-3' (SEQ ID NO: 25) і 5'-CGGAATTC CTT GTA CAG CTC GTC CAT GCC G-3' (SEQ ID NO: 26), що містять сайти BamHI і EcoRI на 5' кінці кожного олігонуклеотиду. Отриманий шляхом полімеразної ланцюгової реакції фрагмент лігували у вектор pGEXSX для створення pGST-GFP. Для одержання плазмідної ДНК, що несе gst-gfp-azu 50-77, ген azu 50- 77 ампліфікували шляхом полімеразної ланцюгової реакції з pGST-azu 50-77 у вигляді матриці й праймеров 5' CCGCTCGAG ССТ GAG CAC CGC CGC CATGCA GGG-3' (SEQ ID NO: 27) і 5'TTTTCCTTTTGCGGCCGC TCA GTC GTC GGG CTT CAG GTA АТС С-3' (SEQ ID NO: 28), де уведені сайти Xho І і Not І відповідно підкреслені. Очищений фрагмент azu 50-77 уводили в pGSTGFP в однозначно рестрикционних ферментних сайтів Xho 1 і Not1. Приклад 2 - Очищення білків Азурин дикого типу й мутантний азурин М44KМ64Е одержали й очистили відповідно до опису Yamada, Т. et al. Proc. Natl. Acad. Sci. USA, vol. 101, pp. 4770-75 (2004) і сумісно розглянутою заявкою на патент США, порядковий номер 37 10/720,603, зміст яких включено за допомогою цього посилання. Короше кажучи якщо коротко, ген азурину дикого типу ампліфікували шляхом полімеразної ланцюгової реакції у відповідності зі способом, описаним Kukimoto et al., FEBS Lett, vol. 394, pp 87-90 (1996). Полімеразну ланцюгову реакцію проводили з використанням геномної ДНК від штаму РАО1 Р. aeruginosa у якості матричної ДНК. Фрагмент ампліфікованої ДНК із 545 bр, гідролізованої Hindlll і Pstl, був вставлений у відповідні сайти pUC 19 таким чином, щоб ген азурину був розміщений нижче промотору lас для одержання експресійної плазміди pUC 19-azu. Як штам-хазяїн використовували E. col JM 109 для експресії гена азурину. Був культивований рекомбінантний штам -1 Е. coil у середовищі 2YT, що містить 50 мкг мол ампіциліну, 0,1 мМ IPTG і 0,5 мМ CuSO4, протягом 16 годин при 37°С для одержання азурину. Для одержання мутантного азурину М44KМ64Е проводили сайт-специфічний мутагенез гена азурину з використанням набору сайтспецифічного мутагенезу QuickChange (Stratagene, La Jolla, CA). Мутації були підтверджені шляхом розшифровки послідовності ДНК. Плазмідна ДНК рЕТ9а, що несе ген rus, який кодує рустиціанін купредоксину з Acidithiobadilus ferrooxidans, була отримана від Dr. Kazuhiko Sasaki, Central Research Institute of Electric Power Industry, Chiba, Japan. Рустиціанін виділяли з Ε. coli BL21 (DE3), що містить ген rus використанням за допомогою способу Sasaki, K., і інші Biosci. Biotechnol. Biochem., vol. 67, pp. 1039-47 (2003) при певних модифікаціях. Коротше кажучи, замість бета-аланінового буфера (рН 4.0) і колонки TSK-gel СМ-650 (Tosoh Bioscience, LLC, Montgomeryville, PA 18936) використовували буфер оцтової кислоти (ρ 4.0) і CMSepharose (Sigma Chemicals, St. Louis, MO 63178). Два інших очищених купредоксини - пластоціанін з Phormidium laminosum і псевдоазурин з Achromobacter cycloclastes - були отримані від Dr. Beatrix G. Schlarb-Ridley, University of Cambridge, UK і Dr. Christopher Dennison, University of Newcastle Upon Tyne, UK, відповідно. Всі рекомбінантні GST-гібридні похідні були очищені в такий спосіб: як штам-хазяїн використовували клітини Ε. coli BL21. Після індукції за допомогою 0,4 м IPTG на ранній фазі логарифмічного росту в L бульйоні, GST-гібридні білки очищали від клітинних екстрактів з використанням афінної хроматографії Glutathione Sepharose 4В і гельфільтраційної колонки Sephadex 75 з PBS (Amersham Biosciences, Piscataway, NJ 08855). Очищені білки - азурин дикого типу й GST-похідні ® або інші купредоксини, - мічені ALEXA FLUOR (Molecular Probes, Inc., Eugene, OR 97402), були виділені відповідно до інструкцій фірми-виробника. Незв'язану вільну флуоресцентну хімічну речовину видаляли за допомогою гель-фільтраційної колонки. Приклад 3 - Культури клітин Клітини J774 і UISO-Mel-2 (отримані від Frederick Cancer Research and Development Center, Frederick, Maryland U.S.A.) були культивовані відповідно до опису в Yamada, Т. та інші Infect. 97466 38 Immun. vol. 70, pp. 7054-62 (2002); Goto, Μ., та інші Мо. Microbiol, vol. 47, pp. 549-59 (2003); і Yamada, Т., і інші Proc. Natl. Acad. Sci. USA vol. 99, pp. 14098-103 (2002), зміст яких інкорпоровано шляхом відсилання. Нормальні фібробластні клітини людини (базова колекція культур мікроорганізмів Відділення хірургічної онкології, Ілінойський університет, Чикаго) вирощували в середовищі MEM з додаванням солі Ерла, що містить 2 мм Lглутаміну, 0,1 мм незамінних амінокислот MEM, 100 одиниць/мл пеніциліну й 100 мкг/мл стрептоміцину. Клітини MCF-7 і MOF-IOF вирощували відповідно до опису в Punj і інші Oncogene 23:236778 (2004). Приклад 4 - Спільна культура клітин J774, UISO-Mel-2 і фібробласта й конфокальна мікроскопія Клітини J774, UISO-Mel-2 і фібробласта вирощували на окремих покривних скельцях. Після інкубування протягом ночі клітини промивали свіжим середовищем, і всі три лінії клітин поміщали в чашку для культивування, яка містить 200 мкг/мл азурину дикого типу, кон'югованого з ALEXA ® FLUOR 568. Клітини далі інкубували протягом 0,5 або 3,5 годин при 37° С в атмосфері 5% СО2. З метою одержання зразків для дослідження під мікроскопом клітини вирощували на покривних скельцях протягом ночі при 37° С Вирощені клітини поміщали в середовище при 37° С або 4° С протягом 2 годин перед обробкою білка. Попередньо нагріте до 37°С або охолоджене до 4° С свіже середовище змішували з купредоксинами, які флуоресціюють червоним кольором (мічені ALEXA ® FLUOR 568), або GST-гібридними похідними й інкубували із клітинами. Клітини промивали PBS і фіксували метанолом при -20°С протягом 5 хвилин. Після подвійного промивання PBS і додавання гістологічного середовища, яке містить 1,5 мкг/мл 4',6-диамідино-2-феніліндолу (DAPI) для забарвлення ядер (VECTASHILD, Vector, Burlingame, CA), зображення одержували за допомогою конфокальної мікроскопії. Приклад 5 - Проникнення купредоксинів у клітини J774 Азурин дикого типу, його мутантні варіанти М44KМ64Е, пластоціанін, псевдоазурин і рустиціанін інкубували за допомогою клітин J774, як і в прикладі 4, і клітини досліджували з використанням конфокальної мікроскопії. У зазначених експериментах купредоксини кон'югували з ALEXA ® FLUOR 568 для одержання флуоресцентного червоного цвіту й інкубували із клітинами J774 протягом 1 години при 37° С при концентрації 200 мкг/мл, і в окремому експерименті азурин дикого типу й рустиціанін інкубували із клітинами J774 протягом 1 години при 37° С при концентрації приблизно 6-7мкм. Ядро забарвлювали в синій колір за допомогою DAPI. Підтримували контроль без білків. У всіх випадках було видно, що купредоксини проникли в цитозоль клітин J774. В аналогічних експериментах аураціаніни А і В переважно проникали у ракові клітини MCF7, а не в доброякісні контрольні клітини. Приклад 6 - Проникнення азурину дикого типу й рустиціаніну в різні типи клітин 39 Азурин дикого типу проявляє низьку цитотоксичну активність відносно клітин MCF-IOF на противагу клітинам MCF-7 Punj et at Oncogene 23:2367-2378 (2004). Клітини J774, перитонеальні макрофаги, гладкі клітини, ракові клітини MCF-7 молочної залози людини й нормальні епітеліальні клітини MCF-IOF людини (базова колекція культур мікроорганізмів Відділення хірургічної онкології, Илінойський університет, Чикаго) обробляли, досліджували як в прикладі 5 і тестували з метою визначення проникнення азурину дикого типу в такі клітини. Азурин дикого типу інтерналізували в клітинах J774 протягом 45 хвилин інкубування. Проте, інтерналізація азурину дикого типу проходила винятково неефективно в перитонеальних макрофагах або гладких клітинах. Навіть після 6-годинної інкубації було виявлено, що такі клітини характеризуються винятково обмеженим проникненням. Аналогічним чином, у той час як азурин дикого типу ефективно проникав у ракові клітини MCF-7 молочної залози, його швидкість проникнення в нормальні клітини MCF-IOF молочної залози була винятково низькою. ® АІеха fluоr -кон'югований азурин ефективно проникав у ракові клітини UISOMel-2 MCF-7, але не в нормальні клітини MCF 10AI молочної залози. ® Проте, АІеха fluor -кон'югований рустиціанін проникав не тільки в цитозоль ракових клітин UISOMel-2 і MCF-7, але також і в нормальні клітини MCF 10AI. На відміну від ракових клітин, у яких рустиціанін був рівномірно розподілений в цитозолі, значна частина рустиціаніну в клітинах MCFIOAI була обмежена перінуклеарним простором, що оточує ядро. Приклад 7 - Опосередкована азурином дикого типу токсичність і інгібування росту З метою подальшої оцінки особливості проникнення азурину дикого типу в різні клітини нами було визначене проникнення АІеха fluorкон'югованого азурину дикого типу в клітини J774, UISO-Mel-2 і нормальні фібробластні клітини в процесі інкубування при 37° С протягом 30 хвилин і 3,5 години. Було виявлено, що азурин дикого типу швидко проникав у клітини J774 і UISO-Mel-2 через 30 хвилин; при цьому винятково невелика кількість азурину дикого типу була виявлена в цитозолі фібробластів через зазначений період часу. Після 3,5 годин інкубування у фібробластах була виявлена лише незначна кількість азурину дикого типу. Для визначення цитотоксичності азурину дикого типу проводили A3 аналіз із використанням броміду 4,5 диметилтіазол-2-іл-2,5 тетразолію (МТТ) відповідно до опису в Yamada, Т., і інші Infect. Immun. 70:7054-62 (2002), Goto, M., і інші Моl. Microbiol 47:549-59 (2003) і в сумісно розглянутій заявці на патент США, порядковий номер 10/720,603, поданій 24 листопада 2003 p., зміст яких включено за допомогою посилання. На Фіг 1 (b) показано, що значна опосередкована азурином дикого типу токсичність спостерігалася тільки відносно клітин J774 і UISO-Mel-2 протягом 24вартового інкубування. 97466 40 Мутантний азурин М44KМ64Е виявив винятково низьку активність індукування апоптозу у клітинах J774, але при концентрації 1 мг/мл значно інгібував (приблизно на 95%) прогресію клітинного циклу на фазі G1 - S. Прогресію клітинного циклу аналізували за допомогою проточної цитометрії відповідно до опису в Hiraoka, Y. et al, Proc. Natl. Acad. Sci. USA, vol. 101 :6427-32 (2004) і Yamada, T. та інші Proc. Natl. Acad. Sci. USA 101 :4770-75 (2004), зміст яких включено за допомогою посилання. На Фіг. 1(а) показано, що при обробці фібробластів 500 мкг/мл або 1 мг/мл мутантного азурину М44KМ64Е ступінь інгібування прогресії клітинного циклу становила приблизно 20%. Приклад 8 - Мікроін'єкція азурину дикого типу в клітини фібробласта й MCF-IOF У відповідності зі способом, описаним Punj, V., et al, Oncogene 23:2367-78 (2004), проводили мікроін'єкції азурину дикого типу в клітини фібробласта й MCF-IOF. Клітини досліджували на індукування апоптозу, який призводить до конденсації й фрагментації ядерної ДНК. Значну конденсацію й фрагментацію ядерної ДНК (міченої синім кольором за допомогою DAPI) спостерігали в одиничних клітинах з тих, яких піддали мікоін'єкції, після 5 годин інкубування з азурином дикого типу, але не протягом 30-хвилинного інкубування з азурином. Приклад 9 - Інтерналізація гібридних похідних азурину дикого типу при 37°С Ряд GST злиттів азурину дикого типу, процессированного як на N-, так і С-кінці, був отриманий і очищений, як і в прикладі 1 (Фіг. 2(а) і 2(b)). Вико® ристовуючи ALEXA FLUOR 568-кон'югований азурин дикого типу, GST і GST-azu гібридні похідні, була досліджена інтерналізація клітин J774 при 37° С протягом 1-вартового інкубування за допомогою способу, описаного в прикладі 5. Ядро офарблювали синім цвітом за допомогою DAPI. У той час як азурин дикого типу інтерналізували, GST залишався на периферії клітин і не був інтерналізований. GST-azu 36-128 і GST-azu 36-89 минулого інтерналізованийи також як і GST-azu 36-77. Проте, подальше процесування продемонструвало, що, у той час як GST-azu 50-77 був інтерналізований, GST-azu 36-50 виявився вкрай неефективним, і було виявлено, що він утворить грудки на поверхні. Приклад 10 - Інтерналізація гібридних похідних азурину при 4° С Досліджували інтерналізацію гібридних похідних азурину дикого типу й GST-azu у клітинах J774, інкубованих при 4° С Інтерналізація азурину дикого типу при температурі 4° С усередині клітин J774 під час інкубування протягом години була істотно послаблена. Аналогічне ослаблення також спостерігалося у відношенні GST-azu 36-128 і GST-azu 36-89. Більше короткі GST-azu 36-77, GST-azu 50-77, GST-azu 50-66 і GST-azu 67-77 продемонстрували значне ослаблення інтерналізації при 4° С. Приклад 11 - Енeргозалежна інтерналізація гібридного білка GST-GFP-azu 50-77 у клітинах J774 і клітинах меланоми UISO-Mel-2 GST гібридизували з GFP з метою одержання гібридного похідного GST-GFP. Крім того, azu 50 41 77 був приєднаний до гібридного білка GST-GFP (Мr 53 kDa) (Фіг. 3(а)). Мобільність очищених гібридних похідних GST, GST-GFP і GST-GFP-azu 50-77 досліджували на SDS-PAGE (Фіг. 3(b)). Визначення було проведено за допомогою забарвлення барвником Coomassie Blue, а також за допомогою методу вестерн-блотування з використанням антитіла антиазурину (Фіг. 3(с)). Визначення клітин J774, оброблених при різних концентраціях GST-GFP за допомогою проточної цитометрії, показало, що зазначений білок не зв'язується із клітинами J774. Проточноцитометричне розділення клітин J774, оброблених при збільшуваних концентраціях гібридного білка GST-GFP-azu 50-77, продемонструвало істотно знижену флюоресценцію в порівнянні з обробкою тільки одним GST-GFP (Фіг. 4). Слід зазначити, що інтерналізація GFP у клітинах ссавців приводить до втрати флюоресценції. Таке ослаблення флюоресценції також очевидне при обробці клітин J774 200 мкг/мл гібридного білка GST- GFP-azu 50-77 і інкубуванні зі збільшуваними періодами часу при° 37 С. З метою визначення наявності розходжень профілю зв'язування й інтерналізації GST-GFP і GST-GFP-azu 50-77, клітини J774 та UISO-Mel-2 інкубували з GST-GFP і GST-GFP-azu 50-77 при 37° С і 4° С Місце розташування флюоресценції зеленого кольору було визначено за допомогою конфокальної мікроскопії. У клітинах J774 пов'язаний з поверхнею гібридний білок GST-GFP не був інтерналізований як при 37°С, так і при 4°С. На противагу цьому було виявлено, що GST-GFP-azu 50-77 інтерналізувався при 37° С, але не при 4° С. У клітинах UISO-Mel-2 гібридний білок GST-GFP утримувався на поверхні як при 37° С, так і при 4° С. На противагу цьому аналогічно клітинам J774 була виявлена інтерналізація гібридного білка GST-GFP-azu 50-77 при 37°С, але не при 4°С. Приклад 12 - Проникнення дикого азурину в клітини ссавців за рахунок проникності клітинної мембрани й ендоцитозного механізму Якщо проникнення азурину дикого типу залежить винятково від опосередкованого рецепторами ендоцитозу, він міг би бути блокований протонофорним карбонілціанід-М-хлорфенілгідразоном (СССР), мітохондріальним відокремлювачем генерації енергії, або преінкубацією з неміченим азурином або іншими купредоксинами, що блокують рецептори. Клітини J774 і UISO-Меl-2 інкубували з купредоксинами при 10-кратній надлишковій концентрації протягом 2 годин при 4°С, клітини ретельно промивали з метою видалення купредоксинів ® і інкубували з ALEXA FLUOR 568-кон'югованим азурином протягом 1 години при 37°С. Була виявлена значна кількість інтерналізованого азурину, як і в клітинах, не оброблених купредоксинами. Також був проаналізований вплив цитохалазину D (Sigma-Aldrich, St. Louis, Mo 63195), - відомого інгібітора опосередкованого рецепторами ендоцитозу, який руйнує клітинну мікроволоконну мережу, і Brefeldin A (Sigma- Aldrich, St. Louis, Mo 63195), що, як відомо, руйнує апарат Ґольджі й інгібує класичну опосередковану везікулами секрецію. При концентрації 20 пМ СССР значно знизив погли 97466 42 нання азурину в клітинах UISO-Mel-2 аналогічному тому, як це відбулося при концентраціях 0,25 - 0,5 пМ цитохалазину D. З іншого боку, Brefeldin А не мав істотного впливу. Приклад 13 - Проникнення гібридного похідного GST-PEDIll-azu 50-77 у клітини UISO-МеІ-2 GST-злиття домену III екзотоксину A Pseudomonas aeruginosa (PEDIII) було побудовано відповідно до опису Hwang, J. et al, Cell 48:129-36 (1987); Reiter, Y. and Pastan, L, Trends Biotechnol 16:513-20 (1998). Зазначене гібридне похідне GSTPEDIII містило амінокислоти 381-613 екзотоксину А. Відомо, що PEDIII локалізує активність ADPрибосилтрансферази й інгібує синтез клітинного білка в еукаріотичних клітинах шляхом інгібування фактора 2 еукаріотичній елонгації. Шляхом використання методу полімеразної ланцюгової реакції, як описувалося у відношенні GST-GFP-azu 50-77, послідовність azu 50-77 була введена в карбоксильній кінець гібридного білка GST-PEDIII (Фіг. 5(а)). Два зазначених гібридних білки (GSTPEDIII і GST-PEDIII-azu 50-77) очищали за допомогою колонкової хроматографії на глютатіон-сефарозі 4В як білки 52 і 54 kDa (Фіг. 5(b)). Далі клітини UISO-Mel-2 і клітини нормального фібробласта інкубували протягом 24 годин при 37°С при різних концентраціях зазначених білків, і ступінь загибелі клітин вимірювали шляхом проведення МТТ аналізу відповідно до опису в прикладі 7. У той час як GST-PEDIII продемонстрував тільки низьку цитотоксичність, гібридний білок GST-PEDIII-azu 50-77 мав високу цитотоксичність через ефективне проникнення в клітини UISO-Mel2 (Фіг. 5(с)). На противагу цьому гібридні білки виявили низький рівень цитотоксичності порівняно з клітинами фібробласта. Приклад 14 - Дестабілізація α-спіралі в азурині дикого типу не має істотного впливу на його інтерналізацію в клітинах UISO-Mel-2 З метою дослідження ролі α-спіралі в проникненні азурину в позиції 54, 61 і 70 азурину дикого типу були впроваджені три дестабілізуючі спіралі пролінових залишки (Фіг. 6), і було проведене вивчення проникнення мутантного азурину А54РТ61РK70Р повної довжини в клітини UISOMel-2. Також були побудовані односпрямовані й двунаправлені мутації в зазначених позиціях й проаналізовано їх проникнення. Мутантний азурин А54РТ61РK70Р був одержаний шляхом сайтспецифічного мутагенезу гена азурину з використанням набору сайт-специфічного мутагенезу QuickChange (Stratagene, La Jolla, CA). Мутанти інкубували при 200 мкг/мл із клітинами UISO-Mel-2 протягом 1 години при 37°С, після чого визначали місце розташування флюоресценції за допомогою конфокальної мікроскопії. У всіх ® випадках ALEXA FLUOR 568-кон'юговані мутантні азурини проникали в клітини UISO-Mel-2. Аналогічним чином при дослідженні проникнення гібридного білка GST-GFP-azu 50-77, а також його потрійного мутантного варіанта А54РТ61РK70Р azu у клітини UISO-Mel-2 не було виявлено істотного розходження. 43 Приклад 15 - Проникнення гібридного похідного GST-PEDIII-рустиціаніну у клітини UISO-Mel-2 GST-злиття домену III екзотоксину A Pseudomonas aeruginosa (PEDIII) було побудовано, як і в прикладі 13. Шляхом використання полімеразної ланцюгової реакції, як описувалося у відношенні GST-GFP-azu 50-77, послідовність рустиціаніну повної довжини була впроваджена в карбоксильний кінець гібридного білка GST-PEDIII. Гібридний білок очищали за допомогою колонкової хроматографії на глютатіон-сефарозі 4В. Далі клітини UISO-Mel-2 і клітини нормального фібробласта інкубували протягом 24 годин при 37°С при різних концентраціях гібридного білка, і ступінь загибелі клітин вимірювали шляхом проведення МТТ аналізу відповідно до опису в прикладі 7. Гібридний білок GST-PEDIII-рустиціанін виявив високу цитотоксичність до клітин UISO-Mel-2 (Фіг. 7). На противагу цьому гібридний білок продемонстрував тільки низький рівень цитотоксичності до клітинами фібробластів. Приклад 16 - Конкуренція азурину з GST-Azu 55-77 по проникненню в клітини J774 Проводили експеримент по визначенню конкуренції з використанням неміченого азурину при ® 37°С у присутності 7 мкМ АІеха fluor кон'югованого GST-azu 50-77. Клітини J774 інкубу® вали без АІеха fluor -кон'югованого азурину з АІе® ха fluor -кон'югованим GST-azu 50-77 (7 мкМ) і з АІеха fluor-кон'югованим GST-azu 50-77 (7 мкМ) у присутності 7, 14 і 56 мкМ неміченого азурину протягом 1 години при 37°С перш, ніж визначити проникнення GST-azu 50-77. Результати однозначно показали, що в порівнянні тільки з одна міченим GST-azu 50-77 (7 мкМ), присутність неміченого азурину (7, 14 і 56 мкм) у зростаючих кількостях забезпечувало конкуренцію, що підсилюється, проникненню міченого GST-azu 50-77 (7 мкМ). На противагу цьому при використанні аналогічних концентрацій (6, 12 і 48 мкМ) неміченого рустиціаніну в присутності міченого GST-azu 50-77 спостерігався вкрай слабкий вплив на проникнення GSTazu 50-77. Приклад 17 - Послідовність і структурне порівняння домену білка-носія азурину (PTD) з іншими купредоксинами Ідентичність послідовності між азурином і рустиціаніном в області azu 50-77 становить менш 20%, що є вірним відносно ряду інших купредоксинів (De Rienzo et al, Protein Science 9:1439-1454, 2000; Murphy et al, J. Mo. Biol. 315:859-871, 2002). Структурний аналіз із використанням алгоритму VAST (Gibrat et al, Curr. Opin. Struct. Biol. 6:377385, 1996) між азурином і декількома членами сімейства купредоксинів продемонстрував істотну ідентичність між областю azu 50-77 і областю аураціаніну В купредоксину - купредоксин, виділений з термофільної зеленої фотосинтезуючої бактерії С aurantiacus (Bond et al, J. Mo. Biol. 306:47-67, 2001). Інші члени сімейства купредоксинів, незважаючи на те, що вони проявляють структурну схожість із іншими областями азурину, не мають істотну ідентичність із PTD азурином, амінокислотами 50-77 (Фіг. 8(а)). Безсумнівно, при порівнянні з іншими білками, структури яких були включені в ба 97466 44 зу даних білків, спостерігався винятково низький ступінь схожості між azu PTD і іншими білками. Суміщення кратної амінокислотної послідовності залишків в області P. aeruginosa PTD з відомими послідовностями інших бактеріальних азуринів з патогенов з використанням програмного забезпечення суміщення CLUSTAL X (Higgins та Sharp, id. 1988). У той час як фітопатогенний азурин P. syringae виявив високу ідентичність із областю PTD азурину P. aeruginosa, азуриноподібний білок з Neisseria meningitidis (Gotschlich and Seiff, FEMS Microbiol Lett. 43:253-255 (1987); Kawula et al, Mo. Microbiol. 1:179-185 (1987); Cannon, Clin. Microbiol. Rev. 2-.S1-S4 (1989)) також виявив істотну ідентичність із доменом PTD азурину P. aeruginosa, також як і азурини з Vibrio parahaemolyticus і Bordetella bronchiseptica (Фіг. 8(b)). Була виявлена консервативна мотивна послідовність D-G-X-X-X-X-X-D-X-X-Y-X-K-XX-D (SEQ ID NO: 35) у всіх зазначених азуринах. Приклад 18 - Індукування N. meningitidis Laz (Η8-азурин) загибелі клітин у лінії клітин LH229 пухлини головного мозку Neisseria meningitidis (Nm) викликає цереброспінальний менінгіт шляхом поширення в кровотоці і проникнення через гематоенцефалічний бар'єр, імовірно по трансклітинному шляху через ендотеліальні клітини головного мозку впроваджуючись в оболонку мозку. Азурини, як з Pseudomonas aeruginosa, так і з Neisseria meningitides, мають аналогічні структури й високу гомологію амінокислотної послідовності (>50%). Крім того, азурин N. meningitidis є частиною більш довгого поліпептиду - Laz (SEQ ID NO: 30), що утримує у своєму N-кінці поверхневий пептид, який називається Н8, присутній у зовнішній мембрані N. meningitidis (Cannon, J.G., Clin. Microbiol. Rev. vol. 2, pp. 51-54 (1989)). Поверхнево-откритий антигенний епітоп Н8 також несе сигнал для ліпідації. Повний білок зовнішньої мембрани Н8 N. meningitidis зберігається на зовнішній поверхні клітин N. meningitidis. Білок Laz Neisseria gonorrhoeae у значній мірі ідентичний білку Laz N. meningitidis protein. Ген Laz N. gonorrhoeae був клонований в Е. соlі, і далі ген laz в Е. соlі був гіперекспресований для одержання білка Laz (Фіг. 13). Здатність очищеного азурину P. aeruginosa і очищеного білка Laz N. gonorrhoeae індукувати загибель клітин у клітинній лінії LH229 пухлини головного мозку за результатами аналізу МТТ (Yamada, Т., і інші, Cell Cycle vol. 3, pp. 11821187 (2004)). У той час як азурин P. aeruginosa, при експресії в Е. соlі є присутнім у періплазмі, білок Laz при експресії в Е. Соlі був виявлений у зовнішній мембрані Е. соlі. Крім того, у той час як азурин мав винятково низьку цитотоксичність до клітин пухлини головного мозку в період часу, обмежений 24 годинами, Laz виявив високу цитотоксичність, забезпечуючи загибель 90% клітин пухлини головного мозку через 24 години (таблиця 3). Азурин всетаки продемонстрував підвищення цитотоксичності через 48 годин (таблиця 4). Цей експеримент вказує на те, що азурин P. aeruginosa і Н8-азурин N. gonorrhoeae (Laz, SEQ ID NO: 36) будуть прида 45 97466 тними для діагностування й (або) лікування пухлин головного мозку in vitro і in vivo. Якщо Laz забезпечує зниження росту пухлини головного мозку, весь білок або його частина буде використаний у якості «домену проникнення купредоксину» відповідно до винаходу для перемі 46 щення транспортованих молекул, включаючи флуоросцентні або радіоізотопні маркери, або лікарські препарати/токсини для знищення пухлин, у головний мозок і в клітини пухлини головного мозку для діагностичних або терапевтичних цілей. Таблиця 3 Цитотоксичність азурину P. aeruginosa і Laz N. Gonorrhoeae до лінії LH229 ракових клітин головного мозку після інкубування протягом 24-годин Білок Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Концентрація (мкг/мл) 0 0 25 25 50 50 100 100 200 200 400 400 800 800 Цитотоксичність (%) 0,00 0,00 5,86 18,80 5,48 23,59 6,00 41,02 8,27 78,99 7,25 94,69 13,22 98,36 STDEV 0,00 0,00 2,45 1,26 2,43 1,57 4,13 1,49 4,79 2,06 3,69 0,97 7,67 0,62 Таблиця 3 Цитотоксичність азурину P. aeruginosa і Laz N. gonorrhoeae відносно лінії LH229 ракових клітин головного мозку після 48-годинної інкубації Білок Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Азурин P. aeruginosa N. gonorrhoeae Laz Концентрація (мкг/мл) 0 0 25 25 50 50 100 100 200 200 400 400 800 800 Приклад 19 - Цитотоксичність білка Laz N. gonorrhoeae для клітин пухлини головного мозку Був побудований ряд плазмід, які кодують конструкції білків, що включають азурин P. aeruginosa, N. gonorrhoeae Laz (SEQ ID NO: 36), гібридні білки й білки з лініями клітин пухлини головного мозку, та проаналізовані за допомогою методу МТТ. Протестовані білкові конструкції включають тільки одну область N. gonorrhoeae Laz Η.8, тільки один азурин P. Aeruginosa, тільки один азурин N. Gonorrhoeae і конструкції, наведені на Фіг. 10. Плазміди, що кодують білкові конструкції, трансформовані в Е. соlі або інші прийнятні системи експресії, експрессированні білкові конструкції Цитотоксичність (%) 0,00 0,00 11,65 20,04 8,55 25,52 16,19 39,72 16,30 87,01 61,96 98,75 82,71 99,93 STDEV 0,00 0,00 1,07 4,25 2,51 1,80 2,60 0,92 1,91 1,21 19,15 0,96 5,91 0,12 й кінцеві очищені білки. Клітинні лінії пухлини головного мозку включають NL229 і CCF- STTGI. Результати даного експерименту вказують на те, що область Н.8 і (або) азурин гена Laz необхідні для забезпечення цитотоксичності конструкції білка до клітин пухлини головного мозку. Даний експеримент також дозволяє визначити чи виявляться інші азурини більше цитотоксичними для клітин пухлини головного мозку при гібридизації з областю Н.8. Результати даного експерименту вказують на те, що область Н.8 здатна адаптувати купредоксин таким чином, щоб він проявляв цитотоксичність для ракових клітин головного мозку шляхом транспортування прикріпленого азурину в ракові клітини головного мозку. Відповідним чином 47 Н.8 може бути використана в якості транспортного домену для переміщення транспортованої молекули у ракові клітини головного мозку. Корисні транспортовані сполуки включають речовини, які застосовуються для лікування й діагностування раку, відомі в даній галузі техніки й наведені в даному описі. Приклад 20 - Лікування пацієнтів, що хворіють на рак Клінічні випробування домену проникнення купредоксину - гібриду llІ домену екзотоксину А (досліджуваний лікарський препарат) фази І/ІІ будуть проведені на пацієнтах, що хворіють на рак. Зокрема, домен проникнення купредоксину є областю амінокислот 50-67 з Pseudomonas aeruginosa, і транспортована сполука є доменом III екзотоксину А з Pseudomonas aeruginosa, що утворюють гібридний білок "PEDIII-azu 50-67." Зазначений гібридний білок передбачається побудувати відповідно до процедури, проілюстрованої в прикладі 13. Сорок дев'ять дорослих пацієнтів з гістологічно підтвердженим раком молочної залози, товстої кишки й меланомою, які продемонстрували клінічну й рентгенографічну прогресію або рецидив після відповідного лікування із застосуванням у цей час наявних хіміотерапевтичних лікарських препаратів і схеми лікування, схвалених Управлінням по контролю за харчовими продуктами й лікарськими засобами США, будуть задіяні у відкритому перспективному дослідженні прийому досліджуваного лікарського препарату. При обранні в групу для участі в дослідженні у всіх пацієнтів повинне спостерігатися збільшення об'єму виміряної пухлини після завершення схваленого курсу лікування із застосуванням методу хіміотерапії. Необхідно одержати гістологічне підтвердження наявності постійних метастазуючих пухлин і (або) постійного збільшення розміру або обсягу пухлин. Зазначене гістологічне підтвердження повинне бути отримане за допомогою пункційної аспіраційної біопсії (FNA). Передбачається приступити до реалізації програми лікування після одержання згоди всіх пацієнтів на основі повної інформації відповідно до Міжнародної Спостережної Ради Ілінойського університету, Чикаго і Управління по контролю за харчовими продуктами й лікарськими засобами США. У пацієнтів не повинне бути будь-яких інтеркурентних захворювань, таких як інша злоякісна пухлина, анамнез попередньої злоякісної пухлини, патологічні зміни крові, інсулінзалежний цукровий діабет або інші серйозні серцево-судинні захворювання, які могли б вплинути на відповідну оцінку впливу запропонованої терапії. До початку лікування передбачається провести початковий аналіз крові (клінічний аналіз крові [СВС] та хімію сирова 97466 48 тки), включаючи функціональні проби печінки (LFT). Протягом періоду проведення випробувань всім включеним у дослідження пацієнтам заборонено проходити одночасно будь-які інші курси хіміотерапії для лікування раку. Передбачається, що досліджуваний(-ні) лікарський засіб(-оби) будуть призначені щодня шляхом внутрішньовенної ін'єкції фармацевтично прийнятного препарату досліджуваних ліків протягом 12 тижнів, і за пацієнтами буде вестися спостереження на наявність будь-якої токсичності, яка обмежуватиме дозу. Передбачається 7 дозових рівнів, починаючи з 10 мг/кг/день зі збільшенням рівня на 5 мг/кг/день до досягнення максимальної дози в розмірі 50 мг/кг/день. Ефективність кожного рівня дозувань буде реєструватися в 7 пацієнтів із запущеним вимірюваним раком (молочної залози, товстої кишки й меланомою). Оцінка реакції буде проводитися шляхом визначення розміру пухлини, що піддається вимірюванню, в 2-х вимірах (а і b). 1) Повне зникнення цільових метастазуючих пухлин буде розглядатися як повна реакція (CR); 2) 75% скорочення буде розглядатися як відмінна часткова реакція (PR); і 3) гарна реакція (PR) передбачає 50% скорочення розміру після проведеного лікування; 4) 25% скорочення розміру буде розглядатися як стабільне захворювання (SD); і 5) скорочення < 25% буде розглядатися як відсутність реакції на лікування (NR). Для пацієнтів, у яких буде спостерігатися прогресування хвороби курс лікування буде припинений однак, спостереження за ними буде тривати додатково протягом 12 тижнів. Повне зникнення й (або) будь-яке скорочення розміру цільових метастазуючих пухлин буде означати, що застосування азурину для лікування ракових захворювань є ефективним. Інші вказівки на те, що лікування азурином є ефективним, включають зниження частоти появи нових метастазуючих пухлин і скорочення розвитку кровоносних судин, пов'язаних з пухлинами. Різні зміни й доповнення описаних прикладів і систем відповідно до винаходу, що не виходять за межі обсягу й суті винаходу, будуть очевидні фахівцям у даній галузі техніки. Незважаючи на те, що винахід був описаний на конкретних прикладах здійснення, фахівцям у даній галузі техніки повинне бути очевидно, що винахід, заявлений як такий, не повинен бути необґрунтовано обмеженим такими конкретними прикладами здійснення. Безсумнівно, різні зміни описаних способів реалізації винаходу, що є очевидними фахівцям у суміжних областях техніки, перебувають у межах обсягу доданої формули. 49 97466 50 51 97466 52 53 97466 54 55 97466 56 57 97466 58 59 97466 60
ДивитисяДодаткова інформація
Назва патенту англійськоюCupredoxin derived transport agents and methods of use thereof
Автори англійськоюCHAKRABARTY, Ananda, DAS GUPTA, Tapas, Yamada Tohru, FIALHO, Arsenio
Назва патенту російськоюТранспортирующие соединения - производные купредоксина и способы их применения
Автори російськоюЧакрабарти Ананда, Дас Гупта Тапас, Ямада Тохру, Фиало Арсенио
МПК / Мітки
МПК: C07K 14/195, C07K 14/82
Мітки: купредоксину, способи, похідні, сполуки, застосування, транспортувальні
Код посилання
<a href="https://ua.patents.su/50-97466-transportuvalni-spoluki-pokhidni-kupredoksinu-i-sposobi-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Транспортувальні сполуки – похідні купредоксину і способи їх застосування</a>
Попередній патент: Пристрій визначення інтегральної нелінійності характеристики перетворення аналого-цифрових перетворювачів
Наступний патент: Спосіб виділення клейковини й крохмалю
Випадковий патент: Ферментний біосенсор для визначення активності алкалоїдів чистотілу