Інгібітори сетр
Номер патенту: 86077
Опубліковано: 25.03.2009
Автори: Ден Сяолін, Томпсон Крістофер Ф., Наполітано Джоанн М., Сінклер Пітер Дж., Курайші Назя, Сміт Камерон Дж., Алі Амджад, Лу Чжицзянь, Хант Джуліан А., Тейлор Гейл Е.
Формула / Реферат
1. Сполука, що має формулу Іе, або її фармацевтично прийнятна сіль
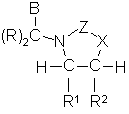 Іе,
Іе,
де
X вибирають з групи, що складається з -О-, -NH-, -N(C1-C5алкіл)- і -(СН2)-;
Z вибирають з групи, що складається з -С(=О)-, -S(O)2- і -C(=N-R9)-, де R9 вибирають з групи, що складається з Н, -CN і C1-C5алкілу, необов'язково заміщеного 1-11 галогенами;
кожний R незалежно вибирають з групи, що складається з Н і -СН3;
В вибирають з групи, що складається з А1 і А2, де А1 має структуру:
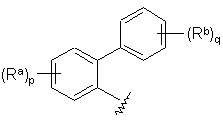 ;
;
R1 вибирають з групи, що складається з Н, -C1-C5алкілу і -(C(R)2)nA2, де -C1-C5алкіл необов'язково заміщений 1-11 галогенами;
R2 вибирають з групи, що складається з Н, -C1-C5алкілу, А1 і -(C(R)2)nA2, де C1-C5алкіл необов'язково заміщений 1-11 галогенами;
де один з В і R2 являє собою А1; і один з В, R1 і R2 являє собою А2 або -(C(R)2)nA2; так що сполука формули Іе включає одну групу А1 і одну групу А2;
А2 вибирають з групи, що складається з фенілу, циклогексилу і піридилу, де А2 необов'язково заміщений 1-2 замісниками, незалежно вибраними з галогену, -С1-С4алкілу і -CN, де С1-С4алкіл необов'язково заміщений 1-3 галогенами;
кожний Ra незалежно вибирають з групи, що складається з -С1-С3алкілу і галогену, де -С1-С3алкіл необов'язково заміщений 1-3 галогенами;
кожний Rb незалежно вибирають з групи, що складається з Сl, F, -С1-С4алкілу і -ОС1-С4алкілу, де -С1-С4алкіл і -ОС1-С4алкіл необов'язково заміщені 1-5 F;
n дорівнює 0 або 1;
р являє собою ціле число від 0 до 2; і
q являє собою ціле число від 0 до 3.
2. Сполука за п. 1, вибрана з групи, яка складається зі сполук, що мають формули If, Ig і Ih, або її фармацевтично прийнятна сіль
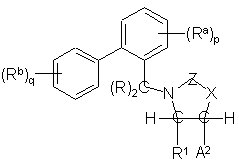 If,
If,
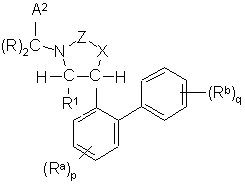 Ig
Ig
і
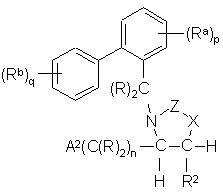 Ih,
Ih,
де кожний з R1 і R2 незалежно вибирають з Н і -С1-С5алкілу, де -С1-С5алкіл необов'язково заміщений 1-11 галогенами.
3. Сполука за п. 2, що має формули If, Ig і Ih, або її фармацевтично прийнятна сіль, де
А2 вибирають з групи, що складається з фенілу, циклогексилу і піридилу, де А2 необов'язково заміщений 1-2 замінними групами, незалежно вибраними з галогену, -СН3, -CF3 і -CN;
кожний Ra незалежно вибирають з групи, що складається з -CF3 і Сl;
кожний Rb незалежно вибирають з групи, що складається з -С1-С3алкілу, -ОСН3 і F;
кожний R1 і R2 незалежно вибирають з групи, що складається з Н і -С1-С2алкілу;
X вибирають з групи, що складається з -О-, -NH-, -N(CH3)- і -СН2-;
Z вибирають з групи, що складається з -С(=О)-, -S(O)2- і -C(=N-CN)-;
n дорівнює 0 або 1;
р дорівнює 1; і
q дорівнює 2 або 3.
4. Сполука за п. 3, що має формулу Іі, або її фармацевтично прийнятна сіль
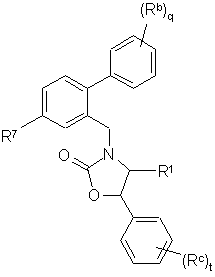 Іі,
Іі,
де
R7 вибирають з групи, що складається з Сl і -CF3;
Rc вибирають з групи, що складається з галогену, -СН3, -CF3 і -CN; і
t являє собою ціле число від 0 до 2.
5. Сполука за п. 3, що має формулу Ij, або її фармацевтично прийнятна сіль
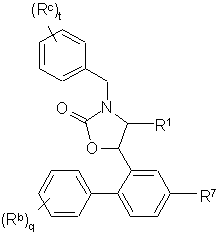 Ij,
Ij,
де
R7 вибирають з групи, що складається з Сl і -CF3;
Rc вибирають з групи, що складається з галогену, -СН3, -CF3 і -CN; і
t являє собою ціле число від 0 до 2.
6. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для одержання лікарського засобу для підвищення HDL-C у пацієнта, який потребує цього.
7. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для одержання лікарського засобу для лікування атеросклерозу.
8. Спосіб підвищення HDL-C у пацієнта, який потребує цього, що включає введення терапевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі вказаному пацієнту.
9. Фармацевтична композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій.
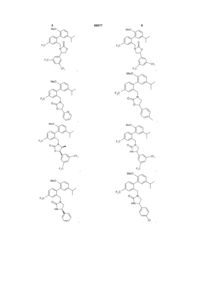
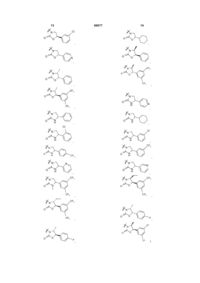
10. Сполука за п. 3, вибрана з наступних сполук або їх фармацевтично прийнятних солей:
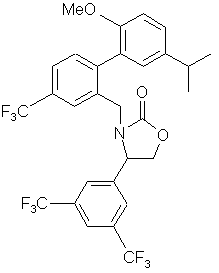 ,
, 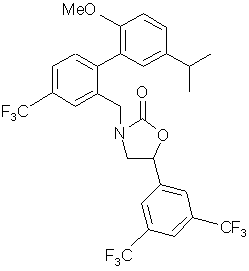 ,
,
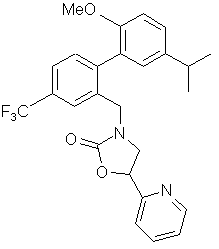 ,
,  ,
,
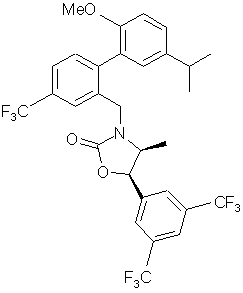 ,
, 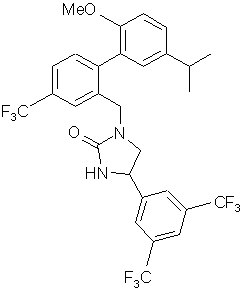 ,
,
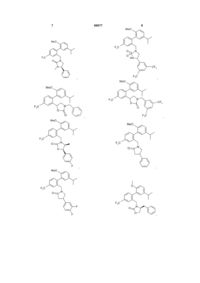
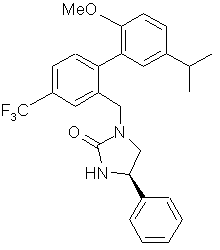 ,
, 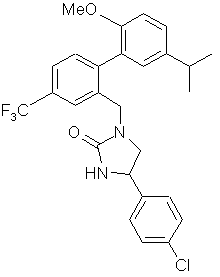 ,
,
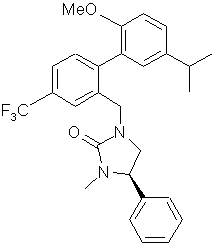 ,
, 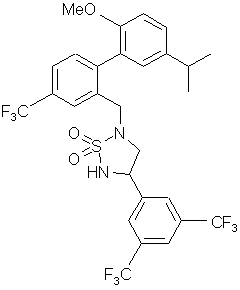 ,
,
 ,
,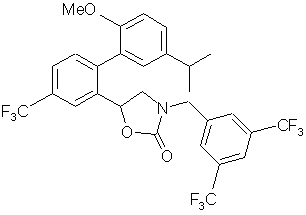 ,
,
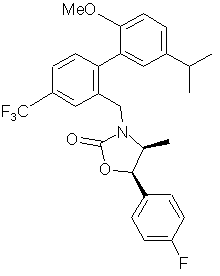 ,
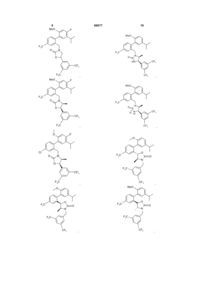
,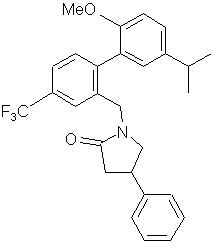 ,
,
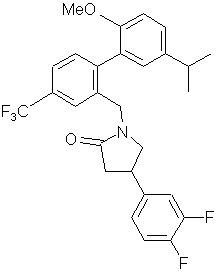 ,
,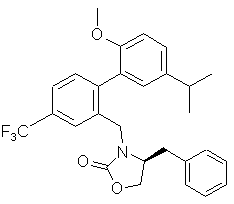 ,
,
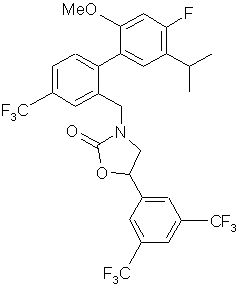 ,
,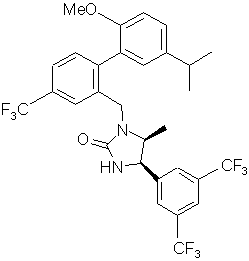 ,
,
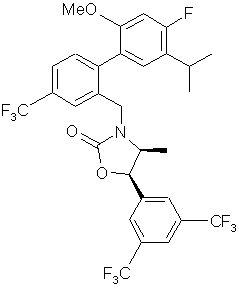 ,
,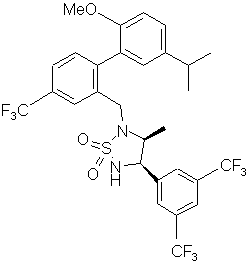 ,
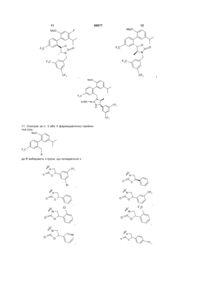
,
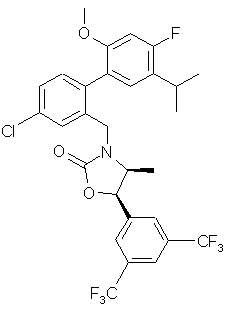 ,
,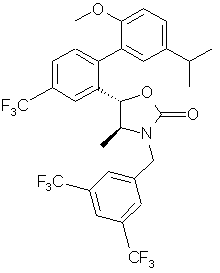 ,
,
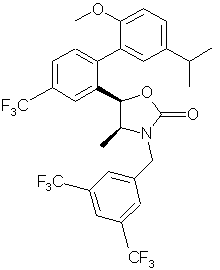 ,
,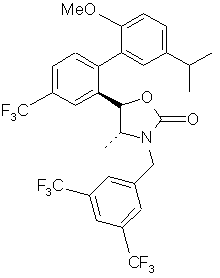 ,
,
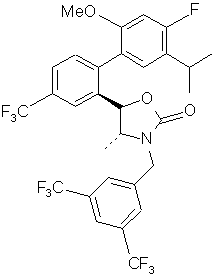 ,
,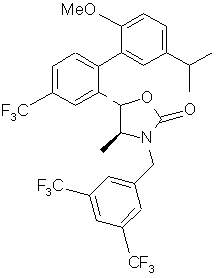 i
i
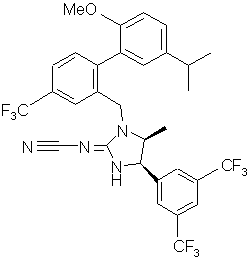 .
.
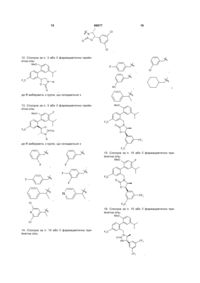
11. Сполука за п. 3 або її фармацевтично прийнятна сіль:
 ,
,
де R вибирають з групи, що складається з
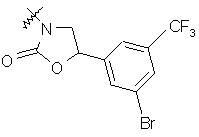 ,
,
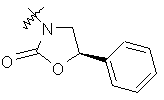 ,
,
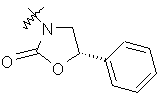 ,
,
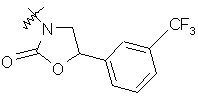 ,
,
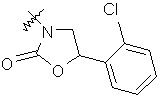 ,
,
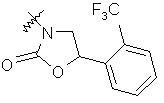 ,
,
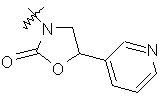 ,
,
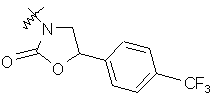 ,
,
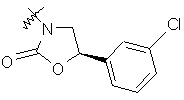 ,
,
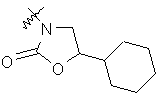 ,
,
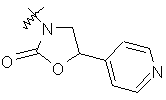 ,
,
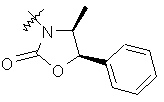 ,
,
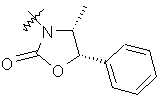 ,
,
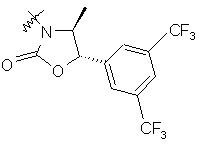 ,
,
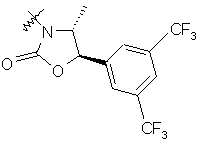 ,
,
 ,
,
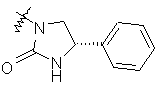 ,
,
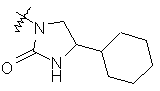 ,
,
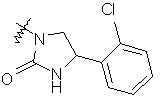 ,
,
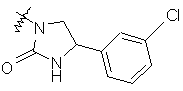 ,
,
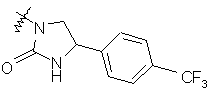 ,
,
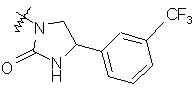 ,
,
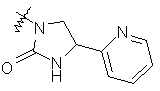 ,
,
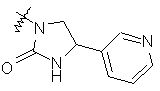 ,
,
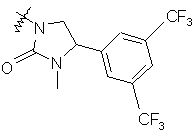 ,
,
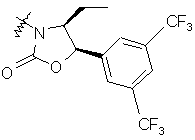 ,
,
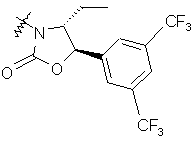 ,
,
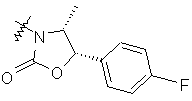 ,
,
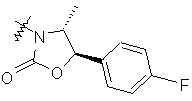 ,
,
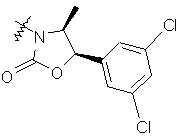 i
i
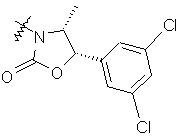 .
.
12. Сполука за п. 3 або її фармацевтично прийнятна сіль:
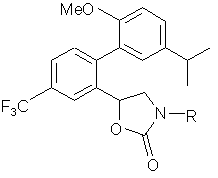 ,
,
де R вибирають з групи, що складається з
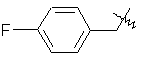 ,
,
 ,
,
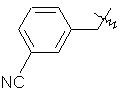 ,
,
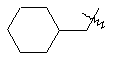 i
i
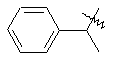 .
.
13. Сполука за п. 3 або її фармацевтично прийнятна сіль:
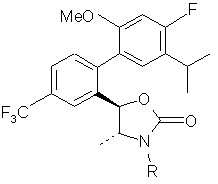 ,
,
де R вибирають з групи, що складається з
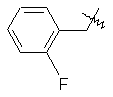 ,
,
 ,
,
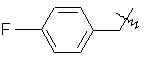 ,
,
 ,
,
 ,
,
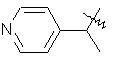 ,
,
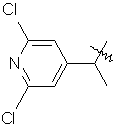 .
.
14. Сполука за п. 10 або її фармацевтично прийнятна сіль:
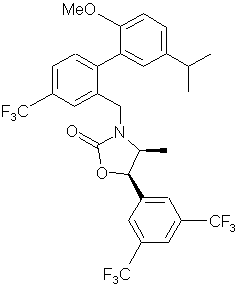 .
.
15. Сполука за п. 10 або її фармацевтично прийнятна сіль:
 .
.
16. Сполука за п. 10 або її фармацевтично прийнятна сіль:
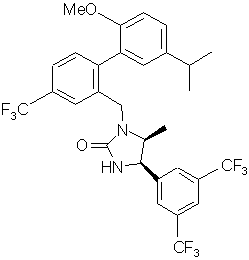 .
.
17. Сполука за п. 10 або її фармацевтично прийнятна сіль:
 .
.
18. Сполука за п. 10 або її фармацевтично прийнятна сіль:
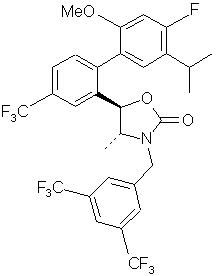 .
.
Текст
1. Сполука, що має формулу Іе, або її фармацевтично прийнятна сіль B Z (R)2C N X (Іе) C C H H 2 (19) 1 3 86077 4 С1-С4алкіл і -ОС1-С4алкіл необов'язково заміщені 4. Сполука за п. 3, що має формулу Іі, або її фар1-5 F; мацевтично прийнятна сіль n дорівнює 0 або 1; (Rb)q р являє собою ціле число від 0 до 2; і q являє собою ціле число від 0 до 3. 2. Сполука за п. 1, вибрана з групи, яка складається зі сполук, що мають формули If, Ig і Ih, або її фармацевтично прийнятна сіль (Ra)p R7 N O (Rb)q Z (R)2C N X H C C H (If) (Іі) R1 O R1 A2 (Rc)t A2 Z (R)2C N X H C C H (Rb)q R1 (Ig) , де R7 вибирають з групи, що складається з Сl і -CF3; Rc вибирають з групи, що складається з галогену, СН3, -CF3 і -CN; і t являє собою ціле число від 0 до 2. 5. Сполука за п. 3, що має формулу Ij, або її фармацевтично прийнятна сіль (Rc)t (Ra)p і (Ra)p (Rb)q (R)2C A2(C(R) N X C C H 2)n H R2 , де кожний з R1 і R2 незалежно вибирають з Н і -С1С5алкілу, де -С1-С5алкіл необов'язково заміщений 1-11 галогенами. 3. Сполука за п. 2, що має формули If, Ig і Ih, або її фармацевтично прийнятна сіль, де А2 вибирають з групи, що складається з фенілу, циклогексилу і піридилу, де А2 необов'язково заміщений 1-2 замінними групами, незалежно вибраними з галогену, -СН3, -CF3 і -CN; кожний Ra незалежно вибирають з групи, що складається з -CF3 і Сl; кожний Rb незалежно вибирають з групи, що складається з -С1-С3алкілу, -ОСН3 і F; кожний R1 і R2 незалежно вибирають з групи, що складається з Н і -С1-С2алкілу; X вибирають з групи, що складається з -О-, -NH-, N(CH3)- і -СН2-; Z вибирають з групи, що складається з -С(=О)-, S(O)2- і -C(=N-CN)-; n дорівнює 0 або 1; р дорівнює 1; і q дорівнює 2 або 3. (Ij) R1 O (Ih) Z N O R7 (Rb) , де R7 вибирають з групи, що складається з Сl і -CF3; Rc вибирають з групи, що складається з галогену, СН3, -CF3 і -CN; і t являє собою ціле число від 0 до 2. 6. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для одержання лікарського засобу для підвищення HDL-C у пацієнта, який потребує цього. 7. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для одержання лікарського засобу для лікування атеросклерозу. 8. Спосіб підвищення HDL-C у пацієнта, який потребує цього, що включає введення терапевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі вказаному пацієнту. 9. Фармацевтична композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. 10. Сполука за п. 3, вибрана з наступних сполук або їх фармацевтично прийнятних солей: q 5 86077 6 MeO MeO O O F3C N F3C O N O F3C CF3 CF3 F3C , , MeO MeO F3C N O F3C N O O O N , , MeO MeO F3C F3C N O O O N HN CF3 CF3 F3C F3C , , MeO MeO F3C O F3 C O N N HN HN , Cl , 7 86077 8 MeO MeO F3C O O F3C O N N S HN N CF3 N F3C , , MeO MeO N F3C N F3C CF3 O O O O F3C , , MeO MeO F3C N O F3C N O O F , , MeO O F3 C O N F F F3C O N O , 9 86077 MeO 10 F MeO F3C O N F3C N O O CF3 O HN CF3 F3C CF3 , MeO , F MeO F3C O N F3C N S O N H O O CF3 F3C CF3 CF3 , O , F O Cl O O F3C N O N O F3C CF3 F3C CF3 , O O F3C , MeO O F3C O O N N F3C F3C CF3 , CF3 , 11 86077 F MeO O F3C 12 MeO O F3C O O N N F3 C F3C CF3 CF3 , i MeO F3C N N N CF3 N H CF3 . 11. Сполука за п. 3 або її фармацевтично прийнятна сіль: MeO F3C R , де R вибирають з групи, що складається з CF3 N O N O O Br , CF3 N N O O , O O O , , F3C Cl N N O O O O , , N O N N O O , O CF3 , 13 86077 Cl N O 14 N O O O , , N N O O O N O , , CF3 N N O O O O CF3 , CF3 N O N O O CF3 N H , N N , N N H O , N H O , , Cl N N H O CF3 N O , N H O CF3 , CF3 N N O O CF3 N N H O , N , N N N H CF3 , O N CF3 , O O F Cl N N O , CF3 N O , CF3 N N H O N H O , N O Cl N O O F , O Cl i , 15 86077 16 Cl N O O Cl . 12. Сполука за п. 3 або її фармацевтично прийнятна сіль: MeO F Cl , F3C N O , R NC , O , де R вибирають з групи, що складається з i . 13. Сполука за п. 3 або її фармацевтично прийнятна сіль: MeO F MeO F 3C O O F3C O N O N R , де R вибирають з групи, що складається з CF3 F 3C . 15. Сполука за п. 10 або її фармацевтично прийнятна сіль: MeO F F , F , F F3C F F , O , N O N , CF3 , Cl F3C . 16. Сполука за п. 10 або її фармацевтично прийнятна сіль: N MeO Cl . 14. Сполука за п. 10 або її фармацевтично прийнятна сіль: F3C O N CF3 O HN CF3 . 17 86077 17. Сполука за п. 10 або її фармацевтично прийнятна сіль: O 18 F MeO F O F3C O N Cl O F3C N O CF3 CF3 . FC 3 . 18. Сполука за п. 10 або її фармацевтично прийнятна сіль: Даний винахід стосується класу хімічних сполук, які інгібують білок перенесення складного ефіру холестерину (СЕТР) і, отже, можуть знайти застосування для лікування і профілактики атеросклерозу. Атеросклероз і його клінічні наслідки, коронарна хвороба серця (CHD), інсульт і захворювання периферичних судин, безсумнівно, являють собою величезний тягар для системи охорони здоров'я промислово розвиненого світу. Тільки у Сполучених Штатах Америки діагноз CHD був поставлений приблизно 13 мільйонам пацієнтів, і кожного року більше півмільйона смертей пов'язано з CHD. Крім того, очікується, що дані втрати будуть зростати у наступній чверті століття, як продовжує зростати поширення ожиріння і діабету. Давно відомо, що у ссавців зміни профілів ліпопротеїну у системі кровообігу корелюють з ризиком появи атеросклерозу і CHD. Клінічний успіх інгібіторів HMG-CoA редуктази, особливо статинів, для зниження коронарних нападів базується на зниженні у системі кровообігу ліпопротеїну низької щільності-холестерину (LDL-C), рівень якого прямо корелює з підвищеним ризиком атеросклерозу. Пізніше епідеміологічні дослідження показали обернене взаємовідношення між ліпопротеїном високої щільності-холестерином (HDL-C) і атеросклерозом, що привело до висновку, що низькі сироваткові рівні HDL-C пов'язані з підвищеним ризиком виникнення CHD. Метаболічний контроль рівнів ліпопротеїну являє собою складний і динамічний процес, що включає множину факторів. Одним важливим метаболічним контролем в організмі людини є білок перенесення складного ефіру холестерину (СЕТР), глікопротеїну плазми крові, який каталізує рух складного ефіру холестерину з HDL у ліпопротеїни, що містять ароВ, зокрема VLDL [див. Hesler. СВ., et al. (1987) Purification and characterization of human plasma cholesteryl ester transfer protein. J. Biol. Chem. 262(5), 2275-2282]. У фізіологічних умовах чиста реакція являє собою гетерообмін, в якому СЕТР переносить тригліцерид до HDL від ароВ-ліпопротеїнів і транспортує складний ефір холестерин}- від HDL до ароВ-ліпопротеїну. У людини СЕТР грає роль зворотного транспорту холестерину, процесу, за допомогою якого холестерин повертається у печінку з периферичних тканин. Примітно, що багато тварин не володіють СЕТР, включаючи тварин, які мають високі рівні HDL, і, як відомо, резистентні до коронарної хвороби серця, таких як гризуни [див. GuyardDangremont, V., et al., (1998) Phospholipid i cholesteryl ester transfer activities in plasma from 14 vertebrate species. Relation to atherogenesis susceptibility, Сотр. Biochem. Physiol. У Biochem. Моl. Biol. 120(3), 517-525]. Були проведені численні епідеміологічні дослідження, що корелюють вплив природних варіацій в активності СЕРТ по відношенню до ризику коронарної хвороби серця, включаючи дослідження невеликого числа відомих нульових мутацій людини [див. Hirano, K.-I., Yamashita, S. and Matsuzawa, Y. (2000) Pros and cons of inhibiting cholesteryl ester transfer protein, Curr. Opin. Lipidol. 11(6), 589-596]. Дані дослідження чітко продемонстрували зворотну кореляцію між концентрацією HDL-C у плазмі крові і активністю СЕРТ [див. Inazu, Α., et al. (2000) Cholesteryl ester transfer protein and atherosclerosis, Curr. Opin. Lipidol. 11(4), 389-396], що привело до появи гіпотези, що фармакологічне інгібування активності СЕРТ-ліпідного перенесення може виявитися сприятливим для людей за рахунок підвищення рівнів HDL-C при зниженні рівнів LDL. Незважаючи на значний терапевтичний успіх, що представляють статини, такі як симвастатин (ZOCOR®), при лікуванні і профілактиці атеросклерозу і подальших випадків атеросклеротичного захворювання статини дозволяють досягти зниження ризику приблизно на одну третину. У наш час доступно декілька фармакологічних методів лікування, які позитивно підвищують рівні HDL 19 86077 20 C у системі кровообігу. Деякі статини та інші фіб(b) фенільного кінця, конденсованого з 5-7 рати дають можливість обмеженого приросту HDLчленним неароматичним циклоалкільним кільцем, C. Недоліком ніацину, який забезпечує більш ефеяке необов'язково включає 1-2 подвійних зв'язки; ктивне лікування для підвищення рівнів HDL-C, що (c) 5-6-членного гетероциклічного кільця, що було підтверджено клінічно, є несхвалення пацієнмістить 1-4 гетероатоми, незалежно вибрані з N, S, тів, що пов'язано з побічними діями, такими як О і -N(O)-, і необов'язково також включає 1-3 поприпливи крові. Агент, який безпечно і ефективно двійних зв'язки і карбонільну групу, де місце приєпідвищує рівні HDL холестерину може бути рішенднання А3 до фенільного кільця, до якого приєднаням важливої, але все ще не задоволеної потреби ний А3, являє собою атом вуглецю; і медицини, пропонуючи засоби фармакологічної (d) бензогетероциклічного кільця, що включає терапії, які можуть значно поліпшити профілі ліпіфенільне кільце, конденсоване з 5-6-членним гедів у системі кровообігу за рахунок механізму, який тероциклічним кільцем, що має 1-2 гетероатоми, буде комплементарний існуючим методам лікунезалежно вибрані з О, N і S, і необов'язково тавання. кож має 1-2 подвійних зв'язки (на додаток до поНові класи хімічних сполук, які інгібують СЕТР, двійного зв'язку конденсованого фенільного кільдосліджуються у декількох фармацевтичних комця), де місце приєднання А3 до фенільного кільця, паніях або знаходяться на стадії клінічних випродо якого приєднаний A3, являє собою атом вуглебувань. У наш час на ринку немає інгібіторів СЕТР. цю; Необхідні нові сполуки для того, щоб можна було А2 вибирають з групи, що складається з: виявити одну або декілька фармацевтичних спо(a)ароматичного кільця, вибраного з фенілу і лук, які були б безпечними і ефективними. Описані нафтилу; у даній заявці сполуки являють собою дуже сильні (b) фенільного кінця, конденсованого з 5-7 інгібітори СЕТР. членним неароматичним циклоалкільним кільцем, Сполуки, які мають формулу І, включаючи фаяке необов'язково включає 1-2 подвійних зв'язки; рмацевтично прийнятні солі сполук, являють со(c) 5-6-членного гетероциклічного кільця, що бою інгібітори СЕТР, що виявляють описані далі містить 1-4 гетероатоми, незалежно вибрані з N, S, корисні властивості: О і -N(O)-, і необов'язково також включає 1-3 подвійних зв'язки і карбонільну групу; (d) бензогетероциклічного кільця, що включає фенільне кільце, конденсоване з 5-6-членним геI тероциклічним кільцем, що має 1-2 гетероатоми, незалежно вибрані з О, N і S, і необов'язково також має 1-2 подвійних зв'язки (на додаток до подвійного зв'язку конденсованого фенільного кільУ сполуках формули І, ця); Υ вибирають з -С(=О) і -(CRR1)-; (e) -С3-С8циклоалкільного кільця, що необов'яX вибирають з -О-, -ΝΗ-, -N(С1-С5алкiл)- і зково має 1-3 подвійних зв'язки; 6 (CRR )-; де кожний з A3 і А2 необов'язково заміщений 1Ζ вибирають з -С(=О)-, -S(O)2- і -C(=N-R9)-, де 5 замінними групами, незалежне вибраними з Ra; R9 вибирають з групи, що складається з Н, -CN і Кожний Ra незалежно вибирають з групи, що С1-С5алкіл необов'язково заміщений 1-11 галогескладається з -С1-С6алкілу, -С2-С6алкенілу, -С2нами; С6алкінілу, -С3-С8циклоалкілу, що необов'язково Кожний R незалежно вибирають з групи, що має 1-3 подвійних зв'язки, -О-С1-С6алкілу, -ОС2складається з Н, -С1-С5алкілу і галогену, де -С1С6алкенілу, -ОС2-С6алкінілу, -ОС3-С8циклоалкілу, С5алкіл необов'язково є заміщеним 1-11 галогенащо необов'язково має 1-3 подвійних зв'язки, ми; С(=О)С1-С6алкілу, -С(=О)С3-С8 циклоалкілу, 1 2 В вибирають з групи, що складається з А і А , С(=О)Н, -СО2Н, -СО2С1-С6алкілу, -C(=O)SС1де А1 має структуру: С6алкілу, -NR3R4, -C(O)NR3R4, -NR3C(=O)OС1С6алкілу, -NR3C(=O)NR3R4, -S(O)xС1-С6алкілу, S(O)yNR3R4, -NR3S(O)yNR3R4, галогену, -CN, -NO2 і 5-6-членного гетероциклічного кільця, що містить 1-4 гетероатоми, незалежно вибрані з N, S і О, кожний з R1 і R6 незалежно вибирають з Н, -С1вказане гетероциклічне кільце також необов'язкоС5алкілу, галогену і -(C(R)2)nA2, де -С1-С5алкіл нево містить карбонільну групу і також необов'язково обов'язково є заміщеним 1-11 галогенами; 2 включає 1-3 подвійних зв'язки, де місце приєднанR вибирають з групи, що складається з Н, -С1ня вказаного гетероциклічного кільця до приєднуС5алкілу, галогену, А і -(C(R)2)nA2, де -С1-С5алкіл ваного кільця являє собою атом вуглецю, де вканеобов'язково є заміщеним 1-11 галогенами; зане гетероциклічне кільце необов'язково де один з В і R2 являє собою А1; і один з В, R1, заміщене 1-5 замінними групами, незалежно вибR2 і R6 являє собою А2 або -(C(R)2)nA2; так що спораними з галогену, -С1-С3алкілу і -ОС1-С3алкілу, де лука формули І включає одну групу А1 і одну групу -С1-С3алкіл і -ОС1-С3алкіл необов'язково заміщені А2; 1-7 галогенами; A3 вибирають з групи, що складається з: де для сполук, в яких Ra вибирають з групи, (a) ароматичного кільця, вибраного з фенілу і що складається з -С1-С6алкілу, -С2-С6алкенілу, -С2нафтилу; С6алкінілу, -С3-С8циклоалкілу, що необов'язково має 1-3 подвійних зв'язки, -ОС1-С6алкілу, -ОС2 21 86077 22 С6алкенілу, -ОС2-С6алкінілу, -ОС3-С8циклоалкілу, що необов'язково має 1-3 подвійних зв'язки, С(=О)С1-С6алкілу, -С(=О)С3-С8циклоалкілу, Ic СО2С1-С6алкілу, -C(=O)SС1-С6алкілу, NR3C(O)OС1-С6алкілу і -S(OxС1-С6алкілу, Ra необов'язково заміщений 1-15 галогенами і необов'язково також заміщений 1-3 замінними групами, Інші сполуки даного винаходу мають структуру незалежно вибраними з (а) -ОН, (b) -CN, (c) 3 4 формули Id або її фармацевтично прийнятної солі NR R , (d) -C3-C8 циклоалкілу, що необов'язково має 1-3 подвійних зв'язки і необов'язково заміщений 1 -15 галогенами, (e) ОС1-С4алкілу, необов'язково заміщеного 1-9 галогенами і також необов'язId ково заміщеного 1-2 замінними групами, незалежно вибраними з ОС1-С2алкілу, (f) -OC3C8циклоалкілу, що необов'язково має 1-3 подвійних зв'язки і необов'язково заміщений 1-15 галогеУ багатьох сполуках формули І, la, Ib, Іс і Id, і нами, (g) -CO2H, (h) -C(=O)CH3 і (і) -СО2С1їх фармацевтично прийнятних солях С4алкілу, який необов'язково заміщений 1-9 галоА являє собою феніл, який необов'язково є генами; заміщеним 1-4 замінними групами Ra, де Ra незаза умови, що коли В являє собою А1, X і Υ явлежно вибирають з -С1-С5алкілу, -ОС1-С3алкілу, ляють собою -СН2-. Ζ являє собою -С(=О)-, R2 явCO2С1-С3алкілу, -СО2Н. галогену, -NR3R4, ляє собою А2, і А2 являє собою феніл, який має C(=O)С1-С3алкілу, -С(=O)Н, -C(=O)NR3R4, -SС1замісник Ra в 4-положенні, де Ra являє собою С3алкілy, -С2-С3 алкенілу, -CN, -NO2 і 1,2,4ОС1-С6алкіл, який необов'язково заміщений 1-11 оксадіазолілу, де -С1-С3алкіл і -С1-С5алкіл у всіх галогенами, то немає інших замісників Ra в А2, де випадках необов'язково заміщені 1-6 замісниками, ці Ra вибирають з -ОС1-С6алкілу, -ОС2-С6алкенілу, незалежно вибраними з 1-5 галогенів і однієї -ОН -ОС2-С6алкінілу і -ОС3-С8циклоалкілу, що необогрупи; і -С2-С3 алкеніл необов'язково заміщений 1в'язково має 1-3 подвійних зв'язки; 3 галогенами. n дорівнює 0 або 1; У багатьох сполуках формули І, la, Ib. Іс і Id, і p являє собою ціле число від 0 до 4: їх фармацевтично прийнятних солях x дорівнює 0, 1 або 2; А вибирають з групи, що складається з фенілу, у дорівнює 1 або 2; циклогексилу і гетероциклічного 5-6-членного кількожний з R3 і R4 незалежно вибирають з Н, -С1ця, що включає 1-2 гетероатоми, які незалежно С5алкілу. -С(=О)С1-С5алкілу і -S(O)yС1-С5алкілу, де вибрані з О, N, S і -N(O)- і також необов'язково -С1-С5алкіл у всіх випадках необов'язково заміщевключають 1-3 подвійних зв'язки, де А2 необов'язний 1-11 галогенами; і 5 ково заміщений 1-2 замінними групами, незалежно R вибирають з групи, що складається з Н, вибраними з -С1-С4алкілу, -ОС1-С3алкілу, -NO2, ОН, -С1-С5алкілу і галогену, де -С1-С5алкіл необоCN, -S(O)xС1-С3алкілу, -NHS(O)2С1-С3алкілу, в'язково заміщений 1-11 галогенами. NR3R4, -NR3C(=O)R4, -C2-C3алкенілу, -C(=O)NR3R4, Багато сполук даного винаходу мають струкгалогену і піридилу, де С1-С3алкіл, С1-С4алкіл, і С2туру, що відповідає формулі Іа, наведеній нижче, С3алкеніл у всіх випадках необов'язково заміщені або її фармацевтично прийнятній солі 1-3 галогенами, за умови, що для сполук формули Іа, коли X і Υ являють собою СН2, Ζ являє собою (С=O)-, n дорівнює 0, і А2 являє собою феніл, тоді число груп Ra, що містяться в А2, які вибирають з Ia ОС1-С3алкілу, дорівнює 0 або 1. У багатьох сполуках формули І, la, Ib, Іс і Id, і їх фармацевтично прийнятних солях кожний з R3 і R4 незалежно вибирають з Η і Багато сполук даного винаходу мають струкС1-С3алкілу. туру формули Іb або її фармацевтично прийнятної о солі У багатьох сполуках формули І, la, Ib, Іс і Id, і їх фармацевтично прийнятних солях ρ дорівнює 02. У підгрупах сполук формули І, включаючи їх фармацевтично прийнятні солі, А1 являє собою Ib Багато інших сполук мають структуру формули Іс або її фармацевтично прийнятної солі де кожний з R7 і R8 незалежно вибирають з групи, що складається з Н, галогену, -NR3R4, -С1С3алкілу, -ОС1-С3алкілу, -CN, -NO2 і піридилу, де у всіх випадках С1-С3алкіл необов'язково заміщений 1-3 галогенами. 23 86077 24 У підгрупах сполук формули І, включаючи їх фармацевтично прийнятні солі, А2 вибирають з групи, що складається з фенілу, піридилу і циклогексилу, де А2 необов'язково заміщений 1-2 замісниками, незалежно вибраними з -С1-С4алкілу, R1 вибирають з групи, що складається з Н, -С1ОС1-С4алкілу. -NO2, -CN і галогену, де С1-С4алкіл у С5алкілу і -(C(R)2)nA2, де -С1-С5алкіл необов'язково всіх випадках необов'язково заміщений 1-3 галозаміщений 1-11 галогенами; генами, за умови, що для сполук формули Іа, якщо R2 вибирають з групи, що складається з Н, -С1X і Υ являють собою СH2, Ζ являє собою -(С=О)-, і С5алкілу, А і -(C(R)2)nA2, де С1-С5алкіл необов'язА2 являє собою феніл, то число груп Rd, що місково заміщений 1-11 галогенами; тяться в А2, які вибирають з ОС1-С4алкіл), необоКоли один з В і R2 являє собою А1; і один з В, в'язково заміщеного 1-3 галогенами, дорівнює 0 R1 і R2 являє собою А2 або -(C(R)2)nA2; так що споабо 1. лука формули Іе включає одну групу А1 і одну груВ інших підгрупах А2 необов'язково заміщений пу А2; 1-2 замінними групами, незалежно вибраними з А2 вибирають з групи, що складається з фенігалогену, -С1-С4алкілу і -CN, де -С1-С4алкіл необолу, циклогексилу і піридилу, де А2 необов'язково в'язково заміщений 1-3 галогенами. заміщений 1-2 замінними групами, незалежно виУ багатьох варіантах здійснення винаходу, як браними з галогену, -С1-С4алкілу і -CN, де -С1описано вище, включаючи їх фармацевтично приС4алкіл необов'язково заміщений 1-3 галогенами; йнятні солі Кожний Ra незалежно вибирають з групи, що А1 являє собою складається з -С1-С3алкілу і галогену, де -С1 де R7 вибирають з Н, галогену, -NR3R4, -C1C3алкілу, -ОC1-C3алкілу, -CN, -NO2 і піридилу, де у всіх випадках C1-C3алкіл необов'язково заміщений 1-3 галогенами; і R8 вибирають з групи, що складається з Н, галогену, -СН3, -CF3, -OCH3 і -OCF3. У багатьох переважних варіантах здійснення винаходу, А3 являє собою феніл, який заміщений 1-3 замісниками, незалежно вибраними з С1С4алкілу, ОС1-С4алкілу. -CN, СІ, F, -C(=O)CH3, CH=CH2, -CO2H, -CO2CH3, -S-CH3, -S(O)CH3, S(O)2CH3, і -C(=O)NR3R4, де С1-С4алкіл і ОС1С4алкіл необов'язково заміщені 1-5 F замісниками і необов'язково також заміщені однією групою -ОН. В інших варіантах здійснення, А3 являє собою феніл, який заміщений 1-3 замісниками, незалежно вибраними з групи, що складається з СІ, F, -С1С4алкілу і -ОС1-С4алкілу, де -С1-С4алкіл і -ОС1С4алкіл необов'язково заміщені 1-5 F. Переважна підгрупа сполук має формулу Іе, включаючи їх фармацевтично прийнятні солі С3алкіл необов'язково заміщений 1-3 галогенами; Кожний Rb незалежно вибирають з групи, що складається з СІ, F, -С1-С4алкілу і -ОС1-С4алкілу, де -С1-С4алкіл і -ОС1-С4алкіл необов'язково заміщені 1-5 F; n дорівнює 0 або 1; p являє собою ціле число від 0 до 2; і q являє собою ціле число від 0 до 3. Підгрупи сполук, що мають формулу Іе, включають сполуки формули If, Ig і In і їх фармацевтично прийнятні солі. If Ig i Ie Ih У сполуках формули Іе, X вибирають з групи, що складається з -О-, -ΝΗ-, -N(С1-С5алкіл)-і-(СН2)-; Ζ вибирають з групи, що складається з -С(=О), -S(O)2-, і -C(=N-R9)-, де R9 вибирають з групи, що складається з Н, -CN і С1-С5алкілу, необов'язково заміщеного 1-11 галогенами; Кожний R незалежно вибирають з групи, що складається з Η і -СН3; В вибирають з групи, що складається з А1 і А2, де А1 має структуру: У сполуках формули If, Ig і Ih кожний з R1 і R2 незалежно вибирають з Η і -С1-С5алкілу, де -С1С5алкіл необов'язково заміщений 1-11 галогенами. У підгрупах описаних вище сполук А2 може бути вибраний з групи, що складається з фенілу, циклогексилу і піридилу, де А2 необов'язково заміщений 1-2 замінними групами, незалежно вибраними з галогену, -СН3, -CF3 і -CN. У підгрупах описаних вище сполук кожний Ra незалежно вибирають з групи, що складається з CF3 і СІ. 25 86077 26 У підгрупах описаних вище сполук кожний R бутил, пентил, гексил, гептил, октил, ноніл і тому незалежно вибирають з групи, що складається з подібні. С1-С3алкілу -ОСН3 і F. «Алкіленові» групи являють собою алкільні У підгрупах описаних вище сполук кожний R1 і групи, які є дифункціональними, а не монофункціR2 незалежно вибирають з групи, що складається ональними. Наприклад, метил являє собою алкіз Η і -С1-С2алкілу. льну групу, і метилен (-СН2-) являє собою відповіУ підгрупах описаних вище сполук X вибирадну алкіленову групу. ють з -О-, -ΝΗ-, -N(CH3)- і -СН2-. Термін "алкеніл" означає вуглецеві ланцюги, У підгрупах описаних вище сполук Ζ вибираякі містять принаймні один подвійний зв'язок вугють з групи, що складається з -С(=О)-, -S(O)2- і лець-вуглець, і які можуть бути лінійними або розC(=N-CN)-. галуженими або їх комбінаціями. Приклади алкеУ підгрупах описаних вище сполук n дорівнює нілy включають вініл, аліл, ізопропеніл, пентеніл, 0 або 1. гексеніл, гептеніл, 1-пропеніл, 2-бутеніл, 2-метилУ підгрупах описаних вище сполук p дорівнює 2-бутеніл і тому подібні. 1. Термін "алкініл" означає вуглецеві ланцюги, які У підгрупах описаних вище сполук q дорівнює містять принаймні один потрійний зв'язок вуглець2 або 3. вуглець, і які можуть бути лінійними або розгалуПідгрупа визначених раніше сполук включає женими або їх комбінаціями. Приклади алкінілу сполуки, що мають формулу Іі, і їх фармацевтично включають етиніл, пропаргіл, 3-метил-1-пентиніл, прийнятні солі. 2-гептиніл і тому подібні. Термін "циклоалкіл" означає насичене карбоциклічне кільце, що має від 3 до 8 атомів вуглецю, якщо не вказано іншого (наприклад, циклоалкіл може бути визначений як такий, що має один або декілька подвійних зв'язків). Термін також включає Ii циклоалкільне кільце, конденсоване з арильною групою. Приклади циклоалкілу включають циклопропіл, циклопентил, циклогексил, циклогептил і тому подібні. Термін "циклоалкеніл" означає неароматичне карбоциклічне кільце, що має один або декілька подвійних зв'язків. У формулі Іі R7 вибирають з групи, що складаТермін «арил» (і «арилен»), коли він викорисється з СІ і -CF3; товується для опису замісника або групи у струкc R вибирають з групи, що складається з галотурі, означає моноциклічну або біциклічну сполуку, гену, -СН3 -CF3 і -CN; і t являє собою ціле число від в якій кільця є ароматичними і яка містить тільки 0 до 2. Інші групи є такими, як визначено раніше. кільцеві атоми вуглецю. Термін «арил» також моПідгрупа визначених раніше сполук включає же стосуватися арильної групи, яка є конденсовасполуки, що мають формулу Ij, або їх фармацевною з циклоалкілом або гетероциклом. Переважні тично прийнятні солі. «арили» являють собою феніл і нафтил. Феніл звичайно являє собою найбільш переважну арильну групу. "EDC" являє собою 1-етил-3-(3диметиламінопропіл)карбодиімід. Ij Терміни "гетероцикліл", "гетероцикл" і "гетероциклічний" означають повністю або частково насичене або ароматичне 5-6-членное кільце, що містить 1-4 гетероатоми, незалежно вибрані з N, S і О, якщо не вказано іншого. "Бензогетероцикл" являє собою фенільне кіУ формулі Ij R7 вибирають з групи, що складальце, конденсоване з 5-6-членним гетероциклічється з СІ і -CF3; ним кільцем, що має 1-2 гетероатоми, кожний з Rc вибирають з групи, що складається з галояких являє собою О, N або S, де гетероциклічне гену, -СН3 -CF3 і -CN; і t являє собою ціле число від кільце може бути насиченим або ненасиченим. 0 до 2. Інші групи є такими, як визначено раніше. Приклади включають індол, бензофуран, 2,3Визначення дигідробензофуран і хінолін. "Ас" являє собою ацетил, який являє собою "DIPEA" являє собою діізопропілетиламін. СН3С(=О)-. "Галоген" включає фтор, хлор, бром і йод. Термін "алкіл" означає насичені вуглецеві ла"НОВТ" являє собою 1-гідроксибензотриазол. нцюги, які можуть бути лінійними або розгалуже"ІРАС" являє собою ізопропілацетат. ними або їх комбінацією, якщо вуглецевий ланцюг "Me" являє собою метил. не визначений інакше. Інші групи, що мають пре"Амін Вейнреба" являє собою N,Oфікс «алк», такі як «алкокси» і «алканоїл» також диметилгідроксиламін. можуть бути лінійними або розгалуженими або їх Мається на увазі, що термін «композиція», як у комбінацією, якщо вуглецевий ланцюг не визначевипадку фармацевтичної композиції, охоплює ний інакше. Приклади алкільних груп включають продукт, що включає активний(і) інгредієнт(и) та метил, етил, пропіл, ізопропіл, бутил, втор- і третінертний інгредієнт, який складає носій, а також 27 86077 28 будь-який продукт, який виникає, прямо або опонів, заміщених амінів, включаючи природні замісередковано, при об'єднанні, комплексоутворенні щені аміни, циклічних амінів та іонообмінних смол, або агрегації двох або більше інгредієнтів або при таких як аргінін, бетаїн, кафеїн, холін, Ν,Ν'дисоціації одного або більше інгредієнтів або внадибензилетилендіамін, діетиламін, 2слідок інших типів реакцій або взаємодій одного діетиламіноетанол, 2-диметиламіноетанол. етаноабо декількох інгредієнтів. Відповідно фармацевламін, етилендіамін, N-етилморфолін, Νтичні композиції за даним винаходом охоплюють етилпіперидин, глюкамін, глюкозамін, гістидин, будь-яку композицію, одержану змішуванням спогідрабрамін, ізопропіламін, лізин, метилглюкамін, луки за даним винаходом і фармацевтично прийнморфолін, піперазин, піперидин, поліамінні смоли, ятного носія. прокаїн, пурини, теобромін, триетиламін, триметиЗамісник «тетразол» означає замінну групу ламін, трипропіламін, трометамін і тому подібні. 2Н-тетразол-5-іл і її таутомери. Коли сполуки за даним винаходом є основниОптичні ізомери - діастереомери - геометричні ми, солі можуть бути одержані з фармацевтично ізомери - таутомери прийнятних нетоксичних кислот, включаючи неорСполуки формули І можуть містити один або ганічні і органічні кислоти. Такі кислоти включають більше асиметричних центрів і можуть існувати у оцтову, бензолсульфонову, бензойну, камфорсувигляді рацематів, рацемічних сумішей, окремих льфонову. лимонну, етансульфонову, фумарову, енантіомерів, діастереомерних сумішей та індивіглюконову, глутамінову, бромистоводневу, хлоридуальних діастереомерів. Мається на увазі, що стоводневу, ізетіонову, молочну, малеїнову, яблуданий винахід охоплює всі такі ізомерні форми чну, мигдалеву, метансульфонову, слизову, азотсполук формули І. Якщо структури зображені у ну, памову, пантотенову, фосфорну, бурштинову, стереохімічному представленні, то вони також сірчану, винну, п-толуолсульфонову кислоту і тому включають інші стереохімічні структури, такі як подібні. Особливо переважними є лимонна, броенантіомери, інші діастереоізомери (де можливі мистоводнева, хлористоводнева, малеїнова, фодіастереоізомери) і суміші енантіомерів і/або діассфорна, сірчана і винна кислоти. тереомерів, включаючи рацемічні суміші. Потрібно розуміти, що як використано у даноДеякі описані тут сполуки можуть містити олему описі, мається на увазі, що посилання на спофінові подвійні зв'язки, і, якщо не вказано іншого, луки формули І також включають посилання на їх мається на увазі, що вони включають як Е, так і Ζ фармацевтично прийнятні солі. геометричні ізомери. Метаболіти-проліки Деякі описані тут сполуки можуть існувати у Терапевтично активні метаболіти, коли самі вигляді таутомерів. Прикладом є кетон і його енометаболіти потрапляють в об'єм заявленого винальна форма, що відомо як кето-енольна таутомеходу, також являють собою сполуки за даним вирія. Сполуки формули І охоплюють індивідуальні находом. Проліки, які являють собою сполуки, що таутомери, а також їх суміші. перетворюються у заявлені сполуки при введенні Сполуки формули І, що мають один або більпацієнту або після введення пацієнту, також являше асиметричних центрів, можуть бути розділені ють собою сполуки за даним винаходом. на діастереоізомери, енантіомери і тому подібне, Застосування методами, добре відомими у даній галузі. Сполуки за даним винаходом являють собою Альтернативно, енантіомери та інші сполуки з сильні інгібітори СЕТР. Отже, вони можуть викорихіральними центрами можуть бути синтезовані стовуватися при лікуванні захворювань і станів, які шляхом стереоспецифічного синтезу з викориспіддаються лікуванню інгібіторами СЕТР. танням оптично чистих вихідних речовин і/або реаОдин аспект даного винаходу стосується спогентів відомої конфігурації. собу лікування або зниження ризику розвитку заДеякі з біфенільних і біарильних сполук у дахворювання або стану, який піддається лікуванню ному описі спостерігаються у спектрі ЯМР у вигляабо профілактиці за допомогою інгібування СЕТР, ді суміші атропоізомерів (ротамери). Сполуки за шляхом введення терапевтично ефективної кільданим винаходом охоплюють індивідуальні атрокості сполуки за даним винаходом пацієнту, який поізомери, а також їх суміші. потребує лікування. Пацієнт являє собою людину Солі або ссавця і найчастіше людину. Термін «терапевТермін «фармацевтично прийнятні солі» стотично ефективна кількість» являє собою кількість сується солей, одержаних з фармацевтично присполуки, яка є ефективною для одержання бажайнятних нетоксичних основ і кислот, включаючи ного клінічного результату при лікуванні конкретнеорганічні або органічні основи і неорганічні або ного захворювання. органічні кислоти. Солі, одержані з неорганічних Захворювання або стани, які можна лікувати основ, включають солі алюмінію, амонію, кальцію, за допомогою сполук за даним винаходом, або міді, двовалентного заліза, тривалентного заліза, ризик розвитку яких у пацієнта може знизитися літію, магнію, тривалентного марганцю, двоваленвнаслідок лікування сполуками за даним винахотного марганцю, калію, натрію, цинку і тому подібдом, включають: атеросклероз, периферичні суного. Особливо переважними є солі амонію, кальдинні захворювання, дисліпідемію, гіпербеталіпопцію, магнію, калію і натрію. Солі у твердому ротеїнемію, гіпоальфаліпопротеїнемію, вигляді можуть існувати у вигляді більш ніж однієї гіперхолестеринемію, гіпертригліцеридемію, спадкристалічної структури і також можуть бути у викову гіперхолістеринемію, серцево-судинні поругляді гідратів. Солі, одержані з фармацевтично шення, стенокардію, ішемічну хворобу, ішемічну прийнятних органічних і нетоксичних основ, вклюхворобу серця, інсульт, інфаркт міокарда, реперчають солі первинних, вторинних і третинних аміфузійне пошкодження, ангіопластичний рестеноз, 29 86077 30 гіпертензію, судинні ускладнення при діабеті, ожикислоти і органічні основи або кислоти. Фармацевріння і ендотоксемію. тична композиція також може включати проліки Очікується, що сполуки за даним винаходом або їх фармацевтично прийнятну сіль, якщо ввобудуть особливо ефективні для підвищення HDL-C дять проліки. Фармацевтична композиція також і/або збільшення співвідношення HDL-C до LDL-C. може складатися по суті зі сполуки формули І і Такі зміни у концентраціях HDL-C і LDL-C можуть фармацевтично прийнятного носія без інших лібути сприятливими для лікування атеросклерозу, карських інгредієнтів. зниження або зміни у зворотний бік процесу розКомпозиції включають композиції, придатні витку атеросклерозу, зниження ризику розвитку для перорального, ректального, зовнішнього, паатеросклерозу або запобігання виникненню атерорентерального (включаючи підшкірне, внутрішсклерозу. ньом'язове і внутрішньовенне), очного (офтальмоВведення і діапазони дозування логічного), легеневого (назальна або букальна Для забезпечення ссавця, особливо людини, інгаляція) або назального введення, хоча найефективною дозою сполуки за даним винаходом більш придатний шлях введення у будь-якому конможна використовувати будь-який придатний кретному випадку буде залежати від природи і шлях введення. Наприклад, можна використовуватяжкості стану, що піддається лікуванню, і від прити пероральний. ректальний, зовнішній, парентероди активного інгредієнта. Вони можуть зручним ральний, очний, легеневий, назальний і тому подічином існувати у вигляді одиничних препаративбні шляхи введення. Препаративні лікарські них лікарських форм і можуть бути одержані будьформи включають таблетки, пілюлі, дисперсії, суяким зі способів, добре відомих у галузі фармацеспензії, розчини, капсули, креми, мазі, аерозолі і втики. тому подібні. Переважно сполуки формули І ввоПри практичному використанні сполуки фордять перорально. мули І можна об'єднувати у вигляді однорідної Ефективне дозування використовуваного аксуміші активного інгредієнта з фармацевтичним тивного інгредієнта може змінюватися в залежносносієм відповідно до звичайних методів фармацеті від конкретної використовуваної сполуки, спосовтичного компаундування. Носій може приймати бу введення, стану, що піддається лікуванню, і множину видів в залежності від форми препарату, тяжкості стану, що піддається лікуванню. Таке донеобхідної для введення, наприклад, пероральнозування легко може бyти встановлене фахівцем у го або парентерального (включаючи внутрішньоданій галyзі. венне). При одержанні композицій для пероральПри лікуванні захворювань, для яких признаних препаративних лікарських форм, можна чені сполуки формули І, загальні задовільні ревикористовувати будь-яке зі звичайних фармацевзультати одержують у тому випадку, коли сполуки тичних середовищ, таких як, наприклад, вода, гліза даним винаходом вводять у добовій дозі від колі, масла, спирти, ароматизатори, консерванти, приблизно 0,01 міліграма до приблизно 100 мілігбарвники і тому подібні у випадку пероральних рамів на кілограм ваги тіла тварини або людини, рідких препаратів, таких як, наприклад, суспензії, що переважно вводиться у вигляді разової добової еліксири і розчини, або носії, такі як крохмалі, цукдози або у вигляді розділених доз від двох до шесри, мікрокристалічна целюлоза, розріджувачі, грати разів на день, або у вигляді форми з уповільненулюючі агенти, змащувальні речовини, зв'язуваним вивільненням. У випадку дорослої людини льні речовини, дезінтегруючі агенти і тому подібні вагою 70 кілограмів, загальна добова доза звичайу випадку пероральних твердих препаратів, таких но буде складати приблизно від 0,5 міліграма до як. наприклад, порошки, тверді і м'які капсули і приблизно 500 міліграмів. Для особливо сильної таблетки, де тверді пероральні препарати більш сполуки дозування для дорослої людини може переважні у порівнянні з рідкими препаратами. бути всього лише 0,1мг. Режим дозування можна Завдяки легкості введення, таблетки і капсули регулювати у даному діапазоні або навіть за меявляють собою найбільш переважні пероральні жами даного діапазону для забезпечення оптимастандартні дозовані лікарські форми, в яких очельної терапевтичної реакції у відповідь. видно використовуються тверді фармацевтичні Пероральне введення звичайно здійснюють з носії. За бажанням, таблетки можуть бути покриті використанням таблеток. Приклади дозування у оболонкою за допомогою стандартних водних або таблетках становлять 0,5мг, 1мг, 2мг, 5мг, 10мг, неводних способів. Такі композиції і препарати 25мг, 50мг, 100мг, 250мг і 500мг. Інші пероральні повинні містити щонайменше 0,1 процента активформи також можуть мати таке ж дозування (наної сполуки. Процент активної сполуки у даних приклад, капсули). композиціях може, звичайно, змінюватися і переФармацевтичні композиції важно складає від приблизно 2 процентів до прибІнший аспект даного винаходу складають фализно 60 процентів за вагою від стандартної форрмацевтичні композиції, які включають сполуку ми. Кількість активної сполуки у таких формули І і фармацевтично прийнятний носій. терапевтично використовуваних композиціях є Фармацевтичні композиції за даним винаходом такою, що одержують ефективне дозування. Активключають сполуку формули І або її фармацевтивні сполуки також можна вводити внутрішньоназачно прийнятну сіль як активний інгредієнт, а також льно, наприклад, у вигляді рідких крапель або фармацевтично прийнятний носій і необов'язково спрею. інші лікарські інгредієнти. Термін «фармацевтично Таблетки, пілюлі, капсули і тому подібні моприйнятні солі» стосується солей, одержаних з жуть також містити зв'язувальну речовину, таку як фармацевтично прийнятних нетоксичних основ трагакантова камедь, аравійська камедь, кукуруабо кислот, включаючи неорганічні основи або дзяний крохмаль або желатин; ексципієнти, такі як 31 86077 32 дикальційфосфат; дезінтегруючий агент, такий як СЕТР, був здійснений на основі модифікації спокукурудзяний крохмаль, картопляний крохмаль, собу, описаного Epps та іншими з використанням альгінова кислота; змащувальну речовину, таку як BODIPY®-CE як ліпідного донора складного ефіру стеарат магнію; і підсолоджувач, такий як сахарохолестерину. [Див. Epps et al. (1995) Method for за, лактоза або сахарин. Коли одинична препараmeasuring the activities of cholesteryl ester transfer тивна лікарська форма являє собою капсулу, вона protein (lipid transfer protein), Chem. Phys. Lipids. 77, може містити, на додаток до матеріалів згаданого 51-63]. вище типу, рідкий носій, такий як жирне масло. Частинки, використані у даному аналізі, ствоРізні інші матеріали можуть бути присутніми як рювали з наступних джерел: синтетичні частинки оболонка або для модифікації фізичних властиводонори HDL, що містять DOPC (Діолеоїл Фосфастей одиничної препаративної лікарської форми. тидил Холін) BODIPY®-CE (Molecular Probes CНаприклад, таблетка може бути покрита шелаком, 3927), триолеїн (тригліцерид) і apoHDL по суті цукром або і тим, і іншим. Сироп або еліксир мостворювали за допомогою зондової обробки ультжуть містити, на додаток до активного інгредієнту, развуком, як описано Epps та ін., але з доданням сахарозу як підсолоджувач, метил і пропілпрабени не здатної до дифузії молекули-гасника. дабциляк консерванти, барвник і ароматизатор, такий як дицетиламіду, для зниження фонової флуоресцевишневий або апельсиновий ароматизатор. нції. Дабцилдицетиламід одержували шляхом наСполуки формули І також можна вводити пагрівання дабцил н-сукциніміду з дицетиламіном у рентерально. Розчини або суспензії даних активДМФ при 95°С протягом ночі у присутності як каних сполук можуть бути одержані у воді, придатталізатора діізопропіламіну. Природні ліпопротеїни ним чином змішаній з поверхнево-активною крові людини використовували як акцепторні часречовиною, такою як гідроксипропілцелюлоза. тинки. Частинки, які мають щільність менше 1,063 Дисперсії також можуть бути одержані у гліцерині, г/мл збирали шляхом ультрацентрифугування. рідких поліетиленгліколях і їх сумішах у маслах. Дані частинки включають VLDL, IDL і LDL. КонценПри звичайних умовах зберігання і використання трації частинок виражали у перерахунку на концедані препарати містять консервант для запобіганнтрацію білка, визначену аналізом ВСА (Pierce, ня росту мікроорганізмів. США). Частинки зберігали при 4°С до використанФармацевтичні форми, придатні для застосуня. вання у вигляді ін'єкцій включають стерильні водні Аналізи проводили у чорних 96-ямкових розчини або дисперсії і стерильні порошки для планшетах Dynex Microfluor 2 з U-дном (каталожприготування для негайного застосування стериний №7205). Одержували «коктейль» для аналізу, льних розчинів або дисперсій для ін'єкцій. У всіх що містить СЕТР, буфер 1Х СЕТР (50мМ Tris, випадках форма повинна бути стерильною і порН7,4, 100мМ NaCl, 1мМ EDTA) і половину кінцевинна бути рідкою у такій мірі, щоб була вої концентрації акцепторних частинок, і 100мкл можливість легкого введення шприцом. Вона «коктейлю» для аналізу додавали у кожну ямку повинна бути стабільною в умовах виготовлення і планшета. Сполуки, що тестуються, у ДМСО дозберігання і повинна бути захищена від давати в об'ємі 3мкл. Вміст планшетів перемішузабруднюючої дії мікроорганізмів, таких як бактерії вали з використанням струшуючого пристрою для і гриби. Носій може являти собою розчинник або планшетів і потім інкубували при 25°С протягом 1 середовище для дисперсії, що містить, наприклад, години. Готували другий «коктейль» для аналізу, воду, етанол, багатоатомний спирт (наприклад, що містить донорні частинки, акцепторні частинки, гліцерин, пропіленгліколь і рідкий що залишилися, і буфер 1Х СЕТР. У реакційні ямполіетиленгліколь), їх придатні суміші і рослинні ки для початку аналізу додавали 47мкл другого олії.Комбінована терапія «коктейлю» для аналізу. Аналізи проводили при Сполуки за винаходом (наприклад такі, що 25°С у кінцевому об'ємі 150мкл. Кінцеві концентмають формулу І і Ia-Ij) можна використовувати у рації речовини складали: 5нг/мкл донорних частипоєднанні з іншими лікарськими засобами, які танок, 30нг/мкл акцепторних частинок (кожна виракож можна використовувати для лікування або жена за вмістом білка), буфер IX СЕТР, 0,8нМ полегшення перебігу захворювань або станів, для рекомбінантного СЕТР людини (експресованого у яких використовуються сполуки формули І. Такі клітинах СНО і частково очищеного) і до 2% інші лікарські засоби можна вводити з використанДМСО, коли використовувалися сполуки, що тесням шляху введення і у кількості, що звичайно туються. Аналізи проводили на флуоресцентному використовуються для цих цілей, одночасно або планшетному рідері (Molecular Devices Spectramax послідовно разом зі сполукою формули І. GeminiXS), встановленому на 45-хвилинний кінеТерапевтичні сполуки, які можна вводити ратичний прохід при 25°С. який зчитував показання зом зі сполуками за даним винаходом, включають для кожного зразка кожні 45 секунд при Ех=480нм, сполуки, які можна використовувати для поліпEm=511нм, з відсічним фільтром при 495нм, з шення ліпідного профілю пацієнта (тобто підвивстановленням електронної лампи фотопомножущення HDL-C і зниження LDL-C). Переважними вача на середнє значення, калібруванням і при 6 сполуками є статини, включаючи симвастатин, зчитуваннях/ямку. ловастатин, розувастатин, правастатин, флувасДані оцінювали шляхом одержання початкової татин, аторвастатин, ривастатин, ітавастатин і ZDшвидкості, вираженої у відносних одиницях флуо4522. ресценції за секунду, для псевдолінійної частини Аналіз СЕТР кривої, часто 0-500 або 1000 секунд. Порівняння Безперервний аналіз in vitro для визначення швидкостей для зразків з інгібіторами відносно ІС50 з метою виявлення сполук, які є інгібіторами зразків без інгібіторів (тільки ДМСО) як позитивний 33 86077 34 контроль давало процент інгібування. Графік проВідновлення 1-3 з використанням DIBAL у дихлорцента інгібування відносно логарифма концентраметані дає альдегід 1-4. Відновлення альдегіду 1-4 ції інгібітору, що відповідає сигмоїдальному 4боргідридом натрію або тому подібним у метанолі параметровому рівнянню, використовували для або етанолі, або тому подібному, дає спирт 1-5. розрахунку ІС50. Обробка 1-5 чотирибромистим вуглецем і трифеПриклади нілфосфіном у таких розчинниках як дихлорметан, Подані далі схеми і приклади наведені для тодихлоретан або тому подібних дає бромистий бенго, щоб винахід був більш повно оцінений і зрозузил 1-6 (див.: [Smith, Μ. В. і March, J. "March's Adмілий. Вихідні речовини одержують з використанvanced Organic Chemistry", 5th Ed., John Wiley і ням відомих способів або так, як показано нижче. Sons, New York, pp.518-519 (2001)] і процитовані Приклади не треба розглядати як такі, що обтам посилання). межують винахід яким-небудь чином. Об'єм винаходу визначає додана формула винаходу. Сполуки за винаходом мають величину ІС50, виміряну за допомогою описаного вище методу аналізу, яка менше або дорівнює 50мкМ. Проміжні сполуки 2-2 і 2-3 за даним винаходом, де Ra, p і A3 є такими, як визначено у формулі винаходу, можуть бути одержані, як показано на схемі 2. 2-Ціанойодбензоли можуть бути придбані у готовому вигляді або одержані відповідно до способів, показаних на схемі 1. Сполуки 2-2 одержують реакціями Сузукі або Стіллє. Або їх варіаціями з використанням каталізованого паладієм крос-сполучення йодиду 2-1 з відповідним чином заміщеними арил- або гетероарил-бороновою кислотою, складним ефіром боронової кислоти або триалкілоловом, як описано [Miyaua et al.. Chem. Rev. 95, 2457 (1995)] і процитованих там посиланнях і як описано [Smith, Μ. В. і March, J. "March's Advanced Organic Chemistry", 5th Ed.. John Wiley і Sons, New York, pp.868-869 (2001)] і процитованих там посиланнях. Відновлення нітриту 2-2 проводять з використанням літійалюмінійгідриду у діетиловому ефірі, одержуючи 2-амінометиланілін 23. Альтернативно, нітрил можна відновити з використанням паладію-на-вугіллі або нікелю Ренея в атмосфері водню у метанолі, етанолі або тому Проміжні сполуки 1-2, 1-3, 1-4, 1-5 і 1-6. викоподібному. Інші способи відновлення нітрильної ристані у даному винаході, можуть бути придбані у групи в амінометильну можна знайти у [Smith, Μ. готовому вигляді або одержані, як показано на В. і March, J. "March's Advanced Organic Chemistry", схемі 1. Придатним чином заміщений 25th Ed., John Wiley і Sons, New York, p.1204 (2001)] галогенанілін 1-1, де Ra і p є такими, як визначено і процитованих там посиланнях. у формулі винаходу, і де галоген переважно являє собою йод або бром, обробляють CuCN у ДМФ при підвищеній температурі, одержуючи відповідний 2-ціаноанілін. Альтернативно, нітрил може бути одержаний обробкою сполуки 1-1 KCN і Cul у присутності солі паладію (II) або у присутності деяких комплексів міді або нікелю (див.: [Smith, Μ. В. і March, J. "March's Advanced Organic Chemistry", 5th Ed., John Wiley i Sons, New York, p.867 (2001)] і процитовані там посилання). Йодиди 1-3 одержують обробкою 1-2 ізоамілнітритом, нпентилнітритом, трет-бутилнітритом або тому подібними сполуками у присутності дийодметану (див., наприклад, [Smith et al., J. Org. Chem. 55, 2543, (1990)] і процитовані там посилання) або за відсутності розчинника або у розчиннику, такому як ТГФ або ацетонітрил. Альтернативно, йодид може бути одержаний за допомогою початкового Сполуки 3-4 за даним винаходом, де R, Ra, p. 2 утворення солі діазонію з використанням ізоамілA , A3 і n є такими, як визначено у формулі винанітриту, н-пентилнітриту, трет-бутилнітриту, нітриходу, можуть бути одержані відповідно до способу, ту натрію, азотистої кислоти або тому подібного з показаного на схемі 3. Бензиламіни 3-1 можуть подальшим нагріванням у присутності йоду або бути придбані у готовому вигляді або одержані солі йоду, такої як йодид міді, йодид натрію, йодид відповідно до способів, показаних на схемі 2. Взакалію, йодид тетрабутиламонію або тому подібних. 35 86077 36 ємодія 3-1 з відповідним чином заміщеним алкіладоданням як каталізатора кислоти Льюїса, такої як цетатом, що містить відхідну групу у положенні 2, Yb(OTf)3 або тому подібної. Аміноспирт 4-2 може приводить до вторинного аміну 3-2. Алкілацетати бути підданий циклізації в оксазолідинон 4-3 з виможуть бути придбані у готовому вигляді або одекористанням фосгену (Y=Cl) або еквівалента фосржані з використанням відомих способів Переважгену, такого як трифосген (Y=OCCl3) або карбонілна відхідна група являє собою бром або йод, але діімідазол (Y=імідазол), або тому подібного, у також може являти собою мезилат, тозилат або розчиннику, такому як дихлорметан, дихлоретан, тому подібні, а розчинник може являти собою дихтетрагідрофуран, диметоксіетан або тому подіблорметан, дихлоретан, тетрагідрофуран диметокному, у присутності основи, такої як триетиламін, сіетан або тому подібні. Реакцію можна проводити діізопропілетиламін, N-метилморфолін або тому у присутності або за відсутності основи, такої як подібного. Альтернативно, аміноспирт 4-2 може триетиламін, діізопропілетиламін, Nбути перетворений у придатний карбамат при обметилморфолін або тому подібних. Відновлення робці такими реагентами, як дибензилкарбонат складноефірної функціональної групи у 3-2 привоабо бензилхлорформіат, у присутності основ, тадить до аміноспирту 3-3. Переважним відновником ких як триетиламін, діізопропілетиламін або тому є LiАІН4, у такому розчиннику як простий ефір, теподібні, у розчинниках, таких як дихлорметан, дихтрагідрофуран, диметоксіетан, діоксан або тому лоретан, тетрагідрофуран, диметоксіетан або тому подібних. Інші способи відновлення складного подібні. Карбамати потім можуть бути перетворені ефіру можна знайти у [Smith, Μ. В. і March, J. в оксазолідинони 4-3 при обробці основами, таки"March's Advanced Organic Chemistry", 5th Ed., John ми як гексаметилдисилазид літію, натрію або каWiley і Sons, New York, p.1551]. Аміноспирт 3-3 лію, у розчинниках, таких як тетрагідрофуран, диможна піддати циклізації в оксазолідинон 3-4 з метоксіетан або тому подібних. Енантіочисті використанням фосгену (Y=Cl) або еквівалента продукти можуть бути одержані за допомогою хіфосгену, такого як трифосген (Y=ОССlз), або карральної хроматографії. бонілдіімідазолу (Y=імідазол) або тому подібного, у такому розчиннику як дихлорметан, дихлоретан, тетрагідрофуран, диметоксіетан або тому подібних, у присутності основи, такої як триетиламін, діізопропілетиламін, N-метилморфолін або тому подібного. Енантіочисті продукти можуть бути одержані за допомогою хіральної хроматографії. Сполуки 4-3 за даним винаходом, де R, Ra, p, 2 А , А3 і n є такими, як визначено у формулі винаходу, можуть бути одержані відповідно до способу, показаного на схемі 4. Придатним чином заміщений бензиламін 4-1 може бути підданий взаємодії з відповідним чином заміщеним оксираном з утворенням аміноспирту 4-2. Оксирани можуть бути придбані у готовому вигляді або одержані з відповідного альдегіду та іліду сірки, як описано в ["March's Advanced Organic Chemistry", 5th Ed., John Wiley і Sons, New York, p.1247]. Альтернативно, епоксид може бути одержаний епоксидуванням олефіну, циклізацією галогенгідрину або 1,2-діолу або іншими способами, описаними в ["March's Advanced Organic Chemistry", 5th Ed., John Wiley і Sons, New York, p.1051]. Переважним розчинником для даної реакції є ізопропанол. Альтернативно, розкриття епоксиду може бути проведене у такому розчиннику як ацетонітрил або тому подібному з Сполуки 5-5 за даним винаходом, де R. Ra, p, А2. А3 і n є такими, як визначено у формулі винаходу, можуть бути одержані відповідно до способу, показаного на схемі 5. Придатним чином заміщений аміноспирт 5-1 може бути одержаний, як показано на схемі 4, і переважно захищений у вигляді карбамату, такого як трет-бутилкарбамат (ВОС) або бензилкарбамат (Cbz). Інші карбаматні і альтернативні захисні групи азоту можна знайти у ["Protective Groups in Organic Synthesis", 3rd Ed. John Wiley і Sons, New York, p.494]. Введення захисної групи азоту з використанням груп ВОС або Cbz може бути проведене при взаємодії 5-1 з дитрет-бутилдикарбонатом або дибензилкарбонатом у придатному розчиннику, такому як дихлорметан, дихлоретан, тетрагідрофуран, диметоксіетан або тому подібному. Спирт 5-2 може бути перетворений в азид 5-3 при реакції з метансульфонілхлоридом у дихлорметані, дихлоретані, тетрагірофу 37 86077 38 рані, диметоксіетані або тому подібному, у присутспособів, описаних у [Smith, Μ. В. і March, J. ності відповідної основи, такої як триетиламін, "March's Advanced Organic Chemistry, 5th Ed., John діізопропілетиламін, N-метилморфолін або тому Wiley і Sons, New York, pp.1187-1189 (2001)] і проподібні. Альтернативно, спирт може бути перетвоцитованих там посиланнях, приводить до 6-2. Перений в альтернативну відхідну групу, таку як тореважними умовами для даного перетворення є зилат, йодид, бромід або тому подібні. Мезилат використання ціаноборгідриду натрію у метанолі з потім заміщають за допомогою джерела азиду, використанням каталітичної кількості оцтової кистакого як NaN3, LiN3, Bu4NN3 або тому подібного, у лоти. Зняття захисних груп у 6-2 приводить до 6-3. відповідному розчиннику, такому як ДМФ, DMPU Для захисної групи ВОС переважним способом або тому подібному. Азид 5-3 також може бути видалення захисної групи є обробка ТФОК/СН2Сl2. одержаний при обробці спирту 5-2 дифенілфосДіаміни 6-3 потім піддають циклізації в імідазоліфорилазидом. діетилазодикарбоксилатом і тридинони 6-4 з використанням фосгену (Y=Cl) або фенілфосфіном у ТГФ. Азид 5-3 можна відновити еквівалента фосгену, такого як трифосген гідруванням над металевим каталізатором, таким (Y=OCCl3), або карбонілдіімідазолу (Y=імідазол) як Рt2О або Pd/C або тому подібним, у відповідноабо тому подібного, у розчиннику, такому як дихму розчиннику, такому як EtOAc, ТГФ, EtOH або лорметан, дихлоретан, тетрагідрофз-ран, диметотому подібному. Після відновлення і видалення ксіетан або тому подібному, з використанням осзахисної групи одержують діамін 5-4. Для захисної нови, такої як триетиламін, діізопропілетиламін. Nгрупи ВОС переважним способом видалення захиметилморфолін або тому подібного. Енантіочисті сної групи є обробка ТФОК/СН2Сl2, для захисної продукти можуть бути одержані за допомогою хігрупи CBZ гідрування над металевим каталізаторальної хроматографії. ром, таким як Рt2О або Pd/C або тому подібним, у відповідному розчиннику, такому як EtOAc, ТГФ, EtOH або тому подібному є переважним способом видалення захисної групи. Діаміни 5-4 піддають циклізації в імідазолідинони 5-5 з використанням фосгену (Y=Cl) або еквівалента фосгену, такого як трифосген (Y=ОССl3) або карбонілдіімідазол (Y=імідазол) або тому подібного, у розчиннику, такому як дихлорметан, дихлоретан, тетрагідрофуран, диметоксіетан або тому подібному, і основи, такої як триетиламін, діізопропілетиламін, Nметилморфолін або тому подібного. Енантіочисті продукти можуть бути одержані за допомогою хіральної хроматографії. Сполуки 7-5 за даним винаходом, де R, Ra, p, А , А3 і n є такими, як визначено у формулі винаходу, можуть бути одержані відповідно до способу, показаного на схемі 7. Обробка аміну 7-1, одержаного, як описано на схемі 4, придатним дикарбонатом або хлорформіатом, приводить до 7-2. Продукт 7-2 може бути перетворений в азид при взаємодії з метансульфонілхлоридом у дихлорметані, дихлоретані, тетрагідрофурані, диметоксіетані або тому подібному, у присутності придатної основи, такої як триетиламін, діізопропілетиламін, N-метилморфолін або тому подібного. Альтернативно, спирт може бути перетворений в альтернативну відхідну групу, таку як тозилат, йодид, бромід або тому подібні. Мезилат потім заміщають за допомогою джерела азиду, такого як NaN3, LiN3, Bu4NN3 або тому подібного, у придатному розчиннику, такому як ДМФ, DMPU або тому подібному. Азид 7-3 також може бути одержаний при обробці 2 Сполуки 6-4 за даним винаходом, де R, Ra, р, А , А3 і n є такими, як визначено у формулі винаходу, можуть бути одержані відповідно до способу, показаного на схемі 6. Обробка 6-1 заміщеним придатним чином аміноальдегідом, який може бути придбаний вже у готовому вигляді або одержаний відомими способами, у присутності відновника, такого як боргідрид натрію, ціаноборгідрид натрію, триацетоксиборгідрид натрію або тому подібного, у метанолі, етанолі, дихлоретані, тетрагідрофурані або тому подібному або відповідно до 2 39 86077 40 спирту 5-2 дифенілфосфорилазидом, діетилазоMarch, J. "March's Advanced Organic Chemistry", 5th дикарбоксилатом і трифенілфосфіном у ТГФ. Азид Ed., John Wiley і Sons, New York, p.1549 (2001)] і 7-3 можна відновити в амін 7-4 з використанням Н2 процитовані там посилання). Альтернативно, 9-2 над Рt2О у ТГФ як розчиннику, коли R4 являє соможе бути перетворений у складний ефір відомибою бензил. Циклізацію 7-4 в імідазолідинони 7-5 ми способами, включаючи обробку триметилсиліздійснюють при використанні придатної основи, лдіазо-метаном, і одержаний складний ефір може такої як діізопропіламід літію або бути відновлений у спирт 9-3 з використанням біс(триметилсиліл)амід літію, натрію або калію, LiAlH4 або тому подібного. Проміжні сполуки 9-3 або тому подібного, у придатному розчиннику, таможуть бути перетворені у бензилброміди 9-4 з кому як ТГФ, диметоксіетан, ДМФ, DMA або тому використанням таких реагентів як трифенілфосфін подібному. Енантіочисті продукти можуть бути і чотирибромистий вуглець, у розчинниках, таких одержані за допомогою хіральної хроматографії. як дихлорметан, дихлоретан або тому подібних (див. [Smith, Μ. В. і March, J. "March's Advanced Organic Chemistry", 5th Ed., John Wiley і Sons, New York, pp.518-519 (2001)] і процитовані там посилання). Сполуки 8-1 (одержані, як описано на схемах 5, 6 і 7), де R, Ra, р, А2, А3 і n є такими, як визначено у формулі винаходу, можуть бути перетворені у 8-2 при обробці придатним алкілуючим агентом, таким як алкілгалогенід, алкілтозилат, алкілмезилат або тому подібним (наприклад, йодистим метилом) у придатному розчиннику, такому як ТГФ, диметоксіетан, ДМФ, DMA або тому подібному, у присутності придатної основи, такої як діізопропіламід літію або біс(триметилсиліл)амід літію, натрію або калію, або тому подібного. Використовувані у даному винаході проміжні сполyки 9-3 і 9-4, де Ra, p, і A3 є такими, як визначено у формулі винаходу, можуть бути одержані, як показано на схемі 9. Придатним чином заміщений бензилнітрил 9-1, одержаний як показано на схемі 2, може бути підданий нагріванню з основою, такою як гідроксид натрію або гідроксид калію або тому подібним, у придатному водному спирті, такому як етанол, пропанол або тому подібне, даючи придатним чином заміщену бензойну кислоту 9-2 (див. [Smith, Μ. В. і March, J. "March's Advanced Organic Chemistry", 5th Ed., John Wiley і Sons, New York, pp.1179-1180 (2001)] і процитовані там посилання). Бензойна кислота 9-2 може бути відновлена до бензилових спиртів 9-3 з використанням відновників, таких як боран, у розчинниках, таких як тетрагідрофуран або тому подібні ([Smith, Μ. В. і Проміжні сполуки 10-4 за даним винаходом, де R, R1, А2, р і n є такими, як визначено у формулі винаходу, можуть бути одержані, як показано на схемі 10, з відповідним чином заміщеного бензальдегіду 10-1 шляхом конденсації з нітроалканом з утворенням заміщеного нітроспирту 10-2. Дану реакцію можна каталізувати водними основами, такими як гідроксид натрію або тому подібними, у розчинниках, таких як етанол, метанол або тому подібні. Нітроспирти 10-2 можуть бути відновлені до аміноспиртів 10-3 з використанням відновників, таких як нікель Ренея, паладій-на-активованому вугіллі або оксид платини, у присутності газоподібного водню і водної кислоти у спиртових розчинниках, таких як метанол, етанол або тому подібні [див. Langer, О., et al., Bioorg. Med. Chem., 2001, 9, 677-694]. Аміноспирти 10-3 можуть бути піддані циклізації в оксазолідинони 10-4 з використанням таких реагентів як фосген (Y=Cl), трифосген (Y=OCCl3) або карбонілдіімідазол (Y=імідазол), у присутності основ, таких як триетиламін, діізопропілетиламін або тому подібні, у розчинниках, таких як дихлорметан, дихлоретан, тетрагідрофуран, диметоксіетан або тому подібні. 41 Проміжні сполуки 11-4 за даним винаходом, до R, R1, А2, р, і n є такими, визначено у формулі винаходу, можуть бути одержані, як показано на схемі 11. Обробка N-карбамоїл-(N-метокси-Nметил)аміду амінокислоти 11-1, який може бути придбаний у готовому вигляді або одержаний відомими способами з реактивом Гріньяра або іншим металоорганічним реагентом, таким як літійорганічна сполука, приводить до відповідного кетону 11-2. Відновлення кетону боргідридом натрію або боргідридом цинку у спиртових розчинниках або ТГФ, або тому подібних, або з використанням інших відновників, таких як фенілдиметилсилан у ТГФ, приводить до спирту 11-3, який може бути підданий циклізації в оксазолідинон 11-4 її ляхом обробки осговою, такою як КОН у розчинниках, таких як МеОН, ΕtОН або тому подібних, і ТГФ, діоксані диметоксіетані або тому подібних. 86077 42 Сполуки 13-4 за даним винаходом, де R, R1, R , А2, А3, р, і n є такими, як визначено у формулі винаходу, можуть бути одержані, як показано на схемі 13. Оксазолідинони 13-2, одержані як показано на схемах 10 і 11, можуть бути піддані алкілуванню бромистими бензилами 13-1, які одержують, як показано на схемі 1, з використанням основ, таких як гексаметилдисилазид натрію або гідрид натрію, у розчинниках, таких як тетрагідрофуран, диметоксіетан, діетиловий ефір або тому подібних, приводячи до продуктів 13-3. Сполуки 13-4 потім одержують за допомогою реакцій Сузукі або Стіллє або їх варіацій з використанням каталізованого паладієм крос-сполучення йодиду 13-3 з відповідним чином заміщеною арил- або гетероарилбороновою кислотою, складним ефіром боронової кислоти або триалкілоловом, як описано у публікації [Miyaua et al, Chem. Rev. 95, 2457 (1995)] і процитованих там посиланнях, і як описано у [Smith, Μ. В. і March, J. "March's Advanced Organic Chemistry", 5th Ed., John Wiley і Sons, New York, pp.868-869 (2001)] і процитованих там посиланнях. a Сполуки 12-3 за даним винаходом, де R, R1, R , А2, А3, р, і n є такими, як визначено у формулі винаходу, можуть бути одержані, як показано на схемі 12. Оксазолідинони 12-2, одержані як показано на схемах 10 і 11, можуть бути піддані алкілуванню бромистими бензилами 12-1, які одержують, як показано на схемі 9, з використанням основ, таких як гексаметилдисилазид натрію або гідрид натрію, у розчинниках, таких як тетрагідрофуран, диметоксіетан, діетиловий ефір, диметилформамід, диметилацетамід або тому подібних, приводячи до продуктів 12-3. a Сполуки 14-5 за даним винаходом, де R, Ra, А2, А3, р, і n є такими, як визначено у формулі винаходу, можуть бути одержані, як показано на схемі 14. Бензилові спирти 14-1 можуть бути у го 43 86077 44 товому вигляді або одержані відповідно до спосоабо тому подібні. Нітроспирти 15-2 можуть бути бу, показаного на схемі 9. Взаємодія 14-1 з періовідновлені до аміноспиртів 15-3 такими відновнидинаном Десс-Мартіна приводить до відповідних ками як нікель Ренея, паладій на активованому бензальдегідів 14-2. Також можна використовувавугіллі або оксид платини у присутності газоподібти інші способи окиснення первинної гідроксильної ного водню і водної кислоти у спиртових розчиннигрупи в альдегід, наприклад, умови окиснення за ках, таких як метанол, етанол або тому подібні Сверном, перутенат тетрапропіламонію, хлорхро[див. Langer, О., et al., Bioorg. Med. Chenu, 2001, 9, мат піридинію, комплекс триоксид сірки-піридин 677-694]. Аміноспирти 15-3 можуть бути піддані або тому подібне. 2-Аміно-1-фенілетаноли 14-3 циклізації в оксазолідинони 15-4 з використанням можуть бути одержані з 14-2 через відповідний таких реагентів як фосген (Y=C1), трифосген силілований ціангідрин, що утворюється при обро(Y=ОССl3) або карбонілдіімідазол (Y=імідазол) у бці триметилсилілціанідом і каталітичною кількістю присутності основ, таких як триетиламін, діізопройодиду цинку з подальшим відновленням літійапілетиламін або тому подібні, у розчинниках, таких люмінійгідридом або подібним відновником. Альяк дихлорметан, дихлоретан, тетрагідрофуран, тернативно, 2-аміно-1-фенілетаноли 14-3 можуть диметоксіетан або тому подібні. Оксазолідинони бути одержані з 14-2 через відповідний ціангідрин, 15-5 потім одержують реакціями Сузукі або Стіллє одержаний при обробці ціанідом калію з подальабо їх варіаціями з використанням каталізованого шим відновленням. 2-Аміно-1-фенілетаноли 14-3 паладієм крос-сполучення йодидів 15-4 з відповідможуть бути піддані циклізації в оксазолідинони ним чином заміщеними арил- або гетероарилбо14-4 з використанням реагентів, таких як фосген роновими кислотами, складними ефірами бороно(Y=Cl) або трифосген (Y=OCCl3), або карбонілдіівих кислот або сполуками триалкілолова, як мідазол (Y=імідазол) у присутності основи, такої як описано у публікації [Miyaua et al., Chem Rev. 95, триетиламін, діізопропілетиламін або тому подібні, 2457 (1995)] і процитованих там посиланнях, і як у розчинниках, таких як дихлорметан, дихлоретан, описано у [Smith, Μ. В. і March, J. "March's Adтетрагідрофуран, диметоксіетан або тому подібні. vanced Organic Chemistry", 5th Ed., John Wiley і Оксазолідинони 14-4 можуть бути піддані алкілуSons, New York, pp.868-869 (2001)] і процитованих ванню алкіл-, гетероалкіл-, арил- або гетероарилтам посиланнях. Оксазолідинони 15-5 можуть бути бромідами з використанням основ, таких як гексапіддані алкілуванню алкіл-, гетероалкіл-, арил- або метилдисилазид натрію або гідрид натрію, у гетероарилбромідами з використанням основ, тарозчинниках, таких як тетрагідрофуран, диметокких як гексаметилдисилазид натрію або гідрид сіетан, діетиловий ефір або тому подібні, з одернатрію, у розчинниках, таких як тетрагідрофуран, жанням продуктів 14-5. Енантіочисті продукти модиметоксіетан, діетиловий ефір або тому подібні, з жуть бути одержані за допомогою хіральної одержанням продуктів 15-6. Енантіочисті продукти хроматографії. можуть бути одержані за допомогою хіральної хроматографії. Сполуки 15-6 за даним винаходом, де R, R1, R , А2, А3, р, і n є такими, як визначено у формулі винаходу, можуть бути одержані, як показано на схемі 15. Альдегіди 15-1 можуть бути придбані у готовому вигляді або одержані відповідно до способу, показаного на схемі 1. Конденсація 15-1 з нітроалканом приводить до заміщених нітроспиртів 15-2. Дану реакцію можна каталізувати водними основами, такими як гідроксид натрію або тому подібні, у розчинниках, таких як етанол, метанол a Сполуки 16-5 за даним винаходом, де R, R1, R , A2, A3, p, і n є такими, як визначено у формулі винаходу, можуть бути одержані, як показано на схемі 16. Альдегіди 16-1 можуть бyти придбані у готовому вигляді або одержані відповідно до способу, показаного на схемі 1. Конденсація 16-1 з хіральними Ν-ацилоксазолідинонами приводить до альдольних аддуктів 16-2, як описано у публікації [Evans, D.A. et al., J. Am. Chem. Soc, 2002, 124, 392-3]. Хіральні N-ацилоксазолідинони моa 45 86077 46 жуть бути придбані у готовому вигляді або одержані, як описано [Ager, Allen, D.A.; Schaad, D.R. Synthesis 1996, 1283-5]. Сполуки 16-2 можуть бути піддані гідролізу з одержанням відповідних кислот і потім оброблені дифенілфосфоразидатом і триалкіламіном як основи для здійснення перегрупування Курциуса, що приводить до хіральних окса2-Йод-5-(трифторметил)бензонітрил золідинонів 16-3. Оксазолідинони 16-4 одержують До розчину 2-аміно-5реакціями Сузукі або Стіллє або їх варіаціями з (трифторметил)бензонітрилу (15,1г) і дийодметану використанням каталізованого паладієм крос(24мл) в ацетонітрилі (150мл) при 35°С додавали сполучення йодидів 16-3 з відповідним чином запо краплях трет-бутилнітрит (21мл). Реакційну міщеними арил- або гетероарилбороновими киссуміш підтримували при температурі 30-35°С під лотами, складними ефірами боронових кислот або час додавання. Реакційну суміш витримували просполуками триалкілолова, як описано у публікації тягом 30 хвилин і потім нагрівали при 60°С протя[Miyaua et al., Chem. Rev. 95, 2457 (1995)] і процигом 30 хвилин. Реакційну суміш охолоджували, тованих там посиланнях, і як описано у [Smith, Μ. розбавляли простим ефіром і промивали 2х воВ. і March. J. "March's Advanced Organic Chemistry", дою, 2х водним розчином бісульфіту натрію, во5th Ed., John Wiley і Sons, New York, pp.868-869 дою і потім насиченим розчином солі. Розчин су(2001)] і процитованих там посиланнях. Оксазолішили над безводним MgSO4, фільтрували через динони 16-4 можуть бути піддані алкілуванню алшар силікагелю і потім концентрували, одержуючи кіл-, гетероалкіл-, арил- або гетероарилбромідами 100г червоного масла. Продукт очищали хроматоз використанням основ, таких як гексаметилдисиграфією на силікагелі, елююючи послідовно гексалазид натрію або гідрид натрію, у розчинниках, ном, сумішшю гексани/СН2Сl2 у співвідношенні 3:1 таких як тетрагідрофуран, диметоксіетан, діетилоі сумішшю гексани/СН2Сl2 у співвідношенні 1:1, вий ефір або тому подібні, з одержанням продуктів одержуючи 2-йод-5-(трифторметил)бензонітрил. 1 16-5. Альтернативно, оксазолідинони 16-3 алкілуΗ ЯМР (CDCI3, 500МГц) δ 8,10 (д, J=8,5Гц, 1H), ють придатними бромідами, одержуючи сполуки 7,85 (д, J=1,8Гц, 1Н), 7.52 (дд, J=8,5, 1,8Гц, 1Н). 16-6. які піддають реакції Сузукі або Стіллє, або їх варіаціям з відповідним чином заміщеними арилабо гетероарилбороновими кислотами, складними ефірами боронових кислот або сполуками триалкілолова, одержуючи продукти 16-5. 2-Аміно-5-(трифторметил)бензонітрил У 2-літрову колбу завантажували 100г (0,348моль) 4-аміно-3-йодбензотрифториду, 40г CuCN і 750мл ДМФ. Суміш нагрівали і потім витримували при кипінні зі зворотним холодильником протягом 1 години. Реакційну суміш охолоджували і виливали у 3л води, що містить 300мл концентрованого гідроксиду амонію. До суміші додавали 1л СН2СІ2. Суміш потім фільтрували через целіт. Шари розділяли, і водний шар знову екстрагували СН2Сl2. Органічні екстракти об'єднували, і розчинник видаляли при зниженому тиску. Залишок розчиняли у 1,5л простого ефіру і одержаний розчин промивали 1н гідроксидом амонію, водним розчином бісульфіту натрію, 1н водним розчином НСI і насиченим розчином солі. Розчин сушили над безводним MgSO4 і фільтрували через шар силікагелю, що містить вгорі шар MgSO4. Шар промивали 5л простого ефіру. Ефірні розчини об'єднували і концентрували до об'єму 750мл і залишали при кімнатній температурі. Через 2 дні утворену тверду речовину збирали, промивали гексаном і сушили при зниженому тиску, одержуючи 2-аміно-5-(трифторметил)бензонітрил. 1H ЯМР (CDCI3, 500МГц) δ 7,68 (с, 1H), 7,58 (д, J=8,5Гц, 1Н), 6,81 (д. J=8,5Гц, 1H), 4,80 (ушир.с, 2Н). 5'-Ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-карбонітрил До розчину 2-йод-5(трифторметил)бензонітрилу (2,0г, 6,7ммоль) і (5ізопропіл-2-метоксифеніл)боронової кислоти (1,6г, 8,4ммоль) у диметилетилен-гліколі (30,4мл) додавали 2М Na2CO3 (6,8мл), етанол (9,6мл) і воду (10мл). Розчин дегазували азотом протягом 2 хвилин. Додавали Pd(PPh3)4 (774мг, 0,67ммоль) і розчин знову дегазували азотом протягом 2 хвилин. Розчин розділяли на дві рівні порції і завантажували у дві пробірки об'ємом 40мл для мікрохвильового опромінення. Кожну пробірку дегазували азотом протягом 1 хвилини, герметично закупорювали і вміщували у мікрохвильовій реактор. Потужність встановлювали на 200Вт доти, доки температура не досягала 150°С і потім температуру підтримували на рівні 150°С протягом десяти хвилин. Пробірки потім охолоджували до кімнатної температури, вміст об'єднували, виливали в Н2О (50мл), і екстрагували ЕtOАс (100мл). Органічний шар промивали насиченим розчином солі (50мл), сушили над Na2SO4, фільтрували і концентрували. Очищення флеш-хроматографією з використанням суміші 15% СН2Сl2/гексани давало 5'-ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-карбонітрил у вигляді світло-жовтого масла. Rf=0,65 (25% EtOAc/гексани). 1H ЯМР (CDCI3, 500МГц) δ 7,97 (с, 1Η), 7,85 (д, J=8,0Гц, 1H), 7,63 (д, J=8,0Гц, 1H), 7,31 (дд, J=8,5, 2,0Гц, 1Н), 7,12 (д, J=2,0Гц, 1H), 6,97 (д, J=8,5Гц, 1H), 3,82 (с, 3Н), 2,93 (м, 1Н), 1,27 (д, J=7,0Гц, 6Н). 47 1-[5'-Ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-іл]метанамін 5'Ізопропіл-2'-метокси-4-(трифторметил)біфеніл-2карбонітрил (996,2мг, 3,12ммоль) розчиняли в Et2O (33мл) і охолоджували до 0°С. LАН (12,49мл 1М розчину в Et2O, 12,49ммоль) додавали по краплях за допомогою шприца. Після перемішування при 0°С протягом 10 хвилин реакційну суміш нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом 6 годин. Реакцію потім гасили шляхом повільного додання по краплях 1,5мл Н2О (інтенсивне виділення газу), потім 1,5мл 30% NaOH, потім 3,0мл Н2О. Одержаний желатиноподібний осад промивали 5´20мл СН2Сl2; органічні фази сушили над Na2SO4, фільтрували і концентрували. Очищення залишку за допомогою флеш-хроматографії з використанням 2% МеОН/СН2Сl2, що містить 0,1% Et3N, давало 1[5'-зопропіл-2'-метокси-4-(трифторметил)біфеніл2-іл]метанамін. Rf=0,30 (10% МеОН/СН2Сl2). РХ/МC=324,3 (М+1)+. 1H ЯМР (CDCI3, 500МГц) δ 7,77 (с, 1Н), 7,55 (д, J=6,8Гц, 1H), 7,32 (д, J=7,8Гц, 1Н), 7,25 (дд, J=8,3, 2,1Гц, 1Н), 7,00 (д, J=2,1Гц, 1H), 6,92 (д, J=8,4Гц, 1H), 3,66-3,74 (м, 5Н), 2,91 (м, 1H), 1,26 (д, J=6,9Гц, 6Н). 4-[3,5-біс(трифторметил)феніл]-3-{[5'ізопропіл-2'-метокси-4-(трифторметил)біфеніл-2iл]метил}-1,3-оксазолідин-2-он Стадія А: метил [3,5біс(трифторметил)феніл](гідрокси)ацетат До розчину [3,5біс(трифторметил)феніл](гідрокси)оцтової кислоти (510мг, 1,77ммоль) у бензолі (10мл) додавали МеОН (1,5мл) з подальшим доданням (триметилсиліл)діазометану (1,06мл 2М розчину у гексанах, 2,12ммоль). Через 10 хвилин реакцію гасили декількома краплями НОАс (додавали до зникнення жовтого забарвлення). Реакційну суміш концентрували і очищали флеш-хроматографією з використанням суміші від 10 до 80% ЕtOАс/гексани, одержуючи метил[3,5біс(трифторметил)феніл](гідрокси)ацетат. 1H ЯМР (CDCI3, 500МГц) δ 7,94 (с, 2Н), 7,85 (с, 1Н), 5,32 (с, 1H), 3,83 (с, 3Н), 3,68 (ушир.с. 1Н). Стадія В: метил [3,5біс(трифторметил)феніл](бром)ацетат 86077 48 Метил [3,5біс(трифторметил)феніл](гідрокси)ацетат (300мг, 0,993ммоль) розчиняли в СН2Сl2 (10мл). Розчин охолоджували до 0°С і додавали СВr4 (659мг, 1,986ммоль) з подальшим доданням PPh3 (521мг, 1,986ммоль). Через 1 годину реакційну суміш нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом 1 години. Реакційну суміш фільтрували через короткий шар силікагелю з використанням СН2Сl2. Фільтрат концентрували і залишок очищали флешхроматографією з використанням 5% ЕtOАс/гексанах. одержуючи метил [3,5біс(трифторметил)феніл](бром)ацетат. Rf=0,24 (5% EtOAc/гексани).1H ЯМР (CDCI3, 500МГц) δ 8,02 (с, 2Н), 7,87 (с, 1Н), 5,41 (с, 1H), 3,83 (с, 3Н). Стадія С: метил-[3,5біс(трифторметил)феніл]({[5'-ізопропіл-2'-метокси4-(трифторметил)біфеніл-2-іл]метил}аміно)ацетат У колбу, що містить метил-[3,5біс(трифторметил)феніл](бром)ацетат (237,7мг, 0,651ммоль) додавали 1-[5'-ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-іл]метенамін (102,1мг, 0,316ммоль) у СН2СІ2 (4мл). Реакційну суміш перемішували при кімнатній температурі протягом 5 годин і потім розбавляли ЕtOАс (50мл). Органічний розчин промивали водою і насиченим розчином солі (по 15мл кожного). Органічний екстракт сушили над Na2SO4, фільтрували і концентрували. Очищення залишку за допомогою флешхроматографії (від 5 до 15% ЕtOАс/гексани) давало метил[3,5біс(трифторметил)феніл]({[5Чзопропіл-2'-метокси4-(трифторметил)біфеніл-2-іл]метил}аміно)ацетат. Rf=0,33 (15% ЕtOАс/гексани). РХ/МС=608,4 (М+1)+. 1 H ЯМР (CDCI3, 500МГц) δ 7,76-7,79 (м, 3Н), 7,62 (с, 1Н), 7,56 (д, J=7,8Гц, 1Н), 7,31 (д, J=7,8Гц, 1Н), 7,23 (дд, J=8,2, 1,9Гц, 1Н), 6,96 (м, 1H), 6,89 (д, J=8,5Гц, 1H), 4,30 (м, 1H), 3,54-3,70 (м, 8Н), 2,87 (м, 1Η), 1,21-1,23 (м, 6Н). Стадія D: 2-[3,5-біс(трифторметил)феніл]-2({[5'-ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-іл]метил}аміно)етанол Розчин метил[3,5біс(трифторметил)феніл]({[5'-ізопропіл-2'-метокси4-(трифторметил)біфеніл-2іл]метил}аміно)ацетату (13,2мг, 0,0217ммоль) розчиняли в Et2O (1,5мл) і охолоджували до 0°С. LAH (108,5мкл 1М розчину в LAH, 0,1085ммоль) додавали по краплях за допомогою шприца. Реакційну суміш нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом 1 години. Реакцію потім гасили, додаючи Н2О (100мкл), потім 1н NaOH (100мкл), після чого Н2О (300мкл). Желатиноподібний залишок промивали декілька разів СН2СІ2. Органічні промивні води фільтрували через шар силікагелю з використанням 2% МеОН/СН2Сl2 і фільтрат концентрували. Очищення залишку за допомогою препаративної тонкошарової хроматографії з використанням 25% ЕtOАс/гексанах давало 2-[3,5біс(трифторметил)феніл]-2-({[5'-ізопропіл-2'метокси-4-(трифторметил)біфеніл-2іл]метил}аміно)етанол. Rf=0,27 (25% ЕtOАс/гексани). РХ/МС=580,4 (М+1)+. 1H ЯМР (CD2Cl2. 500МГц) δ 7,79 (с, 1H), 7,75 (с, 2Н), 7.63 49 86077 50 7,68 (м, 1H), 7,55 (д, J=7,8Гц, 1H), 7,31 (д, J=7,8Гц, 1Н), 7,74 (с, 2Н), 3,99 (дд, J=3,9, 2,5Гц, 1Н), 3,23 1Н), 7,23 (м, 1Н), 6,94 (м, 1H), 6,89 (м, 1Н), 3,43(дд, J=5,2, 4,1Гц, 1H), 2,79 (дд, J=5,5, 2,5Гц, 1H). 3,76 (м, 9Н), 2,86 (м, 1H), 1,90 (ушир.с, 1Н), 1,20 (д, Стадія В: 1-[3,5-біс(трифторметил)феніл]-2J=6,8Гц, 6Н). ({[5'-ізопропіл-2'-метокси-4Стадія Е: 4-[3,5-біс(трифторметил)феніл]-3(трифторметил)біфеніл-2-іл]метил}аміно)етанол {[5'-ізопропіл-2'-метокси-4-(трифторметил)біфенілРозчин 1-[5'-ізопропіл-2'-метокси-42-іл]метил}-1,3-оксазолідин-2-он (трифторметил)біфеніл-2-іл]метенаміну (300мг, До розчину фосгену (21мкл 20% розчину у то0,929ммоль) і 2-[3,5луолі, -0,0535ммоль) у СН2Сl2 біс(трифторметил)феніл]оксирану (297мг, (0,5мл) додавали 2-[3,51,161ммоль) у 2-пропанолі (9мл) нагрівали при біс(трифторметил)феніл]-2-({[5'-ізопропіл-2'кипінні зі зворотним холодильником протягом 15 метокси-4-(трифторметил)біфеніл-2годин і потім охолоджували до кімнатної темпераіл]метил}аміно)етанол (3,1мг, 0,00535ммоль) у тури. Розчин концентрували, і очищення залишку СН2Сl2 (0,5мл) з подальшим додаванням DIPEA за допомогою флеш-хроматографії з використан(19мкл, 0,107ммоль). Після перемішування протяням від 10 до 80% ЕtOАс/гексани давало 1-[3,5гом 5 хвилин, реакційну суміш виливали у воду біс(трифторметил)феніл]-2-({[5'-ізопропіл-2'(1мл) і суміш екстрагували ЕtOАс (20мл). Органічметокси-4-(трифторметил)біфеніл-2ний екстракт промивали Н2О, насиченим розчином іл]метил}аміно)етанол. Rf=0,24 (25% NаНСО3 і насиченим розчином солі (по 5мл кожноЕtOАс/гексани). РХ/МC=580,3 (М+1)+. 1H ЯМР го). Органічний шар потім сушили над Na2SO4, (CDCI3, 500МГц) δ 7,75-7,76 (м, 3Н), 7,69 (с, 1Н), фільтрували і концентрували. Залишок очищали 7,58 (д, J=7,8Гц, 1Н), 7,34 (д, J=7,7Гц, 1H), 7,25 (м, препаративною тонкошаровою хроматографією, 1H), 6,98 (>шир.с, 1H), 6,92 (д, J=8,5Гц, 1Н), 4,62 одержуючи 4-[3,5-біс(трифторметил)феніл]-3-{[5'(м, 1Н), 3,65-3,82 (м, 5Н), 2,89 (м, 1H), 2,79 (дд, ізопропіл-2'-метокси-4-(трифторметил)біфеніл-2J=12,4, 3,0Гц, 1H), 2,48 (м, 1Н), 1,23 (д, J=6,8Гц, іл]метил}-1,3-оксазолідин-2-он. Rf=0,27 (25% 6Н). ЕtOАс/гексани). РХ/МC=606,3 (М+1)+. 1H ЯМР Стадія С: 5-[3,5-біс(трифторметил)феніл]-3(CD2Cl2, 500МГц) (Спостерігалося подвоєння де{[5'-ізопропіл-2'-метокси-4-(трифторметил)біфеніляких піків, атропоізомери присутні у співвідношенні 2-іл]метил}-1,3 -оксазолідин-2-он 1:1) δ 7,84 (с, 1H), 7,19-7,60 (м, 6Н), 6,80-6,87 (м, До розчину 1-[3,5-біс(трифторметил)феніл]-22Н), 3,84-4,68 (м, 5Н), 3,68 і 3,64 (2с, 3Н), 2,82 (м, ({[5'-ізопропіл-2'-метокси-41H), 1,17-1,21 (м, 6Н). (трифторметил)біфеніл-2-іл]метил}аміно)етанолу (31,9мг, 0,0551ммоль) у СН2Сl2 (5мл) при 0°С додавали DBPEA (67мкл, 0,386ммоль), потім трифосген (8,2мг, 0,0276ммоль). Реакційну суміш перемішували при 0°С протягом 30 хвилин. Реакційну суміш потім виливали > насичений розчин NaHCO3 (15мл) і суміш екстрагували ЕtOАс (50мл). Органічний шар промивали насиченим розчином солі (15мл), сушили над Na2SO4, фільтрували і концентрували. Очищення залишку за допомогою флешхроматографії (20% ЕtOАс/гексани) давало 5-[3,5біс(трифторметил)феніл]-3-{[5'-ізопропіл-2'5-[3,5-біс(трифторметил)феніл]-3-{[5'метокси-4-(трифторметил)біфеніл-2-іл]метил}-1,3ізопропіл-2'-метокси-4-(трифторметил)біфеніл-2оксазолідин-2-он. Rf=0,32 (25% ЕtOАс/гексани). іл]метил}-1,3-оксазолідин-2-он РХ/МС=606,3 (М+1)+. 1H ЯМР (CD2Cl2, 500МГц) Стадія А: 2-[3,5(присутність атропоізомерів у співвідношенні 1:1 біс(трифторметил)феніл]оксиран приводило до подвоєння деяких піків) δ 7,90 (с, У суху колбу вміщували NaH (1,09г 60% NaH, 1Н), 7,77 (с, 2Н), 7,57-7,62 (м, 2Н), 7,37 (д, J=8,0Гц, 27,27ммоль). Додавали ДМСО (90мл) з подаль1H), 7,27 (м, 1H), 6,98 (с. 1Н), 6,93 (дд, J=8,4, шим доданням йодиду триметилсульфоксонію 3,2Гц, 1H), 5,42-5,53 (м, 1H), 4,15-4,59 (м, 2Н), 3,72 (7,0г, 31,82ммоль). Реакційну суміш перемішували і 3,73 (2с, 3Н), 3,05-3,65 (м, 2Н), 2,88 (м, 1H), 1,19протягом 5 хвилин і потім добавляли 3,51,23 (м,6Н). біс(трифторметил)бензальдегід (1,5мл, 2 енантіомери можуть бути розділені за допо9,09ммоль) у вигляді розчину у ДМСО (15мл). Реамогою хіральної ВЕРХ з використанням 15% кційну суміш перемішували при кімнатній темпераIPА/гептани і хіральної колонки AD. турі протягом 1 години і потім виливали у суміш лід/вода (300мл). Суміш екстрагували пентанами (3´150мл). Екстракти у пентанах об'єднували і фільтрували через короткий шар силікагелю з використанням розчину 10% Еt2О/пентани. Фільтрат концентрували і залишок очищали флешхроматографією з використанням 10% Еt2О/пентани, одержуючи 2-[3,5біс(трифторметил)феніл]оксиран. Rf=0,42 (10% Еt2О/пентани). 1H ЯМР (CDCI3, 500МГц) δ 7,82 (с, 51 3-{[5'-Ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-іл]метил}-5-піридин-2-іл1,3-оксазолідин-2-он Стадія А: 2-({[5'-ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-іл]метил} аміно)-1 піридин-2-іл етанол Розчин 1-[5'-ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-іл]метенаміну (300мг, 0,929ммоль) і 2-оксиран-2-ілпіридину (640мг) [одержаний взаємодією 2-піридинкарбоксальдегіду з NaH і йодидом триметилсульфоксонію у ДМСО] у 2-пропанолі (9мл) нагрівали при кипінні зі зворотним холодильником протягом 5 годин і потім охолоджували до кімнатної температури. Розчин концентрували, і залишок очищали флешхроматографією з використанням суміші, що містить від 50 до 100% EtOAc/гексани, що містить 0,5% Et3N, одержуючи 2-({[5'-ізопропіл-2'-метокси4-(трифторметил)біфеніл-2-іл]метил}аміно)-1піридин-2-ілетанол. Аналіз методом РХ/МС показав, що цільовий продукт забруднений декількома мінорними домішками. Дану речовину використовували у наступній реакції без додаткового очищення або аналізу. Стадія В: Бензил(2-гідрокси-2-піридин-2ілетил){[5'-ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-іл]метил}карбамат Розчин (PhCH2OCO)2O (103мг, 0,360ммоль) у безводному СН2Сl2 (2мл) додавали за допомогою канюлі до перемішуваного розчину 2-({[5'ізопропіл-2'-метокси-4-(трифторметил)біфеніл-2іл]метил} аміно)-1-піридин-2-іл етанолу (160мг, 0,360ммоль) у безводному CH2CI2 (10мл) при кімнатній температурі в атмосфері N2. Реакційну суміш перемішували протягом 2 годин при кімнатній температурі і концентрували у вакуумі, одержуючи неочищений продукт. Його очищали з використанням флеш-хроматографії (Si, 25´160мм, градієнт 0-50% ЕtOАс у гексанах), одержуючи бензил(2гідрокси-2-піридин-2-ілетил){[5'-ізопропіл-2'метокси-4-(трифторметил)біфеніл-2іл]метил}карбамат. Rf=0,63 (50% EtOAc/гексани). РХ/МС: обчислено= 579,25; знайдено= 579,2 (М+1)+. Стадія С3-{[5'-Ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-іл]метил-5-піридин-2-іл1,3-оксазолідин-2-он Розчин біс(триметилсиліл)аміду калію (464мкл 0,5М розчину у толуолі, 0,232ммоль) додавали по краплях до перемішуваного розчину бензил(2гідрокси-2-піридин-2-ілетил){[5'-ізопропіл-2'метокси-4-(трифторметил)біфеніл-2іл]метил}карбамату (134,3мг, 0,232ммоль) у безводному ТГФ (10мл) при кімнатній температурі в 86077 52 атмосфері N2. Після перемішування при кімнатній температурі протягом 1 години, реакцію гасили насиченим розчином NH4Cl (10мл) і екстрагували ЕtOАс (3´20мл). Об'єднані екстракти сушили (Na2SO4) і концентрували у вакуумі, одержуючи неочищений продукт. Його очищали з використанням флеш-хроматографії (Si, 25´160мм, градієнт 0-70% ЕtOАс у гексанах), одержуючи 3-{[5'ізопропіл-2'-метокси-4-(трифторметил)біфеніл-2іл]метил}-5-піридин-2-іл-1,3-оксазолідин-2-он. Rf=0,58 (50% ЕtOАс/гексани). РХ/МС: обчислено= 471,19; знайдено= 471,2 (М+1)+. 5'-Ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-карбонова кислота Розчин 5'-ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-карбонітрилу (727мг, 2,28ммоль) і КОН (767мг, 13,7ммоль) в Н2О (7,70мл) та і-РrOН (11,55мл) піддавали мікрохвильовому опроміненню (300Вт, 130°С, 4 години) у запаяній ампулі. Реакційну суміш концентрували у вакуумі для видалення і-РrOН. Одержану водну суспензію розбавляли водою (50мл) і екстрагували ЕtOАс (50мл). Органічний екстракт сушили (Na2SO4) і концентрували у вакуумі, одержуючи 5'ізопропіл-2'-метокси-4-(трифторметил)біфеніл-2карбоксамід. Водний шар підкислювали концентрованою НСI і екстрагували ЕtOАс (3´50мл). Об'єднані органічні екстракти сушили (Na2SO4) і концентрували у вакуумі, одержуючи 5'-ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-карбонову кислоту у вигляді безбарвної твердої речовини. 1H ЯМР (CDCI3, 500МГц) δ 8.01 (с, 1H). 7,71 (д, J=7,8Гц, 1Н), 7,41 (д. J=7,8Гц, 1Н), 7,14 (д, J=8,1Гц, 1H), 7,04 (с, 1Н), 6,77 (д, J=8,1Гц, 1Н), 3,68 (с, 3Н), 2,84 (с, J=6,7Гц, 1Н), 1,19 (д, J=6,7Гц, 6Н). [5'-Ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-іл]метанол Розчин борану у ТГФ (1М, 859мкл, 0,859ммоль) додавали по краплях до перемішуваного розчину 5'-ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-карбонової кислоти і 5'ізопропіл-2'-метокси-4-(трифторметил)біфеніл-2карбоксаміду (3:1, 96,8мг, 0,286ммоль) у безводному ТГФ при кімнатній температурі в атмосфері N2. Реакційну суміш перемішували при кімнатній температурі протягом 3 годин і обережно гасили водою (10мл). Суміш екстрагували ЕtOАс (3´20мл) і об'єднані екстракти промивали насиченим розчином солі, сушили (Na2SO4) і концентрували у ваку 53 86077 54 умі, одержуючи неочищений продукт. Його очища4,49 (дд, J=13,3, 3,1Гц, 1H), 2,79 (д, J=3,7, 1H), 2,36 ли з використанням флеш-хроматографії (Si, (с, 3Н). 125´160мм, градієнт 0-30% ЕtOАс у гексанах), одержуючи [5'-ізопропіл-2-метокси-4(трифторметил)біфеніл-2-іл]метанол у вигляді безбарвного масла. Rf=0,27 (10% ЕtOАс/гексани). 1 H ЯМР (CDCI3, 500МГц) δ 7,89 (ушир.с, 1Н), 7,62 (дд, J=8,0, 1,3Гц, 1H), 7,36 (д, J=8,0Гц, 1H), 7,29 (дд. J=8,5, 2,3Гц, 1H), 7,03 (д, J=2,3Гц, 1Н), 6,96 (д, 2-Аміно-1 -(4-метилфеніл)етанол J=8,5Гц, 1Н), 4,51 (м, 2Н), 3,74 (с, 3Н), 2,93 (с, Суспензію 10% Pd/C (24мг) у розчині 1-(4J=7,0Гц, 1H), 2,51 (с, 1H), 1,29 (д, J=7,0Гц, 6Н). метилфеніл)-2-нітроетанолу (50мг, 0,276ммоль) в абсолютному ЕtOН (1мл) перемішували протягом ночі при кімнатній температурі під тиском 15фт/кв.дюйм Н2. Реакційну суміш фільтрували через шар целіту і фільтрат концентрували у вакуумі, одержуючи 2-аміно-1-(4-метилфеніл)етанол у вигляді масла. РХ/МС: обчислено= 152,10; знайдено=152 (М+1)+. 1H ЯМР (CDCI3, 500МГц) δ 7,20 (д, J=8,0Гц, 2Н), 7,13 (д, J=8,0Гц, 2Н), 4,57 (дд, 2-(Бромметил)-5'-ізопропіл-2'-метокси-4J=7,9, 3,9Гц, 1H), 2,86 (дд, J=12,7, 3,9Гц, 1H), 2,76 (трифторметил)біфеніл (дд, J=12,7, 7,9Гц, 1H), 2,33 (с, 3Н). CBr4 (112мг, 0,211ммоль) і Ph3P (55мг, 0,211ммоль) додавали послідовно до: перемішуваного розчину [5'-ізопропіл-2'-метокси-4(трифторметил)біфеніл-2-іл]метанолу (57,1мг, 0,176ммоль) у безводному СН2СІ2 (1мл) при 0°С в атмосфері N2. Розчин перемішували при кімнатній температурі протягом 1 години і реакційну суміш концентрували у вакуумі, одержуючи неочищений продукт. Його очищали з використанням флеш5-(4-Метилфеніл)-1,3-оксазолідин-2-он хроматографії (Si, 12´160мм, градієнт 0-20% Діізопропілетиламін (181мг, 244мкл, ЕtOАс у гексанах), одержуючи 2-(бромметил)-5'1,40ммоль) і трифосген (138мг, 0,466ммоль) додаізопропіл-2'-метокси-4-(трифторметил)біфеніл у вали послідовно до перемішуваного розчину 2вигляді безбарвного масла. Rf=0,95 (20% аміно-1-(4-метилфеніл)етанолу (35,2мг, ЕtOАс/гексани). РХ/МС: обчислено= 387,05; знай0,233ммоль) у безводному СН2Сl2 (22мл) при 0°С в + 1 дено= 387,0 (М+1) . H ЯМP (CDCI3, 500МГц) δ атмосфері N2. Реакційну суміш перемішували при 7,83 (ушир.с, 1H), 7,60 (дд, J=8,0, 1,3Гц, 1H), 7,37 0°С протягом 1 години, потім концентрували у ва(д, J=8,0Гц, 1Н), 7,29 (дд, J=8,5, 2,3Гц, 1Н), 7,14 (д, куумі до об'єму приблизно 5мл. Суміш розбавляли J=2,3Гц, 1Н), 6,95 (д, J=8,5, 1H), 4,45 (д, J=10,6Гц, водою (50мл) і екстрагували EtOAc (3´50мл). Об'1Н), 4,33 (д, J=10,6Гц, 1Н), 3,76 (с, 3Н), 2,94 (с, єднані органічні екстракти сушили (Na2SO4) і конJ=6,9Гц, 1H), 1,29 (д, J=6,9Гц, 6Н). центрували у вакуумі, одержуючи неочищений продукт. Продукт очищали з використанням флешхроматографії (Si, 12´160мм, градієнт 0-80% ЕtOАс у гексанах), одержуючи 5-(4-метилфеніл)1,3-оксазолідин-2-он. Rf=0,41 (50% EtOAc/гексани). РХ/МС: обчислено= 178,08; знайдено= 178,1 (М+1)+. 1H ЯМР (CDCI3, 500МГц) δ 7,25 (д, J=7,4Гц, 1-(4-Метилфеніл)-2-нітроетанол 2Н), 7,19 (д, J=7,4Гц, 2Н), 6,69 (ушир.с, 1Н), 5,55 Перемішуваний розчин 4-метилбензальдегіду (т, J=7,8Гц, 1Н), 3,93 (т, J=8,6Гц, 1Н), 3,52 (т, (325мг, 319мкл, 2,71ммоль) нітрометану (531мкл, J=8,1Гц, 1H), 2,35 (с, 3Н). 9,89ммоль) в абсолютному ЕtOН (20мл) при 0°С обробляли 10% водним NaOH (мас/об.) (1,14мл, 2,84ммоль), перемішували протягом 1 години і обробляли 2% водною оцтовою кислотою (мас/об.) (8,54мл, 2,84ммоль). Реакційну суміш перемішували протягом 1 години при кімнатній температурі, потім розподіляли між водою (50мл) і ЕtOАс (50мл). Водний шар екстрагували ЕtOАс (2´50мл) і об'єднані органічні екстракти промивали і насиченим NaHCO3 (50мл) і насиченим розчином солі (50мл), сушили (Na2SO4) концентрували у вакуумі, одержуючи 1-(4-метилфеніл)-2-нітроетанол у вигляді безбарвного масла. 1H ЯМР (CDCI3, 500МГц) δ 7,28 (д, J=8,1Гц, 2Н), 7,21 (д, J=8,1Гц, 2Н), 5,42 (дт, J=9,6, 3,3Гц, 1Н), 4,60 (дд, J=13,3, 9,7Гц, 1Н), 55 86077 56 3-{[5'-Ізопропіл-2'-метокси-47,88 (ушир.с, 1H), 7,86 (ушир.с, 2Н), 5,22 (д, (трифторметил)біфеніл-2-іл]метил)-5-(4J=8,4Гц, 1H), 4,77 (кв.д, J=8,4, 6,9Гц, 1H), 3,03 метилфеніл)-1,3-оксазолідин-2-он (ушир.с, 1Н). 1,42 (д, J=6,9Гц, 3Н), еритроГідрид натрію (6,4мг 60% дисперсії у мінерадіастереоізомер: δ 7,90 (ушир.с, 1Н), 7,86 (ушир.с, льному маслі, 0,161ммоль) додавали до перемі2H), 5,59 (д, J=3,2Гц, 1Н), 4,72 (кв.д, J=3,2, 6,9Гц, шуваного розчину 5-(4-метилфеніл)-1,31Н), 3,03 (ушир.с, 1H), 1,50 (д, J=6,9Гц, 3Н). оксазолідин-2-онy (37,7мг, 0,0973ммоль) у безводному ТГФ (1мл) при кімнатній температурі в атмосфері N2. Реакційну суміш перемішували протягом 30 хвилин і додавали за допомогою канюлі розчин 2-(бромметил)-5'-ізопропіл-2'-метокси-4(трифторметил)біфенілу (19,0мг, 0,107ммоль) у безводному ТГФ (2мл). Реакційну суміш перемішували при кімнатній температурі протягом 3 днів. 2-Аміно-1-[3,5Реакцію гасили насиченим розчином NH4Cl (10мл) біс(трифторметил)феніл]пропан-1-ол і екстрагували ЕtOАс (3´20мл). Об'єднані органічні Суспензію нікелю Ренея (50мг) у розчині суміекстракти промивали насиченим розчином солі ші трео- і еритро-1-[3,5-біс(трифторметил)феніл](10мл), сушили (Na2SO4) і концентрували у вакуу2-нітропропан-1-олу у співвідношенні 1,5:1 (50мг, мі, одержуючи неочищений продукт. Його очищали 0,158ммоль) в 30% (об./об.) водної НСО2Н з використанням флеш-хроматографії (Si, (0,75мл) і МеОН (10мл) перемішували протягом 12´160мм, градієнт 0-80% ЕtOАс у гексанах), оденочі при кімнатній температурі під тиском ржуючи 3-{[5'-ізопропіл-2'-метокси-415фт./кв.дюйм Н2. Реакційну суміш фільтрували (трифторметил)біфеніл-2-іл]метил}-5-(4через шар целіту і фільтрат концентрували у вакуметилфеніл)-1,3-оксазолідин-2-он у вигляді безбаумі для видалення МеОН. Водну суспензію доворвного масла. Rf=0,37 (20% ЕtOАс/гексани). дили до рН9-10 з використанням 28% водного РХ/МС: обчислено= 484,21; знайдено= 484,2 NH4OH, розбавляли водою (20мл) і екстрагували (М+1)+. 1H ЯМР (бензол-d6, 500МГц, суміш атропоЕtOАс (3´20мл). Об'єднані екстракти промивали ізомерів у співвідношенні 1:1) δ 7,76 (с, 0,5Η), 7,65 насиченим розчином солі (10мл), сушили (Na2SO4) (с, 0,5Η), 7,31 (д, J=7,7Гц, 1H), 7,08 (дд, J=8,4, і концентрували у вакуумі, одержуючи суміш трео2,4Гц, 1Н), 7,05 (ушир.д, J=7,8Гц, 1H), 6,95-6,86 (м, і еритро-2-аміно-1-[3,55H), 6,58 (т, J=7,7Гц, 1Н), 4,74 (т, J=8,0Гц, 0,5Η), біс(трифторметил)феніл]пропан-1-олу у вигляді 4,70 (т, J=8,0Гц, 0,5Η), 4,50 (д, J=15,7Гц, 0,5Η), безбарвної твердої речовини. РХ/МС: обчислено= 4,42 (д, J=15,7Гц, 0,5Η), 4,25 (д, J=15,7Гц, 0,5Η), 288,08; знайдено= 288,1 (М+1)+. 1H ЯМР (CDCI3, 4,11 (д, J=15,7Гц, 0,5Η), 3,26 (с, 1,5 Η), 3,21 (с, 1,5 500МГц) трео-діастереоізомер: δ 7,79 (ушир.с, 3Н), Η), 2,81 (т, J=8,6Гц, 0,5Η), 2,76 (с, J=7,0Гц, 1H), 4,35 (ушир.с, 1Н), 3,25 (ушир.с, 1Н), 2,59 (ушир.с, 2,68 (т, J=8,6Гц, 0,5Η), 2,55 (т, J=8,6Гц, 0,5Η), 2,53 3Н), 0,86 (д, J=6,1Гц, 3Н), еритро-діастереоізомер: (т, J=8,6Гц, 0,5Η), 2,04 (с, 3Н), 1,20 (т, J=7,0Гц, 3Н), δ 7,79 (ушир.с, 3Н), 4,71 (ушир.с, 1H), 3,00 (ушир.с, 1,19 (т, J=7,0Гц, 3Н). 1Н), 2,59 (ушир.с, 3Н), 1,06 (д, J=5,0Гц, 3Н). 1-[3,5-Біс(трифторметил)феніл1-2нітропропан-1-ол Перемішуваний розчин 3,5біс(трифторметил)бензальдегіду (1,00г, 4,13ммоль) і нітроетану (1,13г, 1,08мл, 15,1ммоль) в абсолютному ЕtOН (20мл) при 0°С обробляли 10% водним NaOH (мас/об.) (1,73мл, 4.34ммоль), перемішували протягом 1 години і обробляли 2% водною оцтовою кислотою (мас/об.) (13,0мл, 4.32ммоль). Реакційну суміш перемішували протягом 1 години при кімнатній температурі, потім розподіляли між водою (50мл) і ЕtOАс (50мл). Водний шар екстрагували ЕtOАс (2x50мл) і об'єднані органічні екстракти промивали насиченим NaHCO3 (50мл) і насиченим розчином солі (50мл), сушили (Na2SO4) і концентрували у вакуумі, одержуючи суміш треоі еритро-1-[3,5біс(трифторметил)феніл]-2-нітропропан-1-олу у співвідношенні 1,5:1 у вигляді безбарвного масла. Ή ЯМР (CDCI3, 500МГц) трео-діастереоізомер: δ 5-[3,5-Біс(трифторметил)феніл]-4-метил-1,3оксазолідин-2-он Діізопропілетиламін (106мг, 142мкл, 0,817ммоль) і трифосген (20,2мг, 0,068ммоль) додавали послідовно до перемішуваного розчину 2аміно-1-[3,5-біс(трифторметил)феніл]пропан-1-олу (39,1мг, 0,136ммоль) у безводному СН2Сl2 (10мл) при 0°С в атмосфері N2. Реакційну суміш перемішували при 0°С протягом 1 години, потім концентрували у вакуумі до об'єму приблизно 5мл. Суміш розбавляли водою (50мл) і екстрагували ЕtOАс (3´50мл). Об'єднані органічні екстракти сушили (Na2SO4) і концентрували у вакуумі, одержуючи неочищений продукт. Його очищали з використанням флеш-хроматографії (Si, 12´160мм, градієнт 0-70% ЕtOАс у гексанах), одержуючи трео-5-[3,5біс(трифторметил)феніл]-4-метил-1,3-оксазолідин2-он (17,5мг) і еритро-5-[3,5 57 86077 58 біс(трифторметил)феніл]-4-метил-1,3-оксазолідинJ=7,0Гц, 1H), 0,84 (д, J=6,6Гц, 1H). Дану сполуку 2-он (14,4мг) у вигляді безбарвних твердих речорозділяли на енантіомери, що складають її, вин. Трео-діастереоізомер: Rf=0,63 (50% (4S,5R)-5-[3,5-біс(трифторметил)феніл]-4-метилЕtOАс/гексани). РХ/МС: обчислено= 314,06; знай1,3-оксазолідин-2-он і (4R,5S)-5-[3,5дено= 314,1 (М+1)+. 1H ЯМР (CDCI3, 600МГц) δ біс(трифторметил)феніл]-4-метил-1,3-оксазолідин7,90 (ушир.с, 1H), 7,83 (ушир.с, 2Н), 6,71 (ушир.с, 2-он з використанням хіральної ВЕРХ (колонка AS, 1H), 5,17 (д, J=7,0Гц, 1Н), 3,86 (ушир.п. J=6,2Гц, 20´250мм, 15% і-РRОН у гептані). 1H), 1,48 (д, J=6,2Гц, 1H). Дану сполуку розділяли Хіральний синтез (4S,5R)-5-[3,5на енантіомери, що складають її, (4R,5R)-5-[3,5біс(трифторметил)феніл]-4-метил-1,3-оксазолідинбіс(трифторметил)феніл]-4-метил-1,3-оксазолідин2-ону 2-он і (4S,5S)-5-[3,5-біс(трифторметил)феніл]-4Дана проміжна сполука може бути безпосереметил-1,3-оксазолідин-2-он з використанням хірадньо одержана з хіральної вихідної речовини CBZльної ВЕРХ (колонка AS, 20´250мм, 20% і-РrОН у L-аланіну з використанням показаного далі 3гептані). Еритро-діастереоізомер: Rf=0,38 (50% стадійного шляху. Сполука (4R,5S)-5-[3,5EtOAc/гексани). РХ/МС: обчислено= 314,06; знайбіс(трифторметил)феніл]-4-метил-1,3-оксазолідиндено= 314,1 (М+1)+. 1H ЯМР (CDCI3, 600МГц) δ 2-он може бути одержана аналогічним шляхом, 7,90 (ушир.с, 1H), 7,79 (ушир.с, 2Н), 5,83 (д, виходячи з CBZ-D-аланіну. J=8,0Гц, 1Н), 5,34 (ушир.с, 1Н), 4,31 (ушир.п, CBZ-L-аланін (6,5кг, 28,5моль), НОВТ-гідрат (4,8кг, 34,8моль), НСI сіль аміну Вейнреба (3,4кг, 36,2моль) і ТГФ (32л) завантажували у чисту колбу в атмосфері азоту. Суміш охолоджували до 010°С і потім повільно додавали DIPEA (12,4л) при температурі нижче 20°С. Потім повільно додавали EDC-HCL (7кг, 36,2моль) при легкому охолоджуванні до 15-25°С. Суспензію залишали на ніч при 20-25°С. Потім суміш охолоджували до 010°С і повільно додавали 3н НСI (13л). Потім додавали ІРАС (45,5л) і шари розділяли. Органіч ний шар промивали один раз НСI (13л) і двічі 8% NаНСО3 (13л). Органічний шар потім концентрували у вакуумі до об'єму 20л при 50°С. Прозорий розчин повільно охолоджували до кімнатної температури, даючи можливість кристалізації продукту. Потім повільно додавали гептан (-70л). Суспензію фільтрували, промивали гептаном (18л) і сушили при кімнатній температурі на фільтрувальному крузі. Продукт одержували з ее >99,9%, виміряним за допомогою хіральної ВЕРХ. Амід Вейнреба зі стадії 1 (6кг, 22,5моль) і 3,5біс(трифторметил)бромбензол (4,85л, 28,1моль) розчиняли у безводному ТГФ (24л). Розчин продували азотом для видалення перегнаного кисню. Розчин охолоджували до -10°С і повільно додавали iso-PrMgCl у ТГФ (56,4моль) (2 години) до реакційної суміші за допомогою краплинної лійки, підтримуючи реакційну температуру £5°С. Розчин залишали нагріватися до 20°С і витримували протягом ночі при 20°С. Реакційну суміш потім охолоджували до -10°С в атмосфері азоту і повільно гасили протягом 2 годин в 5н НСI (14л), підтримуючи температуру при 0-5°С. Додавали МТВЕ (60л) і двофазову суміш витримували протягом 5 хвилин. Після нагрівання до 20°С-25°С суміші давали можливість прийти у норму протягом 30 хвилин і потім шари розділяли. Органічний шар двічі промивали водою (12л). Органічний шар переносили у вакуумі через 1-мікронний PTFE фільтр у перегінну колбу і потім концентрували у вакуумі до ~12л (внутрішня температура
ДивитисяДодаткова інформація
Назва патенту англійськоюCetp inhibitors
Автори англійськоюAli Amjad, Napolitano Joann M., Deng Qiaolin, Lu Zhijian, Sinclair Peter J, Taylor Gayle E., Thompson Christopher F., Quraishi Nazia, Smith Cameron J., Hunt Julianne A.
Назва патенту російськоюИнгибиторы сетр
Автори російськоюАли Амджад, Наполитано Джоанн М., Ден Сяолин, Лу Чжицзянь, Синклер Питер Дж., Тейлор Гейл Э., Томпсон Кристофер Ф., Курайши Назя, Смит Камерон Дж., Хант Джулиан А.
МПК / Мітки
МПК: C07D 263/22, A61P 3/06, C07D 233/24, C07D 401/04, A61K 31/4439, C07D 413/06, C07D 413/04, C07D 207/26, C07D 285/10, A61K 31/4166, A61K 31/4015, C07D 263/20, A61K 31/433
Мітки: інгібітори, сетр
Код посилання
<a href="https://ua.patents.su/51-86077-ingibitori-setr.html" target="_blank" rel="follow" title="База патентів України">Інгібітори сетр</a>
Попередній патент: Спосіб одержання композиційного органо-мінерального добрива і спосіб обробки насіння та вегетативної маси рослин композиційним органо-мінеральним добривом
Наступний патент: Спосіб швидкодіючого максимального струмового захисту електричних кіл (варіанти)
Випадковий патент: Апарат для сатурації лужних цукрових розчинів