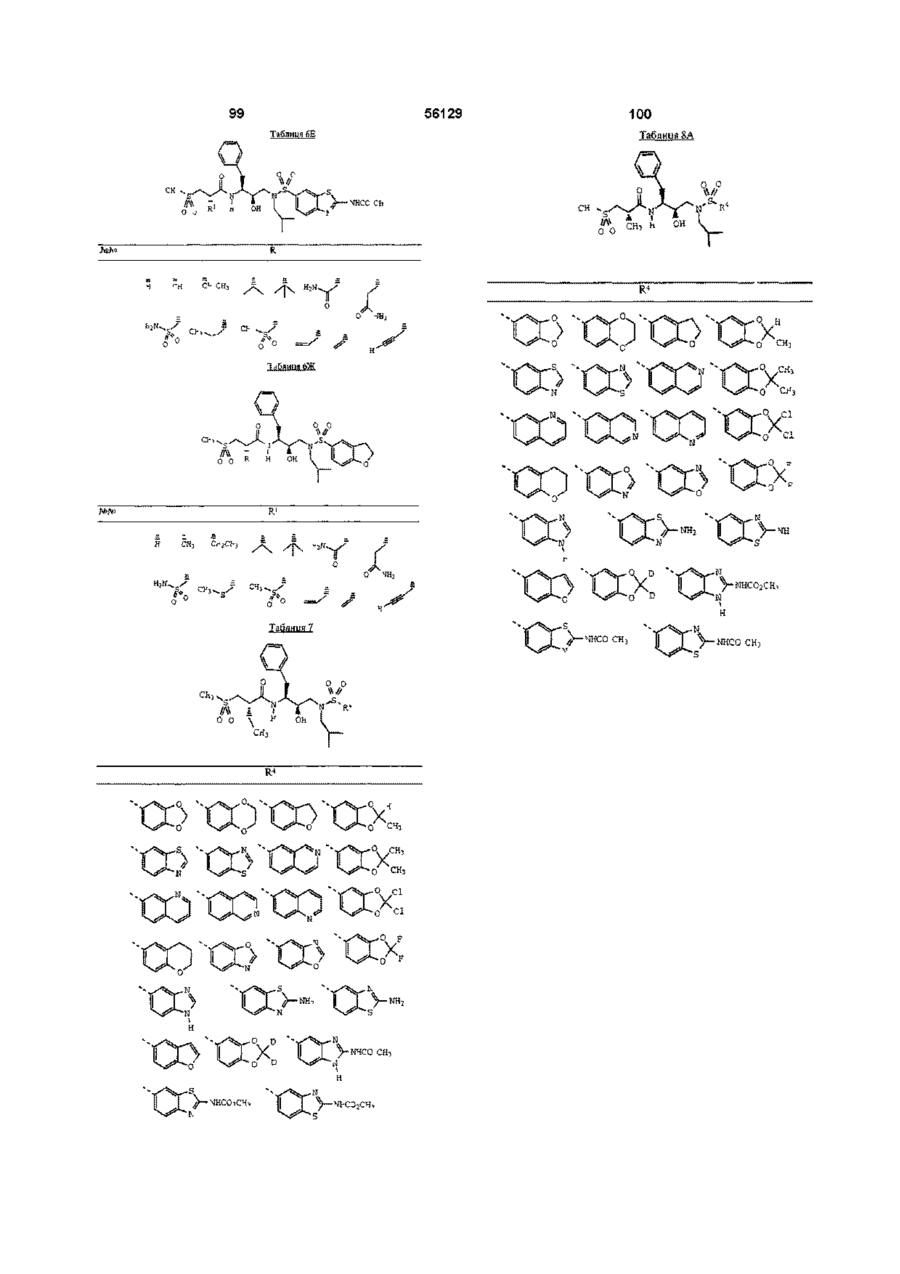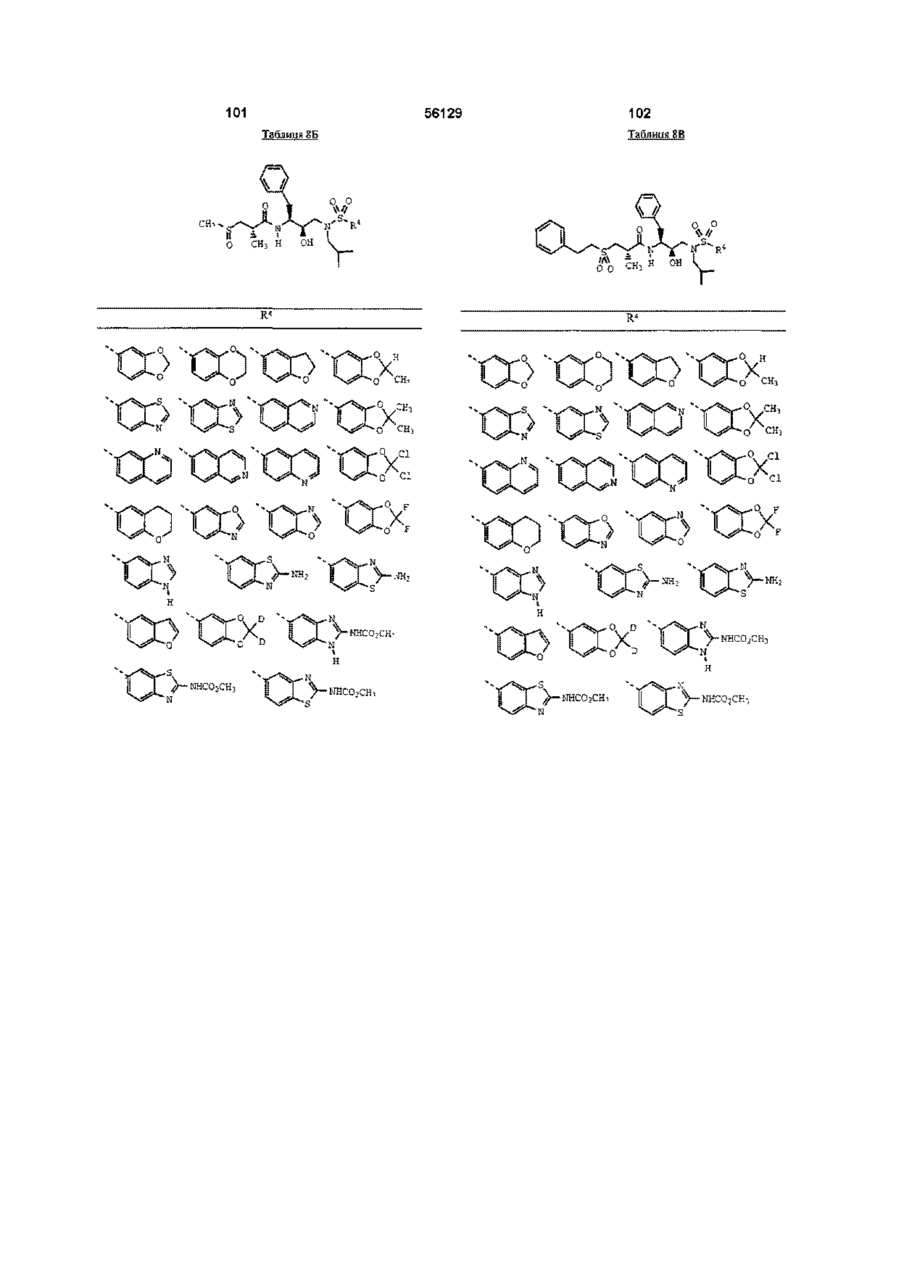Сульфонілалканоїламіногідроксіетиламіносульфонаміди, фармакологічна композиція, що їх містить, спосіб інгібування протеаз ретровірусів та запобігання реплікації ретровірусу, зокрема, in vitro, а також спосіб лі
Номер патенту: 56129
Опубліковано: 15.05.2003
Автори: Фрескос Джон Н., Макдонелд Джозеф Дж., Сікорскі Джеймс А., Гетмен Деніел П., Васкез Майкл Л., Нагарян Срінівазан, Декрессенцо Гері А., Девадас Балекудру
Формула / Реферат
1. Сульфонілалканоїламіногідроксіетиламіносульфонаміди за формулою
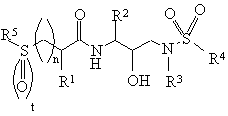
або їх фармацевтичнo прийнятні солі, проліки або складні ефіри,
де символи n і t кожний незалежно один від одного дорівнюють 0, 1 або 2;
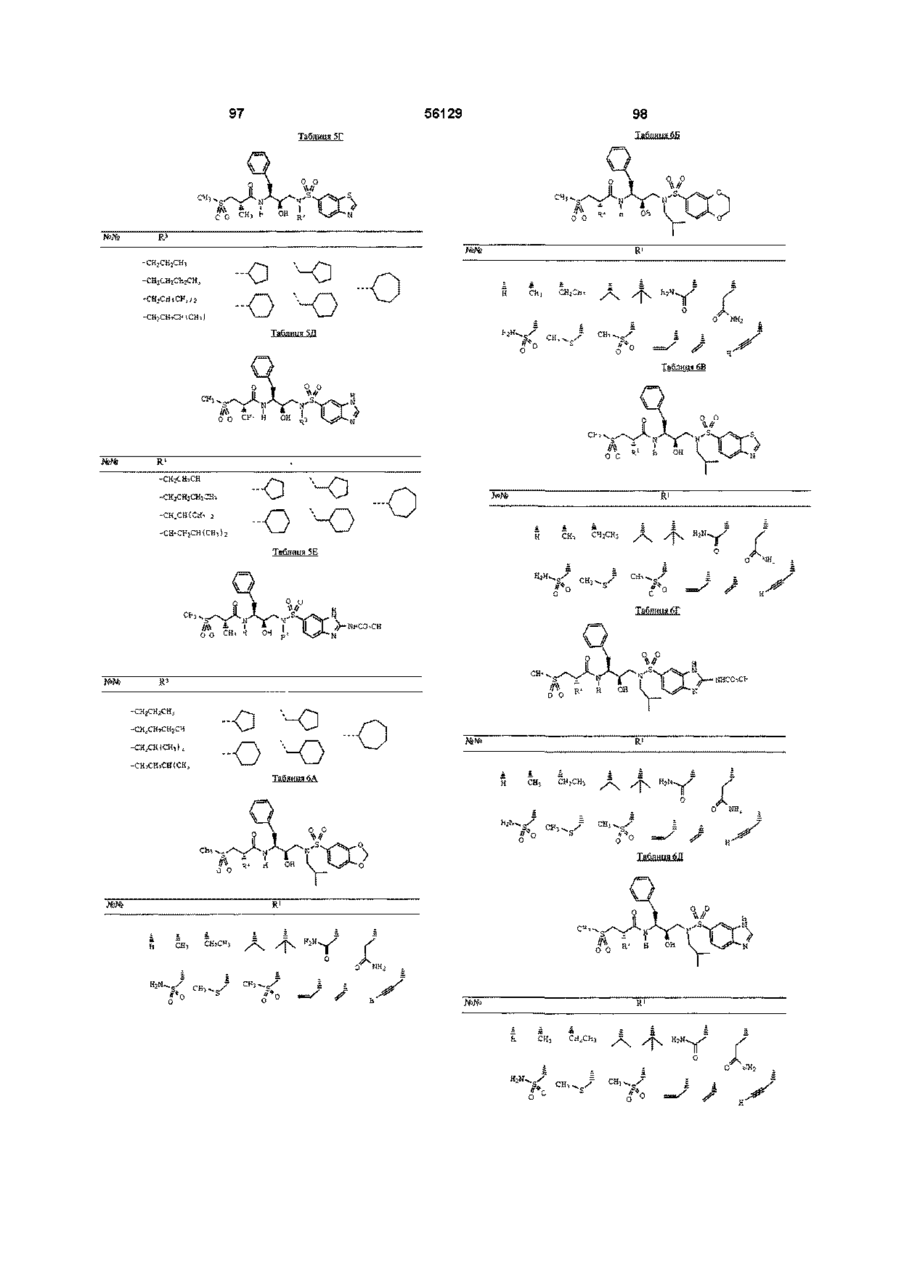
R1 означає водень, алкіл з 1 - 5 атомами вуглецю, алкеніл з 2 - 5 атомами вуглецю, алкініл з 2 - 5 атомами вуглецю, гідроксіалкіл з 1 - 3 атомами вуглецю, алкоксіалкіл, що складається з алкілу з 1 - 3 атомами і алкокси з 1 - 3 атомами вуглецю, ціаноалкіл, що містить алкіл з 1 - 3 атомами вуглецю, -СН2СОNН2, -CH2CH2CONH2, -CH2S(O)2NH2, -CH2SCH3, -СН2S(О) СН3 або -CH2S(O)2СН3;
R2 означає алкіл з 1 - 5 атомами вуглецю, аралкіл, що містить алкіл з 1 - 3 атомами вуглецю, алкілтіоалкіл, що містить алкіл з 1 - 3 атомами вуглецю, арилтіоалкіл, що містить алкіл з 1 - 3 атомами вуглецю, або циклоалкілалкіл, що складається з алкілу з 1 - 3 атомами вуглецю і 3-6-членного вуглецевого кільця;
R3 означає алкіл з 1 - 5 атомами вуглецю, 5 - 8-членний циклоалкіл або 3 - 6-членний циклоалкілметил;
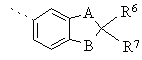
R4 означає сконденсований з бензольним ядром 5 - 6-членний гетероарил або сконденсований з бензольним ядром 5 - 6-членний гетероцикл; або групу за формулою
 ,
,
де А і В кожний незалежно один від одного означає О, S, SO або SO2;
R6 означає дейтерій, алкіл з 1 - 5 атомами вуглецю, фтор або хлор;
R7 означає водень, дейтерій, метил, фтор або хлор;
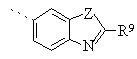
або групу за формулою
 ,
,
де Z означає О, S або NH і R9 означає групу за формулою
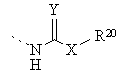 ,
, 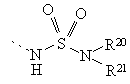 ,
, 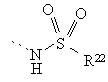 ,
,
де Y означає О, S або NH;
Х означає зв'язок, О або NR21;
R20 означає водень, алкіл з 1 - 5 атомами вуглецю, алкеніл з 2 - 5 атомами вуглецю, алкініл з 2 - 5 атомами вуглецю, аралкіл, що містить алкіл з 1 - 5 атомами вуглецю, гетероаралкіл, що складається з 5 - 6-членного кільця і алкілу з 1 - 5 атомами вуглецю, гетероциклоалкіл, що складається з 5 - 6-членного кільця і алкілу з 1 - 5 атомами вуглецю, аміноалкіл з 2 - 5 атомами вуглецю, N -монозаміщений або N, N -дизаміщений аміноалкіл, що містить алкіл з 2 - 5 атомами вуглецю, де означені замісники вибрані з групи, яка включає алкіл з 1 - 3 атомами вуглецю, аралкіл, що містить алкіл з 1 - 3 атомами вуглецю, карбоксіалкіл з 1 - 5 атомами вуглецю, алкоксікарбонілалкіл, що містить алкіл з 1 - 5 атомами вуглецю, ціаноалкіл з 1 - 5 атомами вуглецю або гідроксіалкіл з 2 - 5 атомами вуглецю;
R21 означає водень або алкіл з 1 - 3 атомами вуглецю;
або група за формулою –NR20R21 означає 5 - 6-членний гетероцикл; і
R22 означає алкіл з 1 - 3 атомами вуглецю або R20R21N -алкільну групу, яка містить алкіл з 1 - 3 атомами вуглецю; і
R5 означає алкіл з 1 - 5 атомами вуглецю, алкеніл з 2 - 5 атомами вуглецю, алкініл з 2 - 5 атомами вуглецю або алкіл, заміщений арилом з 1 - 5 атомами вуглецю.
2. Сполука за п. 1 або її фармацевтичнo прийнятна сіль, проліки або складний ефір, де n дорівнює 1; t дорівнює 1 або 2;
R1 означає водень, алкіл з 1 - 3 атомами вуглецю, алкеніл з 2 - 3 атомами вуглецю, алкініл з 2 - 3 атомами вуглецю або ціанометил;
R2 означає алкіл з 3 - 5 атомами вуглецю, арилметил, алкілтіоалкіл, алкіл з 1 - 3 атомами вуглецю, арилтіометил або циклоалкілметил, що містит 5-6-членне вуглецеве кільце;
R3 означає алкіл з 1 - 5 атомами вуглецю, 3-6-членний циклоалкілметил, циклогексил або циклогептил;
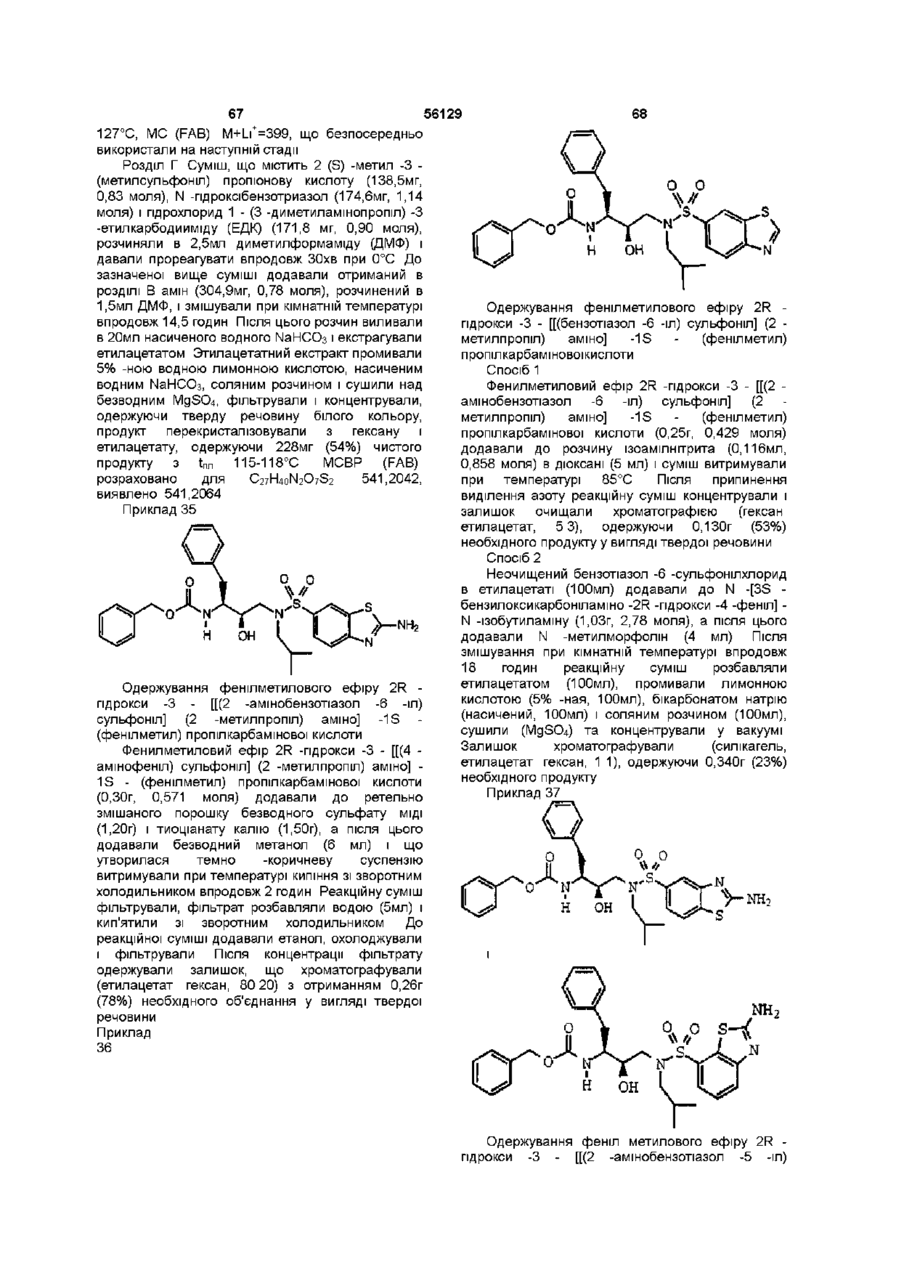
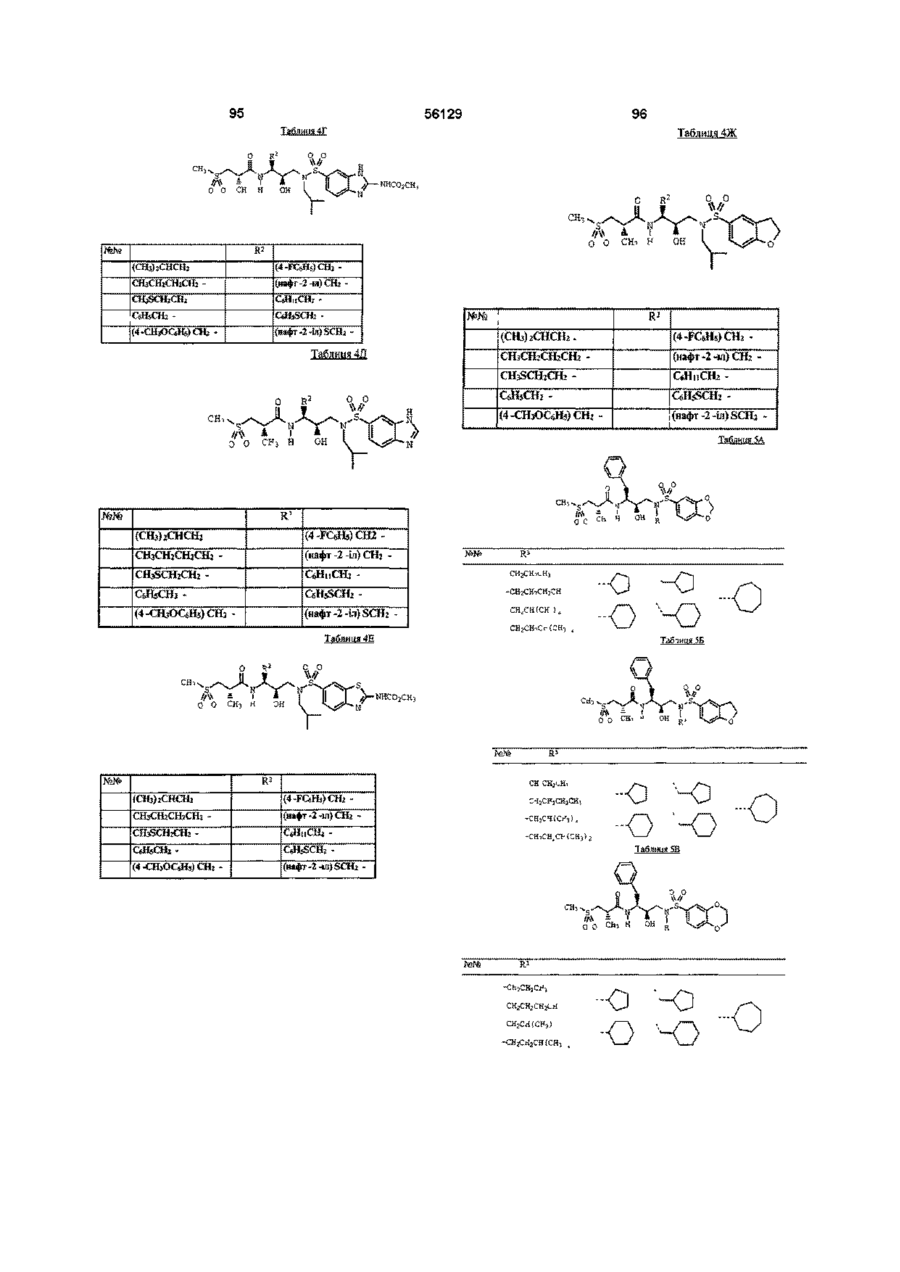
R4 означає 2 -амінобензотіазол -5 -іл, 2 -амінобензотіазол -6 -іл, бензотіазол-5-іл, бензотіазол-6-іл, бензоксазол-5-іл, 2,3-дигідробензофуран-5-іл, бензофуран-5-іл, 1,3-бензодіоксол-5-іл або 1,4-бензодіоксан-6-іл; або групу за формулою
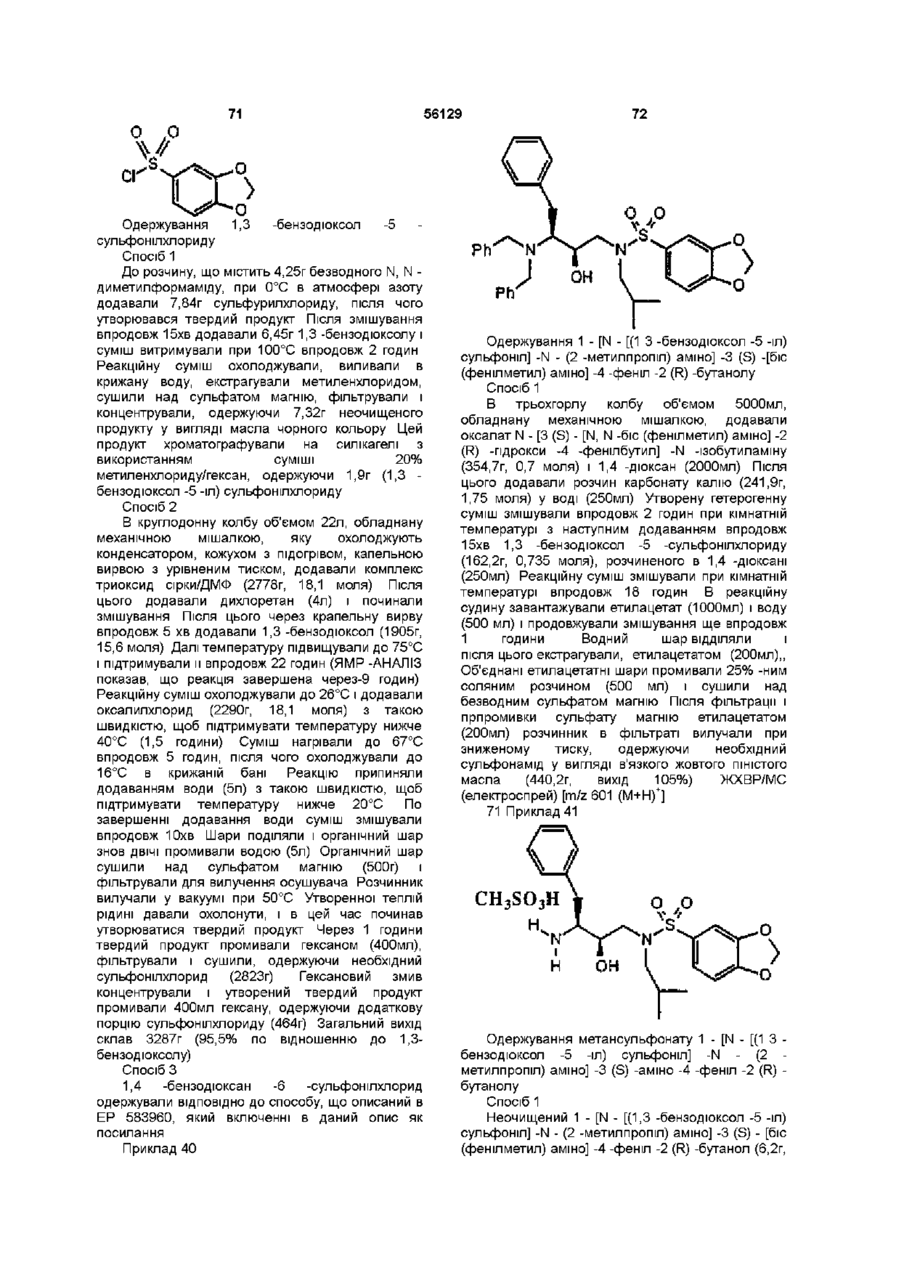
 ,
,
де А і В кожний означає О;
R6 означає дейтерій, метил, етил, пропіл, ізопропіл або фтор і R7 означає водень, дейтерій, метил або фтор;
або групу за формулою
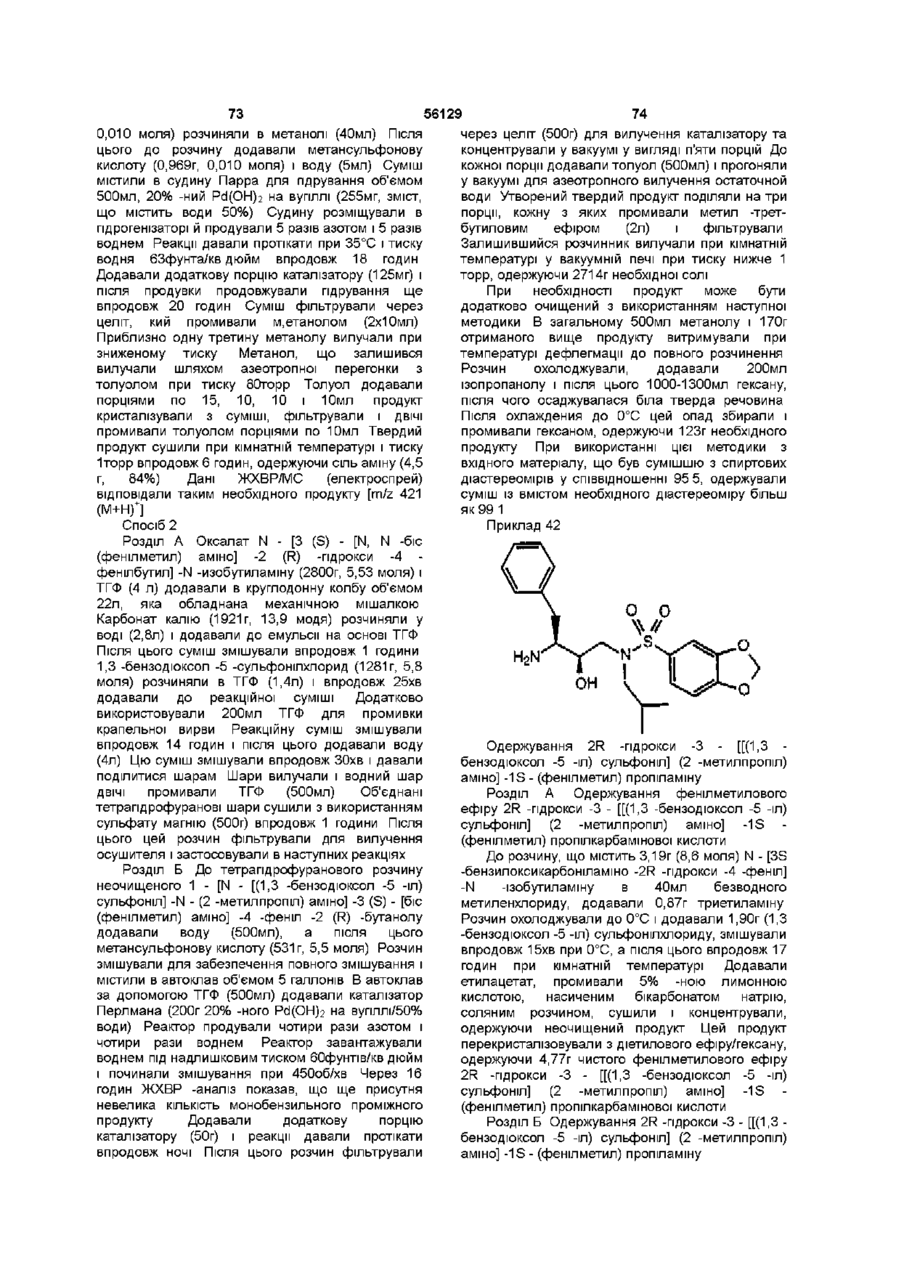
 ,
,
де Z означає О, S або NH і
R9 означає групу за формулою
 ,
,  ,
,  ,
,
деY означає О, S або NH;
Х означає зв'язок, О або NR21;
R20 означає водень, алкіл з 1 - 5 атомами вуглецю, фенілалкіл, що містить алкіл з 1 - 3 атомами вуглецю, гетероциклоалкіл, що складається з 5 - 6-членного кільця і алкілу з 1 - 3 атомами вуглецю, або N -монозаміщений або N, N -дизаміщений аміно алкіл, який міститьалкіл з 2 - 3 атомами вуглецю, де означені замісники є алкілом з 1 - 3 атомами вуглецю;
R21 означає водень або метил;
або група за формулою -NR20R21 означає піролідиніл, піперидиніл, піперазиніл, 4-метилпіперазиніл, 4 -бензилпіперазиніл, морфолініл або тіаморфолініл; і
R22 означає алкіл з 1 - 3 атомами вуглецю; і
R5 означає алкіл з 1 - 5 атомами вуглецю, алкеніл з 3 - 4 атомами вуглецю, алкініл з 3 - 4 атомами вуглецю або алкіл, заміщений арилом з 1 - 4 атомами вуглецю.
3. Сполука за п. 2 або її фармацевтичнo прийнятна сіль, проліки або складний ефір, де
R1 означає водень, метил, етил або ціанометил;
R2 означає ізобутил, н -бутил, CH3SCH2CH2-, фенілтіометил, (2 -нафтилтіо) метил, бензил, 4 -метоксифенілметил, 4 -гідроксифенілметил, 4 -фторфенілметил або циклогексилметил;
R3 означає пропіл, ізоаміл, ізобутил, бутил, циклогексил, циклогептил, циклопентилметил або циклогексилметил; і
R4 означає бензотіазол -5 -іл, бензотіазол -6 -іл, бензоксазол -5 -іл, 2,3-дигідробензофуран -5 -іл, бензофуран -5 -іл, 1,3 -бензодіоксол-5 -іл, 2 -метил -1,3 -бензодіоксол -5 -іл, 2,2 -диметил -1,3 -бензодіоксол -5 -іл, 2,2 -дидейтерій -1,3 -бензодіоксол -5 -іл, 2,2 -дифтор -1, 3 -бензодіоксол -5 -іл або 1,4 -бензодіоксан -6 -іл; або групу за формулою
 ,
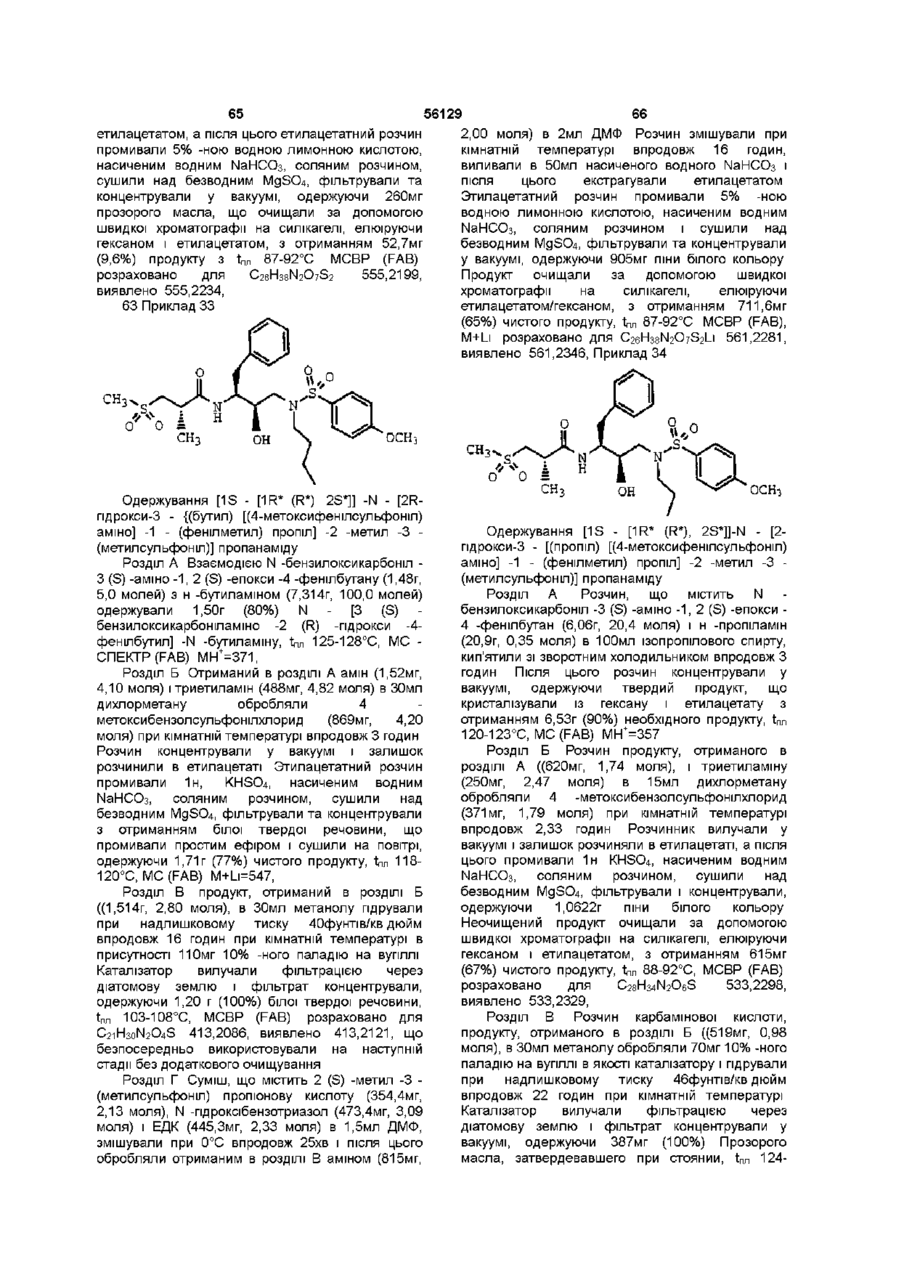
,
де Z означає О, S або NH і
R9 означає групу за формулою
 ,
,  або
або  ,
,
де Y означає О, S або NH; Х означає зв'язок, О або NR21;
R20 означає водень, метил, етил, пропіл, ізопропіл, ізобутил, бензил, 2-(1-піролідиніл)етил, 2-(1-піперидиніл)етил, 2-(1-піперазиніл)етил, 2-(4-метилпіперазин-1-іл)етил, 2-(1-морфолініл)етил, 2-(1-тіаморфолініл)етил або 2-(N,N-диметиламіно)етил;
R21 означає водень і
R22 означає метил; і
R5 означає алкіл з 1-5 атомами вуглецю або алкіл, заміщений фенілом з 2-4 атомами вуглецю.
4. Сполука за п. 3 або її фармацевтичнo прийнятна сіль, проліки або складний ефір, де
R1 означає метил або етил;
R2 означає бензил, 4-фторфенілметил або циклогексилметил;
R4 означає бензотіазол-5-іл, бензотіазол-6-іл, 2,3-дигідробензофуран-5-іл, бензофуран-5-іл, 1,3-бензодіоксол-5-іл, 2-метил-1,3-бензодіоксол-5-іл, 2,2-диметил-1,3-бензодіоксол-5-іл, 2,2-дидейтерій-1,3-бензодіоксол-5-іл, 2,2-дифтор-1,3-бензодіоксол-5-іл, 1,4-бензодіоксан-6-іл, 2-(метоксикарбоніламіно)бензотіазол-6-іл або 2-(метоксикарбоніламіно)бензимідазол-5-іл; і
R5 означає метил, етил, пропіл, ізопропіл або 2-фенілетил.
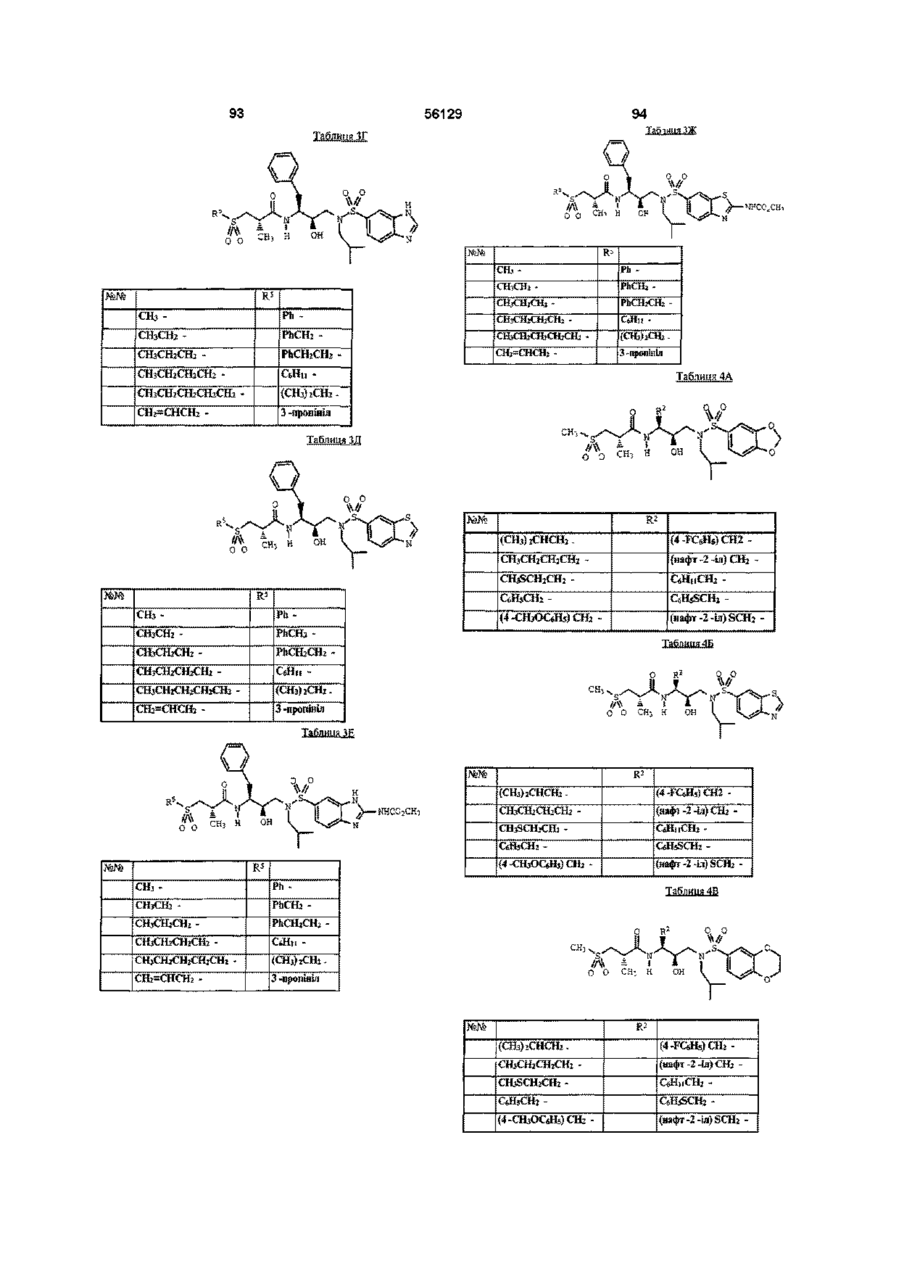
5. Сполука за п. 1, вибрана з групи, яка включає:
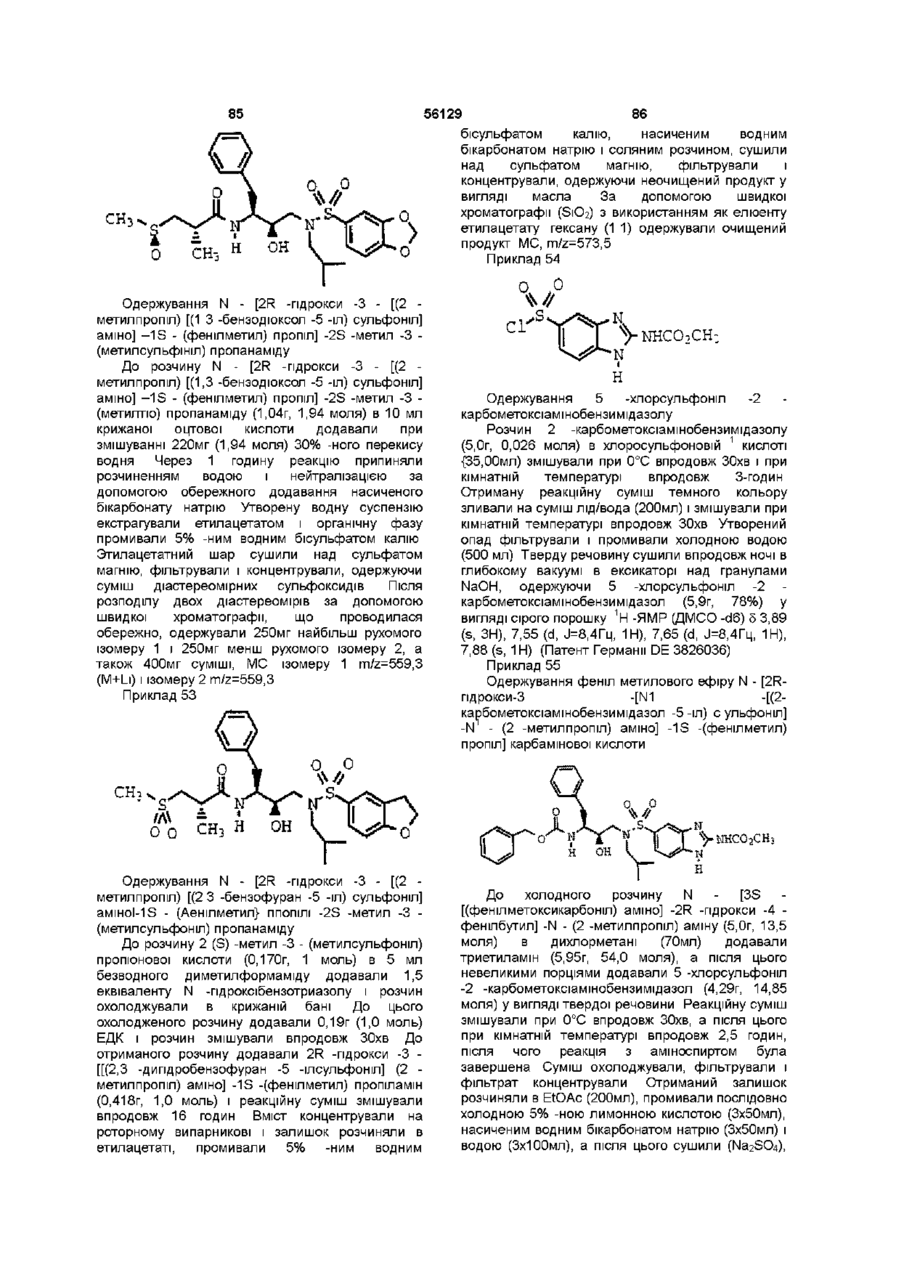
N-[2R -гідрокси -3 - [(2 -метилпропіл) [(1,3 -бензодіоксол -5 -іл) сульфоніл] аміно] -1S - (фенілметил) пропіл] -2S -метил -3 - (метилсульфоніл) пропанамід;
N - [2R -гідрокси -3 - [(2 -метилпропіл) [(1,4 -бензодіоксан -6 -іл) сульфоніл] аміно] -1S - (фенілметил) пропіл] -2S -метил -3 - (метилсульфоніл) пропанамід;
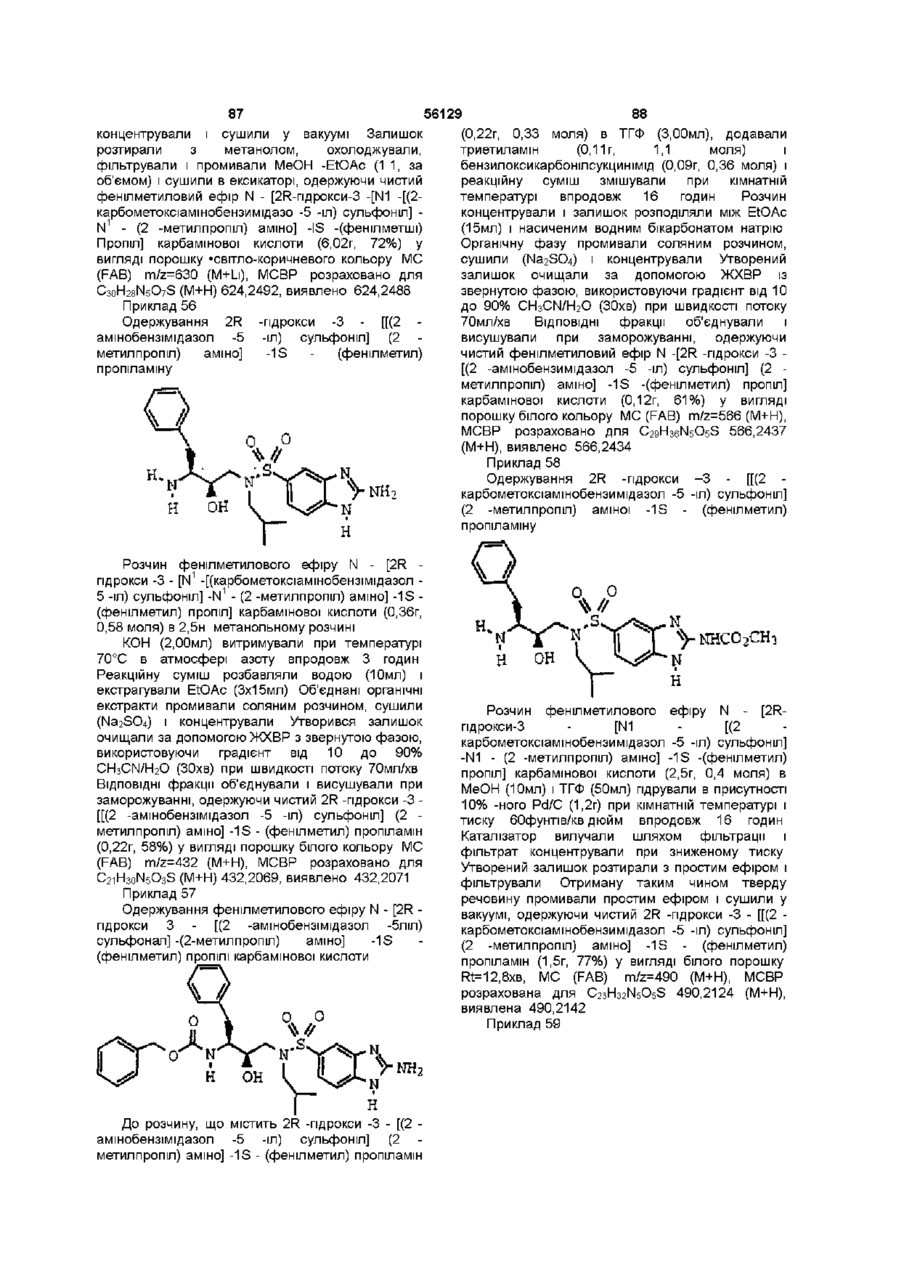
N - [2R-гідрокси-3 - [(2-метилпропіл) [(бензотіазол-6-іл) сульфоніл] аміно]-1S -(фенілметил) пропіл] -2S -метил -3 - (метилсульфоніл) пропанамід;
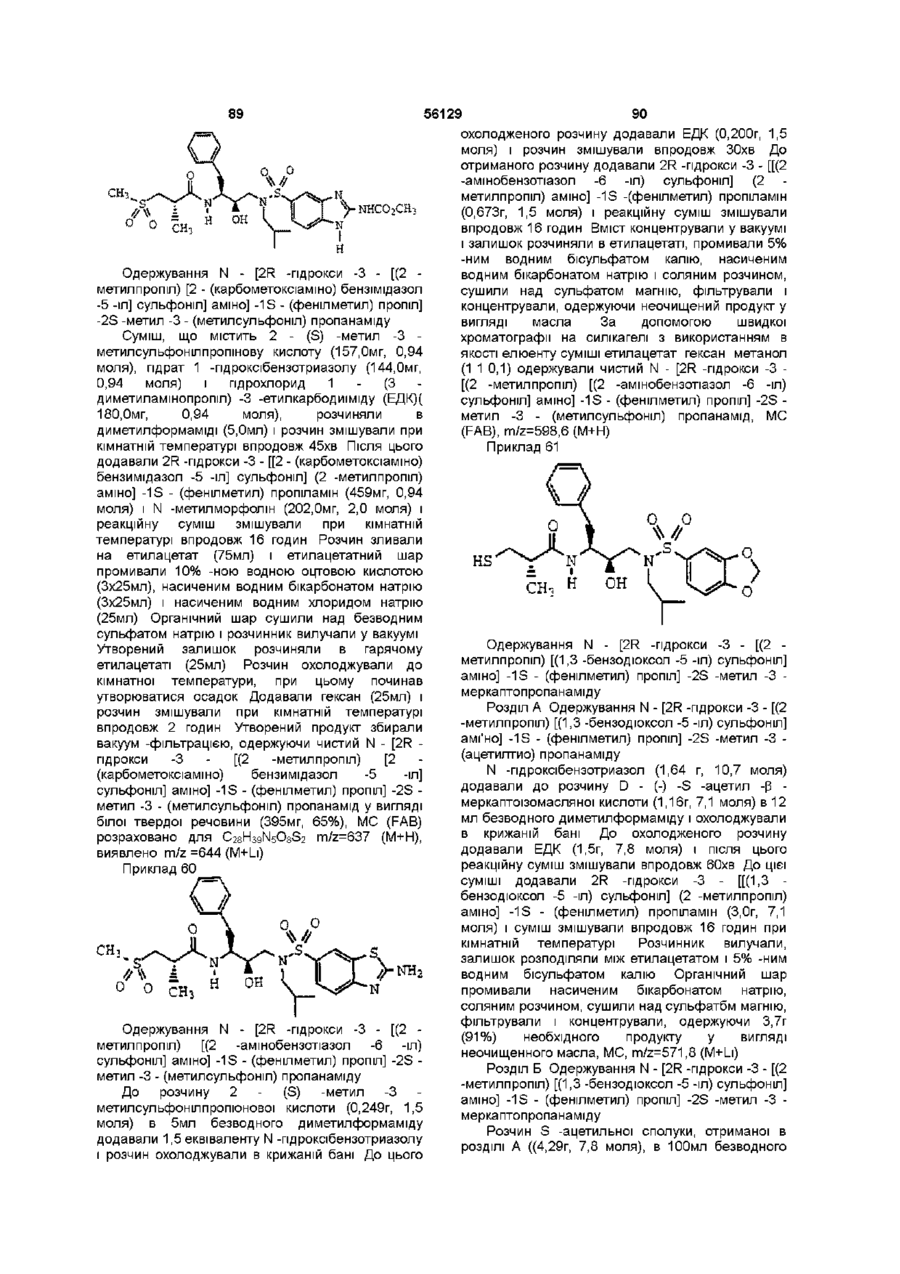
N - [2R -гідрокси -3 - [(2 -метилпропіл) [(бензотіазол -5 -іл) сульфоніл] аміно] -1S -(фенілметил) пропіл] -2S -метил -3 - (метилсульфоніл) пропанамід; і
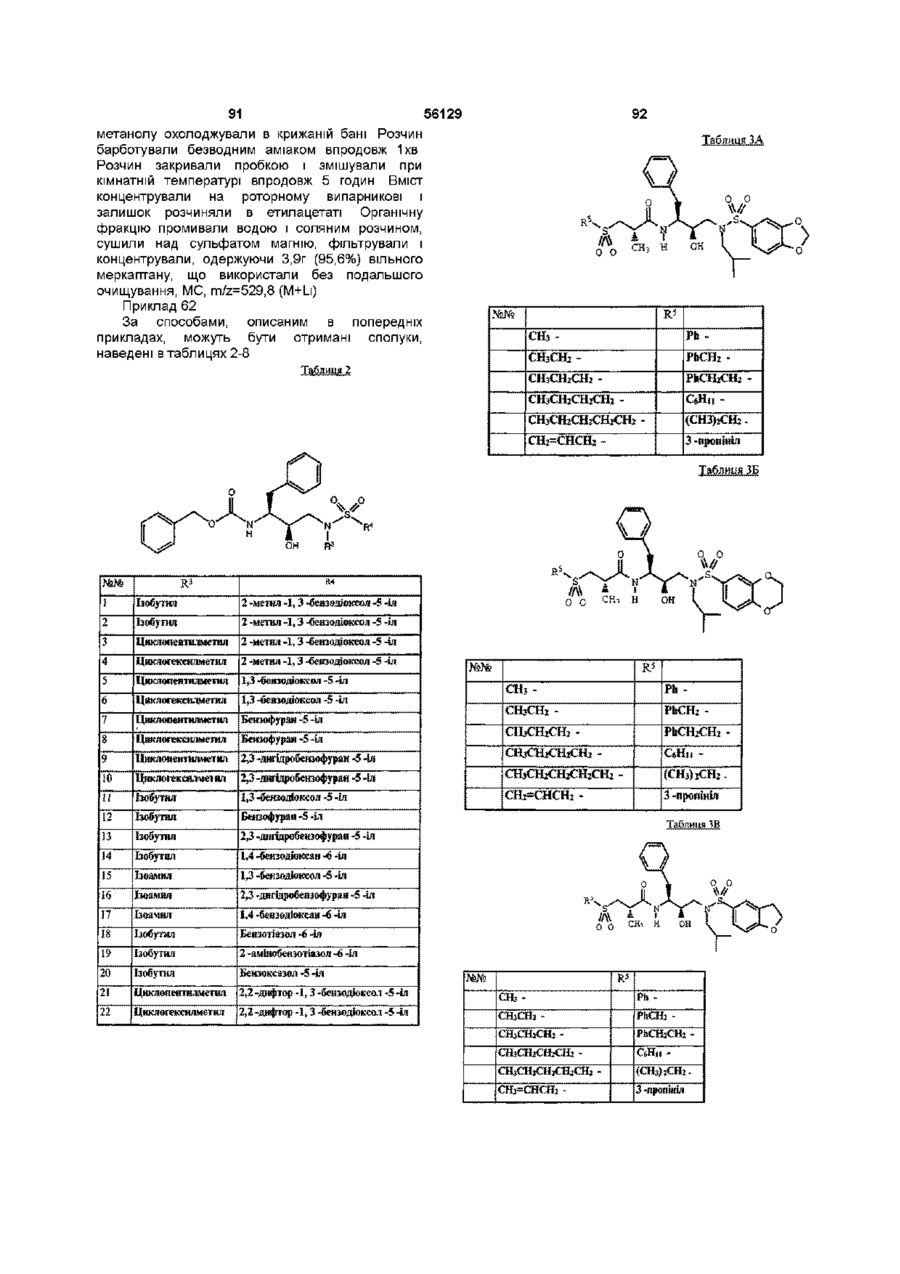
N - [2R -гідрокси -3 - [(2 -метилпропіл) [(2,3 -дигідробензофуран -5 -іл) сульфоніл] аміно] -1S - (фенілметил) пропіл] -2S -метил -3 - (метилсульфоніл) пропанамід.
6. Композиція, що містить сполуку за п. 1 і фармацевтичнo прийнятний носій.
7. Спосіб інгібування протеази ретровірусу, що включає введення ефективної кількості сполуки за п. 1.
8. Спосіб лікування ретровірусної інфекції, що включає введення ефективної кількості композиції за п. 6.
9. Спосіб запобігання реплікації ретровірусу, що включає введення ефективної кількості сполуки за п. 1.
10. Спосіб запобігання реплікації ретровірусу in vitro, що включає введення ефективної кількості сполуки за п. 1.
11. Спосіб лікування СНІДу, що включає введення ефективної кількості композиції за п. 6.
Текст
1 Сульфонілалканоіламінопдроксіетиламшосульфонаміди за формулою О R2 О. О атомами вуглецю, або циклоалкілалкіл, що складається з алкілу з 1 -3 атомами вуглецю і 3-6членного вуглецевого кільця, R3 означає алкіл з 1 -5 атомами вуглецю, 5 -8 членний циклоалкіл або 3 -6 -членний циклоалкілметил, R4 означає сконденсований з бензольним ядром 5 -6 -членний гетероарил або сконденсований з бензольним ядром 5 -6 -членний гетероцикл, або групу за формулою -А де А і В кожний незалежно один від одного означає О, S, SO або SO 2 , R6 означає дейтерій, алкіл з 1 -5 атомами вуглецю, фтор або хлор, R7 означає водень, дейтерій, метил, фтор або хлор, або групу за формулою 'z\ R9 де Z означає О, S або NH і R означає групу за формулою або їх фармацевтично прийнятні солі, проліки або складні ефіри, де символи п 11 кожний незалежно один від одного дорівнюють 0, 1 або 2, R1 означає водень, алкіл з 1 -5 атомами вуглецю, алкеніл з 2 -5 атомами вуглецю, алкініл з 2 -5 атомами вуглецю, пдроксіалкіл з 1 -3 атомами вуглецю, алкоксіалкіл, що складається з алкілу з 1 -З атомами і алкокси з 1 -3 атомами вуглецю, ціаноалкіл, що містить алкіл з 1 -3 атомами вуглецю, -CH 2 CONH 2 , -CH2CH2CONH2, CH 2 S(O) 2 NH 2 , -CH2SCH3, -CH 2 S(O) СНз або CH 2 S(O) 2 CH 3 , R2 означає алкіл з 1 -5 атомами вуглецю, аралкіл, що містить алкіл з 1 -3 атомами вуглецю, алкілтюалкіл, що містить алкіл з 1 -3 атомами вуглецю, арилтюалкіл, що містить алкіл з 1 -З О Y , R20 1 N х" H L N H і 0 (О 0 ю • - - P 2 2 к де Y означає О, S або NH, X означає зв'язок, О або NR 2 1 , R означає водень, алкіл з 1 -5 атомами вуглецю, алкеніл з 2 -5 атомами вуглецю, алкініл з 2 -5 атомами вуглецю, аралкіл, що містить алкіл з 1 -5 атомами вуглецю, гетероаралкіл, що складається з 5 -6 -членного кільця і алкілу з 1 -5 атомами вуглецю, гетероциклоалкіл, що складається з 5 -6 членного кільця і алкілу з 1 -5 атомами вуглецю, аміноалкіл з 2 -5 атомами вуглецю, N монозаміщений або N, N -дизаміщений аміноалкіл, що містить алкіл з 2 -5 атомами вуглецю, де означені замісники вибрані з групи, яка включає алкіл з 1 -3 атомами вуглецю, аралкіл, що містить 56129 алкіл з 1 -3 атомами вуглецю, карбоксіалкіл з 1 -5 атомами вуглецю, алкоксікарбонілалкіл, що містить алкіл з 1 -5 атомами вуглецю, ціаноалкіл з 1 -5 атомами вуглецю або пдроксіалкіл з 2 -5 атомами вуглецю, 21 R означає водень або алкіл з 1 -3 атомами вуглецю, або група за формулою - N R R означає 5 -6 членний гетероцикл, і 22 R означає алкіл з 1 -3 атомами вуглецю або R R N -алкільну групу, яка містить алкіл з 1 -З атомами вуглецю, і 5 R означає алкіл з 1 -5 атомами вуглецю, алкеніл з 2 -5 атомами вуглецю, алкініл з 2 -5 атомами вуглецю або алкіл, заміщений арилом з 1 -5 атомами вуглецю 2 Сполука за п 1 або и фармацевтично прийнятна сіль, проліки або складний ефір, де п дорівнює 1, t дорівнює 1 або 2, R1 означає водень, алкіл з 1 -3 атомами вуглецю, алкеніл з 2 -3 атомами вуглецю, алкініл з 2 -З атомами вуглецю або ціанометил, R2 означає алкіл з 3 -5 атомами вуглецю, арилметил, алкілтюалкіл, алкіл з 1 -3 атомами вуглецю, арилтюметил або циклоалкілметил, що містит 5-6-членне вуглецеве кільце, R3 означає алкіл з 1-5 атомами вуглецю, 3-6членний циклоалкілметил, циклогексил або циклогептил, R4 означає 2 -амінобензотіазол -5 -іл, 2 амінобензотіазол -6 -іл, бензотіазол-5-іл, бензотіазол-6-іл, бензоксазол-5-іл, 2,3дипдробензофуран-5-іл, бензофуран-5-іл, 1,3бензодюксол-5-іл або 1,4-бензодюксан-6-іл, або групу за формулою -А пірол ід иніл, піперидиніл, піперазиніл, 4метилпіперазиніл, 4 -бензил піперазиніл, морфолініл аботіаморфолініл, і 2 2 ї ї ' R означає алкіл з 1 -3 атомами вуглецю, і 5 R означає алкіл з 1 -5 атомами вуглецю, алкеніл з З -4 атомами вуглецю, алкініл з 3-4 атомами вуглецю або алкіл, заміщений арилом з 1 -4 атомами вуглецю З Сполука за п 2 або и фармацевтично прийнятна сіль, проліки або складний ефір, де 1 R означає водень, метил, етил або ціанометил, 2 R означає ізобутил, н -бутил, CH3SCH2CH2-, фенілтюметил, (2 -нафтилтю) метил, бензил, 4 метоксифенілметил, 4 -гідроксифенілметил, 4 фторфенілметил або циклогексилметил, 3 R означає пропіл, ізоаміл, ізобутил, бутил, циклогексил, циклогептил, циклопентилметил або циклогексилметил, і R4 означає бензотіазол -5 -іл, бензотіазол -6 -іл, бензоксазол -5 -іл, 2,3-дипдробензофуран -5 -іл, бензофуран -5 -іл, 1,3 -бензодюксол-5 -іл, 2 -метил -1,3 -бензодюксол -5 -іл, 2,2 -диметил -1,3 бензодюксол -5 -іл, 2,2 -дидейтерій -1,3 бензодюксол -5 -іл, 2,2 -дифтор - 1 , 3 -бензодюксол -5 -іл або 1,4 -бензодюксан -6 -іл, або групу за формулою 'z\ де Z означає О, S або NH і R9 означає групу за формулою О Y 'X' О де А і В кожний означає О, R6 означає дейтерій, метил, етил, пропіл, ізопропіл або фтор і R7 означає водень, дейтерій, метил або фтор, або групу за формулою 'z\ R9 де Z означає О, S або NH і R9 означає групу за формулою О О Y N Н >1 X , К і и N' Н -S о о 20 Ж Ж •R2l N Н 22 R деУ означає О, S або NH, X означає зв'язок, О або NR 2 1 , R означає водень, алкіл з 1 -5 атомами вуглецю, фенілалкіл, що містить алкіл з 1 -3 атомами вуглецю, гетероциклоалкіл, що складається з 5 -6 членного кільця і алкілу з 1 -3 атомами вуглецю, або N -монозаміщений або N, N -дизаміщений аміно алкіл, який міститьалкіл з 2 -3 атомами вуглецю, де означені замісники є алкілом з 1 -З атомами вуглецю, R 21 означає водень або метил, або група за формулою -NR R означає R9 R 20 о N' н О ,2 R0 або N' 22 R н означає О, Y де S або NH, X означає зв'язок, О або NR 2 1 , 20 R означає водень, метил, етил, пропіл, ізопропіл, ізобутил, бензил, 2-(1-піролідиніл)етил, 2-(1піперидиніл)етил, 2-(1-піперазиніл)етил, 2-(4метилпіперазин-1-іл)етил, 2-(1-морфолшіл)етил, 2(і-тіаморфолшіл)етил або 2-(N,Nдиметиламшо)етил, R 21 означає водень і R 22 означає метил, і R5 означає алкіл з 1-5 атомами вуглецю або алкіл, заміщений фенілом з 2-4 атомами вуглецю 4 Сполука за п 3 або и фармацевтично прийнятна сіль, проліки або складний ефір, де R1 означає метил або етил, R2 означає бензил, 4 -фторфенілметил або циклогексилметил, R4 означає бензотіазол-5-іл, бензотіазол-6-іл, 2,3дипдробензофуран-5-іл, бензофуран-5-іл, 1,3бензодюксол-5-іл, 2-метил-1,3-бензодюксол-5-іл, 2,2-диметил-1,3-бензодюксол-5-іл, 2,2-дидейтерій1,3-бензодюксол-5-іл, 2,2-дифтор-1,3бензодюксол-5-іл, 1,4-бензодюксан-6-іл, 2(метоксикарбоніламшо)бензотіазол-б-іл або 2(метоксикарбоніламшо)бензимідазол-5-іл, і 56129 R означає метил, етил, пропіл, ізопропіл або 2фе ніл етил 5 Сполука за п 1, вибрана з групи, яка включає N-[2R -гідрокси -3 - [(2 -метилпропіл) [(1,3 бензодюксол -5 -іл) сульфоніл] аміно] -1S (феніл метил) пропіл] -2S -метил -З (метилсульфоніл) пропанамід, N - [2R -гідрокси -3 - [(2 -метилпропіл) [(1,4 бензодюксан -6 -іл) сульфоніл] аміно] -1S (феніл метил) пропіл] -2S -метил -З (метилсульфоніл) пропанамід, N - [2R-riflpoKCH-3 - [(2-метилпропіл) [(бензотіазол6-іл) сульфоніл] aMiHo]-1S -(фенілметил) пропіл] 2S -метил -3 - (метилсульфоніл) пропанамід, N - [2R -гідрокси -3 - [(2 -метилпропіл) [(бензотіазол -5 -іл) сульфоніл] аміно] -1S (фенілметил) пропіл] -2S -метил -З (метилсульфоніл) пропанамід, і N - [2R -гідрокси -3 - [(2 -метилпропіл) [(2,3 Дана заявка є частковим продовженням заявки, що знаходиться в процеси одночасного розгляду на патент США 08/401838, поданої 10 березня 1995р на ім'я заявника поданій заявці Даний винахід стосується інгібіторів протеаз ретровірусів, зокрема нових сполук, композицій і способу інгібування протеаз ретровірусу, таких, як протеаз а вірусу імунодефіциту людини (ВІЛ) Винахід передусім стосується сполук з класу сульфонілалканоіламінопдроксиетиламшосульфо намідів, що можуть інгібувати протеази ретровірусів, композицій і способу інгібування протеаз ретровірусів, профілактичному запобіганню ретровірусної інфекції або розповсюдження ретровірусу та лікування ретровірусної інфекції, наприклад, ВІЛ-інфекцм Винахід стосується способів отримання таких сполук, а також проміжних сполук, що використовуються в цих способах Під час циклу реплікації ретровірусів продукти транскрипції гена gag і gag-pol транслюються у вигляді протеїнів Ці протеїни далі підлягають впливу (процесингу), який кодується вірусом протеаз и (або протеїнази), що призводить до утворення ферментів вірусу та структурних протеїнів ядра вірусу В основному протешипопередники гену gag процесуються до протеїнів ядра, а протеши-попередники гена рої процесуються до ферментів вірусу, наприклад, до оберненої транскриптази та протеаз и ретровірусу Було встановлене, що правильний процесинг протешів-попередників протеаз ою ретровірусу є необхідним для складання інфекційних вірюнів Наприклад, було доведено, що мутації "зрушення рамки" в протеаз ній області гена рої ВІЛ перешкоджають процесингу протешу-по передника гена gag Також було доведено, що сайтнаправлений мутагенез залишку аспарагінової кислоти в активному сайті протеаз и ВІЛ запобігає процесинг протешу-попередника гена gag Таким чином, було зроблено спроби інгібувати реплікацію вірусу інгібуванням активності протеаз ретровірусів Інгібування протеаз и ретровірусу звичайно 6 дипдробензофуран -5 -іл) сульфоніл] аміно] -1S (фенілметил) пропіл] -2S -метил -З (метилсульфоніл) пропанамід 6 Композиція, ЩО МІСТИТЬ сполуку за п 1 і фармацевтично прийнятний носій 7 Спосіб інгібування протеази ретровірусу, що включає введення ефективної КІЛЬКОСТІ сполуки за п 1 8 Спосіб лікування ретровірусної інфекції, що включає введення ефективної КІЛЬКОСТІ КОМПОЗИЦІЇ за п 6 9 Спосіб запобігання реплікації ретровірусу, що включає введення ефективної КІЛЬКОСТІ сполуки за п 1 10 Спосіб запобігання реплікації ретровірусу m vitro, що включає введення ефективної КІЛЬКОСТІ сполуки за п 1 11 Спосіб лікування СНІДу, що включає введення ефективної КІЛЬКОСТІ композиції за п 6 включає використання перехідної міметичної фази, при цьому протеаз а ретровірусу піддається дії міметичної сполуки, яка конкурентно відносно протеїнів gag і gag-pol зв'язується (звичайно зворотним чином) з ферментом, завдяки цьому інгібуючи специфічний процесинг структурних протеїнів і вивільнення самої протеаз и ретровірусу Таким чином, може бути здійснене ефективне інгібування реплікаційних протеаз ретровірусу Спеціально для інгібування протеаз , зокрема для інгібування протеаз и ВІЛ, було запропоновано декілька класів сполук У міжнародних заявках WO 92/08701, WO 93/23368, WO 93/23379, WO 94/04493, WO 94/10136 і WO 94/14793 (кожна з яких повністю включена до даного опису як посилання) описані, наприклад, ізотери сульфонілалканоіламінопдроксіетиламшу, сульфонілалканоіламшопдроксиетилсечевини, сульфонілалканоіламшопдроксиетилсульфонамід у та сульфонілалканоіламінопдроксиетиламшосуфона міду, що включають інгібітори протеаз и ретровірусу Див, наприклад, ЕР 0346847, ЕР 0342541, Roberts та ш , "Rational Design of PeptideBased Protemase Inhibitors, "Science 248, 358 (1990), і Enckson та ш , "Design Activity, and 2,8 A Crystal Structure of Сз Symmetric Inhibitor Complexed to HIV-1 Protease", Science, 249, 527 (1990) Наприклад, у патенті США 5157041, міжнародних заявках WO 94/04491, WO 94/04492, WO 94/05639 та у заявці на патент США 08/294468, поданої 23 серпня 1994р (кожний документ повністю включений до даного опису як посилання) описані інгібітори протеаз и ретровірусу, що включають ізостери пдроксиетиламшу, пдроксиетилсечевини або пдроксиетилсульфонаміду ВІДОМІ декілька класів сполук, придатні для використання як інгібітори протеолітичного ферменту реніну Див , наприклад, патент США 4599198, патент Великобританії 2184730, патент Великобританії 2209752,,ЕР, 0264795, патент Великобританії 2200115 і U S Sir H725 Серед цих 56129 публікацій у патенті Великобританії 2200115, патенті Великобританії 2209752, ЕР 0264795, U S Sir H725 і в патенті США 4599198 описані інгібітори реніну з класу уреідовмісних пдроксиетиламшів В ЕР 0468641 описані інгібітори реніну та проміжні продукти для отримання інгібіторів, що включають сульфонамідвмісні сполуки з класу пдроксиетиламінів, такі, як 3-(тре-бутоксикарбоніл) амшоциклогексил-і-(фенілсульфоніл) аміно-2 (5)бутанол У патенті Великобританії 2200115 також описані інгібітори реніну з класу сульфамоілвмісних пдроксиетиламінів, а в ЕР 0264795 описані деякі інгібітори реніну з класу сульфонамідвмісних пдроксиетиламінів Однак відомо, що хоча протеаз и реніну та ВІЛ обидві і класифікуються як аспартильні протеаз й, звичайно не можна очікувати, що сполуки, ефективні як інгібітори реніну, будуть ефективними інгібіторами і для протеаз и ВІЛ Даний винахід стосується певних сполукшпбіторів протеаз и ретровірусу, їх аналогів і фармацевтичне прийнятних солей, складних ефірів і проліків Сполуки за винаходом характеризуються як сполуки-шпбіторів з класу сульфонілалканоіламінопдроксиетиламшосульфо намідів Сполуки за винаходом здебільшого інгібують протеаз и ретровірусів, такі, як протеаз а вірусу імунодефіциту людини (ВІЛ) Таким чином, даний винахід також включає фармацевтичні композиції, засоби інгібування протеаз ретровірусів і засоби лікування або профілактики ретровірусної інфекції, такої, як ВІЛ-шфекція Винахід також включає способи отримання таких сполук, а також проміжні сполуки, що використовуються в цих способах Даний винахід стосується ретровірусу сполуки, яка інгібує протеаз у, за формулою або и фармацевтичне прийнятної солі, проліків або складного ефіру, де символи п і t кожний незалежно один від одного дорівнюють 0,1 або 2, краще, коли п дорівнює 1 11 дорівнює 1 або 2, R1 означає водень, алкіл, алкеніл, алкініл, гідроксі алкіл, алкоксіалкіл, ціаноалкіл,-СН 2 СОІ\ІН 2 , -CH 2 CH 2 CONH 2 , -CH 2 S(O) 2 NH 2 , -CH2SCH3, CH 2 S(O)CH 3 або -CH 2 S(O) 2 CH 3 , перевага надається, коли R1 означає водень, алкіл з 1-5 атомами вуглецю, алкеніл з 2-5 атомами вуглецю, алкініл з 2-5 атомами вуглецю, пдроксіалкіл з 1-3 атомами вуглецю, алкоксіалкіл, що складається з алкілу з 1-3 атомами і алкокси з 1-3 атомами вуглецю, ціаноалкіл, який містить алкіл з 1-3 атомами вуглецю, -CH 2 CONH 2 , -CH 2 CH 2 CONH 2 , CH 2 S(O) 2 NH 2 , -CH 2 SCH 3 , -CH 2 S(O)CH 3 або CH 2 S(O) 2 CH 3 , краще коли R1 означає водень, алкіл з 1-3 атомами вуглецю, алкеніл з 2-3 атомами вуглецю, алкініл з 2-3 атомами вуглецю або ціанметил, більша перевага, коли R1 означає водень, метил, егил або ціанометил, і найбільша перевага надається, коли R1 означає метил або етил, і ще краще коли R1 означає метил, R2 означє алкіл, аралкіл, алкілтюалкіл, арилтюалкіл або циклоалкілалкіл, перевага надається, коли R2 означає алкіл з 1-5 атомами вуглецю, аралкіл, алкіл з 1-3 атомами вуглецю, алкілтюалкіл, що містить алкіл з 1-3 атомами вуглецю, арилтюалкіл, що містить алкіл з 1-3 атомами вуглецю, або циклоалкілалкіл, що містить алкіл з 1-3 атомами вуглецю і 3-6-членне вуглеводневе кільце, краще коли R2 означає алкіл з 3-5 атомами вуглецю, арилметил, алкілтюалкіл, алкіл з 1-3 атомами вуглецю, арилтюметил або цикл оал кіл метил, що містить 5-6-члене вуглеводневе кільце, ще краще коли R2 означає ізобутил, н-бутил, CH3SCH2CH2 -, бензил, фенілтюметил, (2-нафтилтю) метил, 4метоксифеніл метил, 4-пдроксифеніл метил, 4фторфеніл метил або циклогексил метил, і найбільша перевага, коли R2 означає бензил, 4фторфенілметил або циклогексилметил, ще краще коли R2 означає бензил, R3 означає алкіл, циклоалкіл або циклоалкілалкіл, превага надається коли R з означає алкіл з 1-5 атомами вуглецю, 5-8-членний циклоалкіл або 3-6-членний циклоалкіл метил, краще коли R3 означає пропіл, ізоаміл, ізобутил, бутил, циклопентил метил, циклогексилметил циклогексил або циклогептил, ще краще коли R означає ізобутил або циклопентилметил, R4 означає гетероарил або гетероцикл, превага надається, коли R4 означає сконденсований з бензольним ядром 5-6-член ний гетероарил або сконденсований з бензольним ядром 5-6-членний гетероцикл, або R4 означає групу за формулою де А і В кожний незалежно один від одного означає О, S, SO або SO 2 , краще, коли А і В кожний означає О, R6 означає дейтерій, алкіл або галоген, перевага надається коли R6 означає дейтерій, алкіл з 1-5 атомами вуглецю, фтор або хлор, ще краще, коли R6 означає дейтерій, метил, етил, пропіл, ізопропіл або фтор, R' означає водень, дейтерій, алкіл або галоген, перевага надається, коли R7 означає водень, дейтерій, алкіл з 1-3 атомами вуглецю, фтор або хлор, ще краще, коли R7 означає водень, дейтерій, метил або фтор, або R6 і R7 кожний незалежно один від одного означає фтор або хлор, і перевага надається, коли R6 і R7 кожний оозначає фтор, або R4 означає групу за формулою де Z означає О, S або NH і 56129 R означає групу за формулою О N X or Н О N Н де Y означає О, S або NH, X означає зв'язок, О 21 або NR , 20 R означає водень, алкіл, алкеніл, алкініл, аралкіл, гетероаралкіл, гетероциклоалкіл, амюалкіл N-монозаміщений або N.N-дизаміщений аміноалкіл, де означені замісники є алкілом або аралкілом, карбоксіалкілом, ал коксі карбоніл алкіл ом, ціаноалкілом або 20 пдроксіалкілом, перевага надається, коли R означає водень, алкіл з 1-5 атомами вуглецю, алкеніл з 2-5 атомами вуглецю, алкініл з 2-5 атомами вуглецю, аралкіл, що містить алкіл з 1-5 атомами вуглецю, гетероаралкіл, який складається з 5-6-членного кільця і алкілу з 1-5 атомами вуглецю, гетероциклоалкіл, що складається з 5-6-членного кільця і алкілу з 1-5 атомами вуглецю, аміноалкіл з 2-5 атомами вуглецю, N-монозаміщений або N.N-дизаміщений аміноалкіл, що містить алкіл з 2-5 атомами вуглецю, де означені замісники є алкілом з 1-3 атомами вуглецю, аралкілом, що містить алкіл з 13 атомами вуглецю, карбоксіалкілом з 1-5 атомами вуглецю, алкоксікарбонілалкіл, що містить алкіл з 1-5 атомами вуглецю, ціаноалкіл з 1-5 атомами вуглецю або пдроксіалкіл з 2-5 атомами вуглецю, ще краще коли R 20 означає водень, алкіл з 1-5 атомами вуглецю, фенілалкіл, що містить алкіл з 1-3 атомами вуглецю, гетероциклоалкіл, що складається з 5-6-членного кільця і алкілу з 1-3 атомами вуглецю, або N-монозаміщений або N,Nдизаміщений аміноалкіл з 2-3 атомами вуглецю, де означені замісники є алкіл з 1-3 атомами вуглецю, і допустимо коли R 20 означає водень, метил, етил, пропіл, і'зопропіл, ізобутил, бензил, 2(1-пірролідиніл) етил, 2-(1-піперидиніл) етил, 2-(1піперазиніл) етил, 2-(4-метилпіперазин-1-іл) етил, 2-(1-морфолшіл) етил, 2-(1-тіаморфолшіл) етил або 2-(N, N-диметиламшо) етил, R2 означає водень або алкіл, перевага надається коли R 21 означає водень або алкіл з 1-3 21 атомами вуглецю, ще краще коли R означає 21 водень або метил, і краще, коли R означає 20 21 водень, або група за формулою -NR R означає гетероцикл, ще краще коли група за формулою NR 2 R2 означає 5-6-членний гетероцикл, і ще 20 21 краще, коли група за формулою -NR R означає пірол ід иніл, піперидиніл, піперазиніл, 4метилпіперазиніл, 4-бензил піперазиніл, морфолініл аботіаморфолініл, і ?? 9ҐІ ?| R означає алкіл або R R N-алкіл, перевага надається , коли R22 означає алкіл або R °R21Nалкіл, де алкіл має 1-3 атоми вуглецю, і ще краще, коли R 2 означає алкіл з 1-3 атомами вуглецю, і ще краще, коли R4 означає бензотіазол-5-іл, бензотіазол-6-іл, 2-амшобензотіазол-5-іл, 2(метоксикарбоніламшо) бензотіазол-5-іл, 2амінобензотіазол-б-іл, 2-(метоксикарбоніламшо) бензотіазол-6-іл, 5-бензоксазоліл, 6-бензоксазоліл,6-бензопіраніл, 3,4-дипдробензопіран-6-іл, 7бензопіраніл, 3,4-дипдробензопіран-7-іл, 2,3 10 дипдробензофуран-5-іл, бензофуран-5-іл, 1,3бензодюксол-5-іл, 2-метіл-1, З-бензодюксол-5-іл, 2,2-диметил-1,3-бензодюксол-5-іл, 2,2-дидейтерій1,3-бензодюксол-5-іл, 2,2-дифтор-1,3бензодюксол-5-іл, 1,4-бензодюксан-6-іл, 5бензимідазоліл, 2-(метоксикарбоніламшо) бензимідазол-5-іл, 6-хінолшіл, 7-хінолшіл, 6ІЗОХІНОЛІНІЛ або 7-ізохінолшіл, найбільша перевага 4 , коли R означає бензотіазол-5-іл, бензотіазол-6іл, бензоксазол-5-іл, 2,3-дипдробензофуран-5-іл, бензофуран-5-іл, 1,3-бензодюксол-5-іл, 2-метил1,3-бензодюксол-5-іл, 2,2-диметил-1,3бензодюксол-5-іл, 2,2-дидейтерій-1,3бензодюксол-5-іл, 2,2-дифтор-1,3-бензодюксол-5іл, 1,4-бензодюксан-6-іл, 2-(метоксикарбоніламшо) бензотіазол-5-іл, 2-(метоксикарбоніламшо) бензотіазол-6-іл або 2-(метоксикарбоніламшо) бензимідазол-5-іл, і найкраще, коли R4 означає бензотіазол-5-іл, бензотиазол-6-ал, 2,3дипдробензофуран-5-іл, бензофуран-5-іл, 1,3бензодюксол-5-іл, 2-метил-1,3-бензодюксол-5-іл, 2,2-диметил-1, З-бензодюксол-5-іл, 2,2дидейтерій-1,3-бензодюксол-5-іл, 2,2-дифтор-1,3бензодюксол-5-іл, 1,4-бензодюксан-6-іл, 2(метоксикарбоніламшо) бензотіазол-6-іл або 2(метоксикарбоніламшо)бензимідазол-5-іл, і R5 означає алкіл, алкеніл, алкініл або аралкіл, перевага надається, коли R5 означає алкіл з 1-5 атомами вуглецю, алкеніл з 2-5 атомами вуглецю, алкініл з 2-5 атомами вуглецю або арйл, заміщений алкілом з 1-5 атомами вуглецю, ще краще , коли R5 означає алкіл з 1-5 атомами вуглецю, алкеніл з 3-4 атомами вуглецю, алкініл з 3-4 атомами вуглецю або арил, заміщений алкілом з 1-4 атомами вуглецю, і ще краще коли R5 означає алкіл з 1-5 атомами вуглецю або феніл, заміщений алкілом з 2-4 атомами вуглецю, і найбільша перевага, коли R5 означає метил, етил, пропіл, ізопропіл або 2-фенілетил Абсолютна стереохімічна конфігурація атому вуглецю -СН(ОН) групи переважно є (R) формою Абсолютна стереохімічна конфігурація атому 1 вуглецю -СН (R ) групи переважно є (S) формою Абсолютна стереохімічна конфігурація атому вуглецю -CH(R2) групи переважно є (S) формою Ряд сполук, що становлять особливий інтерес серед сполук за формулою І, є сполуки за формулою О R V N' к ОН RJ або їх фармацевтичне прийнятні солі, проліки або складні ефіри, де t, R1, R2, R3, R4 і R5 мають значення, які зазначені вище Ряд сполук, що становлять додатковий інтерес серед сполук за формулою II, є сполуки за формулою 11 56129 12 "алкеніл" індивідуально або в комбінації означає О R' О, О вуглеводневий радикал з прямим або розгалудженим ланцюгом, який має один або W// більше подвійних зв'язків І МІСТИТЬ переважно від 2 до 8 атомів вуглецю, краще, коли від 2 до 5 атомів вуглецю, переважно від 2 до 3 атомів вуглецю ОН RПриклади ВІДПОВІДНИХ алкенільних радикалів включають етеніл, пропеніл, 2-метилпропеніл, 1,4або їх фармацевтичне прийнятні солі, проліки бутадіеніл , тощо Поняття "алкініл" індивідуально 1 2 3 4 5 або складні ефіри, де t, R , R , R , R і R мають або в комбінації означає вуглеводневий радикал з значення, зазначені вище прямим або розгалудженим ланцюгом, який має Перевага надається коли ряд сполук за один або більше потрійних зв'язків та містить формулою III утворюють сполуки або їх переважно від 2 до 8 атомів вуглецю, переважніше фармацевтичне прийнятні солі проліки або від 2 до 5 атомів вуглецю, краще, коли від 2 до З складні ефіри, де t дорівнює 2, R означає метил атомів вуглецю Приклади алкінільних радикалів або етил, включають етиніл, пропініл (пропарпл), бутиніл, 2 тощо Поняття "алкоксі" індивідуально або в R означає бензил, 4-фторфенілметил або комбінації означає алкілефірний радикал, де циклогексшшетил, поняття "алкіл" має значення, які зазначені вище R3 означає пропіл, ізоаміл, ізобутил, бутил, Приклади ВІДПОВІДНИХ алкілефірних радикалів циклогексил, циклогептил, циклопентилметил або включають метокси, етокси, н-пропокси, циклогексилметил, і ізопропокси, н-бутокси, ізобутокси, фтор-бутокси, R4 означає 2,3-дипдробензофуран-5-іл, 1,3трет-бутокси, тощо Поняття "циклоалкіл" бензодюксол-5-іл, 2-метил-1,3-бензодюксол-5-іл, індивідуально або в комбінації означає насичений 2,2-диметил-1,3-бензодюксол-5-іл, бензотіазол-6або частково насичений моно -, бі - або іл, 2,2-дидейтерій-1,3-бензодюксол-5-іл, 2,2трициклічний алкільний радикал, в якому кожний дифтор-1,3-бензодюксол-5-іл або 1,4циклічний фрагмент переважно містить в КІЛЬЦІ ВІД бензодюксан-6-іл, і R5 означає метил, етил, З до 8 атомів вуглецю, переважніше від 3 до 7 і пропіл, ізопропіл або 2-фенілетил краще, коли від 5 до 6 атомів вуглецю, який Сполуки, що є цікавими, включають наступні необов'язково може бути сконденсованою з N-[2R-nflpoKCH-3-[(2-Me™-inponuT) [(1,3бензогрупою кільцевою системою, що бензодюксол-5-іл) сульфоніл] aMiHo]-1Sнеобов'язково заміщена аналопчнодо того, як є (феніл метил) пропіл]-23-метил-3відносно арилу Приклади таких циклоалкільних (метилсульфоніл) пропанамід, радикалів включають циклопропіл, циклобутил, N-[2R-riflpoKCH-3-[(2-MeTnnnponin) [0,4циклопентил, циклогексил, циклогептил, бензодюксан-6-іл) сульфоніл] 3MIHO]1Sоктапдронафтил, 2,3-дипдро-1Н-шденіл, (феніл метил) пропіл]-23-метил-3(метилсульфоніл) пропанамід, адамантил, тощо Припускається, що поняття N-[2R-riflpoKCH-3-[(2-MeTHnnpomn) "біциклічний" і "трициклічний", які [(бензотіазол-6-іл) сульфоніл] aMmo]-1Sвикористовуються в даному описі, включають як (феніл метил) пропіл]-23-метил-3конденсовані кільцеві системи, такі, як нафтил і р(метилсульфоніл) пропанамід, карболініл, так і пов'язані кільцеві системи, такі, як N-[2R-napOKcn-3-[(2-MeTHnnpomn) біфеніл, фенілпіридил, нафтил і [(бензотіазол-5-іл) сульфоніл] aMmo]-1Sдифенілпіперазиніл Поняття "циклоалкілалкіл" (феніл метил) пропіл]-23-метил-3означає алкільний радикал, як визначено вище, (метилсульфоніл) пропанамід, і який заміщений циклоалкільним радикалом, як N-[2R-riflpoKCH-3-[(2-MeTHnnpomn) [(2,3визначено вище Приклади таких дипдробензофуран-5-іл) сульфоніл] aMmo]-1Sциклоалкілалкільних радикалів включають (феніл метил) пропіл]-23-метил-3циклопропіл метил, циклобутил метил, циклопентилметил, циклогексилметил, 1(метилсульфоніл) пропанамід циклопентилетил, 1-циклогексилетил, 2У контексті даного опису поняття "алкіл" циклопентилетил, 2-циклогексилетил, індивідуально або в комбінації означає алкільний радикал з прямим або розгалудженим ланцюгом, циклобутил пропіл, циклопентил пропіл, що містить переважно від 1 до 8 атомів вуглецю, циклогексилбутил тощо Поняття "бензо" більша перевага від 1 до 5 атомів вуглецю, ще індивідуально або в комбінації означає краще 1-3 атомів вуглецю Приклади таких двовалентний радикал СєН4=, похідний від радикалів включають метил, етил, н-пропіл, бензолу Поняття "арил" індивідуально або в ізопропіл, н-бутил, ізобутил, втор-бутил, треткомбінації означає фенільний або нафтильний бутил, пентил, ізоаміл, гексил, октил, тощо радикал, необов'язково заміщений одним або Поняття "пдроксіалкіл" індивідуально або в декількома замвсниками, вибраними з групи, що комбінації означає алкільний радикал, як включає алкіл, ал коксі, галоген, гідроксі, аміно, визначене вище, де принаймні один атом водню нітро, ціано, галоідалкіл, карбоксі, алкоксікарбоніл, заміщений гідроксильною групою, переважно 1-3 циклоалкіл, гетероцикло, алканоіламшо, амідо, атому водня заміщені гідроксильними групами, амідино, алкоксикарбоніламшо, N-алкіламідино, більш переважно 1-2 атоми водня заміщені алкіламшо, діалкіламшо, N-алкіламідо, N,Nгідроксильними групами і краще, коли один атом діалкіламідо, аралкоксікарбоніламшо, алкілтю, водню заміщений гідроксильною групою Поняття алкілсульфініл, алкілсульфоніл тощо Прикладами 14 13 56129 арильних радикалів є феніл, пара-тол іл, 4поняття "гетероцикло" включає сульфони, метоксифеніл, 4-(трет-бутокси) феніл, З-метид-4сульфоксиди, N-оксиди третинного азоту в КІЛЬЦІ метоксифеніл, 4-СРз-феніл, 4-фторфеніл, 4та карбоциклоконденсовані і бензоконденсовані хлорфеніл, 3-нітрофеніл, 3-амінофеніл, 3кільцеві системи У таких гетероциклічних ацетамідофеніл, 4-ацетамідофеніл, 2-метил-Зрадикалах принаймні один, переважно 1-4, ацетамідофеніл, 2-метил-З-амшофеніл, З-метил-4найбільш переважно 1 -2 атому вуглецю амінофеніл, 2-амшо-З-метилфеніл, 2,4-диметил-Знеобов'язково можуть бути заміщені галогеном, амінофеніл, 4-пдроксифеніл, З-метил-4алкілом, алкокси-, гідрокси-, оксогрупою, арилом, пдроксифеніл, 1-нафтил, 2-нафтил, З-амшо-1аралкілом, гетероарилом, гетероаралкілом, нафтил, 2-метил-3-амшо-1-нафтил, 6-амшо-2амідино -, N-алкіламідино -, алкоксікарбоніламшо нафтил, 4,6-диметокси-2-нафтил, алкілсульфоніламіногрупою, тощо, і/або вторинний атом азоту (тобто-NH -) може бути піперазинілфеніл, тощо Поняття "аралкіл" і заміщений пдроксигрупою, алкілом, "аралкоксі" індивідуально або в комбінації означає алкіл або алкоксі, як визначено вище, в якому аралкоксікарбонілом, алканоілом, принаймні один атом водню заміщений арильним гетероаралкілом, фенілом або фенілалкілом, і/або радикалом, як визначено вище, наприклад, третинний атом азоту (TO6TO=N -) може бути бензил, бензилокси, 2-фенілетил, дибензилметил, заміщений оксидогрупою "Гетероциклоалкіл" гід роксифеніл метил, метилфеніл метил, означає алкільний радикал, як визначене вище, в якому принаймні один атом водню заміщений дифеніл метил, дифеніл метокси, 4гетероциклічним радикалом, як визначено вище, метоксифенілметокси.тощо Поняття наприклад, пірол ІДИНІЛ метил, "аралкоксікарбоніл" індивідуально або в комбінації означає радикал за формулою аралкіл-О-С (О) -, в тетрапдротіенил метил, піридил метил, тощо якому поняття "аралкіл" має зазначене вище Поняття "гетероарил" індивідуально або в значення Прикладами аралкоксікарбоніл ьного комбінації означає ароматичний гетероциклічний радикалу є бензилоксикарбоніл і 4радикал, як визначено вище, що необов'язково метоксифенілметоксикарбоніл Поняття заміщений аналогічно до того, як це визначено вище відносно арилу і гетероцикло Прикладами "арилокси" означає радикал за формулою арил-Отаких гетероциклічних і гетероарильних груп є , в якому поняття "арил" має зазначене вище піролідиніл, піперидиніл, піперазиніл, морфолініл, значення Поняття "алканоїл" індивідуально або в тіаморфолініл, піроліл, імідазоліл (наприклад, комбінації означає ацильний радикал, похідний від імідазол-4-іл, 1-бензилоксикарбонілімідазол-4-іл, алканкарбонової кислоти, приклади якого тощо), піразоліл, піридил (наприклад, 2-(1включають ацетил, пропюніл, бутирил, валерил, 4піперидиніл) піридил і 2-(4-бензилпіперазин-1-іл-1метилвалерил, тощо Поняття піридиніл тощо), піразиніл, піримідиніл, фурил, "циклоалкілкарбоніл" означає ацильний радикал тетрапдрофурил, тіенил, тетрапдротіенил і його за формулою циклоалкіл-С(О)-, в якому поняття сульфоксиди! і сульфонові ПОХІДНІ, тріазоліл, "циклоалкіл" має зазначені вище значення, оксазоліл, тіазоліл, ІНДОЛІЛ (наприклад, 2-ІНДОЛІЛ наприклад, циклопропіл карбоніл, тощо), ХІНОЛІНІЛ (наприклад, 2-хінолшіл, 3циклогексилкарбоніл, адамантилкарбоніл, 1,2, 3,4 тетрапдро-2-нафтоіл, 2-ацетамідо-1,2,3,4тетрапдро-2-нафтоіл, 1-пдрокси-1,2,3, 4тетрапдро-6-нафтоіл, тощо Поняття "аралканоїл" означає ацильний радикал, похідний від заміщеної арилом алканкарбонової кислоти, наприклад, фенілацетил, 3-фенілпропюніл (пдроцинамоїл), 4фенілбутирил, (2-нафтил) ацетил, 4хлорпдроцинамоїл, 4-амінопдроциннамоіл, 4метоксипдроциннамоїл тощо Поняття "ароїл" означає ацильний радикал, похідний арилкарбонової кислоти, де "арил" має зазначені вище значення Приклади таких ароільних радикалів включають заміщений і незаміщений бензоїл або нафтоїл, наприклад, бензоїл, 4хлорбензоїл, 4-карбоксібензоіл, 4 (бензилоксикарбоніл) бензоїл, 1-нафтоїл, 2нафтоїл, 6-карбокси-2-нафтоіл, 6(бензилоксикарбоніл)-2-нафтоіл, З-бензилокси-2нафтоїл, З-пдрокси-2-нафтоіл, 3(бензилоксиформамідо)-2-нафтоіл, тощо Поняття "гетероцикло" індивідуально або в комбінації означає насичений або частково ненасичений моно-, бі- або трициклічний гетероциклічний радикал, що містить у КІЛЬЦІ принаймні один, перевага надається 1-4, краще, коли 1-2 атому азоту, кисню або сірки і що має переважно 3-8 членів у кожному КІЛЬЦІ, найбільша перевага, коли 3-7 і ще краще 5-6 членів Маємо на увазі, що ХІНОЛІНІЛ, 1-ОКСИДО-2-ХІНОЛІНІЛ ТОЩО), ІЗОХІНОЛІНІЛ (наприклад, 1-ізохінолшіл, 3-ізохінолшіл тощо), тетрапдрохінолшіл (наприклад, 1,2, 3,4-тетрапдро2-ХІНОЛІЛ, тощо), 1,2, 3,4-тетрапдроізохінолшіл (наприклад, 1,2, 3,4-тетрапдро-1-оксоизохінолшіл, тощо), хіноксалініл, р-карболініл, 2бензофуранкарбоніл, 1 -, 2-, 4або 5бензімідазоліл, метилендюксифен-4-іл, метилендюксифен-5-іл, етилендюксифеніл, бензотіазоліл, бензопіранил, бензофурил, 2,3дипдробензофурил, бензоксазоліл, тюфеніл, тощо Поняття "гетероаралкіл" індивідуально або в комбінації означає алкіл, як визначено вище, в якому принаймні один атом водню заміщений гетероарильним радикалом, як визначено вище, наприклад, бензофурил метил, 3-фурил пропіл, ХІНОЛІНІЛ метил, 2-тіенилетил, піридил метил, 2п і рол іл пропіл, 1-імідазолілетил,тощо Поняття "циклоалкілалкоксікарбоніл" означає ацильну групу, похідну від циклоалкілалкоксикарбонової кислоти за формулою циклоалкілалкіл-0-СООН, де циклоалкілалкіл має значення, що визначене вище Поняття "арилоксалканоїл" означає ацильний радикал за формулою арил-О-алканоїл, де арил і алканоїл мають зазначені вище значення Поняття "гетероциклоалкоксикарбоніл" означає ацильну групу, похідну від гетероциклоалкіл-О-СООН, де гетероциклоалкіл 16 15 56129 має зазначене вище значення Поняття "гетероциклоалканоїл" означає ацильний радикал, похідний від гетероциклоалкілкарбонової кислоти, m 1 де гетероцикло має зазначені вище значення 2 H R Поняття "гетероциклоалкоксікарбоніл" означає ацильний радикал, похідний від гетероциклоалкілО-СООН, де гетероцикло має зазначені вище V значення Поняття "гетероарилоксикарбоніл" \ означає ацильний радикал, похідний від карбонової кислоти і який подано формулою гетероарил-О-СООН, де гетероарил має значення, які вище зазначені Поняття "амінокарбоніл" індивідуально або в комбінації означає заміщену coupling аміногрупою карбонільну (карбамоільну) групу, де аміногрупа може бути первинною, вторинною або третинною аміногрупою, яка містить замісники, вибрані з алкілу, арилу, аралкілу, циклоалкілу, циклоалкілалкілу , тощо Поняття "аміноалканоїл" означає ацильну групу, похідну від алкілкарбонової кислоти і заміщену аміногрупою, а) вилучення захисної групи, X означає СІ або де аміногрупа може бути первинною, вторинною Br або третинною аміногрупою, що містить замісники, Схема вибрані з алкілу, арилу, аралкілу, циклоалкілу, циклоалкілалкілу , тощо Поняття "галоген" означає фтор, хлор, бром або йод Поняття "галоідалкіл" означає алкіл, що має зазначені вище значення, де один або більше атомів водню заміщені галогеном Приклади таких галоідалкільних радикалів включають хлорметил, 1-брометил, фторметил, дифторметил, трифторметил, 1,1, І-трифторетил , тощо Поняття " група, що відходить" (L або W) звичайно означає H і I групу, що легко заміщується нуклеофільною O H P.3 групою, таку, як амін, тіол або спиртова нуклеофільна група Такі ВІДХІДНІ групи добре ВІДОМІ у даній галузі техніки Приклади таких груп, О FT щовідходять, включають, але не обмежені ними, N-пдроксисукцинімід, N-пдроксибензотріазол, AC. галогеніди, трифталати, тозилати, тощо Групи, що OH відходять, яким надається перевага, при необхідності вказані в даному описі -Л ОН R 1 2 2 3 4 фенілаланшолу, D-гексапдрофенілаланінолу, де Р, Р , Р , R , R і R мають зазначені вище тощо, або ж розподіл можна проводити на значення Ці проміжні продукти придатні для проміжній або кінцевій стадіях Для утворення отримання сполук-шпбіторів за даним винаходом солей, складних ефірів або амідів сполук за даним В альтернативному варіанті захищений винаходом можуть бути використані хіральні аміноспирт, отриманий при розриванні ДОПОМІЖНІ речовини, такі, як один або два епоксидного зв'язку, далі може бути захищений на еквівалента камфорсульфокислоти, лимонної введеній знов аміногрупі за допомогою захисної кислоти, камфарної кислоти, 2групи Р, яка не вилучається при вилученні 1 2 1 метоксифенілоцтової кислоти, тощо Ці сполуки амінозахисних груп Р або Р і Р , тобтоР є або ПОХІДНІ можуть бути піддані кристалізації або вибірково вилучаємою захисною групою Фахівець виділені хроматографічним шляхом з у даній галузі техніки може вибрати ВІДПОВІДНІ 1 2 використанням або хіральною, або нехіральною комбінації Р', Р, Р і Р , Наприклад, придатними колонки, як це відомо фахівцям у даній галузі комбінаціями є наступні Р означає Cbz і Р1 техніки означає ВОС, Р означає Cbz і Р означає ВОС, Р1 означає Cbz, Р2 означає бензил і Р означає ВОС, і Після ЦЬОГО аміноепоксиди піддають взаємодії Р1 і Р2 означає бензил і Р' означає ВОС Сполуки, в придатній системі розчиннків з однаковою що утворилися наведено формулою КІЛЬКІСТЮ або переважно з надлишком ВІДПОВІДНОГО аміну за формулою R3NH2, де R3 означає водень *2 R2 або має зазначені вище значення Реакцію можна проводити в широкому діапазоні температур, .Р' наприклад, від приблизно 10°С до приблизно N 100°С, але краще, хоча це не є необхідним, ОН ОН R проводити и при температурі, при якій починається кипіння з зворотним холодильником може бути піддане іншим стадіям синтезу з розчинника Придатні системи розчиннків отриманням сполуки за формулою включають протонні, апротонні і біполярні О R2 органічні розчинники, наприклад, такі, в яких розчинником є спирт, такий, як метанол, етанол, ізопропанол, тощо, прості ефіри, такі, як тетрапдрофуран, діоксан, тощо, і толуол, N, Nдиметилформамід, диметилсульфоксид і їх суміші Розчинником, якому надається первага, є ізопропанол Отриманий продукт є похідним 3 - (Nзахищений амш)-3 -(R2)-1-(NHR3)-nponaH-2-ony ( в даному описи названий аміноспиртом), які можуть де n, t, P', R1, R2, R31 R5 мають зазначені вище бути представлені формулами значення Зазначені вище ІНШІ стадії синтезу можуть бути проведені при необхідності або шляхом додавання необхідних фрагментів або груп \ окремо, або в заздалегідь створену молекулу N H вбудавують більш ніж по одному фрагменту або ОН групі впродовж однієї стадії Перший ПІДХІД Є он способом послідовного синтезу, а останній є 1 2 2 3 де Р, Р , Р , R і R мають зазначені вище конвергентним способом синтезу На цій стадії значення В альтернативному варіанті замість також можливі трансформації синтезу Захисну аміноепоксиду може бути використаний групу Р' після цього вибірково вилучають і галоідспирт утворений амін піддають взаємодії з Після ЦЬОГО зазначений вище спирт піддають сульфонілхлоридом R4SO2CI, сульфонілбромідом взаємодії у відповідному розчинникові з R4SO2Br або з ВІДПОВІДНИМ сульфоніланпдридом, сульфонілхлоридом R4SO2CI, сульфонілбромідом переважно в присутності акцептору кислоти, з R4SO2Br або з ВІДПОВІДНИМ сульфоніланпдридом, отриманням сполук за даним винаходом переважно у присутності акцептору кислоти Придатні для здійснення реакції розчинники включають метиленхлорид, тетрапдрофуран, тощо Придатні акцептори кислоти включають триетиламш, піридин, тощо В залежності від епоксиду, що використовується, сульфонамідне похідне, що утворилося, може бути представлене формулами де n, t, Р', R1, R2, R3, R4 і R5 мають зазначені вище значення Це вибіркове вилучення захисної групи і перетворення в сульфонамід при 3 26 25 56129 необхідності може бути проведене або в КІНЦІ синтезу, або на будь-якій ВІДПОВІДНІЙ проміжній HO S стадії Приклади описані на схемі II 4 Сул ьфоніл галогенід и за формулою R SO2X можуть бути отримані взаємодією ВІДПОВІДНОГО арилу, гетероарилу і сконденсованого з бензольним ядром гетероциклічного реагенту Гриньяра або ЛІТІЄВОГО реагенту з HO S сульфурилхлоридом або дюксидом сірки з наступним окисленням галогеном, переважно хлором Арил, гетероарил і сконденсований з бензольним ядром гетероциклічний реагент де А, В, Z, R , R і R мають зазначені вище Гриньяра або литієвий реагент можуть бути значення, одержують з 1,2-бензодитюлу, 2отримані з ВІДПОВІДНИХ їм галогенідів (таких, як меркаптофенолу, 1,2-бензодюлу, 2хлор - або броммісткі сполуки), що є комерційне амінобензотіазолу, бензотіазолу, 2доступними або легко можуть бути отримані з амінобензімідазолу, бензімідазолу, тощо, які є комерційне доступних вхідних продуктів з комерційно доступними, див патент США 4595407 використанням способів, відомих у даній галузі на ім'я Carter, патент США 4634465 на ім'я техніки Крім того, тіоли можуть бути окислені до Ehrenfreund та ш , Yoder і ш , J Heterocycl Chem сульфонілхлоридів з використанням хлора в 4 166-167 (1967), Cole і ін , Aust J Chem 33 675присутності води в ретельно контрольованих 680 (1980), Cabiddu і ш Synthesis 797-798 (1976), умовах Ncube і IH , Tet Letters 2345-2348 (1978), Ncube і Крім того, сульфонові кислоти, такі, як IH , Tet Letters 255-256 (1977), Ansmk і Cerfontain, арилсульфонові кислоти, можуть бути Rec Trav Chim Pays-Bas 108 395-403 (1989), і перетворені в Сул ьфоніл галогенід и з Kajihara і Tsuchiya, EP 638564 A1 (кожний використанням таких реагентів, як РСІ5, SOCb, документ повністю включений до даного опису як СІС(О)С(О)СІ, тощо, а також в ангідриди з посилання) Наприклад, 1,2-бензодитюл, 2використанням депдратуючих реагентів меркаптофенол або 1,2-бензодюл можуть бути Сульфонові кислоти можуть бути в свою чергу піддані взаємодії з R6R7C (L)'2, де L' має визначені отримані з використанням способів, добре відомих вище значення і означає переважно Вг або І, у у даній галузі техніки, деякі сульфонові кислоти є присутності основи, такої, як гідроксид, або з комерційне доступними Замість R6R7C=O у присутності кислоти, такої, як сул ьфоніл галогенід їв для отримання сполук, в толуолсульфонова кислота, або з Р2Оз з яких фрагмент-802 - замінений фрагментом-SO отриманням заміщеного сконденсованого з або-S - ВІДПОВІДНО, можуть використовуватися бензольним ядром гетероциклу за формулою сул ьфініл галогенід и (R4SOX) або 4 сульфенілгалогенди (R SX) Арилсульфонові кислоти, сконденсовані з бензольним ядром гетероциклічні сульфонові кислоти або гетероарил сульфонові кислоти можуть бути який після цього може бути сульфонільований отримані сульфіруванням ароматичного кільця за до зазначеної вище сульфонової кислоти способами, добре відомими у даній галузі техніки, Наприклад, СРгВгг або СОгВгг можуть бути ПІДДІНІ такими, як взаємодія з сірчаною кислотою, з SO3, з взаємодії з 1,2-бензодитюлом, 2комплексами на основі SO3, такими, як ДМФ (SO3), меркаптофенолом або 1,2-бензодюлом у піридин (SO3), N.N-диметилацетамід (SO3), тощо, присутності основи з отриманням ВІДПОВІДНО переважні арилсульфонілгалогеніди одержують з сполук за формулами ароматичних сполук взаємодією з ДМФ (SO3) і SOCI2 або СІС(О)С(О)СІ Реакції можна здійснювати стадіями або в одній судині Арилсульфонові кислоти, сконденсовані з бензольним ядром гетероциклосульфонові кислоти, гетероарилсульфонові кислоти, арил меркаптани, сконденсовані з бензольним ядром гетероциклічні меркаптани, D гетероарил меркаптани, арил галогеніди, де А і В означає О або S і D означає атом сконденсовані з бензольним ядром гетероциклічні дейтерію Коли А і/або В означає S, сірка може галогеніди, гетероарил галогеніди, тощо, є бути також окиснена з використанням способів, комерційне доступними або легко можуть бути описаних нижче , де це стосувалалося отримані з комерційне доступних вхідних продуктів сульфоновим або сульфоксидним похідним з використанням стандартних способів, добре Після отримання сульфонамідного похідного відомих у даній галузі техніки Наприклад, ряд амінозахищену групу Р або амінозахищені групи Р1 4 сульфонових кислот (R SO3H), які наведені і Р2 вилучають в умовах, що не виявляють впливу формулами на решту молекул Ці способи добре ВІДОМІ у даній галузі техніки та включають кислотний гідроліз, пдрогеноліз, тощо У способі, якому надається перевага, використовується вилучення захисної 3 3 27 56129 28 групи, наприклад, вилучення карбобензоксигрупи, де Р3, R1 і R5 мають зазначені вище значення пдрогенолізом у присутності паладію на вугіллі у Придатні для проведення реакції Майкла ВІДПОВІДНІЙ системі розчиннків, такий, як спирт, розчинники включають спирти, такі, як, наприклад, оцтова кислота, тощо або їх суміші Коли захисна метанол, етанол, бутанол, тощо, а також прості група є трет-бутоксикарбонільною групою, вона ефіри, наприклад, ТГФ і ацетонітрил, ДМФ, ДМСО, може бути усунена з використанням неорганічної тощо, включаючи їх суміші Придатні основи або органічної кислоти, наприклад, НСІ або включають алкоксіди металів групи І, такі, як, трифтороцтової кислоти, у придатній системі наприклад, метоксид натрію, етоксид натрію, розчинників, наприклад, у діоксані або бутоксид натрію, тощо, а також гідриди металів метиленхлориді Отриманий продукт є похідним групи І, такі, як гідрид натрію, включаючи їх суміші аміновоісолі Тюльне похідне перетворюють до ВІДПОВІДНОГО сульфон або сульфоксид за формулою Після нейтралізації солі амін піддають поєднанню з сульфон/сульфоксидалканоільною сполукою або з її оптичним ізомером (наприклад, таким, в якому група -СН (R1)- має R -або Sконфігурацію) за формулою 0 де n, 11 R мають зазначені вище значення і L означає групу, що відходить, таку, як галогенід, ангідрид, активний складний ефір, тощо В альтернативному варіанті сульфон/ сульфоксидалканоільні сполуки або їх оптичний ізомер можуть бути піддані сполученню з захищеним аміном R з наступним вилученням захисної групи і поєднанням з R4SO2X, де X означає СІ або Вг і Р, 3 4 R R i R мають значення, що зазначені вище Такі сульфон/сульфоксидалканоільні сполуки, в яких п дорівнює 1, можуть бути отримані взаємодією меркаптану за формулою R SH зі заміщеним метакрилатом за формулою окиснення тюльного похідного ВІДПОВІДНИМ окиснювачем у відповідному розчинникові Придатні окиснювачі включають, наприклад, пероксид водню, мета-перборат натрію, оксон (пероксимоносульфат калію), метахлорпероксибензойну кислоту, перйодну кислоту, тощо, включаючи їх суміші Придатні розчинники включають оцтову кислоту (для мета-перборату натрію) 5 прості ефіри для інших перкислот, такі, як ТГФ і діоксан, а також ацетонітрил, ДМФ, тощо, включаючи їх суміші Сульфон/сульфоксид після цього перетворюють до відповідної вільної кислоти за формулою використовуючи придатну основу, наприклад, гідроксид литію, пдроксід натрію, тощо, включаючи їх суміші, у придатному розчинникові, такому, як, наприклад, ТГФ, ацетонітрил, ДМФ, ДМСО, метиленхлорид, тощо, включаючи їх суміші Вільна кислота після цього може бути перетворена в сульфон/сульфоксидалканоільні сполуки за формулою 0 за допомогою реакції Майкла Такі заміщені метакрилати є комерційне доступними або можуть бути легко отримані з комерційне доступних вхідних продуктів з використанням стандартних способів, добре відомих у даній галузі техніки Реакцію Майкла проводять у придатному розчинникові та у присутності придатної основи з отриманням ВІДПОВІДНОГО тюльного похідного, наведеного формулою Е: ОР ; RJ де n, 11 R5 мають зазначені вище значення і L означає групу.що відходить, таку, як галогенід, ангідрид, активний складний ефір, тощо В альтернативному варіанті вільна кислота може бути поділена на її оптичні ізомери (наприклад, такі, в яких група-СН (R1) - має R - або Sконфігурацію) з використанням способів, добре відомих у даній галузі техніки, таких, як утворення діастереомерних солей або складних ефірів і кристалізація або хроматографія, а після цього перетворення до 29 56129 сульфон/сульфоксидалканоільної сполуки В альтернативному варіанті тіоефір або ВІДПОВІДНИЙ заміщений тіол формул 1 5 ВІДПОВІДНО, де n, L, R і R мають значення, які зазначені вище, може бути поєднаний з одним із амінів С" H. -N ОН ЕЬКГ он з наступним перетворенням до інгібіторів протеази за даним винаходом Р4 означає сірку, яка захищає групу, таку, як ацетил, бензоїл, тощо Ацетильна і бензоільна групи можуть бути усунені обробкою неорганічної основи або аміном, перевага надається аміаку, у відповідному розчинникові, такому, як метанол, етанол, ізопропанол, толуол або тетрапдрофуран Розчинником, якому надається перевага, є метанол Наприклад, може бути проведене сполучення комерційне доступної кислоти о ЗО придатних окиснювачів, як описане отриманням сполуки за формулою де t і R мають зазначені вище значення Ця сульфон/сульфоксидна карбонова кислота після цього може бути піддана сполученню з проміжною аміносполукою, яка описана вище, з наступною додатковою взаємодією з отриманням сульфонамідного інгібітору або з отриманням сульфонамідного аміну і безпосереднім отриманням сульфонамідного інгібітору Група L' або агент R5L' є ВІДХІДНОЮ групою, такою, як галогенід (хлорид, бромід, йодид), мезилат, тозилат або трифталат Взаємодію меркаптану з R5L' проводять у присутності придатної основи, такого, як триетиламш, дмзопропілетиламін, 1,8діазабіцикло [5, 4, 0] ундек-7-ен (ДБУ), тощо, у придатному розчинникові, такому, як толуол, тетрапдрофуран або метиленхлорид Основою, якій надається є ДБУ, а найбільш переважним розчинником є толуол Коли R5 означає метильну групу, R5L' може бути метилхлорид, метилбромід, метил йодид або д и мети л сульфат, переважно метилйодид В альтернативному метакрилат за формулою О ОН сн 3 R ОН варіанті заміщений ОР3 з одним із амінів за формулою H N j вище, з он деацетилірування групи сірки, наприклад, за допомогою гідролізу з використанням придатної основи, такої, як гідроксид, або амін, такого, як аміак, і наступна взаємодія тіолу, що утворився, з агентом R5L', де R5 і U мають зазначені вище значення, з отриманням сполук, що мають одну з означених нижче структур R/ о. io де L' означає групу, що відходить, як описано раніше, Р3 має зазначені вище значення і R10 означає радикали, що при відновленні подвійного зв'язку утворюють радикали R1, піддають 5 взаємодії з R SM з наступним окисненням, як описано вище, або з придатним сульфіруючим агентом, таким, як, наприклад, сульфінова кислота, наведена формулою R5SO2M, де R5 має значення, зазначені вище, а М означає метал, придатний для утворення солі кислоти, априклад, натрій, з отриманням О о СЬ, або його певних діастереомерів Після цього сірка може бути окислнена до ВІДПОВІДНОГО сульфону або сульфоксиду з використанням придатних окиснювачів, як описане вище, з отриманням необхідного проміжного продукту, а після цього в результаті додаткових взаємодій отриманням сульфонамідного інгібітору або безпосередньо з отриманням сульфонамідного інгібітору В альтернативному варіанті кислота або Р3-захищ-ена кислота може бути деацетильована, піддана взаємодії з агентом R5L', вилученню захисної групи і окисленню до ВІДПОВІДНОГО сульфону або сульфоксиду з використанням //W О 0 R 10 ВІДПОВІДНОГО сульфону, наведеного формулою де Р , R5 і R10 мають зазначені вище значення 3 сульфону після цього вилучають захисну групу з отриманням відповідної карбонової кислоти Наприклад, коли Р означає трет-бутильну групу, вона може бути усунена обробкою кислотою, такою, як соляна або трифтороцтова кислота У найкращому випадку використовують 4н соляну кислоту в діоксані Карбонову кислоту, що утворилася, після 31 56129 цього асиметрично гідрують з використанням каталізатору для асиметричного гідрування, такого, як, наприклад, комплекс рутеній-BINAP, з отриманням відновленого продукту, в значному ступені збагаченого ізомером, якому надається особлива перевага, наведеним однією з формул 0 A О & l О R 1 32 Приклад 1 0 ОН ОН о о 5 де R і R мають зазначені вище значення Якщо активний ізомер має R-стереохімічну конфігурацію, то як каталізатор для асиметричного гідрування може бути використаний Ru (R-BINAP) І навпаки, якщо активний ізомер має Sстереохімичну конфігурацію, то як каталізатор може бути використаний Ru (S-BINAP) Якщо обидва ізомери є активними або якщо вимагається отримати суміш двох діастереоізомерів, для відновлення вищезазначеної сполуки гідруванням може бути використаний такий каталізатор, як платина або паладій на вугіллі Після цього відновлені сполуки піддають сполученню з аміном, як вказано вище Описані вище ХІМІЧНІ реакції в цілому наведені в формі, ВІДПОВІДНІЙ їх широкому застосуванню для отримання сполук за даним винаходом Може виявитися, що реакції не застосовані в тому вигляді, як вони описані, до кожної з сполук, включених до об'єму даного винаходу Сполуки, для яких це має місце, легко можуть бути визначені фахівцями у даній галузі техніки В усіх таких випадках або реакції можуть бути успішно здійснені звичайними модифікаціями, які відомим! фахівцям уданій галузі техніки, наприклад, шляхом ВІДПОВІДНОГО захисту взаємодіючих груп, шляхом використання альтернативних звичайних реагентів, шляхом звичайної модифікації умов реакції, тощо, або для отримання ВІДПОВІДНИХ сполук за даним винаходом можуть бути застосовані ІНШІ реакції, наведені в даному описи або ІНШІ звичайні реакції В усіх способах отримання вси ВХІДНІ продукти є відомими або можуть бути легко отримані з відомих вхідних продуктів Припускається, що фахівець у даній галузі техніки може без подальших досліджень, використовуючи попередній опис, застосувати даний винахід в його повному обсязі Тому наведені нижче конкретні варіанти здійснення, яким надається перевага, повинні розглядатися винятково як ілюстративні, а не як такі, що обмежують яким-небуть чином решту об'єму винаходу Вси реагенти використовували в тому вигляді, як вони були отримані, без очищення Вси протонні і вуглеводневі ЯМР-спектри одержували з використанням спектрометра ядерного магнітного резонансу або типу Vanan VXR-300, або типу VXR-400, Наступні приклади ілюструють отримання сполук-шпбіторів за даним винаходом і проміжних продуктів, придатних для отримання сполукшпбіторів за даним винаходом Одержування 2S-[6ic (феніл метил) аміно] бензопропанолу Спосіб 1 Одержування 2S-[6ic (фенілметил) аміно] бензопропанолу відновленням фенілметилового ефіру N, N-біс (фенілметил)-І_фенілаланила за допомогою ДІБАЛ Стадія 1 Розчин, що містить L-фенілаланіл (50,0г, 0,302 моля), гідроксид натрію (24,2г, 0,605 моля) і карбонат калію (83,6г, 0,605 моля) у воді (500мл), нагрівали до 97°С Після цього поволі додавали (час додавання 25 хв) бензилбромід (108,5мл, 0,605 моля) Суміш змішували при 97°С впродовж ЗОху в атмосфері азоту Розчин охолоджували до кімнатної температури і екстрагували толуолом (2х250мл) Об'єднані органічні шари промивали водою і соляним розчином, сушили над сульфатом магнію, фільтрували та концентрували, одержуючи масло Ідентичність продукту підтверджували наступним чином Аналітична ТСХ (суміш 10% етилацетату/гексан, силікагель) показала, що основний компонент із значенням Rf 0,32 є необхідною трибензилірованою сполукою, тобто феніл метиловим ефіром N, N-біс (фенілметил)-Д-фенілаланілу Ці сполуки можуть бути очищені за допомогою хроматографії на колонках (силікагель, суміш 15% етил ацетату/гексан) Звичайно продукт є достатньо чистим для його використання безпосередньо на наступній стадії без додаткового очищення 1Н-ЯМР-спектр відповідав такому, який відомий по опублікованим літературним даним 1 НЯМР(СОСІз) 5, 3,00 і 3,14 (АВХ-система, 2Н, JAB=14, 1 ГЦ, JAX=7,3I~4 І J B X=5,9I~4), 3,54 і 3,92 (АВ еистема,4Н, иАВ=13,9Гц), 3,71 (t, 1Н, J=7,6I~4), 5,11 і 5,23 (АВ-система, 2Н, иАВ=12,ЗГц), і 7,18 (m, 20H) МС-ЕІ m/z434(M-1) Стадія 2 Феніл метиловий ефір бензил іруваного фенілаланіну (0,302 моля), отриманий на попередній стадії, розчиняли в толуолі (750мл) і охолоджували до -55°С Додавали 1,5М розчин ДІБАЛ в толуолі (443,9мл, 0,666 моля) з такою швидкістю, щоб підтримувати температуру між -55 і -50°С (час додавання 1 година) Суміш змішували впродовж 20ху в атмосфері азоту і після цього реакцію припиняли при -55°С шляхом повільного додавання метанолу (37мл) Після цього холодний розчин зливали на холодний (5°С) 1,5н розчин НСІ (1,8л) Твердий продукт, що осів (приблизно 138г) фільтрували і промивали толуолом Твердий продукт суспендували в суміші толуолу (400мл) і води (100мл) Суміш охолоджували до 5°С і обробляли 2,5н NaOH (186мл) і після цього змішували при кімнатній температурі до 34 33 56129 розчинення твердого продуїсгу Толуоловий шар отриманої згідно способу 1 відокремлюваляли від водної фази і промивали Приклад 2 водою і соляним розчином, сушили над сульфатом магнію, фільтрували та концентрували до об'єму 75мл (89г) До залишку додавали етилацетат (25мл) і гексан (25мл), після чого починав кристалізуватися необхідний спиртовий продукт Через ЗОхв для підсилення подальшого кристал ізування додавали ще 50мл гексану О Твердий продукт відфільтровували і промивали 50мл гексану, одержуючи 34,9г продукту в першому виході Другий вихід продукту (5,6г) виділяли повторною фільтрацією маточного Отримання 2S-[6ic (фенілметил) аміно] розчину Обидва виходи об'єднували і бензопропанальдепду перекристалізовували з етилацетату (20мл) і Спосіб 1 гексану (ЗОмл), одержуючи 40г (3S-2-[6ic 2S-[6ic (фенілметил) аміно] бензопропанол (феніл метил) аміно] бензопропанолу, 40%-ний (200г, 0,604 моля) розчиняли в триетиламші вихід з L-фенілаланину Додаткові 7г (7%) (ЗООмл, 2,15 моля) Суміш охолоджували до 12°С і продукту можуть бути отримані в результаті додавали розчин комплексу триоксид перекристалізації маточного концентрованого сірки/піридин (380г, 2,39 моля) в ДМСО (1,6л) з розчину ТСХ продукту з Rf=0,23 (див еь 10% такою швидкістю, щоб підтримувати температуру етилацетату/гексан, силікагель), 1Н-ЯМР (CDCI3) 5 від 8 до 17°С (час додавання 1,0 годин) Розчин 2,44 ( т , 1Н), 3,09 (т, 2Н), 3,33 (т, 1Н), 3,48 і 3,92 змішували при температурі навколишнього (АВ-система, 4Н, JAB=13,3 ГЦ), 3,52 (m, 1H) і 7,23 25 середовища в атмосфері азоту впродовж 1,5 (m, 15Н), [a] D + 42,4 (с 1,45, СН2СІ2), ДСК годин, і до цього часу за даним ТСХ-аналізу (суміш 77,67°С Аналіз розраховано для C23H25ON С 33% етилацетату/гексан, силікагель) реакція була 83,34, Н 7,60, N 4,23, виявлено С 83,43, Н 7,59, N завершена Реакційну суміш охолоджували 4,22, ЖХВР на хіральній стаціонарній фазі крижаною водою і реакцію припиняли за колонка Cyclobond I SP (250x4,6мм внутрішній допомогою додавання 1,6л холодної води (10діаметр (В Д)), рухома фаза 15°С) впродовж 45хв Розчин, що утворився, метанолл'риетиламонійацетатний буфер з рН4,2 екстрагували етилацетатом (2,0л), промивали 5%(58 42, по об'єму), швидкість потоку 0,5мл/хв, ною лимонною кислотою (2,0л) і соляним визначення детектором при 230нм і температурі розчином (2,2л), сушили над MgSO4 (280г) і 0°С Час утримування 11,25хв, час утримування фільтрували Розчинник вилучали за допомогою необхідного енантюмеру 12,5хв роторного випарника при 35-40°С і після цього сушили під вакуумом, одержуючи 198,8г 2S-[6ic Спосіб 2 Одержування pS-2-[6ic (фенілметил) (фенілметил) аміно] бензопропанальдепду у аміно] бензопропанолу N.N-дибензиліруванням Lвигляді масла світло-жовтого кольору (99,9%) фенілаланшолу Отриманий неочищений продукт був достатньо L-фенілаланинол (176,6г, 1,168 моля) чистим для його використання безпосередньо на додавали до змішуванного розчину карбоната наступній, стадії без додаткового очищення калію (484,6г, 3,506 моля) в 710 мл води Суміш Аналітичні характеристики , сполуки відповідали нагрівали до 65°С в атмосфері азоту Додавали таким, відомим з опублікованним літературним розчин бензилброміду (400 г, 2,339 моля) в даним, [a] D25-92,9° (с 1,87, СН2СІ2), 1Н-ЯМР етанолі (305мл) з такою швидкістю, щоб (400МГц, CDCI3) 5 2,94 і 3,15 (АВХ-система, 2Н, підтримувати температуру між 60 і 68°С JAB=13,9 ГЦ, JAX= 7,3ГЦ І J X=6,2 ГЦ), 3,56 (t, 1H, Двофазний розчин змішували при 65°С впродовж и=7,1Гц), 3,69 і 3,82 (АВ-система, 4Н, иАВ=13,7Гц), 55хв і після цього давали охолодитися до 10°С при 7,25 (m, 15H) і 9,72 (s, 1H), МСВР розраховано інтенсивному змішуванні Маслянистий продукт для (М+1) C23H24NO 330, 450, Виявлено 330,1836, твердів у вигляді невеликих гранул, продукт Аналіз розраховано для C23H23ON С 83,86, Н розбавляли 2,0л водопроводною водою і 7,04, N 4,25, виявлено С 83,64, Н 7,42, N 4,19, змішували впродовж 5хв до розчинення ЖХВР на хіральній стаціонарній фазі (S,S) неорганічних побічних продуктів, продукт виділяли колонка Pirkle-Whelk-0 1 (250x4,6мм внутрішній фільтрацією при пониженому тиску і промивали діаметр (ВД)), рухома фаза гексан/ізопропанол водою до одержування значення рН7 Отриманий (99,5 0,5, за об'ємом), швидкість потоку 1,5мл/хв, неочищений продукт сушили на повітрі протягом визначення УФ-детектором при 21 Онм Час ночі, одержуючи півоцтовий твердий продукт утримання необхідного S-ізомеру 8,75хв, час (407г), що перекристалізовували з 1,1л утримання R-енантюмера 10,62хв етилацетату/гептану (1 10, за об'єму), продукт виділяли фільтрацією (при -8°С), промивали 1,6л Спосіб 2 холодної суміші (-10°С) етил ацетат/гептан (1 10, Розчин оксалілхлориду (8,4мл, 0,096 моля) в по об'єму) і сушили на повітрі, одержуючи 339г дихлорметані (240мл) охолоджували до -74°С (вихід 88%) pS-2-[6ic (фенілметил) аміно] Після ЦЬОГО ПОВОЛІ додавали розчин ДМСО бензопропанолу, tm=71,5-73,0°C При необхідності (12,0мл, 0,155 моля) в дихлорметані (50мл) з додаткова КІЛЬКІСТЬ продукту може бути отримана такою швидкістю, щоб підтримувати температуру з маточного розчину Інші аналітичні на рівні -74°С (час додавання -1,25 годин) Суміш характеристики ідентичні таким для сполуки, змішували впродовж 5 хв, а після цього додавали н B 36 35 56129 Приклад З розчин pS-2-[6ic (феніл метил) аміно] бензопропанолу (0,074 моля) в 100 мл дихлорметану (час додавання -20 хв, температура від -75°Сдо -68°С) Розчин змішували при -78°С впродовж 35ху в атмосфері азоту Після цього впродовж Юхв (температура від -78°С до -68°С) додавали триетиламш (41,2мл, 0,295 моля), після чого осідала амонієва сіль Холодну суміш змішували впродовж ЗОхв і після цього додавали V воду (225мл) Дихлорметановий шар О відокремлювали від водної фази і промивали водою, соляним розчином, сушили над сульфатом магнію, фільтрували та концентрували Залишок Отримання N N-дибензил-З (S)-aMmo-i 2-(S)розріджували етилацетатом і гексаном і після епокси-4-фенілбутану цього фільтрували для наступного вилучення Спосіб 1 амонієвої солі Фільтрат концентрували, Розчин, що містить aS-[6ic (фенілметил) одержуючи aS-[6ic (феніл метил) аміно] аміно] бензопропанальдепд (191,7г, 0,58 моля) і бензопропанальдепд Альдегід використовували хлорйод метан (56,4мл, 0,77 моля) в на наступній стадії без очищування тетрапдрофурані (1,8л), охолоджували до температури від -ЗО до -35°С в реакторі з Спосіб З неіржавіючої сталі в атмосфері азоту (можна До суміші, що містить 1,0г (3,0 моля) pS -2 також працювати і при нижчій температурі, такій, [біс (фенілметил) аміно] бензопропанолу, 0,531г як -70°С, однак вищі температури легше (4,53 моля) N-метилморфолшу, 2,27г одержувати при крупномасштабних процесах) молекулярних сит (4А) і 9,1 мл ацетонітрилу, Після ЦЬОГО додавали розчин н -бутиллітію в додавали 53мг (0,15 моля) гексані (1,6М, 365мл, 0,58 моля) з такою тетрапропіламонійперутенату (ТПАП) Суміш швидкістю, щоб підтримувати температуру нижче змішували впродовж 40хв при кімнатній 25°С Після додавання суміш змішували при температурі та концентрували при зниженому температурі від -ЗО до -35°С впродовж 10хв тиску Залишок суспендували в 15мл етилацетату, Додаткові додавання реагентів здійснювали фільтрували через подушку з силікагелю Фільтрат наступним чином (1) Додавали додаткову порцію концентрували при зниженому тиску з отриманням хлорйодметану (17 мл), після цього н -бутиллітій продукту, що містить приблизно 50% aS-2-[6ic (110мл) при температурі не вище -25°С Після (фенілметил) аміно] бензопропанальдепду у додавання суміш змішували при температурі від вигляді масла світло-жовтого кольору ЗО до -35°С впродовж 10хв Цю процедуру Спосіб 4 повторювали ще один раз (2) Додавали додаткову порцію хлорйодметану (8,5мл, 0,11 моля), після До розчину, що містить 1,0г (3,02 моля) pS-2цього н-бутиллітій (55мл, 0,088 моля) при [біс (фенілметил) аміно] бензопропанолу в 9,0 мл температурі не вище -25°С Після додавання толуолу, додавали 4,69мг (0,03 моля) 2,2,6,6суміш змішували при температурі від -ЗО до -35°С тетраметил-1-піперидинілокси (ТЕМПО) як вільний впродовж Юхв Цю процедуру повторювали п'ять радикал, 0,32г (3,11 моля) броміду натрію, 9,0мл разів (3) Додавали додаткову порцію етилацетату і 1,5мл води, Суміш охолоджували до хлорйодметану (8,5мл, 0,11 моля), після цього н 0°С і поволі додавали впродовж 25ху водний бутиллітій (37мл, 0,059 моля) при температурі не розчин 2,87мл 5%-ного побутового хлорного вище -25°С Після додавання суміш змішували при вапна, що містить 0,735г (8,75 моля) бікарбонату температурі від -ЗО до-35°С впродовж 10 хв Цю натрію і 8,53мл води Суміш змішували при 0°С процедуру повторювали ще один раз Припиняли впродовж бОхв При змішуванні впродовж Юхв зовнішнє охолоджування і суміш нагрівали до додавали ще дві порції (по 1,44мл кожна) хлорного температури навколишнього середовища вапна Двофазній суміші давали поділитися впродовж 4-16 годин, після чого ТСХ (силікагель, Водний шар екстрагували ДВІЧІ 20МЛ етилацетату суміш 20% етил ацетату/гексан) показала, що Об'єднаний органічний шар промивали 4,0мл реакція завершена Реакційну суміш розчину, що містить 25 мг йодиду калію і воду охолоджували до Ю°С і реакцію припиняли, (4,0мл), 20мл 10%-ного водного розчину додаючи 1452г 16%-ного розчину хлориду амонію тіосульфату натрію і після цього соляним (отриманого розчином 232г хлориду амонію в розчином Органічний розчин сушили над 1220мл води), підтримуючи температуру нижче сульфатом магнію, фільтрували та концентрували 23°С Суміш змішували впродовж Юхв і поділяли при зниженому тиску, одержуючи 1,3г органічний і водний шари Водну фазу неочищеного масла, що містить невелику КІЛЬКІСТЬ екстрагували етилацетатом (2х500мл) необхідного альдегіду, тобто aS-[6ic (фенілметил) Этилацетатний шар об'єднували з аміно] бензопропанальдепду тетрапдрофурановим шаром Об'єднаний розчин Спосіб 5 сушили над сульфатом магнію (220г), фільтрували За методикою, аналогічною описаній у способі та концентрували на роторном випарникові при 1 даного прикладу, за винятком того, що 65°С Залишок у вигляді коричневого масла використали 3,0 еквіваленти комплексу триоксид сушили при 70°С у вакуумі (0,8бар) впродовж 1 сірки/піридин, виділяли aS-[6ic (фенілметил) години, одержуючи 222,8г неочищеного продукту аміно] бензопропанальдепд з виходом, який можна зіставити 38 37 56129 (Маса неочищеного продукту складала >100% Спосіб З Внаслідок відносної нестабільності продукту на Розчин, що містить aS-[6ic (феніл метил) силікагелі неочищений продукт звичайно аміно] бензопропанальдепд (178,84г, 0,54 моля) і використовували безпосередньо на наступній бромхлорметан (46мл, 0,71 моля) в стадії без додаткового очищування) тетрапдрофурані (1,8л), охолоджували до Співвідношення діастереомірів неочищеної суміші температури від -ЗО до -35°С в реакторі з визначали протонним ЯМР (2S)/(2R) 86 14, неіржавіючої сталі в атмосфері азоту (можна Характеристики хворного і основного епоксидних працювати також при більш низькій температурі, діастереомірів в цій суміші визначали за такий, як -70°С, однак більш високі температури допомогою ТСХ -аналізу (силікагель, суміш 10% легше одержувати при крупномасштабних етилацетату /гексан), Rf=O, 29 і 0,32 ВІДПОВІДНО процесах) Розчин н-бутиллітія в гексані (1,6М, Аналітичний зразок кожного з цих діастереоміров 340мл, 0,54 моля) додавали з такою швидкістю, одержували очисткою за допомогою щоб підтримувати температуру нижче -25°С Після хроматографії на силікагелі (суміш 3% додавання суміш змішували при температурі від етилацетату/гексан), при цьому були отримані ЗО до 35°С впродовж Юхв Додаткові додавання наступні характеристики реагентів здійснювали наступним чином (1) Додавали додаткову порцію бромхлорметану N,N, aS-трис (феніл метил)-23(14мл), а після цього н-бутиллітій (102мл) при оксиранметанумін температурі не вище -25°С Після додавання 1 Н -ЯМР (400МГц, CDCI3) 5 2,49 і 2,51 (АВ суміш змішували при температурі від -ЗО до -35°С система, 1Н, иАВ=2,82Гц), 2,76 і 2,77 (АВ -система, впродовж Юхв Цю процедуру повторювали ще 1Н, J B=4,03I~4), 2,83 (m, 2H), 2,99 і 3,03 (АВ один раз (2) Додавали додаткову порцію система, 1Н, JAB=10,1l~4), 3,15 (m, 1H), 3,73 і 3,84 бромхлорметану (7мл, 0,11 моля), а після цього н(АВ -система, 4Н, иАВ=14,00Гц), 7,21 (m, 15H), 1Н бутиллітій (51 мл, 0,082 моля) при температурі не ЯМР (400МГц, CDCI3) 5 139,55, 129,45, 128,42, вище -25°С Після додавання суміш змішували при 128,14, 128,09, 126,84, 125,97,60,32, 54,23, температурі від -ЗО до 35°Свпродовж Юхв Цю 52,13,45,99, 33,76 МСВР розраховане для процедуру повторювали п'ять раз (3) Додавали C24H26NO (M+1) 344,477, виявлене 344,2003, додаткову порцію , бромхлорметану (7мл, 0,11 N, N, aS-трис (феніл метил)-2Рмоля), а після цього н-бутиллітій (51 мл, 0,082 оксиранметанумін моля) при температурі не вище -25°С Після 1 Н -ЯМР (300МГц, CDCI3) 5 2,20 (m, 1H), 2,59 додавання суміш змішували при температурі від (m, 1H), 2,75 (m, 2H), 2,97 (m, 1H), 3,14 (m, 1H), ЗО до 35°С впродовж 10хв Цю процедуру 3,85 (АВ -система, 4Н), 7,25 (m, 15H) ЖХВР на повторювали ще один раз Припиняли зовнішнє хиральній стаціонарній фазі колонка Pirkle -Whelkохолоджування і суміш нагрівали до температури О 1 (250x4,6мм ВД), рухома фаза навколишньої середи впродовж 4-16 годин, після гексан/ізопропанол (99,5 0,5, О/О), швидкість чого ТСХ (силікагель, суміш 20% потоку 1,5 мл/хв, визначення УФ-детектором при етил ацетату/гексан) показала, що реакція 210нм Час утримання продукту (8) 9,38хв, час завершена Реакційну суміш охолоджували до утримання енантюмеру (4) 13,75хв Ю°С і реакцію припиняли додаванням 1452г 16% ного розчину хлориду амонію (отриманого Спосіб 2 розчиненням 232г хлориду амонію в 1220мл води), Розчин, що містить 0,704 моля неочищеного підтримуючи температуру нижче 23°С Суміш альдегіду і хлорйодметан (7,0мл, 0,096 моля) в змішували впродовж Юхв і поділяли органічний і тетрапдрофурані (285мл) охолоджували до -78°С водний шари Водну фазу екстрагували в атмосфері азоту Після цього додавали 4,6М етилацетатом (2х500мл) Этилацетатний шар розчин и-бутиллитію в гексані (25мл, 0,040 моля) з об'єднували з тетрапдрофурановим шаром такою швидкістю, щоб підтримувати температуру Об'єднаний розчин сушили над сульфатом магнію на рівні -75°С (час додавання 15хв) Після першого (220г), фільтрували та концентрували на роторном додавання знов додавали хлорйодметан (1,6мл, випарникові при 65°С Залишок у вигляді 0,022 моля), а після цього н-бутиллітій (23мл, коричневого масла сушили при 70°С у вакуумі 0,037 моля), підтримуючи температуру на рівні (0,8бар) впродовж 1 години, одержуючи 222,8г 75°С Суміш змішували впродовж 15хв Кожний з неочищеного продукту реагентів, хлорйодметан (0,70мл, 0,010 моля) і н бутиллітій (5мл, 0,008 моля), додавали ще чотири рази впродовж 45хв при -75°С Охолоджуючу баню Спосіб 4 після цього вилучали і розчин нагрівали до 22°С Використали засоби, описані в способі З впродовж 1,5 годин Суміш виливали в ЗООмл даного прикладу, за винятком того, що насиченого водного розчину хлориду амонію температура реакції складала -20°С Отриманий ВІДДІЛЯЛИ тетрапдрофурановий шар Водну фазу N,N, aS-трис (фенілметил)-23-оксиранметанумш екстрагували етилацетатом (1х300мл) Об'єднані являв собою суміш діастереомірів меншої чистоти органічні шари промивали соляним розчином, у порівнянні з отриманої по засобу З сушили над сульфатом магнію, фільтрували і Спосіб 5 концентрували, одержуючи масло коричневого Використали засоби, описані в способі З кольору (27,4г) продукт може використовуватися даного прикладу, за винятком того, що на наступній стадії без подальшого очищування температури реакції складали від -70 до -78°С Необхідний діастереомір може бути очищений Отриманий N,N, aS-трис (феніл метил)-23перекристаллізацією на наступній стадії, продукт оксиранметанумін являв собою суміш також може бути очищений хроматографією діастереомірів, яку безпосередньо застосовували A 40 39 56129 на наступній стадії без додаткового очищування Приклад 5 Спосіб 6 Використали засоби, описані в способі З даного прикладу, за винятком того, що безперервне додавання бромхлорметану і нбутиллитія здійснювали при температурі від -ЗО до -35°С Після здійснення реакції і відповідної обробки, як описано в способі 3 даного прикладу, виділяли необхідний N,N, aS-трис (фенілметил)23-оксиранметанумш з виходом і чистотою, що можна зіставити Рїї Спосіб 7 Використали засоби, описані в способі 2 даного прикладу, за винятком того, що замість Отримання оксалату N-[3 (S)-[N,N-6ic хлорйод метану застосовували дибромметан (фенілметил) аміно]-2-(Р)-пдрокси-4-фенілбутил]Після здійснення реакції і відповідної обробки, як N -ізобутиламшу описане в способі 2 даного прикладу, виділяли До розчину щавлевої кислоти (8,08г, 89,72 необхідний N,N, aS-трис (феніл метил)-23моля) в метанолі (76мл) впродовж 15хв додавали оксиранметанумін розчин неочищеного 3 (S)-[N,N-6ic (фенілметил) Приклад 4 амшо]-1 -(2 -метилпропіл) амшо-4-фенілбутан-2Ролу (39, 68г, що містить приблизно 25,44г (61,06 моля) З (S), 2 (RJ-ізомеру і приблизно 4,49г (10,78 моля) З (S), 2 (S)-i3OMepy, в етилацетаті (90мл) Суміш змішували при кімнатній температурі впродовж приблизно 2 годин Твердий продукт виділяли фільтрацією, промивали етилацетатом (2х20мл) і сушили під вакуумом впродовж приблизно 1 години, одержуючи 21,86г (вихід ізомеру 70,7%) солі з 97% -ною діастереомірною чистотою (за даними про площу ПІКІВ при ЖХВРаналізі) ЖХВР-аналізі колонка типу Vydecпептид/Отеш С18, УФ -детектор, 254нм, швидкість Отримання N-[3 (S)-[N,N-6ic (феніл метил) потоку 2мл/хв, градієнт {А=0,05% трифтороцтова аміно]-2-(Р)-гідрокси-4 -фенілбутил]-г\Ікислота у воді, 5=0,05% трифтороцтова кислота в ізобутиламшу ацетонітрилі, Охв 75% А/25% Б, ЗОхв 10% А/90% Б, До розчину N, N-дибензил-З (S)-aMmo-1,2(S)35хв 10% А/90% Б, 37хв 75% А/25% Б}, час епокси-4-фенілбутану (388,5г, 1,13 моля) в утримання 10,68хв для З (S), 2 (R) -ізомеру і 9,73хв ізопропанолі (2,7л) (або в етилацетаті) впродовж для З (S), 2 (S) -ізомеру) t m 174,99°C, 2хв додавали ізобутиламш (1,7кг, 23,1 моля) микроаналіз розрахован С 71,05%, Н 7,50%, N Температура підвищувалася від 25°С до 30°С 5,53%, виявлене С 71,71%, Н 7,75%, N 5,39% Розчин нагрівали до 82°С і змішували при цій В альтернативному варіанті дипдрат температурі впродовж 1,5 годин Теплий розчин щавелевої кислоти (119г, 0,94 моля) додавали в концентрували при зниженому тиску і при 65°С круглодонную колбу об'ємом 5000мл, обладнану Залишок у вигляді масла коричневого кольору механічною мешалкою і капельною вирвою переносили в колбу об'ємом Зл і сушили у вакуумі Додавали метанол (ЮООмл) і суміш змішували до (0,8мм рт ст) впродовж 16 годин, одержуючи 450г повного розчинення Впродовж 20хв додавали З (S)-[N,N-6ic (фенілметил) амшо]-4-фенілбутанрозчин неочищеного 3 (S)-[N,N-6ic (фенілметил) 2R-on у вигляді неочищеного масла амшо]-1-(2-метилпропіл) амшо-4-фенілбутан-2 (R)Аналітичний зразок основного ола в етилацетаті (1800мл, 0,212г ізомерів діастереомірного продукту одержували очисткою аміноспирту/мл, 0,9160 моля) Суміш змішували невеликого зразка неочищеного продукту за впродовж 18 годин і твердий продукт виділяли допомогою хроматографії на силікагелі (суміш центрифугуванням при 400хд у ВИГЛЯДІ шести 40% етил ацетату/гексан) ТСХ -аналіз силікагель, порцій Кожну порцію промивали 125мл суміш 40% етилацетату/гексан, Rf=0,28, ЖХВР етилацетату Після цього сіль збирали і сушили аналіз ультрасферна колонка типу ODS, 25% впродовж ночі при тиску 1торр, одержуючи 336,3г триетиламшо/фосфатний буфер з рНЗ продукту (71% по відношенню до загального змісту ацетонітрил, швидкість потоку 1мл/хв, УФаміноспирту) Дані ЖХВР/МС (електроспрей) детектор, час утримання 7,49хв, МСВР відповідали необхідному продукту (m/z 417 розрахований для C28H27N2O (M+1) 417,616, [М+Н]+) виявлений 417,2887, Аналітичний зразок хворного В альтернативному варіанті неочищений З (S)діастереомірного продукту, тобто З (S)-[N, N-біс [N.N-біс (фенілметил) амшо]-1-(2-метил пропіл) (феніл метил) амшо]-4-фенілбутан-23-ола, амшо-4-фенілбутан-2 (R)-on (5г) розчиняли в одержували очищенням невеликого зразка метил-трет-бутил о во му ефірі (МТБЕ) (Юмл) і неочищенного продукту за допомогою додавали щавлеву кислоту (1г) в метанолі (4мл) хроматографії на силікагелі (суміш 40% Суміш змішували впродовж приблизно 2 годин Що етил ацетату/гексан) утворився твердий продукт фільтрували, 42 41 56129 промивали холодним МТБЕ і сушили, одержуючи кольору у вигляді продукту з приблизно 85%-ною 2,1г білий твердий продую" з 98,9%-ною діастереомірною чистотою (за даними про площу діастереомірною чистотою (за даними про площу ПІКІВ при ЖХВР-аналізі) Коричневе масло ПІКІВ при ЖХВР-аналізі) кристалізували наступним чином 0,2г масла розчиняли при нагріванні в першому розчинникові, Приклад 6 одержуючи прозорий розчин, додавали другий Отримання ацетату N-[3 (S)-(N -біс розчинник до тих пір, доки розчин не ставав (фенілметил) аміно]-2-(Р)-пдрокси-4-фенілбутил]каламутним, суміш знов нагрівали до отримання N-ізобутиламшу прозорого розчину, вносили затравку у вигляді До розчину неочищеного 3 (S)-N,N-6ic продукту з приблизно 99%-ною діастереомірною (феніл метил) амшо]-1-(2-метил пропіл) аміно-4чистотою, охолоджували до кімнатної температури фенілбутан-2 (R)-ona в метил-трет-бутиловому і після цього витримували в холодильникові ефірі (МТБЕ) (45мл, 1,1г ізомерів аміноспирту/мл) впродовж ночі Кристали фільтрували, промивали по краплям додавали оцтову кислоту (6,9мл) другим розчинником і сушили Діастереомірну Суміш змішували при кімнатній температурі чистоту кристалів оцінювали за площею ПІКІВ при впродовж приблизно 1 години Розчинник ЖХВР -аналізі Результати наведені в таблиці 1 вилучали у вакуумі, одержуючи масло коричневого Таблиця 1 Перший розчинник МТБЕ Перший розчинник МТБЕ Метанол Толуол Толуол Другий розчинник Гептан Другий розчинник Гексан Вода Гептан Гексан Співвідношення розчинників 1 10 Співвідношення розчинників 1 10 1 1,5 1 10 1 10 В альтернативному варіанті неочищений З (S)[N.N-біс (феніл метил) амшо]-1-(2-метил пропіл) амшо-4-фенілбутан-2 (R)-on (50,0г, що містить приблизно 30,06г (76,95 моля) З (S), 2 (RJ-ізомеру і приблизно 5,66г (13,58 моля) З (S), 2 (SJ-ізомеру) розчиняли в метил-трет-бутиловому ефірі (45,0мл) До цього розчину впродовж приблизно Юхв додавали оцтову кислоту (6,90мл, 120,6 моля) Суміш змішували при кімнатній температурі впродовж приблизно 1 години та концентрували при зниженому тиску Маслянистий залишок очищували перекристалізацією з метил-третбутилового ефіру (32мл) і гептану (320мл) Твердий продукт виділяли фільтрацією, промивали холодним гептаном і сушили у вакуумі впродовж приблизно 1 години, одержуючи 21,34г (вихід ізомеру 58,2%) моноацетатної солі з 96%ною діастереомірною чистотою (за даними про площу ПІКІВ при ЖХВР -аналізі) Т пл 105-106°С, мікроаналіз розраховано С 75,53%, Н 8,39%, N 5,87%, виявлено С 75,05%, Н 8,75%, N 5,71% Приклад 7 Одержування тартрату N-[3(S)-[N N-біс (фенілметил) аміно]-2-(Р)-пдрокси-4-фенілбутил]N-ізобутиламшу Неочищений 3 (S)-[N,N-6ic (феніл метил) амшо]-1 -(2 -метилпропіл) амшо-4-фенілбутан-2Рол (10,48г, що містить приблизно 6,72г (16,13 моля) З (S), 2 (RJ-ізомеру і приблизно 1,19г (2,85 моля) З (S), 2 (SJ-ізомеру) розчиняли в тетрапдрофурані (10,0мл) До цього розчину впродовж приблизно 5хв додавали розчин Lвинної кислоти (2,85г, 19 молей) в метанолі (5,0мл) Суміш змішували при кімнатній температурі впродовж приблизно Юхв та концентрували при зниженому тиску До Вихід ПО маси (г) 0,13 Вихід ПО маси (г) 0,03 0,05 0,14 0,10 Діастереомірна чистота (%) 98,3 Діастереомірна чистота (%) 99,6 99,5 98,7 99,7 маслянистого залишку додавали метил-третбутиловий ефір (20,0мл) і суміш змішували при кімнатній температурі впродовж приблизно 1 години Твердий продукт виділяли фільтрацією, одержуючи 7,50г неочищеної солі Неочищену сіль очищали перекристалізацією з етилацетату і гептану при кімнатній температурі, одержуючи 4,13г (вихід ізомеру 45,2%) тартрату з 95%-ною діастереомірною чистотою (за даними про площу ПІКІВ при ЖХВР-аналізі) Мікроаналіз розраховано С 67,76%, Н 7,41%, N 4,94%, виявлено С 70,06%, Н 7,47%, N 5,07% Приклад 8 Одержування дипдрохлориду N-[3 (S)-[N,N-6ic (фенілметил) аміно]-2 (Р)-пдрокси-4-бенілбутиліN-ізобутиламшу Неочищений 3 (S)-[N,N-6ic (феніл метил) амшо]-1-(2 -метилпропіл) амшо-4-фенілбутан-2 (R)-on (10,0г, що містить приблизно 6,41г (15,39 моля) З (S), 2 (RJ-ізомеру і приблизно 1,13г (2,72 моля) З (S), 2 (SJ-ізомеру) розчиняли в тетрапдрофурані (20,0мл) До цього розчину впродовж приблизно 5хв додавали соляну кислоту (20мл, 6,Он) Суміш змішували при кімнатній температурі впродовж приблизно 1 години та концентрували при зниженому тиску Залишок перекристалізували з етанолу при 0°С, одержуючи 3,20г (вихід ізомеру 42,7%) дихлориду з 98%-ною діастереомірною чистотою (за даними про площу пиків при ЖХВР -аналізі) Микроаналіз розраховано С 68,64%, Н 7,76%, N 5,72%, виявлено С 68,79%, Н 8,07%, N 5,55% Приклад 9 Одержування толуолсульфонату N-[3 (S)-[N,Nбіс (феніл метил) амшо]-2 (Р)-пдрокси-4фенілбутил]-М-ізобутиламшу 44 43 56129 Неочищений 3 (S)-[N,N-6ic (феніл метил) L-фенілаланшол (5г, 33 моля) і 3,59г (33,83 амшо]-1-(2-метилпропіл) амшо-4-фенілбутан-2 (R)моля) бензальдегіду розчиняли в 55мл ЗА етанолу ол (5,0г, що містить приблизно 3,18г (7,63 моля) З в атмосфері інертного газу у вібраторі Парра і (S), 2 (R)-i3OMepy і приблизно 0,56г (1,35 моля) З суміш нагрівали до 60°С впродовж 2,7 годин (S), 2 (S) -ізомеру) розчиняли в метил-третСуміш охолоджували до приблизно 25°С, бутиловом ефірі (10,0мл) До цього розчину додавали 0,99г 5%-ноі платини на вугіллі і суміш впродовж приблизно 5хв додавали розчин гідрували при тиску водня бОфунтів/кв дюйм і 40°С толуолсульфонової кислоти (2,28г, 12 молей) в впродовж 10 годин Каталізатор відфільтровували, метил-трет-бутил овом ефірі (2,0мл) і метанол продукт концентрували при зниженому тиску і (2,0мл) Суміш змішували при кімнатній неочищений твердий продукт температурі впродовж приблизно 2 годин та перекристалізовували з 150мл гептану, одержуючи концентрували при зниженому тиску Залишок 3,83г (вихід 48%) І\І-бензил-І_-фенілаланінолу у перекристалізовували з метил-трет-бутилового вигляді білої твердої речовини ефіру і гептану при 0°С, фільтрували, промивали Приклад 12 холодним гептаном і сушили у вакуумі, одержуючи Одержування г\І-(трет-бутоксикарбоніл)-М 1,85г (вихід ізомеру 40,0%) бензил-і-фенілаланшолу монотолуол сул ьфонату з 97%-ною І\І-бензил-І_-фенілаланінол (2,9г, 12 молей) розчиняли в Змл триетиламшу і 27мл метанолу і діастереомірною чистотою (за даними про площу додавали 5,25г (24,1 моля) ди-третПІКІВ при ЖХВР-аналізі) бутилдикарбонату Суміш нагрівали до 60°С Приклад 10 впродовж 35хв та концентрували при зниженому Одержування метансульфонату N-[3 (S)-[N,Nтиску Залишок розчиняли в 150мл етилацетату і біс (феніл метил) амшо]-2 (Р)-пдрокси-4ДВІЧІ промивали Юмл холодною (0-5°С) фенілбутил]-г\І-изобутиламіну розбавленою соляною кислотою (рН від 2,5 до 3), Неочищений 3 (S)-(N,N-6ic (феніл метил) 15мл води, Юмл соляного розчину, сушили над амшо]-1-(2-метилпропіл) амшо-4-фенілбутан-2 (R)сульфатом магнію, фільтрували та концентрували ол (10,68г, що містить приблизно 6,85г (16,44 при зниженому тиску Неочищений продукт у моля) З (S), 2 (RJ-ізомеру і приблизно 1,21г (2,90 вигляді масла очищали за допомогою моля) З (S), 2 (SJ-ізомеру) розчиняли в хроматографії на силікагелі (етилацетат гексан в тетрапдрофурані (10,0мл) До цього розчину якості розчинника для елюїрування, 12 3), додавали м етан сул ьфо нову кислоту (1,25мл, одержуючи 3,98г (вихід 97%) безбарвного масла 19,26 молей) Суміш змішували при кімнатній температурі впродовж приблизно 2 годин та Приклад 13 Одержування N - (третконцентрували при зниженому тиску Маслянистий бутоксикарбоніл) -N -бензил -L -фенілаланшалу залишок перекристалізовували з метанолу і води Спосіб 1 при 0°С, фільтрували, промивали холодним До розчину, що містить 0,32г (0,94 моля) N метанолом/водою (1 4) і сушили у вакуумі, (трет-бутоксикарбоніл) -N -бензил -L одержуючи 2,40г (вихід ізомеру 28,5%) фенілаланшолу в 2,8мл толуолу, додавали 2,4мг монометансул ьфонату з 98%-ною (0,015 моля) 2,2, 6,6 -тетраметил -1 піперидинілоксиду (ТЕМПО) в якості вільного діастереомірною чистотою (за даними О площу радикалу, 0,1г (0,97 моля) броміду натрію, 2,8мл ПІКІВ при ЖХВР-аналізі) етилацетату і 0,34мл води Суміш охолоджували Приклад 11 до 0°С і впродовж ЗОхв поволі додавали 4,2мл Одержування І\І-бензил-І_-фенілаланінолу водного розчину 5% -ной побутового хлорного Спосіб 1 вапна, що містить 0,23г (3,0мл, 2,738 моля) L-фенілаланшол (89,51 г, 0,592 моля) бікарбонату натрію Суміш змішували при 0°С розчиняли в 375мл метанолу в атмосфері впродовж Юхв Додавали ще три порції (по 0,4мл инертного газу, додавали 35,52г (0,592 моля) кожна) хлорного вапна з наступним змішуванням крижаної оцтової кислоти і 50мл метанолу, а після впродовж 10хв після кожного додавання до цього додавали розчин, що містить 62,83г (0,592 поглинання всього вхідного продукту Двуфазній моля) бензальдегіду в 100мл метанолу Суміш суміші давали поділитися Водний шар ДВІЧІ охолоджували до приблизно 15°С і приблизно екстрагували 8мл толуолу Об'єднаний органічний впродовж 40хв додавали розчин, що містить шар промивали 1,25мл розчину, що містить 0,075г 134,6г (2,14 моля) ціанборопдрида натрію в 700мл йодиду калію, бісульфат натрію (0,125г) і воду (1,1 метанолу, підтримуючи температуру між 15°С і мл), 1,25 мл 10% -ного водного розчину 25°С Суміш змішували при кімнатній температурі тиосульфату натрію, 1,25мл фосфатного буферу з впродовж 18 годин Суміш концентрували при рН7 і 1,5мл соляного розчину Органічний розчин зниженому тиску і розподіляли між 1л 2М розчину сушили над сульфатом магнію, фільтрували та гідроксиду амонію і 2л простого ефіру Ефірний концентрували при зниженому тиску, одержуючи шар промивали 1л 1М розчину гідроксиду амонію, 0,32г (вихід 100%) N -(трет-бутоксикарбоніл) -N ДВІЧІ 500мл води, 500мл соляного розчину і бензил -L -фенілаланіналю сушили над сульфатом магнію впродовж 1 години Ефірний шар фільтрували, концентрували при Спосіб 2 зниженому тиску і неочищений твердий продукт До розчину 2,38г (6,98 моля) N - (третперекристалізовували з 110мл етилацетату і 1,3л бутоксикарбоніл) -N -бензил -L -фенілаланшолу в гексану, одержуючи 115г (вихід 81%) І\І-бензил-І_3,8мл (27,2 моля) триетиламшу при 10°С фенілаланшолу у вигляді білої твердої речовини додавали розчин 4,33г (27,2 моля) комплексу триоксид сірки/піридин в 17мл Спосіб 2 45 46 56129 диметилсульфоксиду Суміш нагрівали до кімнатної температури і змішували впродовж 1 години Додавали воду (16мл) і суміш екстрагували 20мл етилацетату Органічний шар промивали 20мл 5% -ною лимонною кислотою, 20мл води, 20мл соляного розчину, сушили над сульфатом магнію та фільтрували Фільтрат концентрували при зниженому тиску, одержуючи 2,37г (вихід 100%) N - (трет-бутоксикарбоніл) -N бензил -L -фенілаланіналю Приклад 14 V о Одержування З (S) [N (третбутоксикарбоніл) -N-бензиламшо] -1,2 - (S)-enoKCH4-фенілбутану Спосіб 1 Розчин, що містить 2,5г (7,37 моля) N - (третбутоксикарбоніл) -N -бензил -L -фенілаланіналю і 0,72мл хлорйодметану в 35мл ТГФ, охолоджували до -78°С Поволі додавали, підтримуючи температуру нижче -70°С, 4,64 мл розчину н бутиллития (1,6М в гексані, 7,42 моля) Суміш змішували впродовж Юхв при температурі між 70°С і -75°С Послідовно додавали ще дві порції по 0,22мл хлорйодметану і 1,4мл н -бутиллитія і після кожного додавання суміш змішували впродовж Юхв при температурі між -70°С і -75°С Послідовно додавали ще чотири порції по 0,11мл хлорйодметану і 0,7мл н -бутиллитія і після кожного додавання суміш змішували впродовж Юхв при температурі між -70°С і 75°С Суміш нагрівали до кімнатної температури впродовж 3,5 годин Реакцію припиняли при температурі нижче 5°С додаванням 24мл крижаної води Двофазні шари поділяли і водний шар ДВІЧІ екстрагували ЗОмл етилацетату Об'єднані органічні шари тричі промивали 10 мл води, після цього Юмл соляного розчину, сушили над сульфатом натрію, фільтрували та концентрували при зниженому тиску, одержуючи 2,8г неочищеного масла жовтого кольору Це неочищене масло (вихід >100%) є сумішшю діастереомірних епоксидів N, aS -біс (фенілметил) -N - (трет-бутоксикарбоніл) -2S оксиранметануміну і N, aS -біс (фенілметил) -N (трет-бутоксикарбоніл) -2R -оксиранметануміну Неочищену суміш використовували безпосередньо на наступній стадії без очищування Спосіб 2 До суспензії, що містить 2,92г (13,28 моля) йодиду триметилсульфоксонію в 45мл ацетонітрилу, додавали 1,49г (13,28 моля) третбутоксиду калію Додавали розчин, що містить 3,0г (8,85 моля) N - (трет-бутоксикарбоніл) -N -бензил L -фенілаланшалу в 18мл ацетонитр'илу, і суміш змішували при кімнатній температурі впродовж 1 години Суміш розбавляли 150мл води і екстрагували ДВІЧІ 2 0 0 М Л етилацетату Органічні шари об'єднували і промивали 100мл води, 50мл соляного розчину, сушили над сульфатом натрію, фільтрували та концентрували при зниженому тиску, одержуючи 3,0г неочищеного масла жовтого кольору Неочищений продукт очищали за допомогою хроматографії на силікагелі (етилацетат гексан як розчинник для елюїрування, 18), одержуючи 1,02г (вихід 32,7%) суміш двох діастереомірів N, aS -біс (фенілметил) -N - (третбутоксикарбоніл) -2S -оксиранметануміну і N, aS біс (фенілметил) -N - (трет-бутоксикарбоніл) -2R оксиранметануміну Спосіб З До суспензії, що містить 0,90г (4,42 моля) йодиду триметилсульфонію в 18мл ацетонітрилу, додавали 0,495г (4,42 моля) трет-бутоксиду калію Додавали розчин, що містить 1,0г (2,95 моля) N (трет-бутоксикарбоніл) -N -бензил -L фенілаланшалюя в 7мл ацетонітрилу, і суміш змішували при кімнатній температурі впродовж 1 години Суміш розбавляли 80мл води і екстрагували ДВІЧІ 8 0 М Л етилацетату Органічні шари об'єднували і промивали ЮОмл води, ЗОмл соляного розчину, сушили над сульфатом натрію, фільтрували та концентрували при зниженому тиску, одержуючи 1,04г неочищеного масла жовтого кольору Неочищений продукт буй сумішшю двох діастереомірів N, aS -біс (фенілметил) -N- (трет-бутоксикарбоніл) -2S оксиранметануміну і N, aS -біс (фенілметил) -N (трет-бутоксикарбоніл) -2R -оксиранметануміну Приклад 15 Одержування 3S - [N - (трет-бутоксикарбоніл) N - (фенілметил) амшо]-1 - (2 -метилпропіл) аміно 4 -фенілбутан -2R -олу До розчину, що містить 500мг (1,42 моля) неочищеного епоксиду (суміш двох діастереомірів N, aS -біс (фенілметил) -N - (трет-бутоксикарбоніл) -2S -оксиранметануміну і N, aS -біс (фенілметил) N (трет-бутоксикарбоніл) -2R оксиранметануміну) в 0,98мл ізопропанолу, додавали 0,71 мл (7,14 моля) ізобутиламшу Суміш кип'ятили зі зворотним холодильником при 85 -90°С впродовж 1,5 годин Суміш концентрували при зниженому тиску і продукт у вигляді масла очищували за допомогою хроматографії на силікагелі (хлороформ метанол в якості розчинника для елюїрування, 100 6), одержуючи ЗЗОмг 3S - [N - (трет-бутоксикарбоніл) N - (фенілметил) аміно] -1 - (2 -метилпропіл) аміно -4 -фенілбутан -2R -олу у вигляді безбарвного масла (вихід 54,5%) Також виділяли 3S - [N 47 48 розчину бікарбонату натрію, і змішували впродовж 5хв Реакційну суміш тричі екстрагували 50мл етилацетату Органічні шари об'єднували і промивали 15мл води, Юмл насиченого розчину хлориду натрію та концентрували при зниженому тиску, одержуючи приблизно 1,1г щільної твердої речовини жовтого кольору Неочищений продукт очищали за допомогою хроматографії на силікагелі (етилацетат гексан як розчинник для елюїрування, 1 3), одержуючи 850мл (вихід 74%) 3S - (N -трет-бутоксикарбоніл) аміно -2R -гідрокси 4 -фенілбут -1 -ілтолуолсульфонату у вигляді білої твердої речовини Приклад 18 56129 (трет-бутоксикарбоніл) -N - (фенілметил) аміно] -1 - (2 -метилпропіл) аміно -4 -фенілбутан -2S -ол Коли в якості вхідного матеріалу використали очищений N, aS -біс (фенілметил) -N - (третбутоксикарбоніл) -2S -оксиранметанумін, то після очищування за допомогою хроматографії виділяли 3S -[N - (трет-бутоксикарбоніл)-М - (фенілметил) амшо]-1 - (2-метилпропіл) аміно -4 -фенілбутан -2R -ол з виходом 86% Приклад 16 Одержування 3S - (N -трет-бутоксикарбоніл) аміно -4 -фенілбутан -1, 2R -дюлу До розчину, що містить 1г (3,39 моля) 2S - (N трет-бутоксикарбоніл) аміно -1S -гідрокси -3 фенілбутанової кислоти (фірмою, що поставляється Nippon Kayaku, Японія) в 50мл ТГФ, при 0°С додавали 50мл комплексу боран -тгф (рідинний, 1,0М в ТГФ), підтримуючи температуру нижче 5°С Реакційну суміш нагрівали до кімнатної температури і змішували впродовж 16 годин Суміш охолоджували до 0°С і поволі додавали 20мл води для розкладу надлишка ВНз і припинення утворення продукту в суміші, підтримуючи температуру нижче 12°С Після припинення реакції суміш змішували впродовж 20хв та концентрували при зниженому тиску Реакційну суміш тричі екстрагували 60мл етилацетату Органічні шари об'єднували і промивали 20мл води, 25мл насиченого розчину хлориду натрію та концентрували при зниженому тиску, одержуючи 1,1г неочищеного масла Неочищений продукт очищали за допомогою хроматографії на силікагелі (хлороформ метанол в якості розчинника для елюїрування, 10 6), одержуючи 900мг (вихід 94,4%) 3S - (N -третбутоксикарбоніл) аміно -4 -фенілбутан - 1 , 2R диолу у вигляді білої твердої речовини ОН Одержування 3S - [N - (трет-бутоксикарбоніл) амшо]-1 - (2 -метилпропіл) аміно -4 -фенілбутан 2R -олу До розчину, що містить 90мг (0,207 моля) 3S (N -трет-бутоксикарбоніл) аміно -2R -гідрокси -4 фенілбут -1 -ілтолуолсульфонату в 0,143мл ізопропанолу і 0,5мл толуолу, додавали 0,103мл (1,034 моля) ізобутиламшу Суміш нагрівали до 80 -85°С і змішували впродовж 1,5 годин Реакційну суміш концентрували при зниженому тиску при 40 50°С і очищали за допомогою хроматографії на силікагелі (хлороформ метанол як розчинник для елюїрування, 10 1), одержуючи 54,9мл (вихід 76,8%) 3S - [N - (трет-бутоксикарбоніл) аміно] 1 - (2 -метилпропіл) аміно -4 -фенілбутан -2R -олу у вигляді білої твердої речовини Приклад 19 Приклад 17 0TS ОН Одержування 3S - (N -трет-бутоксикарбоніл) аміно -2R -гідрокси -4 -фенілбут -1 ілтолуолсульфонату До розчину, що містить 744,8мг (2,65 моля) 3S - (N -трет-бутоксикарбоніл) аміно -4 -фенілбутан 1, 2R -диолу в 13мл піридину, при 0°С у вигляді однієї порції додавали 914мг толуолсульфонілхлориду Суміш змішували при температурі від 0°С до 5°С впродовж 5 годин До реакційної суміші додавали суміш, що містить 6,5мл етилацетату і 15мл 5% -ного водного Одержування N [З (S) бензилоксикарбоніламшо -2 (R) -гідрокси -4 фенілбутил] -N -ізобутиламшу Розділ А До розчину, що містить 75,0г (0,226 моля) хлорметил кетону N -бензилоксикарбоніл -L фенілаланіну в суміші з 807мл метанолу і 807мл тетрапдрофурану, при -2°С впродовж ЮОхв додавали 13,17г (0,348 моля, 1,54екв) твердого боропдриду натрію Розчинники вилучали при зниженому тиску при 40°С і залишок розчиняли в етилацетаті (приблизно 1л) Розчин промивали послідовно 1М бісульфатом калію, насиченим 49 розчином бікарбонату натрію і після цього насиченим розчином хлориду натрію Після сушки над безводним сульфатом магнію і фільтрації розчин прогоняли при зниженому тиску До масла, що утворилося додавали гексан (приблизно 1л) і суміш нагрівали при змішуванні до 60°С Після охолодження до кімнатної температури збирали твердий продукт і промивали 2л гексану Твердий продукт, що утворився, перекристалізовували з гарячого етилацетату і гексану, одержуючи 32,3г (вихід 43%) N -бензилоксикарбоніл -З (S) -аміно -1 -хлор -4 -феніл -2 (S) -бутанолу, t m , 150-151 °С і М+І_Ґ=340, Розділ Б До розчину, що містить 6,52г (0,116 моля, 1,2екв) гідроксиду калію в 968мл абсолютного етанолу, при кімнатній температурі додавали 32,3г (0,097 моля) N -Cbz -З (S) -аміно -1 -хлор -4 -феніл -2 (S) -бутанолу Після змішування впродовж 15хв розчинник вилучали при зниженому тиску і твердий продукт розчиняли в метиленхлориді Після прпромивки водою, сушки над сульфатом магнію, фільтрації і упарювання одержували 27,9г білої твердої речовини Після перекристалізації з гарячого етилацетату і гексану одержували 22,3г (вихід 77%) N -бензилоксикарбоніл -З (S) -аміно - 1 , 2 (S) -епокси -4 -фенілбутану, t m 102-103°С і МН + 298, Розділ В Розчин N -бензилоксикарбоніл -З (S) -аміно - 1 , 2 (S) -епокси -4 -фенілбутану (1,00г, 3,36 моля) і ізобутиламшу (4,90г, 67,2 моля, 20екв) в Юмл ізопропілового спирту нагрівали зі зворотним холодильником впродовж 1,5 годин Розчин охолоджували до кімнатної температури, концентрували у вакуумі і після цього зливали при змішуванні в ЮОмл гексану, після чого продукт кристалізувався з розчину, продукт виділяли фільтрацією і сушили на повітрі, одержуючи 1,18г (вихід 95%) N - [[З (S) -фенілметилкарбамоїл) аміно -2 (R) -гідрокси -4 -фенілбутил] -N - [(2 метилпропіл)] аміну, C22H30N2O3, t m 108,0-109,5°С, МН+ m/z=371 Приклад 20 Одержування феніл метил [2R -гідрокси -3 - [(З -метилбутил) (фенілсульфоніл) аміно] -1S (фенілметил) пропіл] карбамату Взаємодією N [З (S) бензилоксикарбоніламшо -2 (R) -гідрокси -4 фенілбутил] -N -ізоаміламшу (1,47г, 3,8 моля), триетиламшу (528мкл, 3,8 моля) і бензилсульфонілхлориду (483мкл, 3,8 моля) одержували фенілметил [2R -гідрокси -3 - [(3 метилбутил) (фенілсульфоніл) аміно] -1S 56129 50 (фенілметил) пропіл] карбамат Після хроматографії на силікагелі, елюїруючи хлороформом, що містять 1% етанолу, одержували чистий продукт Аналіз розраховано для C29H36N2O5 S С 66,39, Н 6,92, N 5,34, виявлено С 66,37, Н 6,93, N 5,26 47 Приклад 21 H2N ОН Одержування 2R -гідрокси -3 - [[(4 амінофеніл) сульфоніл] (2 -метилпропіл) аміно] 1S -(фенілметил) пропіламіну Розділ А Одержування феніл метилового ефіру 2R -гідрокси -3 - [[(4 -нітрофеніл) сульфоніл] (2 -метилпропіл) аміно] -1S - (фенілметил) пропілкарбамшової кислоти До розчину, що містить 4,0г (10,8 моля) N - [З (S) -бензилоксикарбоніламшо -2 (R) -гідрокси -4 феніл] -N -изобутиламшу в 50мл безводного метиленхлориду, додавали 4,5мл (3,27г, 32,4 моля) триетиламшу Розчин охолоджували до 0°С і додавали 2,63г (11,9 моля) 4 нітробензолсульфонілхлориду, змішували впродовж ЗОхв при 0°С, а після цього впродовж 1 години при кімнатній температурі Додавали етилацетат, промивали 5% -ною лимонною кислотою, насиченим бікарбонатом натрію, соляним розчином, сушили і концентрували, одержуючи 5,9г неочищенного продукту Цей продукт перекристалізовували з етил ацетату/гексану, одержуючи 4,7 г чистого фенілметилового ефіру 2R -гідрокси -3 - [[(4 нитрофеніл) сульфоніл] (2 -метилпропіл) аміно] 1S - (фенілметил) пропілкарбамшовой кислоти, m/e=556 (M+H) Розділ Б Одержування 2R -гідрокси -3 - [[(4 амінофеніл) сульфоніл] (2 -метилпропіл) аміно] 1S - (фенілметил) пропіламіну Розчин, що містить 3,0г (5,4 моля) фенілметилового ефіру 2R -гідрокси -3 - [[(4 нитрофеніл) сульфоніл] (2 -метилпропіл) аміно] 1S - (фенілметил) пропілкарбамшової кислоти в 20мл етилацетату, гідрували впродовж 3,5 годин з використанням в якості каталізатору 1,5г 10% ного паладію на вугіллі при надлишковому тиску водня 35фунтів/кв дюйм Каталізатор вилучали фільтрацією і розчин концентрували, одержуючи 2,05г необхідного 2R -гідрокси -3 - [[(4 -амінофеніл) сульфоніл] (2 -метилпропіл) аміно] -1S (фенілметил) пропіламіну, m/e=392 (M+H) Приклад 22 56129 H2N H2N О Одержування 2R -гідрокси -3 - [[(З амінофеніл) сульфоніл] (2 -метилпропіл) аміно] 1S -(фенілметил) пропіламіну Розділ А Одержування феніл метилового ефіру 2R -гідрокси -3 - [[(3 -нитрофеніл) сульфоніл] (2 -метилпропіл) аміно] -1S - (фенілметил) пропілкарбамшової кислоти До розчину, що містить 1,1г (3,0 моля) N - [З (S) -бензилоксикарбоніламшо -2 (R) -гідрокси -4 феніл] -N -ізобутиламшу в 15мл безводного метиленхлориду, додавали 1,3мл (0,94г, 9,3 моля) триетиламшу Розчин охолоджували до 0°С і додавали 0,67г (3,0 моля) З нітробензолсульфонілхлориду, змішували впродовж ЗОхв при 0°С, а після цього впродовж 1 години при кімнатній температурі Додавали етилацетат, промивали 5% -ною лимонною кислотою насиченим бікарбонатом натрію, соляним розчином, сушили і концентрували, одержуючи 1,74г неочищеного продукту Цей продукт перекристалізовували з етил ацетату/гексану, одержуючи 1,40г чистого фенілметилового ефіру 2R -гідрокси -3 - [[(3 нітрофеніл) сульфоніл] (2 -метилпропіл) аміно] -1S (фенілметил) пропілкарбамшової кислоти, m/e=562 (M+Li) Розділ Б Одержування 2R -гідрокси -3 - [[(3 амінофеніл) сульфоніл] (2 -метилпропіл) аміно] 1S - (фенілметил) пропіламіну Розчин, що містить 1,33г (2,5 моля) фенілметилового ефіру 2R -гідрокси -3 - [[(3 нитрофеніл) сульфоніл] (2 -метилпропіл) аміно] 1S - (фенілметил) пропілкарбамшової кислоти в 40мл суміші метанол тетрапдрофуран (11), гідрували впродовж 1,5 годин з використанням в якості каталізатору 0,70г 10% -ного паладію на вугіллі при надлишковому тиску водня 40фунтов/кв дюйм Каталізатор вилучали фільтрацією і розчин концентрували, одержуючи 0,87г необхідного 2R -гідрокси -3 - [[(3 -амінофеніл) сульфоніл] (2 -метилпропіл) аміно] -1S (фенілметил) пропіламіну Приклад 23 Одержування 2R -гідрокси -3 - [[(2 3 дипдробензофуран -5 -іл) сульфоніл] (2 метилпропіл) аміно] -1S (фенілметил) пропіламіну Розділ А Одержування 5 (2,3 дипдробензофураніл) сульфонілхлориду До розчину, що містить 3,35г безводного N, N диметилформаміду, при 0°С в атмосфері азоту додавали 6,18г сульфурилхлориду, після чого утворювався твердий продукт Після змішування впродовж 15хв додавали 4,69г 2,3 дипдробензофурану і суміш витримували при 100°С впродовж 2 годин Реакційну суміш охолоджували, зливали на крижану воду, екстрагували метиленхлоридом, сушили над сульфатом магнію, фільтрували та концентрували неочищений продукт Цей продукт перекристалізовували з етилацетату, одержуючи 2,45г 5 (2,3 -дипдробензофураніл) сульфонілхлориду Розділ Б Одержування фенілметилового ефіру 2R -гідрокси -3 - [[(2,3 -дипдробензофуран -5 -іл) сульфоніл] (2 -метилпропіл) аміно] -1S (фенілметил) пропілкарбамшової кислоти До розчину, що містить 1,11г (3,0 моля) N - [З (S) -бензилоксикарбоніламшо -2R -гідрокси -4 феніл] -N -изобутиламшу в 20мл безводного метиленхлориду, додавали 1,3мл (0,94г, 9,3 моля) триетиламшу Розчин охолоджували до 0°С і додавали 0,66г 5 - (2,3 -дипдробензофураніл) сульфонілхлориду, змішували впродовж 15хв при 0°С, а після цього впродовж 2 годин при кімнатній температурі Додавали етилацетат, промивали 5% -ною лимонною кислотою, насиченим бікарбонатом натрію, соляним розчином, сушили і концентрували, одержуючи 1,62г неочищенного продукту Цей продукт перекристалізовували з диетилового ефіру, одержуючи 1,17г чистого фенілметилового ефіру 2R -гідрокси -3 - [[(2,3 дипдробензофуран -5 -іл) сульфоніл] (2 метилпропіл) аміно] -1S -(фенілметил) пропілкарбамшової кислоти Розділ В Одержування 2R -гідрокси -3 - [[(2,3 дипдробензофуран -5 -іл) сульфоніл] (2 метилпропіл) аміно] -1S (фенілметил) пропіламіну Розчин, що містить 2,86г фенілметилового ефіру 2R -гідрокси -3 - [[(2,3 -дипдробензофуран -5 -іл) сульфоніл] (2 -метилпропіл) аміно] -1S (фенілметил) пропілкарбамшової кислоти в ЗОмл тетрапдрофурану, гідрували впродовж 16 годин з використанням 0,99г 10% -ного паладію на вугіллі при надлишковому тиску водня 50фунтів/кв дюйм Каталізатор вилучали фільтрацією і фільтрат 54 53 56129 концентрували, одержуючи 1,99г необхідного 2R замість метилметакрилату можна використати гідрокси -3 - [[(2,3 -дипдробензофуран -5 -іл) метил -3 -бром -2 -метилпропюнат сульфоніл] (2 -метилпропіл) аміно] -1S Розділ Б Розчин метил -2 - (R, S) -метил -4 (фенілметил) пропіламшу тіа -6 -фенілгексаноата (4,00г, 16,8 моля) в ЮОмл Приклад 24 дихлорметану змішували при кімнатній температурі і обробляли порціями впродовж приблизно 40хв мета -хлорпероксибензойною кислотою (7,38г, 39,2 моля) Розчин змішували при кімнатній температурі впродовж 16 годин, а після цього фільтрували і фільтрат промивали насиченим водним бікарбонатом натрію, 1н гідроксидом натрію, насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію, фільтрували і концентрували, одержуючи 4,50г (99%) необхідного сульфону Неочищений сульфон розчиняли в 100 мл тетрапдрофурану і Одержування N -[(1 1-диметилетокси обробляли розчином гідроксиду ЛІТІЮ (1,04г, 24,5 карбонілі-N [2-метилпропіл]-33 -[N1 моля) в 40мл води Розчин змішували при (фенілметоксикарбоніл) аміно] -2R -гідрокси -4 кімнатній температурі впродовж 2хв і після цього фенілбутиламшу концентрували у вакуумі Після цього залишок До розчину, що містить 7,51г (20,3 моля) N підкислювали 1н водним, бісульфатом калію до [3S - [(фенілметоксикарбоніл) аміно] -2R -гідрокси рН=1, після чого тричі екстрагували етилацетатом 4 -фенілбутил] -2 -метил пропіламшув 67мл Об'єднаний етилацетатний розчин промивали безводного тетрапдрофурану додавали 2,25г (22,3 насиченим водним розчином хлориду натрію, моля) триетиламшу Після охолоджування до 0°С сушили над безводним сульфатом магнію, додавали 4,4г (20,3 моля) ди -третфільтрували і концентрували, одержуючи білу бутилдікарбонатуї змішування прожували при тверду речовину Тверду речовину розчиняли в кімнатній температурі впродовж 21 годин Летючі киплячому етилацетаті/гексані і давали вистоятися компоненти вилучали у вакуумі, додавали без змішування, після чого утворювалися білі етилацетат, після цього промивали 5% -ною гольчаті кристали, що виділяли фільтрацією і лимонною кислотою, насиченим бікарбонатом сушили на повітрі, одержуючи 3,38 г (79%) 2 - (R, натрію, соляним розчином, сушили над сульфатом S) -метил -3 - р -фенетилсульфоніл) пропюнової магнію, фільтрували і концентрували, одержуючи кислоти, t m 91-93°C 9,6г неочищеного продукту Після хроматографії на силікагелі з використанням суміші 30% Розділ В Розчин, що містить 2 - (R, S) -метил етил ацетату/гексан одержували 8,2г чистого N З - (р -фенетилсульфоніл) пропюнову кислоту [[3S - (фенілметилкарбамоїл) aMmo]-2R-riflpoKCH-4(166,1мг, 0,65 моля), N -пдроксібензотриазол феніл]-1 -[(2 -метилпропіл) аміно -2 - (1,1 (ГОБТ) (146,9мг, 0,97 моля) і пдрохлорид 1 - (3 диметилетоксил) карбоніл] бутану, мас -спектр диметиламшопропіл) -3 -етилкарбодмміда (ЕДК) m/e=477 (M+Li) (145,8мг, 0,75 моля) в 4мл безводного диметилформаміду (ДМФ), охолоджували до 0°С і Приклад 25 змішували в атмосфері азоту впродовж 0,5 годин Після ЦЬОГО цей розчин обробляли необхідною амінозахисною групою або'проміжним продуктом у вигляді ізостеру сульфонаміду і змішували при кімнатній, температурі впродовж 16 годин Розчин виливали в ЗОмл 60% -ного насиченого водного О 0 розчину бікарбонату натрію Після цього водний Одержування N -пдроксібензотриазолового розчин зливали з органічного залишку Органічний ефіру 2 -метил -3 - [(2 -фенілетил) сульфоніл] залишок розчиняли в дихлорметані і промивали пропюнової кислоти 10% -ною водною лимонною кислотою, соляним розчином, сушили над безводним сульфатом Розділ А Розчин, що містить метилметакрилат магнію, фільтрували і концентрували Може бути (7,25г, 72,5 моля) і фенетилмеркаптан (10,0г, 72,5 використана швидка хроматографія суміші на моля) в 100мл метанолу, охолоджували в силікагелі з елюїрованням гексаном етилацетатом крижаній бані і обробляли метоксидом натрію (1 1), що дозволяє поділити діастереоміри (ЮОмг, 1,85 моля) Розчин змішували в атмосфері азоту впродовж 3 годин і після цього Приклад 26 концентрували у вакуумі, одержуючи масло, що розчиняли в простому ефірі і промивали 1 н, водним бісульфатом калію, насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію, фільтрували і концентрували, одержуючи 16,83г (97,5%) метил -2 - (R, S) -метил -4 -тиа -6 -фенілгексаноата у вигляді масла О О СН 3 Значення Rr=0,41 при аналізі за допомогою ТСХ Одержування N -пдроксібензотриазолового на S1O2 при елюїруванні гексаном етилацетатом ефіру 2 -метил -3 - (метилсульфоніл) пропюнової (20 1, за об'ємом) В альтернативному варіанті кислоти 55 56129 Розділ А Розчин метил -2 - (бромметил) акрилату (26,4г, 0,148 моля) в ЮОмл метанолу обробляли за порціям метансульфинатом натрію (15,1г, 0,148 моля) впродовж Юхв при кімнатній температурі Після ЦЬОГО розчин змішували при кімнатній температурі впродовж 1,25 годин і FbC розчин концентрували у вакуумі Залишок розчиняли у воді і 4 разу екстрагували етилацетатом Об'єднаний етилацетатний розчин промивали насиченим хлоридом натрію, сушили над безводним сульфатом магнію, фільтрували і концентрували, одержуючи 20,7 г білої твердої Одержування N - [2R -гідрокси -3 - [[(1 1 речовини, що розчиняли в киплячому диметилетокси) карбоніл] (2 -метилпропіл) аміно] ацетоні/метил -трет-бутиловом ефірі і давали 1S - (фенілметил) nponin-3S - [2-R S-метил-З вистояться без змішування, після чого (метилсульфоніл)] пропанаміду утворювалися кристали чистого метил -2 Розділ А Отриманий в прикладі 24 N - [(1,1 (метилсульфонілметил) акрилату (18,0г, 68%) t m диметилетокси) карбоніл] -N - [2 -метилпропіл] -3S 65-68°С - [N1 - (фенілметоксикарбоніл) аміно] -2R -гідрокси Розділ Б Розчин метил -2 -4 -фенілбутиламш, (метилсульфонілметил) акрилату (970мг, 5,44 моля) в 15мл тетрапдрофурану обробляли розчином гідроксиду литія (270мг, 6,4 моля) в 7мл води Розчин змішували при кімнатній температурі впродовж 5хв і після цього підкислювали 1 н водним бісульфатом калію до рН=15 розчин тричі екстрагували етилацетатом Об'єднаний етилацетатний розчин сушили над безводним сульфатом магнію, фільтрували і концентрували, одержуючи 793мг (89%) 2 (метилсульфонілметил) акрилової кислоти, t m 147149°С Розчинений в етанолі, гідрували при тиску Розділ В Розчин 2 - (метилсульфонілметил) водня 45фунтів/кв дюйм в присутності 5% -ного акрилової кислоти (700мг, 4,26 моля) в 20мл Pd/C в якості каталізатору, одержуючи N - [(1,1 метанолу завантажували в атмосфері азоту в диметилетокси) карбоніл] -N - [2 -метилпропіл] -3S судину Фішера -портера разом з 10% -ним - [N 1 -аміно] -2R -гідрокси -4 -фенілбутиламш паладієм на вугіллі як каталізатор Реакційну ВІДПОВІДНО ДО стандартних способів фільтрації судину закривали і продували п'ять раз азотом, а каталізатору (5% -ний Pd/C) і після випарювання після цього п'ять раз воднем Надлишковий тиск розчинника фільтрату при зниженому тиску з підтримували впродовж 16 годин на рівні використанням роторного випарика одержували 50фунтів/кв дюйм, а після цього водень амін за формулою замінювали на азот і розчин фільтрували через подушку з целіту для вилучення каталізатору і фільтрат концентрували у вакуумі, одержуючи 682мг (96%) 2 - (R, S) -метил -3 - (метилсульфоніл) пропюнової кислоти Розділ Г РОЗЧИН, ЩО МІСТИТЬ 2 - (R, S) -метил З - (метилсульфоніл) пропіонову кислоту (263,5мг, 1,585 моля), N -пдроксібензотриазол (ГОБТ) (322,2мг, 2,13 моля) і пдрохлорид 1 - (3 диметиламшопропіл) -3 -етилкарбодмміду (ЕДК) (339,1 мг, 1,74 моля) в 4 мл безводного диметилформаміду (ДМФ), охолоджували до 0°С і змішували в атмосфері азоту впродовж 0,5 години Після ЦЬОГО цей розчин обробляли необхідною амінозахисню групою або проміжним продуктом у вигляді ізостеру сульфонаміду і змішували при кімнатній температурі впродовж 16 годин Розчин виливали в 60мл 60% -ного насиченого водного розчину бікарбонату натрію Після цього водний розчин зливали з органічного залишку Органічний залишок розчиняли в дихлорметані і промивали 10% -ною водною лимонною кислотою, соляним розчином, сушили над безводним сульфатом магнію, фільтрували і концентрували, одержуючи необхідний продукт Приклад 26А Розділ Б Амін, отриманий в розділі А, піддавали взаємодії в ДМФ з N пдроксибензотріазоловим ефіром 2 -метил -3 (метилсульфоніл) пропюнової кислоти, отриманим в прикладі 26, при або приблизно при кімнатній температурі Розчин промивали розчином бікарбонату натрію і екстрагували етилацетатом Этилацетатний екстракт промивали розчином лимонної кислоти, соляним розчином і сушили над сульфатом натрію Осушувач відфільтровували та органічний розчинник вилучали, одержуючи 57 56129 продую" за формулою Одержування N - [2R -гідрокси -3 - [(2 метилпропіл) [(1,3 -бензодюксол -5 -іл) сульфоніл] аміно] -1S - (фенілметил) пропіл] -3S - [2 -R, S метил -3 - (метилсульфоніл)] пропанаміду N - [2Rпдрокси-3 - [[(1,1 -диметилетокси) карбоніл] (2метилпропіл) aMiHo]-1S -(фенілметил) пропіл] -3S [2 -R, S -метил -3 - (метилсульфоніл)] пропанамід (приклад 26А) розчиняли в дюксані/НСІ і суміш змішували впродовж приблизно 2 годин при кімнатній температурі Розчинник вилучали і залишок сушили у вакуумі, одержуючи амін за формулою Залишок змішували в етилацетаті, додавали 1,3 -бензодюксол -5 -ілсульфонілхлорид, а після цього триетиламш, і суміш змішували приблизно при кімнатній температурі Реакційну суміш розбавляли етилацетатом, промивали насиченим бікарбонатом натрію та соляним розчином, сушили (MgSO4) і концентрували, одержуючи необхідний продукт При необхідності додаткового очищування і/або розподілу ізомерів (наприклад, див нижче) залишок хроматографували Приклад 27 Одержування сульфонових шпбиторів з L - (+) -S -ацетил -(3 -меркаптоізомасляної кислоти Розділ А До круглодоної колби завантажували необхідні амінозахисні сполуки або проміжний продукт, який був ізостером сульфонаміду (2,575 моля), і піддавали поєднанню з L - (+) -S -ацетил Р -меркаптомасляною кислотою в присутності пдрохлориду 1 - (3 -диметиламшопропіл) -3 етилкарбодиіміду (ЕДК) (339,1мг, 1,74 моля) в Юмл СН2СІ2 і давали змішуватись при кімнатній температурі впродовж 16 годин Розчин концентрували у вакуумі і залишок розчиняли в етилацетаті, промивали 1н KHSO4, насиченим водним розчином Nah-ІСОз, соляним розчином, сушили над безводним MgSO4, фільтрували і концентрували, одержуючи масло, що може бути очищене за допомогою радіальної хроматографії на S1O2 при елюїруванні етилацетатом з отриманням чистого продукту Розділ Б Розчин продукту, отриманого в розділі А ((0,85 моля), в Юмл метанолу обробляли безводним аміаком впродовж приблизно 1хв при 0°С Розчин змішували при цій темпеартурі впродовж 16 годин і після цього концентрували у вакуумі, одержуючи необхідний продукт, що може використовуватись безпосередньо на наступній стадії без додаткового очищування Розділ В Розчин продукту, отриманого в розділі Б ((0,841 моля), в Юмл безводного толуолу в атмосфері азоту швидко послідовно обробляли 1,8 -діазабицикло [5,4,0] ундек -7 -еном (ДБУ) (128,1мг, 0,841 моля) і йодметаном (119,0мг, 0,841 моля) Після витримування впродовж 0,5 годин при кімнатній температурі реакційну суміш розчинювали етилацетатом, промивали 1н KHSO4, насиченим водним розчином Nah-ІСОз, соляним розчином, сушили над безводним MgSO4, фільтрували та концентрували у вакуумі, одержуючи необхідний продукт, що може бути використаний безпосередньо на наступній стадії Розділ Г РОЗЧИН продукту, отриманого в розділі В ((0,73 моля), і перборату натрію (500мг, 3,25 моля) в ЗОмл крижаної оцтової кислоти нагрівали до 55°С впродовж 16 годин Розчин концентрували у вакуумі і після цього залишок розчиняли в етилацетаті, промивали водою, насиченим водним розчином Nah-ІСОз, соляним розчином, сушили над безводним MgSO4, фільтрували та концентрували, одержуючи необхідний продукт Загальна методика поєднання сульфонільних сполук з сульфонамідами Суміш, що містить сульфонілалканоільні сполуки (приблизно 1 моль), N пдроксібензотріазол (1,5 моля) і пдрохлорид 1 - (З 59 56129 60 -диметиламшопропіл) -3 -етилкарбодмміда (ЕДК) зниженому тиску, одержуючи 2,18г неочищеного (1,2 моля), розчиняли в придатному розчинникові, продукту, що перекристалізовували з такому, як ДМФ, і давали прореагувати впродовж етил ацетату/гексану, одержуючи 1,44г 2 (S) -метил приблизно ЗОхв при 0°С Необхідні амшозахисні -З (метилсульфоніл) пропюнової сполуки або проміжний продукт, який є ізостером кислотну.вигляді кристалів білого кольору сульфонаміду (1,05 моля), розчиняли в ДМФ, Приклад 29 додавали до вищезазначеної суміші і змішували при кімнатній температурі впродовж періоду, достатнього для завершення реакції Після цього розчин зливали на насичений водний розчин ЫаНСОз і екстрагували, наприклад, етилацетатом Экстракти промивали, сушили, фільтрували і концентрували Продукт, що утворився після цього кристалізували з придатного розчинника або суміші розчинників, таких, як гексан і етилацетат, з осн 3 отриманням кінцевого продукту Приклад 28 Одержування [1S - [1R* (R*) 2S*]] -N - [2R0 S' о о сн Одержування 2 (S) -метил -З (метилсульфоніл) пропюнової кислоти Розділ А Розчин, що містить 10г третбутилового ефіру D - (-) -S -бензоїл -|3 меркаптоізомасляної кислоти в 20мл метанолу, барботували газоподібним аміаком при 0°С Після цього реакційній суміші давали нагрітися до кімнатної температури, змішували впродовж ночі та концентрували при зниженому тиску Утворену суміш твердого продукту (бензамід) і рідини фільтрували, одержуючи 5,21г масла, яке після цього Продукт був ідентифікований як третбутиловий ефір 2 (S) -метил -З меркаптопропюнової кислоти Розділ Б До розчину, що містить 5,21г третбутилового ефіру 2 (S) -метил -З меркаптопропюнової кислоти в 75мл толуолу, при 0°С додавали 4,50г 1,8 -діазабіцикло [5,4,0] ундек 7 -єну і 1,94мл метилйодиду Після змішування при кімнатній температурі впродовж 2,5 годин вилучали летючі компоненти, додавали етилацетат, промивали розбавленою соляною кислотою, водою, соляним розчином, сушили і концентрували, одержуючи 2,82г світлого масла, що ідентифікувалось як трет-бутиловий ефір 2 (S) -метил -3 - (тюметил) пропюнової кислоти Розділ В До розчину, що містить 2,82г третбутилового ефіру 2 (S) -метил -3 -(тюметил) пропюнової кислоти в 50мл оцтової кислоти, додавали 5,58г пербората натрію і суміш нагрівали до 55°С впродовж 17 годин Реакційну суміш зливали на воду, екстрагували метиленхлоридом, промивали водним бікарбонатом натрію, сушили і концентрували, одержуючи 2,68г трет-бутилового ефіру 2 (S) -метил -3 - (метилсульфоніл) пропюнової кислоти у вигляді білої твердої речовини Розділ Г ДО 2,68г трет-бутилового ефіру 2 (S) -метил -3 - (метилсульфоніл) пропюнової кислоти додавали 20мл 4н Соляної кислоти/діоксану і суміш змішували при кімнатній температурі впродовж 19 годин Розчинник вилучали при пдрокси-3 Г(2 -метилпропіл) [(3 4 диметоксифенілсульфоніл) аміно] -1 (феніл метил) пропіл] -2 -метил -З (метилсульфоніл)] пропанаміду Розділ А Розчин, що містить N бензилоксикарбоніл -З (S) -аміно -1,2 - (S) -епокси 4 -фенілбутан (50,0г, 0,168 моля) і ізобутиламш (246г, 3,24 моля, 20екв) в 650мл ізопропілового спирту, кип'ятили зі зворотним холодильником впродовж 1,25 годин Розчин охолоджували до кімнатної температури, концентрували у вакуумі і після цього виливали при змішуванні в 1л гексану, при цьому продукт кристалізувався з розчину Продукт виділяли фільтрацією і сушили на повітрі, одержуючи 57,56г (92%) N - [З (S) бензилоксикарбоніламшо -2 (R) -гідрокси -4 феніл] -N -ізобутиламшу, t m 108,0-109,5°С, MH+m/z=371, Розділ Б Розчин N [З (S) бензилоксикарбоніламшо -2 (R) -гідрокси -4 феніл] -N -ізобутиламшу (1,5356г, 4,14 моля) і триетиламшу (522мг, 5,17 моля) в 15мл дихлорметану обробляли 3,4 диметоксибензолсульфонілхлор (1,0087г, 4,26 моля) при кімнатній температурі впродовж 14 годин Розчинник вилучали у вакуумі і залишок розчиняли в етилацетаті і після цього промивали 1н KHSO4, насиченим водним ЫаНСОз, соляним розчином, сушили над безводним MgSO4, фільтрували і концентрували, одержуючи 2,147г (90,5%) білої твердої речовини, t m 124-127°C, МСВР (FAB), M+Li розраховане для C30H38N2O7S+L1 577,2560, виявлене 577,2604, Розділ В Розчин карбамшової кислоти, продукту, отриманого в розділі Б ((513мг, 0,90 моля), в ЗОмл метанолу змішували впродовж 15 годин при кімантній температурі з 20мг палладієвої черні як каталізатор і 10 мл мурав'шої кислоти Каталізатор вилучали фільтрацією через діатомову землю, фільтрат концентрували у вакуумі і залишок розчиняли в етилацетаті Этилацетатний розчин промивали насиченим водним Nah-ІСОз, соляним розчином і сушили над безводним MgSO4, фільтрували та концентрували у вакуумі, одержуючи 386мг білого твердого продукту (вихід 98%), t m 123-130°С, МС (FAB), M+Li =443, що безпосередньо використали на наступній-стадм без додаткового очищування Розділ Г Суміш, що містить 2 (S) -метил -3
ДивитисяДодаткова інформація
Назва патенту англійськоюSulfonylalkanoylamino hydroxyethylamine sulfonamides, a pharmacological composition containing them, a process for retroviral proteases inhibiting and preventing retroviral replication, particularly in vitro, and also a method for retroviral infection treatment, particularly aids
Автори англійськоюSikorski James A., Devadas Balekurdu
Назва патенту російськоюСульфонилалканоиламиногидроксиэтиламиносульфонамиды, фармакологическая композиция, содержащая их, способ ингибирования протеаз ретровирусов и предотвращения репликации ретровируса, в частности, in vitro, а также способ лечения ретровирусной инфекции, в частности спида
Автори російськоюСикорски Джеймс А., Девадас Балекудру
МПК / Мітки
МПК: C07D 235/30, C07D 339/00, C07D 215/36, A61K 31/39, A61K 31/425, C07D 307/79, C07D 319/00, A61K 31/415, A61K 31/472, A61K 31/36, A61K 31/385, A61K 31/42, C07C 311/41, C07D 263/54, A61K 31/423, C07D 303/00, A61K 31/335, A61K 31/47, A61P 31/12, C07C 317/44, C07C 211/18, C07D 277/62, C07D 235/06, C07D 317/62, A61K 31/34, C07C 309/00, C07D 249/18, A61K 31/4184, C07D 235/32, A61K 31/428, C07C 271/16, C07D 327/00, C07C 311/29, A61K 31/343, C07D 277/82, A61K 31/357, C07D 217/02
Мітки: містить, ретровірусів, vitro, сульфонілалканоїламіногідроксіетиламіносульфонаміди, зокрема, ретровірусу, композиція, протеаз, запобігання, також, спосіб, фармакологічна, інгібування, реплікації
Код посилання
<a href="https://ua.patents.su/55-56129-sulfonilalkanolaminogidroksietilaminosulfonamidi-farmakologichna-kompoziciya-shho-kh-mistit-sposib-ingibuvannya-proteaz-retrovirusiv-ta-zapobigannya-replikaci-retrovirusu-zokrema-i.html" target="_blank" rel="follow" title="База патентів України">Сульфонілалканоїламіногідроксіетиламіносульфонаміди, фармакологічна композиція, що їх містить, спосіб інгібування протеаз ретровірусів та запобігання реплікації ретровірусу, зокрема, in vitro, а також спосіб лі</a>
Попередній патент: Композиція, що містить селективні інгібітори вірусних або бактеріальних нейромінідаз та способи лікування
Випадковий патент: Пристрій дистанційного керування електролампами