Карбоніламінопохідні як інгібітори гістондеацетилази
Номер патенту: 78033
Опубліковано: 15.02.2007
Автори: Бакс Лео Якобус Йозеф, ван Брандт Свен Францискус Анна, Вердонк Марк Густааф Селін, ван Емелен Крістоф
Формула / Реферат
1. Сполука формули (І)
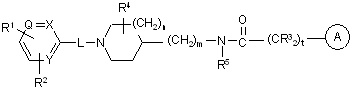 ,
,
її N-оксидні форми, фармацевтично прийнятні кислотно адитивні солі та їх стереоізомерні форми, де
n є 0, 1, 2 або 3, і коли n є 0, мається на увазі безпосередній зв'язок;
m є 0 або 1, і коли m є 0, мається на увазі безпосередній зв'язок;
t є 0, 1, 2, 3 або 4, і коли t є 0, мається на увазі безпосередній зв'язок;
кожен Q є азотом або ![]() ;
;
кожен Х є азотом або ![]() ;
;
кожен Y є азотом або ![]() ;
;
R1 є -C(O)NR8R9, -NHC(O)R10, -С(O)-С1-6алкіліденSR10, -NR11C(O)N(OH)CR10, -NR11C(O)C1-6алкіліденSR10, -NR11C(O)C=N(OH)R10 або інша Zn-хелатуюча група, де R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, C1-6алкіл-, гідроксіC1-6алкіл-, аміноC1-6алкіл- і аміноарилрадикалів; R10 є воднем, C1-6алкіл-, С1-6алкілкарбоніл-, арилC1-6алкіл-, C1-6алкілпіразиніл-, піридиноніл-, піролідиноніл- або метилімідазолілрадикалом;
R11 є воднем або C1-6алкілом;
R2 є воднем, галогенрадикалом, гідроксилом, аміногрупою, нітрогрупою, C1-6алкіл-, C1-6алкокси-, трифторметилрадикалом, ді(C1-6алкіл)аміногрупою, гідроксаміногрупою або нафталінсульфонілпіразинілрадикалом;
-L- є безпосереднім зв'язком або двовалентним радикалом, вибраним з C1-6алкіліден-, C1-6алкіліденоксирадикалів, аміногрупи, карбонільної групи та амінокарбонільної групи;
кожен R3 незалежно від інших являє собою атом водню, і один атом водню може бути замінений на замісник, вибраний з арилрадикалів;
R4 є воднем, гідроксилом, аміногрупою, гідроксіC1-6алкіл-, C1-6алкіл-, C1-6алкокси-, арилC1-6алкіл-, амінокарбоніл-, гідроксикарбоніл-, аміноC1-6алкіл-, амінокарбонілC1-6алкіл-, гідроксикарбонілC1-6алкіл-, гідроксамінокарбоніл-, C1-6алкоксикарбоніл-, C1-6алкіламіноC1-6алкіл- або ді(C1-6алкіл)аміноC1-6алкілрадикалом;
R5 є воднем, C1-6алкіл-, C3-10циклоалкіл-, гідроксіC1-6алкіл-, C1-6алкоксіC1-6алкіл-, ді(C1-6алкіл)аміноC1-6алкіл- або арилрадикалом;
![]() є радикалом, вибраним з
є радикалом, вибраним з
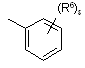
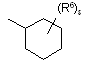
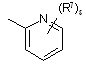
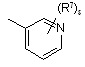
(a-1)
(a-2)
(a-3)
(a-4)
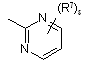
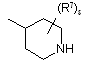
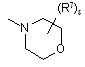
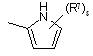
(a-5)
(a-6)
(a-7)
(a-8)
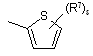
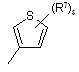
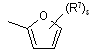
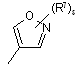
(a-9)
(a-10)
(a-11)
(a-12)
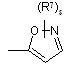
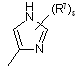
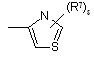

(a-13)
(a-14)
(a-15)
(a-16)

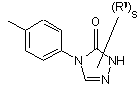
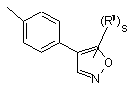
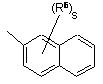
(a-17)
(a-18)
(a-19)
(a-20)
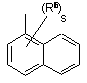
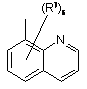


(a-21)
(a-22)
(a-23)
(a-24)

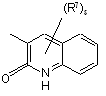
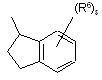
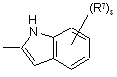
(a-25)
(a-26)
(a-27)
(a-28)
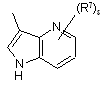
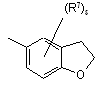
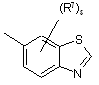
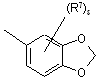
(a-29)
(a-30)
(a-31)
(a-32)

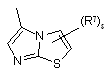

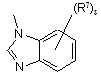
(a-33)
(a-34)
(a-35)
(a-36)
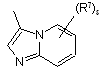
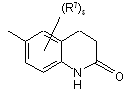
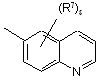
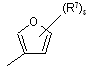
(a-37)
(a-38)
(a-39)
(a-40)
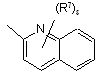
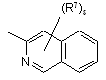
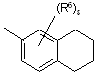
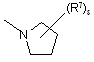
(a-41)
(a-42)
(a-43)
(a-44)
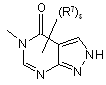

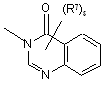
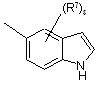
(a-45)
(a-46)
(a-47)
(a-48)
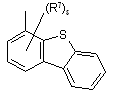
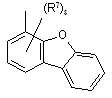
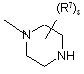 ,
,
(a-49)
(a-50)
(a-51)
де кожен s незалежно від інших є 0, 1, 2, 3, 4 або 5;
кожен R6 та R7 незалежно один від одного є радикалом, вибраним з водню; галогенрадикалів; гідроксилу; аміногрупи; нітрогрупи; тригалогенС1-6алкіл-; тригалогенС1-6алкокси-; С1-6алкілрадикалів; С1-6алкілрадикалів, заміщених арил- та С3-10циклоалкілрадикалами; С1-6алкокси-; С1-6алкоксіС1-6алкокси-; С1-6алкілкарбоніл-; С1-6алкоксикарбоніл-; С1-6алкілсульфоніл-; ціаноС1-6алкіл-; гідроксіС1-6алкіл-; гідроксіС1-6алкоксирадикалів; гідроксіС1-6алкіламіногруп; аміноС1-6алкокси-; ді(С1-6алкіл)амінокарбонілрадикалів; ди(гідроксіС1-6алкіл)аміногруп; (арил)(С1-6алкіл)аміногруп; ді(С1-6алкіл)аміноС1-6алкоксирадикалів; ді(С1-6алкіл)аміноС1-6алкіламіногруп; ді(С1-6алкіл)аміноС1-6алкіламіноС1-6алкіл-; арилсульфонілрадикалів; арилсульфоніламіногруп; арилокси-; арилоксіС1-6алкіл-; арилС2-6алкеніліденрадикалів; ді(С1-6алкіл)аміногруп; ді(С1-6алкіл)аміноС1-6алкілрадикалів; ді(С1-6алкіл)аміно(С1-6алкіл)аміногруп; ді(С1-6алкіл)аміно(С1-6алкіл)аміноС1-6алкілрадикалів; ді(С1-6алкіл)аміноС1-6алкіл(С1-6алкіл)аміногруп; ді(С1-6алкіл)аміноС1-6алкіл(С1-6алкіл)аміноС1-6алкілрадикалів; аміносульфоніламіно(С1-6алкіл)аміногруп; аміносульфоніламіно(С1-6алкіл)аміноС1-6алкілрадикалів; ді(С1-6алкіл)аміносульфоніламіно(С1-6алкіл)аміногруп; ді(С1-6алкіл)аміносульфоніламіно(С1-6алкіл)аміноС1-6алкілрадикалів; ціаногрупи; тіофенілрадикала; тіофенілрадикалів, заміщених ді(С1-6алкіл)аміноС1-6алкіл(С1-6алкіл)аміноС1-6алкіл-, ді(С1-6алкіл)аміноС1-6алкіл-, С1-6алкілпіперазинілС1-6алкіл-, гідроксіС1-6алкілпіперазинілС1-6алкіл-, гідроксіС1-6алкоксіС1-6алкілпіперазинілС1-6алкіл-, ді(С1-6алкіл)аміносульфонілпіперазинілС1-6алкіл-, С1-6алкоксипіперидиніл-,С1-6алкоксипіперидинілС1-6алкіл-, морфолінілС1-6алкіл-, гідроксіС1-6алкіл(С1-6алкіл)аміноС1-6алкіл- або ди(гідроксіС1-6алкіл)аміноС1-6алкілрадикалами; фуранілрадикала; фуранілрадикалів, заміщених гідроксіС1-6алкілрадикалами; бензофураніл-; імідазоліл-; оксазолілрадикалів; оксазолілрадикалів, заміщених арил- та С1-6алкілрадикалами; С1-6алкілтриазоліл-; тетразоліл-; піролідиніл-; піроліл-; піперидинілС1-6алкокси-; морфолініл-; С1-6алкілморфолініл-; морфолінілС1-6алкокси-; морфолінілС1-6алкілрадикалів; морфолінілС1-6алкіламіногруп; морфолінілС1-6алкіламіноС1-6алкіл-; піперазиніл-; С1-6алкілпіперазиніл-; С1-6алкілпіперазинілС1-6алкокси-; піперазинілС1-6алкіл-; нафталінсульфонілпіперазиніл-; нафталінсульфонілпіперидиніл-; нафталінсульфоніл-; С1-6алкілпіперазинілС1-6алкілрадикалів; С1-6алкілпіперазинілС1-6алкіламіногруп; С1-6алкілпіперазинілС1-6алкіламіноС1-6алкіл-; С1-6алкілпіперазинілсульфоніл-; аміносульфонілпіперазинілС1-6алкокси-; аміносульфонілпіперазиніл-; аміносульфонілпіперазинілС1-6алкіл-; ді(С1-6алкіл)аміносульфонілпіперазиніл-; ді(С1-6алкіл)аміносульфонілпіперазинілС1-6алкіл-; гідроксіС1-6алкілпіперазиніл-; гідроксіС1-6алкілпіперазинілС1-6алкіл-; С1-6алкоксипіперидиніл-; С1-6алкоксипіперидинілС1-6алкілрадикалів; піперидиніламіноС1-6алкіламіногруп; піперидиніламіноС1-6алкіламіноС1-6алкілрадикалів; (С1-6алкілпіперидиніл)(гідроксіС1-6алкіл)аміноС1-6алкіламіногруп; (С1-6алкілпіперидиніл)(гідроксіС1-6алкіл)аміноС1-6алкіламіноС1-6алкіл-; гідроксіС1-6алкоксіС1-6алкілпіперазиніл-; гідроксіС1-6алкоксіС1-6алкілпіперазинілС1-6алкілрадикалів; (гідроксіС1-6алкіл)(С1-6алкіл)аміногруп; (гідроксіС1-6алкіл)(С1-6алкіл)аміноС1-6алкіл-; гідроксіС1-6алкіламіноС1-6алкіл-; ді(гідроксіС1-6алкіл)аміноС1-6алкіл-; піролідинілС1-6алкіл-; піролідинілС1-6алкокси-; піразоліл-; тіопіразолілрадикалів; піразолілрадикалів, заміщених двома замісниками, вибраними з С1-6алкіл- і тригалогенС1-6алкілрадикалів; піридинілрадикала; піридинілрадикалів, заміщених С1-6алкокси-, арокси- або арилрадикалами; піримідиніл-; тетрагідропіримідинілпіперазиніл-; тетрагідропіримідинілпіперазинілС1-6алкіл-; хінолініл-; індоліл-; фенілрадикалів; фенілрадикалів, заміщених одним, двома або трьома замісниками, незалежно вибраними з галогенрадикалів, аміногрупи, нітрогрупи, С1-6алкіл-, С1-6алкокси-, гідроксіС1-6алкіл-, трифторметил-, трифторметокси-, гідроксіС1-4алкокси-, С1-4алкілсульфоніл-, С1-4алкоксиС1-4алкокси-, С1-4алкоксикарбоніл-, аміноС1-4алкокси-, ді(С1-4алкіл)аміноС1-4алкоксирадикалів, ді(С1-4алкіл)аміногруп, ді(С1-4алкіл)амінокарбоніл-, ді(С1-4алкіл)аміноС1-4алкіл-, ді(С1-4алкіл)аміноС1-4алкіламіноС1-4алкілрадикалів, ді(С1-4алкіл)аміно(С1-4алкіл)аміногруп, ді(С1-4алкіл)аміно(С1-4алкіл)аміноС1-4алкілрадикалів, ді(С1-4алкіл)аміноС1-4алкіл(С1-4алкіл)аміногруп, ді(С1-4алкіл)аміноС1-4алкіл(С1-4алкіл)аміноС1-4алкілрадикалів, аміносульфоніламіно(С1-4алкіл)аміногруп, аміносульфоніламіно(С1-4алкіл)аміноС1-4алкілрадикалів, ді(С1-4алкіл)аміносульфоніламіно(С1-4алкіл)аміногруп, ді(С1-4алкіл)аміносульфоніламіно(С1-4алкіл)аміноС1-6алкілрадикалів, ціаногрупи, піперидинілС1-4алкокси-, піролідинілС1-4алкокси-, аміносульфонілпіперазиніл-, аміносульфонілпіперазинілС1-4алкіл-, ді(С1-4алкіл)аміносульфонілпіперазиніл-, ді(С1-4алкіл)аміносульфонілпіперазинілС1-4алкіл-, гідроксіС1-4алкілпіперазиніл-, гідроксіС1-4алкілпіперазинілС1-4алкіл-, С1-4алкоксипіперидиніл-, С1-4алкоксипіперидинілС1-4алкіл-, гідроксіС1-4алкоксіС1-4алкілпіперазиніл-, гідроксіС1-4алкоксіС1-4алкілпіперазинілС1-4алкілрадикалів, (гідроксіС1-4алкіл)(С1-4алкіл)аміногруп, (гідроксіС1-4алкіл)(С1-4алкіл)аміноС1-4алкілрадикалів, ди(гідроксіС1-4алкіл)аміногруп, ди(гідроксіС1-4алкіл)аміноС1-4алкіл-, фуранілрадикалів, фуранілрадикалів, заміщених -СН=СН-СН=СН-, піролідинілС1-4алкіл-, піролідинілС1-4алкокси-, морфолініл-, морфолінілС1-4алкокси-, морфолінілС1-4алкілрадикалами, морфолінілС1-4алкіламіногрупами, морфолінілС1-4алкіламіноС1-4алкіл-, піперазиніл-, С1-4алкілпіперазиніл-, С1-4алкілпіперазинілС1-4алкокси-, піперазинілС1-4алкіл-, С1-4алкілпіперазинілС1-4алкілрадикалами, С1-4алкілпіперазинілС1-4алкіламіногрупами, С1-4алкілпіперазинілС1-4алкіламіноС1-4алкіл-, тетрагідропіримідинілпіперазиніл-, тетрагідропіримідинілпіперазинілС1-4алкілрадикалами, піперидиніламіноС1-4алкіламіногрупами, піперидиніламіноС1-4алкіламіноС1-4алкілрадикалами, (С1-4алкілпіперидиніл)(гідроксіС1-4алкіл)аміноС1-4алкіламіногрупами, (С1-4алкілпіперидиніл)(гідроксіС1-4алкіл)аміноС1-4алкіламіноС1-4алкіл-, піридинілС1-4алкоксирадикалами, гідроксіС1-4алкіламіногрупами, гідроксіС1-4алкіламіноС1-4алкілрадикалами, ді(С1-4алкіл)аміноС1-4алкіламіногрупами, амінотіадіазоліл-, аміносульфонілпіперазинілС1-4алкоксирадикалами або тіофенілС1-4алкіламіногрупами;
кожен R6 та R7 може бути поміщений на атом азоту замість водню;
арил у вищеприведеній формулі це феніл або феніл, заміщений одним або більшою кількістю замісників, незалежно вибраних з галоген-, С1-6алкіл-, С1-6алкокси-, трифторметилрадикалів, ціаногрупи і гідроксикарбонілрадикала.
2. Сполука за пунктом 1, де
R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, гідроксіС1-6алкіл-, аміноС1-6алкіл- і аміноарилрадикалів;
R5 є воднем, С1-6алкіл-, С3-10циклоалкіл-, гідроксіС1-6алкіл-, С1-6алкоксіС1-6алкіл- або ді(С1-6алкіл)аміноС1-6алкілрадикалом;
![]() є радикалом, вибраним з (а-1), (а-2), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8),
є радикалом, вибраним з (а-1), (а-2), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8),
(а-9), (а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а-19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а-26), (а-27), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (а-34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а-41), (а-42), (а-43) та (а-44);
і кожен R6 і R7 незалежно один від одного є радикалом, вибраним з водню; галогенрадикалів; гідроксилу; аміногрупи; нітрогрупи; тригалогенС1-6алкіл-; тригалогенС1-6алкокси-; С1-6алкіл-; С1-6алкокси-; С1-6алкоксіС1-6алкокси-; С1-6алкілкарбоніл-; С1-6алкілсульфоніл-; ціаноС1-6алкіл-; гідроксіС1-6алкіл-; гідроксіС1-6алкоксирадикалів; гідроксіС1-6алкіламіногруп; аміноС1-6алкокси-; ді(С1-6алкіл)амінокарбонілрадикалів; ди(гідроксіС1-6алкіл)аміногруп; арил(С1-6алкіл)аміногруп; ді(С1-6алкіл)аміноС1-6алкоксирадикалів; ді(С1-6алкіл)аміноС1-6алкіламіногруп; арилсульфонілрадикалів; арилсульфоніламіногруп; арилокси-; арилС2-6алкеніліденрадикалів; ді(С1-6алкіл)аміногруп; ді(С1-6алкіл)аміноС1-6алкіл-; ді(С1-6алкіл)аміноС1-6алкіл(С1-6алкіл)аміноС1-6алкілрадикалів; ціаногрупи; тіофенілрадикала; тіофенілрадикалів, заміщених ді(С1-6алкіл)аміноС1-6алкіл(С1-6алкіл)аміноС1-6алкіл-, ді(С1-6алкіл)аміноС1-6алкіл-, С1-6алкілпіперазинілС1-6алкіл- або ди(гідроксіС1-6алкіл)аміноС1-6алкілрадикалами; фураніл-; імідазоліл-; С1-6алкілтриазоліл-; тетразоліл-; піролідиніл-; піперидинілС1-6алкокси-; морфолініл-; С1-6алкілморфолініл-; морфолінілС1-6алкокси-; морфолінілС1-6алкіл-; С1-6алкілпіперазиніл-; С1-6алкілпіперазинілС1-6алкокси-; С1-6алкілпіперазинілС1-6алкіл-; С1-6алкілпіперазинілсульфоніл-; аміносульфонілпіперазинілС1-6алкокси-; аміносульфонілпіперазиніл-; аміносульфонілпіперазинілС1-6алкіл-; ді(С1-6алкіл)аміносульфонілпіперазиніл-; ді(С1-6алкіл)аміносульфонілпіперазинілС1-6алкіл-; гідроксіС1-6алкілпіперазиніл-; гідроксіС1-6алкілпіперазинілС1-6алкіл-; С1-6алкоксипіперидиніл-; С1-6алкоксипіперидинілС1-6алкіл-; гідроксіС1-6алкоксіС1-6алкілпіперазиніл- ; гідроксіС1-6алкоксіС1-6алкілпіперазинілС1-6алкілрадикалів; (гідроксіС1-6алкіл)(С1-6алкіл)аміногруп; (гідроксіС1-6алкіл)(С1-6алкіл)аміноС1-6алкіл-; піролідинілС1-6алкокси-; піразоліл-; тіопіразолілрадикалів; піразолілрадикалів, заміщених двома замісниками, вибраними з С1-6алкіл- і тригалогенС1-6алкілрадикалів; піридинілрадикала; піридинілрадикалів, заміщених С1-6алкокси- або арилрадикалами; піримідиніл-; хінолініл-; індоліл-; фенілрадикалів; фенілрадикалів, заміщених одним, двома або трьома замісниками, незалежно вибраними з галогенрадикалів, аміногрупи, С1-6алкіл-, С1-6алкокси-, гідроксіС1-4алкіл-, трифторметил-, трифторметокси-, гідроксіС1-4алкокси-, С1-4алкоксіС1-4алкокси-, аміноС1-4алкокси-, ді(С1-4алкіл)аміноС1-4алкоксирадикалів, ді(С1-4алкіл)аміногруп, ді(С1-4алкіл)аміноС1-4алкіл-, ді(С1-4алкіл)аміноС1-4алкіл(С1-4алкіл)аміноС1-4алкіл-, піперидинілС1-4алкокси-, піролідинілС1-4алкокси-, аміносульфонілпіперазиніл-, аміносульфонілпіперазинілС1-4алкіл-, ді(С1-4алкіл)аміносульфонілпіперазиніл-, ді(С1-4алкіл)аміносульфонілпіперазинілС1-4алкіл-, гідроксіС1-4алкілпіперазиніл-, гідроксіС1-4алкілпіперазинілС1-4алкіл-, С1-4алкоксипіперидиніл-, С1-4алкоксипіперидинілС1-4алкіл-, гідроксіС1-4алкоксіС1-4алкілпіперазиніл-, гідроксіС1-4алкоксіС1-4алкілпіперазинілС1-4алкілрадикалів, (гідроксіС1-4алкіл)(С1-4алкіл)аміногруп, (гідроксіС1-4алкіл)(С1-4алкіл)аміноС1-4алкіл-, піролідинілС1-4алкокси-, морфолінілС1-4алкокси-, морфолінілС1-4алкіл-, С1-4алкілпіперазиніл-, С1-4алкілпіперазинілС1-4алкокси-, С1-4алкілпіперазинілС1-4алкілрадикалів, гідроксіС1-4алкіламіногруп, ди(гідроксіС1-4алкіл)аміногруп, ді(С1-4алкіл)аміноС1-4алкіламіногруп, амінотіадиазоліл-, аміносульфонілпіперазинілС1-4алкоксирадикалів і тіофенілС1-4алкіламіногруп.
3. Сполука за пунктом 1, де t є 0; m є 0;
R1 є -C(O)NR8R9, -C(O)-С1-6алкіліденSR10, -NR11C(O)N(OH)R10, -NR11C(O)С1-6алкіліденSR10, -NR11C(O)C=N(OH)R10 або інша Zn-хелатуюча група, де R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, гідроксіС1-6алкіл- і аміноС1-6алкілрадикалів;
R2 є воднем, галогенрадикалом, гідроксилом, аміногрупою, нітрогрупою, С1-6алкіл-, С1-6алкокси-, трифторметилрадикалом або ді(С1-6алкіл)аміногрупою;
-L- є безпосереднім зв'язком або двовалентним радикалом, вибраним з С1-6алкіліден-,
С1-6алкіліденоксирадикалів, аміногрупи та карбонільної групи;
R4 є воднем, гідроксилом, аміногрупою, гідроксіС1-6алкіл-, С1-6алкіл-, С1-6алкокси-, арилС1-6алкіл-, амінокарбоніл-, аміноС1-6алкіл-, С1-6алкіламіноС1-6алкіл- або ді(С1-6алкіл)аміноС1-6алкілрадикалом;
R5 є воднем;
![]() є радикалом, вибраним з (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9),
є радикалом, вибраним з (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9),
(а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а-19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а-26), (а-28). (а-29), (а-30), (а-31), (а-32), (а-33), (а-34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а-41), (а-42), (а-44), (а-45), (а-46), (а-47), (а-48) та (а-51);
кожен s незалежно від інших є 0, 1, 2, 3 або 4;
R6 є воднем; галогенрадикалом; гідроксилом; аміногрупою; нітрогрупою; тригалогенС1-6алкіл-; тригалогенС1-6алкокси-; С1-6алкіл-; С1-6алкокси-; С1-6алкілкарбоніл-; С1-6алкоксикарбоніл-; С1-6алкілсульфоніл-; гідросіС1-6алкіл-; ароксирадикалом; ді(С1-6алкіл)аміногрупою; ціаногрупою; тіофеніл-; фуранілрадикалом; фуранілрадикалом, заміщеним гідроксіС1-6алкілрадикалом; бензофураніл-; імідазоліл-; оксазоліл- радикалом; оксазолілрадикалом, заміщеним арил- та С1-6алкілрадикалами; С1-6алкілтриазоліл-; тетразоліл-; піролідиніл-; піроліл-; морфолініл-; С1-6алкілморфолініл-; піперазиніл-; С1-6алкілпіперазиніл-; гідроксіС1-6алкілпіперазиніл-; С1-6алкоксипіперидиніл-; піразолілрадикалом; піразолілрадикалом, заміщеним одним або двома замісниками, вибраними з С1-6алкіл- і тригалогенС1-6алкілрадикалів; піридинілрадикалом; піридинілрадикалом, заміщеним С1-6алкокси-, арокси- або арилрадикалом; піримідиніл-; хінолініл-; індоліл-; фенілрадикалом або фенілрадикалом, заміщеним одним або двома замісниками, незалежно вибраними з галоген-, С1-6алкіл-, С1-6алкокси- і трифторметилрадикалів;
та R7 є воднем; галогенрадикалом; гідроксилом; аміногрупою; нітрогрупою; тригалогенС1-6алкіл-; тригалогенС1-6алкокси-; С1-6алкіл-; С1-6алкокси-; С1-6алкілкарбоніл-; С1-6алкоксикарбоніл-; С1-6алкілсульфоніл-; гідросіС1-6алкіл-; ароксирадикалом; ді(С1-6алкіл)аміногрупою; ціаногрупою; піридиніл-; фенілрадикалом або фенілрадикалом, заміщеним одним або двома замісниками, незалежно вибраними з галоген-, С1-6алкіл-, С1-6алкокси- і трифторметилрадикалів.
4. Сполука за пунктами 1 і 2, де n є 1; m є 0 або 1; t є 0, 1 або 2; кожен Q є
![]() ; R1 є -C(О)NH(OH); R2 є воднем або С1-6алкілом; -L- є безпосереднім зв'язком;
; R1 є -C(О)NH(OH); R2 є воднем або С1-6алкілом; -L- є безпосереднім зв'язком;
R4 є воднем; R5 є воднем; ![]() є радикалом, вибраним з (а-1), (а-20), (а-25), (а-27), (а-28), (а-29), (а-41) та (а-42); кожен s незалежно від інших є 0, 1 або 2; та кожен R6 незалежно від інших є радикалом, вибраним з водню, галоген-, С1-6алкіл- і С1-6алкоксирадикалів.
є радикалом, вибраним з (а-1), (а-20), (а-25), (а-27), (а-28), (а-29), (а-41) та (а-42); кожен s незалежно від інших є 0, 1 або 2; та кожен R6 незалежно від інших є радикалом, вибраним з водню, галоген-, С1-6алкіл- і С1-6алкоксирадикалів.
5. Сполука за пунктами 1, 2 і 4, де n є l; m є 0 або 1; є 0, 1 або 2; кожен
Q є ![]() ; R1 є -C(O)NH(OH); R2 є воднем; -L- є безпосереднім зв'язком; R4 є воднем;
; R1 є -C(O)NH(OH); R2 є воднем; -L- є безпосереднім зв'язком; R4 є воднем;
R5 є воднем; ![]() є радикалом, вибраним з (а-1), (а-20), (а-27), (а-28), (а-29), (а-41) та (а-42); кожен s незалежно від інших є 0, 1 або 2; та кожен R6 незалежно від інших є радикалом, вибраним з водню, галоген-, C1-6алкіл- і C1-6алкоксирадикалів.
є радикалом, вибраним з (а-1), (а-20), (а-27), (а-28), (а-29), (а-41) та (а-42); кожен s незалежно від інших є 0, 1 або 2; та кожен R6 незалежно від інших є радикалом, вибраним з водню, галоген-, C1-6алкіл- і C1-6алкоксирадикалів.
6. Сполука за пунктами 1, 2, 4 і 5, де сполука є сполукою №3.
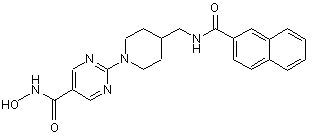
сполука 3.
7. Фармацевтична композиція, що містить фармацевтично прийнятні носії і як активну складову - терапевтично ефективну кількість сполуки за пунктами 1-6.
8. Спосіб приготування фармацевтичної композиції, за пунктом 7, за яким фармацевтично прийнятні носії і сполуку за пунктами 1-6 ретельно перемішують.
9. Сполука, заявлена у будь-якому з пунктів 1-6, призначена для використання як ліків.
10. Використання сполуки за будь-яким з пунктів 1-6 для виробництва засобу лікування хвороб, пов'язаних з розростанням клітин пухлин.
11. Спосіб отримання сполуки за пунктом 1, що характеризується тим, що піддають реакції проміжний продукт формули (II) з відповідною кислотою, такою як, наприклад, трифтороцтова кислота (CF3COOH), що призводить до утворення гідроксамової кислоти формули (I-а), де R1 є -C(O)NH(OH)
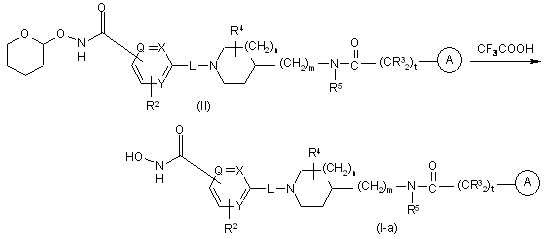 .
.
12. Спосіб виявлення або визначення ГДАЦ у біологічному зразку, який являє собою (метод) виявлення або вимірювання кількісних характеристик утворення комплексу міченої сполуки, визначеної у пункті 1, з ГДАЦ.
13. Композиція протиракових агентів і інгібітора ГДАЦ, заявлена у будь-якому з пунктів 1-6.
Текст
1. Сполука формули (І) R4 O N C Y (CR3 2 )t A R5 R2 , її N-оксидні форми, фармацевтично прийнятні кислотно адитивні солі та їх стереоізомерні форми, де n є 0, 1, 2 або 3, і коли n є 0, мається на увазі безпосередній зв'язок; m є 0 або 1, і коли m є 0, мається на увазі безпосередній зв'язок; t є 0, 1, 2, 3 або 4, і коли t є 0, мається на увазі безпосередній зв'язок; кожен Q є азотом або C кожен Х є азотом або C ; ; C кожен Y є азотом або ; R1 є -C(O)NR8R9, -NHC(O)R 10, -С(O)-С110 11 10 11 6алкіліденSR , -NR C(O)N(OH)CR , -NR C(O)C 1алкіліденSR10, -NR11C(O)C=N(OH)R 10 або інша Zn6 хелатуюча група, де R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, C1-6алкіл-, гідроксіC1-6алкіл-, аміноC1-6алкілі аміноарилрадикалів; R10 є воднем, C1-6алкіл-, С16алкілкарбоніл-, арилC 1-6алкіл-, C 1-6алкілпіразиніл-, піридиноніл-, піролідиноніл- або метилімідазолілрадикалом; R11 є воднем або C1-6алкілом; C2 (CH2 )m (13) N 78033 L (11) (CH2)n X UA R1 Q (19) (21) 20041008337 (22) 11.03.2003 (24) 15.02.2007 (86) PCT/EP03/02512, 11.03.2003 (31) 60/363,799 (32) 13.03.2002 (33) US (31) PCT/EP02/14074 (32) 10.12.2002 (33) EP (46) 15.02.2007, Бюл. №2, 2007р. (72) Ван Емелен Крістоф, BE, Вердонк Марк Густааф, BE, Ван Брандт Свен, BE, Бакс Лео Якобус, BE (73) ЯНССЕН ФАРМАЦЕВТИКА Н.В., BE (56) STERNSON S M ET AL: "Synthesis of 7200 Small Molecules Based on a Substructural Analysis of the Hi stone Deacetylase Inhibitors Trichostatin and Trapoxin" ORGANIC LETTERS, ACS, WASHINGTON, DC, US, vol. 3, no. 26, 2001 WO 01 38322 A (METHYLGENE INC) 31 May 2001 (2001-05-31) GB 1 345 872 A (WYETH JOHN & BROTHER LTD) 6 February 1974 (1974-02-06) US 4 348 401 A (FRIEBE WALTER-GUN AR ET AL) 7 September 1982 (1982-09-07) DATABASE C A 'Online! CHEMIC AL ABSTRACTS SERVICE, COLUMBUS, OHIO, US; IRIKURA, TSUTOMU ET AL: "Absorption, excretion, and metabolism of l-(p-aminobenzoyl)-4-(3,4,5trimethoxybenzamido)piperidine (KU-55)" retrieved from STN Database accession no. 80:140980 XP002239597 & OYO YAKURI (1973), 7(7) ARCHIBALD J L ET AL: "BENZAMIDOPIPERIDINES. 3. CARBOCYCLIC DERIVATIVES RELATED TO INDORAMIN" JOURNAL OF MEDICIN AL 2 3 78033 R2 є воднем, галогенрадикалом, гідроксилом, аміногрупою, нітрогрупою, C1-6алкіл-, C1-6алкокси-, трифторметилрадикалом, ді(C16алкіл)аміногрупою, гідроксаміногрупою або нафталінсульфонілпіразинілрадикалом; -L- є безпосереднім зв'язком або двовалентним радикалом, вибраним з C1-6алкіліден-, C16алкіліденоксирадикалів, аміногрупи, карбонільної групи та амінокарбонільної групи; кожен R3 незалежно від інших являє собою атом водню, і один атом водню може бути замінений на замісник, вибраний з арилрадикалів; R4 є воднем, гідроксилом, аміногрупою, гідроксіC16алкіл-, C 1-6алкіл-, C 1-6алкокси-, арилC 1-6алкіл-, амінокарбоніл-, гідроксикарбоніл-, аміноC1-6алкіл-, амінокарбонілC1-6алкіл-, гідроксикарбонілC1-6алкіл, гідроксамінокарбоніл-, C1-6алкоксикарбоніл-, C1або ді(C1-6алкіл)аміноC16алкіламіноC 1-6алкіл6алкілрадикалом; 5 R є воднем, C1-6алкіл-, C3-10циклоалкіл-, гідроксіC16алкіл-, C 1-6алкоксіC 1-6алкіл-, ді(C 1-6алкіл)аміноC 16алкіл- або арилрадикалом; 4 N (R 6)s (R6)s (a-1) N (a-2) (a-3) (a-5) S (a-9) H N (a-37) (R7) s O (R 7 )s (a-11) (R7)s (a-15) 7 CH3 (R ) s H3 C N N N N O N NH (a-18) (R7 )s (R6) s (R6) s (R7) s N (a-17) (R 7)s (a-16) (R7)s O N S S (a-14) (a-19) (R7) (a-20) (R 7) s s N N N (a-21) (a-22) (R7 )s (R7 )s (a-23) (R6) s N N (a-25) O (a-24) H N N H (a-26) (a-27) O (R7)s N (a-39) (R7) s (a-40) ( R7 )s (R 6) s N (a-41) (a-28) (a-42) O NH N (a-45) (a-43) O (R7 )s S N (R7) s (a-44) (R7)s N N H N N (a-46) (a-47) (R7 )s (a-48) (R7 )s O N (R7)s H N (R7) s N O N S (a-12) N (a-13) (R7 )s (a-8) O H N O N (R7 )s (a-38) (R7)s (R 7)s (a-7) (a-10) N H N (R7 )s S (R7 )s (a-36) N N N O (a-6) N (a-35) (R 7) s (R 7)s N N (a-34) (R7 ) s (R7)s N S (a-33) O (R7) s (a-4) (R7 )s NH N (a-32) O (R7)s N O N H (R 7)s N N (a-31) (R7 )s N (R 7 )s (R 7)s (a-30) N O N O (a-29) N (R7 )s N O S N H є радикалом, вибраним з A (R7 )s (R7 )s (R 7)s (R7) s (R 7)s NH , (a-49) (a-50) (a-51) де кожен s незалежно від інших є 0, 1, 2, 3, 4 або 5; кожен R6 та R7 незалежно один від одного є радикалом, вибраним з водню; галогенрадикалів; гідроксилу; аміногрупи; нітрогрупи; тригалогенС 1-6алкіл; тригалогенС 1-6алкокси-; С1-6алкілрадикалів; С1заміщених арилта С36алкілрадикалів, С1-6алкокси-; С110циклоалкілрадикалами; С1-6алкілкарбоніл-; С16алкоксіС 1-6алкокси-; 6алкоксикарбоніл-; С 1-6алкілсульфоніл-; ціаноС 1гідроксіС 1-6алкіл-; гідроксіС 16алкіл-; 6алкоксирадикалів; гідроксіС 1-6алкіламіногруп; аміноС1-6алкокси-; ді(С1ди(гідроксіС 16алкіл)амінокарбонілрадикалів; 6алкіл)аміногруп; (арил)(С 1-6алкіл)аміногруп; ді(С 1ді(С16алкіл)аміноС 1-6алкоксирадикалів; ді(С16алкіл)аміноС 1-6алкіламіногруп; 6алкіл)аміноС 1-6алкіламіноС 1-6алкіл-; арилсульфонілрадикалів; арилсульфоніламіногруп; арилокси-; арилоксіС 1-6алкіл-; арилС2-6алкеніліденрадикалів; ді(С1-6алкіл)аміногруп; ді(С1-6алкіл)аміноС 1ді(С1-6алкіл)аміно(С16алкілрадикалів; ді(С1-6алкіл)аміно(С16алкіл)аміногруп; ді(С16алкіл)аміноС 1-6алкілрадикалів; ді(С16алкіл)аміноС 1-6алкіл(С 1-6алкіл)аміногруп; 6алкіл)аміноС 1-6алкіл(С 1-6алкіл)аміноС 1аміносульфоніламіно(С 16алкілрадикалів; аміносульфоніламіно(С 16алкіл)аміногруп; 5 6алкіл)аміноС 1-6алкілрадикалів; 78033 ді(С1 6алкіл)аміносульфоніламіно(С 1-6алкіл)аміногруп; ді(С1-6алкіл)аміносульфоніламіно(С 16алкіл)аміноС 1-6алкілрадикалів; ціаногрупи; тіофенілрадикала; тіофенілрадикалів, заміщених ді(С16алкіл)аміноС 1-6алкіл(С 1-6алкіл)аміноС 1-6алкіл-, ді(С1-6алкіл)аміноС 1-6алкіл-, С1-6алкілпіперазинілС16алкіл-, гідроксіС 1-6алкілпіперазинілС 1-6алкіл-, гідроксіС1-6алкоксіС1-6алкілпіперазинілС1-6алкіл-, ді(С1-6алкіл)аміносульфонілпіперазинілС1-6алкіл-, С1-6алкоксипіперидиніл-,С1-6алкоксипіперидинілС 16алкіл-, морфолінілС 1-6алкіл-, гідроксіС 1-6алкіл(С 1або ди(гідроксіС 16алкіл)аміноС 1-6алкіл6алкіл)аміноС 1-6алкілрадикалами; фуранілрадикала; фуранілрадикалів, заміщених гідроксіС 16алкілрадикалами; бензофураніл-; імідазоліл-; оксазолілрадикалів; оксазолілрадикалів, заміщених арил- та С1-6алкілрадикалами; С1-6алкілтриазоліл-; тетразоліл-; піролідиніл-; піроліл-; піперидинілС 1морфолініл-; С1-6алкілморфолініл-; 6алкокси-; морфолінілС1-6алкокси-; морфолінілС1морфолінілС1-6алкіламіногруп; 6алкілрадикалів; морфолінілС1-6алкіламіноС 1-6алкіл-; піперазиніл-; С1-6алкілпіперазиніл-; С1-6алкілпіперазинілС16алкокси-; піперазинілС 1-6алкіл-; нафталінсульфонілпіперазиніл-; нафталінсульфонілпіперидиніл-; нафталінсульфоніл-; С1-6алкілпіперазинілС1С1-6алкілпіперазинілС16алкілрадикалів; С1-6алкілпіперазинілС16алкіламіногруп; С16алкіламіноС 1-6алкіл-; 6алкілпіперазинілсульфоніл-; аміносульфонілпіперазинілС1-6алкокси-; аміносульфонілпіперазиніл-; аміносульфонілпіперазинілС1-6алкіл-; ді(С1ді(С16алкіл)аміносульфонілпіперазиніл-; 6алкіл)аміносульфонілпіперазинілС 1-6алкіл-; гідроксіС1-6алкілпіперазиніл-; гідроксіС 1С16алкілпіперазинілС 1-6алкіл-; С1-6алкоксипіперидинілС 16алкоксипіперидиніл-; піперидиніламіноС16алкілрадикалів; 6алкіламіногруп; піперидиніламіноС 1-6алкіламіноС 16алкілрадикалів; (С 1-6алкілпіперидиніл)(гідроксіС 1(С16алкіл)аміноС 1-6алкіламіногруп; 6алкілпіперидиніл)(гідроксіС 1-6алкіл)аміноС 1гідроксіС 1-6алкоксіС 16алкіламіноС 1-6алкіл-; гідроксіС 1-6алкоксіС 16алкілпіперазиніл-; (гідроксіС 16алкілпіперазинілС 1-6алкілрадикалів; (гідроксіС 1-6алкіл)(С16алкіл)(С 1-6алкіл)аміногруп; гідроксіС 1-6алкіламіноС16алкіл)аміноС 1-6алкіл-; 6алкіл-; ді(гідроксіС 1-6алкіл)аміноС 1-6алкіл-; піролідинілС 1-6алкіл-; піролідинілС 1-6алкокси-; піразоліл-; тіопіразолілрадикалів; піразолілрадикалів, заміщених двома замісниками, вибраними з С1-6алкіл- і тригалогенС 1-6алкілрадикалів; піридинілрадикала; піридинілрадикалів, заміщених С 1-6алкокси-, арокси- або арилрадикалами; піримідиніл-; тетрагідропіримідинілпіперазиніл-; тетрагідропіримідинілпіперазинілС1-6алкіл-; хінолініл-; індоліл-; фенілрадикалів; фенілрадикалів, заміщених одним, двома або трьома замісниками, незалежно вибраними з галогенрадикалів, аміногрупи, нітрогрупи, С1-6алкіл-, С1-6алкокси-, гідроксіС 1-6алкіл-, трифторметил-, трифторметокси-, гідроксіС1С1-4алкілсульфоніл-, С1-4алкоксиС 14алкокси-, 4алкокси-, С 1-4алкоксикарбоніл-, аміноС 1-4алкокси-, ді(С1-4алкіл)аміноС 1-4алкоксирадикалів, ді(С1 4алкіл)аміногруп, 6 ді(С1-4алкіл)амінокарбоніл-, ді(С1ді(С1-4алкіл)аміноС 1ді(С14алкіламіноС 1-4алкілрадикалів, ді(С14алкіл)аміно(С 1-4алкіл)аміногруп, 4алкіл)аміно(С 1-4алкіл)аміноС 1-4алкілрадикалів, ді(С1-4алкіл)аміноС 1-4алкіл(С 1-4алкіл)аміногруп, ді(С1-4алкіл)аміноС 1-4алкіл(С 1-4алкіл)аміноС 1аміносульфоніламіно(С 14алкілрадикалів, аміносульфоніламіно(С 14алкіл)аміногруп, ді(С14алкіл)аміноС 1-4алкілрадикалів, 4алкіл)аміносульфоніламіно(С 1-4алкіл)аміногруп, ді(С1-4алкіл)аміносульфоніламіно(С 14алкіл)аміноС 1-6алкілрадикалів, ціаногрупи, піперидинілС 1-4алкокси-, піролідинілС1-4алкокси-, аміносульфонілпіперазиніл-, аміносульфонілпіперазинілС 1-4алкіл-, ді(С1ді(С14алкіл)аміносульфонілпіперазиніл-, 4алкіл)аміносульфонілпіперазинілС 1-4алкіл-, гідроксіС1-4алкілпіперазиніл-, гідроксіС 1С14алкілпіперазинілС 1-4алкіл-, С1-4алкоксипіперидинілС 14алкоксипіперидиніл-, гідроксіС 1-4алкоксіС1-4алкілпіперазиніл-, 4алкіл-, гідроксіС1-4алкоксіС 1-4алкілпіперазинілС1(гідроксіС 1-4алкіл)(С14алкілрадикалів, (гідроксіС 1-4алкіл)(С14алкіл)аміногруп, ди(гідроксіС14алкіл)аміноС 1-4алкілрадикалів, ди(гідроксіС 1-4алкіл)аміноС 14алкіл)аміногруп, 4алкіл-, фуранілрадикалів, фуранілрадикалів, заміщених -СНСН-СНСН -, піролідинілС1-4алкіл-, = = піролідинілС1-4алкокси-, морфолініл-, морфолінілС1-4алкокси-, морфолінілС1-4алкілрадикалами, морфолінілС1-4алкіламіногрупами, морфолінілС1піперазиніл-, С14алкіламіноС 1-4алкіл-, С1-4алкілпіперазинілС14алкілпіперазиніл-, піперазинілС 1-4алкіл-, С14алкокси-, С14алкілпіперазинілС 1-4алкілрадикалами, С14алкілпіперазинілС 1-4алкіламіногрупами, 4алкілпіперазинілС 1-4алкіламіноС 1-4алкіл-, тетрагідропіримідинілпіперазиніл-, тетрагідропіримідинілпіперазинілС1-4алкілрадикалами, піперидиніламіноС1-4алкіламіногрупами, піперидиніламіноС1(С14алкіламіноС 1-4алкілрадикалами, 4алкілпіперидиніл)(гідроксіС 1-4алкіл)аміноС 1(С14алкіламіногрупами, 4алкілпіперидиніл)(гідроксіС 1-4алкіл)аміноС 1піридинілС 14алкіламіноС 1-4алкіл-, гідроксіС 14алкоксирадикалами, гідроксіС 1-4алкіламіноС14алкіламіногрупами, ді(С1-4алкіл)аміноС 14алкілрадикалами, 4алкіламіногрупами, амінотіадіазоліл-, аміносульфонілпіперазинілС1-4алкоксирадикалами або тіофенілС 1-4алкіламіногрупами; кожен R6 та R7 може бути поміщений на атом азоту замість водню; арил у вищеприведеній формулі це феніл або феніл, заміщений одним або більшою кількістю замісників, незалежно вибраних з галоген-, С1-6алкіл-, С1-6алкокси-, трифторметилрадикалів, ціаногрупи і гідроксикарбонілрадикала. 2. Сполука за пунктом 1, де R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, гідроксіС 1-6алкіл-, аміноС 1-6алкіл- і аміноарилрадикалів; 4алкіл)аміноС 1-4алкіл-, 7 78033 R5 є воднем, С1-6алкіл-, С3-10циклоалкіл-, гідроксіС 1С1-6алкоксіС1-6алкілабо ді(С 16алкіл-, 6алкіл)аміноС 1-6алкілрадикалом; A є радикалом, вибраним з (а-1), (а-2), (а3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а16), (а-17), (а-18), (а-19), (а-20), (а-21), (а-22), (а23), (а-24), (а-25), (а-26), (а-27), (а-28), (а-29), (а30), (а-31), (а-32), (а-33), (а-34), (а-35), (а-36), (а37), (а-38), (а-39), (а-40), (а-41), (а-42), (а-43) та (а44); і кожен R6 і R7 незалежно один від одного є радикалом, вибраним з водню; галогенрадикалів; гідроксилу; аміногрупи; нітрогрупи; тригалогенС 1-6алкіл; тригалогенС 1-6алкокси-; С1-6алкіл-; С1-6алкокси-; С1-6алкоксіС 1-6алкокси-; С1-6алкілкарбоніл-; С16алкілсульфоніл-; ціаноС 1-6алкіл-; гідроксіС 1-6алкіл; гідроксіС1-6алкоксирадикалів; гідроксіС 1аміноС1-6алкокси-; ді(С16алкіламіногруп; ди(гідроксіС 16алкіл)амінокарбонілрадикалів; 6алкіл)аміногруп; арил(С 1-6алкіл)аміногруп; ді(С 1ді(С16алкіл)аміноС 1-6алкоксирадикалів; 6алкіл)аміноС 1-6алкіламіногруп; арилсульфонілрадикалів; арилсульфоніламіногруп; арилокси-; арилС2-6алкеніліденрадикалів; ді(С16алкіл)аміногруп; ді(С 1-6алкіл)аміноС 1-6алкіл-; ді(С 16алкіл)аміноС 1-6алкіл(С 1-6алкіл)аміноС 1ціаногрупи; тіофенілрадикала; 6алкілрадикалів; тіофенілрадикалів, заміщених ді(С1-6алкіл)аміноС 1ді(С16алкіл(С 1-6алкіл)аміноС 1-6алкіл-, С1-6алкілпіперазинілС16алкіл)аміноС 1-6алкіл-, або ди(гідроксіС 1-6алкіл)аміноС 16алкілфураніл-; імідазоліл-; С16алкілрадикалами; 6алкілтриазоліл-; тетразоліл-; піролідиніл-; піперидинілС 1-6алкокси-; морфолініл-; С16алкілморфолініл-; морфолінілС 1-6алкокси-; морфолінілС 1-6алкіл-; С1-6алкілпіперазиніл-; С1С16алкілпіперазинілС 1-6алкокси-; С16алкілпіперазинілС 1-6алкіл-; 6алкілпіперазинілсульфоніл-; аміносульфонілпіперазинілС1-6алкокси-; аміносульфонілпіперазиніл-; аміносульфонілпіперазинілС1-6алкіл-; ді(С1ді(С16алкіл)аміносульфонілпіперазиніл-; 6алкіл)аміносульфонілпіперазинілС 1-6алкіл-; гідроксіС1-6алкілпіперазиніл-; гідроксіС 1С16алкілпіперазинілС 1-6алкіл-; С1-6алкоксипіперидинілС 16алкоксипіперидиніл-; гідроксіС 1-6алкоксіС1-6алкілпіперазиніл- ; 6алкіл-; гідроксіС1-6алкоксіС 1-6алкілпіперазинілС1(гідроксіС1-6алкіл)(С16алкілрадикалів; (гідроксіС 1-6алкіл)(С16алкіл)аміногруп; піролідинілС 1-6алкокси-; 6алкіл)аміноС 1-6алкіл-; піразоліл-; тіопіразолілрадикалів; піразолілрадикалів, заміщених двома замісниками, вибраними з С1-6алкіл- і тригалогенС 1-6алкілрадикалів; піридинілрадикала; піридинілрадикалів, заміщених С 16алкокси- або арилрадикалами; піримідиніл-; хінолініл-; індоліл-; фенілрадикалів; фенілрадикалів, заміщених одним, двома або трьома замісниками, незалежно вибраними з галогенрадикалів, аміногрупи, С1-6алкіл-, С1-6алкокси-, гідроксіС 1-4алкіл-, трифторметил-, трифторметокси-, гідроксіС1С1-4алкоксіС1-4алкокси-, аміноС 14алкокси-, 4алкокси-, ді(С 1-4алкіл)аміноС 1-4алкоксирадикалів, 8 ді(С1-4алкіл)аміногруп, ді(С1-4алкіл)аміноС 1-4алкіл-, ді(С1-4алкіл)аміноС 1-4алкіл(С 1-4алкіл)аміноС 1-4алкіл, піперидинілС 1-4алкокси-, піролідинілС 1-4алкокси-, аміносульфонілпіперазиніл-, аміносульфонілпіперазинілС1-4алкіл-, ді(С1ді(С14алкіл)аміносульфонілпіперазиніл-, 4алкіл)аміносульфонілпіперазинілС 1-4алкіл-, гідроксіС1-4алкілпіперазиніл-, гідроксіС 1С14алкілпіперазинілС 1-4алкіл-, С1-4алкоксипіперидинілС 14алкоксипіперидиніл-, гідроксіС 1-4алкоксіС1-4алкілпіперазиніл-, 4алкіл-, гідроксіС1-4алкоксіС 1-4алкілпіперазинілС1(гідроксіС 1-4алкіл)(С14алкілрадикалів, (гідроксіС 1-4алкіл)(С14алкіл)аміногруп, піролідинілС 1-4алкокси-, 4алкіл)аміноС 1-4алкіл-, морфолінілС1-4алкокси-, морфолінілС 1-4алкіл-, С1С1-4алкілпіперазинілС14алкілпіперазиніл-, 4алкокси-, С 1-4алкілпіперазинілС 1-4алкілрадикалів, гідроксіС1-4алкіламіногруп, ди(гідроксіС 1ді(С1-4алкіл)аміноС 14алкіл)аміногруп, 4алкіламіногруп, амінотіадиазоліл-, аміносульфонілпіперазинілС1-4алкоксирадикалів і тіофенілС14алкіламіногруп. 3. Сполука за пунктом 1, де t є 0; m є 0; R1 є -C(O)NR8R9, -C(O)-С1- 6алкіліденSR10, NR11C(O)N(OH)R10, -NR11C(O)С1- 6алкіліденSR10, NR11C(O)C=N(OH)R 10 або інша Zn-хелатуюча група, де R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, гідроксіС 16алкіл- і аміноС 1-6алкілрадикалів; R2 є воднем, галогенрадикалом, гідроксилом, аміногрупою, нітрогрупою, С1-6алкіл-, С1-6алкокси-, трифторметилрадикалом або ді(С 16алкіл)аміногрупою; -L- є безпосереднім зв'язком або двовалентним радикалом, вибраним з С1-6алкіліден-, С1-6алкіліденоксирадикалів, аміногрупи та карбонільної групи; R4 є воднем, гідроксилом, аміногрупою, гідроксіС16алкіл-, С 1-6алкіл-, С 1-6алкокси-, арилС 1-6алкіл-, амінокарбоніл-, аміноС1-6алкіл-, С1-6алкіламіноС16алкіл- або ді(С 1-6алкіл)аміноС 1-6алкілрадикалом; R5 є воднем; A є радикалом, вибраним з (а-1), (а-3), (а4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а17), (а-18), (а-19), (а-20), (а-21), (а-22), (а-23), (а24), (а-25), (а-26), (а-28). (а-29), (а-30), (а-31), (а32), (а-33), (а-34), (а-35), (а-36), (а-37), (а-38), (а39), (а-40), (а-41), (а-42), (а-44), (а-45), (а-46), (а47), (а-48) та (а-51); кожен s незалежно від інших є 0, 1, 2, 3 або 4; R6 є воднем; галогенрадикалом; гідроксилом; аміногрупою; нітрогрупою; тригалогенС 1-6алкіл-; тригалогенС 1-6алкокси-; С1-6алкіл-; С1-6алкокси-; С1С1-6алкоксикарбоніл-; С16алкілкарбоніл-; 6алкілсульфоніл-; гідросіС 1-6алкіл-; ароксирадикалом; ді(С1-6алкіл)аміногрупою; ціаногрупою; тіофеніл-; фуранілрадикалом; фуранілрадикалом, заміщеним гідроксіС 1-6алкілрадикалом; бензофураніл-; імідазоліл-; оксазоліл- радикалом; оксазолілрадикалом, заміщеним арил- та С1-6алкілрадикалами; С1-6алкілтриазоліл-; тетразоліл-; піролідиніл-; піроліл-; морфолініл-; С1-6алкілморфолініл-; піперази 9 78033 ніл-; С1-6алкілпіперазиніл-; гідроксіС 16алкілпіперазиніл-; С 1-6алкоксипіперидиніл-; піразолілрадикалом; піразолілрадикалом, заміщеним одним або двома замісниками, вибраними з С16алкіл- і тригалогенС 1-6алкілрадикалів; піридинілрадикалом; піридинілрадикалом, заміщеним С 16алкокси-, арокси- або арилрадикалом; піримідиніл-; хінолініл-; індоліл-; фенілрадикалом або фенілрадикалом, заміщеним одним або двома замісниками, незалежно вибраними з галоген-, С16алкіл-, С 1-6алкокси- і трифторметилрадикалів; та R7 є воднем; галогенрадикалом; гідроксилом; аміногрупою; нітрогрупою; тригалогенС 1-6алкіл-; тригалогенС 1-6алкокси-; С1-6алкіл-; С1-6алкокси-; С1С1-6алкоксикарбоніл-; С16алкілкарбоніл-; 6алкілсульфоніл-; гідросіС 1-6алкіл-; ароксирадикалом; ді(С1-6алкіл)аміногрупою; ціаногрупою; піридиніл-; фенілрадикалом або фенілрадикалом, заміщеним одним або двома замісниками, незалежно вибраними з галоген-, С1-6алкіл-, С16алкокси- і трифторметилрадикалів. 4. Сполука за пунктами 1 і 2, де n є 1; m є 0 або 1; t є 0, 1 або 2; кожен Q є C ; R1 є -C(О)NH(OH); R2 є воднем або С16алкілом; -L- є безпосереднім зв'язком; A R4 є воднем; R5 є воднем; є радикалом, вибраним з (а-1), (а-20), (а-25), (а-27), (а-28), (а29), (а-41) та (а-42); кожен s незалежно від інших є 0, 1 або 2; та кожен R6 незалежно від інших є радикалом, вибраним з водню, галоген-, С1-6алкіл- і С1-6алкоксирадикалів. 5. Сполука за пунктами 1, 2 і 4, де n є l; m є 0 або 1; є 0, 1 або 2; кожен C 1 2 Qє ; R є -C(O)NH(OH); R є воднем; -L- є безпосереднім зв'язком; R4 є воднем; 5 A R є воднем; є радикалом, вибраним з (а1), (а-20), (а-27), (а-28), (а-29), (а-41) та (а-42); кожен s незалежно від інших є 0, 1 або 2; та кожен R6 незалежно від інших є радикалом, вибраним з водню, галоген-, C1-6алкіл- і C1-6алкоксирадикалів. 6. Сполука за пунктами 1, 2, 4 і 5, де сполука є сполукою №3. Даний винахід стосується сполук, які проявляють здатність інігібірувати ферментативну активність гістон-деацетилази (ГДАЦ). Далі він стосується процесів їх о тримання, композицій, що їх містять, а також їх застосування, як in vitro, так і in vi vo, для інгібірування ГДАЦ та як ліків, наприклад, ліків, що інгібірують проліферативні стани, такі як рак і псоріаз. В усі х е укаріотичних клітинах ДНК геному у хроматині зв’язується з гістонами, утворюючи нуклеосоми. Кожна нуклеосома складається з протеїнового октамера, що містить по дві молекули кожного з гістонів H2A, H2B, H3 і H4. ДНК накручується на цю протеїнову серцевину, причо 10 O N N H N H N N HO O сполука 3. 7. Фармацевтична композиція, що містить фармацевтично прийнятні носії і як активну складову терапевтично ефективну кількість сполуки за пунктами 1-6. 8. Спосіб приготування фармацевтичної композиції, за пунктом 7, за яким фармацевтично прийнятні носії і сполуку за пунктами 1-6 ретельно перемішують. 9. Сполука, заявлена у будь-якому з пунктів 1-6, призначена для використання як ліків. 10. Використання сполуки за будь-яким з пунктів 16 для виробництва засобу лікування хвороб, пов'язаних з розростанням клітин пухлин. 11. Спосіб отримання сполуки за пунктом 1, що характеризується тим, що піддають реакції проміжний продукт формули (II) з відповідною кислотою, такою як, наприклад, трифтороцтова кислота (CF3COOH), що призводить до утворення гідроксамової кислоти формули (I-а), де R1 є C(O)NH(OH) O O O N H R4 Q O (CH 2)n X L (CH 2)m N Y N C A (CR 32)t CF 3COOH R5 R2 (II) O HO N H Q R4 (CH2 )n X L Y N O (CH2 )m N C (CR3 2)t A R5 (I-a) R . 12. Спосіб виявлення або визначення ГДАЦ у біологічному зразку, який являє собою (метод) виявлення або вимірювання кількісних характеристик утворення комплексу міченої сполуки, визначеної у п ункті 1, з ГДАЦ. 13. Композиція протиракових агентів і інгібітора ГДАЦ, заявлена у будь-якому з пунктів 1-6. 2 му основні амінокислоти гістонів взаємодіють з негативно зарядженими фосфатними групами ДНК. Найпоширеніша пост-трансляційна модифікація цих серцевинних гістонів - це оборотне ацетилування e-аміногруп збережених сильноосновних N-кінцевих залишків лізину. Стаціонарний стан ацетилування гістонів встановлюється внаслідок динамічної рівноваги між конкуруючими гістонацетилтрансферазою(ами) і гістондеацетилазою(ами), які ми тут називаємо "ГДАЦ". Ацетилування і деацетилування гістонів давно пов’язують з управлінням транскрипцією. Недавне клонування генів, які кодують різні гістонацетилтрансферази та гістон-деацетилази, дало 11 78033 можливість запропонувати пояснення зв’язку між ацетилуванням гістонів та управлінням транскрипцією. Оборотне ацетилування гістонів може призвести до перебудови хроматину і внаслідок цього діяти як механізм управління транскрипцією генів. Взагалі гіперацетилування гістонів полегшує експресію генів, тоді як їх деацетилування корелює з пригніченням транскрипції. Показано, що гістонацетилтрансферази діють як коактиватори транскрипції, тоді як гістон-деацетилази є учасниками процесів пригнічення транскрипції. Динамічна рівновага між ацетилуванням та деацетилуванням гістонів суттєва для нормального росту клітини. Інгібірування гістон-деацетилази призводить до зупинки клітинного циклу, диференціації клітин, апоптозу і зникнення перетвореного фенотипу. Тому інгібітори ГДАЦ можуть мати великий терапевтичний потенціал у лікуванні захворювань або станів, пов’язаних з розмноженням клітин [Marks et al. // Nature Reviews. - 2001. Cancer 1. – P. 194-202]. Вивчення інгібіторів гістон-деацетилаз (ГДАЦ) вказує на те, що ці ферменти насправді грають важливу роль у розмноженні та диференціації клітин. Інгібітор трихостатин А (ТСА) призводить до зупинки клітинного циклу на обох G1 і G2-стадіях, усуває перетворений фенотип різних клітинних ліній та викликає диференціацію клітин лейкемії Френда та інших клітин. Повідомлялося, що ТСА (і субероїланілід-гідроксамова кислота САГК) інгібірує ріст клітин, викликає кінцеву диференціацію та перешкоджає утворенню пухлин у мишей [Finnin et al. // Nature. – 1999. – 401. – P. 188-193]. Також повідомлялося, що трихостатин А допомагає при лікуванні фіброзу, наприклад, фіброзу печінки, та цирозу печінки [EP, 0827742, 11.03.1998]. [Патентна заявка WO, 01/38322, 31.05.2001] відкриває, серед інших, 10 інгібіторів гістондеацетилази загальної формули Cy-L1-Ar-Y1-C(O)NH-Z, приводячи композиції та методи лікування хвороб і станів, зв’язаних з розмноженням клітин. [Патентна заявка WO, 01/70675, 27,09.2001] відкриває інгібітори гістон-деацетилази, що мають формулу C y2-C y1-X-Y1-W та Cy-S(O)2-NH-Y3-W і далі приводить композиції та методи лікування хвороб і станів, зв’язаних з розмноженням клітин. Проблема, яку потрібно розв’язати, це забезпечення інгібіторами гістон-деацетилази, які мали б високу ферментну активність, а також сприятливі властивості, такі як клітинна активність та підвищене біонакопичування, головним чином біонакопичування при прийомі через рот, і мали б незначну побічну дію або не мали її зовсім. Нові сполуки даного винаходу вирішують вищеописані проблеми. Своєю будовою ці сполук відрізняються від тих, що були отримані раніше. Сполуки даного винаходу виявляють прекрасну ферментну активність інгібірування гістондеацетилази in-vitro. Ці сполуки мають сприятливі властивості щодо клітинної активності та специфі 12 чні властивості щодо інгібірування продовження клітинного циклу в обох реперних точках G1 і G2 (здатність до індукції p21). Сполуки даного винаходу показують хорошу метаболічну стійкість та високе біонакопичування, зокрема, біонакопичування при прийомі через рот. Даний винахід стосується сполук формули (I) (I) їх N-оксидних форм, солей фармацевтично прийнятних додатків та стереоізомерних форм, де: n є 0, 1, 2 або 3, і коли n є 0, мається на увазі безпосередній зв’язок; m є 0 або 1, і коли m є 0, мається на увазі безпосередній зв’язок; t є 0, 1, 2, 3 або 4, і коли t є 0, мається на увазі безпосередній зв’язок; кожен Q є азотом або кожен X є азотом або ; ; кожен Y є азотом або ; R1 є -C(O)NR8R9, -NHC(O)R10, -C(O)-C110 11 10 11 6алкіліденSR , -NR C(O)N(OH)R , -NR C(O)C 110 11 10 або іншою 6алкіліденSR , -NR C(O)C=N(OH)R Zn-хелатуючою гр упою, де: R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, гідроксиC1-6алкіл-, аміноC1-6алкіл- і аміноарил- радикалів; R10 є воднем, C1-6алкіл-, C16алкілкарбоніл-, арилC 1-6алкіл-, C 1-6алкілпіразиніл-, піридиноніл-, піролідиноніл- або метилімідазолілрадикалом; R11 є воднем або C1-6алкіл-радикалом; R2 є воднем, галоген-радикалом, гідроксилом, аміногрупою, нітрогрупою, C1-6алкіл-, C1-6алкокси-, трифторметилрадикалом, ди(C16алкіл)аміногрупою, гідроксаміногрупою або нафталінсульфонілпіразиніл-радикалом; -L- є безпосереднім зв’язком або двовалентним радикалом, вибраним з C1-6алкіліден-, C16алкіліденокси- радикалів, аміногрупи, карбонільної групи та амінокарбонільної групи; кожен R3 незалежно від інших представляє атом водню, і один атом водню може бути замінений на замісник, вибраний з арил-радикалів; R4 є воднем, гідроксилом, аміногрупою, гідроксиC1-6алкіл-, C1-6алкіл-, C1-6алкокси-, арилC16алкіл-, аміно карбоніл-, гідроксикарбоніл-, аміноC1-6алкіл-, амінокарбонілC1-6алкіл-, гідроксикарбонілC1-6алкіл-, гідроксамінокарбоніл-, C1C1-6алкіламіноC1-6алкіл- або 6алкоксикарбоніл-, ди(C1-6алкіл)аміноC1-6алкіл- радикалом; R5 є воднем, C1-6алкіл-, C3-10циклоалкіл-, гідроксиC1-6алкіл-, C1-6алкоксиC1-6алкіл-, ди(C16алкіл)аміноC 1-6алкіл- або арил- радикалом; є радикалом, вибраним з 13 78033 14 де кожен s незалежно від інших є 0, 1, 2, 3, 4 або 5; кожен R6 та R7 незалежно один від одного є радикалами, вибраними з водню; галогенрадикалів; гідроксилу; аміногрупи; нітрогрупи; тригалогенC1-6алкокси-; C1-6алкіл- радикалів; C1заміщених арилта C36алкіл-радикалів, радикалами; C1-6алкокси-; C110циклоалкілC1-6алкілкарбоніл-; C16алкоксиC 1-6алкокси-; 6алкоксикарбоніл-; C 1-6алкілсульфоніл-; цианоC 1гідроксиC1-6алкіл-; гідроксиC1-6алкокси6алкіл-; радикалів; гідроксиC1-6алкіламіногруп; аміноC16алкокси-; ди(C 1-6алкіл)аміно карбоніл- радикалів; ди(гідроксиC1-6алкіл)аміногруп; (арил)(C1ди(C1-6алкіл)аміноC1-6алкокси6алкіл)аміногруп; радикалів; ди(C1-6алкіл)аміноC1-6алкіламіногруп; ди(C1-6алкіл)аміноC1-6алкіламіноC1-6алкіл-; арилсульфоніл- радикалів; арилсульфоніламіногруп; арокси-; ароксиC1-6алкіл-; арилC2-6алкеніліден- радикалів; ди(C1-6алкіл)аміногруп; ди(C1-6алкіл)аміноC1радикалів; ди(C1-6алкіл)аміно(C16алкілди(C1-6алкіл)аміно(C16алкіл)аміногруп; ди(C16алкіл)аміноC 1-6алкіл-радикалів; ди(C16алкіл)аміноC 1-6алкіл(C 1-6алкіл)аміногруп; 6алкіл)аміноC 1-6алкіл(C 1-6алкіл)аміноC 1-6алкілрадикалів; аміносульфоніламіно(C1аміносульфоніламіно(C16алкіл)аміногруп; ди(C16алкіл)аміноC 1-6алкіл-радикалів; 6алкіл)аміносульфоніламіно(C 1-6алкіл)аміногруп; ди(C1-6алкіл)аміносульфоніламіно(C16алкіл)аміноC 1-6алкіл-радикалів; цианогрупи; тіофеніл--радикалу; тіофеніл-радикалів, заміщених ди(C1-6алкіл)аміноC1-6алкіл(C1-6алкіл)аміноC1ди(C1-6алкіл)аміноC1-6алкіл-, C16алкіл-, гідроксиC16алкілпіперазинілC 1-6алкіл-, 6алкілпіперазинілC 1-6алкіл-, гідроксиC 1-6алкоксиC 1ди(C16алкілпіперазинілC 1-6алкіл-, C16алкіл)аміносульфонілпіперазинілC 1-6алкіл-, C1-6алкоксипіперидинілC16алкоксипіперидиніл-, 6алкіл-, морфолінілC 1-6алкіл-, гідроксиC 1-6алкіл(C 1або ди(гідроксиC16алкіл)аміноC 1-6алкілрадикалами; ураніл6алкіл)аміноC 1-6алкілрадикалу; ураніл-радикалу, заміщеного гідроксиC16алкіл-радикалом; бензофураніл-; імідазоліл-; оксазоліл- радикалів; оксазоліл-радикалів, заміщених арил- та C1-6алкіл- радикалами; C16алкілтриазоліл-; тетразоліл-; піролідиніл-; піроліл; піперидинілC1-6алкокси-; морфолініл-; C 16алкілморфолініл-; морфолінілC 1-6алкокси-; морфолінілC1-6алкілрадикалів; морфолінілC1морфолінілC1-6алкіламіноC16алкіламіногруп; піперазиніл-; C1-6алкілпіперазиніл-; C16алкіл-; піперазинілC16алкілпіперазинілC 1-6алкокси-; 6алкіл-; нафталінсульфонілпіперазиніл-; нафталінсульфонілпіперидиніл-; нафталінсульфоніл-; C 1радикалів; C16алкілпіперазинілC 1-6алкілC16алкілпіперазинілC 1-6алкіламіногруп; C16алкілпіперазинілC 1-6алкіламіноC 1-6алкіл-; 6алкілпіперазинілсульфоніл-; аміносульфонілпіперазинілC1-6алкокси-; аміносульфонілпіперазиніл-; аміносульфонілпіперазинілC1-6алкіл-; ди(C1ди(C16алкіл)аміносульфонілпіперазиніл-; 6алкіл)аміносульфонілпіперазинілC 1-6алкіл-; гідроксиC1-6алкілпіперазиніл-; гідроксиC1C16алкілпіперазинілC 1-6алкіл-; 15 6алкоксипіперидиніл-; 78033 C1-6алкоксипіперидинілC1радикалів; піперидиніламіноC16алкіламіногруп; піперидиніламіноC 1-6алкіламіноC 16алкіл-радикалів; (C 1-6алкілпіперидиніл)(гідроксиC 1(C16алкіл)аміноC 1-6алкіламіногруп; 6алкілпіперидиніл)(гідроксиC 1-6алкіл)аміноC 1гідроксиC1-6алкоксиC16алкіламіноC 1-6алкіл-; гідроксиC1-6алкоксиC16алкілпіперазиніл-; 6алкілпіперазинілC 1-6алкіл- радикалів; (гідроксиC 1(гідроксиC1-6алкіл)(C16алкіл)(C 1-6алкіл)аміногруп; гідроксиC1-6алкіламіноC16алкіл)аміноC 1-6алкіл-; 6алкіл-; ди(гідроксиC 1-6алкіл)аміноC 1-6алкіл-; піролідинілC1-6алкіл-; піролідинілC1-6алкокси-; піразоліл-; тіопіразоліл- радикалів; піразоліл-радикалів, заміщених двома замісниками, вибраними з C16алкіл- і тригалогенC 1-6алкіл- радикалів; піридинілрадикалу; піридиніл-радикалів, заміщених C16алкокси-, арокси- або арил- радикалами; піримідиніл-; тетрагідропіримідинілпіперазиніл-; тетрагідропіримідинілпіперазинілC1-6алкіл-; хінолініл-; індоліл-; феніл- радикалу; феніл-радикалів, заміщених одним, двома або трьома замісниками, незалежно вибраними з галоген-радикалів, аміногрупи, нітрогрупи, C1-6алкіл-, C1-6алкокси-, гідроксиC14алкіл-, трифторметил-, трифторметокси-, гідроксиC1-4алкокси-, C1-4алкілсульфоніл-, C1C1-4алкоксикарбоніл-, амі4алкоксиC 1-4алкокси-, ноC1-4алкокси-, ди(C1-4алкіл)аміноC1-4алкокси- радикалів, ди(C1-4алкіл)аміногруп, ди(C14алкіл)амінокарбоніл-, ди(C 1-4алкіл)аміноC 1-4алкіл-, ди(C1-4алкіл)аміноC1-4алкіламіноC1-4алкіл- радикалів, ди(C1-4алкіл)аміно(C1-4алкіл)аміногруп, ди(C14алкіл)аміно(C 1-4алкіл)аміноC 1-4алкіл-радикалів, ди(C1-4алкіл)аміноC1-4алкіл(C1-4алкіл)аміногруп, ди(C1-4алкіл)аміноC1-4алкіл(C1-4алкіл)аміноC1аміносульфоніламіно(C14алкіл-радикалів, аміносульфоніламіно(C14алкіл)аміногруп, ди(C14алкіл)аміноC 1-4алкіл-радикалів, 4алкіл)аміносульфоніламіно(C 1-4алкіл)аміногруп, ди(C1-4алкіл)аміносульфоніламіно(C14алкіл)аміноC 1-6алкіл-радикалів, цианогрупи, піперидинілC1-4алкокси-, піролідинілC1-4алкокси-, аміносульфонілпіперазиніл-, аміносульфонілпіперазинілC1-4алкіл-, ди(C1ди(C14алкіл)аміносульфонілпіперазиніл-, 4алкіл)аміносульфонілпіперазинілC 1-4алкіл-, гідроксиC1-4алкілпіперазиніл-, гідроксиC1C14алкілпіперазинілC 1-4алкіл-, C1-4алкоксипіперидинілC14алкоксипіперидиніл-, гідроксиC1-4алкоксиC1-4алкілпіперазиніл-, 4алкіл-, гідроксиC1-4алкоксиC1-4алкілпіперазинілC1-4алкілрадикалів, (гідроксиC1-4алкіл)(C1-4алкіл)аміногруп, (гідроксиC1-4алкіл)(C1-4алкіл)аміноC1-4алкілрадикалів, ди(гідроксиC1-4алкіл)аміногруп, ди(гідроксиC1-4алкіл)аміноC1-4алкіл-, ураніл- радикалів, ураніл-радикалів, заміщених -CH=CHCH=CH-, піролідинілC1-4алкіл-, піролідинілC14алкокси-, морфолініл-, морфолінілC 1-4алкокси-, морфолінілC1-4алкіл- радикалами, морфолінілC1морфолінілC1-4алкіламіноC14алкіламіногрупами, піперазиніл-, C1-4алкілпіперазиніл-, C14алкіл-, піперазинілC14алкілпіперазинілC 1-4алкокси-, 4алкіл-, C 1-4алкілпіперазинілC 1-4алкіл- радикалами, C1-4алкілпіперазинілC1-4алкіламіногрупами, C14алкілпіперазинілC 1-4алкіламіноC 1-6алкіл-, тетрагі6алкіл 16 дропіримідинілпіперазиніл-, тетрагідропіримідинілпіперазинілC1-4алкіл- радикалами, піперидиніламіноC1-4алкіламіногрупами, піперидиніламіноC1(C14алкіламіноC 1-4алкіл-радикалами, 4алкілпіперидиніл)(гідроксиC 1-4алкіл)аміноC 1(C14алкіламіногрупами, 4алкілпіперидиніл)(гідроксиC 1-4алкіл)аміноC 14алкіламіноC 1-4алкіл-, піридинілC 1-4алкокси- радикалами, гідроксиC1-4алкіламіногрупами, гідроксиC1ди(C14алкіламіноC 1-4алкіл-радикалами, 4алкіл)аміноC 1-4алкіламіногрупами, амінотіадиазоліл-, аміносульфонілпіперазинілC1-4алкокси- радикалами або тіофенілC1-4алкіламіногрупами; кожен R6 та R7 може бути поміщений на атом азоту замість водню; арил у ви щеприведеній формулі це феніл або феніл, заміщений одним або двома замісниками, незалежно вибраними з галоген-, C1-6алкіл-, C1-6алкокси-, трифторметил- радикалів, цианогрупи та гідроксикарбоніл-радикалу. Термін "інгібітор гістон-деацетилази" уживається для означення сполуки, яка здатна взаємодіяти з гістон-деацетилазою та інгібірувати її активність, точніше, її ферментативну активність. Інгібірувати ферментативну активність гістондеацетилази означає зменшувати здатність гістондеацетилази усувати з гістону ацетильну гр упу. Краще, щоб таке інгібірування було специфічним, тобто щоб інгібітор гістон-деацетилази зменшував здатність гістон-деацетилази усувати з гістону ацетильну гр упу при концентрації, меншій від тієї концентрації інгібітора, що необхідна для виконання якоїсь іншої, не зв’язаної з обговорюваною, біологічної дії. У попередніх означеннях і далі "галоген" - це загальне позначення фтор-, хлор-, бром- та йодрадикалів; "C1-4алкіл-радикали" означає нерозгалужені і розгалужені насичені вуглеводневі радикали з кількістю атомів вуглецю від 1 до 4, такі як метил, етил, пропіл, бутил, 1-метилетил, 2метилпропіл та їм подібні; C1-6алкіл-радикали включають C1-4алкіл-радикали та їх вищі гомологи, що мають від 5 до 6 атомів вуглецю, наприклад, пентил, 2-метилбутил, гексил, 2-метилпентил та їм подібні; "C1-6алкіліден" означає двовалентні нерозгалужені і розгалужені насичені вуглеводневі радикали, що містять від 1 до 6 атомів вуглецю, такі як, наприклад, метилен, 1,2-етиліден, 1,3пропіліден, 1,4-бутиліден, 1,5-пентиліден, 1,6гексиліден та їх розгалужені ізомери, такі як 2метилпентиліден, 3-метилпентиліден, 2,2диметилбутиліден, 2,3-диметилбутиліден та їм подібні; "тригалогенC1-6алкіл" означає C1-6алкіл, що містить три однакових або різних галогензамісники, наприклад, трифторметил; "C26алкеніліден" означає двовалентні нерозгалужені та розгалужені вуглеводневі радикали, що містять один подвійний зв’язок та від 2 до 6 атомів вуглецю, наприклад, етеніліден, 2-пропеніліден, 3бутеніліден, 2-пентеніліден, 3-пентеніліден, 3метил-2-бутеніліден та їм подібні; "аміноарил" означає арил, заміщений аміногрупою; "C310циклоалкіл" включає циклічні вуглеводневі групи, що містять від 3 до 10 атомів вуглецю, такі як циклопропіл, циклобутил, циклопентил, циклопенте 17 78033 ніл, циклогексил, циклогексеніл, циклогептил, циклооктил та їм подібні. Термін "інша Zn-хелатуюча гр упа" означає груп у, що здатна взаємодіяти з іоном цинку, який може бути присутній у місці зв’язування фермента. Солі фармацевтично прийнятних додатків включають солі фармацевтично прийнятних додатків-кислот та солі фармацевтично прийнятних додатків-основ. Солі фармацевтично прийнятних додатків-кислот, згадані вище, це терапевтично активні нетоксичні сольові форми додатків-кислот, які здатні утворювати сполуки формули (I). Сполуки формули (I), що мають основні властивості, можуть бути перетворені у їх солі фармацевтично прийнятних додатків-кислот за допомогою обробки даної основної форми придатною кислотою. Придатні кислоти включають, наприклад, неорганічні кислоти, такі як галогеноводневі кислоти, наприклад, соляну або бромоводневу; сірчану; азотну; фосфорну та їм подібні кислоти; або органічні кислоти, такі як, наприклад, оцтову, трифтороцтову, пропіонову, гідроксиоцтову, молочну, піровиноградну, щавльову, малонову, янтарну (тобто бутандикарбонову), малеїнову, фумарову, яблучн у, винну, лимонну, метансульфонову, етансульфонову кислоти, бензолсульфокислоту, птолуолсульфокислоту, цикламову, саліцилову, паміносаліцилову, памоїнову та їм подібні кислоти. Сполуки формули (I), що мають кислотні властивості, можуть бути перетворені у їх солі фармацевтично прийнятних додатків-основ за допомогою обробки даних кислотних форм придатними органічними або неорганічними основами. Придатні сольові форми основ включають, наприклад, амонійні солі, солі лужних та лужноземельних металів, наприклад, літію, натрію, калію, магнію, кальцію, та їм подібні, солі органічних основ, наприклад, бензатіну, N-метил-D-глюкаміну, гідрабаміну та солі з амінокислотами, такими як, наприклад, аргінін, лізин та їм подібні. Термін "солі додатків-кислот або додатківоснов" також включає гідрати та сольватні форми, які здатні утворювати сполуки формули (I). Приклади таких форм це гідрати, алкоголяти та їм подібні. Термін "стереоізомерні форми сполук формули (I)", уживаний тут, означає всі можливі сполуки, утворені з тих самих атомів, зв’язаних тією ж самою послідовністю зв’язків, але різних тривимірних структур, які не переходять одна в одну, які можуть мати сполуки формули (I). Якщо не згадано або не вказано інше, хімічна назва сполуки включає суміш усіх можливих стереоізомерних форм, які може мати дана сполука. Передбачається, що всі стереоізомерні форми сполук формули (I), як у чистому вигляді, так і у суміші одна з одною, включені у сферу даного винаходу. N-оксидні форми сполук формули (I) означають ті сполуки формули (I), в яких один або кілька атомів азоту окислені до так званих N-оксидів, особливо ті N-оксиди, в яких N-окислені один або більше атомів азоту залишків піперидину, піперазину або піридазину. Деякі з сполук формули (I) можуть також існувати у таутомерних формах. Передбачається, що 18 такі форми, хоч явно вони й не вказані у вищеприведеній формулі, включені у сферу даного винаходу. У всіх випадках подальшого згадування терміну "сполуки формули (I)" мається на увазі, що він також включає солі фармацевтично прийнятних додатків та всі стереоізомерні форми. Передбачається, що використовувані тут терміни "гістон-деацетилаза" та "ГДАЦ" відносяться до будь-якого фермента з родини ферментів, що усувають ацетильні групи з e-аміногруп залишків лізину, що знаходяться на N-кінцях гістонів. Якщо відповідно до контексту не вказано інше, мається на увазі, що термін "гістон" означає будь-який гістоновий протеїн, у тому числі H1, H2A, H2B, H3, H4 і H5, будь-якого біологічного виду. Протеїни або генні продукти ГДАЦ людини включають, але не обмежуються ГДАЦ-1, ГДАЦ-2, ГДАЦ-3, ГДАЦ4, ГДАЦ-5, ГДАЦ-6, ГДАЦ-7, ГДАЦ-8, ГДАЦ-9 і ГДАЦ-10. Гістон-деацетилаза також може бути отримана з найпростіших або грибів. Перша група сполук, що викликають інтерес, це ті сполуки формули (I), для яких мають місце одне або кілька з наступних обмежень: а) n є 1; б) m є 0 або 1; в) t є 0,1 або 2; г) кожен Q є ; д) R1 є -C(O)NH(OH); е) R2 є воднем або C1-6алкілом; є) -L- є безпосереднім зв’язком; ж) R4 є воднем; з) R5 є воднем; і) є радикалом, вибраним з (а-1), (а-20), (а-25), (а-27), (а-28), (а-29), (а-41) та (а-42); ї) кожен s незалежно від інших є 0, 1, 2 або 3; й) кожен R6 незалежно від інших є радикалом, вибраним з водню, галоген-, C1-6алкіл- і C16алкокси- радикалів. Друга гр упа сполук, що викликають інтерес, це ті сполуки формули (I), для яких мають місце одне або більше з наступних обмежень: а) n є 1; б) m є 0 або 1; в) t є 0,1 або 2; г) кожен Q є ; д) R1 є -C(O)NH(OH); е) R2 є воднем; є) -L- є безпосереднім зв’язком; ж) R4 є воднем; з) R5 є воднем; і) є радикалом, вибраним з (а-1), (а20), (а-25), (а-27), (а-28), (а-29), (а-41) та (а-42); ї) кожен s незалежно від інших є 0, 1, 2 або 3; й) кожен R6 незалежно від інших є радикалом, вибраним з водню, галоген-, C1-6алкіл- і C16алкокси- радикалів. Третя група сполук, що викликають інтерес, це ті сполуки формули (I), для яких R1 є -C(O)NH(OH). Четверта група сполук, що викликають інтерес, це ті сполуки формули (I), для яких R1 є C(O)NH(OH) і -L- є безпосереднім зв’язком. П’ята група сполук, що викликають інтерес, це 19 78033 ті сполуки формули (I), для яких R1 є -C(O)NH(OH) і R2 є воднем. Шоста група сполук, що викликають інтерес, це ті сполуки формули (I), для яких R1 є C(O)NH(OH), R2 є воднем і -L- є безпосереднім зв’язком. Сьома група сполук, що викликають інтерес, це ті сполуки формули (I), для яких мають місце одне або більше з наступних обмежень: а) t є 0; б) m є 0; в) R1 є -C(O)NR8R9, -C(O)-C1-6алкіліденSR10, 11 NR C(O)N(OH)R10, -NR11C(O)C1- 6алкіліденSR10, NR11C(O)C=N(OH)R 10 або іншою Zn-хелатуючою групою, де R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, гідроксиC1-6алкіл- і аміноC1-6алкіл- радикалів; г) R2 є воднем, галоген-радикалом, гідроксилом, аміногрупою, нітрогрупою, C1-6алкіл-, C16алкокси-, трифторметил- радикалом або ди(C 16алкіл)аміногрупою; д) -L- є безпосереднім зв’язком або двовалентним радикалом, вибраним з C1-6алкіліден-, C16алкіліденокси- радикалів, аміногрупи та карбонільної групи; е) R4 є воднем, гідроксилом, аміногрупою, гідроксиC1-6алкіл-, C1-6алкіл-, C1-6алкокси-, арилC1амінокарбоніл-, аміноC1-6алкіл-, C16алкіл-, або ди(C1-6алкіл)аміноC16алкіламіноC 1-6алкіл6алкіл- радикалом; є) R5 є воднем; ж) є радикалом, вибраним з (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (а34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а41), (а-42), (а-44), (а-45), (а-46), (а-47), (а-48) та (а51); з) кожен s незалежно від інших є 0, 1, 2, 3 або 4; і) R6 є воднем; галоген-радикалом; гідроксилом; аміногрупою; нітрогрупою; тригалогенC1тригалогенC1-6алкокси-; C1-6алкіл-; C16алкіл-; 6алкокси-; C 1-6алкілкарбоніл-; C 1-6алкоксикарбоніл-; C1-6алкілсульфоніл-; гідросиC1-6алкіл-; арокси- радикалом; ди(C1-6алкіл)аміногрупою; цианогрупою; тіофеніл-; фуранілрадикалом; фуранілрадикалом, заміщеним гідроксиC1-6алкілрадикалом; бензофураніл-; імідазоліл-; оксазолілрадикалом; оксазоліл-радикалом, заміщеним арилта C1-6алкілрадикалами; C16алкілтриазоліл-; тетразоліл-; піролідиніл-; піроліл; морфолініл-; C1-6алкілморфолініл-; піперазиніл-; C1-6алкілпіперазиніл-; гідроксиC1-6алкілпіперазиніл; C1-6алкоксипіперидиніл-; піразоліл- радикалом; піразоліл-радикалом, заміщеним одним або двома замісниками, вибраними з C1-6алкіл- і тригалогенC1-6алкіл- радикалів; піридиніл-радикалом; піридиніл-радикалом, заміщеним C1-6алкокси-, арокси- або арил- радикалом; піримідиніл-; хінолініл-; індоліл-; феніл- радикалом або феніл-радикалом, заміщеним одним або двома замісниками, незалежно вибраними з галоген-, C1-6алкіл-, C16алкокси- і трифторметил- радикалів; 20 ї) R7 є воднем; галоген-радикалом; гідроксилом; аміногрупою; нітрогрупою; тригалогенC1тригалогенC1-6алкокси-; C1-6алкіл-; C16алкіл-; 6алкокси-; C 1-6алкілкарбоніл-; C 1-6алкоксикарбоніл-; C1-6алкілсульфоніл-; гідросиC1-6алкіл-; арокси- радикалом; ди(C1-6алкіл)аміногрупою; цианогрупою; піридиніл-; фенілрадикалом або фенілрадикалом, заміщеним одним або двома замісниками, незалежно вибраними з галоген-, C1-6алкіл-, C1-6алкокси- і трифторметил- радикалів; Восьма група сполук, що викликають інтерес, це ті сполуки формули (I), для яких мають місце одне або кілька з наступних обмежень: а) R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, гідроксиC16алкіл-, аміноC 1-6алкіл- і аміноарил- радикалів; б) R5 є воднем, C1-6алкіл-, C3-10циклоалкіл-, гідроксиC1-6алкіл-, C1-6алкоксиC1-6алкіл- або ди(C16алкіл)аміноC 1-6алкіл- радикалом; в) є радикалом, вибраним з (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (а34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а41), (а-42) та (а-44); г) R6 і R7 є радикалами, вибраними незалежно один від одного з водню; галоген-радикалів; гідроксилу; аміногрупи; нітрогрупи; тригалогенC1-6алкіл; тригалогенC1-6алкокси-; C1-6алкіл-; C1-6алкокси-; C1-6алкоксиC1-6алкокси-; C1-6алкілкарбоніл-; C1цианоC1-6алкіл-; гідроксиC16алкілсульфоніл-; 6алкіл-; гідроксиC 1-6алкокси- радикалів; гідроксиC 1аміноC1-6алкокси-; ди(C16алкіламіногруп; радикалів; ди(гідроксиC16алкіл)амінокарбоніл6алкіл)аміногруп; арил(C 1-6алкіл)аміногруп; ди(C 1радикалів; ди(C16алкіл)аміноC 1-6алкоксиарилсульфоніл6алкіл)аміноC 1-6алкіламіногруп; радикалів; арилсульфоніламіногруп; арокси-; арилC2-6алкеніліденрадикалів; ди(C1ди(C1-6алкіл)аміноC1-6алкіл-; 6алкіл)аміногруп; ди(C1-6алкіл)аміноC1-6алкіл(C1-6алкіл)аміноC16алкіл- радикалів; цианогрупи; тіофеніл-радикалу; тіофеніл-радикалів, заміщених ди(C16алкіл)аміноC 1-6алкіл(C 1-6алкіл)аміноC 1-6алкіл-, ди(C1-6алкіл)аміноC1-6алкіл-, C1або ди(гідроксиC16алкілпіперазинілC 1-6алкіл6алкіл)аміноC 1-6алкіл- радикалами; фураніл-; імідазоліл-; C1-6алкілтриазоліл-; тетразоліл-; піролідиніл-; піперидинілC1-6алкокси-; морфолініл-; C16алкілморфолініл-; морфолінілC 1-6алкокси-; морфолінілC1-6алкіл-; C1-6алкілпіперазиніл-; C1C16алкілпіперазинілC 1-6алкокси-; C16алкілпіперазинілC 1-6алкіл-; 6алкілпіперазинілсульфоніл-; аміносульфонілпіперазинілC1-6алкокси-; аміносульфонілпіперазиніл-; аміносульфонілпіперазинілC1-6алкіл-; ди(C1ди(C16алкіл)аміносульфонілпіперазиніл-; 6алкіл)аміносульфонілпіперазинілC 1-6алкіл-; гідроксиC1-6алкілпіперазиніл-; гідроксиC1C16алкілпіперазинілC 1-6алкіл-; C1-6алкоксипіперидинілC16алкоксипіперидиніл-; гідроксиC1-6алкоксиC1-6алкілпіперазиніл-; 6алкіл-; гідроксиC1-6алкоксиC1-6алкілпіперазинілC1-6алкілрадикалів; (гідроксиC1-6алкіл)(C1-6алкіл)аміногруп; 21 78033 (гідроксиC1-6алкіл)(C1-6алкіл)аміноC1-6алкіл-; піролідинілC1-6алкокси-; піразоліл-; тіопіразоліл- радикалів; піразоліл-радикалів, заміщених двома замісниками, вибраними з C1-6алкіл- і тригалогенC16алкіл- радикалів; піридиніл-радикалу; піридинілрадикалів, заміщених C1-6алкокси- або арил- радикалами; піримідиніл-; хінолініл-; індоліл-; фенілрадикалів; феніл-радикалів, заміщених одним, двома або трьома замісниками, незалежно вибраними з галоген-радикалів, аміногрупи, C1-6алкіл-, C1-6алкокси-, гідроксиC1-4алкіл-, трифторметил-, трифторметокси-, гідроксиC1-4алкокси-, C1аміноC1-4алкокси-, ди(C14алкоксиC 1-4алкокси-, радикалів, ди(C14алкіл)аміноC 1-4алкоксиди(C1-4алкіл)аміноC1-4алкіл-, 4алкіл)аміногруп, ди(C1-4алкіл)аміноC1-4алкіл(C1-4алкіл)аміноC1піперидинілC1-4алкокси-, піролідинілC14алкіл-, 4алкокси-, аміносульфонілпіперазиніл-, аміносульфонілпіперазинілC1-4алкіл-, ди(C1ди(C14алкіл)аміносульфонілпіперазиніл-, 4алкіл)аміносульфонілпіперазинілC 1-4алкіл-, гідроксиC1-4алкілпіперазиніл-, гідроксиC1C14алкілпіперазинілC 1-4алкіл-, C1-4алкоксипіперидинілC14алкоксипіперидиніл-, гідроксиC1-4алкоксиC1-4алкілпіперазиніл-, 4алкіл-, гідроксиC1-4алкоксиC1-4алкілпіперазинілC1-4алкілрадикалів, (гідроксиC1-4алкіл)(C1-4алкіл)аміногруп, (гідроксиC1-4алкіл)(C1-4алкіл)аміноC1-4алкіл-, піролідинілC1-4алкокси-, морфолінілC1-4алкокси-, морфолінілC1-4алкіл-, C1-4алкілпіперазиніл-, C1C14алкілпіперазинілC 1-4алкокси-, 4алкілпіперазинілC 1-4алкіл- радикалів, гідроксиC 1ди(гідроксиC1-4алкіл)аміногруп, 4алкіламіногруп, ди(C1-4алкіл)аміноC1-4алкіламіногруп, амінотіадиазоліл-, аміносульфонілпіперазинілC1-4алкоксирадикалів і тіофенілC1-4алкіламіногруп. Група кращих сполук складається з тих сполук формули (I), в яких R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, гідроксиC16алкіл-, аміноC 1-6алкіл- і аміноарил- радикалів; R5 є воднем, C1-6алкіл-, C3-10циклоалкіл-, гідроксиC1-6алкіл-, C1-6алкоксиC1-6алкіл- або ди(C16алкіл)аміноC 1-6алкіл- радикалом; є радикалом, вибраним з (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (а34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а41), (а-42) та (а-44); і кожен R6 і R7 вибрані незалежно один від одного з водню; галоген-радикалів; гідроксилу; аміногрупи; нітрогрупи; тригалогенC1-6алкіл-; тригалогенC1-6алкокси-; C1-6алкіл-; C1-6алкокси-; C1C1-6алкілкарбоніл-; C16алкоксиC 1-6алкокси-; цианоC1-6алкіл-; гідроксиC16алкілсульфоніл-; 6алкіл-; гідроксиC 1-6алкокси- радикалів; гідроксиC 1аміноC1-6алкокси-; ди(C16алкіламіногруп; радикалів; ди(гідроксиC16алкіл)амінокарбоніл6алкіл)аміногруп; арил(C 1-6алкіл)аміногруп; ди(C 1радикалів; ди(C16алкіл)аміноC 1-6алкоксиарилсульфоніл6алкіл)аміноC 1-6алкіламіногруп; радикалів; арилсульфоніламіногруп; арокси-; арилC2-6алкеніліденрадикалів; ди(C1 6алкіл)аміногруп; 22 ди(C1-6алкіл)аміноC1-6алкіл-; ди(C1-6алкіл)аміноC1-6алкіл(C1-6алкіл)аміноC16алкіл- радикалів; цианогрупи; тіофеніл-радикалу; тіофеніл-радикалів, заміщених ди(C16алкіл)аміноC 1-6алкіл(C 1-6алкіл)аміноC 1-6алкіл-, ди(C1-6алкіл)аміноC1-6алкіл-, C1або ди(гідроксиC16алкілпіперазинілC 1-6алкіл6алкіл)аміноC 1-6алкіл- радикалами; фураніл-; імідазоліл-; C1-6алкілтриазоліл-; тетразоліл-; піролідиніл-; піперидинілC1-6алкокси-; морфолініл-; C16алкілморфолініл-; морфолінілC 1-6алкокси-; морфолінілC1-6алкіл-; C1-6алкілпіперазиніл-; C1C16алкілпіперазинілC 1-6алкокси-; C16алкілпіперазинілC 1-6алкіл-; 6алкілпіперазинілсульфоніл-; аміносульфонілпіперазинілC1-6алкокси-; аміносульфонілпіперазиніл-; аміносульфонілпіперазинілC1-6алкіл-; ди(C1ди(C16алкіл)аміносульфонілпіперазиніл-; 6алкіл)аміносульфонілпіперазинілC 1-6алкіл-; гідроксиC1-6алкілпіперазиніл-; гідроксиC1C16алкілпіперазинілC 1-6алкіл-; C1-6алкоксипіперидинілC16алкоксипіперидиніл-; гідроксиC1-6алкоксиC1-6алкілпіперазиніл-; 6алкіл-; гідроксиC1-6алкоксиC1-6алкілпіперазинілC1-6алкілрадикалів; (гідроксиC1-6алкіл)(C1-6алкіл)аміногруп; (гідроксиC1-6алкіл)(C1-6алкіл)аміноC1-6алкіл-; піролідинілC1-6алкокси-; піразоліл-; тіопіразоліл- радикалів; піразоліл-радикалів, заміщених двома замісниками, вибраними з C1-6алкіл- і тригалогенC16алкіл- радикалів; піридиніл-радикалу; піридинілрадикалів, заміщених C1-6алкокси- або арил- радикалами; піримідиніл-; хінолініл-; індоліл-; фенілрадикалів; феніл-радикалів, заміщених одним, двома або трьома замісниками, незалежно вибраними з галоген-радикалів, аміногрупи, C1-6алкіл-, C1-6алкокси-, гідроксиC1-4алкіл-, трифторметил-, трифторметокси-, гідроксиC1-4алкокси-, C1аміноC1-4алкокси-, ди(C14алкоксиC 1-4алкокси-, радикалів, ди(C14алкіл)аміноC 1-4алкоксиди(C1-4алкіл)аміноC1-4алкіл-, 4алкіл)аміногруп, ди(C1-4алкіл)аміноC1-4алкіл(C1-4алкіл)аміноC1піперидинілC1-4алкокси-, піролідинілC14алкіл-, 4алкокси-, аміносульфонілпіперазиніл-, аміносульфонілпіперазинілC1-4алкіл-, ди(C1ди(C14алкіл)аміносульфонілпіперазиніл-, 4алкіл)аміносульфонілпіперазинілC 1-4алкіл-, гідроксиC1-4алкілпіперазиніл-, гідроксиC1C14алкілпіперазинілC 1-4алкіл-, C1-4алкоксипіперидинілC14алкоксипіперидиніл-, гідроксиC1-4алкоксиC1-4алкілпіперазиніл-, 4алкіл-, гідроксиC1-4алкоксиC1-4алкілпіперазинілC1-4алкілрадикалів, (гідроксиC1-4алкіл)(C1-4алкіл)аміногруп, (гідроксиC1-4алкіл)(C1-4алкіл)аміноC1-4алкіл-, піролідинілC1-4алкокси-, морфолінілC1-4алкокси-, морфолінілC1-4алкіл-, C1-4алкілпіперазиніл-, C1C14алкілпіперазинілC 1-4алкокси-, 4алкілпіперазинілC 1-4алкіл- радикалів, гідроксиC 1ди(гідроксиC1-4алкіл)аміногруп, 4алкіламіногруп, ди(C1-4алкіл)аміноC1-4алкіламіногруп, амінотіадиазоліл-, аміносульфонілпіперазинілC1-4алкоксирадикалів і тіофенілC1-4алкіламіногруп. Наступна група кращих сполук складається з тих сполук формули (I), в яких t є 0; m є 0; R1 є -C(O)NR8R9, -C(O)-C1-6алкіліденSR10, 23 78033 NR11C(O)N(OH)R10, -NR11C(O)C1- 6алкіліденSR10, NR11C(O)C=N(OH)R 10 або іншою Zn-хелатуючою групою, де R8 і R9 є радикалами, вибраними незалежно один від одного з водню, гідроксилу, гідроксиC1-6алкіл- і аміноC1-6алкіл- радикалів; R2 є воднем, галоген-радикалом, гідроксилом, аміногрупою, нітрогрупою, C1-6алкіл-, C1-6алкокси-, трифторметилрадикалом або ди(C16алкіл)аміногрупою; -L- є безпосереднім зв’язком або двовалентним радикалом, вибраним з C1-6алкіліден-, C16алкіліденокси- радикалів, аміногрупи та карбонільної групи; R4 є воднем, гідроксилом, аміногрупою, гідроксиC1-6алкіл-, C1-6алкіл-, C1-6алкокси-, арилC1амінокарбоніл-, аміноC1-6алкіл-, C16алкіл-, або ди(C1-6алкіл)аміноC16алкіламіноC 1-6алкіл6алкіл- радикалом; R5 є воднем; є радикалом, вибраним з (а-1), (а-3), (а4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (а34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а41), (а-42), (а-44), (а-45), (а-46), (а-47), (а-48) та (а51); кожен s незалежно від інших є 0, 1, 2, 3 або 4; R6 є воднем; галоген-радикалом; гідроксилом; аміногрупою; нітрогрупою; тригалогенC1-6алкіл-; тригалогенC1-6алкокси-; C1-6алкіл-; C1-6алкокси-; C1C1-6алкоксикарбоніл-; C16алкілкарбоніл-; 6алкілсульфоніл-; гідросиC 1-6алкіл-; арокси- радикалом; ди(C1-6алкіл)аміногрупою; цианогрупою; тіофеніл-; фуранілрадикалом; фуранілрадикалом, заміщеним гідроксиC1-6алкілрадикалом; бензофураніл-; імідазоліл-; оксазолілрадикалом; оксазоліл-радикалом, заміщеним арилта C1-6алкілрадикалами; C16алкілтриазоліл-; тетразоліл-; піролідиніл-; піроліл-; морфолініл-; C1-6алкілморфолініл-; піперазиніл-; C1-6алкілпіперазиніл-; гідроксиC16алкілпіперази-ніл-; C 1-6алкоксипіперидиніл-; піразоліл- радикалом; піразоліл-радикалом, заміщеним одним або двома замісниками, вибраними з C1-6алкіл- і тригалогенC1-6алкіл- радикалів; піридиніл-радикалом; піридиніл-радикалом, заміщеним C1-6алкокси- або арил- радикалом; піримідиніл-; хінолініл-; індоліл-; феніл- радикалом або фенілрадикалом, заміщеним одним або двома замісниками, незалежно вибраними з галоген-, C1-6алкіл-, C1-6алкокси- і трифторметил- радикалів; та R7 є воднем; галоген-радикалом; гідроксилом; аміногрупою; нітрогрупою; тригалогенC1 24 6алкіл-; тригалогенC1-6алкокси-; C1-6алкіл-; C1C1-6алкілкарбоніл-; C1-6алкоксикарбоніл-; C1-6алкілсульфоніл-; гідросиC1-6алкіл-; арокси- радикалом; ди(C1-6алкіл)аміногрупою; цианогрупою; піридиніл-; фенілрадикалом або фенілрадикалом, заміщеним одним або двома замісниками, незалежно вибраними з галоген-, C1-6алкіл-, C1-6алкокси- і трифторметил- радикалів. Група ще кращих сполук складається з тих сполук формули (I), в яких n є 1; m є 0 або 1; t є 0, 1 або 2; кожен Q є 6алкокси-; ; R1 є -(O)NH(OH); R2 є воднем або C14 6алкілом; -L- є безпосереднім зв’язком; R є воднем; R5 є воднем; є радикалом, вибраним з (а-1), (а-20), (а-25), (а-27), (а-28), (а-29), (а-41) та (а-42); кожен s незалежно від інших є 0, 1 або 2; та кожен R6 є радикалом, вибраним незалежно від інших з водню, галоген-, C1-6алкіл- і C1-6алкоксирадикалів. Наступна група ще кращих сполук складається з тих сполук формули (I), в яких n є 1; m є 0 або 1; t є 0, 1 або 2; кожен Q є ; R1 є -C(O)NH(OH); R 2 є воднем; -L- є безпосереднім зв’язком; R4 є воднем; R5 є воднем; є радикалом, вибраним з (а-1), (а-20), (а27), (а-28), (а-29), (а-41) та (а-42); кожен s незалежно від інших є 0, 1 або 2; та кожен R6 є радикалом, вибраним незалежно від інших з водню, галоген-, C1-6алкіл- і C1-6алкокси- радикалів. Найкращою сполукою є сполука №3: сполука 3 Сполуки формули (I) та їх фармацевтично прийнятні солі і N-оксиди, а також їх стереоізомерні форми можуть бути отримані традиційним шляхом. Приводимо приклад загального напрямку синтезу: а) Гідроксамові кислоти формули (I), де R 1 є C(O)NH(OH), назвемо ці сполуки сполуками фомули (I-a), можуть бути отримані внаслідок реакції проміжного продукту формули (II) з відповідною кислотою, такою як, наприклад, трифтороцтова кислота (CF3COOH). Дана реакція проводиться у відповідному розчиннику, такому як, наприклад, метанол. 25 78033 26 б) проміжні продукти формули (II) можуть бути отримані за допомогою реакції проміжного продукту формули (III) з проміжним продуктом формули (IV) в присутності відповідних реагентів, таких як моногідрохлорида N’-(етилкарбонімідоїл)-N,N диметил-1,3-пропандиаміну (ЕДХ) і 1-гідрокси-1Hбензотриазолу (ГОБТ). Реакція може бути проведена у відповідному розчиннику, такому як суміш ДХМ і ТГФ. в) проміжні продукти формули (III) можуть бути отримані за допомогою реакції проміжного продукту формули (V) з відповідною основою, такою як NaOH, в присутності відповідного розчинника, такого як етанол. Сполуки формули (I) також зручно отримувати, уживаючи метод твердофазного синтезу. В загальному випадку твердофазний синтез передбачає введення у реакцію синтезу проміжного продукту, що знаходиться на полімерній підкладці. З таким проміжним продуктом на полімерній підкладці можна провести багато стадій синтезу. Після кожної стадії проводиться відфільтровування смоли та багаторазове її промивання різноманітними розчинниками, що усуває її забруднення домішками. На кожній стадії смолу можна ділити на частини і вводити в реакцію наступної стадії з різними про міжними продуктами, синтезуючи таким чином багато різних сполук. На останній стадії процесу смола обробляється реагентом або піддається процесу, які відщеплюють смолу від зразка. Докладніше пояснення методик, які використовуються у хімії твердої фази, приводиться, наприклад, у [Bunin B. The Combinatorial Index. - Academic Press; Каталог і довідник з синтезу пептидів 1999 року фірми "Новабіохем". - Novabiochem AG, Швейцарія], обидва джерела приводяться тут як посилання. 27 78033 Сполуки формули (I) і деякі з проміжних продуктів мають у своїй структурі принаймні один стереохімічно активний центр. Цей стереохімічно активний центр може мати R- або S-конфігурацію. Сполуки формули (I), отримані внаслідок процесу, описаного тут вище, можуть являти собою рацемічну суміш енантіомерів, які можна відділити один від одного за допомогою відомих для цієї галузі хімії методик розділення. Рацемічні сполуки формули (I) можуть бути перетворені у відповідні діастереомерні сольові форми за допомогою реакції з відповідними хіральними кислотами. Дані діастереомерні сольові форми далі розділяють, наприклад, за допомогою вибіркової або фракційної кристаллізації, після чого енантіомери звільняються з них за допомогою лугу. Альтернативний спосіб розділення енантіомерних форм сполук формули (I) включає рідинну хроматографію з використанням хіральної стаціонарної фази. Такі чисті стереоізомерні форми можуть бути також отримані з відповідних чистих стереоізомерних форм відповідних вихідних матеріалів за умови, що реакція проводиться стереоспецифічно. Якщо бажано отримати конкретний стереоізомер, краще, щоб дана сполука синтезувалася за допомогою стереоспецифічних методів отримання. Ці методи зможуть реалізувати перевагу використання енантіомерно чистих ви хідних матеріалів. Сполуки формули (I) та їх фармацевтично прийнятні солі додатків-кислот і стереоізомерні форми мають цінні фармакологічні якості завдяки тому, що діють як інгібітори гістон-деацетилази (ГДАЦ). Винахід забезпечує метод інгібірування аномального росту клітин, у тому числі перетворених клітин, шляхом застосування ефективної кількості винайденої сполуки. Під аномальним ростом клітин розуміється ріст клітин, незалежний від звичайних механізмів регуляції (тобто втрата контактного інгібірування). Це включає інгібірування росту пухлини як безпосередньо, викликаючи зупинку росту, кінцеву диференціацію та (або) апоптоз ракових клітин, так і непрямо, завдяки інгібіруванню неоваскуляризації пухлин. Даний винахід також забезпечує метод інгібірування росту пухлин шляхом прописування ефективної кількості сполуки даного винаходу суб’єкту, наприклад, ссавцю (а конкретніше людині), який потребує такого лікування. Таким чином, цей винахід забезпечує метод інгібірування росту пухлин шляхом застосування ефективної кількості сполук, що становлять даний винахід. Приклади пухлин, що можуть бути інгібірувані, але не обмежуються нижчеприведеними, це рак легені (наприклад, аденокарцинома, у тому числі недрібноклітинний рак легені), різні види раку підшлункової залози (наприклад, карцинома підшлункової залози, така як, наприклад, карцинома ациноцитів), різні види раку кишечника (наприклад, карциноми прямої кишки, такої як, наприклад, аденокарцинома кишечника та аденома кишечника), рак простати, у тому числі прогресуючі стадії захворювання, пухлини крові лімфоїдного походження (наприклад, гостра лімфоцитарна лейкемія, лімфома клітин Б-типу, лімфома Беркіта), мієлоїдні лейкемії (наприклад, 28 гостра мієлогенна лейкемія (ГМЛ)), фолікулярний рак щитовидної залози, мієлодиспластичний синдром (МДС), пухлини мезенхімного походження (наприклад, фібросаркоми та рабдоміосаркоми), меланоми, тератокарциноми, нейробластоми, гліоми, доброякісний рак шкіри (наприклад, кератоакантоми), карцинома грудей (наприклад, прогресуючий рак грудей), карцинома нирки, карцинома яєчника, карцинома сечового міхура та епідермальна карцинома. Сполука згідно з даним винаходом може використовуватись для інших терапевтичних цілей, наприклад: а) збільшення чутливості пухлин щодо радіотерапії шляхом застосування сполуки згідно з винаходом перед, під час або після опромінення пухлини з метою лікування раку; б) лікування артропатій та остеопатологій, таких як ревматоїдні артрити, остеоартрити, ювенільні артрити, подагра, поліартрити, псоріатичні артрити, анкілозуючі спондиліти та системна червона вовчанка; в) інгібірування розмноження клітин гладкої мускулатури, у тому числі васкулярних проліферативних розладів, атеросклерозу та рестенозу; г) лікування запальних станів та шкірних станів, таких як виразкові коліти, хвороба Крона, алергічні риніти, хвороби "трансплантант проти господаря", кон’юнктивіти, астма, респіраторний дістрес-синдром дорослих (РДСД), хвороба Бехсета, відторгнення трансплантату, кропивниця, алергічний дерматит, місцеве облисіння, склеродерма, екзантема, екзема, дерматоміозит, прищі, діабет, системна червона вовчанка, хвороба Кавасакі, розсіяний склероз, емфізема, кістозний фіброз та хронічний бронхіт; д) лікування ендометріозу, фіброми матки, дисфункції маточної кровотечі та ендометрійної гіперплазії; е) лікуваня очної васкулярізації, у тому числі васкулопатії, що захоплює судини сітківки та судинної оболонки; є) лікування функційного порушення серцевої діяльності; ж) стримування імуносупресивних станів, наприклад, лікування ВІЛ-інфекції; з) лікування порушень ниркової діяльності; і) пригнічення ендокринних розладів; ї) стримування порушення глюконеогенезу; к) лікування нервової патології, наприклад, хвороби Паркінсона або нервової патології, що призводить до когнітивних розладів, наприклад, хвороби Альцгеймера або захворювань нейронів, зв’язаних з поліглутаміном; л) стримування нервово-м’язової патології, наприклад, амілотрофного латерального склерозу; м) лікування атрофії спинних м’язів; н) лікування інших патологічних станів, що піддаються лікуванню посиленням експресії гену; о) посилення генної терапії. Таким чином, даний винахід відкриває сполуки формули (I) для використання як ліків, а також використання цих сполук формули (I) для виробництва ліків для лікування одного або більшої кількості вищезгаданих станів. 29 78033 Сполуки формули (I), їх фармацевтично прийнятні солі додатків-кислот і стереоізомерні форми можуть мати цінні діагностичні властивості завдяки тому, що можуть використовуватись для виявлення або визначення ГДАЦ у біологічних зразках, у тому числі для виявлення або визначення комплексів, які ГДАЦ утворює з міченими сполуками. У методах виявлення або визначення можуть використовува тись сполуки, мічені такими мітками, як радіоізотопи, ферменти, флуоресцентні речовини, світловипромінюючі речовини тощо. Приклади радіоізотопів включають 125I, 131 I 3H та 14C. Ферменти звичайно піддаються виявленню після їх зв’язування з відповідним субстратом, що, в свою чергу, каталізує реакцію, яка може бути виявлена. Приклади таких ферментів це бетагалактозідаза, бета-глюкозідаза, лужна фосфатаза, пероксидаза і малат-дегідрогеназа, переважно пероксидаза хрону. Приклади світловипромінюючих речовин це люмінол, похідні люмінолу, люциферин, екворин та люцифераза. Біологічні зразки можна означити як тканини тіла або рідини тіла. Приклади рідин тіла це спинномозкова рідина, кров, плазма крові, сироватка крові, сеча, мокрота, слина та їм подібні. Беручи до уваги їх корисні фармакологічні властивості, сполуки, про які йдеться, можна сформувати у різні фармацевтичні форми з метою застосування. Для приготування фармацевтичних композицій даного винаходу ефективна кількість визначеної сполуки у формі солі додатку-основи або додаткукислоти як активний складник сполучається з фармацевтично прийнятним носієм, утворюючи з ним однорідну суміш. Цей носій може мати різноманітні форми в залежності від форми препарату, який передбачається прописувати. Ці фармацевтичні композиції бажано мати у формі одиничних доз, зручних, переважно, для перорального, ректального, підшкірного застосування або для парентеральної ін’єкції. У приготуванні композицій, наприклад, у вигляді пероральних доз можуть використовува тись будь-які звичайні фармацевтичні носії, такі як, наприклад, вода, гліколі, олії, спирти та їм подібні - у випадку рідких пероральних препаратів, таких як суспензії, сиропи, еліксири і розчини; або тверді наповнювачі, такі як крохмали, цукри, каолін, мастильні матеріали, зв’язуючі речовини, розділяючі чинники та їм подібні - у випадку порошків, пілюль, капсул і таблеток. Завдяки легкості їх уживання таблетки та капсули представляють собою найкращу форму одиничного орального дозування. У цьому випадку, очевидно, використовуються тверді фармацевтичні носії. Для парентеральних композицій носій звичайно буде являти собою стерильну воду, принаймні більша його частина, хоча в нього можуть бути включені інші складники, наприклад, для полегшення розчинення. Можна приготувати, наприклад, розчини, призначені для ін’єкцій, в яких носій являє собою розчин солі, розчин глюкози або суміш розчинів солі та глюкози. Можна також приготувати призначені для ін’єкцій суспензії, у цьому випадку можуть бути використані відповідні рідкі носії, суспендуючі агенти та їм подібні. У компози 30 ціях, зручних для підшкірного уживання, носій може містити чинник, що полегшує проникнення речовини через шкіру та (або) відповідний зволожуючий агент, а також відповідні додатки будь-якої природи у невеликих кількостях, які (додатки) не створюють значного шкідливого впливу на шкіру. Такі додатки можуть полегшувати підшкірне уживання і (або) допомагати у приготуванні бажаних композицій. Ці композиції можуть уживатися різними способами, наприклад, шляхом підшкірної ін’єкції, безпосереднього місцевого уживання або у ви гляді мазі. Особливо корисно формувати вищезгадані фармацевтичні композиції у вигляді окремих дозових форм для легкості уживання та однаковості доз. Термін "окрема дозова форма", використовуваний тут у специфікації та заявках, означає фізично окремі одиниці, зручні для того, щоб служити однаковими дозами, причому кожна одиниця містить наперед визначену кількість активного компоненту, розраховану для створення бажаного терапевтичного ефекту, з’єднану з необхідним фармацевтичним носієм. Прикладами таких окремих дозових форм служать таблетки (у тому числі таблетки з насічкою або з покриттям), капсули, пілюлі, пакетики з порошком, облатки, розчини або суспензії, призначені для ін’єкцій, дози у вигляді чайних ложок, столових ложок та їм подібні, та їх кількократні збільшення. Ті, хто має навички у цій галузі, можуть легко визначити ефективну кількість, користуючись результатами досліджень, представленими далі. Взагалі було помічено, що терапевтично ефективна кількість становить від 0,005мг/кг до 100мг/кг ваги тіла, а особливо від 0,005мг/кг до 10мг/кг ваги тіла. Може бути доцільним призначати необхідну дозу у ви гляді двох, трьох, чотирьох або більше субдоз, які приймають через відповідні проміжки часу протягом дня. Дані субдози можуть бути сформовані у вигляді окремих дозових форм, що містять, наприклад, від 0,5 до 500мг, особливо від 10мг до 500мг активного компоненту у окремій дозовій формі. Передбачається, що ще одним аспектом даного винаходу стане сполучення ГДАЦ-інгібітора з іншим протираковим засобом, особливо з метою застосування як ліку, особливо для лікування раку або подібних хвороб. Для лікування вищезгаданих станів сполуки даного винаходу можуть бути вигідно ужиті у сполученні з одним або більшою кількістю інших медичних засобів, конкретніше, інших протиракових засобів. Прикладами протиракових засобів є: - координаційні сполуки платини, наприклад, цисплатин, карбоплатин або оксаліплатин; - таксанові сполуки, наприклад, паклітаксел або доцетаксел; - інгібітори топоізомерази I, такі як камптотецинові сполуки, наприклад, іринотекан або топотекан; - інгібітори топоізомерази II, такі як протипухлинні похідні подофілотоксину, наприклад, етопозид або теніпозид; - протипухлинні алкалоїди барвінку, наприклад, вінбластин, вінкристин або вінорелбін; 31 78033 - протипухлинні нуклеозидні похідні, наприклад, 5-фторурацил, гемцитабін або капецитабін; - алкілуючі чинники, такі як азотна гірчиця або нітрозосечовина, наприклад, циклофосфамід, хлорамбуцил, кармустин або ломустин; - протипухлинні похідні антрацикліну, наприклад, даунорубіцин, доксорубіцин, ідарубіцин або мітоксантрон; - антитіла РЕЛ2, наприклад, трастуз умаб; - антагоністи рецепторів естрогену, або селективні модулятори рецепторів естрогену, наприклад, тамоксифен, тореміфен, дролоксифен, фаслодекс або ралоксифен; - інгібітори ароматази, такі як егземестан, анастрозол, летразол і ворозол; - чинники диференціації, такі як ретиноїди, вітамін D та чинники блокування метаболізму ретинової кислоти (ЧБМРК), наприклад, акутан; - інгібітори ДНК-метилтрансферази, наприклад, азацитидин; - інгібітори кінази, наприклад, флавоперидол, іматиніб-мезилат або гефітиніб; - інгібітори фарнезилтрансферази; або - інші інгібітори ГДАЦ. Термін "координаційні сполуки платини" уживається тут для позначення будь-якої координаційної сполуки платини, що інгібірує ріст клітин пухлини і у якій платина присутня у вигляді іону. Термін "таксанові сполуки" означає клас сполук, які містять таксанову кільцеву систему і зв’язані або отримуються з екстрактів певних видів тису (Ta xus). Термін "інгібітори топоізомерази" уживається для позначення ферментів, які здатні змінювати топологію ДНК у клітинах еукаріот. Вони надзвичайно важливі для виконання важливих клітинних функцій та розмноження клітин. У клітинах еукаріот зустрічаються топоізомерази двох класів, а саме тип I і тип II. Топоізомераза I це мономерний фермент з молекулярною вагою приблизно 100000. Фермент зв’язується з ДНК і викликає тимчасовий розрив одного з ланцюжків, розплітає подвійну спіраль (або дозволяє їй розплестись), а потім зшиває розрив перед тим, як відокремитись від ланцюжка ДНК. Механізм дії топоізомерази II подібний і включає індукування розривів ланцюжка ДНК або утворення вільних радикалів. Термін "камптотецинові сполуки" уживається для позначення сполук, які зв’язані або походять від вихідної сполуки камптотецину, що являє собою водонерозчинний алкалоїд, отримуваний з китайського дерева Camptothecin acuminata та індійського дерева Nothapodytes foetida. Термін "подофілотоксинові сполуки" уживається тут для позначення сполук, які зв’язані або походять від ви хідної сполуки подофілотоксину, яку екстрагують з рослини мандрагора. Термін "протипухлинні алкалоїди барвінку" уживається тут для позначення сполук, які зв’язані або походять з екстрактів рослини барвінку (Vinca rosea). Термін "алкілуючі чинники" включає різноманітні групи хімічних речовин, які мають спільну властивість, а саме, у фізиологічних умовах приєднувати алкільні групи до біологічно важливих 32 макромолекул, таких, як ДНК. У випадку більшості найважливіших чинників, таких як азотні гірчиці та нітрозосечовини, активні алкілуючі частки утворюються in vivo після складних реакцій розкладу, деякі з яких є ферментативними. Найважливіші фармакологічні дії алкілуючих чинників - ті, що порушують головні механізми, зв’язані з розмноженням клітин, зокрема синтез ДНК та поділ клітини. Здатність алкілуючих чинників перешкоджати функції та порушувати цільність ДНК у тканинах, що швидко ростуть, закладає підвалини їх терапевтичного застосування та багатьох з їх токсичних властивостей. Термін "протипухлинні похідні антрацикліну" включає антибіотики, отримувані з грибка Strep. peuticus var. caesius та їх по хідні, що характеризуються наявністю тетрациклінової кільцевої структури з незвичайним цукром, даунозаміном, приєднаним глікозидним зв’язком. Показано, що збільшення кількості протеїну рецептора чинника росту епідермісу людини 2 (РЕЛ2) у первинних карциномах грудей корелює з поганими клінічними прогнозами для певних пацієнтів. Трастузумаб це високоочищене гуманізоване моноклональне IgG1 каппа-антитіло, що походить від рекомбінантної ДНК і дуже сильно та специфічно зв’язується з зовнішньоклітинною частиною рецептора РЕЛ2. Багато видів раку грудей мають рецептори естрогену, який може посилювати ріст цих пухлин. Терміни "антагоністи рецепторів естрогену" та "селективні модулятори рецепторів естрогену" уживаються для позначення конкурентних інгібіторів зв’язування естрадіолу з рецепторами естрогену (РЕ). Селективні модулятори рецепторів естрогену, будучи зв’язані з РЕ, викликають зміну тривимірної форми рецептора, інгібіруючи його зв’язування з елементом ДНК, що створює відгук на естроген (ЕВЕ). У жінок після менопаузи головним джерелом циркулюючого естрогену є перетворення наднирникових та яєчникових андрогенів (андростендіону та тестостерону) у естрогени (естрон та естрадіол) у периферичних тканинах за допомогою фермента ароматази. Позбавлення естрогену внаслідок інгібірування або інактивації ароматази є ефективним та селективним лікуванням деяких пацієнтів після менопаузи, що мають гормон-залежний рак грудей. Термін "антиестрогенні чинники" уживається тут для позначення не тільки антагоністів та селективних модуляторів рецепторів естрогену, а також для інгібіторів ароматази згідно з обговореним вище. Термін "чинники диференціації" включають сполуки, які здатні різними шляхами стримувати розмноження клітин та викликати диференціацію. Відомо, що вітамін D і ретиноїди грають значну роль у регулюванні росту та диференціації широкої верстви типів нормальних та злоякісних клітин. Чинники блокування метаболізму ретинової кислоти (ЧБМРК) підви щують рівень ендогенної ретинової кислоти, сповільнюючи її катаболізм, що протікає за участю цитохрому P450. Зміни у метилуванні ДНК - одне з найпошире 33 78033 ніших порушень, що мають місце у новоутвореннях людини. Надмірне метилування у промоторах певних генів звичайно зв’язане з їх інактивацією. Термін "інгібітори ДНК-метилтрансферази" уживається для позначення сполук, які діють шляхом фармакологічного інгібірування ДНКметилтрансферази та реактивації експресії генасупресора пухлини. Термін "інгібітори кінази" включає сильнодіючі інгібітори кіназ, що беруть участь у продовженні клітинного циклу та запрограмованій смерті клітини (апоптозі). Термін "інгібітори фарнезилтрансферази" уживається для позначення сполук, що були створені з метою запобігання фарнезилуванню Ras та інших внутрішньоклітинних протеїнів. Показано, що вони впливають на розмноження і виживання злоякісних клітин. Термін "інші інгібітори ГДАЦ" включає, але не обмежується ними: - коротколанцюжкові жирні кислоти, наприклад, бутират, 4-фенілбутират, або вальпрову кислоту; - гідроксамові кислоти, наприклад, субероїланілід-гідроксамову кислоту (САГК), диарилгідроксамат A-161906, двокільцеві арил-Nгідроксикарбоксаміди, піроксамід, CG-1521, PXD101, сульфонамід-гідроксамову кислоту, L AQ-824, трихостатин A (ТС А), оксамфлатин, скриптаїд, бісгідроксамова кислота м-карбоксикоричної кислоти або аналог трапоксин-гідроксамової кислоти; - кільцеві тетрапептиди, наприклад, трапоксин, апіцидін, або депсипептид; - бензаміди, наприклад, MS-275 або CI-994, або - депудецин. Для лікування раку сполуки даного винаходу можуть бути прописані пацієнту як описано вище, у поєднанні з опромінюванням. Опромінювання означає використання іонізуючої радіації, зокрема гамма-радіації, особливо тієї, що випускається лінійними прискорювачами або радіонуклідами, які звичайно використовуються сьогодні. Опромінювання пухлини радіонуклідами може бути зовнішнім або внутрішнім. Даний винахід також стосується сполучень згідно з винаходом протиракових чинників та інгібіторів ГДАЦ згідно з винаходом. Даний винахід також стосується сполучення згідно з винаходом, призначеного для застосування у медичній терапії, наприклад, для стримування росту п ухлинних клітин. Даний винахід також стосується сполучень згідно з винаходом, призначених для стримування росту п ухлинних клітин. Даний винахід також стосується методу стримування росту пухлинних клітин суб’єкта-людини, який включає прописування суб’єкту ефективної кількості сполучення, згідного з винаходом. Даний винахід далі створює метод стримування аномального росту клітин, у тому числі перетворених, за допомогою прописування ефективної кількості сполучення, згідного з винаходом. Інший ліковий чинник та інгібітор ГДАЦ можуть бути прописані для уживання одночасно (напри 34 клад, у вигляді окремого або з’єднаного сполучення) або послідовно у будь-якому порядку. В останньому випадку дві складові частини будуть прийматись через проміжок часу, у кількостях та способом, які забезпечують досягнення сприятливого результату або синергічної дії. Зрозуміло, що кращий метод і порядок прописування та відповідні кількості та режими дозування для кожного складника сполучення будуть залежати від того, який конкретно інший ліковий чинник та інгібітор ГДАЦ будуть прописуватись, їх способу уживання, конкретної пухлини, яку лікують, та конкретного пацієнта. Найкращі метод і порядок прописування та кількості і режими дозування можуть бути легко визначені тими, хто має навички у галузі використання традиційних методів, та беручи до уваги інформацію, представлену тут. Координаційні сполуки платини добре прописува ти у дозах від 1 до 500мг на квадратний метр (мг/м 2) поверхні тіла, наприклад, від 50 до 400мг/м 2, зокрема цисплатин у дозах приблизно 75мг/м 2 та карбоплатин - приблизно 300мг/м 2 на курс лікування. Таксанові сполуки добре прописувати у дозах від 50 до 400мг на квадратний метр (мг/м 2) поверхні тіла, наприклад, від 75 до 250мг/м 2, зокрема паклітаксел у дозах приблизно від 175 до 250мг/м 2 та доцетаксел - приблизно від 75 до 150мг/м 2 на курс лікування. Камптотецинові сполуки добре прописувати у дозах від 0,1 до 400мг на квадратний метр (мг/м 2) поверхні тіла, наприклад, від 1 до 300мг/м 2, зокрема іринотекан у дозах приблизно від 100 до 350мг/м 2 та топотекан - приблизно від 1 до 2мг/м 2 на курс лікування. Протипухлинні похідні подофілотоксину добре прописувати у дозах від 30 до 300мг на квадратний метр (мг/м 2) поверхні тіла, наприклад, від 50 до 250мг/м 2, зокрема етопозид у дозах приблизно від 35 до 100мг/м 2 та теніпозид - приблизно від 50 до 250мг/м 2 на курс лікування. Протипухлинні алкалоїди барвінку добре прописувати у дозах від 2 до 30мг на квадратний метр (мг/м 2) поверхні тіла, зокрема вінбластин у дозах приблизно від 3 до 12мг/м 2, вінкристин у дозах приблизно від 1 до 2мг/м 2 та вінорелбін - приблизно від 10 до 30мг/м 2 на курс лікування. Протипухлинні нуклеозидні похідні добре прописувати у дозах від 200 до 2500мг на квадратний метр (мг/м 2) поверхні тіла, наприклад, від 700 до 1500мг/м 2, зокрема 5-фторурацил у дозах від 200 до 500мг/м 2, гемцитабін у дозах приблизно від 800 до 1200мг/м 2 та капецитабін - приблизно від 1000 до 2500мг/м 2 на курс лікування. Алкілуючи чинники, такі як азотну гірчицю або нітрозосечовину, добре прописувати у дозах від 100 до 500мг на квадратний метр (мг/м 2) поверхні тіла, наприклад, від 120 до 200мг/м 2, зокрема циклофосфамід у дозах приблизно від 100 до 500мг/м 2, хлорамбуцил у дозах приблизно від 0,1 до 0,2мг/кг, кармустин у дозах приблизно від 150 до 200мг/м 2 та ломустин у дозах приблизно від 100 до 150 мг/м 2 на курс лікування. Протипухлинні похідні антрацикліну добре прописувати у дозах від 10 до 75мг на квадратний 35 78033 метр (мг/м 2) поверхні тіла, наприклад, від 15 до 60мг/м 2, зокрема доксорубіцин у дозах приблизно від 40 до 75мг/м 2, даунорубіцин у дозах приблизно від 25 до 45мг/м 2 та ідарубіцин у дозах приблизно від 10 до 15мг/м 2 на курс лікування. Трастуз умаб добре прописувати у дозах від 1 до 5мг на квадратний метр (мг/м 2) поверхні тіла, зокрема від 2 до 4мг/м 2 на курс лікування. Антиестрогенні чинники добре прописувати у дозах приблизно від 1 до 100мг на день, в залежності від конкретного чинника та стану, який лікують. Тамоксифен добре прописувати перорально у дозах від 5 до 50мг, краще від 10 до 20мг двічі на день, продовжуючи лікування достатньо часу, щоб отримати та підтримувати терапевтичний ефект. Тореміфен добре прописувати перорально у дозах приблизно 60мг один раз на день, продовжуючи лікування достатньо часу, щоб отримати та підтримувати терапевтичний ефект. Анастрозол добре прописувати перорально у дозах приблизно 1мг один раз на день. Дролоксифен добре прописувати перорально у дозах приблизно 20-100мг один раз на день. Ралоксифен добре прописувати перорально у дозах приблизно 60 мг один раз на день. Егземестан добре прописувати перорально у дозах приблизно 25мг один раз на день. Ці дози можуть бути прописані, наприклад, один, два або більше разів на курс лікування, що може повторюватись, наприклад, кожні 7, 14, 21 або 28 днів. Беручи до уваги їх корисні фармакологічні властивості, складники сполучень згідно з винаходом, тобто інші ліковий чинник та інгібітор ГДАЦ, можуть бути сформовані у різноманітні фармацевтичні форми з метою прописування. Складники можуть бути сформовані у окремі фармацевтичні сполучення або у єдине фармацевтичне сполучення, що містить обидва складники. Отже даний винахід також стосується фармацевтичного сполучення, що містить інший ліковий чинник та інгібітор ГДАЦ разом з одним або більшою кількістю фармацевтичних носіїв. Даний винахід також стосується сполучення згідно з винаходом у формі фармацевтичної композиції, що містить протираковий чинник та інгібітор ГДАЦ згідно з винаходом разом з одним або більшою кількістю фармацевтичних носіїв. Даний винахід далі стосується використання сполучення згідно з винаходом у виробництві фармацевтичної композиції, призначеної для стримування росту пухлинних клітин. Даний винахід далі стосується продукту, що містить інгібітор ГДАЦ згідно з винаходом як перший активний складник та протираковий чинник як другий активний складник, як складеного препарату для одночасного, окремого або послідовного використання у лікуванні пацієнтів, хворих на рак. Експериментальна частина З метою ілюстрації наводимо наступні приклади. "БІНАФ" тут означає 2,2’-біс(дифенілфосфіно)1,1’-бінафтил, "Boc" означає третичний бутоксикарбоніл, "БСА" означає бичачий сироватковий альбумін, "ДХМ" означає дихлорметан, "ДІК" означає диізопропілкарбодиімід, "ДІЕА" означає диізопро 36 пілетиламін, "ДІПЕ" означає диізопропіловий ефір, "ДМАП" означає диметиламінопіридин, "ДМФ" означає диметилформамід, "ДМСО" означає диметилсульфоксид, "ЕДХ" означає моногідрохлорид N’-(етилкарбонімідоїл)-N,N-диметил-1,3пропандиаміну, "ЕДТК" означає етилендиамінтетраоцтову кислоту, "EtOAc" означає етилацетат, "ГЕПЕС" означає 4-(2-гідроксиетил)-1-піперазинетансульфонову кислоту, "ГОБТ" означає гідроксибензотриазол, "MeOH" означає метанол, "МТТ" означає бромід 3-(4,5-диметилтіазол-2-іл)-2,5дифеніл-2H-тетразолію, "НМП" означає Nметилпіролідинон, "СФБ" означає сольовий фосфатно-буферний, "ТЕА" означає триетиламін, "ТФО" означає трифтороцтову кислоту, "ТІС" означає триізопропілсилан, "ТГФ" означає тетрагідрофуран, "ТГП" означає тетрагідропіраніл та "ТМСОТф" означає триметилсиліл трифлат. А. Отимання проміжних продуктів Приклад А1 а) Отримання проміжного продукту 1 Суміш 4-метокси-2-хінолінкарбонової кислоти (0,00024моль; 1,2екв.), ДМФ (2мл), карбодиіміду, зв’язаного зі смолою, (0,200г; 2екв.) (постачальник: Аргонавт 800369) та 1-гідроксибензотриазолу (0,040г; 1,5екв.) у ДХМ (3мл) струшували 15хв. при кімнатній температурі. Додали етиловий ефір 6-(4аміно-1-піперидиніл)-3-піридинкарбонової кислоти (0,0002моль). Реакційну суміш стр ушували протягом 20год. при кімнатній температурі. Додали МПкарбонат (0,150г; 4,5екв.) (постачальник: Аргонавт 800267) і струшували реакційну суміш протягом 20год. при кімнатній температурі. Суміш профільтрували, фільтрат випарували, отримавши проміжний продукт 1 (кількісний вихід). б) Отримання проміжного продукту 2 Суміш проміжного продукту 1 (максимум 0,0002моль) з гідроксидом натрію (1,5мл), ТГФ (4мл) і MeOH (1мл) перемішували протягом 6год. при 60°C, потім протягом вихідних при кімнатній температурі. Реакційну суміш нейтралізували 1 н HCl, потім додали ДХМ (4мл). Суміш профільтрували через екстрелют (постачальник "Ізолюту HMN" об’ємом 3мл: IST 800-0220-EM), фільтрат випарували, отимавши проміжний продукт 2 (кількісний 37 78033 вихід). в) Отримання проміжного продукту 3 N,N-диметил-4-піридинамін (0,018г) додали до ГОБТ, зв’язаного зі смолою (0,200г) (постачальник: Новабіохем 01-64-0425) у ДХМ/ДМФ 5/1 (6мл). Додали проміжний продукт 2 (максимум 0,0002моль) і струшували суміш протягом 15хв. Додали N,N’-метантетраїл-біс-2-пропіламін (0,070мл) і струшували реакційну суміш протягом 4год. при кімнатній температурі. Смолу відфільтрували і промили ДХМ (тричі), ДМФ (тричі), ДХМ (тричі), ДМФ (тричі) і ДХМ (тричі). До смоли додали розчин O-(тетрагідро-2H-піран-2-іл)гідроксиламіну (0,030г, 0,00026моль) у ДХМ (5мл) і струшували реакційну суміш протягом ночі при кімнатній температурі. Смолу відфільтрували, промили ДХМ (тричі), фільтрат випарували. Залишок розчинили у ДХМ (5мл). Додали зв’язані зі смолою тозилхлорид (0,100г) (постачальник: Аргонавт 800276) і морфолін (0,100г) (постачальник морфолінметилполістиролу HL: Новабіохем 01-640171). Реакційну суміш стр ушували протягом 48год. Смолу відфільтрували, промили ДХМ, фільтрат випарували, отримавши проміжний продукт 3 (кількісний вихід). Приклад А2 а) Отримання проміжного продукту 4 Розчин 2-нафталінкарбонілхлориду (0,0102моль) у ДХМ (40мл) додали при 0°C до суміші 4-(амінометил)-1-піперидинкарбонової кислоти, 1,1-диметилетилового ефіру (0,0093моль) і ТЕА (0,0158моль) у ДХМ (40мл). Суміш перемішували при кімнатній температурі протягом ночі, вилили у льодяну воду та екстрагували ДХМ. Органічний шар промили 10% K2CO3, висушили (MgSO4), профільтрували і випарували розчинник. Залишок (3,1г) кристалізували з диетилового ефіру. Осад відфільтрували і висушили, отримавши 2,52 г (74%) проміжного продукту 4, температура плавлення 153°C. б) Отримання проміжного продукту 5 Суміш проміжного продукту 4 (0,0068моль) з 3н. HCl (25мл) і ТГФ (5мл) перемішували при 80°C 38 протягом 12год., вилили у льодяну воду, підлужили NH4OH та екстрагували ДХМ. Органічний шар промили водою, висушили (MgSO4), профільтрували і випарували розчинник. Залишок (1г) кристалізували з диетилового ефіру/CH3CN. Осад відфільтрували і висушили, отримавши 0,8г (44%) проміжного продукту 5, температура плавлення 209°C. в) Отримання проміжного продукту 6 Гідрид натрію (0,0044моль) додали при 0°C до суміші проміжного продукту 5 (0,0029моль) з ТГФ (10мл) у струмені N2. Суміш перемішували протягом 1год. Додали розчин етилового ефіру 2(метилсульфоніл)-5-піримідинкарбонової кислоти (0,0035моль) у ТГФ (10мл). Суміш перемішували при кімнатній температурі протягом 2 годин, вилили у льодяну воду та екстрагували EtOAc. Органічний шар промили водою, висушили (MgSO4), профільтрували і випарували розчинник. Залишок кристалізували з CH3CN/диетилового ефіру. Осад відфільтрували і висушили, отримавши 0,56г проміжного продукту 6, температура плавлення 161°C. г) Отримання проміжного продукту 7 Суміш проміжного продукту 6 (0,0013моль) та гідроксиду натрію (0,0026моль) у етанолі (15мл) перемішували, використовуючи зворотний холодильник, протягом 12год., потім охолодили. Осад відфільтрували, промили диетиловим ефіром і висушили, отримавши 0,44г (83%) проміжного продукту 7. д) Отримання проміжного продукту 8 Розчин 1-гідроксибензотриазолу (0,0014моль) у ТГФ (10мл), а потім розчин моногідрохлориду N’(етилкарбонімідоїл)-N,N-диметил-1,3пропандиаміну (0,0014моль) у ДХМ (10мл) додали при кімнатній температурі до суміші проміжного продукту 7 (0,0011моль) і O-(тетрагідро-2H-піран2-іл)-гідроксиламіну (0,0014моль) у ДХМ (10мл) і ТГФ (10мл). Суміш перемішували при кімнатній 39 78033 температурі протягом 12год., вилили у воду та екстрагували ДХМ. Органічний шар відділили, висушили (MgSO 4), профільтрували і випарували розчинник. Залишок (0,9г) очистили за допомогою колонкової хроматографії на сілікагелі (елюент: CH2Cl2/CH3OH/NH4OH 97/3/0,1; 15-40мкм). Відібрали чисті фракції і випарували розчинник. Залишок (0,47г) кристалізували з диетилового ефіру/ДІПЕ. Осад відфільтрували і висушили, отримавши 0,4г проміжного продукту 8, температура плавлення 149°C. Б. Отимання кінцевих сполук Приклад Б1 а) Отримання смоли (1): Суміш смоли, що продається під маркою "Новабіохем 01-64-0261" (200мг, ємність: 0,94ммоль/г), моно-N-Boc-4-амінопіперидину (188мг) та ізопропоксиду титану (IV) (Ti(OiPr)4) (277мкл) у ДХМ (4мл) м’яко струшували протягом 90хв. при кімнатній температурі. Додали триацетоксиборогідрид натрію (199мг) і м’яко струшували реакційну суміш протягом ночі при кімнатній температурі, після чого смолу відфільтрували, один раз промили ДХМ, один раз MeOH, потім двічі ДХМ/10% ДІЕА, промили три рази спочатку ДХМ, після чого три рази метанолом, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH. У результаті була отримана смола, означена як смола (1), що використовується у наступній стадії реакції без подальшого очищення. б) Отримання смоли (2): Смола (1) була тричі промита ДХМ. До смоли (1) додали 2-нафталінкарбонілхлорид (175мг) у 4мл ДХМ і ДІЕА (307мкл), смолу м’яко струшували протягом ночі, відфільтрували, промили тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH. У результаті була о тримана смола (2), що використовується у наступній стадії реакції без подальшого очищення. в) Отримання смоли (3): Смола (2) була тричі промита ДХМ. До смоли (2) додали 4мл ТМСОТф - 2,6-лутидину (1М/1,5М) у ДХМ, смолу м’яко струшували протягом 3год. при кімнатній температурі, відфільтрували, промили тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH. У результаті була отримана смола (3), що використовується у наступній стадії реакції без подальшого очищення. 40 г) Отримання смоли (4): Смола (3) була тричі промита толуолом. До смоли (3) додали 4-бромметилбензоат (606мг) у 3мл толуолу, БІНАФ (117мг) і Cs 2CO3 (326мг), смолу м’яко струшували протягом 45хв. при кімнатній температурі у стр умені азоту. До реакційної суміші додали Pd(OAc)2 у 1мл толуолу. Смолу м’яко струшували протягом 18год. при 110°C у струмені азоту. Смолу відфільтр ували теплою, промили тричі ДМФ при 80°C, тричі H2O при 80°C, тричі ДМФ при 80°C, промили тричі ДМФ при кімнатній температурі, тричі H2O, тричі ДМФ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ. У результаті була о тримана смола (4), що використовується у наступній стадії реакції без подальшого очищення. д) Отримання смоли (5): Смола (4) була тричі промита НМП. До смоли (4) додали триметилсиланолат калію (KOSiMe3) (240мг) у 4мл НМП, смолу м’яко струшували протягом 24год. при 50°C, відфільтрували, промили тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH, тричі ДХМ, тричі MeOH. У результаті була отримана смола (5), що використовується у наступній стадії реакції без подальшого очищення. е) Отримання проміжного продукту 9: Смола (5) була тричі промита ДХМ. До смоли (5) додали 5мл ТФО/ТІС/ДХМ (5:2:93), смолу м’яко струшували протягом 2год. при кімнатній температурі, відфільтр ували, промили ДХМ. З фільтрату видули розчинник струменем азоту при 50°C, додали ДХМ (2мл) і видули розчинник струменем азоту при 50°C, додали ДХМ (2мл) і видули розчинник струменем азоту при 50°C. У результаті отримали вільну карбонову кислоту (проміжний продукт 30) у вигляді солі ТФО кількістю 58мг. є) Отримання смоли (6), метод А: Проміжний продукт 9 концентрували при 50°C у струмені азоту за допомогою тіонілхлориду (SOCl2) (1мл), додали ДХМ (2мл) і видули розчин 41 78033 ник струменем азоту при 50°C, додали ДХМ (2мл) і видули розчинник струменем азоту при 50°C. Додали ДХМ (3мл), розчин додали до ГОБТ, зв’язаного зі смолою (300мг, ємність: 1,3ммоль/г) (постачальник: Новабіохем 01-64-0425), до суміші додали 1мл 2,6-лутидину і 1мл ДХМ. Смолу м’яко струшували протягом 1год., відфільтрували, промили тричі ДМФ, тричі ДХМ, тричі ДМФ. У результаті була отримана смола (7), що використовується у наступній стадії реакції без подальшого очищення. ж) Отримання смоли (6), метод Б: Проміжний продукт 9 обробили ДХМ, NEt 3 і H2O і кількома краплями MeOH, висушили над екстрелютом (постачальник "Ізолюту HM-N" об’ємом 3мл: IST 800-0220-EM) і видули розчинник струменем азоту при 50°C. Тричі додали ДХМ (3мл) і видули розчинник струменем азоту при 50°C. Вільну основу розчинили у ДХМ/ДМФ 4мл/1мл і розчин додали до ГОБТ, зв’язаного зі смолою (300мг, ємність: 1,3ммоль/г) (постачальник: Новабіохем 01-64-0425), до суміші додали ДМАП (10мг). Смолу м’яко струшували протягом 15хв. при кімнатній температурі, додали ДІК (70мкл). Смолу м’яко струшували протягом 4год. при кімнатній температурі, відфільтрували, промили тричі ДМФ, тричі ДХМ, тричі ДМФ. У результаті була отримана смола (7), що використовується у наступній стадії реакції без подальшого очищення. з) Отримання проміжного продукту 10: До смоли (6) додали O-(тетрагідро-2H-піран-2іл)-гідроксиламін (60мг) у 4мл ДХМ, смолу м’яко струшували протягом 18год. при кімнатній температурі, відфільтрували, промили ДХМ (2мл), відфільтрували і видули розчинник струменем азоту при 50°C. У результаті отримали проміжний продукт 10. проміжний продукт 10 42 и) Отримання сполуки 1: Проміжний продукт 10 перемішували протягом ночі у 5% ТФО у MeOH (5мл), реакційну суміш вилили у 4мл H2O і NaHCO3 (300мг), продукт двічі екстрагували ДХМ (5мл), шар ДХМ висушили над MgSO4 , профільтрували і видули розчинник струменем азоту при 50°C. У результаті отримали кінцеву сполук у 1 у кількості 2,3мг. сполука 1 Приклад Б2 Отримання сполуки 2 Проміжний продукт 3 (максимум 0,0002 моль) перемішували у 5% CF3COOH/CH3OH (q.s.) протягом вихідних при кімнатній температурі. Розчинник випарували, отримавши (еталонна реакція): 0,058г (87% чистоти) сполуки 2. Приклад Б3 Отримання сполуки 3 Трифтороцтову кислоту (0,5мл) додали при 0°C до суміші проміжного продукту 8 (0,0006моль) у MeOH (5мл). Суміш довели до кімнатної температури, після чого перемішували протягом 48год. Осад відфільтрували, промили MeOH, диетиловим ефіром і висушили, отримавши 0,168г (65%) сполуки 3, температура плавлення 226°C. Табл. Е-1 перелічує сполуки, отримані згідно з одним з прикладів, приведених вище. У таблиці використовуються наступні скорочення: Сп.№ означає "Сполука №"; Пр.[Бn] означає той же самий метод, що був описаний у прикладах Бn. Деякі сполуки охарактеризовані температурою плавлення (т.пл.). 43 78033 44 Таблиця Е-1 Сп.№1; Пр.[Б1] Сп.№4; Пр.[Б1] Сп.№5; Пр.[Б1] Сп.№2; Пр.[Б2] Сп.№6; Пр.[Б2] Сп.№7; Пр.[Б2] Сп.№8; Пр.[Б2] Сп.№9; Пр.[Б2] Сп.№10; Пр.[Б2] Сп.№11; Пр.[Б2] Сп.№12; Пр.[Б2] Сп.№13; Пр.[Б2] Сп.№14; Пр.[Б2] Сп.№3; Пр.[Б3]; т.пл. 226°C 45 78033 В. Фармакологічний приклад Аналіз інгібірування пістон-деацетилази in vitro (див. Приклад В.1) вимірює кількісні показники інгібірування ферментативної активності ГДАЦ сполуками формули (I). Клітинна активність сполук формули (I) була визначена для пухлинних клітин A2780 за допомогою колориметричного аналізу токсичності або виживання клітин [Mosmann Tim // Journal of Immunological Methods. – 1983/ - 65. – P.55-63] (див. Приклад В.2). Кінетична розчинність у водному середовищі вимірює здатність сполуки залишатися у водному розчині при розведенні (див. Приклад В.3). Вихідні розчини у ДМСО розводять тим самим водним буферним розчинником у три послідовні стадії. Для кожного розведення нефелометром вимірюють мутність. Проникність ліку виражає його здатність пересува тися з одного середовища до іншого або через інше, а конкретно його здатність переноситись через кишкову мембрану у кровотік і (або) з кровотоку у місце призначення. Проникність (див. Приклад В.4) можна вимірювати за допомогою утворення фільтр-іммобілізованої штучної мембранної фосфоліпідної біверстви. У аналізі на фільтріммобілізованій штучній мембрані утворюється "сандвіч" з мікротитрувального планшету з 96 лунками і фільтрувального планшету з 96 лунками, так що кожна складена лунка розділяється на дві камери - з вихідним розчином внизу і прийомним розчином зверху, - розділених 125мкм мікрофільтрувальним диском (з 0,45мкм порами), покритим 2% (вага/об’єм) розчином диолеїлфосфатидилхоліну у додекані в умовах, за яких при контакті системи з водним буферним розчином всередині каналів фільтру утворюються багатоламелярні біверстви. Проникність сполук через цю штучну мембрану вимірюють у см/с. Мета полягає в тому, щоб визначити ліки, які проникають через паралельну штучн у мембрану при двох різних значеннях pH: 4,0 і 7,4. Виявлення сполук проводять методом УФ-спектрометрії при оптимальних довжинах хвиль між 250 та 500нм. Метаболізм ліків означає, що жиророзчинна ксенобіотична або ендобіотична сполука піддається ферментативному перетворенню у полярний(і) водорозчинний(і) метаболіт(и), що виводи(я)ться з організму. Головний орган метаболізму ліків це печінка. Продукти метаболізму часто менш активні, ніж вихідний лік, або неактивні. Однак деякі метаболіти можуть виявляти більшу активність або бути токсичними. Метаболізм ліку може включати процеси як "детоксикації", так і "токсикації". Одна з головних ферментних систем, які визначають здатність організму справлятися з ліками та хімікатами, представлена монооксигеназами (цитохром P450), що являють собою НАДФH-залежні ферменти. Метаболічну стійкість сполук можна визначити in vitro, використовуючи субклітинну тканину людини (див. Приклад В.5). Метаболічна стійкість сполук виражена тут у процентах ліку, метаболізованого після 15хв. витримування цієї сполуки з мікросомами. Кількості сполук визначали 46 за допомогою РХ-МС-аналізу. Супресор пухлин p53 у відповідь на пошкодження ДНК транскрипційно активує багато генів, у тому числі ген WAF1/CIP1. Продукт гену WAF1 молекулярною вагою 21кДа знаходять у комплексі, який включає цикліни, циклін-залежні кінази (ЦЗК) і ядерний антиген проліферуючи х клітин (ЯАПК), у нормальних (не перетворених) клітинах і уявляється, що цей продукт є універсальним інгібітором ЦЗК. Одним з наслідків зв’язування p21WAF1 з ЦЗК та інгібірування ЦЗК є запобігання ЦЗКзалежному фосфорилюванню та наступній інактивації протеїну Rb, що є істо тним для продовження клітинного циклу. Тому індукція p21WAF1 у відповідь на зіткнення клітини з інгібітором ГДАЦ є сильним і специфічним вказівником інгібірування продовження клітинного циклу в обох реперних точках G1 і G2. Здатність сполук викликати утворення p21WAF1 вимірювалась за допомогою твердофазного імуноферментного аналізу p21WAF1 (WAF1 ЕЛАЙЗА Онкогену). Аналіз p21WAF1 це "сандвичевий" імуноферментний аналіз з використанням як моноклональних антитіл мишей, так і поліклональних антитіл кроликів. Поліклональне антитіло кроликів, специфічне щодо протеїну WAF1 людини, іммобілізували на поверхні пластикових лунок, що постачаються у наборі. Весь p21WAF1, що міститься у зразку, що аналізується, зв’язується з іммобілізованним антитілом. Біотиніловане детектуюче моноклональне антитіло також розпізнає протеїн p21WAF1 людини і зв’язується з кожним p21WAF1, що був утриманий іммобілізованним антитілом. Детектуюче антитіло, у свою чергу, зв’язується з стрептавідіном, зв’язаним з пероксидазою хрону. Пероксидаза хрону каталізує перетворення хромогенного субстрату те траметилбензидину, внаслідок чого безбарвний розчин стає синім (або жовтим після додавання зупиняючого реагенту), причому інтенсивність кольору пропорційна кількості протеїну p21WAF1, зв’язаного з планшетом. Кількість забарвленого продукту реакції визначається за допомогою спектрофотометра. Визначення кількості досягається за допомогою побудови стандартної кривої з використанням відомих концентрацій p21WAF1 (постачається ліофілізованим) (див. Приклад В.6). Приклад В.1: Аналіз інгібірування гістондеацетилази in vitro Ядерні витяжки HeLa (постачальник: Біомол) витримували при концентрації 60мкг/мл з 2´10-8М радіоактивно міченим пептидним субстратом. Як субстрат для вимірювання активності ГДАЦ використовувався синтетичний пептид, а саме, амінокислоти 14-21 гістону H4. Субстрат був біотинілований на NH2-кінці з використанням спейсера 6аміногексанової кислоти, захищений на COOHкінці амідною групою і специфічно [3H]ацетилований на лізині 16. Субстрат, біотин-(6аміногексанова)Gly-Ala-([3H]-ацетил-L ys)-Arg-HisArg-Lys-Val-NH 2, додавали у буфер, що містив 25мМ ГЕПЕС, 1М цукрозу, 0,1мг/мл БСА і 0,01% Тритон X-100 при pH 7,4. Через 30хв. реакцію деацетилування зупиняли додаванням HCl і оцтової 47 78033 кислоти (кінцеві концентрації 0,035мМ і 3,8мМ відповідно). Після зупинки реакції вільний 3H-ацетат екстрагували етилацетатом. Після перемішування та центрифугування радіоактивність аліквотної частини верхньої (органічної) фази вимірювали bлічильником. Кожний експеримент проводили паралельно з контрольним розчином (що містив ядерну витяжку HeLa і ДМСО без сполуки), холостим витримуванням (з ДМСО але без ядерної витяжки HeLa і без сполуки) і зразком (що містив сполуку, розчинену у ДМСО і ядерну витяжку HeLa). Спочатку сполуки були досліджені при концентрації 10-5М. Якщо сполуки виявляли активність при 10 -5М, будували криву відгуку в залежності від концентрації, для чого проводили дослідження при концентраціях від 10-5М до 10-12 М. Для кожного дослідження значення, отримане для холостого витримування, віднімали від значень, отриманих у контрольному досліді і досліді із зразком. Контрольний зразок представляв 100% деацетилування субстрату. Для кожного зразка радіоактивність була представлена у вигляді відсотка від середнього значення контрольних дослідів. Коли це було доречно, розраховували значення IC50 (концентрація ліку, потрібна для зменшення кількості метаболітів до 50% від контрольної) з уживанням пробітного аналізу каліброваних даних. Результати для досліджених сполук представлені тут у вигляді pIC50 (негативного десяткового логарифму значення IC50). Усі досліджені сполуки виявили ферментну активність при контрольній концентрації 10-5 М і 13 сполук мали pIC50³5 (див. таблицю Е-2). Приклад В.2: Визначення антипроліферативної активності на клітинах A2780 Усі досліджені сполуки були розчинені у ДМСО і наступні розведення виконувались у середовищі клітинної культури. У аналізах на розмноження клітин кінцеві концентрації ДМСО ніколи не перевищували 0,1% (об’єм/об’єм). Контрольні зразки містили клітини A2780 і ДМСО без сполуки, а холості - ДМСО, але без клітин. МТТ розчиняли у СФБ у концентрації 5мг/мл. Приготували гліциновий буфер, що містив 0,1 М гліцин і 0,1М NaCl, забуферований до pH 10,5 за допомогою NaOH (1н) (усі реагенти були від фірми "Мерк"). Клітини карциноми яєчника людини A2780 (люб’язний подарунок др. Т.Ч. Гамільтона [Фоксчейський онкологічний центр, Пенсильванія, США]) були культивовані у середовищі RPMI 1640 з додаванням 2мМ L-глутаміну, 50мкг/мл гентаміцину і 10% фетальної телячої сироватки. Клітини зберігали згідно з загальновідомою методикою у вигяді моноверствових культур при 37°C у атмосфері зволоженого 5% CO2. Клітини пасирували один раз на тиждень уживаючи розчин трипсину/ЕДТК у split співвідношенні 1:40. Усі середовища та додатки були отримані від Лайф Текнолоджіз. Клітини були вільні від забруднення мікоплазмою, що було встановлено за допомогою набору генного зондування тканинних культур на мікоплазму (постачальник: БіоМерьє). Клітини були посіяні на культуральних планшетах NUNCTM з 96 лунками (постачальник: Лайф Текнолоджіз) і залишені на ніч, щоб могли прилип 48 нути до пластика. Густина посіву складала 1500 клітин на одну лунку при загальному об’ємі середовища 200мкл. Після прилипання клітин до планшетів середовище заміняли і додавали ліки і (або) розчинники (кінцевий об’єм 200мкл). Після чотирьох днів витримування середовище заміняли 200мкл свіжого середовища і визначали густину і життєздатність клітин за допомогою аналізу на основі МТТ. До кожної лунки додавали 25мкл розчину МТТ, після чого клітини витримували протягом 2год. при 37°C. Потім середовище обережно відсмоктували і синій МТТ-формазановий продукт солюбілізували додаванням 25мкл гліцинового буфера, а потім 100мкл ДМСО. Мікроаналітичні планшети струшували протягом 10хв. на струшувачі мікропланшетів, після чого на 540нм вимірювали поглинання за допомогою 96-лункового спектрофотометра Емакс (постачальник: Сопахем). У кожному експерименті результати для кожного набору умов експерименту являли собою середньоарифметичне для 3 відтворюваних лунок. Для початкового скринінгу сполуки були досліджені при одній сталій концентрації 10-6М. Для активних сполук експерименти повторювали, будуючи повну криву залежності відгуку від концентрації. Кожний експеримент проводили паралельно з контрольним зразком (без ліку), і холостим витримуванням (без клітин і ліків). Значення для холостого досліду віднімали від усіх значень для контрольних дослідів і дослідів із зразками. Для кожного зразка середнє значення росту клітин (у одиницях поглинання) було виражене у вигляді відсотка середнього значення росту клітин у контрольному досліді. Коли це було доречно, розраховували значення IC50 (концентрація ліку, потрібна для зменшення значення росту клітин до 50% від контрольного) з уживанням пробітного аналізу каліброваних даних [Finney D.J. Probit Analyses. 2 nd Ed. Chapter 10, Graded Responses. – Cambridge: Cambridge University Press, 1962]. Результати для досліджених сполук представлені тут у вигляді pIC50 (негативного десяткового логарифму значення IC50). Більшість досліджених сполук виявили клітинну активність при контрольній концентрації 10-6М і 12 сполук мали pIC50³5 (див. таблицю Е-2). Приклад В.3: Кінетична розчинність у водних середовищах На першій стадії розведення 10мкл концентрованого маточного розчину активної сполуки, солюбілізованої у ДМСО (5мМ), додавали до 100мкл фосфат-цитратного буферу з pH 7,4 і перемішували. На другій стадії розведення аліквотну частину (20мкл) першого розведення знову вводили у 100мкл фосфат-цитратного буферу з pH 7,4 і перемішували. У кінці, на третій стадії розведення, зразок (20мкл) другого розведення знову розводили у 100мкл фосфат-цитратного буферу з pH 7,4 і перемішували. Усі розведення проводили у 96лункових планшетах. Зразу після останнього розведення мутність трьох послідовних розведень вимірювали нефелометром. Для кожної сполуки розведення проводили тричі, для виключення випадкових помилок. На основі вимірювань мутності сполуки розділили на 3 класи. Сполуки з високою розчинністю отримали показник 3, для цих сполук 49 78033 перше розведення прозоре. Сполуки з середньою розчинністю отримали показник 2. Для цих сполук перше розведення непрозоре, а друге прозоре. Сполуки з низькою розчинністю отримали показник 1, для цих сполук перше і друге розведення непрозорі. Виміряли розчинність 52 сполук. З них 9 мали показник 3 і одна - показник 1 (див. таблицю Е-2). Приклад В.4: Паралельний аналіз проникності через штучну мембрану Маточні зразки (аліквотні частини об’ємом 10мкл маточного розчину з концентрацією 5мМ у 100% ДМСО) розводили у глибоколунковому планшеті або планшеті для попереднього змішування, що містив 2мл водної буферної системи з pH 4 або pH7,4 (концентрат системного розчину PSR4 (pION)). Перед тим, як додавати зразки до планшету порівняння, у лунки вводили 150мкл буферу і виконували холосте УФ-вимірювання. Після цього буфер видаляли і використовували планшет як планшет порівняння. Всі вимірювання проводили у плншетах, стійких щодо дії УФ-випромінювання (постачальник: Костар або Грейнер). Після проведення холостого вимірювання планшета порівняння 150мкл розведених зразків додавали до планшета порівняння і 200мкл розведених зразків додавали до вихідного планшета 1. Прийомний фільтрувальний планшет 1 (постачальник: Міліпор, тип: MAIP N45) покривали 4мкл розчину, що утворював штучн у мембрану (1,2диолеїл-sn-гліцер-3-фосфохолін у додекані, що містив 0,1% 2,6-ди-трет-бутил-4-метилфенолу), і клали зверху на вихідний планшет 1, утворюючи "сандвіч". У прийомні (верхні) лунки вводили буфер (200мкл). "Сандвіч" закривали кришкою і зберігали протягом 18год. при кімнатній температурі у темряві. Холосте вимірювання прийомного планшета 2 виконували, додаючи до лунок 150мкл буферу і проводячи УФ-вимірювання. Після проведення холостого вимірювання прийомного планшета 2 буфер видаляли і з прийомного фільтрувального планшета 1 до прийомного планшета 2 переносили 150мкл прийомного розчину. Потім прийомний фільтрувальний планшет 1 з "сандвічу" видаляли. Після холостого вимірювання вихідного планшета 2 (див. вище) 150мкл вихідного розчину переносили з вихідного планшета 1 до ви хідного планшета 2. Знімали УФ-спектри лунок вихідного планшета 2, прийомного планшета 2 і планшета порівняння (за допомогою СпектраМАКС 190). Усі спектри обробляли, розраховуючи проникність, за допомогою програмного забезпечення PSR4p Command. Вимірювання для всіх сполук проводили тричі. У кожному експерименті як стандарти використовували карбамазепін, гризеофульвін, ациклогуанізін, атенолол, фуроземід і хлортіазид. Сполуки розділили на три категорії: низької проникності (середній результат середній результат
ДивитисяДодаткова інформація
Назва патенту англійськоюCarbonyl amine derivatives as histone deacetylase inhibitors
Автори англійськоюVan Emelen Kristof, Verdonck Marc Gustaaf Celine, van Brandt Sven Franciscus Anna, Backx Leo Jacobus Jozef
Назва патенту російськоюКарбониламинопроизводные как ингибиторы гистондеацетилазы
Автори російськоюван Эмелен Кристоф, Вердонк Марк Густааф Селин, ван Брандт Свен Францискус Анна, Бакс Лео Якобус Йозеф
МПК / Мітки
МПК: C07D 401/12, C07D 295/155, C07D 211/58, C07D 207/09, C07D 307/68, C07D 413/04, C07D 295/14, C07D 409/12, A61P 29/00, C12Q 1/48, C07D 401/04, A61K 31/506, A61P 35/00, A61K 31/4709, C07D 213/78, C07D 239/42, C07D 217/02, C07D 207/14, C07D 295/26, A61K 31/4725, C07D 401/14, C07D 403/04, C07D 471/10, A61K 31/4545, A61K 31/451
Мітки: інгібітори, карбоніламінопохідні, гістондеацетилази
Код посилання
<a href="https://ua.patents.su/27-78033-karbonilaminopokhidni-yak-ingibitori-gistondeacetilazi.html" target="_blank" rel="follow" title="База патентів України">Карбоніламінопохідні як інгібітори гістондеацетилази</a>
Попередній патент: Сульфонілпохідні як інгібітори гістондезацетилази
Наступний патент: Пристрій для вимірювання коєфіцієнта незалежності відліків випадкових процесів
Випадковий патент: Застосування 1-[4-(5-ціаноіндол-3-іл)бутил]-4-(2-карбамоїлбензофуран-5-іл)-піперазину для лікування біполярних розладів та манії












