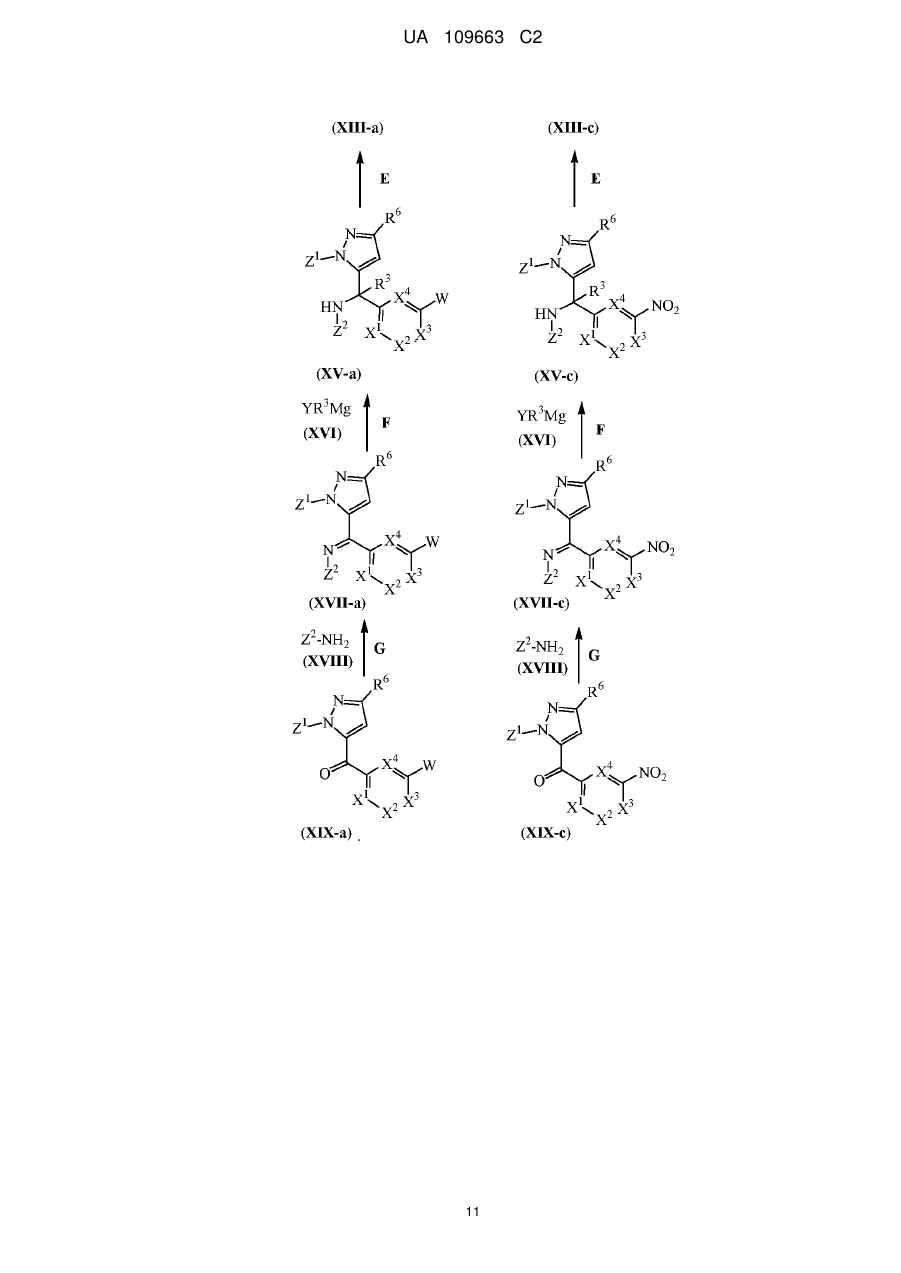
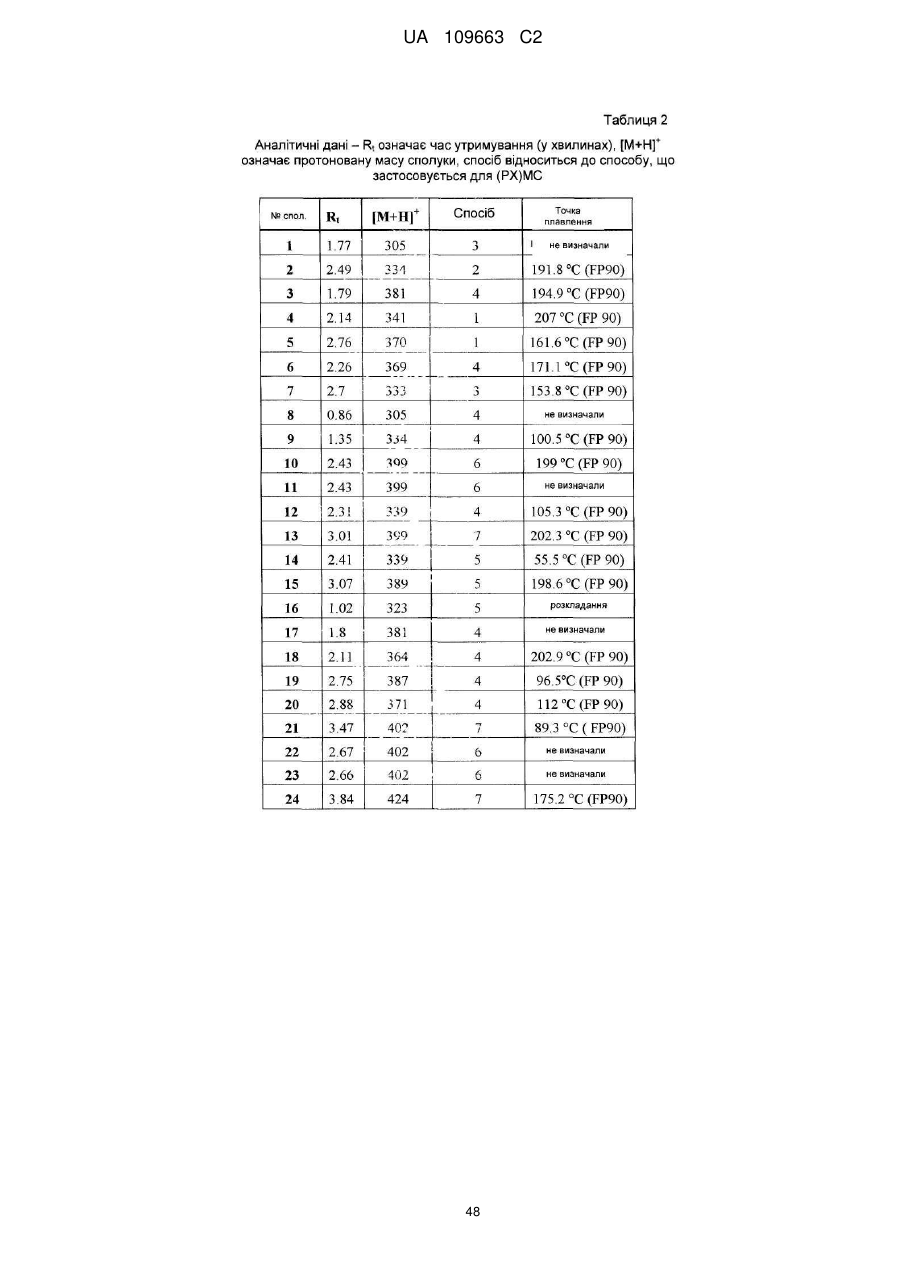
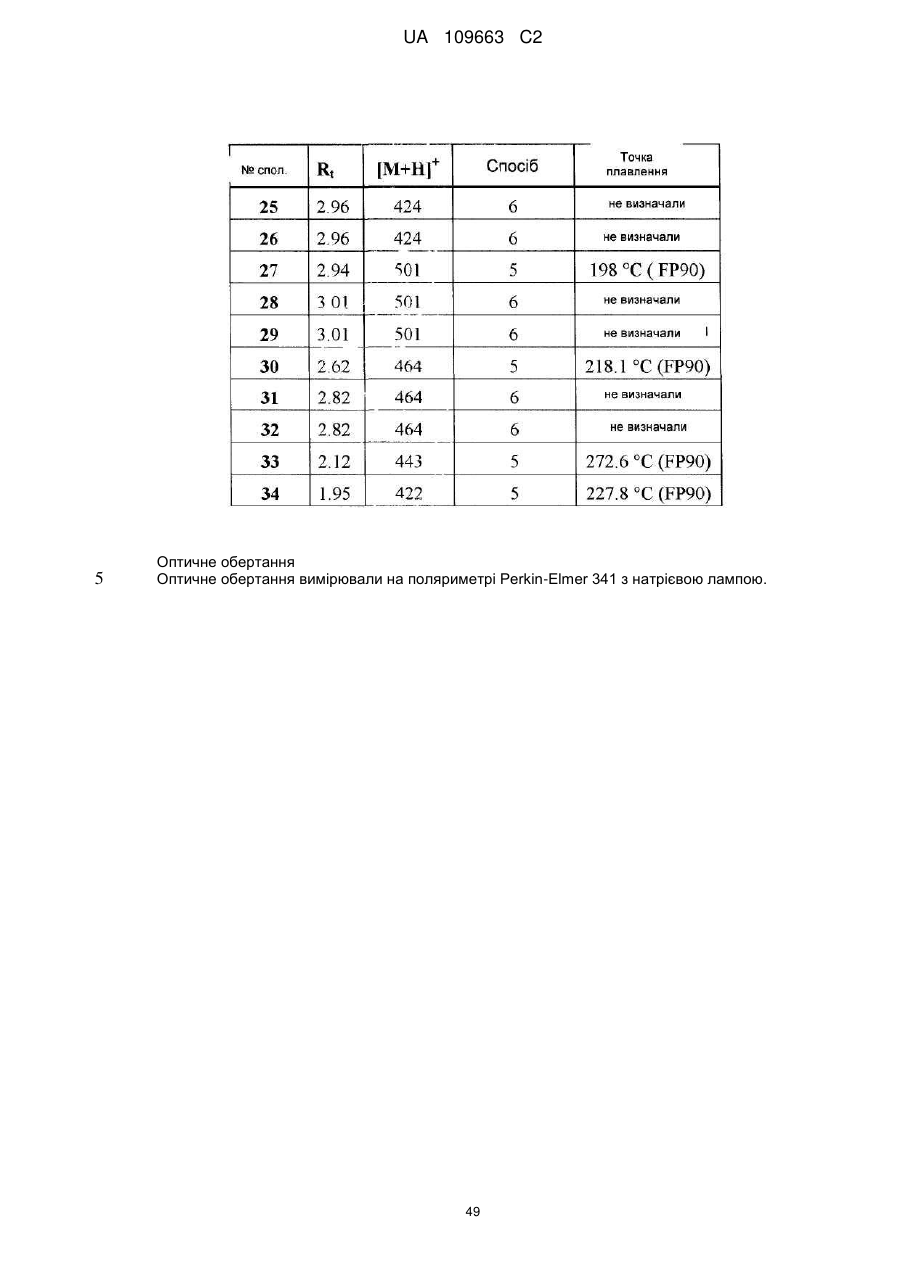
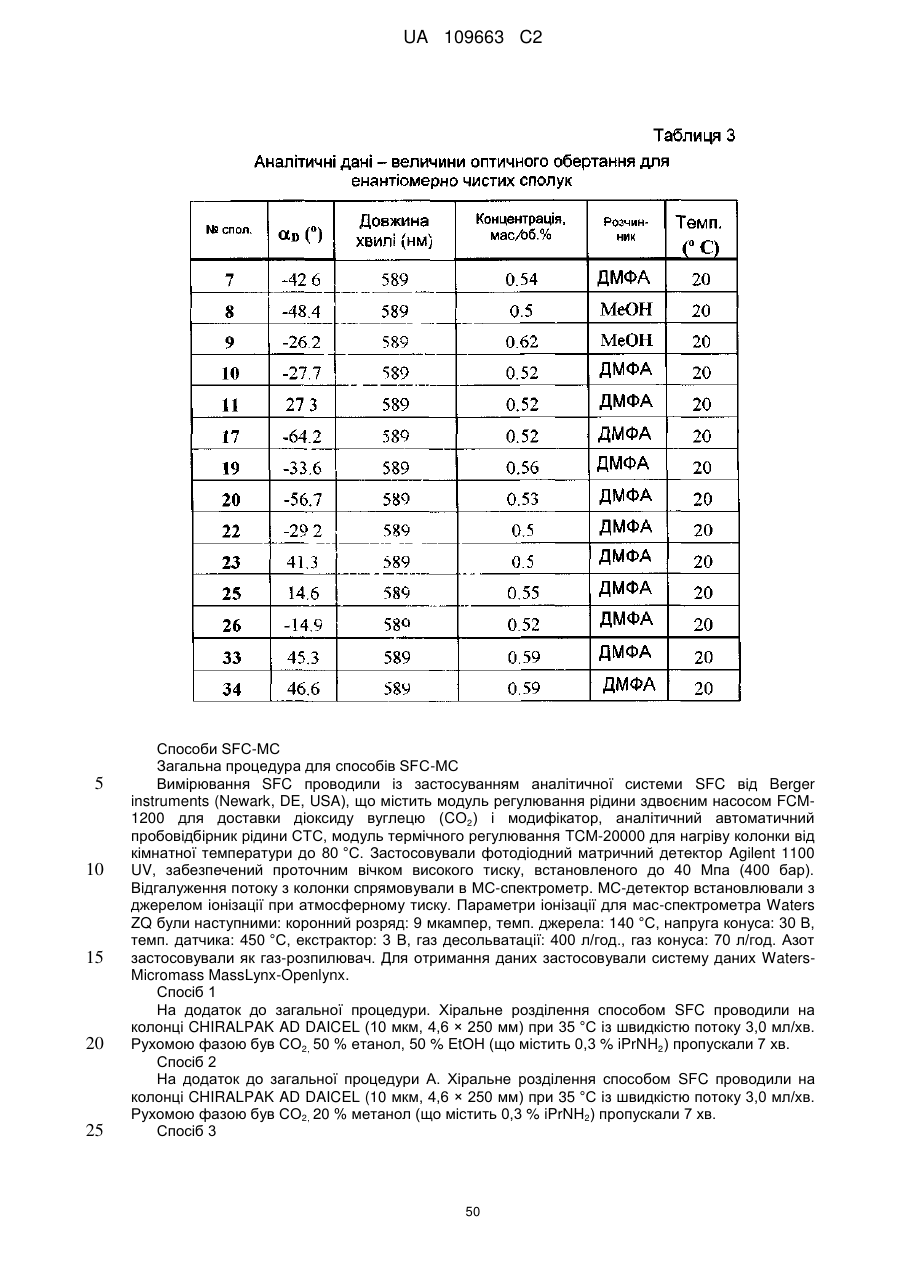
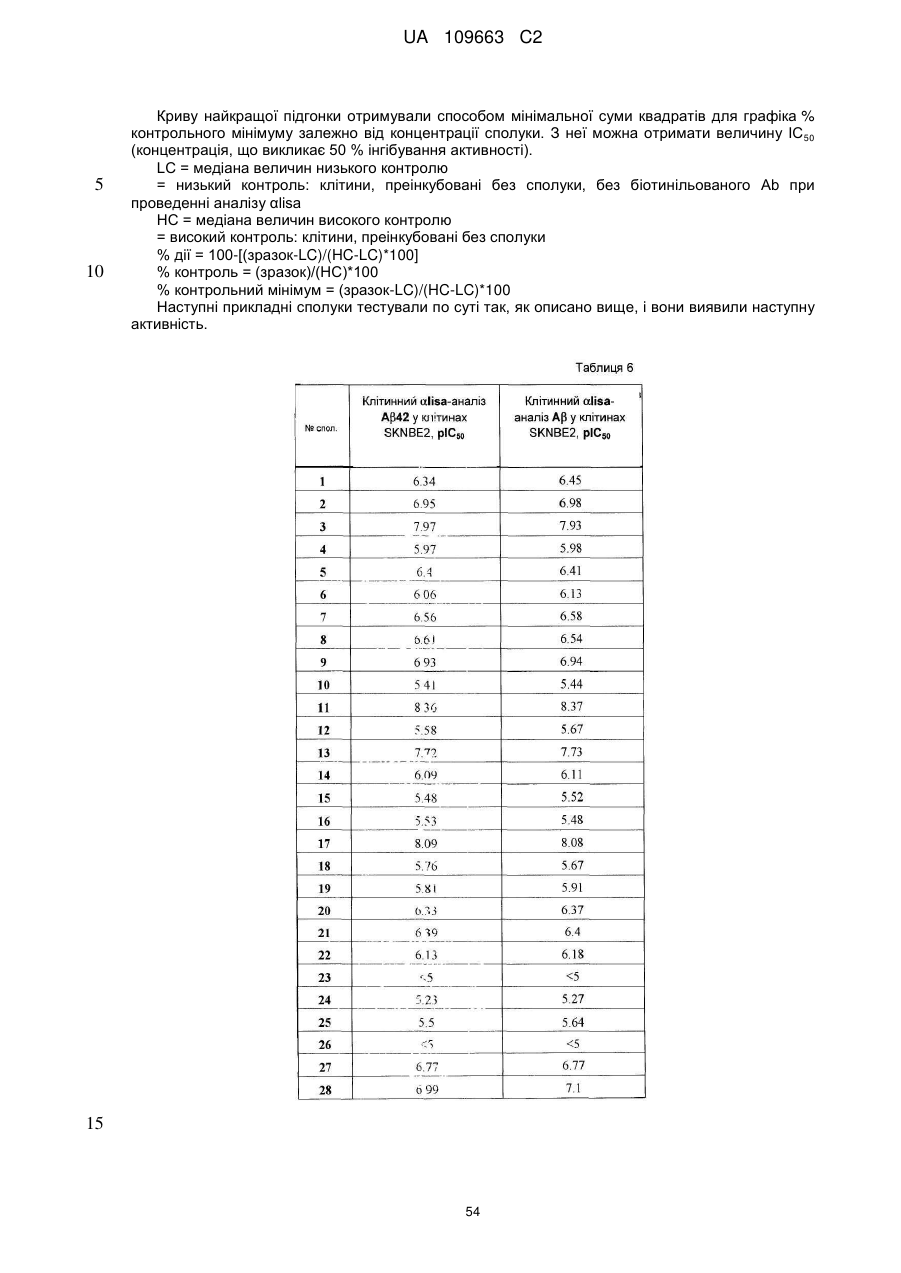
Похідні 4,7-дигідропіразоло[1,5-a]піразин-6-іламіну, що використовуються як інгібітори бета-секретази (васе)
Номер патенту: 109663
Опубліковано: 25.09.2015
Автори: Трабанко-Суарез Андрес Авеліно, Тресадерн Ґері Джон, Делгадо-Джіменез Франціска
Формула / Реферат
1. Сполука формули (І)
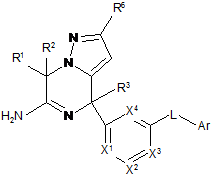 (І)
(І)
або її таутомерна або стереоізомерна форма, де
R1 і R2 є воднем;
R3 є метилом або циклопропілом;
X1, X2, X3, X4 є CН та, необов’язково, Х1 та Х3 можуть бути СF;
L є зв'язком або -N(R5)CO-, де R5 є воднем або С1-3алкілом;
R6 є воднем або трифторметилом;
Аr є гомоарилом або гетероарилом, за умови, що:
гомоарил є фенілом, необов’язково заміщеним одним або двома замісниками, вибраними з групи, що складається з галогену, ціано, С1-3алкілу, С1-3алкілокси, а
гетероарил є піридилом, піримідилом і піразилом, необов’язково заміщеними одним або двома замісниками, вибраними з групи, що складається з галогену, ціано, С1-3алкілу, С1-3алкілокси;
або її адитивна сіль або сольват.
2. Сполука за п. 1, в якій
R1 і R2 є воднем;
X1, X2, X3, X4 є CН та, необов’язково, Х1 та Х3 можуть бути СF;
L є зв'язком або -N(R5)CO-, де R5 с воднем;
Аr є гомоарилом або гетероарилом, за умови, що:
гомоарил є фенілом, необов’язково заміщеним одним або двома замісниками, вибраними з групи, що складається з галогену, ціано, С1-3алкілу, С1-3алкілокси, а
гетероарил є піридилом, піримідилом і піразилом, необов’язково заміщеними одним або двома замісниками, вибраними з групи, що складається з галогену, ціано, С1-3алкілу, С1-3алкілокси;
або її адитивна сіль або сольват.
3. Сполука за п. 1, в якій
R1 і R2 є воднем;
X1, X2, Х3, Х4 є СН;
L є зв'язком або -N(R5)CO-, де R5 є воднем;
Аr є гомоарилом або гетероарилом, за умови, що
гомоарил є фенілом, заміщеним хлором;
гетероарил є піридилом і піримідилом, необов'язково заміщеними одним або двома замісниками, вибраними з групи, що складається з хлору, фтору, ціано, метилу і метокси;
або її адитивна сіль або сольват.
4. Сполука за п. 1, в якій атом вуглецю, заміщений R3, має R-конфігурацію.
5. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4 і фармацевтично прийнятний носій.
6. Спосіб отримання фармацевтичної композиції за п. 5, який відрізняється тим, що фармацевтично прийнятний носій ретельно змішують з терапевтично ефективною кількістю сполуки за будь-яким з пп. 1-4.
7. Застосування сполуки за будь-яким з пп. 1-4 для лікування, запобігання або профілактики хвороби Альцгеймера (AD), помірного когнітивного розладу, старіння, деменції, деменції з тільцями Леві, синдрому Дауна, деменції, пов'язаної з інсультом, деменції, пов'язаної з хворобою Паркінсона, або деменції, пов'язаної з бета-амілоїдом.
8. Спосіб лікування порушення, вибраного з групи, що складається з хвороби Альцгеймера, помірного когнітивного розладу, старіння, деменції, деменції з тільцями Леві, синдрому Дауна, деменції, пов'язаної з інсультом, деменції, пов'язаної з хворобою Паркінсона, і деменції, пов'язаної з бета-амілоїдом, який передбачає введення суб'єктові, що потребує цього, терапевтично ефективної кількості сполуки за будь-яким з пп. 1-4 або фармацевтичної композиції за п. 5.
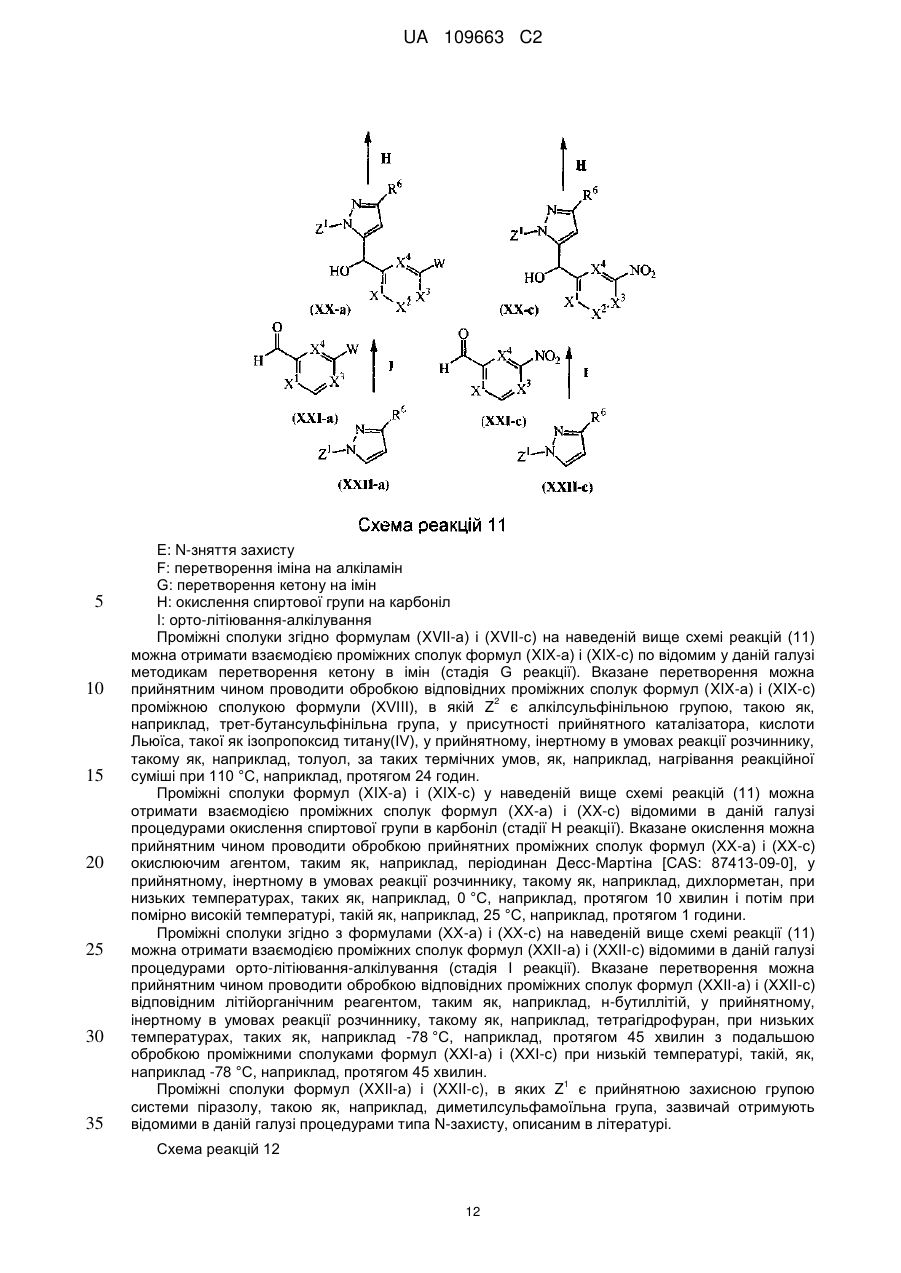
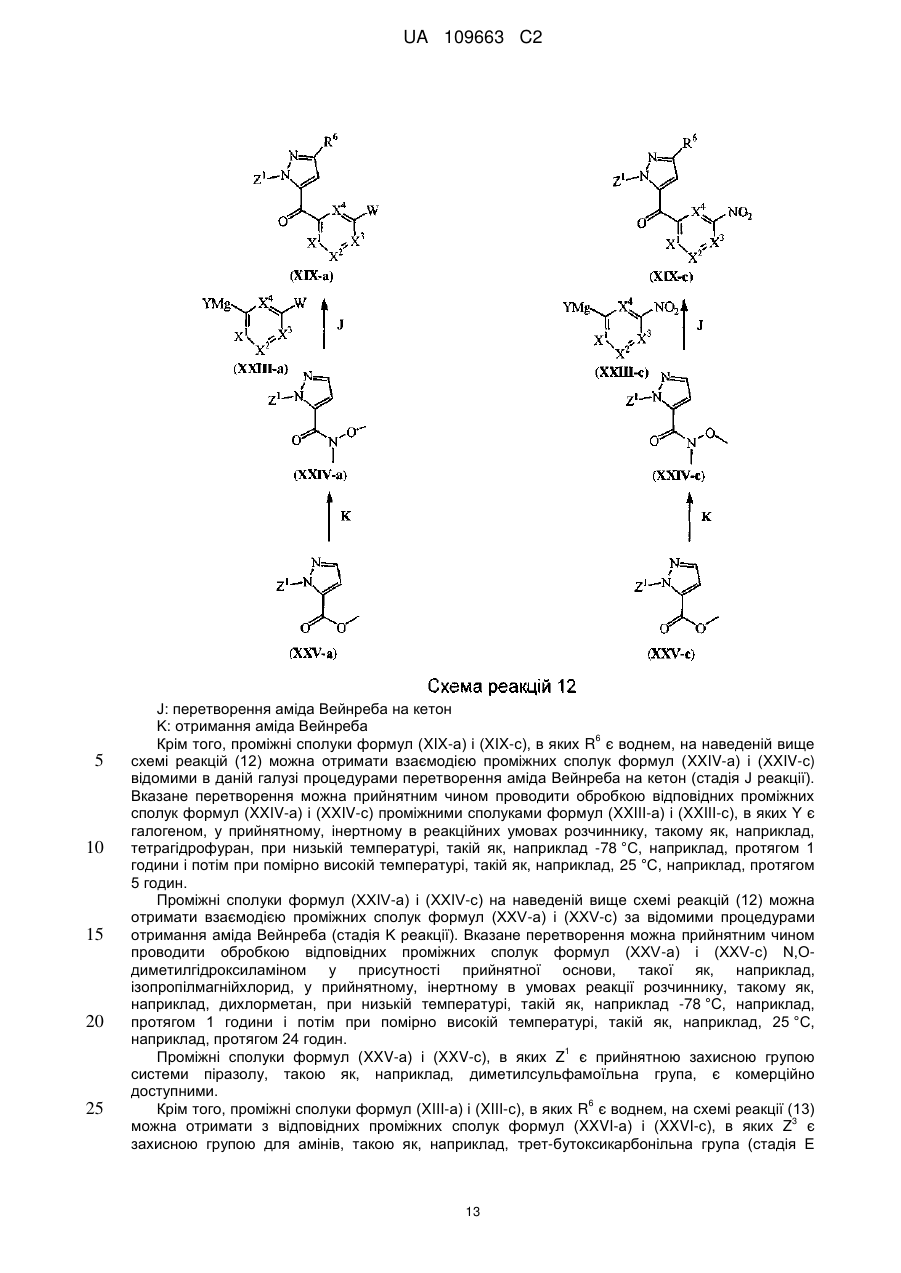
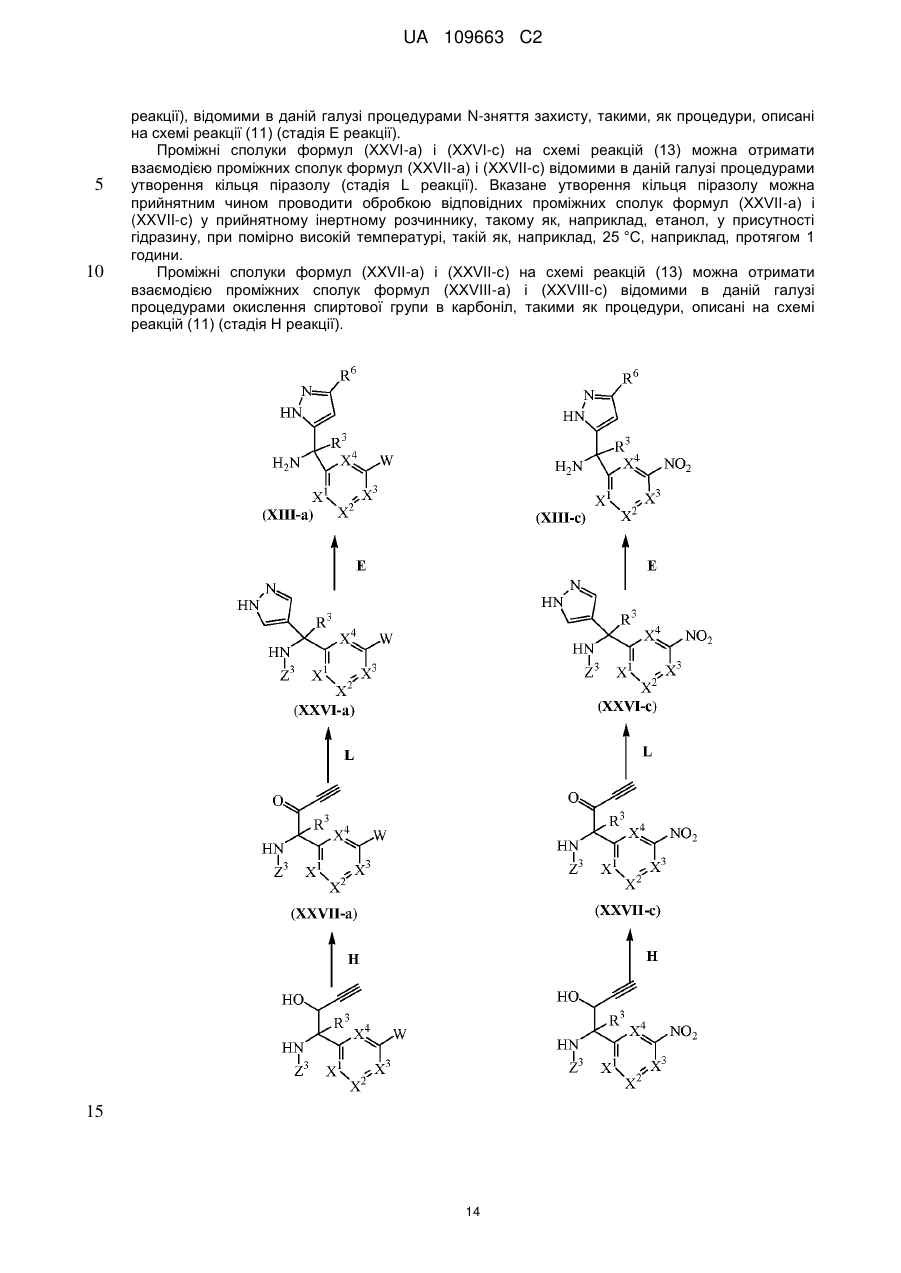
Текст
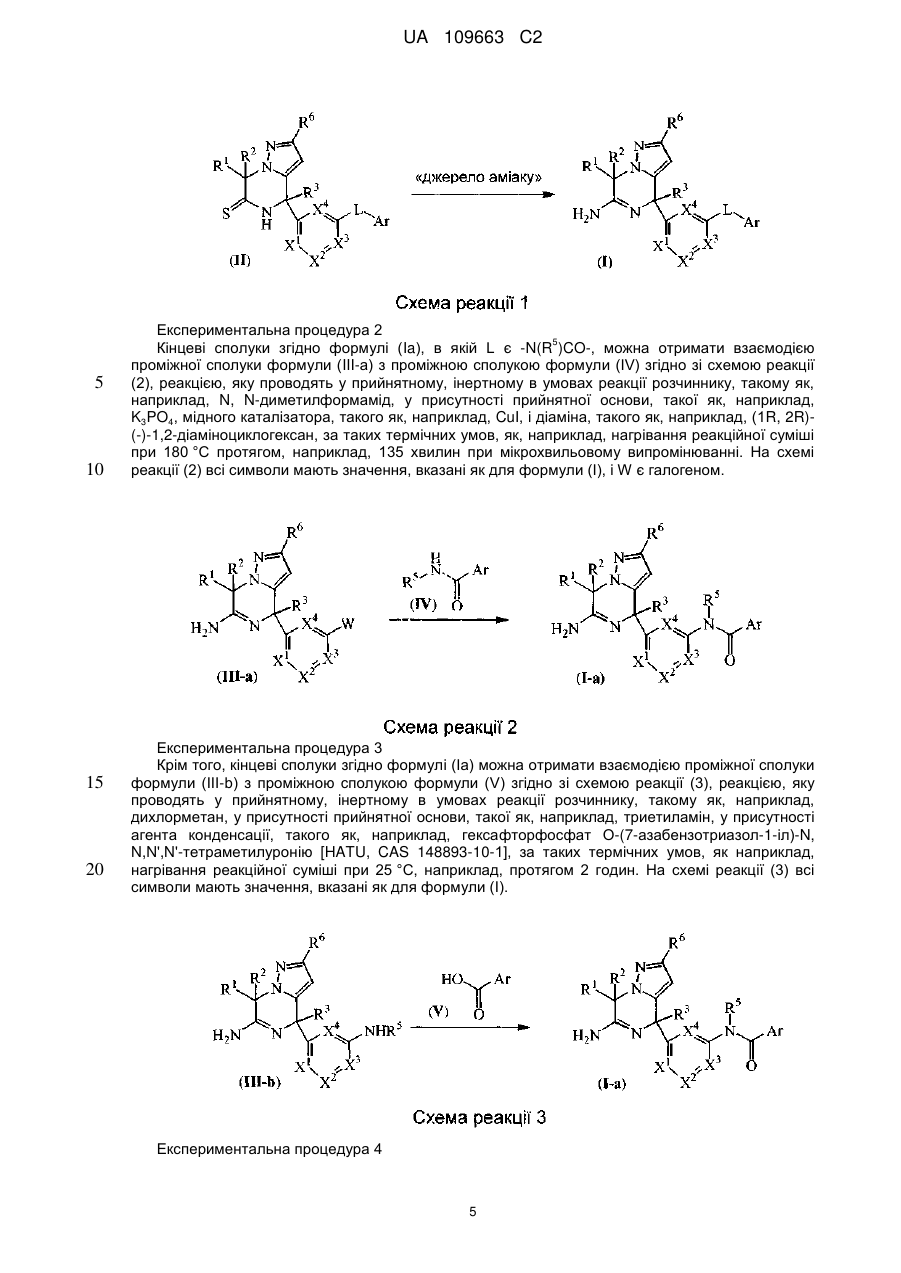
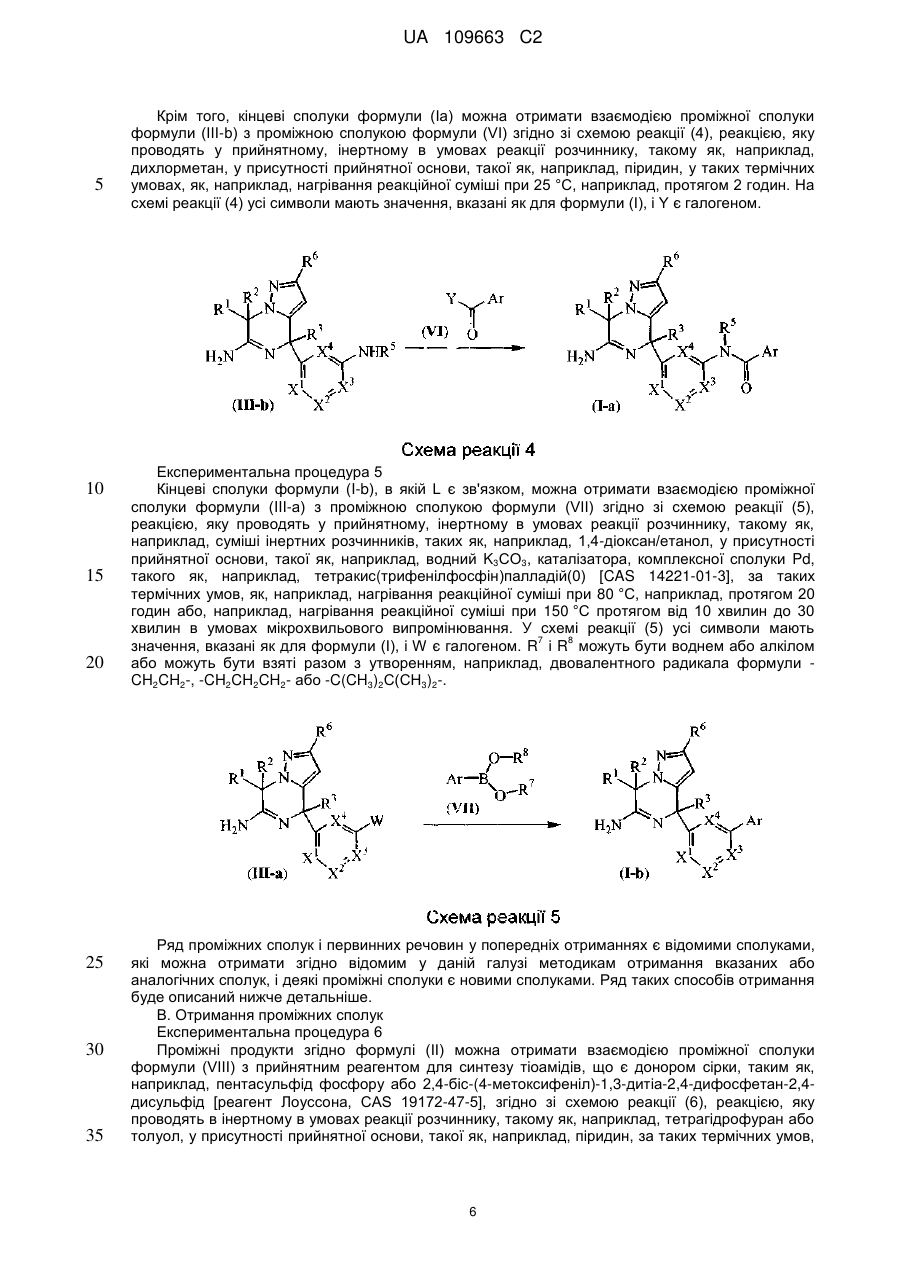
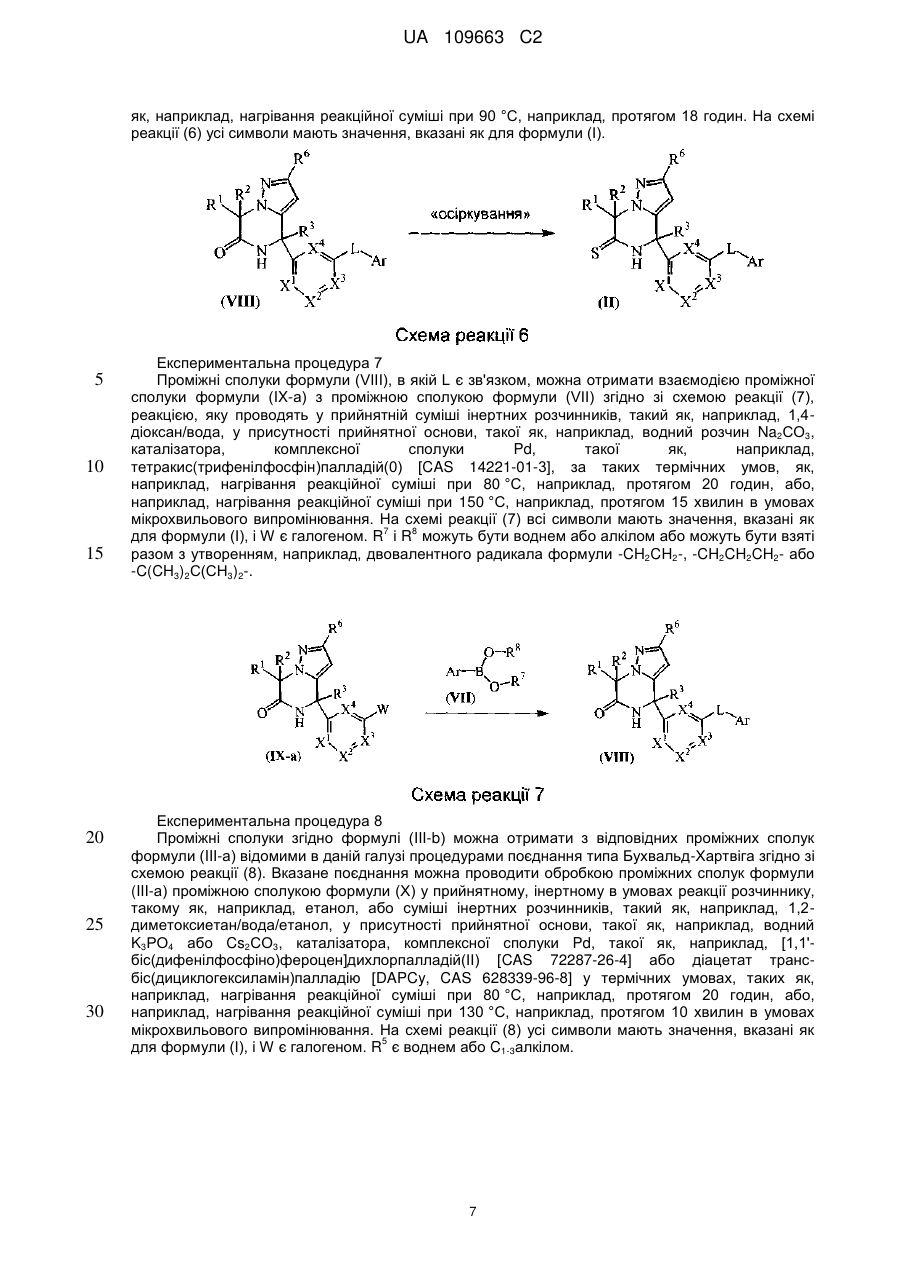
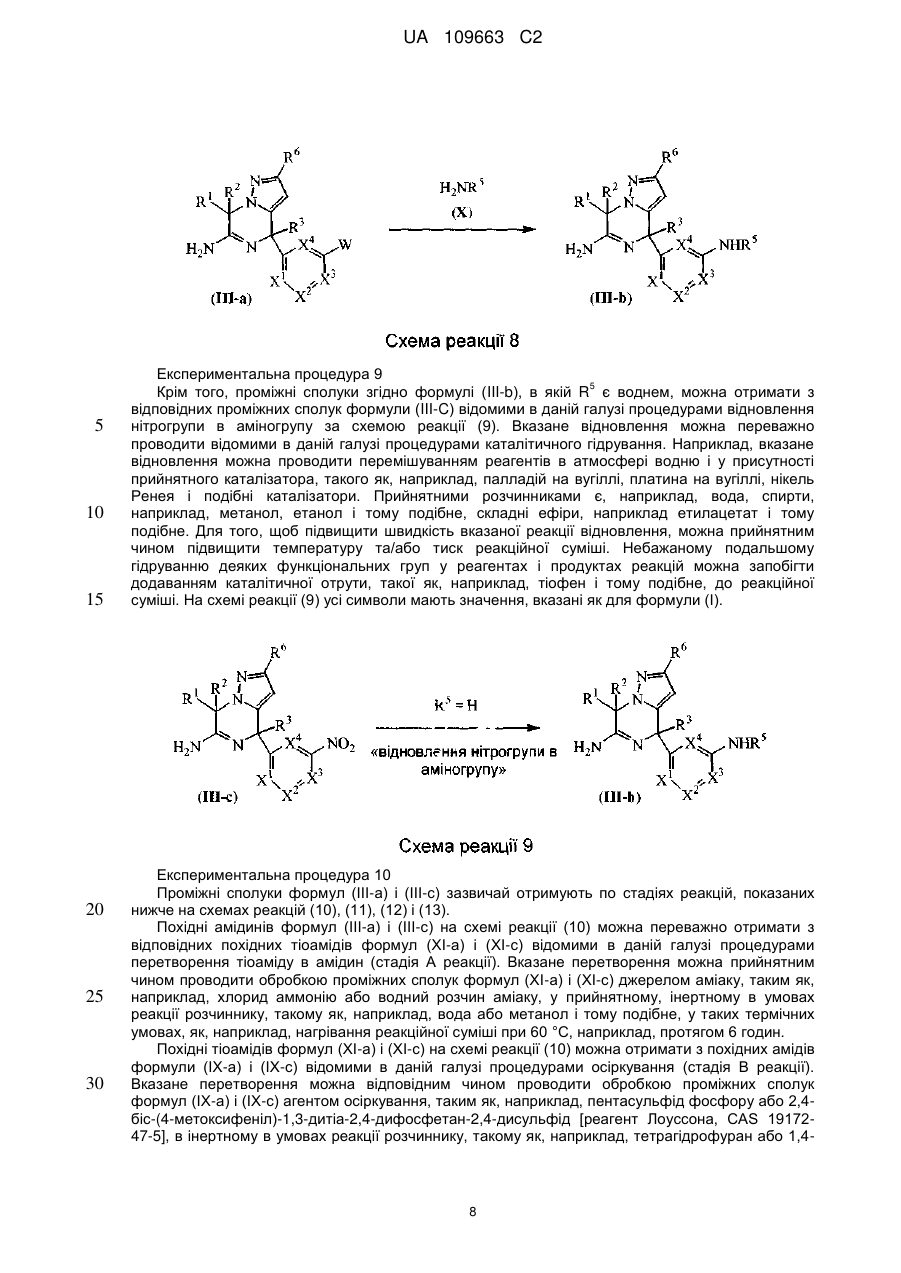
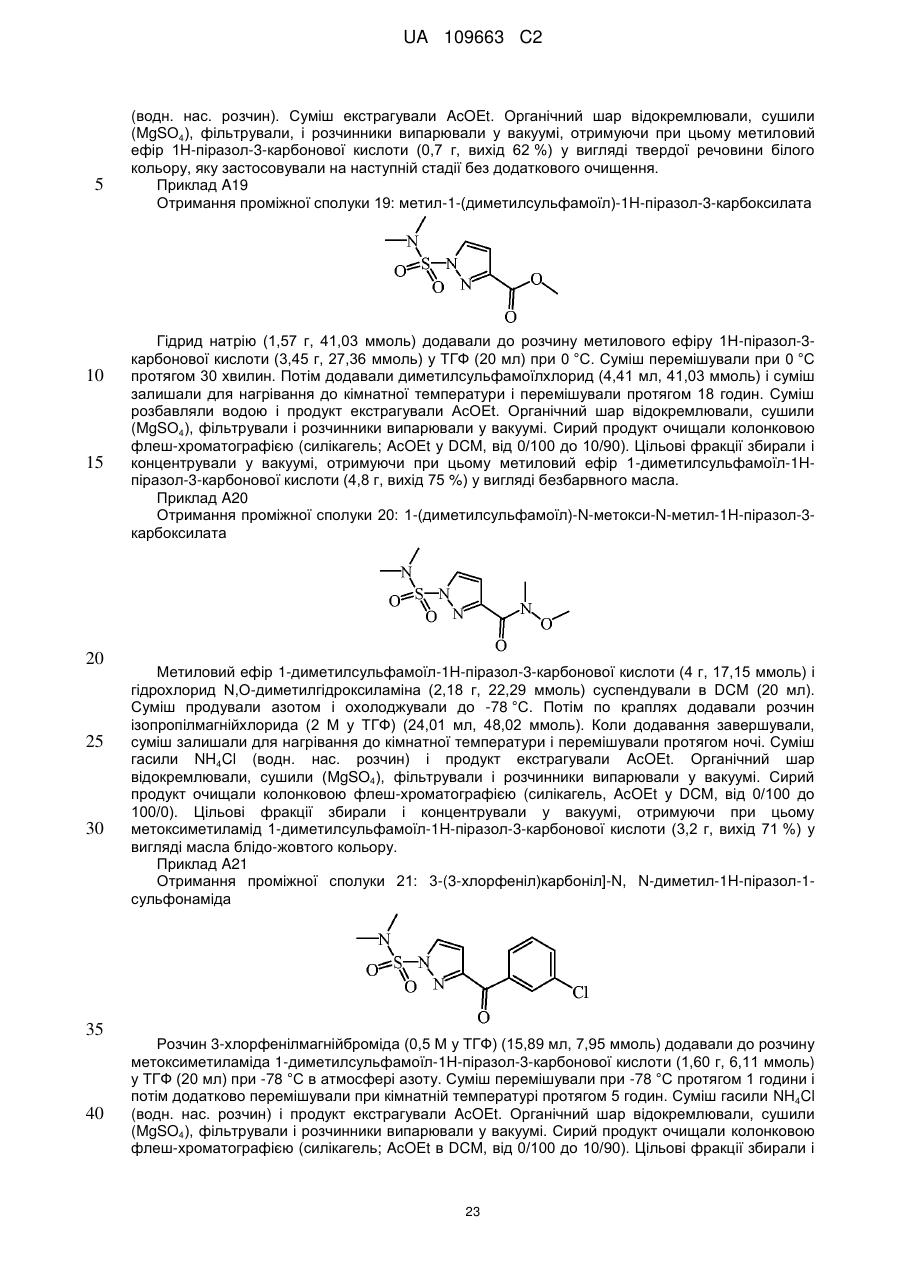
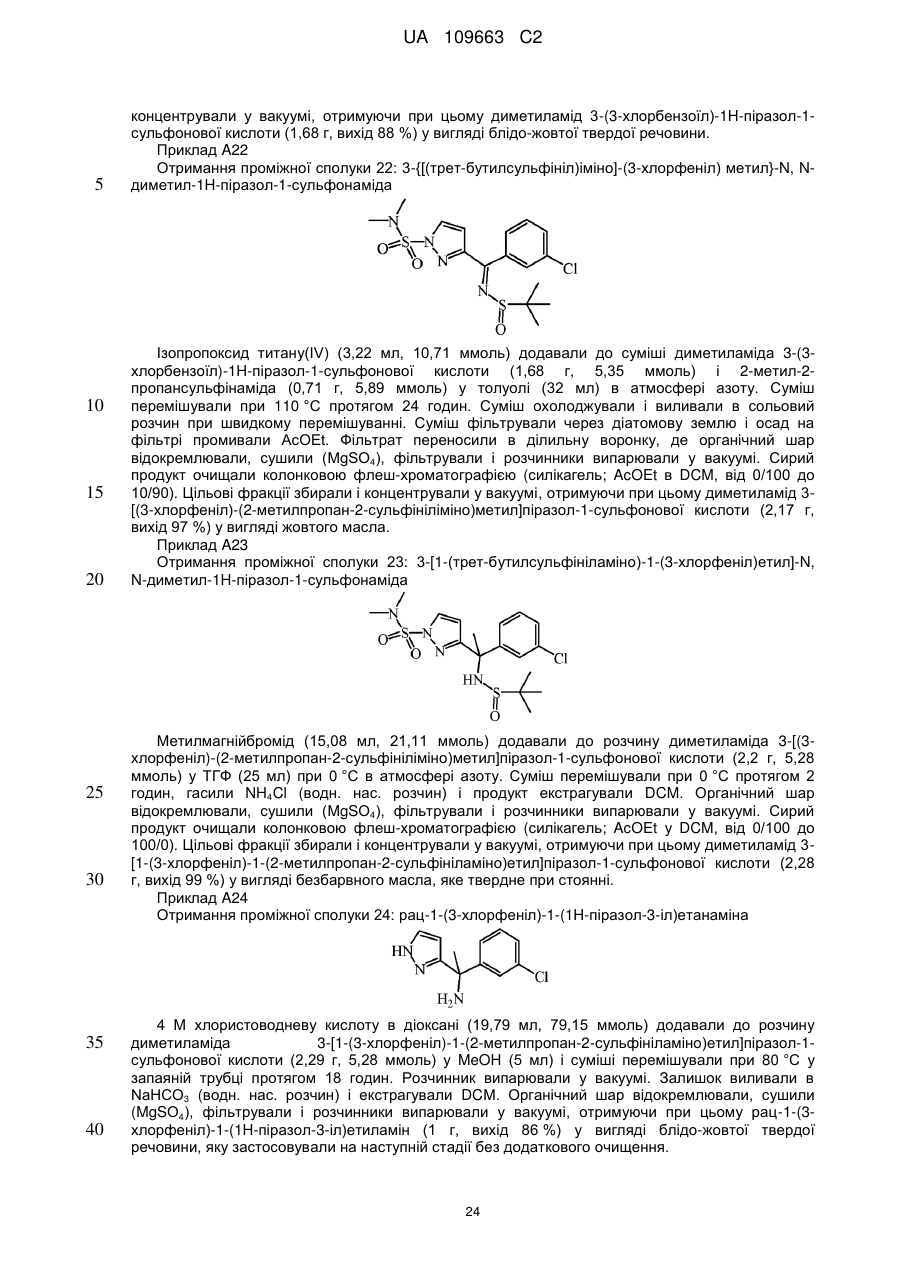
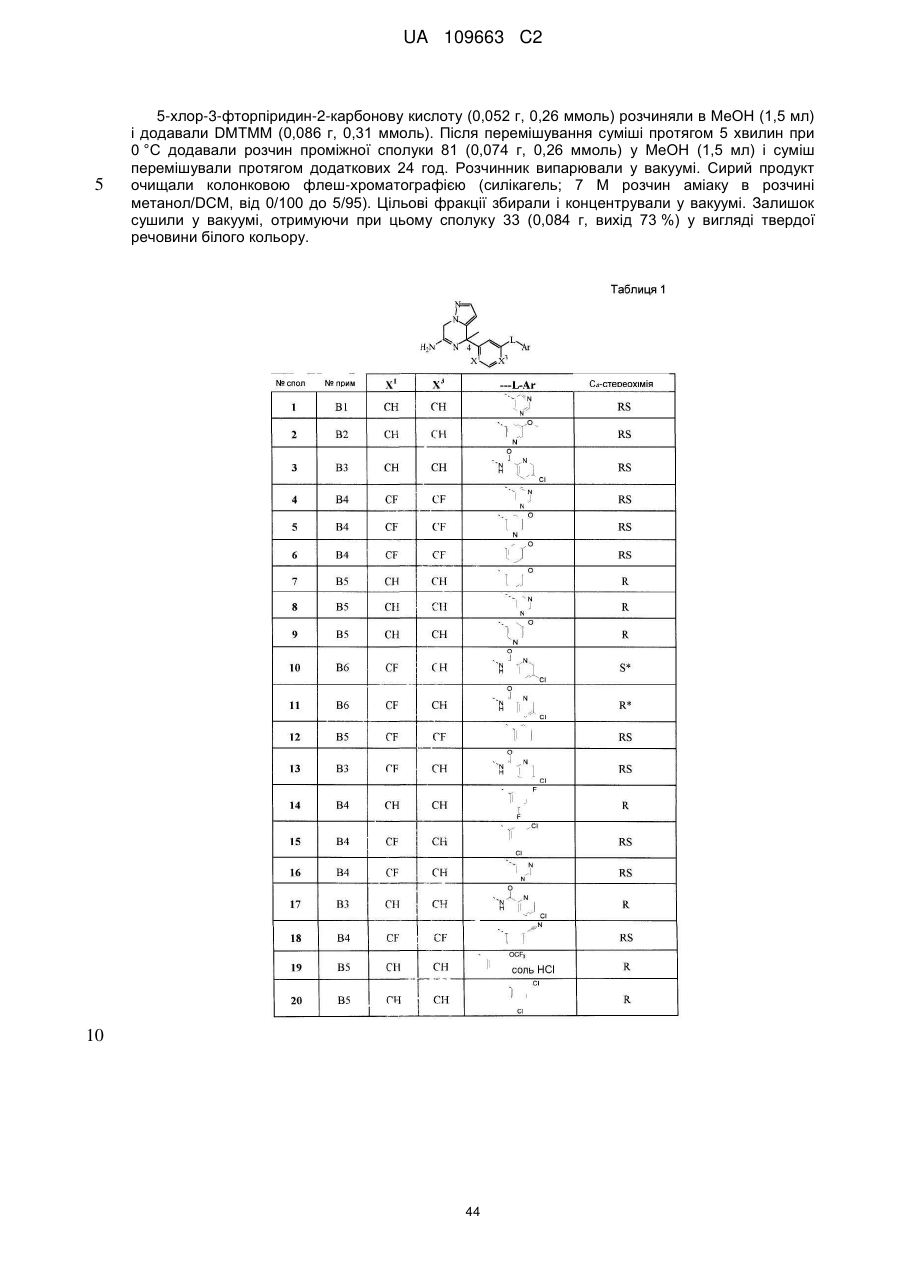
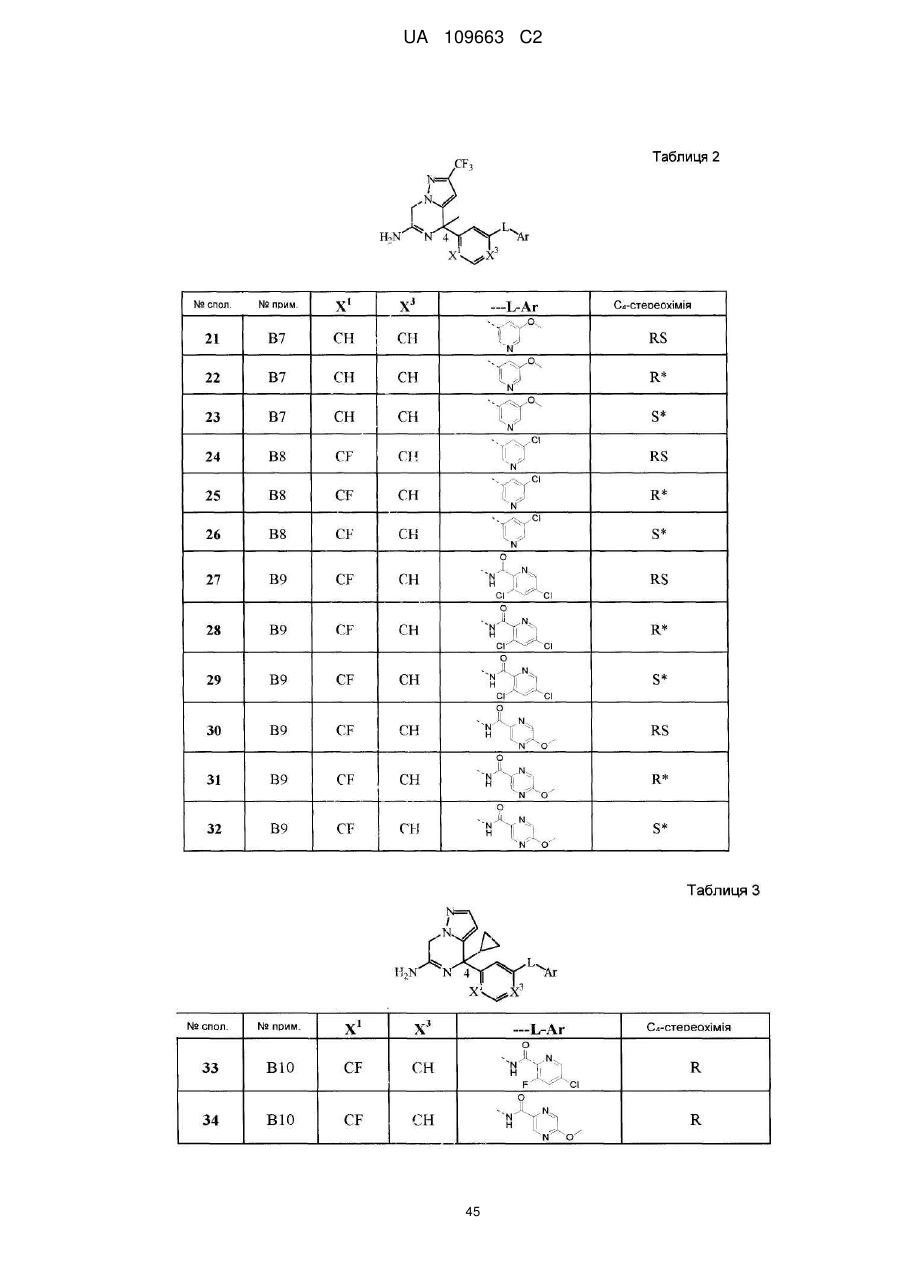
Реферат: Даний винахід стосується нових похідних 4,7-дигідропіразоло[1,5-а]піразин-6-іламіну, що використовуються як інгібітори бета-секретази, відомої також як фермент, що розщеплює бетасайт амілоїду, ВАСЕ, ВАСЕ1, Asp2 або мемапсину. Винахід стосується також фармацевтичних композицій, що містять такі сполуки, способів отримання таких сполук і композицій і застосування таких сполук і композицій для запобігання і лікування порушень, в яких бере участь бета-секретаза, таких як хвороба Альцгеймера (AD), помірний когнітивний розлад, старіння, деменція, деменція з тільцями Леві, синдром Дауна, деменція, пов'язана з інсультом, деменція, пов'язана з хворобою Паркінсона, або деменція, пов'язана з бета-амілоїдом. UA 109663 C2 (12) UA 109663 C2 UA 109663 C2 5 10 15 20 25 30 35 40 45 Область техніки, до якої відноситься винахід Даний винахід відноситься до нових похідних 4,7-дигідропіразоло[1,5-а]піразин-6-іл-аміна, що використовуються як інгібітори бета-секретази, яка відома також як фермент, що розщеплює бета-сайт амілоїда, BACE, BACE1, Asp2 або мемапсина 2. Винахід відноситься також до фармацевтичних композицій, що містять такі сполуки, до способів отримання таких сполук і композицій, і до застосування таких сполук і композицій для запобігання і лікування порушень, в яких бере участь бета-секретаза, таких як хвороба Альцгеймера (AD), помірний когнітивний розлад, старіння, деменція, деменція з тільцями Леві, синдром Дауна, деменція, пов'язана з інсультом, деменція, пов'язана з хворобою Паркінсона, або деменція, пов'язана з бетаамілоїдом. Рівень техніки Хвороба Альцгеймера (AD) є нейродегенеративним захворюванням, пов'язаним із старінням. Пацієнти з хворобою Альцгеймера страждають на порушення пізнавальної здатності і втрату пам'яті, а також на поведінкові проблеми, такі як тривога (страх). Більше 90 % пацієнтів, уражених AD, мають спорадичну форму порушення, тоді як менше 10 % випадків таких порушень є родинними або спадковими. У Сполучених Штатах приблизно 1 з 10 людей у віці 65 років має AD, тоді як у віці 85 років 1 людину з кожних двох осіб уражено AD. Середня тривалість життя від первинного діагнозу складає 7-10 років, і пацієнтам з AD потрібний ретельний догляд для допомоги в життєзабезпеченні пацієнта або особою, що здійснює догляд за хворим, що дуже дорого, або членами сім'ї. У зв'язку із зростанням кількості літніх людей серед мешканців, AD є зростаючою медичною проблемою. Доступні на даний час терапії для AD лише лікують симптоми захворювання і включають застосування інгібіторів ацетилхолінестерази для поліпшення когнітивних властивостей, а також транквілізаторів і антипсихотичних засобів для послаблення поведінкових проблем, пов'язаних з цією недугою. Відмітними патологічними ознаками мозку пацієнтів з AD є нейрофібриллярні клубки, які генеруються гіперфосфорилуванням тау-білка, і амілоїдні бляшки, які утворюються агрегацією пептиду бета-амілоїда 1-42 (абета 1-42). Абета 1-42 утворює олігомери і потім фібрилли, і врешті-решт амілоїдні бляшки. Вважається, що олігомери і фібрилли є особливо нейротоксичними і можуть викликати більшість неврологічних пошкоджень, пов'язаних з AD. Агенти, які перешкоджають утворенню абета 1-42, мають потенціал бути модифікуючими захворювання агентами для лікування AD. Абета 1-42 утворюється з амілоїдного білкапопередника (APP), що складається з 770 амінокислот. N-кінець абети 1-42 розщеплюється бета-секретазою (BACE), а потім гамма-секретаза розщеплює С-кінець. Окрім абета 1-42 гамма-секретаза виділяє також абета 1-40, яка є основним продуктом розщеплювання, а також абета 1-38 і абета 1-43. Ці форми абета можуть також агрегуватись з утворенням олігомерів і фібрилл. Таким чином, можна передбачити, що інгібітори BACE запобігають утворенню абета 142, а також абета 1-40, абета 1-38 і абета 1-43 і можуть бути потенційними терапевтичними агентами при лікуванні AD. Суть винаходу Даний винахід відноситься до сполуки формули (I) або її таутомерної або стереоізомерної форми, в якій 1 2 R і R незалежно вибрані з групи, що складається з водню, фтору, ціано, C1-3алкіла, моно- і полігалогенC1-3алкіла і C3-6циклоалкіла, або 1 2 R і R , узяті разом з атомом вуглецю, до якого вони приєднані, можуть утворювати C13циклоалкандіїльне кільце; 1 UA 109663 C2 3 5 10 15 20 25 30 35 40 45 50 55 60 R вибраний з групи, що складається з водню, C1-3алкіла, C3-6циклоалкіла, моно- і полігалогенC1-3алкіла, гомоарила і гетероарила; 1 2 3 4 4 4 X , X , X , X незалежно є C(R ) або N, за умови, що не більше ніж два з них є N; кожен R вибраний з групи, що складається з водню, галогену, C1-3алкілу, моно- і полігалогенC1-3алкілу, ціано, C1-3алкілокси, моно- і полігалогенC1-3алкілокси; 5 5 L є зв'язком або -N(R )CO-, де R є воднем або C1-3алкілом; 6 R є воднем або трифторметилом; Ar є гомоарилом або гетероарилом; гомоарил є фенілом або фенілом, заміщеним одним, двома або трьома замісниками, вибраними з групи, що складається з галогену, ціано, C1-3алкілу, C1-3алкілокси, моно- і полігалогенC1-3алкілу і моно- і полігалогенC1-3алкілокси; гетероарил вибраний з групи, що складається з піридила, піримідила, піразила, піридазила, фураніла, тієніла, пірроліла, піразоліла, імідазоліла, триазоліла, тіазоліла, тіадіазоліла, оксазоліла і оксадіазоліла, кожен з яких необов'язково заміщений одним, двома або трьома замісниками, вибраними з групи, що складається з галогену, ціано, C1-3алкілу, C1-3алкілокси, моно- і полігалогенC1-3алкілу і моно- і полігалогенC1-3алкілокси, або її аддитивної солі або сольвату. Ілюстрацією винаходу є фармацевтична композиція, що містить фармацевтично прийнятний носій і будь-яку із сполук, описаних вище. Ілюстрацією винаходу є фармацевтична композиція, виготовлена змішуванням будь-якої із сполук, описаних вище, і фармацевтично прийнятного носія. Ілюстрацією винаходу є спосіб виготовлення фармацевтичної композиції, що містить змішування будь-якої із сполук, описаних вище, і фармацевтично прийнятного носія. Репрезентацією винаходу є способи лікування порушення, опосредкованого ферментом бета-секретазою, що включають введення суб'єктові, який потребує цього, терапевтично ефективної кількості будь-якої з описаних вище сполук або фармацевтичних композицій. Наступною репрезентацією винаходу є способи інгібування ферменту бета-секретази, що містять введення суб'єктові, який потребує цього, терапевтично ефективної кількості будь-якої з описаних вище сполук або фармацевтичних композицій. Прикладом винаходу є спосіб лікування порушення, вибраного з групи, що складається з хвороби Альцгеймера, помірного когнітивного розладу, старіння, деменції, деменції з тільцями Леві, синдрому Дауна, деменції, пов'язаної з інсультом, деменції, пов'язаної з хворобою Паркінсона, і деменції, пов'язаної з бета-амілоїдом, бажано хвороби Альцгеймера, що включає введення суб'єктові, який потребує цього, терапевтично ефективної кількості будь-якої з описаних вище сполук або фармацевтичних композицій. Іншим прикладом винаходу є будь-яка з описаних вище сполук для застосування при лікуванні (а) хвороби Альцгеймера, (b) помірного когнітивного розладу, (с) старіння, (d) деменції, (е) деменції з тільцями Леві, (f) синдрому Дауна, (g) деменції, пов'язаної з інсультом, (h) деменції, пов'язаної з хворобою Паркінсона і (i) деменції, пов'язаною з бета-амілоїдом, у суб'єкта, що потребує цього. Детальний опис винаходу Даний винахід відноситься до сполук формули (I), в якій символи мають значення, вказані вище, і їх фармацевтично прийнятним солям і сольватам. Сполуки формули (I) є інгібіторами ферменту бета-секретази (відомою також як фермент розщеплювання бета-сайту, BACE, BACE1, Asp2 або мемапсин 2), і є застосовними при лікуванні хвороби Альцгеймера, помірного когнітивного порушення, старіння, деменції, деменції, пов'язаної з інсультом, деменції з тільцями Леві, синдрому Дауна, деменції, пов'язаної з хворобою Паркінсона, і деменції, пов'язаної з бета-амілоїдом, бажано хвороби Альцгеймера, помірного когнітивного порушення або деменції, бажаніше хвороби Альцгеймера. 1 2 У варіанті здійснення даного винаходу запропоновано сполуку, в якій R і R незалежно вибрані з водню і C1-3алкіла; 1 2 3 4 4 4 X , X , X , X незалежно є C(R ), де кожен R вибраний з водню і галогену; 5 5 L є зв'язком або -N(R )CO-, де R є воднем; Ar є гомоарилом або гетероарилом; гомоарил є фенілом або фенілом, заміщеним одним або двома замісниками, вибраними з групи, що складається з галогену, ціано, C1-3алкілу і C1-3алкілокси; гетероарил вибраний з групи, що складається з піридила, піримідила і піразила, кожен з яких необов'язково заміщений одним або двома замісниками, вибраними з групи, що складається з галогену, ціано, C1-3алкілу і C1-3алкілокси; або її аддитивна сіль або сольват. 1 2 У іншому варіанті здійснення даного винаходу, запропоновано сполуку, в якій R і R незалежно вибрані з водню; 2 UA 109663 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 2 3 X , X , X , X4 незалежно є CН; 5 5 L є зв'язком або -N(R )CO-, де R є воднем; Ar є гомоарилом або гетероарилом; гомоарил є фенілом, заміщеним хлором; гетероарил вибраний з групи, що складається з піридила і піримідила, кожен з яких необов'язково заміщений одним або двома замісниками, вибраними з групи, що складається з хлору, фтору, ціано, метила і метокси; або її аддитивна сіль або сольват. 3 У іншому варіанті здійснення атом вуглецю, заміщений R , має R-конфігурацію. 1 2 У іншому варіанті здійснення даного винаходу запропоновано сполуку, в якій R і R є воднем; 1 2 3 4 X є СН або CF і X , X , X є CH; 5 5 L є -N(R )CO-, де R є воднем; Ar є піридинілом, заміщеним одним або двома атомами галогену, або піразинілом, заміщеним метокси, або її сіль або сольват. ВИЗНАЧЕННЯ "Галоген" означатиме фтор, хлор і бром; "С1-3алкіл" означатиме нерозгалужену або розгалужену насичену алкільну групу, що має 1, 2 або 3 атоми вуглецю, наприклад метил, етил, 1-пропіл і 2-пропіл; "С1-3алкілокси" означатиме радикал простого ефіру, в якого С1-3алкіл має значення, вказані вище; "моно- і полігалогенС1-3алкіл" означатиме С1-3алкіл, який має значення, вказані вище, і заміщений 1, 2, 3 або у разі, коли можливо, більшим числом атомів галогену, які мають значення, вказані вище, "моно- і полігалогенС1-3алкілокси" означатиме радикал простого ефіру, в якого моно- і полігалогенС1-3алкіл має значення, вказані вище; "С3-6циклоалкіл" означатиме циклопропіл, циклобутил, циклопентил і циклогексил; "С3-6циклоалкандіїл" означатиме двовалентний радикал, такий як циклопропандіїл, циклобутандіїл, циклопентандіїл і циклогександіїл. Термін "суб'єкт", що застосовується в контексті, відноситься до тварини, бажано ссавцю, найбажаніше людині, який є або був об'єктом лікування, спостереження або експерименту. Термін "терапевтично ефективна кількість", що застосовується в контексті, означає, що кількість активної сполуки або фармацевтичного агента, яке викликає біологічну або лікарську відповідь у системі тканини, організмі тварини або людини, якої домагається дослідник, ветеринар, лікар або інший клініцист, і яка включає полегшення симптомів хвороби або порушення, що піддається лікуванню. Передбачається, що в даному контексті термін "композиція" включає продукт, що містить вказані інгредієнти у вказаних кількостях, а також будь-який продукт, який отримують, безпосередньо або опосередковано, з комбінацій вказаних інгредієнтів у вказаних кількостях. Слід мати на увазі, що деякі із сполук формули (I) і їх аддитивні солі, гідрати і сольвати можуть містити один або декілька центрів хіральності і можуть існувати у вигляді стереоізомерних форм. Термін "стереоізомерні форми", що використовується в контексті раніше або пізніше, означає всі можливі стереоізомерні форми, які можуть мати сполуки згідно з формулою (I) і їх аддитивні солі. Якщо не обумовлено або не вказано інше, хімічне визначення сполук означає суміш усіх можливих стереохімічно ізомерних форм, причому вказані суміші містять усі діастереомери і енантіомери основної молекулярної структури, а також кожну з індивідуальних ізомерних форм згідно з формулою (I) і їх солей, сольватів, по суті індивідуальних, тобто зв'язаних менше ніж з 10 %, бажано менше ніж з 5 %, зокрема, менше ніж з 2 % і найбажаніше менше ніж з 1 % інших ізомерів. Коли сполуки згідно з даним винаходом мають принаймні один хіральний центр, вони можуть відповідно існувати у вигляді енантіомерів. Коли сполуки мають два або більше хіральних центри, вони можуть додатково існувати у вигляді діастереомерів. Повинно бути зрозуміло, що всі такі ізомери і їх суміші включені в обсяг даного винаходу. Коли сполука присутня у вигляді енантіомера, енантіомер бажано присутній при енантіомерному надлишку, який перевищує або рівний приблизно 80 %, бажаніше при енантіомерному надлишку, який перевищує або рівний приблизно 90 %, ще бажаніше при енантіомерному надлишку, який перевищує або рівний приблизно 95 %, ще бажаніше при енантіомерному надлишку, який перевищує або рівний приблизно 98 %, найбажаніше при енантіомерному надлишку, який перевищує або рівний приблизно 99 %. Аналогічно цьому, коли сполука присутня у вигляді діастереомера, діастереомер присутній при діастереомерному надлишку, що перевищує або рівний приблизно 80 %, бажаніше при діастереомерному надлишку, який перевищує або рівний приблизно 90 %, ще бажаніше при діастереомерному надлишку, який перевищує або рівний приблизно 95 %, ще бажаніше при діастереомерному надлишку, який перевищує або рівний 3 UA 109663 C2 5 10 15 20 25 30 35 40 45 50 55 приблизно 98 %, найбажаніше при діастереомерному надлишку, який перевищує або рівний приблизно 99 %. Крім того, деякі з кристалічних форм сполук за даним винаходом можуть існувати у вигляді поліморфів, і передбачається, що як такі вони включені в даний винахід. Крім того, деякі із сполук за даним винаходом можуть утворювати сольвати з водою (тобто гідрати) або звичайними органічними розчинниками, і передбачається, що такі сольвати також включені в обсяг даного винаходу. Для застосування в медицині солі сполук за даним винаходом відносяться до нетоксичних "фармацевтично прийнятних солей". Інші солі, проте, можуть бути застосовними при отриманні сполук згідно з даним винаходом або їх фармацевтично прийнятних солей. Прийнятні фармацевтично прийнятні солі сполук включають аддитивні солі кислот, які можна, наприклад, отримати змішуванням розчину сполуки з розчином фармацевтично прийнятної кислоти, такої як хлористоводнева кислота, сірчана кислота, фумарова кислота, малеїнова кислота, бурштинова кислота, оцтова кислота, бензойна кислота, лимонна кислота, винна кислота, вугільна кислота або фосфорна кислота. Крім того, коли сполуки за винаходом містять кислотний залишок, їх прийнятні фармацевтично прийнятні солі можуть включати у себе солі лужних металів, наприклад, солі натрію або калію, солі лужноземельних металів, наприклад, солі кальцію або магнію, і солі, утворені з прийнятними органічними лігандами, наприклад, солі четвертинного аммонію. Репрезентативні кислоти, які можна застосовувати при отриманні фармацевтично прийнятних солей, включають, але не обмежуються перерахованим: оцтову кислоту, 2,2дихлороцтову кислоту, ацильовані амінокислоти, адіпінову кислоту, альгінову кислоту, аскорбінову кислоту, L-аспарагінову кислоту, бензолсульфонову кислоту, бензойну кислоту, 4ацетамідобензойну кислоту, (+)-камфорну кислоту, камфорасульфонову кислоту, капринову кислоту, капронову кислоту, каприлову кислоту, коричну кислоту, лимонну кислоту, цикламову кислоту, етан-1,2-дисульфонову кислоту, етансульфонову кислоту, 2-гідроксиетансульфонову кислоту, мурашину кислоту, фумарову кислоту, галактарову кислоту, гентизинову кислоту, глюкогептонову кислоту, D-глюконову кислоту, D-глюкуронову кислоту, L-глутамінову кислоту, бета-оксоглутарову кислоту, гліколеву кислоту, гіппурову кислоту, бромистоводневу кислоту, хлористоводневу кислоту, (+)-L-молочну кислоту, (±)-DL-молочну кислоту, лактобіонову кислоту, малеїнову кислоту, (-)-L-яблучну кислоту, малонову кислоту, (±)-DL-мигдальну кислоту, метансульфонову кислоту, нафталін-2-сульфонову кислоту, нафталін-1,5-дисульфонову кислоту, 1-гідрокси-2-нафтойну кислоту, нікотинову кислоту, азотну кислоту, олеїнову кислоту, оротову кислоту, щавлеву кислоту, пальмітинову кислоту, памову кислоту, фосфорну кислоту, L-піроглутамінову кислоту, саліцилову кислоту, 4-аміносаліцилову кислоту, себацинову кислоту, стеаринову кислоту, бурштинову кислоту, сірчану кислоту, дубильну кислоту, (+)-L-винну кислоту, тіоціанову кислоту, п-толуолсульфонову кислоту, трифторметилсульфонову кислоту і ундециленову кислоту. Репрезентативні основи, які можна застосовувати при отриманні фармацевтично прийнятних солей, включають, але не обмежуються перерахованим, аміак, Lаргінін, бенетамін, бензатин, гідроксид кальцію, холін, диметилетаноламін, діетаноламін, діетиламін, 2-(діетиламіно)етанол, етаноламін, етилендіамін, N-метилглюкамін, гідрабамін, 1Hімідазол, L-лізин, гідроксид магнію, 4-(2-гідроксиетил)морфолін, піперазин, гідроксид калію, 1-(2гідроксиетил) пірролідин, вторинний амін, гідроксид натрію, триетаноламін, трометамін і гідроксид цинку. Хімічні назви сполук за даним винаходом створювали згідно з правилами номенклатури, прийнятим Chemical Abstраcts Service. Сполуки згідно з формулою (I) можуть також існувати в їх таутомерній формі. Передбачається, що такі форми, хоча вони і не вказані безпосередньо в приведеній вище формулі, включені в обсяг даного винаходу. А. Отримання кінцевих сполук Експериментальна процедура 1 Кінцеві сполуки формули згідно формулі (I) можна отримати взаємодією проміжної сполуки формули (II) з прийнятним джерелом аміаку, таким як, наприклад, хлорид аммонію або водний розчин аміаку, згідно зі схемою реакції (1), реакції, яку проводять у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, вода або метанол, за таких термічних умов, як, наприклад, нагрівання реакційної суміші при 60 °C, наприклад, протягом 6 годин. На схемі реакції (1) усі символи мають значення, вказані як для формули (I). 4 UA 109663 C2 5 10 15 20 Експериментальна процедура 2 5 Кінцеві сполуки згідно формулі (Ia), в якій L є -N(R )CO-, можна отримати взаємодією проміжної сполуки формули (III-а) з проміжною сполукою формули (IV) згідно зі схемою реакції (2), реакцією, яку проводять у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, N, N-диметилформамід, у присутності прийнятної основи, такої як, наприклад, K3PO4, мідного каталізатора, такого як, наприклад, CuI, і діаміна, такого як, наприклад, (1R, 2R)(-)-1,2-діаміноциклогексан, за таких термічних умов, як, наприклад, нагрівання реакційної суміші при 180 °C протягом, наприклад, 135 хвилин при мікрохвильовому випромінюванні. На схемі реакції (2) всі символи мають значення, вказані як для формули (I), і W є галогеном. Експериментальна процедура 3 Крім того, кінцеві сполуки згідно формулі (Ia) можна отримати взаємодією проміжної сполуки формули (III-b) з проміжною сполукою формули (V) згідно зі схемою реакції (3), реакцією, яку проводять у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, дихлорметан, у присутності прийнятної основи, такої як, наприклад, триетиламін, у присутності агента конденсації, такого як, наприклад, гексафторфосфат O-(7-азабензотриазол-1-іл)-N, N,N',N'-тетраметилуронію [HATU, CAS 148893-10-1], за таких термічних умов, як наприклад, нагрівання реакційної суміші при 25 °C, наприклад, протягом 2 годин. На схемі реакції (3) всі символи мають значення, вказані як для формули (I). Експериментальна процедура 4 5 UA 109663 C2 5 10 15 20 25 30 35 Крім того, кінцеві сполуки формули (Ia) можна отримати взаємодією проміжної сполуки формули (III-b) з проміжною сполукою формули (VI) згідно зі схемою реакції (4), реакцією, яку проводять у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, дихлорметан, у присутності прийнятної основи, такої як, наприклад, піридин, у таких термічних умовах, як, наприклад, нагрівання реакційної суміші при 25 °C, наприклад, протягом 2 годин. На схемі реакції (4) усі символи мають значення, вказані як для формули (I), і Y є галогеном. Експериментальна процедура 5 Кінцеві сполуки формули (I-b), в якій L є зв'язком, можна отримати взаємодією проміжної сполуки формули (III-а) з проміжною сполукою формули (VII) згідно зі схемою реакції (5), реакцією, яку проводять у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, суміші інертних розчинників, таких як, наприклад, 1,4-діоксан/етанол, у присутності прийнятної основи, такої як, наприклад, водний K3СО3, каталізатора, комплексної сполуки Pd, такого як, наприклад, тетракис(трифенілфосфін)палладій(0) [CAS 14221-01-3], за таких термічних умов, як, наприклад, нагрівання реакційної суміші при 80 °C, наприклад, протягом 20 годин або, наприклад, нагрівання реакційної суміші при 150 °C протягом від 10 хвилин до 30 хвилин в умовах мікрохвильового випромінювання. У схемі реакції (5) усі символи мають 7 8 значення, вказані як для формули (I), і W є галогеном. R і R можуть бути воднем або алкілом або можуть бути взяті разом з утворенням, наприклад, двовалентного радикала формули CH2CH2-, -CH2CH2CH2- або -C(CH3)2С(СН3)2-. Ряд проміжних сполук і первинних речовин у попередніх отриманнях є відомими сполуками, які можна отримати згідно відомим у даній галузі методикам отримання вказаних або аналогічних сполук, і деякі проміжні сполуки є новими сполуками. Ряд таких способів отримання буде описаний нижче детальніше. B. Отримання проміжних сполук Експериментальна процедура 6 Проміжні продукти згідно формулі (II) можна отримати взаємодією проміжної сполуки формули (VIII) з прийнятним реагентом для синтезу тіоамідів, що є донором сірки, таким як, наприклад, пентасульфід фосфору або 2,4-біс-(4-метоксифеніл)-1,3-дитіа-2,4-дифосфетан-2,4дисульфід [реагент Лоуссона, CAS 19172-47-5], згідно зі схемою реакції (6), реакцією, яку проводять в інертному в умовах реакції розчиннику, такому як, наприклад, тетрагідрофуран або толуол, у присутності прийнятної основи, такої як, наприклад, піридин, за таких термічних умов, 6 UA 109663 C2 як, наприклад, нагрівання реакційної суміші при 90 °C, наприклад, протягом 18 годин. На схемі реакції (6) усі символи мають значення, вказані як для формули (I). 5 10 15 20 25 30 Експериментальна процедура 7 Проміжні сполуки формули (VIII), в якій L є зв'язком, можна отримати взаємодією проміжної сполуки формули (IX-а) з проміжною сполукою формули (VII) згідно зі схемою реакції (7), реакцією, яку проводять у прийнятній суміші інертних розчинників, такий як, наприклад, 1,4діоксан/вода, у присутності прийнятної основи, такої як, наприклад, водний розчин Na2СО3, каталізатора, комплексної сполуки Pd, такої як, наприклад, тетракис(трифенілфосфін)палладій(0) [CAS 14221-01-3], за таких термічних умов, як, наприклад, нагрівання реакційної суміші при 80 °C, наприклад, протягом 20 годин, або, наприклад, нагрівання реакційної суміші при 150 °C, наприклад, протягом 15 хвилин в умовах мікрохвильового випромінювання. На схемі реакції (7) всі символи мають значення, вказані як 7 8 для формули (I), і W є галогеном. R і R можуть бути воднем або алкілом або можуть бути взяті разом з утворенням, наприклад, двовалентного радикала формули -CH2CH2-, -CH2CH2CH2- або -C(CH3)2С(СН3)2-. Експериментальна процедура 8 Проміжні сполуки згідно формулі (III-b) можна отримати з відповідних проміжних сполук формули (III-а) відомими в даній галузі процедурами поєднання типа Бухвальд-Хартвіга згідно зі схемою реакції (8). Вказане поєднання можна проводити обробкою проміжних сполук формули (III-а) проміжною сполукою формули (X) у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, етанол, або суміші інертних розчинників, такий як, наприклад, 1,2диметоксиетан/вода/етанол, у присутності прийнятної основи, такої як, наприклад, водний K3РО4 або Cs2СО3, каталізатора, комплексної сполуки Pd, такої як, наприклад, [1,1'біс(дифенілфосфіно)фероцен]дихлорпалладій(II) [CAS 72287-26-4] або діацетат трансбіс(дициклогексиламін)палладію [DAPCy, CAS 628339-96-8] у термічних умовах, таких як, наприклад, нагрівання реакційної суміші при 80 °C, наприклад, протягом 20 годин, або, наприклад, нагрівання реакційної суміші при 130 °C, наприклад, протягом 10 хвилин в умовах мікрохвильового випромінювання. На схемі реакції (8) усі символи мають значення, вказані як 5 для формули (I), і W є галогеном. R є воднем або C1-3алкілом. 7 UA 109663 C2 5 10 15 20 25 30 Експериментальна процедура 9 5 Крім того, проміжні сполуки згідно формулі (III-b), в якій R є воднем, можна отримати з відповідних проміжних сполук формули (III-C) відомими в даній галузі процедурами відновлення нітрогрупи в аміногрупу за схемою реакції (9). Вказане відновлення можна переважно проводити відомими в даній галузі процедурами каталітичного гідрування. Наприклад, вказане відновлення можна проводити перемішуванням реагентів в атмосфері водню і у присутності прийнятного каталізатора, такого як, наприклад, палладій на вугіллі, платина на вугіллі, нікель Ренея і подібні каталізатори. Прийнятними розчинниками є, наприклад, вода, спирти, наприклад, метанол, етанол і тому подібне, складні ефіри, наприклад етилацетат і тому подібне. Для того, щоб підвищити швидкість вказаної реакції відновлення, можна прийнятним чином підвищити температуру та/або тиск реакційної суміші. Небажаному подальшому гідруванню деяких функціональних груп у реагентах і продуктах реакцій можна запобігти додаванням каталітичної отрути, такої як, наприклад, тіофен і тому подібне, до реакційної суміші. На схемі реакції (9) усі символи мають значення, вказані як для формули (I). Експериментальна процедура 10 Проміжні сполуки формул (III-а) і (III-с) зазвичай отримують по стадіях реакцій, показаних нижче на схемах реакцій (10), (11), (12) і (13). Похідні амідинів формул (III-а) і (III-с) на схемі реакції (10) можна переважно отримати з відповідних похідних тіоамідів формул (XI-а) і (XI-с) відомими в даній галузі процедурами перетворення тіоаміду в амідин (стадія А реакції). Вказане перетворення можна прийнятним чином проводити обробкою проміжних сполук формул (XI-а) і (XI-с) джерелом аміаку, таким як, наприклад, хлорид аммонію або водний розчин аміаку, у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, вода або метанол і тому подібне, у таких термічних умовах, як, наприклад, нагрівання реакційної суміші при 60 °C, наприклад, протягом 6 годин. Похідні тіоамідів формул (XI-а) і (XI-с) на схемі реакції (10) можна отримати з похідних амідів формули (IX-а) і (IX-с) відомими в даній галузі процедурами осіркування (стадія В реакції). Вказане перетворення можна відповідним чином проводити обробкою проміжних сполук формул (IX-а) і (IX-с) агентом осіркування, таким як, наприклад, пентасульфід фосфору або 2,4біс-(4-метоксифеніл)-1,3-дитіа-2,4-дифосфетан-2,4-дисульфід [реагент Лоуссона, CAS 1917247-5], в інертному в умовах реакції розчиннику, такому як, наприклад, тетрагідрофуран або 1,4 8 UA 109663 C2 5 діоксан і тому подібне, за таких термічних умов, як, наприклад, нагрівання реакційної суміші при 50 °C, наприклад, протягом 50 хвилин. Похідні амідів формул (IX-а) і (IX-с) на схемі реакції (10) можна отримати з відповідних проміжних сполук формул (XII-а) і (XII-с) відомими в даній галузі процедурами циклізації (стадія С реакції). Вказану циклізацію можна прийнятним чином проводити обробкою проміжних сполук формул (XII-а) і (XII-с) прийнятною основою, такою як гідрид натрію, у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, тетрагідрофуран і тому подібне, при температурі від -80 °C до 100 °C, бажано від -15 °C до 25 °C протягом від 30 хвилин до 100 годин, бажано від 1 години до 24 годин. 10 15 20 А: перетворення тіоаміду на амідин B: перетворення аміда на тіоамід (осіркування) C: циклізація D: N-ацилування Проміжні сполуки формул (XII-а) і (XII-с) на наведеній вище схемі реакцій (10) можна отримати з відповідних проміжних сполук формул (XIII-а) і (XIII-с) відомими в даній галузі процедурами N-ацилування (стадія D реакції). Вказане N-ацилування можна прийнятним чином проводити обробкою проміжних сполук формул (XIII-а) і (XIII-с) проміжною сполукою формули (XIV) у присутності основи, такої як бікарбонат натрію, або суміші основ, такої як бікарбонат 9 UA 109663 C2 5 10 15 20 натрію/N, N-діізопропілетиламін, у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, етанол, або суміші інертних розчинників, такої як, наприклад, етанол/дихлорметан, при температурі від -80 °C до 100 °C, бажано від -15 °C до 25 °C, протягом від 30 хвилин до 100 годин, бажано від 1 години до 24 годин. Проміжні сполуки формул (XIII-а) і (XIII-с) на схемі реакцій (11) можна отримати з 1 відповідних проміжних сполук формул (XV-а) і (XV-с), в яких Z є прийнятною захисною групою 2 системи піразолу, такою як, наприклад, диметилсульфамоїльна група, і Z є прийнятною захисною групою амінів, такою як, наприклад, трет-бутансульфінільна група, відомими в даній галузі процедурами N-зняття захисту (стадія Е реакції). Вказане N-зняття захисту можна відповідним чином проводити обробкою відповідних проміжних сполук формул (XV-а) і (XV-с) прийнятним кислотним агентом, таким як, наприклад, хлористоводнева кислота, у прийнятному інертному розчиннику, такому як, наприклад, 1,4-діоксан, при помірно високій температурі, такій як, наприклад, 25 °C, наприклад, протягом 1 години. Проміжні сполуки згідно формул (XV-а) і (XV-с) на схемі реакції (11) можна отримати взаємодією проміжних сполук формул (XVII-а) і (XVII-с) відомими в даній галузі процедурами перетворення іміна в алкіламін (стадія F реакції). Вказане перетворення можна прийнятним чином проводити обробкою відповідних проміжних сполук формул (XVII-а) і (XVII-с) проміжною сполукою формули (XVI), в якій Y є галогеном, у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, тетрагідрофуран, при низькій температурі, такій як, наприклад, 0 °C, наприклад, протягом 2 годин. 10 UA 109663 C2 11 UA 109663 C2 5 10 15 20 25 30 35 E: N-зняття захисту F: перетворення іміна на алкіламін G: перетворення кетону на імін H: окислення спиртової групи на карбоніл I: орто-літіювання-алкілування Проміжні сполуки згідно формулам (XVII-а) і (XVII-с) на наведеній вище схемі реакцій (11) можна отримати взаємодією проміжних сполук формул (XIX-а) і (XIX-с) по відомим у даній галузі методикам перетворення кетону в імін (стадія G реакції). Вказане перетворення можна прийнятним чином проводити обробкою відповідних проміжних сполук формул (XIX-а) і (XIX-с) 2 проміжною сполукою формули (XVIII), в якій Z є алкілсульфінільною групою, такою як, наприклад, трет-бутансульфінільна група, у присутності прийнятного каталізатора, кислоти Льюїса, такої як ізопропоксид титану(IV), у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, толуол, за таких термічних умов, як, наприклад, нагрівання реакційної суміші при 110 °C, наприклад, протягом 24 годин. Проміжні сполуки формул (XIX-а) і (XIX-с) у наведеній вище схемі реакцій (11) можна отримати взаємодією проміжних сполук формул (XX-а) і (XX-с) відомими в даній галузі процедурами окислення спиртової групи в карбоніл (стадії Н реакції). Вказане окислення можна прийнятним чином проводити обробкою прийнятних проміжних сполук формул (XX-а) і (XX-с) окислюючим агентом, таким як, наприклад, періодинан Десс-Мартіна [CAS: 87413-09-0], у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, дихлорметан, при низьких температурах, таких як, наприклад, 0 °C, наприклад, протягом 10 хвилин і потім при помірно високій температурі, такій як, наприклад, 25 °C, наприклад, протягом 1 години. Проміжні сполуки згідно з формулами (XX-а) і (XX-с) на наведеній вище схемі реакції (11) можна отримати взаємодією проміжних сполук формул (XXII-а) і (XXII-с) відомими в даній галузі процедурами орто-літіювання-алкілування (стадія I реакції). Вказане перетворення можна прийнятним чином проводити обробкою відповідних проміжних сполук формул (XXII-а) і (XXII-с) відповідним літійорганічним реагентом, таким як, наприклад, н-бутиллітій, у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, тетрагідрофуран, при низьких температурах, таких як, наприклад -78 °C, наприклад, протягом 45 хвилин з подальшою обробкою проміжними сполуками формул (XXI-а) і (XXI-с) при низькій температурі, такій, як, наприклад -78 °C, наприклад, протягом 45 хвилин. 1 Проміжні сполуки формул (XXII-а) і (XXII-с), в яких Z є прийнятною захисною групою системи піразолу, такою як, наприклад, диметилсульфамоїльна група, зазвичай отримують відомими в даній галузі процедурами типа N-захисту, описаним в літературі. Схема реакцій 12 12 UA 109663 C2 5 10 15 20 25 J: перетворення аміда Вейнреба на кетон K: отримання аміда Вейнреба 6 Крім того, проміжні сполуки формул (XIX-а) і (XIX-с), в яких R є воднем, на наведеній вище схемі реакцій (12) можна отримати взаємодією проміжних сполук формул (XXIV-а) і (XXIV-с) відомими в даній галузі процедурами перетворення аміда Вейнреба на кетон (стадія J реакції). Вказане перетворення можна прийнятним чином проводити обробкою відповідних проміжних сполук формул (XXIV-а) і (XXIV-с) проміжними сполуками формул (XXIII-а) і (XXIII-с), в яких Y є галогеном, у прийнятному, інертному в реакційних умовах розчиннику, такому як, наприклад, тетрагідрофуран, при низькій температурі, такій як, наприклад -78 °C, наприклад, протягом 1 години і потім при помірно високій температурі, такій як, наприклад, 25 °C, наприклад, протягом 5 годин. Проміжні сполуки формул (XXIV-а) і (XXIV-с) на наведеній вище схемі реакцій (12) можна отримати взаємодією проміжних сполук формул (XXV-а) і (XXV-с) за відомими процедурами отримання аміда Вейнреба (стадія K реакції). Вказане перетворення можна прийнятним чином проводити обробкою відповідних проміжних сполук формул (XXV-а) і (XXV-с) Ν,Οдиметилгідроксиламіном у присутності прийнятної основи, такої як, наприклад, ізопропілмагнійхлорид, у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, дихлорметан, при низькій температурі, такій як, наприклад -78 °C, наприклад, протягом 1 години і потім при помірно високій температурі, такій як, наприклад, 25 °C, наприклад, протягом 24 годин. 1 Проміжні сполуки формул (XXV-а) і (XXV-с), в яких Z є прийнятною захисною групою системи піразолу, такою як, наприклад, диметилсульфамоїльна група, є комерційно доступними. 6 Крім того, проміжні сполуки формул (XIII-а) і (XIII-с), в яких R є воднем, на схемі реакції (13) 3 можна отримати з відповідних проміжних сполук формул (XXVI-а) і (XXVI-с), в яких Z є захисною групою для амінів, такою як, наприклад, трет-бутоксикарбонільна група (стадія Е 13 UA 109663 C2 5 10 реакції), відомими в даній галузі процедурами N-зняття захисту, такими, як процедури, описані на схемі реакції (11) (стадія Е реакції). Проміжні сполуки формул (XXVI-а) і (XXVI-с) на схемі реакцій (13) можна отримати взаємодією проміжних сполук формул (XXVII-а) і (XXVII-с) відомими в даній галузі процедурами утворення кільця піразолу (стадія L реакції). Вказане утворення кільця піразолу можна прийнятним чином проводити обробкою відповідних проміжних сполук формул (XXVII-а) і (XXVII-с) у прийнятному інертному розчиннику, такому як, наприклад, етанол, у присутності гідразину, при помірно високій температурі, такій як, наприклад, 25 °C, наприклад, протягом 1 години. Проміжні сполуки формул (XXVII-а) і (XXVII-с) на схемі реакцій (13) можна отримати взаємодією проміжних сполук формул (XXVIII-а) і (XXVIII-с) відомими в даній галузі процедурами окислення спиртової групи в карбоніл, такими як процедури, описані на схемі реакцій (11) (стадія Н реакції). 15 14 UA 109663 C2 5 10 15 20 25 30 35 E: N-видалення захисту L: утворення кільця піразолу H: окислення спиртової групи в карбоніл М: перетворення альдегідної групи в гідроксиалкініл Проміжні сполуки згідно формул (XXVIII-а) і (XXVIII-с) на наведеній вище схемі реакцій (13) можна отримати взаємодією проміжних сполук формул (XXIX-а) і (XXIX-с) відомими в даній галузі процедурами перетворення альдегідної групи в гідроксиалкініл (стадії М реакції). Вказане перетворення можна прийнятним чином проводити обробкою відповідних проміжних сполук формул (XXIX-а) і (XXIX-с) прийнятним магнієвим реагентом, таким як, наприклад, етинілмагнійбромід, у прийнятному, інертному в умовах реакції розчиннику, такому як, наприклад, тетрагідрофуран, при низькій температурі, такій як, наприклад, 0 °C, наприклад, протягом 10 хвилин і потім при помірно високій температурі, такій як, наприклад, 25 °C, наприклад, протягом 30 хвилин. Проміжні сполуки формул (XXIX-а) і (XXIX-с) на наведеній вище схемі реакцій (13) можна отримати взаємодією проміжних сполук формул (XXX-а) і (XXX-с) відомими в даній галузі процедурами окислення спиртової групи на карбоніл, такими, як процедури, описані на схемі реакцій (11) (стадія Н реакції). 3 Проміжні сполуки формул (XXX-а) і (XXX-с), в яких Z є захисною групою для амінів, такою як, наприклад, трет-бутоксикарбонільна група, зазвичай отримують відомими в даній галузі процедурами типа Strecker, описаними в літературі. ФАРМАЦЕВТИЧНІ КОМПОЗИЦІЇ Даний винахід також відноситься до композицій для запобігання або лікування захворювань, при яких інгібування бета-секретази є сприятливим, таких як хвороба Альцгеймера (AD), помірний когнітивний розлад, старіння, деменція, деменція з тільцями Леві, синдром Дауна, деменція, пов'язана з інсультом, деменція, пов'язана з хворобою Паркінсона, і деменція, пов'язана з бета-амілоїдом. Вказані композиції містять терапевтично ефективну кількість сполуки формули (I) і фармацевтично прийнятний носій або розчинник. Хоча активний інгредієнт можна вводити окремо, бажаним є його застосування у складі фармацевтичної композиції. Відповідно до цього, даний винахід відноситься далі до фармацевтичної композиції, що містить сполуки згідно з даним винаходом разом з фармацевтично прийнятним носієм або розчинником. Носій або розчинник має бути "прийнятним" у сенсі сумісності з іншими інгредієнтами композиції і має бути нешкідливим для його реципієнтів. Фармацевтичні композиції за даним винаходом можна отримати будь-якими способами, добре відомими в області фармації. Терапевтично ефективну кількість конкретної сполуки, у 15 UA 109663 C2 5 10 15 20 25 30 35 40 45 50 55 60 формі основи або у формі аддитивної солі, як активного інгредієнта об'єднують з утворенням однорідної суміші з фармацевтично прийнятним носієм, який може приймати різні форми залежно від форми препарату, потрібного для введення. Ці фармацевтичні композиції є бажаними у вигляді дозованої лікарської форми, прийнятної бажано для системного введення, такого як пероральне, черезшкірне або парентеральне введення, або місцевого введення, такого як введення за допомогою інгаляції, спрея для носа, очних крапель або за допомогою крему, гелю, шампуня або тому подібного. Наприклад, при отриманні композицій у пероральній лікарській формі, можна застосовувати будь-яке із звичайних фармацевтичних середовищ, таких як, наприклад, вода, гліколі, масла, спирти і тому подібне в разі пероральних рідких препаратів, таких як суспензії, сиропи, еліксири та розчини; або тверді носії, такі як крохмалі, цукри, каолін, змащуючі речовини, в'яжучі речовини, дезинтегруючі агенти і тому подібне в разі порошків, пілюль, капсул і пігулок. Через легкість їх уведення, пігулки і капсули є найбільш прийнятною пероральною дозованою лікарською формою, у цьому випадку, поза сумнівом, застосовують тверді фармацевтичні носії. Для парентеральних композицій носій зазвичай містить стерильну воду, щонайменше в значній кількості, хоча можуть бути включені інші інгредієнти, наприклад, для підвищення розчинності. Наприклад, можна отримати розчини для ін'єкцій, в яких носій містить сольовий розчин, розчин глюкози або суміш сольового розчину і розчину глюкози. Можна також отримати суспензії для ін'єкцій, у цьому випадку можна застосовувати прийнятні рідкі носії, суспендуючі агенти, і тому подібне. У композиціях, прийнятних для підшкірного введення, носій необов'язково містить агент, що підвищує проникнення, та/або прийнятний змочуючий агент, необов'язково у поєднанні з прийнятними добавками будь-якої природи в невеликих пропорціях, такі добавки не спричиняють ніяких істотних шкідливих впливів на шкіру. Вказані добавки можуть полегшити введення в шкіру та/або можуть бути корисними при отриманні бажаних композицій. Ці композиції можна вводити різними шляхами, наприклад, у вигляді черезшкірного пластиру, у вигляді плями або у вигляді мазі. Особливо прийнятним є виготовлення вищезгаданих фармацевтичних композицій у дозованій лікарській формі для простоти введення і однорідності дозування. Дозована лікарська форма, що застосовується в описі і формулі винаходу, відноситься до фізично дискретних одиниць, прийнятних як одиничні дози, причому кожна одиниця містить задану кількість активного інгредієнта, розраховану для отримання бажаної терапевтичної дії, у поєднанні з необхідним фармацевтичним носієм. Прикладами таких дозованих лікарських форм є пігулки (включаючи пігулки з насічками або пігулки, вкриті оболонкою), капсули, пілюлі, пакетики з порошком, облатки, розчини або суспензії для ін'єкції, чайні ложки з препаратом, столові ложки з препаратом і тому подібне, і їх сегреговані багатократні дози. Точне дозування і частота введення залежать від конкретної сполуки формули (I), що застосовується, конкретного стану, що піддається лікуванню і важкості стану, що піддається лікуванню, віку, маси, статі, міри порушення і загального фізичного стану конкретного пацієнта, а також іншої лікарської терапії, яку може приймати індивідуум, що добре відоме фахівцям у даній галузі. Крім того, очевидно, що вказану ефективну добову кількість можна зменшити або збільшити, залежно від реакції суб'єкту, що піддається лікуванню та/або залежно від оцінки лікаря, що прописує сполуки за даним винаходом. Залежно від способу введення, фармацевтична композиція міститиме від 0,05 до 99 мас. %, бажано від 0,1 до 70 мас. %, бажаніше від 0,1 до 50 мас. % активного інгредієнта, і від 1 до 99,95 мас. %, бажано від 30 до 99,9 % мас. %, бажаніше від 50 до 99,9 мас. % фармацевтично прийнятного носія, причому всі відсотки засновані на загальній масі композиції. Дані сполуки можна застосовувати для системного введення, такого як пероральне, черезшкірне або парентеральне введення, або місцевого введення, такого як введення за допомогою інгаляції, спрея для носа, очних крапель або за допомогою крему, гелю, шампуня або тому подібного. Сполуки бажано вводять перорально. Точне дозування і частота введення залежать від конкретної сполуки згідно формулі (I), що застоовується, конкретного стану, що піддається лікуванню, важкості стану, що піддається лікуванню, віку, маси, статі, міри порушення і загального фізичного стану конкретного пацієнта, а також іншої лікарської терапії, яку може приймати індивідуум, що добре відоме фахівцям у даній галузі. Крім того, очевидно, що вказану ефективну добову кількість можна зменшити або збільшити, залежно від реакції суб'єкта, що піддається лікуванню, та/або залежно від оцінки лікаря, що прописує сполуки за даним винаходом. Кількість сполуки формули (I), яка може бути об'єднана з речовиною-носієм для виготовлення лікарської форми для разового застосування, змінюватиметься залежно від захворювання, що піддається лікуванню, виду ссавця і конкретного способу введення. Тим не 16 UA 109663 C2 5 10 15 20 25 30 35 40 45 менш, як загальне правило, прийнятні одиничні дози сполук за даним винаходом можуть, наприклад, бажано містити від 0,1 мг до 1000 мг активної речовини. Бажана одинична доза складає від 1 мг до приблизно 500 мг. Бажанішою одиничною дозою є доза від 1 мг до приблизно 300 мг. Ще бажанішою дозою є доза від 1 мг до приблизно 100 мг. Такі одиничні дози можна вводити більше одного разу на день, наприклад, 2, 3, 4, 5 або 6 раз на день, але бажано 1 або 2 рази в день, так щоб загальна доза для дорослого пацієнта масою 70 кг була в діапазоні від 0,001 до приблизно 15 мг на кг маси суб'єкта на одне введення. Бажана доза складає від 0,01 до приблизно 1,5 мг на кг маси суб'єкта на одне введення, і така терапія може тривати протягом ряду тижнів або місяців, а в деяких випадках, років. Проте, повинно бути зрозуміло, що конкретний рівень дози для будь-якого конкретного пацієнта залежатиме від цілого ряду чинників, що включають активність конкретної сполуки, що використовується, вік, масу тіла, загальний стан здоров'я, стать і харчування пацієнта, що піддається лікуванню; час і шлях введення; швидкість виведення; інші лікарські засоби, які раніше були введені, і важкості конкретного захворювання, що піддається лікуванню, що добре знають фахівці в даній галузі. У деяких випадках може бути необхідно застосовувати дози поза цими діапазонами, що має бути очевидним фахівцям у даній галузі. Крім того, звертається увага на те, що клініцист або лікар, який здійснює лікування, повинні знати, як і коли почати, перервати, регулювати або припинити терапію залежно від реакції окремого пацієнта. Мається на увазі, що наступні приклади ілюструють, але не обмежують обсяг даного винаходу. Експериментальна частина Надалі "т.пл" означає точку плавлення, "вод." означає, водний, "р.с." означає, реакційну суміш, "к.т.", означає кімнатну температуру, "DIPEA" означає діізопропілетиламін, "DIPE" означає діізопропіловий простий ефір, Et2О означає діетиловий простий ефір, "ТГФ" означає тетрагідрофуран, "ДМФА" означає диметилформамід, "DCM" означає дихлорметан, "AcOEt" означає етилацетат, "AcOH" означає оцтову кислоту, "MeOН" означає метанол, "EtOH" означає етанол, "рац." означає рацемічний, "нас." означає насичений, "SFC" означає надкритичну рідинну хроматографію, "SFC-МС" означає надкритичну рідинну хроматографію/масспектрометрію, "LCMS" означає рідинну хроматографію/мас-спектрометрію, "ВЕРХ" означає високоефективну рідинну хроматографію, "DMTMM" означає хлорид 4-(4,6-диметокси-1,3,5триазин-2-іл)-4-метилморфолінію, "HATU" означає гексафторфосфат O-(7-азабензотриазол-1іл)-N, N,N',N'-тетраметилуронію. А. Отримання проміжних сполук Приклад A1 Отримання проміжної сполуки 1: рац-2-аміно-2-(3-бромфеніл)пропаннітрила Триметилсилілціанід (20 г, 200 ммоль) додавали до перемішуваного розчину 3бромацетофенона (20 г, 100 ммоль) і NH4Cl (11 г, 200 ммоль) у розчині NH3/MeOH (400 мл). Суміш перемішували при кімнатній температурі протягом 4 днів. Потім розчинник упарювали у вакуумі і залишок поміщали в АсОЕt (100 мл). Тверду речовину фільтрували і фільтрат упарювали у вакуумі, отримуючи при цьому рац-2-аміно-2-(3-бромфеніл)пропіонітрил (20 г, вихід 86 %), який застосовували на наступній стадії без додаткового очищення. Приклад А2 Отримання проміжної сполуки 2: рац-метил-2-аміно-2-(3-бромфеніл)пропаноата Рац-2-аміно-2-(3-бромфеніл)пропіонітрил (20 г, 88,9 ммоль) розчиняли в розчині НСl/MeOH (500 мл) і суміш кип'ятили із зворотнім холодильником протягом 4 днів. Після охолоджування до кімнатної температури додавали AcOEt (100 мл) і воду (100 мл) і суміш екстрагували AcOEt (2 × 100 мл). Об'єднані водні шари підлужували водним розчином аміаку до рН 8 і екстрагували 17 UA 109663 C2 5 10 15 20 25 30 35 40 АсОЕt (5 × 100 мл). Об'єднані органічні шари сушили (Na2SO4), фільтрували і розчинники випарювали у вакуумі, отримуючи при цьому метиловий ефір рац-2-аміно-2-(3бромфеніл)пропіонової кислоти (10,6 г, 46 % вихід) у вигляді масла. Приклад A3 Отримання проміжної сполуки 3: рац-2-аміно-2-(3-бромфеніл)пропан-1-ола Літійалюмінійгідрид (1 М у ТГФ; 22 мл, 22 ммоль) додавали по краплях до перемішуваного розчину метилового ефіру рац-2-аміно-2-(3-бромфеніл)пропіонової кислоти (7,5 г, 29,1 ммоль) у ТГФ (200 мл) при -15 °C. Суміш залишали для повільного прогрівання до 0 °C протягом 1 години. Потім по краплях додавали ще ТГФ (150 мл) і нас. розчин Na2SO4 до того часу, поки більше не утворювався водень. Потім додавали безводний Na2SO4 і суміш перемішували протягом ночі при кімнатній температурі. Суміш фільтрували через діатомову землю, промивали ТГФ і розчинник випарювали у вакуумі. Сирий продукт очищали колонковою флешхроматографією (силікагель, 7 М розчин аміаку в розчині метанолу в DCM, від 0/100 до 3/97). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому рац-2-аміно-2-(3бромфеніл)пропан-1-ол (5,70 г, вихід 85 %) у вигляді масла. Приклад A4 Отримання проміжної сполуки 4: (R)-2-аміно-2-(3-бромфеніл)пропан-1-ола Зразок рац-2-аміно-2-(3-бромфеніл)пропан-1-ола (15,4 г) розділяли на відповідні енантіомери препаративною SFC (на Chiralpak® Daicel ADх250 мм). Рухома фаза (СО2, MeOH з 0,2 % iPrNH2), отримуючи при цьому (R)-2-аміно-2-(3-бромфеніл)пропан-1-ол (7,21 г, вихід 40 %). αD=-14,9 (589 нм, с 0,2946 мас./об. %, MeOH, 20 °C). Приклад А5 Отримання проміжної сполуки 5: рац-трет-бутил-N-[1-(3-бромфеніл)-2-гідрокси-1метилетил]карбамат Ди-трет-бутилдикарбонат (4,84 г, 22,16 ммоль) додавали порціями до перемішуваного розчину рац-2-аміно-2-(3-бромфеніл)пропан-1-ола (1,7 г, 7,39 ммоль) у суміші нас. NaHCО3 (15 мл) і ТГФ (15 мл) при 0 °C. Суміш перемішували при 0 °C протягом 10 хвилин і при кімнатній температурі протягом 15 годин. Суміш охолоджували на бані з крижаною водою і підкислювали при перемішуванні до рН 1-2 за допомогою KHSO4. Органічний шар відокремлювали і водний шар далі екстрагували АсОЕt. Об'єднані органічні шари відокремлювали, сушили (MgSO4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флешхроматографією (діоксид кремнію; AcOEt у DCM, від 0/100 до 20/80). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому трет-бутиловий ефір рац-[1-(3-бромфеніл)-2гідрокси-1-метилетил]карбамінової кислоти (2,36 г, вихід 93 %) у вигляді безбарвного масла. Приклад A6 Отримання проміжної сполуки 6: рац-трет-бутил-N-[1-(3-бромфеніл)-1-метил-2оксоетил]карбамата 18 UA 109663 C2 5 10 15 20 25 30 35 40 Періодинан Десса-Мартина (3,55 г, 8,36 ммоль) додавали порціями впродовж 5 хвилин до розчину трет-бутилового ефіру рац-[1-(3-бромфеніл)-2-гідрокси-1-метилетил]карбамінової кислоти (2,3 г, 6,97 ммоль) у сухому DCM (45 мл) при 0 °C. Суміш перемішували при 0 °C протягом 10 хвилин і при кімнатній температурі протягом 1 години. Реакційну суміш гасили NaHCО3 (водн. нас. розчин) з подальшим гасінням NaHSО3 (водн. нас. розчин). Потім додавали Et2О і суміш перемішували при кімнатній температурі протягом 30 хвилин. Органічний шар відокремлювали і водний шар далі екстрагували Et2О. Об'єднані органічні шари відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель; DCM). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому трет-бутиловий ефір рац-[1-(3бромфеніл)-1-метил-2-оксоетил]карбамінової кислоти (2 г, вихід 80 %) у вигляді безбарвного масла. Приклад A7 Отримання проміжної сполуки 7: рац-трет-бутил-N-[1-(3-бромфеніл)-2-гідрокси-1-метилбут3-иніл]карбамат 0,5 М розчин етинілмагнійброміда в ТГФ (23,89 мл, 11,94 ммоль) по краплях додавали до розчину трет-бутилового ефіру рац-[1-(3-бромфеніл)-1-метил-2-оксоетил]карбамінової кислоти (1,96 г, 5,97 ммоль) у ТГФ (60 мл) при 0 °C в атмосфері азоту. Суміш перемішували при 0 °C протягом 15 хвилин і при кімнатній температурі протягом 30 хвилин. Суміш розбавляли NH4Cl (водн. нас. розчин) і екстрагували DCM. Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі, отримуючи при цьому трет-бутиловий ефір рац-[1-(3-бромфеніл)-2-гідрокси-1-метил-бут-3-иніл]карбамінової кислоти (2,11 г, вихід 99 %) у вигляді масла, яке застосовували на наступній стадії без додаткового очищення. Приклад A8 Отримання проміжної сполуки 8: рац-трет-бутил-N-[1-(3-бромфеніл)-1-метил-2-оксобут-3иніл]карбамата Періодінан Десса-Мартина (3,04 г, 7,16 ммоль) додавали порціями впродовж 5 хвилин до розчину трет-бутилового ефіру рац-[1-(3-бромфеніл)-2-гідрокси-1-метилбут-3-иніл]карбамінової кислоти (2,12 г, 5,97 ммоль) у сухому DCM (20 мл) при 0 °C. Суміш перемішували при 0 °C протягом 10 хвилин і при кімнатній температурі протягом 1 години. Реакційну суміш гасили NaHCО3 (водн. нас. розчин) з подальшим гасінням NaHSО3 (водний нас. розчин). Потім додавали Et2О і суміш перемішували при кімнатній температурі протягом 30 хвилин. Органічний шар відокремлювали і водний шар додатково екстрагували Et2О. Об'єднані органічні шари відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель, DCM). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому трет-бутиловий ефір рац-[1-(3бромфеніл)-1-метил-2-оксобут-3-иніл]карбамінової кислоти (1,89 г, вихід 90 %) у вигляді масла. Приклад A9 19 UA 109663 C2 Отримання проміжної іл)етил]карбамата 5 10 15 20 25 30 35 40 сполуки 9: рац-трет-бутил-N-[1-(3-бромфеніл)-1-(1H-піразол-3 Гідразингідрат (2,48 мл, 51,10 ммоль) додавали до розчину трет-бутилового ефіру рац-[1-(3бромфеніл)-1-метил-2-оксо-бут-3-иніл]карбамінової кислоти (1,8 г, 5,11 ммоль) в EtOH (30 мл) і суміш перемішували при кімнатній температурі протягом 1 години. Розчинник видаляли у вакуумі і залишок розчиняли в DCM і промивали водою. Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель; AcOEt у DCM, від 0/100 до 50/50). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому трет-бутиловий ефір рац-[1-(3бромфеніл)-1-(1H-піразол-3-іл)етил]карбамінової кислоти (1,62 г, вихід 87 %) у вигляді твердої речовини білого кольору. Приклад A10 Отримання проміжної сполуки 10: рац-1-(3-бромфеніл)-1-(1H-піразол-3-іл)етанаміна 4 М хлористоводневу кислоту в діоксані (7,88 мл, 31,54 ммоль) додавали до трет-бутилового ефіру рац-[1-(3-бромфеніл)-1-(1H-піразол-3-іл)етил]карбамінової кислоти (1,65 г, 4,51 ммоль) при кімнатній температурі. Суміш перемішували при кімнатній температурі протягом 1 години. Розчинник випарювали у вакуумі. Залишок суспендували в DCM і промивали NaHCO3 (водн. нас. розчин). Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі, отримуючи при цьому рац-1-(3-бромфеніл)-1-(1H-піразол-3-іл)етиламін (1,2 г, вихід 100 %) у вигляді твердої речовини білого кольору, яку застосовували на наступній стадії без додаткового очищення. Приклад A11 Отримання проміжної сполуки 11: рац-N-[1-(3-бромфеніл)-1-(1H-піразол-3-іл)етил]-2хлорацетаміда DIPEA (1,18 мл, 6,77 ммоль) додавали до розчину рац-1-(3-бромфеніл)-1-(1H-піразол-3іл)етиламіну (1,2 г, 4,51 ммоль) у DCM (20 мл) і суміш охолоджували на крижаній бані. Потім додавали хлорацетилхлорид (0,40 мл, 4,96 ммоль) і суміш перемішували при 0 °C протягом 3 годин. Суміш розбавляли NH4C1 (водн. нас. розчин) і екстрагували DCМ. Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель, AcOEt у DCM, від 0/100 до 20/80). Цільові фракції збирали і концентрували у вакуумі. Залишок розчиняли в етанолі (10 мл) і NaHCО3 (водн. нас. розчин) (1 мл) і суміш перемішували при кімнатній температурі протягом 30 хвилин. Суміш розбавляли водою і продукт екстрагували DCМ. Об'єднані органічні шари концентрували у вакуумі, отримуючи при цьому рац-N-[1-(3-бромфеніл)-1-(1H-піразол-3-іл)етил]2-хлорацетамід (1,22 г, вихід 79 %) у вигляді безбарвного масла, яке застосовували на наступній стадії без додаткового очищення. Приклад A12 Отримання проміжної сполуки 12: рац-4-(3-бромфеніл)-4-метил-4,5-дигідропіразоло[1,5а]піразин-6-она 20 UA 109663 C2 5 10 15 20 25 30 35 Розчин рац-N-[1-(3-бромфеніл)-1-(1H-піразол-3-іл)етил]-2-хлорацетаміда (1,22 г, 3,56 ммоль) у ТГФ (40 мл) по краплях додавали до суспензії гідриду натрію (0,28 г, 7,12 ммоль) у ТГФ (40 мл) при 0 °C в атмосфері азоту. Суміш перемішували при 0 °C протягом 1 години. Суміш розбавляли водою і продукт екстрагували DCМ. Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі. Сирийпродукт очищали колонковою флеш-хроматографією (силікагель: AcOEt у DCM, від 50/50 до 100/0). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому рац-4-(3-бромфеніл)-4-метил-4,5дигідропіразоло[1,5-а]піразин-6-он (0,7 г, вихід 64 %) у вигляді твердої речовини білого кольору. Приклад A13 Отримання проміжної сполуки 13: рац-4-(3-бромфеніл)-4-метил-4,5-дигідропіразоло[1,5а]піразин-6-тіона Пентасульфід фосфору (1,02 г, 4,57 ммоль) додавали до розчину рац-4-(3-бромфеніл)-4метил-4,5-дигідропіразоло[1,5-а]піразин-6-она (0,7 г, 2,29 ммоль) у піридині (10 мл) і суміш нагрівали при 95 °C протягом 18 годин. Потім розчинник випарювали у вакуумі і залишок очищали колонковою флеш-хроматографією (силікагель; розчин AcOEt у DCM, від 0/100 до 100/0). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому рац-4-(3бромфеніл)-4-метил-4,5-дигідропіразоло[1,5-а]піразин-6-тіон (0,45 г, вихід 61 %) у вигляді твердої речовини білого кольору. Приклад A14 Отримання проміжної сполуки 14: рац-4-(3-бромфеніл)-4-метил-4,7-дигідропіразоло[1,5а]піразин-6-аміна NH4Cl (0,15 г, 2,79 ммоль) додавали до перемішуваного розчину рац-4-(3-бромфеніл)-4метил-4,5-дигідропіразоло[1,5-а]піразин-6-тіона (0,45 г, 1,40 ммоль) в EtOH (50 мл) і суміші нагрівали при 80 °C протягом 28 годин. Розчинник видаляли у вакуумі і залишок розчиняли в DCM і промивали водою. Органічний шар відокремлювали, сушили (MgSО4), фільтрували, і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель; 7 М розчин аміаку в розчині метанолу в AcOEt, від 0/100 до 20/80). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому рац-4-(3-бромфеніл)-4-метил-4,7дигідропіразоло[1,5-а]піразин-6-іламін (0,42 г, вихід 99 %) у вигляді жовтої твердої речовини. Приклад A15 Отримання проміжної сполуки 15: рац-4-[3-(бензгідриліденаміно)феніл]-4-метил-4,7дигідропіразоло[1,5-а]піразин-6-аміна 21 UA 109663 C2 5 10 15 20 25 30 35 40 Толуол (10 мл) додавали до суміші рац-4-(3-бромфеніл)-4-метил-4,7-дигідропіразоло[1,5а]піразин-6-іламіна (0,39 г, 1,28 ммоль), трис(дибензиліденацетон) дипалладію(0) (0,12 г, 0,13 ммоль), рац-2,2'-біс(дифенілфосфіно)-1,1'-бінафтила (0,24 г, 0,38 ммоль) і трет-бутоксида натрію (0,22 г, 2,3 ммоль) у запаяній трубці в атмосфері азоту при кімнатній температурі. Суміш продували азотом протягом декількох хвилин і потім додавали імін бензофенону (0,43 мл, 2,56 ммоль) і суміш перемішували при 100 °C протягом 2 годин. Після охолоджування суміш розбавляли водою і екстрагували DCM. Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флешхроматографією (діоксид кремнію; 7 М розчин аміаку в розчині метанолу в DCM, від 0/100 до 3/97). Необхідні фракції збирали і концентрували у вакуумі, отримуючи при цьому рац-4-[3(бензгідриліденаміно)феніл]-4-метил-4,7-дигідропіразоло[1,5-а]піразин-6-іламін (0,37 г, вихід 70 %) у вигляді жовтої піни. Приклад A16 Отримання проміжної сполуки 16: рац-4-(3-амінофеніл)-4-метил-4,7-дигідропіразоло[1,5а]піразин-6-аміна 37 % хлористоводневу кислоту в Н2О (0,14 мл) додавали до розчину рац-4-[3(бензгідриліденаміно)феніл]-4-метил-4,7-дигідропіразоло[1,5-а]піразин-6-іламіна (0,37 г, 0,9 ммоль) в ізопропанолі (10 мл). Суміш перемішували при кімнатній температурі протягом 3 годин. Додавали Et2О і суміш перемішували протягом 15 хвилин. Осаджену тверду речовину відокремлювали фільтруванням, промивали Et2О і сушили у вакуумі. Залишок суспендували в DCM і промивали NaHCО3 (водн. нас. розчин). Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі, отримуючи при цьому рац-4-(3амінофеніл)-4-метил-4,7-дигідропіразоло[1,5-а]піразин-6-амін (0,21 г, вихід 97 %) у вигляді твердої речовини білого кольору, яку застосовували на наступній стадії без додаткового очищення. Приклад A17 Отримання проміжної сполуки 17: 1H-піразол-3-карбонової кислоти Розчин перманганату калію (16,17 г, 102,31 ммоль) у воді (150 мл) додавали до розчину 3метилпіразола (4,2 г, 51,15 ммоль) у воді (100 мл) і суміш кип'ятили із зворотним холодильником протягом ночі. Після охолоджування до кімнатної температури нерозчинну речовину видаляли фільтруванням. Фільтрат концентрували до 30 мл і 2 н HCl додавали до осадження твердої речовини. Тверду речовину відокремлювали фільтруванням, промивали холодною водою і сушили у вакуумі, отримуючи при цьому 1H-піразол-3-карбонову кислоту (3,1 г, вихід 54 %) у вигляді твердої речовини білого кольору, яку застосовували на наступній стадії без додаткового очищення. Приклад A18 Отримання проміжної сполуки 18: метил-1H-піразол-3-карбоксилата Сірчану кислоту (5,8 мл) додавали по краплях до перемішуваного розчину 1H-піразол-3карбонової кислоти (1 г, 8,92 ммоль) у MeOH (65 мл) при 0 °C. Після завершення додавання суміші надавали можливість для нагрівання до кімнатної температури і перемішували протягом 18 годин. Суміш концентрували у вакуумі і залишок розчиняли у воді і підлужували NaHCО3 22 UA 109663 C2 5 10 15 20 25 30 35 40 (водн. нас. розчин). Суміш екстрагували AcOEt. Органічний шар відокремлювали, сушили (MgSО4), фільтрували, і розчинники випарювали у вакуумі, отримуючи при цьому метиловий ефір 1H-піразол-3-карбонової кислоти (0,7 г, вихід 62 %) у вигляді твердої речовини білого кольору, яку застосовували на наступній стадії без додаткового очищення. Приклад A19 Отримання проміжної сполуки 19: метил-1-(диметилсульфамоїл)-1H-піразол-3-карбоксилата Гідрид натрію (1,57 г, 41,03 ммоль) додавали до розчину метилового ефіру 1H-піразол-3карбонової кислоти (3,45 г, 27,36 ммоль) у ТГФ (20 мл) при 0 °C. Суміш перемішували при 0 °C протягом 30 хвилин. Потім додавали диметилсульфамоїлхлорид (4,41 мл, 41,03 ммоль) і суміш залишали для нагрівання до кімнатної температури і перемішували протягом 18 годин. Суміш розбавляли водою і продукт екстрагували АсОЕt. Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель; AcOEt у DCM, від 0/100 до 10/90). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому метиловий ефір 1-диметилсульфамоїл-1Hпіразол-3-карбонової кислоти (4,8 г, вихід 75 %) у вигляді безбарвного масла. Приклад A20 Отримання проміжної сполуки 20: 1-(диметилсульфамоїл)-N-метокси-N-метил-1H-піразол-3карбоксилата Метиловий ефір 1-диметилсульфамоїл-1H-піразол-3-карбонової кислоти (4 г, 17,15 ммоль) і гідрохлорид Ν,Ο-диметилгідроксиламіна (2,18 г, 22,29 ммоль) суспендували в DCM (20 мл). Суміш продували азотом і охолоджували до -78 °C. Потім по краплях додавали розчин ізопропілмагнійхлорида (2 M у ТГФ) (24,01 мл, 48,02 ммоль). Коли додавання завершували, суміш залишали для нагрівання до кімнатної температури і перемішували протягом ночі. Суміш гасили NH4Cl (водн. нас. розчин) і продукт екстрагували AcOEt. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель, AcOEt у DCM, від 0/100 до 100/0). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому метоксиметиламід 1-диметилсульфамоїл-1H-піразол-3-карбонової кислоти (3,2 г, вихід 71 %) у вигляді масла блідо-жовтого кольору. Приклад A21 Отримання проміжної сполуки 21: 3-(3-хлорфеніл)карбоніл]-N, N-диметил-1H-піразол-1сульфонаміда Розчин 3-хлорфенілмагнійброміда (0,5 М у ТГФ) (15,89 мл, 7,95 ммоль) додавали до розчину метоксиметиламіда 1-диметилсульфамоїл-1H-піразол-3-карбонової кислоти (1,60 г, 6,11 ммоль) у ТГФ (20 мл) при -78 °C в атмосфері азоту. Суміш перемішували при -78 °C протягом 1 години і потім додатково перемішували при кімнатній температурі протягом 5 годин. Суміш гасили NH4Cl (водн. нас. розчин) і продукт екстрагували AcOEt. Органічний шар відокремлювали, сушили (MgSO4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель; AcOEt в DCM, від 0/100 до 10/90). Цільові фракції збирали і 23 UA 109663 C2 5 10 15 20 25 30 35 40 концентрували у вакуумі, отримуючи при цьому диметиламід 3-(3-хлорбензоїл)-1H-піразол-1сульфонової кислоти (1,68 г, вихід 88 %) у вигляді блідо-жовтої твердої речовини. Приклад A22 Отримання проміжної сполуки 22: 3-{[(трет-бутилсульфініл)іміно]-(3-хлорфеніл) метил}-N, Nдиметил-1H-піразол-1-сульфонаміда Ізопропоксид титану(IV) (3,22 мл, 10,71 ммоль) додавали до суміші диметиламіда 3-(3хлорбензоїл)-1H-піразол-1-сульфонової кислоти (1,68 г, 5,35 ммоль) і 2-метил-2пропансульфінаміда (0,71 г, 5,89 ммоль) у толуолі (32 мл) в атмосфері азоту. Суміш перемішували при 110 °C протягом 24 годин. Суміш охолоджували і виливали в сольовий розчин при швидкому перемішуванні. Суміш фільтрували через діатомову землю і осад на фільтрі промивали АсОЕt. Фільтрат переносили в ділильну воронку, де органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель; AcOEt в DCM, від 0/100 до 10/90). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому диметиламід 3[(3-хлорфеніл)-(2-метилпропан-2-сульфініліміно)метил]піразол-1-сульфонової кислоти (2,17 г, вихід 97 %) у вигляді жовтого масла. Приклад A23 Отримання проміжної сполуки 23: 3-[1-(трет-бутилсульфініламіно)-1-(3-хлорфеніл)етил]-N, N-диметил-1H-піразол-1-сульфонаміда Метилмагнійбромід (15,08 мл, 21,11 ммоль) додавали до розчину диметиламіда 3-[(3хлорфеніл)-(2-метилпропан-2-сульфініліміно)метил]піразол-1-сульфонової кислоти (2,2 г, 5,28 ммоль) у ТГФ (25 мл) при 0 °C в атмосфері азоту. Суміш перемішували при 0 °C протягом 2 годин, гасили NH4Cl (водн. нас. розчин) і продукт екстрагували DCM. Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель; AcOEt у DCM, від 0/100 до 100/0). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому диметиламід 3[1-(3-хлорфеніл)-1-(2-метилпропан-2-сульфініламіно)етил]піразол-1-сульфонової кислоти (2,28 г, вихід 99 %) у вигляді безбарвного масла, яке твердне при стоянні. Приклад A24 Отримання проміжної сполуки 24: рац-1-(3-хлорфеніл)-1-(1H-піразол-3-іл)етанаміна 4 М хлористоводневу кислоту в діоксані (19,79 мл, 79,15 ммоль) додавали до розчину диметиламіда 3-[1-(3-хлорфеніл)-1-(2-метилпропан-2-сульфініламіно)етил]піразол-1сульфонової кислоти (2,29 г, 5,28 ммоль) у MeOH (5 мл) і суміші перемішували при 80 °C у запаяній трубці протягом 18 годин. Розчинник випарювали у вакуумі. Залишок виливали в NaHCО3 (водн. нас. розчин) і екстрагували DCМ. Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинники випарювали у вакуумі, отримуючи при цьому рац-1-(3хлорфеніл)-1-(1H-піразол-3-іл)етиламін (1 г, вихід 86 %) у вигляді блідо-жовтої твердої речовини, яку застосовували на наступній стадії без додаткового очищення. 24 UA 109663 C2 Приклад A25 Отримання проміжної іл)етил]ацетаміду 5 10 15 20 25 30 35 сполуки 25: рац-2-хлор-N-[1-(3-хлорфеніл)-1-(1H-піразол-3 Проміжну сполуку 25 синтезували таким же способом, як спосіб, описаний у прикладі A11. Виходячи з проміжної сполуки 24 (1 г, 4,51 ммоль), проміжну сполуку 25 отримували (0,73 г, вихід 54 %) у вигляді твердої речовини білого кольору. Приклад A26 Отримання проміжної сполуки 26: рац-4-(3-хлорфеніл)-4-метил-4,5-дигідропіразоло[1,5а]піразин-6-она Проміжну сполуку 26 синтезували таким же способом, як спосіб, описаний у прикладі A12. Виходячи з проміжної сполуки 25 (0,73 г, 2,43 ммоль), проміжну сполуку 26 отримували (0,45 г, вихід 71 %) у вигляді твердої речовини білого кольору. Приклад A27 Отримання проміжної сполуки 27: рац-4-метил-4-(3-піримідин-5-ілфеніл)-4,5дигідропіразоло[1,5-а]піразин-6-он Ацетат палладію(II) (0,017 г, 0,075 ммоль) додавали до перемішуваної суспензії рац-4-(3хлорфеніл)-4-метил-4,5-дигідропіразоло[1,5-а]піразин-6-она (0,13 г, 0,50 ммоль), піримідин-5боронової кислоти (0,19 г, 1,49 ммоль), 2-дициклогексилфосфіно-2',6'-диметоксибіфеніла (0,061 г, 0,149 ммоль) і фосфату калію (0,21 г, 0,99 ммоль) у толуолі (5 мл) і EtOH (0,5 мл) при кімнатній температурі і в атмосфері азоту. Суміш перемішували при 150 °C протягом 30 хвилин в умовах мікрохвильового випромінювання. Потім суміш фільтрували через діатомову землю і промивали AcOEt. Фільтрат випарювали у вакуумі. Залишок очищали колонковою флешхроматографією (силікагель; АсОЕt). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому рац-4-метил-4-(3-піримідин-5-ілфеніл)-4,5-дигідропіразоло[1,5-а]піразин6-он (0,09 г, вихід 59 %) у вигляді твердої речовини білого кольору. Приклад A28 Отримання проміжної сполуки 28: рац-4-метил-4-(3-піримідин-5-ілфеніл)-4,5дигідропіразоло[1,5-а]піразин-6-тіона Реагент Лоуссона (0,14 г, 0,35 ммоль) додавали до перемішуваного розчину рац-4-метил-4(3-піримідин-5-ілфеніл)-4,5-дигідропіразоло[1,5-а]піразин-6-тіона (0,09 г, 0,30 ммоль) у піридині (2 мл) при кімнатній температурі. Суміш нагрівали при 95 °C протягом 18 годин. Розчинник випарювали у вакуумі і неочищений продукт очищали колонковою флеш-хроматографією (силікагель; AcOEt в DCM, від 0/100 до 20/80). Цільові фракції збирали і концентрували у 25 UA 109663 C2 5 10 15 20 25 30 35 40 вакуумі, отримуючи при цьому рац-4-метил-4-(3-піримідин-5-іл-феніл)-4,5-дигідропіразоло[1,5а]піразин-6-тіон (0,02 г, вихід 21 %) у вигляді твердої речовини білого кольору. Приклад A29 Отримання проміжної сполуки 29: рац-4-[3-(5-метоксипіридин-3-іл)феніл]-4-метил-4,5дигідропіразоло[1,5-а]піразин-6-она Ацетат палладію(II) (0,022 г, 0,097 ммоль) додавали до перемішуваної суспензії рац-4-(3хлорфеніл)-4-метил-4,5-дигідропіразоло[1,5-а]піразин-6-она (0,17 г, 0,65 ммоль), 5метоксипіридин-3-боронової кислоти (0,15 г, 0,97 ммоль), 2-дициклогексилфосфіно-2',6'диметоксибіфеніла (0,080 г, 0,195 ммоль) і фосфату калію (0,28 г, 1,30 ммоль) у толуолі (2 мл) і EtOH (0,2 мл) при кімнатній температурі і в атмосфері азоту. Суміш перемішували при 150 °C протягом 30 хвилин в умовах мікрохвильового випромінювання. Потім суміш фільтрували через діатомову землю і промивали АсОЕt. Фільтрат випарювали у вакуумі. Залишок очищали колонковою флеш-хроматографією (силікагель; AcOEt). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому рац-4-[3-(5-метоксипіридин-3-іл)феніл]-4-метил4,5-дигідропіразоло[1,5-а]піразин-6-он (0,11 г, вихід 51 %) у вигляді твердої речовини білого кольору. Приклад A30 Отримання проміжної сполуки 30: рац-4-[3-(5-метоксипіридин-3-іл)феніл]-4-метил-4,5дигідропіразоло[1,5-а]піразин-6-тіона Піридин (3 мл) додавали до суміші рац-4-[3-(5-метоксипіридин-3-іл)феніл]-4-метил-4,5дигідропіразоло[1,5-а]піразин-6-она (0,11 г, 0,31 ммоль) і пентасульфіда фосфору (0,07 г, 0,31 ммоль), суміш нагрівали при 80 °C протягом 5 годин. Потім додавали ще пентасульфід фосфору (0,07 г, 0,31 ммоль) і суміш нагрівали при 100 °C протягом 18 годин. Потім розчинник випарювали у вакуумі і залишок очищали колонковою флеш-хроматографією (силікагель; МеОН у DCM, від 0/100 до 3/97). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому рац-4-[3-(5-метоксипіридин-3-іл)феніл]-4-метил-4,5-дигідропіразоло[1,5-а]піразин-6-тіон (0,1 г, вихід 93 %) у вигляді твердої речовини білого кольору. Приклад A31 Отримання проміжної сполуки 31: рац-4-(5-бром-2,4-дифторфеніл)-4-метил-4,5дигідропіразоло[1,5-а]піразин-6-тіона Пентасульфід фосфору (2,53 г, 11,40 ммоль) додавали до розчину рац-4-(5-бром-2,4дифторфеніл)-4-метил-4,5-дигідропіразоло[1,5-а]піразин-6-она (3 г, 8,77 ммоль), отриманого по такій самій методиці, яка описана раніше для отримання проміжного рац-4-(3-бромфеніл)-4метил-4,5-дигідропіразоло[1,5-а]піразин-6-она, в піридині (30 мл) і суміш нагрівали при 95 °C протягом 18 годин. Потім розчинник випарювали у вакуумі і залишок очищали колонковою флеш-хроматографією (силікагель; AcOEt у DCM, від 0/100 до 40/60). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому рац-4-(5-бром-2,4-дифторфеніл)-4-метил-4,5дигідропіразоло[1,5-а]піразин-6-тіон (2,4 г, вихід 76 %) у вигляді твердої речовини білого кольору. Приклад A32 26 UA 109663 C2 Отримання проміжної сполуки дигідропіразоло[1,5-а]піразин-6-аміна 5 10 15 20 25 30 35 32: рац-4-(5-бром-2,4-дифторфеніл)-4-метил-4,5 NH4Cl (0,72 г, 13,4 ммоль) додавали до перемішуваної суспензії рац-4-(5-бром-2,4дифторфеніл)-4-метил-4,5-дигідропіразоло[1,5-а]піразин-6-тіона (2,4 г, 6,7 ммоль) у 2 M розчині аміаку в ETOH (67 мл) і суміш нагрівали при 85 °C протягом 18 годин. Розчинник видаляли у вакуумі і залишок суспендували в DCM і промивали водою. Органічний шар відокремлювали, сушили (MgSО4), фільтрували і розчинник випарювали у вакуумі. Сирий продукт очищали колонковою флеш-хроматографією (силікагель; 7 М розчин аміаку в розчині метанолу в AcOEt, від 0/100 до 20/80). Цільові фракції збирали і концентрували у вакуумі, отримуючи при цьому рац-4-(5-бром-2,4-дифторфеніл)-4-метил-4,5-дигідропіразоло[1,5-а]піразин-6-іламін (1,8 г, вихід 78 %) у вигляді жовтої твердої речовини. Приклад А33 Отримання проміжної сполуки 33: (R)-трет-бутил-N-[1-(3-бромфеніл)-2-гідрокси-1метилетил]карбамата Проміжну сполуку 33 синтезували по такій самій методиці, яка описана в прикладі A5. Виходячи з (R)-2-аміно-2-(3-бромфеніл)пропан-1-ола (4,7 г, 20,43 ммоль), проміжну сполуку 33 отримували (6,4 г, вихід 95 %) у вигляді безбарвного масла, яке отверджувалось при стоянні. Приклад A34 Отримання проміжної сполуки 34: (R)-трет-бутил-N-[1-(3-бромфеніл)-1-метил-2оксоетил]карбамата Проміжну сполуку 34 синтезували по такій самій методиці, яка описана в прикладі A6. Виходячи з проміжної сполуки 33 (6,4 г, 19,38 ммоль), проміжну сполуку 34 отримували (5,7 г, вихід 90 %) у вигляді безбарвного масла, яке отверджувалось при стоянні. Приклад А35 Отримання проміжної сполуки 35: діастереоізомерної суміші (1R, 2R) - і (1R, 2S)-трет-бутилN-[1-(3-бромфеніл)-2-гідрокси-1-метилбут-3-ініл]карбамата Проміжну сполуку 35 синтезували по такій самій методиці, як методика, описана в прикладі A7. Виходячи з проміжної сполуки 34 (5,7 г, 17,38 ммоль), проміжну сполуку 35 отримували (5,4 г, вихід 88 %) у вигляді діастереоізомерної суміші у формі масла, яке використовували на наступній стадії без додаткового очищення. Приклад A36 Отримання проміжної сполуки 36: (R)-трет-бутил-N-[1-(3-бромфеніл)-1-метил-2-оксобут-3ініл]карбамата 27 UA 109663 C2 5 10 15 20 25 Проміжну сполуку 36 синтезували за такою ж методикою, як методика, описана в прикладі A8. Виходячи з проміжної сполуки 35 (5,4 г, 15,24 ммоль), проміжну сполуку 36 отримували (5,3 г, вихід 99 %) у вигляді масла блідо-жовтого кольору. Приклад A37 Отримання проміжної сполуки 37: (R)-трет-бутил-N-[1-(3-бромфеніл)-1-(1H-піразол-3іл)етил]карбамата Проміжну сполуку 37 синтезували за такою ж методикою, як методика, описана в прикладі A9. Виходячи з проміжної сполуки 36 (5,3 г, 15,05 ммоль), проміжну сполуку 37 отримували (5 г, вихід 91 %) у вигляді піни. Приклад A38 Отримання проміжної сполуки 38: (R)-1-(3-бромфеніл)-1-(1H-піразол-3-іл)етанаміна Проміжну сполуку 38 синтезували за такою ж методикою, як методика, описана в прикладі A10. Виходячи з проміжної сполуки 37 (5 г, 13,65 ммоль), проміжну сполуку 38 отримували (3,5 г, вихід 96 %) у вигляді твердої речовини білого кольору, яку використовували на наступній стадії без додаткового очищення. Приклад A39 Отримання проміжної сполуки 39: (R)-N-[1-(3-бромфеніл)-1-(1H-піразол-3-іл)етил]-2хлорацетаміда Проміжну сполуку 39 синтезували за такою ж методикою, як методика, описана в прикладі A11. Виходячи з проміжної сполуки 38 (3,5 г, 13,15 ммоль), проміжну сполуку 39 отримували (3,5 г, вихід 78 %) у вигляді безбарвного масла. Приклад A40 Отримання проміжної сполуки 40: (R)-4-(3-бромфеніл)-4-метил-4,5-дигідропіразоло[1,5а]піразин-6-она 28
ДивитисяДодаткова інформація
Назва патенту англійською4,7-dihydro-pyrazolo[1,5-a]pyrazin-6-ylamine derivatives useful as inhibitors of beta-secretase (bace)
Автори англійськоюTrabanco-Suarez, Andres, Avelino, Tresadern, Gary, John, Delgado-Jimenez, Francisca
Автори російськоюТрабанко-Суарез Андрес Авелино, Тресадерн Гэри Джон, Делгадо-Джименез Франциска
МПК / Мітки
МПК: A61P 25/28, A61K 31/4985, C07D 487/04
Мітки: васе, бета-секретази, 4,7-дигідропіразоло[1,5-a]піразин-6-іламіну, похідні, використовуються, інгібітори
Код посилання
<a href="https://ua.patents.su/59-109663-pokhidni-47-digidropirazolo15-apirazin-6-ilaminu-shho-vikoristovuyutsya-yak-ingibitori-beta-sekretazi-vase.html" target="_blank" rel="follow" title="База патентів України">Похідні 4,7-дигідропіразоло[1,5-a]піразин-6-іламіну, що використовуються як інгібітори бета-секретази (васе)</a>
Попередній патент: Фармацевтичні та/або дієтичні композиції на основі коротколанцюгових жирних кислот
Наступний патент: Стінкова конструкція, яка працює як шумовий заслон, для залізних доріг і використання стінкової конструкції як шумового заслону або бар’єра
Випадковий патент: Пломба