Олігосахариди, спосіб їх одержання та фармацевтична композиція на їх основі
Номер патенту: 72545
Опубліковано: 15.03.2005
Автори: Валь Флоренс, Вісков Крістіан, Мур'є П'єр, ШТУТЦМАНН Жан-Марі, Перрін Елізабет
Формула / Реферат
1. Олігосахариди формули:
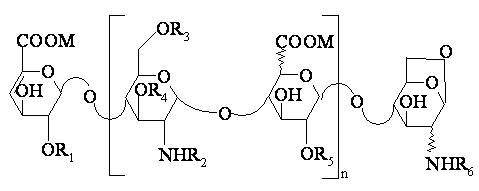 (I),
(I),
у якій n є цілим числом від 0 до 25; R1, R3, R4 і R5, однакові чи різні, означають атом водню чи радикал SO3M; R2 і R6, однакові чи різні, означають атом водню чи радикал SO3M чи СОСН3, і Μ означає натрій, кальцій, магній чи калій, суміш цих олігасахаридів і їх діастереоізомери.
2. Олігосахариди формули І за п. 1, у яких R4 означає атом водню, суміш цих олігасахаридів і їх діастереоізомери.
3. Олігосахариди формули І за одним з пп.1 чи 2, у яких n є цілим числом від 0 до 10, суміш цих олігасахаридів і їх діастереоізомери,
4. Олігосахариди формули І за одним з пп. 1 чи 2, у яких n є цілим числом від 0 до 6, суміш цих олігасахаридів і їх діастереоізомери.
5. Олігосахариди формули І за одним з пп.1 чи 2, у яких n є цілим числом від 1 до 6, суміш цих олігасахаридів і їх діастереоізомери.
6. Спосіб одержання олігасахаридів формули І за п. 1, який відрізняється тим, що гідроксид лужного металу чи четвертинного амонію вводять у взаємодію з олігасахаридами формули:
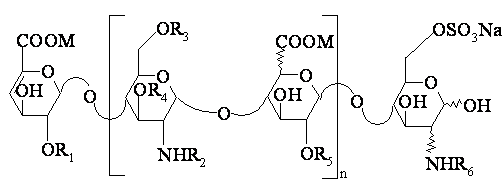 (II),
(II),
у якій n є цілим числом від 0 до 25; R1, R3, R4 і R5, однакові чи різні, означають атом водню чи радикал SO3M; R2 і R6, однакові чи різні, означають атом водню чи радикал SO3M чи СОСН3, і Μ означає натрій, кальцій, магній чи калій, чи їх суміші, і виділяють олігасахариди чи їх суміші.
7. Спосіб за п. 6, який відрізняється тим, що реакцію проводять у водному середовищі при температурі від 40 до 80°С і рН від 10 до 13.
8. Спосіб за одним з пп. 6 чи 7, який відрізняється тим, що використовують 1-5%-ий водний розчин гідроксиду лужного металу чи четвертинного амонію.
9. Спосіб за одним з пп. 6-8, який відрізняється тим, що реакцію проводять при температурі від 60 до 70°С.
10. Спосіб за одним з пп. 6-9, який відрізняється тим, що рН реакційного середовища складає від 11 до 12,5.
11. Спосіб за пп. 6-10, який відрізняється тим, що гідроксидом лужного металу чи четвертинного амонію є гідроксид натрію, гідроксид калію, гідроксид літію, цезію чи гідроксид тетрабутиламонію.
12. Фармацевтична композиція, що складається з активного начала і фармацевтично прийнятних добавок, яка відрізняється тим, що як активне начало містить щонайменше один олігасахарид за п. 1.
13. Фармацевтична композиція, що складається з активного начала і фармацевтично прийнятних добавок, яка відрізняється тим, що як активне начало містить щонайменше один олігасахарид за одним з пп. 1-5.
14. Олігосахариди формули І за одним з пп.1-5 для одержання лікувального засобу, придатного для профілактики чи лікування захворювань, пов'язаних з запальним процесом, при якому відбувається продукування закису азоту (NO).
15. Олігосахариди формули І за п. 14 для одержання лікувального засобу, придатного для профілактики і лікування церебральних, серцевих чи периферійних судинних ішемій, остеоартритів, ушкоджень центральної нервової системи, черепних, спиномозкових і черепно-спиномозкових травм, розсіяного склерозу, невропатичних болів і периферичних невропатій, захворювань рухових нейронів, бічного аміотрофічного склерозу, нейро-СНІДу, хвороби Альцгеймера, хвороби Паркінсона і хореї Гентінгтона.
Текст
Дійсний винахід відноситься до олігасахариди формули: їхніх сумішей, їх діастереоізомерів, способу їх одержання й олігасахаридвмісних фармацевтичних композицій. Дисахариди-сульфати, що мають на відновлюючому кінці структуру 1,6-ангідро, були описані Н.Р.Wessel, J.Carbohydrate chemistry, 1(8), 1039-1052 (1992). Ні про яку їхню фармакологічну активність не згадувалося. У патенті ЕР 84999 і авторами Y.Ichikawa із співроб., Carbohydr. Res., 141, 273-282 (1985), були також описані трисахариди-сульфати з ланкою 1,6-ангідро як проміжні продукти для одержання вищих олігасахариди. Ці трисахариди мають слабку активність анти-Ха. У формулі І є цілим числом від 0 до 25; R1, R3, R4 і R5, однакові чи різні, означають атом чи водню радикал SO3M; R1 і R6, однакові чи різні, означають атом водню чи радикал SO3M чи СОСН3; і Μ означає натрій, кальцій, магній чи калій. Ці олігасахариди містять, таким чином, парНе число сахаридів. R4 у формулі І є переважно атомом водню, а n переважно є цілим числом від 0 до 10, переважно від 0 до 6 і ще більш переважно від 1 до 6. Олігасахариди формули І можуть бути отримані дією гідроксиду лужного металу чи четвертинного амонію на олігасахариди формули: у якій n є цілим числом від 0 до 25; R1, R3, R4 і R5, однакові чи різні, означають атом водню чи радикал SO3M; R1 і R6 однакові чи різні, означають атом водню чи радикал SO3M чи СОСН3; і Μ означає натрій, кальцій, магній чи калій чи їхні суміші. Названу реакцію проводять у водному середовищі при температурі від 40 до 80°С і рН від 10 до 3. Як можливо використовуваний гідроксид лужного металу можна назвати гідроксид натрію, гідроксид калію, гідроксид літію і гідроксид цезію. Як можливо використовуваний гідроксид четвертинного амонію можна назвати гідроксид тетрабутиламмонію. Кількість гідроксиду лужного металу чи четвертинного амонію повинна бути достатньою для того, щоб значення рН реакційного середовища під час реакції зберігалося постійним. Для цієї мети гідроксид лужного металу чи четвертинного амонію необхідно додавати безупинно протягом усієї реакції. Гідроксид лужного металу чи четвертинного амонію використовується переважно у вигляді 1-5%-ного водного розчину. Реакцію проводять переважно при температурі від 60 до 70°С. рН реакційного середовища переважно дорівнює 11-12,5. Реакцію зупиняють шляхом підкислення реакційного середовища, наприклад додаванням кислої смоли, такої як смола Amberlite IR120R (Fluka). Олігасахариди формули І можуть бути, при необхідності, очищені за допомогою гель-проникаючої хроматографії на гелі типу поліакриламід-агароза, такому як гель, що поставляється під маркою Ultrogel ACA202R (Biosepra), відповідно до пропису приведеного нижче для розділення проміжних олігасахариди формули II. Олігасахариди формули І, у яких η дорівнює 0 чи 1, також можуть бути, у разі потреби, очищені на колонці з окисом алюмінію з використанням суміші вода-етанол як елюента. Проміжні олігасахариди формули II і їх суміші можуть бути отримані розділенням за допомогою гелевой хроматографії суміші олігасахаридів III, отриманої ферментативною деполімеризацією гепарину чи лужною деполімеризацією бензилового ефіру гепарину чи напівсинтетичного бензилового ефіру гепарину. Названу вище хроматографію проводять на колонках, заповнених гелем типу поліакриламід-агароза, що поставляється маркою Ultrogel АСА 202R Biosepra). Переважно використовують батарею колонок з поліакриламід-агарозним гелем. Число використовуваних колонок залежить від обсягу, гелю і олігасахаридів, які дідлягають розділенню. Суміш елююють за допомогою розчину, що містить фосфатний буфер і хлорид натрію. Фосфатний буфер являє собою переважно 0,02моль/л розчин NaH2PO4/NaHPO4 (pH 7), який містить 0,1моль/д хлориду натрію. Детекцию різних фракцій здійснюють за допомогою УФ спектрометрії (254нм) і іонної спектрометрії (IBF). Одержувані при цьому фракції можуть бути потім при необхідності очищені, наприклад за допомогою хроматографії SAX (strong anion exchange) з використанням відомих фахівцям способів, зокрема способів описаних K.G.Rice і R.J.Linhardt, Carbohydrate Research, 219-233 (1989), A.Larnkjaer, S.H.Hansen і P.B.Ostergaard, Carbohydrate Research, 266, 37-52 (1995) і в патенті WO 90/01501 (приклад 2). Фракції після цього ліофілізують і потім збезсолюють на заповненій гелем колонці, такій як колонка з гелем Sephadex G10R (Pharmacia Biochemicals). Якщо очищення здійснюють, не користуючись допомогою хроматографії SAX, ліофілізати можуть бути очищені простим осадженням чи піддані фракціонуванню за допомогою відомих фахівцям способів, зокрема за допомогою способу, описаного в патенті FR 2548672. У загальному випадку операції проводять у відповідності з наступним прописом: ліофiлізовану фракцію, щоочищається розчиняють при 25°С в приблизно десятьох об'ємах дистильованої води. За допомогою додавання метанолу чи етанолу осаджують бажаний олігасахарид, контролюючи його чистоту за допомогою хроматографії РХВР (рідинної хроматографії високої розділяючої здатності). Додавання метанолу чи етанолу визначають у залежності від бажаних чистоти чи виходу олігасахариду. Ця операція може бути проведена в кілька послідовних етапів, виходячи з початкового розчину ліофілізату. З цією метою агент для висолювання( метанол чи етанол) додають малими порціями, відокремлюючи після кожного додавання осад, що утвориться. Отримані в такий спосіб осади аналізують за допомогою хроматографії РХВР. У залежності від бажаних чистоти та виходу збирають відповідні їм фракції осаду. Для проміжних продуктів формули II, у яких n=0,1 чи 2, доцільно виходити із суміші IIІ, одержуваної за допомогою ферментативної деполімеризації. Цю деполімеризацію проводять з використанням гепаринази І (EC 4.2.2.7) у розчині фосфатного буферу з рН 7 у присутності хлориду натрію і БСА (бичачого сироваткового альбуміну) при температурі в межах від 10 до 18°С, переважно при 15°С, протягом 8-10 діб, переважно 9 діб. Деполімеризація може бути зупинена, наприклад, нагріванням реакційного середовища до 100°С протягом 2хв, а суміш може бути виділена ліофілізацією. На 25г гепарину переважно використовують 7меж.од. гепаринази І. Фосфатний буфер звичайно містить 0,05моль/л NaH2PO4/NaHPO4 (pH 7) у присутності 0,1моль/л хлориду натрію. Концентрація БСА звичайно складає 2%. Для проміжних продуктів формули II, у яких n=0, 1, 2, 3 чи 4, доцільно виходити із суміші III, одержуваної деполімеризацією бензилового ефіру гепарину. Бензиловий ефір гепарину може бути отриманий за допомогою методів, описаних у патентах US 5389618, ЕР 40144, FR 2548672. Ступінь естерифікації в цьому випадку складає від 50 до 100%, переважно від 70 до 90%. Деполімеризацію проводять у водному середовищі за допомогою гідроксиду лужного металу (наприклад, гідроксиду літію, гідроксиду натрію, гідроксиду калію чи гідроксиду цезію) чи гідроксиду четвертинного амонію (наприклад, гідроксиду тетрабутиламонію) переважно в молярній концентрації від 0,1 до 0,2моль/л при температурі від 40 до 80°С протягом від 5 до 120хв. У кращому варіанті реакцію проводять протягом 5-15хв при температурі від 60 до 70°С з використанням 0,15моль/л розчину гідроксиду натрію. Реакцію деполімеризації зупиняють за допомогою нейтралізації, додаючи кислоту, таку як оцтова кислота. Після додавання 10% мас/об ацетату натрію суміш олігасахаридів осаджують, додаючи метанол переважно в кількості 2 об'ємів на 1 об'єм реакційного середовища, після чого суміш фільтрують. Відповідно до переважного аспекту винаходу, суміш олігасахаридів, отриману після хімічної деполімеризації у вигляді водного розчину, збагачують за допомогою ультрафільтрації на мембранах з відповідною номінальною межею розділення (типу Peliicon з регенерованої целюлози, що поставляються фірмою Мilliроrе), причому тип мембрани підбирають відповідно до типу збагачених олігасахаридів, що виділяються. Для олігасахаридів II, у яких n=0, використовують мембрану з номінальною межею розділення 1кДа, для олігасахаридів II, у яких n=1, використовують мембрану 1кДа чи 3кДа, для олігасахаридів II, у яких n=2, використовують мембрану 3кДа, для олігасахаридів II, у яких ь=3 чи 4, використовують мембрану 5кДа. У процесі цієї операції збирають фільтрат, а затриманий матеріал відкидають. У результаті операції фракція збагаченого продукту може складати від 50 до 100% вихідної суміші олігасахаридів, містячи при цьому не менш 80% бажаного олігасахариду. Для проміжних продуктів формули II, у яких n=від 0 до 25, доцільно виходити із суміші III, одержуваної деполімеризацією напівсинтетичного бензилового ефіру полісахарид-сульфату. Напівсинтетичний бензиловий ефір полісахарид-сульфату одержують з напівсинтетичних полісахарид-сульфатів, одержуваних з полісахариду К5 за допомогою методів, описаних у патентах WO 94/29352 і WO 96/14425. Умови естерифікації, деполімеризації і виділення такі ж, як ті, котрі описані вище для бензилового ефіру гепарину. У всіх описаних вище способах вихідний гепарин може бути отриманий від свині, вівці, кози чи бика і може бути взятий зі слизу, легень чи шкіри тварин. Переважно використовують гепарин зі слизу свині, вівці чи з легень бика, причому переважніше зі слизу свині. Олігасахариди формули І мають протизапальні властивості і можуть, таким чином, бути використані для профілактики чи лікуванняхвороб, пов'язаних із запальним процесом, при якому відбувається продукція цитотоксичних речовин, таких як закис азоту (N0), і при якому вивільняється його форма, що піддається індукції, зокрема нейтрофілами чи макрофагами, коли останні мігрують і активуються в тканині. Активація, міграція, злипання й інфільтрація нейтрофілов відбуваються в порушених ішемією зонах тканини в результаті закупорки чи спазму артерії, що живить цю тканину. Такі ішемії можуть виникати чи в головному мозку (порушення мозкового кровообігу), чи в серцевому м'язі (інфаркт міокарда), чи в нижніх кінцівках (так звані периферичні ішемії). Олігасахариди формули І можуть бути, таким чином, використані для профілактики і/чи лікування нейродегенеративних захворювань, у випадку яких запалення мозку відіграє руйнуючу роль з можливим летальним результатом, з яких можна назвати церебральні ішемії, ішемії серця (інфаркт міокарда), периферичні ішемії, ушкодження центральної нервової системи і, зокрема черепні, спинномозкові і черепноспинномозкові травми, розсіяний склероз, невропатичні болі і периферичні невропатії, захворювання рухових нейронів, у тому числі бічний аміотрофічний склероз, нейро-СНІД, хвороба Альцгеймера, хвороба Паркінсона і хорея Гентінгтона, і деякі форми остеоартритів, зокрема локалізованих у суглобах. Протизапальна активність цих продуктів доведена in vivo у тесті на продукцію NOx (нітрит і нітрат), индуковану ліпополісахаридом (LPS), отриманим від Е.соlі способом, описаним M.Yamashita із сотр., Eur. J. Pharmacol., 338, 2,151-158 (1997) чи J.E.Shellito із сотр.. Am. J. Respir. Cell Моl. Biol., 13,1,45-53 (1995). Мишам-самцям CDI (Charles River, 25-35г) вводять внутрішньовенно в момент часу ТО 0,5мг/кг олігасахариду у вигляді кульок, у момент часу Т+15хв підшкірНо 1 чи 2мг/кг олігасахариду. У момент часу Т+30хв уводять 100мг/кг ліпополісахариду (LPS), отриманого від Е.соlі (Sigma L3129, серотип 0127:У8). У момент часу Т+3 години знову вводять підшкірно 1 чи 2мг/кг олігасахариду. У момент часу Т+5 годин 30хв за допомогою очної пункції відбирають пробу крові і ^визначають концентрації NOx (нітрит і нітрат) у плазмі, використовуючи колориметрический метод Грісса після відновлення нітрату в нітрит за допомогою нітратредуктази в такий спосіб: 12mл зразка плазми змішують з 88mл деіонізованої води та інкубують у темряві протягом 1 години при кімнатній температурі з 40mл фосфатного буферу (0.31М, рН 7,5), 20mл β-НАДФН (відновлений нікотинамідаденіндинуклеотид-фосфат) (0,86мМ), 20mл ФДА (флавінаденіндинуклеотид) (0,11мМ) і 20mл нітратредуктази (2од./мол) (Boehringer Mannheim). Додають 10mл ZnSO4 (1М) для осадження білків, і після змішування зразки центрифугують при 20000q протягом 5хв. На закінчення 50mл супернатанту інкубують протягом 10хв при кімнатній температурі з 100mл реактиву Грісса (1%-ний розчин сульфаніламіду в 0,1%-ному розчині суміші фосфорна кислота/нафтилетилендіамін у деіонізованій воді (об/об). Оптичну густину вимірюють при 540нм на мікропластинчастому спектрофотометрі, роблячи по два виміри на кожну точку. Як стандарт у колориметричному методі використовують KNO3 і NaNO2. Олігасахариди винаходу в названому дослідженні інгібують утворення NOx більш ніж на 50%. З кращих олігасахаридів формули І можна, зокрема назвати олігасахариди, у яких: n дорівнює 0, R1 і R6 означають радикал SO3Na і Μ означає натрій, і суміш його діастериоізомерів, n дорівнює 1, R1, R2, R3 і R5 і R6 означають радикал SO3Na, R4 означає атом водню і Μ означає натрій, і суміш його діастериоізомерів, n дорівнює 2, R1, R2, R3 і R5 і R6 означають радикал SO3Na, R4 означає атом водню і Μ означає натрій, і суміш його діастериоізомерів, n дорівнює 2, R1, R2, R3 і R6 означають радикал SO3Na, R5 означає атом водню чи радикал SO3Na, R4 означає атом водню і Μ означає натрій, і суміш його діастериоізомерів (похідне 1,6-ангідро-ÑIs-Is-IIs). Одержання олігасахаридів формули І і проміжних продуктів ілюструють наступні приклади. У цих прикладах використовують наступні значення скорочень: ÑIs: (4-дезокси-2-О-сульфо-a-L-трео-гексенпіранозилуронієва кислота)-(1®4)-2-дезокси-2-сульфаміно-6O-сульфо-O-a-D-глюкопіраноза, тринатрієва сіль, чи ÑUAp2S-(1®4)-a-D-GlcNp2S6S, Is: (2-сульфо-a-L-ідопіранозилуронієва кислота)-(1®4)-2-дезокси-2-сульфаміно-6-О-сульфо-a-Dглюкопіраноза, тетранатрієва сіль, чи a-L-IdoAp2S-(1®4)-a-D-GlcNp2S6S, IIs: (a-L-ідопіранозилуронієва кислота)-(1®4)-2-дезокси-2-сульфаміно-6-О-сульфо-a-D-глюкопіраноза, тринатрієва сіль, чи a-L-IdoAp2S-(1®4)-a-D-GlcNp2S6S, Ills: 2-сульфо-a-L-ідопіранозилуронієва кислота)-(1®4)-2-дезокси-2-сульфаміно-a-D-глюкопіраноза, тринатрєва сіль чи a-L-IdoAp2S-(1®4)-a-D-GlcNp2S, IdoAp ідопіранозилуронієва кислота, GlcNp: 2-дезокси-2-аміноглюкопіраноза, ÑUAp: 4-дезокси-a-L-трео-гексенпіранозилуронієва кислота, S: сульфат Приклади одержання сумішей формули II ПРИКЛАД А - одержання олігасахаридів формули II, у яких n=0,1 і 2, ферментативною деполімеризацією і розділенням Розчиняють 25г гепарину в 250мл розчину фосфатного буферу, що містить 0,05моль/л КаН2РО4/Nа2НРO4 (рН=7), 0,2моль/л хлориду натрію і 2% БСА (бичачого сироваткового альбуміну). У суміш вводять 7меж.од. гепаринази (EC 4.2.2.2.7) охолоджують отриманий розчин до 15 °С і витримують при цій температурі протягом усієї реакції деполімеризації. За протіканням реакції стежать шляхом ступінчатого відбору проб, аналізованих за допомогою гельпроникаючої хроматографії. Після закінчення 9 доби ферментативну реакцію зупиняють, нагріваючи реакційне середовище протягом двох хвилин при 100°С. Суміш після цього охолоджують і ліофілізують, одержуючи в такий спосіб суміш олігасахаридів III. Отриману суміш олігасахаридів IIІ хроматографують за наступною методикою: хроматографію проводять на колонках, заповнених поліакриламід-агарозним гелем, відомим за назвою Ultrogel АСА 202, і елююють суміш розчином, що містить фосфатний буфер (0,02моль/л NaH2PO4/Na2HPO4), рН=7, і 0,1моль/л хлориду натрію. Детекцію здійснюють за допомогою УФ спектрометрії (254нм) і іонної спектрометрії (IBF). Продукти можуть бути потім при необхідності очищені за допомогою хроматографії SAX (strong anion exchange) чи фракційним осадженням згідно Методу, описаному в патенті FR 2548672. Виділені фракції продукту ліофілізують і потім збезсолюють на колонці, заповненій гелем Sephadex G10R (Pharmacia Biochemicals). Використовуючи цю методику, одержують 3г дисахариду Is і 1100мг суміші гексасахариду, що містить, як правило, похідного ÑIs—Is-Is, 35% ÑIs-Is-IIs і 10% ÑIs-Is-IIIs. Ця суміш може бути очищена з використанням відомих фахівцям способів, що дозволяють виділити кожний з компонентів, чи використана як така для перетворення в 1,6-ангідро-похідні формули І. Слід зазначити, що в процесі цього перетворення гексасахарид ÑIs-Is-IIIs не може дати сполук формули І. ПРИКЛАД В - одержання олігасахаридів формули II, у яких n=0, 1, 2, 3 чи 4, деполімеризацією бензилового ефіру гепарину і розділенням a. Одержання бензилового ефіру гепарину Бензиловий ефіру гепарину одержують як описано в прикладі 2 патенти US 5389618. b. Деполімеризація Розчиняють 100г бензилового ефіру гепарину в 1,9л демінералізованої води. Суміш нагрівають до 60°С при перемішуванні. Після утворення гомогенного розчину вводять в один прийом приблизно 35мл 23%-ного розчину гідроксиду натрію. Після проведення реакції протягом 10хв розчин охолоджують і нейтралізують 80мл приблизно 2н. розчину оцтової кислоти. До отриманого розчину додають 10% мас/об ацетату натрію. Суміш олігасахаридів осаджують додаванням приблизно 2 об'ємів метанолу. Осад відокремлюють фільтрацією, двічі промивають метанолом і сушать при 50°С і зниженому тиску. Після висушування одержують 73,8г суміші олігасахаридів II. c. Збагачення олігасахариду з n=1 Розчиняють 30г отриманої вище суміші олігасахаридів у приблизно 35 об'ємах води. Цей розчин піддають ультрафільтрації на мембрані 3кДа (Pellicon). Після одержання 600мл фільтрату затриману частину розбавляють 500мл води. Продовжують операцію до одержання додаткових 450мл фільтрату. Обидві фракції фільтрату об'єднують і потім до суха випарюють при зниженому тиску. Одержують 6,1г жовтувато-білої твердої речовини. Аналіз цієї речовини за допомогою гельпроникаючої хроматографії вказує на зміст у ньому приблизно 30% олігасахаридів формули II, у яких n=1. d. Фракціонування підданих! ультрафільтрації сумішей олігасахаридів Збагачену суміш фракціонють на колонках, заповнених поліакриламід-агарозним гелем, відомим за назвою Ultrogel АСА 202 (використовують 4 послідовно розташовані колоники з діаметром 10см і висотою 50см). 5г збагаченої ультрафільтрацією суміші розчиняють у 25мл води, після чого елююють 0,2моль/л розчином хлориду натрію зі швидкістю 5мл/хв. Відбирають з низу колонки фракції по 25мл. Детекцію .продуктів здійснюють за допомогою УФ спектрометрії (254нм) і іонної спектрометрії (IBF). Фракції продукту з n=1 виділяють, ліофілізують і потім збезсолюють на колонці, заповненій гелем Sephadex G10. Після ліофілізации одержують 1г тетрасахариду, що містить, як правило, 70% похідного Vis-Is формули II (R1, R2, R3 і R5 і R6 означають радикал SO3Na, R4=Η і Μ=Na). Похідне ÑIs-Is може бути при необхідності очищене за допомогою хроматографії SAX (strong anion exchange) чи, що є кращим, фракційним осадженням згідно з методом, описаним в патенті FR 2548672. ПРИКЛАД 1 У реактор при температурі 66°С завантажують 5мл 0,0063моль/л розчину гідроксиду натрію. Вимірюють рН розчину і приймають його значення за необхідне (рН 11,35). Додають при перемішуванні в один прийом 30мг олігасахариду формули II, у якого n дорівнює 0, R1 і R6 означають радикал SO3Na і Μ означає натрій. Після цього коректують рН і підтримують його рівним 11,35 за допомогою безупинного додавання 0,5моль/л розчину гідроксиду натрію. Через 10 годин додавання гідроксиду натрію припиняють і реакційну суміш охолоджують до 25°С. Після цього доводять рН розчину до 6-7, додаючи смолу Amberlite IR 120. Суміш фільтрують на мембрані Whatman GF/B і досуха випарюють при зниженому тиску (2,7кПа) при температурі, близькій до 25°С. Продукт забирають 0,5мл дистильованої води і ліофілізують, одержуючи 29мг суміші діастериоізомерів олігасахариду формули І, у якого n дорівнює 0, R1 і R6 означають радикал SO3Na і Μ означає натрій [(4-дезокси-2-О-сульфо-a-L-трео-гекс-4-єнпіранозилуронієва кислота)-(1®4)-1,6-ангідро-2дезокси-2-сульфаміно-b-D-маннопіраноза, тринатрієва сіль: спектр ПМР у D2O, 400мгц, Т=298К, d у м.д.: 3,15 (1Н, с, Н2), 3,75(2Н, м, Н6 і Н3), 3,88(1Н, м, Н4), 4,20(1Н, д, J=8Гц, Н6), 4,22(1Н, т, J=5Гц, Н3'), 4,58(1Н, м, Н2'), 4,75(1Н, м, Н5), 5,53(1Н, с, НІ), 5,60(1Н, дд, J=6 і 1Гц, Н1’), 6,03(1Н, д, J=5Гц, Н4’); (4-дезокси-2-О-сульфо-a-Lтрео-гекс-4-єнпіра-нозилуронієва кислота)-(1®4)-1,6-ангідро-2-дезокси-2-сульфаміно-b-D-глюкопіраноза, тринатрієва сіль): спектр ПМР у D20, 400мгц, Т=298ДО, 5 у м.д.: 3,34(1Н, дд, J=7 і 2Гц, Н2), 3,72(1Н, т, J=8Гц, Н6), 3,90(1Н, м, Н3), 4,03(1Н, з, Н4), 4,20(1Н, д, J=8Гц, Н6) , 4,23(1Н, т, J=5Гц, Н3’), 4,58(1Н, м, Н2') , 4,78(1Н, м, Н5), 5,50(1Н, з, Н1), 5,60(1Н, дд, J=6 і 1Гц, H1’), 6,03(1Н, д, J=5Гц, Н4’)]. ПРИКЛАД 2 У реактор при температурі 62°С завантажують 33,3 мол 0,0063моль/л розчину гідроксиду натрію. Вимірюють рН розчину і приймають його значення за необхідне (рН 11,15). Додають при перемішуванні в один прийом 200мг олігасахарида формули II, у якого η дорівнює 1, R1, R2, R3, R5 і R6 означають радикал SO3Na, R4 означає атом водню і Μ означає натрій. Після цього коректують рН і підтримують його рівним 11,15 за допомогою безупинного додавання 0,5моль/л розчину гідроксиду натрію. Через 12 годин додавання гідроксиду натрію припиняють і реакційну суміш охолоджують до 25°С. Після цього доводять рН розчину до 6-7, додаючи смолу Amberlite IR 120. Суміш фільтрують на мембрані Whatman GF/B і до суха випарюють при зниженому тиску (2,1кПа) при температурі близькій до 25°С. Продукт забирають 3мл дистильованої води і ліофілізують, одержуючи 230мг олігасахариду формули І, у якого n дорівнює 1, R1, R2, R3, R5 і R6 означають радикал SO3Na, R4 означає атом водню і Μ означає натрій, у вигляді суміші діастереоізомерів [(4-дезокси-2-О-сульфо-a-Lтрео-гекс-4-єнпіранозилуронієва кислота)-(1®4)-2-дезокси-2-сульфаміно-6-O-сульфо-a-O-глюкопіранозил(1®4)-(2-О-сульфо-a-L-ідопіранозилуронієва кислота)-(1®4)-1,6-ангідро-2-дезокси-2-сільфаміно-b-Dманнопіраноза, гептанатрієва сіль): спектр ПМР у D2O, 400мгц, Т=298К, d у м.д.: 3,15(1Н, с, Н2), 3,25(1Н, м, Н2"), 3,60(1Н, м, Н3"), 3,70-4,70(14Н, масив, Н3/Н4/Н6, Н2І/Н3’/Н4'/Н5’, Н4"/Н5"/Н6", Н2’’’/Н3’’’), 4,75(1Н, м, Н5), 5,20-5,40(2Н, м, Н1’ і Н1"), 5,45 (1Н, м, Н1"), 5,56(1Н, м, Н1), 5,94(1Н, д, J=5Гц, Н4); [(4-дезокси-2-О-сульфо-aL-трео-гекс-4-єнпіранозилуронієва кислота)-(1®4)-2-дезокси-2-сульфаміно-6-О-сульфо-a-О-глюкопіранозил(1®4)-(2-О-сульфо-a-L-ідопіранозилуронієва кислота)-(1®4)-1,6-ангідро-2-дезокси-2-сільфамiно-b-Dглюкопіраноза, гептанатрієва сіль) : спектр ПМР у D2O, 400мгц, Т=298К, d у м.д.: 3,25(1Н, м, Н2"), 3,42(1Н, дд, J=4 і 1Гц, Н2), 3,60(1Н, м, Н3"), 3,70-4,70 (14Н, масив, Н3/Н4/Н6, H2’/H3’/H4’/H5', Н4"/Н5"/Н6", Н2'’’/Н3'"), 4,75(1Н, м, Н5), 5,20-5,40 (2Н, м, Н1’ і Н1"), 5,45 (1Н, м, Н1’"), 5,52(1Н, м, Н1), 5,94(1Н, д, J=5Гц, Н4)]. ПРИКЛАД 3 У реактор при температурі 62°С завантажують 16,7мл 0,0063моль/л розчину гідроксиду натрію. Вимірюють рН розчину і приймають його значення за необхідне (рН 11,7). Додають при перемішуванні в один прийом 100мг олігасахариду формули II, у якого n дорівнює 2, R1, R2, R3, R5 і R6 означають радикал SO3Na, R4 означає атом водню і Μ означає натрій. Після чого коректують рН й підтримують його рівним 11,7 за допомогою непреривного додавання 0,5моль/л розчину гідроксиду натрію. Через 10 годин додавання гідроксиду натрію припиняють й реакційну суміш охолоджують до 25°С. Після цього доводять рН розчину до 6-7, додаючи смолу Amberlite IR 120. Суміш фільтрують на мембрані Whatma GH/B й до суха випарюють при зниженому тиску (2,7кПа) при температуі близькій до 25°С. Продукт забирають 3мл дистильованої води й оіофілізують, одержуючи 108мг олігосахариду формули І, у якого n дорівнює 2, R1, R2, R3, R5 і R6 означають радикал SO3Na, R4 означає атом водню і Μ означає натрій, у вигляді суміші діастереоізомерів. Означають символами від А до F цукри, котрі утворюють гексасахариди, де А являє собою залишок 1,6-анигідро й F-залишок ненасиченої уронієвої кислоти. [((4-дезокси-2-О-сульфо-a-L-трео-гекс-4-єнпіранозилуронієва кислота)-(1®4)-2-дезокси-2сульфаміно-6-O-сульфо-a-D-глюкопіранозил-(1®4)-(2-О-сульфо-a-L-ідопіранозилуронієва кислота)-(1®4)-2дезокси-2-сульфаміно-6-O-сульфо-a-D-глюкопіранозил-(1®4)-(2-O-сульфо-a-L-ідопіранозилуронієва кислота)(1®4)-1,6-ангідро-2-дезокси-2-сульфаміно-b-D-маннопіраноза, ундеканатрієва сіль): спектр ПМР у D2O, 600мгц, Т=298К, d у м.д.: 3,15(1Н, с, Н2 (А)), 3,25(2Н, м, Н2(С+Е)), 3,60(2Н, м, Н3(С+Е)), 3,65-4,50(19Н, масив, H2(B+D)/H3(A+B+D+F)/H4(A+B+C+D+E)/H5(C+E)/H6(A+C+E)),4,6O(1H, C, H2(F)), 4,80(3Н, м, H5(A+B+D)), 5,18(1H, С, H1(D) 5,30(1Н, С, Н1(В)), 5,34(1Н, д, Н1(С)) , 5,36(1Н, д, H1 (Ε)), 5,46(1Н, 3, Н1(Е)), 5,57 (1Н, 3, H1 (А)), 5,95 (1Н, д, J=5Гц, Н4 (F)); 4-дезокси-2-О-сульфо-a-L-трео-гекс-4-єнпіранозилуронієа кислота)-(1®4)-2дезокси-2-сульфаміно-6-O-сульфо-a-D-глюкопіранозил-(1®4)-(2-O-сульфо-a-L-ідопіранозилуронієва кислота)(1®4)-2-дезокси-2-сульфаміно-6-O-сульфо-a-D-глюкопіранозил-(1®4)-(2-О-сульфо-a-L-ідопіранозилуронієва кислота)-(1®4)-1,6-ангідро-2-дезокси-2-сульфаміно-b-D-глюкопіраноза, ундеканатрієва сіль): спектр ПМР у Р2О, 600мгц, Т=298К, d у м.д.: 3,25(2Н, м, Н2 (С+Е)), 3,42 (1Н, м, Н2(А)), 3,60(2Н, м, Н3(С+Е)), 3,65-4,50(19Н, масив, H2(B+D)/H3(A+B+D+F)/H4(A+B+C+D+E)/H5(C+E)/H6(AC+E)), 4,60(1Н, с, H2(D)), 4,80(3Н, м, H5(A+B+D)), 5,18(1Н, с, H1(D)), 5,31(1Н, с, Н1(В)), 5,34(1Н, д, Н1(С)), 5,36(1Н, д, Н1(Е)), 5,46(1Н, с, H1(F)), 5,52(1Н, с, Н1(А)), 5,95(1Н, д, J=5Гц, H4(F)). ПРИКЛАД 4 У реактор при температурі 62°С завантажують 4мл 0,0316моль/л розчину гідроксиду натрію. Вимірюють рН розчину й приймають його значення за необхідне (рН 11,8). Додають при перемішуванні в один прийом 100,8мг суміші олігосахаридів формули II, у котрих n дорівнює 2, що містить 55% похідного ÑIs-Is-Іs (R1, R2, R3 і R6 означають радикал SO3Na, R5 означає атом водню і Μ означає натрій), 35% ÑIs-Is-IIs (R1, R2, R3, R5 і R6 означають радикал SO3Naa, R4 означає атом водню і Μ означає натрій) й 10% ÑIs-Is-IIIs (R1, R2, R3, R5 і R6 означають радикал SO3Na, R4 означає атом водню і Μ означає натрій, причому функція SO3M у вуглецю С6 замінена воднем). Після цього коректують рН й підтримують його рівним 11,8 за допомогою непреривного додавання 0,5моль/л розчину гідроксиду натрію. Через 11 годин додавання гідроксиду натрію припиняють й реакційну суміш охолоджують до 25°С. Після цього доводять рН розчину до 6-7, додаючи смолу Amberlite IR 120. Суміш фільтрують на мембрані Whatman GF/B й до суха випарюють при зниженому тиску (2,7кПа) при температурі близькій до 25°С. Продукт забирають 1,5мл дистильованої води й ліофілізують, одержуючи 110мг суміші олігасахаридів формули І, у котрих n дорівнює 2, що містить, зокрема, похідне 1,6-ангідро-ÑIs-Is-ls (R1, R2, R3, R5 і R6 означають радикал SO3Na, R4 означає атом водню і Μ означає натрій) й похідне 1,6-ангідро-ÑIsIs-IIs (R1, R2, R3, і R6 означають радикал SO3Na, R5 означає атом водню і Μ означає натрій). Аналіз за допомогою РХВР (рідинної хроматографії високої розділяючої здатності) у режимі іонних пар дозволяє стежити за перетворенням похідних формули І. Отримані дані РХВР вказують на те, що перетворення здійснюється з похідними ÑIs-Is-Is і ÑIs-Is-IIs. ПРИКЛАД 5 У реактор при температурі 66°С завантажують 8,6мл 0,025моль/л розчину гідроксиду літію. Вимірюють рН розчину і приймають його значення за необхідне (рН 11,68). Додають при перемішуванні в один прийом 50мг олігасахариду формули II, у якого n дорівнює 0, R1 і R6 означають радикал SO3Na і Μ означає натрій. Після цього коректують рН і підтримують його рівним 11,68 за допомогою безупинного додавання 0,466моль/л розчину гідроксиду літію. Через 8 годин додавання гідроксиду літію припиняють і реакційну суміш охолоджують до 25°С. Аналіз за допомогою РХВР (рідинної хроматографії високої розділяючої здатності) у режимі іонних пар дозволяє стежити за перетворенням похідного формули І, у якого η дорівнює 0, R1 і R6 означають радикал SO3Na і Μ означає натрій чи літій. Отримані дані РХВР вказують на те, що перетворення здійснюється на 100%. Вихід кінцевого продукту на підставі порівняння з еталонними даними складає 81,2%. ПРИКЛАД 6 У реактор при температурі 66°С завантажують 8,3мл 0,0063моль/л розчину гідроксиду калію. Вимірюють рН розчину і приймають його значення за необхідне (рН 11,1). Додають при перемішуванні в один прийом 50мг олігасахариду формули II, у якого η дорівнює 0, R1 і R6 означають радикал SO3Na і Μ означає натрій. Після цього коректують рН і підтримують його рівним 11,1 за допомогою безупинного додавання 0,515моль/л розчину гідроксиду калію. Через 24 години додавання гідроксиду калію припиняють і реакційну суміш охолоджують до 25°С. Аналіз за допомогою РХВР (рідинної хроматографії високої розділяючої здатності) у режимі іонних пар дозволяє стежити за перетворенням похідного формули І, у якого n дорівнює 0, R1 і R6 означають радикал SO3M і Μ означає натрій чи калій. Отримані дані РХВР вказують на те, що перетворення здійснюється на 100%. Вихід на підставі порівняння з еталонними даними складає 75,6%. ПРИКЛАД 7 У реактор при температурі 66°С завантажують 8,3мл 0,0063моль/л розчину гідроксиду цезію. Вимірюють рН розчину і приймають його значення за необхідне (рН 10,75). Додають при перемішуванні в один прийом 50мг олігосахариду формули II, у якого n дорівнює 0, R1 і R6 означають радикал SO3Na і Μ означає натрій. Після цього коректують рН і підтримують його рівним 10,75 за допомогою безупинного додавання 0,476моль/л розчину гідроксиду цезію. Через 20 годин додавання гідроксиду цезію припиняють і реакційну суміш охолоджують до 25°С. Аналіз за допомогою РХВР (рідинної хроматографії високої розділяючої здатності) у режимі іонних пар дозволяє стежити за перетворенням похідного формули І, у якого n дорівнює 0, R1 і R6 означають радикал SO3Na і Μ означає натрій чи цезій. Отримані дані РХВР вказують на те, що перетворення здійснюється на 90,3%. Вихід на підставі порівняння з еталонними даними складає 73%. ПРИКЛАД 8 У реактор при температурі 66°С завантажують 8,3мл 0,0063моль/л розчину гідроксиду тетрабутиламмонію. Вимірюють рН розчину і приймають його значення за необхідне (рН 10,95). Додають при перемішуванні в один прийом 50мг олігосахариду формули II, у якого n дорівнює 0, R1 і R6 означають радикал SO3Na і Μ означає натрій. Після цього коректують рН і підтримують його рівним 10,95 за допомогою безупинного додавання 0,521моль/л розчину гідроксиду тетрабутиламмонію. Через 16 годин додавання гідроксиду цезію припиняють і реакційну суміш охолоджують до 25°С. Аналіз за допомогою РХВР (рідинної хроматографії високої розділяючої здатності) у режимі іонних пар дозволяє стежити за перетворенням похідного формули І, у якого n дорівнює 0, R1 і R6 означають радикал SO3Na і Μ означає натрій чи тетрабутиламмоній. Отримані дані РХВР вказують на те, що перетворення здійснюється на 96,7%. Вихід на підставі порівняння з еталонними даними складає 65%. Лікувальні засоби згідно з винаходом містять як активний початок щонайменше один олігасахарид формули І чи суміш олігасахаридів формули І у вигляді композиції, у якій активний початок асоційований з будь-яким іншим фармацевтично сумісним продуктом, що може бути як інертним, так і фізіологічно активним. Лікувальні засоби згідно з винаходом можуть застосовуватися внутрішньовенно, підшкірно, перорально, ректально, місцево і пульмонарно (інгаляцією). Стерильні композиції для внутрішньовенного і підшкірного застосування звичайно є водними розчинами. Ці композиції можуть також містити адьюванти, зокрема змочувальні, ізотонізуючі, емульгуючі, диспергуючі і стабілізуючі агенти. Стерилізація може бути здійснена різними способами, наприклад асептичною фільтрацією, введенням у композицію агентів, що стерилізують, опроміненням. Ці композиції можуть бути також виготовлені у вигляді твердих стерильних композицій, що безпосередньо перед застосуванням можуть бути розчинені в стерильній воді чи в будь-якому іншому придатному для ін'єкцій стерильному середовищі. Як тверді композиції для перорального застосування можуть бути використані таблетки, пігулки, порошки (желатинові капсули, крохмальні облатки) чи гранули. Активний початок у композиціях змішують у струмі аргону з одним чи декількома інертними розріджувачами, такими як крохмаль, целюлоза, сахароза, лактоза чи ремнезем. Ці композиції можуть також містити інші, відмінні від розріджувачів, речовини, наприклад один чи кілька маслянистих матеріалів, таких як стеарат магнію чи тальк, агент, що сприяє всмоктуванню при пероральному застосуванні, барвник, оболонка (драже) чи лак. Як рідкі композиції для перорального застосування можна використовувати фармацевтично прийнятні розчини, суспензії, емульсії, сиропи й еліксири, що містять інертні розріджувачі, такі як вода, етиловий спирт, гліцерин, рослинні олії чи парафінова олія. Ці композиції можуть містити інші, відмінні від розріджувачів, речовини, що наприклад змочують, підсолоджують, загущують, ароматизують або стабілізуючі продукти. Композиціями для ректального застосування є суппозиторії чи ректальні капсули, що крім активного продукту містять ексципієнти, такі як олія какао, напівсинтетичні гліцериди чи поліетиленгліколі. Композиції для місцевого застосування можуть, наприклад, являти собою креми, лосьйони, очні краплі, полоскання, краплі для носа чи аерозолі. Дози залежать від бажаного ефекту, від тривалості лікування і від шляху введення. Звичайно вони складають від 0,5 до 10мг/кг на добу при підшкірному застосуванні, що відповідає добовій дозі від 3 до 60мг для дорослої людини вагою 60кг. У загальному випадку лікар повинний визначити придатну дозу в залежності від віку, ваги і всіх інших факторів, пов'язаних з процесом лікування конкретної особи. Винахід відноситься також до способу попередження і лікування хвороб, зв'язаних із запальним процесом, при якому відбувається продукція цитотоксичних речовин, таких як закис азоту (NO). Олігасахариди формули І можуть у такий спосіб бути використані для попередження і/чи лікування нейродегенеративних захворювань, у випадку яких запалення мозку відіграє руйнуючу роль з можливим летальним результатом, з яких можна назвати ішемії центральної нервової системи, церебральні ішемії, ішемії сітківки і внутрішнього вуха, ішемії серця (інфаркт міокарда), периферичні ішемії, ушкодження центральної нервової системи і, зокрема черепні, спинномозкові і черепно-спинномозкові травми, травми сітківки і внутрішнього вуха, розсіяний склероз, невропатичні болі і периферичні невропатії, захворювання рухових нейронів, у тім числі бічний аміотрофічний склероз, нейро-СНІД, хворобу Альцгеймера, хвороба Паркінсона і хорея Гентінгтона, і деякі форми остеоартритів, зокрема, локалізованих у суглобах.
ДивитисяДодаткова інформація
Назва патенту англійськоюOligosaccharides, a method for preparing them and a pharmaceutical composition based thereon
Автори англійськоюStutsman Jean-Mary, Viskov Christian
Назва патенту російськоюОлигосахариды, способ их получения и фармацевтическая композиция на их основе
Автори російськоюШтутцманн Жан-Мари, Висков Кристиан
МПК / Мітки
МПК: C08B 37/10, A61P 19/00, A61P 25/16, A61P 19/02, C07H 19/01, C07H 11/00, C08B 37/00, A61P 9/10, A61P 25/28, A61K 31/7024, A61P 25/00, A61P 25/14
Мітки: композиція, олігосахариди, одержання, фармацевтична, основі, спосіб
Код посилання
<a href="https://ua.patents.su/6-72545-oligosakharidi-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Олігосахариди, спосіб їх одержання та фармацевтична композиція на їх основі</a>
Попередній патент: Пневмопульсаційний сепаратор зерна
Наступний патент: Механізоване кріплення кінцевої ділянки лави
Випадковий патент: Теплообмінна труба










