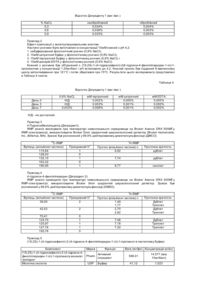
Фармацевтична композиція, що містить агоніст рецептора nmda (варіанти) та спосіб лікування
Формула / Реферат
1. Фармацевтична композиція, що містить фармацевтично ефективну кількість (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанол або його фармацевтично прийнятну сіль і воду, причому згадана композиція містить менше, ніж приблизно 2 мільйонні частини вільного іону міді і менше, ніж приблизно 2 мільйонні частини вільного іону заліза.
2. Фармацевтична композиція за п.1, яка по суті вільна від вільного іону міді і вільного іону заліза.
3. Фармацевтична композиція за п. 1, яка містить менше, ніж приблизно 2 мільйонні частини слідів будь-якого вільного іону металу.
4. Фармацевтична композиція за п. 3, яка по суті вільна від слідів будь-якого вільного іону металу.
5. Фармацевтична композиція, що містить (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанол або його фармацевтичнo прийнятну сіль, воду і фармацевтичнo прийнятний хелатоутворювальний агент у концентрації, ефективній для хелатоутворення із слідами іонів металів у згаданій композиції.
6. Фармацевтична композиція за п.5, в якій згаданий хелатоутворювальний агент вибраний з етилендіамінтетраоцтової кислоти, лимонної кислоти, бурштинової кислоти і винної кислоти і їх фармацевтичнo прийнятних солей.
7. Фармацевтична композиція за кожним з пп. 1-6, яка додатково містить фармацевтичнo прийнятний буфер у концентрації, ефективній підтримувати рH композиції між приблизно 3,8 до приблизно 5,0.
8. Фармацевтична композиція за п.7, у якій концентрація буфера є ефективною, щоб підтримувати рH композиції між приблизно 4,0 до приблизно 4,5.
9. Фармацевтична композиція за п. 7 або 8, у якій аніон згаданого буфера вибраний із ацетату, цитрату, тартрату, форміату і лактату.
10. Фармацевтична композиція за п. 9, у якій аніоном згаданого буфера є лактат.
11. Фармацевтична композиція за пп. 1-10, яка по суті вільна від кисню.
12. Фармацевтична композиція, що містить (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанол або його фармацевтичнo прийнятну сіль у водному розчині, де відсоток продукту деградації, 4-гідроксибензальдегіду, є не більше, ніж приблизно 0,15 відсотків від згаданої композиції після зберігання при 50°С протягом 12 тижнів.
13. Фармацевтична композиція за п. 12, у якій відсоток згаданого продукту деградації не більше, ніж приблизно 0,07 відсотків.
14. Фармацевтична композиція за п. 13, у якій відсоток згаданого продукту деградації не більше, ніж приблизно 0,04 відсотків.
15. Спосіб лікування інсульту, травми спинного мозку, травматичного пошкодження головного мозку, васкулярної деменції, дегенеративних хвороб центральної нервової системи, таких як хвороба Альцгеймера, сенільна деменція типу Альцгеймера, хвороба Хантингтона, хвороба Паркінсона, епілепсія, латеральний аміотрофічний склероз, біль, деменція, пов'язана зі СНІДом, психотичних станів, наркоманії, мігрені, гіпоглікемії, тривожних станів, нетримання сечі, ішемічних випадків, що виникають внаслідок хірургічного втручання на ЦНС, серці або будь-якій процедурі, протягом якої функція серцево-судинної системи піддається ризику у ссавця, який полягає у призначенні ссавцеві, який потребує такого лікування, фармацевтичної композиції за пп. 1-14.
Текст
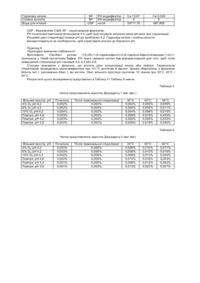
Цей винахід забезпечує стабільні фармацевтичні композиції антагоністу рецепторів N-метил-Оаспарагінової кислоти (NMDA), (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1пропанолу, способів виготовлення таких фармацевтичних композицій і способів лікування інсульту, травми спинного мозку, травматичного пошкодження головного мозку, васкулярної деменції, дегенеративних хвороб центральної нервової системи, таких як: хвороба Альцгеймера, сенільна деменція типу Альцгеймера, хвороба Хантингтона, хвороба Паркінсона, епілепсія, латеральний аміотрофічний склероз, біль, деменція, пов'язана зі СНІДом; психотичних станів, наркоманії, мігрені, гіпоглікемії, тривожних станів, нетримання сечі, ішемічних випадків, що виникають внаслідок хірургічного втручання на ЦНС, серці або будь-якій процедурі, протягом якої функція серцево-судинної системи піддається ризику, використовуючи фармацевтичні композиції цього винаходу. (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанол (надалі згадуваний як "сполука") - нейропротектор, що є корисним для лікування інсульту, травми спинного мозку, травматичного пошкодження головного мозку, васкулярної деменції, дегенеративних хвороб центральної нервової системи, таких як: хвороба Альцгеймера, сенільна деменція типу Альцгеймера, хвороба Хантингтона, хвороба Паркінсона, епілепсія, латеральний аміотрофічний склероз, біль, деменція, пов'язана зі СНІДом; психотичних станів, наркоманії, мігрені, гіпоглікемії, тривожних станів, нетримання сечі, ішемічних випадків, що виникають внаслідок хірургічного втр учання на ЦНС, серці або будь-якої процедури, протягом якої функція серцево-судинної системи піддається ризику. Сполука демонструє активність як антагоніст NMDA рецептора. NMDA - збуджувальна амінокислота, залучена в збуджувальну нейротрансмісію у центральній нервовій системі. NMDA антагоністи - сполуки, що блокують NMD A рецептор, взаємодіючи з сайтом зв'язування рецептора. Антагоністи нейротрансмісії у NMDA рецепторах - корисні терапевтичні агенти для лікування неврологічних розладів. Патент США №4,902,695 спрямований до ряду конкурентних NMDA антагоністів, корисних для лікування неврологічних розладів, включаючи епілепсію, інсульт, тривогу, церебральну ішемію, м'язові спазми, і нейродегенеративні розлади типу хвороби Альцгеймера і Хантингтона. Патент США №4,968,878 спрямований на другий ряд конкурентних антагоністів NMDA рецепторів, корисних для лікування подібних неврологічних і нейродегенеративних розладів. Патент США №5,192,751 розкриває метод лікування нетримання сечі у ссавців, який полягає у введенні ефективної кількості конкурентного NMDA-антагоніста. Патенти США №5,272,160 і 5,710,168 (розкриття яких включено як посилання) розкривають сполуку і способи використання сполуки для лікування хвороб або станів, що є сприйнятливими до лікування шляхом блокування NMDA рецепторних сайтів, включаючи інсульт, травму спинного і головного мозку, васкулярну деменцію, дегенеративні захворювання ЦНС, епілепсію, латеральний аміотрофічний склероз, біль, деменції, повязаної зі СНІДом, психотичних станів, наркоманії, мігрені, гіпоглікемії, тривожних станів, нетримання сечі і ішемічних випадків. Патент США №6,008,233 (розкриття якого включено як посилання) розкриває метансульфонату тригідрат і використання цієї сполуки для лікування вищезгаданих захворювань і станів. Сполука переважно призначається як багатогодинна внутрішньовенна інфузія. Таке введення призначено, щоб підтримати бажаний рівень сполуки у крові для тривалості терапії. Як правило, терапія сполукою розпочинається в відділенні невідкладної терапії і продовжується протягом бажаного часу в інши х відділеннях інтенсивної терапії. Композиції і представлені дозування сполуки повинні бути розроблені для зручного й ефективного введення і повинні бути особливо прийнятні для невідкладної терапії. Деградація сполуки в таких композиціях повинна бути мінімізована. Цей винахід забезпечує відносно стабільні композиції сполуки у водних розчинах, виготовлених редукуванням або видаленням слідів іонів металу у розчинах. Стабільність надалі поліпшується за допомогою фармацевтично прийнятного буфера. Додаткова стабільність надається зменшенням кисню в композиціях. Один аспект представленого винаходу - фармацевтичні композиції, що включають фармацевтично ефективну кількість (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанол або його фармацевтично прийнятну сіль і воду, причому згадані композиції містять менше, ніж приблизно 2 мільйонні частини вільного іону міді і менше, ніж приблизно 2 мільйонні частини вільного іону заліза. Інший аспект представленого винаходу - фармацевтичні композиції, що включають (1S,2S)-1-(4-гідроксифеніл)-2-(4гідрокси-4-фенілпіперидин-1-іл)-1-пропанол або його фармацевтично прийнятну сіль, воду і фармацевтично прийнятний хелатоутворювальний агент, переважно етилендіамінтетраоцтову кислоту, лимонну кислоту, бурштинову кислоту або винну кислоту, або їх фармацевтично прийнятну сіль в концентрації, ефективній для хелатоутворення із залишками(слідами) іонів металу у згаданій композиції. Подальший аспект представленого винаходу - фармацевтичні композиції, що включають (1S,2S)-1-(4гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанол або його фармацевтично прийнятну сіль у водному розчині, у якій відсоток продукту деградації -4-гідроксибензальдегіду - не більше, ніж приблизно 0,15 відсотків від згаданої композиції після зберігання при 50°С протягом 12 тижнів, переважно не більше, ніж приблизно 0,07 відсотків і, найбільш переважно не більше, ніж приблизно 0,04 відсотків. Додатковий аспект цього винаходу - фармацевтичні композиції, що включають (1S,2S)-1-(4гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанол або його фармацевтично прийнятну сіль у водному розчині, причому відсоток продукту деградації, 4-гідрокси-4фенілпіперидину - не більше, ніж приблизно 0,2 відсотків від згаданої композиції після зберігання при 50°С протягом 12 тижнів, переважно не більше, ніж приблизно 0,1 відсотків і найбільш переважно не більше, ніж приблизно 0,05 відсотків. Додатковий аспект цього винаходу - способи лікування інсульту, травми спинного мозку, травматичного пошкодження головного мозку, васкулярної деменції, дегенеративних хвороб центральної нервової системи, таких як: хвороба Альцгеймера, сенільна деменція типу Альцгеймера, хвороба Хантингтона, хвороба Паркінсона, епілепсія, латеральний аміотрофічний склероз, біль, деменція, пов'язана зі СНІДом; психотичних станів, наркоманії, мігрені, гіпоглікемії, тривожних станів, нетримання сечі, ішемічних випадків, що виникають внаслідок хірургічного втручання на ЦНС, серці або будь-якій процедурі, протягом якої функція серцево-судинної системи піддається ризику у ссавців, що полягають у призначенні ссавцю, який потребує такого лікування фармацевтичної композиції цього винаходу. У переважному варіанті реалізації аспектів композиції цього винаходу, композиції по суті вільні від вільного іону міді і вільного іону заліза. В іншому переважному варіанті реалізації аспектів композицій цього винаходу, композиції містять менше, ніж приблизно 2 мільйонні частини слідів(залишків) будь-якого вільного іона металу, і більш переважно - по суті вільні від слідів будь-якого вільного іона металу. Ін ший переважний варіант реалізації аспектів композицій цього винаходу забезпечує, що композиції містять фармацевтично прийнятний буфер в концентрації, ефективній підтримувати рН композицій між приблизно 3,8 до приблизно 5,0 і, більш переважно між приблизно 4,0 до приблизно 4,5. У більш переважному варіанті реалізації, аніон буфера вибраний з ацетату, цитрату, тартрату, форміату і лактату, найбільш переважно з лактату. Подальший переважний варіант реалізації аспектів композицій цього винаходу забезпечує, що композиції по суті вільні від кисню. У переважному варіанті реалізації аспектів способу лікування цього винаходу ссавцем є людина. Термін "хелатоутворювальний агент" як використовується тут означає будь-яку сполуку, що ізолює, утворює комплекс або інакше взаємодіє із залишками(слідами) іонів металу так, що ефект дестабілізації таких металевих іонів щодо сполуки у водному розчині мінімізований. Приклади агентів включають етилендіамінтетра-оцтову кислоту (EDTA) і її солі, транс-1,2-діаміноциклогексантетра-оцтову кислоту (DCTA) і її солі, біс-(2-аміноетил) етиленгліколь-NNN'N'-тетраоцтову кислоту (EGTA) та її солі, диетилентриамінопента-оцтову кислоту (DTPA) і її солі, три-(2-аміноетил)амін (tren), NNN'N'-тетра-(2аміноетил)етилендіамін (penten), нітрилоцтову кислоту (NTA) і її солі, 2,3-димеркапто-1-пропансульфонову кислоту (DMPS) і її солі, мезо-2,3-димеркаптобурштинову кислоту (DMSA) і її солі, гідроксильні кислоти типу лимонної, винної, молочної, бурштинової і т.д. і їх солі, і деякі амінокислоти типу гліцину, гістидин у, і глутамінової кислоти і їх солей. Термін "Деградант 1", використовуваний тут відноситься до продукту деградації сполуки - 4гідроксибензальдегіду. Термін "Деградант 2", використовуваний тут відноситься до продукту деградації сполуки - 4-гідрокси-4фенілпіперидину. Терміни "вільний іон міді", "вільний іон заліза" і "вільний від слідів іонів металів", використовувані тут, означають іони міді, іони заліза або сліди(залишки) іонів металів відповідно, які, коли присутні у водній композиції, що містить сполуку є у формі або стані, що дозволяє їм викликати, ініціювати, сприяти або каталізувати деградацію сполуки. "Вільний простір" відноситься до різниці в об'ємі між закритим контейнером (напр., флакон) і об'ємом рідини, що міститься в контейнері. Вільний простір може бути визначений кількісно як відсоток від загального об'єму закритого контейнера. Вираз "спосіб видалення слідів іонів металів", що використовується тут, означає будь-які способи, що можуть використовуватися, щоб видалити сліди іонів металів з водного розчину. Наприклад, такі способи можуть включати використання метал-хелатоутворювальні полімери або інші хелатоутворювальні реагенти, що відомі фахівцям. Термін "інертний газ" як використовується тут, означає будь-який газ, що не реагує або не взаємодіє хімічно з фармацевтичною композицією або з кожним з її компонентів. Такий газ переважно азот, але може бути аргон, гелій, або будь-який інший газ, відомий фахівцям з його інертними властивостями. Вираз "відсоток від Деграданту 1" і "відсоток від Деграданту 2" означає . відсоток відповідного продукту деградації, представленої у фармацевтичній композиції сполуки як вага щодо ваги (ваг./ваг.) Відсоток розраховують від пікових площин HPLC аналізу (високоефективна рідинна хроматографія, ВЕРХ) відповідно до формули: Відсоток Деграданту=[(ASAMP´DSAMP)/(RAVG ´CLAB)]´100, де: ASAMP = площа піку домішки, DSAMP = фактор розведення, розрахований як: DSAMP=CLAB/C SAMP, де: CLAB = мічена концентрація сполуки в композиції, що тестується (концентрація вільної основи), CSAMP = концентрація вільної основи сполуки в тестованому зразку (заснована на розведенні міченої концентрації, використовуваної для одержання зразка (прoби) RAVG = середній стандартний фактор відповіді ("R") отриманий від аналізу стандартного розчину, розрахованого як: R=ASTD/(CSTD´PF), де: ASTD = площа піку сполуки в стандартному розчині, CSTD = концентрація Сполуки в стандартному розчині, PF = фактор потенції сполуки в стандартному розчині, розрахований як молярна вага вільної основи сполуки, розділена на фактичну молярну вагу сполуки в стандартному розчині. Фактор розведення, DSAMP, розрахунок розведення можуть бути необхідними для того, щоб перевірений зразок був у затверджених межах концентрацій HPLC методу. Вираз "фармацевтично прийнятний", як використовується тут відноситься до носіїв, розчинників, інертних наповнювачів, буферів або солей, що є сумісними з іншими компонентами композиції і нешкідливі для реципієнта. Термін " по суті вільний", як використовується тут щодо присутності слідів іонів металів у фармацевтичних композиціях, що включають сполуку, означає кількість, яка є меншою від тієї, яка мала б істотний ефект на деградацію сполуки в таких композиціях. Незважаючи на попереднє, така кількість - менше, ніж приблизно 2 мільйонні частини для будь-якого відповідного залишку іона металу. Термін "по суті вільний", як використовується тут щодо присутності кисню в або в контакті з фармацевтичними композиціями, що включають сполуку, означає кількість кисню, що є менше, ніж та, яка мала б істотний ефект на деградацію сполуки в таких композиціях. Наприклад, в композиціях, упакованих у закриті контейнери або флакони, що мають вільний простір, причому такий вільний простір - 25% або менше об'єму контейнера або флакону, термін "по суті вільний" означає, що маються менше, ніж 10% кисню у такому вільному просторі. Термін "сліди іонів металів" як використовується тут означає будь-який металевий іон, коли присутній у водній фармацевтичній композиції, що містить сполуку, спричиняє, ініціює, сприяє або каталізує деградацію сполуки, особливо іони перехідних металів і найбільш особливо іони зала і міді. Активний інгредієнт у представлених фармацевтичних композиціях є (1S,2S)-1-(4-гідроксифеніл)-2-(4гідрокси-4-фенілпіперидин-1-іл)-1-пропанол, який може бути представлений як вільна основа або як фармацевтично прийнятна сіль, переважно як метансульфонат (мезилат). Виготовлення (1S,2S)-1-(4гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанолу описане в патенті США 5,272,160 та в патенті США 6,008,233. Виготовлення три гідрату мезилатної солі описане в Патенті США №6,008,233. У представленому прикладі, (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1пропанол призначається для лікування інсульту або травми в стаціонарному відділенні невідкладної допомоги внутрішньовенною інфузією. Терапія може бути продовжена в відділеннях інтенсивної терапії або інших підрозділах інтенсивної терапії. Кількість призначуваної сполуки частково залежить від ваги тіла пацієнта. Концентрований розчин (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанолу, що може бути розведений відповідно до потреб пацієнта, забезпечує необхідну гнучкість дозування. Концентрований розчин можна, у разі потреби, розводити до відповідної концентрації для введення пацієнтові. Прописи представлених фармацевтичних композицій можуть бути у формі концентрованих розчинів і розведені у прийнятному IV розчиннику до введення. Прописи можуть також бути виготовлені як готові форми в концентраціях, що можуть призначатись без подальшого розведення. Переважна концентрація композицій у формі концентрату - 10мг вільної основи активної сполуки (1S,2S)-1-(4-гідроксифеніл)-2-(4гідрокси-4-фенілпіперидин-1-іл)-1-пропанолу на 1мл розчину (10мгA/мл). Переважна концентрація готових форм 1,25мгА/мл. Композиція призначається в повній концентрації або розводиться, як потрібно. Переважна концентрація дозування для введення пацієнту - 0,1мгА/мл до 10мгА/мл. Більш переважне дозування для введення - в концентрації 0,5мгА/мл до 2,0мгА/мл. Більш переважна концентрація дозування 1,25мгА/мл. Переважний IV розчинник композиції - фізіологічний розчин (0,9% NaCI). Два деграданти, що утворюються хімічною деградацією (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4фенілпіперидин-1-іл)-1-пропанолу у водних розчинах - сполуки: 4-гідроксибензальдегід ("Деградант-1") і 4гідрокси-4-фенілпіперидин ("Деградант-2"). У той час, як така деградація не є суттєвою для здійснення цього винаходу і не має наміру обмежити будь-яким чином, вона - результат окиснення (1S,2S)-1-(4гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанолу. Було знайдено, що контамінація слідами металевих іонів - критичний фактор у деградації сполуки. Такі ефекти ілюструються експериментами збагачених розчинів, що містять сполуку з іонами заліза або міді. Таблиця 1 показує ефект іонів міді і заліза у небуферованому розчині води для ін'єкцій (WFI) на утворення продукту деградації. Таблиця 1 Ефект збагачення іонами Fe2+ і Сu+ на деградацію Сполуки. Числа представляють відсоток Деграданту 1 (ваг./ваг.). Дні День 0 День 3 День 7 тільки Вода д/ін'єкцій 0,002% 0,007% 0,009% Fe2+ (20 мільйонних частин) 0,024% 0,061% 0,110% Сu+ (20 мільйонних частин) 0,085% 0,107% 0,128% ChelexR розчини, що містять 1,25мгА/мл сполуки, збагачені 20 мільйонними частинами заліза або міді і піддані автоклавуванню при 121°С протягом 8 хвилин. Ефективні засоби поліпшення хімічної стабільності сполуки досягаються видаленням слідів іонів металів з водної композиції. Один метод видалення металевого іона - використання агентів, спеціально розроблених для цієї мети. Зразкові агенти для видалення металевих іонів включають хелатоутворювальні полімери типу ChelexR (Chelex - торговельна марка лабораторії Bio-Red, компанія, Hercules, CA). Однак, інші фармацевтично прийнятні хелатоутворювальні полімери або реактиви, що виконують ту ж саму функцію були б прийнятні, за умови, що вони не будуть мати шкідливого впливу щодо сполуки або інших компонентів композиції. Обробка для видалення слідів іонів металів може бути виконана на окремих компонентах композиції до виготовлення готової композиції, або така обробка може бути виконана на готовій композиції безпосередньо. Наприклад, вода, що використовується в композиціях, може бути оброблена, щоб видалити сліди металів. Альтернативно, концентровані буферні розчини композиції з активним інгредієнтом можна обробляти перед розведенням водою. В іншій альтернативі, водний розчин, що містить усі компоненти композиції, крім активного фармацевтичного компонента можна піддавати обробці по видаленню металевих іонів. В подальшій альтернативі обробляється готова композиція, що містить усі компоненти, включно активний інгредієнт. Альтернативно, видалення слідів іонів металів повинно включати певні сполуки композиції, що утворюють хелат з залишками(слідами) іонів металу, таким чином мінімізуючи ефект деградації. Приклади таких хелатоутворювальних агентів включають динатрій-етилендіамінтетраоцтову кислоту (EDTA) і цитратні або тартратні буфери. Переважна концентрація динатрій - EDTA, цитратного буфер у і тартратного буферу - 10мМ кожного. Цитрат і тартрат, як припускають, діють як хелатоутворювальні агенти для слідів іонів металів. Крім того, сукцинат, як припускають, діє як хелатоутворювальний агент. Інші хелато утворювальні агенти будуть очевидні фахівцям в світлі цього розкриття. Водні розчини сполуки сприйнятливі до зміни рН. Сполука, як припускають, демонструє кращу хімічну стабільність між рН 4,0 і 4,5. Коли сполука виготовлена тільки з водою, рН композиції збільшується вище 5. Ця зміна рН приводить до умов, сприятливих окисній реакції деградації, таким чином прискорюючи деградацію водної сполуки. Збільшення рН також зменшує солюбільність сполуки, таким чином збільшується можливість осадження з розчину. Зміна рН може бути мінімізована, використовуючи прийнятний буфер. Фахівці оцінять, що може використовува тися будь-який фармацевтично прийнятний буфер, який підтримує рН сполуки в межах певного діапазону,. Діапазон рН такого буфера - переважно між приблизно 3,8 і приблизно 5,0, і найбільше переважно між 4,0 і 4,5. Прийнятні буфери включають, але не обмежуються: ацетатний, бензоатний, цитратний, форміатний, лактатний і тартратний буфери, переважно лактатний. Таблиця 2 ілюструє використання різних буферів, щоб стабілізувати рН композицій, що містять 10мгА/мл сполуки. Таблиця 2 рН при 70°С Буферний лот 10мМ ацетатний 10мМ бензоатний 10мМ цитратний 10мМ форміатний 3мМ лактатний 10мм тартатний Вихідна (після термінальної стерилізації) 4,16 4,21 4,16 4,17 4,24 4,15 2 день 4 день 7 день 21 день Н/Б Н/Б 4,16 4,18 4,21 4,17 4,14 4,16 Н/Б Н/Б Н/Б Н/Б 4,14 4,20 4,17 4,16 4,20 4,17 4,17 Н/Д 4,11 4,13 4,14 4,07 Н/Б не брали; Н/А = не доступний. В порядку подальшого поліпшення стабільності активної сполуки переважним є те, що кисень у композиції зменшується. Це може бути досягнено барботуванням розчину сполуки азотом, аргоном або іншим інертним газом і, коли композиції винаходу упаковані у флакони або подібні контейнери, що містять вільний простір, використовують такий інертний газ для останнього. Коли композиції винаходу упаковані так, що вони містять вільний простір, переважно, що кисень, який міститься в вільному просторі буде менше, ніж приблизно 12% і, найбільш переважно, менше, ніж приблизно 8%. Кисень може бути вилучений іншими методами, включаючи використання вакууму, щоб видалити повітря і кисень. Інші способи видалення кисню будуть очевидні фахівцям. В переважних аспектах представлені композиції включають сполуку в концентрації 10мгА/мл. Ця концентрація - біля максиму солюбільності сполуки (приблизно 12мгА/мл при 5°С). Переважний розчин композиції - 10мМ лактатний буфер. Однак, фа хівці оцінять, що можуть використовуватися буферні розчини інших аніонів, що включають, але не обмежуються буферними розчинами аніонів ацетату, цитрату, тартрату і форміату. Переважна упаковка композицій - 40см 3 флакони з фасонного скла тип І Флінта з гумовою пробкою й алюмінієвою оболонкою. Альтернативно, можуть бути інші флакони або типи контейнерів, як попередньо заповнений шприць або IV пакети. Інші представлені упаковки будуть очевидні фа хівцям. Флакони переважно стерилізують методами стерилізації, включно автоклавуванням. Переважно, стерилізація - протягом 8 хвилин при 121°С. Стерилізація може викликати невелику зміну рН. У композиції, забуферованій лактатом, рН переміщується злегка вниз. Щоб досягати середини в переважному діапазоні рН, початкова рН переважно встановлена 4,5. Періодичний цикл стерилізації приводить до зменшення рН до приблизно 4,2. Даний винахід ілюструється наступними прикладами, але не обмежується їх деталями. Відсотки Деграданту 1 і Деграданту 2 вимірювали використанням зворотної фази ВЕРХ (високоефективна рідинна хроматографія) на Kromasil С4 колонці, 5, mm, 25см довжини ´ внутрішнім діаметром 4,6мм (ЕКА Chemicals, Bonus Швеція). Температура колонки була 30°С±5°С. Мобільна фаза А: вода/ацетонітрил/трифтороцтова кислота, 90/10/0,1 (ν/ν/ν). Мобільна фаза В: вода/ацетонітрил/трифтороцтова кислота, 40/60/0.1 (ν/ν/ν). Профіль градієнта: лінійний. Виявлення: UV @ 215нм. Швидкість потоку: 1,5мл/хв. Об'єм ін'єкції: 10mm. Приклад 1 Ефект обробки з хелатоутворювальним полімером. Розчини натрію хлориду 0.3, 0,6 та 0,9% обробляли 5%ваг/ваг ChelexR полімером і повільно розмішували протягом 1 години. РН розчинів був встановлений до 4,6 при перемішуванні з ChelexR полімером. Потім суміш фільтрували. Були виготовлені контрольні зразки розчинів натрію хлориду 0,3, 0,6 і 0,9%, які не обробляли Chelex полімером. Оброблені і необроблені розчини були об'єднані з (1S,2S)-1-(4гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанолом в концентрації 1,25мгА/мл і зберігались в герметичних флаконах з фасонного скла типу Флінт І 5см 3, що містять розчин 4,0мл, і 2,0мл повітря вільного простору при 70°С протягом 7 днів. Результати цього експерименту представлені в Таблиці 3. Таблиця 3 Відсоток Деграданту 1 (ваг./ваг.) % NaCL 0,3 0,6 0,9 необроблений 0,034% 0,038% 0,033% оброблений 0,004% 0,003% 0,003% Приклад 2 Ефект композиції з хелатоутворювальним агентом. Наступні розчини були виготовлені в концентрації 10мМ кожний з рН 4,2: 1. небуферований фізіологічний розчин (0,9% NaCI); 2. 10мМ цитратний буфер у фізіологічному розчині (0,9% NaCI); 3. 10мМ тартратний буфер у фізіологічному розчині (0,9% NaCI); і 4. 10мМ динарій-EDTA у фізіологічному розчині (0,9% NaCI). Кожний з розчинів був об'єднаний з (1S,2S)-1-(4-гідроксифеніл)-2(4-гідрокси-4-фенілпіперидин-1-іл)-1пропанолом у концентрації 1,25мгА/мл і рН встановили до 4,2. Кожний пропис був підданий 8-хвилинному циклу автоклавування при 121°С і потім зберігався при 70°С. Результати цього експерименту представлені в Таблиці 4 нижче. Таблиця 4 Відсоток Деграданту 1 (ваг./ваг.) 0,9% NaCL Н/Д Н/Д 0,033% День 0 День 3 День 7 мМ тартратний 0,002% 0,003% 0,006% мМ цитратний 0,000% 0,001% 0,001% мМ EDTA 0,000% 0,000% 0,002% Н/Д - не доступний. Приклад 3 4-Пдроксибензальдегід (Деграданті). ЯМР аналіз виконували при температурі навколишнього середовища на Bruker Avance DRX 500МГц ЯМР-спектрометрі, використовуючи Bruker 5mm градієнтний широкополосний детектор (Bruker Instruments, Inc., Billerica, MA). Зразок був розчинений у 99,9% дейтерованому диметилсульфоксиді (ДМСО). 13 С-ЯМР Вуглець (мільйонні частини) 115,84 128,43 132,10 163,32 190,95 1 Приєднаний Н 1 0 1 0 1 + Н-ЯМР Протон (мільйонні частини) d 6,92 Протонна кратність дублет 7,74 дублет 9,77 синглет Приклад 4 4-гідрокси-4-фенілпіперидин (Деградант 2). ЯМР аналіз проводили при температурі навколишнього середовища на Bruker Avance DRX 500МГц ЯМР-спектрометрі, використовуючи Bruker 5mm градієнтий широкополосний детектор. Зразок був розчинений у 99,9% дейтерованому диметилсульфоксиді (DMSO). 13 С-ЯМР Вуглець (мільйонні частини) 39,05 Приєднаний Н+ 2 1 42,03 2 70,41 124,70 125,97 127,76 150,76 0 1 1 1 0 Н-ЯМР Протон (мільйонні частини) d 1,49 1,77 2,70 2,92 Протонна кратність Дублет Триплет Дублет Триплет 7,46 7,18 7,30 Дублет Триплет Триплет Приклад 5 (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4-фенілпіперидин-1-іл)-1-пропанол в лактатному буфері. Компонент (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4фенілпіперидин-1-іл)-1-пропанолу мезилат тригідрат Молочна кислота Марка Функція Активний Pharm інгредієнт USP Буфер Вага (мг/фл) Концентрація мг/мл 586,01 14,577 (екв. 10мгА/мл) 41,12 1,023 Гідроксид натрію Соляна кислота Вода для ін'єкцій NF NF USP РН модифікатор РН модифікатор носій Са 13,87 0 39711,76 Са 0,345 0 987,855 USP - Фармакопея США, NF - національний формуляр. PH початкової композиції встановили 4.5, щоб пристосувати незначні зміни рН вниз при стерилізації. Кінцевий цикл стерилізації знижує рН до приблизно 4,2. Гідроксид натрію і соляна кислота використовуються за необхідністю, щоб коректувати розчин до бажаного рН. Приклад 6 Прискорені вивчення стабільності. Виготовили 10мгА/мл розчин (1S,2S)-1-(4-гідроксифеніл)-2-(4-гідрокси-4фенілпіперидин-1-іл)-1пропанолу у 10мМ лактатному буфері. РН трьох окремих частин був відкоректований для того, щоб після завершення стерилізації рН становив 3,9, 4,2 або 4,6. Сполуки упакували у флакони, що містять різні концентрації кисню або повітря. Термінальна стерилізація проводилась автоклавуванням при 121°С протягом 8 хвилин. Зразки зберігались у флаконах Флінта тип І, заповнених 40мл і, які містять 10мл вільного простору протягом 12 тижнів при 30°С, 40°С і 50°С. Результати цього експерименту представлені в Таблиці 5 і Таблиці 6 нижче. Таблиця 5 Числа представляють відсоток Деграданту 1 (ваг./ваг.) Вільний простір, рН 4% О2, рН 4,2 6% О2, рН 4,2 10% О2, рН 4,2 Повітря, рН 4,6 Повітря, рН 4,2 Повітря, рН 3,9 Початков. 0,002% 0,002% 0,004% 0,003% 0,003% 0,003% Після термінальної стерилізації 0,004% 0,004% 0,003% 0,003% 0,004% 0,003% 30°С 0,003% 0,004% 0,004% 0,008% 0,004% 0,009% 40°С 0,005% 0,005% 0,006% 0,015% 0,006% 0,019% 50°С 0,009% 0,011% 0,015% 0,033% 0,032% 0,040% Таблиця 6 Числа представляють відсоток Деграданту 2 (ваг./ваг) Вільний простір, рН 4% О2, рН 4,2 6% О2, рН 4,2 10% О2, рН 4,2 Повітря, рН 4,6 Повітря, рН 4,2 Повітря, рН 3,9 Початков. 0,003% 0,003% 0,002% 0,002% 0,001% 0,001% Після термінальної стерилізації 0,006% 0,006% 0,006% 0,005% 0,005% 0,003% 30°С 0,008% 0,008% 0,009% 0,012% 0,008% 0,013% 40°С 0,010% 0,010% 0,013% 0,018% 0,012% 0,023% 50°С 0,017% 0,019% 0,024% 0,043% 0,042% 0,051%
ДивитисяДодаткова інформація
Назва патенту англійськоюStable pharmaceutical compositions of nmda receptor agonist (variants) and method of treatment
Назва патенту російськоюФармацевтическая композиция агониста рецепторов nmda (варианты) и способ лечения
МПК / Мітки
МПК: A61K 31/445, A61K 31/675
Мітки: рецептора, варіанти, містить, спосіб, композиція, агоніст, фармацевтична, лікування
Код посилання
<a href="https://ua.patents.su/6-73619-farmacevtichna-kompoziciya-shho-mistit-agonist-receptora-nmda-varianti-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить агоніст рецептора nmda (варіанти) та спосіб лікування</a>
Попередній патент: Дезактивуючий мийний засіб із зниженим піноутворенням
Наступний патент: Привід транспортного засобу
Випадковий патент: Мікродозатор рідини