Трансдомінантно інгібіторна h-sgk кіназа, в якій лізин в положенні 127 замінений аргініном, та її застосування для одержання лікарського засобу
Номер патенту: 79066
Опубліковано: 25.05.2007
Автори: Брьоер Штефан, Вальдеггер Зігфрід, Вагнер Карстен, Клінгель Карін
Формула / Реферат
1. Трансдомінантно інгібіторна h-sgk кіназа, в якій лізин в положенні 127 замінений аргініном.
2. Застосування трансдомінантно інгібіторної h-sgk кінази, в якій лізин в положенні 127 замінений аргініном, для одержання лікарського засобу для лікування захворювань, що супроводжується зниженням активності епітеліального натрієвого каналу і/або Na+, K+, 2Cl- співпереносника, вибраних з групи: цироз печінки, фіброзний панкреатит, фіброз легень, радіаційний фіброз, склеродермія, кістозний фіброз, хронічний бронхіт, артеріальна гіпертонія, хвороба Крона і хвороба Альцгеймера.
Текст
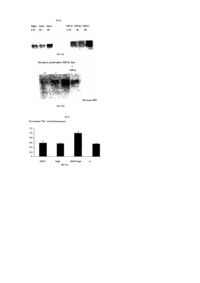
Даний винахід стосується лікарських засобів, що містять інгібітори або активатори людської h-sgk кінази, яка регулює розмір клітин. Такі лікарські засоби придатні для лікування хворобливих станів, при яких спостерігається підвищена чи знижена експресія h-sgk. H-sgk, а також спосіб її одержання, [описаний у європейській заявці на патент ЕР-0 861 896], докладний зміст якого є складовою пропонованого опису. Тлумачення понять: h-sgk: ENaC: MDEG: TGFβ1: NKCC: HEPES: SEM: Трансдомінантна інгібіторна кіназа: людська серин і глюкокортикоїд залежна кіназа (Серин/Треонін-Кіназа) епітеліальний Na+ канал (натрієвий канал) переродження у ссавця (Waldmann, R., Lazdunski, М. (1998) Current Opinion in Neurobiology 8 : 418-424); синонім поняття «BNC» (Na+ канал головного мозку) фактор β1 росту пухлини Na+, K+-, 2СІ - співперенощик [4-(2-гідроксиетил)-піперазино]-етансульфонова кислота стандартна помилка іменна шляхом мутації h-sgk: лізин у положенні 127 замінений аргініном (К 127 R); мутація відбувається в каталітичній області і паралізує каталітичну функцію кінази. Підвищення експресії h-sgk яскраво виражається при таких хворобах, як: цукровий діабет, артеріосклероз, хвороба Альцгеймера, цироз печінки, хвороба Крона, фіброзний панкреатит, фіброз легень і хронічний бронхіт. Підвищене утворення h-sgk можна пояснити стимуляцією експресії через фактор TGF3, (Фіг.1). Причиною фіброзних захворювань є високий ступінь утворення і слабкий ступінь розщеплення матричних протеїнів. Обидва явища є результатом дії фактора ΤGFβ1. У фібробластах можна призупинити підвищену експресію матричних протеїнів за допомогою пригнічення NKCC фуросемідом (Фіг.2). Дотепер було не ясно, чи є підвищена експресія h-sgk лише наслідком чи причиною захворювання. Дані аналізу підтверджують, що h-sgk активує Na+, K+, 2Сl- співперенос (Фіг.3). Звідси можна зробити висновок, що стимуляція NKCC за допомогою h-sgk викликає фіброз. Разом з Na+, K+, 2Сl- співпереносом за допомогою h-sgk активуються ще ENaC (Фіг.4 і 5) і MDEG. Стимулюючу дію h-sgk на ENaC можна призупинити за допомогою інгібітору кінази, як наприклад, стауроспорин (Sigma, D-8204 Deisenhofen) чи хелеритрин (Sigma, loc.cit.) (Фіг.4). Крім цього дію h-sgk на ENaC можна призупинити, наприклад, за допомогою трансдомінантної інгібіторної кінази (Фіг.5). Тому інгібітори hsgk, такі як стауроспорин, хелеритрин чи інші інгібітори кіназ, могли б бути використані при лікуванні названих вище захворювань. В основному для цих цілей придатні усі відомі інгібітори кіназ. Інгібітори кіназ в багатьох випадках можна придбати в торговій мережі, наприклад, фірми Calbiochem-Novabiochem Gmb, Lisztweg 1, D65812 Bad Soden («1998 General Catalog»). Інші інгібітори кіназ можна придбати з інших комерційних і некомерційних джерел, відомих фахівцю. При епілептичному приступі h-sgk багаторазово експримується. Виявлені нами дані показують, що корисними є впливи, що знижують збудливість нейронів, тому що активація NKCC приводить до зниження позаклітинної концентрації K+ і, як наслідок цього, гіперполяризації і зв'язаним з цим пригніченням активності нейронів. Крім цього пригнічення MDEG повинне стримувати збудливість нейронів. Тому активатори кінази, що перевищують гемато-енцефалічний бар'єр, могли б успішно застосовуватися при епілептичних приступах. І навпаки, стримування кінази могло б у сполученні з медикаментами, що перевищують гемато-енцефалічний бар'єр, підвищувати уважність і здатність до навчання. Активатори кіназ давно відомі фахівцям, особливий інтерес представляють С-активатори протеїнкінази [див. Calbiochem -Novabiochem 1998 General Catalog, loc.cit.]. Інші активатори кіназ можна придбати з інших відомих фахівцю комерційних і не комерційних джерел. Оскільки Na+, K+, 2Сl- співперенос і Na+ - канал відіграють важливу роль при нирковій Na+ резорбції, а підвищена ниркова Na+ - резорбція протікає при гіпертонії, варто припустити, що підвищення експресії кінази приводить до гіпертонії, а зниження експресії кінази до гіпотонії. Даний винахід стосується, таким чином, також застосування інгібіторів h-sgk для одержання лікарських засобів для лікування цукрового діабету, артеріосклерозу, хвороби Альцгеймера, цирозу печінки, хвороби Крона, фіброзного панкреатиту, фіброзу легень, хронічного бронхіту, радіаційного фіброзу, склеродермії, кістозного фіброзу і інших фіброзних захворювань, а також для лікування артеріальної гіпертонії. Крім цього, лікарські засоби, що містять інгібітори чи активатори h-sgk можна використовувати для регулювання нейрональной збудливості. Найкраще застосування в якості інгібіторів стауроспорину чи хелеритрину, а також їхніх аналогів. Результати Діабетична нирка: У звичайній нирці h-sgk лише слабко експримована. Чітка експресія h-sgk виявляється в окремих клітинах ниркового клубочка, пізніх проксимальних і дистальних канальців. На відміну від цього в діабетичній нирці виявляються скупчення клітин з масивною еспресією h-sgk. Артеріосклероз: У стінках артеріосклеротичних судин виявляється збільшення масиву експрисуючих h-sgk клітин. Хвороба Альцгеймера: У звичайному мозку виявлені лише окремі клітини, що експримують h-sgk. Цими клітинами очевидно є олігодендрогліальні клітини. При хворобі Альцгеймера спостерігається значне збільшення числа клітин, експрисуючих h-sgk. Цироз печінки: У звичайній печінці h-sgk експримує лише в Купферовских клітинах. При цирозі печінки тканини усіяні клітками, експримуючими h-sgk. Хвороба Крона: В нормальній тканині кишечника h-sgk експримує винятково в ентероцитах. При хворобі Крона кіназу виявляють також і в сполучній тканині. Фіброзний панкреатит: В нормальній підшлунковій залозі h-sgk виявляють в ацинарних клітинах і мігруючих клітинах. Одиночні групи h-sgk - експримуючих одноядерних клітин виявляються навколо входу в підшлункову залозу. При фіброзному панкреатиті чітко підвищується експресія кінази. Фіброз легень і хронічний бронхіт: Масивна експресія h-sgk спостерігаються при фіброзі легень і хронічних бронхітах. Стимуляція h-sqk-експресії за допомогою фактора TGFβ1: Експресія h-sgk стимулюється за допомогою фактора TGFpn (Фіг.1). Оскільки TGFβ1, утворюються в фіброзних запалених тканинах, то цим пояснюється підвищена експресія h-sgk в запаленій тканині. TGFβ1 стимулює експресію матричного протеїну біглікану, процес, що призупиняється під впливом інгібітору NKCC фуросеміду. TGFβ1 стимулює експресію біглікана. В присутності NKCC-інгібітора фуросеміду дія фактора TGFβ1 на експресію біглікана повністю паралізована. Таким чином фіброзна дія фактора TGFβ1 припускає активування NKCC (Фіг.2). Стимулювання NKCC за допомогою h-sqk: Підвищена експресія кінази в фіброзних тканинах може мати різне значення, що не має причинного зв'язку з фіброзом. Однак, експерименти з двохелектродною клемою напруги показують, що активність NKCC масовано стимулюється h-sgk (Фіг.3). Ці дані дослідження, приймаючи до уваги чутливість фуросеміда при синтезі біглікана, однозначно доводять причинну роль h-sgk при фіброзі. Стимулювання ENaC за допомогою h-sqk: Цей процес можна призупинити за допомогою інгібіторів кінази стауроспорину і хелеритрину. Як показано на Фіг.4, потік через ENaC значно зростає завдяки співекспресії з h-sgk. Кіназа, таким чином, стимулює ENaC. Під впливом інгібіторів кінази стауроспорину і хелеритрину можна зовсім призупинити активування ENaC за допомогою h-sgk. Стимулювання епітеліального ENaC за допомогою h-sgk може змінитися прямо в протилежну сторону через співекспресію трансдомінантної інгібіторної h-sgk кінази: Як показано на Фіг.5, стимулюючу дію h-sgk-cniBeKcnpecii на №+-потік, обумовлений ENaC, можна призупинити за допомогою співкспресії трансдомінантної інгібіторної кінази. Ця трансдомінантно-інгібіторна кіназа (дивися розділ «Тлумачення понять») при каталізі так змінюється, що вона не може більше розвивати свою функцію. Але оскільки вона нашаровується на субстрат, вона витісняє активну кіназу і пригнічує таким чином її дію. Трансдомінантно-інгібіторна кіназа пригнічує не тільки ріст ENaC-активності за допомогою екзогенної h-sgk, але і, як видно, пригнічує стимулювання за допомогою ендогенної h-sgk. MDEG цілком виключається завдяки співекспресії з h-sqk: Як показано на Фіг.6, експресія MDEG індукує в овоцитах сильний №+-потік, що активується шляхом зниження позаклітинної величини рН. Канал повністю блокується за рахунок співекспресії з h-sgk. Звідси напрошується висновок, що h-sgk пригнічує нейрональну збудливість. Приклади: Приклад 1: Гібридизація in situ Тканини нормальної підшлункової залози, печінки, судин, мозку, легень, нирок і кишечнику, а також тканини при діабетичний нефропатії, артеріосклерозі, хворобі Альцгеймера, цирозі печінки, хворобі Крона, фіброзному панкреатиті ι фіброзі легень у 4% параформальдегід/0,1Μ натрійфосфатному буфері (рН7,2) заливають на 4 години в парафін. Зі зрізів тканини видаляють парафін і проводять гібридизацію, як це описано раніше [Kandolf, R., D. Ameis, P. Kirschner Α., Canu, P.H. Hofschneider, Proc. Natl. Acad. Sci. USA 84: 6272-6276, 1987; Hohenadl, C, K.. Klingel, J. Mertsching, P.H. Hofschneider, R. Kandolf., Моl. Cell. Probes 5: 11-20, 1991; Klingel,K.., С Hohenadl, A. Canu, M. Albrecht, M. Seemann, G. Mall, R. Kandolf, Proc. Natl. Acad. Sci. USA, 89: 314318, 1992]. Гібридизована суміш містить або кодучу h-sgk, 35S-марковану сенс-РНК, чи комплементарну до останьої РНК, 35S-марковану антисенс-РНК (по необхідності 500нг/мл) в 10мМ Трис-НСІ, рН7,4; 50% (об'єм/об'єм) деіонізованого формаміда; 600мМ NaCI; 1мМ EDTA (етилендіамінтетраоцтова кислота); 0,02% полівінілпірролідону; 0,02% фіколу; 0,05% телячого сироваткового альбуміну; 10% декстрансульфату; 10мм дитіотреітолу; 200мкг/мл денатурованої соніцованої (гомогенат, отриманий під впливом ультразвуку) ДНК сперми лосося і 100мг/мл РНК печінки кролика. Гібридизацію з РНК-пробами проводять при температурі 42°С протягом 18 годин Носії об'єктів промивають, як це описано в [Hohenadl et al., 1991; Klingel et al., 1992], а потім проводять інкубацію протягом 1 години при температурі 55°С в 2x стандартному цитраті натрію. Негібрідизовані проби однониткових РНК піддають ферментативному розкладанню за допомогою РНКази А (20мг/мл) у 10мМ Трис-НСІ, рН8,0/0,5Μ NaCI протягом 30хв. при температурі 37°С Проби тканини протягом трьох тижнів ауторадіографують [Klingel et al., 1992] і забарвлюють гематоксилін/еозином. Приклад 2: Транскрипційне регулювання біглікана і h-sgk. Клітини культивують у RPMi/5% СО2/10мМ глюкози при температурі 37°С, рН7,4, додаючи до 10% (об'єм/ об'єм) зародкової телячої сироватки (FCS). Клітини культивують до 90% злиття і після цього гомогенезують в трізолі (GIBCO/BRL) (приблизно 0,4´106 на зразок). Повну РНК препарують відповідно до вказівки виробника. Блоти за Нортоном розділяють за методом електрофорезу з 15 чи 20мкг/мл повної РНК із роздільним контролем в присутності 2,4моль/л формальдегіду з використанням 10г/л агарового гелю. У вакуумі (Appligene Oncor Trans DNA Express Vacuum Blotter, Appligene, Хайдельберг, Німеччина) РНК переносять на позитивно заряджені нейлонові мембрани (Boehringer Маннгейм, Гермния) і зшивають під впливом ультрафіолетового світла (UV Stratalinker 2400, Stratagane, Хайдельберг, Німеччина). Гібридизацію проводять протягом ночі з застосуванням DIG-Easy-Hyb (Boehringer Маннгейм) при концентрації проб 25мг/л при температурі 50°С. Дігоксигенін (DIG) - марковані проби одержують за допомогою полімеразної ланцюгової реакції (ПЦР), як це докладно описано в [Waldegger et.al. (1997) PNAS 94: 4440-4445]. Для ауторадіографії фільтри експонують на рентгенівську плівку (Кодак) в середньому протягом 5хв. Приклад 3: Експерименти за допомогою двоелектродної клеми напруги і мічених атомів. Розсічення Xenopus laevis, одержання й обробка овоцитів докладно описана в [Busch et.al. 1992]. Овоцити ін'єкують по 1нг цРНК із NKCC, ENaC чи MDEG з чи без одночасною ін'єкцією h-sgk. Експерименти з двоелектродними клемами напруги і струму можна проводити через 2-8 днів після ін'єкції. Стримування фуросемідом проникнення Na+ за допомогою NKCC виявляють шляхом поглинання 22Na+ овоцитами, що визначають із застосуванням сцинтиляційного лічильника. Потік Na+ (ENaC) фільтрують при частоті 10гц і реєструють за допомогою самописця. Експерименти проводять звичайно на другий день після ін'єкції цРНК. Розчин у ванні містить: 96мм хлористого натрію, 2мм хлористого калію, 1,8мм хлористого кальцію, 1мМ хлористого магнію і 5мМ HEPES при величині рН7,5 і підтримуваному потенціалі -50mV. У всіх експериментах величину рН встановлюють шляхом титрування соляною кислотою або їдким натром. Швидкість протікання через ванну складає 20мл/хв., завдяки чому забезпечується повна зміна розчину у вимірювальній камері протягом 10-15сек. Всі дані приведені в середньоарифметичних величинах ±SEM. Пояснення до креслень Фіг.1 Стимулювання експресії h-sgk за допомогою фактора TGFβ1: Експресія h-sgk стимулюється фактором TGFβ1. Показано дію фактора TGFβ1 після закінчення 0,5-6 годин (вгорі). Форболовий ефір PDD (4-альфа-форбол-12,13-дидеканоат; стимулює протеїн кіназу С) і іонофор Са++ іономіцин (Sigma, loc.cit.; підвищує внутрішньоклітинну концентрацію Са++) одночасно стимулюють експресію h-sgk (внизу). Фіг.2 Стимулювання експресії біглікана за допомогою фактора TGFβ1: Експресія біглікана (В) стимулюється осмотичним набряканням клітини (гіпо=h, вгорі, ліворуч) і фактором TGFβ1 (праворуч, вгорі). В присутності NKCC-інгібітору буметаніду (b) дія фактора TGFβ1 на експресію біглікана майже цілком припинена (контроль=с). Фіг.3 Стимулювання NKCC за допомогою h-sgk: Поглинання 22Na* овоцитами, стримуване фуросемідом [поглинання (нмоль/20хв./овоцит) =u], що експримує NKCC, масовано стимулюється за допомогою h-sgk. Овоцити, ін'єковані NKCC, не характеризуються більш високим проникненням Na+, в порівнянні з неін'єкованими овоцитами (n.і.). Проникнення Na+ не стримується інгібітором NKCC фуросемідом (=F) (вгорі). Експресія h-sgk сама по собі не приводить до стимулювання проникнення Na+. Співекспресія h-sgk з NKCC веде до сильного збільшення проникнення Na+, що цілком паралізується фуросемідом. Фіг.4 Стимулювання ENaC за допомогою h-sgk: Потік через ENaC (1) сильно зростає завдяки співекспресії з h-sgk. Обробка овоцитів інгібіторами кінази стауроспорином (S) чи хелеритрином (С) паралізує активність №+-каналу завдяки h-sgk. Фіг.5 Стимулювання ENa за допомогою h-sgk може виглядати протилежним чином внаслідок співекспресії трансдомінантної інгібіторної кінази: Овоцити, що одночасно експримують ENaC і h-sgk, показують набагато більший потік (1) в порівнянні з овоцитами, що експримують тільки ENaC. Співекспресія трансдомінантної інгібіторної кінази припиняє стимулювання ENaC за допомогою h-sgk. Фіг. 6 Придушення MDEG за допомогою h-sgk: Потік, викликаний MDEG (1), зростає в міру збільшення тривалості інкубування [день (Т) 1-4]. Внаслідок співекспресії з h-sgk потік зовсім припиняється (пік=р; плато=рl).
ДивитисяДодаткова інформація
Назва патенту англійськоюTransdominant inhibitory kinase h-sgk in which lysine is substituted in the 127 position by arginine, and its use for preparation the remedy
Назва патенту російськоюТрансдоминантно ингибиторная h-sgk киназа, в которой лизин в положении 127 заменен аргинином, и ее использование для получения лекарственного средства
МПК / Мітки
МПК: A61K 38/45, A61P 9/12, A61P 17/00, A61P 1/16, A61P 25/28, A61P 11/00, A61P 1/18
Мітки: кіназа, якій, лікарського, засобу, застосування, аргініном, замінений, лізин, h-sgk, положенні, інгібіторна, трансдомінантно, одержання
Код посилання
<a href="https://ua.patents.su/6-79066-transdominantno-ingibitorna-h-sgk-kinaza-v-yakijj-lizin-v-polozhenni-127-zaminenijj-argininom-ta-zastosuvannya-dlya-oderzhannya-likarskogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Трансдомінантно інгібіторна h-sgk кіназа, в якій лізин в положенні 127 замінений аргініном, та її застосування для одержання лікарського засобу</a>