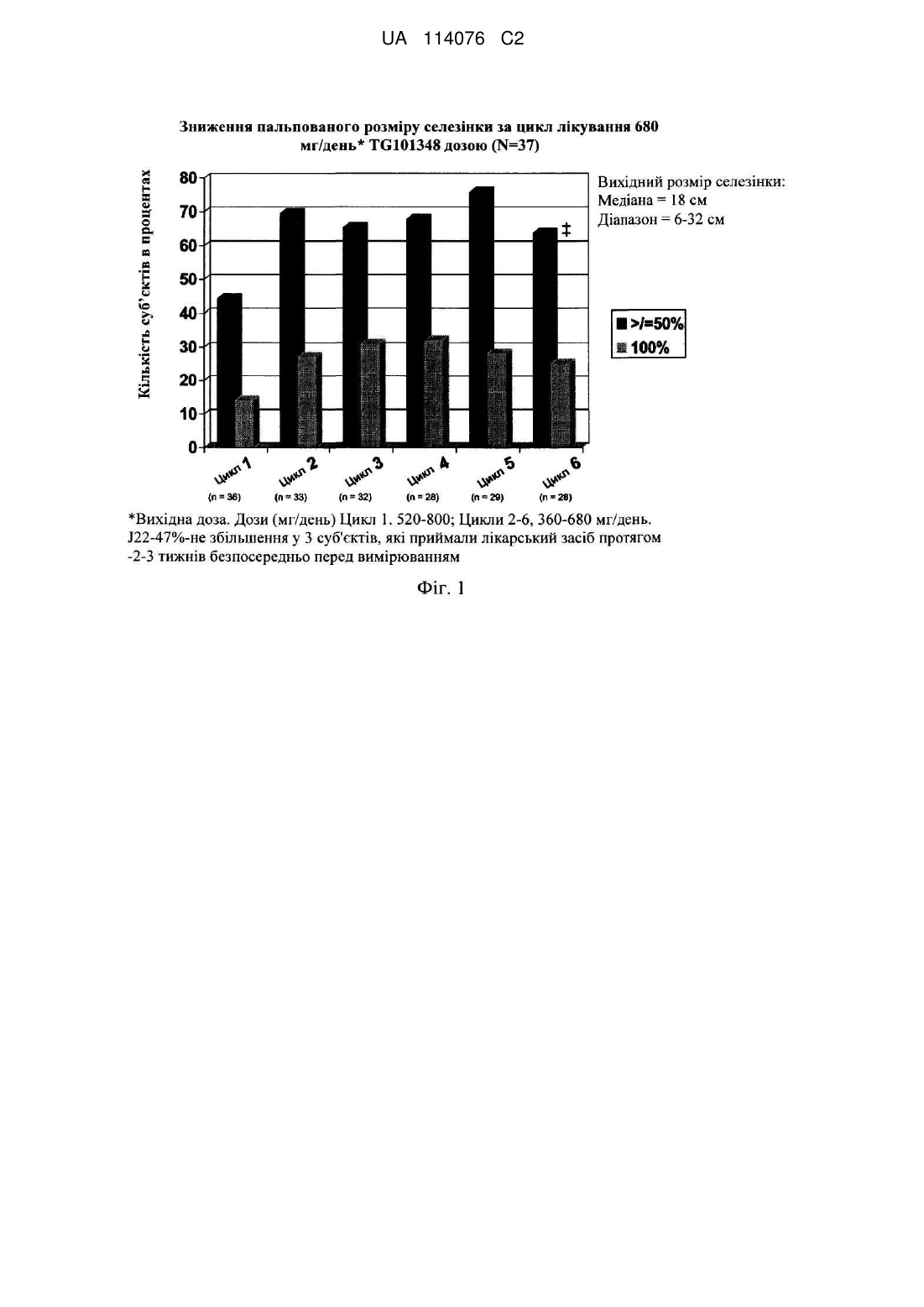
Композиція і спосіб лікування мієлофіброзу
Формула / Реферат
1. Капсула, прийнятна для перорального введення, яка містить суміш, що включає (і) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрат, (іі) мікрокристалічну целюлозу, і (ііі) стеарилфумарат натрію, де суміш міститься в капсулі.
2. Капсула за п. 1, де капсула містить приблизно від 10 мг до приблизно 500 мг сполуки, де вказана маса є масою фрагмента сполуки, що відповідає вільній основі.
3. Капсула за п. 2, де капсула містить приблизно 10 мг, приблизно 40 мг, приблизно 100 мг або приблизно 200 мг сполуки.
4. Капсула за п. 3, де капсула містить приблизно 100 мг сполуки.
5. Капсула за будь-яким з пп. 1-4, де масове співвідношення сполуки і мікрокристалічної целюлози в суміші знаходиться в діапазоні від приблизно 1:1,5 до приблизно 1:15, де маса сполуки в масовому співвідношенні дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі.
6. Капсула за будь-яким з пп. 1-5, де масове співвідношення сполуки і стеарилфумарату натрію в суміші знаходиться в діапазоні від приблизно 5:1 до приблизно 50:1, де маса сполуки в масовому співвідношенні дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі.
7. Капсула за будь-яким з пп. 1-6, де мікрокристалічна целюлоза являє собою силікатовану мікрокристалічну целюлозу.
8. Капсула за будь-яким з пп. 1-7, де сполука являє собою моногідрат дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду.
9. Капсула за п. 8, де капсула містить суміш, яка включає приблизно 12 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду, приблизно 122 мг силікатованої мікрокристалічної целюлози і приблизно 1 мг стеарилфумарату натрію.
10. Капсула за п. 8, де капсула містить суміш, яка включає приблизно 47 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду, приблизно 448 мг силікатованої мікрокристалічної целюлози і приблизно 5 мг стеарилфумарату натрію.
11. Капсула за п. 8, де капсула містить суміш, яка включає приблизно 117 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду.
12. Капсула за п. 8, де капсула містить суміш, яка включає приблизно 235 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду, приблизно 357 мг силікатованої мікрокристалічної целюлози і приблизно 6 мг стеарилфумарату натрію.
13. Капсула за будь-яким з пп. 1-8, де стеарилфумарат натрію становить приблизно 1 мас. % від маси вмісту капсули.
14. Капсула за п. 7 або 8, де масове співвідношення сполуки і силікатованої мікрокристалічної целюлози становить приблизно 1:1,5.
15. Капсула за п. 7 або 8, де масове співвідношення сполуки і силікатованої мікрокристалічної целюлози становить приблизно 1:9.
16. Капсула за будь-яким з пп. 1-15, де капсула являє собою тверду желатинову капсулу.
17. Спосіб лікування мієлофіброзу у суб'єкта, який включає оральне введення капсули, яка містить суміш (і) N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду або його фармацевтично прийнятної солі, або його гідрату, (іі) мікрокристалічної целюлози, і (ііі) стеарилфумарату натрію, де суміш міститься в капсулі.
18. Спосіб за п. 17, де суб'єкт має первинний мієлофіброз.
19. Спосіб за п. 17, де суб'єкт має мієлофіброз, розвинений на фоні попередньої справжньої поліцитемії (post-PV MF).
20. Спосіб за п. 17, де суб'єкт має мієлофіброз, розвинений на фоні попередньої есенціальної тромбоцитемії (post-ET MF).
21. Спосіб за будь-яким з пп. 17-20, де сполуку вводять щодня.
22. Спосіб за будь-яким з пп. 17-21, де масове співвідношення сполуки і мікрокристалічної целюлози в суміші знаходиться в діапазоні від приблизно 1:1,5 до приблизно 1:15, і де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі.
23. Спосіб за будь-яким з пп. 17-22, де масове співвідношення сполуки і стеарилфумарату натрію в суміші знаходиться в діапазоні від приблизно 5:1 до приблизно 50:1, і де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі.
24. Спосіб за будь-яким з пп. 17-23, де суб'єкт являє собою людину.
25. Спосіб за будь-яким з пп. 17-23, де сполука являє собою моногідрат дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду.
26. Спосіб отримання капсульного лікарського продукту, який включає а) змішування стеарилфумарату натрію із сполукою, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрат, для отримання гранул; і b) змішування гранул, отриманих на стадії а), з силікатованою мікрокристалічною целюлозою.
27. Спосіб за п. 26, де стеарилфумарат натрію становить приблизно 1 мас. % від маси вмісту капсули.
28. Спосіб за п. 26 або 27, де масове співвідношення сполуки і силікатованої мікрокристалічної целюлози становить приблизно 1:1,5.
29. Спосіб за п. 26 або 27, де масове співвідношення сполуки і силікатованої мікрокристалічної целюлози становить приблизно 1:9.
30. Спосіб за будь-яким з пп. 26-29, де капсула являє собою тверду желатинову капсулу.
31. Виріб, який містить (а) капсулу, придатну для перорального введення, яка містить суміш (і) N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду або його фармацевтично прийнятної солі, або його гідрату, (іі) мікрокристалічної целюлози, і (ііі) стеарилфумарату натрію, де суміш міститься в капсулі, і (b) листок-вкладиш в упаковці або етикетку, де вказано, що суміш корисна для лікування мієлофіброзу у суб'єкта.
32. Виріб за п. 31, де листок-вкладиш в упаковці або етикетка на упаковці знаходиться в такому місці, яке є видимим для потенційних покупців.
Текст
Реферат: Винахід належить до галузі медицини і стосується капсули для перорального введення для лікування мієлофіброзу у суб'єкта, яка містить суміш N-трет-бутил-3-[(5-метил-2-{[4-(2піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду або його фармацевтично прийнятної солі, або його гідрату, мікрокристалічної целюлози і стеарилфумарату натрію; способу лікування мієлофіброзу у суб'єкта шляхом орального введення такої капсули; способу одержання такого капсульного лікарського продукту; виробу, який містить таку капсулу. UA 114076 C2 (12) UA 114076 C2 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПЕРЕХРЕСНЕ ПОСИЛАННЯ НА СПОРІДНЕНІ ЗАЯВКИ Ця заявка вимагає пріоритет попередньої заявки США № 61/410924, поданої 7 листопада 2010, яка включена в цей документ шляхом посилання в повному її обсязі. ГАЛУЗЬ ТЕХНІКИ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД У цьому документі надані композиції і способи для лікування мієлофіброзу. Композиції і способи, представлені в цьому документі, стосуються лікування мієлофіброзу сполуками, які інгібують JAK2-кінази, або їх фармацевтично прийнятними солями, або їх гідратами. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ Мієлофіброз («MF») являє собою рідкісне захворювання, яке в основному вражає людей старечого віку. MF являє собою BCR-ABL1-негативну мієлопроліферативну неоплазію («MPN»), яка є знову виниклим захворюванням (первинним захворюванням) або може передуватися справжньою поліцитемією («PV») або есенціальною тромбоцитемією («ET»). Клінічні ознаки включають прогресуючу анемію, виражену спленомегалію, конституціональні симптоми (наприклад, стомлюваність, нічні припливи, біль в кістках, свербіж і кашель) і втрату ваги (Tefferi А, N. Engl. J. Med. 342:1255-1265, 2000). Медіана виживання коливається в діапазоні від менше 2 роки до більше 15 років, що основано на виявлених останнім часом прогностичних факторах (Cervantes F. et al., Blood 113:2895-2901, 2009; Hussein K. et al. Blood 115:496-499, 2010; Patnaik MM et al., Eur. J. Haematol 84:105-108, 2010). Мутації, які залучають JAK2-кіназу (James C. et al., Nature 434:1144-1148, 2005; Scott L.M. et al., N. Engl. J. Med. 356:459-468, 2007), ген MPL (монофосфорил ліпід А) (Pikman Y. et al., PLoS. Med. 3:e270, 2006), ген TET2 (Delhommeau F. et al., N. Engl. J. Med. 360:2289-2301, 2009), ген ASXL1 (Carbuccia N. et al., Leukemia 23:2183-2186, 2009), ген IDH1/IDH2 (ізоцитратдегідрогенази) (Green A. et al., N. Engl. J. Med. 362:369-370, 2010; Tefferi A. et al., Leukemia 24:1302-1309, 2010), ген CBL (Grand FH et al., Blood 113:6182-6192, 2009), ген IKZF1 (Jager R. et al., Leukemia 24:1290-1298, 2010), ген LNK (Oh. ST. et al., Blood 116:988-992, 2010), або ген EZH2 (Ernst T. et al., Nat. Genet. 42:722-726) були описані у пацієнтів з MNP, в тому числі у пацієнтів з MF. Деякі мутації виникають з високою частотою при MF (наприклад, мутації JAK2-кіназ у ~50% пацієнтів), і або безпосередньо (наприклад, мутації JAK2кінази або MPL), або непрямо (наприклад, мутації LNK або CBL) індукують гіперактивацію JAKSTAT-кіназ (сигнальний трансдуктор і активатор транскрипції)- кіназа). Доступні в цей час методи лікування є неефективними в реверсуванні течії процесу MF, будь то первинне або повторне/вторинне захворювання. Єдиною можливістю вилікувати захворювання на сьогоднішній день є трансплантація кісткового мозку. Однак більшість пацієнтів не є відповідними кандидатами для трансплантації кісткового мозку в зв'язку з їх старечим середнім віком на момент постановки діагнозу, де клінічні вияви захворювання і смертність, пов'язані з трансплантацією, зростають. Таким чином, можливості керування протіканням мієлофіброзу на даний момент є неадекватними в тому, щоб задовольняти потреби всіх пацієнтів. Основні можливості для активного втручання включають циторедуктивну терапію, наприклад, за допомогою гідроксисечовини, лікування анемії за допомогою андрогенів, еритропоетину і спленектомію. Ці можливості, як було показано, не покращують виживання і переважно розглядаються як паліативні (що тимчасово полегшують або послаблюють вияв захворювання) (Cervantes F., Myelofibrosis: Biology and treatment options, European Journal of Haematology, 2007, 79 (suppl.68) 13-17). Таким чином, існує потреба в забезпеченні додаткових методів терапії для пацієнтів, страждаючих на мієлофіброз. КОРОТКИЙ ВИКЛАД СУТІ ВИНАХОДУ У цьому документі надані капсули, які підходять для перорального введення. У деяких варіантах здійснення, капсули містять суміш, яка включає (i) сполуку, яка являє собою N-третбутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль або його гідрати, (ii) мікрокристалічну целюлозу, і (iii) стеарилфумарат натрію, де суміш міститься в капсулі. У деяких варіантах здійснення, капсула містить приблизно 10 мг - приблизно 680 мг сполуки, де вказана маса дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, капсула містить приблизно 10 мг - приблизно 500 мг сполуки. У деяких варіантах здійснення, капсула містить будь-яку кількість, вибирану з 10 мг, 40 мг, 100 мг, 200 мг, 300 мг, 400 мг, 500 мг, або 600 мг сполуки. У деяких варіантах здійснення, масове співвідношення сполуки до мікрокристалічної целюлози в капсулі знаходиться від приблизно 1:1,5 до 1:15, де маса для сполуки в масовому співвідношенні рівна масі фрагмента сполуки, відповідного вільній основі. У деяких варіантах здійснення, масове співвідношення сполуки до стеарилфумарату натрію в капсулі складає від приблизно 5:1 до приблизно 50:1, і де маса для сполуки в масовому співвідношенні рівна масі фрагмента сполуки, відповідного вільній основі. У деяких варіантах здійснення, мікрокристалічна целюлоза являє собою силікатовану 1 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 мікрокристалічну целюлозу. У деяких варіантах здійснення, силікатована мікрокристалічна целюлоза являє собою комбінацію 98% мікрокристалічної целюлози і 2% колоїдного діоксиду кремнію. Також надані в цьому документі стандартні лікарські форми, які містять суміш, яка включає (i)сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, (ii) мікрокристалічну целюлозу, і (iii) стеарилфумарат натрію. У деяких варіантах здійснення, стандартні лікарські форми призначені для лікування мієлофіброзу, а саме для лікування мієлофіброзу відповідно до способу, описаного в цьому документі. У деяких варіантах здійснення, стандартна лікарська форма містить суміш, яка включає (i) від приблизно 10 мг до приблизно 680 мг (або від приблизно 10 мг до приблизно 500 мг) сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, де вказана маса відповідає масі фрагмента сполуки, який складає вільну основу, (ii) мікрокристалічну целюлозу, і (iii) стеарилфумарат натрію. У деяких варіантах здійснення, стандартна лікарська форма має форму капсули, і суміш міститься в капсулі. У деяких варіантах здійснення, сполука в суміші складає від приблизно 10 мг до приблизно 500 мг, де вказана маса відповідає масі фрагмента сполуки, який складає вільну основу. У деяких варіантах здійснення, добавка містить (i) приблизно 10 мг (або приблизно будь-яку кількість, вибирану з 40 мг, 100 мг, 200 мг, 300 мг, 400 мг, або 500 мг) сполуки, (ii) мікрокристалічну целюлозу, і (iii) стеарилфумарат натрію, де вказана маса дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, сполука являє собою моногідрат дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, масове співвідношення сполуки до мікрокристалічної целюлози в капсулі знаходиться в діапазоні від приблизно 1:1,5 до приблизно 1:15, де маса сполуки в масовому співвідношенні дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, масове співвідношення сполуки до стеарилфумарату натрію в капсулі знаходиться в діапазоні між приблизно 5:1 і приблизно 50:1, і де маса сполуки в масовому співвідношенні дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, мікрокристалічна целюлоза являє собою силікатовану мікрокристалічну целюлозу. У деяких варіантах здійснення, силікатована мікрокристалічна целюлоза являє собою комбінацію 98% мікрокристалічної целюлози і 2% колоїдного діоксиду кремнію. У деяких варіантах здійснення, стеарилфумарат натрію становить приблизно 1% (мас./мас.) від маси вмісту капсули. У деяких варіантах здійснення, масове співвідношення сполуки до мікрокристалічної целюлози, наприклад, до силікатованої мікрокристалічної целюлози, складає від приблизно 40:60 до приблизно 10:90 (наприклад, приблизно 40:60 або приблизно 1:1,5, або приблизно 10:90, або приблизно 1:9). У деяких варіантах здійснення, сполука являє собою моногідрат дигідрохлориду N-третбутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, стандартна лікарська форма або капсула містить суміш, яка включає приблизно 12 мг моногідрату дигідрохлориду N-трет-бутил3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду, приблизно 122 мг силікатованої мікрокристалічної целюлози, і приблизно 1 мг стеарилфумарату натрію. У деяких варіантах здійснення, стандартна лікарська форма або капсула містить суміш, яка включає приблизно 47 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду, приблизно 448 мг силікатованої мікрокристалічної целюлози, і приблизно 5 мг стеарилфумарату натрію. У деяких варіантах здійснення, стандартна лікарська форма або капсула містить суміш, яка включає приблизно 117 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, стандартна лікарська форма або капсула містить суміш, яка включає приблизно 235 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду, приблизно 357 мг силікатованої мікрокристалічної целюлози, і приблизно 6,00 мг стеарилфумарату натрію. У деяких варіантах здійснення, капсула являє собою тверду желатинову капсулу. Також надані в цьому документі способи отримання капсульного лікарського продукту, які включають в себе а) змішування мастильної речовини із сполукою, яка являє собою N-третбутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4 2 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, для отримання гранул і b) змішування гранул, отриманих на стадії а), з ексципієнтом. У деяких варіантах здійснення, мастильна речовина являє собою стеарилфумарат натрію. У деяких варіантах здійснення, ексципієнт являє собою мікрокристалічну целюлозу, наприклад, силікатовану мікрокристалічну целюлозу. У деяких варіантах здійснення, стеарилфумарат натрію становить приблизно 1% (мас./мас.) від маси вмісту капсули. У деяких варіантах здійснення, масове співвідношення сполуки до силікатованої мікрокристалічної целюлози складає від приблизно 1:1,5 до приблизно 1:9. У деяких варіантах здійснення, масове співвідношення сполуки до силікатованої мікрокристалічної целюлози становить приблизно 1:1,5. В деяких варіантах здійснення, масове співвідношення сполуки до силікатованої мікрокристалічної целюлози становить приблизно 1:9. У деяких варіантах здійснення, капсула являє собою тверду желатинову капсулу. Також надані в цьому документі способи лікування мієлофіброзу у суб'єкта, які включають в себе пероральне введення сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль або його гідрати, і де сполука міститься в суміші, яка включає в себе (i) сполуку, (ii) ексципієнт (наприклад, мікрокристалічну целюлозу), і (iii) мастильну речовина (наприклад, стеарилфумарат натрію). Можуть бути використані будь-які із стандартних лікарських форм або капсул, описаних в цьому документі. У деяких варіантах здійснення, надають спосіб лікування мієлофіброзу у суб'єкта, який включає в себе пероральне введення сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, і де сполука знаходиться в капсулі, яка містить суміш, що включає в себе (i) сполуку, (ii) мікрокристалічну целюлозу (наприклад, силікатовану мікрокристалічну целюлозу), і (iii) стеарилфумарат натрію. Також надані в цьому документі способи лікування мієлофіброзу у суб'єкта, які включають в себе введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, де суб'єкт дає негативний результат відносно мутації із заміною валіну на фенілаланін в позиції 617 в гені Янус-Кінази 2 (JAK2) людини або дає негативний результат відносно мутації, що відповідає мутації із заміною валіну на фенілаланін в позиції 617 гена JAK2-кінази людини. Також надані в цьому документі способи лікування мієлофіброзу у суб'єкта, які включають в себе введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, де суб'єкт раніше отримав інше лікування мієлофіброзу. У деяких варіантах здійснення, попереднє лікування являє собою метод лікування за допомогою інгібітору JAK2-кінази, який являє собою не N-трет-бутил-3-[(5-метил-2{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати. У деяких варіантах здійснення, попереднє лікування включає в себе введення INCB018424 (руксолітиніб). У деяких варіантах здійснення, суб'єкт не сприйнятливий до попереднього лікування. У деяких варіантах здійснення, попереднє лікування являє собою метод лікування за допомогою N-трет-бутил-3-[(5-метил-2-{[4-(2піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду або його фармацевтично прийнятної солі, або гідрату солі. У деяких варіантах здійснення, попереднє лікування було перерване при показанні, яке включає підвищені рівні амілази, ліпази, аспартатамінотрансферази («AST»), аланін-амінотрансферази («ALT»), і/або креатиніну. У деяких варіантах здійснення, попереднє лікування було перерване при показанні гематологічного стану, вибраного з групи, яка складається з анемії, тромбоцитопенії і нейтропенії. Також надані в цьому документі способи зменшення інтенсивності симптомів стану насиченості клітинами тканини кісткового мозку або фіброзу кісткового мозку, супутнього мієлофіброзу, у суб'єкта, які включають в себе введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати. Також надані в цьому документі способи зменшення свербежу, супутнього мієлофіброзу, у суб'єкта, які включають в себе введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати. Також надані в цьому документі способи контролю за проведенням лікування мієлофіброзу у суб'єкта, які включають в себе (а) введення суб'єкту ефективної кількості сполуки, яка являє 3 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати; (b) контроль негематологічного параметра, вибраного з групи, яка складається з рівня амілази, рівня ліпази, рівня аспартат-амінотрансферази (AST) і рівня креатиніну у суб'єкта; і (с) визначення того, чи потрібно суб'єкту продовжувати лікування або чи потрібно перервати його. Також надані в цьому документі способи контролю за проведенням лікування мієлофіброзу у суб'єкта, які включають в себе введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати; і переривання лікування при показанні підвищених рівнів одного або більше ферментів або молекул, вибраних із групи, яка складається з амілази, ліпази, аспартат-амінотрансферази (AST), аланін-амінотрансферази (ALT) і креатиніну в сироватці суб'єкта, без попереднього зниження дози. У деяких варіантах здійснення, один або більше підвищених рівнів складають ускладнення 4 ступеня. Також надані в цьому документі способи контролю за проведенням лікування мієлофіброзу у суб'єкта, які включають в себе (а) введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати; (b) контроль гематологічного параметра, вибраного з групи, яка складається з анемії, тромбоцитопенії і нейтропенії, в сироватці суб'єкта; і (с) визначення того факту, чи потрібно суб'єкту продовжувати лікування або чи потрібно перервати його. Також надані в цьому документі способи контролю за проведенням лікування мієлофіброзу у суб'єкта, які включають в себе введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати; і переривання лікування при показанні одного або більше гематологічних станів, вибраних з групи, яка складається з анемії, тромбоцитопенії і нейтропенії, без попереднього зниження дози. У деяких варіантах здійснення, один або більше гематологічних станів складають ускладнення 4 ступеня. У деяких варіантах здійснення способів контролю за проведенням лікування, які надаються в цьому документі, способи додатково включають в себе введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, після переривання суб'єкту лікування щонайменше на 2 тижні. У деяких варіантах здійснення, суб'єкту було перервано лікування щонайменше на 3 тижні. У деяких варіантах здійснення, суб'єкту було перервано лікування щонайменше на 4 тижні. У деяких варіантах здійснення, лікування було перерване без попереднього зниження дози. У деяких варіантах здійснення, сполуку вводять суб'єкту-людині в дозі від приблизно 240 мг на день до приблизно 680 мг на день, і де вказана маса відповідає масі фрагмента сполуки, який складає вільну основу. У деяких варіантах здійснення, сполуку вводять в дозі від приблизно 300 мг на день до приблизно 500 мг на день (наприклад, від приблизно 300 мг на день до приблизно 400 мг на день, або від приблизно 400 мг на день до приблизно 500 мг на день), і де вказана маса відповідає масі фрагмента сполуки, який складає вільну основу. У деяких варіантах здійснення, сполуку вводять в дозі, рівній приблизно будь-якій дозі з приблизно 240 мг на день, 250 мг на день, 300 мг на день, 350 мг на день, 400 мг на день, 450 мг на день, 500 мг на день, 550 мг на день, 600 мг на день, 650 мг на день, або 680 мг на день, і де вказана маса відповідає масі фрагмента сполуки, який складає вільну основу. У деяких варіантах здійснення, сполуку вводять щодня і/або перорально. У деяких варіантах здійснення, сполуку вводять протягом періоду щонайменше 1 циклу, щонайменше 2 циклів, щонайменше 3 циклів, щонайменше 4 циклів, щонайменше 5 циклів, або щонайменше 6 циклів (наприклад, щонайменше 7 циклів, щонайменше 8 циклів, щонайменше 9 циклів, щонайменше 10 циклів, щонайменше 11 циклів, щонайменше 12 циклів, щонайменше 15 циклів, щонайменше 18 циклів, щонайменше 24 циклів), де 1 цикл являє собою 28-денний цикл лікування. У деяких варіантах здійснення, сполука знаходиться в капсулі і вводиться перорально. У деяких варіантах здійснення, сполука знаходиться в стандартній лікарській формі. Можуть бути введені будь-які капсули або стандартні лікарські форми, описані в цьому документі. У деяких варіантах здійснення способів, які надаються в цьому документі, сполука знаходиться в суміші, яка включає (i) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, (ii) мікрокристалічну целюлозу, і (iii) стеарилфумарат натрію. У деяких варіантах здійснення, масове співвідношення сполуки до мікрокристалічної целюлози в 4 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 суміші знаходиться в діапазоні від приблизно 1:1,5 до 1:15, і де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, масове співвідношення сполуки до стеарилфумарату натрію в суміші має значення в діапазоні від приблизно 5:1 до приблизно 50:1, і де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, сполука являє собою моногідрат дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, мікрокристалічна целюлоза являє собою силікатовану мікрокристалічну целюлозу. У деяких варіантах здійснення, суб'єктом є людина. У деяких варіантах здійснення композицій і способів, які надаються в цьому документі, суб'єкт має первинний мієлофіброз. У деяких варіантах здійснення композицій і способів, які надаються в цьому документі, суб'єкт має мієлофіброз, розвинений на фоні попередньої справжньої поліцитемії. У деяких варіантах здійснення композицій і способів, які надаються в цьому документі, суб'єкт має мієлофіброз, розвинений на фоні попередньої есеціальної тромбоцитемії. У деяких варіантах здійснення, суб'єкт має високий ризик виникнення мієлофіброзу. У деяких варіантах здійснення, суб'єкт має середній ризик виникнення мієлофіброзу (наприклад, як проміжний 2 рівень ризику виникнення захворювання). У деяких варіантах здійснення композицій і способів, які надаються в цьому документі, суб'єкт дає позитивний результат відносно мутації із заміною валіну на фенілаланін в позиції 617 в Янускіназі 2 (JAK2) людини або дає позитивний результат відносно мутації, відповідній мутації із заміною валіну на фенілаланін в позиції 617 JAK2-кінази людини. У деяких варіантах здійснення композицій і способів, які надаються в цьому документі, суб'єкт дає негативний результат відносно мутації із заміною валіну на фенілаланін в позиції 617 в Янус-кіназі 2 (JAK2) людини або дає негативний результат відносно мутації, що відповідає мутації із заміною валіну на фенілаланін в позиції 617 JAK2-кінази людини. У деяких варіантах здійснення композицій і способів, які надаються в цьому документі, суб'єкт має пальповану спленомегалію. У деяких варіантах здійснення, суб'єкт з мієлофіброзом має селезінку, розташовану щонайменше на 5 см нижче ребрових країв, що визначено пальпацією. У деяких варіантах здійснення композицій і способів, які надаються в цьому документі, суб'єкт є трансфузійно-залежним (залежним від підтримуючої трансфузійної терапії). У деяких варіантах здійснення композицій і способів, які надаються в цьому документі, суб'єкт не є трансфузійно-залежним. У деяких варіантах здійснення способів, які надаються в цьому документі, при введенні сполуки суб'єкту-людині, Сmax сполуки досягається в межах від приблизно 2 до приблизно 4 годин після введення дози. У деяких варіантах здійснення, після введення сполуки суб'єктулюдині, період напіввиведення сполуки складає від приблизно 16 до приблизно 34 годин. У деяких варіантах здійснення, середнє значення AUC (площини під кривою), отриманої для сполуки, збільшується більше ніж пропорційно з підвищенням доз, які знаходяться в діапазоні від приблизно 30 мг до приблизно 800 мг на день. У деяких варіантах здійснення, накопичення сполуки знаходиться в діапазоні від приблизно 1,25-кратного до приблизно 4,0-кратного в стаціонарному стані, коли дозу сполуки вводять один раз на день. У деяких варіантах здійснення, сполука знаходиться в суміші, яка включає в себе (i) сполуку, яка являє собою Nтрет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, (ii) мікрокристалічну целюлозу, і (iii) стеарилфумарат натрію. У деяких варіантах здійснення, масове співвідношення сполуки до мікрокристалічної целюлози в суміші знаходиться в діапазоні між приблизно 1:1,5 і 1:15, і де маса сполуки відповідає масі фрагмента сполуки, який складає вільну основу. У деяких варіантах здійснення, масове співвідношення сполуки до стеарилфумарату натрію в суміші має значення в діапазоні від приблизно 5:1 до приблизно 50:1, і де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, сполука являє собою моногідрат дигідрохлориду N-третбутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, мікрокристалічна целюлоза являє собою силікатовану мікрокристалічну целюлозу. Також надані в цьому документі вироби виробництва або набори, які містять (а) будь-який виріб з капсул, які забезпечуються в даній заявці, і (b) листок-вкладиш в упаковці або етикетку, де вказано, що капсула корисна для лікування мієлофіброзу у суб'єкта. Також надані в цьому документі вироби виробництва або набори, які містять (а) будь-який виріб з стандартних лікарських форм, що забезпечуються в цій заявці, і (b) листок-вкладиш в упаковці або етикетку, вказуючий(у), що капсула корисна в лікуванні мієлофіброзу у суб'єкта. У деяких варіантах здійснення, надається виріб виробництва або набір, який містить (а) суміш, яка включає в себе 5 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 (i) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, (ii) мікрокристалічну целюлозу, і (iii) стеарилфумарат натрію, і (b) листок-вкладиш в упаковці або етикетку, вказуючий(у), що добавка корисна в лікуванні мієлофіброзу у суб'єкта. Також надані в цьому документі вироби виробництва або набори, які містять (а) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, і (b) листок-вкладиш в упаковці або етикетку, вказуючий(у), що сполука може бути застосована для лікування мієлофіброзу у суб'єкта, де суб'єкт дає негативний результат відносно мутації із заміною валіну на фенілаланін в позиції 617 Янус-кінази 2 (JAK2) людини або дає негативний результат відносно мутації, що відповідає мутації із заміною валіну на фенілаланін в позиції 617 JAK2-кінази людини. Також надані в цьому документі вироби виробництва або набори, які містять (а) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, і (b) листок-вкладиш в упаковці або етикетку, вказуючий(у), що сполука може бути застосована для лікування мієлофіброзу у суб'єкта, де суб'єкт раніше отримав інше лікування мієлофіброзу. У деяких варіантах здійснення, попереднє лікування являє собою метод лікування із застосуванням інгібітору JAK2-кінази, який не являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати. Також надані в цьому документі вироби виробництва або набори, які містять (а) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, і (b) листок-вкладиш в упаковці або етикетку, вказуючий(у), що сполука може бути застосована для зменшення інтенсивності симптомів стану насиченості клітинами тканини кісткового мозку і/або фіброзу кісткового мозку. Також надані в цьому документі вироби виробництва або набори, які містять (а) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, і (b) листок-вкладиш в упаковці або етикетку, вказуючий(у), що сполука може бути застосована для зменшення свербежу, супутнього мієлофіброзу. Також надані в цьому документі вироби виробництва або набори, які містять сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, і листок вкладиш-інструкцію в упаковці або етикетку, вказуючу на упаковці, що сполука може бути застосована для лікування мієлофіброзу у суб'єкта, і що суб'єкт повинен перервати лікування при показанні підвищених рівнів одного або більше ферментів або молекул, вибраних з групи, яка складається з: амілази, ліпази, аспартат-амінотрансферази (AST), аланінамінотрансферази (ALT) і креатиніну, в сироватці суб'єкта, і/або при показанні одного або більше гематологічних станів, вибраних з групи, яка складається з анемії, тромбоцитопенії і нейтропенії. У деяких варіантах здійснення, листок-вкладиш в упаковці або етикетка на упаковці додатково вказує, що введення сполуки припинене без попереднього зниження дози. У деяких варіантах здійснення, один або декілька показників підвищених рівнів ферментів або молекул являють собою ускладнення 4 ступеня. У деяких варіантах здійснення, один або декілька гематологічних станів являють собою ускладнення 4 ступеня. У деяких варіантах здійснення, листок-вкладиш в упаковці або етикетка на упаковці розміщений(а) так, щоб його/її могли побачити передбачувані покупці. У деяких варіантах здійснення, сполука знаходиться в стандартній лікарській формі або капсульній формі. У деяких варіантах здійснення, листок-вкладиш або етикетка показує, що при введенні суб'єкту-людині Сmax сполуки досягається в межах від приблизно 2 до приблизно 4 годин після введення дози. У деяких варіантах здійснення, листок-вкладиш в упаковці або етикетка на упаковці показує, що при введенні сполуки суб'єкту-людині, період напіввиведення сполуки складає від приблизно 16 до приблизно 34 годин. У деяких варіантах здійснення, листоквкладиш показує, що AUC (середня площина під кривою), отриманою для сполуки, збільшується більше ніж пропорційно із збільшенням доз, які знаходяться в діапазоні від приблизно 30 мг до приблизно 800 мг на день. У деяких варіантах здійснення, листок-вкладиш в упаковці або етикетка на упаковці вказує, що накопичення сполуки знаходиться в діапазоні від приблизно 1,25-кратного до приблизно 4,0-кратного в стаціонарному стані, коли дозу сполуки 6 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 вводять один раз на день. У деяких варіантах здійснення, сполука знаходиться в суміші, яка включає в себе (i) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, (ii) мікрокристалічну целюлозу, і (iii) стеарилфумарат натрію. У деяких варіантах здійснення, масове співвідношення сполуки до мікрокристалічної целюлози в суміші складає від приблизно 1:1,5 до 1:15, і де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, масове співвідношення сполуки до стеарилфумарату натрію в суміші має значення в діапазоні від приблизно 5:1 до приблизно 50:1, і де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, сполука являє собою моногідрат дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, мікрокристалічна целюлоза являє собою силікатовану мікрокристалічну целюлозу. У деяких варіантах здійснення, надається застосування сполуки у виготовленні лікарського препарату для лікування мієлофіброзу у суб'єкта, де сполука являє собою N-трет-бутил-3-[(5метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати. У деяких варіантах здійснення, сполука знаходиться в суміші, яка включає в себе (i) сполуку, (ii) ексципієнт (наприклад, мікрокристалічну целюлозу, таку як силікатована мікрокристалічна целюлоза), і (iii) мастильну речовину (наприклад, стеарилфумарат натрію). У деяких варіантах здійснення, сполуку вводять перорально. У деяких варіантах здійснення, застосування здійснюють відповідно до способу, описаного в цьому документі. У деяких варіантах здійснення, надається застосування сполуки у виготовленні лікарського препарату для лікування мієлофіброзу у суб'єкта, де сполука являє собою N-трет-бутил-3-[(5метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, де суб'єкт дає негативний результат відносно мутації із заміною валіну на фенілаланін в позиції 617 в Янус-кіназі 2 (JAK2) людини або дає негативний результат відносно мутації, що відповідає мутації із заміною валіну на фенілаланін в позиції 617 в JAK2-кінази людини. У деяких варіантах здійснення, надається застосування сполуки у виготовленні лікарського препарату для лікування мієлофіброзу у суб'єкта, де сполука являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, де суб'єкт раніше отримав інше лікування мієлофіброзу. У деяких варіантах здійснення, попереднє лікування включає в себе введення інгібітору JAK2кінази, який не являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль або його гідрати. У деяких варіантах здійснення, застосування здійснюють відповідно до способу, описаного в цьому документі. У деяких варіантах здійснення, надають сполуку для лікування мієлофіброзу у суб'єкта, де сполука являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати. У деяких варіантах здійснення, сполука знаходиться в суміші, яка включає в себе (i) сполуку, (ii) ексципієнт (наприклад, мікрокристалічну целюлозу, таку як силікатована мікрокристалічна целюлоза), і (iii) мастильну речовину (наприклад, стеарилфумарат натрію). У деяких варіантах здійснення, сполуку вводять перорально. У деяких варіантах здійснення, застосування здійснюють відповідно до способу, описаного в цьому документі. У деяких варіантах здійснення, надають сполуку для лікування мієлофіброзу у суб'єкта, де сполука являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, де суб'єкт дає негативний результат відносно мутації із заміною валіну на фенілаланін в позиції 617 в Янус-кіназі 2 (JAK2) людини або дає негативний результат відносно мутації, що відповідає мутації із заміною валіну на фенілаланін в позиції 617 в JAK2-кінази людини. У деяких варіантах здійснення, надається сполука для лікування мієлофіброзу у суб'єкта, де сполука являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, де суб'єкт раніше отримав інше лікування мієлофіброзу. У деяких варіантах здійснення, попереднє лікування включає в себе введення інгібітору JAK2кінази, який не являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично 7 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 прийнятну сіль, або його гідрати. У деяких варіантах здійснення, лікування здійснюють відповідно до способу, описаного в цьому документі. Потрібно розуміти, що одна, декілька, або всі властивості різних варіантів здійснення, описаних в цьому документі, можуть бути об'єднані з отриманням інших варіантів здійснення композицій і способів, які надаються в цій заявці. Ці і інші аспекти композицій і способів, які надаються в цьому документі, стануть зрозумілі фахівцеві в даній галузі. КОРОТКИЙ ОПИС ФІГУР Фігура 1 показує зниження пальпованого розміру селезінки за цикл лікування для пацієнтів, яких лікують за допомогою TG101348 дозою 680 мг/день (вихідна доза) (N=37). Дози для циклу 1 були 520 800 мг/день, і дози для циклів 2-6 були 360-680 мг/день. Для ≥50% суб'єктів циклу 6, було 22-47%-не збільшення у 3 суб'єктів, які приймали лікарський засіб протягом ~2-3 тижнів безпосередньо перед вимірюванням. Фігура 2 показує рівень лейкоцитів в крові (WBC = білі кров'яні тільця) у суб'єктів, які отримували лікування за допомогою TG101348. Вихідний рівень лейкоцитів в крові становив 9 >1110 /л. Дози в фазі контрольного спостереження пацієнта знаходилися в діапазоні від 360 до 680 мг/день. Останній візит контрольного спостереження потрапляв у діапазон від 8 до 24 тижнів (медіанне значення 24 тижні). «ULN» означає верхню межу норми. Фігура 3 показує рівень тромбоцитів у суб'єктів, які отримували лікування за допомогою 9 TG101348. Вихідний рівень тромбоцитів у крові становив >45010 /л. Дози в фазі контрольного спостереження пацієнта знаходилися в діапазоні від 360 до 680 мг/день. Останній візит контрольного спостереження потрапляв у діапазон від 12 до 24 тижнів (медіанне значення 24 тижні). «ULN» означає верхню межу норми. Фігура 4 показує виражену в процентах кількість суб'єктів з погіршеними, незміненими, покращеними або усуненими конституціональними симптомами (стомлюваність, почуття швидкого насичення, кашель, нічні припливи і свербіж) у суб'єктів, які отримували лікування за допомогою TG101348. Останній візит потрапляв в діапазон від 4 до 24 тижнів (медіанне значення 20 тижнів). Дані тут відображали зміни відносно симптомів, присутніх на вихідному рівні. 18 суб'єктів повідомили про вперше виявлений симптом (≥1) під час дослідження; з них симптоми у 12 суб'єктів були усунені до моменту останнього візиту контрольного спостереження. Тяжкість оцінювалася суб'єктами за шкалою 1-10:0 = відсутність симптому; 1-3 = слабко виражений симптом; 4-7 = помірно виражений симптом; 8-10 = сильно виражений симптом. Покращення прирівнюється зниженню ступеня вираженості симптому до відсутності такого або до слабкого або помірного ступеня вираженості відносно оцінки ступеня вираженості на вихідному рівні. Фігура 5 показує рівні цитокінів (IL-6, IL-8, IL-2 (інтерлейкіни) і TNF-α (чинник некрозу пухлини альфа)) у суб'єктів, які отримували лікування за допомогою TG101348. Фігура 6 показує зміну алельного навантаження при мутації із заміною валіну на фенілаланін в позиції 617 (V617F) відносно вихідного рівня у вигляді частинки вихідного рівня алельного навантаження у суб'єктів з вихідним рівнем >20% (N=22), яких лікували із застосуванням TG101348. Фігура показує підгрупу суб'єктів з позитивним результатом відносно мутації JAK2V617F в загальній групі пацієнтів (N=48). Дози в фазі контрольного спостереження пацієнта становили 360-680 мг/день. Останній візит контрольного спостереження потрапляв в діапазон від 20 до 72 тижнів (медіанне значення 24 тижні). Фігура 7 показує насиченість клітинами тканини кісткового мозку на вихідному рівні (насиченість 60%) і після 18 циклів лікування із застосуванням TG101348 (насиченість 5-10%) у 76-річного суб'єкта чоловічої статі, який має первинний мієлофіброз (PMF) з негативним результатом відносно мутації із заміною V617F. вихідна доза була 30 мг/день, і доза в фазі контрольного спостереження пацієнта становила 520 мг/день. Фігура 8 показує фіброз тканини кісткового мозку на вихідному рівні (3+) і після 18 циклів лікування із застосуванням TG101348 (0) у 56-річного суб'єкта чоловічої статі, який має первинний мієлофіброз (PMF) з негативним результатом відносно мутації із заміною V617F. Вихідна доза була 240 мг/день, і доза в фазі контрольного спостереження пацієнта становила 440 мг/день. Фігура 9 показує різні показники для суб'єкта, який має первинний мієлофіброз (PMF) з позитивним результатом відносно мутації із заміною V617F JAK2-кінази, якого лікують із застосуванням TG101348 (вихідна доза на рівні 680 мг/день). Фігури 10А-10G показують розподіл доз TG101348 в кінці кожного циклу лікування для суб'єктів, у яких первинна доза становила 30 мг/день, 60 мг/день, 120 мг/день, 240 мг/день, 360 мг/день, 520 мг/день, і 800 мг/день, відповідно (n=25). Фігура 11 показує розподіл доз TG101348 в кінці кожного циклу лікування суб'єктів, у яких 8 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 первинна доза становила 680 мг/день (n=34). Фігура 12А показує графік середніх значень концентрацій TG101348 в плазмі крові залежно від часу в напівлогарифмічному масштабі (Цикл 1, День 1). Фігура 12В показує графік середніх значень концентрацій TG101348 в плазмі крові залежно від часу в напівлогарифмічному масштабі (Цикл 1, День 28). Фігура 13 показує реакцію, яка стосується спленомегалії, на лікування із застосуванням TG101348. Ця фігура показує зниження пальпованого розміру селезінки відносно вихідного рівня після циклу лікування для суб'єктів в когорті з максимальною переносимою дозою (n=37). Показана частка суб'єктів з ≥50%-ним і 100%-ним зниженням пальпованої спленомегалії. Що стосується суб'єктів, які завершили 6 циклів лікування, 90% суб'єктів мали ≥25%-не зниження пальпованого розміру селезінки, 66% суб'єктів мали ≥50%-не зниження пальпованого розміру селезінки, і у 31% суб'єктів селезінка стала непальпованою. Фігури 14А-14С показують дію TG101348 відносно симптомів мієлофіброзу. (А): Частка суб'єктів в когорті, де отримували максимальну переносиму дозу, з повною регресією почуття швидкого насичення за цикл лікування відносно вихідної оцінки за шкалою симптомів: «слабко виражений симптом» (оцінка = 1-3), «помірно виражений симптом» (оцінка = 4-7), або «сильно виражений симптом» (оцінка = 8-10). Двадцять сім (79%) і 19 (56%) пацієнтів підлягали оцінці відносно зменшення почуття швидкого насичення в кінці 1 і 6 циклів лікування, відповідно. Після 2 циклів лікування, 56% повідомили про повну регресію цього симптому з довготривалою користю. (В): Частка суб'єктів в когорті, де отримували максимальну переносиму дозу, з повною регресією стомлюваності за цикл лікування відносно вихідної оцінки за шкалою симптомів: «слабко виражений симптом» (оцінка = 1-3), або із зменшенням або з повною регресією стомлюваності відносно вихідної оцінки за шкалою симптомів: «помірно виражений симптом» (оцінка = 4-7), або «сильно виражений симптом» (оцінка = 8-10). Двадцять чотири (71%) і 16 (47%) пацієнтів підлягали оцінці відносно зменшення стомлюваності в кінці 1 і 6 циклів лікування, відповідно. Після 6 циклів лікування, 63% пацієнтів повідомляли про зменшення і 25% мали повну регресію цього симптому. (С): Частка суб'єктів в когорті, де отримували максимальну переносиму дозу, з повною регресією нічних припливів за цикл лікування відносно вихідної оцінки за шкалою симптомів: «слабко виражений симптом» (оцінка = 1-3), «помірно виражений симптом» (оцінка = 4-7), або «сильно виражений симптом» (оцінка = 8-10). Чотирнадцять (40%) і 9 (26%) пацієнтів підлягали оцінці відносно зменшення нічних припливів в кінці 1 і 6 циклів лікування, відповідно. Після 1 циклу лікування, 64% суб'єктів мали повну регресію цього симптому; після 6 циклів, ця частка збільшилася до 89%. Фігура 15 показує реакцію, яка стосується лейкоцитозу, на лікування із застосуванням TG101348. Зміни рівня лейкоцитів в крові (WBC = білі кров'яні тільця) після 6 циклів у суб'єктів, 9 які потрапили на дослідження з лейкоцитозом (рівень WBC > 1110 /л. Після 6 циклів лікування, 16 суб'єктів, які отримували дози у всьому діапазоні доз (57%), і 13 суб'єктів в когорті, де отримували максимальну переносиму дозу (MTD), (72%) досягали нормального рівня WBC, з довготривалою користю. Фігури 16А-16D показують ефект лікування із застосуванням TG101348 у відношенні алельного навантаження мутації із заміною валіну на фенілаланін в позиції 617 (V617F) JAK2кінази. Представлення даних по алельному навантаженню мутації із заміною V617F JAK2-кінази у вигляді коробчастої діаграми для всіх суб'єктів з позитивною реакцією на мутацію (n=51; фігури А і В) і для підгрупи з вихідним алельним навантаженням >20% (n=23; фігури 16С і 16D). у-Вісь відображає алельне навантаження мутації із заміною V617F JAK2-кінази від 1,0 (100%) до 0,0 (0%). Зміна алельного навантаження мутації із заміною V617F JAK2-кінази за цикл лікування (аж до кінця 12 циклу; тобто, С13D1) в порівнянні з отриманим в ході попереднього дослідження вихідним рівнем показана для 2 груп (фігури 16А і 16С); зміни в кінці 6 циклу (тобто, С7D1) і 12 циклу показані на фігурах 16В і 16D. Значне зниження алельного навантаження мутації із заміною V617F JAK2-кінази в порівнянні з отриманим в ході попереднього дослідження вихідним рівнем спостерігали в кінці 6 циклу для групи, яка показує позитивний результат відносно мутації (фігура 16В; р=0,04), і для підгрупи з вихідним алельним навантаженням >20% (фігура 16D; р=0,002); схоже значне зниження спостерігали в кінці 12 циклу для попередньої (фігура 16В; р=0,01) і наступної (фігура 16D; р=0,002) груп. Для виконання порівняння медіанного алельного навантаження мутації із заміною V617А JAK2кінази використовують ранговий критерій узгоджених пар Вілкоксона. Фігура 17 показує абсолютні зміни рівнів прозапальних цитокінів відносно вихідного рівня на стадії циклу 6: IL-6 (Інтерлейкін-6) (А), TNF-α (фактор некрозу пухлини альфа) (В), IL-8 (Інтерлейкін-8) (С), і IL-2 (Інтерлейкін-2) (D). Абсолютні різниці IL-6 (- 4719 пг/мл) і IL-2 (-1827 пг/мл) опущені на фігурах 17А і 17D, відповідно, для 1 суб'єкта (101-039), оскільки вони 9 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 спотворюють представлення даних для інших суб'єктів. Фігура 18 показує залежність середніх концентрацій TG101348 в плазмі крові від часу на лінійній діаграмі після перорального введення доз один раз на день (Цикл 1; День 28). ДОКЛАДНИЙ ОПИС I. Визначення «Лікування» або «проведення лікування» означає підхід для отримання благотворних або бажаних результатів, в тому числі клінічних результатів. Благотворні або бажані клінічні результати можуть включати один або більше результатів, вибраних з наступного: зниження симптомів, які виникли внаслідок захворювання, підвищення якості життя суб'єктів, страждаючих від захворювання, зниження дози інших лікарських препаратів, необхідних для лікування захворювання, сповільнення прогресування захворювання, і/або продовження виживання індивідуумів, але не обмежуються цим. У деяких варіантах здійснення, для лікування мієлофіброзу, благотворні клінічні результати включають один або більше результатів, вибраних із зниження спленомегалії, зменшення конституціональних симптомів (таких як почуття швидкого насичення, стомлюваність, нічні припливи, кашель і свербіж), зниження лейкоцитозу, зниження тромбоцитозу, зниження алельного навантаження мутації із заміною V617F JAK2-кінази, зниження фіброзу тканини кісткового мозку, і/або зниження насиченості клітинами тканини кісткового мозку. «Сповільнення розвитку захворювання» означає відстрочення, затримання, сповільнення, гальмування, стабілізування, і/або віддалення розвитку захворювання (такого як мієлофіброз) або симптомів захворювання, і можуть включати «виживання без прогресування захворювання». Таке сповільнення може мати різну тривалість у часі, залежно від історії захворювання і/або від індивідуума, який підлягає вилікуванню. Фахівцеві в даній галузі буде зрозуміло, що достатнє або значне сповільнення може, по суті, охоплювати попередження (профілактику), в тому значенні, що індивідуум не розвиває захворювання. «Ефективне дозування» або «ефективна кількість» лікарського засобу, сполуки, або фармацевтичної композиції складає кількість, достатню для отримання благотворних або бажаних результатів. Для профілактичного застосування, благотворні або бажані результати можуть включати, наприклад, один або більше результатів, таких як усунення або зниження ризику, пониження тяжкості, або відстрочення виникнення захворювання, включаючи біохімічні, гістологічні і/або поведінкові симптоми захворювання, його ускладнення і проміжні патологічні фенотипи, які виявляються під час розвитку захворювання. Для терапевтичного застосування, благотворні або бажані результати можуть включати, наприклад, один або більше клінічних результатів, таких як зниження одного або більше симптомів і патологічних станів, зумовлених або пов'язаних із захворюванням, підвищення якості життя індивідуумів, страждаючих на захворювання, зниження дози інших лікарських препаратів, необхідних для лікування захворювання, посилення дії іншого лікарського препарату, наприклад, за допомогою таргетингу (направленої доставки лікарського засобу до органу-мішені), відстрочення прогресування захворювання, і/або продовження виживання. У випадку мієлофіброзу, ефективна кількість лікарського засобу може мати ефект зниження одного або більше симптомів спленомегалії, послаблення конституціональних симптомів (таких як почуття швидкого насичення, стомлюваність, нічні припливи, кашель і свербіж), зниження лейкоцитозу, зниження тромбоцитозу, зниження алельного навантаження мутації із заміною V617F JAK2-кінази, зниження фіброзу тканини кісткового мозку, і/або зниження насиченості клітинами тканини кісткового мозку. Ефективне дозування може бути введене одним або декількома введеннями. Ефективне дозування лікарського засобу, сполуки або фармацевтичної композиції може являти собою, наприклад, кількість, достатню для виконання профілактичного або терапевтичного лікування, або прямого, або опосередкованого. Як зрозуміло з клінічного контексту, ефективне дозування лікарського засобу, сполуки або фармацевтичної композиції може бути досягнуте або може бути не досягнуте в поєднанні з іншим(ою) лікарським засобом, сполукою або фармацевтичною композицією. Таким чином, «ефективне дозування» може бути розглянуте в контексті введення одного або більше терапевтичних засобів, і може бути передбачено, що окремо взятий засіб повинен бути введений в ефективній кількості, якщо в поєднанні з одним або декількома іншими засобами, може бути досягнутим або досягається бажаний результат. «Зменшення інтенсивності симптомів» насиченості клітинами тканини кісткового мозку або фіброзу тканини кісткового мозку стосується зниження рівня насиченості клітинами тканини кісткового мозку або фіброзу тканини кісткового мозку у суб'єкта в порівнянні з рівнем насиченості клітинами тканини кісткового мозку або фіброзу тканини кісткового мозку до початку лікування сполукою, яка надається в цій заявці. Зниження насиченості клітинами тканини кісткового мозку або фіброзу тканини кісткового мозку може становити щонайменше 5, 10, 20, 10 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 30, 40, 50, 60, 70, 80 або 90%. «У поєднанні з» стосується введення одного методу лікування в доповнення до іншого методу лікування. Саме по собі, вираження «в поєднанні з» може відноситися до введення одного методу лікування до, під час або після введення іншого методу лікування індивідууму. Як використовується в цьому документі, «пацієнт» або «суб'єкт» належить до ссавця, який включає в себе людину, собаку, коня, корову або кішку і так далі. Термін «фармацевтично прийнятний» стосується того факту, що носій, розріджувач або ексципієнт повинен бути сумісний з іншими інгредієнтами складу і може бути введений суб'єкту. «Фармацевтично прийнятні солі» стосуються розкритих похідних сполук, де вихідна родоначальна сполука є модифікованою внаслідок виготовлення її солей приєднання кислоти або основи. Форми однини включають посилання на форми множини, якщо контекст не вказує ясно інше. Згадка значення або параметра разом з «приблизно» включає (і описує) варіанти здійснення, які направлені на те значення або той параметр сам по собі. Наприклад, опис, який стосується «приблизно Х», включає опис «Х». Зрозуміло, що аспекти і варіації композицій і способів, які надаються в цьому документі, можуть включати «той, що складається з» і/або «що в основному, складається з» аспектів і варіацій. II. Сполуки і Фармацевтичні композиції У цій заявці надається сполука, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати. Також в цій заявці надаються фармацевтичні композиції, які містять N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)][феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, і фармацевтично прийнятний ексципієнт або носій. Сполуки і фармацевтичні композиції, описані в цьому документі, можуть бути застосовані для лікування або сповільнення розвитку мієлофіброзу у суб'єкта. N-трет-Бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід має наступну хімічну структуру: Сполука, яка надається в цій заявці, може бути введена до складу терапевтичних композицій у вигляді природних або сольових форм. Фармацевтично прийнятні нетоксичні солі включають солі приєднання основи (утворені вільними карбоксильними або іншими аніонними групами), які можуть бути отримані з неорганічних основ, таких як, наприклад, гідроксид натрію, гідроксид калію, гідроксид амонію, гідроксид кальцію, або гідроксид тривалентного заліза, і таких органічних основ, як ізопропіламін, триметиламін, 2-етиламіно-етанол, гістидин, прокаїн і тому подібне. Такі солі також можуть бути утворені як солі приєднання кислоти з будь-якими вільними катіонними групами і, як правило, будуть утворені неорганічними кислотами, такими як, наприклад, хлористоводнева кислота, сірчана кислота, або фосфорна кислота, або органічними кислотами, такими як оцтова кислота, лимонна кислота, паратолуолсульфокислота, метансульфокислота, щавлева кислота, винна кислота, мигдалева кислота і тому подібне. Солі сполук, які надаються в цій заявці, можуть включати амінні солі, утворені протонуванням аміногрупи за допомогою неорганічних кислот, таких як хлористоводнева кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, фосфорна кислота і тому подібне. Солі сполук, які надаються в цій заявці, також можуть включати амінні солі, утворені протонуванням аміногрупи за допомогою прийнятних органічних кислот, таких як пара-толуолсульфокислота, оцтова кислота, метансульфокислота і тому подібне. Додаткові ексципієнти, які передбачені для використання при практичному застосуванні композицій і способів, які надаються в цій заявці, являють собою ексципієнти, доступні середньому фахівцеві в даній галузі, наприклад, ексципієнти, які можна виявити в Фармакопеї Сполучених Штатів, том XXII, і в Національному Формулярі Сполучених Штатів, том XVII, в Фармакопейній конвенції 11 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 США, Inc., Rockville, Md. (1989), релевантний зміст яких включений в цей документ за допомогою посилань. У доповнення до того, сполуки, які надаються в цій заявці, можуть включати поліморфні модифікації. Сполука, описана в цьому документі, може знаходитися в альтернативних формах. Наприклад, сполука, описана в цьому документі, може включати гідратну форму. «Гідрат» стосується сполуки, яка надається в цій заявці, яка пов'язана з водою в молекулярній формі, тобто в якій зв'язок Н-ОН не розщеплений, і може бути представлена, наприклад, формулою R.H2O, де R являє собою сполуку, яка надається в цьому документі. Дана сполука може утворювати більше одного гідрату, який включає, наприклад, моногідрати (R. H 2O) або полігідрати (R.nH2O, де n є цілим числом, яке перевищує 1), в тому числі, наприклад, дигідрати (R.2 H2O), тригідрати (R.3H2O), і тому подібне, або часткові гідрати, такі як, наприклад, R.n/2H 2O, R.n/3H2O, R.n/4H2O і тому подібне, де n являє собою ціле число. Сполуки, описані в цьому документі, також можуть включати гідратні форми солі приєднання кислоти. Як використовують в цьому документі, «гідрат солі приєднання кислоти» належить до комплексу, який може бути утворений через зв'язування сполуки, яка має один або більше основних фрагментів щонайменше з однією сполукою, яка має один або більше кислотних фрагментів, або через зв'язування сполуки, яка має один або більше кислотних фрагментів щонайменше з однією сполукою, яка має один або більше основних фрагментів, де згаданий комплекс додатково пов'язаний з молекулами води з утворенням гідрату, де згаданий гідрат є таким самим, як він визначений раніше, і R означає комплекс, описаний в цьому документі вище. У деяких варіантах здійснення, сполука являє собою моногідрат дигідрохлориду N-третбутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонаміду і має наступну хімічну структуру: Фармацевтичні композиції для введення сполуки, описаної в цьому документі, або як такої, або в комбінації з іншими терапевтичними засобами, можуть бути зручно представлені в дозованій одиничній формі і можуть бути приготовані будь-яким способом із способів, добре відомих в галузі фармацевтики, і способами, описаними в Прикладах 4, 5 і 6. Такі способи можуть включати приведення активного інгредієнта до поєднання з носієм, який складається з одного або більше допоміжних інгредієнтів. Загалом, фармацевтичні композиції приготовляють шляхом приведення активного інгредієнта до однорідного і ретельного з`єднання з рідким носієм або з тонкоподрібненим твердим носієм, або і з тим і з іншим, і потім, за необхідності, шляхом формування продукту з отриманням бажаного складу. У фармацевтичній композиції активна цільова сполука включена в кількості, достатній для того, щоб виконувати бажану дію на патологічний процес або на патологічний стан. Фармацевтичні композиції, які містять активний інгредієнт, можуть мати форму, відповідну для перорального застосування, наприклад, як тверді або м'які капсули. Прийнятна оболонка капсули може являти собою твердий желатин або гідроксипропілметил-целюлозу («HPMC»). У цій заявці надають склади, які містять (i) сполуку, яка являє собою N-трет-бутил-3-[(5метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, (ii) один або більше ексципієнтів, і (iii) одну або більше мастильних речовин. Склади можуть знаходитися в капсульній формі і вводяться перорально. Склади можуть знаходитися в стандартній лікарській формі. У деяких варіантах здійснення, ексципієнт являє собою лактозу (таку як Fast-Flo), манніт (такий як Parteck M200), мікрокристалічну целюлозу («MCC») (таку як Avicel PH102), MCC (таку як ProSolv 90 HD). У деяких варіантах здійснення, мастильна речовина являє собою стеарат магнію, стеарилфумарат натрію (такий як Pruv), або лаурилфумарат натрію. У деяких варіантах здійснення, мікрокристалічна целюлоза являє собою силікатовану мікрокристалічну целюлозу. У деяких варіантах здійснення, капсула являє собою тверду желатинову капсулу. У деяких варіантах здійснення, надають капсулу, відповідну для перорального введення, яка містить суміш, що включає (i) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2 12 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, (ii) ексципієнт (наприклад, мікрокристалічну целюлозу, таку як силікатована мікрокристалічна целюлоза), і (iii) мастильну речовину (наприклад, стеарилфумарат натрію), де суміш міститься в капсулі. Для виготовлення капсул можуть бути використані способи, відомі в даній галузі і описані в цьому документі. Див., наприклад, Приклад 3. Мікрокристалічна целюлоза може бути використана як наповнювач і/або розріджувач у капсулах, які надаються в цій заявці. Стеарилфумарат натрію може бути використаний як мастильна речовина в капсулах, які забезпечуються в цьому документі. У деяких варіантах здійснення, мікрокристалічна целюлоза являє собою силікатовану мікрокристалічну целюлозу. Наприклад, силікатована мікрокристалічна целюлоза може складатися з мікрокристалічної целюлози і частинок колоїдного діоксиду кремнію. У деяких варіантах здійснення, силікатована мікрокристалічна целюлоза являє собою комбінацію 98% мікрокристалічної целюлози і 2% колоїдного діоксиду кремнію. У деяких варіантах здійснення, капсула містить від приблизно 10 мг до приблизно 680 мг сполуки, де вказана маса дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, капсула містить від приблизно 10 мг до приблизно 650 мг (або від приблизно 10 мг до приблизно 550 мг, або від приблизно 10 мг до приблизно 500 мг), де вказана маса дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, капсула містить від приблизно 100 мг до приблизно 600 мг (або від приблизно 200 мг до приблизно 550 мг, або від приблизно 300 мг до приблизно 500 мг), де вказана маса дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, капсула містить приблизно 10 мг, приблизно 20 мг, приблизно 40 мг, приблизно 100 мг, приблизно 150 мг, приблизно 200 мг, приблизно 250 мг, приблизно 300 мг, приблизно 350 мг, приблизно 400 мг, приблизно 450 мг, приблизно 500 мг, приблизно 550 мг, приблизно 600 мг, і приблизно 650 мг сполуки, де вказана маса дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, капсула являє собою тверду желатинову капсулу. У деяких варіантах здійснення, сполука являє собою моногідрат дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, масове співвідношення сполуки до ексципієнту (наприклад, до мікрокристалічної целюлози, такої як силікатована мікрокристалічна целюлоза) в капсулі складає від приблизно 1:1,5 до приблизно 1:15 (наприклад, від приблизно 1:5 до приблизно 1:10, від приблизно 1:5 до приблизно 1:12, або від приблизно 1:10 до приблизно 1:15), де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, масове співвідношення сполуки до мастильної речовини (наприклад, до стеарилфумарату натрію) в капсулі знаходиться в діапазоні від приблизно 5:1 до приблизно 50:1 (наприклад, між приблизно 5:1 і приблизно 10:1, між приблизно 5:1 і приблизно 25:1, між приблизно 5:1 і приблизно 40:1, між приблизно 7:1 і приблизно 34:1, або між приблизно 8:1 і приблизно 34:1), де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, капсула містить від приблизно 5% до приблизно 50% (наприклад, від приблизно 5% до приблизно 10% або від приблизно 5% до приблизно 35%) сполуки від загальної маси вмісту капсули, де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, капсула містить від приблизно 40% до приблизно 95% (наприклад, від приблизно 50% до приблизно 90% або від приблизно 60% до приблизно 90%) ексципієнта (наприклад, мікрокристалічної целюлози, такої як силікатована мікрокристалічна целюлоза) від загальної маси вмісту капсули. У деяких варіантах здійснення, капсула містить від приблизно 0,2% до приблизно 5% (наприклад, від приблизно 0,2% до приблизно 2% або від приблизно 0,5% до приблизно 1,5%, або приблизно 0,5%, приблизно 1%, або приблизно 1,5%) мастильних речовини (наприклад, стеарилфумарату натрію) від загальної маси вмісту капсули. Також в цій заявці надають стандартні лікарські форми, які містять суміш, що включає (i) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, (ii) ексципієнт (такий як мікрокристалічна целюлоза), і (iii) мастильну речовину (таку як стеарилфумарат натрію). Будь-яка з капсул, описаних в цьому документі, може бути використана в стандартній лікарській формі. У деяких варіантах здійснення, стандартна лікарська форма призначена для лікування мієлофіброзу. У деяких варіантах здійснення, лікування провадитиметься відповідно до способу, описаного в цьому документі. 13 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення, стандартна лікарська форма містить суміш, яка включає (i) від приблизно 10 мг від приблизно 680 мг (або від приблизно 10 мг від приблизно 500 мг) сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, де вказана маса відповідає масі фрагмента сполуки, який складає вільну основу, (ii) мікрокристалічну целюлозу, і (iii) стеарилфумарат натрію. У деяких варіантах здійснення, сполука в суміші складає від приблизно 10 мг від приблизно 500 мг, де вказана маса дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, стандартна лікарська форма має форму капсули, і суміш міститься в капсулі. У деяких варіантах здійснення, стандартна лікарська форма містить приблизно 10 мг, приблизно 20 мг, приблизно 40 мг, приблизно 100 мг, приблизно 150 мг, приблизно 200 мг, приблизно 250 мг, приблизно 300 мг, приблизно 350 мг, приблизно 400 мг, приблизно 450 мг, приблизно 500 мг, приблизно 550 мг, приблизно 600 мг, або приблизно 650 мг сполуки, де вказана маса дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, сполука являє собою моногідрат дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, добавка містить (i) приблизно 10 мг (або приблизно будь-яку кількість з 40 мг, 100 мг, 200 мг, 300 мг, 400 мг або 500 мг) сполуки, (ii) мікрокристалічну целюлозу, і (iii) стеарилфумарат натрію, де вказана маса дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, сполука являє собою моногідрат дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, масове співвідношення сполуки до ексципієнту (наприклад, до мікрокристалічної целюлози, такої як силікатована мікрокристалічна целюлоза) в стандартній лікарській формі знаходиться в діапазоні від приблизно 1:1,5 до приблизно 1:15 (наприклад, між приблизно 1:5 і приблизно 1:10, між приблизно 1:5 і приблизно 1:12, або між приблизно 1:10 і приблизно 1:15), де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, масове співвідношення сполуки до мастильної речовини (наприклад, до стеарилфумарату натрію) в стандартній лікарській формі складає від приблизно 5:1 до приблизно 50:1 (наприклад, в діапазоні від приблизно 5:1 до приблизно 10:1, від приблизно 5:1 до приблизно 25:1, від приблизно 5:1 до приблизно 40:1, від приблизно 7:1 до приблизно 34:1, або від приблизно 8:1 до приблизно 34:1), де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, мікрокристалічна целюлоза являє собою силікатовану мікрокристалічну целюлозу. У деяких варіантах здійснення, силікатована мікрокристалічна целюлоза являє собою комбінацію 98% мікрокристалічної целюлози і 2% колоїдного діоксиду кремнію. У деяких варіантах здійснення, мастильна речовина (наприклад, стеарилфумарат натрію) складає від приблизно 0,1% до приблизно 10%, від приблизно 0,5% до приблизно 5%, від приблизно 0,5% до приблизно 3%, від приблизно 0,5% до приблизно 2%, від приблизно 0,75% до приблизно 1,5% від маси вмісту капсули. У деяких варіантах здійснення, мастильна речовина (наприклад, стеарилфумарат натрію) складає щонайменше приблизно будь-яку кількість з 0,1%, 0,25%, 0,5%, 0,75%, 1%, 1,25%, 1,5%, 1,75%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5% або 5% маси вмісту капсули. У деяких варіантах здійснення, мастильна речовина (наприклад, стеарилфумарат натрію) складає приблизно будь-яку кількість з 0,1%, 0,25%, 0,5%, 0,75%, 1%, 1,25%, 1,5%, 1,75%, 2%, 2,5%, 3%, 3,5%, 4%, 4,5% або 5% від маси вмісту капсули. У деяких варіантах здійснення, масове співвідношення сполуки, яка являє собою N-третбутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, до ексципієнту (наприклад, до мікрокристалічної целюлози, такої як силікатована мікрокристалічна целюлоза) в капсулі або в стандартній лікарській формі складає від приблизно 40:60 до приблизно 10:90. У деяких варіантах здійснення, масове співвідношення сполуки до ексципієнту (наприклад, до мікрокристалічної целюлози, такої як силікатована мікрокристалічна целюлоза) в капсулі або в стандартній лікарській формі складає приблизно будь-яке співвідношення, вибране з 95:5, 90:10, 85:15, 80:20, 75:25, 70:30, 65:35, 60:40, 55:45, 50:50, 45:55, 40:60, 35:65, 30:70, 25:75, 20:80, 15:85, 10:90, або 5:95. У деяких варіантах здійснення, масове співвідношення сполуки до ексципієнту (наприклад, до мікрокристалічної целюлози, такої як силікатована мікрокристалічна целюлоза) складає від приблизно 1:1,5 до приблизно 1:9,5, наприклад, приблизно будь-яке співвідношення, вибране з 1:1,5, 1:2, 1:2,5, 1:3, 1:3,5, 1:4, 1:4,5, 1:5, 1:5,5, 1:6, 1:6,5, 1:7, 1:7,5, 1:8, 1:8,5, 1:9 або 1:9,5. В деяких варіантах здійснення, сполука являє собою моногідрат дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1 14 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, капсула містить від приблизно 5% до приблизно 50% (наприклад, від приблизно 5% до приблизно 10% або від приблизно 5% до приблизно 35%) сполуки від загальної маси добавки, де маса сполуки дана з розрахунку на масу фрагмента сполуки, що відповідає вільній основі. У деяких варіантах здійснення, капсула містить від приблизно 40% до приблизно 95% (наприклад, від приблизно 50% до приблизно 90% або від приблизно 60% до приблизно 90%) мікрокристалічної целюлози (такої як силікатована мікрокристалічна целюлоза) від загальної маси добавки. У деяких варіантах здійснення, капсула містить від приблизно 0,2% до приблизно 5% (наприклад, від приблизно 0,2% до приблизно 2% або від приблизно 0,5% до приблизно 1,5%, або приблизно 0,5%, приблизно 1%, або приблизно 1,5%) стеарилфумарату натрію від загальної маси добавки. У деяких варіантах здійснення, капсула або стандартна лікарська форма містить суміш, яка включає приблизно 12 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду, приблизно 122 мг силікатованої мікрокристалічної целюлози, і приблизно 1 мг стеарилфумарату натрію. У деяких варіантах здійснення, капсула або стандартна лікарська форма містить суміш, яка включає приблизно 47 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду, приблизно 448 мг силікатованої мікрокристалічної целюлози, і приблизно 5 мг стеарилфумарату натрію. У деяких варіантах здійснення, капсула або стандартна лікарська форма містить суміш, яка включає приблизно 117 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду. У деяких варіантах здійснення, капсула або стандартна лікарська форма містить суміш, яка включає приблизно 235 мг моногідрату дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонаміду, приблизно 357 мг силікатованої мікрокристалічної целюлози, і приблизно 6,00 мг стеарилфумарату натрію. Також в цьому документі надають пероральні склади в формі розчину, які містять сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати. У деяких варіантах здійснення, пероральний склад у формі розчину додатково містить метилцелюлозу. У деяких варіантах здійснення, пероральний склад у формі розчину додатково містить метилцелюлозу і Твін 80. У деяких варіантах здійснення, пероральний склад у формі розчину містить сполуку в концентрації від приблизно 1 мг/мл до приблизно 25 мг/мл, від приблизно 2 мг/мл до приблизно 20 мг/мл, від приблизно 3 мг/мл до приблизно 15 мг/мл, від приблизно 5 мг/мл до приблизно 10 мг/мл. У деяких варіантах здійснення, пероральний склад у формі розчину містить сполуку в приблизно будь-якій концентрації з 2 мг/мл, 3 мг/мл, 4 мг/мл, 5 мг/мл, 6 мг/мл, 6,25 мг/мл, 6,5 мг/мл, 7 мг/мл, 8 мг/мл, 9 мг/мл, 10 мг/мл, або 12,5 мг/мл, або 15 мг/мл. У деяких варіантах здійснення, пероральний склад у формі розчину містить від приблизно 0,1% до приблизно 5%, від приблизно 0,2% до приблизно 3%, від приблизно 0,25% до приблизно 2%, від приблизно 0,25% до приблизно 1%, або приблизно 0,5% по масі метилцелюлози. У деяких варіантах здійснення, пероральний склад у формі розчину містить від приблизно 0,01% до приблизно 0,5%, від приблизно 0,02% до приблизно 0,3%, від приблизно 0,025% до приблизно 0,2%, від приблизно 0,025% до приблизно 0,1%, або приблизно 0,05% по масі Твін 80. У деяких варіантах здійснення, капсула не містить сприяючу всмоктуванню речовину. У деяких варіантах здійснення, капсула містить сприяючу всмоктуванню речовину (наприклад, вітамін Е TPGS, Gelucire 44/14, Pluronic F127, або гліцерилмоностеарат). Капсула або стандартна лікарська форма, яка надається в цій заявці, може мати одну або більше з наступних властивостей: (1) при введенні суб'єкту, такому як людський суб'єкт, Сmax сполуки досягається в межах від приблизно 2 до приблизно 4 годин після введення дози; (2) при введенні людському суб'єкту, період напіввиведення сполуки складає від приблизно 16 до приблизно 34 годин; (3) середнє значення AUC (площини під кривою), отриманої для сполуки, збільшується більше ніж пропорційно з підвищенням доз, які знаходяться в діапазоні від приблизно 30 мг до приблизно 800 мг на день; (4) накопичення сполуки знаходиться в діапазоні від приблизно 1,25-кратного до приблизно 4,0-кратного в стаціонарному стані в тому випадку, коли дозу сполуки вводять один раз на день. Також надають способи отримання капсульного лікарського продукту, які включають а) змішування мастильної речовини із сполукою, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, для отримання гранул і b) змішування гранул, 15 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 отриманих на стадії а), з ексципієнтом. У деяких варіантах здійснення, мастильна речовина являє собою стеарилфумарат натрію. У деяких варіантах здійснення, ексципієнт являє собою мікрокристалічну целюлозу, таку як силікатована мікрокристалічна целюлоза. Такий спосіб може бути використаний для виготовлення капсули або стандартної лікарської форми, описаної в цьому документі. Маса (наприклад, як масове співвідношення або масовий процентний зміст) і компоненти, що стосується сполуки, ексципієнта, і/або мастильної речовини, можуть відповідати будь-якій масі і компонентам, описаним у цьому документі. III. Способи лікування і попередження мієлофіброзу У цьому документі надають способи лікування, сповільнення розвитку, і/або попередження мієлофіброзу у суб'єкта, які включають в себе введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати (наприклад, моногідрат дигідрохлориду N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно])(бензолсульфонаміду). У деяких варіантах здійснення, суб'єкт має мієлофіброз. У деяких варіантах здійснення, суб'єкт знаходиться в групі ризику розвитку мієлофіброзу. У деяких варіантах здійснення, суб'єкт є людським суб'єктом. Будь-який із складів, описаних в цьому документі, таких як капсули або стандартні лікарські форми, описані в цьому документі, можуть бути використані для лікування суб'єкта з мієлофіброзом. У деяких варіантах здійснення, сполука знаходиться в суміші, яка включає в себе (i) сполуку, яка являє собою (i) сполуку, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, (ii) ексципієнт (такий як мікрокристалічна целюлоза), і (iii) мастильну речовину (таку як стеарилфумарат натрію). Мієлофіброз, який може бути вилікуваний сполуками, описаними в цьому документі, включає первинний мієлофіброз (MF) і вторинний мієлофіброз (наприклад, мієлофіброз, розвинений на фоні попередньої справжньої поліцитемії (post-PV MF) або есенціальної тромбоцитемії (post-ET MF)). Мієлофіброз, який може бути вилікуваний сполуками, описаними в цьому документі, також включає в себе мієлофіброз високого ризику розвитку, проміжного ризику розвитку, такого як проміжного 2 рівня ризику розвитку захворювання. Способи діагностування різних типів мієлофіброзу відомі в даній галузі. Див., наприклад, Cervantes et al., Blood 2009. У деяких варіантах здійснення, суб'єкт з мієлофіброзом має селезінку, розташовану щонайменше на 5 см нижче ребрових країв, що визначено пальпацією. У деяких варіантах здійснення, суб'єкт має точкову мутацію із заміною валіну на фенілаланін в позиції 617 в Янус-кіназі 2 (JAK2-кіназа) (JAK2V617F), якщо суб'єкт є людиною, або точкову мутацію, відповідну заміні валіну на фенілаланін в позиції 617 в Янус-кіназі 2 (JAK2-кіназа) (JAK2V617F), якщо суб'єкт не є людиною. У деяких варіантах здійснення, суб'єкт має негативний результат відносно мутації із заміною валіну на фенілаланін в позиції 617 JAK2-кінази в тому випадку, якщо суб'єкт є людиною, або негативний результат відносно мутації, відповідної заміні валіну на фенілаланін в позиції 617 Янус-кінази 2 (JAK2-кінази) в тому випадку, якщо суб'єкт не є людиною. Має суб'єкт позитивний результат або негативний результат відносно мутації JAK2V617F, можна визначити за допомогою аналізу методом полімеразної ланцюгової реакції («PCR») з використанням геномної ДНК з клітин тканини кісткового мозку або клітин крові (наприклад, лейкоцитів суцільної крові). Аналіз методом ПЛР може являти собою алельспецифічну ПЛР (наприклад, алель-специфічну кількісну ПЛР) або ПЛР секвенування. Див. публікації: Kittur J. et al., Cancer 2007, 109(11):2279-84, і McLornan D. et al., Ulster Med J. 2006, 75(2):112-9, кожна з яких явним чином включена в цей документ за допомогою посилань. У деяких варіантах здійснення, суб'єкт, якого лікують способами, описаними в даному документі, раніше отримав іншу терапію або лікування мієлофіброзу. У деяких варіантах здійснення, суб'єкт не дає клінічної відповіді на іншу терапію мієлофіброзу або має повернення хвороби (рецидив) після отримання іншої терапії мієлофіброзу. Попередня терапія може включати інгібітор JAK2-кінази (наприклад, INCB018424 (також відомий як руксолітиніб, доступний для придбання в Incyte), CEP-701 (лестауртиніб, доступний для придбання в Сephalon), або XL019 (доступний для придбання в Exelixis)) (див. публікацію Verstovsek S., Hematology Am. Soc. Hematol. Educ. Program. 2009:636-42) або інгібітор не-JAK2-кінази (такий як гідроксисечовина). У деяких варіантах здійснення, суб'єкт отримав лікування руксолітинібом первинного мієлофіброзу, мієлофіброзу, розвиненого на фоні справжньої поліцитемії (Post-PV MF), мієлофіброзу, розвиненого на фоні есенціальної тромбоцитемії (Post-ET MF), справжньої поліцитемії, або есенціальної тромбоцитемії протягом щонайменше 14 днів, і мав перерву в лікуванні протягом щонайменше 30 днів. У деяких варіантах здійснення, попередня терапія являє собою лікування сполукою, описаною в даному документі, і попередня терапія була 16 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 перервана при показанні, яке включає один або більше підвищених рівнів амілази, ліпази, аспартат-амінотрансферази (AST), аланін-амінотрансферази (ALT) і/або креатиніну, в сироватці суб'єкта, і/або при показанні гематологічного стану, вибраного з групи, яка складається з анемії, тромбоцитопенії і нейтропенії. У деяких варіантах здійснення, доза сполуки у другому лікуванні є аналогічною або нижчою, ніж доза в попередній терапії. Суб'єкт може отримувати пероральне і/або щоденне лікування. Суб'єкт (такий як людина) може отримати лікування шляхом введення сполуки в дозі від приблизно 240 мг на день до приблизно 680 мг на день (або від приблизно 300 мг на день до приблизно 500 мг на день), де вказана маса є масою фрагмента сполуки, відповідного вільній основі. У деяких варіантах здійснення, сполуку вводять в дозі, яка складає приблизно будь-яку кількість, вибрану з 240 мг/день, 250 мг/день, 300 мг/день, 350 мг/день, 400 мг/день, 450 мг/день, 500 мг/день, 550 мг/день, 600 мг/день, 650 мг/день, або 680 мг/день. Сполука може знаходитися в капсулі і/або в стандартній лікарській формі, описаній в даному документі. У деяких варіантах здійснення, сполука, яка вводиться, знаходиться в суміші разом з мікрокристалічною целюлозою і стеарилфумаратом натрію, а суміш міститься в капсулі. У деяких варіантах здійснення, сполуку вводять перорально. Також в даній заявці надають способи зменшення інтенсивності одного або більше симптомів, супутніх мієлофіброзу. Наприклад, лікування із застосуванням сполуки, описаної в даному документі, є ефективним в зменшенні розміру селезінки, зменшенні інтенсивності конституціональних симптомів (таких як почуття швидкого насичення, стомлюваність, нічні припливи, кашель і свербіж), зниженні лейкоцитозу, зниженні тромбоцитозу, зниженні алельного навантаження мутації JAK2V617F, зменшенні фіброзу кісткового мозку, зменшенні свербежу, зменшенні кахексії, і/або зниженні насиченості клітинами тканини кісткового мозку. Зниження, пониження, зменшення інтенсивності, або покращення стану можливо щонайменше на 5, 10, 20, 30, 40, 50, 60, 70, 80, або 90%, в порівнянні з рівнем до початку лікування сполукою, яка надається в даному документі. У деяких варіантах здійснення, селезінка стає непальпованою у суб'єкта після лікування. У деяких варіантах здійснення, суб'єкт має повну регресію лейкоцитозу і/або тромбоцитозу після лікування. У деяких варіантах здійснення, суб'єкт має повну регресію свербежу після лікування. У деяких варіантах здійснення, сполуку вводять суб'єкту щодня протягом щонайменше 1 циклу, щонайменше 2 циклів, щонайменше 3 циклів, щонайменше 4 циклів, щонайменше 5 циклів, або протягом щонайменше 6 циклів, де цикл становить 28 днів. У деяких варіантах здійснення, сполуку вводять суб'єкту щодня протягом щонайменше 6 циклів, де цикл становить 28 днів, протягом щонайменше 8 циклів, де цикл становить 28 днів, протягом щонайменше 10 циклів, де цикл становить 28 днів, протягом щонайменше 12 циклів, де цикл становить 28 днів, протягом щонайменше 15 циклів, де цикл становить 28 днів, протягом щонайменше 18 циклів, де цикл становить 28 днів, або протягом щонайменше 24 циклів, де цикл становить 28 днів. У деяких варіантах здійснення, сполуку вводять суб'єкту щодня протягом щонайменше одного місяця, протягом щонайменше двох місяців, протягом щонайменше трьох місяців, протягом щонайменше чотирьох місяців, протягом щонайменше п'яти місяців, протягом щонайменше шести місяців, протягом щонайменше восьми місяців, або протягом щонайменше одного року. У деяких варіантах здійснення, сполуку вводять один раз на день. У деяких варіантах здійснення, при введенні сполуки, яка являє собою N-трет-бутил-3-[(5метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, суб'єкту, такому як суб'єкт-людина, Сmax сполуки досягається в межах від приблизно 1 до приблизно 5 годин, від приблизно 1,5 до приблизно 4,5 годин, від приблизно 2 до приблизно 4 годин, або від приблизно 2,5 до приблизно 3,5 годин після введення дози. У деяких варіантах здійснення, при введенні сполуки суб'єктулюдині, період напіввиведення сполуки складає від приблизно 12 до приблизно 40 годин, від приблизно 16 до приблизно 34 годин, або від приблизно 20 до приблизно 30 годин. У деяких варіантах здійснення, середнє значення AUC (площини під кривою), отриманої для сполуки, збільшується більше ніж пропорційно з підвищенням доз, які знаходяться в діапазоні від приблизно 30 мг до приблизно 800 мг в день. У деяких варіантах здійснення, накопичення сполуки знаходиться в діапазоні від приблизно 1,1-кратного до приблизно 5-кратного, від приблизно 1,25-кратного до приблизно 4,0-кратного, від приблизно 1,5-кратного до приблизно 3,5-кратного, від приблизно 2-кратного до приблизно 3-кратного в стаціонарному стані в тому випадку, коли дозу сполуки вводять один раз на день. У деяких варіантах здійснення, спосіб включає видання розпорядження суб'єкту приймати всередину ефективну кількість сполуки на пустий шлунок. У деяких варіантах здійснення, способи додатково включають видання розпорядження суб'єкту уникати прийому всередину 17 UA 114076 C2 5 10 15 20 25 30 35 40 45 50 55 60 засобів, які є щонайменше помірно діючими індукторами або інгібіторами ферменту CYP3A4 (цитохром Р450 3А4). У деяких варіантах здійснення, суб'єкт не отримує супутню терапію із застосуванням лікарських засобів - рослинних засобів, відомих як щонайменше помірно діючі інгібітори або індуктори ферменту CYP3A4. З урахуванням оцінок in vitro, N-трет-бутил-3-[(5метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід метаболізується ферментом CYP3A4 людини. Засоби, які можуть збільшувати концентрації Nтрет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонаміду в плазмі (тобто, інгібітори CYP3А4) або зменшувати концентрації N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонаміду в плазмі (тобто, індуктори CYP3А4), включаючи рослинні засоби і харчові продукти (наприклад, грейпфрут/грейпфрутовий сік), потрібно уникати суб'єктам, які проходять лікування таким чином, як описано в даному документі. У доповнення до того, дані, отримані in vitro, показали, що N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід інгібує фермент CYP3A4 часзалежним чином. Засоби, які є чутливими субстратами відносно метаболізму з участю ферменту CYP3A4, потрібно використовувати з обережністю, оскільки спільне введення з Nтрет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамідом може призводити до вищих концентрацій спільно введеного засобу в плазмі. Перелік клінічно релевантних субстратів ферменту CYP3A4 включає алфентаніл, циклоспорин, діерготамін, етинілестрадіол, ерготамін, фентаніл, пимозид, квінідин, сиролімус, такролімус, кларитроміцин, еритроміцин, телітроміцин, алпразолам, діазепам, мідазолам, триазолам, індинавір, ритонавір, саквинавір, прокінетик, цизаприд, астемізол, хлорфенірамін, амлодипін, дилтіазем, фелодипін, ніфедипін, верапаміл, аторвастатин, церивастатин, ловастатин, симвастатин, арипіпразол, глівек, галоперидол, силденафіл, тамоксифен, таксанес, тразодон і вінкристин. Перелік клінічно релевантних індукторів ферменту CYP3A4 включає карбамазепін, фенобарбітал, фенітоїн, піоглітазон, рифабутин, рифампін, звіробій звичайний (продірявлений), і троглітазон. Перелік клінічно релевантних інгібіторів ферменту CYP3А4 включає індинавір, нелфінавір, ритонавір, кларитроміцин, ітраконазол, кетоконазол, нефазодон, еритроміцин, грейпфрутовий сік, верапаміл, дилтіазем, циметидин, аміодарон, флувоксамін, мібефрадил і тролеандоміцин. Див., посилання на публікацію Flockhart et al., http://medicine.iupui.edu/clinpharm/ddis/clinicaltable.aspx., 2009. Також надають в цій заявці способи моніторингу (контролю за проведенням) лікування мієлофіброзу у суб'єкта, які включають в себе (а) введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати; (b) моніторинг (контроль) гематологічного параметра і/або негематологічного параметра у суб'єкта; і (с) визначення того, чи потрібно суб'єкту продовжувати лікування або потрібно перервати його. У деяких варіантах здійснення, гематологічний параметр вибирають з групи, яка складається з анемії, тромбоцитопенії і нейтропенії. У деяких варіантах здійснення, негематологічний параметр являє собою фермент або молекулу в крові або в сироватці, де підвищений рівень ферменту або молекули служить ознакою пошкодження тканини або органу. У деяких варіантах здійснення, сироватковий(а) фермент або молекула може являти собою, наприклад, амілазу, ліпазу, аспартатамінотрансферазу (AST), аланін-амінотрансферазу (ALT), креатинін, лужну фосфатазу і кальцій. Способи моніторингу цих параметрів відомі в даній галузі і описані в даному документі. Див., Приклади 1- 3. У деяких варіантах здійснення, спосіб додатково включає в себе введення суб'єкту ефективної кількості сполуки, описаної в даному документі, після того, як суб'єкту перервали лікування щонайменше на 2 тижні, щонайменше на 3 тижні, або щонайменше на 4 тижні. У деяких варіантах здійснення, попереднє лікування було перерване без попереднього зниження дози. Також в даній заявці надані способи моніторингу лікування мієлофіброзу у суб'єкта, які включають в себе введення суб'єкту ефективної кількості сполуки, яка являє собою N-третбутил-3-[(5-метил-2-{[4-(2-піролідин-1-ілетокси)феніл]аміно}піримідин-4іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, і переривання лікування при показанні підвищених рівнів одного або більше ферментів або молекул, вибраних із групи, яка складається з амілази, ліпази, аспартат-амінотрансферази (AST), аланін-амінотрансферази (ALT) і креатиніну, і/або зниженого рівня кальцію в крові або в сироватці суб'єкта без попереднього зниження дози. Також надані в даному документі способи моніторингу лікування мієлофіброзу у суб'єкта, які включають в себе введення суб'єкту ефективної кількості сполуки, яка являє собою N-трет-бутил-3-[(5-метил-2-{[4-(2-піролідин-1 18 UA 114076 C2 5 10 ілетокси)феніл]аміно}піримідин-4-іл)аміно]бензолсульфонамід або його фармацевтично прийнятну сіль, або його гідрати, і переривання лікування при показанні одного або більше гематологічних станів, вибраних з групи, яка складається з анемії, тромбоцитопенії і нейтропенії без попереднього зниження дози. У деяких варіантах здійснення, лікування переривають в тому випадку, коли один або більше параметрів (в тому числі гематологічні і негематологічні параметри) складають ускладнення 3 або 4 ступеня. Небажані явища 3 або 4 ступеня відносно гематологічних і негематологічних параметрів відомі в даній галузі і показані в Таблиці нижче. Див., наприклад, публікацію: Common Terminology Criteria for Adverse Events (CTCAE), Варіант 4.0, Опубліковано: 28 травня 2009 р. (в4.03: 14 червня 2010 р.). Відповідь (гематологічна і негематологічна) Гіперліпаземія Сироваткова амілаза Підвищений рівень аланінамінотрансферази Підвищений рівень аспартатамінотрансферази Підвищений рівень креатиніну в крові Підвищений рівень лужної фосфатази в крові Гіпокальціємія Визначення Ступінь 3 Виявлення основане на результатах лабораторних досліджень, які показують збільшення рівня ліпази в біологічному зразку. Виявлення основане на результатах лабораторних досліджень, які показують збільшення рівнів амілази в сироватковій пробі. Виявлення основане на результатах лабораторних досліджень, які показують збільшення рівня аланінамінотрансферази (ALT або SGPT) в пробі крові. Виявлення основане на результатах лабораторних досліджень, які показують збільшення рівня аспартатамінотрансферази (AST або SGOT) в пробі крові. Виявлення основане на результатах лабораторних досліджень, які показують збільшені рівні креатиніну в біологічному зразку. Виявлення основане на результатах лабораторних досліджень, які показують збільшення рівня лужної фосфатази в пробі крові. Порушення, підтверджене результатами лабораторних досліджень, які показують низьку концентрацію кальцію (скореговано за альбуміном) в крові 19 Ступінь 4 >2,0-5,0ULN* >5,0ULN >2,0-5,0ULN >5,0ULN >5,0-20,0ULN >20,0ULN >5,0-20,0ULN >20,0ULN >3,0 (вихідний рівень); >3,0 6,0ULN>6,0ULN >5,0-20,0ULN >20,0ULN Скорегований сироватковий кальцій:
ДивитисяДодаткова інформація
Назва патенту англійськоюCompositions and methods for treating myelofibrosis
Автори англійськоюJayan, Arvind, Cacace, Janice, Terreri, Ayalew
Автори російськоюДжайан Арвинд, Какэйс Джэнис, Теффери Эйалу
МПК / Мітки
МПК: A61K 9/48, A61K 31/497
Мітки: лікування, мієлофіброзу, спосіб, композиція
Код посилання
<a href="https://ua.patents.su/60-114076-kompoziciya-i-sposib-likuvannya-miehlofibrozu.html" target="_blank" rel="follow" title="База патентів України">Композиція і спосіб лікування мієлофіброзу</a>
Попередній патент: Багатошарова таблетка, що містить рилпівірин hcl, емтрицитабін і тенофовіру дизопроксилфумарат
Наступний патент: Нейтралізуюче антитіло проти ccl20
Випадковий патент: Структуроутворювач бурових розчинів