Спосіб одержання норбензоморфану, проміжного продукту при одержанні фармацевтично цінних похідних бензоморфану, зокрема (-)-(1r,5s,2”r)-3′-гідрокси-2(2-метоксипропіл)-5,9,9-триметил-6,7-бензоморфану
Номер патенту: 64699
Опубліковано: 15.03.2004
Автори: Грауерт Маттіас, Бальтес Ханфрід, Мерц Херберт
Формула / Реферат
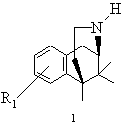
1. Спосіб одержання норбензоморфанів загальної формули 1
 ,
,
в якій
R1 може означати водень, алкіл із 1-6 атомами вуглецю, галоген, гідроксил, алкоксил із 1-8 атомами вуглецю, зв'язаний через атом кисню залишок бензоїлу або алкілкарбоксильний залишок з лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену, нітрогрупу, ціаногрупу, групи -NH2, -NH(С1-С8-алкіл), -N(С1-С8-алкіл)2, при цьому алкільні залишки можуть бути однаковими або різними, -NH-ацил-(С1-С8-алкіл), де ацил означає бензоїл або алкілкарбонільний залишок із лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену який відрізняється тим, що
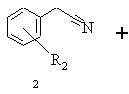
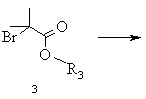
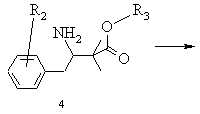
а) бензилціанід формули 2, в якій R2 означає водень, алкіл із 1-6 атомами вуглецю, галоген, гідроксил, алкоксил із 1-8 атомами вуглецю, зв'язаний через атом кисню залишок бензоїлу або алкілкарбоксильний залишок з лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену, піддають взаємодії зі складним ефіром бромізомасляної кислоти загальної формули 3, в якій R3 означає алкіл із 1-8 атомами вуглецю або бензил, в присутності алкілгалогенсилану та цинкового порошку в інертному розчиннику та в присутності селективного стосовно відновлення імінофункцій відновлювального засобу в умовах реакції Реформатського і виділяють одержану похідну етилового складного ефіру 3-аміно-2,2-диметилбутанової кислоти загальної формули 4
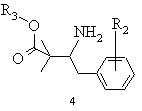 ,
,
а також тим, що
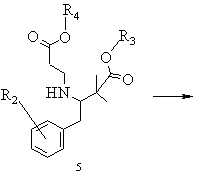
b) похідну складного етилового ефіру 3-аміно-2,2-диметилбутанової кислоти загальної формули 4 піддають взаємодії зі складним ефіром акрилової кислоти, в якому R4 означає алкіл із 1-8 атомами вуглецю або бензил, в умовах реакції приєднання Міхаеля і виділяють одержану похідну складного етилового ефіру 3-(2-етоксикарбонілетил)аміно-2,2-диметилбутанової кислоти загальної формули 5
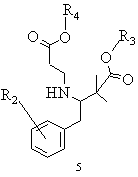 ,
,
а також тим, що
с) отриману таким чином похідну складного етилового ефіру 3-(2-етоксикарбоніл-етил)аміно-2,2-диметилбутанової кислоти загальної формули 5 в інертному розчиннику в присутності сполуки з основною реакцією піддають умовам складноефірної конденсації Дікмана і виділяють одержану похідну піперидону загальної формули 6
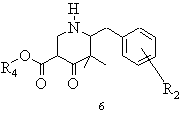 ,
,
а також тим, що
d) похідну піперидону загальної формули 6 піддають лужному або кислому омиленню в полярному розчиннику або в суміші розчинників до відповідної похідної 3,3-диметилпіперидону загальної формули 7 із наступним декарбоксилюванням, виділяють і при необхідності за допомогою кислоти одержують і виділяють відповідну кислотно-адитивну сіль
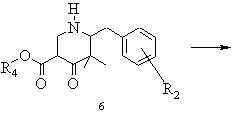
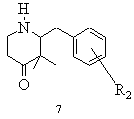 ,
,
а також тим, що
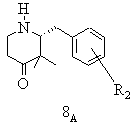
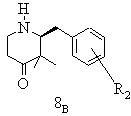
е) одержану таким чином суміш стереоізомерів при необхідності після звільнення енантіомерних вільних основ розчиняють у інертному з точки зору розділення енантіомерів реакційному середовищі, змішують з підходящим стереоізомером придатної до утворення солей зі стереомером енантіомерної суміші органічної кислоти, бажаний стереоізомер виділяють в формі його солі приєднання оптично активної кислоти, матковий розчин, що містить небажані ізомери, нагрівають і при цьому небажаний енантіомер термічно переводять в бажаний стереоізомер, змішують із оптично активною енантіомерно чистою, придатною для утворення солі, органічною кислотою і одержаний таким чином бажаний стереоізомер у формі кислотно-адитивної солі при необхідності з додаванням середовища, що не розчиняє бажану сіль, виділяють і при необхідності цей процес повторюють
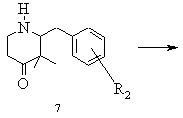
 ,
,
а також тим, що
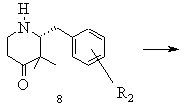
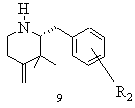
f) одержаний таким чином чистий стереоізомер після вивільнення із енантіомерно чистої кислотно-адитивної солі в інертному розчиннику піддають реакції з реагентом Віттіга, що генерує метиленову групу, в присутності сполуки з основною реакцією і виділяють реакційний продукт типу 9 або відповідний стереоізомер при необхідності в формі його кислотно-адитивної солі
 ,
,
а також тим, що
g) одержаний в результаті реакції Віттіга алкен 9 при необхідності спочатку вивільняють із його кислотно-адитивної солі, вільну основу типу 9 розчиняють в органічному розчиннику і здійснюють реакцію формілування азоту піперидину, і виділяють реакційний продукт 10 або його відповідний стереоізомер
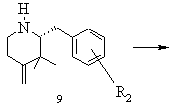
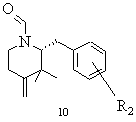 ,
,
а також тим, що
h) одержану таким чином формільну сполуку 10 або відповідний стереоізомер розчиняють в інертному розчиннику, перетворюють кислотою Льюіса і виділяють одержаний в результаті цього перетворення циклізований продукт типу 10
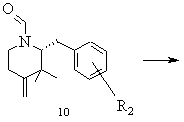
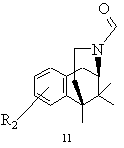 ,
,
а також тим, що
і) одержану в результаті реакції циклізації похідну бензоморфану розчиняють у полярному розчиннику, вводять в реакцію з кислотно реагуючою сполукою і виділяють одержаний в результаті цієї реакції деформільований норбензоморфан типу 12 при необхідності в формі його кислотно-адитивної солі
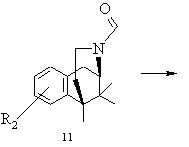
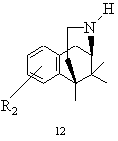 ,
,
а також тим, що
j) при бажанні після вивільнення основи бензоморфану замісник R2 - коли він приєднаний до алкоксигрупи - шляхом розщеплення складного ефіру переводять у вільну гідроксильну функцію і виділяють реакційний продукт - при необхідності в формі його кислотно-адитивної солі - типу 13, причому основа відповідає загальній формулі 1
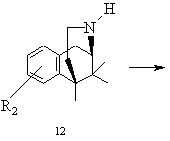
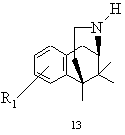 .
.
2. Спосіб одержання норбензоморфанів згідно з п. 1 загальної формули 1
 ,
,
в якій
R1 може означати водень, алкіл із 1-6 атомами вуглецю, галоген, гідроксил, алкоксил із 1-8 атомами вуглецю, зв'язаний через атом кисню залишок бензоїлу або алкілкарбоксильний залишок з лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену,
нітрогрупу, ціаногрупу, групи -NH2, -NH(С1-С8-алкіл), -N(С1-С8-алкіл)2, при цьому алкільні залишки можуть бути однаковими або різними, -NН-ацил-(С1-С8-алкіл), де ацил означає бензоїл або алкілкарбонільний залишок із лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену який відрізняється тим, що
а) бензилціанід формули 2, в якій R2 означає водень, алкіл із 1-6 атомами вуглецю, галоген, гідроксил, алкоксил із 1-8 атомами вуглецю, зв'язаний через атом кисню залишок бензоїлу або алкілкарбоксильний залишок з лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену, піддають взаємодії зі складним ефіром бромізомасляної кислоти загальної формули 3, в якій R3 означає алкіл із 1-8 атомами вуглецю або бензил, в присутності алкілгалогенсилану та цинкового порошку в інертному розчиннику, реакційну суміш нагрівають, після закінчення реакції дають охолонути, цинковий порошок відокремлюють і реакційну суміш змішують із селективним стосовно відновлення імінофункцій відновлювальним засобом, реакційну суміш розводять алканолом і після цього змішують з водним розчином сполуки з основною реакцією, органічну фазу відокремлюють і згущують, залишок розчиняють в інертному розчиннику, одержаний розчин екстрагують водним розчином кислоти, об'єднані водні екстракти підлуговують сполукою з основною реакцією, цей лужний розчин екстрагують органічним розчинником, що не змішується з водою, і виділяють одержану в результаті реакції похідну складного ефіру 3-аміно-2,2-диметилбутанової кислоти формули 4
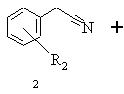

 ,
,
а також тим, що
b) похідну складного ефіру 3-аміно-2,2-диметилбутанової кислоти загальної формули 4 піддають взаємодії зі складним ефіром акрилової кислоти, в якому R4 означає алкіл із 1-8 атомами вуглецю або бензил, в умовах реакції приєднання Міхаеля в інертному розчиннику, по закінченні реакції реакційне середовище видаляють і виділяють одержану похідну складного ефіру 3-(2-етоксикарбонілетил)аміно-2,2-диметилбутанової кислоти загальної формули 5

 ,
,
а також тим, що
с) отриману таким чином похідну складного ефіру 3-(2-етоксикарбонілетил)аміно-2,2-диметилбутанової кислоти загальної формули 5 в інертному розчиннику в присутності сполуки з основною реакцією піддають умовам складноефірної конденсації Дікмана, летючі складові видаляють із одержаної реакційної суміші шляхом дистилювання, після цього суміш гідролізують і змішують з водним розчином сполуки з кислотною реакцією, результуючу суміш змішують із незмішуваним з водою органічним розчинником та водним розчином сполуки з основною реакцією, об'єднані органічні екстракти згущують і виділяють одержану похідну піперидону загальної формули 6

 ,
,
а також тим, що
d) похідну піперидону загальної формули 6 піддають лужному або кислому омиленню в полярному розчиннику або в суміші розчинників до відповідної похідної 3,3-диметилпіперидону загальної формули 7 із наступним декарбоксилюванням, виділяють і при необхідності за допомогою кислоти одержують і виділяють відповідну кислотно-адитивну сіль

 ,
,
а також тим, що
е) одержану таким чином суміш стереоізомерів при необхідності після звільнення енантіомерних вільних основ розчиняють у інертному з точки зору розділення енантіомерів реакційному середовищі, змішують з підходящим стереоізомером придатної до утворення солей зі стереомером енантіомерної суміші органічної кислоти, бажаний стереоізомер виділяють в формі його солі приєднання оптично активної кислоти, матковий розчин, що містить небажані ізомери, нагрівають і при цьому небажаний енантіомер термічно переводять в бажаний стереоізомер, змішують із оптично активною енантіомерно чистою, придатною для утворення солі, органічною кислотою і одержаний таким чином бажаний стереоізомер у формі кислотно-адитивної солі при необхідності з додаванням середовища, що не розчиняє бажану сіль, виділяють і при необхідності цей процес повторюють


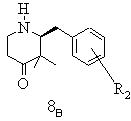 ,
,
а також тим, що
f) одержаний таким чином чистий стереоізомер після вивільнення із енантіомерно чистої кислотно-адитивної солі в інертному розчиннику піддають реакції з реагентом Віттіга, що генерує метиленову групу, в присутності сполуки з основною реакцією в інтервалі температур від 0°С до 80°С, після закінчення перетворення реакційну суміш змішують з водою, а також з не змішуваним з водою органічним розчинником, водну фазу вичерпно екстрагують і виділяють реакційний продукт типу 9 або - після додавання протонної кислоти - відповідний стереоізомер в формі його кислотно-адитивної солі

 ,
,
а також тим, що
g) одержаний в результаті реакції Віттіга алкен 9 при необхідності спочатку вивільняють із його кислотно-адитивної солі, вільну основу типу 9 розчиняють в органічному розчиннику і здійснюють реакцію формілування азоту піперидину, і виділяють реакційний продукт 10 або його відповідний стереоізомер

 ,
,
а також тим, що
h) одержану таким чином формільну сполуку 10 або відповідний стереоізомер розчиняють в інертному розчиннику, перетворюють кислотою Льюіса і виділяють одержаний в результаті цього перетворення циклізований продукт типу 11

 ,
,
а також тим, що
і) одержану в результаті реакції циклізації похідну бензоморфану розчиняють у полярному розчиннику, вводять в реакцію з кислотно реагуючою сполукою і виділяють одержаний в результаті цієї реакції деформільований норбензоморфан типу 12 - після додавання мінеральної кислоти - в формі його кислотно-адитивної солі

 ,
,
а також тим, що
j) при бажанні після вивільнення основи бензоморфану замісник R2 - коли він приєднаний до алкоксигрупи - шляхом розщеплення складного ефіру переводять у вільну гідроксильну функцію і виділяють реакційний продукт - при необхідності в формі його кислотно-адитивної солі - типу 13, причому основа відповідає загальній формулі 1

 .
.
3. Спосіб одержання норбензоморфану згідно з п. 2 загальної формули 1, в якій R1 має значення, наведене в п. 1, який відрізняється тим, що
а) бензилціанід формули 2, в якій R2 означає водень, алкіл із 1-6 атомами вуглецю, галоген, гідроксил, алкоксил із 1-8 атомами вуглецю, зв'язаний через атом кисню залишок бензоїлу або алкілкарбоксильний залишок з лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену, піддають взаємодії зі складним ефіром бромізобутилмасляної кислоти загальної формули 3, в якій R3 означає алкіл із 1-6 атомами вуглецю, в присутності триалкілгалогенсилану та цинкового порошку в простому ефірі та галогеноалкані, реакційну суміш нагрівають, після закінчення реакції дають охолонути, цинковий порошок відокремлюють і реакційну суміш змішують із селективною стосовно відновлення імінофункцій комплексною похідною борогідриду лужного металу, реакційну суміш розводять спиртом з 1-4 атомами вуглецю і після цього змішують з водним розчином аміаку, органічну фазу відокремлюють і згущують, залишок розчиняють в аліфатичному або ароматичному вуглеводні, одержаний розчин екстрагують водним розчином мінеральної кислоти, підлуговують об'єднані водні екстракти водним розчином аміаку, цей лужний розчин екстрагують галогеновуглеводнем і виділяють одержану в результаті реакції похідну етилового ефіру 3-аміно-2,2-диметилбутанової кислоти формули 4
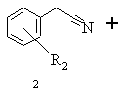

 ,
,
а також тим, що
b) похідну складного етилового ефіру 3-аміно-2,2-диметилбутанової кислоти загальної формули 4 піддають взаємодії зі складним ефіром акрилової кислоти, в якомуR4 означає алкіл із 1-8 атомами вуглецю або бензил, в умовах реакції приєднання Міхаеля в лінійному або розгалуженому спирті з 1-4 атомами вуглецю, по закінченні реакції реакційне середовище видаляють і виділяють одержану похідну складного ефіру 3-(2-етоксикарбонілетил)аміно-2,2-диметилбутанової кислоти загальної формули 5

 ,
,
а також тим, що
с) отриману таким чином похідну складного етилового ефіру 3-(2-етоксикарбоніл-етил)аміно-2,2-диметилбутанової кислоти загальної формули 5 в аліфатичному або ароматичному вуглеводні в присутності алкоголяту лужного металу лінійного або розгалуженого спирту з 1-4 атомами вуглецю піддають умовам складноефірної конденсації Дікмана, шляхом дистилювання видаляють летючі складові із одержаної в результаті реакції циклізації реакційної суміші, після цього суміш гідролізують і змішують з водним розчином мінеральної кислоти, результуючу суміш змішують із незмішуваним з водою діалкіловим ефіром та водним розчином аміаку, об'єднані органічні екстракти згущують і виділяють одержану похідну піперидону загальної формули 6

 ,
,
а також тим, що
d) похідну піперидону загальної формули 6 в суміші, що складається із лінійного або розгалуженого спирту з 1-4 атомами вуглецю та води, в присутності гідроксиду лужного металу або мінеральної кислоти при нагріванні омилюють та декарбоксилюють до одержання відповідної похідної 3,3-диметилпіперидону загальної формули 7, виділяють і при необхідності за допомогою протонної кислоти одержують і виділяють відповідну кислотно-адитивну сіль

 ,
,
а також тим, що
е) одержану таким чином суміш стереоізомерів при необхідності після звільнення енантіомерних вільних основ розчиняють у лінійному або розгалуженому спирті з 1-4 атомами вуглецю, змішують з відповідним енантіомером яблучної, винної, мигдалевої або камфорносульфонової кислоти, бажаний стереоізомер виділяють в формі його солі приєднання оптично активної кислоти, матковий розчин, що містить небажані ізомери, нагрівають і при цьому небажаний енантіомер термічно переводять в бажаний стереоізомер, змішують із оптично активною енантіомерно чистою, придатною для утворення солі, органічною кислотою і одержаний таким чином бажаний стереоізомер у формі кислотно-адитивної солі при необхідності з додаванням середовища, що не розчиняє бажану сіль, виділяють і при необхідності цей процес повторюють


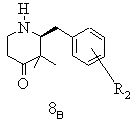 ,
,
а також тим, що
f) одержаний таким чином чистий стереоізомер після вивільнення із енантіомерно чистої кислотно-адитивної солі в - при необхідності циклічному - простому ефірі піддають реакції Віттіга з галогенідом метилтрифенілфосфонію в присутності алкоголяту лужного металу в інтервалі температур від 20°С до 60°С, після закінчення перетворення реакційну суміш змішують з водою, а також з галогеноалканом, водну фазу вичерпно екстрагують і виділяють реакційний продукт типу 9 або - після додавання протонної кислоти - відповідний стереоізомер в формі його кислотно-адитивної солі

 ,
,
а також тим, що
g) одержаний в результаті реакції Віттіга алкен 9 при необхідності спочатку вивільняють із його кислотно-адитивної солі, вільну основу типу 9 розчиняють в розчиннику - ароматичному алкілі - і за допомогою алкілформіату здійснюють реакцію формілування азоту піперидину, виділяють реакційний продукт 10 або його відповідний стереоізомер

 ,
,
а також тим, що
h) одержану таким чином формільну сполуку 10 або відповідний стереоізомер розчиняють в галогенізованому вуглеводні, перетворюють галогенідом алюмінію (ІІІ) і виділяють одержаний в результаті цього перетворення циклізований продукт типу 11

 ,
,
а також тим, що
і) одержану в результаті реакції циклізації похідну бензоморфану розчиняють у алканолі, вводять в реакцію з водним розчином галогеноводневої кислоти і виділяють одержаний в результаті цієї реакції деформільований норбензоморфан типу 12 - після додавання протонної кислоти - в формі його кислотно-адитивної солі

 ,
,
а також тим, що
j) при бажанні після вивільнення основи бензоморфану замісник R2 - коли він приєднаний до алкоксигрупи - шляхом розщеплення складного ефіру переводять у вільну гідроксильну функцію і виділяють реакційний продукт – при необхідності в формі його кислотно-адитивної солі - типу 13, в якому основа відповідає загальній формулі 1

 .
.
4. Спосіб одержання норбензоморфану згідно з п. 3 загальної формули 1, в якій R1 має значення, наведене в п. 1, який відрізняється тим, що
а) бензилціанід формули 2, в якій R2 означає водень, алкіл із 1-6 атомами вуглецю, галоген, гідроксил, алкоксил із 1-8 атомами вуглецю, зв'язаний через атом кисню бензоїльний залишок або алкілкарбоксильний залишок з лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену, після розведення тетрагідрофураном піддають взаємодії зі складним ефіром бромізобутилмасляної кислоти загальної формули 3, в якій R3 означає алкіл із 1-6 атомами вуглецю, в присутності хлортриметилсилану та цинкового порошку в дихлорметані, реакційну суміш нагрівають, після закінчення реакції дають охолонути, цинковий порошок відокремлюють і реакційну суміш змішують із ціаноборогідридом натрію, реакційну суміш розводять етанолом і після цього змішують з концентрованим водним розчином аміаку, органічну фазу відокремлюють і згущують, залишок розчиняють в толуолі, одержаний розчин екстрагують 2-н. соляною кислотою, підлуговують об'єднані водні екстракти концентрованим водним розчином аміаку, цей лужний розчин екстрагують дихлорметаном і виділяють одержану в результаті реакції похідну ефіру 3-аміно-2,2-диметилбутанової кислоти загальної формули 4
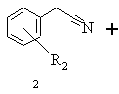

 ,
,
а також тим, що
b) похідну складного етилового ефіру 3-аміно-2,2-диметилбутанової кислоти загальної формули 4 піддають взаємодії зі складним ефіром акрилової кислоти, в якому R4 означає алкіл із 1-6 атомами вуглецю, в умовах реакції приєднання Міхаеля в етанолі як розчиннику, по закінченні реакції реакційне середовище видаляють і виділяють одержану похідну складного ефіру 3-(2-етоксикарбонілетил)аміно-2,2-диметилбутанової кислоти загальної формули 5

 ,
,
а також тим, що
с) отриману таким чином похідну складного етилового ефіру 3-(2-етоксикарбоніл-етил)аміно-2,2-диметилбутанової кислоти загальної формули 5 в толуолі в присутності калій-трет.-бутанолату піддають умовам складноефірної конденсації Дікмана, шляхом дистилювання видаляють летючі складові із одержаної в результаті реакції циклізації реакційної суміші, після цього суміш гідролізують і змішують з концентрованою соляною кислотою, результуючу суміш змішують із діетиловим ефіром та концентрованим розчином аміаку, об'єднані органічні екстракти згущують і виділяють одержану похідну піперидону загальної формули 6

 ,
,
а також тим, що
d) похідну піперидону загальної формули 6 в суміші, що складається із етанолу та води, в присутності гідроксиду натрію або соляної чи сірчаної кислоти при нагріванні до температури кипіння із зворотним холодильником омилюють та декарбоксилюють до одержання відповідної похідної 3,3-диметилпіперидону загальної формули 7, виділяють і при необхідності за допомогою хлористо- або бромистоводневої кислоти одержують відповідний гідрогалогенід

 ,
,
а також тим, що
е) одержану таким чином суміш стереоізомерів при необхідності після звільнення енантіомерних вільних основ розчиняють в етанолі, змішують з відповідним енантіомером (у D- або L-формі) винної кислоти, бажаний стереоізомер виділяють в формі відповідного тартрату, матковий розчин, що містить небажані ізомери, нагрівають і при цьому небажаний енантіомер термічно переводять в бажаний стереоізомер, змішують із D- або L-формою винної кислоти і одержаний таким чином бажаний стереоізомер у формі відповідного тартрату при необхідності шляхом додаванням ізопропанолу кристалізують, осад виділяють і при необхідності цей процес повторюють


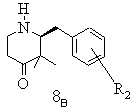 ,
,
а також тим, що
f) одержаний таким чином чистий стереоізомер після вивільнення із енантіомерно чистої кислотно-адитивної солі в тетрагідрофурані піддають реакції Віттіга з бромідом метилтрифенілфосфонію в присутності калій-трет.-бутанолату при температурі 40оС, після закінчення перетворення реакційну суміш змішують з водою, а також з дихлорметаном, водну фазу вичерпно екстрагують і виділяють реакційний продукт типу 9 або - після додавання протонної кислоти - відповідний стереоізомер в формі його гідрогалогеніду

 ,
,
а також тим, що
g) одержаний в результаті реакції Віттіга алкен 9 при необхідності спочатку вивільняють із його кислотно-адитивної солі, вільну основу типу 9 розчиняють в толуолі і за допомогою н-бутилформіату здійснюють реакцію формілування азоту піперидину, виділяють реакційний продукт 10 або його відповідний стереоізомер

 ,
,
а також тим, що
h) одержану таким чином формільну сполуку 10 або відповідний стереоізомер розчиняють в дихлорметані, при температурі, не вищій від -5°С перетворюють хлоридом алюмінію (ІІІ) і виділяють одержаний в результаті цього перетворення циклізований продукт типу 11

 ,
,
а також тим, що
і) одержану в результаті реакції циклізації похідну 11 бензоморфану розчиняють у н-пропанолі, вводять в реакцію з концентрованою соляною кислотою і виділяють одержаний в результаті цієї реакції деформільований норбензоморфан типу 12 - після додавання протонної кислоти - в формі його гідрохлориду

 ,
,
а також тим, що
j) при бажанні після вивільнення основи бензоморфану замісник R2 - коли він приєднаний до алкоксигрупи - шляхом розщеплення складного ефіру переводять у вільну гідроксильну функцію і виділяють реакційний продукт - при необхідності після додавання хлористо- або бромистоводневої кислоти - в формі його галогеніду типу 13, причому основа відповідає загальній формулі 1

 .
.
5. Спосіб одержання норбензоморфану згідно з п. 4 загальної формули 1, в якій R1 означає гідроксильну групу, який відрізняється тим, що
а) бензилціанід загальної формули 2, в якій R2 означає метоксильну групу, що стоїть в положенні 3, після розведення тетрагідрофураном піддають взаємодії з етиловим ефіром бромізобутилмасляної кислоти загальної формули 3 (R3=C2H5) в присутності хлортриметилсилану та цинкового порошку в дихлорметані, реакційну суміш нагрівають, після закінчення реакції дають охолонути, цинковий порошок відокремлюють і реакційну суміш змішують із ціаноборогідридом натрію, реакційну суміш змішують з ціаноборогідридом натрію, розводять етанолом і після цього змішують з концентрованим водним розчином аміаку, органічну фазу відокремлюють і згущують, залишок розчиняють в толуолі, одержаний розчин екстрагують 2-н. соляною кислотою, підлуговують об'єднані водні екстракти концентрованим водним розчином аміаку, цей лужний розчин екстрагують дихлорметаном і виділяють одержаний в результаті реакції етиловий ефір 3-аміно-4-(3-метоксифеніл)-2,2-диметилбутанової кислоти (4, R2=3-ОСН3)
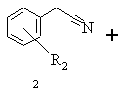

 ,
,
а також тим, що
b) етиловий ефір 3-аміно-4-(3-метоксифеніл)-2,2-диметилбутанової кислоти (4, R2=3-ОСН3) піддають взаємодії з етиловим ефіром акрилової кислоти (R4= С2H5), в умовах реакції приєднання Міхаеля в етанолі як розчиннику, по закінченні реакції реакційне середовище видаляють і виділяють етиловий ефір 3-(2-етоксикарбонілетил)аміно-40(3-метоксифеніл)-2-диметилбутанової кислоти (5, R2=3-ОСН3)

 ,
,
а також тим, що
с) етиловий ефір 3-(2-етоксикарбонілетил)аміно-40(3-метоксифеніл)-2-диметилбутанової кислоти (5, R2=3-ОСН3) в толуолі в присутності калій-трет.-бутанолату піддають умовам складноефірної конденсації Дікмана, із одержаної в результаті реакції циклізації реакційної суміші шляхом дистилювання видаляють летючі складові, після цього суміш гідролізують і змішують з концентрованою соляною кислотою, результуючу суміш змішують із діетиловим ефіром та концентрованим розчином аміаку, об'єднані органічні екстракти згущують і виділяють 5-карбоетокси-3,3-диметил-2-(3-метоксифеніл)метил-4-піперидон (6, R2=3-ОСН3)

 ,
,
а також тим, що
d) 5-карбоетокси-3,3-диметил-2-(3-метоксифеніл)метил-4-піперидон (6, R2=3-ОСН3) в суміші, що складається із етанолу та води, в присутності гідроксиду натрію або соляної чи сірчаної кислоти при нагріванні до температури кипіння із зворотним холодильником омилюють та декарбоксилюють до одержання гідрохлориду 2-(3-метоксифеніл)метил-3,3-диметил-4-піперидону (7, R2=м-СН3О), виділяють реакційний продукт і за допомогою хлористоводневої кислоти осаджують відповідний гідрохлорид 2-(3-метоксифеніл)метил-3,3-диметил-4-піперидону

 ,
,
а також тим, що
е) одержану таким чином суміш стереоізомерів гідрохлориду 2-(3-метоксифеніл)метил-3,3-диметил-4-піперидону типу 7 (R2=3-ОСН3) після вивільнення енантіомерних вільних основ розчиняють в етанолі, змішують із D-(-)-винною кислотою, виділяють бажаний гідротартрат (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-піперидонію типу 8А (R2=3-ОСН3), матковий розчин, що містить небажані ізомери, нагрівають і при цьому небажаний (-)-2-(3-метоксифеніл)-метил-3,3-диметил-4-піперидон типу 8В (R2=3-ОСН3) термічно переводять в бажаний (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-піперидон (8А), змішують із D-(-)-винною кислотою і одержаний таким чином бажаний гідротартрат (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-піперидонію типу 8А (R2=3-ОСН3) шляхом додаванням ізопропанолу кристалізують, осад виділяють і при необхідності цей процес повторюють


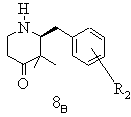 ,
,
а також тим, що
f) одержаний таким чином чистий гідротартрат (+)-2-(3-метоксифеніл)метил-,3,3-диметил-4-піперидонію типу 8А (R2=3-ОСН3) після вивільнення із енантіомерно чистої кислотно-адитивної солі в тетрагідрофурані піддають реакції Віттіга з бромідом метилтрифенілфосфонію в присутності калій-трет.-бутанолату при температурі 40oС, після закінчення перетворення реакційну суміш змішують з водою, а також з дихлорметаном, водну фазу вичерпно екстрагують і виділяють (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-метиленпіперидин (9) і за допомогою хлористоводневої кислоти переводять в гідрохлорид (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-метиленпіперидину типу 9 (R2=3-ОСН3)

 ,
,
а також тим, що
g) одержаний в результаті реакції Віттіга (3-метоксифеніл)метил-3,3-диметил-4-метилен-піперидин типу 9 (R2=3-ОСН3) вивільняють із його гідрохлориду, вільну основу розчиняють в толуолі і за допомогою н-бутилформіату здійснюють реакцію формілування азоту піперидину, виділяють (+)-N-форміл-2-(3-метоксифеніл)метил-3,3-диметил-4-метиленпіперидин типу 10 (R2=3-ОСН3)

 ,
,
а також тим, що
h) (+)-N-форміл-2-(3-метоксифеніл)метил-3,3-диметил-4-метиленпіперидин типу 10 (R2=3-ОСН3) розчиняють в дихлорметані, перетворюють хлоридом алюмінію (ІІІ) і виділяють одержаний в результаті цього перетворення (-)-2-форміл-3'-метокси-5,9,9-триметил-6,7-бензоморфан типу 11 (R2=3'-СН3О)

 ,
,
а також тим, що
і) одержаний в результаті реакції циклізації (-)-2-форміл-3'-метокси-5,9,9-триметил-6,7-бензоморфан типу 11 (R2=3'-СН3О) розчиняють у н-пропанолі, вводять в реакцію з концентрованою соляною кислотою, виділяють одержаний в результаті цієї реакції (-)-3'-метокси-5,9,9-триметил-6,7-бензоморфан типу 12 (R2=3'-СН3О) і за допомогою хлористоводневої кислоти переводять в гідрохлорид

 ,
,
а також тим, що
j) після вивільнення (-)-3'-метокси-5,9,9-триметил-6,7-бензоморфану типу 12 (R2=3'-СН3О) із гідрохлориду 3'-метоксильну функцію за допомогою бромистоводневої кислоти за умов кип’ятіння із зворотним холодильником переводять у вільну гідроксильну функцію, а (-)-3'-гідрокси-5,9,9-триметил-6,7-бензоморфан типу 1 за допомогою бромистоводневої кислоти переводять у відповідний гідробромід (-)-3'-гідрокси-5,9,9-триметил-6,7-бензоморфану загальної формули 13, (R2=3'-ОН), який відповідає загальній формулі 1

 .
.
6. Спосіб згідно з пп. 1-5, який відрізняється тим, що в разі, коли R1 означає нітрогрупу, ціаногрупу, групи –NH2, -NН(С1-С8-алкіл), -N(С1-С8-алкіл)2, при цьому алкільні залишки можуть бути однаковими або різними, -NН-ацил-(С1-С8-алкіл), де ацил означає бензоїл або алкілкарбонільний залишок із лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену, сполуку загальної формули 12, в якій R2 означає водень, відомим чином переводять у відповідно функціоналізовану сполуку загальної формули 13.
Текст
Винахід відноситься до нового способу одержання норбензоморфану - основного проміжного продукту при одержанні фармацевтично цінних похідних бензоморфану загальної формули (1), зокрема (-)-(1R,5S,2"Р)-3'гідрокси-2-(2-метоксипропіл)-5,9,9-триметил-6,7-бензоморфану або ж [(-)-(2R,6S,2'R)-3-(2-метоксипропіл)6,11,11-триметил-1,2,3,4,5,6-гексагідро-2,6-метано-бензо[a]оксацин-9-ола] (коду ВІII 277) де R1 водень, алкіл із 1-6 атомами вуглецю, галоген, гідроксил, алкоксил із 1-8 атомами вуглецю, зв'язаний через атом кисню залишок бензоїлу або алкілкарбоксильний залишок з лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену, нітрогрупа, ціаногрупа, групи -NH2, -NН(С1-С8-алкіл), N(С1-С8-алкіл)2, при цьому алкільні залишки можуть бути однаковими або різними, -NН-ацил-( С1-С8-алкіл), де ацил означає бензоїл або алкілкарбонільний залишок із лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену. Якщо в конкретному випадку нічого іншого не зазначено, то діють такі загальні визначення: Алкіл із 1-6 атомами вуглецю або ж алкіл із 1-8 атомами вуглецю в загальному означає лінійний або розгалужений вуглеводневий залишок із 1-6 або ж 8 атомами вуглецю, незаміщений або заміщений одним або декількома однаковими або різними атомами галогену, переважно фтору. У якості прикладів можна назвати такі вуглеводневі залишки: метил, етил, пропіл, 1-метилетил (ізопропіл), бутил, 1-метилпропіл, 2-метилпропіл, 1,1диметилетил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропш, 1,2-диметилпропіл, 2,2диметилпропіл, 1-етилпропіл, гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-етилбутил, 2-етилбутил, 1,1,2-триметилпропіл, 1,2,2-триметилпропіл, 1-етил-1-метилпропіл і 1-етил-2метилпропіл. Кращими є - якщо нічого іншого не зазначено - залишки нижчих алкілів із 1-3 атомами вуглецю, наприклад, метил, етил, пропіл, ізопропіл. Ацил у загальному означає бензоїл або алкілкарбонільні залишки, наприклад лінійний або розгалужений нижчий алкіл із 1-6 атомами вуглецю, зв'язані через карбонільну групу, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену. Кращими є алкільні залишки з 1-4 атомами вуглецю. У якості прикладів можна назвати: ацетил, трифторацетил, етилкарбоніл, пропілкарбоніл, ізопропілкарбоніл, бутилкарбоніл і ізобутилкарбоніл. Особливо віддають - перевагу ацетилу. Вище названі похідні бензоморфану являють собою багатообіцяючі активні речовини для лікування нейродегенеративних захворювань, а також ішемій мозку різної генези. У якості прикладів можна назвати: епілептичний статус, гіпоглікемія, гіпоксія, аноксія, травма мозку, набряк мозку, аморфний бічний склероз, хвороба Хантингтона, хвороба Альцгеймера, гіпотонія, інфаркт міокарда, крововилив у мозок і перинатальна асфіксія. Похідна бензоморфану коду ВІII 277 і споріднені бензоморфани докладно описані, наприклад, у заявці DE №41 21 821. Крім цього в рівні техніки описуються подальші способи одержання похідних бензоморфану, наприклад, у заявці DE №2 027 077 і європейській заявці №0 004 960. Однак за винятком заявки DE №41 21 821 у даних публікаціях описуються лише способи одержання рацематів, при розчепленні яких у кінцевому рахунку доводиться видаляти 50% небажаного ізомеру. Крім цього на окремих стадіях реакції є ризик утворення регіоізомерів. Тому завданням цього винаходу є подолання недоліків відомих із рівня техніки способів і розробка способу, у рамках якого, з одного боку, уникається утворення можливо виникаючих регіоізомерів при утворенні основної структури бензоморфану і, з іншого боку, забезпечується одержання фармакологічно більш ефективного стереоізомеру з більш високим виходом. Це завдання вирішується описаним нижче способом і, зокрема, приведеними в прикладах стадіями способу. Різні, інші і подальші ознаки, варіанти способу і т.п., що відносяться до цього винаходу, випливають із опису і стають ще більш зрозумілим фахівцю в поєднанні з прикладами, у яких приведені кращі в даний час варіанти даного винаходу. Однак варто спеціально зазначити, що приклади і відповідний опис передбачені лише для пояснення й опису і не обмежують винахід, зокрема одержання (-)-(2R,6S,2')-3-(2-метоксипропіл)6,11,11-триметил- 1,2,3,4,5,6-гексагідро-2,6-метано-бензо [a]оксацин-9-олу (коду ВІII 277). На відміну від відомих способів цей винахід пропонує поліпшений спосіб одержання, у рамках якого на першій стадії заміщена придатним чином похідна бензилціаніду формули 2 - при одержанні продукту коду ВІII 277, наприклад, m-метоксибензилціаніду - де R2 означає водень, алкіл із 1-6 атомами вуглецю, галоген, гідроксил, алкоксил із 1-8 атомами вуглецю, зв'язаний через атом кисню залишок бензоїлу або алкілкарбоксильний залишок з лінійним або розгалуженим залишком нижчого алкілу з 1-6 атомами вуглецю, при цьому алкільний залишок може бути заміщений одним або декількома однаковими або різними атомами галогену, піддають взаємодії зі складним ефіром бромізомасляної кислоти загальної формули 3, де R 3 означає алкіл із 1-8 атомами вуглецю або бензил, переважно алкіл із 1-6 атомами вуглецю, особливо переважно зі складним етиловим ефіром бромізомасляної кислоти, де R 3 означає С 2Н5, з одержанням відповідно заміщеної похідної складного ефіру 3-аміно-2,2-диметилбутанової кислоти загальної формули 4 - при одержанні продукту коду ВІII 277: складного етилового ефіру 3-аміно-4-(3-метоксифеніл)-2,2-диметилбутанової кислоти: У такий спосіб запропонований спосіб забезпечує одержання відомого з заявки DE №20 27 077 попереднього продукту 3-амінодиметилбутанової кислоти на одній стадії виходячи з загальнодоступних вихідних матеріалів, для чого в зазначеному рівні техніки вимагаються 4 стадії. Для здійснення цього синтезу типу реакції Реформатського алкілгалогенсилан, переважно триалкілхлорсилан, особливо переважно триметилхлорсилан, і порошковий цинк змішують у середовищі інертного в умовах реакції розчинника, переважно простого ефіру або галогенованого вуглеводню, особливо переважно дихлорметану. Після розведення цієї суміші в середовищі полярного-інертного-розчинника, переважно циклічного простого ефіру, особливо переважно тетрагідрофурану, реакційну суміш нагрівають, переважно до температури флегми, змішують із сумішшю складного ефіру бромізомасляної кислоти загальної формули 3 і заміщеного придатним чином бензилціаніду загальної формули 2 і продовжують нагрівати, переважно до температури флегми. Після охолодження порошковий цинк відфільтровують і реакційну суміш змішують із селективним щодо відновлення імінофункцій відновником, переважно комплексним похідним борану лужного металу, особливо переважно ціанбораном натрію, а потім алканолом, переважно лінійним або розгалуженим спиртом із 1-4 атомами вуглецю, особливо переважно етанолом. Продукт змішують із водним розчином сполуки з основною реакцією, переважно розчином аміаку, особливо переважно концентрованим розчином аміаку, після чого органічну фазу виділяють. Сушать, згущують у вакуумі і залишок подають в інертний розчинник, переважно аліфатичний або ароматичний вуглеводень, особливо переважно толуол, і екстрагують водним розчином кислоти, переважно мінеральної кислоти, особливо переважно 2-н. соляної кислоти. Потім водну фазу підлужують за допомогою водного розчину сполуки з основною реакцією, переважно розчину аміаку, особливо переважно концентрованого розчину аміаку, після чого екстрагують органічним агентом, що не змішується з водою і може бути екстрагованим, переважно галогенованим вуглеводнем, особливо переважно дихлорметаном. Отриманий у такий спосіб екстракт сушать, згущують і виділяють похідну складного ефіру 3-аміно-2,2-диметилбутанової кислоти загальної формули 4. Неочікувано було виявлено, що на цій стадії вуглець-вуглецева реакції сполучення і відновлення іміногрупи до аміну можна здійснювати на одній стадії без попереднього виділення й очищення іміну, що звичайно потрібно при проведенні каталітичних гідрувань. Завдяки цьому, можна уникнути утворення продуктів гідролізу, виникнення яких при стандартній водній переробці призводить до зменшення виходу. На другій стадії реакції отриману в такий спосіб похідну складного етилового ефіру 3-аміно-2,2диметилбутанової кислоти загальної формули 4 піддають взаємодії зі складним ефіром акрилової кислоти (СН2=CH-COOR4, при цьому R4 означає алкіл із 1-8 атомами вуглецю або бензил, переважно алкіл із 1-6 атомами вуглецю й особливо переважно етил) з одержанням відповідної похідної складного етилового ефіру 3(2-етоксикарбоніл-етил)аміно-2,2-диметилбутанової кислоти загальної формули 5 - при одержанні продукту коду ВІII 277, наприклад, складного етилового ефіру 3-(2-етоксикарбонілетил)аміно-4-(3-метоксифеніл)-2,2диметилбутанової кислоти (R2=СН3О-): Для здійснення цієї реакції Міхаеля похідну складного етилового ефіру 3-аміно-2,2-диметилбутанової кислоти загальної формули 4 і складний ефір акрилової кислоти розчиняють в інертному в даних умовах реакції середовищі, переважно в середовищі лінійного або розгалуженого алканолу з 1-4 атомами вуглецю, особливо переважно етанолу, і нагрівають, переважно до температури флегми. По закінченні реакції розчинник видаляють у вакуумі, після чого виділяють отриману похідну складного етилового ефіру 3-(2етоксикарбонілетил)аміно-2,2-диметилбутанової кислоти загальної формули 5. На наступній третій стадії реакції отриману на попередній стадії похідну складного етилового ефіру 3-(2етоксикарбонілетил)аміно-2,2-диметилбутанової кислоти загальної формули 5 - у випадку синтезу продукту коду ВІII 277: складного ефіру 3-(2-етоксикарбонілетил)аміно-4-(3-метоксифеніл)-2-диметилбутанової кислоти піддають циклізації з одержанням відповідного піперидону - у випадку синтезу продукту коду ВІII 277: 5карбоетокси-3,3-диметил-2-(3-метоксифеніл)метил-4-піперидону загальної формули 6: Для проведення циклізації типу складноефірної конденсації Дікмана похідну складного ефіру 3-(2етоксикарбонілетил)аміно-2,2-диметилбутанової кислоти загальної формули 5 розчиняють у середовищі інертного в умовах циклізації розчинника, переважно аліфатичного або ароматичного вуглеводню, особливо переважно толуолу, і в присутності сполуки з основною реакцією, переважно алкоголяту лужного металу лінійного або розгалуженого спирту з 1-4 атомами вуглецю, особливо переважно трет-бутилату калію, нагрівають до температури флегми, а летючі при таких температурах компоненти реакційної суміші видаляють перегонкою, наприклад у рамках азеотропної реакції. Після закінчення реакції реакційну суміш гідролізують і змішують із водним розчином сполуки з кислою реакцією, переважно з водними мінеральними кислотами, особливо переважно з концентрованою соляною кислотою. Потім до суміші добавляють інертний у даних умовах агент, що не змішується з водою і що може бути екстрагованим, переважно простий діалкіловий ефір, особливо переважно простий діетиловий ефір, після чого змішують із водним розчином сполуки з основною реакцією, переважно водним розчином аміаку, особливо переважно концентрованим розчином аміаку. Органічні фази» відокремлюють, водну фаз у цілком екстрагують, об'єднані органічні екстракти промивають водою, сушать і згущують у вакуумі. Виділяють отриманий піперидон загальної формули 6 - у випадку одержання продукту коду ВІII 277: 5-карбоетокси-3,3-диметил-2-(3-метоксифеніл)метил-4-піперидон. У вигляді альтернативи вищеописану конденсацію Дікмана можна також здійснювати за допомогою тетрахлориду титану в середовищі галогенованого вуглеводню, переважно дихлорметану (див. М. Deshmukh та ін. у джерелі Synth. 25 (1995р.), стор.177). На четвертій стадії реакції похідну піперидону загальної формули 6 піддають лужному або кислому омиленню до відповідної похідної 3,3-диметил-4-піперидону загальної формули 7 із наступним декарбоксилюванням. При цьому умови реакції вибирають у залежності від хімічних властивостей ви хідної речовини. Так, наприклад, у випадку одержання продукту коду ВІII 277 працюють в умовах лужного омилення з одержанням 2-(3-метоксифеніл)метил-3,3-диметил-4-піперидону, що можна виділяти у вигляді кислотноадитивної солі, переважно у вигляді його гідрогалогеніду: Для цього похідну складного ефіру піперидону загальної формули 6 нагрівають у середовищі полярного водовмісного розчинника або ж суміші розчинників, переважно в середовищі суміші лінійного або розгалуженого алканолу з 1-4 атомами вуглецю і води, особливо переважно суміші етанолу і води, у присутності сполуки з основною або кислою реакцією, переважно в присутності гідроксиду лужного металу або мінеральної кислоти, особливо переважно гідроксиду натрію або, при застосуванні кислоти, наприклад у присутності соляної кислоти або сірчаної кислоти; переважно нагрівають до температури флегми. Після омилення реакційне середовище видаляють у вакуумі, залишок подають у придатний для наступного солеутворення розчинник, переважно полярний органічний розчинник, особливо переважно ацетон, після чого осаджують кислотно-адитивну сіль. Наступне розчеплення отриманої в такий спосіб суміші енантіомерних 3,3-диметил-4-піперидонів - у випадку продукту коду ВІII 277: гідрохлориду 2-(3-метоксифеніл)-метил-3,3-диметил-4-піперидону-загальної формули 7 у результаті відомих методів поділу енантіомерів, наприклад шляхом взаємодії з яблучною кислотою, винною кислотою, мигдальною кислотою або камфорною сульфокислотою, переважно винною кислотою, одержують такі сполуки: Так, наприклад, у результаті взаємодії з D-(-)-винною кислотою одержують відповідну чисту енантіомерну похідну З.З-диметил-4-піперидону загальної формули 8А або 8В у вигляді її гідротартрату, у випадку продукту коду ВІН 277, наприклад, гідротартрат (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-піперидонію (R2= метаметокси). Для поділу ізомерів, наприклад за допомогою відповідних тартратів, похідну піперидону загальної формули 7 у вигляді її кислотно-адитивної солі, наприклад у вигляді гідрохлориду, розчиняють у воді і змішують із сполукою з основною реакцією або, переважно, її водним розчином. Особливо переважно застосовують концентрований водний розчин аміаку. Водну фазу екстрагують органічним розчинником, що не змішується з водою, переважно галогеналканом, особливо переважно дихлорметаном. Після сушіння і згущення у вакуумі залишок розчиняють у реакційному середовищі, інертному в даних умовах реакції, переважно в середовищі лінійного або розгалуженого алканолу з 1-4 атомами вуглецю, особливо переважно в середовищі етанолу, після чого змішують із відповідним стереоізомером однієї з названих кислот, наприклад D-(-)-винної кислоти. У разі потреби добавляють достатню кількість нерозчинника стосовно бажаної солі, переважно відповідного гідротартрату, переважно лінійний або розгалужений алканол із 3-8 атомами вуглецю, особливо переважно ізопропанол, після чого ізомер піперидону у ви гляді чистих енантіомерів кристалізується в якості гідротартрату піперидонію. У випадку одержання продукту коду ВІII 277 мова йде про гідротартрат (+)-2-(3метоксифеніл)метил-3,3-диметил-4-піперидонію (R2=мета-метокси). Неочікувано було встановлено, що після нагрівання маткового лугу, що містить головним чином інший енантіомер, при новій спробі кристалізації в аналогічних умовах можна ще раз одержувати велику частину бажаного енантіомеру, наприклад у вигляді його гідротартрату. Термічну рацемізацію небажаного енантіомеру і наступний процес одержання бажаного стереоізомеру можна цілком здійснювати декілька разів. У такий* спосіб у випадку гідротартрату (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-піперидонію загальний вихід бажаного ізомеру можна підвищити до понад 75 %. Наступна реакція Віттіга в присутності броміду метилтрифенілфосфонію на наступній стадії приводить до одержання відповідної похідної 4-метилен-піперидину загальної формули 9-у випадку продукту коду ВІII 277: (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-метилен-піперидину (R2=мета-метокси ), який можна виділяти у вигляді його кислотно-адитивної солі, переважно у вигляді гідрогалогеніду, особливо переважно у вигляді його гідрохлориду. Для проведення реакції Віттіга похідну 3,3-диметилпіперидону загальної формули 8 у вигляді її кислотноадитивної солі, наприклад, у вигляді гідрохлориду, розчиняють у воді і змішують із сполукою з основною реакцією, переважно його водним розчином. Особливо переважно використовують концентрований водний розчин аміаку. Водну фазу екстрагують органічним розчинником, що не змішується з водою, переважно галогеналканом, особливо переважно дихлорметаном. Продукт сушать, згущують у вакуумі і залишок подають в інертне в умовах реакції Віттіга реакційне середовище, переважно в циклічний простий ефір, особливо переважно в тетрагідрофуран, після чого змішують з утворюючим метиленову груп у реагентом Віттіга, переважно галогенідом метилтрифенілфосфонію, особливо переважно бромідом метилтрифенілфосфонію, у присутності сполуки з основною реакцією, переважно алкоголяту лужного металу, особливо переважно третбутанолату калію, і піддають реакції - у залежності від реакційної здатності застосовуваних у конкретному випадку вихідних речовин - при. температурі від 0 до 80°С, переважно від 20 до 60°С і особливо переважно при температурі близько 40°С. Після здійснення реакції реакційну суміш змішують із водою і органічним розчинником, що не змішується з водою переважно галогеналканом, особливо переважно дихлорметаном, і органічну фазу відокремлюють. Після повного екстрагування водної фази і сушіння об'єднаних екстрактів екстрагувальний агент видаляють, залишок розчиняють у середовищі відповідного для утворення кислотноадитивної солі розчинника, переважно в середовищі лінійного або розгалуженого алканолу з 1-4 атомами вуглецю, особливо переважно ізопропанолу. Потім змішують із придатною кислотою, переважно мінеральною кислотою, наприклад галогенованою водневою кислотою, особливо переважно концентрованою соляною кислотою. Викристалізовану кислотно-адитивну сіль продукту реакції Віттіга загальної формули 9 виділяють. На наступній сьомій стадії реакції здійснюють формілування азоту піперидину, наприклад за допомогою нбутилформіату, з одержанням відповідної похідної г\І-форміл-3,3-диметил-4-метилен-піперидину у вигляді чистих енантіомерів - у випадку одержання продукту коду ВІII 277: відповідного (+)-N-форміл-2-(3метоксифеніл)метил-3,3-диметил-4-метилен-піперидину (R2=мета-метокси) загальної формули 10:13 Для цього похідну піперидину загальної формули 9, яку на попередній стадії виділяли у вигляді гідрогалогеніду, спочатку переводять у відповідну вільну основу, наприклад шляхом розчинення похідної піперидину загальної формули 9 у вигляді її гідрогалогеніду у воді і змішування зі сполукою з основною реакцією, переважно водним розчином сполуки з основною реакцією й особливо переважно концентрованим розчином аміаку. Потім вільний піперидин екстрагують органічним розчинником, переважно галогенованим вуглеводнем і особливо переважно дихлорметаном. Екстракт сушать, екстрагувальний агент відганяють і вільну основу подають в органічний розчинник, наприклад вуглеводень, переважно алкілований ароматичний вуглеводень, особливо переважно толуол. Суміш доводять до реакції за допомогою агента формілування, переважно алкілформіату, особливо переважно н-бутилформіату, і продукт реакції виділяють. На восьмій стадії реакції, під час наступної реакції циклізації в присутності відповідно реакційноздатних кислот Льюїса, наприклад мінеральних кислот, зокрема бромистоводневої кислоти, переважно сульфокислоти, особливо переважно в присутності галогенідів алюмінію(ІІІ), зокрема переважно в присутності трихлориду алюмінію, у кінцевому рахунку відбувається утворення структури бензоморфану, що у випадку одержання продукту коду ВІII 277 приводить до одержання відповідного (-)-2-форміл-3'-метокси-5,9,9-триметил-6,7бензоморфану загальної формули 11 (R2=m-ОСН3). Похідну піперидину загальної формули 10 добавляють до суспензії зазначеної кислоти Льюїса, наприклад у присутності хлориду алюмінію (III), у середовищі інертного в умовах реакції розчинника, переважно галогенованого вуглеводню, особливо переважно дихлорметану. Після закінчення реакції циклізації реакційну суміш обережно гідролізують. Потім водну фазу відокремлюють і екстрагують. Об'єднані органічні фази сушать і згущують, після чого виділяють похідну бензоморфану загальної формули 11. Неочікувано було встановлено, що при проведенні реакції циклізації - на відміну від відомих способів рівня техніки - продукт циклізації при застосуванні АІСІ3 одержують у майже кількісному виході. У випадку метазаміщення фенільної системи запропонований спосіб відрізняється ще тією перевагою, що циклізація відбувається селективно в пара-положенні відносно положення R2. На наступній дев'ятій стадії реакції формільну групу відщеплюють з одержанням відповідного 3'-метокси5,9,9-триметил-6,7-бензоморфану загальної формули 12. Для цього формілбензоморфан загальної формули 11 розчиняють у полярному розчиннику, переважно в алканолі, особливо переважно в н-пропанолі, і змішують із сполукою з кислою реакцією, переважно водним розчином мінеральної кислоти, особливо переважно концентрованою соляною кислотою, після чого суміш нагрівають. Після відщеплення формільної групи реакційну суміш згущують і змішують із водою і екстрагують розчинником, що не змішується із водою, переважно складним ефіром карбонової кислоти, особливо переважно складним етиловим ефіром оцтової кислоти. Очищену в такий спосіб водну фазу підлужують переважно за допомогою концентрованого розчину аміаку і екстрагують органічним розчинником, переважно^ галогенованим вуглеводнем, особливо переважно дихлорметаном. Після сушіння і згущення об'єднаних органічних екстрактів можна виділяти, наприклад, відповідний (-)-3'-метокси-5,9,9-триметил-6,7-бензоморфан (R2=m-CH3O). На цій стадії можна - при бажанні - здійснювати, хімічну модифікацію замісника R 2 у фенільній структурі. В іншому випадку R2 одержує зазначене у формулі винаходу значення замісника R1. На наступній стадії синтезу отриману на попередній стадії реакції похідну бензоморфану загальної формули 12 можна піддавати розчепленню простого ефіру в кислих умовах, переважно мінеральної кислоти, наприклад галогенованої водневої кислоти, особливо переважно бромисто-водневої кислоти, у результаті чого одержують відповідну вільну фенольну стр уктур у. Розчеплення простого ефіру відбувається в кислих умовах, при цьому застосування мінеральних кислот виявилося переважним. У випадку (-)-3'-метокси-5,9,9-триметил-6,7-бензоморфану особливо переважним є застосування бромисто-водневої кислоти. У такий спосіб отриманий у результаті цієї реакції омилення продукт омилення можна одержувати у вигляді його гідроброміду [гідроброміду (-)-3'-гідрокси-5,9,9-триметил-6,7-бензоморфана] у кристалічній модифікації. Приклади 1-а стадія реакції Складний етиловий ефір 3-аміно-4-(3-метоксифеніл)-2-диметилбутанової кислоти загальної формули 4 [R2=m-CH 3O] 229,3г (3,5моль) цинку в 3,0л дихлорметану в атмосфері азоту змішують із 230мл триметилхлорсилану і перемішують при кімнатній температурі протягом 20 хвилин. До суміші добавляють 1,1л абсолютного тетрагідрофурану і нагрівають із зворотним холодильником, після чого краплями додають суміш 500г (2,6моль) складного етилового ефіру бромізомасляної кислоти загальної формули 1 і 226,4г (1, моль) тметоксибензилціаніду загальної формули 2 і нагрівають із зворотним холодильником протягом 1,5 годин. Суміші дають охолоджуватися, декантують від надлишкового цинку, охолоджують до температури близько 10°С і змішують із 96,7г (1,5моль) ціаноборогідриду натрію. Потім до суміші повільно краплями додають 300 мл етанолу (виділення газу). Суміш залишають стояти ще 20 хвилин, потім змішують із 1,0л конц. розчину аміаку, фази розділяють і органічну фазу ще раз промивають сумішшю 500мл конц. розчину аміаку і 500мл води. Органічну фазу суша ть над сульфатом натрію і згущують у вакуумі. Залишок подають у 2,3л толуолу і два рази струшують 2-н. соляною кислотою, взятою у кількості по 1,8л. Водну фазу підлужують 700мл конц. розчину аміаку і два рази екстрагують дихлорметаном, узятим у кількості по 2,2л. Органічну фазу сушать над сульфатом натрію і згущують у вакуумі. Одержують 322,5г (81% теорії) складного етилового ефіру 3-аміно-4-(3метоксифеніл)-2-диметилбутанової кислоти загальної формули 4 у формі жовтого масла. 2-а стадія реакції Складний етиловий ефір 3-(2-етоксикарбонілетил)аміно-4-(3-метоксифеніл)-2-диметил-бутанової кислоти загальної формули 5 [R2=m-CH 3O] 382,2г (1,4моль) складного етилового ефіру 3-аміно-4-(3-метоксифеніл)-2-диметил-бутанової кислоти загальної формули 4 і 195,4мл (1,8моль) складного етилового ефіру акрилової кислоти розчиняють у 570мл абс. етанолу і нагрівають зі зворотним холодильником протягом 7 днів. Реакційну суміш цілком згущують у вакуумі. Виділяють 469,2г (89,2% теорії) складного етилового ефіру 3-(2-етоксикарбонілетил)аміно-4-(3метоксифеніл)-2-диметилбутанової кислоти загальної формули 5 у формі червоно-коричневого масла. 3-я стадія реакції 5-карбоетокси-3,3-диметил-2-(3-метоксифеніл)-метил-4-піперидон загальної формули 6 [R2=m-CH 3O] 469,2г (1,3моль) складного етилового ефіру 3-(2-етоксикарбонілетил)аміно-4-(3-метокси-феніл)-2диметилбутанової кислоти загальної формули 5 [R2=m-CH 3O] розчиняють у 7,8л толуолу і близько 100мл суміші розчинника і води відганяють. Суміші дають охолоджуватися до температури близько 70°С, змішують із 158,3г (1,4моль) трет-бутилату калію і нагрівають до 105°С протягом 40 хвилин, при цьому етанол, що утвориться, відганяють. Потім охолоджують до 5°С і змішують із 1,2л крижаної води і 280мл конц. соляної кислоти. Змішують із 1,2л діетилового ефіру і 220мл конц. розчину аміаку, органічну фазу відокремлюють і водну фазу два рази екстрагують діетиловим ефіром, узятим у кількості по 600мл. Об'єднані органічні фази двічі промивають водою, взятою у кількості по 600мл, після чого сушать над сульфатом натрію і згущують у вакуумі. Виділяють 390,1г (95,1% теорії) 5-карбоетокси-3,3-диметил-2-(3-метоксифеніл)-метил-4-піперидон загальної формули 6 у формі червоно-коричневого масла. 4-а стадія реакції Гідрохлорид 2-(3-метоксифеніл)метил-3,3-диметил-4,4-піперидону загальної формули 7 [R2=m-СН3О] 390,1г (1,22моль) 5-карбоетокси-3,3-диметил-2-(3-метоксифеніл)-метил-4-піперидону загальної формули 6 [R2=m-СН3О] розчиняють у суміші 204,8г (5,1моль) гідроксиду натрію, 680мл етанолу і 680мл води і нагрівають із зворотним холодильником протягом 20 хвилин. Розчинник відганяють у вакуумі, залишок подають в ацетон і гідрохлорид осаджують за допомогою ефірної соляної кислоти. Одержують 311,9г (90,1% теорії), гідрохлориду 2-(3-метоксифеніл)метил-3,3-диметил-4,4-піперидону загальної формули 7 у формі білих кристалів. Т.пл.: 224225°С. 5-а стадія реакції Поділ енантіомерів піперидону Гідротартрат (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-піперидонію формули 8 [R2=m-СН3О] 28,7г (101ммоль) гідрохлориду 2-(3-метоксифеніл)метил-3,3-диметил-4-піперидону формули 7 розчиняють у 57мл води. Водну фазу три рази екстрагують дихлорметаном, узятим у кількості по 35мл. Об'єднані органічні фази промивають 25мл води, сушать над сульфатом натрію і розчинник відганяють у вакуумі. Залишок сушать у вакуумі при температурі 80°С до досягнення сталості ваги (24,7г). Залишок при нагріванні розчиняють у 200мл етанолу в присутності 15г (100ммоль) D-(-)-винної кислоти, після чого до суміші при перемішуванні добавляють 50мл ізопропанолу і невелику кількість затравних кристалів. Суміші дають кристалізуватися протягом 24 годин при кімнатній температурі і відсмоктують від кристалів (15г, т.пл.: 142°С; [a]25D=+31,7° (с=1 у метанолі)). Матковий розчин упарюють у вакуумі насухо, змішують із 150мл суміші етанолу і ізопропанолу в співвідношенні 80:20 і нагрівають із зворотним холодильником протягом 20 годин. Потім до розчину ще раз добавляють невелику кількість затравних кристалів і суміш залишають стояти протягом 6 діб. Ще раз відсмоктують (6,65г, т.пл.: 142°С; [a]25D=+32,2° (с=1 у метанолі)). Матковий розчин нагрівають із зворотним холодильником протягом 20 годин і потім упарюють насухо. Залишок подають у 100мл води, до суміші добавляють 10мл 2-н. соляної кислоти і три рази екстрагують діетиловим ефіром, узятим у кількості по 25мл. Ефірну фазу видаляють (неосновні домішки), водну фаз у підлужують конц. розчином аміаку і ще тричі екстрагують діетиловим ефіром, узятим у кількості по 30мл. Об'єднані ефірні фази сушать над сульфатом магнію і згущують у вакуумі (10,35г залишку). Залишок і 6,28г (42ммоль) D-(+)-винної кислоти при нагріванні розчиняють у 104мл суміші етанолу і ізопропанолу в співвідношенні 80:20. До суміші добавляють затравні кристали і суміш залишають стояти протягом доби при кімнатній температурі. Кристали відсмоктують (5,8г, т.пл.: 142°С: [a]25D=+31,6° (с=1 у метанолі)). Матковий розчин упарюють, залишок (11,5г) розчиняють у 72мл суміші етанолу і ізопропанолу у співвідношенні 80:20 і нагрівають із зворотним холодильником протягом 20 годин. Потім до суміші добавляють затравні кристали і залишають стояти протягом 6 діб при кімнатній температурі. Кристали, що випали, відсмоктують (2,66г, т.пл.: 140°С; [a]25D=+31,8° (с=1 у метанолі)) і об'єднують із попередніми фракціями. У такий спосіб одержують 30,11г (75% теорії) гідротартрату (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-піперидонію формули 8. 6-а стадія реакції Гідрохлорид (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-метилен-піперидину формули 9 24,0г (60,3ммоль) гідротартрату (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-піперидонію формули 8 розчиняють у 50мл води, після чого змішують із 15мл конц. розчину аміаку і 50мл дихлорметану. Фази розділяють, водну фазу два рази екстрагують дихлорметаном. узятим у кількості по 25мл, і об'єднану органічну фазу сушать над сульфатом магнію. Потім розчинник видаляють у вакуумі і залишок подають у 30мл абс. тетрагідрофурану. 25,7г (720ммоль) броміду метилтрифенілфосфонію суспендують у 205мл абсолютного тетрагідрофурану. В атмосфері азоту при кімнатній температурі суспензію змішують із 8,1г (720ммоль) трет-бутилату калію. Перемішують протягом 30 хвилин при 40°С, охолоджують до кімнатної температури і протягом 10 хвилин змішують із вищеотриманим розчином піперидону в 30мл тетрагідрофурану. С уміш залишають стояти при кімнатній температурі протягом години, охолоджують до 10°С і протягом 15 хвилин змішують із 66мл води. Потім тетрагідрофуран видаляють у вакуумі і залишок змішують із 46мл дихлорметану і 30мл крижаної води. Фази розділяють, водну фазу два рази екстрагують дихлорметаном, узятим у кількості по 15мл, і об'єднані органічні екстракти струшують 40мл води. Потім сушать над суль фатом магнію, розчинник відганяють у вакуумі, залишок розчиняють у 85мл ізопропанолу і при охолодженні льодом змішують із 5,7мл конц. соляної кислоти. Через годину відсмоктують (8,5г), матковий розчин змішують із 150мл діетилового ефіру для повторної кристалізації і через годину ще раз відсмоктують (5,2г). Ма тковий розчин упарюють у вакуумі, залишок подають у 30мл ізопропанолу і змішують із 200мл діетилового ефіру. Після тригодинної кристалізації при кімнатній температурі відсмоктують (2,1г), а потім усі кристалізаційні фракції сушать при 60°С. Всі три фракції є ідентичними відповідно до даних тонкошарової хроматографії (елюент: суміш дихлорметану, метанолу і конц. аміаку в співвідношенні 95:5:0,1). У такий спосіб одержують 15,8г (93,2% теорії) гідрохлориду (+)-2-(3метоксифеніл)метил-3,3-диметил-4-метилен-піперидину формули 9 із температурою плавлення 199-200°С, [a]25D=+59,9° (с=1 у метанолі). 7-а стадія реакції (+)-N-фopмiл-2-(3-мeтoкcифeнiл)мeтил-3,3-димeтил-4-мeтилeн-пiпepидин формули 10 [R2=3-СН3О] 12,7г (45ммоль) гідрохлориду (+)-2-(3-метоксифеніл)метил-3,3-диметил-4-метилен-піперидину формули 9 розчиняють у 50мл води, після чого змішують із 8мл конц. аміаку. Три рази екстрагують дихлорметаном, узятим у кількості по 20мл, сушать над сульфатом магнію і розчинник відганяють у вакуумі. Залишок подають у 15 мл толуолу, упарюють, подають у 75мл толуолу і разом із 23,1г (22ммоль) н-бутилформіату нагрівають із зворотним холодильником протягом 4 годин. Потім упарюють у вакуумі з одержанням 12,2г (99,5% теорії) (+)-Nформіл-2-(3-метоксифеніл)метил-3,3-диметил-4-метилен-піперидину формули 10 у формі масла, [a]25D=+52,0° (с=1 у метанолі). 8-а стадія реакції (-)-2-форміл-3'-метокси-5,9,9-триметил-6,7-бензоморфан формули 11 [R2=3'-СН3О] 16г (120ммоль) хлориду алюмінію подають у 140мл дихлорметану при температурі -10°С. 10,9г (40ммоль) (+)-N-форміл-2-(3-метоксифеніл)метил-3,3-диметил-4-метилен-піперидину, розчиненого в 35мл дихлорметану, краплями додають до суміші так повільно, щоб температура не перевищувала -5°С (близько 45 хвилин). Залишають стояти ще 30 хвилин при 0°С, після чого суміш подають на 100г льоду й інтенсивно перемішують. Органічну фаз у відокремлюють, водну фазу два рази екстрагують дихлорметаном, узятим у кількості по 30мл, об'єднані органічні екстракти сушать і розчинник видаляють у вакуумі. У такий спосіб одержують 10,9г (99,6% теорії) (-)-2-форміл-3'-метокси-5,9,9-триметил-6,7-бензоморфану формули 11 у формі масла, [a]25D=-198,4° (с=1 у метанолі). 9-а стадія реакції (-)-3'-метокси-5,9,9-триметил-6,7-бензоморфан формули 12 [R2=3'-CH3O] 9,57г (35ммоль) (-)-2-форміл-3'-метокси-5,9,9-триметил-6,7-бензоморфану формули 11 розчиняють у 75мл н-пропанолу і разом із 25мл конц. Соляної кислоти і 14,3мл води нагрівають із зворотним холодильником протягом 14 годин. Упарюють у вакуумі, залишок подають у 50мл крижаної води і три рази екстрагують складним етиловим ефіром оцтової кислоти, узятим у кількості по 20мл (органічну фазу видаляють). Водну фазу змішують із 55мл конц. аміаку і три рази екстрагують дихлорметаном, узятим у кількості по 25мл. Об'єднані органічні екстракти сушать над сульфа том магнію і згущують у вакуумі. У такий спосіб одержують 7,9г (92% теорії) (-)-3'-метокси-5,9,9-триметил-6,7-бензоморфану формули 12 у формі масла. [a]25D=-66,0° (с=1 у метанолі). 10-а стадія реакції Гідробромід (-)-3'-гідрокси-5,9,9-триметил-6,7-бензоморфану формули 13 [R1=3'-ОН] 10г (41ммоль) (-)-3'-метокси-5,9,9-триметил-6,7-бензоморфану формули 12 змішують із 22,5мл води і 77,5мл 62%-ною бромисто-водневою кислотою і нагрівають із зворотним холодильником протягом 2 годин. Потім згущують у вакуумі і залишок перекристалізують із близько 80мл ацетону, після чого одержують 11,8г (92,8% теорії) гідроброміду (-)-3'-гідрокси-5,9,9-триметил-6,7-бензоморфану формули 13 у формі кристалів із. температурою плавлення > 290°С. [a]25D=-55,8° (с=1 у метанолі).
ДивитисяДодаткова інформація
Назва патенту англійськоюA method of preparing norbenzomorphane, an intermediate product in preparing pharmaceutically valuable benzomorphane derivatives, in particular (-)-(1r,5s,2"r)-3'-hydroxy-2-(2-methoxypropyl)-5,9,9-trimethyl-6,7-benzomorphane
Автори англійськоюGrauert Matthias
Назва патенту російськоюСпособ получения норбензоморфана, промежуточного продукта при получении фармацевтически ценных производных бензоморфана, в частности (-)-(1r,5s,2''r)-3'-гидрокси-2(2-метоксипропил)-5,9,9-триметил-6,7-бензоморфана
Автори російськоюГрауэрт Маттиас
МПК / Мітки
МПК: C07D 211/74, C07D 211/70, C07C 229/34, C07D 211/78, C07D 221/26
Мітки: похідних, одержанні, бензоморфану, фармацевтично, проміжного, цінних, норбензоморфану, спосіб, зокрема, 1r,5s,2''r)-3'-гідрокси-2(2-метоксипропіл)-5,9,9-триметил-6,7-бензоморфану, продукту, одержання
Код посилання
<a href="https://ua.patents.su/7-64699-sposib-oderzhannya-norbenzomorfanu-promizhnogo-produktu-pri-oderzhanni-farmacevtichno-cinnikh-pokhidnikh-benzomorfanu-zokrema-1r5s2r-3-gidroksi-22-metoksipropil-599-trimetil-67-ben.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання норбензоморфану, проміжного продукту при одержанні фармацевтично цінних похідних бензоморфану, зокрема (-)-(1r,5s,2”r)-3′-гідрокси-2(2-метоксипропіл)-5,9,9-триметил-6,7-бензоморфану</a>
Попередній патент: Машина для незалежного від рядків скошування кукурудзи та інших подібних стеблових культур
Наступний патент: Підводний апарат
Випадковий патент: Пневматичний висівний апарат