Спосіб гістохімічного визначення кислих мукополісахаридів в тканинах тварин за мікроскопічного дослідження
Номер патенту: 98829
Опубліковано: 12.05.2015
Автори: Яценко Іван Володимирович, Богатко Леонід Мечиславович, Сердюков Ярослав Костянтинович, Богатко Денис Леонідович, Богатко Надія Михайлівна
Формула / Реферат
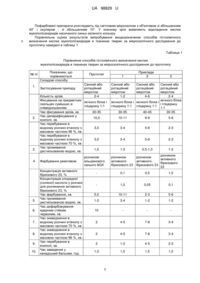
Спосіб гістохімічного визначення кислих мукополісахаридів у тканинах тварин за мікроскопічного дослідження при використанні парафінових зрізів у кількості 2-4 на санному або ротаційному мікротомі, товщиною 7-10 мкм, наклеєних на предметні скельця за допомогою суміші яєчного білка і гліцерину в співвідношенні 1:1 упродовж 30-35 хв., який відрізняється тим, що послідовно фарбують зрізи після депарафінування в ксилолі упродовж 5-6 хв., проводять через розчини етанолу упродовж 2-3 хв. з масовими частками 96 % і 70 %, з промиванням в дистильованій воді, фарбують розчином активного бірюзового 23 з масовою часткою 1 % у водному розчині хлоридної (соляної) кислоти з масовою часткою 0,1 % та промивають дистильованою водою упродовж 1-2 хв., зневоднюють в розчинах етанолу упродовж 3-4 хв. з масовими частками 70 % і 96 % та витримують у ксилолі упродовж 2-3 хв. та заводять в канадський бальзам на 1 годину з подальшим розгляданням препаратів під світловим мікроскопом із виявленням відкладень кислих мукополісахаридів насиченого синьо-зеленого кольору.
Текст
Реферат: Спосіб гістохімічного визначення кислих мукополісахаридів у тканинах тварин за мікроскопічного дослідження при використанні парафінових зрізів у кількості 2-4 на санному або ротаційному мікротомі, товщиною 7-10 мкм, наклеєних на предметні скельця за допомогою суміші яєчного білка і гліцерину в співвідношенні 1:1 упродовж 30-35 хв. Послідовно фарбують зрізи після депарафінування в ксилолі упродовж 5-6 хв. та проводять через розчини етанолу упродовж 2-3 хв. з масовими частками 96 % і 70 %. та промивають в дистильованій воді. Фарбують розчином активного бірюзового 23 з масовою часткою 1 % у водному розчині хлоридної (соляної) кислоти з масовою часткою 0,1 % та промивають дистильованою водою упродовж 1-2 хв. Зневоднюють в розчинах етанолу упродовж 3-4 хв. з масовими частками 70 % і 96 %, витримують у ксилолі упродовж 2-3 хв. та заводять в канадський бальзам на 1 годину і подальше розглядають препарати під світловим мікроскопом із виявленням відкладень кислих мукополісахаридів насиченого синьо-зеленого кольору. UA 98829 U (12) UA 98829 U UA 98829 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до сільського господарства, зокрема до ветеринарної медицини, і може бути використана для визначення кислих мукополісахаридів в тканинах тварин за мікроскопічного дослідження при морфологічній діагностиці заразних та незаразних хвороб тварин, що супроводжуються ураженням слизових оболонок, в роботі патоморфологічних відділів державних лабораторій ветеринарної медицини. За результатами цього способу можна отримати якісні показники при гістохімічному визначенні кислих мукополісахаридів в тканинах тварин за мікроскопічного дослідження. Аналогом корисної моделі є спосіб диференційованого виявлення вуглеводвмісних біополімерів (Singh, Gorton, 1989) [1], який базується на визначенні кислих мукополісахаридів за допомогою фарбування орсеїном із дофарбовуванням зрізів альціановим синім та калію перманганатом. Недоліком даного способу є те, що він громіздкий, фарба для нього складна у приготуванні та дає похибку від 25 до 50 %. Прототипом корисної моделі є спосіб визначення кислих мукополісахаридів за допомогою альціанового синього 8 GX за Стідменом [2], в якому застосовують розчини барвника, різні за значенням рН, і дофарбовують зрізи ядерним стійким червоним. Недоліком даного способу є те, що альціановий синій є досить рідкісним барвником і на даний час майже не випускається підприємствами хімічної промисловості. В основу даної корисної моделі поставлено задачу - розробити спосіб гістохімічного визначення кислих мукополісахаридів у тканинах тварин за мікроскопічного дослідження шляхом зміни часу та реактиву при послідовному фарбуванні зрізів в кількості 2-4 після депарафінування у ксилолі проведенням через розчини етанолу упродовж 2-3 хв. з масовими частками 96 % і 70 %, промиванням в дистильованій воді і доведення до води розчином активного бірюзового 23 з масовою часткою 1 % у водному розчині хлоридної (соляної) кислоти з масовою часткою 0,1 %, промиванні дистильованою водою, зневодненні в етанолах зростаючої концентрації 70 % та 96 %, витримуванні у ксилолі та заведенні в канадський бальзам на 1 годину і подальшим розгляданням препаратів під світловим мікроскопом із виявленням відкладень кислих мукополісахаридів насиченого синьо-зеленого кольору. Задача вирішується тим, що використовують парафінові зрізи з тканин тварин у кількості 24, виготовлені на санному або ротаційному мікротомі, товщиною 7-10 мкм (мікрометрів), які наклеюють на предметні скельця за допомогою суміші яєчного білка і гліцерину в співвідношенні 1:1 і витримують упродовж 30-35 хв. за кімнатної температури (20±2 °C) і, використовуючи хімічний посуд з відповідними реактивами, послідовно фарбують отримані препарати: - депарафінують препарати в ксилолі упродовж 5-6 хв.; - переносять препарати у водний розчин етанолу з масовою часткою 96 % на 2-3 хв.; - переносять препарати у водний розчин етанолу з масовою часткою 70 % на 2-3 хв.; - промивають препарати у дистильованій воді упродовж 1-2 хв.; - фарбують препарати розчином активного бірюзового 23 з масовою часткою 1 % у водному розчині хлоридної (соляної) кислоти з масовою часткою 0,1 % упродовж 5-6 хв.; - промивають препарати у дистильованій воді упродовж 1-2 хв.; - зневоднюють препарати у водному розчині етанолу з масовою часткою 70 % упродовж 3-4 хв.; - зневоднюють препарати у водному розчині етанолу з масовою часткою 96 % упродовж 3-4 хв.; - переносять препарати в ксилол на 2-3 хв.; - заводять препарати в канадський бальзам: на поверхню зрізів наносять 1 краплю канадського бальзаму, зверху кладуть покривне скельце і притискають його вантажем на 1 год. Пофарбовані препарати розглядають під світловим мікроскопом з об'єктивом зі збільшенням х х 40 і окуляром - зі збільшенням 10 . У кожному зрізі виявляють відкладення кислих мукополісахаридів насиченого синьо-зеленого кольору. Етапи вирішення даної задачі наведено у нижчезазначених прикладах. Приклад 1. З проби тканин тварин виготовляють парафінові зрізи у кількості 1-2 на санному або ротаційному мікротомі, товщиною 7-10 мкм (мікрометрів), які наклеюють на предметні скельця за допомогою суміші яєчного білка і гліцерину в співвідношенні 1:1 і витримують упродовж 30-35 хв. за кімнатної температури (20±2 °C) і, використовуючи хімічний посуд з відповідними реактивами, послідовно фарбують отримані препарати: - депарафінують препарати в ксилолі упродовж 10-11 хв.; - переносять препарати у водний розчин етанолу з масовою часткою 96 % на 3-4 хв.; - переносять препарати у водний розчин етанолу з масовою часткою 70 % на 3-4 хв.; 1 UA 98829 U 5 10 15 20 25 30 35 40 45 50 55 - промивають препарати у дистильованій воді упродовж 1-2 хв.; - фарбують препарати розчином активного бірюзового 23 з масовою часткою 0,1 % у водному розчині хлоридної (соляної) кислоти з масовою часткою 1 % упродовж 10-11 хв.; - промивають препарати у дистильованій воді упродовж 3-4 хв.; - зневоднюють препарати у водному розчині етанолу з масовою часткою 70 % упродовж 4-5 хв.; - зневоднюють препарати у водному розчині етанолу з масовою часткою 96 % упродовж 4-5 хв.; - переносять препарати в ксилол на 1-2 хв.; - заводять препарати в канадський бальзам: на поверхню зрізів наносять 1 краплю канадського бальзаму, зверху кладуть покривне скельце і притискають його вантажем на 1 год. Пофарбовані препарати розглядають під світловим мікроскопом з об'єктивом зі збільшенням х х 40 і окуляром - зі збільшенням 10 . У кожному зрізі виявляють відкладення кислих мукополісахаридів блідо-синьо-зеленого кольору. Приклад 2. З проби тканин тварин виготовляють парафінові зрізи у кількості 4-6 на санному або ротаційному мікротомі, товщиною 7-10 мкм (мікрометрів), які наклеюють на предметні скельця за допомогою суміші яєчного білка і гліцерину в співвідношенні 1:1 і витримують упродовж 40-45 хв. за кімнатної температури (20±2 °C) і, використовуючи хімічний посуд з відповідними реактивами, послідовно фарбують отримані препарати: - депарафінують препарати в ксилолі упродовж 8-9 хв.; - переносять препарати у водний розчин етанолу з масовою часткою 96 % на 5-6 хв.; - переносять препарати у водний розчин етанолу з масовою часткою 70 % на 5-6 хв.; - промивають препарати у дистильованій воді упродовж -0,5-1 хв.; - фарбують препарати розчином активного бірюзового 23 з масовою часткою 0,5 % у водному розчині хлоридної (соляної) кислоти з масовою часткою 0,05 % упродовж 2-3 хв.; - промивають препарати у дистильованій воді упродовж 1-2 хв.; - зневоднюють препарати у водному розчині етанолу з масовою часткою 70 % упродовж 7-8 хв.; - зневоднюють препарати у водному розчині етанолу з масовою часткою 96 % упродовж 7-8 хв.; - переносять препарати в ксилол на 4-5 хв.; - заводять препарати в канадський бальзам: на поверхню зрізів наносять 1 краплю канадського бальзаму, зверху кладуть покривне скельце і притискають його вантажем на 1,5 години. Пофарбовані препарати розглядають під світловим мікроскопом з об'єктивом зі збільшенням х х 40 і окуляром - зі збільшенням 10 . У кожному зрізі виявляють відкладення кислих мукополісахаридів блідо-синьо-зеленого кольору. Приклад 3. З проби тканин тварин виготовляють парафінові зрізи у кількості 2-4 на санному або ротаційному мікротомі, товщиною 7-10 мкм (мікрометрів), які наклеюють на предметні скельця за допомогою суміші яєчного білка і гліцерину в співвідношенні 1:1 і витримують упродовж 30-35 хв. за кімнатної температури (20±2 °C) і, використовуючи хімічний посуд з відповідними реактивами, послідовно фарбують отримані препарати: - депарафінують препарати в ксилолі упродовж 5-6 хв.; - переносять препарати у водний розчин етанолу з масовою часткою 96 % на 2-3 хв.; - переносять препарати у водний розчин етанолу з масовою часткою 70 % на 2-3 хв.; - промивають препарати у дистильованій воді упродовж 1-2 хв.; - фарбують препарати розчином активного бірюзового 23 з масовою часткою 1 % у водному розчині хлоридної (соляної) кислоти з масовою часткою 0,1 % упродовж 5-6 хв.; - промивають препарати у дистильованій воді упродовж 1-2 хв.; - зневоднюють препарати у водному розчині етанолу з масовою часткою 70 % упродовж 3-4 хв.; - зневоднюють препарати у водному розчині етанолу з масовою часткою 96 % упродовж 3-4 хв.; - переносять препарати в ксилол на 2-3 хв.; - заводять препарати в канадський бальзам: на поверхню зрізів наносять 1 краплю канадського бальзаму, зверху кладуть покривне скельце і притискають його вантажем на 1 год. 2 UA 98829 U 5 Пофарбовані препарати розглядають під світловим мікроскопом з об'єктивом зі збільшенням х х 40 і окуляром - зі збільшенням 10 . У кожному зрізі виявляють відкладення кислих мукополісахаридів насиченого синьо-зеленого кольору. Порівняльна оцінка результатів випробування вищезазначених способів гістохімічного визначення кислих мукополісахаридів в тканинах тварин за мікроскопічного дослідження до прототипу наведені в таблиці 1. Таблиця 1 Порівняння способів гістохімічного визначення кислих мукополісахаридів в тканинах тварин за мікроскопічного дослідження до прототипу № п/ 1. 2. 3. 4 5. 6. 7. 8. 9. 10. Показники, що порівнюються Складові способу: Застосування приладу Прототип 1 Санний або ротаційний мікротом 2-4 Кількість зрізів Фіксування на предметних яєчного білка і скельцях сумішшю зі гліцерину 1:1 співвідношенням Час фіксування зрізів, хв. 30-35 Час депарафінування у 10,0 ксилолі, хв. Час перебування в водному розчині етанолу з 3,0 масовою часткою 96 %, хв. Час перебування в водному розчині етанолу з 3,0 масовою часткою 70 %, хв. Час промивання 1,0 дистильованою водою, хв. Фарбування реактивом Концентрація активного бірюзового 23, % Концентрація хлоридної (соляної) кислоти у розчині для розчинення активного бірюзового 23, % Час фарбування, хв. Час промивання дистильованою водою, хв. Час дофарбовування ядерним стійким червоним, хв. Час зневоднення в водному розчині етанолу з масовою часткою 70 %, хв. Час зневоднення в водному розчині етанолу з масовою часткою 96 %, хв. Час перебування в ксилолі, хв. Час заведення у канадський бальзам, год. розчином альціанового синього 8GX Санний або ротаційний мікротом 1-2 Приклади 2 3 Санний або ротаційний мікротом 4-6 Санний або ротаційний мікротом 2-4 яєчного білка яєчного білка і яєчного білка і і гліцерину гліцерину 1:1 гліцерину 1:1 1:1 30-35 40-45 30-35 10-11 8-9 5-6 3-4 5-6 2-3 3-4 5-6 2-3 1-2 0,5-1,0 1-2 розчином розчином розчином активного активного активного бірюзового бірюзового 23 бірюзового 23 23 0,1 0,5 1,0 1,0 0,05 0,1 5,0 10-11 2-3 5-6 1-2 3-4 1-2 1-2 10 2 4-5 7-8 3-4 2 4-5 7-8 3-4 2 1-2 4-5 2-3 1,0 1,0 1,5 1,0 3 UA 98829 U Продовження Таблиці 1 х 11. 12. 13. 14. 15. 16. 5 10 збільшення 40 ; збільшення х Мікроскопія препаратів під окуляр зі 40 ; окуляр зі світловим мікроскопом збільшенням збільшенням х х 10 10 Інтенсивність кольору блідо-синьовідкладень кислих помірно синій зелений мукополісахаридів Швидкість визначення 97 хв. 89 хв. досліду, хв. Стабільність показників по гістохімічному визначенню кислих мукополісахаридів 72,2 86,7 за мікроскопічного дослідження, % % співвідношення результатів гістохімічних досліджень до виявлення 78,0-82,5 80,8-83,6 загального білка в тканинах тварин % співвідношення результатів гістохімічних досліджень до виявлення 81,6-84,3 83,4-85,3 глікогену в тканинах тварин збільшення х 40 ; окуляр зі збільшенням х 10 блідо-синьозелений збільшення х 40 ; окуляр зі збільшенням х 10 Насичений синьозелений 2 год. 25 хв. 84 хв. 85,9 98,2 83,7-86,5 89,5-92,3 84,8-87,5 92,3-95,6 Дані таблиці 1 свідчать, що більш достовірні дані, порівняно із результатами гістохімічних досліджень до виявлення загального білка в тканинах тварин - у 89,5-92,3 % [3] та до результатів гістохімічних досліджень до виявлення глікогену в тканинах тварин - у 92,3-95,6 % [4, 5], були отримані при застосуванні методу за прикладом № 3. Також найвища стабільність показників по гістохімічному визначенню кислих мукополісахаридів у тканинах тварин за мікроскопічним дослідженням була за прикладом № 3-98,2 %. Використовуючи метод за прикладом № 3, ми провели гістохімічне визначення кислих мукополісахаридів в тканинах тварин на 25 пробах, узятих з різних органів різних видів тварин: шлунок (фундальна частина) - 7 проб; порожня кишка - 6 проб; ободова кишка - 5 проб; трахея 5 проб; матка - 5 проб. Попередньо проби з цих же органів були досліджені на виявлення загального білка та глікогену гістохімічними методами. Результати наведені в таблиці 2. Таблиця 2 Показники гістохімічних методів визначення якості тканин тварин й визначення кислих мукополісахаридів за мікроскопічного дослідження за прикладом № 3 Гістохімічні дослідження тканин тварин Виявлення кислих №/ № Види тканин тварин Виявлення Виявлення мукополісахаридів за загального білка глікогену прикладом №3 Шлунок, фундальна частина, Утворення Утворення Утворення забарвлення 1. n=5 забарвлення забарвлення відкладень кислих мукочервонуваточервоного полісахаридів 2. Порожня кишка, n=5 оранжевого кольору насиченого синьо3. Ободова кишка, n=5 кольору зеленого кольору 4. Трахея, n=5 5. Матка, n=5 15 Проведеними дослідженнями встановлено, що при фарбуванні препаратів тканин тварин за розробленим способом на пофарбованих препаратах, які розглядали під світловим мікроскопом х х з об'єктивом зі збільшенням 40 і окуляром зі збільшенням 10 , виявляли відкладення кислих мукополісахаридів насиченого синьо-зеленого кольору. 4 UA 98829 U 5 10 15 20 25 30 35 Ці дані були стабільними та достовірними, отже, ці показники можна використовувати при мікроскопічній діагностиці патологічних процесів на слизових оболонках. Крім цього, слід зазначити, що спосіб є простим у виконанні, менш тривалим у часі порівняно із прототипом, а його результати дають конкретні якісні показники по інтенсивності фарбування відкладень кислих мукополісахаридів у насичений синьо-зелений колір. Метод за прикладом № 3 нами пропонується як якісний спосіб гістохімічного визначення кислих мукополісахаридів в тканинах тварин за мікроскопічного дослідження поряд з іншими методами гістохімічного дослідження тканин тварин [5]. Метод має перевагу перед існуючими методами гістохімічного дослідження тканин тварин в тому, що результати мають достовірні показники по інтенсивності забарвлення. Джерела інформації: 1. Омеляненко М.М. Основи патогістологічних досліджень: Методичні вказівки для студентів та лікарів ветеринарної медицини / М.М. Омеляненко, Л.М. Потоцька. - К., 2013. - 137 с. 2. Горальський Л.П. Основи гістологічної техніки і морфофункціональні методи досліджень в нормі та при патології / Л.П. Горальський, В.Т. Хомич, О.І. Кононський. - Житомир: Полісся, 2005. - 288 с. 3. Меркулов Г.А. Курс патологогистологической техники /Г.А. Меркулов. -Л.: Медицина, 1979. -423 с. 4. Шабадаш А.Л. Рациональная методика гистохимического обнаружения гликогена и ее теоретическое обоснование /А.Л. Шабадаш // Изв. АН СССР. Серия биологических наук. - 1947.№ 6. - С. 745-760. 5. Лилли Р. Патогистологическая техника и практическая гистохимия /Р. Лилли. -М.: Мир, 1969. -423 с. ФОРМУЛА КОРИСНОЇ МОДЕЛІ Спосіб гістохімічного визначення кислих мукополісахаридів у тканинах тварин за мікроскопічного дослідження при використанні парафінових зрізів у кількості 2-4 на санному або ротаційному мікротомі, товщиною 7-10 мкм, наклеєних на предметні скельця за допомогою суміші яєчного білка і гліцерину в співвідношенні 1:1 упродовж 30-35 хв., який відрізняється тим, що послідовно фарбують зрізи після депарафінування в ксилолі упродовж 5-6 хв., проводять через розчини етанолу упродовж 2-3 хв. з масовими частками 96 % і 70 %, з промиванням в дистильованій воді, фарбують розчином активного бірюзового 23 з масовою часткою 1 % у водному розчині хлоридної (соляної) кислоти з масовою часткою 0,1 % та промивають дистильованою водою упродовж 1-2 хв., зневоднюють в розчинах етанолу упродовж 3-4 хв. з масовими частками 70 % і 96 % та витримують у ксилолі упродовж 2-3 хв. та заводять в канадський бальзам на 1 годину з подальшим розгляданням препаратів під світловим мікроскопом із виявленням відкладень кислих мукополісахаридів насиченого синьозеленого кольору. 40 Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Автори англійськоюBohatko Nadia Mykhailivna, Yatsenko Ivan Volodymyrovych, Bohatko Leonid Mechyslavovych, Bohatko Denys Leonidovych
Автори російськоюБогатко Надежда Михайловна, Яценко Иван Владимирович, Богатко Леонид Мечиславович, Богатко Денис Леонидович
МПК / Мітки
МПК: G01N 33/12
Мітки: визначення, тканинах, тварин, гістохімічного, мікроскопічного, мукополісахарідів, спосіб, кислих, дослідження
Код посилання
<a href="https://ua.patents.su/7-98829-sposib-gistokhimichnogo-viznachennya-kislikh-mukopolisakharidiv-v-tkaninakh-tvarin-za-mikroskopichnogo-doslidzhennya.html" target="_blank" rel="follow" title="База патентів України">Спосіб гістохімічного визначення кислих мукополісахаридів в тканинах тварин за мікроскопічного дослідження</a>
Попередній патент: Спосіб гістохімічного визначення жирних кислот в м’ясі та м’ясопродуктах за мікроскопічного дослідження
Наступний патент: Ємність для напоїв
Випадковий патент: Спосіб анодного рафінування свинцю і вісмуту від домішок сурми, олова та миш'яку з одночасним одержанням сурми у металевому стані