(4,4-дифторбутен-3-ілтіо) заміщені гетероциклічні або карбоциклічні похідні, що мають пестицидну активність, спосіб їх одержання, сільськогосподарська композиція, спосіб її одержання та спосіб знищення або приг
Номер патенту: 44732
Опубліковано: 15.03.2002
Автори: Годфрей Крістофер Річард Ейлз, Сміт Елісон Мері, Бансал Харджіндер Сінгх, Сілларс Нен Кетрін, Фітцджон Стівен, Тенбулл Майкл Драйсдейл, Селмон Роджер, Хотсон Метью Брайан, Даулінг Алан Джон
Формула / Реферат
1.Соединение формулы (I) R-S(О)nСН2СН2СН=СF2 или его соль, где n равно 0, 1 или 2, и R является группой (ІІ)-(ХХІ),
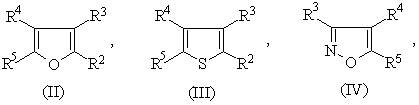
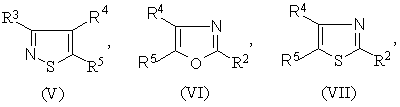
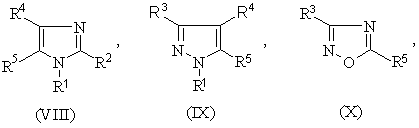
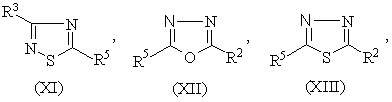
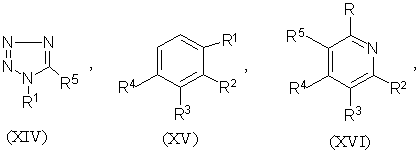
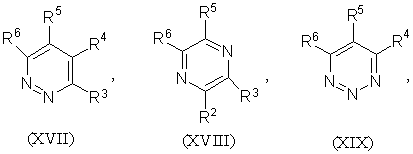
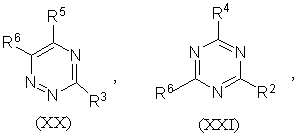
где:
-S(O)nCH2CH2CH=CF2 группа является, по крайней мере, одной из R1 (когда он присоединен к атому углерода), R2, R3, R4, R5 или R6;
R1 (когда он присоединен к атому углерода), R2, R3, R4, R5 и R6, каждый, независимо, обозначают водород, необязательно замещенный алкил, необязательно замещенный алкенил, алкинил, циклоалкил, алкилциклоалкил, алкокси, алкенилокси, алкинилокси, гидроксиалкил, алкоксиалкил, необязательно замещенный арил, необязательно замещенный арилалкил, необязательно замещенный гетероарил, необязательно замещенный гетероарилалкил, необязательно замещенный арилокси, необязательно замещенный арилалкокси, необязательно замещенный арилоксиалкил, необязательно замещенный гетероарилокси, необязательно замещенный гетероарилалкокси, необязательно замещенный гетероарилоксиалкил, галогеналкил, галогеналкенил, галогеналкинил, галогеналкокси, галогеналкенилокси, галогеналкинилокси, галоген, гидрокси, циано, нитро, -NR7R8, -NR7COR8, -NR7CSR8, -NR7SO2R8, -N(SO2R7)(SO2R8), -СОR7, -СОNR7R8, -алкилCONR7R8, -CR7NR8, -СООR7, -ОСОR7, -SR7, -SОR7, -SO2R7, -алкилSR7, -алкилSОR7, -алкилSО2R7, -ОSО2R7, -SО2NR7R8, -СSNR7R8, -SiR7R8R9, -ОСН2СO2R7, -ОСН2СН2СO2R7, -СОNR7SO2R8, -алкилСОNR7SO2R8, -NНСОNR7R8, -NНСSNR7R8 или пара соседних R1, R2, R3, R4, R5 и R6, взятых вместе, образует конденсированное 5- или 6-членное карбоциклическое или гетероциклическое кольцо;
R1 (когда он присоединен к атому азота) обозначает водород, необязательно замещенный алкил, циклоалкил, алкилциклоалкил, гидроксиалкил, алкоксиалкил, необязательно замещенный арил, необязательно замешенный арилалкил, необязательно замещенный арилоксиалкил, необязательно замещенный гетероарил, необязательно замещенный гетероарилалкил, необязательно замещенный гетероарилоксиалкил, галогеналкил, гидрокси, циано, нитро, -NR7R8, -NR7COR8, -NR7CSR8, -NR7COOR8, -NR7SO2R8, -N(SO2R7)(SO2R8), -СОR7, -СОNR7R8, -алкилCONR7R8, -CR7NR8, -СООR7, -ОСОR7, -SОR7, -SO2R7, -алкилSR7, -алкилSОR7, -алкилSО2R7, -ОSО2R7, -SО2NR7R8, -SR7, -СSNR7R8, -SiR7R8R7, -ОСН2СO2R7, -ОСН2СН2СO2R7, -СОNR7SO2R8, -алкилСОNR7SO2R8, -NНСОNR7R8, -NНСSNR7R8 и
R7, R8 и R9, каждый, независимо, обозначают водород, необязательно замещенный алкил, необязательно замещенный алкенил, алкинил, необязательно замещенный арил или необязательно замещенный арилалкил, галогеналкил, галогеналкенил, галогеналкинил, галоген или гидрокси.
2. Соединение по п.1, где:
-S(O)nCH2CH2CH=CF2 группа является, по крайней мере, одной из R1 (когда он присоединен к атому углерода), R2, R3, R4, R5 или R6;
R1 (когда он присоединен к атому углерода), R2, R3, R4, R5 или R6, каждый, независимо, обозначают водород, необязательно замещенный С1-C6алкил, необязательно замещенный С2-C6алкенил, необязательно замещенныйС2-C6алкинил, С3-C6циклоалкил, С4-C7алкилциклоалкил, С1-C6алкокси, С2-C6алкенилокси, С2-C6алкинилокси, С1-C6гидроксиалкил, С2-C6моноалкоксиалкил, С3-C6диалкоксиалкил, необязательно замещенный С6-C10арил, необязательно замещенная группа С6-C10арил-С1-C2алкил, необязательно замещенный 5- или 6-членный гетероарил, необязательно замещенный 5- или 6-членный гетероарил-С1-C6алкил, необязательно замещенный С6-C10арилокси, необязательно замещенный С6-C10арил-С1-C2алкокси, С6-C10арилокси-С1-C6алкил, необязательно замещенный 5- или 6-членный гетероарилокси, необязательно замещенный 5- или 6-членный гетероарил-С1-C6алкокси, 5- или 6-членный гетероарилокси-С1-C2алкил, С1-C6галогеналкил, С2-C6галогеналкенил, С2-C6галогеналкинил, С1-C6галогеналкокси, С2-C6галогеналкенилокси, С2-C6галогеналкинилокси, галоген, гидрокси, циано, нитро, -NR7R8, -NR7COR8, -NR7CSR8, -NR7SO2R8, -N(SO2R7)(SO2R8), -СОR7, -СОNR7R8, -C1-C6алкилCONR7R8, -CR7NR8, -СООR7, -ОСОR7, -SR7, -SОR7, -SO2R7, -C1-C6алкилSR7, -C1-C6алкилSОR7, -C1-C6алкилSО2R7, -ОSО2R7, -SО2NR7R8, -СSNR7R8, -SiR7R8R9, -ОСН2СO2R7, -ОСН2СН2СO2R7, -СОNR7SO2R8, -C1-C6алкилСОNR7SO2R8, -NНСОNR7R8, -NНСSNR7R8 или пара соседних R1, R2, R3 и R4, взятых вместе, образует конденсированное 5- или 6-членное карбоциклическое или гетероциклическое кольцо;
R1 (когда он присоединен к атому азота) обозначает водород, необязательно замещенный С1-C6алкил, С3-C6циклоалкил, С4-C6алкилциклоалкил, С1-C6гидроксиалкил, С2-C6моноалкоксиалкил, С3-C6диалкоксиалкил, необязательно замещенный С6-C10арил, необязательно замещенный С6-C10арил-С1-C2алкил, необязательно замещенный С6-C10арилокси-С1-C6алкил, необязательно замещенный 5- или 6-членный гетероарил, необязательно замещенный 5- или 6-членный гетероарил-С1-C2-алкил, необязательно замещенный 5- или 6-членный гетероарилокси-С1-C2-алкил, С1-C6-галогеналкил, гидрокси, циано, нитро, -СОNR7R8, -C1-C6алкилCONR7R8, -NНСОNR7R8, -NНСSNR7R8, -NR7R8, -NR7COR8, -NR7CSR8, -NR7COOR8, NR7SO2R8, -N(SO2R7)(SO2R8), -СОR7, -СООR7, -ОСОR7, -ОSО2R7, -SО2NR7R8, -SO2R7, -SOR7, -СSNR7R8, -SiR7R8R7, -ОСН2СO2R7, -ОСН2СН2СO2R7, -СОNR7SO2R8 или -C1-C6алкилСОNR7SO2R8; и
R7, R8 и R9, каждый, независимо, обозначают водород, необязательно замещенный С1-C6алкил, необязательно замещенный С2-C6алкенил, С2-C6алкинил, С1-C6галогеналкил, С2-C6галогеналкенил, С2-C6галогеналкинил, необязательно замещенный С4-C6арил или необязательно замещенный С4-C6арил-С1-C6алкил, галоген или гидрокси.
3. Соединение по п.2, где любой из R1–R6 обозначают:
-замещенный алкил, или содержит замещенный алкильный фрагмент, который содержит один или несколько заместителей, выбранных из галогена, нитро, циано, -СООR7 или его соли, гидрокси, алкокси, алкоксимино, алкоксикарбонила, карбамоила, моно- или диалкилкарбамоила, амино, моно- или диалкиламино, ациламидо, алкансульфонила и арилсульфонила;
-замещенный алкенил, или содержит замещенный алкенильный фрагмент, который содержит один или несколько заместителей, выбранных из галогена, -СООR7 или его соли, гидрокси, нитро и циано;
-замещенный арил или гетероарил, или содержит замещенный арильный или гетероарильный фрагмент, который содержит один или несколько заместителей, выбранных из алкила, алкокси, галогеналкила, галогена, гидрокси, СООR7 или его соли, аминосульфонила, циано и нитро.
4. Соединение по п.2 или 3, где когда какой-либо из R1–R6 обозначает -SR7, он предпочтительно является необязательно замещенным С1-C6алкилтио, С2-C6алкенилтио, С2-C6алкинилтио, С1-C6галогеналкил, С2-C6галогеналкенилтио, С2-C6галогеналкинилтио или С6-C10арилтио.
5. Соединение по п. 1, где:
по крайней мере, один из R1 (когда он присоединен к атому углерода) является -S(O)nCH2CH2CH=CF2 группой;
R1 (когда он присоединен к атому углерода)- R6, каждый, независимо, обозначают водород, нитро, галоген, циано, -СН=NОН, С1-C4алкил, С1-C4галогеналкил, С1-C4алкенил, С1-C4галогеналкенил, циклопропил, гидрокси, С1-C4алкокси, С2-C4алкоксиалкил, -СООН, С2-C4алкоксикарбонил, С2-C4галогеналкенилоксикарбонил, -СОNH2, моно или ди-С1-C2алкиламинокарбонил, С2-C4алканкарбонил, фенил, необязательно моно- или дизамещенный группами, независимо выбранными из галогена, нитро, С1-C4алкила, С1-C4алкокси или аминосульфонила, -СОNHSO2-С1-C4алкил, бензил, необязательно моно- или дизамещенный группами, независимо выбранными из галогена, нитро, С1-C4алкила или С1-C4алкокси, фенокси, необязательно моно- или дизамещенный группами, независимо выбранными из галогена, циано, С1-C4алкила или С1-C4алкокси, амино, необязательно моно- или дизамещенный группами С1-C4алкил, -SН, С1-C4алкилтио, бензилтио, необязательно моно- или дизамещенный группами, независимо выбранными из галогена или С1-C4галогеналкила, С1-C4алкенилтио, С2-C4галогеналкенилтио, вторичная S(О)nСН2СН2СН=СF2 группа, С1-C4алкансульфонил, С1-C4галогеналкансульфонил, фторсульфонил, моно- или ди-С1-C4алкилсульфамоил, 5- или 6-членная гетероарильная группа, необязательно замещенная галогеном, или любая соседняя пара образует конденсированное 5- или 6-членное карбоциклическое или гетероциклическое кольцо; и
R1 (когда он присоединен к атому азота) обозначают водород, нитро, циано, -СН=NОН, С1-C4алкил, С1-C4галогеналкил, циклопропил, гидрокси, -СООН, С2-C4алкоксикарбонил, С2-C4галогеналкенилоксикарбонил, -СОNН2, моно или ди-С1-C2алкиламинокарбонил, С2-C4алканкарбонил, фенил, необязательно моно- или дизамещенный группами, независимо выбранными из галогена, нитро, С1-C4алкила, С1-C4алкокси или аминосульфонила; -СОNНSO2-С1-C4алкил, бензил, необязательно моно- или ди- замещенный группами, независимо выбранными из галогена, нитро, С1-C4алкила или С1-C4алкокси, фенокси, необязательно моно- или дизамещенный группами, независимо выбранными из галогена, циано, С1-C4алкила или С1-C4алкокси, амино, необязательно моно- или дизамещенный группами С1-C4алкил, -SН, С1-C4алкилтио, бензилтио, необязательно моно- или дизамещенный группами, независимо выбранными из галогена или С1-C4галогеналкила, С1-C4алкенилтио, С2-C4галогеналкенилтио, С1-C4алкансульфонил, С1-C4галогеналкансульфонил, фторсульфонил, моно- или ди-C1-C4алкилсульфамоил, 5- или 6-членная гетероарильная группа, необязательно замещенная гaлогеном.
6. Способ получения соединения, указанного в любом из пп.1-3, включающий взаимодействие соединения формулы
R-Х
с соединением формулы
СF2=СНСН2СН2Y,
где R такой, как указан в любом из пп.1-3, X и Y обозначают группы SН или L, при условии, что X и Y не могут быть одинаковыми, и L является легко удаляемой группой, с получением соединения формулы (I), где n=0, и, если желательно, последующее окисление указанного соединения с получением соединения формулы (I), где n=1 или 2.
7. Способ по п.6, где n равно 0, включающий взаимодействие соединения формулы (XXIII)
R-SН (XXIII)
с соединением формулы (XXIV)
СF2=СНСН2СН2L ,(XXIV)
где R такой, как указан в любом из пп.1-3, и L является легко удаляемой группой.
8. Способ по п.6, где n равно 0, включающий взаимодействие соединения формулы (XXVII)
R-L (XXVII)
с соединением формулы (XXVIII)
СF2=СНСН2СН2SН ,(XXVIII)
где R такой, как указан в любом из пп.1-3, и L является легко удаляемой группой.
9. Способ по п.7 или 8, где n равно 1 или 2, который включает окисление соответствующим образом замещенного соединения формулы (І), где n равно 0.
10. Сельскохозяйственная композиция, содержащая эффективное количество соединения, указанного в любом из пп.1-3, в качестве активного ингредиента, в смеси с сельскохозяйственно приемлемым разбавителем или носителем.
11. Сельскохозяйственная композиция по п.10, дополнительно содержащая поверхностно-активное вещество.
12. Сельскохозяйственная композиция по любому из п.10 и 11, дополнительно содержащая, по меньшей мере, другой активный ингредиент, который является инсектицидом, фунгицидом, бактерицидом, акарицидом или другим биологически активным соединением.
13. Способ получения сельскохозяйственной композиции, указанной в любом из пп.10-12, включающий смешивание соединения, указанного в любом из пп.1-3 и сельскохозяйственно приемлемого разбавителя или носителя.
14. Способ уничтожения или подавления нематод, вредных насекомых или клещей, включающий нанесение соединения, указанного в любом из пп.1-3, или композиции по любому из пп.10-12 на паразиты, их место обитания или растение, подвергшееся нападению паразитов.
Текст
1 Соединение формулы (І) RS(O)nCH2CH2CH=CF2 или его соль, где п равно 0, 1 или 2, и R является группой (II)-(XXI), R3 О го (XXI) где -S(O)nCH2CH2CH=CF2 группа является, по крайней мере, одной из Ri (когда он присоединен к атому углерода), R2, R3, R4, Rs или R6, Ri (когда он присоединен к атому углерода), R2, 44732 5- или 6-членный гетероарил, необязательно заF?3, R4, R5 и F?6, каждый, независимо, обозначают мещенный 5- или 6-членный гетероарил-Сг водород, необязательно замещенный алкил, неСбалкил, необязательно замещенный Сєобязательно замещенный алкенил, алкинил, цикСюарилокси, необязательно замещенный Сєлоалкил, алкилциклоалкил, алкокси, алкенилокси, Сюарил-СгС2алкокси, Сб-Сюарилокси-СгСбалкил, алкинилокси, гидроксиалкил, алкоксиалкил, необянеобязательно замещенный 5- или 6-членный гезательно замещенный арил, необязательно затероарилокси, необязательно замещенный 5- или мещенный арилалкил, необязательно замещен6-членный гетероарил-Сі-Сбалкокси, 5- или 6ный гетероарил, необязательно замещенный членный гетероарилокси-Сі-Сгалкил, Сг гетероарилалкил, необязательно замещенный арилокси, необязательно замещенный арилалкокСб гал о ге нал кил, СгСєгалогеналкенил, С2си, необязательно замещенный арилоксиалкил, Сєгалогеналкинил, Сі-Сєгалогеналкокси, С2необязательно замещенный гетероарилокси, неСєгалогеналкенилокси, СгСбГалогеналкинилокси, обязательно замещенный гетероарилалкокси, негалоген, гидрокси, циано, нитро, -NR7R8, обязательно замещенный гетероарилоксиалкил, NR7COR8, -NR7CSR8, -NR7SO2R8, галогеналкил, галогеналкенил, галогеналкинил, N(SO2R7)(SO2R8), -COR?, -CONR7R8, -С1галогеналкокси, галогеналкенилокси, галогеналкиC6anKm-iCONR7R8, -CR7NR8, -COOR7, -OCOR7, нилокси, галоген, гидрокси, циано, нитро, -NR7R8, SR7, -SOR?, -SO2R7, -Ci-C6anKHnSR7, -Cr NR7COR8, -NR7CSR8, -NR7SO2R8, C6anKm-iSOR7, -Ci-C6anKHnSO2R7, -OSO2R7, SO2NR7R8, -CSNR7R8, -SiR7R8R9, -OCH2CO2R7, N(SO2R7)(SO2R8), -COR?, -CONR7R8, OCH2CH2CO2R7, -CONR7SO2R8, -C1anKHnCONR7R8, -CR7NR8, -COOR7, -OCOR7, -SR7, SOR7, -SO2R7, -anKHnSR?, -anKHnSOR?, C6anKHnCONR7SO2R8, -NHCONR7R8, -NHCSNR7R8 anKnnSO2R7, -OSO2R7, -SO2NR7R8, -CSNR7R8, или пара соседних Ri, R2, R3 и R4, взятых вместе, SiR7R8R9, -OCH2CO2R7, -OCH2CH2CO2R7, образует конденсированное 5- или 6-членное карCONR7SO2R8, -anKHnCONR7SO2R8, -NHCONR7R8, боциклическое или гетероциклическое кольцо, NHCSNR7R8 или пара соседних Ri, R2, R3, R4, R5 и Ri (когда он присоединен к атому азота) обознаR6, взятых вместе, образует конденсированное 5чает водород, необязательно замещенный С г или 6-членное карбоциклическое или гетероцикСбалкил, Сз-СбЦиклоалкил, С4-Сбалкилциклоалкил, лическое кольцо, Сі-Сєгидроксиалкил, СгСємоноалкоксиалкил, СзСбДиалкоксиалкил, необязательно замещенный Ri (когда он присоединен к атому азота) обознаСб-Сюарил, необязательно замещенный Сєчает водород, необязательно замещенный алкил, Сюарил-СгС 2 алкил, необязательно замещенный циклоалкил, алкилциклоалкил, гидроксиалкил, Сб-Сюарилокси-СгСбалкил, необязательно замеалкоксиалкил, необязательно замещенный арил, щенный 5- или 6-членный гетероарил, необязанеобязательно замешенный арилалкил, необязательно замещенный 5- или 6-членный гетероарилтельно замещенный арилоксиалкил, необязательСгСг-алкил, необязательно замещенный 5- или 6но замещенный гетероарил, необязательно замечленный гетероарилокси-Сі-Сг-алкил, Сі-Сєщенный гетероарилалкил, необязательно галогеналкил, гидрокси, циано, нитро, -CONR7R8, замещенный гетероарилоксиалкил, галогеналкил, Ci-C6anKHnCONR7R8, -NHCONR7R8, -NHCSNR7R8, гидрокси, циано, нитро, -NR7R8, -NR7COR8, NR7R8, -NR7COR8, -NR7CSR8, -NR7COOR8, NR7CSR8, -NR7COOR8 -NR7SO2R8, NR7SO2R8, -N(SO2R7)(SO2R8), -COR?, -COOR?, N(SO2R7)(SO2R8), -COR?, -CONR7R8, OCOR?, -OSO2R7, -SO2NR7R8, -SO2R7, -SOR?, anKHnCONR7R8, -CR7NR8, -COOR?, -OCOR?, -SOR7, CSNR7R8, -SiR7R8R7, -OCH2CO2R7, -SO2R7, -anKHnSR?, -anKHnSOR?, -anKnnSO2R7, OSO2R7, -SO2NR7R8, -SR7 -CSNR7R8, -SiR7R8R7, OCH2CH2CO2R7, -CONR7SO2R8 или -CiOCH2CO2R7, -OCH2CH2CO2R7, -CONR7SO2R8, C6anKHnCONR7SO2R8, и anKHnCONR7SO2R8, -NHCONR7R8, -NHCSNR7R8 и R7, Rs и Rg, каждый, независимо, обозначают воR7, Rs и Rg, каждый, независимо, обозначают водород, необязательно замещенный Сі-Сєалкил, дород, необязательно замещенный алкил, необянеобязательно замещенный Сг-Сєалкенил, С2зательно замещенный алкенил, алкинил, необязаСбалкинил, Ci-Сбгалогеналкил, С2тельно замещенный арил или необязательно Сбгалогеналкенил, С2-Сєгалогеналкинил, необязазамещенный арилалкил, галогеналкил, галогеналтельно замещенный С4-Сбарил или необязательно кенил, галогеналкинил, галоген или гидрокси замещенный С4-Сбарил-Сі-Сєалкил, галоген или 2 Соединение по п 1, где гидрокси -S(O)nCH2CH2CH=CF2 группа является, по крайней 3 Соединение по п 2, где любой из Ri-R6 обознамере, одной из Ri (когда он присоединен к атому чают углерода), R2, R3, R4, Rs или R6, -замещенный алкил, или содержит замещенный Ri (когда он присоединен к атому углерода), R2, алкильный фрагмент, который содержит один или R3, R4, Rs или R6, каждый, независимо, обозначают несколько заместителей, выбранных из галогена, водород, необязательно замещенный Сі-Сєалкил, нитро, циано, -COOR7 или его соли, гидрокси, алнеобязательно замещенный С2-Сєалкенил, необякокси, алкоксимино, алкоксикарбонила, карбамоизательно замещенныйСг-Сбалкинил, Сзла, моно- или диалкилкарбамоила, амино, моноСбЦиклоалкил, С4-С?ал кил циклоалкил, Сг или диалкиламино, ациламидо, алкансульфонила Сбалкокси, Сг-Сбалкенилокси, СгСєалкинилокси, и арилсульфонила, Сі-Сбгидроксиалкил, СгСємоноалкоксиалкил, Сз-замещенный алкенил, или содержит замещенный СбДиалкоксиалкил, необязательно замещенный алкенильный фрагмент, который содержит один Сб-Сюарил, необязательно замещенная группа Сєили несколько заместителей, выбранных из галоСюарил-СгС2алкил, необязательно замещенный гена, -COOR7 или его соли, гидрокси, нитро и циа 44732 обязательно моно- или дизамещенный группами но, Сі-С4алкил, -SH, Сі-С4алкилтио, бензилтио, не-замещенный арил или гетероарил, или содержит обязательно моно- или дизамещенный группами, замещенный арильный или гетероарильный независимо выбранными из галогена или d фрагмент, который содержит один или несколько С4 гал о ге нал кила, Сі-С4алкенилтио, С2заместителей, выбранных из алкила, алкокси, гаС4галогеналкенилтио, СгС4алкансульфонил, d логеналкила, галогена, гидрокси, COOR7 или его С4галогеналкансульфонил, фторсульфонил, моносоли, аминосульфонила, циано и нитро или ди-Сі-С4алкилсульфамоил, 5- или 6-членная 4 Соединение по п 2 или 3, где когда какой-либо гетероарильная группа, необязательно замещениз R-I-R6 обозначает -SR7, он предпочтительно ная галогеном является необязательно замещенным dСбалкилтио, Сг-Сбалкенилтио, С2-Сєалкинилтио, 6 Способ получения соединения, указанного в Ci-Сбгалогеналкил, СгСєгалогеналкенилтио, С2любом из пп 1-3, включающий взаимодействие Сєгалогеналкинилтио или Сб-Сюарилтио соединения формулы 5 Соединение по п 1, где R-X по крайней мере, один из Ri (когда он присоедис соединением формулы нен к атому углерода) является CF2=CHCH2CH2Y, S(O)nCH2CH2CH=CF2 группой, где R такой, как указан в любом из пп 1-3, X и Y Ri (когда он присоединен к атому углерода)- R6, обозначают группы SH или L, при условии, что X и каждый, независимо, обозначают водород, нитро, Y не могут быть одинаковыми, и L является легко галоген, циано, -CH=NOH, Сі-С4алкил, dудаляемой группой, с получением соединения С4 гал о ге нал кил, Сі-С4алкенил, dформулы (I), где п=0, и, если желательно, последующее окисление указанного соединения с полуС4галогеналкенил, циклопропил, гидрокси, d чением соединения формулы (I), где п=1 или 2 С4алкокси, С2-С4алкоксиалкил, -СООН, С2С4алкоксикарбонил, С27 Способ по п 6, где п равно 0, включающий взаимодействие соединения формулы (XXIII) С4галогеналкенилоксикарбонил, -CONH2, моно или R-SH (XXIII) ди-Сі-Сгалкиламинокарбонил, С2С4алкан карбон ил, фенил, необязательно монос соединением формулы (XXIV) или дизамещенный группами, независимо выCF2=CHCH2CH2L ,(XXIV) бранными из галогена, нитро, СгС4алкила, d где R такой, как указан в любом из пп 1-3, и L явС4алкокси или аминосульфонила, -CONHSO2-Cr ляется легко удаляемой группой С4алкил, бензил, необязательно моно- или диза8 Способ по п 6, где п равно 0, включающий мещенный группами, независимо выбранными из взаимодействие соединения формулы (XXVII) галогена, нитро, СгС4алкила или СгС4алкокси, R-L (XXVII) фенокси, необязательно моно- или дизамещенный с соединением формулы (XXVIII) группами, независимо выбранными из галогена, CF2=CHCH2CH2SH ,(XXVIII) циано, СгС4алкила или Сі-С4алкокси, амино, негде R такой, как указан в любом из пп 1-3, и L явобязательно моно- или дизамещенный группами ляется легко удаляемой группой Сі-С4алкил, -SH, Сі-С4алкилтио, бензилтио, не9 Способ по п 7 или 8, где п равно 1 или 2, котообязательно моно- или дизамещенный группами, рый включает окисление соответствующим обранезависимо выбранными из галогена или d зом замещенного соединения формулы (I), где п С4 гал о ге нал кила, Сі-С4алкенилтио, С2равно О С4галогеналкенилтио, вторичная 10 Сельскохозяйственная композиция, содержащая эффективное количество соединения, укаS(O)nCH2CH2CH=CF2 группа, Сг занного в любом из пп 1-3, в качестве активного С4алкансульфонил, СгС4галогеналкансульфонил, ингредиента, в смеси с сельскохозяйственно прифторсульфонил, моноили ди-Сг емлемым разбавителем или носителем С4алкилсульфамоил, 5- или 6-членная гетероарильная группа, необязательно замещенная гало11 Сельскохозяйственная композиция по п 10, геном, или любая соседняя пара образует кондендополнительно содержащая поверхностносированное 5- или 6-членное карбоциклическое активное вещество или гетероциклическое кольцо, и 12 Сельскохозяйственная композиция по любому Ri (когда он присоединен к атому азота) обознаиз п 10 и 11, дополнительно содержащая, по чают водород, нитро, циано, -CH=NOH, d меньшей мере, другой активный ингредиент, котоС4алкил, Сі-С4галогеналкил, циклопропил, гидрорый является инсектицидом, фунгицидом, бактекси, -СООН, С2-С4алкокси карбон ил, С2рицидом, акарицидом или другим биологически С4галогеналкенилоксикарбонил, -CONH2, моно или активным соединением ди-Сі-С2алкиламинокарбонил, С213 Способ получения сельскохозяйственной композиции, указанной в любом из пп 10-12, вклюС4алкан карбон ил, фенил, необязательно моночающий смешивание соединения, указанного в или дизамещенный группами, независимо вылюбом из пп 1-3 и сельскохозяйственно приемлебранными из галогена, нитро, СгС4алкила, d мого разбавителя или носителя С4алкокси или аминосульфонила, -CONHSO2-Cr С4алкил, бензил, необязательно моно- или ди14 Способ уничтожения или подавления нематод, замещенный группами, независимо выбранными вредных насекомых или клещей, включающий наиз галогена, нитро, СгС4алкила или СгС4алкокси, несение соединения, указанного в любом из пп 1фенокси, необязательно моно- или дизамещенный 3, или композиции по любому из пп 10-12 на парагруппами, независимо выбранными из галогена, зиты, их место обитания или растение, подвергциано, СгС4алкила или СгС4алкокси, амино, нешееся нападению паразитов 44732 Настоящее изобретение относится к новым гетероциклическим или карбоциклическим производным, обладающим нематоцидной, инсектицидной и акарицидной активностью, к способу получения, к содержащим их фармацевтическим композициям и к использующих их способам уничтожения или подавления нематод, вредных насекомых или акарицид В соответствии с настоящим изобретением предложено соединение формулы (1) или его соль, где п равно 0, 1 или 2, и R является группой (2) - (XXI), где S(O)nCH2CH2CH=CF2 группа является, по крайней мере, одной из R1 (когда он присоединен к атому углерода), R2, R3, R4, R5 или R6, R1 (когда он присоединен к атому углерода), R2, R3, R4, R5 или R6, каждый, независимо, обозначают водород, необязательно замещенный алкил, необязательно замещенный алкенил, алкинил, циклоалкил, алкилциклоалкил, алкокси, алкенилокси, алкинилокси, гидроксиалкил, алкоксиалкил, необязательно замещенный арил, необязательно замещенный арилалкил, необязательно замещенный ге-тероарил, необязательно замещенный арилокси, необязательно замещенный арилалкокси, необязательно замещенный арилоксиалкил, необязательно замещенный гетероарилокси, необязательно замещенный гетероарилалкокси, необязательно замещенный гетероарилокси-алкил, галогеналкил, галогеналкенил, галогеналкинил, галогенал-кокси, галогеналкенилокси, галогеналкинилокси, галоген, гид-рокси, циано, нитро, -NR7R8, -NR7COR8, -NR7CSR8, NR7SCO2R8, -N(SO2R7)(SO2R8), -COR7, CONR7R8, -anKHnCONR7R8, -CR7NR8, -COOR7, OCOR7, -SR7, -SOR7, -SO2R7, -anKHnSR7, алкилБСШ, -anKHnSO2R7, -OSO2R7, -SO2NR7R8, -CSNR7R8, -S1R7R8R9, -OCH2CO2R7, OCH2CH2CO2R7, -CONR7SO2R8, anKHnCONR7SO2R8, -NHCONR7R8, -NHCSNR7R8 или пара соседних R1, R2, R3, R4, R5 и R6, взятых вместе, образует 5- или 6-членное карбоциклическое или гетероциклическое кольцо, R1 (когда он присоединен к атому азота) обозначает водород, необязательно замещенный алкил, циклоалкил, алкилциклоалкил, гидроксиалкил, алкоксиалкил, необязательно замещенный арил, необязательно замещенный арилалкил, необязательно замещенный арилоксиалкил, необязательно замещенный гетероарил, необязательно замещенный гетероарилалкил, гидрокси, циано, нитро, -NR7R8, -NR7COR8, -NR7CSR8, NR7SCOOR8, -NR7SO2R8, -N(SO2R7)(SO2R8), COR7, -CONR7R8, -anKHnCONR7R8, -CR7NR8, COOR7, -OCOR7, -SOR7, -SO2R7, -anKHnSR7, алкилБСШ, -anKHnSO2R7, -OSO2R7, -SO2NR7R8, -SR7, -SOR7, -SO2R7, -CSNR7R8, -SiR7R8R7, OCH2CO2R7, -OCH2CH2CO2R7, -CONR7SO2R8, anKHnCONR7SO2R8, -MHCONR7R8 или NHCSNR7R8, и R7, R8 и R9, каждый, независимо, обозначают водород, необязательно замещенный алкил, необязательно замещенный алкенил, алкинил, необязательно замещенный арил, необязательно замещенный арилалкил, галогеналкил, галогеналкенил, галогеналкинил, галоген или гидрокси Следует учесть, что только для удобства отсылок, заместитель в группу R наименован в соответствии с положением в данной группе R Например, когда R имеет формулу (2), заместители R2, R3, R4 и R5 находятся в положениях 2, 3, 4 и 5 кольца, соответственно Для того, чтобы избежать дублирования, группа -S(O)nCH2CH2CH=CF2 группа может находиться при любом положении заместителя, обозначаемом R1 (когда он присоединен к атому углерода) - R6 Когда какой-нибудь из R -R9 является алкильной группой или содержит алкильный радикал, он может быть прямой или разветвленной цепью и предпочтительно является С1-6 алкилом, даже, более предпочтительно, С1-4 алкилом, например, метилом, этилом, пропилом, изо-пропилом, нбутилом, изо-бутилом, втор-бутилом или третбутилом Когда алкильная группа действует как "связующая" группа, то есть, R-алкил, например, в R-anKnnSR7, особенно предпочтительны С1-4 алкил или С1-2 алкил Когда какой-нибудь из R1-R8 является замещенной алкильной группой или содержит замещенный алкильный радикал, он может содержать один или несколько заместителей, выбранных из галогена, циано, -COOR7 или его соли, гидрокси, алкокси, алкоксимино, ал-коксикарбонила, карбамоила, моно- или ди-алкилкарбамоила, ами-но, моно- или ди-алкиламино, ациламидо (предпочтительно, С1-6 ациламидо), алкансульфонила и арилсульфонила, который, в свою очередь, может быть замещен галогеном, алкокси или нитро Когда какой-нибудь из R1-R8 является алкенильной или алки-нильной группой или содержит алкенильный или алкинильный радикал, он может быть прямой или разветвленной цепью и предпочтительно является С2-6 алкенилом или С2-6 алкинилом, даже, более предпочтительно, С2-4 алкенилом или С2-4 алкинилом, например, винилом, аллилом, бут-3-енилом, З-метилбут-3-енилом, этинилом или пропаргилом Когда какой-нибудь из R1-R8 является замещенной алкенильной группой или содержит замещенный алкенильный радикал, он может содержать один или несколько заместителей, выбранных из галогена, -COOR7 или его соли, гидрокси, нитро или циано Когда какой-нибудь из R1-R6 является циклоалкильной или ал-килциклоалкильной группой или содержит такой радикал, он предпочтительно является С1-6 алкокси, например, метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси, втор-бутокси и трет-бутокси, С2-6 алкинилокси, например, винилокси, аллилок-си, бут-3-енилокси и З-метилбут-3-енилокси, С2-6 моноалкоксиал 44732 10 фторэтил, 2,2,2-трифторэтил, пентафторэтил, 2,2кил, например, метоксиметил, метоксиэтил и этокдифтор-этил, 3,3-дихлорпроп-2-енил, 2-хлор-2симетил, или СЗ-6 диалкоксиалкил, например, енил, 3,4,4-трифторбут-З-енил, 4-фторбут-З-енил, диметоксиметил и диэтоксиметил 4,4-дифторбут-З-енил и 3-метил-4,4-дифторбут-3Когда какой-нибудь из R1-R9 является арилом енил или содержит арильный радикал, он, предпочтительно, является С6-10 арилом, более предпочтиКогда какой-нибудь из R1-R6 является галогетельно, он является фенилом Когда какой-нибудь налкенилокси-группой или галогеналкинилоксииз R1-R9 является арилалкилом, он, предпочтигруппой, он может содержать один или несколько тельно, является СЄ-10 арил-метилом, даже боатомов галогена, предпочтительно, хлор, фтор лее предпочтительно, он является бензилом или или бром Примерами предпочтительных С1-6 фенетилом алкокси, С2-6 алкенилокси и С2-6 алкинилокси групп являются трихлорметокси, фторметокси, Когда какой-нибудь из R1-R6 является гетедифторметокси, трифторметокси, 2-фторэтокси, роарилом или содержит гетероарильный радикал, 2,2,2-трифтор-этокси, пентафторэтокси, 1,1,2,2он, предпочтительно, является 5-или 6-членным тетрафторэтокси, 2-дифтор-этенилокси, 3,4,4циклом, содержащим, по крайней мере, один О, N трифторбут-3-енилокси, 4-фторбут-З-енилокси, или S атом в качестве гетероатома, например, 4,4-дифторбут-З-енилокси, З-метил-4,4пиридином, пирролом, пиразином, фураном или тиофеном Когда какой-нибудь из R1-R6 является дифторбут-3-енилокси, 2-хлорпроп-2-енилокси и гетероарилом, более предпочтительно, он явля3,3-дихлорпроп-2-енилокси ется гетероарил-С1-2 алкилом Когда какой-нибудь из R1-R6 является группой -NR7R8, он, предпочтительно, является -NH2, моКогда какой-нибудь из R1-R9 является заменоалкиламиногруппой, например, метиламине и щенной арильной, арилалкильной, гетероарильэтиламино, или диалкиламиногруппой, например, ной или гетероарилалкильной группой, он может диметиламино и диэтиламино содержать один или несколько заместителей, выбранных из алкила, алкокси, галогеналкила, галоКогда какой-нибудь из R1-R6 является группой гена, гидрокси, -COOR7 (или его соли), амино-NR7COR8, он, предпочтительно, является сульфонила, циано или нитро Примерами этих NHCHO, C2-6 ациламиногруппой, например, групп являются 4-метилфенил, 4-хлорфенил, 4NHCOCH3, -NHCOC2H5, или бензамидо, который фторфенил, 4-нитрофенил, 3может быть замещен одним или более заместителями, выбранными из галогена, например, хлора, трифторметилфенил, 4-трифторметилфенил, 4фтора и брома, алкилом, например, метилом и аминосульфонилфенил, 4-хлорбензил, 4этилом, алкокси, например, метокси и этокси, гафторбензил, 3-трифтор-метилбензил, 4логеналкилом, например, хлорметилом, фторметрифторметилбензил, 4-нитробензил и 4-метилтилом, трифторметилом и 2,2,2-трифторэтилом, бензил галогеналкокси, например, трифторметокси и Когда какой-нибудь из R1-R6 является ари2,2,2-трифторэтокси, гидрокси, циано и нитро локси или арилал-кокси группой, он, предпочтительно, является фенокси, бензилокси или фенеКогда какой-нибудь из R1-R6 является группой то кс и -NR7CSR8, R7 и R8, предпочтительно, являются метилом и этилом Когда какой-нибудь из R1-R6 является замещенной алкокси, арилалкокси, гетероарилокси или Когда какой-нибудь из R1-R6 является группой гетероарилокси группой, он может содержать один -NR7SO2RS, он, предпочтительно, является алили несколько заместителей, выбранных из алкикансульфонамидогруппой, например, ла, алкокси, галогеналкила, галогена, гидрокси, -NR7SO2CH3 и -NR7SO2C2H5 циано или нитро Примерами этих групп являются Когда какой-нибудь из R1-R6 является группой 4-метилфенокси, 4-хлор-фенокси, 4-фторфенокси, -N(SO2R7)(SO2R8), он, предпочтительно, яв4-нитрофенокси, 3-трифторметилфенокси, 4ляется ди(алкансульфо-нил)аминогруппой, натрифтор-метилфенокси, 4-хлорбензилокси, 4пример, -N(SO2CH3)2 и -N(SO2C2H5)2 фторбензилокси, 3-трифторметил-бензилокси, 4Когда какой-нибудь из R1-R6 является группой трифторметилбензилокси, 4-нитро-бензилокси и -COR7, он, предпочтительно, является С1-6 4-метилбензилокси ацильной группой, или необязательно замещенной бензоильной группой Бензоил может быть Когда какой-нибудь из R1-R6 является аризамещен одним или более заместителями, вылокси или арилалкокси группой, он, предпочтибранными из галогена, например, хлора, фтора и тельно, является фенокси, бензилокси или фенеброма, алкила, например, метила и этила, алкокто кс и си, например, метокси и этокси, галогеналкила, Когда какой-нибудь из R1-R6 является галогенапример, хлорметила, фторметила, трифторменом или содержит радикал галоген, он, предпочтила и 2,2,2-трифторэтила, га-логеналкокси, натительно, является фтором, хлором, бромом или пример, трифторметокси и 2,2,2-трифторэтокси, иодом Даже более предпочтительно, он является гидрокси, циано и нитро Примерами предпочтифтором, хлором или бромом тельных -COR7 групп являются ацетил, пропиоКогда какой-нибудь из R1-R6 является галогенил, н-бутаноил, 4-хлорбензоил, 4-фтор-бензоил, налкильной, га-логеналкенильной или галогенал4-бромбензоил, 4-метилбензоил и 4кинильной группой, он может содержать один или тр и фтор метил бен зо ил несколько атомов галогена, предпочтительно, хлор, фтор или бром Примерами этих групп явКогда какой-нибудь из R1-R6 является группой ляются фторметил, дифторметил, трифторметил, -CONR7R8, он, предпочтительно, является хлорметил, дихлорметил, трихлорме-тил, 2CONH2, -N-алкилкарбоксамидогруппой, например, 11 44732 12 -C0NHCH3, -COMHC2H5 и -CONHCH2CH2CH3, SOF, -SOBr или -SOCI или группой N.N-диалкилкарбоксамидо, например, Когда какой-нибудь из R1-R6 является группой -CON(CH3)2, -CON(CH3)(C2H5) и -CON(C2H5)2 -SO2R7, он, предпочтительно, обозначает алкансульфонильную, алкенсульфо-нильную, алкинилКогда какой-нибудь из R1-R6 является группой сульфонильную, галогеналкансульфонильную, -anKnnCONR7R8, он, предпочтительно, обозначагалогеналкенилсульфонильную, галогеналкинилет -С1 -4 алKHnCONR7R8 сульфонильную группу, или необязательно замеКогда какой-нибудь из R1-R6 является группой щенную бензолсульфонильную группу БензолCR7NR8, он, предпочтительно, обозначает сульфонильная группа может содержать один или CH=NOH несколько заместителей, выбранных их галогена, Когда какой-нибудь из R1-R6 является группой например, хлора, фтора и брома, алкила, напри-COOR7, он, предпочтительно, обозначает мер, метила и этила, алкокси, например, метокси СООН, алкоксикарбонильную группу, например, и этокси, галогеналкила, например, хлорметила, метоксикарбонил и этоксикарбонил, или галогефторметила, трифторметила и 2,2,2налке-нилоксикарбонильную группу, например, трифторэтила, галогеналкокси, такого как триф3,4,4-трифторбут-З-енилоксикарбонил, 4-фторбутторметокси и 2,2,2-трифторэтокси, гидрокси, циа3-енилоксикарбонил, 4,4-дифторбут-Зно и нитро Примерами таких групп являются меенилкарбонил и 3-метил-4,4-дифторбут-3тансульфонил, этансульфонил, енилоксикарбонил Когда какой-нибудь из R1-R6 является группой трифторметансульфонил и 4-OCOR7, он, предпочтительно, обозначает С2-6 метилбензолсульфонил При другом предпочтиацилоксигруппу, например, -ОСОСНЗ и тельном осуществлении -SO2R7 предпочтительно ОСОС2Н5, или необязательно замещенную бенобозначает -SO2F, -SO2Br или -SO2CI зоилоксиг-руппу Бензоилоксигруппа может соТаким образом, можно ожидать, что R группа держать один или несколько заместителей, выв формулах (2) -(XXI) может содержать более, чем бранных из галогена, например, хлора, фтора и одну группу брома, алкила, например, метила и этила, алкокS(O)nCH2CH2CH=CF2 Предпочтительно, R си, например, ме-токси и зтокси, гал о ген ал кила, группа содержит один или два таких заместителя например, хлорметила, фтормет-ла, трифтормеКогда какой-нибудь из R1-R6 является группой тила и 2,2,2-трифторэтила, галогеналкокси, на-OSO2R7, он, предпочтительно, обозначает алпример, трифторметокси и 2,2,2-трифторэтокси, кансульфонилокси группу или негидрокси, циано и нитро обязательно замещенную бензолсульфонилокси группу Бензолсуль-фонильная группа моКогда какой-нибудь из R1-R6 является группой жет быть замещена одним или несколькими за-SR7, R7, предпочтительно, обозначает водород, местителями, выбранных их галогена, например, необязательно замещенный алкил, необязательно хлора, фтора и брома, алкила, например, метила замещенный алкенил, алкинил, галогеналкил, гаи этила, алкокси, например, ме-токси и этокси, логеналкенил, галогеналкинил, необязательно галогеналкила, например, хлорметила, фторметизамещенный арил или необязательно замещенла, трифторметила и 2,2,2-трифторэтила, галогеный арилалкил Примерами предпочтительных налкокси, например, трифторметокси и 2,2,2С1-6 алкилтио (С1-4 алкил является особенно трифторэтокси, гидрокси, циано и нитро предпочтительным), С2-6 алкенилтио или С2-6 алкинилтио групп являются метилтио, этилтио, нКогда какой-нибудь из R1-R6 является группой пропилтио, изо-пропилтио, н-бутилтио, изо-SO2NR7NR8, он, предпочтительно, обозначает бутилтио, втор-бутилтио, аллилтио, бут-3-енилтио, SO2NH2, алкиламиносульфонилок-си группу, наЗ-метилбут-3-енилтио и пропаргилтио Примерами пример, -SO2NHCH3 и -SO2NHC2H5, или диалкипредпочтительных С1-6 гал о ген алкилтио (С1-4 ламино-сульфонильную группу, например, алкил является особенно предпочтительным), С2SO2N(CH3)2 и -SO2N(C2H5)2 6 гал о ген алкенилтио или С2-6 галогеналкинил-тио Когда какой-нибудь из R1-R6 является группой групп являются фторметилтио, дифторметилтио, -CSNR7NR8, он, предпочтительно, обозначает три фтор метил-ти о, трихлорметилтио, 2CS2NH2, -CSNHCH3 или -CSN(CH3)2 фторэтилтио, 2,2,2-трифторэтилтио, 3-фтор-нКогда какой-нибудь из R1-R6 является группой пропилтио, пентафторэтилтио, 2-хлорпроп-2-SiR7R8R9, он, предпочтительно, является триаленилтио, 3,3-дихлорпроп-2-енилтио, 3,4,4килсилильной группой, например, триметилсилитрифторбут-3-енилтио, 4-фторбут-З-енилтио, 4,4лом и триэтилсилилом дифторбут-3-енилтио и 3-метил-4,4-дифторбут-3Когда какой-нибудь из R1-R6 является группой енилтио Примером предпочтительных С6-10 -OCH2CO2R7, он, предпочтительно, является аларилтио и С6-10 арил-С1-2 алкилтио групп являкоксикарбонилметокси группой, например, метокется 3-трифторметилбензилтио сикарбонилметокси и этоксикарбонилметокси Когда какой-нибудь из R1-R6 является группой Когда какой-нибудь из R1-R6 является группой -SOR7, он, предпочтительно, обозначает алкан-OCH2CH2CO2R7, он, предпочтительно, является сульфинил, алкенсульфинил или алкинилсульфиалкоксикарбонилэтокси группой, например, метокнилгруппу, например, метансульфинил или этансикарбонилэтокси и этоксикарбонилтокси сульфинил, или галогеналкансульфинил, Когда какой-нибудь из R1-R6 является группой -CONR7SO2R8, он, предпочтительно, является Nгалогеналкенилсульфинил или галогеналкинилалкансульфонилкарбоксамидо группой или Nсульфинил группу, например, трифторметан алкил-Ы-алкансульфонилкарбоксамидо группой, сульфинил При другом предпочтительном осущенапример, І\І-(метансульфонил)карбоксамидо и Nствлении -SOR7, предпочтительно, является 13 44732 14 метил-І\І-(метан-сульфонил)карбоксамидо ди- замещенный группами, независимо выбранными из галогена, нитро, С1-4 алкила, С1-4 алкокКогда какой-нибудь из R1-R6 является группой си или аминосульфонила, бензил, необязательно -anKHnCONR7SO2R8, R7 и R8, предпочтительно, моно-или ди- замещенный группами, независимо являются алкильными группами, например, этивыбранными из галогена, нитро, С1-4 алкила или лом и метилом С1-4 алкокси, фенокси, необязательно мо-но- или Когда какой-нибудь из R1-R6 является ди- замещенный группами, независимо выбранNHCONR7R8, R7 и R8, предпочтительно, являютными из галогена, циано, С1-4 алкила или С1-4 ся алкильными группами, например, этилом и меалкокси, амино, необязательно моно- или ди- затилом мещенный С1-4 алкильными группами, -SH, C1-4 Когда какой-нибудь из R1-R6 является алкилтио, бензилтио, необязательно моно- или NHCSNR7R8, R7 и R8, предпочтительно, являютди- замещенный группами, независимо выбранся алкильными группами, например, этилом и меными из галогена или С1-4 галогенал-кила, С1-4 тилом алкенилтио, С2-4 галогеналкенилтио, вторая Когда пара соседних R1, R2, R3, R4, R5 и R6, S(O)nCH2CH2CH=CF2 группа, С1-4 алкансульфовзятые вместе, образуют конденсированное 5- или нил, С1-4 галогенал-кансульфонил, фторсульфо6-членное карбоциклическое или гетероцикличенил, моно- или ди- С1-4 алкилсульфамо-ил, 5 или ское кольцо, предпочтительно содержащее два 6 членная гетероарильная группа, например, фуатома кислорода, пара заместителей, взятая вмерил,пиридинил или тиенил, необязательно заместе, обозначает, предпочтительно, -(СН2)3-, щенные галогеном (СН2)4-, -СН=СН-СН=СН-, -О-СН2-О-, необязательно замещенные одним или двумя атомами В следующих таблицах даны примеры соедигалогена или ме-тильными группами, например, нений по изобретению Примеры соединений O-CHF-O- или -O-CF2-O-, -О-СН(СНЗ)-О- или -Оформулы (2) в соответствии с изобретением предС(СН2)2-Оставлены в таблице II В соответствии с предпочтительным осущестС1-4 алкокси или аминосульфонила, бензил, влением настоящего изобретения радикал из R1 необязательно моно-или ди- замещенный группа(когда он присоединен к атому углерода) - R6, ками, независимо выбранными из галогена, нитро, ждый, независимо, обозначает водород, нитро, С1-4 алкила или С1-4 алкокси, фенокси, необязагалоген, циано, -CH=NOH, С1-4 алкил, С1-4 галотельно моно- или ди- замещенный группами, негеналкил, С1-4 алкенил, С1-4 галогеналкинил, зависимо выбранными из галогена, циано, С1-4 циклопропил, гидрокси, С1-4 алкокси, С2-4 алкокалкила или С1-4 алкокси, амино, необязательно сиалкил, -СООН, С2-4 алкокси карбон ил, С2-4 гамоно- или ди- замещенный С1-4 алкильными логенал-кенилоксикарбонил, -CONH2, моно или группами, -SH, C1-4 алкилтио, бензилтио, необяди-С1-2 алкиламинокарбонил, С2-4 алканкарбозательно моно- или ди- замещенный группами, нил, -CONHSO2 С1-4 алкил, предпочтительно, независимо выбранными из галогена или С1-4 CONHSO2CH3, фенил, необязательно моно- или галогенал-кила, С1-4 алкенилтио, С2-4 галогеналди- замещенный группами, независимо выбранкенилтио, вторая S(O)nCH2CH2CH=CF2 группа, ными из галогена, нитро, С1-4 алки-ла, С1-4 алС1-4 алкансульфонил, С1-4 галогеналкокси или аминосульфонила, бензил, необязакансульфонил, фторсульфонил, моно- или ди- С1тельно моно- или ди- замещенный группами, 4 алкилсульфамо-ил, 5 или 6 членная гетероанезависимо выбранными из галогена, нитро, С1-4 рильная группа, например, фурил, пиридинил или алкила или С1-4 алкокси, фенокси, необязательно тиенил, необязательно замещенные галогеном моно- или ди- замещенный группами, независимо В следующих таблицах даны примеры соедивыбранными из галогена, нитро, С1-4 алкила или нений по изобретению Примеры соединений С1-4 алкокси, амино, необязательно моно- или диформулы (II) в соответствии с изобретением предзамещенный С1-4 алкильными группами, ставлены в таблице I - II -SH, C1-4 алкилтио, бензилтио, необязательно Соединения формулы (1), когда п равно О, моно- или ди- замещенный группами, независимо может быть получено различными способами выбранными из галогена или С1-4 галогеналкила, Они могут быть получены, например, путем С1-4 алкенилтио, С2-4 галогеналкенилтио, вторая взаимодействия соответствующего производного S(O)nCH2CH2CH=CF2 группа, С1-4 алкансульфотиола формулы (XIII) с подходящим дифторбут-1нил, С1-4 галогенал-кансульфонил, фторсульфоеновым алкилирующим агентом формулы (XXIV), нил, моно- или ди- С1-4 алкилсульфамо-ил, 5 или где L является уходящей группой Это взаимодей6 членная гетероарильная группа, например, фуствие предпочтительно осуществляют в присутстрил, пи-ридинил или тиенил, необязательно завии мягкого основания, такого как карбонат щемещенные галогеном, либо любая соседняя пара лочного металла, например, карбонат натрия или образует конденсированное 5- или 6-членное каркалия, в инертном растворителе при температуре боциклическое или гетероциклическое кольцо, и от 0° до 200°С Обычно взаимодействие можно проводить при температуре кипения с обратным R1 (когда он присоединен к атому азота) обохолодильником в подходящем инертном раствозначает водород, нитро, циано, -CH=NOH, C1-4 рителе, например, в ацетоне, который имеет темалкил, С1-4 галогеналкил, циклопро-пил, гидрокси, пературу кипения в этой области -СООН, С2-4 алкокси карбон ил, С2-4 галогеналкенилоксикарбонил, -CONH2, моно или ди-С1-2 алВ формуле (XXIV) уходящая группа L предкиламинокарбонил, С2-4 ал кан карбон ил, ставляет, предпочтительно, галоген или сложноCONHSO2 С1-4 алкил, предпочтительно, эфирную группу сульфоновой кислоты, имеющей CONHSO2CH3, фенил, необязательно моно- или формулу OSO2Rb, как показано формулой (XXV), 15 44732 16 где Rb обозначает С1-4 алкильную группу, необяним эквивалентом подходящего окислительного зательно замещенную С1-4 алкильную группу агента приводит к соответствующему производБолее предпочтительно, L обозначает бром, как ному, где п равно 1, а окисление с использованипоказано в формуле (XXVI) ем двух окислительных агентов приводит к соотСульфоновый эфир формулы (XXV) может ветствующему производному, где п равно 2 быть получен путем взаимодействия 1,4-дибромПодходящие окислительные агенты включают 1,1,2--трифторбутана с серебряной солью сульорганические и неорганические пероксиды, такие фоновой кислоты и дебромфторирования полукак надоксикарбоновые кислоты или их соли, наченного промежуточного продукта, 4пример, мета-хлорнадбензойная кислота, надбентолуолсульфонового эфира зойная кислота, магниевая соль монопероксифталевой кислоты или калий пероксимоносульфат В родственной международной патентной заявке PCT/GB94/01570 описан способ получения Таким образом, в соответствии со следующим соединения формулы (XXVI), а именно 4-бромаспектом настоящего изобретения предложен 1,1-дифторбут-1-ена, по которому бромистый воспособ получения соединений формулы (1), где п дород подвергают взаимодействию с коммерчески равно 1 или 2, который включает окисление соотдоступным 4-бром-1,1,2-трифторбут-1 -еном в ветствующим образом замещенного соединения инертном растворителе с получением 1,4-дибромформулы (1), где п равно О 1,1,2-трифторбутаном Этот промежуточный проСледует учесть, что как и для соединений дукт может быть обработан с дебромфторируюформулы (1), получаемых из соответствующих щим агентом в соответствующем растворителе, замещенных соединений формулы (XXIII), (XXVII) например, ацетоне или воде, с получением соили (XXIX), последовательные преобразования единения формулы (XXVI) функциональных групп можно проводить, используя известные способы для осуществления треСпециалисту в данной области понятно, что буемого замещения в кольце Примеры таких пресоединения формулы (XXIII) могут быть в таутообразований функциональных групп включают мерном равновесии между эквивалентными мервосстановление нитрогрупп до аминогрупп, галокапто и тионовой формами Для удобства эти согенирование, например хлорирование, гидролиз единения указаны здесь в виде их меркапто эфира до кислоты, окисление спирта до кислоты, формы, если не указано иного образование соли Соединения формулы (XXIII) являются коммерчески доступными или могут быть получены из Различные дальнейшие предпочтительные коммерчески доступных предшественников обычпризнаки и варианты осуществления настоящего ными способами, хорошо известными специалиизобретения описаны далее подробно в следуюстам щих иллюстративных примерах, в которых проценты приведены по массе и используются слеАльтернативно, соединения формулы (1) модующие сокращения т пл = температура гут быть получены взаимодействием соответстплавления, т кип = температура кипения, г = вующего соединения формулы (XXVII), где L граммы, ГХ = газовая хроматография, ЯМР = вновь обозначает хорошо уходящую группу, с ядерно магнитный резонанс, с = синглет, д = дубмеркаптопроизводным формулы (XXVIII), в услолет, дд = дублет дублетов, т = триплет, кв = кварвиях, хорошо известных в данной области для тет, м = мультиплет, ушир = уширенный, М = подобных реакций замещения Предпочтительно, моль, мМ = ммоль, CDCI3 = дейтерохлороформ L обозначает галоген или нитрогруппу Удобно, Химические сдвиги (5) измерены в частях на милкогда взаимодействие проводят с системе двухлион относительно тетраметилсилана CDCI3 был фазного растворителя, такого как воиспользован в качестве растворителя для ЯМР да/дихлорметан, в присутствии катализатора спектра, если не указано иного М + = молекулярмежфазного переноса, например, тетра-нный ион, как определено масс спектроскопией, бутиламмонийбромида, при комнатной темпераFAB = бомбардировка быстрыми атомами, ТСХ = туре в атмосфере азота тонкослойная хроматография Меркаптопроизводное формулы (XXVIII) удобно подвергать взаимодействию в виде его SСинтез ряда промежуточных соединений, исацетил или его изотиоурониевой бромистоводопользуемых при получении соединений по изородной соли, которая легко гидролизуется до мербретению, приведен далее Некоторые из этих каптопро-изводного формулы (XXVIII) соединений известны в данной области Производное формулы (1) также может быть ПРИГОТОВЛЕНИЕ 1 получено из соответствующего аминопроизводноВ данном Приготовлении описан 3-х стадийго формулы (XXIX), которое может быть диазотиный способ получения 4-бром-4,4ровано, например, алкилнитритом, таким кактретдифторбутилметансульфоната бутилнитрит, в присутствии дисульфида формулы Стадия 1 4-бром-4,4-дифторбутановая кисло(XXX) в подходящем растворителе, таком как дита хлорметан или ацетонитрил К перемешиваемому раствору акриловой киПроизводное формулы (1), где п равно 1 или слоты (1,44г) и ацетонитрила (80см3) прибавляют 2, может быть получено путем окисления соответдитионит натрия (4,18г), бикарбонат натрия ствующим образом замещенного соединения (2,01 г), воду (20см3) и, наконец, дибромдифтормеформулы (1),где п равно 0, используя обычные тан (5см3) Двухфазную смесь перемешивают при методы, например, подходящим окислительным комнатной температуре при постепенном раствоагентом в инертном органическом растворителе рении неорганических солей ГХ анализ через 4 Обычно, окисление соединения формулы (1) одчаса показывает полный расход акриловой кисло 17 44732 18 ты Водную фазу насыщают раствором хлорида м) натрия Органическую фазу отделяют, сушат над Стадия 2 Получение 4-бром-3,4,4сульфатом магния, фильтруют и упаривают при трифторбут-4-метилбензолсульфонат пониженном давлении с получением бледноПродукт со стадии 1 (1г) прибавляют по капжелтого масла с небольшим содержанием белого лям к перемешиваемому раствору тозилата се3 твердого продукта Эту смесь обрабатывают ребра (1,03г) в ацетонитриле (10см ) при комнатетилацетатом, фильтруют и растворитель упариной температуре, предохраняя от попадания вают при пониженном давлении с получением света Реакционную смесь нагревают с обратным 1 бледно-желтого масла (2,54г) Н ЯМР (DMSO-d6) холодильником в течение 24 часов, после чего ГХ 5 2,45 (2Н, т), 2,65 (2Н, м) анализ показывает полный расход исходного продукта Реакционную смесь охлаждают до комнатСтадия 2 4-бром-4,4-дифторбутанол ной температуры и выпавший осадок отфильтроРаствор литийалюминийгидрида в диэтило3 вывают и промывают этилацетатом Фильтрат и вом эфире (5см ,5 мМ) охлаждают до 0°С Подзтилацетатные промывки объединяют и промыдерживая эту температуру, по каплям при перевают водой и водный слой экстрагируют етилацемешивании прибавляют 4-бром-4,4татом Объединенные этилацетатные слои продифторбутановую кислоту (1г), растворенную в 3 мывают водой и насыщенным раствором соли, сухом диэтиловом эфире (5см ) Через час при сушат над сульфатом магния и упаривают при 0°С реакционную смесь осторожно гасят прибавпониженном давлении с получением коричневого лением 2М соляной кислоты Органическую фазу масла (1,21 г) ГХ анализ показывает, что чистота отделяют, промывают насыщенным раствором продукта > 99% 1Н ЯМР 5 2,20 (2Н, м), 2,46 (ЗН, бикарбоната натрия, сушат над сульфатом магс), 4,19 (2Н, м), 4,74 (1Н, м), 7,38 (2Н, д), 7,80 (2Н, ния, фильтруют и упаривают при пониженном давлении с получением бесцветного масла (0,57г) Д) 1 Н ЯМР 5 1,82 - 1,96 (2Н, м), 2,40 - 2,60 (2Н, м), Стадия 3 Получение 4,4-дифторбут-3-енид-43,74 (2Н, т) метилбензолсульфоната Стадия 3 4-бром-4,4дифторбутилметансульфонат Перемешиваемый раствор 4-бром-4,4дифторбутанола (0,57г) в сухом диэтиловом эфи3 ре (5см ) охлаждают до 0°С Поддерживая эту температуру прибавляют триэтиламин (1,7см3) Через десять минут прибавляют метансульфонилхлорид (0,3см3) и смесь перемешивают в течение еще часа при 0°С Реакционную смесь выливают в 2М соляную кислоту (2см3) и диэтиловый эфир (20см3) Органическую фазу отделяют, промывают насыщенным раствором соли, затем пропускают через плаг из силикагеля, элюируя дополнительным количеством диэтилового эфира Диэтиловые фракции упаривают при пониженном давлении с получением бледно-желтого масла (0,705г) 1Н ЯМР 5 2,04 - 2,18 (2Н, м), 2,46 - 2,64 (2Н, м), 3,04 (ЗН, с), 4,32 (2Н, т) ПРИГОТОВЛЕНИЕ 2 В данном Приготовлении описан 3-х стадийный способ получения 4,4-дифторбут-З-енилового эфира 4-м етил бе н зол сул ьфо но вой кислоты из коммерчески доступного 4-бром-1,1,2-трифторбут1-ена Стадия 1 1,4-дибром-1,1,2-трифторбутана Перед использованием 4-бром-1,1,2трифторбут-1-ен (Fluorochem Ltd) (240г) промывают водой (300см3) и сушат (MgSO4) Одной порцией прибавляют бензилпероксид (приблизительно 0,7г) и через смесь барботируют газообразный бромистый водород с такой скоростью, чтобы температура поддерживалась при 30 - 40°С Через 2 часа ГХ образца реакционной смеси показывает, что немного исходного материала осталось Реакционную смесь промывают водой (300см3), затем насыщенным раствором бикарбоната натрия (300см3), сушат (MgSO4) и фильтруют с получением бледножелтого масла (296,7г), идентифицированного как 1,4-дибром-1,1,2-трифторбутан По данным ГХ анализа чистота продукта выше, чем 98% 1Н ЯМР 5 2,38 (2Н, м), 3,57 (2Н, м), 4,90 (1Н, К перемешиваемой суспензии порошка цинка (1,41 г) и иода (один гран, катализатор) в метаноле (Зсм3) прибавляют раствор 4-бром-3,4,4трифторбутил-п-толилсульфоната (0,71 г) в метаноле (2см3) Реакционную смесь нагревают с обратным холодильником в течение ТА часов, после чего ГХ анализ показывает полный расход исходного продукта Органическую фазу отбирают пипеткой от суспензии цинка и цинк промывают 3 порциями этилацетата Объединенные этилацетатные части промывают 2М соляной кислотой, сушат над сульфатом магния и упаривают при пониженном давлении с получением коричневой жидкости (0,47г) ГХ анализ показывает, чточистота продукта > 99% 1Н ЯМР 5 2,35 (2Н, м), 2,46 (ЗН, с), 4,01 (2Н, м), 4,15 (1Н, м), 7,38 (2Н, д), 7,79 (2Н, д) ПРИГОТОВЛЕНИЕ 3 В данном Приготовлении описан способ получения 4-бром-1,1-дифторбут-1-ена из 1,4-дибром1,1,2-трифторбутана Порошок цинка (0,88г) прибавляют к переме1,4-дибром-1,1,2шиваемому раствору трифторбутана (1,38г) в ацетоне (6см ), содержащем воду (1 капля), в атмосфере азота Через 45 минут ГХ анализ показывает, что большая часть исходного продукта израсходована Затем смесь прибавляют к дополнительному количеству порошка цинка (Зг) в ацетоне, содержащем следы воды, предварительно нагретому до 55°С Через еще 20 минут при этой температуре ГХ анализ показывает, что весь исходный продукт израсходован, свидетельствуя о том, что реакция дебромфторирования началась К реакционной смеси в течение более 75 минут при поддержании температуры реакционной смеси при 55°С прибавляют еще исходного продукта (12,34г) Затем нагревание продолжают еще 95 минут ГХ анализ образца показывает, что около 3% исходного дибромпроизводного остается неизмененными Добавляют еще порошок цинка (0,16г) и нагревание 44732 20 19 продолжают до тех пор, пока ГХ анализ будет по(150см3) Смесь ступенчато нагревают и перемеказывать, что израсходован весь исходный прошивают при нагревании с обратным холодильнидукт Ацетоновый раствор декантируют от осадка ком в течение 2 часов, затем охлаждают и упарицинка с получением раствора 4-бром-1,1вают при пониженном давлении Остаток дифторбут-1-ена, подходящего для использоваэкстрагируют диэтиловым эфиром, органическую ния в дальнейших химических реакциях фазу фильтруют для удаления бромида натрия и эфир упаривают при пониженном давлении с поПРИГОТОВЛЕНИЕ 4 лучением жидкого продукта, который перегоняют В данном Приготовлении описан способ полупри 16 ммртст, т кип 120°С с получением бисчения тиоацетата 4,4-дифторбут-З-енила (4,4-дифторбут-3-енил)дисульфида (24г) в виде Тиоацетат калия (1,98г) 4-бром-1,1 бесцветного жидкого продукта дифторбут-1-ена (3,0г) и тетра-н-бутиламмоний бромид (0,Зг, катализатор) перемешивают при ПРИМЕР II 1 комнатной температуре в атмосфере азота в теВ данном примере описан способ получения чение 5 часов и оставляют на 18 часов Смесь 2-(4,4-дифторбут-3-енилтио)фурана (соединеперегоняют в аппарате Кугельрора (Kugelrohr) с ниеІІ 1) получением тиоацетата 4,4-дифторбут-З-енила в Бутиллитий (6,5см3, 2,5М в эфире) прибавлявиде бесцветной жидкости (1,12г) 1Н ЯМР 5 2,25 ют по каплям к раствору фурана (1 г) в диэтиловом (2Н, м), 2,30 (ЗН, с), 2,90 (2Н, т), 4,20 (1Н, м), (т эфире (40см3) Через 90 минут реакционную смесь кип 115°С при 120мм рт ст) нагревают с обратным холодильником в течение 30 минут и затем охлаждают до комнатной темпеПРИГОТОВЛЕНИЕ 5 ратуры При перемешивании порциями прибавляВ данном Приготовлении описан способ полуют порошок серы (0,48г) Через 2 часа прибавляют чения бензолсуль-фонатной соли 4,4-дифторбут4-бром-1,1-дифторбут-1-ен (3,0г) и перемешиваЗ-енила ние продолжают при комнатной температуре в Тиомочевину (0,29г) и 4течение 18 часов Реакционную смесь гасят водой метилбензолсульфоната 4,4-дифторбут-З-енила и продукт экстрагируют диэтиловым эфиром (1,0г) нагревают вместе при кипячении с обратным 3 Объединенные органические экстракты сушат, холодильником в этаноле (20см ) в течение 24 фильтруют и упаривают с получением темнокочасов Реакционную смесь охлаждают и раствориричневой жидкости Хроматография насиликагеле тель упаривают при пониженном давлении с полу(элюент - смеси гексан-диэтиловый эфир) дает чением масла, которое медленно кристаллизуетсоединение II 1 (0,965г) 1Н ЯМР 5 2,2 - 2,3 (2Н, м), ся Растирание с гексаном дает (4,4-дифторбут-З2,7 - 2,8 (2Н, т), 4,15 - 4,35 (1Н, м), 6,4 (1Н, дд), енил)тиомочевину в виде ее 46,53 (1Н, д), 7,5 (1Н, д), (масло) + метилбензолсульфонатной соли (1,14г) МН 1 (FAB) = 167, Н ЯМР (DMSO-d6) 5 2,48 (ЗН, с), 2,46 ПРИМЕР II 2 - 2,58 (2Н, м), 3,42 (2Н, т), 4,46 - 4,84 (1Н, м), 7,32 В данном примере описан способ получения (2Н, д), 7,68 (2Н, д), 9,10-9,40 (ЗН, ушир) 2-(4,4-дифторбут-3-енилтио)-5-метилфурана (соединение II 4) ПРИГОТОВЛЕНИЕ 6 Бутиллитий (5,4см3, 2,5М в эфире) прибавляВ данном Приготовлении описан способ полуют по каплям к раствору фурана (1 г) в диэтиловом чения гидробромида 4,4-дифторбут-Зэфире (40см3) Через 90 минут реакционную смесь енилизотиомочевины нагревают с обратным холодильником в течение Тиомочевину (18,5г) прибавляют к раствору 430 минут и затем охлаждают до комнатной темпебром-1 1-дифторбут-З-ена (41,5г) в этаноле ратуры При перемешивании порциями прибавля(150см ) и нагревают с обратным холодильником ют порошок серы (0,38г) Через 2 часа прибавляют при перемешивании в течение 18 часов Реакци4-бром-1,1-дифторбут-1-ен (2,05г) и перемешиваонную смесь охлаждают и растворитель упаривание продолжают при комнатной температуре в ют при пониженном давлении Полученный воскотечение 18 часов Реакционную смесь гасят водой образный продукт промывают диэтиловым и продукт экстрагируют ди-этиловым эфиром эфиром, фильтруют, промывают дополнительным Объединенные органические экстракты сушат, количеством диэтилового эфира и отсасывают фильтруют и упаривают Хроматография на силидосуха с получением требуемого продукта в виде кагеле (элюент -смеси гексан-эфир) дает соедибесцветного твердого продукта (57г) МН+ (FAB) = нение II 4 (1,25г) 1Н ЯМР 5 2,2 - 2,3 (2Н, м), 2,3 167, 1Н ЯМР (DMSO-d6) 5 2,20 (2Н, м), 2,20 (2Н, т), (ЗН, с), 2,7 - 2,77 (2Н, т), 4,16 - 4,34 (1Н, м), 5,97 4,50 (1Н, м), 8,95 (4Н, широкий сигнал) (1Н, м), 6,43 (1Н, д), (масло) N-Метилпроизводное продукта выше получаПРИМЕР II 3 ют по вышеописанному способу, но используя NВ данном примере описан способ получения метилтиомочевину вместо тиомочевины Оно 3-(4,4-дифторбут-3-енилтио)-2-метилфурана (соимеет МН+ = 181, 1Н ЯМР (DMSO-d6) 5 2,45 - 2,55 единение II 7) (2Н, м), 3,0 - 3,05 (ЗН, д), 3,4 - 3,5 (2Н, т), 4,30 4,45 (1Н, м), (т пл 74-77,2°С) Раствор, содержащий 2-метил-З-фурантиол (2,0г), 4-бром-1,1-дифторбут-1-ен (3,24г) и карбоПРИГОТОВЛЕНИЕ 7 нат калия (2,48г) в ацетоне (50см3) нагревают с В данном Приготовлении описан способ полуобратным холодильником в течение 2 часов и зачения бис-(4,4-дифторбут-3-енил)дисульфида тем оставляют стоять 18 часов Реакционную Раствор дисульфида натрия (предварительно смесь гасят водой и продукт экстрагируют диэтиполученный из но-нагидрата сульфида натрия ловым эфиром Объединенные органические экс(53г) и серы (7,0г)) в этаноле (250см3) прибавляют тракты сушат, фильтруют и упаривают Хроматок 1-бром-4,4-дифторбут-3-ену (50г) в этаноле 44732 22 21 графия на силикагеле (элюент - 10% эфир в гексиликагеле (элюент 5% эфир в гексане) дает Сосане) дает соединение II 7 (3,338г) 1Н ЯМР 5 2,1 единение III 1 (9,5г), М + = 206, 1 Н ЯМР 5 2,2 - 2,4 2,25 (2Н, м), 2,35 (ЗН, с), 2,65 (2Н, т), 4,1 - 4,3 (1Н, (2Н, м), 2,8 (2Н, т), 4,1 - 4,3 (1Н, м), 6,95 - 7,0 (1Н, м), 6,3 (1Н, д), 7,3 (1Н, д), (масло) дд), 7,15 (1Н, д), 7,35 (1Н, д), (масло) ПРИМЕР II 4 Вышеописанными методами в соответствии с изобретением получают следующее соединение В данном примере описан способ получения 2-(4,4-дифторбут-3-енилсульфинил)фурана (со(1) 2-(4,4-дифторбут-3единение II 2) енилтио)бензо[Ь]тиофен (соединение III 10), 1Н ЯМР 5 2,2 - 2,3 (2Н, м), 2,7 - 2,8 (2Н, т), 4,15 - 4,35 З-Хлорнадбензойную кислоту (0,54г 50% по (1Н, м), 6,4 (1Н, дд), 6,53 (1Н, д), 7,5 (1Н, д) из совесу твердого продукта, 1,58мМ) порциями приединения бензотиофена ПРИМЕР III 2 бавляют к раствору соединения II 1 (0,30г) в дихлорметане (5см3) при охлаждении на ледяной В данном примере описан способ получения бане После перемешивания в течении 4 часов 2-(4,4-дифторбут-3-енилтио)-5-формилтиофена реакционную смесь распределяют между етил(соединение III 4) ацетатом и 2М раствором NaOH Отделяют оргаСоединение III 1 (1,0г) медленно прибавляют к нический слой, промывают дополнительным колираствору, содержащему диметилформамид чеством 2М раствора NaOH, сушат над сульфатом (0,48см3) и фосфорилхлорид (0,56см3) Реакционмагния, фильтруют и упаривают с получением ную смесь нагревают при 100°С в течение 2 часов, соединения II 2 (0,21 Ог) 1Н ЯМР 5 2,3 - 2,5 (2Н, м), охлаждают на ледяной бане и затем нейтрализуют 2М раствором NaOH Водный раствор дважды 3.1 -3,4(2Н, м), 4,15-4,35 (1Н, м), 6,5 (1Н, дд), 7,0 экстрагируют диэтиловым эфиром и объединен(1Н, д), 7,7 (1Н, д), (масло) ные органические слои промывают водой и расВышеописанными методами получают слетвором NaHCO3 Органические экстракты сушат дующие соединения над сульфатом магния, фильтруют и упаривают с (1) 2-(4,4-дифторбут-3-енилсульфонил)фуран получением темной жидкости Фильтрован^ через (соединение II 3), 1Н ЯМР 5 2,4 - 2,55 (2Н, м), 3,25 силикагель (элюент 20% диэтиловый эфир в гек- 3,3 (2Н, т), 4,1 - 4,3 (1Н, м), 6,6 (1Н, м), 6,6 (1Н, сане) дает соединение III 4 (0,91 г) М + = 234, 1Н дд), 7,23 (1Н, д), 7,67 (1Н, д), (масло) из соединеЯМР 5 2,4 (2Н, м), 3,0 (2Н, т), 4,2 - 4,4 (1Н, м), 7,1 ния II 1, используя 2,1 эквивалента окислителя (1Н, д), 7,7 (1Н, д), 9,8 (1Н, с), (масло) (2) 2-(4,4-дифторбут-3-енилсульфинил)-5метилфуран ПРИМЕР III 3 В данном примере описан способ получения (соединение II 5), 1Н ЯМР 5 2,3 - 2,45 (5Н, м), 2-(4,4-дифторбут-3-енилтио)-53,0-3,15 и 3,3 - 3,4 (всего, 2Н, м), 4,2-4,3 (1Н, м), гидроксиметилтиофена (соединение III 5) 6,6 (1Н, д), 6,85 (1Н, д), (масло) из соединения II 4, используя 1 эквивалент окислителя Боргидрид натрия (0,065г) прибавляют к раствору соединения III 4 (0,75г) в этаноле (21см3) и (3) 2-(4,4-дифторбут-3-енилсульфонил)-5воде (9см ) Реакционную смесь перемешивают метилфуран при комнатной температуре в течение 2 часов, (соединение II 6), 1Н ЯМР 5 2,4 - 2,55 (5Н, м), гасят 2М хлористоводородной кислотой и затем 3.2 - 3,28 (2Н, т), 4,15 - 4,3 (1Н, м), 6,2 (1Н, д), 7,1 распределяют между водой и диэтиловым эфи(1Н, д), (масло) из соединения II 4, используя 2,1 ром Органическую фазу сушат над сульфатом эквивалента окислителя магния, фильтруют и упаривают с получением (4) 3-(4,4-дифторбут-3-енилсульфинил)-2зеленоватой жидкости Хроматография на силикаметилфуран геле (элюент 20% этилацетат в гексане) дает со(соединение II 8), Н ЯМР S 2,3-2,45 (5Н, м), единение III 5 (0,44г) М + = 236, 1Н ЯМР 5 1,8 - 2,0 2,8-2,9 и 3,1-3,2 (всего, 2Н, м), 4,2-4,35 (1Н, м), (1Н, ушир, с), 2,3 (2Н, м), 2,8 (2Н, т), 4,1 - 4,3 (1Н, 6,66 (1Н, д), 7,4 (1Н, д), из соединения II 4, испольм), 4,8 (2Н, с), 6,8 (1Н, д), 7,0 (1Н, д), (масло) зуя 1 эквивалент окислителя (5) 3-(4,4-дифторбут-3-енилсульфонил)-2метилфуран (соединение II 9), 1Н ЯМР 5 2,42 - 2,52 (2Н, м), 2,6 (ЗН, с), 3,2 - 3,28 (2Н, т), 4,1 - 4,23 (1Н, м), 6,6 (1Н, д), 7,36 (1Н, д) из соединения II 4, используя 2,1 эквивалента окислителя ПРИМЕР III 1 В данном примере описан способ получения 2-(4,4-дифторбут-3-енилтио)тиофена (соединение N11) Раствор, содержащий 2-меркаптотиофен (Юг), 4-бром-1,1 -дифторбут-1 -ен (15,47г) и карбонат калия (11,87г) в ацетоне (250см3), нагревают при кипячении с обратным холодильником в течение 2 часов и затем оставляют стоять в течение 18 часов Реакционную смесь гасят водой и несколько раз экстрагируют диэтиловым эфиром Объединенные органические экстракты сушат над сульфатом магния, фильтруют и упаривают с получением янтарного масла Хроматография на ПРИМЕР III 4 В данном примере описан способ получения (Е)и (2)-(4,4-дифторбут-3-енилтио)-5гидроксиметилтиофена (соединения III 6 и III 7) В течение 5 минут в этаноле (15см3) воде (15см3) перемешивают гидрохлорид гидроксиламина (0,9г) и гидрокарбонат натрия (1,09г) Прибавляют соединение III 4 (Зг) и реакционную смесь перемешивают при комнатной температуре в течение 2 часов и затем оставляют стоять в течение 18 часов Реакционную смесь распределяют между водой и диэтиловым эфиром Органическую фазу сушат над сульфатом магния, фильтруют и упаривают с получением янтарной жидкости Хроматография на силикагеле (элюент 20% етилацетат в гексане) дает соединение III 6 (1,5г) и III 7 (1,3г) М + = 249, 1Н ЯМР 5 2,25 - 2,35 (2Н, м), 2,85 (2Н, т), 4,14 - 4,35 (1Н, м), 7,05 (2Н, м), 7,52 (1Н, ушир, с), 8,18 (1Н, с), (масло) и М + = 249, 5 2,25 2,38 (2Н, м), 2,85 - 2,95 (2Н, т), 4,18 - 4,35 (1Н, м), 23 44732 24 7,08 (1Н, д), 7,25 (1Н, д), 7,64 (1Н, с), (масло) (2) 2-(4,4-дифторбут-3енилсульфинил)бензо[Ь1тиофен ПРИМЕР III 5 В данном примере описан способ получения (соединение III 11), f H ЯМР 5 2,3 - 2,4 (2Н, м), 5-циано-2-(4,4-дифторбут-3-енилтио)тиофена (со3,0 - 3,2 (2Н, м), 4,2 - 4,4 (1Н, м), 7,45 (1Н, м), 7,9 единение III 8) (2Н, м), 7,75 (1Н, с) из соединения III 10, используя один эквивалент окислителя 1,1-Карбонилдиимидазол (0,326г) прибавляют к раствору соединения III 6 (0,5г) и затем реакци(3) 2-(4,4-дифторбут-3онную смесь перемешивают при комнатной теменилсульфонил)бензо[Ь]тиофен пературе в течение 10 минут, затем нагревают с (соединение III 12), 1Н ЯМР 5 2,5 (2Н, м), 3,3 обратным холодильником в течение 2 часов и ос(2Н, т), 4,2 - 4,35 (1Н, м), 7,5 (2Н, м), 7,9 (ЗН, м) из тавляют стоять в течение 18 часов Прибавляют соединения III 10, используя два эквивалента еще эквивалент 1,1-карбонил-диимидазола и реокисли теля акционную смесь нагревают с обратным холоПРИМЕР IV 1 дильником в течение 1 часа Реакционную смесь В данном примере описан способ получения фильтруют через целит и затем упаривают с поэтил 5-(4,4-дифторбут-3-енилтио)метилизоксазол1 лучением соединения III 8 (0,28г) Н ЯМР 5 2,274-карбоксилат (соединение IV 8) 2,38 (2Н, м), 2,94 (2Н, т), 4,15 - 4,33 (1Н, м), 7,05 Раствор 4,4-дифторбут-З-енилтиоацетата (2г) (1Н, д), 7,5 (1Н, д), (масло) в 50%-ном растворе гидроксида натрия (6,7см3) ПРИМЕР III 6 энергично перемешивают в течение 30 минут В данном примере описан способ получения Прибавляют этил 5-хлор-4-метилизоксазол (2,2г) и 5-ацетил-2-(4,4-дифторбут-3-енилтио)тиофена затем тетра-н-бутиламмонийбромид (катализатор) (соединения III 9) и реакционную смесь перемешивают при комнатной температуре в атмосфере азота Через 3 часа К раствору метилмагнийбромида (1,3см3, 2М слои разделяют и органическую фазу промывают раствор в диэти-ловом эфире, 3 эквивалента) солевым раствором, сушат (МдБОД фильтруют и медленно прибавляют к раствору соединения III 8 упаривают при пониженном давлении Остаток (0,3г) в тетрагидрофуране (10см3) Реакционную перемешивают с 880 аммиаком, вызывая крисмесь перемешивают при комнатной температуре сталлизацию Кристаллы отделяют фильтрацией с в течение 3 часов и растворитель упаривают Осполучением соединения IV 8 (2,87г) 1Н ЯМР 5 таток распределяют между раствором гидроксида 1,35 (ЗН, т), 2,45 (ЗН, с), 2,50 (2Н, м), 3,20 (2Н, т), аммония и хлороформом Органический слой 4,25 (1Н, м), 4,30 (2Н, кв), (т пл 41 - 42°С) промывают водой, сушат над Na2SO4 и упаривают Остаток хроматографируют на силикагеле (элюПРИМЕРА 2 ент 10% етилацетат в гексане) с получением соВ данном примере описан способ получения 1 единения III 9 (0,16г) Н ЯМР 5 2,30 - 2,40 (2Н, м), 5-(4,4-дифторбут-3-енилтио)метилизоксазол-42,50 (ЗН, с), 2,97 (2Н, т), 4,15 - 4,33 (1Н, м), 7,04 карбоновой кислоты (соединение IV 9) (1Н, д), 7,55 (1Н, д), (масло) Раствор соединения IV 8 (0,5г) в изопропаноле ПРИМЕР III 7 (5см3) и 2М NaOH (1см3) перемешивают в течение В данном примере описан способ получения 3 часов Смесь затем выливают в воду и промы2-(4,4-дифторбут-3-енилсульфинил)тиофена (совают этилацетатом Водный слой затем подкисединение III 2) ляют 2М HCI и продукт экстрагируют этилацетатом Экстракт затем сушат (МдБОД фильтруют и Соединение III 1 (0,50г) перемешивают при упаривают при пониженном давлении с полученикомнатной температуре в дихлорметане (5см3) и ем соединения IV 9 (0,16г) М + = 249, 1Н ЯМР 5 прибавляют 3-хлорнадбензойную кислоту (0,834г 2,45 (ЗН, с), 2,50 (2Н, м), 3,20 (2Н, т), 4,20 -4,40 50%-ной твердой по весу, 1 эквивалент) После (1Н, м), (т пл 132-133°С) того, как ТСХ показывает полное расходование исходного продукта реакционную смесь гасят доПРИМЕР IV 3 бавлением насыщенного водного раствора бикарВ данном примере описан способ получения боната натрия и продукт затем экстрагируют ди5-(4,4-дифторбут-3-енилтио)-3-метилизоксазол-4хлорметаном Органическую фазу отделяют, карбоксамида (соединение IV 7) промывают насыщенным раствором соли и сушат Триэтиламин (0,33см3) и этилхлорформиата над сульфатом магния После фильтрации и кон(0,24см3) прибавляют к соединению IV 9 (0,56г) в центрирования упариванием при пониженном дихлорметане (15см3) при 0°С Реакционной смедавлении получают жидкий продукт (0,584г), котоси дают нагреться до комнатной температуры и рый затем очищают хроматографией на силикагеперемешивают в течение 2 часов Через раствор ле, используя 20%-ный этилацетат в гексане в барботируют аммиак до насыщения и затем реаккачестве элюента и затем диэтиловый эфир для ционную смесь перемешивают в течение 1 часа вымывания соединения III 2 (0,29г) 1Н ЯМР 5 2,3Прибавляют водный аммиак и продукт экстраги2,55 (2Н, м), 2,9 - 3,2 (2Н, м), 4,2 - 4,5 (1Н, м), 7,15 руют дихлорметаном Органическую фазу промы(1Н, м), 7,5 (1Н, м), 7,7 (1Н, м), (масло) вают водой, сушат (MgSO4), фильтруют и упаривают при пониженном давлении Очистка Вышеописанным способом получают следуюдистилляцией в аппарате кугельрора с полученищие соединения в соответствии с изобретением ем соединения IV 7 (0,069г) 1Н ЯМР 5 2,45 (2Н, (1) 2-(4,4-дифторбут-3-енилсульфонил)тиофен 1 м), 2,50 (ЗН, с), 3,25 (2Н, т), 4,25 (1Н, м), (т пл (соединение III 3), Н ЯМР 5 2,4 - 2,6 (2Н, м), 3,2 87°С) 3,4 (2Н, т), 4,1 - 4,3 (1Н, м), 7,15 (1Н, дд), 7,7 - 7,8 (1Н, м), (масло) из соединения III 1, используя два ПРИМЕР IV 4 эквивален та окислителя В данном примере описан способ получения 25 44732 26 3-(5-хлорфур-2-ил)-5-(4,4-дифторбут-3-енилтио)-3(1Н, м), 6,00 (1Н, с), (масло) изоксазол (соединение IV 23) ПРИМЕР IV 6 Через перемешиваемый раствор метоксида В данном примере описан способ получения калия (1,9г) в этаноле (10см3), охлажденном на 3-(5-хлорфур-2-ил)-5-(4,4-дифторбут-3бане ацетон со льдом барботируют сероводород енилсульфинил)изоксазол (соединение IV 24) Прибавляют 5-хлор-3-(5-хлорфур-2-ил)изоксазол К перемешиваемому раствору соединения (2,2г) и реакционную смесь затем нагревают с обIV 23 (2г) в метаноле (40см3), охлаждаемому на ратным холодильником в течение 1 часа, в течебане из ацетона со льдом, прибавляют магний ние которого упаривают растворитель Прибавлямонопероксифталат (9,4г) После перемешивания ют ацетон (10см3) и 4-бром-1,1 -дифторбут-1 -ен в течение 30 минут охлаждающую баню удаляют и (2г) и смесь нагревают с обратным холодильником реакционной смеси дают нагреться до комнатной еще в течение 2 часов Полученный раствор охтемпературы и перемешивают в течение 1 часа лаждают, выливают в диэтиловый эфир и солевой Смесь выливают в диэтиловый эфир и солевой раствор и слои разделяют Водный слой экстрагираствор и слои разделяют Объединенные оргаруют эфиром Объединенные органические фазы нические фазы промывают 2М NaOH, водой и сопромывают солевым раствором, сушат (MgSO4), левым раствором и слои разделяют Объединенфильтруют и упаривают при пониженном давленые органические фазы промывают 2М NaOH, нии с получением темного твердого продукта водой и насыщенным раствором соли, сушат Очистка колоночной хроматографией на силика(MgSO4), фильтруют и упаривают при пониженном геле с использованием 10%-ного эфира в гексане давлении с получением соединения IV 24 (1,9г) в качестве элюента дает соединение IV 23 (2г) М + М + = 323, 1Н ЯМР 5 2,50 - 2,60 (2Н, м), 3,40 (2Н, т), = 291, 1Н ЯМР 5 2,35 - 2,50 (2Н, м), 3,10 (2Н, т), 4,25 (1Н, м), 6,38 (1Н, д), 7,05 (1Н, д), 7,20 (1Н, с), 4,30 (1Н, м), 6,30 (1Н, д), 6,43 (1Н, с), 6,90 (1Н, д), (т пл 86,5 - 88,5°С) Вышеописанным способом (т пл 80-82°С) получают следующие соединения в соответствии с изобретением Следующее соединение в соответствии с изобретением получают вышеописанным способом (1) 5-(4,4-дифторбут-3-енилсульфинил)-3фенилизоксазол (соединение IV 2), М + = 283, 1Н (1) 5-(4,4-дифторбут-3-енилтио)-3ЯМР 5 2,53 (2Н, м), 3,25 (2Н, т), 4,29 (1Н, м), 7,18 фенилизоксазол (1Н, с), 7,50 (ЗН, м), 7,80 (2Н, м), (масло) из соеди(соединение IV 1), М + = 267, 1Н ЯМР 5 2,43 нения IV 1 и одного эквивалента окислителя (2Н, м), 3,10 (2Н, т), 4,28 (1Н, м), 6,50 (1Н, с), 7,45 (ЗН, (2) 5-(4,4-дифторбут-3-енилсульфонил)-3м), 7,78 (2Н, м), (масло) из 5-хлор-З-фенилфенилизоксазол изоксазола (соединение IV 3), М + = 299, 1Н ЯМР 5 2,57 ПРИМЕР IV 5 (2Н, м), 3,43 (2Н, т), 4,27 (1Н, м), 7,2 (1Н, с), 7,51 В данном примере описан способ получения (ЗН, м), 7,80 (2Н, м), (т пл 57 - 58,5°С) из соеди2-(4,4-дифторбут-3-енилтио)-3-метилизоксазол нения IV 1 и двух эквивалентов окислителя (соединение IV 10) (3) 3-(тиен-2-ил)-5-(4,4-дифторбут-3К перемешиваемому раствору оксима ацетона енилсульфонил)-изоксазол (соединение IV 26), М+ (0,365г) в сухом тетрагидрофуране (20см3) при 0°С = 306, 1Н ЯМР 5 2,50 - 2,63 (2Н, м), 3,41 (2Н, т), в атмосфере азота прибавляют н-бутиллитий 4,27 (1Н, м), 7,20 (2Н, с), 7,14 - 7,23, 7,52 (2Н, м), (4,6см3 2,5М раствора в гексане) с получением (т пл 55 - 57°С) из 3-(тиен-2-ил)-5-(4,4-дифторбутбледно-желтого осадка После перемешивания 3-енилтио)изоксазола, соединения IV 25, в свою при 0°С в течение 30 минут прибавляют дисульочередь полученного из 5-хлор-3-(тиен-2фид углерода (0,3 см3) с получением яркооранжеил)изоксазола по способу примера IV 4 вого раствора Еще через 10 минут прибавляют ПРИМЕРV1 ЗМ НСІ (20см3) и реакционную смесь нагревают с В данном примере описан способ получения обратным холодильником в течение 3 часов и за3-хлор-4-циано-5-(4,4-дифторбут-3тем охлаждают Слои разделяют и водный слой енилтио)изотиазола (соединение V 2) экстрагируют хлороформом Объединенные оргаРаствор 4-циано-3,5-дихлоризотиазола (1г) в нические фазы сушат (МдБОД фильтруют и упаметаноле (10см ) прибавляют в течение более 15 ривают при пониженном давлении с получением мин к раствору наногидрата сульфида натрия коричневого масла Масло затем обрабатывают (1,3г) в воде (2,6см3) и метаноле (25см3), нагретом 3 ацетоном (11см ) и прибавляют 1-бром-4,4до 50°С Реакционную смесь перемешивают в дифторбут-3-ен (0,77г) и карбонат калия (0,87г) и течение 1 часа и затем растворитель упаривают реакционную смесь нагревают с обратным холопри пониженном давлении с получением желтого дильником в течение 3,5 часов и затем охлаждатвердого продукта Остаток растворяют в ацетоне ют Затем смесь выливают в зтилацетат и 1М НСІ (20см3), прибавляют 4-бром-1,1-дифторбут-1-ен и слои разделяют Водный слой экстрагируют (0,68г) и реакционную смесь перемешивают в теэтилацетатом и объединенные органические фачение 12 часов Полученную смесь выливают в зы сушат (MgSO4), фильтруют и упаривают при воду и слои разделяют Водный слой экстрагирупониженном давлении с получением коричневого ют етилацетатом Объединенные органические масла Очистка колоночной хроматографией на фазы сушат (МдБОД фильтруют и упаривают при силикагеле с использованием 1 9 этилацетапониженном давлении Очистка колоночной хрота гексана дает 2-(4,4-дифторбут-3-енилтио)-3матографией на силикагеле с использованием в + 1 метилизоксазола (0,105г) М = 205, Н ЯМР 5 2,3 качестве элюента 1 1 этилацетата гексана дает (ЗН, с), 2,40 (ЗН, с), 2,40 (2Н, м), 3,05 (2Н, т), 4,25 соединение V 2 (0,88г) М + = 266, 1Н ЯМР 5 2,50 27 44732 28 (2Н, м), 3,20 (2Н, т), 4,20 - 4,40 (1Н, м), (масло) единение VI 1) 1Н ЯМР (CDCI3) 5 2,45 (2Н, м), 3,20 По вышеуказанному способу получают сле(2Н, т), 4,25 (1Н, м), 7,10 (1Н, с), 7,66 (1Н, с), (масдующее соединение по изобретению, но испольло) из оксазол-2-тиона зуя 2 эквивалента нонагидрата сульфида натрия и (2) 2-(4,4-дифторбут-3-енилтио)-44-бром-1,1 -д ифторбут-1 -ен метилоксазол (1) 3,5-бис-(4,4-дифторбут-3-енилтио)-4(соединение VI 6) М + 205, 1Н ЯМР 5 2,04 (ЗН, цианоизотиазол с), 2,45 (2Н, м), 3,18 (2Н, т), 4,25 (1Н, м), 7,38 (1Н, (соединение V12) 1Н ЯМР 5 2,40 - 2,60 (4Н, кв), (масло) из 2-меркапто-4-метилоксазола м), 3,20 (2Н, т), 3,30 (2Н, т), 4,20 - 4,40 (2Н, м), ПРИМЕР VI 2 (масло) В данном примере описан 3-х стадийный споПРИМЕРУ 2 соб получения метил 2-(4,4-дифторбут-3В данном примере описан способ получения енилтио)метилизоксазол-5-карбоксилата (соеди5-(4,4-дифторбут-3-енилсульфонил)-4нение VI 32) цианоизотиазола (соединение V 6) и 3,5-(4,4Стадия 1 Метил-2-амино-4-метилоксазол-5дифторбут-3-енилсульфонил)-4-цианоизотиазола карбоксилат (соединение V 15) Метил 3-хлорацетоацетат (75г) и мочевину К раствору соединения V 12 (0,1 г) в дихлорме(90г) в метаноле (200 см3) перемешивают и нагре3 тане (5см ) прибавляют 3-хлорнадбензойную кивают с обратным холодильником в течение 24 слоту (0,42г) и реакционную смесь перемешивают часов Реакционную смесь охлаждают до комнатдо тех пор, пока исходный продукт не израсходуной температуры и осадок отфильтровывают от ют Реакционную смесь выливают в этилацетат и раствора, промывают холодным метанолом и отводу и слои разделяют Водный слой экстрагирусасывают досуха Этот твердый продукт обрабают етилацетатом Объединенные этилацетатные тывают 2М гидроксидом натрия и продукт экстрафазы промывают гидрокарбонатом натрия, сушат гируют этилацетатом (несколько порций) (MgSO4), фильтруют и упаривают при пониженном Упаривание растворителя при пониженном давледавлении Остаток обрабатывают диэтиловым нии дает бесцветный твердый продукт (14,5г), коэфиром и прибавляют триэтиламин, вызывающий торый перекристаллизовывают из ацетонитрила, помутнение раствора Эфирный раствор затем т пл 225°С (разл) 1Н ЯМР DMSO-d6) 5 2,15 (ЗН, промывают водой, сушат (MgSO4), фильтруют и с), 3,75 (ЗН, с), 7,4 (2Н, шир) упаривают Очистка остатка колоночной хроматоСтадия 2 Метил-2-хлор-4-метилоксазол-5графией на силикагеле с использованием в качекарбоксилат стве элюента 1 1 этилацетата гексана дает соедиПродукт со стадии 1 (1,56г) частично раствонение V15 (0,01г) М+ = 418, 1Н ЯМР 5 2,60 -2,70 ряют в сухом ацетонитриле (40см3) и прибавляют (4Н, м), 3,60 (4Н, т), 4,30 (2Н, м), (масло) и соедипо частям при 8°С к перемешиваемой смеси хлонение V 6 (0,08г) М + = 264, 1Н ЯМР 5 2,60 (2Н, м), рида меди (2) (1,61 г) и третичного бутилнит-рита в 3,60 (2Н, т), 4,30 (1Н, м), 9,40 (1Н, с), (масло) ацетонитриле (сухой, 20см3) в атмосфере азота Полученный коричневый раствор перемешивают ПРИМЕР VI 1 при 20°С в течение 2 часов и упаривают при поОксазолы, замещенные группой 4,4ниженном давлении Остаток обрабатывают воддифторбут-3-енилтио по 2, 4 и 5-му положению, ной 2М соляной кислотой и продукт экстрагируют могут быть получены исходя из соответственно диэтиловым эфиром Органическую фазу сушат замещенного меркаптооксазола и подходящего (MgSO4) и затем промывают на короткой колонке с дифторбут-1-енового алкилирующего агента Это силикагелем еще эфиром Фильтрат упаривают иллюстрировано следующим получением 2-(4,4при пониженном давлении с получением требуедифторбут-3-енилтио)-5-фенилоксазола (соедимого промежуточного продукта (0,9г) в виде желнение VI 18) того твердого продукта М + = 175 К раствору 2-меркапто-5-фенилоксазола (0,44г) в ацетоне (15см3) прибавляют 4,4-дифторЗ-бутен-4-метилбензолсульфонат (0,7г) и карбонат калия (0,369г) и реакционную смесь нагревают с обратным холодильником в течение всего 8 часов, после чего часть исходного тозилата остается Прибавляют еще 2-меркапто-5-фенилоксазола (0,05г) и нагревание продолжают в течение 5 часов Реакционную смесь охлаждают, выливают в диэтиловый эфир и воду и слои разделяют Водный слой экстрагируют эфиром и объединенные органические фазы сушат (MgSO4) и упаривают при пониженном давлении с получением желтой жидкости Хроматография на силикагеле с использованием 5%-ного трет-бутилдиметилового эфира в гексане дает соединение VI 18, 1Н ЯМР (CDCI3) 5 2,51 (2Н, м), 3,23 (2Н, т), 4,30 (1Н, м), 7,23 - 7,47 (4Н, м), 7,58 (2Н, д), (масло) По вышеуказанному способу получают следующие соединения по изобретению (1) 2-(4,4-дифторбут-3-енилтио)-оксазол (со Стадия 3 Метил-(4,4-дифторбут-3-енилтио)-4метилоксазол-5-карбоксилат Продукт со стадии 2 (0,176г) и тиомочевину (0,084г) в этаноле (5см3) перемешивают и нагревают с обратным холодильником в течение 5 часов Реакционную смесь охлаждают и растворитель удаляют путем упаривания при пониженном давлении с получением желтой смолы, которую растворяют в ацетоне, содержащем 4-бром-1,1дифторбут-1-ена (0,17г) и карбонат калия (0,Зг) Эту смесь перемешивают в течение 1 часа в атмосфере азота при комнатной температуре и оставляют стоять в течение 18 часов Растворитель упаривают при пониженном давлении и остаток обрабатывают водой и диэтиловым эфиром Органическую фазу отделяют, сушат (MgSO4) и упаривают с получением соединения VI 32 (0,095г), М + = 175, 1Н ЯМР 5 2,45 (5Н, м), 3,22 (2Н, т), 3,90 (ЗН, с), 4,25 (5Н, м), (масло) ПРИМЕР VI 3 29 44732 30 В данном примере описан способ получения пониженном давлении, экстрагируют гексаном 2-(4,4-дифторбут-3-енилтио)-4-метилоксазол-5(50см3), фильтруют и фильтрат упаривают при карбоновой кислоты (соединение VI 37) пониженном давлении Остаток фракционируют с помощью хроматографии (силикагель, элюент Соединение VI 32 (0,4г) растворяют в пропан20%-ный ди-этиловый эфир в гексане) с получе2-оле (10см3), содержащем водный гидроксид нанием соединения VI 13 (0,75г) М + = 225, 1Н ЯМР 5 трия (2см3 2М раствора) и перемешивают в тече2,46 (2Н, м), 3,16 (2Н, т), 4,28 (1Н, м), 6,86 (14, с), ние 5 часов при комнатной температуре Смесь (масло) упаривают при пониженном давлении и остаток разбавляют водой, экстрагируют етилацетатом, По вышеуказанному способу получают слеподкисляют разбавленной хлористоводородной дующее соединение по изобретению из соединекислотой и вновь экстрагируют этилацетатом (3 х ния VI 6 100см3) Последние экстракты объединяют, про(1) 2-(4,4-дифторбут-3-енилтио)-4-метил-5мывают насыщенным солевым раствором, сушат хлороксазол (МдБСч) и упаривают при пониженном давлении с (соединение VI 15) МН+ = 239, 1Н ЯМР 5 2,05 получением требуемого продукта в виде бесцвет(ЗН, с), 2,45 (2Н, м), 3,15 (2Н, т), 4,25 (1Н, м), (масного твердого продукта (0,Зг) М + = 249, 1Н ЯМР 5 ло) 2,5 (5Н, м), 3,27 (2Н, т), 4,27 (1Н, м), 6,5 (1Н, ПРИМЕР VI 6 ушир с), (т пл 66 - 68°С) Натриевая соль этого В данном примере описан способ получения соединения получена обработкой образца (0,7г) 2-(4,4-дифторбут-3-енилтио)-4-метилоксазол-5раствором метоксида натрия в сухом метаноле карбоксамила (соединение VI 40) (0,061г металлического натрия, растворенного в Соединение VI 32 (1,5г) растворяют в метанометаноле (10см3)) при комнатной температуре ле (10см3) и обрабатывают водным аммиаком Упаривание раствора при пониженном давлении (35см3, плотность 0,88) при комнатной температудает натриевую соль соединения VI 37 в виде + ре Смесь перемешивают в течение 5 часов, разбесцветного твердого продукта, M (FAB) = 271, (т бавляют солевым раствором и продукт экстрагипл 211 -212°С) руют этилацетатом (2 х 100см3) Объединенные органические фазы промывают солевым раствоПо вышеуказанному способу получают слером (4 х 50см3), сушат (MgSO4) и упаривают при дующее соединение по изобретению пониженном давлении, остаток промывают гекса(1) 2-(4,4-дифторбут-3-енилтио)-4ном с получением соединения VI 40 (1г) М + = 248, тр и фто р м етил о ксазол-5-карбоновая кислота (со1 1 Н ЯМР 5 2,50 (5Н, м), 3,26 (2Н, т), 3,85 (ЗН, с), единение VI 36) Н ЯМР 5 2,54 (2Н, м), 3,32 (2Н, 4,28 (1Н, м), 5,6, 6,0 (2Н, ушир, с), (т пл 72-73°С) т), 4,28 (1Н, м), 7,65 (1Н, ушир, с) из соединения VI 31 ПРИМЕР VI 7 ПРИМЕР VI 4 В данном примере описан способ получения В данном примере описан способ получения 5-циано-2-(4,4-дифторбут-3-енилтио)-42-(4,4-дифторбут-3-енилтио)-4метилоксазола (соединение VI 25) тр и фтор метил о ксазол а (соединение VI 4) Соединение VI40 (0,64г) растворяют в ди2-Амино-4-трифторметилоксазол (0,84г) в дихлорметане (10см3), содержащем сухой пиридин хлорметане (25см3), содержащем бис(4,4(1см3), при комнатной температуре и обрабатыдифторбут-3-енил)сульфид (2,71 г), перемешивают вают метансульфонилхлоридом (0,5см3) Раствор при 0°С и обрабатывают по каплям третперемешивают в течение 5 часов, пиридин (1см3), бутилнитритом (0,62г) в атмосфере азота Реаквыдерживают в течение 72 часов, прибавляют ционный раствор упаривают при пониженном давеще метансульфонилхлорид (0,25см3) и пиридин лении и остаток фракционируют с помощью хро(0,5см3), перемешивают в течение 48 часов мато-графии (силикагель, элюент - гексан) с Смесь обрабатывают разбавленной хлористовополучением соединения VI 4 (0,35г) М + = 259, 1Н дородной кислотой и продукт экстрагируют етилЯМР 5 2,50 (2Н, м), 3,26 (ЗН, т), 4,28 (1Н, м), 7,95 ацетатом Объединенные органические фазы про(1Н, кв), (масло) мывают солевым раствором и сушат (MgSO4) После фильтрации растворитель упаривают при По вышеуказанному способу получают слепониженном давлении и остаток фракционируют с дующее соединение по изобретению помощью хроматографии (силикагель, элюент (1) Этил 2-(4,4-дифторбут-3-енилтио)-410%-ный этилацетат в гексане) с получением сотрифторметил-оксазод-5-карбоксилат (соединение единения VI 25 (0,46г) М + = 230, 1Н ЯМР 5 2,32 VI 31) МН+ = 322, 1Н ЯМР 5 1,40 (ЗН, т), 2,52 (2Н, (ЗН, с), 2,50 (2Н, м), 2,58 (ЗН, с), 3,25 (2Н, т), 3,85 м), 3,30 (2Н, м), 4,28 (1Н, м), 4,43 (2Н, кв), (масло) (ЗН, с), 4,28 (1Н, м), (масло) из этил 2-амино-4-трифторметилоксазол-5карбоксилата (полученного из 1,1,1ПРИМЕР VI 8 трифторметилацетоацетата и мочевины по спосоВ данном примере описан способ получения бу, аналогичному примеру VI 2) г\|-метилсульфонил-2-(4,4-дифторбут-3-енилтио)4-метилоксазолкарбоксамида (соединение VI 38) ПРИМЕР VI 5 В данном примере описан способ получения Натриевую соль соединения VI 37 (0,52г) пе2-(4,4-дифторбут-3-енилтио)-5-хлороксазола (соремешивают в гексане (6,5см3) и обрабатывают единение VI 13) оксалилхлоридом (0,275г) при комнатной температуре Смесь перемешивают в течение 6 часов, Соединение VI 1 (2,0г) растворяют в ацетовыдерживают в течение 18 часов и упаривают при нитриле (50см3), содержащем N-хлорсукцинимид пониженном давлении Остаток, содержащий про(1,50г), и перемешивают при комнатной темпераизводное оксазолкарбонилхлорид, обрабатывают туре в течение 24 часов Смесь упаривают при 31 32 (соединение VII 17) К раствору 2-меркапто-5-фенилтиазола (0,483г) в ацетоне (15см3) прибавляют 4,4-дифторЗ-бутенил-4-метилбензол-сульфоната (0,7г) и карбонат калия (0,369г) и реакционную смесь нагревают с обратным холодильником в течение всего 8 часов, после чего часть исходного тозилата остается Прибавляют еще 2-меркапто-5фенилоксазола (0,05г) и нагревание продолжают в течение 5 часов Реакционную смесь охлаждают, выливают в диэтиловый эфир и воду и слои разделяют Водный слой экстрагируют эфиром и объединенные органические фазы сушат (MgSC^) и упаривают при пониженном давлении с получением желтой жидкости Хро-матография на силикагеле с использованием 5%-ного трет-бутилдиметилового эфира в гексане дает соединение VII 17 (0,582г) М + = 283, 1Н ЯМР 5 2,51 (2Н, м), 3,31 (2Н, т), 4,32 (1Н, м), 7,26 (1Н, с), 7,30 - 7,48 (ЗН, м), 7,89 (2Н, д), (масло) 44732 раствором метансульфонамида (0,20г) в сухом бутан-2-оне (5см3), нагревают с обратным холодильником при перемешивании в течение 18 часов, охлаждают до комнатной температуры выдерживают в течение 18 часов Смесь упаривают при пониженном давлении, остаток растворяют в воде, подкисляют 2М хлористоводородной кислотой и продукт экстрагируют диэтиловым эфиром (2x150см3) Эфирные экстракты объединяют, промывают водным насыщенным раствором хлорида натрия, сушат (MgSC^), упаривают при пониженном давлении и остаток очищают с помощью хроматогра-фии (силикагель, элюент ацетонитрил) с получением соединения VI 38 (0,20г) М + = 326, 1Н ЯМР 5 2,50 (5Н, м), 3,27 (2Н, т), 3,40 (ЗН, с), 4,28 (1Н, м), (т пл 60-62°С) ПРИМЕР VI 9 В данном примере описан способ получения 2-(4,4-дифторбут-3-енилсульфинил)-5фенилоксазола (соединение VI 19) К раствору соединения VI 18 (1г) в дихлорметане (40см3) прибавляют 3-хлорнадбензойную кислоту (1,3г 50%-ной твердой по весу, (1экв)) и реакционную смесь перемешивают при комнатной температуре в течение 5 часов Реакционную смесь выливают в смесь диэтилового эфира и водного бикарбоната натрия и слои разделяют Органический слой сушат (MgSC^) и упаривают при пониженном давлении с получением белого твердого продукта, который очищают с помощью хроматографии на силикагеле, элюируя 1 4 этилацетатом гексаном с получением соединения VI 19 (0,567г) М + = 283, 1Н ЯМР 5 2,50 (2Н, м), 3,41 (2Н, т), 4,29 (1Н, м), 7,27 (1Н, с), 7,38 - 7,55 (ЗН, м), 7,71 (2Н, д), (масло) По общему описанному выше способу из соответствующих тио-эфиров, но используя 2 эквивалента 3-хлорнадбензойной кислоты получают следующие соединения по изобретению (1) 2-(4,4-дифторбут-3-енилсульфонил)-4трифторметил-оксазол (соединение VI 5) 1Н ЯМР 5 6 2,65 (2Н, м), 3,58 (2Н, т), 4,28 (1Н, м), 8,24 (1Н, кв), (масло) (2) 5-хлор-2-(4,4-дифторбут-3енилсульфонил)оксазол (соединение VI 14) MNH 4 + = 275, 1Н ЯМР 5 2,60 (2Н, м), 3,47 (2Н, т), 4,26 (1Н, м), 7,18 (1Н, с), (масло) (3) 5-хлор-2-(4,4-дифторбут-3енилсульфонил)-4-метилоксазол (соединение VI 16) 1Н ЯМР 5 2,25 (ЗН, с), 2,60 (2Н, м), 3,45 (2Н,т), 4,26 (1Н, м), (масло) (4) 2-(4,4-дифторбут-3-енилсульфонил)-5фенилоксазол (соединение VI 20) М + = 299, 1Н ЯМР 5 2,62 (2Н, м), 3,51 (2Н, т), 4,27 (1Н, м), 7,26 (1Н, с), 7,427,55 (ЗН, м), 7,69-7,79 (2Н, д), (т пл 55 - 59°С) ПРИМЕР VII 1 Данный пример иллюстрирует общий способ получения тиазолов, замещенных 4,4-дифторбут3-енилтио группой по 2, 4 или 5-му положению, исходя из соответствующим образом замещенного меркаптотиазола и подходящего дифторбут-1енового алкилирующего агента Это продемонстрировано следующим получением 2-(4,4дифторбут-3-енилсульфинил)-5-фенилоксазола По общему описанному выше способу получают следующие соединения по изобретению (1) 2-(4,4-дифторбут-3-енилтио)тиазол (соединение VI 5) М + = 207, 1Н ЯМР 5 2,47 (2Н, м), 3,62 (2Н, т), 4,27 (1Н, м), 7,22 (1Н, д), 7,68 (1Н, д), (масло) из 2меркаптотиазола (2) 2-(4,4-дифторбут-3-енилтио)тиазолин (соединение VII 134) М + = 209, 1Н ЯМР 5 2,40 (2Н, м), 3,15 (2Н, т), 3,4 (2Н, т), 4,18 - 4,31 (1Н, м), 4,2 (2Н, т), (масло) из 2-меркаптотиазолина ПРИМЕР VII 2 Данный пример иллюстрирует двухстадийный способ получения 2-(4,4-дифторбут-3-енилтио)-4трифторметилтиазола (соединение VII 4) Стадия 1 Получение 2-меркапто-4трифторметилтиазола 1-Бром-3,3,3-трифторпропан-2-он (5,0г) втретбутаноле (20см3) обрабатывают дитиокарбаматом (2,9г), смесь перемешивают при комнатной температуре в течение 18 часов, выливают в воду, экстрагируют этилацетатом и органическую фазу сушат (MgSC^) Растворитель упаривают при пониженном давлении и остаток фракционируют с помощью хроматографии (силикагель, элюент гексан этилацетат от 17 3 до 7 3 по объему) с получением гидрата (2,16г) требуемого меркаптотиазола Часть этого продукта (1,0г) прибавляют к толуолу (20см3), содержащему паратолуолсульфоновую кислоту (0,005г, каталитическое количество) и нагревают с обратным холодильником в течение 4 часов Образующуюся в реакции воду удаляют с помощью насадки ДинаСтарка Раствор охлаждают до комнатной температуры, промывают водой, сушат (МдБОД упаривают при пониженном давлении с получением требуемого промежуточного продукта (0,37г) 1Н ЯМР 8 7,10(11-1, с), 7,8(11-1, с) Стадия 2 Получение соединения VII 4 Продукт со стадии 1 (0,37г) в ацетоне (14см3), содержащий безводный карбонат калия (0,Зг) и 4бром-1,1-дифторбут-1-ен (0,34г) перемешивают и нагревают с обратным холодильником в течение 4 часов Смесь охлаждают, выливают в воду, экстрагируют етилацетатом, сушат (MgSO4) и упаривают при пониженном давлении с получением 33 4473234 водородную кислоту (0,6см3) в течение более 4 Соединения VII 4 (0,30г) М + = 275, 1Н ЯМР 5 2,50 часов для завершения реакции Смесь охлаждают (2Н, м), 3,32 (2Н, т), 4,28 (1Н, м), 7,60 (1Н, с), (масдо комнатной температуры, фильтруют через кило) зельгур с использованием дихлор-метана в качеПо описанной выше стадии 2 получают слестве растворителя и фильтрат экстрагируют дидующие соединения по изобретению хлор-метаном (5 х 250см3) Объединенные (1) этил 2-(4,4-дифторбут-3-енилтио)тиазол-4органические фазы сушат (МдБОД упаривают при карбоксилат (соединение VII 8) 1Н ЯМР 5 1,40 пониженном давлении и остаток фракционируют с (ЗН, т), 2,48 (2Н, м), 4,28 (1Н, м), 4,40 (2Н, кв), 8,03 помощью хроматографии на силикагеле, элюируя (1Н, с), (масло) из этил 2-меркаптотиазол-4гексаном с получением соединения VII 24 (140г) карбоксилата М + = 241, 1Н ЯМР 5 2,42 (2Н, м), 3,20 (2Н, т), 4,25 (2) метил 2-(4,4-дифторбут-3-енилтио)-4(1Н, м), 7,45(14, с), (масло) метилтиазол-5-карбоксилат (соединение VII41) 1 Н ЯМР 5 2,48 (2Н, м), 2,68 (ЗН, с), 3,26 (2Н, т), ПРИМЕР VII 4 3,85 (ЗН, с), 4,28 (1Н, м), (масло) из метил 2В данном примере описан способ получения меркапто-4-метилтиазол-5-карбоксилата 5-бром-2-(4,4-дифторбут-3-енилтио)тиазола (соединение VII 14) (3) 2-(4,4-дифторбут-3-енилтио)-5-нитротиазол Гидробромид 2-амино-5-бромтиазола (11 г) (соединение VII 47) М + = 252, 1Н ЯМР 5 2,52 обрабатывают водным гидрокарбонатом калия, (2Н, м), 3,35 (2Н, м), 4,27 (1Н, м), 8,35 (1Н, с), экстрагируют дихлорметаном (2 х 250см3) и сушат (масло) из 2-меркапто-5-нитротиазола (полученно(MgSO4) Смесь фильтруют и фильтрат прибавго из 2-бром-5-нитротиазола и тиомочевины) ляют к бис-(4,4-дифторбут-3-енил)дисульфиду ПРИМЕР VII 3 (20г) По каплям к перемешиваемому раствору при Данный пример иллюстрирует трехстадийный комнатной температуре в атмосфере азота приспособ получения 5-хлор-2-(4,4-дифторбут-3бавляют трет-бутилнитрит (9,6см ) в дихлорметаенилтио)тиазола (соединение VII 24) Стадия 1 2не (40см3) Реакционную смесь перемешивают в (4-бром-3,4,4-трифторбутилтио)тиазол 2течение 18 часов, упаривают на силикагеле, остаМеркаптотиазол (11,7г) в ацетоне (30см3), содерток помещают на короткую колонку с силикагелем, жащем 1,4-дибром-1,1,2-трифторбутан (27,Ог) обкоторую элюируют (1) гексаном и (2) гексан дирабатывают безводным карбонатом калия (13,8г) этиловым эфиром, 20 1 по объему с получением в атмосфере азота Реакционную смесь перемесоединения VII 14 шивают в течение 1,5 часа, фильтруют и нерастворенный продукт промывают еще ацетоном (4 х (6,4г) М + = 285, 1Н ЯМР 5 2,46 (2Н, м), 3,24 3 25см ) Фильтрат упаривают при пониженном дав(ЗН, т), 4,27 (1Н, м), 7,54 (1Н, с), (масло) лении и остаток фракционируют с помощью хроПРИМЕР VII 5 матографии (силикагель, элюент - 10%-ный этилВ данном примере описан способ получения ацетат в гексане) с получением 2-(4-бром-3,4,42-(4,4-дифторбут-3-енилтио)-4-метилтиазол-5трифторбутилтио)тиазола (29,5г) 1Н ЯМР 5 2,2 сульфонилфторида (соединение VII 52) с приме2,5 (2Н, м), 3,2 - 3,6 (2Н, м), 4,7 - 5,0 (1Н, м), 7,23 нением альтернативного способа диазотирования, (1Н, д), 7,68(1 Н, д) представленного в примере VII 4 2-Амино-4-метилтиазолсульфонилфторид Стадия 2 2-(4-бром-3,4,4-трифторбутилтио)-5(1,5г) в ацетонитриле (10см ) прибавляют по капхлортиазол Продукт со стадии 1 (30,6г) в дихлорлям к перемешиваемой смеси трет-бутилнитрита метане (130см3) обрабатывают при комнатной 3 (1,65см ) и бис-(4,4-дифторбут-3температуре сульфурилхлоридом (9,6см3) в ди3 енил)дисульфида (2,25г) в ацетонитриле (50см3) хлорметане (30см ) в течение более 1 часа при при 60°С в атмосфере азота Смесь нагревают 1 перемешени-вании в атмосфере азота Реакциончас, упаривают при пониженном давлении и останую смесь перемешивают еще 1 час, медленно ток фракционируют с помощью хроматографии выливают в воду (250см3) и перемешивают в те(силикагель, элюент гексан етилацетат 4 1 по чение 0,25 часа Органическую фазу отделяют, объему) с получением соединения VII 52 (1,84г) водную фазу экстрагируют дихлорметаном (2 х М + = 303, 1Н ЯМР 5 2,50 (2Н, м), 2,68 (ЗН, с), 3,32 75см ), объединенные органические фазы промы(2Н,т), 4,28 (1Н, м), (масло) вают водным раствором гидрокарбоната натрия, солевым раствором и сушат (MgSC^) РаствориПо описанному выше способу получают слетель упаривают при пониженном давлении и остадующие соединения по изобретению ток фракционируют с помощью хроматографии (1) 2-(4,4-дифторбут-3-енилтио)-5(силикагель, элюент 5%-ный диэтиловый эфир в метилтиазол гексане) с получением 2-(4-бром-3,4,4(соединение VII 21) М + = 221, 1Н ЯМР 5 2,45 трифторбутилтио)-5-хлортиазола (28,Ог) 1Н ЯМР (5Н, м), 3,22 (2Н, т), 4,26 (1Н, м), 7,30 (1Н, с), (мас5 2,20 - 2,45 (2Н, м), 3,25 - 3,50 (24, м), 4,70 - 5,0 ло) из 2-амино-5-метилтиазола (1Н, м), 7,45 (1Н, с), (масло) (2) 5-хлор-2-(4,4-дифторбут-3-енилтио)тиазол (соединение VII 24) М + = 241, 1Н ЯМР 5 2,45 (2Н, Стадия 3 Соединение VII 24 м), 3,22 (2Н, т), 4,26 (1Н, м), 3,22 (Н, т), 4,26 (1Н, Порошок цинка (ЗЗг) в воде (600см3) перемем), 7,45 (1Н, с), (масло) из 2-амино-5-хлортиазола шивают с иодом (0,17г, каталитическое количестс примене нием альтернативного способа диазово) нагревают до 80°С и прибавляют концентритирования, пред ставленного в примере VII 3 вырованную хлористоводородную кислоту (0,5см ) и ше далее соединение со стадии 2 (125г)в течение более 1,5 часов в атмосфере азота Еще порция(3) 5-хлор-2-(4,4-дифторбут-3-енилтио)-4ми прибавляют цинк (16,6г), иод (0,1 г) и хлористометилтиазол 36 35 44732 Дукт) (соединение VII 27) М + = 255, 1Н ЯМР 5 2,35 (ЗН, с), 2,42 (2Н, м), 3,18 (2Н, т), 4,26 (1Н, м), (масСтадия 3 Получение соединения VII 56 ло) из 2-амино-5-хлор-4-метилтиазола Продукт со стадии 2 подвергали реакции диазотирования, как описано в примере VII 5 выше и ПРИМЕР VII 6 получали соединение VII 56, М + = 356, 1Н ЯМР 5 В данном примере описан двухстадийный 1,15 (6Н, т), 2,45 (2Н, м), 2,60 (ЗН, с), 3,25 (2Н, т), способ получения этил 5-бром-2-(4,4-дифторбут-33,26 (Н, кв), 4,25 (1Н, м), (масло) енилтио)тиазол-4-карбоксилата (соединение VII 11) ПРИМЕР VII 8 Стадия 1 Получение этил 2-амино-5В данном примере описан способ получения бромтиазол-4-карбоксилата 2-амино-5-(4,4-дифторбут-3-енилтио)тиазола (соединение VII 128) Этил 2-амино-4-карбоксилат (5,0г) (полученный из этилбром-пирувата и тиомочевины по споГидробромид 4,4-дифторбут-Зсобу, описанному в J Med Chem , 1971, 14, 1075, енилизотиоурония (16,87г) прибавляют к раствору из соответствующего оксазола) в концентрирогидроксида калия (18,0г) в этаноле (150см3) при 3 ванной бромистоводородной кислоте (9см ) перекомнатной температуре и перемешивают в течемешивают при комнатной температуре и обрабание 0,2 часа в атмосфере азота Порциями притывают по каплям бромом (3,2г), затем нагревают бавляют гидробромид 2-амино-5-бромтиазол до 60°С в течение 2 часов, нейтрализуют карбона(17,76г) в этаноле (150см3), смесь нагревают до том натрия и продукт экстрагируют этилацетатом 40°С в течение 2 часов, нейтрализуют хлористоОрганическую фазу сушат (MgSC^) и упаривают водородной кислотой и упаривают при пониженпри пониженном давлении с получением этил 2ном давлении Остаток растворяют в 2М хлориамино-5-бромтиазол-4-карбоксилата (1,54г) МН+ = стоводородной кислоте, экстрагируют диэтиловым 251, 1Н ЯМР 5 1,40 (ЗН, т), 4,40 (2Н, т), 5,6 (2Н, эфиром, подщелачивают 2М гидроксидом натрия ушир с) и вновь экстрагируют диэтиловым эфиром Последние эфирные экстракты объединяют, сушат Стадия 2 Получение соединения VII 11 (MgSO4) и упаривают при пониженном давлении с Продукт со стадии 1 подвергали реакции диаполучением соединения VII 128 (4,9г) М + = 222, 1Н зотирования, как описано в примере VII 5 выше и + 1 ЯМР 5 2,28 (2Н, м), 2,67 (2Н, т), 4,24 (1Н, м), 5,3 получали соединение VII 11, М = 357, Н ЯМР 5 (2Н, два ушир, с), 7,08 (1Н, с), (т пл 34,6 - 35,4°С) 1,40 (ЗН, т), 2,50 (2Н, м), 3,30 (2Н, т), 4,30 (1Н, м), 4,25 (24, кв), (масло) ПРИМЕР VII 7 В данном примере описан трехстадийный способ получения N.N-диэтил 2-(4,4-дифторбут-3енилтио)-4-метилтиазол-5-сульфонамида (соединение VII 56) Стадия 1 N.N-диэтил 2-ацетамидо-4метилтиазол-5-сульфонамид 2-Ацетамидо-4-метилтиазол-5сульфонилхлорид (5,2г) в тетрагидрофуране (100см3) перемешивают при комнатной температуре и обрабатывают по каплям диэтиламином (4,5см3) Смесь перемешивают в течение 4 часов, упаривают при пониженном давлении и остаток экстрагируют этилацетатом (200см3), промывают водой (2x100см3), сушат (MgSC^) и вновь упаривают при пониженном давлении с получением N.N-диэтил 2-ацетамидо-4-метилтиазол-5сульфонамида (4,9г) 1Н ЯМР 5 1,20 (6Н, т), 2,28 (ЗН, с), 2,57 (ЗН, с), 3,32 (2Н, кв), 9,7 (1Н, ушир, с), (твердый продукт) Стадия 2 N.N-Диэтил 2-амино-4-метилтиазол5-сульфонамид Продукт со стадии 1 (2,5г) растворяют в метаноле (25см3) и охлаждают до 5°С при перемешивании в атмосфере азота Прибавляют по каплям метоксид натрия в метаноле (2см3 25%ного раствора (вес/объем)) и смеси дают нагреться до комнатной температуры в течение 18 часов Реакционную смесь нагревают с обратным холодильником в течение 1 часа, охлаждают, разбавляют водой (250см3), экстрагируют диэтиловым эфиром (2x100см3), сушат (MgSO4) и упаривают при пониженном давлении с получением N,Nдиэтил 2-амино-4-метилтиазол-5-сульфонамида (0,48г) М + = 249, 1Н ЯМР 5 1,20 (6Н, т), 2,48 (ЗН, с), 3,28 (4Н, кв), 5,25 (2Н, ушир, с), (твердый про ПРИМЕР VII 9 В данном примере описан способ получения 5-(4,4-дифторбут-3-енилтио)тиазола (соединение VII 82) Соединение VII 128 (0 30г) растворяют в сухом тетрагидро-фуране (14см ) и нагревают с обратным холодильником в атмосфере азота Прибавляют по каплям трет-бутилнитрит (0,52см3) в тетрагидрофуране (8см3) в течение 0,25ч Смесь нагревают в течение 2 часов Прибавляют еще трет-бутилнитрит (0,52см3) и нагревание продолжают еще в течение 2 часов Раствор охлаждают, упаривают при пониженном давлении и остаток фракционируют с помощью хроматографии (силикагель, элюент гексан этилацетат 1 1 по объему) с получением соединения VII 128 (0,10г) 1Н ЯМР 5 2,28 (2Н, м), 2,82 (2Н, т), 4,24 (1Н, м), 2,82 (2Н, т), 4,24 (1Н, м), 7,86 (1Н, с), 8,86 (1Н, с), (масло) ПРИМЕР VII 10 В данном примере описан способ получения 2-хлор-5-(4,4-дифторбут-3-енилтио)тиазола (соединение VII 114) Соединение VII 128 (4,0г) в ацетонитриле (50см3) прибавляют при 0°С к перемешиваемой смеси хлорида меди (2) (5,38г) и третбутилнитрита (3,71 г) в ацетонитриле (50см ) и дают медленно нагреться до комнатной температуры в течение более 18 часов Растворитель упаривают при пониженном давлении, продукт растворяют в диэтиловом эфире, фильтруют и фильтрат вновь упаривают с получением желтокоричневой жидкости, который фракционируют с помощью хроматографии (силикагель, элюент гексан ди-этиловый эфир 4 1 по объему) с получением соединения VII 114 (2,43г) М + = 241, 1Н ЯМР 5 2,28 (2Н, м), 2,68 (2Н, т), 4,22 (1Н, м), 7,52 (1Н, с), (масло) 37 44732 38 ПРИМЕР VII 10 метилтиазол-5-карбоксамид (соединение VII36) 1 Н ЯМР 5 2,48 (2Н, м), 2,66 (ЗН, с), 3,26 (2Н, т), В данном примере описан способ получения 3,85 (ЗН, с), 4,28 (1Н, м), 5,7 (2Н, ушир, с), (т пл 2-(4-цианфенокси)-5-(4,4-дифторбут-399 - 100°С) из соединения VII 41 енилтио)тиазола (соединение VII 130) Соединение VII 114 (0,483г), 4-цианфенол ПРИМЕР VI 14 (0,238г), безводный карбонат калия (0,276г) и В данном примере описан способ получения фторид цезия (0,304г) в І\І-метилпирролидин-2-оне 4-циано-5-(4,4-дифторбут-3-енилтио)тиазола (со(Зсм3) перемешивают вместе в атмосфере азота и единение VII 90) нагревают при 90°С в течение 36 часов РеакциСоединение VII 94 (0,27г) в сухом дихлормеонную смесь разбавляют водой, продукт экстрагитане (13см3) обрабатывают пиридином (1см3) и руют диэтиловым эфиром, сушат (MgSC^), упариметансульфурилхлоридом (0,26см3) Смесь перевают при пониженном давлении и остаток мешивают в течение 5 дней, затем прибавляют фракционируют с помощью тонкослойной хромаме-тансульфурилхлорид (0,2см3) и опять переметографии (силикагель, элюент гексан диэтиловый шивают в течение 2 часов Реакционную смесь эфир 4 1 по объему) с получением соединения выливают в водную 2М хлористоводородную ки+ 1 VII 130 (0,125г) М = 324, Н ЯМР 5 2,28 (2Н, м), слоту и продукт экстрагируют етилацетатом Ор2,80 (2Н, т), 4,20 (1Н, м), 7,40 (2Н, м), 7,75 (2Н, м), ганическую фазу сушат (MgSO4) и упаривают при (масло) пониженном давлении Хроматография остатка на силикагеле дает соединение VII 90 (0,142г) 1Н ПРИМЕР VII 12 ЯМР 5 2,40 (2Н, м), 3,20 (2Н, т), 4,30 (1Н, м), 8,80 В данном примере описан способ получения (1Н,с) 5-(4,4-дифторбут-3-енилтио)тиазол-4карбоксилата (соединение VII 98) По вышеуказанному способу получают слеЭтилизоцианат (2,3г) в сухом тетрагидрофудующее соединение по изобретению ране (15см3) прибавляют к перемешиваемой сме(1) 4-циано-2-(4,4-дифторбут-3си трет-бутоксида (2,24г) при -40°С в атмосфере енилтио)тиазол (соединение VII 6) 1Н ЯМР 5 2,50 азота Через 10 минут реакционную смесь охлаж(2Н, м), 3,32 (2Н, т), 4,26 (1Н, м), 7,86 (1Н, с), (масдают до -78°С и медленно прибавляют дисульфид ло) из соединения VII 7 углерода (1,52г) в тетрагидрофуране (20см3) По(2) 5-циано-2-(4,4-дифторбут-3-енилтио)-4сле окончания прибавления реакционной темпеметилтиазол (соединение VII 32) 1Н ЯМР 5 2,48 ратуре дают подняться до -10°С и прибавляют 4,4(2Н, м), 2,58 (ЗН, с), 3,85 (ЗН, с), 4,28 (1Н, м), (масдифторбут-З-енил-4-метилбензолсульфамид ло) из соединения VII 36 (5,24г) в тетрагидрофуране (10см ) Смеси дают ПРИМЕР VII 15 нагреться до комнатной температуры и перемеВ данном примере описан способ получения шивают в течение 24 часов, нагревают с обрат5-бром-2-(4,4-дифторбут-3-енилтио)тиазол-4ным холодильником в течение 3 часов и охлажкарбоновой кислоты (соединение VII 13) дают до комнатной температуры Реакционную Соединение VII 11 (0,30г) в метаноле (5см3), смесь выливают в водную 2М хлористоводородсодержащем водный раствор гидроксида натрия ную кислоту и продукт экстрагируют этилацета(1,2см3 2М-ного раствора) перемешивают при том Органические фазы сушат (MgSC^) и раствокомнатной температуре в течение 18 часов, вылиритель удаляют упаривание при пониженном вают в водную 2М хлористоводородную кислоту давлении Колоночная хроматография остатка на Продукт экстрагируют етилацетатом, сушат силикагеле, элюи-руя 1 1 гексаном этилацетатом (MgSO4) и упаривают при пониженном давлении с 1 с получением соединения VII 98 (3,15г) Н ЯМР 5 получением соединения VII 13 (0,18г) М + = 239, 1Н 1,45 (ЗН, т), 2,50 (2Н, м), 3,10 (2Н, т), 4,3-4,4 (1Н, ЯМР 5 2,48 (2Н, м), 3,30 (2Н, т), 4,28 (1Н, м), 7,0 м), 4,50 (2Н, кв), 8,65 (1Н, с), (масло) (1Н, широкий сигнал), (т пл 86,5 - 87,5°С) ПРИМЕР VI 13 По вышеуказанному способу из соответстВ данном примере описан способ получения вующего эфира получают следующее соединение 5-(4,4-дифторбут-3-енилтио)-тиазол-4по изобретению карбоксамида (соединение VII 94) (1) 2-(4,4-дифторбут-3-енилтио)тиазол-43 Соединение VII 98 (0,5г) в метаноле (8см ) пекарбоновая кисло та (соединение VII 10) М + = 251, 1 ремешивают с водным аммиаком (35см3, плотН ЯМР 5 2,50 (2Н, м), 3,35 (2Н, т), 4,28 (1Н, м), ность 0,88) в течение 4 часов Соединение VII 94 8,18 (1Н, с), (т пл 114 - 115°С) из соединения получают в виде твердого продукта, который отVII 8 фильтровывают от раствора и отсасывают досуха (2) 2-(4,4-дифторбут-3-енилтио)-41 (0,27г) Н ЯМР 5 2,50 (2Н, м), 3,00 (2Н, т), 4,30метилтиазол-5-карбоновая кислота (соединение + 1 4,41 (1Н, м), 5,5 и 7,0 (2Н, ушир, с), (т пл 141 VII 45) М = 265, Н ЯМР 5 2,50 (2Н, м), 2,70 (ЗН, 142°С) с), 3,27 (2Н, т), 4,28 (1Н, м), 9,8 (1Н, широкий сигПо вышеуказанному способу получают сленал), (т пл 52,0 - 53,5°С) из соединения VII 41 дующее соединение по изобретению (3) 5-(4,4-дифторбут-3-енилтио)-тиазол-4(1) 2-(4,4-дифторбут-3-енилтио)тиазол-4карбоновая кислота (соединение VII 102) М + = карбоксамид 251, 1Н ЯМР 5 2,50 (2Н, м), 3,10 (2Н, т), 4,28 (1Н, (соединение VII 7) М + = 250, 1Н ЯМР 5 2,50 м), 8,70 (1Н, с), (т пл 128,5°С) из соединения (2Н, м), 3,27 (2Н, т), 4,28 (1Н, м), 5,9 и 7,1 (2Н, VII 98 ушир, с), 8,03 (1Н, с), (т пл 57 - 58°С) из соединеПРИМЕР VII 15 ния VII 8 В данном примере описаны способы, подхо(2) 2-(4,4-дифторбут-3-енилтио)-4 39 44732 40 дящие для получения соединений по изобретеэквивален та окислителя нию, в которых атом серы из 4,4-дифтор-З(5) 2-(4,4-дифторбут-3-енилсульфонил)-5енилтио заместителя соответствующего неокисметилтиазол (соединение VII 23) 1Н ЯМР 5 2,55 ленного соединения окисляют до сульфоксида (2Н, м), 3,45 (2Н, т), 4,25 (1Н, м), 7,73 (1Н, кв), (сульфинила) или сульфона (сульфонила) Метод (масло) из соединения VII 21 и двух эквивалентов А Использование пероксимоносульфата калия в окислителя качестве окислителя (6) 5-хлор-2-(4,4-дифторбут-3Получение 5-хлор-2-(4,4-дифторбут-3енилсульфинил)тиазол енилсульфонил)тиазола (соединение VII 26) (соединение VII 25) M(NH4)+ = 240, 1Н ЯМР 5 Перемешиваемый раствор соединения VII 24 2,38 (1Н, м), 3,18 (2Н, м), 4,25 (1Н, м), 7,74 (1Н, с), (4,83г) в метаноле (50см3) при 8°С обрабатывают (масло) из соединения VII 24 и одного эквивалента по каплям пероксимоносульфатом калия (27,Ог) в окислителя 3 воде (100см ) при охлаждении в течение более (7) 5-(4,4-дифторбут-3-енилсульфинил)тиазол 0,25 часов и прибавляют еще метанол(50см3) (соединение VII 83) 1Н ЯМР 5 2,50 (2Н, м), 3,05 Реакционную смесь перемешивают при комнатной (1Н, м), 3,20 (1Н, м), 4,28 (1Н, м), 8,20 (1Н, с), 9,12 температуре в течение 18 часов, нерастворимые (1Н, с), (масло) из соединения VII 82 и одного экпродукты отфильтровывают, фильтрат экстрагививалента окислителя руют дихлорметаном (4 х 50 см ) и сушат (MgSO4) (8) 5-(4,4-дифторбут-3-енилсульфонил)тиазол Растворитель удаляют при пониженном давлении (соединение (VII 84) 1Н ЯМР 5 2,50 (2Н, м), 3,30 и остаток фракционируют с помощью хромато(2Н, м), 4,25 (1Н, м), 8,20 (1Н, с), 9,12 (1Н, с), (масграфии (силикагель, элюент гексан этилацетат ло) из соединения VII82 и двух эквивалентов 4 1 по объему) с получением соединения VII 26 окислителя (3,91г) M(NH4)+ = 291, f H ЯМР 5 2,60 (2Н, м), 3,50 (9) 2-хлор-5-(4,4-дифторбут-3(2Н, т), 4,25 (1Н, м), 7,85 (1Н, с), (масло) енилсульфинил)тиазол Метод В Использование мономагниевой соли (соединение VII 115) 1Н ЯМР 5 2,50 (2Н, м), пероксифталевой кислоты 3,05 (1Н, м), 3,20 (1Н, м), 4,28 (1Н, м), 7,85 (1Н, с), Получение 5-бром-2-(4,4-дифторбут-3(масло) из соединения VII 114 и одного эквивалененилсульфинил)тиазола (соединение VII 15) та окислителя Соединение VII 14 (1,50г) растворяют в ди(10) 2-хлор-5-(4,4-дифторбут-3хлорметане (10см3) и обрабатывают гексагидраенилсульфонил)тиазол том мономагниевой соли пероксифталевой кисло(соединение VII 116) 1Н ЯМР 5 2,52 (2Н, м), ты (1,6г, 80% надкислота) и водой (15см3) Смесь 3,30 (2Н, м), 4,28 (1Н, м), 8,08 (1Н, с), (масло) из перемешивают при комнатной температуре в тесоединения VII 114 и двух эквивалентов окислите3 чение 1 часа, разбавляют дихлорметаном (90см ) ля и органическую фазу промывают водным гидроМетод С Использование 3-хлорнадбензойной карбонатом натрия и водой Органическую фазу кислоты сушат (MgSO4), упаривают при пониженном давИз соответствующих тиоэфиров получают лении и остаток фракционируют с помощью хроследующие соединения по изобретению, примематографии (силикагель, элюент гексан этиняя метод В, описанный выше, но с использовалацетат 10 1 по объему) с получением соединением 3-хлорнадбензойной кислоты вместо гексания VII 15(1,0г) M(NH4)+ = 321, 1 НЯМР 5 2,38 (1Н, гидратом мономагниевой соли пероксифталевой м), 2,60 (2Н, м), 4,20 (1Н, м), 7,85 (1Н, с), (масло) кислоты Из соответствующих тиоэфиров получают (11) этил 2-(4,4-дифторбут-3следующие соединения по изобретению, примеенилсульфинил)тиазол-4-карбоксилат (соединеняя метод В, описанный выше ние VII 9) М + = 311, 1Н ЯМР 5 1,43 (ЗН, т), 2,60 (1) 2-(4,4-дифторбут-3-енилсульфинил)тиазол (2Н, м), 3,56 (2Н, т), 4,28 (1Н, м), 4,48 (2Н, кв), 8,50 (соединение VII 2) МН+ = 224, 1Н ЯМР 5 2,36 (1Н, (1Н, с), (т пл 64 - 64°С) из соединения VII 8 и двух м), 2,50 - 2,70 (1Н, м), 3,20 (2Н, м), 4,22 (1Н, м), эквивалентов окислителя 7,67 (1Н, д), 7,98 (1Н, д), (масло) из соединения (12) этил 5-бром-2-(4,4-дифторбут-3VII 1 и одного эквивалента окислителя енилсульфонил)тиазол-4-карбоксилат (соедине(2) 2-(4,4-дифторбут-3-енилсульфонил)тиазол ние VII 12) М + = 389, 1Н ЯМР 5 1,43 (ЗН, т), 2,60 + 1 (соединение VII 3) МН = 240, Н ЯМР 5 2,55 (2Н, (2Н, м), 3,56 (2Н, т), 4,28 (1Н, м), 4,48 (2Н, кв), (т м), 3,45 (2Н, т), 4,24 (1Н, м), 7,78 (1Н, д), 8,08 (1Н, пл 72 - 73°С) из соединения VII 11 и двух эквивад), (масло) из соединения VII 1 и двух эквиваленлентов окислителя тов окислителя (13) 5-хлор-2-(4,4-дифторбут-3(3) 5-бром-2-(4,4-дифторбут-3енилсульфонил)-4-метилтиазол (соединение енилсульфонил)тиазол VII 28) 1Н ЯМР 5 2,55 (2Н, м), 2,45 (ЗН, с), 3,40 + 1 (соединение VII 6) M(NH4) = 335, Н ЯМР 5 (2Н, т), 4,25 (1Н, м), (масло) из соединения VII 27 и 2,58 (2Н, м), 3,46 (2Н, т), 4,25 (1Н, м), 7,96 (1Н, с), двух эквивалентов окислителя (масло) из соединения VII 14 и двух эквивалентов (14) метил 2-(4,4-дифторбут-3окислителя енилсульфонил)-4-метилтиазол-5-карбоксилат (4) 2-(4,4-дифторбут-3-енилсульфинил)-5(соединение VII 43) 1Н ЯМР 5 2,60 (2Н, м), 2,85 метилтиазол (ЗН, с), 3,50 (2Н, т), 3,95 (ЗН, с), 4,25 (1Н, м), (мас(соединение VII 22) 1Н ЯМР 5 2,38 (1Н, м), ло) из соединения VII41 и двух эквивалентов 2,50 - 2,65 (4Н, м), 3,15 (1Н, м), 4,23 (1Н, м), 7,60 окислителя (1Н, кв), (масло) из соединения VII 21 и одного 42 41 44732 (15) 2-(4,4-дифторбут-3-енилсульфонил)-42-(4,4-дифторбут-3-енилтио)имидазола (соединеметилтиазол-5-сульфонилфторид (соединение ние VIII 1) и 1-(4,4-дифторбут-3-енилтио)-2-(4,41 VII 53) Н ЯМР 5 2,60 (2Н, м), 2,85 (ЗН, с), 3,55 дифторбут-3-енилтио)имидазола (соединение (2Н, т), 4,28 (1Н, м), (т пл 67°С) из соединения VIII 8) в виде смеси продуктов, которые можно разделить хрома-тографически VII 52 и двух эквивалентов окислителя К раствору 2-меркаптоимидазола (10,01 г) в ПРИМЕР VIII 1 3 ацетоне (400см ) прибавляют карбонат калия В данном примере описан способ получения (20,73г) и 4-бром-1,1-дифторбут-1-ен (16,79г) 2-(4,4-дифторбут-3-енилтио)-1 -метил имидазола Смесь нагревают с обратным холодильником в (соединение VIII 5) течение 18 часов и оставляют остывать НерасК раствору 2-меркапто-1-метил имидазола 3 творимые твердые продукты удаляют фильтраци(9,78г) в ацетоне (300см ) прибавляют карбонат ей реакционной смеси через плаг из силикагеля калия (14,2г) и 4-бром-1,1-дифторбут-1-ен (16,12г) 3 sorbsil-СЗО, промывая этилацетатом Фильтрат в виде раствора в ацетоне (100см ) Смесь нагреупаривают при пониженном давлении с полученивают с обратным холодильником в течение 18 ем бледноко-ричневого масла (19,2г), которое часов и оставляют остывать Нерастворимые хроматографируют на силикаге-ле, элюируя 15%твердые продукты удаляют фильтрацией реакциным этилацетатом в гексане, поднимая до 50% онной смеси через плат из силикагеля sorbsil-СЗО, этилацетата в гексане Получают две основные промывая етилацетатом Фильтрат упаривают при фракции, первая из которых (7,4г), согласно данпониженном давлении с получением соединения ным ТСХ, содержит два продукта Вторая фракция VIII 5 (17,8г), которое подходит для дальнейшей (10,75г), полученная в виде белого твердого прореакции (см пример VIII 7) дукта, как показано, является чистым соединениЧасть (1г) очищают с помощью хроматограем VIII 1 Первую фракцию подвергают дальнейфии на силикагеле sorbsil-СЗО, элюируя этилацешей хроматографии, как описано татом гексаном З 7 и получают чистое соединение VIII 5 (0,776г) 1Н ЯМР 5 2,3 - 2,4 (2Н, м), 3,05 выше, с получением соединения VIII 8 (1,61 г) 3,15 (2Н, т), 3,60 (ЗН, с), 4,15 - 4,35 (1Н, м), 7,05 М + = 280, 1Н ЯМР 5 2,3 - 2,45 (4Н, м), 3,1 - 3,15 (1Н, с), (масло) (2Н, т), 3,9 - 4,0 (2Н, т), 4,05 - 4,3 (1Н, с), 7,05 (1Н, с), (масло), и соединения VIII 1 (5,31 г) Образец Используя соответствующие меркаптоимидасоединения VIII 1 перекристалл изовывал и из золы получают следующие соединения по изобреэтилацетата и гексана с получением 4,2г, которые тению, применяя способ, описанный выше имели М + = 190, 1Н ЯМР 5 2,3 - 2,4 (2Н, м), 3,0 (1) 2-(4,4-дифторбут-3-енилтио)-1фенилимидазол 3.1 (2Н, т), 4,15-4,3 (1Н, м), 7,0-7,1 (2Н, ушир, с), 9.2 (1Н, ушир, с), (т пл 58,6 - 59,6°С) (соединение VIII 3) М + = 266, 1Н ЯМР 5 2,3 ПРИМЕР VIII 3 2.4 (2Н, м), 3,1 -3,15(21-1, т), 4,1 -4,25 (1Н, м), 7,1 В данном примере описан способ получения 7.2 (2Н, м), 7,3 - 7,55 (5Н, м), (масло) 2-(4,4-дифторбут-3-енилтио)-4-фенил имидазола (2) 2-(4,4-дифторбут-3-енилтио)-1(соединение VIII 19) этилимидазол Фенилбромид (1,611 г) в хлороформе (7см3) (соединение VIII 10) М + = 218, 1Н ЯМР 5 1,4 прибавляют к гидробромиду 4,4-дифторбут-З(ЗН, т), 2,3 - 2,4 (2Н, м), 3,15 (2Н, т), 4,0 (2Н, кв), енилизотиоурония (2г) в 84% эта-ноле/воде 4,2-4,35 (1Н, м), 6,95(11-1, с), 7,1 (1Н, с), (масло) (20см3) и при перемешивании медленно прибав(3) 2-(4,4-дифторбут-3-енилтио)-4-этил-5+ 1 ляют бикарбонат натрия (2,72г) Полученную желметилимидазол (соединение VIII 27) М = 232, Н тую суспензию нагревают с обратным холодильЯМР 5 1,15 (ЗН, т), 2,15 (ЗН, с), 2,35 - 2,45 (2Н, м), ником в течение 3 часов Смесь охлаждают и 2.5 - 2,6 (2Н, кв), 2,95 (2Н, т), 4,1 - 4,3 (1Н, м), (т растворитель удаляют упариванием при пониженпл 54-56°С) ном давлении Остаток дважды промывают теп(4) 2-(4,4-дифторбут-3-енилтио)-4лой водой (2 х 20см3), который декантируют от метилимидазол нерастворимых твердых продуктов Полученный (соединение VIII 58) М + = 204, 1Н ЯМР 5 2,25таким образом сырой продукт очищают хромато2,35 (5Н, м), 3,0 (2Н, т), 4,15 - 4,3 (1Н, м), 6,75 (1Н, графией на силикагеле, элюируя 20%-ным этилс), (масло) ацетатом в гексане и продукт, содержащий фрак(5) 2-(4,4-дифторбут-3-енилтио)-4ции, вновь пропускают через колонку с этоксикарбонилимидазол использованием 5%-ного этилацетата в толуоле + 1 (соединение VIII 64) М = 262, Н ЯМР 5 1,3 Это дает соединение VIII 19 (0,78г) М + = 266, 1Н 1,35 (ЗН, т), 2,25 - 2,35 (2Н, м), 3,05 - 3,15 (2Н, т), ЯМР 5 2,3 - 2,4 (2Н, м), 3,05 - 3,1 (2Н, т), 4,15 - 4,3 4,1 - 4,25 (1Н, м), 4,3 - 4,4 (2Н, кв), 7,8 (1Н, ушир, (1Н, м), 7,2 - 7,4 (4Н, м), 7,6 - 7,75 (2Н, ушир, с), не с), (т пл 57,8-61 °С) содержащее побочного продукта, соответствую(6) 3-(4,4-дифторбут-3-енилтио)-[1,5-а]щего N-фенацилпроизводное пиридин Применяя способ, описанный выше, получают (соединение VIII 151) 1Н ЯМР 5 2,30 (2Н, м), следующие соединения по изобретению 3,00 (2Н, т), 4,20 (1Н, м), 6,65 (1Н, м), 6,80 (1Н, м), (1) 2-(4,4-дифторбут-3-енилтио)-1-метил-47,45 (1Н, дт), 7,55 (1Н, с), 8,15 (1Н, дд), (масло) из фенилимидазол 2.3 - дигидроимидазо - [1,5 - а] - пиридин - 3 - тио(соединение VIII 22) М + = 280, 1Н ЯМР 5 2,35на 2,45 (2Н, м), 3,10 - 3,18 (2Н, т), 3,65 (ЗН, с), 4,19 ПРИМЕР VIII 2 4,35 (1Н, м), 7,2 - 7,25 (2Н, м), 7,33 - 7,38 (2Н, т), В данном примере описан способ получения 7,72 - 7,78 (2Н, д), (масло), используя гидробро 43 44732 44 мид г\І-метил-4,4-дифторбут-3-енилизотиоурония элюируя эти-лацетатом гексаном З 7 и получая соединение VIII 12 (2,15г) М + = 232, 1Н ЯМР 5 0,9 (2) 2-(4,4-дифторбут-3-енилтио)-5-этил-4метоксикарбонил-1-метил имидазол (соединение - 0,95 (ЗН, т), 1,75 - 1,85 (2Н, м), 2,3 - 2,45 (2Н, м), VIII 68) М + = 290, 1 НЯМР 5 1,21 -1,25 (ЗН, т), 2,35 3,1 - 3,15 (2Н, т), 4,15 - 4,35 (1Н, м), 6,9 (1Н, с), 7,1 - 2,45 (2Н, м), 2,9 - 2,9 (2Н, кв), 3,2 - 3,25 (2Н, т), (1Н, с), (масло) 3,78 (ЗН, с), 3,85 (ЗН, с), 4,16 - 4,32 (1Н, м), (масПрименяя способ, описанный выше, испольло), используя гидробромид Ы-метил-4,4зуя подходящий алки-лирующий агент и исходный дифторбут-3-енилизотиоурония и метил 2-бром-ЗN-H имидазол, получают следующие соединения оксопентаноат по изобретению ПРИМЕР VIII 4 (1) 2-(4,4-дифторбут-3-енилтио)-1-(1метилэтил)имидазол В данном примере описан способ получения 2-(4,4-дифторбут-3-енилтио)-4,5(соединение VIII 14) М + = 232, 1Н ЯМР 5 1,4 диметилфенилимидазола (соединение VIII29) (6Н, д), 2,3 - 2,4 (2Н, м), 3,1 - 3,15 (2Н, т), 4,15 - 4,3 Карбонат калия (18,9г) и гидробромид 4,4(1Н, м), 4,5 - 4,6 (1Н, м), 7,0 (1Н, с), 7,1 (1Н, с), дифторбут-3-енилизотиоурония (16,9г) прибавля(масло) из соединения VIII 1 ют к раствору З-бромбутан-2-она (10,32г) в диме(2) 2-(4,4-дифторбут-3-енилтио)-1,4,5тилформамиде (100см ) и смесь перемешивают триметилимидазол (соединение VIII 31) 1Н ЯМР 5 при 60°С в течение 90 минут, затем при 80°С в 2,15(61-1, два с), 2,25-2,35 (2Н, м), 2,95 (2Н, т), 3,5 течение 30 минут Полученную смесь охлаждают, (ЗН, с), 4,15-4,3 (1Н, м), (масло) из соединения 3 прибавляют воду (100см ) и продукт VIII 29 экстрагируют диэтиловым эфиром Объеди(3) 1-этил-2-(4,4-дифторбут-3-енилтио)-4,5ненные органические фазы промывают водой и диметил-имидазол (соединение VIII 33) 1Н ЯМР 5 солевым раствором и сушат (MgSO4) Концентри1,25 (ЗН, т), 2,15 (6Н, ушир, с), 2,3 - 2,4 (2Н, м), 3,0 рованно упариванием при пониженном давлении (2Н,т), 3,9-3,95 (2Н, кв), 4,15-4,3 (1Н, м), (масло) дает бледно-оранжевую жидкость (12,2г), которую из соединения VIII 29 очищают хроматографией на силикагеле sorbital (4) смесь 2-(4,4-дифторбут-3-енилтио)-1,5СЗО, элюируя 30%-ным етилацетатом в гексане диметилимидазол (соединение VIII 35) и 2-(4,4Получают три компонента Первый элюированный дифторбут-3-енилтио)-1,4-диметил имидазол (сопродукт был идентифицирован как 3-(4,4единение VIII 60) 1Н ЯМР 5 2,15 (ЗН, с), 2,3 - 2,4 + дифторбут-3-енилтио)бутан-2-он (0,68г) М = 194, (2Н, м), 3,0 - 3,05 (2Н, т), 3,5 и 3,55 (ЗН, два с), 1 Н ЯМР 5 1,4 (ЗН, д), 2,15 - 2,3 (5Н, м), 2,45 (2Н, 4,15 - 4,3 (1Н, м), 6,65 и 6,80 (1Н, два с), из соедит), 3,3 - 3,4 (1Н, кв), 4,1 - 4,35 (1Н, м) Второй нения VIII 58 элюированный продукт был требуемым соедине+ 1 (5) смесь 2-(4,4-дифторбут-3-енилтио)-5нием VIII 29 (4,1 г) М = 218, Н ЯМР 8 2,15(61-1, с), метил-1-(1-метилэтил)-имидазол (соединение 2,25 - 2,35 (2Н, м), 2,9 - 3,0 (2Н, т), 4,15 - 4,3 (1Н, VIII 37) и 2-(4,4-дифторбут-3-енилтио)-4-метил-1м), (т пл 81,4 - 84,4°С) Третье элюированное (1- метилэтил) -имидазол (соединение VIII 62), как соединение было идентифицировано как продукт показано, главным является последний изомер, 1Н дальнейшего N-алкилирования соединением ЯМР 5 1,35 (6Н, д), 2,2 (ЗН, с), 2,3 - 2,4 (2Н, м), VIII 29 дополнительным количеством З-бромбутан3,05 (2Н, т), 4,15-4,3 (1Н, м), 4,5-4,6 (1Н, м), 6,70 2-она, а именно, как N-(1-метилпропан-2-он)-2(1Н, с), из соединения VIII 58 (4,4-дифторбут-3-енилтио)-4,5(6) 2-(4,4-дифторбут-3-енилтио)-5диметилимидазолабутан-2-он (1,11 г) М + = 217, 1Н этоксикарбонил-1-метил имидазол (соединение ЯМР 5 1,55 (ЗН, с), 2,0 (ЗН, с), 2,05 (ЗН, с), 2,15 VIII 52), М + = 276, 1 НЯМР 8 1,32-1,40(ЗН,т), 2,73 (ЗН, с), 2,3 - 2,4 (2Н, м), 3,0 - 3,05 (2Н, т), 4,15 4,35(11-1, м), 5,0-5,1 (1Н, м), (масло) - 2,47 (2Н, м), 3,2 - 3,3 (2Н, т), 3,82 (ЗН, с), 4,17 4,32 (1Н, м), 4,25 - 4,35 (2Н, кв), 7,70 (1Н, с), (масПРИМЕР VIII 5 ло) из соединения VIII 64 По данной реакции поВ данном примере описан способ получения лучают хроматографически разделяемую смесь 2-(4,4-дифторбут-3-енилтио)-1-пропил имидазола соединения VIII 52 и VIII 65, первое элюируется (соединение VIII 12) из соответствующего N-H первым имидазола, соединение VIII 1, путем алкилирова(7) 2-(4,4-дифторбут-3-енилтио)-4ния с использованием пропилиодида этоксикарбонил-1-метил имидазол (соединение Соединение VIII 1 (2г) прибавляют по частям VIII 65) М + = 276, 1 НЯМР 8 1,35-1,40(ЗН,т), 2,35 (вскипание) к суспензии гидрида натрия (0,73г - 2,42 (2Н, м), 3,20 - 3,27 (2Н, т), 3,63 (ЗН, с), 4,15 60%-ного твердого продукта в масле) в диметил4,30 (1Н, м), 4,3 - 4,4 (2Н, кв), 7,60 (1Н, с), (масло) 3 формамиде (20см ) в атмосфере азота После из соединения VIII 64 перемешивания в течение 30 минут прибавляют нПРИМЕР VIII 6 пропил йодид (2,68г) и реакционную смесь переВ данном примере описан способ получения мешивают при комнатной температуре в течение 2-(4,4-дифторбут-3-енилтио)-Н18 часов Прибавляют затем воду и диэтиловый (метинсульфонил)имидазола (соединение VIII 18) эфир и продукт экстрагируют эфиром ОбъедиРаствор соединения VIII 1 (0,49г) в сухом тетненные органические фазы промывают водой и рагидрофуране (Зсм3) прибавляют по каплям к насыщенным солевым раствором и сушат суспензии гидрида натрия (55% в масле, 0,12г, (MgSO4) После фильтрации удаляют растворипромытый гексаном перед использованием) в сутель упариванием при пониженном давлении с хом тетрагидрофуране (5см3), охлажденном на получением сырого продукта (2,7г), который очихолодной водяной бане Реакционной смеси дают щают хроматографией на силикагеле sorbital СЗО, 45 44732 46 перемешиваться при комнатной температуре в 7,05 (1Н, с), 7,15 (1Н, с), (масло) течение 2 часов и затем прибавляют метансуль(5) 2-(4,4-дифторбут-3-енилсульфонил)-1фонилхлорид (0,Зг) и реакционную смесь перепропил-имидазол (соединение VIII 13) МН+ = 265, 1 мешивают еще в течение 16 часов Реакционную НЯМР 5 0,9-1,0 (ЗН, т), 1,8-2,0 (2Н, м), 2,5-2,6 смесь выливают в этил ацетат/вод у и слои разде(2Н, м), 3,5 - 3,6 (2Н, т), 4,15 - 4,35 (ЗН, м), 7,05 ляют Водный слой экстрагируют етилацетатом и (1Н, с), 7,15 (1Н, с), (масло) органические фазы сушат (MgSO4), фильтруют и (6) 2-(4,4-дифторбут-3-енилсульфинил)-1-(1упаривают при пониженном давлении с получениметилэтил)имидазол (соединение VIII 15), М + = ем желтого масла Очистка колоночной хромато264, Н1Н ЯМР 5 1,5 (6Н, д), 2,55 - 2,65 (2Н, м), 3,5 графией на силикагеле с использованием 3 7 - 3,6 (2Н, м), 4,15 - 4,35 (1Н, м), 5,15 - 5,35 (1Н, м), этилацетата гексана дает соединение VIII 18 7,15 (2Н, широкий), (масло) 1 (0,31г) Н ЯМР 5 2,40 - 2,50 (2Н, м), 3,30 (2Н, т), (7) 2-(4,4-дифторбут-3-енилсульфонил)-43,30 (ЗН, с), 4,25 (1Н, м), 7,05 (1Н, д), 7,35 (1Н, д), фенилимидаэол (соединение VIII 20) М + = 282, 1Н (масло) ЯМР 5 2,35 - 2,65 (2Н, м), 3,25 - 3,4 (2Н, т), 4,15 ПРИМЕР VIII 7 4,3 (1Н, м), 7,25 - 7,5 (4Н, кв), 7,6 - 7,8 (2Н, м), В данном примере описан способ, подходя(масло), используя 1,5 эквивалента окислителя щий для получения соединений по изобретению, в (8) 2-(4,4-дифторбут-3-енилсульфонил)-4которых атом серы в 4,4-дифторбут-З-енилтио фенилимидазол (соединение VIII 21) М + = 298, 1Н заместителе соответствующего неокисленного ЯМР 5 2,45 - 2,6 (24, м), 3,4 - 3,5 (2Н, т), 4,1 - 4,28 соединения окислен до сульфоксида (сульфинил) (1Н, м), 7,3 - 7,55 (4Н, кв), 7,7 - 7,75 (2Н, д), (т пл или сульфона (сульфонил) 109,6 - 110,4°С), используя 1,5 эквивалента окисПолучение соединения VIII 7 из соединения лителя VIII 5 (9) 2-(4,4-дифторбут-3-енилсульфинил)-1Соединение VIII 5 (18,1г) охлаждают до 0°С в метил-4-фенилимидазол (соединение VIII 23) М + 3 дихлорметане (400см ) и прибавляют 3= 296, 1Н ЯМР 5 2,5 - 2,65 (2Н, м), 3,4 - 3,65 (2Н, хлорнадбензойную кислоту (61,2г влажного тверм), 4,0 (ЗН, с), 4,25 - 4,4 (Ш, м), 7,25 - 7,45 (4Н, м), дого продукта, 2экв) Смесь перемешивают при 7,7 - 7,75 (2Н, дд), (т пл 106 - 106.6С), используя комнатной температуре в течение 18 часов и за1,5 эквивалента окислителя тем выливают в насыщенный водный бикарбонат (10) 2-(4,4-дифторбут-3-енилсульфонил)-1натрия Продукт экстрагируют дихлормета-ном, метил-4-фенилимидазол (соединение VIII 24) М + органическую фазу промывают водой и насыщен= 312, 1Н ЯМР 5 2,6 - 2,7 (2Н, м), 3,58 - 3,65 (2Н, ным солевым раствором и сушат (MgSC^) Упарим), 4,02 (ЗН, с), 4,2 - 4,35 (1Н, м), 7,25 - 7,42 (4Н, вание растворителя при пониженном давлении м), 7,7 - 7,75 (2Н, дд), (т пл 78,6 - 79,6°С), испольдает сырое соединение VIII 7, которое хроматозуя 1,5 эквивалента окислителя графируют на силикагеле, элюируя 15%-ным ети(11) 2-(4,4-дифторбут-3-енилсульфонил)-4лацетатом в гексане, увеличивая до 50%-ного этил-5-метил-имидазол (соединение VIII 28) М + = этилацетата в гексане с получением чистого со264, 1Н ЯМР 5 1,15 - 1,3 (ЗН, кв), 2,25 (ЗН, два с единения VIII 7 1Н ЯМР 5 2,55 - 2,6 (2Н, м), 3,5 (таутомеры)), 2,45 - 2,7 (4Н, м), 3,35 - 3,45 (2Н, т), 3,55 (2Н, т), 4,0 (ЗН, с), 4,15 - 4,3 (1Н, м), 7,0 (1Н, 4,1 -4,3(1Н, м), 11,3 (1Н, ушир, с), (масло) с), 7,15 (1Н, с), (масло) (12) 2-(4,4-дифторбут-3-енилсульфонил)-4,5Применяя способ, описанный выше в примере диметилимидазол (соединение VIII 30) М + = 250, 1 VIII, используя два эквивалента окислителя, если Н ЯМР 5 2,25 (6Н, два с), 2,45 - 2,55 (2Н, м), 3,35 не указано другого, вместе с подходящим исход(2Н, т), 4,1 - 4,25 (1Н, м), 10,3 - 10,6 (1Н, ушир, с), ным продуктом, получают следующие соединения (т пл 113,4 -114,6°С) по изобретению (13) 2-(4,4-дифторбут-3-енилсульфонил)-1,4,5(1) 2-(4,4-дифторбут-3-енилсульфонил)триметилимидазол (соединение VIII 32) М + = 264, 1 имидазол Н ЯМР 5 2,2 (6Н, ушир с), 2,5 - 2,6 (2Н, м), 3,4 (соединение VIII 2) МН+ = 223, 1Н ЯМР 5 2,4 3,5(2Н,т), 3,85 (ЗН, с), 4,15-4,3 (1Н, м), (масло) 2,6 (2Н, м), 3,4 - 3,45 (2Н, т), 4,1 - 4,3 (1Н, м), 7,3 (14) 1 -этил-2-(4,4-дифторбут-37,4 (ЗН, ушир, с), (белый твердый продукт, т пл енилсульфонил)-4,5-диметилимидазол (соедине113-114°С) ние VIII 34) М + = 278, 1Н ЯМР 5 1,4 (ЗН, т), 2,15 (2) 2-(4,4-дифторбут-3-енилсульфонил)-1(6Н, ушир, с), 2,5 - 2,6 (2Н, м), 3,5 (2Н, т), 4,15 - 4,3 фенилимидазол (соединение VIII 4) М + = 298, 1Н (1Н, м), (масло) ЯМР 5 2,45 - 2,55 (2Н, м), 3,45 - 3,55 (2Н, т), 4,15 (15) смесь 2-(4,4-дифторбут-34,3 (1Н, м), 7,2 (1Н, д), 7,25 (1Н, д), 7,45 - 7,55 (5Н, енилсульфонил)-1,5-диметилимидазола (соединем), (масло) ние VIII 36) и 2-(4,4-дифторбут-3-енилсульфонил)(3) 1-(4,4-дифторбут-3-енил)-2-(4,4-дифторбут1,4-диметилимидазола (соединение VIII61), 1Н 3-енилсульфонил)имидазол (соединение VIII9) ЯМР 5 2,20 (ЗН, с), 2,25 (ЗН, с), 2,5 - 2,6 (4Н, м), М + = 312, 1Н ЯМР 5 2,5 - 2,65 (4Н, м), 3,5 - 3,6 (2Н, 3,45 - 3,55 (4Н, м), 3,95 (ЗН, с), 4,15 - 4,3 (2Н, м), т), 4,1 - 4,35 (2Н, м), 4,4 - 4,45 (2Н, м), 7,05 (1Н, с), 6,75 (1Н, с), 6,95 (1Н, с), из смеси соединений 7,15 (1Н, с), (масло) VIII 35 и VIII 60, по лученных по примеру VIII 5(4) (4) 2-(4,4-дифторбут-3-енилсульфонил)-1выше этилимидазол (16) смесь 18 82 2-(4,4-дифторбут-3+ 1 (соединение VIII 11) М = 250, Н ЯМР 5 1,5 енилсульфонил)-5-метил-(1-метилэтил)имидазола (ЗН, т), 2,5 - 2,65 (2Н, м), 3,5 - 3,6 (2Н, т), 4,15 (соединение VIII 38), 1Н ЯМР 5 1,55 (6Н, д), 2,4 4,35 (1Н, м), 4,15 - 4,35 (1Н, м), 4,4 - 4,45 (2Н, кв), 44732 48 47 (ЗН, с), 2,55 - 2,65 (2Н, м), 3,6 (2Н, т), 4,15 - 4,35 соединения IX 82 (0,526г) в дихлорметане (10см3) (1Н, м), 5,15 - 5,30 (1Н, м), 6,85 (1Н, с), и 2-(4,4и реакционную смесь перемешивают при комнатдифторбут-3-енилсульфонил)-4-метил-(1ной температуре в течение 3 дней Реакционную метилэтил)имидазол (соединение VIII 63), 1Н ЯМР смесь разбавляют дихлорметаном (100см3), про5 1,45 (6Н, д), 2,25 (ЗН, с), 2,55 - 2,65 (2Н, м), 3,55 мывают водным раствором гидрокарбоната на(2Н, т), 4,15 - 4,35 (1Н, м), 5,15 - 5,30 (1Н, м), 6,90 трия и затем водой, сушат (MgSO4) и упаривают (1Н, с), из смеси соединений VIII 37 и VIII 62, полупри пониженном давлении с получением масляниченных по примеру VIII 5(5) выше стого тваердого продукта Сырой продукт фракционируют с помощью хроматографии с получе(17) 2-(4,4-дифторбут-3-енилсульфонил)-5нием соединения IX 84 (0,15г) 1Н ЯМР 5 2,52 (ЗН, этоксикарбонил-1-метил имидазол (соединение + 1 м), 2,60 (2Н, м), 3,74 (2Н, т), 4,20 (ЗН, с), 4,25 (1Н, VIII 53) М = 308, НЯМР 5 1,37-1,42 (ЗН, т), 2,55 м), (смола) - 2,67 (2Н, м), 3,6 - 3,65 (2Н, т), 4,2 - 4,35 (1Н, м), 4,25 (ЗН, с), 4,32 - 4,4 (2Н, кв), 7,7 (1Н, с), (масло) ПРИМЕР IX 3 В данном примере описан 3-х стадийный спо(18) 2-(4,4-дифторбут-3-енилсульфонил)-4соб получения 5-(4,4-дифторбут-3-енилтио)-1,3метилимидазол (соединение VIII 59) М + = 2368, 1Н диметил-4-иодпиразол (соединение 1X61) ЯМР 5 2,3 - 2,4 (ЗН, широкий), 2,45 - 2,55 (2Н, м), 3,4 (2Н, т), 4,2 - 4,4 (1Н, м), 7,0 (1Н, широкий), Стадия 1 Получение 4-амино-5-(4,4(масло) дифторбут-3-енилтио)-1,3-диметил пиразола Соединение IX 82 (1,0г) растворяют в пропан(19) 2-(4,4-дифторбут-3-енилсульфинил)-42-оле (10см3), содержащем воду (2см3) и конценэтоксикарбонил-1-метил имидазол (соединение трированную хлористоводородную кислоту (катаVIII 66) М + = 292, 1 НЯМР 5 1,35-1,4(ЗН,т), 2,49литическое количество, 0,1см ), и обрабатывают 2,7 (2Н, м), 3,35 - 3,6 (2Н, м), 4,02 (ЗН, с), 4,2 - 4,38 восстановителем, порошком железа (1,0г) Смесь (1Н, м), 4,35 - 4,42 (4Н, кв), 7,67 (1Н, с), (масло), перемешивают и нагревают с обратным холоиспользуя 1,5 эквивалента окислителя дильником в течение 3 часов, охлаждают, нейтра(20) 2-(4,4-дифторбут-3-енилсульфонил)-4лизуют твердым гидрокарбонатом натрия и этоксикарбонил-1-метил имидазол (соединение фильтруют через кизельгель Нерастворимые осVIII 67) М + = 308, 1 НЯМР 5 1,35-1,4(ЗН,т), 2,55татки промывают пропан-2-олом и фильтрат упа2,65 (2Н, м), 3,65 - 3,70 (2Н, т), 4,02 (ЗН, с), 4,2 ривают при комнатной температуре с получением 4,38 (1Н, м), 4,35 - 4,42 (2Н, кв), 7,65 (1Н, с), (масаминопиразола в виде красно-коричневого масла ло), используя 1,5 эквивалента окислителя (1,0г) М + = 233 (21) 3-(4,4-дифторбут-3-енилсульфонил)Стадия 2 [1,5а]-пиридин Продукт со стадии 1 (4,6г) растворяют в сухом (соединение VIII 152) М + = 272, 1Н ЯМР 5 2,50 дихлорметане (25см3) и прибавляют к перемеши(2Н, м), 3,50 (2Н, т), 4,15 (1Н, м), 6,90 (1Н, м), 7,10 ваемому раствору диэтилэфирата трифторида (1Н, м), 7,20 (1Н, с), 7,65 (1Н, м), 8,95 (1Н, дд), бора (4,26г) в сухом дихлорметане (25см ) при (масло) 15°С По каплям к смеси прибавляют третПРИМЕР 1X1 бутилнитрит в дихлорметане (10см3) Реакционной В данном примере описан способ получения смеси дают нагреться до 5°С в течение 0,3 часа, 5-(4,4-дифторбут-3-енилтио)-1,3-диметил-4разбавляют гексаном и требуемую соль тетрафнитропиразол (соединение IX 82) торбората диазония фильтруют из раствора в виГидробромид 4,4-дифторбут-Зде коричневого твердого продукта (6,7г) енилизотиоурония (2,46г) перемешивают при комСтадия 3 Соединение IX 61 натной температуре водным гидроксидом натрия Продукт со стадии 1 (1,33г) прибавляют час(1,2г в 12см3 воды) в течение 0,3 часа 2-Хлор-1,3тями к перемешиваемому раствору иодида калия диметил-4-нитропиразол (1,76г) в дихлорметане (1,7г) в воде (5см3) при 35°С Реакционная смесь в (12см3), содержащем тетра-нпроцессе проведения реакции выделяет газ и дабутиламмонийхлорид (0,01 г, каталитическое коет красно-коричневое масло Через 1 час при 35°С личество) прибавляют при комнатной температуре смесь охлаждают, разбавляют водой, экстрагируи реакционную смесь перемешивают в течение 18 ют диэтиловым эфиром (100см3), органическую часов в атмосфере азота Реакционную смесь 3 фазу промывают последовательно водным метаразбавляют водой (100см ) и продукт экстрагирубисульфитом натрия, затем водой и сушат ют дихлор-метаном (100см3) Органические фазы (MgSO4) Растворителя удаляют при пониженном объединяют, промывают водой, сушат (MgSO4) и давлении и оставшееся масло фракционируют с упаривают при пониженном давлении с полученипомощью хроматографии (силикагель, гексан ем желтой жидкости (2,6г) Образец (0,9г) фракэтилацетат 10 1 по объему) с получением соедиционируют с помощью хроматографии (силиканения 1X61 в виде коричневого масла (0,2г) М + = гель, гексан этилацетат 10 1 по объему) с 344 получением соединения IX 82 (0,78г) М + = 263, 1Н ПРИМЕР IX 4 ЯМР 5 2,25 (2Н, м), 2,55 (ЗН, с), 3,08 (2Н, т), 3,94 (ЗН, с), 4,20 (ТН, м), (масло) В данном примере описан способ получения 5-(4,4-дифторбут-3-енилсульфонил)-1,3ПРИМЕР IX 2 диметилпиразола (соединение IX 55) В данном примере описан способ получения Диазониевую соль по примеру IX 3, стадия 2 5-(4,4-дифторбут-3-енилсульфонил)-1,3-диметил(2,0г) перемешивают в метаноле (20см3) при 0°С и 4-нитропиразол (соединение IX 84) порциями прибавляют бор-гидрид натрия (пороЗ-Хлорнадбензойную кислоту (1,74 г 50% ного шок, 0,25г) Выделяется газ и раствор изменяется по весу твердого продукта) прибавляют к раствору 49 44732 50 от бесцветного до оранжево-коричневого Смеси с), 3,38 (2Н, т), 4,14 (ЗН, с), 4,36 (1Н, м), (т пл 78 дают нагреться до 15°С в течение более 0,5 ча81 °С) сов, выдерживают при комнатной температуре в Применяя способ, описанный выше, и испольтечение 18 часов, разбавляют водой, экстрагирузуя подходящий пиразол получают следующие ют диэтиловым эфиром, сушат (MgSC^) и упарисоединения по изобретению вают при пониженном давлении с получением (1) 4-бром-5-(4,4-дифторбут-3красно-коричневой жидкости Жидкость фракциоенилсульфонил)-1 -метил пиразол (соединение нируют с помощью хроматографии (силикагель, IX 33) 1Н ЯМР 5 2,54 (2Н, м), 3,35 (2Н, т), 4,00 гексан диэтиловый эфир 1 1 по объему) с получе(ЗН, с), 4,27 (1Н, м), 7,55 (1Н, с), (т пл 42,6 нием соединения IX 55 (0,42г) М + = 218, 1Н ЯМР 5 43,6°С) из соединения IX 31 2,20 - 2,30 (5Н, м), 2,74 (2Н, м), 3,75 (ЗН, с), 4,23 (2) этил 5-(4,4-дифторбут-3-енилсульфонил)(2Н, м), 6,12(11-1, с), (масло) 1-метилпиразол-4-карбоксилат (соединение IX 36) 1 Н ЯМР 5 1,38 (ЗН, т), 2,50 (2Н, м), 3,78 (2Н, т), ПРИМЕР IX 5 4,15 - 4,30 (1Н, м), 4,36 (2Н, кв), 7,95 (1Н, с), (масВ данном примере описан способ получения ло) из соединения IX 34 этил 5-(4,4-дифторбут-3-енилтио)-1метилпиразол-4-ил карбоксилата (соединение (3) этил 5-(4,4-дифторбут-3-енилсульфонил)IX 34) 1-фенил пиразол-4-карбоксилат (соединение Бис-(4,4-дифторбут-3-енил)дисульфид (2,90г) 1X126) 1Н ЯМР 5 1,42 (ЗН, т), 2,45 (2Н, м), 3,72 и трет-бутилнитрит (1,22г) в ацетонитриле (40см3) (2Н, т), 4,18 (1Н, м), 4,40 (2Н, кв), 7,35-7,55 (5Н, м), нагревают при 60°С в атмосфере азота К пере8,13 (1Н, с), (т пл 62,5 - 63,0°С) из соединения мешиваемому раствору по каплям прибавляют 1X124 этил 5-амино-1-метил пиразол-4-илкарбоксилат ПРИМЕР VII 7 (1,00г) в ацетонитриле (10см3) По завершении В данном примере описан способ получения прибавления реакционный раствор нагревают при 5-(4,4-дифторбут-3-енилтио)-1-метил пиразол-460°С в течение 2 часов, упаривают при пониженкарбоновой кислоты (соединение IX 40) и пропанном давлении и фракционируют с помощью хро2-ил 5-(4,4-дифторбут-3-енилтио)-1 -метилпиразолматографии (силикагель, гексан диэтиловый эфир 4-карбоксилат (соединение IX 37) 5 1 по объему) с получением соединения IX 34 Соединение IX 34 (1,5г) растворяют в пропан+ 1 (выход 42%) М = 276, Н ЯМР 5 1,38 (ЗН, т), 2,20 2-оле (40см3) и обрабатывают 2М водным гидро(2Н, м), 3,05 (2Н, т), 3,97 (ЗН, с), 4,25 (1Н, м), 4,34 ксидом калия (8см ) и перемешивают при комнат(2Н, кв), 7,98 (ТН, с), (масло) ной температуре в течение 18 часов Смесь разбавляют 2М водной хлористоводородной кислотой Применяя способ, описанный выше, и испольи экстрагируют етилацетатом (Зх50см3) Объедизуя подходящий аминопиразол получают следуюненные органические фазы сушат (MgSO4) и упащие соединения по изобретению ривают при пониженном давлении с получением (1) 4-бром-5-(4,4-дифторбут-3-енилтио)-1желтого масла, которое затвердевает при обраметилимидазол ботке гексаном/этиловым эфиром Твердый про(соединение IX 31) МН+ = 282, 1Н ЯМР 5 2,32 дукт отфильтровывают от раствора, промывают (2Н, м), 2,95 (2Н, т), 3,88 (ЗН, с), 4,30 (1Н, м), 7,38 гексаном и сушат досуха с получением соедине(1Н, с), (масло) ния IX 40 (0,76г) 1Н ЯМР 5 2,24 (2Н, м), 3,06 (2Н, (2) 4-циано-5-(4,4-дифторбут-3-енилтио)-1,31 т), 4,00 (ЗН, с), 4,20 (1Н, м), 8,08 (1Н, с), (т пл 59,4 диметилпиразол (соединение IX 73) Н ЯМР - 60,0°С) 5 1,38 (ЗН, т), 2,20 (2Н, м), 2,38 (ЗН, с), 3,02 (2Н, т), 3,97 (ЗН, с), 4,25 (1Н, м), (масло) Гексан/диэтиловый эфирный фильтрат упаривают при пониженном давлении и масло (содер(3) этил 5-(4,4-дифторбут-3-енилтио)-1жащее соединение IX 37 с около 10% этилового фенилпиразол эфира исходного продукта со стадии 1) обрабаты(соединение 1X124) М + = 338, 1Н ЯМР 5 1,40 вают про-пан-2-олом (20см3), содержащим меток(ЗН, т), 2,05 (2Н, м), 2,88 (2Н, т), 3,97 (1Н, м), 4,37 сидом натрия (катализатор переэтерификации, (2Н, кв), 7,50 (5Н, м), 8,16 (1Н, с), (масло) 10мг), и смесь нагревают с обратным холодильниПРИМЕР IX 6 ком в течение 5 часов Реакционную смесь охлажВ данном примере описан способ получения дают, разбавляют водой и продукт экстрагируют 4-циано-5-(4,4-дифторбут-3-енилсульфонил)-1,3диэтиловым эфиром Органическую фазу сушат диметилпиразола (соединение IX 75) (MgSO4) и упаривают при пониженном давлении с Соединение IX 73 (1,32г) в дихлорметане получением соединения IX 37 (0,1 г) МН+ = 291, 1Н (120см3) обрабатывают 3-хлорнадбензойной киЯМР 5 1,35 (5Н, д), 2,22 (2Н, м), 3,05 (2Н, т), 3,97 слотой (3,94г, содержащие 50% над-кислоты) (ЗН, с), 4,20 (1Н, м), 5,20 (1Н, септиплет), 7,95 (1Н, Смесь перемешивают в течение 18 часов, разбавс), (масло) ляют еще дихлорметаном и промывают последовательно водным раствором карбоната натрия, ПРИМЕР IX 8 метабисульфита натрия Осуществляют промываВ данном примере описан способ получения ние водой, карбонатом натрия и водой перед тем, 5-(4,4-дифторбут-3-енилсульфонил)-1как органическую фазу сушат (MgSC^) Раствориметилпиразол-4-карбоновой кислоты (соединение тель упаривают при пониженном давлении и остаIX 42) ток фракционируют с помощью хроматографии Соединение IX 36 (0,83г) растворяют в этано(силикагель, гексан диэтиловый эфир 1 1 по объле (35см3) и обрабатывают моногидратом гидро+ ему) с получением соединения IX 75 (0,47г) М = ксида лития (0,34г) в воде (7см3) при комнатной 275, 1Н ЯМР 5 2,42 (ЗН, с), 2,30 (2Н, м), 2,58 (ЗН, температуре Реакционную смесь перемешивают 52 51 44732 в течение 18 часов, этанол упаривают при понифильтрат упаривают с получением вязкого масла 3 женном давлении, водную фазу подкисляют 2М (9,2г) Масло прибавляют к толуолу (60см ) и су3 хлористоводородной кислотой и продукт экстрагихому диметилформамиду (4см ), содержащему руют этилацетатом Органическую фазу сушат 1,1-тиокарбонилимидазол (5,655г), и смесь пере(MgSO4) и растворитель упаривают при пониженмешивают при комнатной температуре в течение ном давлении с получением смолы, которую рас2 часов После выдерживания еще в течение 60 тирают с диэтиловым эфиром/гексаном с получечасов образуется твердый продукт бежевого цве+ 1 нием соединения IX 42 (0,43г) M(NH4) = 298, Н та, который отделяют фильтрацией (получают ЯМР 5 2,52 (2Н, м), 3,72 (2Н, т), 4,10-4,30 (ЗН, м), 5,2г), и ЯМР которого показывает, что он пред8,05 (1Н, с), (т пл 118,4-122,0°С) ставляет собой нециклизованный продукт взаимодействия между гидроксигруппой амидоксима и ПРИМЕРХ1 тиокар-бонильной группой Часть раствора (2г) Данный пример иллюстрирует два родственприбавляют к суспензии гидрида натрия (0,33г) в ных способа получения меркапто-1,2,43 сухом диметилформамиде (30см ) (вспенивание) оксадиазолов, необходимых в качестве промежуи смесь перемешивают при комнатной температуточных продуктов для получения соединений по ре в течение 5 часов и оставляют стоять на 18 изобретению Общим способом получения 5часов Продукт реакции выливают в воду и промеркапто-1,2,4-оксадиазолов является циклизация дукт экстрагируют этилацетатом Объединенные амидоксима и активированного тиокарбонильного органические фазы отделяют, сушат (MgSO4) и соединения, такого как тиофосген или 1,1упаривают при пониженном давлении, а в конце в тиокарбонилдиимидазол Применение первого из высоком вакууме для удаления следов диметилэтих реагентов проиллюстрировано получением 5формамида Сырой 5-меркапто-З-метоксиметилмеркапто-3-фенил-1,2,4-оксадиаэола 1,2,4-оксадиазол имеет 1Н ЯМР 5 3,2 (ЗН, с), 4,10 Бензонитрил (15г), гидрохлорид гидроксила(2Н, с), 6,92 - 6,98 (1Н, ушир, с), и используется мина (Юг), карбонат калия (Юг), этанол (150см3) и далее без дополнительной очистки воду нагревают вместе с обратным холодильником в течение 6 часов и затем оставляют на холоПРИМЕРХ2 ду в течение ночи Реакционную смесь фильтруют Данный пример иллюстрирует общий способ и твердый остаток промывают этанолом Фильтполучения 5-(4, 4-дифторбут-3-енилтио)-3рат и промывные жидкости объединяют и упаризамещенных-1,2,4-оксадиазолов, используя соотвают и полученный коричневый осадок распредеветствующие 5-меркаптопроизводные, полученляют между этилацетатом и водой Органическую ные по примеру выше Это показано следующим фазу отделяют, промывают насыщенным солевым получением 5-(4,4-дифторбут-3-енилтио)-3раствором и сушат (MgSO4) Упаривание дает кометоксиметил-1,2,4-оксадиазола, соединения ричневое масло, которое кристаллизуют при доХ26 бавлении этилацетата и гексана с получением К раствору 5-меркапто-3-метоксиметил-1,2,4серого твердого продукта (10,Зг) Твердый продукт оксадиазола (2,78г) в ацетоне (150см3) прибавля3 (4,4г) перемешивают в эфире (50см ) и прибавляют 4-бром-1,1-дифторбут-1-ен (4,87г) и карбонат ют тиофосген (0,55см3), что дает образование гускалия (3,15г) и смесь нагревают вместе с обраттого белого осадка Реакционную смесь нагревают ным холодильником в течение 18 часов ГХ покас обратным холодильником в течение 1 часа и зывает, что реакция завершена Неорганические затем оставляют охлаждаться Затем прибавляют твердые продукты удаляют фильтрацией реакцираствор гидроксида натрия в воде (50см3) и реаконной смеси через плаг силикагеля sorbital-СЗО, ционную смесь нагревают еще в течение 4 часов, промывают ацетоном Фильтрат упаривают при затем оставляют охлаждаться для образования пониженном давлении и желтый осадок хроматодвухфазной реакционной смеси Органическую графируют на sorbital-СЗО, элюируя 5%-ным этилфазу отделяют и водный слой дважды экстрагиацетатом в гексане с получением соединения X 26 руют эфиром Водный слой экстрагируют этилаце(1,6г) 1Н ЯМР 5 2,47 - 2,58 (2Н, м), 3,28 - 3,35 (2Н, татом и объединенные эти-лацетатные слои сут), 3,49 (ЗН, с), 4,18 - 4,36 (1Н, м), 4,54 (2Н, с), шат (MgSO4) и упаривают с получением 5(масло) меркапто-3-фенил-1,2,4-оксадиазола в виде оранПо способу, описанному выше, используя сожево-коричневого твердого продукта (0,554г), коответствующие промежуточные продукты, полуторое используют без дополнительной очистки 1Н чают следующие соединения по изобретению ЯМР 5 7,45 - 7,63 (ЗН, м), 7,70 - 7,90 (2Н, м) (1) 5-(4,4-дифторбут-3-енилтио)-3метил1,2,4-оксадиазол (соединение X 32) 1Н ЯМР 5 Использование альтернативного реагента, 2,37 (ЗН, с), 2,45 - 2,55 (2Н, м), 3,22 - 3,30 (2Н, т), 1,1-тиокарбонилдиимидазола, проиллюстрирова4,16 - 4,35 (1Н, м), (масло) из 5-меркапто-З-метилно получением 5-меркапто-3-метоксиметил-1,2,41,2,4-оксадиазола оксадиазола Метоксиацетонитрил (7,1 г), гидрохлорид гид(2) 5-(4,4-дифторбут-3-енилтио)-3-фенилроксиламина (7г), карбонат калия (13,8г), этанол 1,2,4-оксадиазол (90см3) и воду (9см3) нагревают вместе при 50°С в (соединение Х1) М + = 268 1Н ЯМР 5 2,58 течение 9 часов и затем оставляют охлаждаться (2Н, м), 3,35 (2Н, т), 4,31 (1Н, м), 7,45 - 7,56 (ЗН, Реакционную смесь фильтруют и белый твердый м), 8,07 (2Н, д),(масло) из 5-меркапто-З-фенилостаток промывают этилацетатом Фильтрат и 1,2,4-оксадиазола промывные жидкости объединяют и упаривают и ПРИМЕРХЗ полученный остаток растворяют в дихлорме-тане Данный пример иллюстрирует способ получеНерастворимые продукты удаляют фильтрацией и ния 5-(4,4-дифторбут-3-енилсульфонтл)-3 53 44732 54 метоксиметил-1,2,4-оксадиазола (соединение (7,17г), охлаждают до 0°С и прибавляют по каплям, поддерживая температуру реакционной смеX 27) из соединения X 26 си ниже 5°С, гидроксид натрия в воде (5,6г в Соединение X 26 ф,6г) охлаждают до 0°С в 200см3) После завершения прибавления реакцидихлорметане (50см ) и прибавляют 3онной смеси дают нагреться до комнатной темпехлорнадбензойную кислоту (2,19, 2,5экв) в течературы и перемешивают в течение ночи Смесь ние более пяти минут Смесь перемешивают при два раза экстрагируют этилацетатом, органичекомнатной температуре 1 час и выдерживают 40 скую фазу отделяют, промывают насыщенным часов Реакционную смесь выливают в насыщенсолевым раствором и сушат (MgSO4) Затем расный водный раствор бикарбоната натрия и протвор продукта фильтруют и упаривают при понидукт экстрагируют дихлорметаном Органический женном давлении с получением коричневого масслой промывают насыщенным водным раствором ла (8,2г), которое хроматографируют на бикарбоната натрия, водой и насыщенным солесиликагеле (Sorbsil C30), используя 3%-ный етилвым раствором и сушат (MgSC^) Упаривание расацетат в гексане в качестве элюента и получают творителя при пониженном давлении дает светлосоединение XI 102 М+ = 242, 1Н ЯМР 5 2,4 - 2,6 коричневое твердое вещество, которое хромато(2Н, м), 3,2 - 3,3 (ЗН, т), 4,2 - 4,4 (1Н, м), (масло) графируют на силикагеле, элюируя 10%-ным зтила-цетатом в гексане, повышая до 20%-ного этилПРИМЕР XI 1В ацетата в гексане, с получением соединения Х27, Общий способ получения 5-[(41 имеющего Н ЯМР 5 2,6 - 2,71 (2Н, м), 3,51 (ЗН, с), метилфенил)сульфонил]-3-замещенных-1,2,43,58 - 3,65 (2Н, т), 4,21 - 4,37 (1Н, м), 4,69 (2Н, с), тиадиазолов проиллюстрирован в следующем (масло) Этот продукт, как обнаружено, нестабидвухстадийном способе получения 3лен и при стоянии в течение 60 часов заметно метоксиметил-5-[(4-метилфенил)сульфонил]-1,2,4гидролизуется тиадиазола из метоксиацетамида Стадия 1 Получение 5-метоксиметил-1,3,4-оксатиазол-2-она ПРИМЕР XI 1А Хлоркарбонилсульфенилхлорид (7,35г) прибавДанный пример иллюстрирует общие способы ляют к суспензии метоксиацетамида (5г) в толуоле получения 5-хлор-3-замещенных-1,2,4(30см3) Реакционную смесь перемешивают и натиадиазолов, как показано на примере следующегревают при 90 - 100°С в течение 5 часов, затем го получения 5-хлор-3-хлорметил-1,2,4охлаждают Растворитель удаляют упариванием тиадиазола из гидрохлорида хлорацетамидина при пониженном давлении с получением коричнеСуспензию гидрохлорида хлорацетамидина вой смолы (6,6г) М + = 147, 1Н ЯМР (flMCO-d6) 5 (1,29г) в дихлорметане (100см3) охлаждают до 0°С 3,30 (ЗН, с), 4,30 (2Н, с), которую используют даи прибавляют перхлорметилмер-каптан По каплее без дополнительной очистки лям прибавляют (выделение тепла) гидроксид натрия в воде (20г в 30см3), поддерживая темпеСтадия 2 Получение 3-метоксиметил-5-[(4ратуру реакционной смеси ниже 5°С После заметилфенил)сульфонил]-1,2,4-тиадиазола вершения прибавления реакционной смеси дают 4-Метилбензолсульфонилцианид (16,26г) принагреться до комнатной температуры и перемебавляют к эмульсии 5-метоксиметил-1,3,4шивают в течение ночи Смесь разбавляют водой оксатиазол-2-она (6,6г) в додекане (60см3) Реаки дихлорметаном и все фильтруют через пад из ционную смесь перемешивают и нагревают при целита для удаления нерастворенного продукта 150°С в течение 18 часов, затем охлаждают ПриОрганическую фазу отделяют, промывают насыбавляют воду и продукт экстрагируют этилацетащенным солевым раствором и сушат над сульфатом Объединенные органические фазы сушат том магния Затем раствор продукта фильтруют и (MgSO4) зтилацетат удаляют путем упаривания упаривают при пониженном давлении с полученипри пониженном давлении Остаток разделяют на ем коричневого масла (9,72г), которое используют коричневую жидкость и прозрачный слой, который без дополнительной очистки М + = 168, 1Н ЯМР 5 удаляют и отбрасывают Хроматография коричне4,75 (с) вой жидкости на силикагеле (Sorbsil СЗО), используя 3 7 этилаце-тат гексан в качестве элюента с По способу примера XI 1А получают следуюполучением бледно оранжевого масла, которое щие промежуточные соединения затвердевает при стоянии (6,94г) М + = 284, 1Н (1) 5-хлор-3-трифторметил-1,2,4-тиадиазол ЯМР 5 2,40 (ЗН, с), 3,45 (ЗН, с), 4,7 (24, с), 7,4 (2Н, М + = 188(т пл 50°С при 12мм ртст) д), 8,0 (2Н, д), (т пл 43,4 - 45,4°С) (2) 5-хлор-3-метилмеркапто-1,2,4-тиадиазол М + = 166 По двухстадийному способу примера XI 1В получают следующие соединения по изобрете(3) 5-хлор-3-метокси-1,2,4-тиадиазол М + = нию Исходные продукты были известными соеди150 нениями (4) 5-хлор-3-(2-пиразинил)-1,2,4-тиадиазол М + = 198 (1) 3-этил-5-[(4-метилфенил)сульфонил]-1,2,4Подобный способ был использован для полутиадиазол чения соединения XI 102 по изобретению, как это М + = 268, 1Н ЯМР 5 1,3 - 1,4 (ЗН, т), 2,45 (ЗН, описано далее с), 2,95 - 3,05 (2Н, кв), 7,4 (2Н, т), 8,0 (2Н, м), из пропионамида Получение 5-хлор-3-(4,4-дифторбут-3енилтио)-1,2,4-тиадиазола (2) 3-(Е-проп-1 -енил)-5-[(4Суспензию гидробромида 4,4-дифторбут-Зметилфенил)сульфонил]-1,2,4-тиадиазол М+ = 3 1 енилизотиоурония (8,68г) в воде (200см ), содер280 Н ЯМР 5 1,95 (ЗН, дд), 2,45 (ЗН, с), 6,5 - 6,6 жащей натрий лаурилсульфат (0,1 г, каталитиче(1Н, м), 7,0 - 7,1 (2Н, м), 7,4 (2Н, м), 8,0 (2Н, м) из ское количество) и перхлорметил меркаптан кротонамида 55 44732 56 ПРИМЕР XI 2 4,2-4,35 (1Н, м), (масло) Данный пример иллюстрирует общие способы (6) 3,5-бис-(4,4-дифторбут-3-енилтио)-1,2,4получения 5-(4,4-дифторбут-3-енилтио)-3тиадиазол замещенных-1,2,4-тиадиазолов, используя либо 5(соединение XI 109) М + = 330 1Н ЯМР 5 2,45хлор- или 5-[(4-метилфенил)сульфонил]-1,2,42,6 (4Н, м), 3,2 - 3,35 (4Н, м), 4,2 - 4,4 (2Н, м), (матиадиазольное промежуточное соединение, полусло) из соединения XI 102 ченное как указано выше Общий метод проиллю(7) 5-(4,4-дифторбут-3-енилтио)-3-(2стрирован следующим получением 5-(4,4пиразинил)-1,2,4-тиадиазол (соединение XI 125) дифторбут-3-енилтио)-3-метоксиметил-1,2,4М + = 286 f H ЯМР 5 2,55 - 2,65 (2Н, м), 3,35 - 3,45 тиадиазол (соединение XI 34) (2Н, т), 4,25 - 4,40 (1Н, м), 8,65 (1Н, д), 8,75 (1Н, дд), 9,55 (1Н, д), (масло) Гидроксид натрия в воде (0,848г в 10см3) прибавляют к 4,4-дифторбут-З-енилизотиуроний гидПРИМЕР XI 3 робромиду (1,75г) и смесь перемешивают при Данный пример иллюстрирует способ получекомнатной температуре в течение 20 минут Расния 3-бутоксиметил-5-(4,4-дифторбут-3-енилтио)твор 3-метоксиметил-5-[(41,2,4-тиадиазола (соединение XI 30) метилфенил)сульфонил]-1,2,4-тиадиазола (2,01 г) Карбонат калия (0,444г) и н-бутанол (0,397г) в дихлорметане (10см ) и прибавляют тетраприбавляют к раствору соединения XI 25 (0,275г) в бутиламмонийбромид (0,1 г, каталитическое колидиметилфорамиде (2см3) и смесь перемешивают чество) и смесь перемешивают в течение 20 мипри комнатной температуре в течение 18 часов нут ТСХ показывает, что продукт образован ТСХ показывает, что соединение XI 25 все еще 3 Смесь разбавляют еще дихлорметаном (10см ) и присутствует в смеси, поэтому прибавляют гидрид органическую фазу отделяют, промывают насынатрия (0,1 г) и н-бутанол (0,4г)и смесь перемешищенным раствором соли, сушат (MgSC^), фильтвают при комнатной температуре в течение еще руют и упаривают при пониженном давлении с 24 часов Прибавляют воду и продукт экстрагируполучением оранжево-желтой жидкости Хроматоют диэтиловым эфиром Органическую фазу суграфия сырого продукта на силикагеле (Sorbsil шат (MSO4), фильтруют и упаривают при пониСЗО), используя 1 4 этилацетат в гексане в качеженном давлении с получением масла (0,442г), стве элюента с получением соединения XI34 которое очищают хроматографией на силикагеле (1,67г) М + = 252, 1 НЯМР 5 2,45 - 2,55 (24, м), 3,25 (Sorbsil СЗО), используя 10%-ный этилацетат в - 3,35 (2Н, т), 3,5 (ЗН, с), 4,15 - 4,35 (1Н, м), 4,65 гексане в качестве элюента с получением соеди(2Н, с), (масло) нения XI 30 (0,131г) М + = 294, 1Н ЯМР 5 0,95- 1,0 (ЗН, т), 1,4 - 1,55 (2Н, м), 1,75 - 1,9 (2Н, м), 2,25 По вышеуказанному способу в соответствии с 2,45 (2Н, м), 2,6 - 2,7 (2Н, т), 3,75 (2Н, с), 4,15 - 4,3 изобретением, но используя соответствующие (1Н, м), 4,4-4,5 (1Н,т), (масло) промежуточные продукты, получают следующие соединения (1) 5-(4,4-дифторбут-3-енилтио)-3трифторметил-1,2,4-тиадиазол (соединение XI 9) М + = 276 1Н ЯМР 5 2,5 - 2,6 (2Н, м), 3,3 - 3,4 (2Н, т), 4,2-4,4 (1Н, м), (масло) (2) 5-(4,4-дифторбут-3-енилтио)-3-(Е-проп-1енил)-1,2,4-тиадиазол (соединение XI 11) М + = 248 1Н ЯМР 5 1,95 (ЗН, дд), 2,5 - 2,6 (2Н, м), 3,3 (2Н,т), 4,2-4,4 (1Н, м), 6,45 - 6,55 (1Н, м), 6,9-7,1 (1Н, м), (масло) (3) 3-этил-5-(4,4-дифторбут-3-енилтио)-1,2,4тиадиазол (соединение XI 23) М + = 236 1Н ЯМР 5 1,3-1,4 (ЗН, т), 2,45 - 2,55 (2Н, м), 2,9 - 3,0 (24, кв), 3,3 (2Н, т), 4,2 - 4,4 (14, м), (масло) (4) 3-хлорметил-5-(4,4-дифторбут-3-енилтио)1,2,4-тиадиазол (соединение XI 25) М + = 256 1Н ЯМР 5 2,45 - 2,55 (2Н, м), 3,35 (2Н, т), 4,2 - 4,35 (1Н, м), 4,7 (2Н, с), (масло) В этой реакции получены еще два продукта, которые разделяют в процессе хроматографии и охарактеризованы Это 3-(4,4-дифторбут-3-енилтиометил)-5-(4,4дифторбут-3-енилтио)-1,2,4-тиадиазол (соединение XI 38) М + = 344 1Н ЯМР 5 2,25 - 2,35 (2Н, м), 2,45 - 2,55 (2Н, м), 2,65 (2Н, т), 3,3 (2Н, т), 4,15 4,35 (2Н, м), (масло) и 5-хлор-3-(4,4-дифторбут-3енилтиометил)-1,2,4-тиадиазол М + = 256 1Н ЯМР 5 2,2 - 2,3 (2Н, м), 2,65 (2Н, т), 2,65 (2Н, т), 3,9 (2Н, с), 4,1 -4,3 (1Н, м), (масло) По вышеописанному способу с н-пропанолом вместо н-бутанола получают следующее соединение (1) 5-(4,4-дифторбут-3-енилтио)-3пропоксиметил-1,2,4-тиадиазола (соединение XI 31) М + = 280, 1Н ЯМР 5 1,0 - 1,1 (ЗН, т), 1,8 1,95 (2Н, м), 2,25 - 2,35 (2Н, м), 2,6 - 2,7 (2Н, т), 3,75 (2Н, с), 4,15 - 4,4 (1Н, м), 4,4 - 4,5 (1Н, т), (масло) ПРИМЕР XI 4 Данный пример иллюстрирует двухстадийный способ получения 5-(4,4-дифторбут-3-енилтио)-3метил-1,2,4-оксадиазола (соединение XI 40) К раствору ацетамида (5г) в метаноле (100см3) прибавляют дисульфид углерода (4г), серу (1,7г) и метоксид натрия (5,7г) и смесь нагревают с обратным холодильником в течение 6 часов Смесь охлаждают, фильтруют через hi-flo фильтр для удаления избытка серы и фильтрат распределяют между водой и этилацетатом Этилацетат упаривают с получением коричневого твердого продукта и при под кислений водного слоя образуется красный твердый продукт и его отфильтровывают Оба твердых продукта, полученных из фильтрата являются смесью 3-метил1,2,4-тиадиазол-5(4Н)-тиона и серы Эти два твердых продукта объединяют и используют на следующей стадии (5) 5-(4,4-дифторбут-3-енилтио)-3-метокси1,2,4-тиадиазол (соединение XI 87) М + = 238 1Н ЯМР 5 2,45 - 2,55 (2Н, м), 3,3 (2Н, т), 4,1 (ЗН, с), Стадия 2 Получение соединения XI 40 К раствору З-метил-1,2 4-тиадиазол-5(4Н)тиона (1,2г) в ацетоне (100см) 4,4-дифторбут-Зенил-4-метилбензолсульфонат (2,4г) и карбонат 57 44732 58 калия (1,2г) и смесь нагревают с обратным холоДанный пример иллюстрирует способ получедильником в течение 4 часов, после чего ТСХ пония 5-(4,4-дифторбут-3-енилтио)-3-(нитрофенил)казывает полное расходование исходного продук1,2,4-тиадиазола (соединение XI 127) та Реакционную смесь выливают в зтилацетат и Газообразный сульфид водорода барботируразделяют воду и слои Водный слой экстрагируют в течение 40 минут через смесь метоксида кают етилацетатом и объединенные органические лия (2,2г) и абсолютного этанола (2,5см3), охлажслои сушат (MgSO4) Раствор продукта затем дают до -10°С Колбу снимают с охлаждающей фильтруют и упаривают при пониженном давлебани, прибавляют 5-хлор-3-(нитрофенил)-1,2,4нии с получением коричневого масла, которое тиадиазол (Зг) и смесь нагревают с обратным хоочищают флэш хроматографией (силикагель, 7% лодильником в течение 1 часа Реакционную зтилацетат в гексане) с получением 5-(4,4смесь охлаждают и выливают в эфир и получендифторбут-3-енилтио)-3-метил-1,2,4-тиадиазола в ный осадок отфильтровывают Фильтрат, содер+ 1 виде коричневого масла (0,645г) М = 222, Н жащий 5-меркапто-3-(нитрофенил)-1,2,4ЯМР 5 2,56 (2Н, ушир кв), 2,63 (ЗН, с), 3,30 (2Н, т), тиадиазол, помещают в колбу и прибавляют 4,44,30 (1Н, м) дифторбут-З-енилтио-4-метилбензолсульфонат (1,5г) и добавляют - 1 г карбоната калия и смесь По вышеуказанному способу, но с 3-фенилнагревают с обратным холодильником в течение 3 1,2,4-тиадиазол-5(4Н)-тионом в качестве исходночасов, после чего ГХ показывает практически полго продукта, получают следующее соединение ное расходование тозилата Реакционную смесь (1) 5-(4,4-дифторбут-3-енилтио)-3-фенилвыливают в зтилацетат и воду и слои разделяют 1 1,2,4-тиадиазол (соединение XI 5) Н ЯМР 5 2,53 Водный слой экстрагируют этилацетатом и объе(2Н, кв), 3,30 (2Н, т), 4,24 (1Н, м), 7,38 (ЗН, м), 8,2 диненные органические слои сушат (MgSO4) Упа(2Н, м) ривание при пониженном давлении дает коричнеПРИМЕР XI 5 вую жидкость, которую очищают флэш Данный пример иллюстрирует способ получехроматографией (силикагель, элюент 5% этилацения 3-(4,4-дифторбут-3-енилтио)-5-метокси-1,2,4тат в гексане) с получением соединения XI 127 тиадиазола (соединение XI 108) (0,901г) М + = 329, 1 НЯМР 5 2,60 (2Н, широкий кв), Гидроксид натрия (0,182г) прибавляют к рас3,44 (2Н, т), 4,34 (1Н, м), 7,65 (1Н, т), 8,32 (1Н, дд), твору соединения XI 102 (1г) в метаноле (5см3) и 8,6 (1Н, д), (масло) смесь перемешивают при комнатной температуре в течение 45 минут, после чего определяется полПРИМЕР XI 8 ное расходование исходного продукта К смеси Данный пример иллюстрирует способ, подхоприбавляют воду и диэтиловый эфир и продукт дящий для получения соединений по изобретеэкстрагируют диэтиловым эфиром Органическую нию, в которых атом серы в заместителе 4,4фазу сушат (MgSO4), фильтруют и упаривают при дифторбут-3-енилтио соответствующего неокиспониженном давлении с получением желтого масленного соединения (полученный по способам ла(0,9г) Очистка флэш хроматографией (силикапредшествующих примеров) окисляют до сульгель, 5% зтилацетат в гексане) дает соединение фоксида (сульфинил) или сульфона (сульфонил) XI 108 (0,78г) М + = 238, 1Н ЯМР 5 2,4 - 2,5 (2Н, м), Соединение XI 34 (0,85г) перемешивают при 3,2(2Н,т), 4,15 (ЗН, с), 4,2-4,35 (1Н, м), (масло) комнатной температуре в дихлорметане (10см3) и прибавляют 3-хлорнадбензойную кислоту (0,814г, ПРИМЕР XI 6 1,4экв) Через три с половиной часа ГЖХ показыДанный пример иллюстрирует способ получевает полное расходование исходных продуктов и ния 5-(4,4-дифторбут-3-енилтио)-3-метилтио-1,2,4образование двух продуктов, реакцию гасят притиадиазола (соединение XI 110) бавлением насыщенного водного раствора бикарНаногидрат сульфида натрия (0,555г) прибавбоната натрия и продукты экстрагируют дихлорляют к 5-хлор-3-метилтио-1,2,4-тиадиазолу (1,5г) в метаном Органические фазы разделяют, этаноле (10см3) и смесь перемешивают и нагрепромывают насыщенным раствором соли и сушат вают с обратным холодильником в течение 18 над сульфатом магния После фильтрации и кончасов Реакционную смесь охлаждают и растворицентрирования при пониженном давлении полутель удаляют упа-риванием при пониженном давчают белый твердый продукт (1,2г), который очилении с получением желтого твердого продукта щают хроматографией на силикагеле, (1,76г), которое растворяют в ацетоне (30см3) Прибавляют карбонат калия (2,22г) и 4-бром-1,1используя 3 7 зтилацетат гексан в качестве дифторбут-1-ен (1,83г) и смесь перемешивают и элюента с получением сначала 5-[(4,4-дифторбутнагревают с обратным холодильником в течение 3-енил)сульфонил]-3-метоксиметил-1,2,418 часов Реакционную смесь охлаждают, фильттиадиазола (соединение XI 36) М + = 284, 1Н ЯМР руют через hi-flo фильтр для удаления неоргани5 2,55 - 2,65 (2Н, м), 3,55 (ЗН, с), 3,5 - 3,6 (2Н, т), ческих продуктов, промывают етилацетатом и 4,2 - 4,35 (1Н, м), 4,80 (2Н, с), (масло) Дальнейрастворитель удаляют упариванием при пониженшее элюирование дает 5-[(4,4-дифторбут-3ном давлении с получением коричневой смолы, енил)сульфинил]-3-метоксиметил-1,2,4-тиадиазол которую очищают хроматографией на силикагеле (соединение XI 35) М + = 268, 1Н ЯМР 5 2,3 - 2,75 (Sorbsil C30), используя 5% зтилацетат в гексане в (2Н, м), 3,15 - 3,4 (2Н, м), 3,55 (ЗН, с), 4,15 - 4,35 качестве элюента с получением соединения (1Н, м), 4,75 (2Н, с), (масло) XI 110(0,392г) М + = 254, 1Н ЯМР 5 2,45 - 2,55 (2Н, По вышеуказанному способу в соответствии с м), 2,65 (2Н, м), 3,25 - 3,35 (2Н, т), 4,2 - 4,35 (14, м), изобретением получают следующие соединения (масло) (1) 5-[(4,4-дифторбут-3-енил)сульфонил]-3этил-1,2,4-тиадиазола (соединение XI24) М = ПРИМЕР XI 7 59 44732 60 1 (2Н, д), (твердый продукт) 268, Н ЯМР 5 1,4 - 1,5 (ЗН, т), 2,55 - 2,65 (2Н, м), 3,05 - 3,15 (2Н, кв), 3,5 - 3,55 (2Н, т), 4,2 - 4,4 (1Н, (8) гидразид (2,6-дифторфенил)уксусной ки+ 1 м), (масло) ПРИМЕР XII 1 слоты М = 186, Н ЯМР 5 3,60 (2Н, с), 6,90 - 7,00 (2Н, м), 7,20 - 7,30 (1Н, м), (твердый продукт) Методы синтеза меркапто-1,3,4-оксадиазолов, + используемых в качестве промежуточных продук(9) гидразид 2-метилбензойной кислоты М = 1 тов, известны Далее проиллюстрированы два 150, Н ЯМР 5 2,45 (ЗН, с), 4,10 (2Н, умир с), 7,00 таких представительных метода (1Н, ушир с), 7,20 - 7,40 (4Н, м), (твердый проМетод А Получение 2-меркапто-5-метил-1,3,4Дукт) оксадиазола Стадия 2 Получение 5-(4-метоксибензил)К раствору гидразида уксусной кислоты (5г) в 1,3,4-оксадиазол-2(ЗН)тиона 3 3 этаноле (10см ) прибавляют дисульфид углерода Раствор гидроксида калия (0,7г) в воде (2см ) (7,7г) и затем гидроксид калия в этаноле (5,7г в прибавляют к перемешиваемому раствору гидра3 20см ), что вызывает образование осадка Реакзида (4-метоксифенил)уксусной кислоты (1,99г) в 3 ционную смесь перемешивают при комнатной этаноле (30см ) Прибавляют дисульфид углерода 3 температуре в течение 2 часов и оставляют сто(0,7см ) и реакционную смесь нагревают с обратять в течение ночи Реакционную смесь фильтруным холодильником в течение 6 часов и затем ют через с получением белого твердого продукта оставляют остывать Реакционную смесь упарива(11 г) Эту соль (5г) обрабатывают пиридином ют досуха при пониженном давлении и твердый (10см3) и реакционную смесь нагревают с обратостаток растворяют в воде Устанавливают рН 1 с ным холодильником всего в течение 14 часов помощью концентрированной хлористоводородПосле охлаждения реакционную смесь подкисляной кислоты, при этом образуется белый осадок ют и дважды экстрагируют диэтиловым эфиром Осадок отделяют фильтрацией, промывают водой Эфирный слой затем сушат над сульфатом маги эфиром и сушат на воздухе с получением 5-(4ния, фильтруют и упаривают при пониженном метоксибензил)-1,3,4-оксадиазол-2(ЗН)тиона давлении с получением оранжевого твердого про(1,96г) М + = 222, 1Н ЯМР 5 3,80 (ЗН, с), 3,95 (2Н, дукта Его пере-кристаллизовывают из этилацетас), 6,90 (2Н, д), 7,20 (2Н, д), (твердый продукт) та с получением 2-меркапто-5-метил-1,3,4Следующие соединения получены по вышеоксадиазола (0,655г) М + = 116, 1Н ЯМР 5 2,43 (ЗН, указанным методам, с использованием подходяс), 10,9 (1Н, ушир с) щих промежуточных продуктов (либо известных Метод В Получение 5-(4-метоксибензил)-1,3,4соединений, либо полученных по стадии 1) оксадиазол-2(ЗН)тиона (1) 1,3,4-тиадиазол-2(ЗН)тион-5-карбоксамид Стадия 1 Получение гидразида (4М + = 145, (твердый продукт) метоксифенил)уксусной кислоты (2) 5-тиенил-1,3,4-тиадиазол-2(ЗН)тион-5Гидразидгидрат (4,7см3) прибавляют по капкарбоксамид М+ = 184, (твердый продукт) лям к этил (4-метоксифенил)ацетату (3,73г) и за(3) 5-изопропил-1,3,4-тиадиазол-2(ЗН)тион М + тем добавляют метанол (20см ) с образованием = 144, (смола) гомогенной реакционной смеси Эту смесь пере(4) 5-циклопропил-1,3,4-тиадиазол-2(ЗН)тион мешивают при комнатной температуре в течение М + = 142, (смола) 18 часов, в течение которых образуется белый (5) 5-пропил-1,3,4-тиадиазол-2(ЗН)тион М + = осадок Осадок отделяют фильтрацией и промы144, (смола) вают метанолом и водой, затем сушат на воздухе (6) 5-этил-1,3,4-тиадиазол-2(ЗН)тион М + = с получением гидразида (4-метоксифенил) уксус130, (смола) + 1 ной кислоты (2г) М = 180, Н ЯМР 5 3,50 (2Н, с), (7) 5-(4-пиридил)-1,3,4-тиадиазол-2(ЗН)тион 3,80 (ЗН, с), 3,85 (2Н, ушир с), 6,70 (1Н, ушир с), М + = 179, ^Н ЯМР 5 7,75 (2Н, д), 8,75 (2Н, д), 6,90 (2Н, д), 7,20 (2Н, д), (твердый продукт) (твердый продукт) 1 Следующие соединения получены по выше(8) 5-бутил-1,3,4-тиадиазол-2(ЗН)тион Н указанным методам ЯМР 5 0,95 (ЗН, т), 1,35 - 1,50 (2Н, м), 1,65 - 1,75 + (1) гидразид 2-метилпропионовой кислоты М (2Н, м), 2,70 (2Н, т), 2,90 (1Н, ушир, с), (масло) 1 = 102, (твердый продукт) (9) 5-пентил-1,3,4-тиадиазол-2(ЗН)тион Н (2) гидразид цикяопропилуксусной кислоты М + ЯМР 5 0,90 (ЗН, т), 1,25 -1,45 (4Н, м), 1,75 (2Н, м), = 100, (твердый продукт) 2,70 (2Н, м), (масло) (3) гидразид бутановой кислоты М + = 102, 1Н (10) 5-(4-нитробензил)-1,3,4-тиадиазолЯМР 5 0,95 (ЗН, т), 1,60- 1,75 (2Н, м), 2,15 (2Н, т), 2(ЗН)тион М + = 237, 1Н ЯМР 5 4,20 (2Н, с), 7,50 3,90 (2Н, ушир с), 6,95 (1Н, ушир, с), (твердый (2Н, д), 8,25 (2Н, д), (твердый продукт) продукт) (11) 5-(2,6-дифторбензил)-1,3,4-тиадиазол+ (4) гидразид пропионовой кислоты М = 188, 2(ЗН)тион 1Н ЯМР 5 4,10 (2Н, с), 7,00 (2Н, м), 7,25 (твердый продукт) - 7,40 (1Н, м), (твердый продукт) (5) гидразид пентановой кислоты 1Н ЯМР 5 (12) 5-(4-метоксифенил)-1,3,4-тиадиазол0,90 (ЗН, т), 1,30 - 1,40 (2Н, м), 1,60 - 1,70 (2Н, м), 2(ЗН)тион 1Н ЯМР 5 3,80 (ЗН, с), 7,10 (2Н, д), 7,75 2,20 (2Н, т), 3,90 (2Н, ушир с), 6,80 (1Н, ушир, с), (2Н, д), (твердый продукт) (твердый продукт) (13) 5-(2-метилфенил)-1,3,4-тиадиазол1 (6) гидразид гексановой кислоты Н ЯМР 5 2(ЗН)тион 1Н ЯМР (ДМСО-de) 5 2,50 (ЗН, с), 7,30 0,90 (ЗН, т), 1,60 - 1,70 (2Н, м), 2,15 (2Н, т), 3,90 7,40 (2Н, м), 7,40 - 7,50 (1Н, м), 7,55 (1Н, ушир, д), (2Н, ушир с), 6,70 (1Н, ушир, с), (твердый продукт) (твердый продукт) (7) гидразид (4-нитрофенил)уксусной кислоты (14) 5-(2-метоксифенил)-1,3,4-тиадиазол1 Н ЯМР 5 (ДМСО-de) 3,50 (2Н, с), 7,50 (2Н, д), 8,10
ДивитисяДодаткова інформація
Автори російськоюHotson, Matthew, Brian
МПК / Мітки
МПК: C07D 233/86, C07D 233/92, C07D 237/30, C07D 261/10, C07D 253/00, A01N 43/50, C07D 271/07, C07D 417/04, C07D 285/135, C07D 413/04, C07D 277/56, A01N 43/82, C07D 213/80, C07C 323/09, A01N 43/40, C07D 241/18, C07D 233/84, A01N 43/707, C07D 231/18, C07D 213/71, C07D 213/82, C07D 271/113, C07D 333/38, C07D 277/36, A01N 43/56, A01N 43/08, C07C 17/087, A01N 43/80, C07C 323/05, A01N 43/76, C07D 261/14, C07D 277/40, C07D 263/34, C07D 233/90, A01N 43/54, C07D 263/46, A01N 43/58, C07D 237/18, C07D 285/08, C07D 241/12, C07D 213/81, C07D 307/64, C07D 231/28, C07D 277/58, C07D 241/44, C07D 333/34, C07D 285/125, A01N 43/64, C07D 237/10, C07C 17/23, C07D 271/06, A01N 43/713, A01N 43/74, C07D 213/85, C07D 213/70, C07D 333/62, A01N 43/66, C07D 277/20, C07C 317/14, C07D 257/00, C07D 213/84, C07D 261/18, C07D 471/04, C07D 251/22, A01N 43/10, C07D 275/00, C07D 271/10, C07D 409/04, C07D 231/30, A01N 33/22
Мітки: карбоциклічні, активність, композиція, спосіб, похідні, сільськогосподарська, заміщені, одержання, мають, знищення, приг, гетероциклічні, 4,4-дифторбутен-3-ілтіо, пестицидну
Код посилання
<a href="https://ua.patents.su/76-44732-44-diftorbuten-3-iltio-zamishheni-geterociklichni-abo-karbociklichni-pokhidni-shho-mayut-pesticidnu-aktivnist-sposib-kh-oderzhannya-silskogospodarska-kompoziciya-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">(4,4-дифторбутен-3-ілтіо) заміщені гетероциклічні або карбоциклічні похідні, що мають пестицидну активність, спосіб їх одержання, сільськогосподарська композиція, спосіб її одержання та спосіб знищення або приг</a>
Попередній патент: Будівельна панель і будівельна конструкція
Наступний патент: Спосіб одержання таблетки, що містить похідне бісфосфонової кислоти, вологим гранулюванням (варіанти) та тверда дозована форма
Випадковий патент: Роздавальний пристрій для мішка, який містить алкогольний напій, та апарат (варіанти) для розливу алкогольних напоїв












