Спіросполуки як антагоністи активності рецептора нейропептиду y
Номер патенту: 72540
Опубліковано: 15.03.2005
Автори: Ітох Такахіро, Канатані Акіо, Хага Юдзі, Такахасі Тосіюкі, Сакамото Тосіхіро, Ісіхара Аканє, Ісіі Ясуюкі, Фукамі Такехіро
Формула / Реферат
1. Сполука, представлена загальною формулою (І)
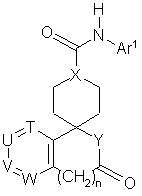 ,(I)
,(I)
де Аr1 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений оксогрупою, і групу, представлену формулою -Q-Ar2;
Ar2 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил;
n дорівнює 0 або 1;
Q - простий зв'язок або карбоніл;
T, U, V і W незалежно являють собою атом азоту або метинову групу, яка може мати замісник, вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу і нижчої алкоксигрупи, причому щонайменше два з вказаних T, U, V і W являють собою вказану метинову групу;
Χ являє собою метинову групу або азот;
Υ являє собою іміногрупу, яка може бути заміщена нижчим алкілом, або кисень;
її сіль або складний ефір.
2. Сполука за пунктом 1, де арил в Ar1 є фенілом.
3. Сполука за пунктом 1, де гетероарил в Аr1 означає піроліл, імідазоліл, піразоліл, тіазоліл, оксазоліл, ізоксазоліл, 1,2,3-триазоліл, 1,2,4-тіадіазоліл, піридил, піразиніл, піримідиніл, 1,2,4-триазиніл, бензоксазоліл, бензотіазоліл, хіноліл або піридо[3,2-b]піридил.
4. Сполука за пунктом 1, в якій T, U, V і W незалежно - метин, який може мати замісник, вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу і нижчої алкоксигрупи.
5. Сполука за пунктом 4, в якій T, U, V і W незалежно - метин, який може бути заміщений галогеном.
6. Сполука за пунктом 1, в якій Т, U, V і W - азот.
7. Сполука за пунктом 1, в якій Υ являє собою незаміщену іміногрупу або кисень.
8. Сполука за пунктом 1, в якій Υ - кисень.
9. Сполука за пунктом 1, яка представлена загальною формулою (I-а):
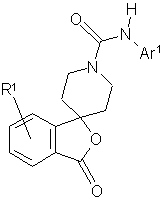 (I-a),
(I-a),
де Аr1 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений оксогрупою, і групу, представлену формулою -Q-Ar2;
Ar2 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил;
Q - простий зв'язок або карбоніл;
R1 - атом водню або галоген.
10. Сполука за пунктом 9, де арил в Ar1 означає феніл.
11. Сполука за пунктом 9, де гетероарил в Аr1 означає імідазоліл, піразоліл, ізоксазоліл, 1,2,4-тіадіазоліл, піразиніл, піримідиніл, хіноліл або піридо[3,2-b]піридил.
12. Сполука за пунктом 1, яка представлена загальною формулою (І-b):
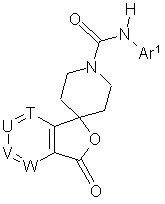 (I-b),
(I-b),
де Аr1 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений оксогрупою, і групу, представлену формулою -Q-Ar2;
Ar2 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил;
Q - простий зв'язок або карбоніл;
T, U, V і W незалежно являють собою атом азоту або метинову групу, яка може мати замісник, вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу і нижчої алкоксигрупи, причому щонайменше два з Т, U, V і W являють собою вказану метинову групу.
13. Сполука за пунктом 12, де арил в Ar1 означає феніл.
14. Сполука за пунктом 12, де гетероарил в Аr1 означає піроліл, імідазоліл, піразоліл, тіазоліл, оксазоліл, ізоксазоліл, 1,2,3-триазоліл, 1,2,4-тіадіазоліл, піридил, піразиніл, піримідиніл або 1, 2, 4-триазиніл.
15. Сполука за пунктом 12, в якій один з T, U, V і W - азот.
16. Сполука за пунктом 12, в якій V - азот, і кожний з T, U і W являє собою метинову групу.
17. Сполука за пунктом 1, яка являє собою
N-(4-бензоїлфеніл)-3-оксоспіро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід,
3-оксо-N-(5-феніл-2-піразиніл)спіро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід,
N-(7-метил-2-хіноліл)-3-оксоспіро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід,
N-(4-бензоїлфеніл)-2-метил-3-оксоспіро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід,
N-(4-бензоїлфеніл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
3,4-дигідро-3-оксо-N-(5-феніл-2-піразиніл)спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
3,4-дигідро-N-(7-метил-2-хіноліл)-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
N(4-ацетилфеніл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
3,4-дигідро-3-оксо-N-[1-(2-хіноліл)-4-імідазоліл]спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
3,4-дигідро-3-оксо-N-(5-оксо-5,6,7,8-тетрагідро-2-нафтил)спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
3,4-дигідро-N-[5-(2-метил-1-пропеніл)-2-піразиніл]-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
3,4-дигідро-3-оксо-N-(3-феніл-5-ізоксазоліл)спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
N-[1-(7-бензо[b]фураніл)-4-імідазоліл]-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
N-[1-(3-дифторметоксифеніл)-4-імідазоліл]-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
3,4-дигідро-3-оксо-N-[4-(2-піридилкарбоніл)феніл]спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
N-(3,4-дихлорфеніл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
N-[1-(3-хлорфеніл)-4-імідазоліл]-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
3,4-дигідро-3-оксо-N-(5-феніл-2-тіазоліл)спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
3,4-дигідро-3-оксо-N-[5-(2-піридил)-2-піразиніл]спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
3,4-дигідро-N-(4-метил-2-бензотіазоліл)-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
N-(5-хлор-2-бензоксазоліл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід,
N-(4-бензоїлфеніл)-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
N-(7-метил-2-хіноліл)-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
3-оксо-N-(4-феніл-5-ізоксазоліл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
3-оксо-N-(7-трифторметилпіридо[3,2-b]піридин-2-іл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
3-оксо-N-[1-(3-хіноліл)-4-імідазоліл]спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
3-оксо-N-(5-феніл-3-піразоліл)спіро[ізобензофуран-1(ЗН),4'-піперидин]-1'-карбоксамід,
N-[5-(4-хлорфеніл)-3-піразоліл]-3-оксоспіро[ізобензофуран-1(3Η),4'-піперидин]-1'-карбоксамід,
3-оксо-N-[5-(3-хіноліл)-3-піразоліл]спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
N-[5-(3-фторфеніл)-2-піримідиніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
3-оксо-N-[5-(3-трифторметилфеніл)-2-піримідиніл]спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
N-[5-(3-хлорфеніл)-2-піримідиніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
N-(7-фторметоксипіридо[3,2-b]піридин-2-іл)-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
3-оксо-N-(5-феніл-1,2,4-тіадіазол-3-іл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
N-{1-[3-(2-гідроксіетил)феніл]-4-імідазоліл}-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
N-[4-(1-етил-2-імідазоліл)феніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
N-[1-(3-метоксифеніл)-4-імідазоліл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
6-фтор-3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
6-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
5-фтор-3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
5-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
N-(4-бензоїлфеніл)-3,4-дигідро-3-оксоспіро[1Н-2-бензопіран-1,4'-тперидин]-1'-карбоксамід,
3,4-дигідро-3-оксо-N-(5-феніл-2-піразиніл)спіро[1Н-2-бензопіран-1,4'-піперидин]-1'-карбоксамід,
N-(5-бензоїл-2-піразиніл)-3,4-дигідро-3-оксоспіро[1Н-2-бензопіран-1,4'-піперидин]-1'-карбоксамід,
транс-N-(4-бензоїлфеніл)-3'-оксоспіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід,
транс-3'-оксо-N-(5-феніл-2-піразиніл)спіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід,
транс-3'-оксо-N-(1-феніл-4-імідазоліл)спіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід,
транс-3'-оксо-N-(5-феніл-2-піримідиніл)спіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід,
транс-N-[1-(3,5-дифторфеніл)-4-імідазоліл]-3'-оксоспіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід,
транс-3'-оксо-N-(5-феніл-3-піразоліл)спіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід,
транс-N-[1-(2-фторфеніл)-4-імідазоліл]-3'-оксоспіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід,
транс-N-(4-ацетил-3-трифторметилфеніл)-3'-оксоспіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід,
транс-3'-оксо-N-[1-(3-хіноліл)-4-імідазоліл]спіро[циклогексан-1,1'(3’H)-ізобензофуран]-4-карбоксамід,
транс-N-[1-(3-ціанофеніл)-4-імідазоліл]-3'-оксоспіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід,
транс-N-(4-бензоїлфеніл)-3-оксоспіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(5-феніл-2-піразиніл)спіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(3-феніл-5-ізоксазоліл)спіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(5-феніл-2-піримідиніл)спіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-(4-бензоїлфеніл)-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-(4-бензоїлфеніл)-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
N-[5-(4-гідроксифеніл)-2-піразиніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
N-[5-(3-гідроксифеніл)-2-піразиніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
4-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
7-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
6-етил-3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
6-гідрокси-3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід,
транс-3-оксо-N-(5-феніл-2-тримідиніл)спіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-фторфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(2-фторфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(4-феніл-2-оксазоліл)спіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(2-метилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-метилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-фторметоксифеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-фторметилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-фтор-5-метоксифеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(2-фтор-5-метилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[4-(3-фторметоксифеніл)-2-оксазоліл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-гідроксиметилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-гідроксифеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(5-феніл-2-піримідиніл)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-фторметилфеніл)-2-піримідиніл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-фторметоксифеніл)-2-піримідиніл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(6-феніл-1,2,4-триазин-3-іл)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(2-дифторметоксифеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-дифторметоксифеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(3-фторфеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[5-(4-фторфеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-(4-бензоїлфеніл)-3-оксоспіро[7-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[1-(3,5-дифторфеніл)-4-імідазоліл]-3-оксоспіро[7-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(2-феніл-4-піридил)спіро[7-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(1-феніл-4-піразоліл)спіро[7-азаізобензофуран-1(3H),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(1-феніл-3-піроліл)спіро[7-азаізобензофуран-1(3H),1'-циклогексан]-4'-карбоксамід,
транс-N-[1-(4-фторфеніл)-3-піразоліл]-3-оксоспіро[7-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(1-феніл-3-піразоліл)спіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(1-феніл-4-піразоліл)спіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[1-(3-фторфеніл)-4-піразоліл]-3-оксоспіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(1-феніл-3-піразоліл)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[1-(4-фторфеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-N-[1-(2-фторфеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(5-феніл-1,2,4-тіадіазол-3-іл)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(5-феніл-3-ізоксазоліл)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(6-феніл-3-піридил)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід,
транс-3-оксо-N-(2-феніл-3-тіазоліл)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід, або
транс-3-оксо-N-(2-феніл-1,2,3-триазол-4-іл)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'- карбоксамід.
18. Сполука за пунктом 1, яка являє собою 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід.
19. Сполука за пунктом 1, яка являє собою 3-оксо-N-(7-трифторметилпіридо[3,2-b]піридин-2-іл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід.
20. Сполука за пунктом 1, яка являє собою N-[5-(3-фторфеніл)-2-піримідиніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід.
21. Сполука за пунктом 1, яка являє собою транс-3'-оксо-N-(5-феніл-2-піримідиніл)спіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід.
22. Сполука за пунктом 1, яка являє собою транс-3'-оксо-N-[1-(3-хіноліл)-4-імідазоліл]спіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід.
23. Сполука за пунктом 1, яка являє собою транс-3-оксо-N-(5-феніл-2 піразиніл)спіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід.
24. Сполука за пунктом 1, яка являє собою транс-N-[5-(3-фторфеніл)-2піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід.
25. Сполука за пунктом 1, яка являє собою транс-N-[5-(2-фторфеніл)-2піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід.
26. Сполука за пунктом 1, яка являє собою транс-N-[1-(3,5-дифторфеніл)-4-імідазоліл]-3-оксоспіро[7-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід.
27. Сполука за пунктом 1, яка являє собою транс-3-оксо-N-(1-феніл-4піразоліл)спіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід.
28. Сполука за пунктом 1, яка являє собою транс-3-оксо-N-(1-феніл-3піразоліл)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід.
29. Сполука за пунктом 1, яка являє собою транс-3-оксо-N-(2-феніл-1,2,3-триазол-4-іл)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід.
30. Спосіб одержання сполуки загальної формули (I-1):
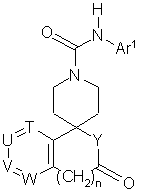 (I-1),
(I-1),
де Аr1 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений оксогрупою, і групу, представлену формулою -Q-Ar2;
Ar2 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил;
Q - простий зв'язок або карбоніл;
T, U, V і W незалежно являють собою атом азоту або метинову групу, яка може мати замісник, вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу і нижчої алкоксигрупи, причому щонайменше два з них являють собою вказану метинову групу;
n іΥ мають значення, описані далі;
її солі або складного ефіру, який включає взаємодію сполуки загальної формули (II):
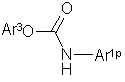 (II),
(II),
де Аr1p - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, нижчий алканоїл, нижчий алкоксикарбоніл, групу, представлену формулою -Qp-Ar2p і необов'язково захищений нижчий алкілен, необов'язково заміщений оксогрупою, гідрокси(нижчим)алкілом або карбоксильною групою;
Аr2p - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, нижчий алкокси, галоген(нижчий)алкокси, ди(нижчий алкіл)аміно, нижчий алканоїл, арил і необов'язково захищений гідрокси(нижчий)алкіл, гідроксил або нижчий алкіламіно;
Аr3 - феніл, який може бути заміщений галогеном або нітрогрупою;
Qp - простий зв'язок або необов’язково захищений карбоніл;
з сполукою загальної формули (III):
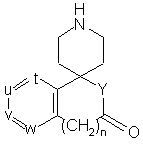 (III),
(III),
де n дорівнює 0 або 1;
t, u, v i w незалежно являють собою атом азоту або метинову групу, яка може мати замісник, вибраний з групи, що складається з галогену, нижчого алкілу, нижчої алкоксигрупи і необов'язково заміщеного гідроксилу, причому щонайменше два з них (t, u, v і w) являють собою вказану метинову групу;
Υ являє собою іміногрупу, яка може бути заміщена нижчим алкілом, або атом кисню;
з одержанням сполуки загальної формули (IV-1):
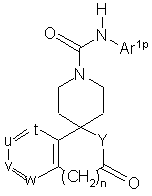 (IV-1),
(IV-1),
де Ar1p, n, t, u, v, w i Υ мають ті ж значення, що вказані вище;
з необов'язковим подальшим видаленням захисної групи.
31. Спосіб одержання сполуки загальної формули (I-2):
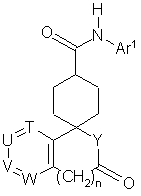 (I-2),
(I-2),
де Ar1 арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений оксогрупою, і групу, представлену формулою -Q-Ar2;
Ar2 арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил;
Q - простий зв'язок або карбоніл;
T, U, V і W незалежно являють собою атом азоту або метинову групу, яка може мати замісник, вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу і нижчої алкоксигрупи, причому щонайменше два з них (T, U, V i W) являють собою вказану метинову групу;
n і Υ мають ті ж значення, що визначені далі;
її сіль або складний ефір, який включає взаємодію сполуки (V):
Ar1p-NH2 (V),
де Аr1p - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, нижчий алканоїл, нижчий алкоксикарбоніл, групу формули -Qp-Ar2p і необов'язково захищений нижчий алкілен, необов'язково заміщений оксогрупою, гідрокси(нижчим)алкілом або карбоксильною групою;
Аr2p арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, нижчий алкокси, галоген(нижчий)алкокси, ди(нижчий алкіл)аміно, нижчий алканоїл, арил і необов'язково захищений гідрокси(нижчий)алкіл, гідроксил або нижчу алкіламіногрупу;
Qp - простий зв'язок або необов’язково захищений карбоніл; з карбоновою кислотою загальної формули (VI):
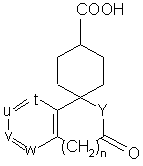 (VI),
(VI),
де n дорівнює 0 або 1;
t, u, v i w незалежно являють собою атом азоту або метинову групу, яка може мати замісник, вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу, нижчої алкоксигрупи і необов'язково захищеного гідроксилу, причому щонайменше два з них (t, u, v і w) являють собою вказану метинову групу;
Υ являє собою іміногрупу, яка може бути заміщена нижчим алкілом або атом кисню;
або її реакційноздатним похідним, з одержанням сполуки загальної формули (IV-2):
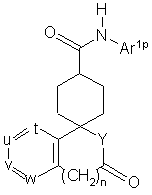 (IV-2),
(IV-2),
де Ar1p, n, t, u, v, w i Υ мають ті ж значення, як описано вище;
з необов'язковим подальшим видаленням захисної групи.
32. Антагоніст рецептора нейропептиду Υ, який містить як активний інгредієнт сполуку загальної формули (І):
 (I),
(I),
де Аr1 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений сксогрупою, і групу, представлену формулою -Q-Ar2;
Ar2 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил;
n дорівнює 0 або 1;
Q - простий зв'язок або карбоніл;
T, U, V і W незалежно являють собою атом азоту або метинову групу, яка може мати замісник, вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу і нижчої алкоксигрупи, причому щонайменше два з них (T, U, V i W) являють собою вказану метинову групу;
Χ - метин або азот;
Υ являє собою іміногрупу, яка може бути заміщена нижчим алкілом, або кисень;
її сіль або складний ефір.
33. Агент для лікування булемії, ожиріння або діабету, який містить як активний інгредієнт сполуку загальної формули (І):
 (I),
(I),
де Аr1 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений оксогрупою, і групу, представлену формулою -Q-Ar2;
Ar2 - арил або гетероарил, який може бути заміщений, причому замісник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил;
n дорівнює 0 або 1;
Q - простий зв'язок або карбоніл;
T, U, V i W незалежно являють собою атом азоту або метинову групу, яка може мати замісник, вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу і нижчої алкоксигрупи, причому щонайменше два з них (T, U, V i W) являють собою вказану метинову групу;
Χ - метин або азот;
Υ являє собою іміногрупу, яка може бути заміщена нижчим алкілом, або кисень;
її сіль або складний ефір.
34. Сполуки загальної формули (VI-1):
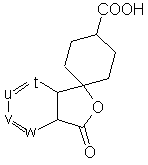 (VI-1),
(VI-1),
де t, u, v і w незалежно являють собою атом азоту або метинову групу, яка може мати замісник, вибраний з групи, що складається з галогену, нижчого алкілу, нижчої алкоксигрупи і необов'язково захищеного гідроксилу, причому щонайменше два з них (t, u, v і w) являють собою вказану метинову групу.
35. Сполука за п.1, яка являє собою транс-3-оксо-N-(5-феніл-2-піримідиніл)спіро[4-азаізобензофуран-1(3 H),1'-циклогексан]-4'-карбоксамід.
36. Сполука за п.1, яка являє собою транс-N-[5-(2-метилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід.
37. Сполука за п.1, яка являє собою транс-3-оксо-N-(5-феніл-2-піримідиніл)спіро[6-азаізобензофуран-1(3H),1'-циклогексан]-4'-карбоксамід.
38. Сполука за п.1, яка являє собою транс-3-оксо-N-(1-феніл-4-піразоліл)спіро[7-азаізобензофуран-1(3H),1'-циклогексан]-4'-карбоксамід.
39. Сполука за п.1, яка являє собою транс-N-[1-(3-фторфеніл)-4-піразоліл]-3-оксоспіро[4-азаізобензофуран-1(3H),1'-циклогексан]-4'-карбоксамід.
40. Сполука за п.1, яка являє собою транс-N-[1-(2-фторфеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3H),1'-циклогексан]-4'-карбоксамід.
Текст
Даний винахід застосовний в медичних областях. Більш детально, нові спіросполуки даного винаходу корисні як антагоністи рецепторів нейропептиду Υ і агенти для лікування серцево-судинних порушень різних типів, порушень центральної нервової системи, порушення обміну речовин і подібного. Нейропептид Υ (тут далі позначений ΝΡΥ), пептид, що складається з 36 амінокислот, уперше був виділений з мозку свині Tatemoto і інш. в 1982 [Nature, 296: 659 (1982)]. ΝΡΥ широко поширений в центральній нервовій системі і периферичній нервовій системі і грає різні ролі як один з найбільш поширених пептидів в нервовій системі. А саме, ΝΡΥ діє в центральній нервовій системі як речовина, що збуджує апетит, і помітно сприяє накопиченню жирів посередництвом секреції різних гормонів або дії нервової системи. Відомо, що тривале інтрацеребровентрикулярне введення ΝΡΥ викликає ожиріння і несприйнятливість до інсуліну (інсулінорезистентність), засновані на даних діях (International Journal of Obesity, vol.19: 517 (1995); Endocrinology, vol.133: 1753 (1993)). Відомо також, що ΝΡΥ володіє центральною діао на такі стани, як депресія, тривога, шизофренія, біль, недоумство і подібні (Drugs, vol.52, 371 (1996)). Крім того, на периферії NPY співіснує з норепінефрином в симпатичному закінченні і залучається до тонусу симпатичної нервової системи. Відомо, що периферичне введення NPY спричиняє звуження кровоносних судин і посилює дію інших судинозвужуючи х речовин, таких ж норепінефрин (British Journal of Pharmacology, vol.95: 419 (1988)). Повідомляється також, що NPY може брати участь в розвитку серцевої гіпертрофії в результаті симпатичної стимуляції (Proceeding National Academic Science USA, vol.97, 1595 (2000)). З іншого боку, повідомляється, що NPY залучається також до секреторної функції статевих гормонів і гормону росту, сексуальної поведінки і репродуктивну функції, шлунково-кишкову рушійну функції, бронхоконстрикцію, запалення і зловживання спиртним (Life Science, vol.55, 551 (1994); The Journal of Allergy and Immunology, vol.101, S345 (1998); Nature,vol.396, 366(1998)). NPY має різноманітні фармакологічні ефекти внаслідок скріплення NPY з NPY-рецепторами. Інші родинні NPY пептиди, включаючи пептид ΥΎ і панкреатичний поліпептид, також зв'язують NPY-рецептори. Відомо, що такі фармакологічні ефекти опосередковані дією, щонайменше, п'яти підтипів рецепторів при синергічних взаємодіях або без таких (Trends in Neuroscience, νοl.2С.294 (1997)). Υ1: Повідомляється, що центральний ефект, опосередкований NPY Y1-рецептором, включає значне збудження апетиту (Endocrinology, vol.137, 3177 (1996); Endocrinology, vol.141, 1011(2000)). Ще повідомляється, що Yl-рецептор залучається до почута тривога і болю (Nature, vol.259, 528 (1993); Brain Research, vol.859, 361 (2000)). Крім того, повідомляється також, що пресорні ефекти, опосередковані сильною судинозвужоючою дією NPY на периферії, опосередковані Y1 (FEBS Letters, vol.362, 192(1995); Nature Medicine, vol.4, 722 (1998)). Y2: Відомо, що інгібуюча дія на вивільнення різних нейротрансмітерів в симпатичних нервових закінченнях опосередкована ΝΡΥ У2-рецептором (British Journal of Pharmacology, vol.102, 41 (1991); Synapse, vol.2, 299 (198 8)). На периферії NPY спричиняє звуження кров'яних судин або сім'явиносної протоки напряму або через регуляцію вивільнення різних нейротрансмітерів (The Journal of Pharmacology and Experimental Therapeutics, vol.261, 863 (1992); British Journal of Pharmacology, vol.100, 190(1990)). Крім того, відоме інгібування ліполізу в жирових тканинах (Endocrinology, vol.131, 1970 (1992)). Ще повідомляється про інгібування секреції іонів в шлунково-кишковому тракті (Br.tish Journal of Pharmacology, vol.101, 247 (1990)). З іншого боку, повідомляється про інгібуючу дію на функції центральної нервової системи, такі як пам'ять і тривога (Brain Research, vol.503, 73 (1989); Peptides, vol.19, 359 (1998)). Y3: Повідомляється, що NPY Y3-рецептори розташовані, головним чином, в стовбурі мозку і в серці і мають відношення до регуляції кров'яного тиску і частоти серцевих скорочень (The Journal of Pharmacology and Experimental Therapeutics, vol.258, 633 (1991); Peptides, vol.11, 545 (1990)). Крім того, відомо, що Y3рецептор залучається до регуляції секреції катехоламінів в надниркових залозах (The Journal of Pharmacology and Experimental Therapeutics, vol.244, 468 (1988); Life Science, vol.50, PL7 (1992)). Y4: NPY ΥΦ-рецептор володіє високою спорідненістю до панкреатичного поліпептиду. Повідомляється що аналогічні фармакологічні ефекти, опосередковані Υ4-рецептором, включають інгібування секреції підшлункової залози і моторики шлунково-кишкового тракту (Gastroenterology, vol.85, 1411 (1983)). Крім того, повідомляється, що NPY посилює секрецію статевого гормону в центральній нервовій системі (Endocrinology, vol.140, 5171 (1999)). Y5: Ефект, опосередкований ΝΡΥ У5-рецептором, включає стимуляцію харчування і накопичення жиру (Nature, vol.3 82, 168 (1996); American Journal of Physiology, vol.277, R1428 (1999)). Повідомляється, що NPY У5-рецептор опосередковує також деякі ефекти CNS, такі ж припадок і епілепсія, або біль і симптоми скасування морфіну (Natural Medicine, vol.3, 761 (1997); Proceeding Academic Science USA, vol.96, 13518 (1999); The Journal of Pharmacology and Experimental Therapeutics, vol.284, 633 (1998)). Повідомляється, що на периферії Y5-рецептор залучений до діурезу і гіпоглікемічного ефекту, викликаного NPY (British Journal of Pharmacology, vol.120, 1335 (1998); Endocrinology, vol.139, 3018 (1998)). Повідомляється також, що NPY збільшує серцеву гіпертрофію внаслідок переважання симпатичної складової (Proceeding National Academic Science USA, vol.97, 1595(2000)). Ефекти NPY відбуваються (виявляються) при скріпленні NPY-рецепторів в центральній і периферичній нервових системах. Таким чином, дії NPY можна запобігти шляхом блокування скріплення NPY-рецепторів. Речовини, протидіючі скріпленню NPY з ΝΡΥ-рецепторами, можуть бути корисні для профілактики або лікування різних захворювань, пов'язаних з NPY, таких як серцево-судинні порушення (наприклад, гіпертензія, нефропатія, хвороба серця, вазоспазм), порушення центральної нервової системи (наприклад, булемія, депресія, тривога, припадок, епілепсія, недоумство, біль, алкоголізм, синдром скасування наркотику), порушення обміну речовин (наприклад, ожиріння, діабет, гормональні порушення), сексуальна і репродуктивна дисфункція, порушення шлунково-кишкової моторики, респіраторні захворювання, запалення або глаукома, і подібних (Trends in Pharmacological Sciences, 15: 153 (1994); Life Science, 55, 551 (1994), Drugs, vol.52: 371 (1996); The Journal of Allergy and Immunology, vol.101, S345 (1998); Nature, vol.396, 366 (1998); The Journal of Phatmacology and Experimental Therapeutics, vol.284, 633 (1998); Trends in Pharmacological Science, 20, 104 (1999);Proceeding National Academic Science USA, vol.97,1595 (2000)). Згідно з дослідженнями авторів даного винаходу недавно було виявлено, що деякі типи антагоністів NPYрецепторів корисні для профілактики або лікування гіперхолестеринемії, гіперліпідемії і артеріосклерозу [публікація міжнародної заявки W099/27965]. Метою даного винаходу є надання нових лікарських засобів, які демонструють NPY-антагоністичну активність. Заявники даного винаходу виявили, що сполуки загальної формули (I): де Аr 1 представляє арил або гетероарил, який може бути заміщений, причому заступник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений оксогрупою, і групу, представлену формулою -Q-Ar2 ; де Аr 2 представляє арил або гетероарил, який може бути заміщений, причому заступник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил; n дорівнює 0 або 1; Q представляє простий зв'язок або карбоніл; Т, U, V і W незалежно представляють атом азоту або метинову гр уп у, яка може мати заступник, вибраний з групи, що складається з галогену нижчого алкілу, гідроксилу і нижчої алкоксигрупи, причому, щонайменше, два з них (Т, U, W і V) представляють вказану метанову груп у; X представляє метинову груп у або азот; Υ представляє іміногрупу, яка може бути заміщена нижчим алкілом, або кисень; демонструють NPYантагоністичну активність і корисні як терапевтичні агенти для лікування різних захворювань, пов'язаних з ΝΡΥ, що і складає даний винахід. Сполуки (І) даного винаходу корисні як агенти для лікування різних захворювань, пов'язаних з ΝΡΥ, наприклад, серцево-судинних порушень (наприклад, гіпертензії, нефропатії, хвороби серця, вазоспазму, артеріосклерозу), порушень центральної нервової системи (наприклад, булемії, депресії, тривоги, припадку, епілепсії, недоумства, болю, алкоголізму, синдрому скасування наркотику), порушень обміну речовин (наприклад, ожиріння, діабету, гормонального порушення, гіперхолестеринемії, гіперліпідемії), сексуальної і репродуктивної дисфункції, шлунково-кишкових порушень, респіраторних захворювань, запалення, глаукоми і подібних. Більш конкретно, сполуки загальної формули (І) корисні ж агенти для лікування булемії, ожиріння, діабету і подібних станів. Даний винахід стосується сполук загальної формули (І), їх солей або ефірів, способу їх одержання і застосування. В іншому варіанті даний винахід стосується проміжного продукту одержання сполуки загальної формули (І). Конкретно, він стосується сполуки, представленої загальною формулою (VI-1): де t, u, v і w незалежно представляють атом азоту або метинову гр уп у, яка може мати заступник, вибраний з групи, що складається з галогену, нижчого алкілу, нижчої алкоксигрупи і необов'язково захищеного гідроксилу, причому, щонайменше, два з них (t, u, v і w) представляють вказану метинову груп у. Далі визначені значення використаних в даному описі термінів і представлено більш докладний опис даного винаходу. Термін «атом галогену» відноситься до атома фтору, а тома хлору, а тома брому і атома йоду. Термін «нижчий алкіл» відноситься до лінійної або розгалуженої алкільної групи С 1-С6, такої як, метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил, ізопентил, гексил, ізогексил і подібні. Термін «галоген(нижчий)алкіл» відноситься до вказаного вище нижчого алкілу, заміщеному 1, 2 або більше за 2, переважно 1-3 вказаними вище атомами галогенів, однаковими або різними в довільних положеннях, що піддаються заміщенню, такому як, фторметил, дифторметил, трифторметил, 2-фторетил, 1,2дифторетил, хлорметил, 2-хлоретил, 1,2-дихлоретил, бромметил, йодметил і подібні. Термін «гідрокси(нижчий)алкіл» відноситься до вказаного вище нижчого алкілу, заміщеному 1, 2 або більше за 2 гідроксигрупами, переважно 1 або 2 в довільних положеннях, що піддаються заміщенню, такому як гідроксиметил, 2-гідроксіетил, 1-гідрокси-1-метилетил, 1,2-дигідроксіетил, 3-гідроксипропіл і подібні. Термін «цикло(нижчий)алкіл» відноситься до циклоалкільної групи С 3-С6, такої як циклопропіл, циклобутил, циклопентил, циклогексил і подібні. Термін «нижчий алкеніл» відноситься до лінійної або розгалуженої алкенільної групи С 2-С6, такій як вініл, 1-пропеніл, 2-пропеніл5 ізопропеніл, 3-бутеніл, 2-бутеніл, 1-бутеніл, 1-метил-2-пропеніл, 1-метил-1-пропеніл, 1етил-1-етеніл, 2-метил-2-пропеніл, 2-метил-1-пропеніл, 3-метил-2-бутеніл, 4-пентеніл і подібні. Термін «нижчий алкокси» відноситься до лінійної або розгалуженої алкоксигрупи С 1-С6, наприклад, метокси, етокси, пропокси, ізопропокси, бутокси, втор-бутокси, ізобутокси, трет-бутокси, пентилокси, ізопентилокси, гексилокси, ізогексилокси і подібним. Термін «галоген(нижчий)алкокси» відноситься до вказаної вище нижчої алкоксигрупи, заміщеної 1, 2 або більше за 2 атомами галогенів з вказаних вище , переважно 1-3, однаковими або різними в довільних положеннях, що піддаються заміщенню, наприклад, фторметокси, дифторметокси, трифторметокси, 2фторетокси, 1,2-дифторетокси, хлорметокси, 2-хлоретокси, 1,2-дихлоретокси, бррмметокси, йодметокси і подібним. Термін «нижчий алкілтіо» відноситься до лінійної або розгалуженої аякілтіогрупи С 1-С6, наприклад, метлтіо, етилтіо, пропілтіо, ізопропілтіо, бутилтіо, втор-бутилтіо, ізобутилтіо, трет-бутилтіо, пентилтіо, ізопентилтіо, гексилтіо, ізогексидтіо і подібним. Термін «нижчий алканоїл» відноситься до алканоїльної групи, що містить вказаний вище нижчий алкіл, тобто алканоїльній групі С 2-С7, такій як ацетил, пропіоніл, бутирил, ізобутирил, валерил, ізовалерил, пивалоїл і подібні. Термін «нижчий алкоксикарбоніл» відноситься до алкокси-карбонільної групи, що містить вказаний вище низший алкокси, тобто алкоксикарбонільній групі С 2-С7, такий як метокси-карбоніл, етоксикарбоніл, пропоксикарбоніл, ізопропокси-карбоніл, бутоксикарбоніл, ізобутоксикарбоніл, трет-бутокси-карбоніл, пентилоксикарбоніл і подібні. Вираз «нижчий алкілен, необов'язково заміщений оксогрупою» відноситься до лінійної або розгалуженої алкіленової групи С 2-С6, яка може бути заміщена в довільних положеннях, що піддаються заміщенню, 1,2 або більше за 2, переважно 1 оксогрупою, такий як етилен, триметилен, тетраметилен, пентаметилен, гексаметилен, 1-оксоетилен, 1-оксотриметилен, 2-оксотриметилен, 1-оксотетраметилен, 2-оксотетраметилен і подібні. Термін «арил» включає феніл, нафтил і подібні. Термін «гетероарил» відноситься до 5-або 6-членної моноциклічної гетероароматичної групи, яка містить 1, 2 або більше за 2, переважно 1-3 гетероатоми, однакових або різних, вибраних з групи, що складається з атома кисню, атома азоту і атома сірки; або конденсованої гідроароматичної групі, де вказана вище моноциклічна гетероароматична група конденсована з вказаною вище арильною групою або з ідентичною або відмінною вказаною вище моноциклічною гетероароматичною групою, такою як піроліл, фурил, тієніл5 імідазоліл, піразоліл, тіазоліл, ізотіазоліл, оксазоліл, ізоксазоліл, 1,2,3-триазоліл, 1,2,4-триазоліл, тетразоліл, оксадіазоліл, 1,2,3-тиадіазоліл, 1,2,4-тіадіазоліл, 1,3,4-тіадіазоліл, піридил, піразиніл, піримідиніл, піридазиніл, 1,2,4-триазиніл, 1,3,5-триазиніл, індоліл, бензофураніл, бензотієніл, бензімідазоліл, бензоксазоліл, бензізоксазоліл, бензотіазоліл, бензізотіазоліл, індазоліл, пуриніл, хіноліл, ізохіноліл, фталазил, нафтилідиніл, хіноксалініл, хіназолініл, циннолініл, птеридиніл, піридо[3,2-b]піридил і подібні. Термін «нижчий алкіламіно» відноситься до аміногрупи, монозаміщеної вказаним вище нижчим алкілом, такий ж метиламіно, етиламіно, пропіламіно, ізопропіламіно, бутиламіно, втор-бутиламіно, третбутиламіногрупою і подібними. Термін «ди(нижчий алкіл)аміно» відноситься до аміногрупи, дизаміщеної вказаними вище однаковими або різними нижчими алкілами, такими як диметиламіно, діетиламіно, етилметиламіно, дипропіламіно, метилпропіламіно, діізопропіламіногрупою і подібними. Солі сполук формули (І) відносяться до фармацевтично прийнятних звичайних солей, наприклад, основно-адитивним солям по карбоксильній групі, якщо сполука має карбоксильну груп у, або кислотноадитивним солям по аміногрупі або основному гетероциклічному радикалу, якщо сполука має аміногрупу або основну гетероциклічну гр упу, і подібним. Вказані вище основно-адитивні солі включають солі з лужними металами (наприклад, натрієм, калієм); лужноземельними металами (наприклад, кальцієм, магнієм); аміаком або органічними амінами (наприклад, триметиламіном, триетиламіном, дициклогексиламіном, етаноламіном, діетаноламіном, триетаноламіном, прокатом, Ν,Ν'-дибензилетилендіаміном) і подібні. Вказані вище кислотно-адитивні солі включають солі з неорганічними кислотами (наприклад, соляною, сірчаною, азотною, фосфорною, перхлорною); органічними кислотами (наприклад, малеїновою, фумаровою, винною, лимонною, аскорбіновою, трифтороцтовою); сульфоновими кислотами (наприклад, метансульфоновою, ізотіоновою, бензолсульфоновою, пара-толуолсульфоновою) і подібні. Складні ефіри сполук формули (І) представляють, наприклад, фармацевтично прийнятні звичайні складні ефіри по карбоксильній групі, якщо сполука має карбоксильну груп у, наприклад, складні ефіри з нижчими алкілами (наприклад, метилом, етилом, пропілом, ізопропілом, бутилом, втор-бутилом, трет-бутилом, пентилом, ізопентилом, неопентилом, циклопропілом, циклобутилом, циклопентилом), аралкілами (наприклад, бензилом, фенетилом), нижчими алкенілами (наприклад, алілом, 2-бутенілом), нижчий алкокси(нижчими)алкілами (наприклад, метоксиметилом, 2-метоксіетилом, 2-етоксіетилом), нижчий алканоїлокси(нижчими)алкілами (наприклад, ацетокси-метилом, півалоїлоксиметилом, 1-півалоїлоксіетилом), нижчий алкоксикарбоніл(нижчими)алкілами (наприклад, метоксикарбоніл-метилом, ізопропоксикарбонілметилом), карбокси(нижчими)алкілами (наприклад, карбоксиметилом), нижчий алкоксикарбонілокси-(нижчими)алкілами (наприклад, 1-(етоксикарбонілскси)етилом, 1(циклогексилоксикарбонілокси) етилом), карбамоїлокси (нижчими)-алкілами (наприклад, карбамоїлоксиметилом), фталідилом, (5-заміщеним-2-оксо-1,3-діоксол-4-іл)метилом (наприклад, (5-метил-2оксо-1,3-діоксол-4-іл)метилом) і подібні. Вираз «агент для лікування» відноситься до лікарського засобу, який застосовують для лікування і/або профілактики різних захворювань. Для більш докладного розкриття вказаних вище сполук загальної формули (І) в переважних варіантах більш детально пояснені позначення, що використовуються в формулі (І). Аr1 представляє арил або гетероарил, який може бути заміщений, причому заступник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений оксогрупою, і групу, представлену формулою-Q-Ar2. Вираз «арил або гетероарил, який може бути заміщений, причому заступник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений оксогрупой, і груп у, представлену формулою-Q-Ar2» відноситься до вказаному вище незаміщеному арилу або гетероарилу або вказаному вище арилу або гетероарилу, який має заступник (заступники) в довільному положенні (положеннях), що піддається заміщенню. Вказані вище заступники можуть бути однаковими або різними, один, два або більше за 2, переважно 1 або 2, вибраними з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, цикло(нижчий)-алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий, алкілтіо, карбоксил, нижчий алканоїл, нижчий алкоксикарбоніл, нижчий алкілен, необов'язково заміщений оксогруплой, і групу формули: -Q-Ar 2. Атом галогену як вказаний вище заступник переважно включає атом фтору, атом хлор у і подібні. Нижчий алкіл як вказаний вище заступник переважно включає метил, етил, пропіл, ізопропіл і подібні. Галоген(нижчий)алкіл як вказаний вище заступник переважно включає дифторметил, трифторметил і подібні. Гідрокси(нижчий)алкіл як вказаний вище заступник переважно включає гідроксиметил, 2-гідроксіетил, 1гідрокси-1-метилетил і подібні. Цикло(нижчий)алкіл як вказаний вище заступник переважно включає циклопропіл, циклобутил і подібні. Нижчий алкеніл як вказаний вище заступник переважно включає вініл, 1-пропеніл, 2-метил-1-пропеніл і подібні. Нижчий алкокси як вказаний вище заступник переважно включає метокси-, етоксигрупу і подібні. Галоген(нижчий)алкокси як вказаний вище заступник переважно включає фторметокси-, дифторметокси-, трифторметоксигрупу і подібні. Нижчий алкілтіо як вказаний вище заступник переважно включає метилтіо-, етилтіогрупу і подібні. Нижчий алканоїл як вказаний вище заступник переважно включає ацетил, пропіоніл і подібні. Нижчий алкоксикарбоніл як вказаний вище заступник переважно включає метоксикарбоніл, етоксикарбоніл і подібні. Нижчий алкілен, необов'язково заміщений оксогрупою, як вказаний вище заступник переважно включає 1оксотетраметилен і подібні. В групі формули-Q-Ar 2 як вказаний вище заступник Ar2 відноситься до арилу або гетероарилу, який може бути заміщений, причому заступник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил;) Q-представляє простий зв'язок або карбоніл. Вираз «арил або гетероарил, який може бути заміщений, причому заступник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси (нижчий) алкіл, гідроксил, нижчий алкокси, галоген-нижчий) алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил» відноситься до вказаному вище незаміщеному арилу або гетероарилу або вказаному вище арилу або гетероарилу, який має заступник(заступники) в довільному положенні, що піддається заміщенню (положеннях). Вказані вище заступники можуть бути однаковими або різними, один або не менше за 2, переважне 1 або 2, вибраними з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкіламіно, ди(нижчий алкіл)аміно, нижчий алканоїл і арил. Атом галогену як вказаний вище заступник переважно включає атом фтору, атом хлор у і подібні. Нижчий алкіл як вказаний вище заступник переважно включає метил, етил, пропіл, ізопропіл і подібні. Галоген(нижчий)алкіл як вказаний вище заступник переважно включає дифторметил, трифторметил і подібні. Гідрокси(нижчий)алкіл як вказаний вище заступник переважно включає гідроксиметил, 2-гідроксіетил, 1гідрокси-1-метилетил і подібні. Нижчий алкокси як вказаний вище заступник переважно включає метокси-, етоксигрупу і подібні. Галоген(нижчий)алкокси як вказаний вище заступник переважно включає фторметокси-, дифторметокси-, трифторметоксигрупу і подібні. Нижчий алкіламіно як вказаний вище заступник переважно включає метиламіно-, етиламіногрупу і подібні. Ди(нижчий алкіл)аміно як вказаний вище заступник переважно включає диметиламіно-, діетиламіногрупу і подібні. Нижчий алканоїл як вказаний вище заступник переважно включає ацетил, пропіоніл і подібні. Арил як вказаний вище заступник переважно включає феніл і подібні. Заступник (заступники) Ar2 переважно включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, гідрокси(нижчий)алкіл, гідроксил, галоген(нижчий)алкокси і подібні. Арил в Ar2 переважно включає феніл і подібні, і гетероарил включає імідазоліл, піридил, бензофураніл, хіноліл і подібні. Отже, група формули-Q-Ar 2 включає, наприклад, феніл, 2-фторфеніл, 3-фторфеніл, 4-фторфеніл, 2,3 дифгорфеніл, 2,4-дифторфеніл, 3,5-дифтор феніл, 2-хлорфеніл, 3-хлорфеніл, 4-хлорфеніл, 2-ціанфеніл, 3ціанфеніл, 4-ціанфеніл, 2-метилфеніл, 3-метилфеніл, 4-метилфеніл, 2-фтор-5-метилфеніл, 3фторметилфеніл, 2-трифторметилфеніл, 3-трифторметилфеніл, 4-трифторметилфеніл, 2-метоксифеніл, 3метоксифеніл, 4-метоксифеніл, 3-фтор-5-метоксифеніл, 3-фторметоксифеніл, 3-дифторметоксифеніл, 3-(2гідроксіетил)феніл, 3-гідроксиметил-феніл, 3-(1-гідрокси-1-метилетил)феніл, 3-гідроксифеніл, 4-гідроксифеніл, 2-імідазоліл, 1-етил-2-імідазоліл, 1,2,4-тіадіазол-5-іл, 1,3,4-тіадіазол-2-іл, 2-піридил, 3-піридил, 4-піридил, 2етил-4-піридил, 4-піримідиніл, 5-піримідиніл, 4-бензо[b]фураніл, 5-бензо[b]фураніл, 7-бензо[b]фураніл, 2хіноліл, 3-хіноліл, 4-хіноліл, 5-хіноліл, 6-хіноліл, 8-хіноліл, бензоїн, 2-піридилкарбоніл і подібні і переважно феніл, 2-фторфеніл, 3-фторфеніл, 3,5-дифгорфеніл, 3-хлорфеніл, 4-хлор феніл, 3-ціанфеніл, 3трифторметилфеніл, 3-дифторметоксифеніл, 3-(2-гідроксіетил)феніл, 3-гідроксифеніл, 4-гідроксифеніл, 1етил-2-імідазоліл, 2-піридил, 7-бензо[b]фураніл, 2-хіноліл, 3-хіноліл, бензоїл, 2-піридилкарбоніл і подібні. Заступник Аr1 переважно включає галоген, нижчий алкіл, галоген(нижчий)алкіл, нижчий алкеніл, нижчий алканоїл, нижчий алкілен, необов'язково заміщений оксогрупою, і груп у формули: -Q-Ar 2 і подібні. Арил в Аr 1 переважно включає феніл і подібні, гетероарил в Аr 1 включає піроліл, імідазоліл, піразоліл, тіазоліл, оксазоліл, ізоксазоліл, 1,2,3-триазоліл, 1,2,4-тіадіазоліл, піридил, піразиніл, піримідиніл, 1,2,4триазиніл, бензоксазоліл, бензотіазоліл, хіноліл, піридо[3,2-b]піридил і подібні. Отже, Аr 1 включає, наприклад, 3-фторфеніл, 4-фторфеніл, 3,4-дифторфеніл, 3-хлор феніл, 4-хлорфеніл, 3,4-дихлорфеніл, 4-ацетилфеніл, 5-оксо-5,6,7,8-тетрагідро-2-нафтил, 4-ацетил-3-трифторметилфеніл, 4-(1етил-2-їмідазоліл)феніл, 3-(2-піридил)феніл, 3-(4-піридил)феніл, 4-(2-піридил)феніл, 4-(3-піридил)феніл, 4-(2етил-4-піридил)феніл, 4-(4-піримідиніл)-феніл, 4-бензоїлфеніл, 4-(2-піридилкарбоніл)феніл, 1-феніл-3-піроліл, і-феніл-4-імідазоліл, 1-(2-фторфеніл)-4-імідазоліл, 1-(3-фторфеніл)-4-імідазоліл, 1-(4-фторфеніл)-4-імідазоліл, 1-(2,3-дифторфеніл)-4-імідазоліл, 1-(2,4-дифторфеніл)-4-імідазоліл, 1-(3,5-дифторфеніл)-4-імідазоліл, 1-(3хлорфеніл)-4-імідазоліл, 1-(2-ціанофеніл)-4-імідазоліл, 1-(3-ціанофеніл)-4-імідазоліл, 1-(4-ціанофеніл) 4імідазоліл, 1-(3-трифторметилфеніл)-4-імідазоліл, 1-[3-(2-гідроксіетил)феніл]4-імідазоліл, 1-[3-(1-гідрокси-1метилетал)феніл]-4-імідазоліл, 1-(3-метоксифеніл)-4-імідазоліл, 1-(2-дифторметоксифеніл)-4-імідазоліл, 1-(3дифторметоксифеніл)4-імідазоліл, 1-(4-дифторметоксифеніл)-4-імідазоліл, 1-(2-піридил)-4-імідазоліл, 1-(4бензо[b]фураніл)-4-імідазоліл, 1-(5-бензо[b]фураніл)-4-імідазоліл, 1-(7-бензо[b]фураніл)-4-імідазоліл, 1-(2хіноліл)-4-імідазоліл, 1-(3-хіноліл)-4-імідазоліл, 1-(4-хіноліл)-4-імідазоліл, 1-(5-хіноліл)4-імідазоліл, 1-(6хіноліл)-4-імідазоліл, 1-(8-хіноліл)4-імідазоліл, 1-феніл-3-піразоліл, 5-феніл-3-піразоліл, 1-феніл-4-піразоліл, 1(2-фторфеніл)-3-піразоліл, 5-(2-фторфеніл)-3-піразоліл, 5-(3-фторфеніл)-3-піразоліл, 1-(3-фторфеніл)-4піразоліл, 1-(4-фторфеніл)-3-піразоліл, 5-(4-фторфеніл)-3-піразоліл, 5-(2-хлорфеніл)-3-піразоліл, 5-(3хлорфеніл)-3-піразоліл, 5-(4-хлорфеніл)-3-піразоліл, 5-(2-дифторметоксифеніл)-3-піразоліл, 5-(3дифторметоксифеніл)-3-піразоліл, 2-метил-5-феніл-3-піразоліл, 5-(2-піридил)-3-піразоліл, 5-(2-хіноліл)-3піразоліл, 5-(3-хіноліл)-3-піразоліл, 4-феніл-2-тіазоліл, 5-феніл-2-тіазоліл, 5-(3-хлорфеніл)-2-тіазоліл, 5-(4хлорфеніл)-2-тіазоліл, 5-(4-метоксифеніл)-2-тіазоліл, 5-(2-піридил)-2-тіазоліл, 2-феніл-4-тіазоліл, 4-феніл-2оксазоліл, 5-феніл-2-оксазоліл, 4-(2-фторметоксифеніл)-2-оксазоліл, 4-(3-фторметоксифеніл)-2-оксазоліл, 5феніл-3-ізоксазоліл, 3-феніл-5-ізоксазоліл, 3-(2-хлорфеніл)-5-ізоксазоліл, 3-(3-хлорфеніл)-5-ізоксазоліл, 3-(4хлорфеніл)-5-ізоксазоліл, 3-(2-піридил)-5-ізоксазоліл, 2-феніл-1, 2, 3-триазол-4-іл, 5-феніл-1, 2, 4-тіадіазол-3іл, 5-феніл-1,3,4-тіадіазол-2-іл, 5-(3-хлорфеніл)-1,3,4-тіадіазол-2-іл, 5-(2-піридил)-1,3,4-тіадіазол-2-іл, 5-(2етил-4-піридил)-1,3,4-тіадіазол-2-іл, 5-феніл-2-піридил, 6-феніл-3-піридил, 2-феніл-4-піридил, 5-(2-піридил)-2піридил, 5-бензоїл-2-пірвдил, 6-бензоїл-3-піридил, 5-хлор-2-піразиніл, 5-(2-метил-1-пропеніл)-2-піразиніл, 5ацетил-2-піразиніл, 5-пропіоніл-2-піразиніл, 5-феніл-2-піразиніл, 5-(3-гідроксифеніл)-2-піразиніл, 5-(4гідроксифеніл)-2-піразиніл, 5-(1,2,4-тіадіазол-5-іл-2-піразиніл, 5-(1,3,4-тіадіазол-2-іл)-2-піразиніл, 5-(2-піридил)2-піразиніл, 5-(3-піридил)-2-піразиніл, 5-(5-піримідиніл)-2-піразиніл, 5-(3-хіноліл)-2-піразиніл, 5-бензоїл-2піразиніл, 5-(2-піридилкарбоніл)-2-піразиніл, 5-ацетил-2-піримідиинл, 5-ацетил-3-метил-2-піримідиніл, 4-феніл2-піримідиніл, 5-феніл-2-піримідиніл, 6-феніл-4-піримідиніл, 2-феніл-5-піримідиніл, 5-(2-фторфеніл)-2піримідиніл, 5-(3-фторфеніл)-2-піримідиніл, 5-(4-фторфеніл)-2-піримідиніл, 5-(2-хлорфеніл)-2-піримідиніл, 5-(3хлорфеніл)-2-піримідиніл, 5-(4-хлорфеніл)-2-піримідиніл, 5-(2-метилфеніл)-2-піримідиніл, 5-(3-метиліфеніл)-2піримідиніл, 5-(2-фторметилфенніл)-2-піримідиніл, 5-(3-фторметилфеніл)-2-піримідиніл, 5-(2трифторметилфеніл)-2-піримідиніл, 5-(3-трифторметилфеніл)-2-піримідиніл, 5-(4-трифторметилфеніл)-2піримідиніл, 5-(2-гідроксиметилфеніл)-2-піримідиніл, 5-(3-гідроксиметилфеніл)-2-піримідиніл, 5-(2гідроксифеніл)-2-піримідиніл, 5-(3-гідроксифеніл)-2-піримідиніл, 5-(2-метоксифеніл)-2-піримідиніл, 5-(3метоксифеніл)-2-піримідиніл, 5-(4-метоксифеніл)-2-піримідиніл, 5-(2-фторметоксифеніл)-2-піримідиніл, 5-(3фторметоксифеніл)-2-піримідиніл, 5-(2-фтор-5-метилфеніл)-2-піримідиніл, 5-(3-фтор-5-метоксифеніл)-2піримідиніл, 6-феніл-2-піридазиніл, 6-феніл-1,2,4-триазин-3-іл, 5-хлор-2-бензоксазоліл, 5-фтор-2бензотіазоліл, 4-метил-2-бензотіазоліл, 2-метил-5-бензотіазоліл5 4-метокси-2-бензотіазоліл, 3-хіноліл, 6хіноліл, 7-метил-2-хіноліл-2-метил-6-хіноліл, 6-хлор-2-хіноксалініл, піридо[3,2-b]піридин-2-іл, 7-хлорпіридо[3,2b]-піридин-2-іл, 7-метилпіридо[3,2-b]піридин-2-іл, 7-трифторметил-піридо[3,2-b]піридин-2-іл, 7дифторметоксипіридо[3,2-b]піридин-2-іл, 7-ацетилпіридо[3,2-b]піридин-2-іл і подібні; переважне 3,4дихлорфеніл, 4-ацетилфеніл, 5-оксо-5,6,7,8-тетрагідро-2-нафтил, 4-ацетил-3-трифторметилфеніл, 4-(1-етил-2імідазоліл)феніл, 4-бензоілфеніл, 4-(2-піридилкарбоніл)феніл, 1-феніл-3-піроліл, 1-феніл-4-імідазоліл, 1-(2фтор феніл)-4-імідазоліл, 1-(3,5-дифторфеніл)-4-імідазоліл, 1-(3-хлорфеніл)-4-імідазоліл, 1-(3-ціанофеніл)4імідазоліл, 1-[3-(2-гідроксіетил)феніл]-4-імідазоліл, 1-(3-дифторметоксифеніл)-4-імідазоліл, 1-(7бензо[b]фураніл)-4-імідазоліл, 1-(2-хіноліл)-4-імідазоліл, 1-(3-хіноліл)-4-імідазоліл, 1-феніл-3-піразоліл, 5феніл-3-піразоліл, 1-феніл-4-піразоліл, 1-(3-фторфеніл)-4-піразоліл, 1-(4-фторфеніл)-3-піразоліл, 5-(4хлорфеніл)-3-піразоліл, 5-(3-хіноліл)-3-піразоліл, 5-феніл-2-тіазоліл, 3-феніл-5-ізоксазоліл, 5-(2-метил-1пропеніл)-2-піразиніл, 5-феніл-2-піразиніл, 5-(3-гідроксифеніл)-2-піразиніл, 5-(4-гідроксифеніл)-2-піразиніл, 5(2-піридил)-2-піразиніл, 5-бензоїл-2-піразиніл, 5-феніл-2-піримідиніл, 5-(2-фторфеніл)-2-піримідиніл, 5-(3фтор феніл)-2-піримідиніл, 5-(3-хлорфеніл)-2-піримідиніл, 5-(3-трифторметилфеніл)-2-піримідиніл, 5-хлор-2бензоксазоліл, 4-метил-2-бензотіазоліл, 7-метил-2-хіноліл, 7-трифторметилпіридо[3,2-b]піридин-2-іл і подібні; особливо переважно 1-феніл-3-піразоліл, 5-феніл-3-піразоліл, 5-феніл-2-піразиніл, 5-(3-гідроксифеніл)-2піразиніл, 5-(4-гідроксифеніл)-2-піразиніл, 5-феніл-2-гаримідиніл, 5-(2-фторфеніл)-2-піримідиніл, 5-(3фтор феніл)-2-піримідиніл, 7-трифторметилпіридо[3,2-b]піридин-2-іл і подібні. n дорівнює 0 або 1, переважне 0. Т, U, V і W незалежно представляють атом азоту або метин, який може мати заступник, вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу і нижчої алкоксигрупи, причому, щонайменше, два з них (Т, U, V і W) представляють вказаний метин. Вираз «метин, який може мати заступник, вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу і нижчої алкоксигрупи» відноситься до незаміщеного метину або метину, що має заступник, який може бути вибраний з групи, що складається з галогену, нижчого алкілу, гідроксилу і нижчої алкоксигрупи. Атом галогену як вказаний вище заступник переважно включає атом фтору, атом хлор у і подібні. Нижчий алкіл як вказаний вище заступник переважно включає метил, етил і подібні. Нижчий алкокси як вказаний вище заступник переважно включає метокси-, етоксигрупу і подібні. Вказаний вище заступник переважно включає галоген і подібні. Переважний варіант Т, U, V і W включає, наприклад, Т, U, V і W, які незалежно представляють метин, необов'язково такий, що має вказаний вище заступник, переважно галоген; або варіант, коли один з Т. U, V і W є атомом азоту. X представляє метин або аз от. Υ представляє іміногрупу, яка може бути заміщена нижчим алкілом, або кисень. Вираз «іміногрупла, яка може бути заміщена нижчим алкілом» відноситься до незаміщеної іміногрупи або іміногрупи, заміщеної нижчим алкілом. Вказаний вище нижчий алкіл переважно включає метил, етил і подібні. Υ переважно є незаміщеною іміногрупою або киснем, особливо, киснем. Більш конкретно, група формули (15): включає групи формул (16): і подібні. Переважними сполуками загальної формули (І) є, наприклад, сполуки загальної формули (I-а): де R1 означає атом водню або галоген, Аr1 має значення, вказане вище; або сполуки загальної формули (І-b): де Аr1 1, Т, U, V і W мають вказані вище значення. Що стосується сполуки, представленої загальною формулою (I-а), переважні, наприклад, сполуки, в яких арильна група в Аr1 є фенілом, або гетероарильна група в Аr1 є імідазолілом, піразолілом, ізоксазолілом, 1,2,4-тіадіазолілом, піразинілом, піримідинілом, хінолілом або піридо[3,2-b]піридилом. Що стосується сполуки, представленої загальною формулою (І-b), переважні, наприклад, сполуки, в яких арильна група в Аr 1 є фенілом, або гетероарильна група в Аr1 є піролілом, імідазолілом, піразолілом, тіазолілом, оксазолілом, ізоксазолілом, 1,2,3-триазолілом, 1,2,4-тіадіазолілом, шридилом, піразинілом, піримідинілом або 1,2,4-триазолілом. Крім того, що стосується сполуки, представленої загальною формулою (І-b), переважні, наприклад, сполуки, в яких Т, U, V і W являють собою атом азоту, і більш переважні, наприклад, сполуки, в яких V являє собою атом азоту, а Т, U і W являють собою незаміщену метанову гр упу. Сполуки даного винаходу можуть включати стереоізомери, такі як оптичні ізомери, діастереоізомери і геометричні ізомери або таутомери в залежності від варіанту заступників. Сполуки даного винаходу включають всі стереоізомери, таутомери і їх суміші. Наприклад, сполуки загальної формули (I-b) включають стереоізомери, такі як транс-форма сполуки загальної формули (І-1b): і цис-форма сполуки загальної формули (І-2b): причому переважна транс-форма. В об'єм даного винаходу включені також поліморфи, гідрати і сольвати сполук даного винаходу. Даний винахід включає в свій об'єм проліки сполук даного винаходу. Взагалі, такі проліки є функціональними похідними сполук даного винаходу, які легко перетворюються in vivo в необхідні сполуки. Таким чином, в способах лікування даного винаходу Вираз «прийом» має на увазі лікування різних станів, описане із застосуванням конкретної розкритої сполуки або сполуки, яка конкретно не розкрита, але перетворюється в описану сполуки in vi vo після введення пацієнту. Звичайні методики вибору і одержання відповідних похідних проліків описані, наприклад, в публікації "Design of Prodrugs" ed. H. Bundga,ard, Elsevier, 1985, яка включена тут у всій своїй повноті у вигляді посилання. Метаболіти даних сполук включають активні різновиди, що продукуються при введенні сполук даного винаходу в біологічні середовища. Конкретними сполуками, представленими загальною формулою (І), є, наприклад: N-(4-бензоїлфеніл)-3-оксоспіро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід, 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід, N-(7-метил-2-хіноліл)-3-оксоспіро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід, N-(4-бензоїлфеніл)-2-3-оксоспіро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід, N-(4-бензоїлфеніл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1’-карбоксамід, 3,4-дигідро-3-оксо-N-(5-феніл-2-піразиніл)спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід, 3,4-дигідро-N-(7-метил-2-хіноліл)-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1’-карбоксамід, N-(4-ацетилфеніл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1’-карбоксамід, 3,4-дигідро-3-оксо-N-[1-(2-хіноліл)-4-імідазоліл]спіро[ізохінолін-1(2Н),4’-пілеридин]-1’-карбоксамід, 3,4-дигідро-3-оксо-N-(5-оксо-5,6,7,8-тетрагідро-2-нафтил)спіро[ізохінолін-1(2Н),4'-піперидин]-1’карбоксамід, 3,4-дигідро-N-[5-(2-метил-1-пропеніл)-2-піразиніл]-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1’-карбоксамід, 3,4-дигідро-3-оксо-N-(3-феніл-5-ізоксазоліл)спіро[ізохінолін-1(2Н),4'-піперидин]-1’-карбоксамід, N-[1-(7-беязо[b]фураніл)-4-імідазоліл]-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1’-карбоксамід, N-[1-(3-дифторметоксифеніл)-4-імідазоліл]-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'карбоксамід, 3,4-дигідро-3-оксо-N-[4-(2-піридилкарбоніл)феніл]спіро[ізохінолін-1(2Н),4’-піперидин]-1’-карбоксамід, N-(3,4-дихлорфеніл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1’-карбоксамід, N-[1-(3-хлорфеніл)-4-імідазоліл]-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н), 4'-піперидин]-1’-карбоксамід, 3,4-дигідро-3-оксо-N-(5-феніл-2-тіазоліл)спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід, 3,4-дигідро-3-оксо-N-[5-(2-піридил)-2-піразиніл]спіро[ізохінолін-1(2Н), 4’-піперидин]-1’-карбоксамід, 3,4-дигідро-N-(4-метил-2-бензотіазоліл)-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1’-карбоксамід, N-(5-хлор-2-бензоксазоліл)-3,4-дигідро-3-оксоспіро[ізохіноліН-1(2Н),4’-піперидин]-1’-карбоксамід, N-(4-бензоїлфеніл)-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід, 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід, N-(7-метил-2-хіноліл)-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід, 3-оксо-N-(3-феніл-5-ізоксазоліл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід, 3-оксо-N-(7-трифторметилпіридо[3,2-b]піридин-2-іл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’карбоксамід, 3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 3-оксо-N-[1-(3-хіноліл)-4-імідазоліл]спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 3-оксо-N-(5-феніл-3-піразоліл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, N-[5-(4-хлорфеніл)-3-піразоліл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 3-оксо-N-[5-(3-хіноліл)-3-піразоліл]спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, N-[5-(3-фторфеніл)-2-піримідиніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 3-оксо-N-[5-(3-трифторметилфеніл)-2-піримідиніл]спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, N-[5-(3-хлорфеніл)-2-піримідиніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, N-(7-дифторметоксипіридо[3,2-b]піридин-2-іл)-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1’карбоксамід, 3-оксо-N-(5-феніл-1,2,4-тіадіазол-3-іл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід, N-{1-[3-(2-гідроксіетил)феніл]-4-імідазоліл}-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, N-[4-(1-етил-2-імідазоліл)феніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, N-[1-(3-метоксифеніл)-4-імідазоліл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 6-фтор-3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 6-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 5-фтор-3-оксо-N-(3-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 5-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід, N-(4-бензоїлфеніл)-3,4-дигідро-3-оксоспіро[1Н-2-бензопіран-1,4'-піперидин]-1'-карбоксамід, 3,4-дигідро-3-оксо-N-(5-феніл-2-піразиніл)спіро[1Н-2-бензопіран-1,4'-піперидин]-1’-карбоксамід, N-(5-бензоїл-2-піразиніл)-3,4-дигідро-3-оксоспіро[1Н-2-бензопіран-1,4'-піперидин]-1’-карбоксамід, транс-N-(4-бензоїлфеніл)-3'-оксоспіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід, транс-3'-оксо-N-(5-феніл-2-піразиніл)спіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід, транс-3'-оксо-N-(1-феніл-4-імідазоліл)спіро[циклогексан-1,1’(3'Н)-ізобензофуран]-4-карбоксамід, транс-3'-оксо-N-(5-феніл-2-піримідиніл)спіро[циклогексан-1,1’(3'Н)-ізобензофуран]-4-карбоксамід, транс-N-[1-(3,5-дифторфеніл)-4-імідазоліл]-3'-оксоспіро[циклог’ексан-1,1’(3'Н)-ізобензофуран]-4карбоксамід, транс-3'-оксо-N-(5-феніл-3-піразоліл)спіро[циклогексан-1,1’(3'Н)-ізобензофуран]-4-карбоксамід, транс-N-[1-(2-фторфеніл)-4-імідазоліл]-3'-оксоспіро[циклогексан-1,1’(3'Н)-ізобензофуран]-4-карбоксамід, транс-N-(4-ацетил-3-трифторметилфеніл)-3'-оксоспіро[циклогексан-1,1’(3'Н)-ізобензофуран]-4карбоксамід, транс-3'-оксо-N-[1-(3-хіноліл)-4-імідазоліл]спіро[циклогексан-1,1’(3'Н)-ізобензофуран]-4-карбоксамід, транс-N-[1-(3-ціанофеніл)-4-імідазоліл]-3'-оксостро[циклогексан-1,1’(3'Н)-ізобензофуран]-4-карбоксамід, транс-N-(4-бензоїлфеніл)-3-оксоспіро[4-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-3-оксо-N-(5-феніл-2-піразиніл)спіро[4-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-3-оксо-N-(3-феніл-5-ізоксазоліл)спіро[4-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-3-оксо-N-(5-феніл-2-піримідиніл)спіро[4-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-N-(4-бензоїлфеніл)-3-оксоспіро[5-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-N-(4-бензоїлфеніл)-3-оксоспіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, N-[5-(4-гідроксифеніл)-2-піразиніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід, N-[5-(3-гідроксифеніл)-2-піразиніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 4-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 7-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, 6-етил-3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід, 6-гідрокси-3-оксо-N-(5-феніл-2-тразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, транс-3-оксо-N-(5-феніл-2-піримідиніл)спіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід, транс-N-[5-(3-фторфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-N-[5-(2-фторфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-3-оксо-N-(4-феніл-2-оксазоліл)спіро[5-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-N-[5-(2-метилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4’карбоксамід, транс-N-[5-(3-метилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-N-[5-(3-трифторметоксифеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]4'-карбоксамід, транс-N-[5-(3-трифторметилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'карбоксамід, транс-N-[5-(3-фтор-5-метоксифеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]4'-карбоксамід, транс-N-[5-(2-фтор-5-метилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4’карбоксамід, транс-N-[4-(3-фторметоксифеніл)-2-оксазоліл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-N-[5-(3-гідроксиметилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобеюофуран-1(3Н),1'-циклогексан]-4'карбоксамід, транс-N-[5-(3-гідроксифеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1'-циклогексан]-4'карбоксамід, транс-3-оксо-N-(5-феніл-2-піримідиніл)спіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-N-[5-(3-фторметилфеніл)-2-піримідиніл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'карбоксамід, транс-N-[5-(3-фторметоксифеніл)-2-піримідиніл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'карбоксамід, транс-3-оксо-N-(6-фетл-1,2,4-триазин-3-іл)спіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-N-[5-(2-дифторметоксифеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'карбоксамід, транс-N-[5-(3-дифторметоксифеніл)-3-піразоліл]-3-океоспіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-N-[5-(3-фторфеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-N-[5-(4-фторфеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-N-(4-бензоїлфеніл)-3-оксоспіро[7-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-N-[1-(3,5-дифторфеніл)-4-імідазоліл]-3-оксоспіро[7-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-3-оксо-N-(2-феніл-4-піридил)спіро[7-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-3-оксо-N-(1-феніл-4-піразоліл)спіро[7-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-3-оксо-N-(1-феніл-3-піроліл)спіро[7-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-N-[1-(4-фторфеніл)-3-піразоліл]-3-оксоспіро[7-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-3-oкco-N-(1-феніл-3-піразоліл)спіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід, транс-3-оксо-N-(1-феніл-4-піразоліл)спіро[4-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-N-[1-(3-фторфеніл)-4-піразоліл]-3-оксоспіро[4-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-3-оксо-N-(1-феніл-3-піразоліл)спіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-N-[1-(4-фторфеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'карбоксамід, транс-N-[1-(2-фторфеніл)-3-піразоліл]-3-оксоспіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-3-оксо-N-(5-феніл-1,2,4-тіадіазол-3-іл)спіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-3-оксо-N-(5-феніл-3-ізоксазоліл)спіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-3-оксо-N-(6-феніл-3-піридил)спіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-3-оксо-N-(2-феніл-3-тіазоліл)спіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, або транс-3-оксо-N-(2-феніл-1,2,3-триазол-4-іл)спіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід. Серед даних сполук переважними є, наприклад, 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід, 3-оксо-N-(7-трифторметилпіридо[3,2-b]піридин-2-іл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’карбоксамід, N-[5-(3-фторфеніл)-2-піримідиніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід, транс-3'-оксо-n-(5-феніл-2-піримідиніл)спіро[циклогексан-1,1’(3'Н)-ізобензофуран]-4-карбоксамід, транс-3'-оксо-n-[1-(3-хіноліл)-4-імідазоліл]спіро[циклогексан-1,1'(3'Н)-ізобензофуран]-4-карбоксамід, транс-3-оксо-N-(5-феніл-2-піразиніл)спіро[4-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-N-[5-(3-фторфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-N-[5-(2-фторфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-N-[1-(3,5-дифторфеніл)-4-імідазоліл]-3-оксоспіро[7-азаізобензофуран-1(3Н),1’-циклогексан]-4'карбоксамід, транс-3-оксо-N-(1-феніл-4-піразоліл)спіро[4-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід, транс-3-оксо-N-(1-феніл-3-піразоліл)спіро[6-азаізобензофуран-1(3Н),1’-циклогексан]-4'-карбоксамід або транс-3-оксо-N-(2-феніл-1,2,3-триазол-4-іл)спіро[6-азаізобензофуран-1(3Н),1'-циклогексан]-4'-карбоксамід. Далі проілюстрований спосіб одержання сполук даного винаходу. Сполуки даного винаходу (І) можна синтезувати, наприклад, використовуючи способи одержання або способи, показані в прикладах, але мається на увазі, що дані варіанти не обмежують спосіб одержання сполук (І) даного винаходу. Спосіб одержання 1 Сполуки загальної формули (ІІ): де Аr1р представляє арил або гетероарил, який може бути заміщений, причому заступник вибраний з групи, що включає галоген, нітрогрупу, нижчий алкіл, галоген(нижчий)алкіл, цикло(нижчий)алкіл, нижчий алкеніл, нижчий алкокси, галоген(нижчий)алкокси, нижчий алкілтіо, нижчий алканоїл, нижчий алкоксикарбоніл, груп у, представлену формулою -Qp-Ar2p і необов'язкове захищений нижчий алкілен, необов'язково заміщений оксогрупою, гідрокси(нижчим)алкілом або карбоксильною групою; Ar2p представляє арил або гетероарил, який може бути заміщений, причому заступник вибраний з групи, що включає галоген, ціаногрупу, нижчий алкіл, галоген(нижчий)алкіл, нижчий алкокси, галоген(нижчий)алкокси, ди(нижчий алкіл)аміно, нижчий алканоїл, арил і необов'язково захищений гідро,кси(нижчий)алкіл, гідроксил або нижчий алкіламіно; Аr3 представляє феніл, який може бути заміщений галогеном або нітрогрупою; Qp представляє простий зв'язок або необов'язкове захищений карбоніл; піддають взаємодії із з'єднанням загальної формули (III): де n, t, u, v, w і Υ мають такі ж значення, як указано вище; одержуючи сполуки загальної формули (ІV-1): де Аr1р , м., t, u, v, w і Υ мають такі ж значення, як указано вище; з необов'язковим подальшим видаленням захисної групи і одержанням сполуки загальної формули (І-1): де Аr1 , n, Τ, U, V, W і Υ мають такі ж значення, як указано вище. Даний спосіб одержання стосується способу одержання сполуки загальної формули (І), де X означає атом азоту, тобто сполуки загальної формули (1-1). Якщо реагент має аміногрупу, гідроксил, карбоксил, оксогрупу, карбоніл або подібну гр упу, яка не бере участь у взаємодії, то реакцію можна проводити після захисту аміногрупи, гідроксилу, карбоксилу, оксогрупи, карбоніла або подібної групи за допомогою амінозахисної, гідроксизахисної, карбоксизахисної, оксо-або карбонілзахисної групи з подальшим видаленням захисту і завершенням реакції. «Амінозахисна група» включає аралкіл (наприклад, бензил, пара-метоксибензил, 3,4-диметоксибензил, орто-нітробензил, пара-нітробензил, бензгідрил, тритил); нижчий алканоїл (наприклад, форміл, ацетил, пропіоніл, бутирил, півалоїл); бензоїл; арилалканоїл (наприклад, фенілацетил, феноксіацетил); нижчий алкоксикарбоніл (наприклад, метоксикарбоніл, етоксикарбоніл, пропілоксикарбоніл, трет-бутоксикарбоніл); аралкілоксикарбоніл (наприклад, бензилоксикарбоніл, пара-нітробензилоксикарбоніл, фенетилоксикарбоніл); нижчий алкілсиліл (наприклад, триметилсиліл, трет-бутилдиметилсиліл) і подібні, особливо ацетил, півалоїл, бензоїл, етоксикарбоніл, трет-бутоксикарбоніл і подібні. «Гідроксизахисна група» включає нижчий алкіл (наприклад, метил, етил, пропіл, ізопропіл, трет-бутил); нижчий алкілсиліл (наприклад, триметилсиліл, трет-бутилдиметилсиліл); нижчий алкоксиметил (наприклад, метоксиметил, 2-метоксиетоксиметил); тетрагідропіраніл; триметилсилілетоксиметил; аралкіл (наприклад, бензил, пара-метоксибензил, 2,3-диметоксибензил, орто-нітробензил, пара-нітробензил, тритил); ацил (наприклад, форміл, ацетил) і подібні, особливо, метил, метоксиметил, тетрагідропіраніл, тритил, триметилсилілетоксиметил, трет-бутилдиметилсиліл, ацетил і подібні. «Карбоксизахисна група» включає нижчий алкіл (наприклад, метил, етил, пропіл, ізопропіл, трет-бутил); нижчий галогеналкіл (наприклад, 2,2,2-трихлоретил); нижчий алкеніл (наприклад, 2-пропеніл); аралкіл (наприклад, бензил, пара-метоксибензил, пара-нітробензил, бензгідрил, тритил) і подібні, особливо, метил, етил, трет-бутил, 2-пропеніл, бензил, пара-метоксибензил, бензгідрил і подібні. «Оксо- і карбонілзахисні групи» включають ацеталь або кеталь (наприклад, етиленкеталь, триметиленкеталь, диметилкеталь) і подібні. Взаємодію між сполукою загальної формули (II) і сполукою загальної формули (III) звичайно проводять, використовуючи кількість від еквівалентного до молярного надлишку, переважно від еквівалента до 1,5моль сполуки (III) на 1моль сполуки (II). Звичайно проводять взаємодію в інертному розчиннику і як інертний розчинник переважно використовують, наприклад, метиленхлорид, хлороформ, тетрагідрофуран, диметилформамід, диметилсульфоксид, їх суміш і подібні. Вказану вище взаємодію можна проводити в присутності основи, включаючи органічні основи (наприклад, триетиламін, діізопропілетиламін, піридин, 4-диметиламінопіридин) або неорганічні основи (наприклад, гідроксид натрію, гідроксид калію) і подібні. Кількість основи, що використовується звичайно складає від еквівалентного до молярного надлишку, переважно 1-5моль основи на 1моль сполуки загальної формули (ІІ). Температура реакції звичайно складає від -30 до 200°С, переважно від 20 до 100°С. Час реакції звичайно складає від 5 хвилин до 7 днів, переважно від 30 хвилин до 24 годин. У завершення реакції сирий продукт сполуки загальної формули (IV-1) можна одержати за допомогою звичайної обробки. Одержану таким чином сполуку загальної формули (TV-1) очищають звичайним способом або не очищають, якщо потрібна подальша необов'язкова комбінація реакції по видаленню аміно-, гідрокси-, карбокси-, оксо і карбонілзахисної групи з одержанням сполуки загальної формули (I-1). Видалення захисних груп в залежності від типу вказаних вище захисних гр уп, стабільності необхідної сполуки (I-1) і т.п. можна проводити, наприклад, описаним в літературі способом [Protective Groups in Organic Synthesis, T.W.Green, John Wiley & Sons (1981)] або аналогічним способом, наприклад, сільволізом з використанням кислоти або основи, а саме, наприклад, від 0,01моль до великого надлишку кислоти, переважно трифтороцтової, мурашиної, соляної або подібної кислоти, або від еквівалента до великого надлишку основи, переважно гідроксиду калію, гідроксиду кальцію або подібного; хімічним відновленням з використанням комплексного гідриду металу або подібного; або каталітичним відновленням з використанням каталізатора: паладію на вугіллі, нікелю Ренею або подібного. Спосіб одержання 2 Сполука загальної формули (V): Ar1p-NH2 (V) де Ar1p має таке ж значення, як вказане вище; піддають взаємодії з одержанням карбонової кислоти загальної формули(VI): де n, t, u, v, w і Υ мають такі ж значення, як указано вище; або його реакційноздатним похідним, одержуючи сполуку загальної формули (IV-2): де Аr1р, n, t, u, v, w і Υ мають такі ж значення, ж вказано вище; з необов'язковим подальшим видаленням захисної групи і одержанням сполуки загальної формули (І-2): де Аr1 , n, Т, U, V, W і Υ мають такі ж значення, як указано вище. Даний спосіб одержання стосується способу одержання сполуки загальної формули (І), де X означає метин, тобто сполуки загальної формули (I-2). Взаємодія між сполукою загальної формули (V) і карбоновою кислотою загальної формули (VI) звичайно проводять, використовуючи від 0,5моль до молярного надлишку, переважно від 1моль до 1,5моль карбонової кислоти (VI) на 1моль сполуки (V). Звичайно проводять взаємодію в інертному розчиннику, і переважні приклади інертних розчинників включають метиленхлорид, хлороформ, тетрагідрофуран, диметилформамід, піридин, їх суміш і подібні. Вказану вище взаємодію переважно проводять в присутності конденсуючих агентів, наприклад, Ν,N'дициклогексилкарбодііміду, Ν,Ν'-діізопропілкарбодііміду, 1-(3-диметиламінопропіл)-3-етилкарбодііміду, 1-(3диметиламінопропіл)-3-етилкарбодіімід гідрохлориду, бензотриазол-1-ілокси-трис-(диметиламіно)фосфоній гексафторфосфату, бензотриазол-1-ілокси-трис-піролідинофосфоній гексафторфосфату, бром-трис(диметиламіно)фосфоній гексафторфосфа ту, ди фенілфосфорилазиду, 1,1’-карбонілдіімідазолу або подібних. Звичайно використовують від 1моль до молярного надлишку, переважно від 1моль до 1,5моль вказаного конденсуючого агента на 1моль сполуки (VI). Температура реакції звичайно складає від -50 до 100°С, переважно від-20 до 50°С. Час реакції звичайно складає від 30 хвилин до 7 днів, переважно від 1 до 24 годин. Сполуку формули (І-2) одержують також шляхом взаємодії сполуки загальної формули (V) з реакційноздатним похідним карбонової кислоти (VI) замість карбонової кислоти (VI). Реакційноздатні похідні карбонової кислоти загальної формули (VI) включають галогенангідриди кислот, змішані галогенангідриди кислот, активовані складні ефіри, активовані аміди і подібні. Галогенангідриди карбонової кислоти загальної формули (VI) можна одержати звичайним способом шляхом взаємодії карбонової кислоти загальної формули (VI) з агентом галогенування. Агент галогенування включає тіонілхлорид, трихлорид фосфору, пентахлорид фосфору, оксихлорид фосфору, трибромід фосфор у, оксалілхлорид, фосген і подібні. Змішані галогенангідриди карбонової кислоти загальної формули (VI) можна одержати звичайним способом шляхом взаємодії карбонової кислоти загальної формули (VI) з алкілхлоркарбонатом (наприклад, етилхлоркарбонатом); хлорангідридом аліфатичної карбонової кислоти (наприклад, півалоїлхлоридом) і подібним. Активовані ефіри карбонової кислоти загальної формули (VI) можна одержати звичайним способом шляхом взаємодії карбонової кислоти загальної формули (VI) з N-гідрокси-сполукою (наприклад, Nгідроксисукцинімідом, N-гідроксифталімідом, 1-гідроксибензо-триазолом); фенольною сполукою (наприклад, 4нітрофенолом, 2,4-динітрофенілом, 2,4,5-трихлорфенолом, пентахлорфенолом) або подібним в присутності конденсуючого агента (наприклад N,N'-дициклогексил-карбодііміду, 1-(3-диметиламінопропіл)-3етилкарбодііміду). Активовані аміди карбонової кислоти загальної формули (VI) можна одержати звичайним способом шляхом взаємодії карбонової кислоти загальної формули (VI), наприклад, з 1,1’-карбонілдіімідазолом, 1,1’карбонілбіс(2-метилімідазолом) або подібним. Взаємодія між сполукою загальної формули (V) і реакційноздатним похідним карбонової кислоти загальної формули (VI), звичайно проводять, використовуючи від 0,5моль до молярного надлишку, переважно від 1моль до 1,5моль реакційноздатного похідного карбонової кислоти (VI) на 1моль сполуки (V), Звичайно проводять взаємодію в інертному розчиннику, і переважні приклади інертних розчинників включають метиленхлорид, хлороформ, тетрагідрофуран, диметилформамід, піридин, їх суміш і подібні. Вказана взаємодія протікає за відсутності основ, але переважно проводити взаємодію в присутності основ, що сприяє спокійному протіканню реакції. Вказані вище основи включають органічні основи (наприклад, триетиламін, діізопропілетиламін, піридин, 4-диметиламінопіридин) або неорганічні основи (наприклад, гідроксид натрію, гідроксид калію, карбонат натрію, карбонат калію, гідрокарбонат натрію) і подібні. Переважно використовувати від 1моль до молярного надлишку вказаної вище основи на 1моль сполуки загальної формули (V). Якщо вказана основа являє собою рідину, то її також можна використовувати як розчинник. Температура реакції звичайно складає від -50 до 100°С, переважно від -20 до 50°С. Час реакції звичайно складає від 5 хвилин до 7 днів, переважно від 30 хвилин до 24 годин. Сполуку загальної формули (І-2) можна одержати звичайною обробкою реакційної суміші в завершення реакції після видалення захисту, якщо продукт має захисну груп у, або звичайною обробкою безпосередньо суміші, якщо захисна група відсутня. Видалення захисних груп, подальшу обробку і подібне можна проводити способом, описаним вище у способі одержання 1. Сполуки загальної формули (І-1) або (І-2) можна легко виділиш і очистити звичайними способами розділення, наприклад, екстракцією розчинником, перекристалізацією, колонковою хроматографією, тонкошаровою хроматографією і/або подібними. Дані сполуки можна звичайними способами перевести в фармацевтично прийнятні солі або складні ефіри, з іншого боку, звичайними способами можна провести перетворення солей або складних ефірів у вільні сполуки. Сполуки загальної формули (ІІ), (III), (V) або (VI) є комерційно доступними або їх одержують описаними в літературі способами [Japanese Patent Unexamined Publication №94/263737-A, Патент США № 3301857, J. Org. Chem, 40:1427 (1975). Міжнародна Патентна Заявка W095/28389 або ін.], або аналогічними способами, або способами, представленими нижче або в прикладах, необов'язково в комбінації. де L означає галоген; Аr1р і Аr 3 мають такі ж значення, що дані вище. Даний спосіб стосується способу одержання сполуки загальної формули (II). Згідно з даним способом сполуку (її) одержують, підцаючи сполуку загальної формули (V) взаємодії із сполукою загальної формули І. Взаємодію між сполукою загальної формули (V) і сполукою І звичайно проводять, використовуючи від 0,5моль до молярного надлишку, переважно від еквівалента до 1,5моль сполуки 1 на 1моль сполуки (V). Звичайно проводять взаємодію в інертному розчиннику, і переважні приклади інертних розчинників включають метиленхлорид, хлороформ, тетрагідрофуран, етиловий ефір, бензол, толуол, диметилформамід їх суміш і подібні. Переважно проводити взаємодію в присутності основ. Вказані основи включають органічні основи (наприклад, триетиламін, діізопропілетиламін, піридин, 4-диметиламінопіридин) або неорганічні основи (наприклад, гідроксид натрію, гідроксид калію, карбонат натрію, карбонат калію, гідрокарбонат натрію) і подібні. Переважно використовува ти від еквівалента до молярного надлишку вказаної основи на 1моль сполуки (V). Якщо вказана основа являє собою рідину, то її можна також використати як розчинник. Температура реакції звичайно складає від -78 до 100°С, переважно від -20 до 50°С. Час реакції звичайно складає від 5 хвилин до 7 днів, переважно від 30 хвилин до 24 годин. Сполуки формули І є комерційно доступними або їх. одержують звичайним способом, способами, описаним в прикладах, або подібними, необов'язково в комбінації. де Р1 представляє амінозахисну груп у; R10 представляє водень, нітрогрупу, нижчий алкіл або нижчий алкокси; L1, t, u, v і w мають такі ж значення, як дані вище. Даний спосіб стосується способу одержання сполук загальної формули (ІII-1). Сполуку (III-1) одержують даним способом, де сполуку загальної формули 2 піддають конденсації з дегідруванням із сполукою загальної формули 3, одержуючи, сполуку загальної формули 4, яку піддають взаємодії із сполукою загальної формули 5 в присутності основи, одержуючи сполуку загальної формули 6, і далі сполуку 6 циклізують внуїрішньомолекулярною реакцією Хека, одержуючи сполуку загальної формули 1, а потім сполуку І піддають відновленню необов'язково з подальшим видаленням амінозахисної групи Р1. Амінозахисна група Р1 включає амінозахисні групи, описані раніше в способі одержання 1. Стадію одержання сполуки 4 за допомогою конденсації з дегідруванням сполуки 2 із сполукою 3 звичайно проводять в інертному розчиннику, наприклад, бензолі, толуолі або подібному. Переважна температура реакції від кімнатної до температури кипіння розчинника, що використовується, а час реакції переважно складає від 30 хвилин до 24 годин. Стадію одержання сполуки 6 із сполуки 4 звичайно проводять в інертному розчиннику (наприклад, бензолі, толуолі, метиленхлориді, хлороформі, ацетонітрилі, днметилформаміді) в присутності основи (наприклад, триетиламіну, діізопропілетиламіну, піридину, 4-диметиламінопіридину). Температура реакції переважно складає від 0°С до температури кипіння розчинника, що використовується, а час реакції переважно складає від 30 хвилин до 24 годин. На стадії одержання сполуки 7 із сполуки 6 можна використати так звану реакцію Хека, добре відому в області органічної хімії. Вказану стадію звичайно проводять в інертному розчиннику (наприклад, бензолі, толуолі, тетрагідрофурані, ацетонітрилі, диметилформаміді, N-метилпіролідоні) в присутності паладієвого каталізатора (наприклад, ацетату паладію, хлориду паладію), фосфінового ліганду (наприклад, трифенілфосфіна, три-2фурилфосфіну), основи (наприклад, карбонату калію, триетиламіну) і необов'язково добавок (наприклад, тетраетиламоній хлориду). Переважна температура реакції від кімнатної до температури кипіння розчинника, що використовується в реакції, а час реакції переважно складає від 30 хвилин до 24 годин. Як спосіб відновлення на стадії одержання сполуки (III-1) із сполуки 7 переважне, наприклад, каталітичне відновлення. Каталітичне відновлення звичайно проводять в інертному розчиннику (наприклад, метанолі, етанолі, метиленхлориді, хлороформі, тетрагідрофурані, диметилформаміді, оцтовій кислоті) в присутності каталізатора, такого ж паладій на вугіллі при тиску водню від 1 до 50 атмосфер. Переважна температура реакції від кімнатної до температури кипіння розчинника, що використовується в реакції, а час реакції переважно складає від 30 хвилин до 24 годин. У завершення реакції, якщо продукт реакції має захисну групу, сполуку (III-1) можна одержати за допомогою видалення захисної групи. Видалення захисної групи можна провести способом, описаним вище в способі одержання 1. Дану стадію можна провести, видаляючи захисну групу сполуки 7 з подальшим відновленням отриманої сполуки. Сполуки загальної формули 2, 3 або 5 є комерційно доступними або їх можна одержати звичайним способом, способами, представленим в прикладах, або подібним ним, необов'язково в комбінації. де L1 представляє водень або галоген; Ph представляє феніл; Y1 представляє кисень або іміногрупу, заміщену нижчим алкілом або арилом; t, u, v і w мають такі ж значення, як указано вище. Даний спосіб одержання стосується способу одержання сполуки загальної формули (VT-1). Сполука, представлена загальною формулою (V-1), є новою сполукою, яка не розкрита в літературі. Дан у сполуку можна одержати, використовуючи даний спосіб одержання, а саме, сполуку загальної формули 8 піддають літуванню, взаємодії із сполукою 9 і лактонізації кислотою з подальшим декеталюванням з одержанням сполуки загальної формули 10; і 1) в сполуку 10 вводять метиленову групу, а потім проводять гідроборування, одержуючи сполуку загальної формули 11, і дану сполук у піддають окисленню, або 2) сполуку 10 відновлюють, одержуючи сполуку загальної формули 12, в яку вводять йдучу груп у, а потім піддають ціануванню, одержуючи сполуку загальної формули ІЗ, з подальшим гідролізом сполуки 13 по ціаногрупі. Літування на стадії одержання сполуки 10 із сполуки 8 звичайно проводять, дозволяючи органічному літієвому реагенту (наприклад, н-бутиллітію, літій 2,2,6,6-тетраметилпіперидиду) впливати на сполуку 8 в інертному розчиннику (наприклад, тетрагідрофурані, діетиловому ефірі). Температура реакції звичайно складає від -120 до 0°С, переважно від -100 до -50°С, а час реакції переважно складає від 1 до 4 годин. Взаємодію між отриманою сполукою літію і кетоном загальної формули 9 звичайно проводять в інертному розчиннику (наприклад, тетрагідрофурані, діетиловому ефірі). Температура реакції переважно складає від -10С°С до кімнатної температури, а час реакції переважно складає від 10 хвилин до 2 годин. Одержану сполуку можна піддати лактонізації при обробці кислотою (наприклад, соляною кислотою, сірчаною кислотою). Температура реакції переважно складає від 0°С до температури кипіння розчинника, що використовується, а час реакції переважно складає від 30 хвилин до 8 годин. Сполуку 10 можна одержати, піддаючи отриману сполуку лактонового типу декеталізації звичайним способом. Температура реакції переважно складає від 50°С до температури кипіння розчинника, що використовується, а час реакції переважно складає від 1 до 24 годин. На стадії одержання сполуки 11 із сполуки 10 можна застосовувати спосіб, що використовується для перетворення оксогрупи в гідроксиметильну груп у, який добре відомий в області органічної хімії, і дану стадію звичайно проводять при взаємодії сполуки 10, наприклад, з метилентрифеніл-фосфораном, вводячи метиленову груп у, з подальшим гідроборуванням в інертному розчиннику (наприклад, бензолі, толуолі, метиленхлориді, хлороформі, ацетонітрилі, тетрагідрофурані, диметилформаміді). На обох стадіях введення метиленової групи і гідроборування температура реакції переважно складає від 0°С до температури кипіння розчинника, що використовується, а час реакції переважно складає від 30 хвилин до 8 годин. На стадії одержання сполуки (VI-1) із сполуки 11 можна застосовувати спосіб, що використовується для окислення гідроксиметильної групи до карбоксильної групи, який добре відомий в області органічної хімії, і дану стадію звичайно проводять, використовуючи окислювальний агент, такий як періодат натрію, і каталітичну кількість хлориду рутенію в інертному розчиннику (наприклад, бензолі, толуолі, метиленхлориді, хлороформі, ацетонітрилі, диметилформаміді). Температура реакції переважно складає від 0°С до температури кипіння розчинника, що використовується, а час реакції переважно складає від 30 хвилин до 8 годин. На стадії одержання сполуки 12 із сполуки 10 можна застосовувати спосіб, що використовується для відновлення оксогрупи до гідроксильної групи, який добре відомий в області органічної хімії, і дану стадію звичайно проводять, використовуючи відновний агент (наприклад, боргідрид натрію, боргідрид літію) в інертному розчиннику (наприклад, воді, метанолі, етанолі, тетрагідрофурані або їх суміші). Температура реакції переважно складає від -20 до 50°С, а час реакції переважно складає від 10 хвилин до 4 годин. На стадії одержання сполуки 13 із сполуки 12 можна застосовувати спосіб, що використовується для перетворення гідроксигрупи в ціаногрупу, який добре відомий в області органічної хімії, і дану стадію звичайно проводять, при взаємодії сполуки .12, наприклад, з метансульфонілхлоридом, паратолуолсульфонілхлоридом або подібним з перетворенням гідроксигрупи в йдучу груп у в присутності основи (наприклад, триетиламіну, піридину) з подальшою взаємодією отриманої сполуки з ціанідом (наприклад, ціанідом натрію, ціанідом калію, тетраетиламоній ціанідом, тетрабутиламоній ціанідом). Дану стадію перетворення гідроксигрупи в йдучу гр упу звичайно проводять в інертному розчиннику (наприклад, метиленхлориді, хлороформі, етилацетаті, ацетонітрилі, тетрагідрофурані, диметилформаміді). Температура реакції переважно складає від -20°С до кімнатної температури, а час реакції переважно складає від 10 хвилин до 8 годин. Стадію взаємодії з ціанідом звичайно проводять в інертному розчиннику (наприклад, тетрагідрофурані, діоксані, диметилформаміді, N-метилпіролідоні, диметилсульфоксиді). Температура реакції переважно складає від 50 до 120°С, а час реакції переважно складає від 2 до 24 годин. На стадії одержання сполуки (VI-1) можна провести гідроліз ціаногрупи, який добре відомий в області органічної хімії, а саме гідроліз ціаногрупи сполуки Б, і дану стадію звичайно проводять, використовуючи кислоту (наприклад, соляну кислоту, сірчану кислоту) або ; основу (наприклад, гідроксид натрію, гідроксид калію, гідроксид кальцію) в розчиннику (наприклад, метанолі, етанолі, тетрагідрофурані, діоксані, воді або їх суміші). Температура реакції переважно складає від 50°С до температури кипіння розчинника, що використовується, а час реакції переважно складає від 1 до 48 годин. Сполуки загальної формули (VI-1) мають два типи стереоізомерів, представлених загальними формулами (VI-1-а) і (VI-1-b): де t, u, v і w мають такі ж значення, як указано вище. Дані стереоізомери можна виділити з суміші загальновідомим способом, таким як хроматографія, фракціонована перекристалізація і подібні. Сполуки загальної формули (VI-1-а) або (VI-1-b) можна одержати, використовуючи проміжний продукт, який одержують шляхом розділення стереоізомерів сполуки загальної формули 11, 12 або 13. Сполуки загальної формули 8 або 9 комерційно доступні або їх одержують, використовуючи звичайний спосіб, способи, описаний в прикладах або подібні способи, необов'язково в комбінації. Застосовність сполук даного винаходу як лікарських засобів забезпечена описом NPY-антагоністичної активності, наприклад, в наступних фармакологічних тестах. Фармакологічний тест 1 (дослідження інгібування NPY-скріплення) Послідовність кДНК, що кодує NPY У5-рецептор людини [публікація міжнародного патенту W096/16542], клонують у векторах експресії pcDNA3, pRc/RSV (одержаний bivitrogen Inc.) і pCI-neo (одержаний Promega Inc.). Одержані вектора експресії трансфікують в клітини-господарі COS-7, СНО і LM(tk-) (American Type Culture Collection) способом з використанням катіонних ліпідів [розроблений в National Academy of Sciences of United States of America, 84: 7413 (1987)], одержуючи клітини, експресуючі NPY Y5-penenTop. Зразки мембран, одержані з клітин, які експресують NPY У5-рецептори, інкубують разом із сполукою, що досліджується і [125І]пептидом ΥΥ (ΝΕΝ) (20000імп/хв.) в буферному розчині (25мМ Трис-буфер, рН 7,4, що містить 10мМ хлориду магнію, 1мМ фенілметилсульфонілфториду, 0,1% бацитрацину і 3,5% бичачого сироваткового альбуміну (SSA)) при 25°С протягом 2 годин, потім фільтрують через скляний фільтр GF/C і промивають 5мМ Трис-буфером (рН 7,4), що містить 0,3% BSA. Вимірюють радіоактивність осадка.на скляному фільтрі. Неспецифічне скріплення вимірюють в присутності 1мкМ пептиду YY і визначають концентрацію сполуки, що досліджується, що викликає 50% інгібування (ІС50) специфічного скріплення пептиду YY [Endocrinology, 131: 2090 (1992)]. Результати підсумовані в таблиці 1. [таблиця 1] Інгібіторні активності скріплення NPY-рецепторів Сполуки Приклад 1 Приклад 9 Приклад 23 Приклад 26 Приклад 32 Приклад 44 Приклад 50 ІС50 (н М) 1,2 0,72 1,9 2,5 0,91 1,5 0,48 Приклад 55 0,59 Як показано вище, сполуки даного винаходу е фективно інгібують скріплення пептиду YY (гомолог NPY) з NPY У5-рецепторами. Фармакологічний тест 2 (Антагоністична дія на bРР-індуковану поведінку при годуванні) Направляючу канюлю (зовнішній діаметр 0,8мм, внутрішній діаметр 0,5мм, довжина 10мМ) вводять стереотаксично в правий латеральний шлуночок головного мозку самців пацюків SD (вік 7-8 тижнів, 200-300г) під наркозом з пентобарбіталу (одне внутрішньочеревне введення 50мг/кг) і фіксують стоматологічною смолою. Верхній кінець канюлі розташовують на 0,9мм вище за брегму, на 1,2мм правіше середньої лінії і на глибину 1,5мм від поверхні головного мозку, таким чином, щоб при введенні в направляючу канюлю ін’єкційної голки вона виступала на 2мм над верхнім краєм направляючої канюлі і досягала латерального шлуночка головного мозку. Приблизно через 1 тиждень відновного періоду в латеральний шлуночок головного мозку вводять бичачий панкреатичний поліпептид (bРР, 5мкг/10мкл/голова, 0,01М, рН 7,4 фосфатний буферний фізіологічний розчин, що містить 0,05% бичачий сироватковий альбумін). Сполуку, що досліджується, суспендовану у водній 0,5% метилцелюлозі, вводять перорально за 2 години до введення bРР і визначають споживання їжі через 2 години після введення bРР. Сполуки даного винаходу істотно інгібують збільшення споживання їжі, викликане bРР (гомолог NPY), введеним в латеральний шлуночок головного мозку. Сполуки загальної формули (I) можна приймати перорально або парентерально і можна готувати у вигляді відповідного для прийому препарату, забезпечуючи агент для лікування різних захворювань, пов'язаних з NPY, які включають, наприклад, серцево-судинні порушення (наприклад, гіпертензію, нефропатію, хворобу серця, вазоспазм, артеріосклероз), порушення центральної нервової системи (наприклад, булемію, депресію, тривогу, припадок, епілепсію, недоумство, біль, алкоголізм, синдром скасування наркотику), порушення обміну речовин (наприклад, ожиріння, діабет, гормональні порушення, гіперхолестеринемію, гіперліпідемію), сексуальну і репродуктивну дисфункцію, порушення шлунково-кишкової моторики, респіраторні захворювання, запалення або глаукому і подібні, переважно булемію, ожиріння, діабет і подібні. При клінічному використанні сполуки даного винаходу можна вводити після складання відповідного препарату разом з фармацевтично прийнятними добавками у відповідності до способу прийому. Як вказані добавки можна використовувати добавки, що звичайно застосовуються в приготуванні фармацевтичних препаратів, наприклад, желатин, лактозу, сахарозу, оксид титана, крохмаль, кристалічну целюлозу, гідроксипропілметилцелюлозу, карбоксиметилцелюлозу, кукурудзяний крохмаль, мікрокристалічний віск, вазелін, метасилікат алюмінат магнію, безводний фосфат кальцію, лимонну кислоту, цитрат натрію, гідроксипропілцелюлозу, сорбіт, складний ефір сорбіту і жирної кислоти, полісорбат, складний ефір сахарози і жирної кислоти, поліоксіетилен, гідровану касторову олія, полівінілпіролідон, стеарат магнію, легкий кремнієвий ангідрид, тальк, рослинну олію, бензиловий спирт, гуміарабік, пропіленгліколь, поліалкіленгліколь, циклодекстрин або гідроксипропілциклодекстрин. Суміш з вказаними добавками можна приготувати у вигляді твердих препаратів (наприклад, таблетки, капсули, гранули, порошки, супозиторії) або рідких препаратів (наприклад, сиропи, еліксири, препарати для ін'єкцій). Такі препарати можна готувати по методиках, добре відомих в області одержання фармацевтичних препаратів. Рідкі препарати можуть бути у вигляді препаратів, які при застосуванні розчиняють або суспендують у воді або інших відповідних середовищах, і, головним чином, препарати для ін'єкцій можна розчиняти або суспендувати в фізіологічному розчині або, якщо необхідно, в розчині глюкози, необов'язково разом з буфером і консервантом. Такі препарати можуть містити від 0,1 до 100мас.%, переважно від 1,0 до 60мас.% сполук даного винаходу, а також можуть містити інші терапевтично ефективні сполуки. Сполуки даного винаходу можна використовувати в комбінації з іншими агентами, корисними для лікування порушень обміну речовин і/або харчування. Індивідуальні компоненти таких комбінацій можна приймати окремо в різний час протягом курсу терапії або разом у вигляді окремих або єдиних комбінованих форм. Таким чином, потрібно розуміти, що даний винахід включає всі подібні схеми одночасного або почергового лікування і відповідно потрібно інтерпретувати термін «прийом». Потрібно також розуміти, що область комбінацій сполук даного винаходу з іншими агентами, корисними для лікування порушень обміну речовин і/або харчування, в принципі включає будь-яку комбінацію з будь-якою фармацевтичною композицією, корисною для лікування порушень обміну речовин і/або харчування. Якщо сполуки даного винаходу використовують клінічно, дозу і частоту прийому можна варіювати в залежності від статі, віку, ваги тіла, міри симптомів і типу і діапазону необхідних терапевтичних ефектів. Денна доза для дорослого становить 0,01-100мг/кг, переважно 0,03-3мг/кг перорально, або 0,001-10мг/кг, переважно 0,001-0,1мг/кг парентерально, переважно єдиною дозою або розділивши на декілька доз. Звичайний фахівець-лікуючий лікар, ветеринар або клініцист може легко визначити і призначити ефективну кількість ліків, необхідну для профілактики, протидії або придушення розвитку хворобливого стану. Найкращий спосіб здійснення винаходу Наступні приклади приведені для більш конкретної ілюстрації даного винаходу, але жодним чином не призначені для його обмеження. Якщо не відмічено інакше, температури плавлення визначені з використанням MP-S3 Model (виробництва Yanagimoto Seisakusho) і розкриті в даному описі без коректувань. Приклад 1 Одержання N-(4-бензоїлфеніл)-3-оксоспіро[ізоіндолін-1,4'-піперидин]-1'-карбоксаміду (1) Одержання N-бензил-N-(1-трет-бутоксикарбоніл-1,2,3,6-тетрагідропіридин-4-іл)-2-йодбензаміду. Суміш N-трет-бутоксикарбоніл-4-піперидону (1,11г) і бензиламіну (597мг), розчинену в толуолі (20мл), перемішують при 100°С протягом 3 годин і потім концентрують. Додають до залишку толуол (30мл), ортойодбензоїлхлорид (1,13г) і триетиламін (0,70г) і суміш перемішують при 80°С протягом 2 годин. Реакційну суміш виливають у воду і екстрагують етилацетатом. Етилацетатний шар сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2), одержуючи вказану сполуку (2,44г). (2) Одержання 2-бензил-1’-трет-бутоксикарбоніл-1',6'-дигідроспіро[1Н-інзол-1,4'(5'Н)-піридин]-3(2Н)-ону. До N-бензил-N-(1-трет-бутоксикарбоніл-1,2,3,6-тетрагідропіридин-4-іл)-2-йодбензаміду (2,4г), розчиненому в ацетонітрилі, додають ацетат паладію (80мг), трифені л фосфін (187мг), безводний К2СО3 (987мг) і тетраетиламонійхлорид (591мг) і перемішують при 8С°С протягом 6 годин. Реакційну суміш виливають у воду і екстрагують етилацетатом. Етилацетатний шар сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2), одержуючи вказану сполуку (1,64г). (3) Одержання 2-бензил-1'-трет-бутоксикарбонілспіро[1H-ізоіндол-1,4'-піперидин]-3(2Н)-ону. До розчину 2-бензил-1'-трет-бутоксикарбоніл-1',6'-дипдросп1ро[1Н-зоіндол-1,4'(5'Н)-піридин]-3(2Н)-ону (1,0г) в хлороформі (200мл) додають трифтороцтову кислоту (20мл) і суміш перемішують 1 годину. Реакційну суміш концентрують. Залишок розчиняють в метанолі і гідрують сумішшю 4 М хлористий водень/етилацетат в присутності 20% паладію на вугіллі при тиску водню 1атм протягом 14 година. Каталізатор видаляють фільтруванням і фільтрат концентрують. До залишку додають водний 1н гідроксид натрію (5мл), ди-третбутилдикарбонат (655мг) і діоксан (10мл) і суміш перемішують при кімнатній температурі протягом 4 годин. Реакційну суміш виливають у воду і екстрагують етилацетатом. Органічний шар сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2), одержуючи вказану сполуку (200мг). (4) Одержання спіро[1Н-ізоіндол-1,4'-піперидин]-3(2Н)-он гідрохлориду. 2-Бензил-1'-трет-бутоксикарбонілспіро[1Н-ізоіндол-1,4'-піперидин]-3(2Н)-ону (200мг) додають до металевого натрію (235мг) в рідкому аміаку (10мл) і суміш перемішують 30 хвилин. До реакційної суміші додають метанол, нейтралізований насиченим водним розчином хлориду амонію і екстрагують етилацетатом. Органічний шар сушать над безводним Na2SO4 і концентрують. Залишок розчиняють в метанолі і перемішують зі сумішшю 4М хлористий водень/етилацетат при 50°С протягом 1 години. Реакційний розчин концентрують, одержуючи вказану сполуку (591мг). 1Н ЯМР (300мгц, ДМСО-d6, dм.д.): 1,70-1,90 (2Н, м), 2,00-2,20 (2Н, м), 3,00-3,20 (2Н, м), 4,20-4,40 (2Н, м), 7,40 (1Н, д, J=7,5Гц), 7,51 (1Н, т, J=7,5Гц), 7,59 (1Н, т, J=7,5Гц), 7,84 (1Н, д, J=7,5Гц). (5) Одержання феніл N-(4-бензоїлфеніл)карбамату. До 4-амінобензофенону (1, 97г), розчиненому в піридині (50мл), додають фенілхлоркарбонат (1,38г) при 0°С і суміш перемішують при кімнатній температурі 1 годину. Реакційну суміш виливають у воду і екстрагують етилацетатом. Органічний шар сушать над безводним Na2SO4 і випаровують. Залишок очищають, способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2), одержуючи вказану сполуку (3,1г). (6) Одержання N-(4-бензоїлфеніл)-3-оксоспіро[ізоіндолін-1,4'-піперидин]-1'-карбоксаміду. Суміш спіро[1Н-ізоіндол-1,4'-піперидин]-3(2Н)-он гідрохлориду (48мг), триетиламіну (0,14мл) і феніл N-(4бензоїлфеніл)карбамату (58мг) перемішують в хлороформі при 80°С протягом 2 годин. Реакційну суміш виливають у воду і екстрагують хлороформом. Органічний шар сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2) і кристалізують з суміші етиловий ефір-гексан, одержуючи вказану сполуку (49мг) у вигляді безбарвних кристалів (температура плавлення 253°С). Сполуки прикладів 2 і 3 одержують аналогічно способу прикладу 1-(6), замінюючи феніл N-(4бензоїлфеніл)карбамат, що використовується в прикладі 1-(6), на відповідні речовини. Приклад 2 3-оксо-N-(5-феніл-2-пиразиніл)стро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід Температура плавлення 286-287°С Приклад 3 N-(7-метил-2-хіноліл)-3-оксоспіро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід Температура плавлення 194-196°С Приклад 4 Одержання N-(4-бензоїлфеніл)-3-оксоспіро[ізоіндолін-1,4'-піперидин]-1'-карбоксамід. Вказану сполуку одержують аналогічно способу прикладу 1-(6), замінюючи спіро[1Н-ізоіндол-1,4’піперидин]-3(2Н)-он гідрохлорид на 2-метилспіро[1Н-ізаіндол-1,4'-піперидин]-3(2Н)-он гідрохлорид. Температура плавлення 154-156°С Приклад 5 Одержання N-(4-бензоїлфеніл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксаміду Спіро[ізохінолін-1(2Н),4'-піперидин]-3(4Н)-он гідрохлорид (30мг) і феніл N-(4-бензоілфеніл)карбамат (37мг) розчиняють в диметилсульфоксиді (2мл) і перемішують разом з водним 10н гідроксидом натрію (12мкл) при кімнатній температурі протягом 30 хвилин. Реакційну суміш виливають у воду і екстрагують етилацетатом (20мл). Органічний шар промивають водою (20мл) і насиченим сольовим розчином (20мл), потім сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/егалацетат від 4/1 до 1/2) і перекристалізовують з суміші хлороформ-ацетон (1:3), одержуючи вказану сполуку (81мг) у вигляді безбарвних кристалів (температура плавлення 241-243°С). Сполуки прикладів 6-21 одержують аналогічно способу прикладу 1-(6) або прикладу 5, використовуючи спіро[ізохінолін-1(2Н),4'-піперидин]-3(4Н)-он гідрохлорид і похідні феніл карбамату, відповідні необхідним сполукам. Приклад 6 3,4-Дигідро-3-оксо-N-(5-феніл-2-піразиніл)спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід Температура плавлення 237-239°С Приклад 7 3,4-Дигідро-N-(7-метил-2-хіноліл)-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід Температура плавлення 216-218°С Приклад 8 N-(4-ацетилфеніл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід Температура плавлення >300°С Приклад 9 3,4-Дігідро-3-оксо-N-[1-(2-хіноліл)-4-імідазоліл]спіро[ізохінолін-1(2Н)4'-піперидині-1'-карбоксамід Температура плавлення 264-266°С Приклад 10 3,4-Дигідро-3-оксо-N-(5-оксо-5,6,7,8-тетрагідро-2-нафтил)спіро[ізохінолін-1(2Н),4'-піперидин]-1'карбоксамід Температура плавлення 220,5-222,2°С Приклад 11 3,4-Дигідро-N-[5-(2-метил-1-пропеніл)-2-піразиніл]-3-оксоспіро[ізохінолін-1(2Н,4'-піперидин]-1'-карбоксамід Температура плавлення 232,9-236,5°С Приклад 12 3,4-Дигідро-3-оксо-N-(3-феніл-5-ізоксазоліл)спіро[ізохинолін-1(2Н),4'-піперидин]-1'-карбоксамід Температура плавлення 239-241°С Приклад 13 N-[1-(7-бензо[Ь]фураніл)-4-імідазоліл]-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Η),4'-піперидин]-1'-карбоксамід Температура плавлення 192-194°С Приклад 14 N-[1-(3-дифторметоксифеніл)-4-імідазоліл]-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Η),4'-піперидин]-1'карбоксамід Температура плавлення 161-163°С Приклад 15 3,4-Дигідро-3-оксо-N-[4-(2-піридилкарбоніл)феніл]спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід Температура плавлення 162-164°С Приклад 16 N-3,4-дихлорфеніл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н),4'-піпериди]-1'-карбоксамід Температура плавлення >300°С Приклад 17 N-[1-(3-хлорфеніл)-4-імідазоліл]-3,4-дигідро-3-оксостро[ізохінолін-1(2Н,4'-піперидині-1'-карбоксамід Температура плавлення 255-258°С Приклад 18 3,4-Дигідро-3-оксо-N-(5-феніл-2-тіазоліл)спіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід Температура плавлення >300°С Приклад 19 3,4-Дігідро-3-оксо-N-[5-(2-піридил)-2-піразиніл]спіро[ізохінолін-1(2Н),4'-піперидині-1'-карбоксамід Температура плавлення 223-225°С Приклад 20 3,4-Дигідро-N-(4-метил-2-бензотіазоліл)-3-оксоспіро[ізохінолін-1(2Н),4'-піперидин]-1'-карбоксамід Температура плавлення 144-146°С Приклад 21 N-(5-хлор-2-бензоксазоліл)-3,4-дигідро-3-оксоспіро[ізохінолін-1(2Н,4'-піперидин]-1'-карбоксамід Температура плавлення 256-258°С Приклад 22 Одержання N-(4-бензоїлфеніл)-3-оксоспіро[ізобензофуран-1(3Н),4’-піперидин]-1'-карбоксамід Суміш спіро[ізобензофуран-1(3Н),4'-піперидин]-3-он гідрохлориду (48мг), феділ N-(4бензоїлфеніл)карбамату (58мг) і триетиламіну (0,14мл) в хлороформі (5мл) перемішують при 80°С протягом 2 годин. Реакційну суміш виливають у воду і ексрагують хлороформом (20мл). Органічний шар промивають насиченим сольовим розчином (20мл), потім сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2) і перекристалізовують з суміші етиловий ефір-гексан, одержуючи вказану сполуку (81мг) у ви гляді безбарвних кристалів (температура плавлення 161-163°С). Приклад 23 Одержання 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3Н,4'-піперидин]-1'-карбоксамід (1) Одержання феніл-N-(5-феніл-2-піразиніл)карбамату Фенілхлоркарбонат (15,05мл) додають при 0°С до розчину 2-аміно-5-фенілпіразину (17,12г) в піридині (200мл). Суміш перемішують при кімнатній температурі 2 години. До реакційної суміші додають воду (200мл) і етиловий ефір (200мл). Все перемішують, одержуючи суспензію, що містить вказану сполуку у вигляді кристалів. Кристали збирають фільтруванням і промивають етиловим ефіром (50мл), потім сушать при зниженому тиску, одержуючи вказану сполуку (24,57г) у вигляді безбарвних кристалів (температура плавлення 192-198°С, розкладається). (2) Одержання 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензо-фуран-1(3Н),4'-піперидин]-1'-карбоксаміду (кристалічна форма А) Суміш спіро[ізобензофуран-1(,Н),4'-піперидин]-3-он гідрохлориду (6,24г, 26,6мМоль), феніл N-(5-феніл-2піразиніл)карбамату (7,59г, 26,0мМоль) і триетиламіну (18мл, 180мМоль) в хлороформі (200мл) перемішують при 80°С протягом 3 годин. Реакційну суміш промивають насиченим водним розчином бікарбонату натрію (100мл). Потім органічний шар промивають 10% водним розчином лимонної кислоти (100мл), 1н водним гідроксидом натрію (100мл) і далі насиченим сольовим розчином (100мл), органічний шар сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат=1/2), одержуючи вказану сполуку у вигляді безбарвної твердої речовини. Дану тверду речовину промивають діетиловим ефіром (30мл), одержуючи вказану сполуку (8,23г) у вигляді сирих кристалів. Кристали розчиняють в гарячому етилацетаті (300мл). Після видалення приблизно 100мл етилацетату відгонкою починає утворюватися біла суспензія. На цій точці відгонку припиняють, суміш охолоджують і зберігають при кімнатній температурі 14 годин. Безбарвні призми, що утворилися збирають фільтруванням і промивають гептаном (20мл). Одержані кристали сушать при 50°С у вакуумі протягом 6 годин, одержуючи вказану сполуку (кристалічна форма А) (5,17г) у вигляді безбарвних призм (температура плавлення 210-211°С). Рентгенівська дифракція порошку 2q (градуси) 8,160 9,600 11,680 14,620 15,320 15,620 15,880 16,080 16,420 17,940 19,100 19,600 20,280 20,860 21,300 22,020 22,740 23,460 23,820 24,420 24,880 25,840 26,360 28,480 29,260 30,860 32,140 34,300 39,160 Інтенсивність (імп/сек) 4135 2607 1372 194 1505 1321 2687 1711 3174 1036 6232 878 206 813 3360 328 1498 3782 549 1915 474 1329 515 433 248 692 246 112 163 Приведені вище дані дослідження рентгенівської дифракції порошку виміряні на RINT1100 (виробництво Rigaku International Corporation), умови аналізу наступні: Джерело рентгенівського випромінювання: Сu, напруження трубки: 40кВ, струм тр убки: 30мА, монохроматор: автоматичний монохроматор, моноприймаюча щілина: 0,60мМ, ширококутовий гоніометр: гоніометр, крок сканування: 0,02град., швидкість сканування: 2,00град/хв., відхиляюча щілина (DS): 1град., розсіююча щілина: 1град., приймаюча щілина (RS): 0,15мМ, температура температура вимірювання: навколишнього середовища (3) Одержання 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензо-фуран-1(3Н),4'-піперидин]-1'-карбоксаміду (кристалічна форма А)-альтернативний спосіб·одержання Сирі кристали (2г), одержані по описаній вище методиці (2), розчиняють при нагріванні в тетрагідрофурані (20мл). Пересвідчившись в повному розчиненні, охолоджують суміш до кімнатної температури, залишаючи стояти при кімнатній температурі. До тетрагідрофуранового розчину додають по краплі гептан (27мл) з подальшим перемішуванням при кімнатній температурі протягом 15 годин. Одержані безбарвні кристали збирають фільтруванням, промивають гептаном (5мл) і сушать в вакуумі при 30°С протягом 15 годин, одержуючи вказану ви ще сполуку в кристалічній формі А (1,82г). (4) Одержання 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензо-фуран-1(3Н),4'-піперидин]-1'-карбоксаміду (кристалічна форма В) Сирі кристали (2г), одержані по описаній вище методиці (2), розчиняють при нагріванні в диметилформаміді (6мл). Пересвідчившись в повному розчиненні, додають по краплі воду (13мл) при 80°С і отриману суміш охолоджують до кімнатної температури, з подальшим перемішуванням протягом 15 годин. Одержані безбарвні кристали збирають фільтруванням при кімнатній температурі, промивають гептаном (5мл) і сушать у вакуумі протягом 15 годин при кімнатній температурі, одержуючи 1,78г вказаної вище сполуки в кристалічній формі В у вигляді безбарвних призм (температура плавлення 208°С, виміряна без коректування при використанні Melting Point B-545, поширюваного Buchi Company). Рентгенівська дифракція порошку 2q (градуси) 7,300 9,540 13^40 14,320 14,680 15,620 15,980 16,400 19,280 19,620 19,920 20,280 20,900 23,000 24,060 24,760 25,300 25,880 26,160 26,620 26,900 27,540 28,920 31,400 31,780 33,320 38,440 39,140 39,660 Інтенсивність (імп/сек.) 211 555 619 848 2435 7792 2307 6800 781 3137 1954 2234 4008 2311 3362 3598 953 3117 632 461 426 584 312 546 247 270 357 307 103 Приведені вище дані дослідження рентгенівської дифракції порошку виміряні в таких же умовах, як в прикладі 23(2). (5) Одержання 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензо-фуран-1(3Н),4'-піперидин]-1'-карбоксаміду (кристалічна форма С) Сирі кристали (2г), одержані по описаній вище методиці (2), розчиняють при нагріванні в тетрагідрофурані (20мл). Пересвідчившись в повному розчиненні, розчин охолоджують до -30°С. До тетрагідрофуранового розчину додають по краплі гептан (30мл) з подальшим перемішуванням при -30°С протягом однієї години. Одержані безбарвні кристали збирають фільтруванням, промивають гептаном (5мл) і сушать у вакуумі при кімнатній температурі протягом 15 годин, одержуючи 1,90г вказаних вище продуктів (монотетрагідрофурановий сольват, кристалічна форма С) у вигляді безбарвних дрібних гранул. Рентгенівська дифракція порошку 2q (градуси) 5,940 7,680 11,420 13,180 14,240 14,840 15,460 16,580 16,800 17,960 18,640 20,340 Інтенсивність (імп/сек.) 1209 7150 1480 2032 1859 623 2629 2244 4076 706 2479 296 21,260 21,680 22,220 23,040 24,000 25,220 26,500 27,160 27,640 28,780 30,940 34,200 699 839 642 2515 1355 467 850 840 1078 389 283 267 Приведені вище дані дослідження рентгенівської дифракції порошку виміряні в таких же умовах, як в прикладі 23(2). (6) Одержання 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензо-фуран-1(3Н),4'-піперидин]- 1'-карбоксаміду (кристалічна форма D) Спіро[ізобензофуран-1(3Н),4'-піперидин]-3-он гідрохлорид (515мг) і феніл N-(5-феніл-2-піразиніл)карбамат (583мг) розчиняють в диметилсульфоксиді (2,6мл), а потім додають по краплі диметилбензиламін (0,33мл). Температуру отриманої суміші підвищують до 50°С і суміш перемішують протягом однієї години. Реакційну суміш охолоджують до кімнатної температури і додають по краплі змішаний розчин ацетонітрил/вода (1:2) (7,8мл). Коли додане 0,2мл змішаного розчину, додають затравковий кристал. Отриману суміш перемішують при кімнатній температурі протягом би годин. Одержані безбарвні кристали збирають фільтруванням, промивають сумішшю ацетонітрил/вода (1:1) і сушать у вакуумі при кімнатній температурі протягом 15 годин, одержуючи вказану вище сполуку (793мг) у вигляді сирих безбарвних кристалів. Сирі кристали (26г), одержані повторенням описаної вище методики, суспендують в суміші вода-насичений ізопропілацетат (143мл). У суміш вносять затравковий кристал і перемішують при кімнатній температурі протягом 18 годин. Одержані кристали збирають фільтруванням, промивають ізопропілацетатом (20мл) і сушать у вакуумі при 30°С протягом 15 годин, одержуючи вказану вище сполуку в кристалічній формі D (25,2г) у вигляді безбарвних кристалів (температура плавлення 206°С, виміряна без коректування при використанні Melting Point B-545, поширюваного Buchi Company). Рентгенівська дифракція порошку 2q (градуси) 9,680 10,260 11,480 11,800 12,580 13,160 13,900 15,440 15,660 16,520 17,520 19,320 20,220 20,660 21,020 21,480 21,820 22,280 22,700 23,140 23,640 24,460 25,400 26,060 26,580 26,960 28,040 28,620 29,080 30,160 30,880 31,820 37,460 Інтенсивність (імп./сек.) 337 1796 1921 2608 2119 5843 1413 4091 4780 1853 298 1748 4858 2115 1063 493 856 947 2126 13619 502 3174 1919 1306 860 337 1036 188 852 328 617 728 315 Приведені вище дані дослідження рентгенівської дифракції порошку виміряні в таких же умовах, як в прикладі 23(2). (7) Одержання 3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензо-фуран-1(3Н),4'-піперидин]-1'-карбоксаміду (кристалічна форма В) - альтернативний спосіб одержання. Сирі кристали (26г), одержані по описаній вище методиці (6), суспендують в ацетонітрилі (260мл). У суміш вносять затравковий кристал, одержаний по описаній вище методиці (4) і перемішують при кімнатній температурі протягом 24 годин. Одержані кристали збирають фільтруванням, промивають ацетонітрилом (50мл) і сушать у вакуумі при 30°С протягом 15 годин, одержуючи вказаний вище продукт в кристалічній формі В (25,5г). Сполуки прикладів 24-39 одержують аналогічно способу прикладу 22, замінюючи феніл N-(4бензоїлфеніл)карбамат, що використовується в прикладі 22, відповідною речовиною. Приклад 24 N-(7-метил-2-хіноліл)-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід Температура плавлення 178-180°С Приклад 25 3-оксо-N-[4-феніл-5-ізоксазоліл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід Температура плавлення 239-242°С Приклад 26 3-оксо-N-(7-трифторметилпіридо[3,2-b]піридин-2-іл)спіро[ізобензофуран-1(3H,4'-піперидин]-1’-карбоксамід Температура плавлення 246-248°С Приклад 27 3-Оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1’-карбоксамід Температура плавлення 211-214°С Приклад 28 3-оксо-Ν-[1-(3-хіноліл)-4-імідазоліліспіро[ізобензофуран-1(3H,4'-піперидин]-1'-карбоксамід Температура плавлення 251-254°С Приклад 29 3-оксо-N-(5-феніл-3-піразоліл)спіро[ізобензофуран-1(3H,4'-піперидин]-1’-карбоксамід Температура плавлення 160-165°С Приклад 30 N-[5-(4-хлорфеніл)-3-піразолілі-3-оксоспіро[ізобензофуран-1(3H,4'-піперидин]-1'-карбоксамід Температура плавлення 255-258°С Приклад 31 3-оксо-N-[5-(3-хіноліл)-3-піразоліл]спіро[ізобензофуран-1(3H,4'-піперидин]-1’-карбоксамід Температура плавлення 253-257°С Приклад 32 N-[5-(3-фторфеніл)-2-піримідиніл]-3-оксоспіро[ізобензофуран-1(3H,4'-піперидині-1'-карбоксамід Температура плавлення 122-125°С Рентгенівська дифракція порошку 2q (градуси) 4,96 9,94 13,82 14,56 14,64 14,94 16,14 16,66 17,12 17,60 17,92 19,40 19,80 19,94 20,42 21,00 21,80 22,06 22,36 23,96 24,16 24,32 25,08 25,38 26,82 27,06 27,84 Інтенсивність (імп./сек.) 5335 2512 1020 555 565 1705 1067 2260 1668 1420 590 447 788 627 1057 963 1698 2397 1235 555 632 402 1603 538 647 1345 1073 28,80 28,86 29,42 30,30 30,74 34,16 38,12 42,36 43,88 465 493 752 1015 850 422 918 625 528 Приведені вище дані дослідження рентгенівської дифракції порошку виміряні на RINT2100 Ultima+System(2KW) (виробництво Rigaku International Corporation), умови аналізу наступні: джерело рентгенівського випромінювання: Сu, напруження трубки: 40кВ, струм тр убки: 30мА, автоматичний монохроматор: монохроматор, моноприймаюча щілина: 0,15мм, горизонтальний гоніометр: гоніометр І, крок сканування: 0,02град., швидкість сканування: 2,00град./хв., відхиляюча щілина (DS): 1град., розсіююча щілина: 1град., приймаюча щілина (RS): 0,15мм, температура температура вимірювання: навколишнього середовища. Приклад 33 3-Оксо-N-[5-(3-трифторметилфеніл)-2-піримідиніл]спіро[ізобензофуран-1(3H),4'-піперидин]-1’карбоксамід Температура плавлення 190-192°С Приклад 34 N-[5-(3-хлорфеніл)-2-піримідиніл]-3-оксоспіро[ізобензофуран-1(3Η),4'-піперидин]-1'-карбоксамід Температура плавлення 126-128°С Приклад 35 N-(7-дифторметокситридо[3,2-В]піридин-2-іл)-3-оксоспіро[ізобензофуран-1(3H),4'-піперидин]-1'карбоксамід Температура плавлення 193°С Приклад 36 3-Оксо-N-(5-феніл-1,2,4-тіадіазол-3-іл)спіро[ізобензофуран-1(3H),4'-піперидин]-1’-карбоксамід Температура плавлення 239-241°С Приклад 37 NН-{1-[3-(2-гідроксіетил)феніл]-4-імідазоліл}-3-оксоспіро[ізобензофуран-1(3H),4'-піперидин]-1'-карбоксамід Температура плавлення 99-100°С Приклад 38 N-[4-(1-етил-2-імідазоліл)феніл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід Температура плавлення 221-223°С Приклад 39 N-[1-(3-метоксифеніл)-4-імідазоліл]-3-оксоспіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксамід Температура плавлення 208-210°С Приклад 40 Одержання 6-фтор-3-оксо-N-(5-феніл-2-піразинил)спіро[зобензофуран-1(3Н),4'-піперидині-1'-карбоксаміду Суміш 6-фторспіро[ізобензофуран-1(3Н),4'-піперидин]-3-он гідрохлориду (64мг), феніл N-(5-феніл-2піразиніл)карбамату (73мг) і триетиламіну (174мкл) в хлороформі (5мл) перемішують при 80°С протягом 2 годин. Реакційну суміш виливають у воду і екстрагують хлороформом (20мл). Органічний шар промивають насиченим сольовим розчином (20мл), потім сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2) і перекристалізовують з суміші етиловий ефір-гексан, одержуючи вказану сполуку (101мг) у вигляді безбарвних кристалів (температура плавлення 222-224°С). Приклад 41 Одержання 6-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'карбоксамід Вказану сполуку одержують аналогічно способу прикладу 40, замінюючи феніл N-(5-феніл-2піразиніл)карбамат, що використовується в прикладі 40, на феніл N-(5-феніл-2-піримідиніл)карбамат. Температура плавлення 176-178°С Приклад 42 Одержання 5-фтор-3-οκсο-Ν-[5-феніл-2-піразиніл)спіро[ізобензофуран-1(3H),4’-піперидин]-1'-карбоксаміду Суміш 5-фторспіро[ізобензофуран-1(3Н),4'-піперидин]-3-он гідрохлориду (64мг), феніл N-(5-феніл-2 піразиніл)карбамату (73мг) і триетиламіну (174мкл) в хлороформі (5мл) перемішують при 80°С протягом 2 годин. Реакційну суміш виливають у воду і екстрагують хлороформом (20мл). Органічний шар промивають насиченим сольовим розчином (20мл), потім сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2) і перекристалізовують з суміші етиловий ефір-гексан, одержуючи вказану сполуку (100мг) у вигляді безбарвних кристалів (температура плавлення 236-23 8°С). Приклад 43 Одержання 5-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3H),4'-піперидин]-1'карбоксаміду Вказану сполуку одержують аналогічно способу прикладу 42, замінюючи феніл N-(5-феніл-2піразиніл)карбамат, що використовується в прикладі 42, на феніл N-(5-феніл-2-піримідиніл)карбамат. Температура плавлення 255-257°С Приклад 44 Одержання N-(4-бензоїлфеніл)-3,4-дигідро-3-оксоспіро[1Н-2-бензопіран-1,4'-піперидин]-1'-карбоксаміду Спіро[1Н-2-бензопіран-1,4'-піперидин]-3(4Н)-он гідрохлорид (50,6мг) і феніл N-(4-бензоїлфеніл)карбамат (63,4мг) суспендують в диметилсульфоксиді (1,0мл) і суспензію інтенсивно перемішують з 10М водним гідроксидом натрію (30мкл) протягом 5 хвилин. Реакційну суміш розбавляють водою і екстрагують етилацетатом. Органічний шар промивають насиченим сольовим розчином, потім сушать над безводним Na2SO4 і концентрують. Залишок кристалізують з суміші метанол-діізопропіловий ефір, одержуючи вказану сполуку (68,0мг) у вигляді безбарвних кристалів (температура плавлення 138-146°С). Сполуки прикладів 45 і 46 одержують аналогічно способу прикладу 44, замінюючи феніл N-(4бензоїпфеніл)карбамат, що використовується в прикладі 44, на відповідні речовини. Приклад 45 3,4-Дигідро-3-оксо-N-(5-феніл-2-піразиніл)спіро[1Н-2-бензопіран-1,4’-піперидин]-1'-карбоксамід Температура плавлення 221°С Приклад 46 N-(5-бензоїл-2-піразиніл)-3,4-дигідро-3-оксоспіро[1Н-2-бензопіран-1,4'-піперидин]-1'-карбоксамід Температура плавлення 128-131°С Приклад 47 Одержання транс-N-(4-бензоїлфеніл)-3'-оксоспіро[циклогексан-1,’1(3’H)-ізобензофуран]-4-карбоксаміду (1) Одержання стро[циклогексан-1,1’(3'Н)-ізобензофуран]-3',4-діону Розчин 2-бромбензойної кислоти (4,77г) в безводному тетрагідрофурані (100мл) охолоджують до -78°С в атмосфері азоту, до нього додають по краплі н-бутиллітій (1,53Μ розчин в гексані, 31мл), підтримуючи внутрішню температуру нижче за -55°С. Після перемішування протягом 1 години до суміші додають по краплі розчин 1,4-циклогександіон моноетиленкеталю (5,18г) в безводному тетрагідрофурані (10мл), підтримуючи внутрішню температур у нижче за -67°С. Після підвищення температури до кімнатної реакційний розчин розподіляють між водою (150мл) і гексаном (100мл). Водний шар підкисляють концентрованою соляною кислотою і кип'ятять 2 години із зворотним холодильником разом з ацетоном (10мл). Після охолоджування отриману таким чином суміш нейтралізують карбонатом калію і екстрагують етилацетатом. Органічний шар промивають насиченим сольовим розчином, потім сушать над безводним Na2SO4 і випаровують. Залишок кристалізують з суміші етилацетат-гексан, одержуючи вказану сполуку (2,42г). (2) Одержання 4-метиленспіро[циклогексан-1,1'(3’H)-ізобензофуран]-3-ону Суспензію метилтрифенілфосфоній броміду (715мг) в безводному тетрагідрофурані (7,0мл) охолоджують до 0°С в атмосфері азоту, додають до неї н-бутиллітий (1,53Μ розчин в гексані, 1,3мл), перемішують при даній температурі 20 хвилин і потім охолоджують до -78°С. Додають до реакційної суміші розчин спіро[циклогексан1,1'(3'Н)-ізобензофуран]-3',4-діону (216мг) в безводному тетрагідрофурані (3мл) і підвищують температуру до 0°С. Після перемішування протягом 20 хвилин до отриманої суміші додають водний хлорид амонію і одержаний сирий продукт екстрагують етилацетатом. Органічний шар промивають насиченим сольовим розчином, потім сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат=4/1), одержуючи вказану сполуку (196мг). (3) Одержання 4-гідроксиметилстро[циклогексан-1,1'(3’H)-ізобензофуран]-3'-ону Розчин 4-метиленспіро[циклогексан-1,1'(3’H)-ізобензофуран]-3-ону (196мг) в безводному тетрагідрофурані (5,0мл) охолоджують до 0°С, до нього додають комплекс боран-диметилсульфоксид (2М розчин в тетрагідрофурані, 690мкл) і суміш перемішують при даній температурі 1,5 години, потім ще 20 хвилин разом з 2М водним гідроксидом натрію (5,0мл) і 30% водним пероксидом водню (5,0мл). Реакційну суміш розбавляють водою, екстрагують етилацетатом, промивають насиченим сольовим розчином, потім сушать над безводним Na2SO4 і випаровують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетаті/1), одержуючи вказану сполуку (190мг) у ви гляді діастереоізомерів. (4) Одержання транс-3’-оксостро[циклогексан-1,1’(3'Н)-ізобензофуран]-4-карбонової кислоти Суміш 4-гідроксиметилстро[циклогексан-1,1'(3’H)-ізобензофуран]-3'-ону (190мг), хлороформу (2,0мл), ацетонітрилу (2,0)мл і натрійфостатного буфера (рН 6,5, 2,0мл) охолоджують до 0°С, додають до неї періодат натрію (612мг) і н-гідрат хлориду рутенію (III) (10мг) і суміш перемішують 30 хвилин. Дану реакційну суміш перемішують разом з 1н соляною кислотою (2,0мл) протягом 30 хвилин і розподіляють між водою (50мл) і етилацетатом (50мл). Органічний шар промивають насиченим сольовим розчином, сушать над безводним Na2SO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (хлороформ/метанол=100/1), одержуючи вказану сполуку (98,6мг). (5) Одержання транс-N-(4-бензоїлфеніл)-3'-оксоспіро-[циклогексан-1,1'(3’H)-ізобензофуран]-4карбоксаміду До розчину транс-3'-оксоспіро[циклогексан-1,1'(3’H)-ізобензофуран]-4-карбонової кислоти (24,6мг) в піридині (500мкл) додають 4-амінобензофенон (19,8мг) і 1-(3-диметиламінопропіл)-3-етилкарбодіімід гідрохлорид, (57,5мг) і суміш перемішують при 50°С протягом 2 годин. Дану реакційну суміш розподіляють між водою і етилацетатом. Органічний шар промивають водним гідросульфатом калію, водним гідрокарбонатом натрію і насиченим сольовим розчином, а потім сушать над безводним Na2SO4 і випаровують. Залишок перекристалізовують з суміші етилацетат-гексан, одержуючи вказану сполуку (31,2мг) у вигляді безбарвних кристалів (температура плавлення 194°С). Сполуки прикладів 48-56 одержують аналогічно способу прикладу 47-(5), замінюючи 4-амінобензофенон, що використовується в прикладі 47-(5), на відповідні речовини. Приклад 48 Транс-3'-оксо-N-(5-феніл-2-піразиніл)спіро[циклогексан-1,1'(3’H)-ізобензофуран]-4-карбоксамід Температура плавлення 223°С Приклад 49 Транс-3'-оксо-N-(1-феніл-4-імідазоліл)спіро[циклогексан-1,1'(3’H)-ізобензофуран]-4карбоксамід Температура плавлення 264°С Приклад 50 Транс-3'-оксо-N-(5-феніл-2-піримідиніл)спіро[циклогексан-1,1'(3’H)-ізобензофурані-4-карбоксамід Температура плавлення 184°С Приклад 51 N-[1-(3,5-дифторфеніл)-4-імідазоліл1-3'-оксоспіро[циклогексан-1,1'(3’H)-ізобензофурані-4-карбоксамід Температура плавлення 294°С Приклад 52 Транс-3’-оксо-N-(5-феніл-3-піразоліл)спіро[циклогексан-1,1'(3’H)-ізобензофуран]-4-карбоксамід Температура плавлення 238°С Приклад 53 Транс-N-[1-(2-фторфеніл)-4-імідазоліл]-3'-оксоспіро[циклогексан-1,1'(3'Н)-ізобензофурані-4-карбоксамід Температура плавлення 258°С Приклад 54 Транс-N-(4-ацетил-3-трифторметилфеніл)-3'-оксоспіро[циклогексан-1,1'(3’H)-ізобензофуран]-4-карбоксамід Температура плавлення 274-275°С Приклад 55 Транс-3'-оксо-n-[1-(3-хіноліл)-4-імідазоліл]спіро[циклогексан-1,1'(3’H)-ізобензофуран]-4-карбоксамід Температура плавлення >300°С Приклад 56 Транс-N-[1-(3-ціанофеніл)-4-імідазоліл]-3'-оксоспіро[циклогексан-1,1'(3’H)-ізобензофуран]-4-карбоксамід Температура плавлення 268-270°С Приклад 57 Одержання транс-N-(4-бензоїлфеніл)-3-оксоспіро[4-азаізобензофуран-1(3’H),1'-циклогексан]-4'карбоксаміду (1) Одержання диспіро[4-азаізобензофуран-1(3Н),1'-циклогексан-4',2"-1”,3"-діоксолан]-3-ону Розчин N-метил-2-піридинкарбоксаміду (9,53г) в безводному тетрагідрофурані (400мл) охолоджують до 78°С в атмосфері азоту, до нього додають по краплі н-бутиллітій (1,54Μ розчин в гексані, 100мл). Після перемішування протягом 1,5 годин при тій самій температурі до суміші додають по краплі розчин 1,4циклогександіон моноетиленкеталю (10,93г) в безводному тетрагідрофурані (100мл). Після підвищення температури до кімнатної реакційну суміш розподіляють між водою (300мл) і етиловим ефіром (100мл). Водний шар підкисляють 2н соляною кислотою, перемішують 30 хвилин, нейтралізують карбонатом калію і залишають на ніч. Одержаний осадок збирають фільтруванням і сушать, одержуючи вказану сполуку (6,84г). (2) Одержання спіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-3,4'-діону Суміш диспіро[4-азаізобензофуран-1(3Н),1'-циклогексан-4',2"-1'',3"-діоксолан]-3-ону (6,8г), 2н соляної кислоти (20мл) і ацетону (5мл) нагрівають при кип'ятінні із зворотним холодильником протягом 13 годин. Після охолоджування суміш нейтралізують карбонатом калію і перемішують з ізопропіловим ефіром (5мл) протягом 3 годин. Одержаний осадок збирають фільтруванням і сушать, одержуючи вказану сполуку (3,39г). (3) Одержання цис-4'-гідроксиспіро[4-азаізобензофуран-1(3Н),1'-циклогексан]-3-ону Спіро[4-азаізобензофуран-1(3H),1’-циклогексан]-3,4'-діон (5,7г) розчиняють в тетрагідрофурані (50мл) і воді (10мл) і охолоджують до 0°С. Розчин перемішують разом з боргідридом натрію (993мг) протягом 20 хвилин, підкисляють 10% сірчаною кислотою, доводять рН до 7,4 насиченим водним розчином гідрокарбонату натрію і екстрагують сумішшю хлороформ-етанол і сумішшю хлороформ-тетрагідрофуран. Органічний шар сушать над безводним Na2SО4 і концентрують. Залишок кристалізують з суміші етилацетат-ізопропіловий ефір, одержуючи вказану сполуку (2,02г). (4) Одержання транс-3-оксоспіро[4-азаізобензофуран-1(3H),1’-циклогексан]-4'-карбонітрилу До розчину цис-4'-гідроксистро[4-азаізобензофуран-1(3H),1’-циклогексан]-3-ону (2,02г) в безводному тетрагідрофурані (60мл) додають триетиламін (3,08мл) і охолоджують до 0°С. До суміші додають по краплі метансульфонілхлорид(1,3мл) і перемішують при даній температурі 1 годину. Реакційну суміш розбавляють водою і екстрагують хлороформом. Органічний шар сушать над безводним Na2SO4 і випаровують. Залишок перекристалізовують з суміші етилацетат-ізопропіловий ефір, одержуючи мезилат (2,47г). Одержаний таким чином мезилат розчиняють в диметилформаміді (25мл) і перемішують разом з тетраметиламонійціанідом (3,25г) при 100°С протягом 3 годин. Після охолоджування реакційну суміш розбавляють водою і екстрагують етилацетатом. Органічний шар промивають водою і насиченим сольовим розчином, суша ть над безводним Na2SO4 і потім концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат=2/3), одержуючи вказану сполуку (1,0г). (5) Одержання транс-3-оксоспіро[4-азаізобензофуран-1(3H),1’-циклогексан]-4'-карбонової кислоти Розчин транс-3-оксоспіро[-азаізобензофуран-1(3H),1'-циклогексан]-4'-карбонітрилу (1,0г) в 30% сірчаній кислоті нагрівають при кип'ятінні із зворотним холодильником протягом 11 годин. Після охолоджування реакційну суміш розбавляють водою і доводять рН до 6 карбонатом калію. Одержаний осадок збирають фільтруванням, промивають водою і суша ть на повітрі, одержуючи вказану сполуку (974мг). (6) Одержання транс-N-(4-бензоїлфеніл)-3-оксоспіро[4-азаізобензофуран-1(3H),1'-циклогексан]-4'карбоксаміду До розчину транс-3-оксоспіро[4-азаізобензофуран-1(3H),1’-циклогексан]-4'-карбонової кислоти (66мг) в піридині (1мл) додають 4-амінобензофенон (52,6мг) і 1-(3-диметиламінопропіл)-3-етилкарбодіімід гідрохлорид (153мг) і суміш перемішують при 40°С протягом 2 годин. Дану реакційну суміш концентрують і залишок розподіляють між водою і етилацетатом. Органічний шар промивають насиченим сольовим розчином, сушать над безводним Na2SO4 і потім концентрують. Залишок кристалізують з суміші етилацетат-гексан, одержуючи вказану сполуку (94,4мг) у вигляді безбарвних кристалів (температура плавлення 237°С). Сполуки прикладів 58-60 одержують аналогічно способу прикладу 57-(6), замінюючи 4-амінобензофенон, що використовується в прикладі 57-(6), на відповідні речовини. Приклад 58 Транс-3-оксо-N-(5-феніл-2-піразиніл)спіро[4-азаізобензофуран-1(3Η),1'-циклогексані-4'-карбоксамід Температура плавлення 203°С Приклад 59 Транс-3-оксо-N-(3-феніл-5-ізоксазоліл)спіро[4-азаиеобензофуран-1(3H),1'-циклогексан]-4'-карбоксамід Температура плавлення 217°С Приклад 60 Транс-3-оксо-N-(5-феніл-2-піримідиніл)спіро[4-азаізобензофуран-1(3H),1'-циклогексані-4'-карбоксамід Температура плавлення 237°С Приклад 61 Одержання транс-N-(4-бензоїлфеніл)-3-оксоспіро[5-азаізобензофуран-1(3H)-1’-циклогексан]-4'карбоксаміду (1) Одержання диспіро[5-азаізобензофуран-1(3H),1’-циклогексан-4',2"-1",3"-діоксолан]-3-ону 2,2,6,6-Тетраметилпіперидин (41,1мл) розчиняють в безводному тетрагідрофурані (400мл) охолоджують до -50°С, до нього послідовно додають н-бутиллітій (1,50Μ розчин в гексані, 217мл) і нікотинову кислоту (10,0г). Після перемішування протягом 1 години при -50°С додають розчин 1,4-циклогександіон моноетиленкеталю (13,9г) в безводному тетрагідрофурані (25мл) і суміш перемішують при -50°С протягом 1 години.·Після підвищення температури до кімнатноїреакційну суміш виливають у воду (800мл) і екстрагують сумішшю гексан-ефір (1:1, 500мл). Доводять рН водного шару до 3 за допомогою 6н соляної кислоти і перемішують при кімнатній температурі протягом 2 годин. Одержаний осадок збирають фільтруванням і промивають водою. Одержану таким чином тверду речовину розчиняють в хлороформі (300мл), промивають насиченим водним розчином бікарбонату натрію (150мл), сушать і потім концентрують. Залишок перекристалізовують з суміші етилацетат-гексан, одержуючи вказану сполуку (4,29г). (2) Одержання спіро[5-азаізобензофуран-1(3H),1’-циклогексан]-3,4'-діону Диспіро[5-азаізобензофуран4(3H),1'-циклогекган-4',2”-1”,3”-діоксюлан]-3-он (4,29г) і моногідрат паратолуолсульфонової кислоти (3,74г) розчиняють в ацетоні (80мл) і воді (8мл) і розчин нагрівають при кип'ятінні із зворотним холодильником протягом 3 годин. Після охолоджування ацетон випаровують і до залишку додають хлороформ (100мл). Суміш промивають насиченим водним розчином бікарбонату натрію (50млх2), сушать над безводним Na2SO4 і випаровують. Одержані кристали перекристалізовують з суміші етилацетатгексан, одержуючи вказану сполуку (2,68г). (3) Одержання цис-4'-гідроксиспіро[5-азаізобензофуран-1(3H),1-циклогексан]-3-ону Суспензію спіро[5-азаізобензофуран-1(3H),1’-циклогексан]-3,4'-діону (167мг) в суміші тетрагідрофуранвода (10:1, 4мл) охолоджують до 0°С і перемішують разом з боргідридом натрію (32мг) при 0°С протягом 30 хвилин. Реакційну суміш виливають у воду (5мл), перемішують 30 хвилин при кімнатній температурі і потім екстрагують хлороформом (20млх3). Екстракт суша ть над безводним Na2SO4 і концентрують. Залишок перекристалізовують з суміші етилацетат-гексан, одержуючи вказану сполуку (77,7мг). (4) Одержання транс-3-оксоспіро[5-азаізобензофуран-1(3H),1’-циклогексан]4'-карбонітрилу Розчин цис-4'-гідроксиспіро[5-азаізобензофуран-1(3H),1'-циклогексан]-3-ону (1,31г) в безводному тетрагідрофурані (20мл) охолоджують до 0°С і перемішують разом з метансульфонілхлоридом (0,555мл) при 0°С протягом 1 години. Реакційну суміш виливають у воду (50мл), екстрагують етилацетатом (100млх2), сушать над безводним Na2SO4 і концентрують, одержуючи сирий мезилат (1,87г). Даний мезилат розчиняють в безводному диметилформаміді (30мл) і перемішують разом з триетиламоній ціанідом (2,98г) при 100°С протягом 5 годин. Реакційну суміш виливають у воду (100мл) і екстрагують ефіром (150млх3) і сумішшю ефіретилацетат (2:1, 200мл). Об'єднані екстракти сушать над безводним Na2SO4 і концентрують. Одержаний маслянистий залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат/метанол від 2/1/0 до 1/1/0 і далі 30/30/1) і отриману тверду речовину перекристалізовують з суміші етилацетат-гексан, одержуючи вказану сполуку (631мг). (5) Одержання транс-3-оксоспіро[5-азаізобензофуран-1(3H),1’-циклогексан]-4'-карбонової кислоти Суміш транс-3-оксоспіро[5-азаізобензофуран-1(3H),1'-циклогексан]-4'-карбонітрилу (100мг), води (0,7мл) і концентрованої сірчаної кислоти (0,3мл) кип'ятять із зворотним холодильником протягом 11 годин. Реакційну суміш о холоджують до кімнатної температури і доводять рН до 4 за допомогою 4н гідроксиду натрію. Одержаний осадок збирають фільтруванням, промивають послідовно водою, етанолом і діізопропіловим ефіром і потім сушать, одержуючи вказану сполуку (78мг). 1 Н ЯМР (200мгц, ДМСО-d6 dм.д.): 1,63-1,87 (2Н, м), 1,88-2,20 (6Н, м), 2,70 (1Н, м), 7,76 (1Н, дд, J=5,2, 1,1Гц), 8,86 (1Н, д, J=5,2Гц), 9,06 (1H, д, J=1,1Гц), (6) Одержання транс-N-(4-бензоїлфеніл)-3-оксоспіро[5-азаізобензофуран-1(3H),1’-циклогексан]-4'карбоксаміду Розчин транс-3-оксоспіро[5-азаізобензефуран-1(3H),1’-циклогексан]-4'-карбонової кислоти (20мг) і 4 амінобензофенону (16мг) в безводному піридині (0,5мл) перемішують разом з 1-(3-диметиламінопропіл)-3етилкарбодіімід гідрохлоридом (20мг) при 60°С протягом 2 годин. Реакційну суміш виливають у воду (10мл) і екстрагують етилацетатом (30млх2). Об'єднані органічні шари сушать над безводним Na2SO4 і концентрують. Одержаний маслянистий залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 1/1 до 1/2) і одержану тверду речовину перекристалізовують з суміші етилацетатгексан, одержуючи вказану сполуку (10мг) у вигляді безбарвних кристалів (температура плавлення 256257°С). Приклад 62 Одержання транс-N-(4-бензоїлфеніл)-3-оксоспіро[6-азаізобензофуран-1(3H),1’-циклогексан]-4'карбоксаміду (1) Одержання диспіро[би-азаізобензофуран-1(3H),1’-циклогексан-4',2"-1”,3"-діоксолан]-3-ону 2,2,6,6-Тетраметилпіперидин (50 ми) розчиняють в безводному тетрагідрофурані (500мл) і даний розчин охоло,цжують до -50°С, до нього послідовно додають н-бутиллітій (1,50Μ розчин в гексані, 270,7мл) і ізонікотинову кислоту (12,5г). Реакційну сумішперемішують 10 хвилин при -50°С і підвищують температуру до 25°С за 30 хвилин. Реакційну суміш перемішують ще 10 хвилин при 25°С і охолоджують до -65°С. Додають 1,4-циклогександіон моноетиленкеталю (19г) і реакційну суміш перемішують при -65°С протягом 10 хвилин. Підвищують температуру реакційної суміші до -15°С за 1 годину, потім до 0°С за 30 хвилин. Потім дану суміш виливають у воду (300мл) і відділяють водний шар. Органічний шар екстрагують 2н водним гідроксидом натрію. Доводять рН об'єднаних водних шарів до 3 за допомогою концентрованої соляної кислоти і екстрагують етилацетатом (500мл). Органічний шар промивають насиченим водним розчином бікарбонату натрію (200мл), насиченим сольовим розчином, сушать над безводним MgSO4 і концентрують. Залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 1/0 до 4/1 і далі ,372) і перекристалізовують з суміші етилацетат-гексан, одержуючи вказану сполуку (7,20г). (2) Одержання спіро[6-азаізобензофуран-1 (3H), 1’-циклогексан]-3,4'-діону Диспіро[6-азаізобензофуран-1(3H),1'циклогексан-4',2"-1”,3"-діоксолан]-3-он (7,20г) і моногідрат паратолуолсульфонової кислоти (5,80г) розчиняють в ацетоні (150мл) і воді (15мл) і розчин нагрівають при кип'ятінні із зворотним холодильником протягом 5,5 годин. Після охолоджування ацетон випаровують і залишок екстрагують етилацетатом (100млх3). Об'єднані органічні шари промивають насиченим сольовим розчином (50мл), сушать над безводним MgSO4 і випаровують. Одержані кристали перекристалізовують з суміші етилацетат; діізопропіловий ефір, одержуючи вказану сполуку (1,96г). (3) Одержання цис-4'-гідроксиспіро[6-азаізобензофуран-1(3H),1’-циклогексан]-3-ону Розчин спіро[6-азаізобензофуран-1(3H),1’-циклогексан]-3,4'-діону (1,0г) в етанолі (100мл) охолоджують до 0°С і перемішують разом з боргідридом натрію (174мг) при 0°С протягом 1 години. Доводять рН реакційної суміші до 4 за допомогою 10% сірчаної кислоти, потім за допомогою насиченого водного розчину бікарбонату натрію роблять його основним і далі екстрагують хлороформом (200млx2). Екстракт сушать над безводним MgSO4 і концентрують. Залишок перекристалізовують з суміші етилацетат-гексан, одержуючи вказану сполуку (954,5мг). (4) Одержання транс-3-оксоспіро[6-азаізобензофуран-1(3H),1’-циклогексан]-4'-карбонітрилу Розчин цис-4'-гідроксиспіро[6-азаізобензофуран-1(3H),1'-циклогексан]-3-ону (954мг) і триетиламіну (0,91мл) в диметилформаміді (10мл) охолоджують до 0°С і перемішують разом з метансульфонілхлоридом (0,40мл) при 0°С протягом 1 години. Реакційну суміш розбавляють етилацетатом (100мл), промивають насиченим водним розчином бікарбонату натрію (50млх2) і насиченим сольовим розчином (50мл), сушать над безводним MgSО4 і концентрують. Залишок перекристалізовують з суміші етилацетат-діізопропіловий ефір, одержуючи мезилат (995мг). Даний мезилат розчиняють в безводному диметилформаміді (30мл) і перемішують разом з триетиламоній ціанідом (1,57г) при 100°С протягом 1,5 годин. Реакційну суміш розбавляють етилацетатом (200мл) і послідовно промивають водою (200мл), насиченим водним розчином бікарбонату натрію (200мл) і насиченим, сольовим розчином (100мл). Органічний шар суша ть над безводним MgSO4 і концентрують. Залишок перекристалізовують з суміші етилацетат-ізопропіловий ефір, одержуючи вказану сполуку (447мг). (5) Одержання транс-3-оксоспіро[6-азаізобензофуран-1(3H),1’-циклогексан]-4'-карбоновой кислоти Суміш транс-3-оксоспіро[6-азаізобензофуран-1(3H),1'-циклогексан]-4'-карбонітрилу (445мг), води [3,5мл) і концентрованої сірчаної кислоти (1,5мл) кип'ятять із зворотним холодильником протягом 6 годин. Реакційну суміш охолоджують до кімнатної температури і доводять рН до 8 за допомогою 5н гідроксиду натрію, потім до рН4 концентрованою соляною кислотою. Одержані кристали збирають фільтруванням, промивають водою і сушать, одержуючи вказану сполуки (416мг) у вигляді безбарвних кристалів (температура плавлення 222223°С). 1 Н ЯМР (300мгц, ДМСО-d6, dм.д.): 1,7-2,2 (6Н, м), 2,65-2,75 (1Н, м), 7,83 (1H, дд, J=1,2, 4,9Гц), 8,86 (1H, д, J=4,9Гц), 9,05 (1H, д, J=1,2Гц), 12,3 (1H, ш.с). (6) Одержання транс-N-(4-бензоїлфеніл)-3-оксоспіро[6-азаізобензофуран-1(3H),1’-циклогексан]-4'карбоксаміду Розчин транс-3-оксоспіро[6-азаізобензофуран-1(3H),1’-циклогексан]-4'-карбонової кислоти (50мг) і 4амінобензофенону (51,6мг) в безводному піридині (1мл) перемішують разом з 1-(3-диметиламінопропіл)-3етилкарбодіімід гідрохлоридом (48,7мг) при 60°С протягом 2 годин. Реакційну суміш розбавляють етилацетатом (20мл) і послідовно промивають водою (20мл), 10% водним розчином лимонної кислоти (20мл χ 2), насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином. Органічний шар сушать над безводним MgSO4 і концентрують. Одержаний маслянистий залишок очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 3/2 до 1/4) і отриману тверду речовину перекристалізовують з суміші етилацетат-гексан, одержуючи вказану сполуку (62,7мг) у вигляді безбарвних кристалів (температура плавлення 147-149°С). Приклад 63 Одержання N-[5-(4-гідроксифеніл)-2-піразиніл]-3-оксоспіро[ізобензофуран-1(3H),4'-піперидин]-1'карбоксаміду (1) Одержання 2-аміно-5-(4-гідроксифеніл)піразину До розчину 2-аміно-5-бромпіразина (366мг) в диметоксіетані (20мл) додають 4-гідроксифенілборонову кислоту (320мл), 1,5 н водний розчин карбонату натрію (2,5мл) і тетракис(трифетлфосфін)паладій(0) (54мг). Суміш перемішують при 80°С протягом 3 годин. До реакційної суміші додають воду (20мл) і все екстрагують етилацетатом (50млх3). Екстракт промивають насиченим сольовим розчином, потім сушать над безводним Na2SO4. Видалення розчинника дає кристалічний залишок, який промивають діетиловим ефіром (10мл), одержуючи вказану сполуку (305мг). (2) Одержання феніл N-[5-(4-гідроксифеніл)-2-піразиніл]-карбамату До розчину 2-аміно-5-(4-гідроксифеніл)піразину (283мг) в піридині (20мл) додають при охолоджуванні льодом феніл хлорформіат (199мкл) і суміш перемішують 1 годину. Реакційну суміш виливають у воду (30мл) і екстрагують етилацетатом (20мл х 3). Органічний шар промивають насиченим сольовим розчином і сушать над безводним Na2SO4. Концентрування розчину дає кристалічний залишок, який промивають діетиловим ефіром (10мл), одержуючи вказану сполуку (314мг). (3) Одержання N-[5-(4-гідроксифеніл)-2-піразиніл]-3-оксоспіро-[ізобензофуран-1(3H),4'-піперидиніл]-1’карбоксаміду Суміш спіро[ізобензофуран-1(3H),4'-піперидин]-3-он гідрохлориду (96мг), феніл N-(4-гідроксифеніл)-2піразиніл]карбамату (128мг) і триетиламіну (279мкл) в хлороформі (5мл) перемішують при 80°С протягом 2 годин. Реакційну суміш виливають у воду і екстрагують хлороформом (20мл). Органічний шар промивають насиченим сольовим розчином (20мл) і суша ть над безводним Na2SO4. Концентрування розчину забезпечує залишок, який очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2) з подальшої перекристалізацією з суміші етиловий ефір-гексан, одержуючи вказану сполуку (114мг) у вигляді безбарвних кристалів (температура плавлення 263-265°С). Приклад 64 Одержання N-[5-(3-гідроксифеніл)-2-піразиніл]-3-океоспіро[ізобензофуран-1(3H),4'-піперидин]1'карбоксаміду. (1) Одержання 2-аміно-5-(3-метоксифеніл)піразину До розчину 2-аміно-5-бромпіразину (642мг) в диметоксіетані (40мл) додають 3-метоксифенілборонову кислоту (560мг), 1,5н водний розчин карбонату натрію (4мл) і тетракис(трифенілфосфін)паладій(0) (86мг). Суміш перемішують при 80°С протягом 6 годин. До реакційної суміші додають воду (20мл) і все екстрагують етилацетатом (50млх3). Екстракт промивають насиченим сольовим розчином і потім сушать над безводним Na2SO4. Концентрування розчину дає кристалічний залишок, який промивають етиловим ефіром (10мл), одержуючи вказану сполуку (760мг). (2) Одержання 2-аміно-5-(3-гідроксифеніл)піразину 2-Аміно-5-(3-метоксифеніл)піразин (566мг) розчиняють в метиленхлориді (10мл). До суміші додають при охолоджуванні льодом трибромистий бор (530мкл) і все перемішують при кімнатній температурі протягом 14 годин. До реакційної суміші додають 1н водний гідроксид натрію. Всі екстрагують етилацетатом (30млх2). Органічний шар промивають насиченим сольовим розчином і сушать над безводним Na2SO4. Концентрування розчину дає вказану сполуку (94мг) у вигляді жовтої твердої речовини. (3) Одержання феніл N-(3-гідроксифеніл)-2-піразиніл]-карбамату До розчину 2-аміно-5-(3-гідроксифеніл)піразину (89мг) в піридині (10мл) додають при охолоджуванні льодом феніл хлорформіат (63мкл). Суміш перемішують 1 годину і виливають у воду (30мл), екстрагують етилацетатом (20млх3). Екстракт промивають насиченим сольовим розчином і потім сушать над безводним Na2SO4. Концентрування розчину дає кристалічний залишок, який промивають етиловим ефіром (10мл), одержуючи вказану сполуку (51мг). (4) Одержання N-[5-(3-гідроксифеніл)-2-піразиніл]-3-оксоспіро-[ізобензофуран-1(3H),4'-піперидин]-1’карбоксаміду Суміш спіро[ізобензофуран-1(3H),4'-піперидин]-3-он гідрохлориду (40мг), феніл N-[5-(3-гідроксифеніл)-2піразиніл]карбамату (51мг) і триетиламіну (119мкл) в хлороформі (5мл) перемішують при 80°С протягом 2 годин. Реакційну суміш виливають у воду і екстрагують хлороформом (20мл). Органічний шар промивають насиченим сольовим розчином (20мл) і сушать над безводним Na2SO4. Концентрування .розчину дає залишок, який очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2) з подальшою перекристалізацією з суміші етиловий ефір-гексан, одержуючи вказану сполуку (24мг) у вигляді безбарвних кристалів (температура плавлення 257-259°С). Приклад 65 Одержання 4-фтор-3-оксо-N-(5-феніл-2-тримідиніл)спіро[ізобензофуран-1(3H),4'-піперидин]-1'карбоксаміду Суміш 4-фторспіро[ізобензофуран-1(3H),4'-піперидин]-3-он гідрохлориду (150мг), феніл N-(5-феніл-2піримідиніл)карбамату (170мг) і триетиламіну (0,24мл) в хлороформі (2мл) перемішують при 60°С протягом 3 годин. Концентрування реакційної суміші дає залишок, який очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат/метанол=1/1/0-8/8/1-6/6/1) з подальшою перекристалізацією з суміші етилацетат-гексан, одержуючи вказану сполуку (190мг) у вигляді безбарвних кристалів (температура плавлення 247-249°С). Приклад 66 Одержання 7-фтор-3-оксо-N-(5-феніл-2-піримідиніл)спіро[ізобензофуран-1(3Н),4'-піперидині-1'карбоксаміду Суміш 7-фторспіро[ізобензофуран-1(3H),4'-піперидин]-3-он гідрохлориду (150мг), феніл N-(5-феніл-2піримідиніл)карбамату (170мг) і триетиламіну (0,24мл) в хлороформі (2мл) перемішують при 60°С протягом 2 годин. Реакційну суміш розбавляють етилацетатом. Всю суміш промивають 10% водним розчином лимонної кислоти, насиченим водним розчином бікарбонату натрію і насиченим сольовим розчином і потім сушать над безводним Na2SO4. Концентрування реакційної суміші дає залишок, який перекристалізовують з етилацетату, одержуючи вказану сполуку (202мг) у вигляді безбарвних кристалів (температура плавлення 244-246°С). Приклад 67 Одержання 6-етил-3-оксо-N-(5-феніл-2-пираеиніл)спіро[ізобензофуран-1(3Н),4'-піперидин]-1'-карбоксаміду (1) Одержання 2-(4-етилфеніл)-4,4-диметил-2-оксазоліну До розчину 4-етилбензойної кислоти (3,80г) в безводному ацетонітрилі (100мл) додають в атмосфері азоту-трифенілфосфін (20г), 2-аміно-2-метил-1-пропанол (2,74мл) і триетиламін (28,2мл). Суміш охолоджують на бані з льодом і потім додають тетрахлорметан (5,36мл). Реакційну суміш залишають при кімнатній температурі і перемішуванні протягом 18 годин. До реакційної суміші додають етилацетат і гексан, і осадок видаляють фільтруванням. Концентрування фільтрату дає залишок, який очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 9/1 до 6/1), одержуючи вказану сполуку (1,15г). (2) Одержання 1’-бензил-6-етилспіро[ізобензофуран-1(3H),4'-піперидин]-3-он гідрохлориду В атмосфері азоту розчин 2-(4-етилфеніл)-4,4-диметил-2-оксазоліну (1,15г) в безводному тетрагідрофурані (100мл) охолоджують до -78°С. До даного розчину додають 1,5Μ розчин бутиллітію в гексані (4,53мл). Після перемішування протягом 1 години додають по краплі 1-бензил-4-піперидон (1,05мл). Потім температурі реакційної суміші дають піднятися до кімнатної і додають до реакційної суміші 2н соляну кислоту, роблячи суміш кислою. Всю суміш кип'ятять із зворотним холодильником протягом 2 годин. Після охолоджування додають водний розчин гідроксиду натрію, роблячи реакційну суміш основною. Дану суміш екстрагують етиловим ефіром. Органічний шар промивають насиченим сольовим розчином і потім сушать над безводним Na2SO4. Концентрування органічного розчину дає залишок який очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат=3/2), одержуючи вказану сполуку (409мг). (3) Одержання 6-етилспіро[ізобензофуран-1(3H),4'-піперидин]-3-он гідрохлориду 1'-Бензил-6-етилспіро[ізобензофуран-1(3H),4'-піперидин]-3-он гідрохлорид (400мг) розчиняють в метанолі (10мл) і додають 10% паладій на вугіллі. Суміш перемішують в атмосфері водню протягом 1,5 годин. Після видалення паладію-вугілля фільтруванням фільтрат концентрують, одержуючи залишок, який піддають кристалізації з суміші метанол-етиловий ефір, одержуючи вказану сполуку (222мг). (4) Одержання 6-етил-3-оксо-N-(5-феніл-2-піразиніл)спіро[ізобензофуран-1(3H),4'-піперидин]-1’карбоксаміду До суспензії 6-етилепіро[ізобензофуран-1(3H),4'-піперидин]-3-он гідрохлориду (53мг) і феніл N-(5-феніл-2піразиніл)карбамат (58мг) в диметилсульфоксиді (1мл) і додають 10М водного розчину гідроксиду натрію (0,02мл). Суміш енергійно перемішують протягом 5 хвилин, а потім розподіляють між водою і етилацетатом. Органічний шар відділяють і промивають насиченим сольовим розчином, а потім сушать над безводним Na2SO4. Концентрування органічного розчину дає залишок, який кристалізують з етилацетату, одержуючи вказану сполуку (46мг) у вигляді кристалів (температура плавлення 176-178°С). Приклад 68 Одержання 6-гідрокси-3-оксо-N-(5-феніл-2-пиразиніл)слиро[ізобензофуран-1(3H),4'-піперидин]-1'карбоксаміду (1) Одержання 2-(4-метоксифеніл)-4,4-диметил-2-оксазоліну До розчину 2-аміно-2-метил-1-пропанолу (14,4г) і триетиламіну (23мл) в сухому ТГФ (200мл) додають по краплі при охолоджуванні льодом розчин 4-метоксибензоїлхлориду (25г) в сухому ТГФ (20мл). Суміш перемішують при кімнатній температурі протягом 1 години і додають воду (200мл). Реакційну суміш двічі екстрагують етилацетатом (100мл). Органічний шар промивають насиченим сольовим розчином і сушать над безводним сульфатом натрію. Концентрування органічного розчину дає сполуку (29,5г) у вигляді білої твердої речовини. До вищезазначеної білої твердої речовини додають тіонілхлорид (25мл) і реакцію проводять при кімнатній температурі протягом однієї години. Реакційну суміш підлужують доданням 5н водного розчину гідроксиду натрію і двічі екстрагують етилацетатом (100мл). Об'єднаний органічний шар промивають насиченим водним розчином хлориду натрію і сушать безводним сульфатом натрію. Розчинник випаровують, одержуючи вказану ви ще сполуку (22г) у вигляді безбарвного масла. (2) Одержання 1'-бензил-6-метоксиспіро[ізобензофуран-1(3H),4'-піперидин]-3-ону В атмосфері азоту до розчину 2-(4-метоксифеніл)-4,4-диметил-2-оксазоліну (7,9г) в безводному толуолі (100мл) додають по краплі при охолоджуванні льодом 1,5 Μ розчин бутиллітію в гексані (28мл). Після перемішування протягом 3 годин при тій же температурі додають по краплі 1-бензил-4-піперидон (8г) в безводному толуолі (20мл). Після перемішування реакційної суміші при кімнатній температурі протягом 14 годин додають насичений водний розчин хлориду амонію (50мл). Суміш двічі екстрагують етилацетатом (100мл). Органічний шар промивають насиченим сольовим розчином і сушать над безводним Na2SO4. Концентрування органічного розчину дає сполуку (8,3г) у вигляді білої твердої речовини. Дану сполуки розчиняють в метанолі (50мл) і додають концентровану сірчану кислоту (4мл). Суміш перемішують 1 годину при кімнатній температурі. Додають до реакційної суміші 1н водний розчин гідроксиду натрію, роблячи суміш основною. Дану суміш двічі екстрагують етилацетатом (100мл). Органічний шар промивають насиченим сольовим розчином і сушать над безводним Na2SO4. Концентрування органічного розчину дає вказану сполуку (6,6г) у вигляді жовтої твердої речовини. (3) Одержання 6-гідроксиспіро[ізобензофуран-1(3H),4'-піперидин]-3-он гідрохлориду 1’-Бензил-6-метоксиспіро[ізобензофуран-1(3H),4'-піперидин]-3-он (1,8г) розчиняють в метиленхлориді (20мл). До даного розчину додають при охолоджуванні льодом трибромистий бор (1,3мл). Після перемішування реакційної суміші при кімнатній температурі протягом 14 годин додають 1н водний розчин гідроксиду натрію. Суміш двічі екстрагують етилацетатом (30мл). Органічний шар промивають насиченим сольовим розчином, а потім сушать над безводним Na2SO4. Концентрування органічного розчину дає сполуку (1,2г) у вигляді жовтої твердої речовини, яку розчиняють в метанолі (30мл). До даного розчину додають суміш 4н хлористий водень-етилацетат (5мл), 20% гідроксид паладію на вугіллі (300мг). Суміш перемішують в атмосфері водню протягом 14 годин. Після видалення каталізатора фільтруванням фільтрат концентрують, одержуючи вказану сполуку (891мг) у вигляді білої твердої речовини. (4) Одержання 6-гідрокси-3-оксо-N-(5-феніл-2-піразиніл)спіро-[ізобензофуран-1(3H),4'-піперидин]-1’карбоксаміду Суміш 6-гідроксиспіро[ізобензофуран-1(3H),4'-піперидин]-3-он гідрохлориду (51мг), феніл N-(5-беніл-2тразиніл)карбамату (53мг) і триетиламіну (119мкл) в хлороформі (5мл) перемішують при 80°С протягом 2 годин. Реакційну суміш виливають у воду і потім екстрагують хлороформом (20мл). Органічний шар промивають насиченим сольовим розчином (20мл) і сушать над безводним Na2SO4. Концентрування органічного розчину дає залишок, який очищають способом колонкової хроматографії на силікагелі (гексан/етилацетат від 4/1 до 1/2) з подальшою перекристалізацією з суміші етиловий ефір-гексан, одержуючи вказану сполуку (29мг) у вигляді безбарвних кристалів (температура плавлення 206-208°С). Сполуки прикладів 69-79 одержують по методиці, аналогічній описаній в прикладі 61, використовуючи відповідні початкові речовини замість 4-амінобензофенону, що використовується в прикладі 61. Приклад 69 Транс-3-оксо-N-(5-феніл-2-піримідиніл)спіро[5-азаізобенеофуран-1(3H),1'-циклогексан]-4'-карбоксамід Температура плавлення 215-217°С Приклад 70 Транс-N-[5-(3-фторфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3H),1’-циклогексан]-4'карбоксамід Температура плавлення 205-207°С Приклад 71 Транс-N-[5-(2-фторфеніл)-2-піримідинід]-3-оксоспіро[5-азаізобензофуран-1(3H),1'-циклогексан]-4'карбоксамід Температура плавлення 226-228°С Рентгенівська дифракція порошку 2q (градуси) 11,14 14,62 15,02 15,12 15,56 16,22 17,10 19,22 20,06 20,54 20,78 21,00 21,78 23,24 24,12 24,90 25,98 26,30 27,52 28,22 28,56 28,82 29,04 29,70 30,54 32,84 36,46 Інтенсивність (імп./сек.) 970 1418 570 920 895 475 1873 1698 3202 542 1013 1063 2405 5557 555 888 487 500 2765 690 553 647 423 653 1102 362 408 Приведені вище дані дослідження рентгенівської дифракції порошку виміряні в таких же умовах, як в прикладі 32. Приклад 72 Транс-3-оксо-N-('4-феніл-2-оксазоліл)спіро[5-азаізобензофуран-1(3H)1'-циклогексан]-4'-карбоксамід Температура плавлення 273-275°С Приклад 73 Транс-N-[5-(2-метилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3H),1'-циклогексан]-4'карбоксамід Температура плавлення 213-215°C Приклад 74 Транс-N-[5-(3-метилфеніл)-2-піримідиніл]-3-оксоспіро[5-азаізобензофуран-1(3H),1'-циклогексан]-4'карбоксамід
ДивитисяДодаткова інформація
Назва патенту англійськоюSpiro compounds as antagonists of neuropeptide y receptor activity
Автори англійськоюKanatasi Akio, Sakamoto Toshiro
Назва патенту російськоюСпиросоединения как антагонисты активности рецептора нейропептида y
Автори російськоюКанатани Акио, Сакамото Тосихиро
МПК / Мітки
МПК: C07D 405/12, C07D 491/10, C07D 519/00, C07D 213/61, C07D 307/94, A61P 25/00, C07D 471/10
Мітки: антагоністи, спіросполуки, нейропептиду, рецептора, активності
Код посилання
<a href="https://ua.patents.su/35-72540-spirospoluki-yak-antagonisti-aktivnosti-receptora-nejjropeptidu-y.html" target="_blank" rel="follow" title="База патентів України">Спіросполуки як антагоністи активності рецептора нейропептиду y</a>
Попередній патент: Регенеративний патрон ізолюючого дихального апарата
Наступний патент: Фармацевтична композиція, що містить похідне бензаміду
Випадковий патент: Інтерфейсний виконавчий механізм клапана












