Гербіцидні піридазинонові похідні
Номер патенту: 114094
Опубліковано: 25.04.2017
Автори: Вінер Расселл Колін, Морріс Джеймс Алан, Мітчелл Глінн, Елліотт Елісон Клер, Рцепа Паула Роча, Бхоноах Юнас, Лінг Кеннет, Гольє Стівен
Формула / Реферат
1. Сполука формули (І),
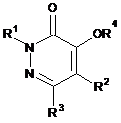 (I)
(I)
або її агрономічно прийнятна сіль,
де
R1 вибраний із групи, що складається з водню, С1-С6алкілу, С3-С6циклоалкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6галогеналкілу, С1-С6алкоксі-С1-С3-алкілу, С3-С6циклоалкіл-С1-С3алкілу-, тетрагідропіранілу - та бензилу, де бензил необов'язково заміщений одним або декількома R11;
R2 вибраний із групи, що складається з А1, А2 та A3,
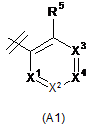 ,
,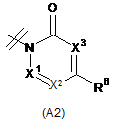 ,
,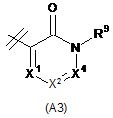 ,
,
де
X1 являє собою N або CR7;
X2 являє собою N або CR8;
X3 являє собою N або CR9;
X4 являє собою N або CR6;
R3 вибраний із групи, що складається з водню, галогену, нітро, аміно, ціано, С1-С6алкілу, С1-С3алкокси-, С3-С6циклоалкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6галогеналкілу, С1-С6алкоксі-С1-С3алкілу, С3-С6циклоалкіл-С1-С3-алкілу, С1-С6алкіл-S(О)p-, С1-С6алкіл-S(О)р-С1-С3алкілу, С1-С6галогеналкіл-S(О)p-, С1-С3алкіламіно, С1-С3діалкіламіно та С1-С6галогеналкілу-S(О)p-С1-С3алкілу;
R4 вибраний із групи, що складається з водню, С1-С6алкілкарбонілу-, арилкарбонілу-, С1-С6алкоксикарбонілу-, С1-С6алкілу-S(О)p-, С1-С6алкіл-S(О)pкарбонілу- та арил-S(O)p-, де вказані арильні групи необов'язково можуть бути заміщені одним або декількома R11;
R5 вибраний із групи, що складається з гідроксилу, галогену, С1-С6алкілу, С1-С6циклоалкілу, С1-С6галогеналкенілу, С2-С6алкенілу, С2-С6галогеналкенілу, С2-С6алкінілу, С1-С6алкоксі-, С2-С6алкенілокси-, С3-С6циклоалкіл-С1-С3-алкілу-, С1-С6алкоксі-С1-С3алкілу-,С1-С6алкоксі-С2-С6алкоксі-, С1-С6алкоксі-С2-С6алкоксі-С1-С3алкілу-, С1-С6галогеналкоксі-, С1-С6галогеналкоксі-С1-С3алкілу-, С1-С6алкіл-S(О)Р-,С1-С6галогеналкіл-S(О)р-, арилу, арил-S(О)р-, гетероциклілу, гетероцикліл-S(О)р-, арилоксі-,арил- С2-С6алкілу-, арил- С1-С6алкокси, гетероциклілоксі-, гетероцикліл-С1-С3алкоксі-С1-С3алкілу-, гідроксикарбонілу, гідроксикарбоніл- С1-С3алкоксі-, С1-С3алкоксикарбонілу-, С1-С3алкоксикарбоніл-С1-С3алкоксі-, С1-С3алкіламіно-, С1-С3діалкіламіно-, С1-С3алкіламіно-S(О)р-, С1-С3алкіламіно-S(О)р-С1-С3алкілу-, С1-С3діалкіламіно-S(О)р-, С1-С3діалкіламіно-S(О)р-С1-С3алкілу-, С1-С3алкіламінокарбонілу-, С1-С3алкіламінокарбоніл-С1-С3алкілу-, С1-С3діалкіламінокарбонілу-, С1-С3діалкіламінокарбоніл-С1-С3алкілу-, С1-С3алкілкарбоніламіно-, С1-С3алкіл-S(О)р-аміно-, С1-С3алкіл-S(О)Р-С1-С3алкіламіно-, С1-С3алкіл-S(О)р-аміноС1-С3алкілу-, ціано та нітро, де вказані гетероцикліли являють собою п'яти- або шестичленні гетероцикліли, що містять від одного до трьох гетероатомів, кожний з яких незалежно вибраний із групи, що складається з кисню, азоту та сірки, та де арильні або гетероциклільні компоненти необов'язково можуть бути заміщені одним або декількома замісниками, вибраними із групи, що складається з галогену, С1-С3алкілу, С1-С3галогеналкілу, С1-С3алкокси, С1-С3галогеналкокси, С1-С6алкіл-S(О)Р-, фенілу, ціано та нітро;
R6 та R9 незалежно вибрані із групи, що складається з водню, гідроксилу, галогену, С1-С6алкілу, С1-С6циклоалкілу, С1-С6галогеналкілу, С2-С6алкенілу, С2-С6галогеналкенілу, С2-С6алкінілу, С1-С6алкоксі-, С2-С6алкенілоксі-, С3-С6циклоалкілС1-С3-алкілу-, С1-С6алкоксі- С1-С3алкілу-, С1-С6алкоксі-С2-С6алкоксі-, С1-С6алкоксі-С2-С6алкоксі-С1-С3алкілу-, С1-С6галогеналкоксі-, С1-С6галогеналкоксі-С1-С3алкілу-, С1-С6алкіл-S(O)P-, С1-С6галогеналкіл-S(О)Р-, арилу, арил-S(О)р-, гетероциклілу, гетероцикліл-S(О)р-, арилоксі-, арил-С2-С6алкілу-, арил-С1-С6алкоксі-, гетероциклілокси-, гетероцикліл-С1-С3алкоксі-С1-С3алкілу-, гідроксикарбонілу, гідроксикарбоніл-С1-С3алкоксі-, С1-С3алкоксикарбонілу-, С1-С3алкоксикарбоніл-С1-С3алкоксі-, С1-С3алкіламіно-, С1-С3діалкіламіно-, С1-С3алкіламіно-S(О)Р-, С1-С3алкіламіно-S(О)Р-С1-С3алкілу-, С1-С3діалкіламіно-S(О)Р-, С1-С3діалкіламіно-S(О)Р-С1-С3алкілу-, С1-С3алкіламінокарбонілу-, С1-С3алкіламінокарбоніл-С1-С3алкілу-, С1-С3діалкіламінокарбонілу-, С1-С3діалкіламінокарбоніл-С1-С3алкілу-, С1-С3алкілкарбоніламіно-, С1-С3алкіл-S(О)р-аміно-, С1-С3алкіл-S(О)Р-С1-С3алкіламіно-, С1-С3алкіл-S(О)р-аміноС1-С3алкілу-, ціано та нітро, де вказані гетероцикліли являють собою п'яти- або шестичленні гетероцикліли, що містять від одного до трьох гетероатомів, кожний з яких незалежно вибраний із групи, що складається з кисню, азоту та сірки, та де арильні або гетероциклільні компоненти необов'язково можуть бути заміщені одним або декількома замісниками, вибраними із групи, що складається з галогену, С1-С3алкілу, С1-С3галогеналкілу, С1-С3алкокси, С1-С3галогеналкокси, С1-С6алкіл-S(О)р-, фенілу, ціано та нітро;
R7 та R8 незалежно вибрані із групи, що складається з водню, галогену, С1-С3алкілу-, С1-С3алкоксі-, С2-С3алкенілу-, С2-С3алкінілу-, С1-С3галогеналкілу- та С1-С3галогеналкокси-;
та де R5 та R9 разом можуть утворювати насичене або ненасичене 5- або 6-членне карбоциклічне або гетероциклічне кільце, при цьому вказане гетероциклічне кільце містить один або декілька гетероатомів азоту та/або кисню, причому 5- або 6-членне кільце необов'язково є заміщеним одним або декількома R12; або
R6 та R9 разом можуть утворювати насичене або ненасичене 5- або 6-членне карбоциклічне або гетероциклічне кільце, при цьому вказане гетероциклічне кільце містить один або декілька гетероатомів, вибраних із групи, що складається з азоту, кисню та S(O)2, причому 5- або 6-членне кільце необов'язково є заміщеним одним або декількома R12; або
R6 та R8 разом можуть утворювати насичене або ненасичене 5- або 6-членне карбоциклічне або гетероциклічне кільце, при цьому вказане гетероциклічне кільце містить один або декілька гетероатомів азоту, причому 5- або 6-членне кільце необов'язково є заміщеним одним або декількома R13; та
R11 вибраний із групи, що складається з галогену-, С1-С3алкілу, С1-С3галогеналкілу та С1-С6алкокси;
R12 вибраний із групи водню, ціано, галогено-, оксі-, С1-С3алкіл-S(О)р-, С1-С3алкілу, С2-С3алкенілу, С2-С3алкінілу, С1-С3алкокси та С1-С3галогеналкілу;
R13 вибраний із групи водню, ціано, галогено-, С1-С3алкіл-S(О)р-, С1-С3алкілу, С2-С3алкенілу, С2-С3алкінілу, морфолінілу- та С1-С3галогеналкілу; та
p=0, 1 або 2;
та де сполука формули (І) не являє собою 2-(1-бензил-5-гідроксі-6-оксо-1,6-дигідропіридазин-4-іл)бензойну кислоту.
2. Сполука за п. 1, де R3 та/або R4 являє собою водень.
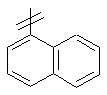
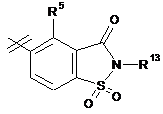
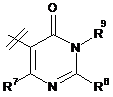
3. Сполука за п. 1 або п. 2, де R2 вибраний із групи, що складається з A1a, A1b, A1c, A1d, A1e, A1f, A1g, A1h, A2a, A2b, А3а, А3b та А3с:
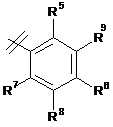 ,
,
 ,
,
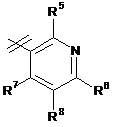 ,
,
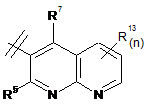 ,
,
(A1a)
(A1b)
(A1c)
(A1d)
 ,
,
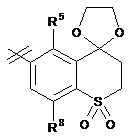 ,
,
 ,
,
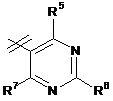 ,
,
(A1e)
(A1f)
(A1g)
(A1h)
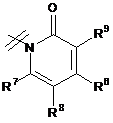 ,
,
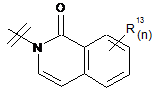 ,
,
(A2a)
(A2b)
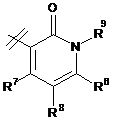 ,
,
 ,
,
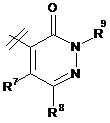 ,
,
(A3a)
(A3b)
(A3c)
де R5, R6, R7, R8, R9 та R13 визначені вище та n дорівнює 0, 1, 2 або 3.
4. Сполука за п. 3, де R2являє собою Ala.
5. Сполука за будь-яким з попередніх пунктів, де R5 вибраний із групи, що складається з гідроксилу, галогену, С1-С6алкілу, С1-С6циклоалкілу, С1-С6галогеналкілу, С1-С6алкокси, С1-С6алкоксі-С1-С3алкілу, С1-С6алкоксі-С2-С6алкоксі-С1-С3алкілу, С1-С6галогеналкоксі-С1-С3алкілу, С1-С6алкіл-S(O)p-, арилу, арилокси, гетероцикліл-С1-С3алкоксі-С1-С3алкілу, С1-С3діалкіламіно-, С1-С3алкіл-S(О)р-аміно-С1-С3діалкілу, ціано та нітро.
6. Сполука за п. 5, де R5 вибраний із групи, що складається з хлору, фтору, метилу, трифторметилу, 2-фторетилу-, метоксіетоксиметилу-, трифторметоксиметилу-, метил-S(О)р-, арилу, ізоксазолінілу, морфолінілу, метил-S(О)р-диметиламіно-, ціано та нітро, де арильні або гетероциклільні компоненти необов'язково можуть бути заміщені одним або декількома замісниками, вибраними із групи, що складається з хлору, метилу або трифторметилу.
7. Сполуки за будь-яким з попередніх пунктів, де R6 вибраний із групи, що складається з водню, галогену, С1-С6алкілу, С1-С6галогеналкілу, С1-С6алкіл-S(О)р-, С2-С6алкенілу та С2-С6алкінілу.
8. Сполука за будь-яким з попередніх пунктів, де R7 та R8 незалежно вибрані із групи, що складається з водню, галогену та С1-С3алкілу-.
9. Сполука за будь-яким з попередніх пунктів, де R9 вибраний із групи, що складається з водню, галогену, С1-С6алкілу, С1-С6галогеналкілу, С1-С6алкіл-S(О)p-, С2-С6алкенілу та С2-С6алкінілу.
10. Гербіцидна композиція, що містить гербіцидну сполуку за будь-яким з попередніх пунктів та прийнятний з точки зору сільського господарства допоміжний засіб для складання.
11. Гербіцидна композиція за п. 10, що додатково містить щонайменше один додатковий пестицид.
12. Гербіцидна композиція за п. 11, де додатковий пестицид являє собою гербіцид або антидот гербіциду.
13. Спосіб боротьби з бур'янами в місцеположенні, що включає застосування щодо місцеположення, достатнього для боротьби з бур'янами кількості композиції за будь-яким із пп. 10-12.
14. Застосування сполуки формули (І)
 (I)
(I)
або її агрономічно прийнятної солі,
де
R1 вибраний із групи, що складається з водню, С1-С6алкілу, С3-С6циклоалкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6галогеналкілу, С1-С6алкоксі-С1-С3-алкілу, С3-С6циклоалкіл-С1-С3алкілу-, тетрагідропіранілу- та бензилу-, де бензил необов'язково заміщений одним або декількома R11;
R2 вибраний із групи, що складається з А1, А2 та A3,
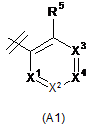 ,
,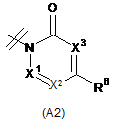 ,
, ,
,
де
X1 являє собою N або CR7;
X2 являє собою N або CR8;
X3 являє собою N або CR9;
X4 являє собою N або CR6;
R3 вибраний із групи, що складається з водню, галогену, нітро, аміно, ціано, С1-С6алкілу, С1-С3алкоксі-, С3-С6циклоалкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6галогеналкілу, С1-С6алкоксі- С1-С3алкілу, С3-С6циклоалкіл-С1-С3-алкілу, С1-С6алкіл-S(О)p-, С1-С6алкіл-S(О)р-С1-С3-алкілу, С1-С6галогеналкіл-S(О)p-, С1-С3алкіламіно, С1-С3діалкіламіно та С1-С6галогеналкіл-S(О)p-С1-С3-алкілу;
R4 вибраний із групи, що складається з водню, С1-С6алкілкарбонілу-, арилкарбонілу-, С1-С6алкоксикарбонілу-, С1-С6алкіл-S(О)p-, С1-С6алкіл-S(О)pкарбонілу- та арил-S(O)p-, де вказані арильні групи необов'язково можуть бути заміщені одним або декількома R11;
R5 вибраний із групи, що складається з гідроксилу, галогену, С1-С6алкілу, С1-С6циклоалкілу, С1-С6галогеналкенілу, С2-С6алкенілу, С2-С6галогеналкенілу, С2-С6алкінілу, С1-С6алкоксі-, С2-С6алкенілокси-, С3-С6циклоалкіл С1-С3-алкілу-, С1-С6алкоксі-С1-С3алкілу-,С1-С6алкоксі-С2-С6алкокси-, С1-С6алкоксі-С2-С6алкоксі-С1-С3алкілу-, С1-С6галогеналкоксі-, С1-С6галогеналкоксі-С1-С3алкілу-, С1-С6алкіл-S(О)р-,С1-С6галогеналкіл-S(О)р-, арилу, арил-S(О)р-, гетероциклілу, гетероцикліл-S(О)р-, арилоксі-, арил- С2-С6алкілу-, арил- С1-С6алкоксі, гетероциклілоксі-, гетероцикліл-С1-С3алкоксі-С1-С3алкілу-, гідроксикарбонілу, гідроксикарбоніл-С1-С3алкоксі-, С1-С3алкоксикарбонілу-, С1-С3алкоксикарбоніл-С1-С3алкоксі-, С1-С3алкіламіно-, С1-С3діалкіламіно-, С1-С3алкіламіно-S(О)р-, С1-С3алкіламіно-S(О)р-С1-С3алкілу-, С1-С3діалкіламіно-S(О)р-, С1-С3діалкіламіно-S(О)Р-С1-С3алкілу-, С1-С3алкіламінокарбонілу-, С1-С3алкіламінокарбоніл-С1-С3алкілу-, С1-С3діалкіламінокарбонілу-, С1-С3діалкіламінокарбоніл-С1-С3алкілу-, С1-С3алкілкарбоніламіно-, С1-С3алкіл-S(О)р-аміно-, С1-С3алкіл-S(О)Р-С1-С3алкіламіно-, С1-С3алкіл-S(О)Р-аміноС1-С3алкілу-, ціано та нітро, де вказані гетероцикліли являють собою п'яти- або шестичленні гетероцикліли, що містять від одного до трьох гетероатомів, кожний з яких незалежно вибраний із групи, що складається з кисню, азоту та сірки, та де арильні або гетероциклільні компоненти необов'язково можуть бути заміщені одним або декількома замісниками, вибраними із групи, що складається з галогену, С1-С3алкілу, С1-С3галогеналкілу, С1-С3алкокси, С1-С3галогеналкокси, С1-С6алкіл-S(О)Р-, фенілу, ціано та нітро;
R6 та R9 незалежно вибрані із групи, що складається з водню, гідроксилу, галогену, С1-С6алкілу, С1-С6циклоалкілу, С1-С6галогеналкілу, С2-С6алкенілу, С2-С6галогеналкенілу, С2-С6алкінілу, С1-С6алкоксі-, С2-С6алкенілоксі-, С3-С6циклоалкілС1-С3-алкілу-, С1-С6алкоксі-С1-С3алкілу-, С1-С6алкоксі-С2-С6алкоксі-, С1-С6алкоксі-С2-С6алкоксі-С1-С3алкілу-, С1-С6галогеналкоксі-, С1-С6галогеналкоксі-С1-С3алкілу-, С1-С6алкіл-S(O)р-, С1-С6галогеналкіл-S(О)р-, арилу, арил-S(О)р-, гетероциклілу, гетероцикліл-S(О)р-, арилокси-, арил-С2-С6алкілу-, арил-С1-С6алкоксі-, гетероциклілоксі-, гетероцикліл-С1-С3алкокси- С1-С3алкілу-, гідроксикарбонілу, гідроксикарбоніл-С1-С3алкоксі-, С1-С3алкоксикарбонілу-, С1-С3алкоксикарбоніл-С1-С3алкоксі-, С1-С3алкіламіно-, С1-С3діалкіламіно-, С1-С3алкіламіно-S(О)р-, С1-С3алкіламіно-S(О)Р-С1-С3алкілу-, С1-С3діалкіламіно-S(О)Р-, С1-С3діалкіламіно-S(О)Р-С1-С3алкілу-, С1-С3алкіламінокарбонілу-, С1-С3алкіламінокарбоніл-С1-С3алкілу-, С1-С3діалкіламінокарбонілу-, С1-С3діалкіламінокарбоніл-С1-С3алкілу-, С1-С3алкілкарбоніламіно-, С1-С3алкіл-S(О)р-аміно-, С1-С3алкіл-S(О)р-С1-С3алкіламіно-, С1-С3алкіл-S(О)р-аміноС1-С3алкілу-, ціано та нітро, де вказані гетероцикліли являють собою п'яти- або шестичленні гетероцикліли, що містять від одного до трьох гетероатомів, кожний з яких незалежно вибраний із групи, що складається з кисню, азоту та сірки, та де арильні або гетероциклільні компоненти необов'язково можуть бути заміщені одним або декількома замісниками, вибраними із групи, що складається з галогену, С1-С3алкілу, С1-С3галогеналкілу, С1-С3алкокси, С1-С3галогеналкокси, С1-С6алкіл-S(О)р-, фенілу, ціано та нітро;
R7 та R8 незалежно вибрані із групи, що складається з водню, галогену, С1-С3алкілу-, С1-С3алкоксі-, С2-С3алкенілу-, С2-С3алкінілу-, С1-С3галогеналкілу- та С1-С3галогеналкокси-;
та де R5 та R9 разом можуть утворювати насичене або ненасичене 5- або 6-членне карбоциклічне або гетероциклічне кільце, при цьому вказане гетероциклічне кільце містить один або декілька гетероатомів азоту та/або кисню, причому 5- або 6-членне кільце необов'язково є заміщеним одним або декількома R12; або
R6 та R9 разом можуть утворювати насичене або ненасичене 5- або 6-членне карбоциклічне або гетероциклічне кільце, при цьому вказане гетероциклічне кільце містить один або декілька гетероатомів, вибраних із групи, що складається з азоту, кисню та S(O)2, причому 5- або 6-членне кільце необов'язково є заміщеним одним або декількома R12; або
R6 та R8 разом можуть утворювати насичене або ненасичене 5- або 6-членне карбоциклічне або гетероциклічне кільце, при цьому вказане гетероциклічне кільце містить один або декілька гетероатомів азоту, причому 5- або 6-членне кільце необов'язково є заміщеним одним або декількома R13; та
R11 вибраний із групи, що складається з галогено-, С1-С3алкілу, С1-С3галогеналкілу та С1-С6алкокси;
R12 вибраний із групи водню, ціано, галогено-, оксі-, С1-С3алкіл-S(О)р-, С1-С3алкілу, С2-С3алкенілу, С2-С3алкінілу, С1-С3алкокси та С1-С3галогеналкілу;
R13 вибраний із групи водню, ціано, галогено-, С1-С3алкіл-S(О)р-, С1-С3алкілу, С2-С3алкенілу, С2-С3алкінілу, морфолінілу- та С1-С3галогеналкілу; та
p=0, 1 або 2; як гербіциду.
Текст
Реферат: Винахід стосується сполуки формули І (72) Винахідник(и): Бхоноах Юнас (MU/GB), Елліотт Елісон Клер (GB), Гольє Стівен (FR/GB), Лінг Кеннет (GB), Мітчелл Глінн (GB), Морріс Джеймс Алан (GB), Рцепа Паула Роча (GB), Вінер Расселл Колін (GB) (73) Власник(и): СІНГЕНТА ЛІМІТЕД, European Regional Centre, Priestley Road, Surrey Research Park, Guildford, Surrey GU2 7YH, United Kingdom (GB) (74) Представник: Петров Андрій Володимирович, реєстр. №139 (56) Перелік документів, взятих до уваги експертизою: JP 11152273 A, 08.06.1999 Synthesis of 4-aryl-5-hydroxy- and 5-aryl-4hydroxypyridazin-3(2H)-ones and their use in the preparation of 4,5-diarylpyridazin-3(2H)ones and hitherto unknown isochromeno[3,4d]pyridazinediones / Bert U.W Maes et al. // Tetrahedron 58. – 2002. – P. 9713 – 9721 UA 114094 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 114094 C2 O R 1 OR N N R R 2 3 R 4 5 (I) або її агрономічно прийнятної солі, де 2 R вибраний із групи, що складається з (А1), (А2) і (A3), O X X 1 X2 (A1) 3 X 4 N X , O X 3 N 1 X2 (A2) R R X 6 , 1 X2 (A3) X 9 4 , де 1 7 X являє собою N або CR ; 2 8 X являє собою N або CR ; 3 9 X являє собою N або CR ; 4 6 X являє собою N або CR ; 1 3 4 5 6 7 8 9 R , R , R , R , R , R , R та R визначені в даному документі, а також стосується гербіцидних композицій, що містять сполуку формули (І) та їх застосування для боротьби з бур'янами. UA 114094 C2 Даний винахід стосується нових похідних піридазинону, способів їх одержання, гербіцидних композицій, які містять нові похідні, та їхнього застосування для боротьби з бур'янами, зокрема серед сільськогосподарських культур корисних рослин, або для пригнічення росту рослин. Таким чином, відповідно до даного винаходу представлена сполука формули (I): 5 (I) 10 або її агрономічно прийнятна сіль, де 1 R вибраний із групи, що складається з водню, C1-C6алкілу, C3-C6циклоалкілу, C2-C6алкенілу, C2-C6алкінілу, C1-C6галогеналкілу, C1-C6алкокси-C1-C3-алкілу, C3-C6циклоалкілC1-C3-алкілу-, 11 тетрагідропіранілу- та бензилу-, де бензил необов'язково заміщений одним або декількома R ; 2 R вибраний із групи, що складається з A1, A2 і A3, (AI) (A2) 20 25 30 35 40 (A3) , 15 де 1 7 X являє собою N або CR ; 2 8 X являє собою N або CR ; 3 9 X являє собою N або CR ; 4 6 X являє собою N або CR ; 3 R вибраний із групи, що складається з водню, гідроксилу, галогену, нітро, аміно, ціано, C 1C6алкілу, C1-C3алкоксі-, C3-C6циклоалкілу, C2-C6алкенілу, C2-C6алкінілу, C1-C6галогеналкілу, C1C6алкокси-C1-С3-алкілу, C3-C6циклоалкіл-C1-С3-алкілу, C1-C6алкіл-S(O)p-, C1-C6алкіл-S(O)p-C1-С3алкілу, C1-C6галогеналкіл-S(O)p-, C1-C3алкіламіно, C1-C3діалкіламіно та C1-C6галогеналкіл-S(O)pC1-С3-алкілу; 4 R вибраний із групи, що складається з водню, C1-C6алкілкарбонілу-, арилкарбонілу-, C1C6алкоксикарбонілу-, C1-C6алкіл-S(O)p-, C1-C6алкіл-S(O)p-карбонілу- та арилу-S(O)p-, де вказані 11 арильні групи необов'язково можуть бути заміщені одним або декількома R ; 5 R вибраний із групи, що складається з гідроксилу, галогену, C 1-C6алкілу, C1-C6циклоалкілу, C1-C6галогеналкілу, C2-C6алкенілу, C2-C6галогеналкенілу, C2-C6алкінілу, C1-C6алкоксі-, C2C6алкенілоксі-, C3-C6циклоалкілC1-C3-алкілу-, C1-C6алкокси-C1-C3алкілу-, C1-C6алкокси-C2C6алкоксі-, C1-C6алкокси-C2-C6алкокси-C1-C3алкілу-, C1-C6галогеналкоксі-, C1-C6галогеналкоксиC1-C3алкілу-, C1-C6алкіл-S(O)p-, C1-C6галогеналкіл-S(O)p-, арилу, арил-S(O)p-, гетероциклілу, гетероцикліл-S(O)p-, арилоксі-, арил-C2-C6алкілу-, арил-C1-C6алкоксі-, гетероциклілоксі-, гетероцикліл-C1-C3алкокси-C1-C3алкілу-, гідроксикарбонілу, гідроксикарбоніл-C1-C3алкоксі-, C1C3алкоксикарбонілу-, C1-C3алкоксикарбоніл-C1-C3алкоксі-, C1-C3алкіламіно-, C1-C3діалкіламіно-, C1-C3алкіламіно-S(O)p-, C1-C3алкіламіно-S(O)p-C1-C3алкілу-, C1-C3діалкіламіно-S(O)p-, C1C3діалкіламіно-S(O)p-C1-C3алкілу-, C1-C3алкіламінокарбонілу-, C1-C3алкіламінокарбоніл-C1C3алкілу-, C1-C3діалкіламінокарбонілу-, C1-C3діалкіламінокарбоніл-C1-C3алкілу-, C1C3алкілкарбоніламіно-, C1-C3алкіл-S(O)p-аміно-, C1-C3алкіл-S(O)p-C1-C3алкіламіно-, C1-C3алкілS(O)p-аміноC1-C3алкілу-, ціано та нітро, де вказані гетероцикліли являють собою п'яти- або шестичленні гетероцикліли, що містять від одного до трьох гетероатомів, кожний з яких незалежно вибраний із групи, що складається з кисню, азоту та сірки, і де арильні або 1 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 гетероциклільні компоненти необов'язково можуть бути заміщені одним або декількома замісниками, вибраними із групи, що складається з галогену, C 1-C3алкілу, C1-C3галогеналкілу, C1-C3алкокси, C1-C3галогеналкокси, C1-C6алкіл-S(O)p-, фенілу, ціано та нітро; 6 9 R та R незалежно вибрані із групи, що складається з водню, гідроксилу, галогену, C 1C6алкілу, C1-C6циклоалкілу, C1-C6галогеналкілу, C2-C6алкенілу, C2-C6галогеналкенілу, C2C6алкінілу, C1-C6алкоксі-, C2-C6алкенілоксі-, C3-C6циклоалкілC1-C3-алкілу-, C1-C6алкокси-C1C3алкілу-, C1-C6алкокси-C2-C6алкоксі-, C1-C6алкокси-C2-C6алкокси-C1-C3алкілу-, C1C6галогеналкоксі-, C1-C6галогеналкокси-C1-C3алкілу-, C1-C6алкіл-S(O)p-, C1-C6галогеналкіл-S(O)p, арилу, арил-S(O)p-, гетероциклілу, гетероцикліл-S(O)p-, арилоксі-, арил-C2-C6алкілу-, арил-C1C6алкоксі-, гетероциклілоксі-, гетероцикліл-C1-C3алкокси-C1-C3алкілу-, гідроксикарбонілу, гідроксикарбоніл-C1-C3алкоксі-, C1-C3алкоксикарбонілу-, C1-C3алкоксикарбоніл-C1-C3алкоксі-, C1C3алкіламіно-, C1-C3діалкіламіно-, C1-C3алкіламіно-S(O)p-, C1-C3алкіламіно-S(O)p-C1-C3алкілу-, C1-C3діалкіламіно-S(O)p-, C1-C3діалкіламіно-S(O)p-C1-C3алкілу-, C1-C3алкіламінокарбонілу-, C1C3алкіламінокарбоніл-C1-C3алкілу-, C1-C3діалкіламінокарбонілу-, C1-C3діалкіламінокарбоніл-C1C3алкілу-, C1-C3алкілкарбоніламіно-, C1-C3алкіл-S(O)p-аміно-, C1-C3алкіл-S(O)p-C1-C3алкіламіно-, C1-C3алкіл-S(O)p-аміноC1-C3алкілу-, ціано та нітро, де вказані гетероцикліли являють собою п'яти- або шестичленні гетероцикліли, що містять від одного до трьох гетероатомів, кожний з яких незалежно вибраний із групи, що складається з кисню, азоту та сірки, і де арильні або гетероциклільні компоненти необов'язково можуть бути заміщені одним або декількома замісниками, вибраними із групи, що складається з галогену, C 1-C3алкілу, C1-C3галогеналкілу, C1-C3алкокси, C1-C3галогеналкокси, C1-C6алкіл-S(O)p-, фенілу, ціано та нітро; 7 8 R та R незалежно вибрані із групи, що складається з водню, галогену, C 1-C3алкілу-, C1C3алкоксі-, C2-C3алкенілу-, C2-C3алкінілу-, C1-C3галогеналкілу- та C1-C3галогеналкокси-; 5 9 і де R та R разом можуть утворювати насичене або ненасичене 5- або 6-членне карбоциклічне або гетероциклічне кільце, при цьому вказане гетероциклічне кільце містить один або декілька гетероатомів азоту та/або кисню, причому 5- або 6-членне кільце необов'язково є 12 заміщеним одним або декількома R ; або 6 9 R та R разом можуть утворювати насичене або ненасичене 5- або 6-членне карбоциклічне або гетероциклічне кільце, при цьому вказане гетероциклічне кільце містить один або декілька гетероатомів, вибраних із групи, що складається з азоту, кисню та S(O)2, причому 5- або 612 членне кільце необов'язково є заміщеним одним або декількома R ; або 6 8 R та R разом можуть утворювати насичене або ненасичене 5- або 6-членне карбоциклічне або гетероциклічне кільце, при цьому вказане гетероциклічне кільце містить один або декілька гетероатомів азоту, причому 5- або 6-членне кільце необов'язково є заміщеним одним або 13 декількома R ; і 11 R вибраний із групи, що складається з галогено-, C1-C3алкілу, C1-C3галогеналкілу та C1C6алкокси; 12 R вибраний із групи водню, ціано, галогено-, оксі-, C1-C3алкіл-S(O)p-, C1-C3алкілу, C2C3алкенілу, C2-C3алкінілу, C1-C3алкокси та C1-C3галогеналкілу; 13 R вибраний із групи водню, ціано, галогено-, C1-C3алкіл-S(O)p-, C1-C3алкілу, C2-C3алкенілу, C2-C3алкінілу, морфолінілу- та C1-C3галогеналкілу; і p=0, 1 або 2. Алкільні групи з довжиною ланцюга від 1 до 6 атомів вуглецю включають, наприклад, метил (Me, CH3), етил (Et, C2H5), н-пропіл, ізопропіл (i-Pr), н-бутил (n-bu), ізобутил (i-bu), втор-бутил і трет-бутил (т-бутил). Алкенільні групи з довжиною ланцюга від 2 до 6 атомів вуглецю включають, наприклад, CH=CH2 (вініл) і -CH2-CH=CH2 (аліл). Алкінільні групи з довжиною ланцюга від 2 до 6 атомів вуглецю включають, наприклад, C≡CH (етиніл) і -CH2-C≡CH (пропаргіл). Циклоалкільні групи включають c-пропіл (c-Pr), c-бутил (c-Bu), c-пентил і c-гексил. Галоген (галогено) охоплює фтор, хлор, бром або йод. Те ж саме, відповідно, застосовне до галогену в контексті інших визначень, таких як галогеналкіл або галогенфеніл. Галогеналкільними групами з довжиною ланцюга від 1 до 6 атомів вуглецю є, наприклад, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, 2,2,2трифторетил, 2-фторетил, 2-хлоретил, пентафторетил, 1,1-дифтор-2,2,2-трихлоретил, 2,2,3,3тетрафторетил і 2,2,2-трихлоретил, гептафтор-н-пропіл і перфтор-н-гексил. Галогеналкенільні радикали включають алкенільні групи, заміщені один або декілька разів галогеном, при цьому галогеном є фтор, хлор, бром або йод, і зокрема фтор або хлор, наприклад, 2,2-дифтор-1-метилвініл, 3-фторпропеніл, 3-хлорпропеніл, 3-бромпропеніл, 2,3,3трифторпропеніл, 2,3,3-трихлорпропеніл і 4,4,4-трифторбут-2-ен-1-іл. Переважні C2 2 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 C6алкенільні радикали, заміщені один, два або три рази галогеном, характеризуються довжиною ланцюга від 2 до 5 атомів вуглецю. Алкоксигрупи переважно характеризуються довжиною ланцюга від 1 до 6 атомів вуглецю. Алкокси являє собою, наприклад, метокси, етокси, пропокси, ізопропокси, н-бутокси, ізобутокси, втор-бутокси, або трет-бутокси, або пентилокси, або ізомер гексилокси, переважно метокси та етокси. Алкілкарбоніл переважно являє собою ацетил або пропіоніл. Алкоксикарбоніл являє собою, наприклад, метоксикарбоніл, етоксикарбоніл, пропоксикарбоніл, ізопропоксикарбоніл, нбутоксикарбоніл, ізобутоксикарбоніл, втор-бутоксикарбоніл або трет-бутоксикарбоніл, переважно метоксикарбоніл, етоксикарбоніл або трет-бутоксикарбоніл. Також слід зазначити, що два замісника алкокси, які присутні на одному та тому самому атомі вуглецю, можуть бути об'єднані з утворенням спірогрупи. Таким чином, метильні групи, які присутні на двох замісниках метокси, можуть бути об'єднані з утворенням замісника спіро-1,3-діоксолан, наприклад. Така можливість підпадає під об'єм даного винаходу. Галогеналкокси являє собою, наприклад, фторметокси, дифторметокси, трифторметокси, 2,2,2-трифторетокси, 1,1,2,2-тетрафторетокси, 2-фторетокси, 2-хлоретокси, 2,2-дифторетокси або 2,2,2-трихлоретокси, переважно дифторметокси, 2-хлоретокси або трифторметокси. Групи алкілтіо (алкіл-S-) переважно характеризуються довжиною ланцюга від 1 до 6 атомів вуглецю. Алкілтіо являє собою, наприклад, метилтіо, етилтіо, пропілтіо, ізопропілтіо, н-бутилтіо, ізобутилтіо, втор-бутилтіо або трет-бутилтіо, переважно метилтіо або етилтіо. Алкілсульфініл (алкіл-SO-) являє собою, наприклад, метилсульфініл, етилсульфініл, пропілсульфініл, ізопропілсульфініл, н-бутилсульфініл, ізобутилсульфініл, втор-бутилсульфініл або трет-бутилсульфініл, переважно метилсульфініл або етилсульфініл. Алкілсульфоніл (алкіл-S(O)2-) являє собою, наприклад, метилсульфоніл, етилсульфоніл, пропілсульфоніл, ізопропілсульфоніл, н-бутилсульфоніл, ізобутилсульфоніл, вторбутилсульфоніл або трет-бутилсульфоніл, переважно метилсульфоніл або етилсульфоніл. Алкіламіно (алкіл-NH-) являє собою, наприклад, метиламіно, етиламіно, н-пропіламіно, ізопропіламіно або ізомер бутиламіно. Діалкіламіно ((алкіл) 2-N-) являє собою, наприклад, диметиламіно, метилетиламіно, діетиламіно, н-пропілметиламіно, дибутиламіно або діізопропіламіно. Перевагу віддають алкіламіногрупам з довжиною ланцюга від 1 до 4 атомів вуглецю. Циклоалкіламіно- або дициклоалкіламіно- являє собою, наприклад, циклогексиламіно або дициклопропіламіно. Алкоксіалкільні групи переважно мають від 1 до 6 атомів вуглецю. Алкоксіалкіл являє собою, наприклад, метоксиметил, метоксиетил, етоксиметил, етоксіетил, н-пропоксиметил, нпропоксіетил, ізопропоксиметил або ізопропоксіетил. Алкілтіоалкільні (алкіл-S-алкіл) групи переважно мають від 1 до 6 атомів вуглецю. Алкілтіоалкіл являє собою, наприклад, метилтіометил, метилтіоетил, етилтіометил, етилтіоетил, н-пропілтіометил, н-пропілтіоетил, ізопропілтіометил, ізопропілтіоетил, бутилтіометил, бутилтіоетил або бутилтіобутил. Циклоалкільні групи переважно мають від 3 до 6 атомів вуглецю в кільці та можуть бути заміщені однією або декількома метильними групами; вони переважно являють собою незаміщений, наприклад, циклопропіл (c-Pr), циклобутил (c-Bu), циклопентил (c-пентил) або циклогексил (c-гексил). Арил включає бензил, феніл, у тому числі феніл в якості частини замісника, такого як фенокси, бензил, бензилокси, бензоїл, фенілтіо, фенілалкіл, феноксіалкіл або тозил, може бути в моно- або полізаміщеній формі, у випадку чого замісники можуть бути, при необхідності, в орто-, мета- та/або пара-положенні (положеннях). Термін також передбачає, наприклад, нафталеніл. Гетероцикліл включає, наприклад, морфолініл, тетрагідрофурил і гетероарил. Гетероарил, у тому числі гетероарил як частина замісника, такого як гетероарилокси, означає, наприклад, п'яти - десяти (переважно п'яти або шести) членний гетероарил, що містить один - три гетероатоми, кожний з яких незалежно вибраний із групи, що складається з кисню, азоту та сірки. Термін гетероарил, таким чином, передбачає, наприклад, бензофураніл, бензимідазоліл, індоліл, ізобензофураніл, фураніл, тіофеніл, тіазоліл, оксазоліл, ізоксазоліл, тіазоліл, піразоліл, ізотіазоліл, піридил, піридазиніл, піразиніл, піримідиніл, піридоніл, тіазоліл, нафтиридиніл і нафтиридиноніл. Гетероарильний компонент необов'язково може бути моно або полізаміщеним, як визначено раніше. 1 Переважно R вибраний із групи, що складається з водню, C1-C6алкілу, C2-C6алкенілу, C2C6алкінілу, C3-C6циклоалкілу, C1-C6галогеналкілу, C1-C6алкокси-C1-C3алкілу та C3-C6циклоалкіл1 C1-C3алкілу. У більш переважному варіанті здійснення R вибраний із групи, що складається з 3 UA 114094 C2 C1-C4алкілу, циклопропілу, дифторметилу, циклопропілметилу-, вінілу та пропаргілу, при цьому метил є особливо переважним. 2 Переважно R вибраний із групи, що складається з A1a, A1b, A1c, A1d, A1e, A1f, A1g, A1h, A2a, A2b, A3a, A3b і A3b: 5 (A1b) (A1a) (A1d) (A1c) (A1g) (A1e) (A1h) (A1f) (A2b) (A2a) (A3a) (A3c) (A3b) , 5 10 15 20 25 30 35 6 7 8 9 13 де R , R , R , R , R та R визначені вище, і n дорівнює 0, 1, 2 або 3. 2 Більш переважно R вибраний із групи, що складається з фенілу (наприклад, A1a), 3піридилу (наприклад, A1c), N-піридонілу (наприклад, A2a) і 3-зв'язаного [1,8]нафтиридинілу 2 (наприклад, A1d). Ще більш переважно R являє собою феніл (наприклад, A1a). 3 Переважно R вибраний із групи, що складається з водню, галогену, ціано, C 1-C6алкілу, C23 C6алкенілу, C2-C6алкінілу, C1-C6галогеналкілу та C1-C6алкіл-S(O)p-. Більш переважно R вибраний із групи, що складається з водню, галогену та C 1-C6алкілу, найбільш переважним є водень або метил. 4 R переважно являє собою водень. 3 4 R та R обоє переважно являють собою водень. 5 R переважно вибраний із групи, що складається з гідроксилу, галогену, C1-C6алкілу, C1C6циклоалкілу, C1-C6галогеналкілу, C1-C6алкенілу, C1-C6алкінілу, C1-C6алкокси, C1-C6алкокси-C1C3алкілу, C1-C6алкокси-C2-C6алкокси, C1-C6алкокси-C2-C6алкокси-C1-C3алкілу, C1C6галогеналкокси, C1-C6галогеналкокси-C1-C3алкілу, C1-C6алкіл-S(O)p-, C1-C6галогеналкіл-S(O)p-, арилу, арилокси, гетероциклілу, гетероцикліл-C1-C3алкокси-C1-C3алкілу, C1-C3алкіламіно-, C1C3діалкіламіно-, C1-C3алкіламіно-S(O)p-, C1-C3алкіламіно-S(O)p-C1-C3алкілу-, C1-C3діалкіламіноS(O)p-, C1-C3діалкіламіно-S(O)p-C1-C3алкілу-, C1-C3алкіламінокарбонілу-, C1C3діалкіламінокарбонілу-, C1-C3діалкіламінокарбоніл-C1-C3алкілу-, C1-C3алкілкарбоніламіно-, C1C3алкіл-S(O)p-аміно-, ціано та нітро, де вказані гетероцикліли являють собою п'яти- або шестичленні гетероцикліли, що містять від одного до трьох гетероатомів, кожний з яких незалежно вибраний із групи, що складається з кисню, азоту та сірки, і де арильні або гетероциклільні компоненти необов'язково можуть бути заміщені одним або декількома замісниками, вибраними із групи, що складається з галогену, C1-C3алкілу, C1-C3галогеналкілу, C1-C3 алкокси, C1-C3галогеналкокси, ціано і нітро. 5 Терміни "арил" і "гетероцикліл" додатково визначені вище. Однак у контексті R особливо переважними є феніл, бензил, ізоксазолініл, піримідиніл, морфолініл, фурил і тіофеніл. 5 Більш переважно R вибраний із групи, яка складається із хлору, фтору, метилу, трифторметилу, 2-фторетилу-, метоксіетоксиметилу-, трифторметоксиметилу-, метил-S(O)p-, 4 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 арилу, ізоксазолінілу, морфолінілу, метил-S(O)p-диметиламіно-, ціано та нітро, де арильні або гетероциклільні компоненти необов'язково можуть бути заміщені одним або декількома замісниками, вибраними із групи, що складається з хлору, метилу та трифторметилу. Найбільш 5 переважно R вибраний із групи, що складається з метилу, метил-S(O)2- і трифторметилу. 6 Переважно R вибраний із групи, що складається з водню, галогену, C 1-C6алкілу, C1C6галогеналкілу, C1-C6алкіл-S(O)p-, C1-C6циклоалкілу, C2-C6алкенілу, C2-C6галогеналкенілу, C2C6алкінілу, C1-C6алкоксі-, C1-C6галогеналкокси, C2-C6алкенілоксі-, C3-C6циклоалкілC1-C3-алкілу-, C1-C6алкокси-C1-C3алкілу-, C1-C6алкокси-C2-C6алкоксі-, нітро та фенілу, де феніл необов'язково може бути заміщений одним або декількома замісниками, вибраними із групи, що складається з галогену, C1-C3алкілу, C1-C3галогеналкілу, C1-C3алкокси, C1-C3галогеналкокси, C1-C6алкіл-S(O)p-, 6 фенілу, ціано та нітро. Більш переважно R вибраний із групи, що складається з водню, галогену, C1-C6алкілу, C1-C6галогеналкілу, C1-C6алкіл-S(O)p-, C2-C6алкенілу та C2-C6алкінілу. 7 Переважно R вибраний із групи, що складається з водню, галогену та C1-C3алкілу-. 8 Переважно R вибраний із групи, що складається з водню, галогену та C1-C3алкілу-. 9 Переважно R вибраний із групи, що складається з водню, галогену, C 1-C6алкілу, C1C6галогеналкілу, C1-C6алкіл-S(O)p-, C1-C6циклоалкілу, C2-C6алкенілу, C2-C6галогеналкенілу, C2C6алкінілу, C1-C6алкоксі-, C1-C6галогеналкокси, C2-C6алкенілоксі-, C3-C6циклоалкілC1-C3-алкілу-, C1-C6алкокси-C1-C3алкілу-, C1-C6алкокси-C2-C6алкоксі-, нітро та фенілу, де феніл необов'язково може бути заміщений одним або декількома замісниками, вибраними із групи, що складається з галогену, C1-C3алкілу, C1-C3галогеналкілу, C1-C3алкокси, C1-C3галогеналкокси, C1-C6алкіл-S(O)p-, 9 фенілу, ціано та нітро. Більш переважно R вибраний із групи, що складається з водню, галогену, C1-C6алкілу, C1-C6галогеналкілу, C1-C6алкіл-S(O)p-, C2-C6алкенілу та C2-C6алкінілу. Сполуки формули I можуть містити асиметричні центри та можуть бути представлені у вигляді єдиного енантіомера, пар енантіомерів у будь-якій пропорції або, за наявності більше одного асиметричного центру, містити діастереоізомери в усіх можливих співвідношеннях. Як правило, один з енантіомерів має підвищену біологічну активність у порівнянні з іншими варіантами. Аналогічно, у випадку дизаміщених алкенів, вони можуть бути представлені в E або Z формі або у вигляді сумішей обох у будь-якій пропорції. Більше того, сполуки формули I можуть перебувати в стані рівноваги з альтернативними гідроксильними таутомерними формами. Слід розуміти, що всі таутомерні форми (окремий таутомер або їх суміші), рацемичні суміші та окремі ізомери охоплюються об'ємом даного винаходу. Даний винахід також включає агрономічно прийнятні солі, які сполуки формули I можуть утворювати з амінами (наприклад, аміаком, диметиламіном і триетиламіном), основами лужного металу та лужно-земельного металу або четвертинними амонієвими основами. Серед гідроксидів, оксидів, алкоксидів і гідрокарбонатів лужних металів і лужно-земельних металів, застосовуваних у якості солеутворювачів, особливу увагу слід приділити гідроксидам, алкоксидам, оксидам і карбонатам літію, натрію, калію, магнію та кальцію, але особливо гідроксидам, алкоксидам, оксидам і карбонатам натрію, магнію та кальцію. Також можна застосовувати відповідну триметилсульфонієву сіль. Сполуки формули (I) за даним винаходом самі по собі можна застосовувати в якості гербіцидів, але зазвичай їх складають у гербіцидні композиції із застосуванням допоміжних засобів для складання, таких як носії, розчинники та поверхнево-активні речовини (SFA). Таким чином, даний винахід додатково передбачає гербіцидну композицію, що містить гербіцидну сполуку за кожним з попередніх пунктів, і прийнятний з точки зору сільського господарства допоміжний засіб для складання. Композиція може бути представлена у формі концентратів, які розводять перед застосуванням, хоча також можуть бути одержані готові до застосування композиції. Кінцеве розведення зазвичай здійснюють за допомогою води, але замість води або на додаток до води, розведення можна здійснити за допомогою, наприклад, рідких добрив, мікроелементів, біологічних організмів, масел або розчинників. Гербіцидні композиції, як правило, містять від 0,1 до 99 ваг. %, зокрема, від 0,1 до 95 ваг. % сполук формули I і від 1 до 99,9 ваг. % допоміжного засобу для складання, який переважно включає від 0 до 25 ваг. % поверхнево-активної речовини. Композиції можна вибрати з ряду типів сполук, багато з яких відомі з Manual on Development and Use of FAO Specifications for Plant Protection Products, 5th Edition, 1999. Такі включають порошки для розпилення (DP), розчинні порошки (SP), розчинні у воді гранули (SG), здатні до диспергування у воді гранули (WG), змочувані порошки (WP), гранули (GR) (з повільним або швидким вивільненням), розчинні концентрати (SL), рідини, що змішуються з маслом (OL), рідини, застосовувані в ультранизькому об'ємі (UL), здатні до емульгування концентрати (EC), 5 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 здатні до диспергування концентрати (DC), емульсії (як "масло у воді" (EW), так і "вода в маслі" (EO)), мікроемульсії (ME), суспензійні концентрати (SC), аерозолі, капсульовані суспензії (CS) і сполуки для обробки насіння. Вибраний тип складу в кожному разі буде залежати від конкретного передбачуваного призначення, а також фізичних, хімічних і біологічних властивостей сполуки формули (I). Порошки, що розпорошуються (DP), можуть бути одержані змішуванням сполуки формули (I) з одним або декількома твердими розріджувачами (наприклад, природними глинами, каоліном, пірофілітом, бентонітом, глиноземом, монтморилонітом, кізельгуром, крейдою, діатомовою землею, фосфатами кальцію, карбонатами кальцію та магнію, сіркою, вапном, тонкодисперсними порошками, тальком та іншими органічними та неорганічними твердими носіями) і механічним подрібненням суміші в дрібний порошок. Розчинні порошки (SP) можуть бути одержані змішуванням сполуки формули (I) з однією або декількома розчинними у воді неорганічними солями (такими як натрію бікарбонат, натрію карбонат або магнію сульфат) або з одним або декількома розчинними у воді органічними твердими речовинами (такими як полісахарид) і необов'язково з одним або декількома змочувальними засобами, одним або декількома диспергуючими засобами або сумішшю вказаних засобів для поліпшення диспергованості/розчинності у воді. Суміш потім подрібнюють до дрібного порошку. Подібні композиції можна також гранулювати для одержання розчинних у воді гранул (SG). Розчинні порошки (WP) можуть бути одержані змішуванням сполуки формули (I) з одним або декількома твердими розріджувачами або носіями, з одним або декількома змочувальними засобами та переважно одним або декількома диспергуючими засобами, а також необов'язково з одним або декількома суспендуючими засобами для забезпечення дисперсії в рідинах. Суміш потім подрібнюють у дрібний порошок. Подібні композиції можна також гранулювати для одержання здатних до диспергування у воді гранул (WG). Гранули (GR) можуть бути утворені або гранулюванням суміші сполуки формули (I) і одного або декількох порошкових твердих розріджувачів або носіїв, або з попередньо утворених порожніх гранул шляхом абсорбування сполуки формули (I) (або її розчину в прийнятному засобі) у пористий матеріал гранули (такий як пемза, атапульгітові глини, фулерова земля, кізельгур, діатомітові землі або подрібнені кукурудзяні качани), або шляхом адсорбції сполуки формули (I) (або її розчину в прийнятному засобі) на матеріалі твердого ядра (такому як піски, силікати, мінеральні карбонати, сульфати або фосфати) і сушіння, якщо необхідно. Засоби, які зазвичай використовують для абсорбції або адсорбції, включають розчинники (такі як аліфатичні та ароматичні нафтові розчинники, спирти, ефіри, кетони та естери) і клейкі засоби (такі як полівінілацетати, полівінілові спирти, декстрини, цукри та рослинні олії). У гранулах також може міститися одна або декілька інших добавок (наприклад, емульгуючий засіб, змочувальний засіб або диспергуючий засіб). Здатні до диспергування концентрати (DC) можуть бути одержані шляхом розчинення сполуки формули (I) у воді або органічному розчиннику, такому як кетон, спирт або гліколевий ефір. Ці розчини можуть містити поверхнево-активний засіб (наприклад, для поліпшення розведення водою або запобігання кристалізації в резервуарі обприскувача). Здатні до емульгування концентрати (EC) або емульсії масло-в-воді (EW) можна одержати шляхом розчинення сполуки формули (I) в органічному розчиннику (який необов'язково містить один або декілька змочувальних засобів, один або декілька емульгуючих засобів або суміш вказаних засобів). Прийнятні для застосування в EC органічні розчинники включають ароматичні вуглеводні (такі як алкіл бензоли або алкілнафталіни, наприклад, SOLVESSO 100, SOLVESSO 150 і SOLVESSO 200; SOLVESSO є зареєстрованою торговельною маркою), кетони (такі як циклогексанон або метилциклогексанон) і спирти (такі як бензиловий спирт, фурфуриловий спирт або бутанол), N-алкілпіролідони (такі як N-метилпіролідон або Nоктилпіролідон), диметиламіди жирних кислот (такі як C 8-C10диметиламід жирної кислоти) і хлоровані вуглеводні. EC-продукт може спонтанно емульгуватися при додаванні у воду з утворенням емульсії з достатньою стабільністю, що дає змогу застосовувати розпилення за допомогою прийнятного устаткування. Приготування EW включає одержання сполуки формули (I) або у вигляді рідини (якщо вона не є рідиною при кімнатній температурі, її можна розплавити при помірній температурі, зазвичай нижче 70 °C), або в розчині (шляхом розчинення її в прийнятному розчиннику), а потім емульгування одержаної рідини або розчину у воді, що містить один або декілька SFA, при високому зсувному зусиллі з одержанням емульсії. Прийнятні розчинники для застосування в EW включають рослинні олії, хлоровані вуглеводні (такі як хлорбензоли), ароматичні 6 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчинники (такі як алкілбензоли або алкілнафталіни) та інші відповідні органічні розчинники, які мають низьку розчинність у воді. Мікроемульсії (ME) можна приготувати шляхом змішування води із сумішшю одного або декількох розчинників з одним або декількома SFA зі спонтанним одержанням термодинамічно стабільного ізотропного рідкого складу. Сполука формули (I) спочатку присутня або у воді, або в суміші розчинника з SFA. Прийнятні для застосування в ME розчинники включають ті, які перераховані в даному документі вище для застосування в EC або в EW. ME може бути системою або масло-в-воді, або вода-в-маслі (те, яка система присутня, можна визначити шляхом вимірювань електричної провідності) і може бути прийнятною для змішування розчинних у воді та розчинних у маслі пестицидів у тому самому складі. ME є прийнятною для розведення у воді, або залишаючись у вигляді мікроемульсії, або утворюючи звичайну емульсію олія-у-воді. Суспензійні концентрати (SC) можуть містити водні або неводні суспензії тонко подрібнених нерозчинних твердих частинок сполуки формули (I). SC можуть бути одержані шляхом помелу на кульовому або бісерному млині твердої сполуки формули (I) у прийнятному середовищі необов'язково з одним або декількома диспергуючими засобами з одержанням суспензії дрібних частинок даної сполуки. В композицію можна включити один або декілька змочувальних засобів, а також можна включити суспендуючий засіб для зниження швидкості, з якою частинки осідають. У якості альтернативи сполуку формули (I) можна помолоти сухою і додати у воду, що містить описані вище засоби, з одержанням бажаного кінцевого продукту. Аерозольні склади містять сполуку формули (I) і прийнятний газ-витискувач (наприклад, нбутан). Сполуку формули (I) також можна розчинити або диспергувати у прийнятному середовищі (наприклад, у воді або змішуваній з водою рідині, такій як н-пропанол) із одержанням композицій для застосування в насосах для обприскування з ручним керуванням, що не перебувають під тиском. Капсульні суспензії (CS) можуть бути одержані подібно приготуванню складів EW, але з додатковим етапом полімеризації задля одержання водної дисперсії крапель масла, у якій кожна крапля масла інкапсулюється полімерною оболонкою та містить сполуку формули (I) і необов'язково її носій або розріджувач. Полімерна оболонка може бути одержана або шляхом реакції міжфазної поліконденсації, або шляхом процедури коацервації. Композиції можуть бути передбачені для контрольованого вивільнення сполуки формули (I) і вони можуть застосовуватися для обробки насіння. Для забезпечення повільного контрольованого вивільнення сполуки, сполука формули (I) також може бути складена в полімерну матрицю, що біологічно розкладається. Композиція може включати одну або декілька добавок для поліпшення біологічної дії композиції, наприклад, шляхом поліпшення змочування, утримання на поверхнях або розподілу по поверхнях; стійкості до змивання дощем з оброблених поверхонь; або поглинання або рухливості сполуки формули (I). Такі добавки включають поверхнево-активні засоби (SFA), добавки для обприскування на основі масел, наприклад, певних мінеральних масел або природних рослинних олій (таких як соєва та рапсова олія), та їх суміші з іншими біопідсилювальними допоміжними засобами (інгредієнтами, які можуть сприяти або модифікувати дію сполуки формули (I)). Змочувальними засобами, диспергуючими засобами та емульгуючими засобами можуть бути SFA катіоногенного, аніоногенного, амфотерного або неіоногенного типу. Прийнятні SFA катіоногенного типу включають четвертинні амонійні сполуки (наприклад, цетилтриметиламонію бромід), імідазоліни та солі амінів. Прийнятні аніоногенні SFA включають солі жирних кислот з лужними металами, солі аліфатичних моноестерів сірчаної кислоти (наприклад, лаурилсульфат натрію), солі сульфованих ароматичних сполук (наприклад, додецилбензолсульфонат натрію, додецилбензолсульфонат кальцію, бутилнафталінсульфонат і суміші ди-ізопропіл- і триізопропіл-нафталінсульфонатів натрію), ефірсульфати, ефірсульфати спирту (наприклад, лаурет-3-сульфат натрію), ефіркарбоксилати (наприклад, лаурет-3-карбоксилат натрію), фосфатні естери (продукти реакції між одним або декількома жирними спиртами та фосфорною кислотою (переважно моноестери) або пентоксид фосфору (переважно діестери), наприклад, реакції між лауриловим спиртом і тетрафосфорною кислотою; ці продукти додатково можуть бути етоксиловані), сульфосукцинамати, парафін- або олефін-сульфонати, таурати та лігносульфонати. Прийнятні SFA амфотерного типу включають бетаїни, пропіонати та гліцинати. Прийнятні SFA неіоногенного типу включають продукти конденсації алкіленоксидів, таких як етиленоксид, пропіленоксид, бутиленоксид або їх суміші, з жирними спиртами (такими як 7 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 олеїловий спирт або цетиловий спирт) або з алкілфенолами (такими як октилфенол, нонілфенол або октилкрезол); неповні естери, одержані із довголанцюгових жирних кислот або ангідридів гекситолу; продукти конденсації вказаних неповних естерів з етиленоксидом; блокполімери (які містять етиленоксид і пропіленоксид); алканоламіди; естери (наприклад, поліетиленгліколеві естери жирних кислот); аміноксиди (наприклад, лаурилдиметиламіноксид) і лецитини. Прийнятні суспендуючі засоби включають гідрофільні колоїди (такі як полісахариди, полівінілпіролідон або карбоксиметилцелюлоза натрію) і глини, що розбухають (такі як бентоніт або атапульгіт). Композиція за даним винаходом може додатково містити щонайменше один додатковий пестицид. Наприклад, сполуки за даним винаходом також можна застосовувати в комбінації з іншими гербіцидами або регуляторами росту рослин. У переважному варіанті здійснення додатковим пестицидом є гербіцид та/або антидот гербіциду. Прикладами таких сумішей (у яких "I" представляє сполуку формули I) є I + ацетохлор, I + ацифлуорфен, I + ацифлуорфен-натрій, I + аклоніфен, I + акролеїн, I + алахлор, I + алоксидим, I + аметрин, I + амікарбазон, I + амідосульфурон, I + амінопіралід, I + амітрол, I + анілофос, I + асулам, I + атразин, I + азафенідин, I + азимсульфурон, I+BCPC, I + бефлубутамід, I + беназолін, I + бенкарбазон, I + бенфлуралін, I + бенфуресат, I + бенсульфурон, I + бенсульфурон-метил, I + бенсулід, I + бентазон, I + бензфендизон, I + бензобіциклон, I + бензофенап, I + біциклопірон, I + біфенокс, I + біланафос, I + біспірибак, I + біспірибак-натрій, I + боракс, I + бромацил, I + бромбутид, I + бромоксиніл, I + бутахлор, I + бутаміфос, I + бутралін, I + бутроксидим, I + бутилат, I + какодилова кислота, I + кальцій хлорат, I + кафенстрол, I + карбетамід, I + карфентразон, I + карфентразон-етил, I + хлорфлуренол, I + хлорфлуренол-метил, I + хлоридазон, I + хлоримурон, I + хлоримурон-етил, I + хлороцтова кислота, I + хлортолурон, I + хлорпрофам, I + хлорсульфурон, I + хлортал, I + хлортал-диметил, I + цинідон-етил, I + цинметилін, I + циносульфурон, I + цисанілід, I + клетодим, I + клодинафоп, I + клодинафоп-пропаргіл, I + кломазон, I + кломепроп, I + клопіралід, I + клорансулам, I + клорансулам-метил, I + ціаназин, I + циклоат, I + циклосульфамурон, I + циклоксидим, I + цигалофоп, I + цигалофоп-бутил, I+2,4-D, I + даїмурон, I + далапон, I + дазомет, I+2,4-DB, I+I + десмедифам, I + дикамба, I + дихлобеніл, I + дихлорпроп, I + дихлорпроп-P, I + диклофоп, I + диклофоп-метил, I + диклосулам, I + дифензокват, I + дифензокват метилсульфат, I + дифлуфенікан, I + дифлуфензопір, I + димефурон, I + димепіперат, I + диметахлор, I + диметаметрин, I + диметенамід, I + диметенамід-P, I + диметипін, I + диметиларсинова кислота, I + динітрамін, I + динотерб, I + дифенамід, I + дипропетрин, I + дикват, I + дикват дибромід, I + дитіопір, I + діурон, I + ендотал, I+EPTC, I + еспрокарб, I + еталфлуралін, I + етаметсульфурон, I + етаметсульфурон-метил, I + етефон, I + етофумесат, I + етоксифен, I + етоксисульфурон, I + етобензанід, I + феноксапропP, I + феноксапроп-P-етил, I + фентразамід, I + сульфат заліза, I + флампроп-M, I + флазасульфурон, I + флорасулам, I + флуазифоп, I + флуазифоп-бутил, I + флуазифоп-P, I + флуазифоп-P-бутил, I + флуазолат, I + флукарбазон, I + флукарбазон-натрій, I + флуцетосульфурон, I + флухлоралін, I + флуфенацет, I + флуфенпір, I + флуфенпір-етил, I + флуметралін, I + флуметсулам, I + флуміклорак, I + флуміклорак-пентил, I + флуміоксазин, I + флуміпропін, I + флуометурон, I + фторглікофен, I + фторглікофен-етил, I + флуоксапроп, I + флупоксам, I + флупропацил, I + флупропанат, I + флупірсульфурон, I + флупірсульфуронметил-натрій, I + флуренол, I + флуридон, I + флурохлоридон, I + флуроксипір, I + флуртамон, I + флутіацет, I + флутіацет-метил, I + фомесафен, I + форамсульфурон, I + фосамін, I + глуфосинат, I + глуфосинат-амоній, I + гліфосат, I + галосульфурон, I + галосульфурон-метил, I + галоксифоп, I + галоксифоп-P, I + гексазинон, I + імазаметабенз, I + імазаметабенз-метил, I + імазамокс, I + імазапік, I + імазапір, I + імазаквін, I + імазетапір, I + імазосульфурон, I + інданофан, I + індазифлам, I + йодометан, I + йодосульфурон, I + йодосульфурон-метил-натрій, I + іоксиніл, I + ізопротурон, I + ізоурон, I + ізоксабен, I + ізоксахлортол, I + ізоксафлутол, I + ізоксапірифоп, I + карбутилат, I + лактофен, I + ленацил, I + лінурон, I + мекопроп, I + мекопропP, I + мефенацет, I + мефлуїдид, I + мезосульфурон, I + мезосульфурон-метил, I + мезотріон, I + метам, I + метаміфоп, I + метамітрон, I + метазахлор, I + метабензтіазурон, I + метазол, I + метиларсонова кислота, I + метилдимрон, I + метил ізотіоціанат, I + метолахлор, I+Sметолахлор, I + метосулам, I + метоксурон, I + метрибузин, I + метсульфурон, I + метсульфурон-метил, I + молінат, I + монолінурон, I + напроанілід, I + напропамід, I + напталам, I + небурон, I + нікосульфурон, I + н-метил гліфосат, I + нонанова кислота, I + норфлуразон, I + олеїнова кислота (жирні кислоти), I + орбенкарб, I + ортосульфамурон, I + оризалін, I + оксадіаргіл, I + оксадіазон, I + оксасульфурон, I + оксазикломефон, I + оксифлуорфен, I + паракват, I + паракват дихлорид, I + пебулат, I + пендиметалін, I + пеноксулам, I + 8 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 пентахлорфенол, I + пентанохлор, I + пентоксазон, I + петоксамід, I + фенмедифам, I + піклорам, I + піколінафен, I + піноксаден, I + піперофос, I + претилахлор, I + примісульфурон, I + примісульфурон-метил, I + продіамін, I + профоксидим, I + прогексадіон-кальцій, I + прометон, I + прометрин, I + пропахлор, I + пропаніл, I + пропаквізафоп, I + пропазин, I + профам, I + пропізохлор, I + пропоксикарбазон, I + пропоксикарбазон-натрій, I + пропізамід, I + просульфокарб, I + просульфурон, I + піраклоніл, I + пірафлуфен, I + пірафлуфен-етил, I + пірасульфотол, I + піразолінат, I + піразосульфурон, I + піразосульфурон-етил, I + піразоксифен, I + пірибензоксим, I + пірибутикарб, I + піридафол, I + піридат, I + пірифталід, I + піримінобак, I + піримінобак-метил, I + піримісульфан, I + піритіобак, I + піритіобак-натрій, I + піроксасульфон, I + піроксулам, I + квінклорак, I + квінмерак, I + квінокламін, I + квізалофоп, I + квізалофоп-P, I + римсульфурон, I + сафлуфенацил, I + сетоксидим, I + сидурон, I + симазин, I + симетрин, I + хлорат натрію, I + сулькотріон, I + сульфентразон, I + сульфометурон, I + сульфометуронметил, I + сульфосат, I + сульфосульфурон, I + сірчана кислота, I + тебутіурон, I + тефурилтріон, I + темботріон, I + тепралоксидим, I + тербацил, I + тербуметон, I + тербутилазин, I + тербутрин, I + тенілхлор, I + тіазопір, I + тифенсульфурон, I + тієнкарбазон, I + тифенсульфурон-метил, I + тіобенкарб, I + топрамезон, I + тралкоксидим, I + триалат, I + триасульфурон, I + триазифлам, I + трибенурон, I + трибенурон-метил, I + триклопір, I + триетазин, I + трифлоксисульфурон, I + трифлоксисульфурон-натрій, I + трифлуралін, I + трифлусульфурон, I + трифлусульфурон-метил, I + тригідрокситриазин, I + тринексапак-етил, I + тритосульфурон, I + етиловий естер [3-[2-хлор-4-фтор-5-(1-метил-6-трифторметил-2,4-діоксо1,2,3,4-тетрагідропіримідин-3-іл)фенокси]-2-піридилоксі]оцтової кислоти (CAS RN 353292-31-6). Сполуки за даним винаходом можна також комбінувати з гербіцидними сполуками, розкритими в WO06/024820 та/або WO07/096576. Компоненти, що змішуються зі сполукою формули I, можуть також перебувати у формі естерів або солей, які згадані, наприклад, в The Pesticide Manual, Fourteenth Edition, British Crop Protection Council, 2006. Сполуку формули I також можна застосовувати в сумішах з іншими агрохімічними засобами, такими як фунгіциди, нематициди або інсектициди, приклади яких наведені в The Pesticide Manual. Співвідношення в суміші сполуки формули I та компонента, що змішується з нею, переважно становить від 1:100 до 1000:1. Суміші переважно можна застосовувати в згаданих вище складах (у випадку чого вираз "активний інгредієнт" стосується відповідної суміші сполуки формули I та компонента, що змішується з нею). Сполуки формули I відповідно до даного винаходу можна також застосовувати в комбінації з одним або декількома антидотами. Аналогічно, суміші сполуки формули I відповідно до даного винаходу з одним або декількома додатковими гербіцидами також можна застосовувати в комбінації з одним або декількома антидотами. Антидотами можуть бути AD 67 (MON 4660), беноксакор, клоквінтосет-мексил, ципросульфамід (CAS RN 221667-31-8), дихлормід, фенхлоразол-етил, фенклорим, флуксофенім, фурилазол і відповідний R-ізомер, ізоксадифенетил, мефенпір-діетил, оксабетриніл, N-ізопропіл-4-(2-метокси-бензоїлсульфамоїл)-бензамід (CAS RN 221668-34-4). Інші можливі варіанти включають сполуки-антидоти, розкриті, наприклад, в EP0365484, наприклад, N-(2-метоксибензоїл)-4[(метиламінокарбоніл)аміно]бензолсульфонамід. Особливо переважними є суміші сполуки формули I із ципросульфамідом, ізоксадифен-етилом, клоквінтосет-мексилом та/або N-(2метоксибензоїл)-4-[(метил-амінокарбоніл)аміно]бензолсульфонамідом. Антидоти сполуки формули I також можуть перебувати у формі естерів або солей, як th згадується, наприклад, в The Pesticide Manual, 14 Edition (BCPC), 2006. Посилання на клоквінтосет-мексил також стосується його літієвої, натрієвої, калієвої, кальцієвої, магнієвої, алюмінієвої, залізної, амонієвої, четвертинної амонієвої, сульфонової або фосфонієвої солі, як розкрито в WO 02/34048, а посилання на фенхлоразол-етил також стосується фенхлоразолу і т. д. Переважне співвідношення в суміші сполуки формули I і антидоту становить від 100:1 до 1:10, переважно від 20:1 до 1:1. Суміші можна переважно застосовувати у вищезгаданих складах (у випадку чого вираз "активний інгредієнт" стосується відповідної суміші сполуки формули I та антидоту). Даний винахід, крім того, додатково передбачає спосіб вибіркової боротьби з бур'янами в місцеположенні культурних рослин і бур'янів, при цьому спосіб включає застосування щодо місцеположення достатньої для боротьби з бур'янами кількості композиції за даним винаходом. "Боротьба" означає знищення, зменшення або вповільнення росту, або запобігання або 9 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 зменшення проростання. Зазвичай рослинами, з якими необхідно боротися, є небажані рослини (бур'яни). "Місце розташування" означає територію, на якій рослини ростуть або будуть рости. Норми внесення сполук формули I можуть варіювати в широких межах і залежать від природи ґрунту, способу застосування (до або після появи сходів; протруювання насіння; застосування щодо борозни для насіння; застосування безорної обробки і т. д.), культурної рослини, бур'яну(бур'янів), з яким(и) необхідно боротися, переважаючих кліматичних умов та інших факторів, за якими регулюють спосіб застосування, час застосування та цільову культуру. Сполуки формули I за даним винаходом зазвичай вносять із нормою від 10 до 2000 г/га, переважно від 50 до 1000 г/га. Застосування зазвичай здійснюють шляхом розпилення композиції, як правило, за допомогою навісного на тракторі розпилювача для великих територій, але також можна застосовувати інші способи, такі як обпилення (для порошків), краплинний полив або зрошення. Прийнятні рослини, щодо яких можна застосовувати композицію за даним винаходом, включають сільськогосподарські культури, такі як зернові, наприклад, ячмінь і пшеницю, бавовник, олійний рапс, соняшник, маїс, рис, сою, цукровий буряк, цукровий очерет і дерновий покрив. Маїс є особливо переважним. Культурні рослини можуть також включати дерева, такі як фруктові дерева, пальмові дерева, кокосові пальми та інші горіхи. Також включені виткі рослини, такі як виноград, плодові чагарники, фруктові рослини та овочі. Під сільськогосподарськими культурами також слід розуміти сільськогосподарські культури, яким була надана толерантність до гербіцидів або класів гербіцидів (наприклад, ALS-, GS-, EPSPS-, PPO-, ACCаза- і HPPD-інгібітори) за допомогою традиційних способів селекції або за допомогою генетичної інженерії. Прикладом культури, якій надали толерантність до імідазолінонів, наприклад, до імазамоксу, за допомогою загальноприйнятих способів селекції, є капуста польова Clearfield® (канола). Прикладами сільськогосподарських культур, яким надали толерантність до гербіцидів за допомогою застосування способів генної інженерії, включають, наприклад, стійкі до гліфосату та глюфосинату сорти маїсу, комерційно доступні під торговельними назвами RoundupReady® і LibertyLink®. У переважному варіанті здійснення культурній рослині надають толерантність до HPPDінгібіторів за допомогою генетичної інженерії. Способи надання культурним рослинам толерантності до HPPD-інгібіторів відомі, наприклад, з WO0246387. Таким чином, у ще більш переважному варіанті здійснення культурна рослина є трансгенною у відношенні полінуклеотиду, що містить послідовність ДНК, яка кодує стійкий до HPPD-інгібітора HPPDфермент, одержаний з бактерії, більш конкретно, з Pseudomonas fluorescens або Shewanella colwelliana, або з рослини, більш конкретно, одержаний з однодольної рослини або, ще більш конкретно, з ячменю, маїсу, пшениці, рису, видів Brachiaria, Chenchrus, Lolium, Festuca, Setaria, Eleusine, Sorghum або Avena. Під сільськогосподарськими культурами також розуміються такі, яким була надана стійкість до шкідливих комах за допомогою способів генної інженерії, наприклад, маїс Bt (стійкий до метелика кукурудзяного), бавовник Bt (стійкий до довгоносика бавовняного), а також картопля Bt (стійка до колорадського жука). Прикладами маїсу Bt є гібриди Bt 176 маїсу NK® (Syngenta Seeds). Токсин Bt являє собою білок, який природньо утворюється ґрунтовою бактерією Bacillus thuringiensis. Приклади токсинів або трансгенних рослин, здатних синтезувати такі токсини, описані в EP-A-451 878, EP-A-374 753, WO 93/07278, WO 95/34656, WO 03/052073 і EP-A-427 529. Прикладами трансгенних рослин, які містять один або декілька генів, що кодують стійкість до інсектицидів і експресують один або декілька токсинів, є KnockOut (маїс), Yield Gard (маїс), NuCOTIN33B (бавовник), Bollgard (бавовник), NewLeaf (картопля), NatureGard і Protexcta. Як рослинні сільськогосподарські культури, так і їх посівний матеріал можуть бути стійкими до гербіцидів і, у той же час, стійкими до поїдання комахами (трансгенні події "стекінгу"). Наприклад, насіння може мати здатність експресувати інсектицидний білок Cry3, у той самий час будучи толерантним до гліфосату. Під сільськогосподарськими культурами також слід розуміти культури, які одержані традиційними способами селекції або генетичної інженерії та мають так звані привнесені ознаки (наприклад, поліпшену стабільність при зберіганні, більш високу поживну цінність та поліпшений смак). Інші прийнятні рослини включають трави дернового покриву, наприклад, на гольфмайданчиках, галявинах, у парках і на узбіччях дороги, або комерційно вирощувані для газону, і декоративні рослини, такі як квіти або чагарники. Композиції можна застосовувати для боротьби з небажаними рослинами (збірно "бур'янами"). Бур'яни, що підлягають боротьбі, можуть бути як видами однодольних рослин, 10 UA 114094 C2 5 10 наприклад, Agrostis, Alopecurus, Avena, Brachiaria, Bromus, Cenchrus, Cyperus, Digitaria, Echinochloa, Eleusine, Lolium, Monochoria, Rottboellia, Sagittaria, Scirpus, Setaria і Sorghum, так і видами дводольних рослин, наприклад, Abutilon, Amaranthus, Ambrosia, Chenopodium, Chrysanthemum, Conyza, Galium, Ipomoea, Nasturtium, Sida, Sinapis, Solanum, Stellaria, Veronica, Viola і Xanthium. Бур'яни також можуть включати рослини, які можна вважати культурними рослинами, але які ростуть за межами посівної площі ("утікачі"), або які виросли із насіння, що залишилося від попереднього посіву іншої сільськогосподарської культури ("рослини-самосіви"). Такі рослини-самосіви або втікачі можуть бути толерантними до деяких інших гербіцидів. Сполуки за даним винаходом можна одержати за допомогою наведених далі способів. Сполуки формули (1a) можуть бути одержані зі сполук формули (I), як показано на схемі реакції 1. Схема реакції 1 (Ia) (I) 15 20 4 Сполуки формули (Ia), у яких R являє собою водень, можуть бути одержані зі сполук 4 формули I, у яких R являє собою нижчий алкіл, наприклад метил, шляхом нагрівання з морфоліном (Nagashima, Hiromu et al. Heterocycles, 26(1), 1-4; 1987); Сполуки формули (I) можуть бути одержані зі сполук формули (2), як показано на схемі реакції 2. Схема реакції 2 (2) 25 30 35 (I) 4 2 Сполуки формули (I), у яких R являє собою нижчий алкіл, наприклад метил, і в яких R являє собою арил або гетероарил, можна одержати зі сполук формули (2) шляхом реакції із прийнятним металом або металоїдним похідним Y-M (наприклад, бороновою кислотою або естером, похідним триалкілолова, похідним цинку або реагентом Гріньяра) у присутності прийнятної основи (наприклад, неорганічної основи, такої як фосфат калію або фторид цезію), джерела металу (наприклад, джерела паладію, такого як Pd(OAc)2) і необов'язково ліганду для металу (наприклад, фосфінового ліганду) у прийнятному розчиннику (наприклад, в окремому розчиннику, такому як диметилформамід, або в системі змішаних розчинників, такій як суміш диметоксиетану і води або толуолу і води). Металевий каталізатор і ліганди також можна додавати у вигляді окремого, попередньо одержаного комплексу (наприклад, комплексу паладій/фосфін, такого як біс(трифенілфосфін)паладію дихлорид або дихлорметановий аддукт [1,1'-біс(дифенілфосфіно)фероцен]паладію дихлориду). Сполуки формули (2) можуть бути одержані зі сполук формули (3), як показано на схемі реакції 3. 11 UA 114094 C2 Схема реакції 3 (3) 5 10 (2) 4 Сполуки формули (2), у яких R являє собою нижчий алкіл, наприклад метил, можуть бути одержані зі сполук формули (3) шляхом реакції із прийнятним алкоксидом металу, наприклад метоксидом натрію, у прийнятному розчиннику, такому як діоксан; Сполуки формул (3) можуть бути одержані зі сполук формули (4), як показано на схемі реакції 4. Схема реакції 4 (4) 15 20 (3) Сполуки формули (3) можуть бути одержані зі сполуки формули (4) (4,5-дихлор-1Hпіридазин-6-ону - комерційно доступного) шляхом реакції із прийнятним алкілувальним засобом 1 R -X, де X являє собою групу, що відходить, таку як галід, наприклад метилйодид, у присутності прийнятної основи (наприклад, неорганічної основи, такої як карбонат калію) у прийнятному розчиннику, такому як N, N-диметилформамід. У якості альтернативи, сполуки формули (1) можуть бути одержані зі сполук формули (5), як показано на схемі реакції 5. Схема реакції 5 (5) 25 30 35 (1) 4 2 Сполуки формули (1), у яких R являє собою нижчий алкіл, наприклад метил, і в яких R являє собою арил або гетероарил, можуть бути одержані зі сполук формули (5) шляхом реакції 2 із прийнятним алкілувальним засобом R -X у присутності прийнятної основи (наприклад, неорганічної основи, такої як фосфат калію або фторид цезію), джерела металу (наприклад, джерела паладію, такого як Pd(OAc)2) і необов'язково ліганду для металу (наприклад, фосфінового ліганду) у прийнятному розчиннику (наприклад, в окремому розчиннику, такому як диметилформамід, або в системі змішаних розчинників, такій як суміш диметоксіетану і води або толуолу і води). Металевий каталізатор і ліганди також можна додавати у вигляді окремого, попередньо одержаного комплексу (наприклад, комплексу паладій/фосфін, такого як біс(трифенілфосфін)паладію дихлорид або дихлорметановий аддукт [1,1'біс(дифенілфосфіно)фероцен]паладію дихлориду). Сполуки формул (5) можуть бути одержані зі сполук формули (6), як показано на схемі реакції 6. 12 UA 114094 C2 Схема реакції 6 (5) (6) 5 10 15 20 4 Сполуки формули (5), у яких R являє собою нижчий алкіл, наприклад метил, можуть бути одержані зі сполук формули (6) шляхом реакції із прийнятною бороновою кислотою або естером, наприклад біс(пінаколато)дибором, у присутності прийнятної основи (наприклад, неорганічної основи, такої як фосфат калію або фторид цезію), джерела металу (наприклад, джерела паладію, такого як Pd2(dba)3 або Pd(OAc)2) і необов'язково ліганду для металу (наприклад, фосфінового ліганду, такого як трициклогексилфосфін) у прийнятному розчиннику (наприклад, в окремому розчиннику, такому як діоксан, або в системі змішаних розчинників, такій як суміш диметоксиетану і води або толуолу і води). Металевий каталізатор і ліганди також можна додавати у вигляді окремого, попередньо одержаного комплексу (наприклад, комплексу паладій/фосфін, такого як біс(трифенілфосфін)паладію дихлорид або дихлорметановий аддукт [1,1'-біс(дифенілфосфіно)фероцен]паладію дихлориду). Аналогічні реакції відомі з рівня техніки, наприклад, з Tetrahedron, 57(49), 9813-9816; 2001. 2 У якості альтернативи, сполуки формули (1c), у яких R являє собою азот-зв'язаний гетероцикл, наприклад, індол або піридон, можуть бути одержані зі сполук формули (3) або (4) як показано на схемі реакції 7. Схема реакції 7 (3) (7) (1b) (4) (1c) 25 30 Сполуки формули (7) і (1b) можуть бути одержані зі сполук формули (3) і (4), відповідно, шляхом реакції з азот-вмісним гетероциклом, таким як індол або піридон, у присутності прийнятної основи в прийнятному розчиннику. 4 Сполуки формули (1b), у яких R являє собою нижчий алкіл, наприклад метил, можуть бути одержані зі сполук формули (7), як описано на схемі реакції 3, а сполуки формули (1c) можуть бути одержані зі сполук формули (1b), як описано на схемі реакції 1. У якості альтернативи, сполуки формули (1c) можуть бути одержані безпосередньо зі сполук формули (7) шляхом реакції із прийнятним гідроксидом металу, таким як гідроксид калію, у прийнятному розчиннику, такому як водний метанол. 13 UA 114094 C2 Сполуки формул (1) можуть бути одержані зі сполук формули (8), як показано на схемі реакції 8. Схема реакції 8 5 (1) (8) 4 10 Сполуки формули (1), у яких R являє собою нижчий алкіл, наприклад метил, можуть бути 1 одержані зі сполук формули (8) шляхом реакції із прийнятним спиртом R OH у прийнятному розчиннику, такому як тетрагідрофуран, у присутності прийнятної добавки, такої як трифенілфосфін, і азодикарбоксилату, такого як діетилазодикарбоксилат (DEAD) або діізопропілазодикарбоксилат (DIAD). Сполуки формул (8) можуть бути одержані зі сполук формули (1d), як показано на схемі реакції 9. Схема реакції 9 15 (1d) (8) 1 20 25 Сполуки формули (8) можуть бути одержані зі сполук формули (1d), у яких R являє собою захисну групу, що вилучається, таку як п-метоксибензил, шляхом реакції із прийнятним окиснювальним засобом, таким як нітрат церію-амонію, в прийнятному розчиннику, такому як водний ацетонітрил. 1 Сполуки формули (1d), у яких R являє собою захисну групу, що вилучається, таку як пметоксибензил, можуть бути одержані з комерційно доступної сполуки (4) (4,5-дихлор-1Hпіридазин-6-ону) способом, аналогічним такому на схемах 2-4. Сполуки формули (3) можуть бути одержані зі сполук (9), як показано на схемі реакції 10. Схема реакції 10 (9) 30 35 40 (3) 3 Сполуки формули (3), у яких R являє собою, наприклад, алкіл, алкеніл або алкініл, також можуть бути одержані зі сполук (9), у яких X являє собою прийнятну групу, що відходить, таку як бромід, шляхом реакції із прийнятним металом або металоїдним похідним Y-M (наприклад, бороновою кислотою або естером, похідним триалкілолова, похідним цинку або реагентом Гріньяра) у присутності прийнятної основи (наприклад, неорганічної основи, такої як фосфат калію або фторид цезію), джерела металу (наприклад, джерела паладію, такого як Pd(OAc)2) і необов'язково ліганду для металу (наприклад фосфінового ліганду) у прийнятному розчиннику (наприклад, в окремому розчиннику, такому як діоксан, або в системі змішаних розчинників, такій як суміш диметоксіетану і води або толуолу і води). Металевий каталізатор і ліганди також можна додавати у вигляді окремого, попередньо одержаного комплексу (наприклад, комплексу паладій/фосфін, такого як біс(трифенілфосфін)паладію дихлорид або дихлорметановий аддукт [1,1'-біс(дифенілфосфіно)фероцен]паладію дихлориду). Сполуки формули (9) можуть бути одержані відомими способами. Сполуки формули (3) також можуть бути одержані як показано на схемі реакції 11. 14 UA 114094 C2 Схема реакції 11 (3) 5 10 3 Сполуки формули (3), у яких R являє собою водень, можуть бути одержані шляхом реакції 3,4-дихлор-2,5-фурандіону або 3,4-дибром-2,5-фурандіону із належним чином захищеним гідразином у прийнятному розчиннику, такому як водна хлористоводнева кислота. Аналогічні реакції відомі, наприклад, з Angewandte Chemie (1965), 77(7), 282-90; Synthetic Communications (2006), 36(18), 2719-2726. 2 Сполуки формули (I), у яких R являє собою C-зв'язаний піридон, можуть бути одержані зі сполук формули 2, як показано на схемі 12. Схема реакції 12 1h 2 1f 1g (Ie) 15 20 25 30 4 Сполуки формули 1h, у яких R являє собою нижчий алкіл, наприклад метил, можуть бути одержані зі сполук формули 2 шляхом реакції із прийнятним металевим або металоїдним похідним 2-метоксипіридину (наприклад, бороновою кислотою або естером, похідним триалкілолова, похідним цинку або реагентом Гріньяра) у присутності прийнятної основи (наприклад, неорганічної основи, такої як фосфат калію або фторид цезію), джерела металу (наприклад, джерела паладію, такого як Pd(OAc) 2) і необов'язково ліганду для металу (наприклад, фосфінового ліганду) у прийнятному розчиннику (наприклад, в окремому розчиннику, такому як диметилформамід, або в системі змішаних розчинників, такій як суміш диметоксіетану і води або толуолу і води). Металевий каталізатор і ліганди також можна додавати у вигляді окремого, попередньо одержаного комплексу (наприклад, комплексу паладій/фосфін, такого як біс(трифенілфосфін)паладію дихлорид або дихлорметановий аддукт [1,1'-біс(дифенілфосфіно)фероцен]паладію дихлориду). Сполука 1g може бути одержана зі сполуки 1h шляхом реакції з розведеною водною кислотою, такою як хлористоводнева кислота, необов'язково за допомогою нагрівання або за допомогою реакції в мікрохвилях, аналогічно відомим способам, таким як розкриті в Bioorganic & Medicinal Chemistry Letters, 18(9), 2967-2971; 2008. 15 UA 114094 C2 5 Сполуки формули 1f можуть бути одержані зі сполук формули 1g шляхом реакції із прийнятним арилйодидом у присутності йодиду міді, прийнятної основи, такої як трифосфат калію, у присутності прийнятного каталізатора, такого як тетрабутиламонію хлорид, у прийнятному розчиннику, такому як N, N-диметилформамід, необов'язково за допомогою нагрівання або за допомогою реакції в мікрохвилях. Аналогічні реакції відомі, наприклад, з Tet. Lett. 45 (2004) 4257-4260. Сполуки формули 1e можуть бути одержані зі сполук формули (1g), як описано на схемі реакції 1. Схема реакції 13 10 (Iaa) (Ia) 4 15 Сполуки формули (1aa), у яких R являє собою, наприклад, алкілкарбоніл, арилкарбоніл, алкоксикарбоніл, алкоксисульфоніл або арилсульфоніл, можуть бути одержані зі сполук 4 загальної формули (Ia), у яких R являє собою водень, шляхом реакції із прийнятним галідом, таким як ацетилхлорид, метилхлорформіат, етилтіохлорформіат або п-толуолсульфоніхлорид, у присутності прийнятної основи, такої як триетиламін або піридин, у присутності прийнятного розчинника, такого як дихлорметан або толуол. Схема реакції 14 20 11 10 1l 1k 12 1j 1i 2 Сполуки формули (1i), у яких R являє собою заміщений піримідин, або формули (1l), у яких R являє собою заміщений піримідинон, можуть бути одержані згідно зі схемою реакцій 14. Сполуки формули (11) можуть бути одержані зі сполук формули 10 шляхом реакції відповідного реагенту Гріньяра із хлоридом трибутилолова в присутності прийнятного розчинника, такого як тетрагідрофуран, при цьому реакційну суміш охолоджують при додаванні реагентів. Аналогічні реакції відомі, наприклад, з J. Org. Chem., 2011, 76, 6670-6677 (утворення Гріньяра), WO2010/59943 (p.32) і Journal of Organometallic Chemistry, 1973, (63), 133-138. Сполуки формули (12) можуть бути одержані зі сполук формули (11) шляхом реакції з метил-(Z)-2-йод-3-метокси-проп-2-еноатом у присутності прийнятної основи (наприклад, неорганічної основи, такої як фосфат калію або фторид цезію), джерела металу (наприклад, 2 25 30 16 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 джерела паладію, такого як паладій(0) тетракіс(трифенілфосфін)) і каталізатора, такого як йодид міді, необов'язково з нагріванням, згідно з аналогічними способами, наприклад, в Angew. Chem. Int. Ed., 2004, 43, 1132-1136. Сполуки загальної формули (1k) можуть бути одержані зі сполук загальної формули (12) шляхом реакції із прийнятним амідином у присутності прийнятного алкоксиду металу, наприклад метоксиду натрію, у прийнятному розчиннику, такому як метанол, при цьому реакційну суміш нагрівають. Сполуки загальної формули (1j) можуть бути одержані зі сполук загальної формули (1k) шляхом реакції із прийнятним хлорувальним реагентом, таким як оксихлорид фосфору, необов'язково в присутності прийнятного розчинника, згідно із процедурами, відомими наприклад, з Journal of Оrganic Chemistry, 76(10), 4149-4153; 2011. Сполуки загальних формул (1i) і (1l) можуть бути одержані зі сполук загальних формул (1j) і (1k), відповідно, як описано на схемі реакції 1. Приклади Нижче представлені приклади синтезу конкретних сполук відповідно до даного винаходу. Приклад 1 5-[2-Хлор-3-(4,5-дигідроізоксазол-3-іл)-4-метилсульфоніл-феніл]-4-гідрокси-2-пропілпіридазин-3-он Суміш 5-[2-хлор-3-(4,5-дигідроізоксазол-3-іл)-4-метилсульфоніл-феніл]-4-метокси-2-пропілпіридазин-3-ону (692 мг, 1,62 ммоль) у морфоліні (1,42 мл) нагрівали до 100 °C протягом 1 години. Реакційну суміш охолоджували, потім додавали дихлорметан (20 мл) і 2 M хлористоводневу кислоту (20 мл) і суміш збовтували протягом 30 хвилин. Дихлорметановий шар відділяли, потім водний шар двічі екстрагували дихлорметаном. Об'єднані органічні екстракти пропускали через картридж для фазового розділення, потім концентрували у вакуумі. Неочищений продукт розчиняли в етилацетаті, потім осаджували гексаном, концентрували у вакуумі та розтирали у порошок з ацетонітрилом з одержанням продукту у вигляді брудно-білої твердої речовини (224,6 мг). 5-[2-Хлор-3-(4,5-дигідроізоксазол-3-іл)-4-метилсульфоніл-феніл]-4-метокси-2-пропілпіридазин-3-он Суміш 5-хлор-4-метокси-2-пропіл-піридазин-3-ону (811 мг, 4 ммоль), ацетату калію (589 мг, 6 ммоль), біс(пінаколато)дибору (1,52 г, 6 ммоль), трис(дибензиліденацетон)дипаладію(0) (148 мг, 0,16 ммоль) і трициклогексилфосфіну (180 мг, 0,64 ммоль) у дегазованому діоксані (12 мл) нагрівали при 150 °C протягом 15 хвилин при мікрохвильовому опроміненні. Суміші дозволяли охолонути до кімнатної температури, потім фільтрували через целіт із елююванням етилацетатом. Фільтрат випарювали при зниженому тиску, потім застосовували безпосередньо на наступній стадії. Неочищений боронатний естер розчиняли в дегазованому диметоксиетані (12 мл); до суміші додавали 3-(3-бром-2-хлор-6-метилсульфоніл-феніл)-4,5-дигідроізоксазол (2,71 г, 8 ммоль), фторид цезію (2,43 г, 16 ммоль) і дихлорметановий аддукт [1,1'біс(дифенілфосфін)фероцен]паладію(II) дихлориду(260 мг, 0,32 ммоль). Одержану в результаті суміш нагрівали при 150 °C протягом 20 хвилин при мікрохвильовому опроміненні, потім дозволяли охолонути до кімнатної температури та фільтрували через целіт із елююванням етилацетатом. Фільтрат концентрували при зниженому тиску, потім очищали хроматографією на оксиді кремнію з елююванням 0-100 % етилацетатом в ізогексані з одержанням продукту у вигляді коричневого масла (692 мг). 8,06 (1H, d, J 8,1), 7,59 (1H, s), 7,56 (1H, d, J 8,1), 4,63 (3H, t, J 10,2), 4,19 (3H, s), 4,12 (2H, dd, J 7,3, 7,3), 3,47 (3H, t, J 10,2), 3,28 (3H, s), 1,90 (2H, m), 1,02 (3H, t, J 7,2). 5-Хлор-4-метокси-2-пропіл-піридазин-3-он До збовтуваного розчину 4,5-дихлор-2-пропіл-піридазин-3-ону (7,31 г, 35,3 ммоль) у діоксані (150 мл) краплями додавали розчин метоксиду натрію в метанолі (25 ваг. % у метанолі, 8,6 мл, 38,8 ммоль) і суміш збовтували при кімнатній температурі протягом 60 хвилин. Додавали воду (150 мл) і суміш екстрагували діетиловим ефіром (3×100 мл). Об'єднані органічні екстракти сушили, фільтрували та концентрували у вакуумі. Неочищений продукт очищали за допомогою хроматографії на силікагелі з елююванням етилацетатом/гексаном з одержанням бажаного продукту у вигляді безбарвного масла (5,44 г). 4,5-Дихлор-2-пропіл-піридазин-3-он До збовтуваного розчину 4,5-дихлор-1H-піридазин-6-ону (8,25 г, 50 ммоль) в N, Nдиметилформаміді (25 мл) при кімнатній температурі додавали карбонат калію (1,2 г, 60 ммоль) і 1-йодпропан (5,85 мл, 60 ммоль). Суміш збовтували при 70 °C протягом 2 годин, потім додавали воду (75 мл) і суміш екстрагували дихлорметаном (3×100 мл). Об'єднані органічні 17 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 екстракти сушили, фільтрували та концентрували у вакуумі, потім розділяли між сольовим розчином (200 мл) і діетиловим ефіром (200 мл). Органічний шар сушили, фільтрували та концентрували у вакуумі з одержанням коричневого масла. Неочищений продукт очищали за допомогою хроматографії на силікагелі з елююванням етилацетатом/гексаном з одержанням бажаного продукту у вигляді безбарвного масла (7,31 г). 7,78 (1H, s), 4,20-4,11 (2H, m), 1,90-1,74 (2H, m), 0,96 (3H, t, J 7,2). Приклад 2 4-Гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3-он Суміш 4-метокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3-ону (48 мг, 0,132 ммоль) у морфоліні (2 мл) нагрівали до 100 °C протягом 3 годин. Потім реакційній суміші дозволяли охолонути до кімнатної температури та випарювали при зниженому тиску. Одержаний у результаті залишок розчиняли в етилацетаті та промивали 2 M хлористоводневою кислотою. Потім органічний шар сушили над сульфатом натрію та випарювали. Одержану в результаті тверду речовину подрібнювали з дихлорметаном/гексаном з одержанням бажаного продукту у вигляді блідо-рожевої твердої речовини (25 мг). 4-Метокси-2-метил-5-[метилсульфоніл-4-(трифторметил)феніл]піридазин-3-он До розчину 4-метокси-2-метил-5-[2-метилсульфаніл-4-(трифторметил)феніл]піридазин-3-ону (90 мг, 0,27 ммоль) в оцтовій кислоті (4 мл) додавали пероксид водню (50 ваг. % у воді, 56 мг, 0,82 ммоль) при кімнатній температурі. Реакційну суміш повільно нагрівали до 55 °C та витримували при цій температурі протягом ночі. Реакційну суміш розбавляли дихлорметаном та повільно гасили насич. водн. гідрокарбонатом натрію та твердим гідрокарбонатом натрію до pH ~6-7. Органічний шар відділяли та водну фазу екстрагували дихлорметаном. Об'єднані органічні екстракти сушили над сульфатом натрію та випарювали з одержанням бажаного продукту (78 мг) у вигляді блідо-жовтого масла. Його застосовували без додаткового очищення. δH (CDCl3) 8,46 (1H, d), 7,98 (1H, dd), 7,60 (1H, s), 7,46 (1H, d), 4,14 (3H, s), 3,85 (3H, s), 3,02 (3H, s). 4-Метокси-2-метил-5-[2-метилсульфаніл-4-(трифторметил)феніл]піридазин-3-он Суміш 5-хлор-4-метокси-2-метил-піридазин-3-ону (100 мг, 0,573 ммоль), ацетату калію (84 мг, 0,86 ммоль), біс(пінаколато)дибору (218 мг, 0,86 ммоль), трис(дибензиліденацетон)дипаладію(0) (4 %, 21 мг, 0,023 ммоль) та трициклогексилфосфіну (16 %, 26 мг, 0,092 ммоль) у дегазованому діоксані (2,5 мл) нагрівали при 150 °C протягом 15 хвилин при мікрохвильовому опроміненні. Суміш фільтрували через целіт із промиванням етилацетатом та фільтрат випарювали при зниженому тиску. Залишок розчиняли в дегазованому 1,2-диметоксиетані (2,5 мл), а потім додавали 1-бром-2-метилсульфаніл-4(трифторметил)бензол (233 мг, 0,86 ммоль), фторид цезію (348 мг, 2,29 ммоль) та [1,1'біс(дифенілфосфін)-фероцен]паладію(II) хлорид, дихлорметановий комплекс (8 %, 38 мг, 0,046 ммоль). Одержану в результаті суміш нагрівали при 160 °C протягом 15 хвилин при мікрохвильовому опроміненні. Реакційну суміш фільтрували через целіт із промиванням етилацетатом. Фільтрат випарювали при зниженому тиску та залишок очищали за допомогою хроматографії на оксиді кремнію з елююванням 0-40 % етилацетатом у гексанах з одержанням бажаного продукту (190 мг, що містить деяку домішку залишкового пінакола) у вигляді червоного масла. Його застосовували без додаткового очищення. δH (CDCl3) 7,52 (1H, s), 7,50 (1H, br s), 7,47 (1H, br d), 7,26 (1H, br d), 4,05 (3H, s), 3,84 (3H, s), 2,49 (3H, s). 5-Хлор-4-метокси-2-метил-піридазин-3-он До збовтуваного розчину 4,5-дихлор-2-метил-піридазин-3-ону (19,7 г, 110 ммоль) у 1,4діоксані (550 мл) краплями додавали метоксид натрію (28,5 г, 132 ммоль, 30,2 мл) та одержану в результаті суміш збовтували при кімнатній температурі протягом 1 години. Реакційну суміш гасили водою (~500 мл), потім екстрагували діетиловим ефіром (500 мл, потім 250 мл). Об'єднані органічні екстракти сушили, фільтрували та концентрували у вакуумі з одержанням 15,83 г білої твердої речовини. δH (CDCl3) 7,68 (1H, s), 4,28 (3H, s), 3,75 (3H, s). 4,5-Дихлор-2-метил-піридазин-3-он До збовтуваного розчину 4,5-дихлор-1H-піридазин-6-ону (25,0 г, 152 ммоль) у N, Nдиметилформаміді (152 мл) додавали карбонат калію (25,4 г, 182 ммоль) та йодметан (25,8 г, 182 ммоль, 11,3 мл). Одержану в результаті суміш збовтували при кімнатній температурі протягом ночі. Потім реакційну суміш виливали в льодяну воду (300 мл) та суміш збовтували протягом 15 хвилин. Одержаний у результаті осад збирали фільтрацією, потім розчиняли в дихлорметані та пропускали через картридж для фазового розділення. Органічні екстракти концентрували у вакуумі з одержанням 19,7 г блідо-коричневої твердої речовини. 18 UA 114094 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H ЯМР (400 МГц, хлороформ) d ppm 3,83 (s, 3H) 7,77 (s, 1H). Приклад 3 4-Гідрокси-2-метил-5-[3-(м-толіл)-2-оксо-4-(трифторметил)-1-піридил]піридазин-3-он Суміш 4-хлор-2-метил-5-[3-(м-толіл)-2-оксо-4-(трифторметил)-1-піридил]піридазин-3-ону (74 мг, 0,19 ммоль) у водному гідроксиді калію (0,5 M, 3 мл, 0,606 ммоль) та метанолі (2,5 мл) нагрівали при 55 °C протягом 90 хвилин. Додавали морфолін (1 мл) та реакційну суміш нагрівали при 90 °C протягом 2 годин. Реакційну суміш концентрували при зниженому тиску. Потім обережно додавали 2 M хлористоводневу кислоту до залишку з енергійним збовтуванням протягом 5-10 хвилин. Одержаний у результаті кремоподібний осад фільтрували, промивали 2 M хлористоводневою кислотою та водою, а потім сушили у вакуумній печі при 55 °C протягом ночі з одержанням бажаного продукту (37 мг). 4-Хлор-2-метил-5-[3-(м-толіл)-2-оксо-4-(трифторметил)-1-піридил]піридазин-3-он Суміш 3-(м-толіл)-4-(трифторметил)-1Н-піридин-2-ону (68 мг, 0,269 ммоль), 4,5-дихлор-2метил-піридазин-3-ону (58 мг, 0,323 ммоль) та карбонату калію (112 мг, 0,807 ммоль) у N, Nдиметилформаміді (1 мл) нагрівали в мікрохвилях при 150 °C протягом 25 хвилин. Потім реакційну суміш виливали в 2 M хлористоводневу кислоту та екстрагували етилацетатом. Органічні екстракти об'єднували, сушили над сульфатом натрію та випарювали при зниженому тиску. Неочищену суміш очищали за допомогою хроматографії на силікагелі з елююванням етилацетатом у гексанах з одержанням бажаного продукту у вигляді жовтого масла (74 мг). δH (CDCl3) 7,84 (1H, s), 7,34-7,22 (3H, m), 7,11 (2H, m), 6,63 (1H, d), 3,88 (3H, s), 2,38 (3H, s). 3-(м-Толіл)-4-(трифторметил)-1Н-піридин-2-он Суміш 2-хлор-3-(м-толіл)-4-(трифторметил)піридину (96 мг, 0,353 ммоль) та гідроксиду натрію в диметилсульфоксиді (0,6 мл) та воді (0,6 мл) нагрівали при 150 °C при мікрохвильовому опроміненні протягом 60 хвилин. Рідку суміш відділяли від склоподібного залишку та підкисляли до pН 1 за допомогою 2 M хлористоводневої кислоти. Одержаний у результаті білий осад фільтрували, промивали декількома краплями води та сушили у вакуумній печі при 55 °C протягом ночі з одержанням продукту у вигляді білої твердої речовини (68 мг). δH (CD3OD) 7,62 (1H, d), 7,34-7,30 (1H, m), 7,25-7,23 (1H, m), 7,06 (1H, s), 7,02 (1H, d), 6,66 (1H, d), 2,40 (3H, s). 2-Xлор-3-(м-толіл)-4-(трифторметил)піридин Суміш 2-хлор-3-йод-4-метил-піридину (200 мг, 0,652 ммоль), м-толілборонової кислоти (132 мг, 0,976 ммоль), тетракіс(трифенілфосфін)паладію(0) (8 %, 60 мг, 0,052 ммоль) та карбонату калію (136 мг, 0,976 ммоль) у 1,2-диметоксиетані (2,8 мл) нагрівали при 150 °C протягом 30 хвилин при мікрохвильовому опроміненні. Реакційну суміш виливали в соляний розчин та екстрагували етилацетатом. Органічні екстракти сушили над сульфатом натрію та випарювали. Неочищену суміш очищали за допомогою хроматографії на силікагелі з елююванням етилацетатом у гексанах з одержанням продукту у вигляді безбарвного масла (96 мг). 2-Хлор-3-йод-4-метил-піридин н-Бутиллітій (1,6 M у гексанах, 13,3 мл, 21,3 ммоль) краплями додавали до розчину діізопропіламіну (33 мл, 23,3 ммоль) у тетрагідрофурані (7 мл) при -70 °C (внутрішня температура) та одержану в результаті суміш збовтували протягом 30 хвилин. Потім краплями додавали 2-хлор-4-трифтор-метилпіридин (2,5 мл, 3,52 г, 19,4 ммоль) за 20 хвилин та суміш збовтували протягом 2 годин при -70 °C. Потім її швидко канюлювали в розчин йоду (5,2 г, 20,4 ммоль) у тетрагідрофурані (3 мл), витримуваний при 0 °C. Одержану в результаті суміш збовтували протягом 10 хвилин, гасили водним метабісульфатом натрію та екстрагували етилацетатом. Органічний шар збирали, промивали соляним розчином, сушили над сульфатом магнію та випарювали. Неочищену суміш очищали за допомогою хроматографії на оксиді кремнію з елююванням етилацетатом у гексані з одержанням бажаної сполуки (4,87 г, ~82 %) у вигляді блідо-жовтої твердої речовини, забрудненої слідами вихідного матеріалу. δH (CDCl3) 8,50 (1H, d), 7,44 (1H, d). Приклад 4 2-Циклопентил-5-[3-(4,5-дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]-4-метоксипіридазин-3-он До збовтуваного розчину 4-[3-(4,5-дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]5-метокси-1Н-піридазин-6-ону (126 мг, 0,35 ммоль), трифенілфосфіну (184 мг, 0,70 ммоль) та циклопентанолу (0,06 мл, 0,70 ммоль) у сухому THF (3,5 мл) в атмосфері азоту краплями додавали діізопропілазодикарбоксилат (0,14 мл, 0,7 ммоль). Одержану в результаті суміш збовтували при кімнатній температурі протягом 3 годин, потім концентрували у вакуумі. Неочищений продукт очищали за допомогою колонкової хроматографії на оксиді кремнію з 19 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 елююванням ізогексаном/етилацетатом з одержанням 2-циклопентил-5-[3-(4,5-дигідроізоксазол3-іл)-2-метил-4-метилсульфоніл-феніл]-4-метокси-піридазин-3-ону (94 мг). 8,06 (1H, d, J 8,1), 7,56 (1H, s), 7,43 (1H, d, J 8,1), 5,50-5,41 (1H, m), 4,61 (2H, t, J 9,9), 4,10 (3H, s), 3,41 (2H, br s), 3,22 (3H, s), 2,17-2,02 (2H, m), 2,04 (3H, s), 2,00-1,86 (4H, m), 1,74-1,67 (2H, m). 4-[3-(4,5-Дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]-5-метокси-1Н-піридазин-6он До збовтуваного розчину 5-[3-(4,5-дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]2-[(4-гідроксифеніл)метил]-4-метокси-піридазин-3-ону (281 мг, 0,58 ммоль) в ацетонітрилі(5 мл) та воді (1 мл) при кімнатній температурі додавали нітрат церію-амонію та суміш збовтували при кімнатній температурі. Реакцію контролювали за допомогою LCMS. Через 90 хвилин додавали соляний розчин (25 мл) та етилацетат (25 мл). Шари розділяли та водний шар екстрагували етилацетатом ще два рази. Об'єднані органічні екстракти промивали насич. водним бікарбонатом натрію (25 мл), потім сушили та концентрували у вакуумі. Неочищений продукт подрібнювали з гексаном (~20 мл) та фільтрували з одержанням 126 мг блідо-жовтої твердої речовини. 8,08 (1H, d, J 8,1), 7,56 (1H, s), 7,44 (1H, d, J 8,1), 4,61 (2H, t, J 10,2), 4,19 (3H, s), 3,43 (2H, br s), 3,22 (3H, s), 2,19 (3H, s). 5-[3-(4,5-Дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]-2-[(4гідроксифеніл)метил]-4-метокси-піридазин-3-он Суміш 5-хлор-4-метокси-2-[(4-метоксифеніл)метил] піридазин-3-ону (281 мг, 1 ммоль), паладію ацетату (18 мг, 0,08 ммоль), 3-[2-метил-6-метилсульфоніл-3-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)феніл]-4,5-дигідроізоксазолу (548 мг, 1,5 ммоль), водного трикалію фосфату (0,4 мл, 2 ммоль) та SРhos (66 мг, 0,16 ммоль) у дегазованому толуолі нагрівали при 150 °C протягом 30 хвилин при мікрохвильовому опроміненні. Суміші дозволяли охолонути до кімнатної температури, потім фільтрували через целіт з елююванням етилацетатом. Фільтрат випарювали при зниженому тиску, а потім очищали за допомогою колонкової хроматографії з одержанням бажаного продукту у вигляді рожевого масла (281 мг). 8,00 (1H, d), 7,49 (1H, s), 7,41 (2H, d), 7,35 (1H, d), 6,86 (2H, d), 5,36-5,14 (2H, br d), 4,54 (2H, t), 4,07 (3H, s), 3,77 (3H, s), 3,34 (2H, br s), 3,18 (3H, s), 2,11 (3H, s). 3-[2-Метил-6-метилсульфоніл-3-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)феніл]-4,5дигідроізоксазол одержували, як описано в прикладі 7 нижче. 5-Хлор-4-метокси-2-[(4-метоксифеніл)метил]піридазин-3-он До збовтуваного розчину 4,5-дихлор-2-[(4-метоксифеніл)метил]піридазин-3-ону (5,70 г, 20 ммоль) у сухому діоксані (50 мл) додавали розчин метоксиду натрію (30 ваг. % розчин. у метанолі (~5,4 M), 4,07 мл, 22 ммоль) при кімнатній температурі. Одержану в результаті суміш збовтували при кімнатній температурі, контролювали за допомогою LCMS, а потім виливали у воду (50 мл)/дихлорметан (50 мл). Органічний шар відділяли, а водний шар екстрагували дихлорметаном (2×50 мл). Об'єднані органічні екстракти сушили над сульфатом магнію та випарювали. Неочищений продукт очищали за допомогою колонкової хроматографії на оксиді кремнію з елююванням етилацетатом/гексаном з одержанням бажаного продукту 5-хлор-4метокси-2-[(4-метоксифеніл)метил]піридазин-3-ону у вигляді білої твердої речовини (4,53 г) разом з ізомерною сполукою 4-хлор-5-метокси-2-[(4-метоксифеніл)метил]піридазин-3-оном (650 мг). Дані ЯМР: 5-хлор-4-метокси-2-[(4-метоксифеніл)метил]піридазин-3-он: 7,70 (1H, s), 7,39 (2H, d), 6,84 (2H, d), 5,20 (2H, s), 4,24 (3H, s), 3,79 (3H, s); 4-хлор-5-метокси-2-[(4-метоксифеніл)метил]піридазин-3-он: 7,80 (1H, s), 7,40 (2H, d), 6,86 (2H, d), 5,29 (2H, s), 4,02 (3H, s), 3,79 (3H, s); Одержували 4,5-дихлор-2-[(4-метоксифеніл)метил]піридазин-3-он з 4,5-дихлор-1Нпіридазин-6-ону процедурою, аналогічною описаній у прикладі 1 вище. Приклад 5 5-[6-Фтор-2-(трифторметил)-1,8-нафтиридин-3-іл]-4-гідкрокси-2-метил-піридазин-3-он 5-[6-Фтор-2-(трифторметил)-1,8-нафтиридин-3-іл]-4-метокси-2-метил-піридазин-3-он (70 мг, 0,1976 ммоль) розчиняли в ацетонітрилі (5 мл) та додавали йодид натрію (50 мг, 0,33 ммоль) у 20 мл пробірці для мікрохвильового реактора. Додавали хлор(триметил)силан (0,043 мл, 0,34 ммоль), та жовта реакційна суміш негайно ставала пурпурною. Суміш збовтували в ємності для мікрохвильового реактора при 100 °C протягом 30 хвилин. LCMS демонструвала тільки часткове перетворення на бажаний продукт. Додавали більше хлор(триметил)силана та йодиду натрію та реакційну суміш повторно обробляли мікрохвилями при 100 °C протягом 30 хвилин. 20 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 LCMS демонструвала збільшення бажаного продукту, але підтверджувала, що вихідний матеріал усе ще залишався головним компонентом (~60 %). Суміш виливали у воду, підлужували 2 M гідроксидом натрію та екстрагували дихлорметаном. Органічні екстракти пропускали через картридж для фазового розділення та випарювали з одержанням вихідного матеріалу, що не прореагував. Основний водний шар підкисляли 2 M хлористоводневою кислотою та екстрагували дихлорметаном. Органічні екстракти пропускали через другий картридж для фазового розділення та випарювали з одержанням бажаного продукту 5-[6-фтор2-(трифторметил)-1,8-нафтиридин-3-іл]-4-гідрокси-2-метил-піридазин-3-ону (21 мг, 0,062 ммоль) у вигляді рожевої твердої речовини. 1 H ЯМР (400 МГц, хлороформ) δ ppm d 1H 9,18, s 1H 8,35, dd 1H 7,98, s 1H 7,69, s 3H 3,90. 5-[6-Фтор-2-(трифторметил)-1,8-нафтиридин-3-іл]-4-метокси-2-метил-піридазин-3-он [6-Фтор-2-(трифторметил)-1,8-нафтиридин-3-іл]-триметил-станан (200 мг, 0,528 ммоль), 5хлор-4-метокси-2-метил-піридазин-3-он (105 мг, 0,60144 ммоль), 1,4біс(дифенілфосфінбутан)паладію дихлорид (33 мг), оксид міді(II) (45 мг, 0,566 ммоль) та N, Nдиметилформамід (5 мл, 64,4 ммоль) збовтували в ємності для мікрохвильового реактора при 140 °C протягом 30 хвилин. LCMS демонструвала добре перетворення на бажаний продукт із невеликою кількістю "гомо-приєднаного" побічного продукту, а також деякі інші незначні домішки. Реакційну суміш фільтрували через дуже невелику кремнеземну пробку. Фільтрат розділяли між ефіром та водою. Органічні екстракти відділяли, промивали, сушили над безводним сульфатом магнію та випарювали. Неочищений продукт розчиняли в дихлорметані та очищали за допомогою колонкової хроматографії з елююванням етилацетатом/ізогексаном з одержанням 5-[6-фтор-2-(трифторметил)-1,8-нафтиридин-3-іл]-4-метокси-2-метил-піридазин-3ону (75 мг, 0,2117 ммоль) у вигляді жовтої твердої речовини. 1 H ЯМР (400 МГц, хлороформ) δ ppm d 1H 9,20, s 1H 8,20, dd 1H 7,92, s 1H 7,61, s 3H 4,14, s 3H 3,88. 5-Хлор-4-метокси-2-метил-піридазин-3-он одержували з 4,5-дихлор-1Н-піридазин-6-ону, як описано в прикладі 2. [6-Фтор-2-(трифторметил)-1,8-нафтиридин-3-іл]-триметил-станан Суміш 6-фтор-3-йод-2-(трифторметил)-1,8-нафтиридину (400 мг, 1,17 ммоль), діолова гексаметилу (1,15 г, 3,40 ммоль) та каталізатора біс(трифенілфосфін)паладію(II) дихлориду (100 мг, 0,141 ммоль) у дегазованому 1,4-діоксані (6 мл, 70,3 ммоль) нагрівали при 110 °C протягом 60 хвилин при мікрохвильовому опроміненні. LCMS демонструвала добре перетворення на бажаний продукт. Реакційну суміш адсорбували на оксиді кремнію та очищали за допомогою колонкової хроматографії з елююванням етилацетатом/ізогексаном з одержанням [6-фтор-2(трифторметил)-1,8-нафтиридин-3-іл]-триметил-станану у вигляді блідо-жовтогарячої твердої речовини (300 мг, 0,7918 ммоль). 1 H ЯМР (400 МГц, хлороформ) δ ppm d 1H 9,10, s 1H 8,48, dd 1H 7,85, s 9H 0,47. 6-Фтор-3-йод-2-(трифторметил)-1,8-нафтиридин можна одержувати із 6-фтор-2(трифторметил)-1,8-нафтиридин-3-аміну процедурами, відомими, наприклад, з J. Org. Chem. 1977, 42 (14), 2426-2431. Приклад 6 4-[3-(4,5-Дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]-1,3-диметил-4Hпіридазин-5,6-діон 4-[3-(4,5-Дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]-1,3-диметил-4Hпіридазин-5,6-діон одержували з 4,5-дихлор-2,6-диметил-піридазин-3-ону послідовністю реакцій, аналогічною такій у прикладі 1. 4,5-Дихлор-2,6-диметил-піридазин-3-он В 20-мл ємність для мікрохвильового реактора додавали 6-бром-4,5-дихлор-2-метилпіридазин-3-он (1,00 г, 3,88 ммоль), [1,1'-біс(дифенілфосфін)фероцен]паладію(II) дихлорид дихлорметановий аддукт (0,032 г, 0,039 ммоль), карбонат цезію (2,02 г, 6,20 ммоль), триметилбороксин (0,787 г, 6,20 ммоль, 0,876 мл) та 1,4-діоксан (9 мл) та нагрівали в мікрохвилях при 100 °C протягом 1 години, а потім ще протягом 30 хвилин при 150 °C. Реакційну суміш фільтрували через целіт, додавали оксид кремнію та концентрували у вакуумі. Залишок очищали за допомогою хроматографії на оксиді кремнію з елююванням 030 % етилацетатом/гексаном з одержанням білої твердої речовини, що містить співвідношення 9:1 бажаного продукту 4,5-дихлор-2,6-диметил-піридазин-3-ону разом з побічним продуктом 5хлор-2,4,6-триметил-піридазин-3-оном (всього 502 мг). Цю суміш застосовували безпосередньо в наступній стадії з утворенням 5-хлор-4-метокси-2,6-диметил-піридазин-3-ону, оскільки побічний продукт не реагує. 1H ЯМР (CDC13): 21 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 4,5-дихлор-2,6-диметил-піридазин-3-он δ 3,79 (s, 3H), 2,44 (s, 3H); 5-хлор-2,4,6-триметил-піридазин-3-он δ 3,73 (s, 3H), 2,38 (s, 3H), 2,29 (s, 3H). Приклад 7 2-Циклопропіл-5-[3-(4,5-дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]-4-гідроксипіридазин-3-он Розчин 2-циклопропіл-5-[3-(4,5-дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]-4метокси-піридазин-3-ону (0,203 г, 0,5032 ммоль у морфоліні (0,4384 г, 5,032 ммоль, 0,440 мл) нагрівали при 100 °C протягом 1 години. Реакційній суміші дозволяли охолонути до кімнатної температури, потім розбавляли дихлорметаном (5 мл) та 2 M хлористоводневу кислоту (5 мл). Потім суміш збовтували протягом 30 хвилин. Органічний шар відділяли, а водний шар екстрагували дихлорметаном (2×5 мл). Об'єднані органічні екстракти сушили та концентрували у вакуумі з одержанням рожевої твердої речовини. Неочищену тверду речовину подрібнювали з ацетонітрилом (3×2-мл порції) та збирали шляхом фільтрації з одержанням 2-циклопропіл-5-[3-(4,5-дигідроізоксазол-3-іл)-2-метил-4метилсульфоніл-феніл]-4-гідрокси-3-ону у вигляді білої твердої речовини (0,0883 г). 1 H ЯМР (400 МГц, хлороформ) δ ppm 1,05-1,12 (m, 2H) 1,22-1,29 (m, 2H) 2,23 (s, 3H) 3,21 (s, 3H) 3,39 (br s, 2H) 4,19 (dt, J=7,65, 3,69 Гц, 1H) 4,60 (t, J=10,07 Гц, 2H) 7,49 (d, J=8,19 Гц, 1H) 7,60 (s, 1H) 8,08 (d, J=8,19 Гц, 1H). 2-Циклопропіл-5-[3-(4,5-дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]-4-метокси3-он Суміш 5-хлор-2-циклопропіл-4-метокси-піридазин-3-ону (0,20 г, 1 ммоль), 3-[2-метил-6метилсульфоніл-3-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)феніл]-4,5-дигідроізоксазолу (0,438 г, 1,2 ммоль), паладію(II) ацетату (0,018 г, 0,08 ммоль), трикалію фосфату (1,026 г, 2 ммоль, 0,4 мл, 5 моль/л) та Sphos (0,0670 г, 0,16 ммоль) у толуолі (3,46 г, 37,4 ммоль, 4,0 мл) нагрівали при 150 °C протягом 30 хвилин при мікрохвильовому опроміненні. Реакційну суміш фільтрували через целіт з елююванням етилацетатом. Фільтрат концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт завантажували на оксид кремнію та очищали за допомогою хроматографії з одержанням 2циклопропіл-5-[3-(4,5-дигідроізоксазол-3-іл)-2-метил-4-метилсульфоніл-феніл]-4-метоксипіридазин-3-ону у вигляді безбарвного масла (0,203 г, 0,503 ммоль). 1 H ЯМР (400 МГц, хлороформ) δ ppm 1,03-1,11 (m, 2H) 1,19 (br. s, 2H) 2,18 (s, 3H) 3,22 (s, 3H) 3,40 (br s, 2H) 4,14 (s, 4H) 4,60 (t, J=10,07 Гц, 3H) 7,41 (d, J=8,19 Гц, 1H) 7,48 (s, 1H) 8,06 (d, J=8,19 Гц, 1H). 3-[2-Метил-6-метилсульфоніл-3-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)феніл]-4,5дигідроізоксазол Суміш 3-(3-бром-2-метил-6-метилсульфоніл-феніл)-4,5-дигідроізоксазолу (A, 3,182 г, 10 ммоль), біс(пінаколато)дибору (3,8476 г, 15 ммоль), трис(дибензиліденацетон)дипаладію(0) (0,092 г, 0,1 ммоль), S-Phos (0,168 г, 0,4 ммоль) та ацетату калію (1,487 г, 15 ммоль) в 1,4діоксані (15,51 г, 176 ммоль, 15 мл) нагрівали при 150 °C протягом 30 хвилин при мікрохвильовому опроміненні. Неочищену суміш фільтрували через подушку целіта з елююванням етилацетатом. Неочищений продукт завантажували на оксид кремнію та очищали за допомогою хроматографії з одержанням 3-[2-метил-6-метилсульфоніл-3-(4,4,5,5-тетраметил1,3,2-діоксаборолан-2-іл)феніл]-4,5-дигідроізоксазолу у вигляді блідо-жовтої твердої речовини (2,06 г, 5,64 ммоль). 1 H ЯМР (400 МГц, хлороформ) δ ppm 1,37 (s, 13H) 2,52 (s, 3H) 3,16 (s, 4H) 3,33 (br. s., 2H) 4,57 (t, J=10,00 Гц, 2H) 7,94 (d, J=8,06 Гц, 1H) 7,99 (d, J=7,92 Гц, 1H). 3-(3-Бром-2-хлор-6-метилсульфоніл-феніл)-4,5-дигідроізоксазол можна одержувати, як викладено, наприклад, у патентному документі Німеччини № 19820722. 5-Хлор-2-циклопропіл-4-метокси-піридазин-3-он До збовтуваного розчину 4,5-дихлор-2-циклопропіл-піридазин-3-ону (A, 0,599 г, 2,9214 ммоль, 100 ваг. %) у 1,4-діоксані (100 мл, 100 ваг. %) краплями додавали метоксид натрію (0,69443 г, 3,2135 ммоль, 0,735 мл, 25 ваг. %) та одержану в результаті суміш збовтували при кімнатній температурі протягом 1 години. Реакційну суміш концентрували у вакуумі з одержанням неочищеного коричневого масла, потім завантажували на оксид кремнію та очищали за допомогою хроматографії з одержанням 5-хлор-2-циклопропіл-4-метокси-піридазин3-ону у вигляді білої твердої речовини (0,498 г). 1H ЯМР (400 МГц, хлороформ) δ ppm 0,96-1,14 (m, 4H) 3,95-4,07 (m, 1H) 4,28 (s, 3H) 7,64 (s, 1H). 22 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 4,5-Дихлор-2-циклопропіл-піридазин-3-он Суміш трет-бутил-N-(трет-бутоксикарбоніламіно)-N-циклопропіл-карбамату (0,68 г, 2,5 ммоль) та мукохлорної кислоти (0,43 г, 2,5 ммоль) у хлористоводневій кислоті (4 моль/л) у воді (25 ммоль, 6,3 мл) нагрівали зі зворотним холодильником протягом 6 годин. Реакційній суміші дозволяли охолонути до кімнатної температури, потім екстрагували дихлорметаном (3×10 мл). Об'єднані органічні екстракти сушили та концентрували у вакуумі. Неочищений продукт очищали за допомогою хроматографії з одержанням 4,5-дихлор-2-циклопропіл-піридазин-3-ону у вигляді білої твердої речовини (0,353 г). 1 H ЯМР (400 МГц, хлороформ) δ ppm 1,02-1,17 (m, 4H) 4,09-4,16 (m, 1H) 7,72 (s, 1H). Трет-бутил-N-(трет-бутоксикарбоніламіно)-N-циклопропіл-карбамат До збовтуваної суспензії магнію (1,34 г, 55 ммоль) та каталітичного йоду в тетрагідрофурані (5 мл) додавали 5 мл з 45 мл розчину циклопропілброміду (4,0 мл) у тетрагідрофурані (50 мл). Суміш нагрівали для ініціації утворення реактиву Гріньяра, потім краплями додавали розчин циклопропілброміду, що залишився, за 30 хвилин з нагріванням (70 °C). Розчин реактиву Гріньяра нагрівали зі зворотним холодильником протягом ще 30 хвилин, потім охолоджували до 0 °C. До збовтуваного розчину ди-трет-бутилазодикарбоксилату в THF (50 мл) при -78 °C краплями через трубочку додавали розчин циклопропілмагніюброміду. Одержаний у результаті розчин збовтували при -78 °C протягом 30 хвилин, потім гасили оцтовою кислотою. Суміші дозволяли нагрітися до кімнатної температури, потім додавали воду (150 мл) та суміш екстрагували три рази діетиловим ефіром. Об'єднані органічні екстракти сушили, фільтрували та концентрували у вакуумі. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з елююванням етилацетатом/гексаном з одержанням продукту у вигляді білої твердої речовини (6,68 г). 1 H ЯМР (400 МГц, хлороформ) δ ppm 0,7 (4H, br s), 1,5 (18H, s), 2,9-3,0 (1H, br m), 6,1 та 6,4 (1H, br s). Приклад 8 [2-Метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-3-оксо-піридазин-4-іл]ацетат До суспензії 4-гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3ону (0,1 г, 0,29 ммоль) у сухому дихлорметані (1 мл) при кімнатній температурі додавали піридин (0,03 г, 0,03 мл, 0,37 ммоль) та 4-(диметиламіно)піридин (0,35 мг, 0,0029 ммоль). Суміш збовтували протягом 2 хвилин та краплями додавали ацетилхлорид (0,027 г, 0,025 мл, 0,345 ммоль). Одержану в результаті суспензію збовтували при кімнатній температурі протягом 2 годин, потім розбавляли дихлорметаном та послідовно промивали 2 M хлористоводневою кислотою та насиченим водним гідрокарбонатом натрію. Органічний шар збирали, пропускали через картридж для фазового розділення та фільтрат випарювали. Неочищений залишок очищали флеш-хроматографією (10-55 % етилацетат у гексанах, 13 хвилин, потім 3 хвилини при 55 %, 4 г оксиду кремнію GOLD) з одержанням [2-метил-5-[2метилсульфоніл-4-(трифторметил)феніл]-3-оксо-піридазин-4-іл]ацетату (0,095 г, 0,2434 ммоль, вихід 84,78 %) у вигляді білої твердої речовини. 4-Гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3-он одержували, як описано в прикладі 2. Приклад 9 Метил-[2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-3-оксо-піридазин-4іл]карбонат До суспензії 4-гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3ону (0,1 г, 0,29 ммоль) у сухому толуолі (1,99 г, 2,3 мл, 21,5 ммоль) при кімнатній температурі додавали триетиламін (0,032 г, 0,044 мл, 0,31 ммоль), а потім метилхлорформіат (0,03 г, 0,024 мл, 0,31 ммоль). Одержану в результаті суміш збовтували протягом ночі. Додавали воду та суміш екстрагували етилацетатом. Органічні екстракти пропускали через картридж для фазового розділення та фільтрат концентрували при зниженому тиску. Неочищений залишок очищали флеш-хроматографією (0-50 % етилацетат у гексанах, 12 хвилин, потім 3 хвилини при 50 %, 4 г оксиду кремнію) з одержанням метил[2-метил-5-[2метилсульфоніл-4-(трифторметил)феніл]-3-оксо-піридазин-4-іл]карбонату (0,113 г, 0,2781 ммоль, вихід 96,87 %) у вигляді білої твердої речовини. Одержували 4-гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3он, як описано в прикладі 2. Приклад 10 [2-Метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-3-оксо-піридазин-4іл]етилсульфанілформіат 23 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 До суспензії 4-гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3ону (0,1 г, 0,29 ммоль) у сухому тетрагідрофурані (4,6 г, 5,17 мл, 63,7 ммоль) при кімнатній температурі додавали триетиламін (0,059 г, 0,08 мл, 0,57 ммоль), а потім етилхлортіоформіат (0,047 г, 0,039 мл, 0,36 ммоль). Одержану в результаті суспензію збовтували при кімнатній температурі протягом 90 хвилин, а потім розбавляли етилацетатом та промивали соляним розчином. Органічний шар збирали, пропускали через картридж для фазового розділення та фільтрат випарювали. Фільтрат випарювали та залишок очищали флеш-хроматографією (040 % етилацетат у гексанах, 13 хвилин, потім 3 хвилини при 40 %, 4 г оксиду кремнію) з одержанням [2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-3-оксо-піридазин-4іл]етилсульфанілформіату (0,126 г, 0,289 ммоль, вихід 100 %) у вигляді білої твердої речовини. 4-Гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3-он одержували, як описано в прикладі 2. Приклад 11 [2-Метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-3-оксо-піридазин-4-іл]пропан-1сульфонат До суспензії 4-гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3ону (0,1 г, 0,29 ммоль) у дихлорметані (1,14 г, 0,86 мл, 13,4 ммоль) при кімнатній температурі додавали розчин карбонату калію (0,06 г, 0,43 ммоль) у воді (0,86 г, 0,86 мл, 47,81 ммоль), а потім розчин 1-пропансульфонілхлориду (0,063 г, 0,05 мл, 0,43 ммоль) у дихлорметані (0,2 мл). Потім додавали бензилтриметиламоній хлорид (0,0027 г, 0,0025 мл, 0,014 ммоль) та двофазну суміш енергійно збовтували при кімнатній температурі протягом ночі. Реакційну суміш розбавляли водою/дихлорметаном та відділяли органічну фазу. Водний шар екстрагували дихлорметаном. Об'єднані органічні екстракти промивали водною 2 M хлористоводневою кислотою та соляним розчином, а потім пропускали через картридж для фазового розділення. Фільтрат випарювали та залишок очищали за допомогою флешхроматографії (0-50 % етилацетат у гексанах, 13 хвилин, 4 г оксиду кремнію) з одержанням [2метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-3-оксо-піридазин-4-іл]пропан-1-сульфонат (0,1 г, 0,22 ммоль, вихід 76,7 %) у вигляді білої твердої речовини. Одержували 4-гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3он, як описано в прикладі 2. Приклад 12 [2-Метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-3-оксо-піридазин-4-іл]пропан-1сульфонат До суспензії 4-гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3ону (0,1 г, 0,2871 ммоль) та пара-толуолсульфонілхлориду (0,061 г, 0,32 ммоль) у сухому ацетонітрилі (4,51 г, 5,7 мл, 110 ммоль) при кімнатній температурі додавали карбонат калію (0,071 г, 0,52 ммоль). Одержану в результаті суспензію збовтували при кімнатній температурі протягом ночі. Реакційну суміш розбавляли водою та екстрагували етилацетатом. Органічний шар збирали, пропускали через картридж для фазового розділення та фільтрат випарювали. Одержану в результаті тверду речовину розчиняли в мінімальній кількості дихлорметану та краплями додавали гексан зі швидким збовтуванням до осадження. Осад збирали фільтрацією та сушили під вакуумом з одержанням [2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]3-оксо-піридазин-4-іл]4-метилбензолсульфонату (0,10 г, 0,2 ммоль, вихід 70,0 %) у вигляді білої твердої речовини. Одержували 4-гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]піридазин-3он, як описано в прикладі 2. Приклад 13 4-Гідрокси-2-метил-5-[4-морфоліно-2-(трифторметил)піримідин-5-іл]піридазин-3-он 5-[4-Хлор-2-(трифторметил)піримідин-5-іл]-4-метокси-2-метил-піридазин-3-он (240,0 мг, 0,22 ммоль) розчиняли в морфоліні (2,5 мл, 28,6 ммоль). Реакційну суміш збовтували при 100 °C протягом 45 хвилин. Реакційну суміш обережно додавали до 30,0 мл води та збовтували протягом 10 хвилин. Водний шар екстрагували дихлорметаном (2×20 м). Потім водний шар підкисляли водною хлористоводневою кислотою (2,0 M), а потім промивали дихлорметаном, який збирали з використанням картриджа для фазового розділення. Розчинник концентрували у вакуумі та неочищений продукт розтирали з 5,0 мл ацетонітрилу, потім обробляли ультразвуком та одержану в результаті тверду речовину (40,0 мг) збирали фільтрацією. TLC демонструвала деяку домішку, тому розтирали ще раз із використанням 5,0 мл метанолу та одержаний у результаті осад виділяли з одержанням 4-гідрокси-2-метил-5-[4-морфоліно-2(трифторметил)піримідин-5-іл]піридазин-3-ону (25,0 мг, 0,07 ммоль, вихід 31,2 %) у вигляді білої 24 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 твердої речовини. 5-[4-Хлор-2-(трифторметил)піримідин-5-іл]-4-метокси-2-метил-піридазин-3-он 4-Метокси-2-метил-5-[6-оксо-2-(трифторметил)-1Н-піримідин-5-іл]піридазин-3-он (515,0 мг, 1,7 ммоль) розчиняли в оксихлориді фосфору(V) (5,0 мл, 53 ммоль). Суміш збовтували при 85 °C протягом 90 хвилин. Потім реакцію зупиняли та дозволяли охолонути до кімнатної температури, а потім концентрували у вакуумі. Неочищений продукт краплями додавали в льодяну воду та водний шар екстрагували дихлорметаном. Органічні шари об'єднували, сушили над сульфатом натрію, фільтрували та концентрували у вакуумі, потім очищали з використанням картриджа 24 г оксиду кремнію з елююванням ізогексаном:етилацетатом (100:0 → 60:40 протягом 12 хвилин, потім тримали градієнт протягом 6 хвилин). Фракції, що містять продукт, концентрували у вакуумі з одержанням 5-[4-хлор-2-(трифторметил) піримідин-5-іл]-4метокси-2-метил-піридазин3-ону (240,0 мг, 0,22 ммоль, вихід 13,18 %) у вигляді прозорого масла. 1 H ЯМР (400 МГц, хлороформ) δ ppm=3,86 (3H, s) 4,29 (3H, s) 7,63 (1H, s) 8,76 (1H, s). 4-Метокси-2-метил-5-[6-оксо-2-(трифторметил)-1Н-піримідин-5-іл]піридазин-3-он 2,2,2-Трифторацетамідин (450 мг, 11,8 ммоль) суспендували в метанолі (3,0 мл). Потім додавали метил-(E)-3-метокси-2-(5-метокси-1-метил-6-оксо-піридазин-4-іл)проп-2-еноат (1,00 г, 3,93 ммоль), а потім метоксид натрію (1,35 мл, 5,90 ммоль). Суміш нагрівали до 65 °C протягом 2 годин. Ще більше додавали 2,2,2-трифторацетамідину (450,0 мг, 11,8 ммоль та метоксид натрію (1,35 мл, 5,90 ммоль) та суміш збовтували протягом ще 2 годин. Реакцію зупиняли та забезпечували остигання до кімнатної температури. Додавали 2 M водну хлористоводневу кислоту та суміш концентрували у вакуумі. Неочищений продукт очищали за допомогою хроматографії на оксиді кремнію з елююванням ізогексаном:етилацетатом, а потім дихлорметаном:метанолом. Фракції, що містять продукт, об'єднували та концентрували у вакуумі з одержанням 4-метокси-2-метил-5-[6-оксо-2(трифторметил)-1Н-піримідин-5-іл]піридазин-3-ону (520,0 мг, 1,72 ммоль, вихід 43,7 %) у вигляді блідо-жовтої твердої речовини. 1 H ЯМР (400 МГц, d3-метанол) δ ppm=3,80 (3H, s) 4,01 (3H, s) 7,94 (1H, s) 8,13 (1H, s). Метил(E)-3-метокси-2-(5-метокси-1-метил-6-оксо-піридазин-4-іл)проп-2-еноат 4-Метокси-2-метил-5-трибутилстаніл-піридазин-3-он (2,9 г, 6,8 ммоль) та метил-(Z)-2-йод-3метокси-проп-2-еноат (1,5 г, 6,2 ммоль) розчиняли в N, N-диметилформаміді (15,0 мл, 193 ммоль). Додавали фторид цезію (1,9 г, 2,0 екв., 12 ммоль) та суміш дегазували азотом. Потім додавали йодид міді (0,12 г, 0,62 ммоль) та паладій(0) тетракіс(трифенілфосфін) (0,36 г, 0,31 ммоль) та суміш ще раз дегазували азотом у приміщенні в попередньо нагрітому до 55 °C нагрівальному блоці протягом 2 годин. Додавали воду (50 мл) і дихлорметан (50 мл) та реакційну суміш енергійно струшували. Додавали 50,0 мл насиченого водного гідрокарбонату натрію та суміш знову струшували. Дихлорметановий шар збирали та концентрували у вакуумі. Неочищений продукт сушили завантаженням у картридж 120 г оксиду кремнію з елююванням дихлорметаном:етилацетатом (100:0 → 40:60 протягом 20 хвилин, потім підтримували градієнт протягом ще 10 хвилин). Фракції, що містять продукт, об'єднували та концентрували у вакуумі з одержанням 1,12 г коричневого масла, яке затвердівало при відстоюванні. Неочищений продукт далі очищали за допомогою колонкової хроматографії на оксиді кремнію з елююванням ізогексаном:етилацетатом (60:40 → 30:70 протягом 8 хвилин, потім витримували градієнт протягом 5 хвилин, потім переходили на 100 % етилацетат). Фракції, що містять продукт, об'єднували та концентрували у вакуумі з одержанням продукту у вигляді блідо-жовтої твердої речовини (882,0 мг, вихід 56 %). 1 H ЯМР (400 МГц, хлороформ, (12wq161h2)) δ ppm=3,74 (3H, s) 3,77 (3H, s) 3,90 (3H, s) 4,11 (3H, s) 7,52 (1H, s) 7,56 (1H, s). 4-Метокси-2-метил-5-трибутилстаніл-піридазин-3-он До збовтуваного розчину 5-бром-4-метокси-2-метил-піридазин-3-ону (5,00 г, 22,8 ммоль) у тетрагідрофурані (40,6 г, 560 ммоль, 45,7 мл) при -40 °C краплями додавали 2-мезитілмагній броміду (1,0 моля) у тетрагідрофурані (46 г, 45,7 ммоль, 46 мл, 1,0 моль/л) за допомогою краплинної лійки (при підтриманні внутрішньої температури нижче -30 °C увесь час) та суміш збовтували при -40 °C протягом 30 хвилин. Потім краплями додавали три-н-бутилолова хлорид (23,2 г, 68,5 ммоль, 19,3 мл) у вигляді розчину в тетрагідрофурані (20 мл) та суміші дозволяли нагрітися до 0 °C протягом ~1 години. 25 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 Потім реакційну суміш гасили насиченим водяним розчином хлориду амонію (100 мл) та екстрагували етилацетатом (3 × 100 мл). Об'єднані органічні екстракти сушили, фільтрували та концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт завантажували на оксиді кремнію та очищали за допомогою хроматографії з одержанням 4-метокси-2-метил-5-трибутилстаніл-піридазин-3-ону у вигляді червонуватого масла (5,21 г, 12,1 ммоль, вихід 53,2 %). 1 H ЯМР (400 МГц, хлороформ) δ ppm 7,56 (1H, s) 4,14 (3H, s) 3,78 (3H, s) 1,44-1,62 (6H, m) 1,27-1,38 (6H, m) 1,00-1,21 (6H, m) 0,89 (9H, t, J=7,3 Гц). 5-Бром-4-метокси-2-метил-піридазин-3-он може бути одержаний аналогічно схемі реакції 3. Приклад 14 3-Циклогексил-2-(3-фторфеніл)-5-(5-гідрокси-1-метил-6-оксо-піридазин-4-іл)піримідин-4-он 3-Циклогексил-2-(3-фторфеніл)-5-(5-метокси-1-метил-6-оксо-піридазин-4-іл)піримідин-4-он (51,0 мг, 0,118 ммоль) розчиняли в морфоліні (2,0 мл, 23 ммоль). Реакційну суміш збовтували при 95 °C протягом 2 годин. LC продемонструвала відсутність реакції, тому температуру підвищували до 105 °C та реакцію збовтували ще протягом 2 годин. Цього разу реакція підійшла до завершення, тому суміші дозволили охолонути до кімнатної температури. Потім до реакційної суміші обережно додавали водну хлористоводневу кислоту до підкислення суміші. Водний шар промивали дихлорметаном та органічні шари об'єднували, та пропускали через картридж для фазового розділення. Розчинник концентрували у вакуумі та неочищений продукт подрібнювали з 3,0 мл ацетонітрилу, розчин обробляли протягом приблизно 1 хвилини. Тверду речовину збирали фільтрацією з виходом продукту у вигляді блідо-рожевої твердої речовини (25,0 мг, вихід 53,4 %). 3-Циклогексил-2-(3-фторфеніл)-5-(5-метокси-1-метил-6-оксо-піридазин-4-іл)піримідин-4-он Етил-3-фторбензолкарбоксимідат гідрохлорид (135,0 мг, 0,6629 ммоль) суспендували в метанолі (3,0 мл). Потім додавали циклогексанамін (0,066 г, 0,6629 ммоль) та суміш збовтували протягом 2 годин протягом 18 годин. Реакційну суміш поступово нагрівали зі зворотним холодильником та збовтували ще 2 години. Ще додавали циклогексиламін (0,066 г, 0,6629 ммоль) та суміш збовтували зі зворотним холодильником протягом 2 годин. Реакцію зупиняли та концентрували у вакуумі з одержанням масла. Неочищений продукт повторно розчиняли в метанолі (3,0 мл), потім додавали метоксид натрію (0,12 г, 0,57 ммоль) та суміш збовтували протягом 5 хвилин перед додаванням метил(E)-3-метокси-2-(5-метокси-1-метил-6-оксо-піридазин-4-іл)проп-2-еноату (145,0 мг, 0,57 ммоль) та суміш збовтували при 65 °C протягом 3 годин. Реакційну суміш охолоджували та розчинник випарювали у вакуумі, потім неочищений продукт поглинали діетиловим ефіром. Органічний шар промивали насиченим гідрокарбонатом натрію, а водний - промивали діетиловим ефіром. Органічні фази об'єднували, сушили над сульфатом натрію, фільтрували та концентрували у вакуумі, потім очищали за допомогою хроматографії на оксиді кремнію з елююванням ізогексаном:етилацетатом з одержанням продукту (95 мг) у вигляді блідо-жовтої смоли. Далі її очищали за допомогою препаративної HPLC та концентрували у вакуумі з одержанням продукту у вигляді прозорого масла (51,0 мг, вихід 21,8 %). 1 H ЯМР (400 МГц, хлороформ) δ ppm=0,93-1,11 (2H, m) 1,14-1,30 (1H, m) 1,57 (1H, d, J=12,9 Гц) 1,72 (2H, d, J=11,3 Гц) 1,81 (2H, d, J=13,4 Гц) 2,63-2,79 (2H, m) 3,81 (3H, s) 3,87-3,97 (1H, m) 4,21 (3H, s) 7,21-7,26 (1H, m) 7,27-7,30 (1H, m) 7,52 (1H, td, J=7,9, 5,6 Гц) 7,88 (1H, s) 8,07 (1H, s). Метил-(E)-3-метокси-2-(5-метокси-1-метил-6-оксо-піридизан-4-іл)проп-2-еноат одержували, як описано в прикладі 13 вище. Приклад 15 4-Гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-6-пропокси-піридазин-3-он 4-Гідрокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-6-пропоксипіридазин-3-он можна одержувати з 4-метокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-6пропокси-піридазин-3-ону способом, аналогічним описаному, наприклад, у прикладі 1, стадія 1. 4-Метокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-6-пропокси-піридазин-3-он До суміші 4-метокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-1H-піридазин3,6-діону (0,09 г, 0,24 ммоль) та карбонату калію (0,17 г, 1,19 ммоль) в N, N-диметилформаміді (1,4 г, 1,5 мол, 19 ммоль) при кімнатній температурі додавали 1-йодпропан (0,045 г, 0,026 мл, 0,26 ммоль). Одержану в результаті жовту суміш збовтували протягом 3 годин, а потім виливали у воду та екстрагували етилацетатом. Органічні екстракти промивали соляним розчином, фільтрували через картридж для фазового розділення та фільтрат випарювали. Неочищений залишок очищали флеш-хроматографією (30-80 % етилацетат у гексанах, 13 26 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 хвилин, 4 г оксиду кремнію) з одержанням 4-метокси-2-метил-5-[2-метилсульфоніл-4(трифторметил)феніл]-6-пропокси-піридазин-3-ону у вигляді блідо-жовтого масла (0,099 г, 0,236 ммоль, вихід 99,0 %). 1 H ЯМР (400 МГц, CDC13): δ 8,41 (1H, br d), 7,94 (1H, br dd), 7,39 (1H, d), 4,10 (3H, s), 4,044,00 (2H, m), 3,72 (3H, s), 2,99 (3H, s), 1,57-1,52 (2H, m), 0,76 (3H, t). 4-метокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-1H-піридазин-3,6-діон До розчину нітриту натрію (0,11 г, 1,6 ммоль) у концентрованій сірчаній кислоті (3 мл) при 0 °C краплями додавали суспензію 6-аміно-4-метокси-2-метил-5-[2-метилсульфоніл-4(трифторметил)феніл]піридазин-3-ону (0,51 г, 1,352 ммоль) у льодяній оцтовій кислоті (6,294 г, 6 мл, 105 ммоль). Одержаній у результаті суміші дозволяли нагрітися до кімнатної температури та збовтували протягом 40 хвилин. Потім її охолоджували до 0 °C та краплями додавали воду (9 мл). Одержану в результаті суспензію збовтували протягом 60 хвилин при кімнатній температурі, потім розбавляли водою (10 мл) та осад збирали фільтрацією, промивали водою та сушили у вакуумній печі при 55 °C протягом ночі з одержанням 4-метокси-2-метил-5-[2метилсульфоніл-4-(трифторметил)феніл]-1H-піридазин-3,6-діону у вигляді брудно-білої твердої речовини (0,35 г, 0,92 ммоль, вихід 68,25 %). 1 H ЯМР (400 МГц, MeOD): δ 8,38 (1H, br d), 8,08 (1H, br dd), 7,62 (1H, d), 3,95 (3H, s), 3,67 (3H, s), 3,14 (3H, s). 6-Аміно-4-метокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-піридазин-3-он До розчину 4-метокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-6-нітропіридазин-3-ону (0,8 г, 1,964 ммоль) в етанолі (19,7 г, 25 мл, 411 ммоль) при 80 °C додавали форміат амонію (2,502 г, 39,28 ммоль) та гідроксид паладію на вуглеці (0,5517 г, 3,928 ммоль). Одержану в результаті чорну суміш витримували при 80 °C протягом 1 години (спостерігали NB сублімацію форміату амонію), а потім гарячим фільтрували через невелику подушку целіту із промиванням гарячим етанолом, етилацетатом та метанолом. Фільтрат випарювали та одержаний у результаті залишок швидко збовтували з водою протягом 10 хвилин, а потім збирали фільтрацією та сушили у вакуумній печі при 55 °C протягом 2 днів (вихідних). Вихід: 510 мг (69 %, жовта тверда речовина). 1 H ЯМР (400 МГц, MeOD): δ 8,42 (1H, br s), 8,14 (1H, br d), 7,65 (1H, d), 3,94 (3H, s), 3,66 (3H, s), 3,16 (3H, s). 4-Метокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-6-нітро-піридазин-3-он До розчину 4-метокси-2-метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-піридазин-3ону (1,81 г, 5,00 ммоль) у сірчаній кислоті (14,7 г, 8 мл, 138 ммоль) при 0 °C краплями додавали азотну кислоту (1,26 г, 0,891 мл, 20,0 ммоль). Одержаний у результаті розчин збовтували при 0 °C протягом 5 хвилин, потім забезпечували нагрівання до кімнатної температури протягом 15 хвилин, а потім нагрівали до 50 °C ще протягом 2,5 годин. Ще додавали азотну кислоту (1,26 г, 0,891 мл, 20,0 ммоль) та продовжували нагрівати ще 2 години. LC-MS усе ще демонструвала присутність вихідного матеріалу. Ще додавали азотну кислоту (1,26 г, 0,891 мл, 20,0 ммоль) та нагрівання продовжували ще 1 годину. Реакційній суміші дозволяли охолонути до кімнатної температури, а потім обережно виливали в льодяну воду зі швидким збовтуванням. Одержаний у результаті блідо-жовтий осад фільтрували, промивали льодяною водою, а потім сушили у вакуумній печі протягом ночі при 55 °C. З'ясували, що неочищений продукт містив деяку кислотну домішку. Жовтогарячу тверду речовину розчиняли в дихлорметані та органічну фазу промивали водою (з додаванням декількох крапель водного гідроксиду натрію - pН 14), а потім пропускали через картридж для фазового розділення. Фільтрат випарювали при зниженому тиску з одержанням 4-метокси-2метил-5-[2-метилсульфоніл-4-(трифторметил)феніл]-6-нітро-піридазин-3-ону (0,8 г, 1,96 ммоль, вихід 39,3 %) у вигляді блідо-рожевої твердої речовини. 1 H ЯМР (400 МГц, CDCl3): δ 8,38 (1H, br s), 7,98 (1H, dd), 7,41 (1H, d), 4,20 (3H, s), 3,92 (3H, s), 3,00 (3H, s). Приклад 16 4-Гідрокси-2-метил-5-[1-метил-2-оксо-6-(трифторметил)-3-піридил]піридазин-3-он 2-Метокси-6-(трифторметил)піридин До розчину 6-(трифторметил)піридин-2-олу (10,0 г, 10,0 г, 61,3 ммоль) у дихлорметані (3 мл/ммоль, 184 мл) додавали карбонат срібла (22,8 г, 82,8 ммоль, 3,75 мл) та йодметан (87,0 г, 613 ммоль, 38,2 мл) та збовтували в темряві протягом 24 годин. Потім реакційну суміш фільтрували через целіт та промивали дихлорметаном. Фільтрат концентрували при 30 °C при 250 мбар, додавали оксид кремнію та залишок очищали хроматографією з елююванням 0-10 % етилацетатом у гексані. Фракції, що містять продукт, об'єднували з одержанням 2-метокси-6 27 UA 114094 C2 5 10 15 20 25 30 35 40 45 50 55 60 (трифторметил)піридину (6,49 г, 36,6 ммоль, 59,8 % вихід). 1 H ЯМР (CDCl3): δ 7,69 (t, J=8,1 Гц, 1H) 7,25 (d, J=7,5 Гц, 1H) 6,91 (d, J=8,6 Гц, 1H) 3,98 (s, 3H). [2-Метокси-6-(трифторметил)-3-піридил]боронова кислота До розчину 2-метокси-6-(трифторметил)піридину (1,0 г, 5,6 ммоль) та діетилового ефіру (1,2 мл/ммоль, 6,8 мл) при -78 °C в азоті додавали nBuLi (2,5 моль/л) у гексанах (4,7 г, 17 ммоль, 6,8 мл) протягом 5 хвилин та забезпечували нагрівання до кімнатної температури протягом 30 хвилин. Триізопропіловий естер борної кислоти (2,1 г, 11 ммоль, 2,6 мл) у діетиловому ефірі (1,2 мл/ммоль, 6,8 мл) охолоджували до -78 °C та до цього розчину додавали [2-метокси-6(трифторметил)-3-піридил]літій протягом 15 хвилин, а потім нагрівали до кімнатної температури протягом 30 хвилин. Додавали хлороводень (водний 25 %) (10 мл, 10 ммоль) та реакційну суміш розбавляли водою та двічі екстрагували дихлорметаном, пропускали через розділювач фаз та концентрували у вакуумі з одержанням жовтого масла, яке затвердівало протягом ночі. Реакційну суміш адсорбували оксидом кремнію та очищали хроматографією на оксиді кремнію з елююванням 0-25 % етилацетатом/гексаном. Фракції, що містять продукт, об'єднували з одержанням [2-метокси-6-(трифторметил)-3-піридил]боронової кислоти у вигляді жовтої твердої речовини (707 мг, 3,20 ммоль, вихід 59 %). 1 H ЯМР (11vu941h1, CDCl3): δ 8,29 (d, J=7,5 Гц, 1H) 7,34 (d, J=7,5 Гц, 1H) 5,92 (s, 2H) 4,10 (s, 3H). 4-Метокси-5-[2-метокси-6-(трифторметил)-3-піридил]-2-метил-піридазин-3-он До суміші 5-хлор-4-метокси-2-метил-піридазин-3-ону (400 мг, 2,29 ммоль), одержаної, як описано в прикладі 2, додавали [2-метокси-6-(трифторметил)-3-піридил]боронову кислоту (0,71 г, 3,20 ммоль), sPhos (0,19 г, 0,46 ммоль), трис(дибензиліденацетоніл)біспаладій (0,11 г, 0,11 ммоль), фосфат калію (1,00 г, 4,58 ммоль, 0,39 мл) та реакційну суміш розбавляли третбутанолом (1,6 мл/ммоль, 2,88 г, 38,5 ммоль, 3,67 мл). Реакційну суміш нагрівали до 80 °C протягом 50 хвилин. Реакційну суміш розбавляли соляним розчином та екстрагували етилацетатом (3 x). Жовтогарячий розчин пропускали через розділювач фаз, додавали оксид кремнію та концентрували у вакуумі. Потім його очищали хроматографією з елююванням 0-50 % етилацетатом у гексані. Фракції, що містять продукт, об'єднували з одержанням 4-метокси-5-[2метокси-6-(трифторметил)-3-піридил]-2-метил-піридазин-3-ону (545 мг, 0,54 г, 1,73 ммоль, вихід 75,46 %). 5-[2-Гідрокси-6-(трифторметил)-3-піридил]-4-метокси-2-метил-піридазин-3-он В 4 ємності для мікрохвильового реактора додавали по 1 г 4-метокси-5-[2-метокси-6(трифторметил)-3-піридил]-2-метил-піридазин-3-ону (4,0 г, 13 ммоль), а потім 15 мл бромоводню (48 % водяний розчин) (60 мл) та послідовно нагрівали при 40 °C у мікрохвилях протягом 45 хвилин. Реакційні суміші об'єднували та додавали етилацетат, потім соляний розчин, а потім екстрагували етилацетатом (3×10 мл), об'єднані органічні екстракти пропускали через розділювач фаз та концентрували у вакуумі з одержанням білої твердої речовини. Потім його очищали хроматографією з елююванням 0-50 % етилацетатом у гексані. Фракції, що містять продукт, об'єднували з одержанням 5-[2-гідрокси-6-(трифторметил)-3піридил]-4-метокси-2-метил-піридазин-3-ону у вигляді рожевої твердої речовини (1,6 г, 5,3 ммоль, вихід 42 %). 1H ЯМР (11vz747h1, CDCl3): δ 7,83 (s, 1H) 7,75 (d, J=7,6 Гц, 1H) 6,96 (d, J=7,4 Гц, 1H) 4,18 (s, 3H) 3,82 (s, 3H). 4-Метокси-2-метил-5-[1-метил-2-оксо-6-(трифторметил)-3-піридил]піридазин-3-он До розчину 5-[2-гідрокси-6-(трифторметил)-3-піридил]-4-метокси-2-метил-піридазин-3-ону (150 мг, 0,49797 ммоль) у 1,2-диметоксиетані (12 мл/ммоль, 5,98 мл) додавали дикалію карбонат (0,21 г, 1,49 ммоль), а потім йодметан (0,64 г, 4,48 ммоль, 0,28 мл) та реакційну суміш нагрівали зі зворотним холодильником (75 °C) протягом 30 хвилин. Реакційну суміш охолоджували до кімнатної температури та неорганічні тверді речовини фільтрували та промивали етилацетатом та розчинником; додавали оксид кремнію, реакційну суміш концентрували у вакуумі та очищали хроматографією з елююванням 0-35-50 % етилацетатом/гексаном. Фракції, що містять продукт, об'єднували з одержанням 4-метокси-2-метил-5-[1-метил-2оксо-6-(трифторметил)-3-піридил]піридазин-3-ону у вигляді білої твердої речовини (88 мг, 0,28 ммоль, вихід 56,06 %). 1 H ЯМР (12wk938h1, CDCl3): δ 7,82 (s, 1H) 7,55 (d, J=7,5 Гц, 1H) 6,78 (d, J=7,0 Гц, 1H) 4,16 (s, 3H) 3,80 (s, 3H) 3,70 (d, J=1,1 Гц, 3H). 4-Гідрокси-2-метил-5-[1-метил-2-оксо-6-(трифторметил)-3-піридил]піридазин-3-он 28
ДивитисяДодаткова інформація
Назва патенту англійськоюHerbicidal pyridazinone derivatives
Автори англійськоюBhonoah, Yunas, Elliott, Alison Clare, Gaulier, Steven, Ling, Kenneth, Mitchell, Glynn, Morris, James, Alan, Rzepa, Paula Rocha, Viner, Russell Colin
Автори російськоюБхоноах Юнас, Эллиотт Элисон Клэр, Голье Стивен, Линг Кэннет, Митчелл Глинн, Моррис Джэймс Алан, Рцэпа Паула Роча, Винер Расселл Колин
МПК / Мітки
МПК: C07D 237/16, C07D 417/04, C07D 295/10, A01N 43/58, C07D 405/14, C07D 471/04, C07D 413/00, C07D 409/14, C07D 405/12, C07D 401/04, C07D 413/14, C07D 401/14, C07D 405/04
Мітки: гербіцидні, піридазинонові, похідні
Код посилання
<a href="https://ua.patents.su/79-114094-gerbicidni-piridazinonovi-pokhidni.html" target="_blank" rel="follow" title="База патентів України">Гербіцидні піридазинонові похідні</a>
Попередній патент: Спосіб збільшення врожаю корисних рослин
Наступний патент: Комплект розливального стакана, вогнетривкий елемент для нього, спосіб одержання вогнетривкого елемента та спосіб з’єднання двох вогнетривких елементів
Випадковий патент: Полімерний біодеструктивний матеріал для очистки ґрунту від нафти та нафтопродуктів












