Спосіб іммобілізації клітин
Номер патенту: 120536
Опубліковано: 10.11.2017
Автори: Стебленко Людмила Петрівна, Курилюк Алла Миколаївна, Науменко Світлана Миколаївна, Кріт Олексій Миколайович, Макара Володимир Арсенійович, Кобзар Юлія Леонідівна, Ніжельська Олена Ігорівна
Формула / Реферат
1. Спосіб іммобілізації клітин, що включає приготування суспензії культури клітин, нанесення її на підкладинку та висушування на повітрі, який відрізняється тим, що для приготування суспензії використовують дистильовану воду, підкладинка виготовлена з монокристалічного полірованого кремнію, а висушування відбувається за дії магнітного поля з індукцією 0,15-0,20 Тл протягом 7-75 діб при температурі 285-296 K.
2. Спосіб за п. 1, який відрізняється тим, що для приготування суспензії використовують етанол.
Текст
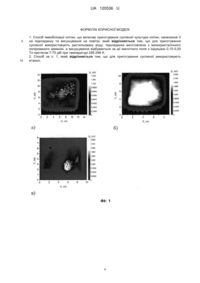
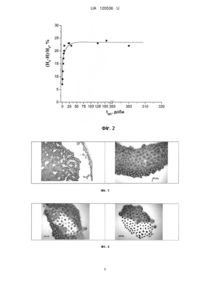
Реферат: Спосіб іммобілізації клітин включає приготування суспензії культури клітин, нанесення її на підкладинку та висушування на повітрі. При цьому для приготування суспензії використовують дистильовану воду, підкладинка виготовлена з монокристалічного полірованого кремнію, а висушування відбувається за дії магнітного поля з індукцією 0,15-0,20 Тл протягом 7-75 діб при температурі 285-296 K. UA 120536 U (12) UA 120536 U UA 120536 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до галузі мікробіології, мікроелектроніки, модифікації поверхні кремнію та може бути використана для підвищення адгезивних властивостей поверхні кремнію, для створення біочипів, для контролю стану поверхні. Прикріплювальні способи іммобілізації мікроорганізмів засновані на утворенні зв'язків між поверхнями клітин та носія. Порівняно з іншими способами іммобілізації, такими як включення всередину гелю, волокон, капсул і т. ін., вони не забезпечують міцність та незворотність закріплення клітин на поверхні. Тому пошук нових способів збільшення ефективності прикріплювальної іммобілізації клітин є актуальним. Відомий спосіб іммобілізації клітин дріжджів (Дигель Н.Э., Жубанова А.А. Влияние водорастворимых полимеров на адгезию клеток к твердым поверхностям // Биотехнология: теория и практика. - 1998. - № 1-2. - С. 122-123). В даному способі на підставі даних про негативний (в цілому) заряд поверхонь клітин та носіїв, показана можливість блокування електростатичного відштовхування поверхонь водорозчинними полімерами. Максимальне збільшення адсорбції дріжджових клітин на 140 % по відношенню до контролю досягалося при застосування розчину поліетилениміну, що пояснюється високою густиною його позитивного заряду. Недоліком такого способу іммобілізації клітин є внесення додаткових речовин, що призводить зокрема до зменшення прозорості середовища і ускладнює оптичні дослідження клітин. В роботі Дигель (Дигель И.Э., Жубанова А.А. Прикрепительная иммобилизация клеток микроорганизмов // Биотехнология: теория и практика. - 1997, № 4. - С. 3-9) запропоновано спосіб ковалентного зв'язування клітин з силікагелем, активованим солями перехідних металів. Імплантовані іони металів здатні змінювати величину, а іноді і знак заряду поверхні, що забезпечує електростатичне притяжіння клітин, оболонки яких переважно мають негативний заряд. Перевагою силікагелю є відсутність набухання в різних розчинниках і водних розчинах, висока механічна міцність, стійкість до дії мікроорганізмів. Носій представляє собою мікропористі матеріали, гранули. За рахунок збільшення площі поверхні сорбційні властивості носія збільшуються, але можливість якісного мікроскопічного спостереження іммобілізованих клітин знижується, або взагалі відсутня, що виступає недоліком цього способу. Стимулююча дія іонів перехідних металів і водорозчинних полімерів зумовлена суттєво різними механізмами. Збільшення прикріплення клітин під дією полімерів відбувається завдяки зменшенню електростатичного відштовхування поверхонь та збільшенню числа сорбційноактивних сайтів, а імплантація у поверхню носія іонів перехідних металів призводить до виникнення якісно нових адсорбційних взаємодій координаційного характеру. Відомо, що при проведенні іммобілізації клітин бажано виключити або звести до мінімуму їх контакт з токсичними для них речовинами, а також температурні та осмотичні стреси. Збільшення адсорбції клітин на поверхні носія можливо досягти без внесення додаткових речовин, а саме за рахунок активації (хімічної активності) поверхні монокристалічного кремнію за допомогою магнітного поля, як показано у роботі (Макара В.А., Васильєв М.А., Стебленко Л.П., Коплак О.В., Курилюк А.Н., Кобзарь Ю.Л., Науменко С.Н. Вызванные действием магнитного поля изменения примесного состава и микротвердости приповерхностных слоев кристаллов кремния. // Физика и техника полупроводников. - 2008, том 42, вып. 9 С. - С. 10611064). Аналіз експериментальних даних, отриманих методом вторинно-іонної мас-спектрометрії і представлених в таблиці, показав, що в приповерхневих шарах кремнію відразу після завершення магнітної обробки в 2-4 рази зростає концентрація іонів лужних металів (K, Na, Ca), + іонів алюмінію та гідроактивних комплексів SiOH в результаті посилення процесів адсорбції домішок на поверхні з оточуючого середовища та процесів гетерування поверхнею домішок з об'єму кристалу. В процесах адсорбції важливу роль відіграє зарядовий стан адсорбуючого центру (дефекту) на поверхні. Вплив магнітної обробки зразків кремнію призводить до значного зростання поверхневого потенціалу (фіг. 1). Характерно, що при цьому електрон або дірка, які захоплюються, залучаються до участі в хемосорбційному зв'язку. Малі терміни магнітної обробки ≤7 діб, які використовувалися в наших експериментах, викликають утворення на поверхні кремнію нестійкої форми адсорбції, яка через певний час релаксує за рахунок протікання процесів десорбції (фіг. 3, 4). Подовження часу магнітної обробки до 300 діб призводить до утворення практично незворотних змін поверхні кремнію (фіг. 2), зокрема адсорбції (фіг. 5). 1 UA 120536 U 5 10 15 20 25 30 35 40 45 50 55 Підкладинка з нанесеними на неї клітинами або частинами клітин може бути використана для створення біочипів. Для цього зазвичай додають адгезивний (клейовий) шар, який з'єднує поверхню планарного носія з іншими гнучкими шарами і тестовими елементами біочипа. За технічною суттю та результатом, що досягається, найближчим до пропонованої корисної моделі є спосіб отримання іммобілізованих висушених мікроорганізмів (SU 1836423 A3, МПК С12N 11/08, А23L 3/34, опубл. 23.08.1993 p.). При здійсненні способу передбачається приготування суспензії шляхом змішування мікроорганізмів (дріжджів) з синтетичним полімером, розчиненим в леткому органічному розчиннику. Таким розчинником може бути ацетон, толуол, етанол, хлористий метилен, циклогексан. Утворену суспензію наносять на поверхню за звичайними рідинними технологіями, після чого леткий розчинник випаровується. Таким чином, на поверхні твердого носія формують плівки з іммобілізованих висушених мікроорганізмів. Носієм може бути картон, фольга, пластик, з яких виготовляють упаковку. Іммобілізовані за таким способом дріжджі можна застосовувати для поглинання (абсорбції) кисню при зберіганні деяких харчових продуктів для запобігання окисленню. Недоліком найближчого аналога є використання летких органічних розчинників, які шкідливо впливають на клітини та на організм людини в процесі виготовлення суспензії, також неможливість візуального спостереження структури іммобілізованих клітин дріжджів мікроскопічними методами через те, що клітини занурені в полімерну плівку. В основу корисної моделі поставлено задачу: досягти високого ступеня фіксації клітин на підкладинці без використання додаткових клеючих речовин та хімічних речовин, які шкідливі для організму; забезпечити тривале зберігання іммобілізованих клітин у звичайних умовах, мати можливість мікроскопічного спостереження та фотографування іммобілізованих клітин на підкладинці без додаткової підготовки зразків, використовувати утворені структури як індикатор стану поверхні кремнію. Поставлена задача вирішується тим, що у способі іммобілізації клітин, який включає приготування суспензії культури клітин, де як розчинник використовують дистильовану воду або етанол, нанесення її на підкладинку та висушування на повітрі, підкладинка виготовляється з пластини монокристалічного полірованого кремнію, а висушування відбувається в умовах дії магнітного поля з індукцією 0,15-0,20 Тл протягом від 7 діб до 75 діб при кімнатній температурі 285-296 K. На фіг. 1 показано поверхневий розподіл електричного потенціалу в зразках кремнію: в контрольних зразках (а) та в зразках, що пройшли обробку в магнітному полі з індукцією 0,17 Тл протягом 75 діб (б), (в). Вигляд мап розподілу електричного потенціалу, зафіксований відразу після вилучення зразків з магнітного поля (б) та через 150 діб після завершення магнітної обробки (в). На фіг. 2 проілюстровано залежність відносної мікротвердості від часу витримки зразків кремнію в постійному магнітному полі: індукція постійного магнітного поля 0,17 Тл. Н 0 мікротвердість вихідних зразків Si; Η - мікротвердість зразків Si після магнітної обробки. На фіг. 3 наведено мікрофотографії поверхні кремнію з нанесеними на них краплями суспензії дріжджів у дистильованій воді, після висихання, без обробки в магнітному полі. В утворених структурах на поверхні кремнію цілі клітини розташовані біля краю краплин, а ближче до центру - клітини з пошкодженими при висиханні оболонками. Ці пошкодження можуть бути пов'язані з нерівномірною швидкістю "гель-золь" переходів при висиханні краплин суспензії. На фіг. 4 наведено мікрофотографії поверхні кремнію з іммобілізованими на неї клітинами дріжджів (суспензія в дистильованій воді) без обробки в магнітному полі через тиждень зберігання. Незначна частина клітин залишилася цілою з непошкодженою клітинною оболонкою, частина клітин - з оболонками нечіткої розмитої форми. Значна кількістьклітин за тиждень зруйнувалася внаслідок процесів дегідратації: на місці клітин, що розпалися, утворюються конкременти з ядра та концентрованих речовин цитоплазми. На фіг. 5 представлені мікрофотографії поверхні кремнію з іммобілізованими на неї клітинами дріжджів (суспензія в дистильованій воді) а) з витримкою в магнітному полі протягом 75 діб, б) з витримкою в магнітному полі протягом 75 діб через 2 роки зберігання. Форма клітин залишилася майже незмінною. Збереглися характерні ознаки початку поділу деяких клітин маленькі бруньки. На фіг. 6 представлені мікрофотографії поверхні кремнію: а) на поверхню нанесено 96 % етанол, 10 діб витримки в магнітному полі; б) з іммобілізованими на неї клітинами дріжджів у спиртовій суспензії (96 % етанол) після дії магнітного поля 10 діб. Утворені структури з мікрокристалів домішок та іммобілізованих клітин виступають індикаторами змін (розподілу) зарядового стану поверхні кремнію під дією магнітного поля. 2 UA 120536 U 5 10 15 20 25 30 35 40 45 Спосіб іммобілізації клітин реалізується наступним чином. Чисту культуру клітин вирощують на стерильному середовищі за оптимальної температури протягом доби, після чого клітини відфільтровують, готують суспензію клітин у дистильованій воді (етанолі) в концентрації, необхідній для створення шару окремих клітин на підкладинці. При випаровуванні дистильованої води або етанолу не утворюється осаду на поверхні. Отриману суспензію наносять за допомогою шприца або капіляра на поліровану знежирену поверхню пластини монокристалічного кремнію, який використовується у мікроелектроніці. Пластини кремнію з нанесеними краплями суспензії поміщають у постійне магнітне (МП) поле, де відбувається висихання крапель суспензії за температури повітря 285-296 K. Ефективний термін дії МП з індукцією 0,15-0,20 Тл становить від 7 діб до 75 діб. При одночасному висиханні та дії МП відбувається активація поверхні кремнію, яка підвищує адгезію клітин на підкладинці. Після висихання краплин утворюється специфічна структура з клітин, іммобілізованих на полірованій світловідбиваючій підкладинці. Клітини міцно закріплені на поверхні і не струшуються при перегортанні пластин. Отримані зразки зручно спостерігати та фотографувати у відбитому світлі за допомогою оптичного мікроскопа. Порівняння фотографій тих самих ділянок, зроблених протягом 2 років, свідчить, що форма іммобілізованих клітин залишається цілісною, на відміну від зразків, нанесених на поверхню кремнію, але не оброблених МП, які руйнуються за кілька діб (фіг. 3-5). Зберігання пластин кремнію з іммобілізованими клітинами відбувається за звичайних умов (кімнатна температура, тиск, вологість) у пластикових пакетах для захисту від пилу. Технічний результат полягає в наступному: 1. При дії магнітного поля на висихаючу краплину суспензії клітин на поверхні кремнію відбувається активація поверхні, зростає величина заряду поверхні, що призводить до збільшення адгезії клітин. 2. Поліровані пластини монокристалічного кремнію являють собою дзеркальну поверхню високої якості. Клітини, які іммобілізовані на такій підкладинці, при спостереженні під мікроскопом у відбитому світлі є добре видимими, включаючи елементи будови клітин. Це робить зручним контроль стану клітин та поверхні, на відміну від клітин, іммобілізованих на гранулах силікатів. Зображення має контрастність, достатню для досліджень, немає потреби забарвлювати прозорі клітини (на відміну від прозорих мікроогранізмів, нанесених на скло). Дистильована вода, яка використовується для створення суспензії клітин, або етанол, при випаровуванні не залишаюсь на поверхні кремнію осаду, який би заважав спостереженню клітин. 3. Іммобілізовані в МП клітини міцно закріплюються на поверхні кремнію, не струшуються при перегортанні. Це може бути використано як допоміжний спосіб для створення біочипів, який не потребує додаткових клеючих речовин та органічних розчинників. 4. За такого способу іммобілізації клітин після зберігання зразків за звичайних умов на повітрі протягом 2 років спостерігається збереження цілісної форми клітин, при тому, що не оброблені МП клітини на поверхні кремнію незворотно руйнуються протягом тижня. Це може бути корисним для створення біочипів, виготовлення препаратів культур мікроорганізмів для довготривалих мікроскопічних досліджень. 5. Утворені структури з клітин та мікрокристалів домішок відображають зарядовий стан поверхні монокристалічного кремнію і можуть слугувати детектором її якості. Суспензія клітин (дріжджів) в комбінації з дією МП стимулює процеси адсорбції домішок на поверхні кремнію. Нанесення суспензії клітин в поєднанні з впливом зовнішніх фізичних полів може бути використано для контролю стану поверхні кремнію (фіг. 6). Таблиця Кількість імпульсів, що реєструються на вторинному іонному мас-спектрометрі для кожної з досліджуваних мас Іон + Na + Аl + Са + K + SiOH Маса елемента Контрольні зразки 23 27 40 41 45 270 55 70 85 17 3 Зразки після магнітної обробки 1016 230 200 190 65 UA 120536 U ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 10 1. Спосіб іммобілізації клітин, що включає приготування суспензії культури клітин, нанесення її на підкладинку та висушування на повітрі, який відрізняється тим, що для приготування суспензії використовують дистильовану воду, підкладинка виготовлена з монокристалічного полірованого кремнію, а висушування відбувається за дії магнітного поля з індукцією 0,15-0,20 Тл протягом 7-75 діб при температурі 285-296 K. 2. Спосіб за п. 1, який відрізняється тим, що для приготування суспензії використовують етанол. 4 UA 120536 U 5 UA 120536 U Комп’ютерна верстка Л. Ціхановська Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C12N 11/14, C12N 13/00
Мітки: клітин, спосіб, іммобілізації
Код посилання
<a href="https://ua.patents.su/8-120536-sposib-immobilizaci-klitin.html" target="_blank" rel="follow" title="База патентів України">Спосіб іммобілізації клітин</a>
Попередній патент: Рознімне з’єднання
Наступний патент: Спосіб хірургічного лікування тяжких розривів печінки
Випадковий патент: Привід круглов'язальної машини