Спосіб одержання заміщеного імідазолу або його нетоксичної фармацевтично прийнятної кислотно-адитивної солі
Номер патенту: 19310
Опубліковано: 25.12.1997
Автори: Рейно Олаві Пєльконен, Рісто Арво Сакарі Ламінтауста, Маттіантеро Ляхде, Ар'я Маркета Калапудас, Арто Йоханес Кар'ялайнен, Ар'ялена Кар'яланен, Мар'я Ліса Сєдервал
Формула / Реферат
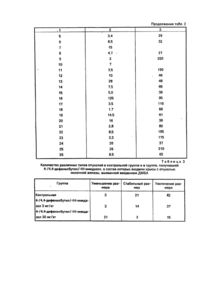
Способ получения замещенного имидазола формулы:
или его нетоксичной фармацевтически приемлемой кислотно-аддитивной соли, где R1, R2, R'1 и R'2, которые могут быть одинаковыми или разными, представляют Н, СН3, С2Н5, С3Н7, ОСН3, NO2, CF3, CHF2, CH2F или галоген;
где R3 представляет Η, СН3 или галоген; R4 представляет Η и R5 представляет Η или ОН или R4 и R5 вместе образуют связь; X и У, которые могут быть одинаковыми или разными, представляют связь имли прямой С/1-2/ алкил и Ζ обозначает 0-2, отличающийся тем, что 4/5/- имидазолальдегид формулы
где R' имеет значение, определенное выше, подвергают взаимодействию с реагентом Гриньяра формулы
где R1, R2, R'1, R'2. X, Υ и Ζ имеют значения, определенные выше, для получения соединения формулы
где R', R1, R2, R'1, R'2, X, Υ и Ζ имеют значения, определенные выше; необязательно, когда R' представляет замещенную или незамещенную бензильную группу, преобразуют данный продукте помощью реакции переноса водорода для получения соединения формулы
дегидратируют продукт, когда R’ представляет Η или замещенный или незамещенный бензил для получения соединения формулы
где R1, R1, R2, R'1. R'2, Χ, Υ и Ζ имеют значения, определенные выше, необязательно гидрируют данный продукт для получения соединения формулы
и необязательно, когда R’ представляет замещенную или незамещенную бензильную группу, гидрогенизируют данный продукт или преобразуют данный продукт с помощью реакции переноса водорода для получения соединения формулы
где R1, R2, R'1, R'2. X, Υ и Ζ имеют значения, определенные выше.
Текст
Предметом настоящего изобретения является способ получения замещенных производных имидазола, их нетоксичных, фармацевтически приемлемых солей присоединения кислоты. Производные имидазола по настоящему изобретению имеют общую формулу I: в которой R1, R2, R1’ и R2’ имеющие одинаковые или различные значения, представляют Н, СН3, С2Н5, С2Н7, ОСН3, NO2 , CF3 . CHF2, CH2F или галоген; R1 представляет Η или где R3 является Н, СН3 или галогеном; R4 представляет Η и R5 представляет Η или ОН, либо элементы R4 и R5 образуют общую связь, X и Y. имеющие одинаковые или различные значения, представляют связь, C1-2 алкил с прямой цепью, a Z является целым числом от 0 до 2. Было установлено, что соединения по настоящему изобретению в зависимости от заместителей R1, R2. R1' и R2' в различной степени обладают свойствами, ингибирующими ароматазу и десмолазу. Среди них имеются соединения, ингибирующие ароматазу, которые характеризуются высоким избирательным действием в отношении ферментов, что является ценным качеством при лечении болезней, вызываемых эстрогенами, например, рака молочной железы. Цель изобретения - получение соединении в ряду имидазолов, обладающих выше указанной активностью. Поставленная цель достигается тем, что 4/5/-имидазолальдегид (II) подвергают взаимодействию с реактивом Гриньяра (III), что позволяет получить соединение формулы (I), в которой R6 представляет ОН (IV). Реактивы Гриньяра получают путем взаимодействия соответствующего галогенированного углеводорода со стружками магния в соответствии с обычным способом. Соединение (IV) далее дегидратируют путем нагрева с KHSO4, что позволяет получить соединения формулы (І), в которой R4 и R5 образуют общую связь (V). Ненасыщенные производные затем гидрогенизируют с образованием соединений формулы (І), в которой R4 и R5 представляют водород. Это изобретение иллюстрируется следующими примерами. Спектры 1H ЯМР определяли при помощи аппарата Брукера WP 80DS/80 мГц). Вещество, выбранное для сравнения, представляло тетраметилсилан. Масс-спектры определяли при помощи аппарата Кратоса Μ 80ΡΡ с автоматическим пультом. Пример 1. 4-/4,4-дифенилбутил/-ІН-имидазол. а) 1-бензил-5-/І-окси-4,4-дифенилбутил/-1Н-имидазол, 2,0 г стр ужек магния покрывали 60 мл сухого тетрагидрофурана. К этой смеси затем по каплям добавляли раствор 1-бром-3,3-дифенилпропана (22,9 г) в 20 мл сухого тетрагидрофурана с такой скоростью, которая обеспечивала равномерное протекание реакции. После окончания добавления реакционную смесь нагревали с обратным холодильником еще в течение одного часа и охлаждали до комнатной температуры. Реакционную смесь затем по каплям добавляли к раствору І-бензил-5-имидазолкарбальдегида (7,35 г) в 80 мл тетрагидрофурана при температуре 60°С. После окончания добавления реакционную смесь нагревали с обратным холодильником в течение 2 часов, охлаждали и выливали в холодную воду. Те трагидрофуран выпаривали и к раствору добавляли концентрированную хлористоводородную кислоту. Этот раствор охлаждали и путем фильтрования удаляли осадок, содержащий целевой продукт в виде хлористоводородной соли, промывали его водой и высуши вали. Выход 14,1 г. Температура плавления 160-168°С. Спектр 1Η ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,50-2,30 (m, 4H), 3,82 (2S, 1H), 4,65 (t, 1H). 45,43 (S, 2H), 7,05-7,50(m, 16H), 8.62 (d, 1H). При использовании аналогичного метода были получены следующие соединения, входящие в объем этого изобретения: I-бензил-5-[I-окси-4-/2-метилфенил-4 -фенил бутил]-1Н-имидазо. Спектр 1Н ЯМР (в виде хлористоводородной соди, МеОН-d4): 1,50-2,40 (m, 4H), 2,21 и 2,15 (25, 3Н), 4,07 (t, 1H), 4,70 (, 1H), 5,49 и 5,46 (2, 2Η), 6,80-7,50 (, 15Н), 8,88 (,1Η). 1-бензил-5-[1-окси-4-/3 /-метилфенил /-4-фенилбутил}-1Н-имидазол. Спектр 1Н ЯМР (в виде хлористоводородной боли, СDCl3: 1,35-2,25 (m, 4H), 2,26 (S, 3H), 3,73 (t, 1H), 4,62 (m, 1H), 5,38 (S, 2H), 6,80-7,40 (m. 15H), 8,51 (S, 1H). 1-бензил-5-[1-окси-4-/4-мвтилфвнил/-4 -фенилбутил]-1Н-имидазол. Спектр 1Н ЯМР (в виде хлористоводородной соли. СDСІ3): 1,40-2,40 (m, 4H), 2,23 и 2,24 (2S, 3H), 3,74 (t, 1H), 4,65 (широкий t, 2Н), 5,38 (S, 2Н), 6,80-7,40 (m, 15Н), 8,55 (S. 1H). 1-бензил-5-[1-окси-4,4-бис/4-метилфенил/бутил}-1Н-имидазол. Температура плавления хлористоводородной соли 155-158°С. 1-бензил-5-[1-окси-4,5-дифенилпентил]-1Н-имидазол. Спектр 1Η ЯМР (в виде кислой сернокислой соли, MeOH-d4): 1,35-1,90 (m, 4H), 2,82 (широкий S, 3H), 4,54 (t 1H), 5,42 (S, 2Η), 6,85-7,50 (m, 10Н), 8,80 (S, 1H). 1-бензил-5-[1-окси-4-/4-метоксифенил/ -4-фенилбутил}-1 Н-имидазол. Спектр 1H ЯМР (в виде хлористоводородной соли, МеОН-d4): 1.50-2,30 (m, 4H), 3,70 (S, 3H), 3,79 (t, 1H), 4,69 (t, 1H). 5,46 (S, 2H), 6,79(t, 2H), 7,0-7,55(S, 13H), 8,85(S, 1H). 1-бензил-5-[1-окси-4,4-бис/4-метоксифенил/бутил]-1H-имидазол. Спектр 1Н ЯМР (в виде основания, MeOH-d4): 1,50-2,20 (m, 4H), 3,66 (t, 1H), 3,74 (S, 6Н), 4,50 (t, 1H), 5,24 (S, 2H), 6,70-7,60 (m, 15H). 1-бензил-5-[4-/2-фторфенил/-1-окси-4-фенилбутил]-1Н-имидазол. Температура плавления хлористоводородной соли 160-163°С. Спектр 1H ЯМР (в виде хлористоводородной соли, CDCI3): 1,45-2,45 (m, 4H), 4,17 (t, 1H), 4,67 (t, 1H), 5,43 (S, 2H), 6,80-7,50 (m, 15H), 8,43 (S, 1H). 1-бензил-5-[4-/2-фторфенил/-1-окси-4-фенилбутил]-1Н-имидазол. Температура плавления хлористоводородной соли 168-171°С. Спектр 1Η ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,50-2,30 (m, 4H), 3,84 (t, 1H), 4,68 (t, 1H), 5,49 (S, 2H), 6,80-7,55 (m, 15H), 8,87 (d, 1H). 1-бензил-5-[1-окси-5,5-дифенилпентил]-1Н-имидазол. Спектр 1H ЯМР (в виде основания, СDСІ3): 1,2-2,2 (m, 6Н), 3,70 (t, 1H), 4,54 (t, 1H), 5,46 (S, 2H), 6,8-7,3 (m. 10H), 8,58 (S. 1H). 1-бензил-5-[1-окси-6,6-дифенилгексил]-1Н-имидазол. Температура плавления хлористоводородной соли 147-149°С. Спектр 1H ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,6-2,2 (m, 8Н), 3,85 (t, 1H), 4,60 (t, 1H), 5,53 (S, 2H), 7,0-7,4 (m, 15H), 7,47 (S, 1H), 8,90(S, 1H). 1-бензил-5-[4-/4-этилфенил/-1-оксии-4 –фенилбутил]-1H-имидазол. Спектр 1Η ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,71 (t, 3H), 1,50-2,35 (m, 4H), 2,57 (g, 2H), 3,78 (t, 1H), 4.68 (t, 1H), 5,46 (S, 2H), 6,9-7,5 (m, 15H), 8,82 (d, 1H). 1-бензил-5-(4,4-бис/-4-фторфенил/-1-оксибутил}-1Н-имидазол( Спектр 1H ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,50-2,00 (m, 4H), 3,86 (t, 1H), 4,70 (t, 1H), 5,52 (S, 2H), 6,80-7,50 (m, 14Н), 8,89 (d, 1Η). б) 1-бензил-5-/4,4-дифенил-1-бутенил/-1Н-имидазол. Хлоргидрат 1-бензил-5-[1-окси-4,4-ди-фенилбутил/-1H-имидазола (5,0 г) и 30,0 г безводного бисульфата калия нагревали при температуре 150°С в течение 4 часов. Эту смесь охлаждали, и по каплям добавляли 90 мл этанола для растворения полученного продукта. Эту смесь затем фильтровали, а фильтрат выпаривали до незначительного объема. Добавляли воду и смесь подщелачивали с помощью гидроокиси натрия. Полученный продукт экстрагировали в метиленхлориде, промывали водой и выпаривали до сухого состояния. Полученный продукт затем превращали в хлористоводородную соль, используя для достижения этого сухую хлористоводородную кислоту в сухом етилацетате. Выход составил 2,9 г. Температура плавления 204-206°С. Спектр 1Н (в виде хлористоводородной соли, MeOH-d4): 2,88-3,05(m, 2H), 4,08 (t, 1H), 5,29 (S, 2H), 6,226,32 (m, 2H), 7,00-7,50 (m, 16H), 8,87 (d, 1H). При использовании аналогичного метода были получены следующие соединения, входящие в объем этого изобретения. 1-бензил-5-[4,4-бис/3-метилфенил/-1-бутенил]-1Н-имидазол. Температура плавления хлористоводородной соли 152-156°C. Спектр 1Η ЯМР (в виде хлористоводородной соли, MeOH-d4): 2,26 (S, 6H), 2,85-3.05 (m, 2Н), 3,99 (t, 1H), 5,27 (S, 2Н), 6,21-6,31 (m, 2H), 76,80-7,50 (m, 14Н), 8,86 (d, 1H). 1-бензил-5-[-4-/3,5-диметилфенил/-4-/3-метипфвнил/-1-бутенил-]-1H- имидазол. Спектр 1Η ЯМР (в виде хлористоводородной соли, MeOH-d4): 2,22 (S, 3H), 2,23 (S, 3H), 2.26 (S, 3H), 2,853,05 (го, 2Н), 3,94 (t, 1H), 5,26 (S, 2Н), 6,20-6,30 (m, H) 6,75-7,50 (m, 13Н), 8,84 (d, 1H). 1-бензил-{4-/3,5-диметилфенил/-4-фенил-1-бутенил}-1Н-имидазол. Температура плавления 110-112°С. Спектр 1Н ЯМР (в виде хлористоводородной соли, MeOH-d4): 2,22 (S, 6Н), 2,85-3,05 (m, 2H), 3,98 (t, 1H), 5,26 (S, 2H), 7,20-630 (m, 2H), 6,75-7,5 (m, 14Н), 8,87 (d, 1H). 1-бензил-5-[4-/2-метилфенил /-4-фенил -1-бутенил]-1Н-имидазол, Спектр 1Н ЯМР (в виде бисульфа та, MeOH-d4): 2,19 (S, 3H), 2,80-3,05 (m, 2Н), 4,28 (t, 1H), 5,29 (S, 2H), 6,06,60 (m, 2H), 7,0-7,5 (m, 14Н), 7,52 (d, 1H), 8,85 (d, 1H). 1-бензил-5-[4- /3-метилфенил /-4-фенил-1-бутенил]-1 Н-имидазол, Спектр 1Н ЯМР (в виде основания, CDCI3): 4,27 (S, 3H), 2,75-3,95 (m, 2Н), 3,93 (t, 1Н), 4,89 (S, 2Н), 5,706,10 (m, 2Н), 6,80-7,40 (m, 16H). 1-бензил-5-[4-/4-метилфенил /-4-фенил -1-фенил-1-бутенил]-1H- имидазол. Спектр 1Н ЯМР (в виде основания, CDCI3): 2,27 (S, 3H), 2,70-2,95 (m, 2Н), 3,93 (t, 1Н), 2,89 (S, 2H), 5,606,20 (m, 2H), 6,80-7,50 (m, 16Н). 1-бензил-5-[4,4-бис/4-метил фенил /-1-бутенил]-1Н-имидазол. Температура плавления хлоргидрата 128132°С. 1-бензил-5-[4-/4-метоксифенил/-4-фенил-1-бутенил]-1Н-имидазол. Спектр 1Н ЯМР (в виде хлористоводородной соли, СРСІ3): 2,70-2,95 (m, 2Н), 3,95 (t, 1Н), 5,16 (S, 2Н), 5,706,20 (m, 2Н), 6,70-7,40 (m, 15Н), 8,99 (S, 1Н). 1-бензил-5-[4,4-бис/4-метоксифенил/-1-бутенил]-1H-имидазол. Спектр 1Н ЯМР (в виде основания, СDCl3): 2,60-2,90 (ш, 2Н), 3,74 (S, 6H), 3,78 (t, 1Н), 4,92 (S, 2H), 5,806,00 (m, 2Н), 6,65-7,50 (m, 15Н). 1-бензил-5-[4,5-дифенил-1-пентенил]-1Н-имидазол. Спектр 1Н ЯМР (в виде основания, CDCI3): 2,30-2,55 (m, 2H), 2,88 (m, 3H), 4,93 (S, 2Н), 5,5-6,1 (m, 2H), 6,87,5 (m, 17Н). 1-бензил-5-[4-/2-фторфенил /-4-фенил-1-бутенил]-1Н-имидазол. Температура плавления хлоргидрата 195-201°С. Спектр 1Н ЯМР (в виде основания, СDCl3): 2,75-3,00 (m, 3H), 4,34(t, 1H), 5,97 (S, 2Н), 5,80-6,10 (m, 2H), 6,75-7.50 (m, 16H). 1-бензил-5-[4-/4-фторфенил /-4-фенил-1-бутенил]-1H-имидазол. Спектр 1Н ЯМР (в виде основания, СDСl3): 2,60-2,95 (m, 2H), 3,96 (t, 1H), 4.93 (S, 2H), 5,80-6,05 (m, 2Н), 6,75-7,50 (m, 16H). 1-бензил-5-[6,6-дифенил-1-гексенил]-1Н-имидазол. Температура плавления хлоргидрата 184-186°С. 1-бензил-5-|4-/4-этилфенил/-4-фенил-1 -бутинил)-1Н-имидазол. Спектр 1Н (в виде хлористоводородной соли. MeOH-d4): 1,17 (t, 3H), 2,56 (q, 2H), 2.93-2.98 (m, 2Н), 4,03 (t, 1Η), 5,28 (S, 2H), 6,20-6.34 (m, 2Н), 7,08-7.41 (m, 14H), 7,52 (d, 1H), 8.87(d, 2H). 1-бензил-5-[4,4-бис/4-фторфенил/-1-бутенил]-1H-имидазол. Спектр 1Η ЯМР (в виде хлористоводородной соли, CDCI3): 2,78-2,94 (m, 2Н), 4.01 (t, 1H), 5,27 (S, 2Н), 5,826,34 (m, 2Н), 6,83-7,40 (m, 14Н), 9,21 (d, 1H). в) 1-бензил-5-/4,4-дифенилбутил/-1Н-) имидазол. Хлоргидрат 1-бензил-5-/4,4-дифенил-1-бутенил/-1Н-имидазола (2,0 г) растворяли в этаноле и добавляликаталитическое количество Pd/C (10%). Реакционную смесь интенсивно перемешивали при комнатной температуре в атмосфере водорода до тех пор, пока не прекращалось поглощение водорода. Затем смесь фильтровали, а фильтрат выпаривали до сухого состояния. Остаток, который представлял целевой продукт, очищали при помощи испарительной хроматографии, осуществляя элюирование смесью метиленхлорида и метанола. Выход составил 1,3 г. Температура плавления хлористоводородной соли 200-2029С. Спектр 1Η ЯМР (в виде хлористоводородной соли, MeOH-d4): 1.30-1,70 (m, 2Н), 1,85-2,20 (m, 2H), 2,61 (m, 2H), 3,83 (t, 1Н), 5,35 (S, 2Н), 7,05-7,50 (m, 16Н), 8,89 (S, 1Η). При использовании аналогичного метода были получены следующие соединения, входящие в объем этого изобретения: 1-бензил-5-(4-/2-метилфенил/-4-фенил-бутил]-1H-имидазол. Температура плавления хлоргидрата 200205°C. Спектр 1Η ЯМР {в виде хлористоводородной соли, CDCl3); 1,30-1,80 (m, 2Н), 1,80-2,15 (m, 2Η), 2,22 (m, 3H), 2,48 (t, 2H), 4,02 (t, 1H), 5,31 (S, 2Н), 6,96(S, 1H), 7,0-7,5 (m, 14Н), 9.28 (S, 1H), 1-бензил-5-[4-/3-метилфенил/-4-фенил-бутил]-1Н-имидазол. Температура плавления хлоргидрата 148158°С. Спектр 1Η ЯМР (в виде хлористоводородной соли, CDCl3): 1,30-1,80 (m, 2Η), 1,80-2,25 (m, 2Н), 2,30(S, 3H), 2,49 (t, 2H), 3,78 (t. 1H), 5.29 (S, 2H), 6,90-7,50 (m, 15H), 9,24 (S, 1H). 1-бензил-5-[4-/4-метилфенил/-4-фенилбутил]-1Н-имидазол. Температура плавления хлоргидрата 164170°С. Спектр 1Η ЯМР (в виде хлористоводородной соли, СDCl3): 1,25-1,75 (m, 2Н), 1,80-2,25 (m, 2Н), 2,29 (S, 3H), 2,48 (t, 2Н), 3,8 (t, 1H), 5,31 (S, 2Н), 6,80-7.50 (m, 15Н), 9.35 (S, 1H). 1-бензил-5-/4,5-дифенилпентил/-1Н-имидазол. Температура плавления хлоргидрата 166-170°С. Спектр 1Η ЯМР (в виде хлористоводородной соли, МеОН-d4): 1,15-1,90 (m, 4Н), 2.49 (t, 2H), 2,81 (m, 3H), 5,30 (S, 2H), 6,90-7.50 (m, 16H), 8,82 (S, 1H). 1-бензил-5-[4-/4-метоксифенил/-4-фенилбутил]-1Н-имидазол. Температура плавления хлоргидрата 180187°С. Спектр 1Н ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,25-1,70 (m. 2H), 1,85-2,20 (m, 2H), 2.62 (t, 2H), 3,74 (S, 3H), 3,78 (t, 1H), 5,34 (S, 2H), 6,81 (d. 2H), 7,0-7,5 (m, 13H), 8,84 (d, 1H). 1-бензил-5-[4-/2-фторфенил /-4-фенил-бутил]-1Н-имидазол. Температура плавления хлоргидрата 185196°С. Спектр 1Η ЯМР (в виде хлористоводородной соли, МеОН-d4): 1,25-1,75 (m, 2Н), 1,80-2,20 (m,2H), 2,65 (t, 2H), 4,18 (t, 1H), 5,37 (S, 2H), 6,80-7,5 (m, 15H), 8,89 (d, 1H). 1-бензил-5-[4-/4-фторфенил/-4-фенил-бутил]-1Н-имидазол. Температура плавления хлоргидрата 172174°С. Спектр 1Н ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,25-1,70 (m, 2H), 1,80-2,25 (m, 2H), 2,64 (t, 2H), 3,85 (t, 1H), 5,37 (S, 2H), 6,80-7,50 (m, 15Н), 8,90 (d, 1H). 1-бензил-5-/5,5-дифенилпентил/-1Н-имидазол. Спектр 1Н ЯМР (в виде основания, MeOH-d4): 1,1-1,6 (m, 4H), 1,8-2,1 (m, 2H), 2,37 (t, 2Н), 3,72 (t, 1H), 5,11 (S, 2H), 6,67 (S, 1H), 6,9-7,3 (m, 15H), 7,59 (S, 1H). 1-бензил-5-[4-/4-этилфенил/-4-фенил-бутил]-1Н-имидазол. Спектр 1H ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,17 (t, 3H), 1,40-1,70 (m, 2Н), 1,90-2,20 (m, 2H), 2,57 (q, 2H), 3,80 (t, tH), 5,34 (S, 2H), 7,00-7,50 (m, 15Н), 8,87 (d, 1H). 1-бензил-5-[4,4-бис/4-фторфенил/бутил] -1Н-имидазол. Спектр 1Н ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,30-1,70 (m, 2Н), 1,80-2,25 (m, 2H), 2,64 (t, 2H), 3,87 (t, 1H), 5,40 (S, 2H), 6,80-7,50 (m, 14H), 8,92 (d, 1H). д) 4-/4,4-дифенилбутил/-1Н-имидазол. Хлоргидрат 1-бензил-5-/4,4-дифенилбутил/-1H-имидазола (0,6 г) гидрогенизировали в смеси 20 мл 2 н. раствора хлористоводородной кислоты и 10 мл этанола при температуре 80°С и использовании в качестве катализатора Р/С (10%). После прекращения поглощения водорода реакционную смесь охлаждали, фильтровали и выпаривали до сухого состояния. Добавляли воду и смесь подщелачивали с помощью гидроокиси натрия. Полученный продукт затем экстрагировали метиленхлоридом, промывали водой, высушивали с помощью сульфата натрия и выпаривали до сухого состояния. Остаток представлял целевой продукт в виде основания, которое превращали в хлоргидрат в этилацетате, используя для этого сухую хлористоводородную кислоту. Вы ход составил 0,2 г. Температура плавления 204-206°С. Спектр 1H ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,40-1,90 (m, 2H), 1,90-2,30 (m, 2Н), 2,75 (S, 2H), 3,95 (t, 1H), 7,00-7,40 (m, 11Н), 8,72 (d, 1H). При использовании аналогичного метода были получены следующие соединения, входящие в объем этого изобретения: 4-[4,4-бис/3-метилфенил/бутил]-1H-имидазол. Температура плавления хлоргидрата 122-129°С. Спектр 1Н ЯМР (в виде хлористоводородной соли, MeOH-d4); 1,40-1,90 (m, 2H), 1,90-2,30 (m, 2H), 2,26 (S, 6H), 2,73 (t, 2H), 3,85 (t, 1H), 6,80-7.25 (m, 9Н), 8,73 (d, 1H). 4-[4-/3,5-диметилфенил/-4-/3-метилфен-ил/бутил]-1Н-имидазол. Температура плавления хлоргидрата 7582°С. Спектр 1Н ЯМΡ (в виде хлористоводородной соли, MeOH-d4): 1,40-1,90 (m, 2H), 1,90-2,30 (m, 2Н), 2,22 (S, 3H), 2,23 (S, 3H), 2,27 (S, 3H), 2,74 (t, 2H), 3,81 (t, 1H), 6,75-7,30 (m, 8H), 8,72 (d, 1H). 4-[4-/3,5-диметилфенил/-4-фенил бутил] -1Н-имидазол. Температура плавления хлоргидрата 104-106°С. Спектр 1Н ЯМΡ (в виде хлористоводородной соли, MeOH-d4): 1,40-1,90 (m, 2Η), 1,90-2,30 (m, 2H), 2,23 (S, 6H), 2,74 (t, 2H), 3,85 (t, 1H), 6,84 (m, 3H), 7,22 (m, 6Н), 8,72 (d, 1H). 4-[4-/3,4-диметилфенил/-4-фенил бутил] -1Н-имидазол. Температура плавления хлоргидрата 118-121°С. 4-/4-/2-метилфенил/-4-фенилбутил]-1Н-имидазол. Температура плавления хлоргидрата 151-154,5°С. Спектр 1Н ЯМР (в виде хлористоводородной соли, СDCl4): 1,50-2,20 (m, 4H), 2,22 (S, 3H), 2,71 (t, 2Н), 4,09 (t, Μ), 6,81 (S, 1Н), 7.0-7,4 (m, 9Н), 9,04 (S, 1H). 5-[4-/3-метилфенил/4-фенилбутил]-1H -имидазол. Температура плавления хлоргидрата 140-153°С. Спектр 1Η ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,40-1,85 (m, 2Η), 1.85-2.25 (m, 2H), 2,27 (S, 3H), 2,74 (t, 2H), 3,90 (t, 1H), 6,80-7,30 (m. 10H), 8,69 (d, 1H). 4-[4-/4-метил фенил /-4-фенилбутил]-1Н -имидазол. Температура плавления хлоргидрата 173-177°C Спектр 1Н ЯМР (в виде хлористоводородной соли, CDCl3 + 2 капли MeOH-d4): 1,40-1,80 (m, 2Н) 1,80-2.25 (m, 2Н), 2,28 (S, 3H), 2,71 (t, 2Н), 3,87 (t, 1H), 6,86 (m, 1H). 7,09 (S, 4H), 7,21 (m, SH), 8,71 (d, 1H). 4-[4-/4-метоксифенил /-4-фенилбутил]-1Н-имидазол. Температура плавления хлоргидрата 156-159°С. Спектр 1H ЯМР (в виде хлористоводородной соли. CDCl3): 1,40-1,90 (m,2H), 1,90-2,30 (m, 2H), 2,71 (m, 2H), 3,76 (S, 3H), 3,87 (t, 1H), 6,82 (d, 2H), 6,90{S, 1H), 7,13(m, 2Η), 7,21 (m, 5H), 8,68 (S, 1H). 4-[4,4-бис/4-метоксифенил /бутил]-1Н-имидазол. Температура плавления хлоргидрата 138-142°С. Спектр 1Н ЯМР (в виде хлористоводородной соли, CDCl3): 1,40-1,25 (m, 4Н), 2,71 (t, 2H), 3,75 (S, 6H), причем в этом случае имеет место (t, 1Н), 6,78 (d, 4Н), 6,83 (S, 1H), 7,8 {d, 4H), 9,02 (S, 1H). 4-/4,5-дифенилпентил/-1Н-имидазол. Спектр 1Н ЯМР (в виде хлористоводородной соли, CDCl3): 1,20-1,90 (m, 4H), 2,57 (t, 2Н), 2,83 (m, 3H), 6,71 (S, 1H), 6,80-7,40 (m, 10Н), 8,84 (S, 1H). 4-/5,5-дифенилпентил/-1Н-имидазол. Спектр 1Н ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,3-1,5 (m, 2H), 1,5-1,7 (m, 2H), 1,8-2,3 (m, 2H), 2,656 (t, 2H), 3,746 (t, 1H), 7,06-7,2 (m, 11Н), 8,716 (d, 1H). 4-(6,6-дифенилгексил)-1Н-имидазол Спектр 1Η ЯМР (в виде основания. CDCl3): 1,1-1,7 (m, 6Н), 1,8-2,2 (m, 2H), 2,530 (t. 2Н), 3,847 (t, 1H), 6,685 (S, 1Н), 7,2 (S, 10Н), 7,470 (S, 1H), 9,6 (широкий S, 1H). 4-[4,4-бис/4-метилфенил /бутил)-1Н-имидазол. Температура плавления хлоргидрата 176-179°С. 4-(4-/4-фторфенил/-4-фенилбутил]-1Н-имидазол. Температура плавления хлоргидрата 175-182°С. 4-[4-/2-фторфенил /-4-фенилбутил]-1H-имидазол. Температура плавления хлоргидрата 182-190°С. 4-[4-/4-этилфенил/-4-фенилбутил]-1Н-имидазол. Спектр 1Η ЯМР (в виде хяористоводородной соли МеОН-d4): 1,18(1, 3H), 1,40-1,90 (m, 2Н), 1,90-2,30 (m, 2Н), 2,57 (q, 2H), 2,75 (t, 2Н), 3,91 (t, 1H), 6,95-7,30 (m, 10H), 8,73 (d, 1H). 4-(4,4-бис/4-фторфенил/бутил]-1Н-имидазол. Спектр 1Η ЯМР (в виде хлористоводородной соли, МеОН-d4): 1,40-1,85 (m, 2Н), 1,90-2,30 (m, 2H), 2,77 (t, 2H), 3,98 (t, 1H), 6,80-7,40 (m, 9Н), 8,72 (d, 1H). Пример 2. 4-4-/4-фторфенил/-4-фенилбутил]-1Н-имидазол. Концентрированный водный раствор формиата аммония (0,98 г, 15,6 ммолей) по каплям добавляли к кипящей смеси 1-бензил-5-[4-/4-фторфенил/-4-фенилбутил]-1Н-имидазола (1,5 г, 3,9 ммолей) и 10% Pd/C (0,156 г) в 16 мл 50% этанола. Эту смесь нагревали с обратным холодильником в течение 2 часов. Катализатор отфильтровывали, а растворитель выпаривали. Добавляли 2М раствор NaOH и полученный продукт после этого экстрагировали в етилацетате. Фазу этилацетата высушивали и выпаривали до сухого состояния, что позволило получить целевой продукт. Выход составил 1,02 г. Температура плавления хлористоводородной соли (из этилацетата) равнялась 175-182°С. Спектр 1Η ЯМР (в виде хлористоводородной соли, MeOH-d4): 1,40-1,90 (m, 2H), 1,90-2,30 (m, 2H), 2,75 (t, 2H), 3,96 (t, 1H), 6,85-7,36 (m, 10Н), 8.74 (d, 1H). В соответствии с выше указанной процедурой было получено следующее замещенное производное: 4-[4-/2-фторфенил/-4-фенилбутил]-1Н-имидазол. Температура плавления хлоргидрата 182-190°С. Спектр 1Н ЯМР (в виде хлористоводородной соли, MeOH-d4): 1.45-1,95 (m, 2H), 1,95-2,30 (m, 2Н). 2,77 (t, 2Н), 4,29 (t, 1H), 6,85-7,45 (m, 10H), 8,74 (d, 1H). Пример 3. 4-/4,4-дифенил-1-бутенил/-1Н-имидазол. а) 4-/1-окси-4,4-дифенилбутил/-1Н-имидазол. Концентрированный водный раствор формиата аммония (4,0 г) по каплям добавляли к кипящей смеси 1бензил-5-/p-окси-4,4-дифенилбутил/-1Н-имидазола (4,5 г) и 10% Pd/C (0,5 г) в 50 мл 50% этанола. Эту смерь нагревали с обратным холодильником в течение 2 часов. Катализатор отфильтровывали, а растворитель выпаривали. Добавляли 2М раствор NaOH и полученный продукт экстрагировали в этилацетате. Фазу этилацетата высушивали и выпаривали до сухого состояния, что позволило получить целевой продукт, который использовали на следующей стадии б). б) 4-/4,4-дифенил-1-бутенил/-1H-имидазол. 4-/1-Окси-4,4-дифенилбутил/-1Н-имидазол (3,0 г) и 20 г безводного бисульфата калия нагревали при температуре 150°С в течение 4 часов. Эту смесь охлаждали и добавляли 90 мл этанола для растворения полученного продукта. Смесь подщелачивали гидроокисью натрия. Полученный продукт экстрагировали в метиленхлориде, промывали водой и выпаривали до сухого состояния. Целевой продукт превращали в хлористоводородную соль, используя для этого сухой хлороводород в этилацетате, Температура плавления выше 240°С. Спектр 1Η ЯМР (в виде хлористоводородной соли, СDCl4): 2,904-3,068 (m, 2Н), 4,116 (t, 1Η), 6,05-6.35 (m, 2H), 6,998 (d, 1H), 7,22-7,25 (m, 10Н), 8,719 (d, 1H). Соединения по настоящему изобретению являются Особенно полезными в качестве ингибиторов ароматазы и поэтому успешно применяются при лечении болезней, вызываемых эстрогенами, например, рака молочной железы. Эстрогены являются важными стероидами в физиологии и нормальном развитии мелочной железы и половых органов у женщин. С другой стороны, эстрогены стимулируют рост злокачественных опухолей, вызываемых эстрогенами, в частности злокачественных опухолей молочной железы и матки, причем они могут увеличивать опасность развития злокачественной опухоли молочной железы при введении в виде фармацевтических доз в течение длительного периода времени. Избыточное образование эстрадиола также может вызывать другие доброкачественные нарушения в гормоно-зависимых органах. Важное значение эстрогенов в качестве стимуляторов и/или регуляторов роста злокачественных опухолей подчеркивается тем фактом, что антиэстрогены занимают центральное место при лечении злокачественных опухолей молочной железы, имеющей многочисленные рецепторы эстрогена. Действие антиэстрогенов выражается в связывании рецепторов эстрогена, в результате чего ингибируется биологическое воздействие эстрогенов. Другим подходом, направленным на блокирование действия эстрогенов, является ингибирование синтеза эстрогенов. Это было достигнуто в клинических усло виях с помощью аминоглютетимида, ингибирующего синтез вредных стероидов. Синтез эстрогенов можно блокировать путем ингибирования ароматазы фермента, которая является ключевым ферментом в биохимическом синтезе эстрогенов. Ингибирование ароматазы имеет важное значение потому, что некоторые опухоли молочной железы синтезируют эстрадиол и эстрон в этом месте, в результате чего стимулируется постоянный рост опухоли. Способность соединений по этому изобретению ингибировать ароматазу фермента испытывалась в лабораторных условиях. В ходе исследования использовали фермент с ароматазой человека. Этот фермент готовили из плаценты человека, которая отличается большим содержанием этого фермента. Микросомную фракцию (100000 х г осадка) готовили центрифугированием. Ферментный препарат использовали без дальнейшей очистки. Испытуемые соединения добавляли вместе с 1,2 / 3Н/-андростен-3,17-дионом, скорость распада которого составляла 100000 распадов в минуту, и системой генерации NADPH. Концентрации испытуемых соединений равнялись 0,001; 0,01; 0,1 и 1,0 ммоль. Инкубацию производили при температуре 37°С в течение 40 минут. Ароматизация 1,2 /3Н/-андростен-3,17-диона привела к образованию 3Н2О. Насыщенную тритием воду и насыщенный тритием субстрат легко разделяли при помощи миниколонны "ерРАКР ", в которой происходило поглощение стероида и элюирование свободной воды. Счет радиоактивности вели при помощи жидкостного сцинтилляционного счетчика. Степень ингибирования ароматазы определяли при сравнении радиоактивности 3Н2О у образцов, обработанных ингибитором, и у контрольных образцов, не содержащих ингибитора. Значения средней концентрации ингибирования (IC-50) высчитывали в виде концентраций, ингибирующи х активность фермента на 50%. Эти концентрации представлены в табл. 2. Активность в отношении расщепления боковой цепи холестерина (С СС) (десмолаза) измеряли по методу Пазанена и Пелконена ("Овроида") (43: 517-527, 1984). Инкубацию производили в 1,5 мл пластиковых пробирках Эппендорфа с использованием в качестве единого устройства вибратора Эппендорфа, центрифуги и термостата. В 300 мл инкубационном объеме готовили субстрат (5 ммолей) по методу Ханукоглу и Джефкоута, в который затем добавляли радиоактивный 3Н-4-холестерин, скорость распада которого составляли 100000 распадов в минуту, (чистоту этого соединения проверяли с помощью тонкослойной хроматографии) в 0,5% "Твине 20я, 10 ммол Μ СІ2, 5 мкмолей цианокетона и 2 ! ммоля NADPH. Контрольные образцы содержали все вышеуказанные вещества, но ферментный препарат инактивировали до инкубации посредством добавления 900 мкл метанола. В качестве источника фермента использовали митохондриальную фракцию (1 мг белка) из плаценты человека или надпочечников коров. После инкубации в течение 30 минут при температуре 37°С реакцию завершали путем добавления 900 мкл метанола; в каждый термостат добавляли маркер, представляющий 14С-4-прегненолон со скоростью распада 1500 распадов в минуту, после чего пробирку интенсивно встряхивали. После достижения равновесного состояния в течение 10 минут осажденные метанолом белки отделяли путем центрифугирования (8000 х г а течение 2 минут), а всплывающий слой засасывали в 1 мл пластиковый шприц и переносили в предварительно уравновешенную (75% метанол) миниколонну. Эту колонну промывали одним мл 75% метанола, а затем 3 мл 80% этанола. Элюат 80% метанола помещали в счетную пробирку и добавляли 10 мл сцинтилляционной жидкости. Счет радиоактивности вели с использованием программы с двумя метками в жидкостном сцинтилляционном счетчике (LKB Rack Beta). Типичные значения активности для ферментного препарата плаценты человека и надпочечников коровы соответственно представляли 0,5-3 и 50-100 ммолей прегненолона, образованного на мг белка в минуту. В экспериментах по ингибированию полученное вещество (в интервале концентраций от 1 до 100 мкмолей) добавляли к инкубационной смеси в объеме 10-20 мкл обычно в виде раствора в метаноле или этаноле. Такой же объем растворенного вещества добавляли в контрольную инкубационную пробирку. Значения средней концентрации ингибирования (концентрация, вызывающая 50% ингибирование) определяли графически, а полученные результаты представлены в табл. 2. Противоопухолевое действие исследовали в живом организме в отношении аденокарциномы молочной железы у крыс, вызванной ДМБА, в соответствии со следующим методом. Аденокарциному молочной железы вызывали введением ДМБА у самок крыс в возрасте 50 ± 2 дней. Лечение испытуемым соединением начинали после появления пальпируемых опухолей. Размер опухоли и количество опухолей определяли один раз в неделю. Размеры опухолей в контрольной группе, лечение в которой проводили растворителем, сравнивали с аналогичными показателями в испытуемых гр уппах. С хема ежедневного введения лекарственного препарата была рассчитана на пять недель, после чего животных умерщвляли. Определяли изменение размеров опухолей. Результаты определяли в виде изменений размеров опухолей и делили на три группы, а именно увеличивающиеся, стабильные и уменьшающиеся размеры опухолей. Проводили испытание противоопухолевого действия 4-/4,4-дифенилбутил/-1Н-имидазола (соединение 9 в табл. 2), результаты которого представлены в табл. 3. Остр ую токсичность, среднюю летальную дозу, определяли с использованием молодых взрослых самок мышей вида ΜΡΙ. Введение испытуемых соединений производили перорально. Значения средней летальной дозы испытуемых соединений формулы (1) равнялись 350 мг/кг или больше. Суточная доза для больного изменяется от 20 до 200 мг при введении пероральным способом. Это изобретение иллюстрируется следующими примерами. Спектры 1Η ЯМΡ определяли при помощи аппарата Брукера WP 80 DS (80 мГц). Вещество, выбранное для сравнения, представляло тетраметилсилан. Масс-спектры определяли при помощи аппарата Кратоса Μ 80 РГ с автоматическим пультом.
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of substituted imidazole or nontoxic pharmaceutically acceptable acid-additive salt thereof
Назва патенту російськоюСпособ получения замещенного имидазола или его нетоксичной фармацевтически приемлемой кислотно-аддитивной соли
МПК / Мітки
МПК: C07D 233/64, A61K 31/415
Мітки: фармацевтично, спосіб, солі, кислотно-адитивної, імідазолу, прийнятної, нетоксичної, заміщеного, одержання
Код посилання
<a href="https://ua.patents.su/8-19310-sposib-oderzhannya-zamishhenogo-imidazolu-abo-jjogo-netoksichno-farmacevtichno-prijjnyatno-kislotno-aditivno-soli.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання заміщеного імідазолу або його нетоксичної фармацевтично прийнятної кислотно-адитивної солі</a>
Попередній патент: Гербіцидний засіб
Наступний патент: Каталізатор для дегідрування вуглеводнів
Випадковий патент: Спосіб насичення рідини вуглекислим газом