Хінолінілпіролопіразоли
Номер патенту: 80571
Опубліковано: 10.10.2007
Автори: Бейт Дуглас Уейд, Їнглінг Джонатан Майкл, Сойєр Джейсон Скотт
Формула / Реферат
1. Сполука формули II
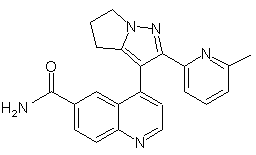
Формула II
та її фармацевтично прийнятні солі.
2. Сполука, яка являє собою 2-(6-метилпіридин-2-іл)-3-(6-амідохінолін-4-іл)-5,6-дигідро-4Н-піроло[1,2-b]піразол, та її фармацевтично прийнятні солі.
3. Фармацевтична композиція, яка містить сполуку за п. 1 або її фармацевтично прийнятну сіль, складний ефір або проліки разом із фармацевтично прийнятним розріджувачем, наповнювачем або носієм.
4. Сполука за п. 1 або її фармацевтично прийнятна сіль для застосування у способі лікування людини або тварини.
5. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для лікування раку.
Текст
1. Сполука формули II 3 клітин [Врана та ін. - Wrana et al., (1994) Nature 370: 41-347]. Спочатку TGF-β зв'язує рецептор типу II, який є конститутивно активною трансмембранною серин/треонін-кіназою. Потім до комплексу залучається рецептор тину І, який фосфорилується на домені GS та активується для фосфорилування подальших сигнальних компонентів (наприклад, протеїнів Smad) для ініціювання внутрішньоклітинного сигнального каскаду. Показано, що конститутивно активний рецептор типу І (мутант T204D) ефективно передає реакції TGF-β, компенсуючи таким чином потребу у TGF-β та рецепторі типу II [Візер та ін. Wieser et al., (1995) EMBO J. 14: 2199-2208]. Хоча сигнальних функцій рецептора типу III не виявлено, він підвищує спорідненість TGF-β2 до рецептора типу II, забезпечуючи ефективність цього ферменту, практично однакову з активністю TGF-β1 та TGF-β3 [Лопес-Касильяс та ін. - LopezCasillas et al., (1993) Cell 73: 1435-1444]. У клітинах судинного ендотелію рецептор типу III відсутній. Замість нього клітини ендотелію експресують структурно подібний протеїн, що має назву ендоглін [Хейфец та ін. - Cheifetz et al., (1992) J. Biol. Chem. 267: 19027-19030], який зв'язує тільки TGF-β1 та TGF-β3 з високою спорідненістю. Таким чином, відносна ефективність TGF-β відображає тип рецепторів, експресованих у системі клітини та органу. Окрім регулювання компонентів у багатофакторному сигнальному шляху, розподіл синтезу поліпептидів TGF-β впливає також на фізіологічну функцію. Розподіл ТGF-β2 та TGF-β3 більш обмежений [Деринк та ін. - Derynck et al., (1988) EMBO J. 7: 3737-3743] у порівнянні з TGF-β1, наприклад, присутність TGF-β обмежена тканинами мезенхімального походження, тоді як TGF-β1 присутній у тканинах як мезенхімального, так і епітеліального походження. TGF-β1 є багатофункціональним цитокіном, якій відіграє вирішальну роль у відновленні тканин. Високі концентрації TGF-β1 постачаються до місця пошкодження гранулами тромбоцитів [Ассоуян та Спорн - Assoian and Sporn (1986) J. Cell Biol. 102: 1217-1223]. TGF-β1 ініціює послідовність явищ, які сприяють загоєнню, в тому числі хемотаксис клітин, наприклад, лейкоцитів, моноцитів та фібробластів, та регуляцію факторів росту та цитокінів, які беруть участь в ангіогенезі, поділ клітин, пов'язаний з відновленням тканини, та запальні реакції. TGF-β1 також стимулює синтез компонентів позаклітинної матриці [Роберте ті ін. Roberts et al., (1986) Proc. Natl. Acad. Soi. USA 83: 4167-4171; Спорн та ін. - Sporn et al., (1983) Science 219: 1329-1330; Maccar - Massague (1987) Cell 49: 437-438] і - що має важливе значення для розуміння патофізіології TGF-β1 - TGF-β1 забезпечує авторегуляцію свого синтезу [Кім та ін. - Kim et al., (1989) J. Biol. Chem. 264: 7041-7045]. Сполуки, розкриті в цьому описі, здатні інгібувати також активність інших кіназ, наприклад, р38-кінази та/або KDR (VEGFR2) кінази. Випробування для визначення активності таких кіназ відомі вг шузі, і фахівець може випробувати розкриті сполуки на таку активність. 80571 4 Розкритий винахід стосується конкретної сполуки формули II також 2-(6-метилпіридин-2-іл)-3-(6-амідохінолін-4-іл)5,6-дигідро-4Н-піроло[1,2-b]піразол та його фармацевтично прийнятних солей. Вищевказану сполуку розкрито у загальному вигляді та заявлено [у заявці PCT/US02/11884, поданій 13 травня 2002p.], яка претендує на пріоритет заявки на [патент США №60/293,464, поданої 24 травня 2001p.], і яку включено до цього опису шляхом посилання. Вищевказану сполуку вибрано з урахуванням її неочікувано значно більш сприятливого токсикологічного профілю у порівнянні зі сполуками, конкретно розкритими у вищезгаданій заявці. Термін "ефективна кількість", вжитий, наприклад, у словосполученні "ефективна кількість сполуки формули І", означає кількість сполуки за цим винаходом, здатну інгібувати TGF-β. Позначення "мкМ" (μΜ) означає "мікромолярний". Загальні хімічні терміни вживаються в цьому описі у своїх звичайних значеннях. У всіх схемах синтезів та прикладах вжито такі абревіатури: DMF (ДМФ) - диметилформамід THF (ТГФ) - тетрагідрофуран Ms - месил, тобто метилсульфоніл ТНР (ТГП) - тетрагідропіран Сполуки, розкриті в цьому описі, можна одержати за поданими нижче схемами та прикладами. Приклади в жодному разі не слід розуміти як такі, що будь-яким чином обмежують можливі способи одержання відповідних сполук. Подана нижче схема ілюструє одержання сполуки формули І. Подана нижче схема ілюструє одержання сполуки формули II. 5 80571 6 етилового складного ефіру метансульфонової кислоти Розчин 2-[4-(2-піридин-2-іл-5,6-дигідро-4Нпіроло[1,2-b]піразол-3-іл)-хінолін-7-ілокси]-етанолу (293мг, 0,78ммоль) та метансульфонілхлориду (68мкл, 0,81ммоль) у безводному піридині (5мл) перемішували протягом 2год. Видаляли піридин у вакуумі, і екстрагували залишок хлороформом. Органічний шар промивали насиченим розчином бікарбонату натрію і сушили над сульфатом натрію, одержуючи бажаний проміжний продукт, вказаний у підзаголовку, у вигляді білої піни (425мг, 100%). MS ES+ m/e 451,1 (M-1). D. Одержання 7-(2-морфолін-4-іл-етокси)-4-(2піридин-2-іл-5,6-дигідро-4Н-піроло[1,2-b]піразол-3іл)-хіноліну Подані нижче приклади більш детально ілюструють процеси одержання сполук за цим винаходом, схематично показані на Схемі І та Схемі II. Приклад 1 Одержання 7-(2-морфолін-4-ілетокси)-4-(2-піридин-2-іл-5,6-дигідро -4Нпіроло[1,2-b]піразол-3-іл)-хіноліну А. Одержання 4-(2-піридин-2-іл-5,6-дигідро-4Нпіроло[1,2-b]піразол-3-іл)-7-[2-(тетрагідропіран-2ілокси)етокси]хіноліну 4-(2-піридин-2-іл-5,6-дигідро-4Н-піроло[1,2b]піразол-3-іл)-хінолн-7-ол (376мг, 1,146ммоль), карбонат цезію (826мг, 2,54ммоль) та 2-(2брометокси)-тетрагідро-2Н-піран (380мкл, 2,52ммоль) у ДМФ (5мл) нагрівали при 120°С протягом 4год. Гасили реакційну суміш насиченим розчином хлориду натрію, після чого екстрагували хлороформом. Органічний шар сушили над сульфатом натрію і концентрували у вакуумі. Реакційну суміш очищали на колонці із силікагелем з елююванням при зміні складу елюенту від дихлорметану до 10% метанолу в дихлорметані, і одержували проміжний продукт, вказаний у підзаголовку, у вигляді жовтого масла (424мг, 81%). Мас-спектр (MS ES+) m/e 457,0 (M+1). B. Одержання 2-[4-(2-піридин-2-іл-5,6-дигідро4Н-піроло[1,2-b]піразол-3-іл)-хінолін-7-ілокси]етанолу Нагрівали розчин 4-(2-піридин-2-іл-5,6-дигідро4Н-піроло[1,2-b]піразол-3-іл)-7-[2-(тетрагідропіран2-ілокси)етокси]хіноліну (421мг, 0,92ммюль) у суміші оцтової кислоти, тетрагідрофурану та води (4:2:1) (20мл). Видаляли розчинник у вакуумі і екстрагували залишок сумішшю хлороформу з ізопропіловим спиртом (3:1). Органічний шар промивали насиченим розчином бікарбонату натрію і сушили над сульфатом натрію. Концентрували у вакуумі. Залишок був досить чистим для застосування на наступній стадії згідно зі схемою (425мг, 100%). MS ES+ m/e 373,1 (M+1). C. Одержання 2-[4-(2-піридин-2-іл-5,6-дигідро4Н-піроло[1,2-b]|піразол-3-іл)-хінолін-7-ілокси] 2-[4-(2-піридин-2-іл-5,6-дигідро-4Н-піроло[ 1,2b]піразол-3-іл)-хінолін-7-ілокси]-етиловий складний ефір метансульфонової кислоти (87мг, 0,19ммоль) та морфолін (1мл) нагрівали при 50°С протягом 4год. Видаляли морфолін у вакуумі, і екстрагували залишок сумішшю ізопропілового спирту з хлороформом (1:3). Органічний шар промивали розчином хлориду натрію і сушили над сульфатом натрію. Після концентрування у вакуумі одержували бажаний продукт, вказаний у заголовку, у вигляді жовтуватої твердої речовини (83мг, 100%). MS ES+ m/e 442,0 (M+1). Приклад 2 Одержання 2-(6-метилпіридин-2-іл)-3-(6амідохінолін-4-іл)-5,6-дигідро-4Н-піроло[1,2b]піразолу A. Одержання 6-бром-4-метилхіноліну Розчин 4-бромфеніламіну (1екв.) в 1,4-діоксані охолоджували при перемішуванні приблизно до 12°С. Повільно додавали сірчану кислоту 12екв.), і нагрівали суміш до кипіння. До розчину додавали краплями при нагріванні зі зворотним холодильником метилвінілкетон (1,5екв.). Після закінчення додавання нагрівали розчин ще протягом 1 год. Випарювали реакційну суміш досуха і розчиняли в дихлорметані. Доводили рН розчину до 8 за допомогою 1Μ розчину карбонату натрію і тричі екстрагували водою. Після хроматографування залишку на SіO2 (елюент суміш гексану з етилацетатом, 70/30) одержували проміжний продукт, вказаний у підзаголовку. MS FS+ m/e 158,2 (M+1). B. Одержання метилового складного ефіру 6метилпіридин-2-карбонової кислоти 6-метилпіридин-2-карбонову кислоту (10г, 72,9ммоль) суспендували у дихлорметані (200мл). Охолоджували суміш до 0°С. Додавали метанол 10мл), 4-диметиламінопіридин (11,6г, 94,8ммоль) та гідрохлорид 1-(3-диметикаміно-пропіл)-3етилкарбодііміду (EDC) (18,2г, 94,8ммоль). Перемішували суміш при кімнатній температурі 7 протягом 6год., промивали водою і розсолом і сушили над сульфатом натрію. Суміш фільтрували і концентрували у вакуумі. Після хроматографування залишку на SіO2 (елюент 50% етилацетату в і океані) одержували бажаний проміжний продукт, вказаний у підзаголовку (9,66г, 92%) у вигляді безбарвної рідини. 1 Н ЯМР (CDCІ 3) δ 7,93-7,88 (n, 1H), 7,75-7,7 (m, 1H), 7,35-7,3 (n, 1H), 4,00 (s, 3H), 2,60 (s, 3H). C. Одержання 2-(6-бромхінолін-4-іл)-1-(6метилпіридин-2-іл)-етанону Розчиняли 6-бром-4-метилхінолін (38,5г, 153ммоль) у 600мл безводного ТГФ. Охолоджували до -70°С і додавали краплями 0,5Μ розчин гексаметилдисилазанату калію (KN(SiMe3)2, 400мл, 200ммоль) протягом 2год, підтримуючи температуру нижче -65°С. Одержаний розчин перемішували при -70°С протягом 1год., і додавали краплями протягом 15хв. розчин метилового складного ефіру 6метилпіридин-2-карбонової кислоти (27,2г, 180ммоль) у 100мл безводного ТГФ. У процесі додавання складного ефіру колір суміші змінювався з темно-червоного на гороховозелений, і утворювався осад. Перемішували суміш при -70°С протягом 2год., після чого давали нагріватися до кімнатної температури при перемішуванні протягом 5год. Охолоджували суміш, після чого гасили 12-н. НСІ до рН=1. Підвищували рН до 9 додаванням твердого карбонату калію. Відділяли розчин декантацією від твердої фази і екстрагували двічі 200мл етилацетату. Об'єднували органічні екстракти, промивали водою і сушили над карбонатом калію. Тверду фазу перемішували у суміші 200мл води та 200мл етилацетату і обробляли додатковою кількістю карбонату калію. Відділяли органічний шар і сушили його разом з вищезгаданими екстрактами в етилацетаті. Концентрували розчин у вакуумі, і одержували темне масло. Пропускали це масло через шар діоксиду кремнію (300мл) із застосуванням дихлорметану, а потім етилацетату. Об'єднували відповідні фракції і концентрували у вакуумі, одержуючи масло бурштинового кольору. Змивали це масло зі стінок колби дихлорметаном, а потім розбавляли гексаном, збовтуючи вміст колби. Одержували 38,5г (73,8%) бажаного проміжного продукту у вигляді жовтої твердої речовини. MS ES+=341 (M+1). D. Одержання 1-[2-(6-бромхінолін-4-іл)-1-(6метилпіридиі-2-іл)-етиліденаміно]-піролідин-2-ону Суміш 2-(6-бромхінолін-4-іл)-1-(6метилпіридин-2-іл)-етанону (38,5г, 113ммоль) та гідрохлориду 1-амінопіролідинону (20г, 147ммоль) у 115мл піридину перемішували при кімнатній температурі протягом 10год. Додавали приблизно 50г неактивованого молекулярного сита 4Å. Продовжували перемішування ще протягом 13год., додавали 10-15г діоксиду кремнію, і фільтрували суміш через шар діоксиду кремнію (50г). Промивали шар діоксиду кремнію 3л етилацетату. Фільтрати об'єднували і концентрували у вакуумі. Відділяли осад гідразону фільтруванням і відсмоктували досуха, одержуючи 80571 8 33,3г (69,7%) бажаного проміжного продукту у вигляді злегка забарвленої твердої речовини. MS ES+=423 (M+1). Ε. Одержання 6-бром-4-[2-(6-метилпіридин-2іл)-5,6-дигідро-4Н-піроло[1,2-b]піразол-3-іл]хіноліну До суміші карбонату цезію (1,2екв.) та 1-[2-(6бромхінолін-4-іл)-1-(6-метилпіридин-2-іл)етиліденаміно]-піролідин-2-ону (33,3г, 78,7ммоль) додавали 300мл безводного Ν,Νдиметилформаміду. Перемішували суміш протягом 20год. при 100°С. (У процесі реакції суміш може темніти). Видаляли Ν,Νдиметилформамід у вакуумі. Залишок розподіляли між водою та дихлорметаном. Водний шар додатково екстрагували дихлорметаном. Фільтрували органічні фази через шар діоксиду кремнію (300г) з елююванням 1,5л дихлорметану, 1,5л етилацетату і 1,5л ацетону. Відповідні фракції об'єднували і концентрували у вакуумі. Одержаний осад відділяли фільтруванням, і одержували 22,7г (71,2%) бажаного проміжного продукту у вигляді злегка забарвленої твердої речовини. MS ES+=405 (M+1). F. Одержання метилового складного ефіру 4[2-(6-метилпіридин-2-іл)-5,6-дигідро-4Н-піроло[ 1,2b]піразол-3-іл] -хінолін-6-карбонової кислоти До суміші ацетату натрію (19г, 230ммоль) та паладієвого каталізатора - комплексу [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладію (II) з дихлорметаном (1:1, 850мг, 1,04ммоль) у 130мл метанолу додавали 6-бром-4-[2-(6-метилпіридин2-іл)-5,6-дигідро-4Н-піроло[1,2-b]піразол-3-іл]хінолін (22,7г, 45ммоль). Створювали над сумішшю атмосферу монооксиду вутлецю під тиском 50фунт/дюйм2 (345кПа) і перемішували при нагріванні при 90°С протягом 1год., безперервно додаючи в реактор монооксид вуглецю. Давали суміші охолоджуватися протягом 8год., знов створювали у реакторі тиск монооксиду вуглецю і нагрівали при 90°С. (Тиск може підвищуватися приблизно до 75фунт/дюйм2 (517кПа). Реакція завершувалася приблизно за 1год., коли тиск переставав змінюватися, а хроматографія в тонкому шарі (елюент толуол/ацетон, 1:1) посвідчувала відсутність залишкового броміду. Розподіляли суміш між дихлорметаном (600мл) та водою (1л). Водну фазу додатково екстрагували дихлорметаном (400мл). Органічний розчин фільтрували через шар діоксиду кремнію (300мл), і промивали фільтр 500мл дихлорметану, 1200мл етилацетату і 1500мл ацетону. Ацетонову промивну рідину відкидали. Відповідні фракції об'єднували і концентрували, одержуючи 18,8г (87,4%) бажаного проміжного продукту у вигляді рожевого порошку. MS ES+=385 (M+1). G. Одержання 2-(6-метилпіридин-2-іл)-3-(6амідохінолін-4-іл)-5,6-дигідро-4Н-піроло[1,2b]піразолу 9 Суміш метилового складного ефіру 4-[2-(6метилпіридин-2-іл)-5,6-дигідро-4Н-піроло[1,2b]піразол-3-іл]-хінолін-6-карбонової кислоти у 60мл 7-н. розчину аміаку в метанолі нагрівали при 90°С у реакторі з нержавіючої сталі для роботи під тиском протягом 66год. Тиск у реакторі при цьому підвищувався приблизно до 80 фунтів на кв. дюйм (550кПа). Цей тиск підтримували до завершення реакції. Охолоджували реактор, і концентрували коричневу суміш у вакуумі. Твердий залишок очищали, застосовуючи два з'єднаних послідовно картриджі з 12г сорбенту Redi-Pak у кожному, з елююванням ацетоном. Відповідні фракції об'єднували і концентрували у вакуумі. Одержану злегка забарвлену тверду речовину суспендували у дихлорметані, розбавляли гексаном і відфільтровували. Одержували бажаний продукт, вказаний у заголовку, у вигляді злегка забарвленої твердої речовини (1,104г, 63,8%). MS ES+=370 (M+1). Розкриті в цьому описі сполуки випробовували на інгібування TGF-β за поданими нижче методиками. Очищення рецептора TGF-β типу І та реакції з кіназами in vitro Для рецепторів TGF-β типу І (RIT204D): Мічений 6X-HIS домен цитоплазматичної кінази кожного рецептора експресували і очищали з лізатів клітин Sf9 комах, як коротко описано нижче: Осаджені клітини через 48-72год. після інфекції лізували у лізісному буфері (LB: 50мМ Трис, рН7,5, 150мМ NaCl, 50мМ NaF, 0,5% NP40 зі свіжододаним 20мМ β-меркаптоетанолом, 10мМ імідазол, 1мМ PMSF, 1Х повний інгібітор протеаз без вмісту EDTA, продукт фірми BoelmngerMannheim). Лізати клітин просвітлювали центрифугуванням і 0,45мкМ фільтрували перед очищенням афінною хроматографією з Ni/NTA (Qiagen). Хроматографічна методика: Врівноважували колонку 10 колонковими об'ємами (CV) LB, завантажували пробу, промивали 10 колонковими об'ємами буфері RIPA (50мМ Трис, рН7,5, 150мМ NaCl, 1% NP40, 1мМ EDTA, 0,25% деоксихолату натрію зі свіжододаним 20мМ β-меркаптоетанолом, 1мМ PMSF), промивали 10 CV LB, промивали 10 CV 1Х KB (50мМ Трис, рН7,5, 150мМ NaCl, 4мМ MgCl2, 1мМ NaF, 2мМ β-меркаптоетанол) і елюювали лінійним градієнтом 1KB, який містив 200мМ імідазол. Обидва ферменти мали ступінь чистоти приблизно 90% і виявляли автофосфорилувальну активність. Реакційні суміші: 170-200нМ фермент у 1Х KB, серія розведень випробовуваної сполуки у 1Х КВ/16% ДМСО (кінцева концентрація від 20мкМ до 80571 10 1нМ при кінцевій концентрації ДМСО 4%), реакції ініціювали введенням суміші АТР (кінцева концентрація 4мкМ АТР на 1мк Kі 33Р-g-ATP) у 1Х KВ. Реакційні суміші інкубували при 30°С протягом 1год. Припиняли реакції і кількісно аналізували суміші, застосовуючи стандартне осадження TCA/BSA на планшети зі скловолокнистими фільтрами Millipore FB та рахування сцинтиляцій на приладі MicroBeta JET із застосуванням рідкого сцинтилятора. Сполуки, розкриті в цьому описі, інгібують домен кінази з рецептором TGF-β тину І (RIT204D) зі значеннями ІС50
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinolinyl-pyrrolopyrazoles
Автори англійськоюBeight Douglas Wade, Sawyer Jason Scott, Yingling Jonathan Michael
Назва патенту російськоюХинолинилпирролопиразолы
Автори російськоюБейт Дуглас Уейд, Сойер Джейсон Скотт, Инглинг Джонатан Майкл
МПК / Мітки
МПК: A61K 31/4709, A61P 35/00, C07D 487/04
Мітки: хінолінілпіролопіразоли
Код посилання
<a href="https://ua.patents.su/8-80571-khinolinilpirolopirazoli.html" target="_blank" rel="follow" title="База патентів України">Хінолінілпіролопіразоли</a>
Попередній патент: Спосіб одержання труб зі сплавів на основі титану
Наступний патент: Похідні тіазолідину як інгібітори hyak3
Випадковий патент: Пристрій для вимірювання просторового розподілу інтенсивності змінного магнітного поля












