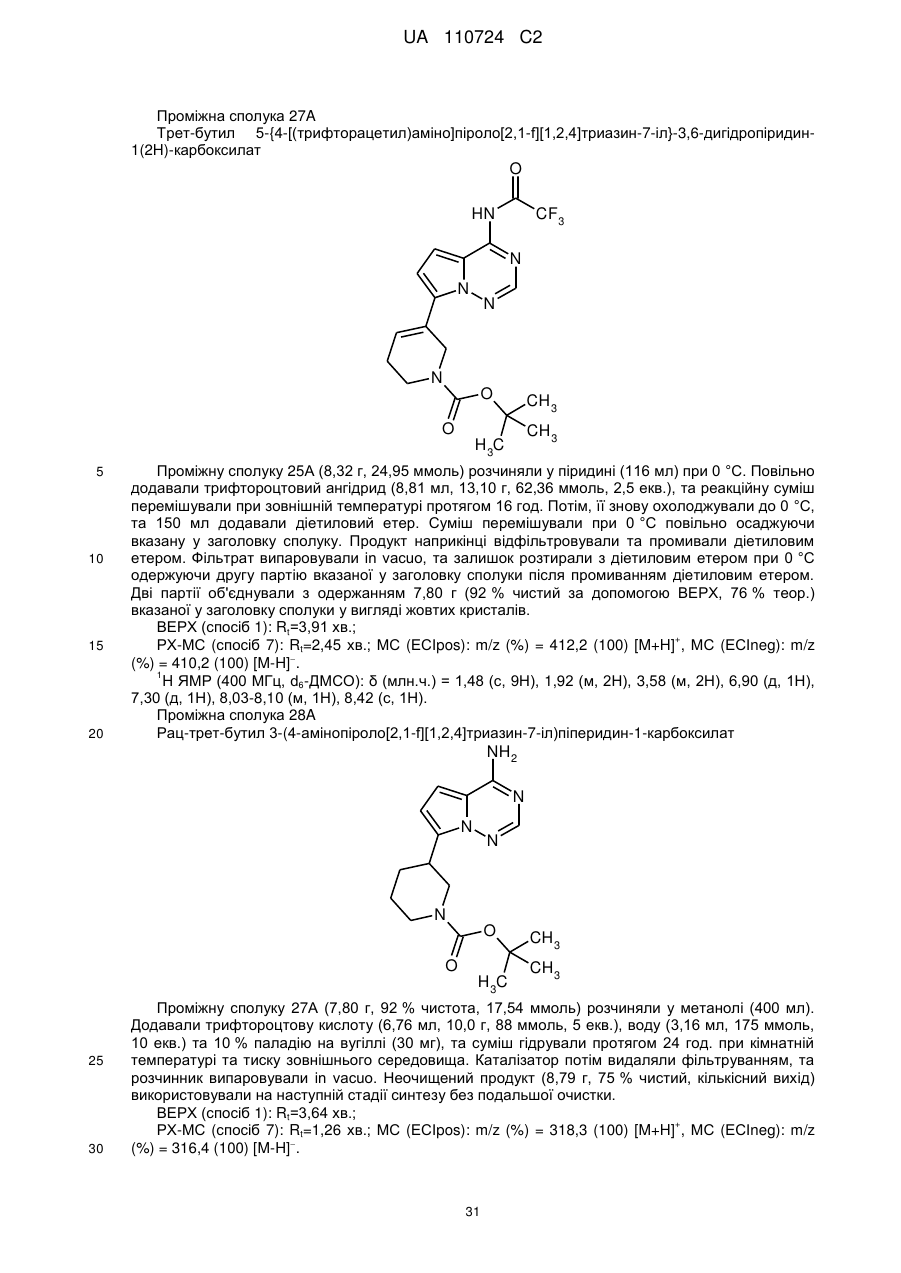
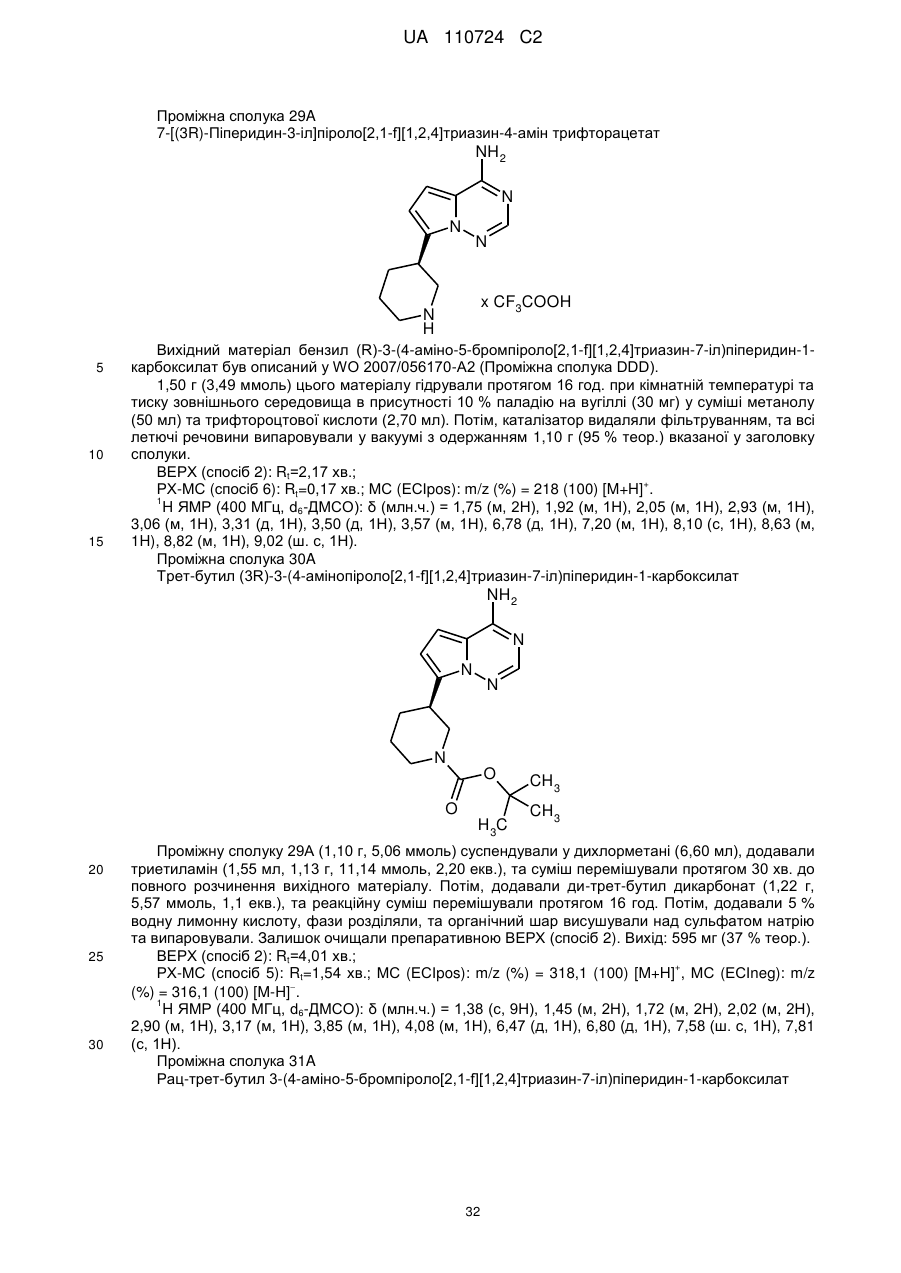
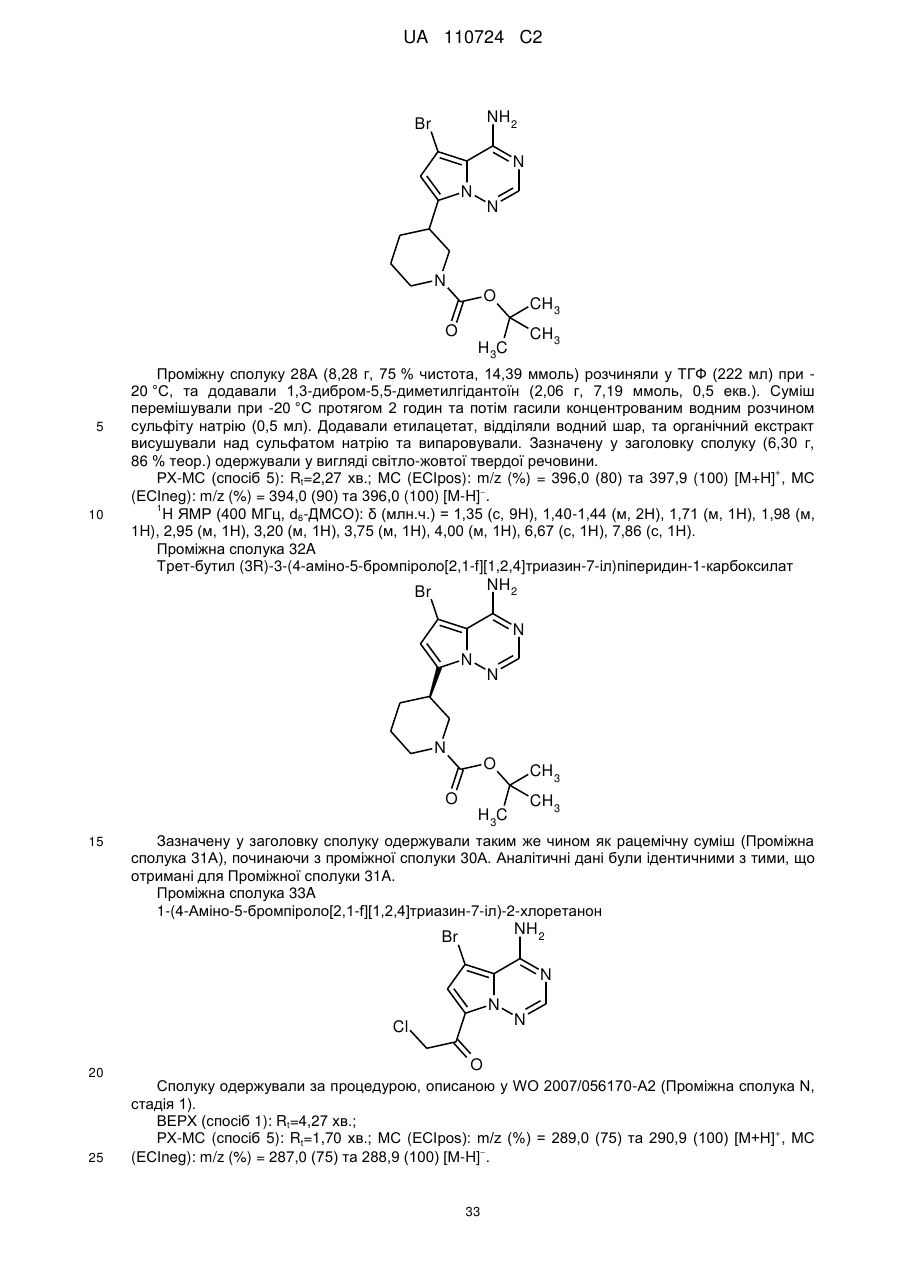
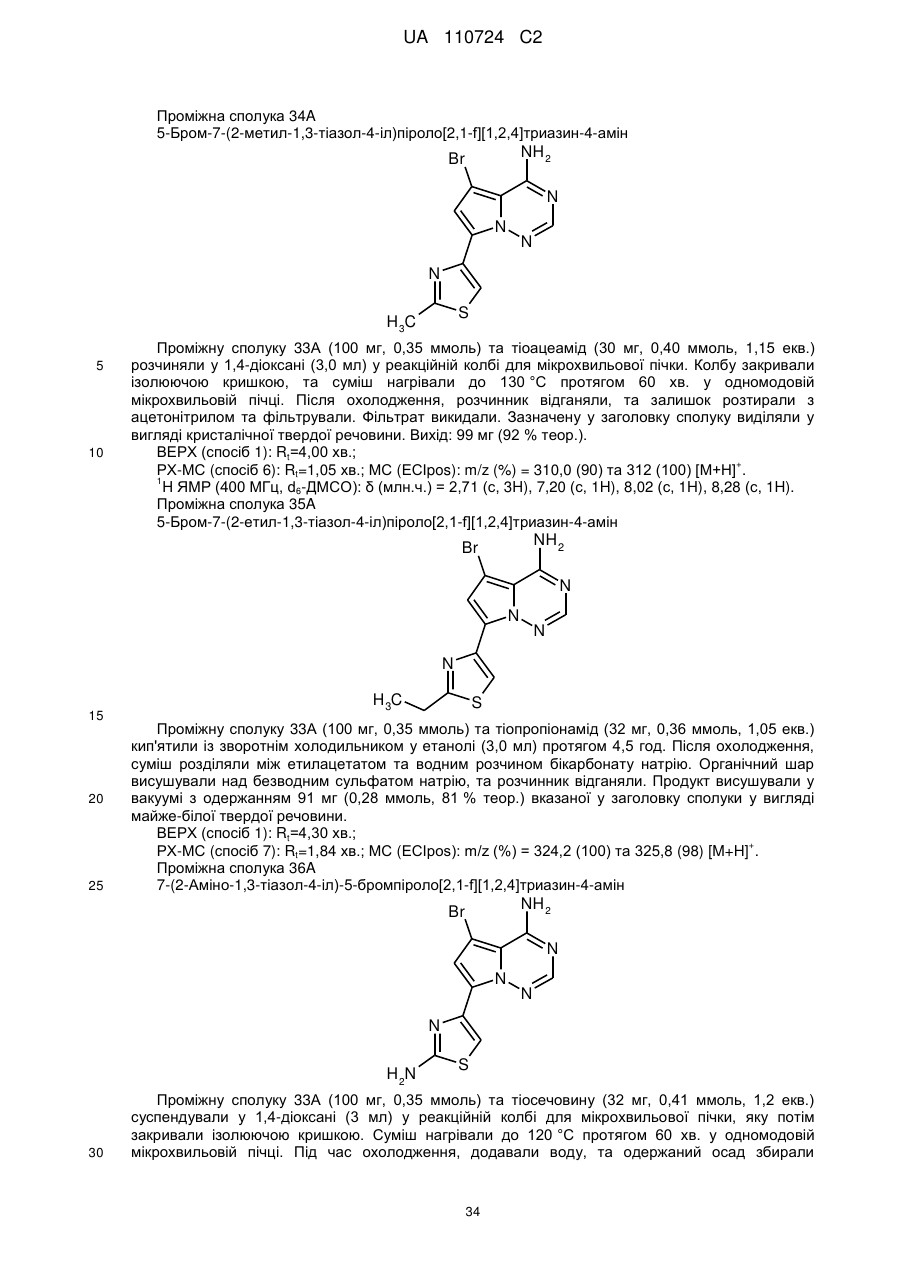
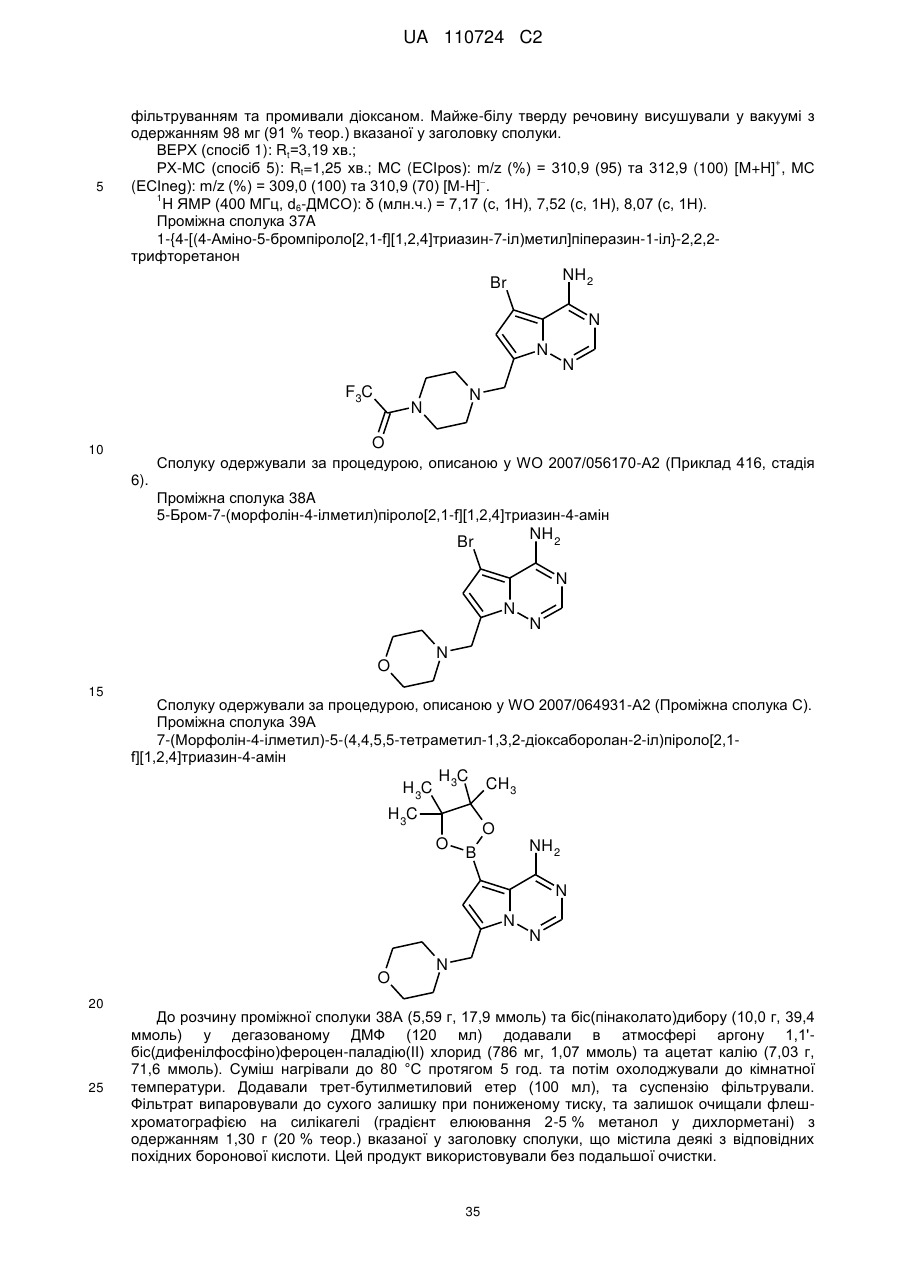
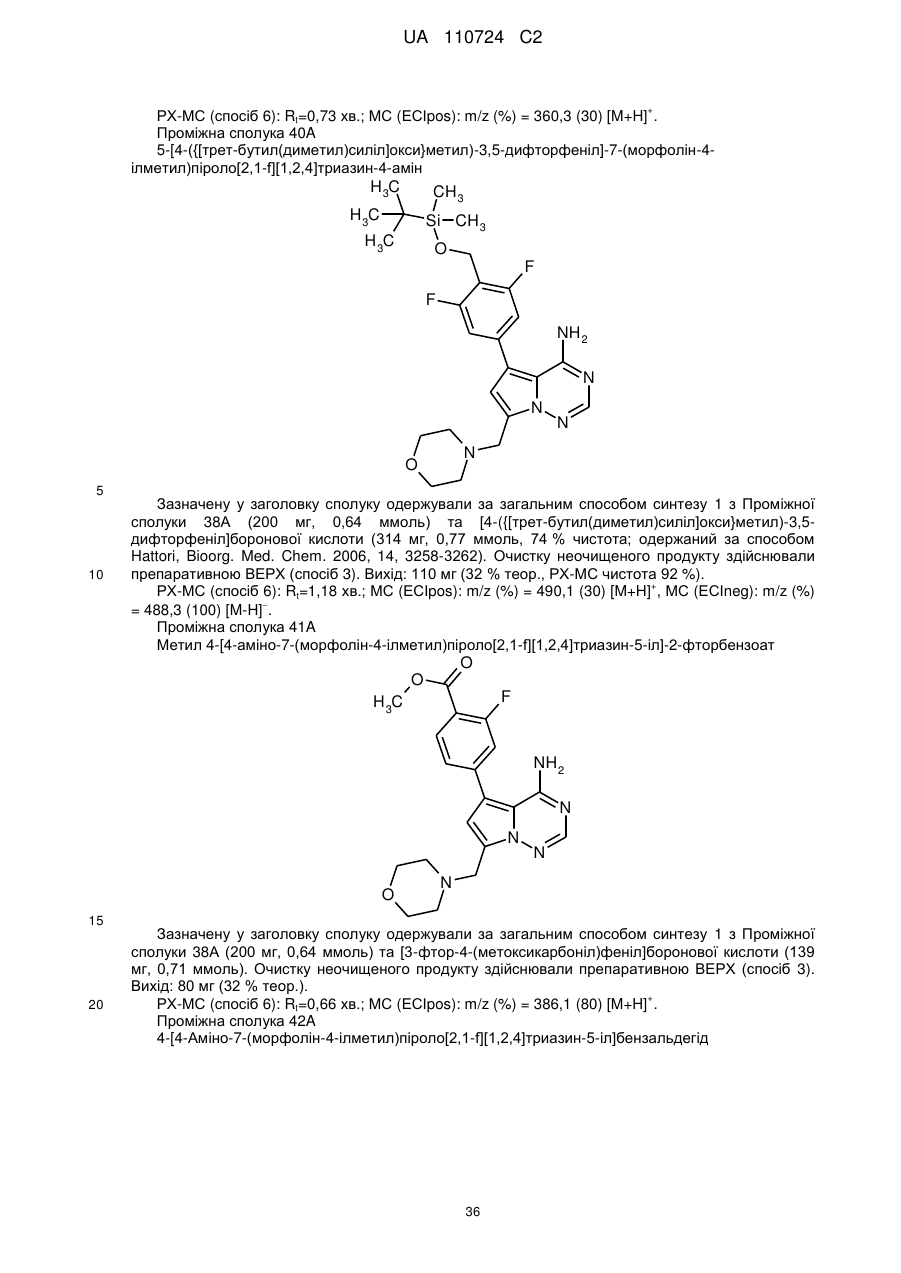
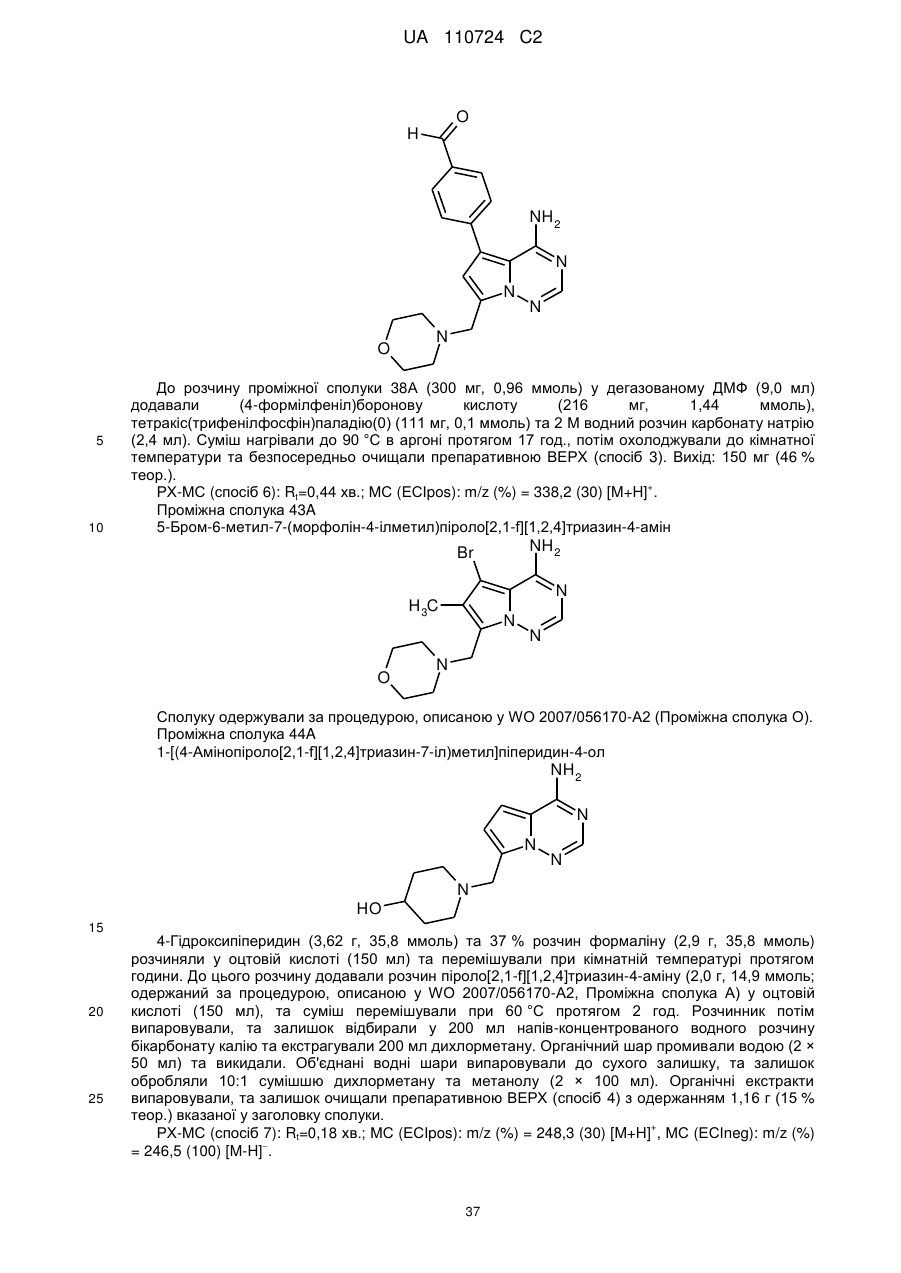
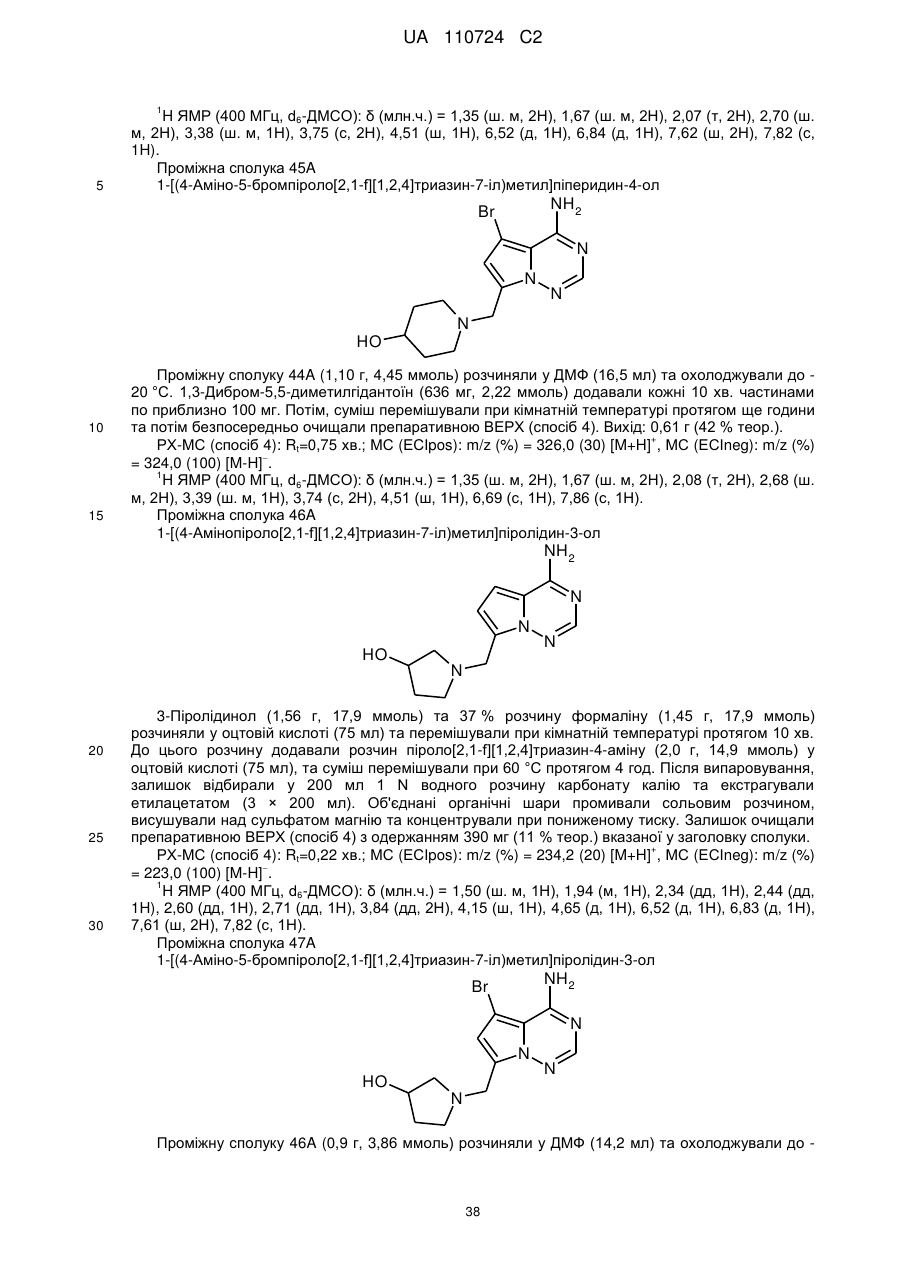
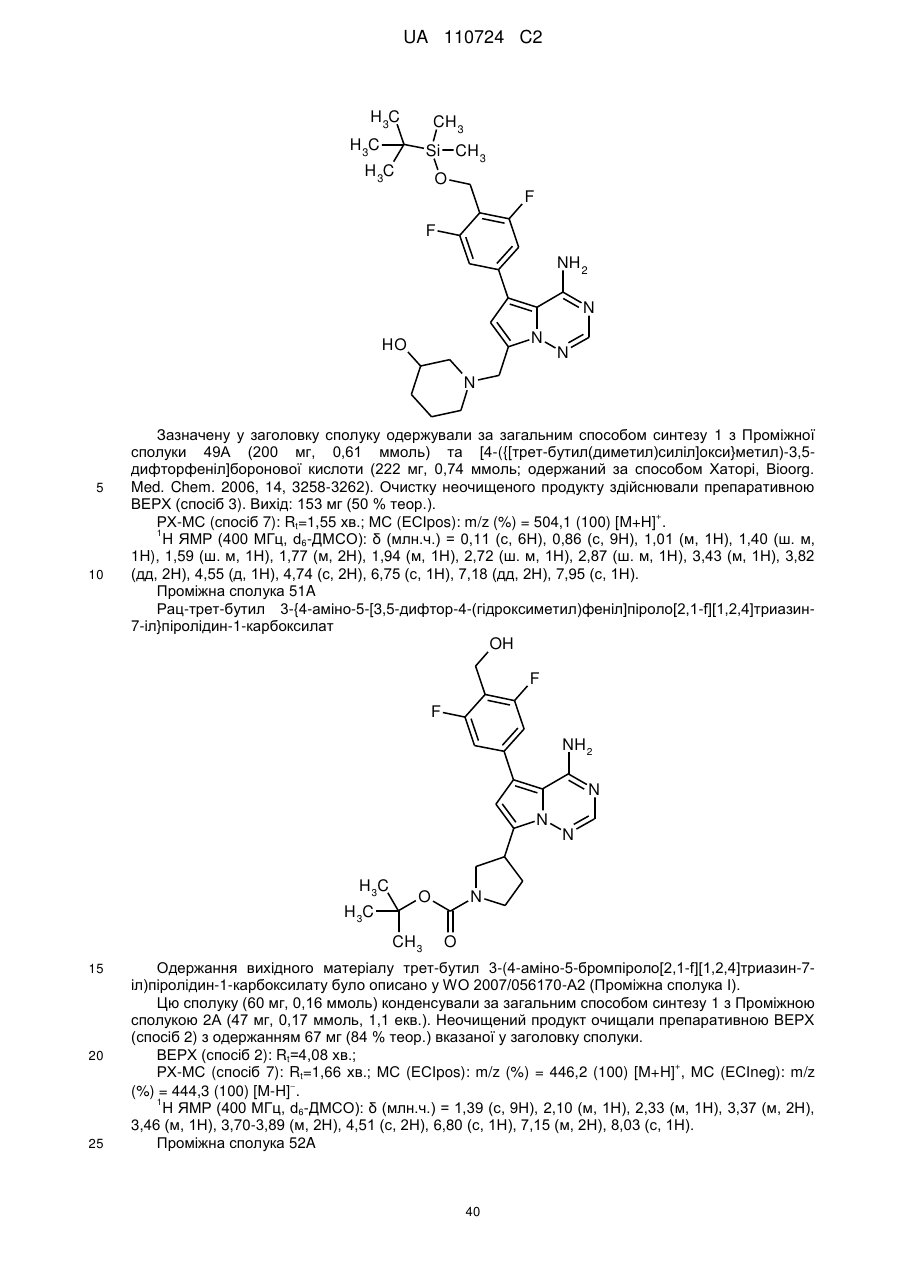
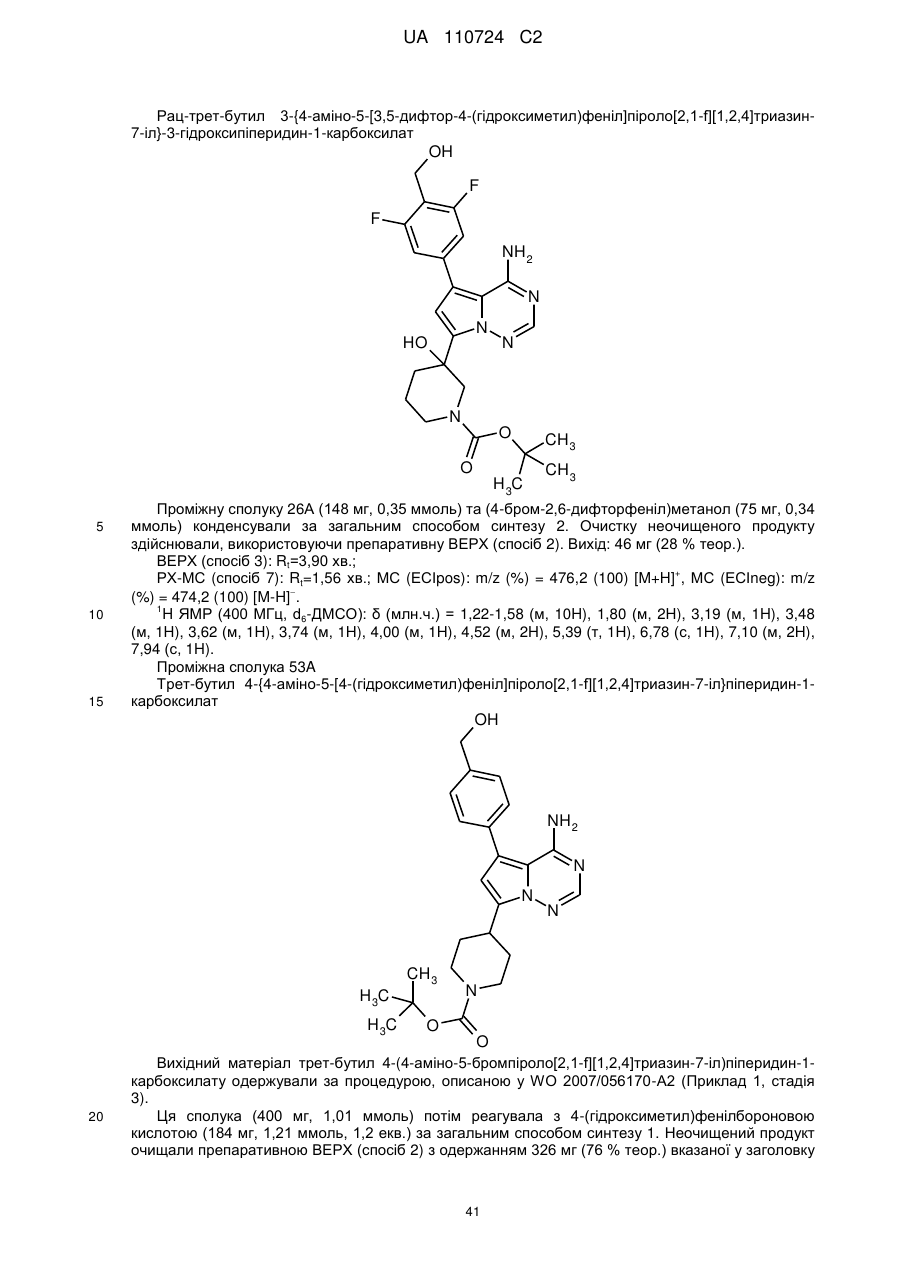
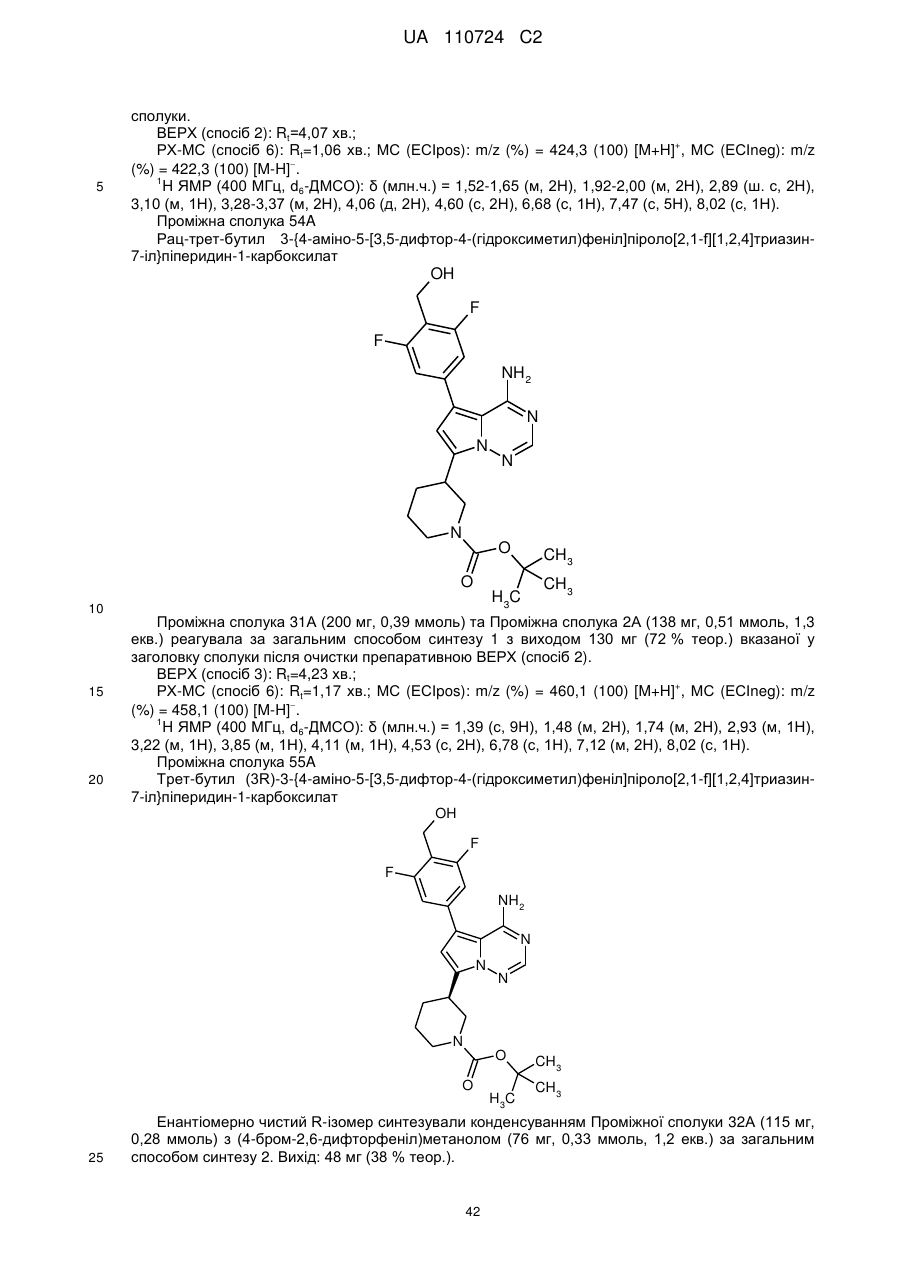
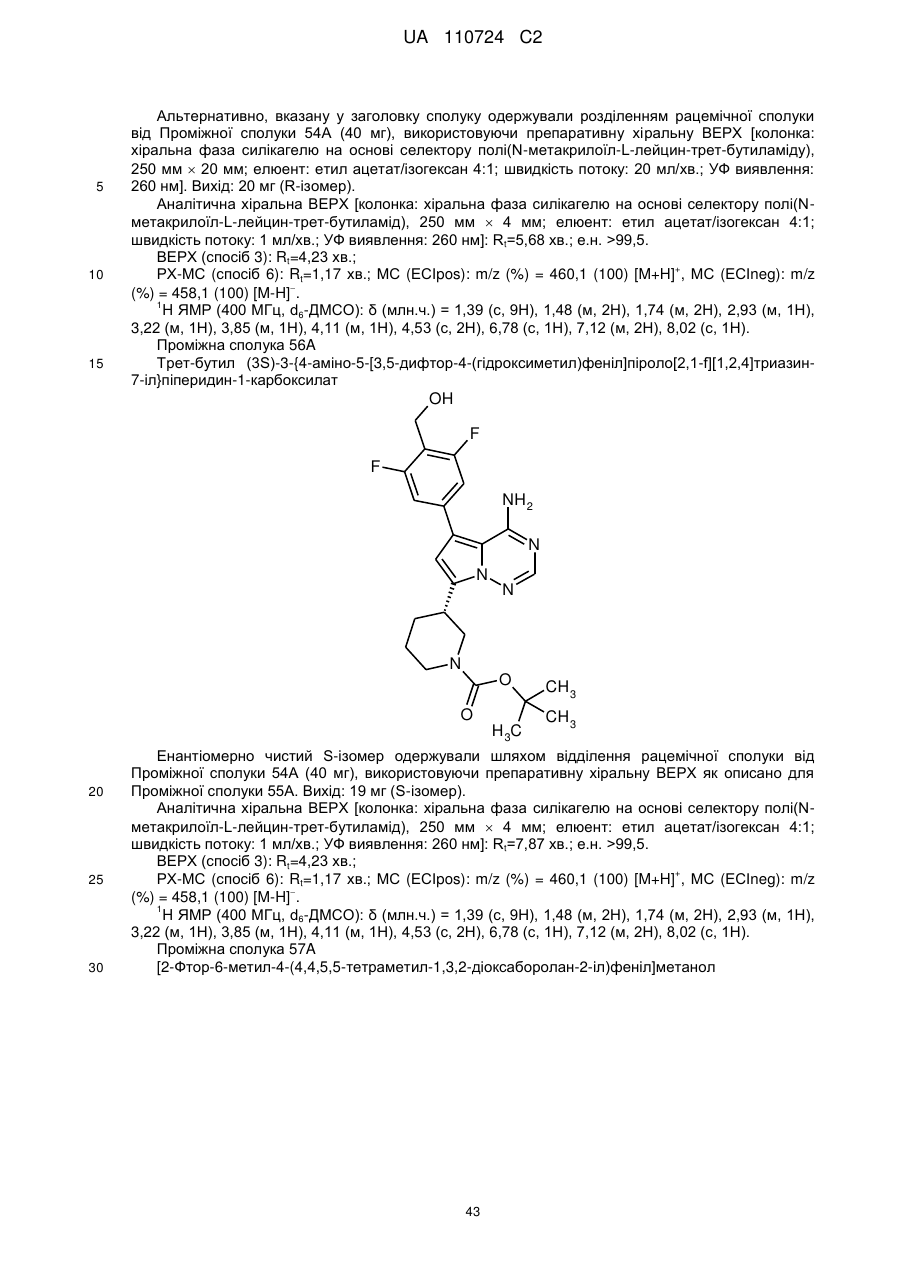
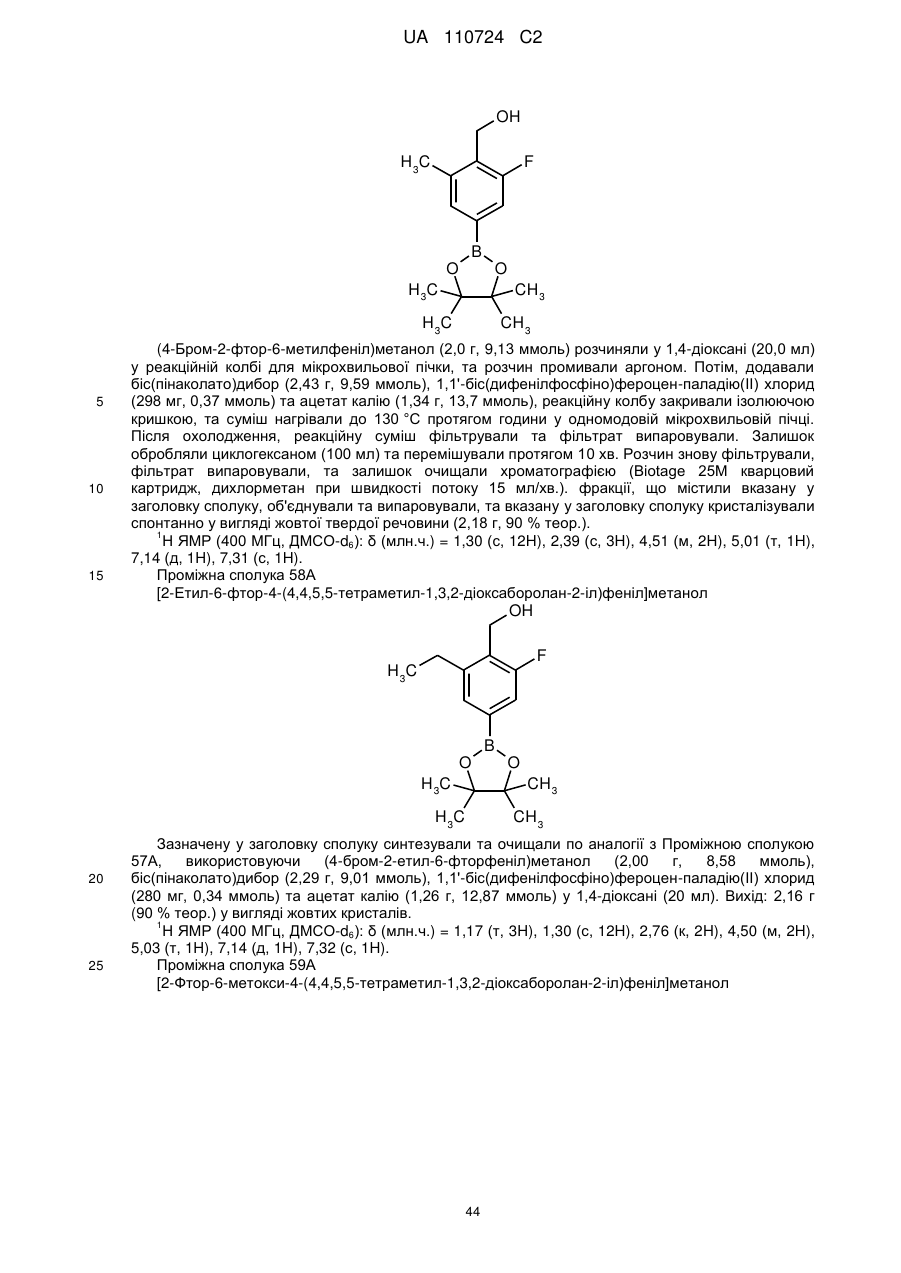
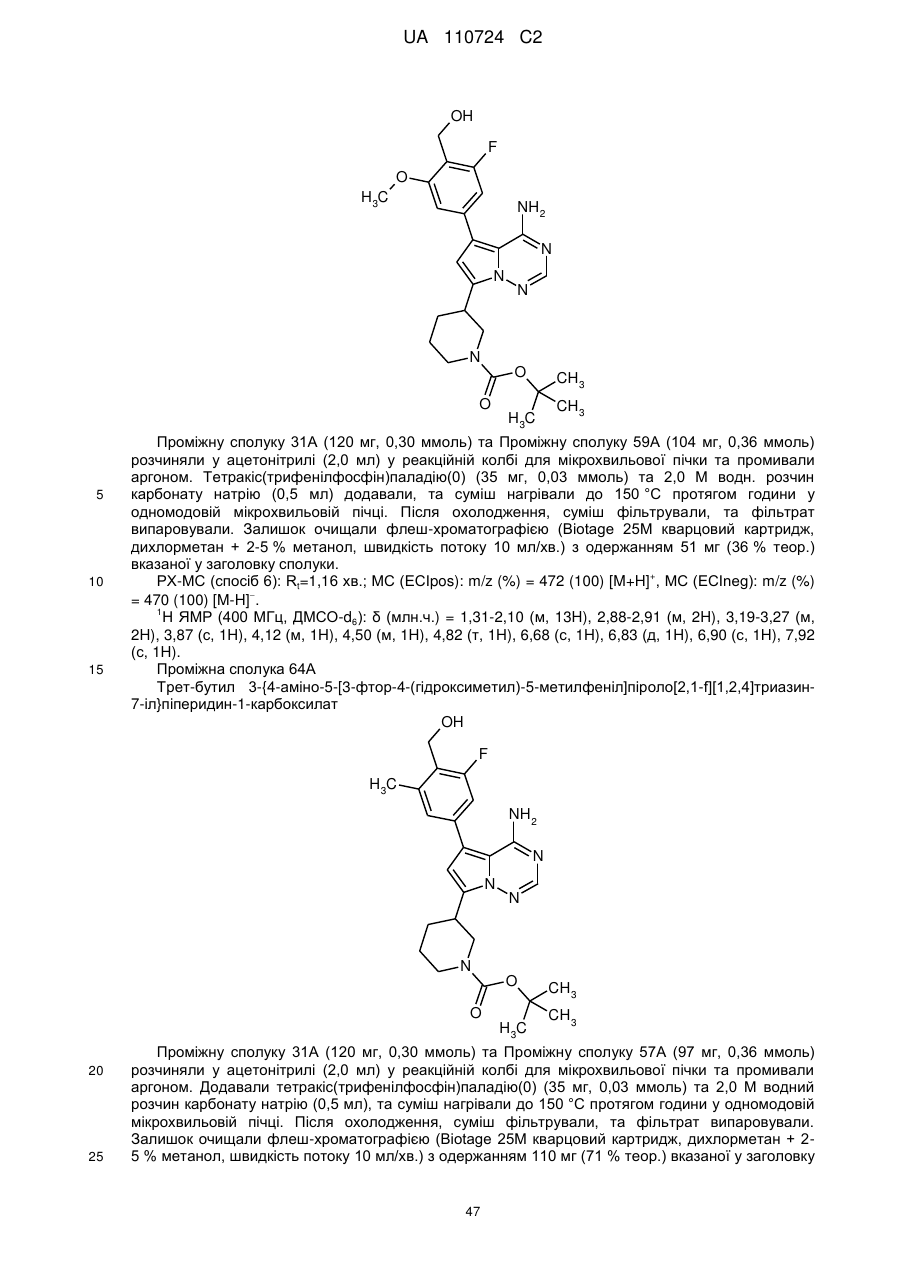
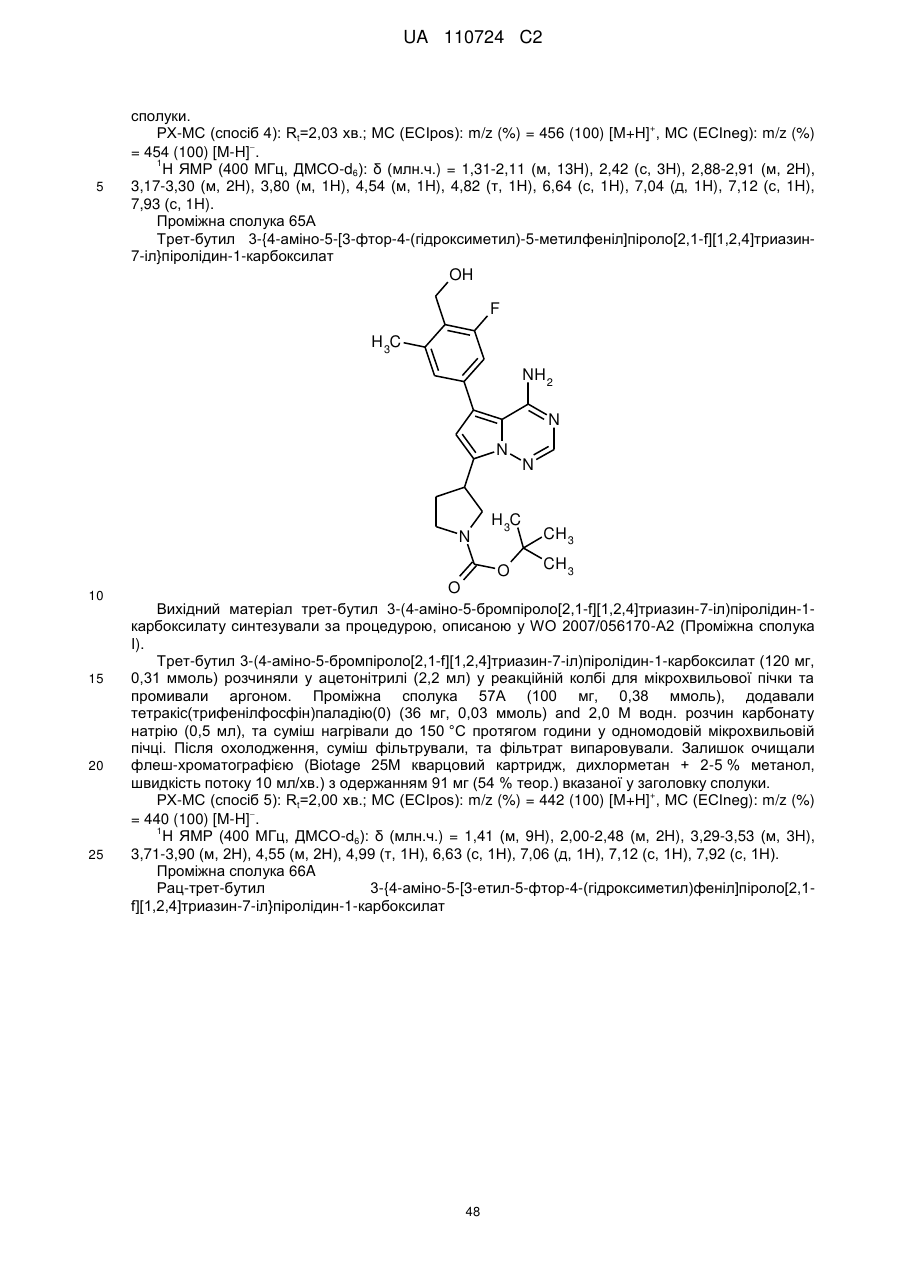
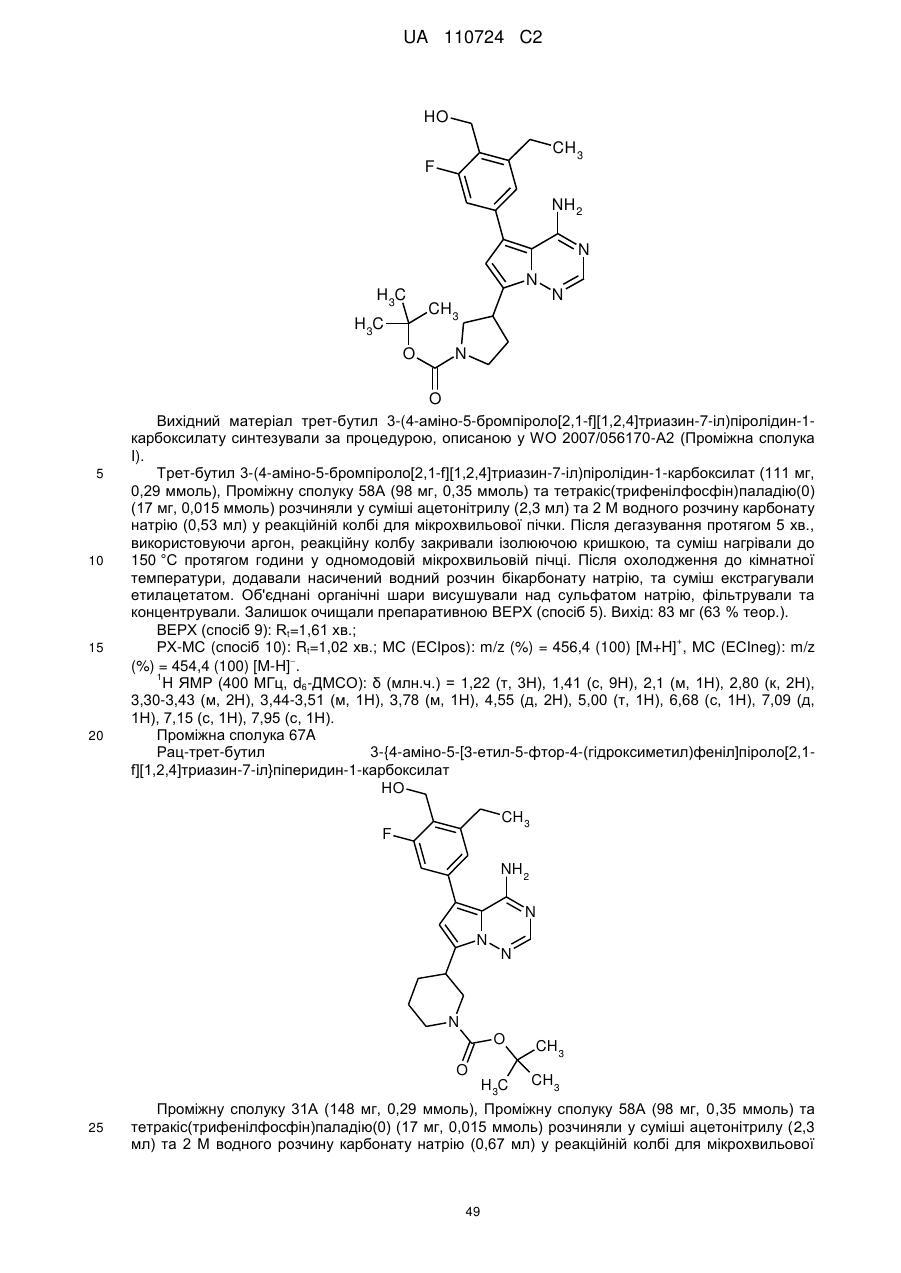
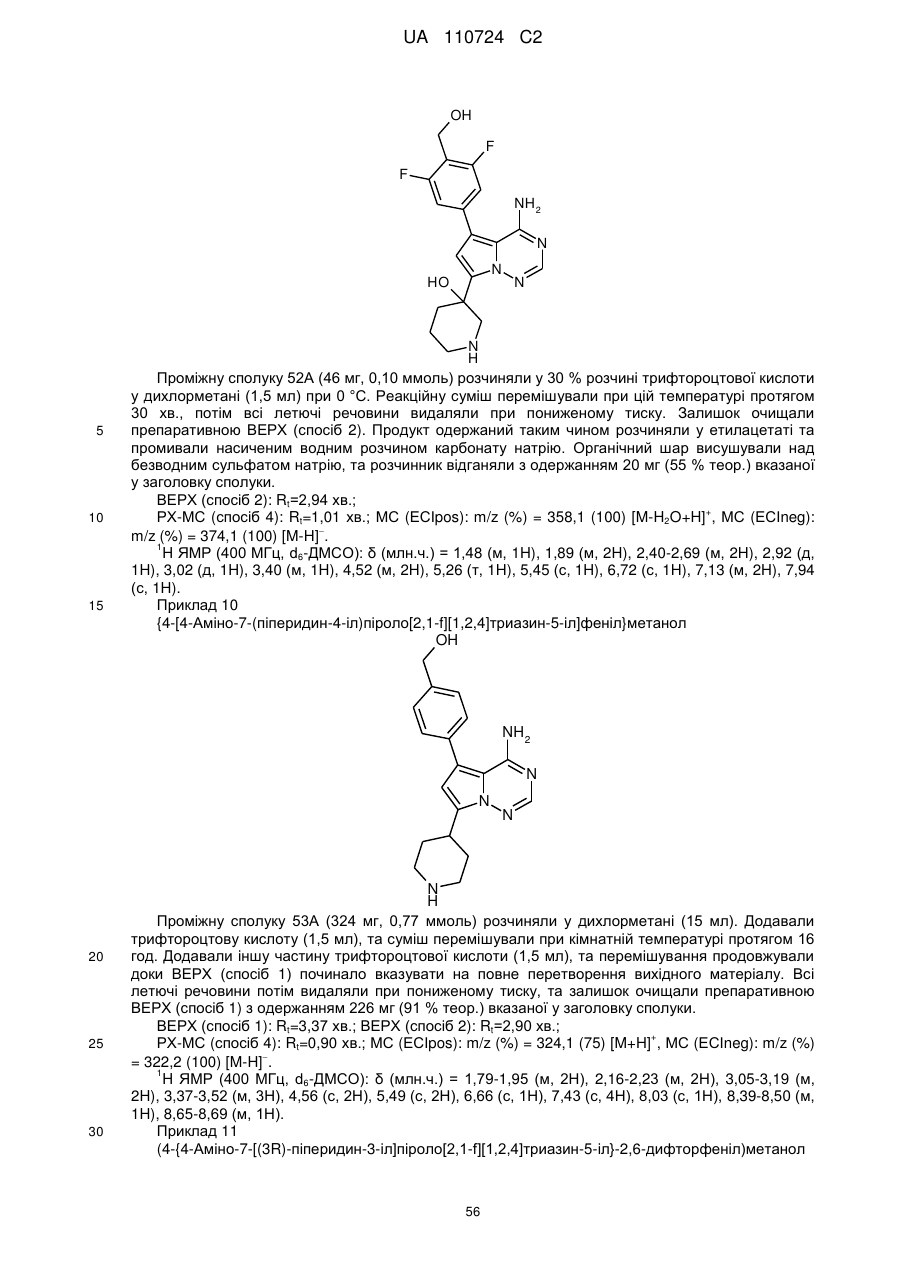
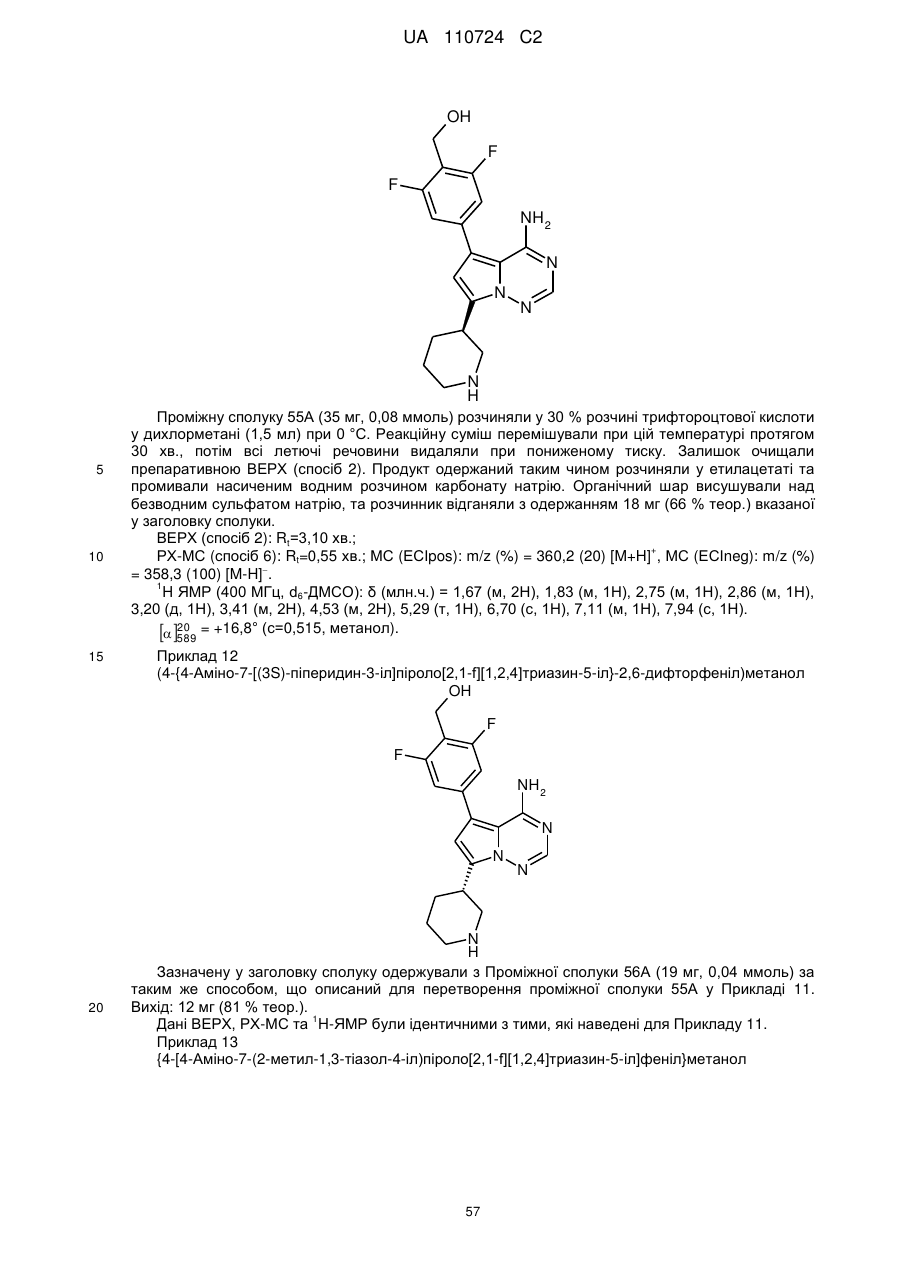
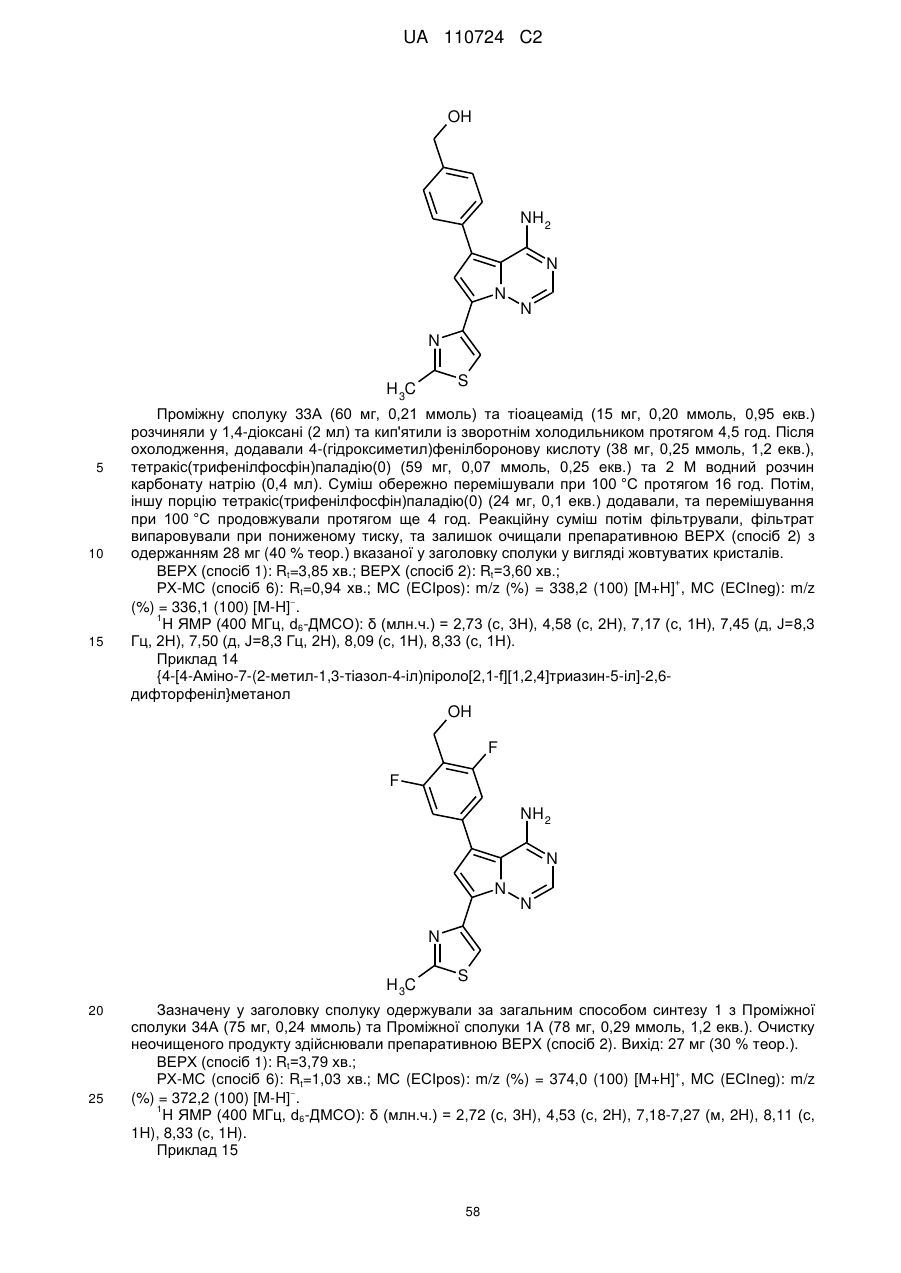
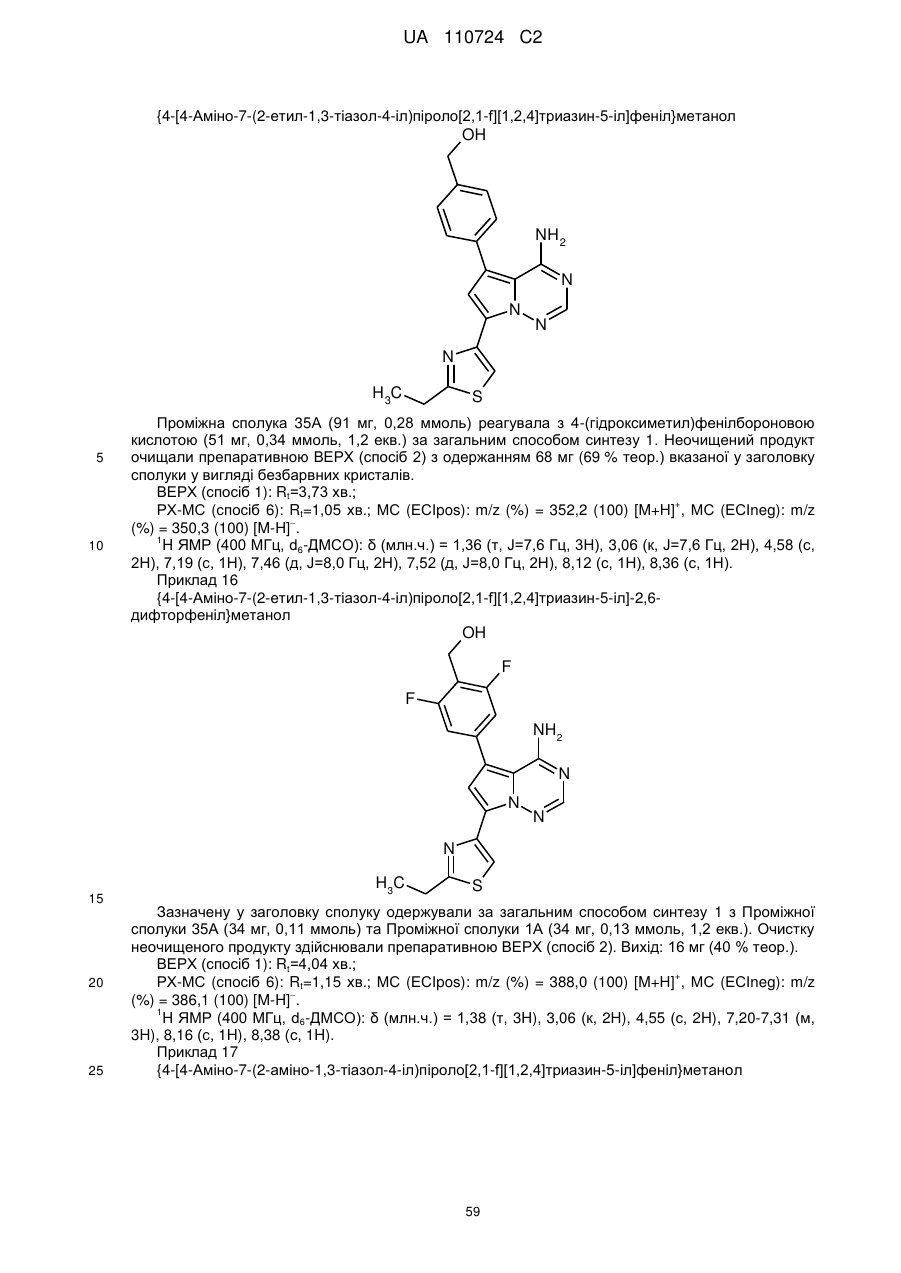
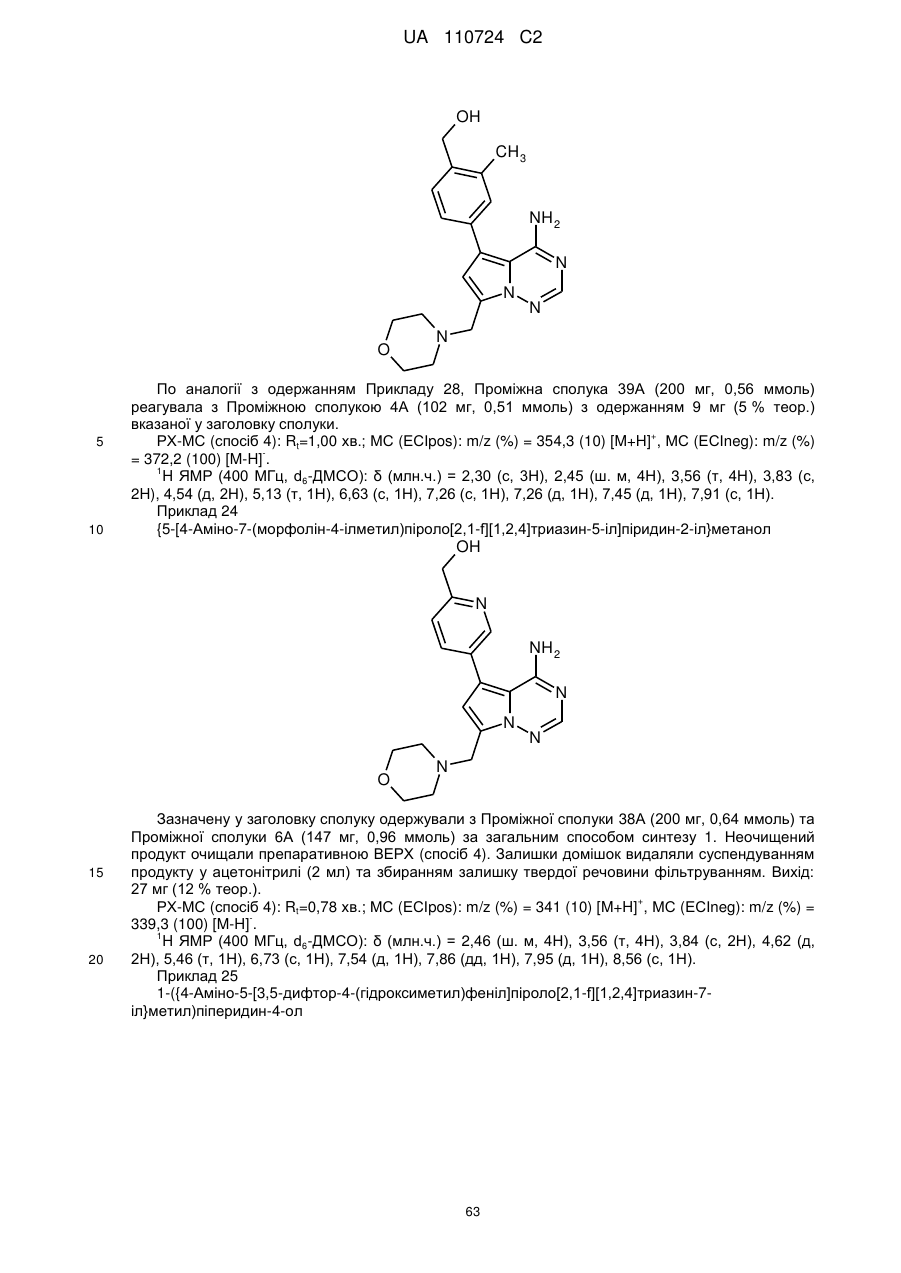
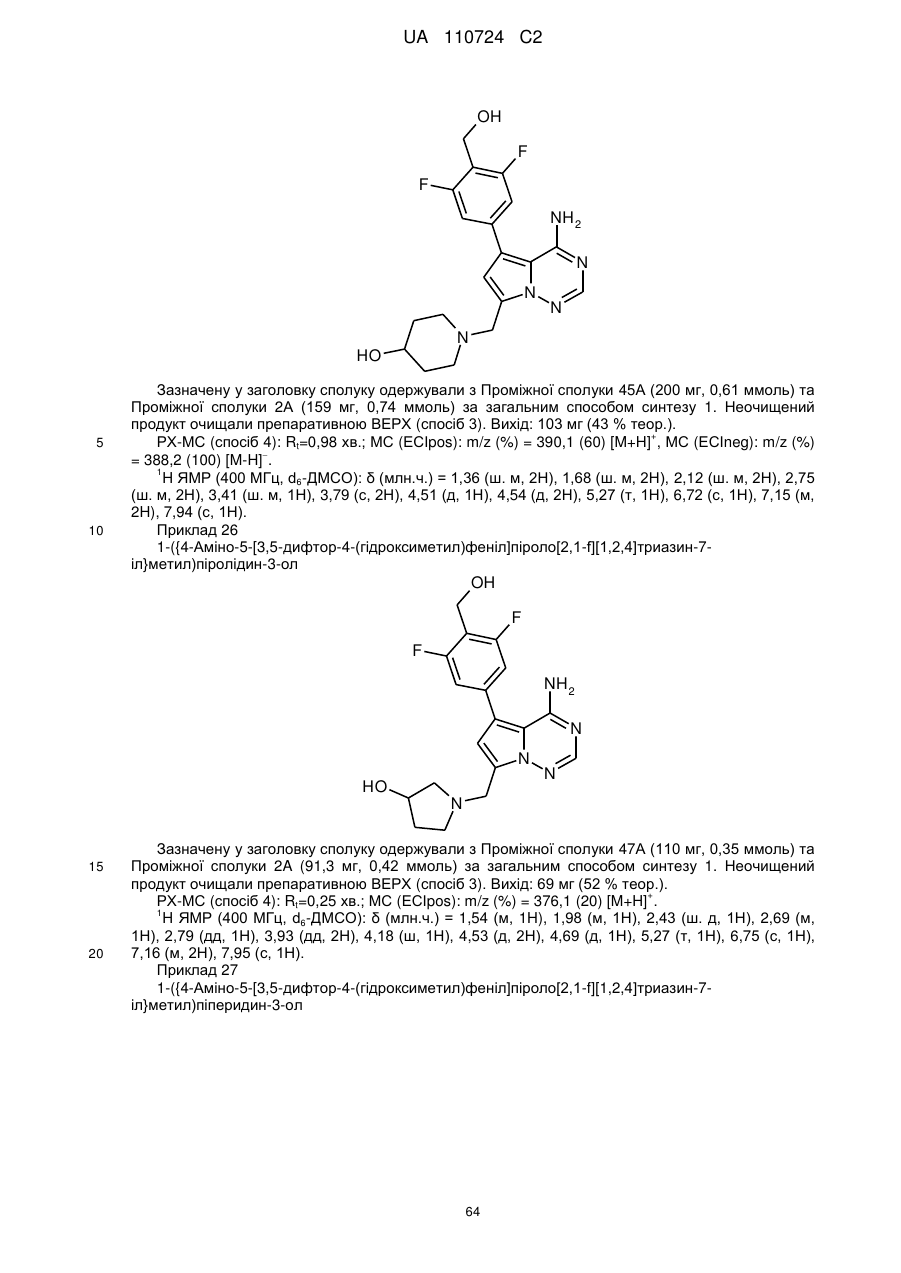
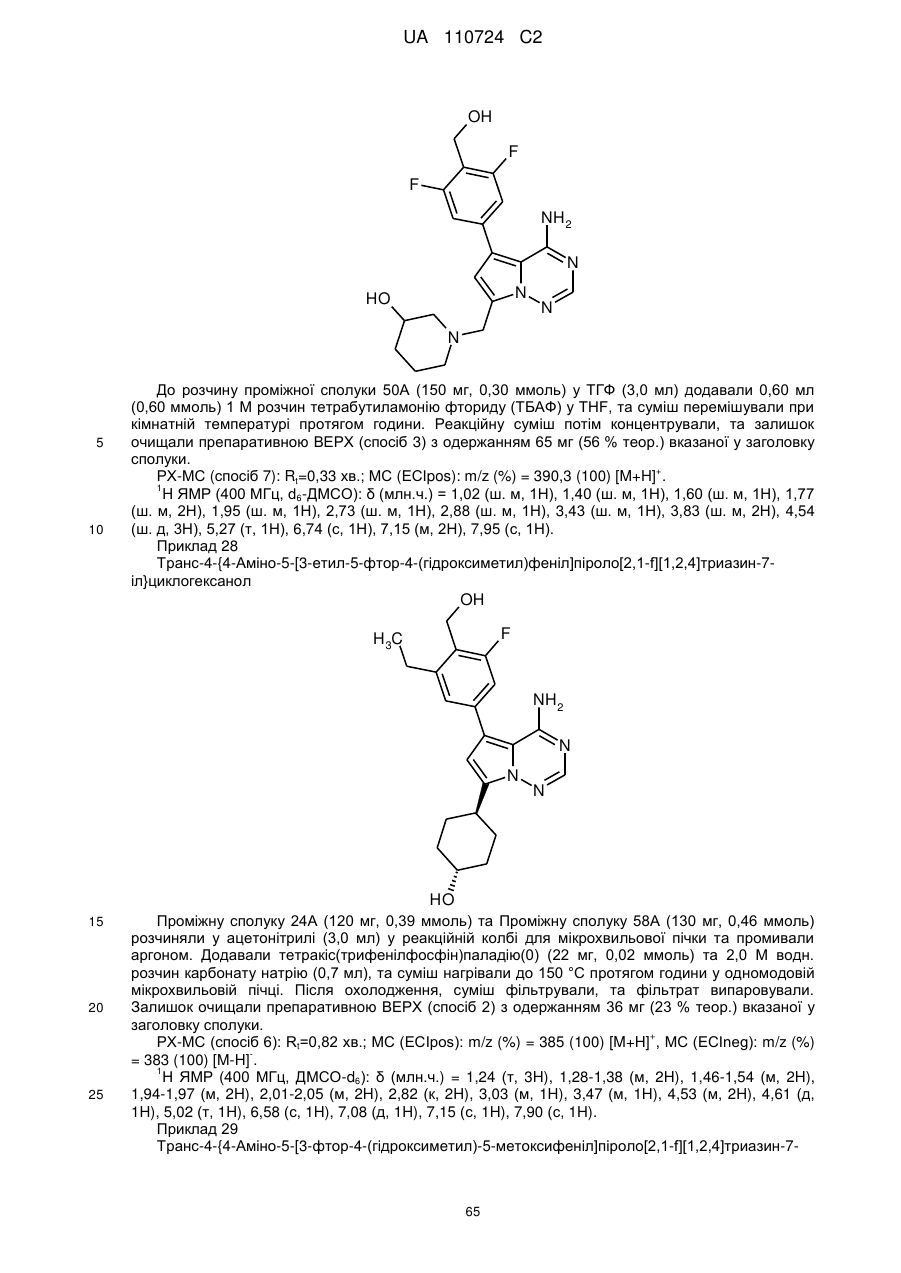
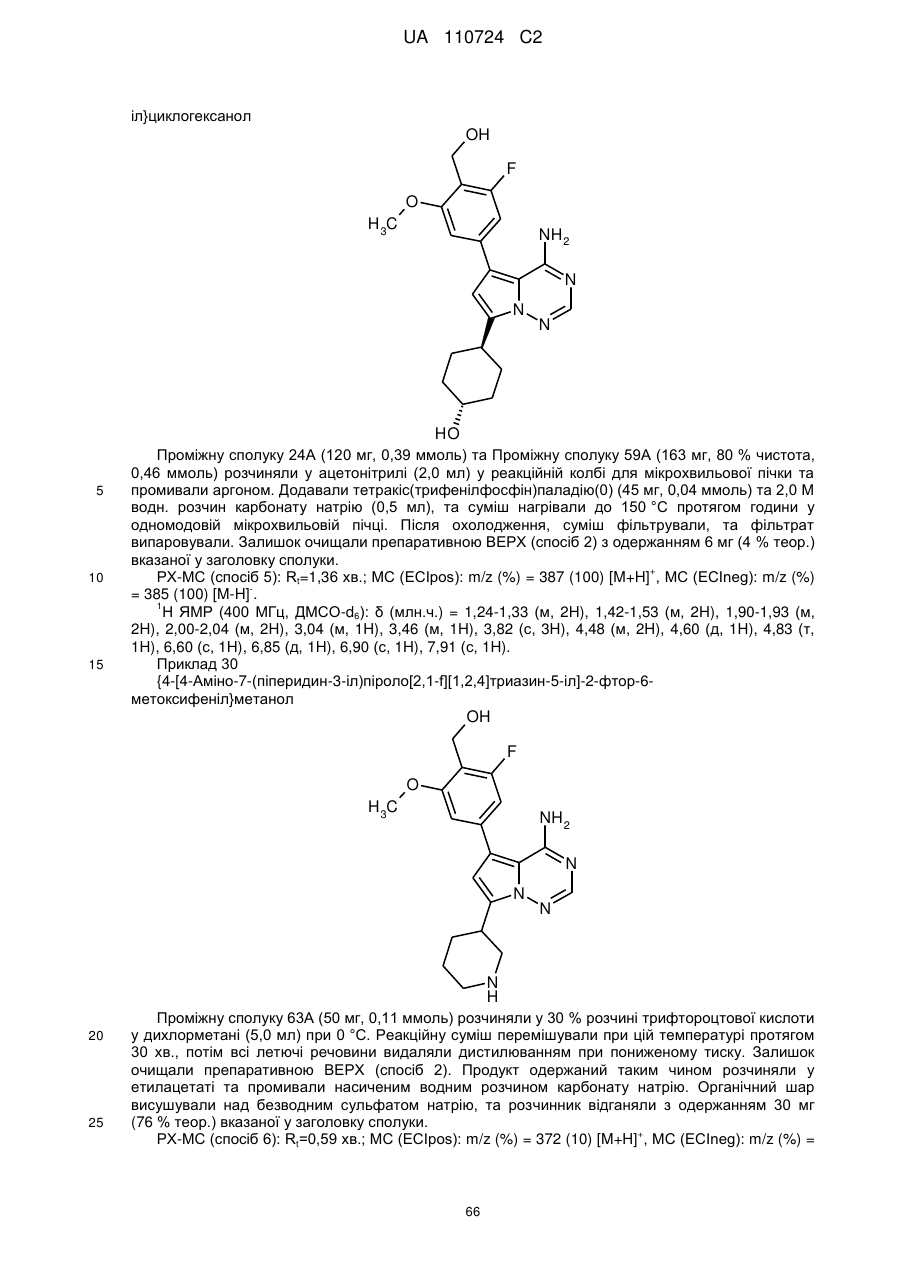
Гідроксиметиларилзаміщені піролотриазини як інгібітори alk1
Номер патенту: 110724
Опубліковано: 10.02.2016
Автори: Шалль Андреас, Фьорінгер Верена, Ланг Дітер, Фу Венланг, Лобелль Маріо, Шлєммер Карл-Хайнц, Гольц Штефан, Шланге Томас, Зюсмаєр Франк, Лі Фолькхарт Мін-Джян, Тельзер Йоахім, Клар Юрген, Бьоттгер Міхаель
Формула / Реферат
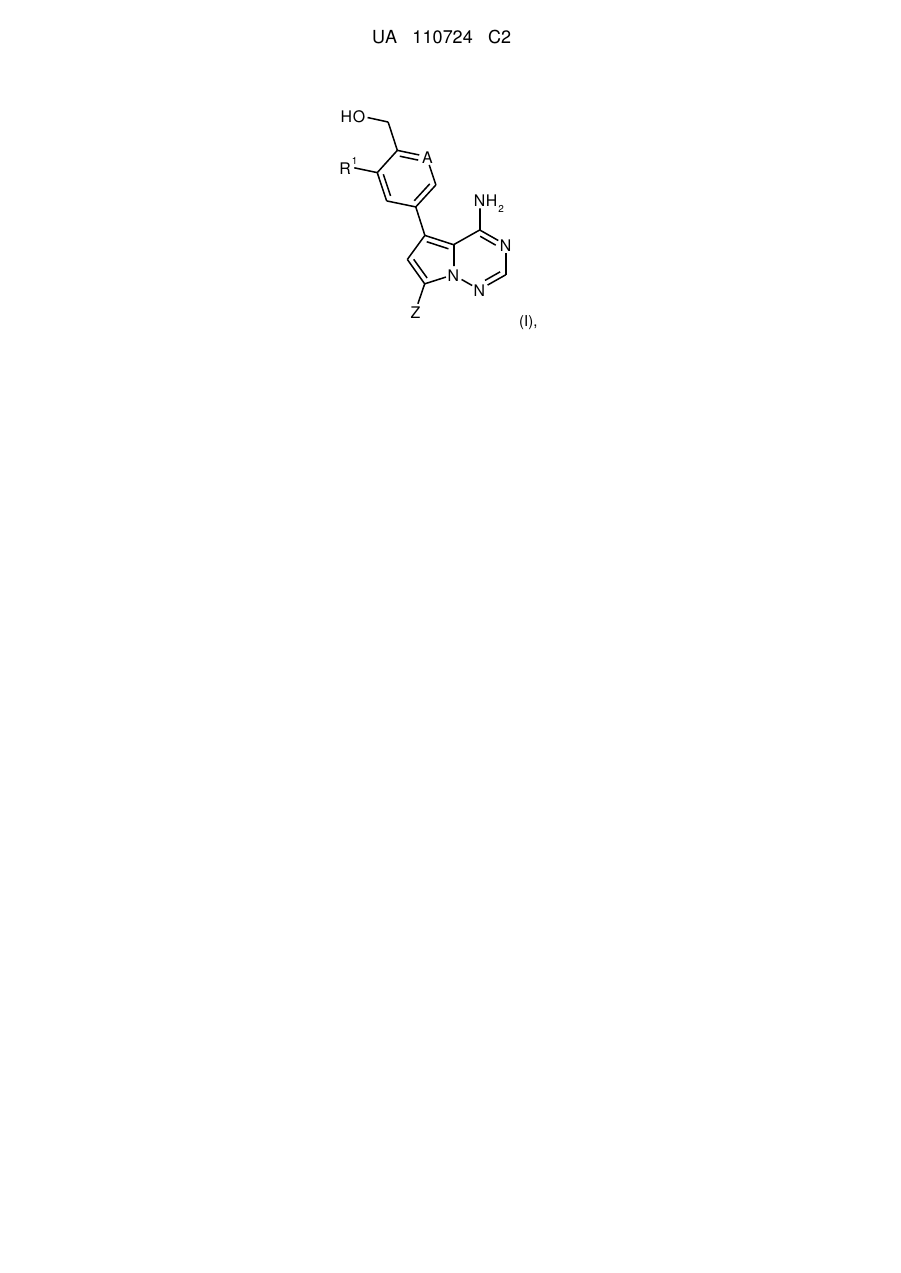
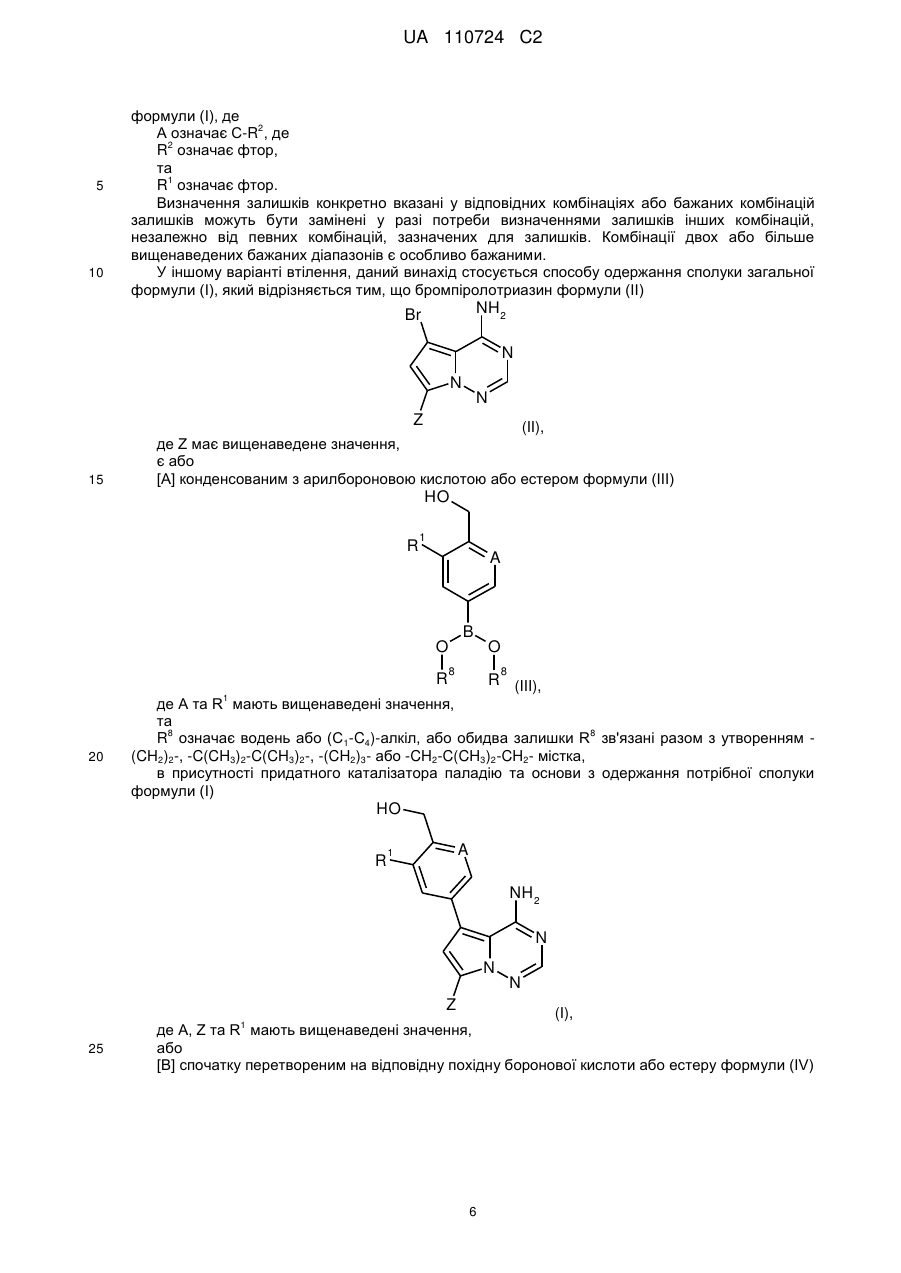
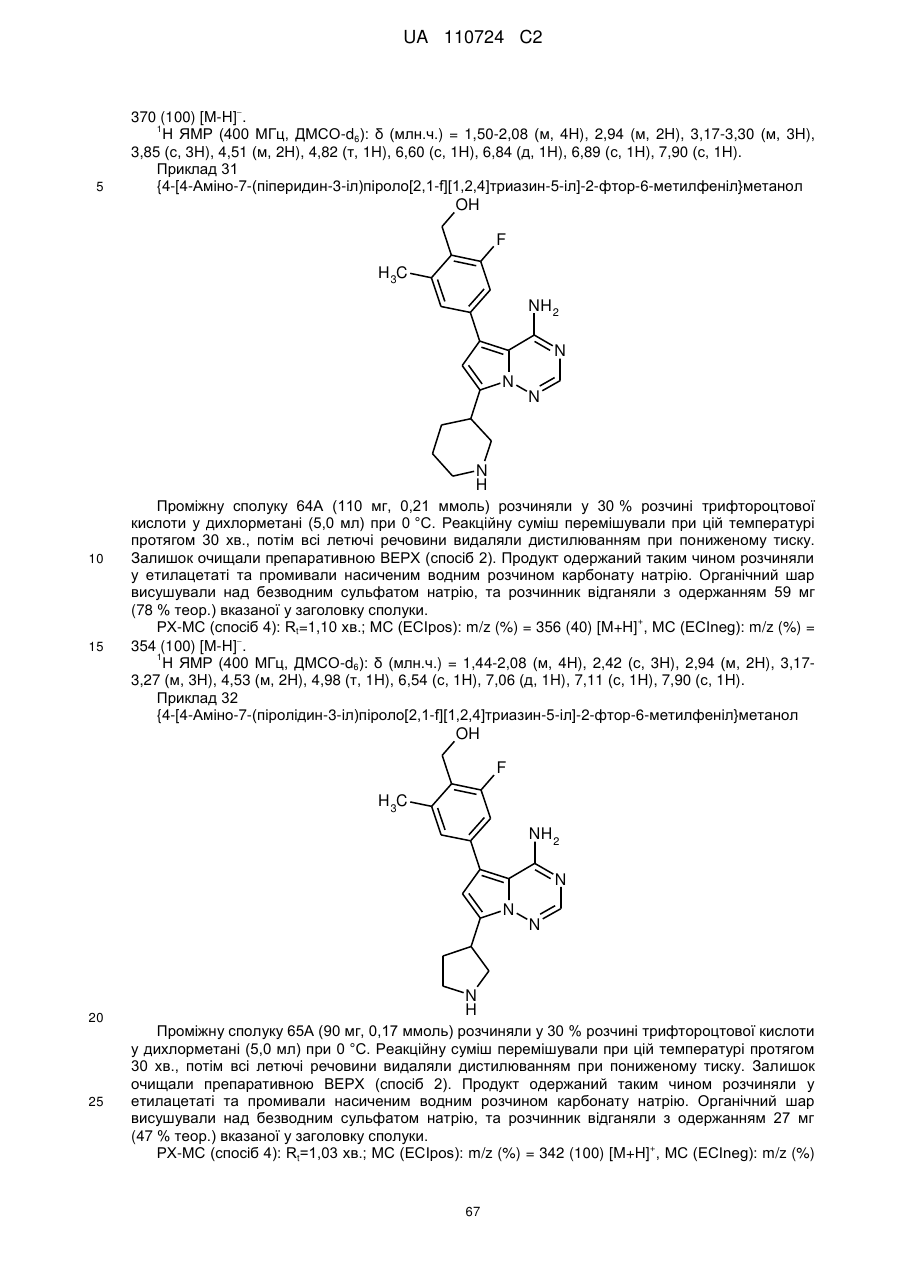
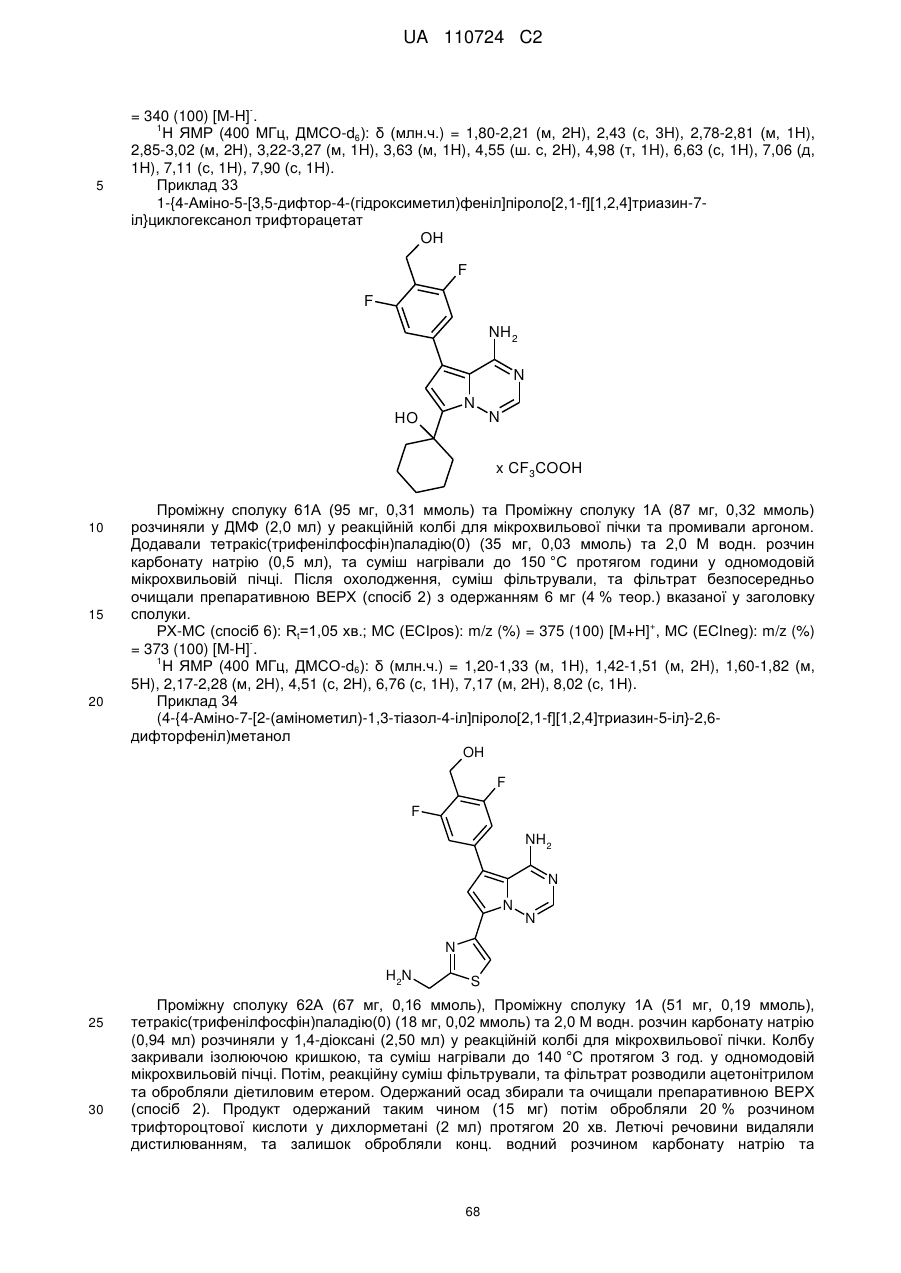
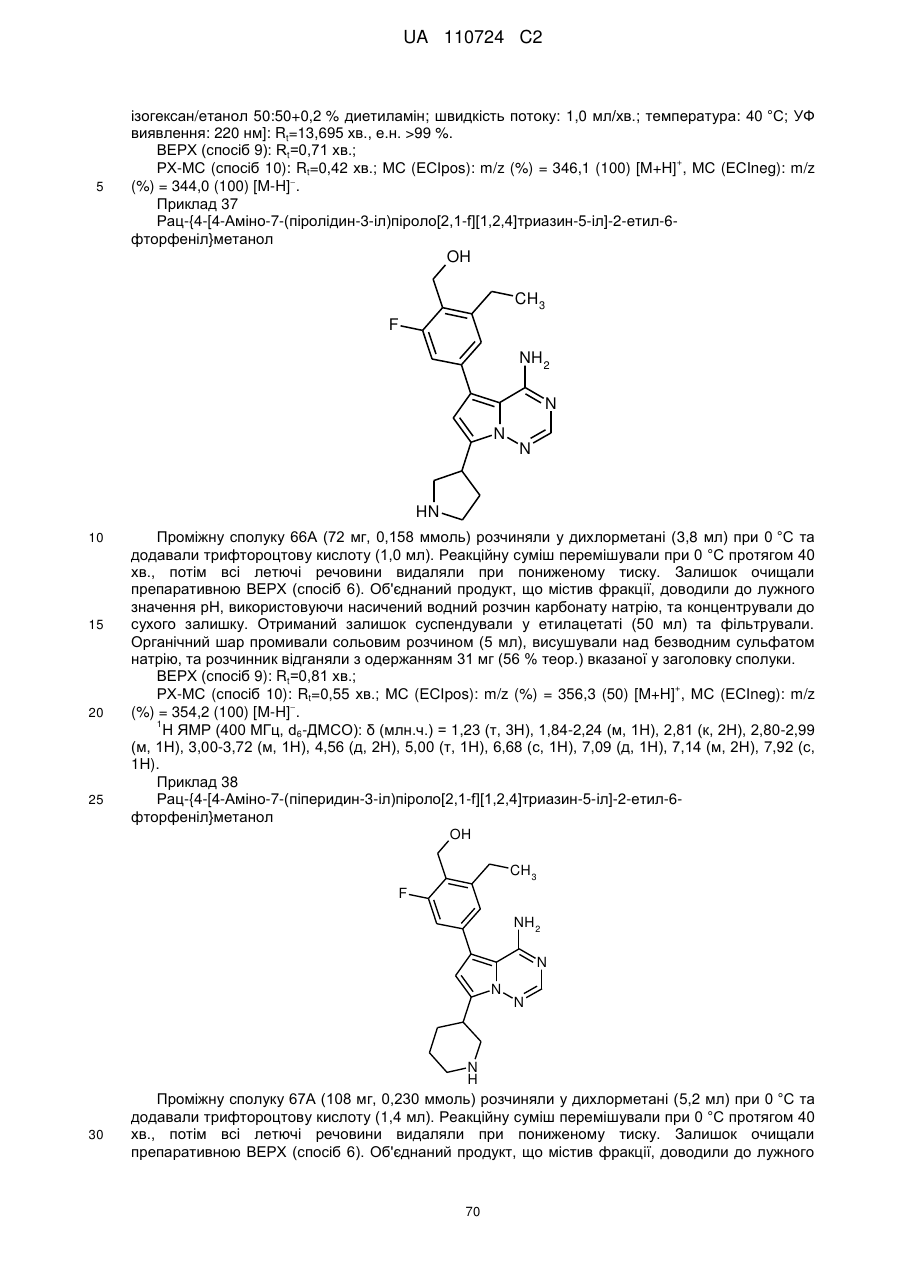
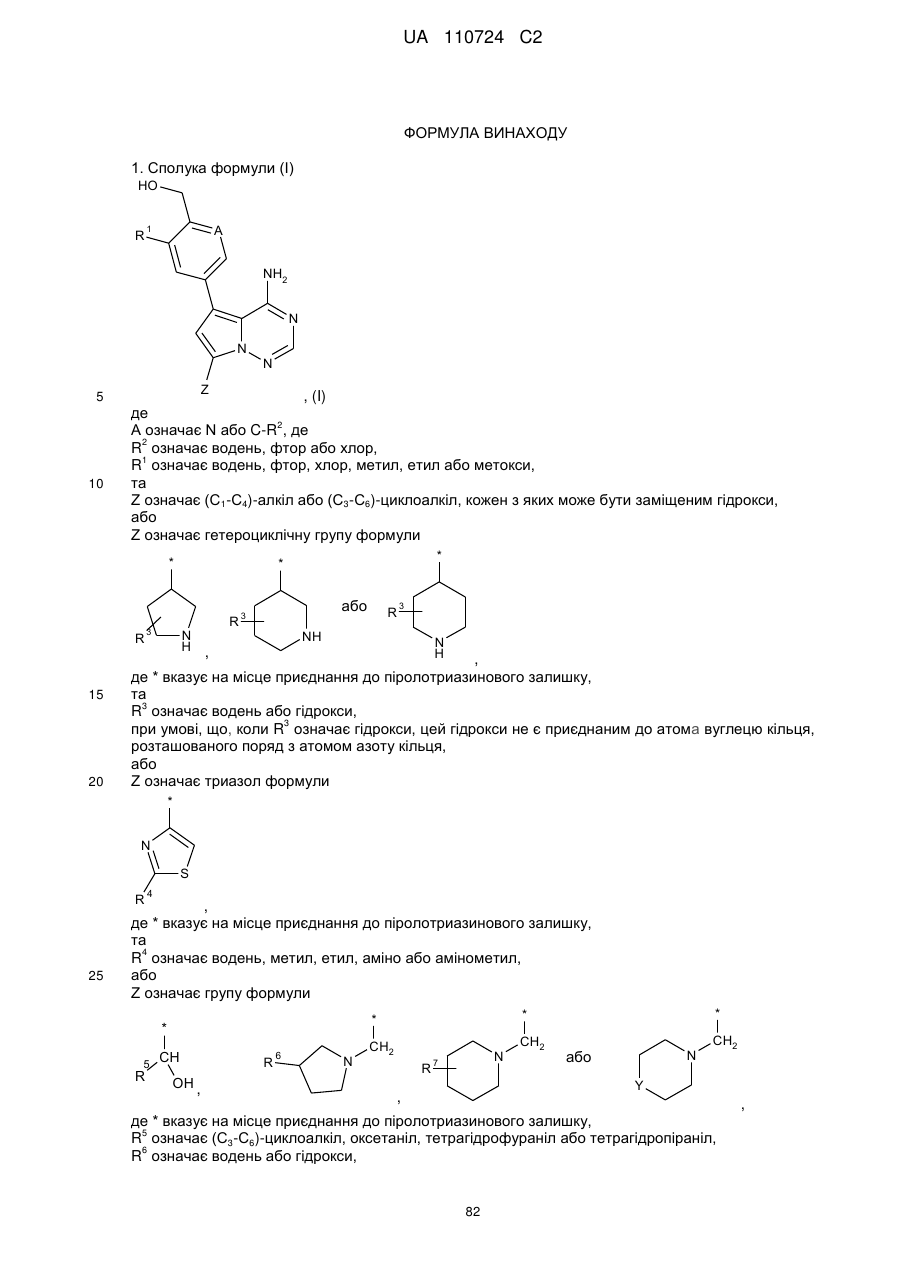
1. Сполука формули (І)
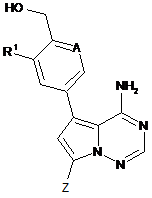 , (I)
, (I)
де
А означає N або C-R2, де
R2 означає водень, фтор або хлор,
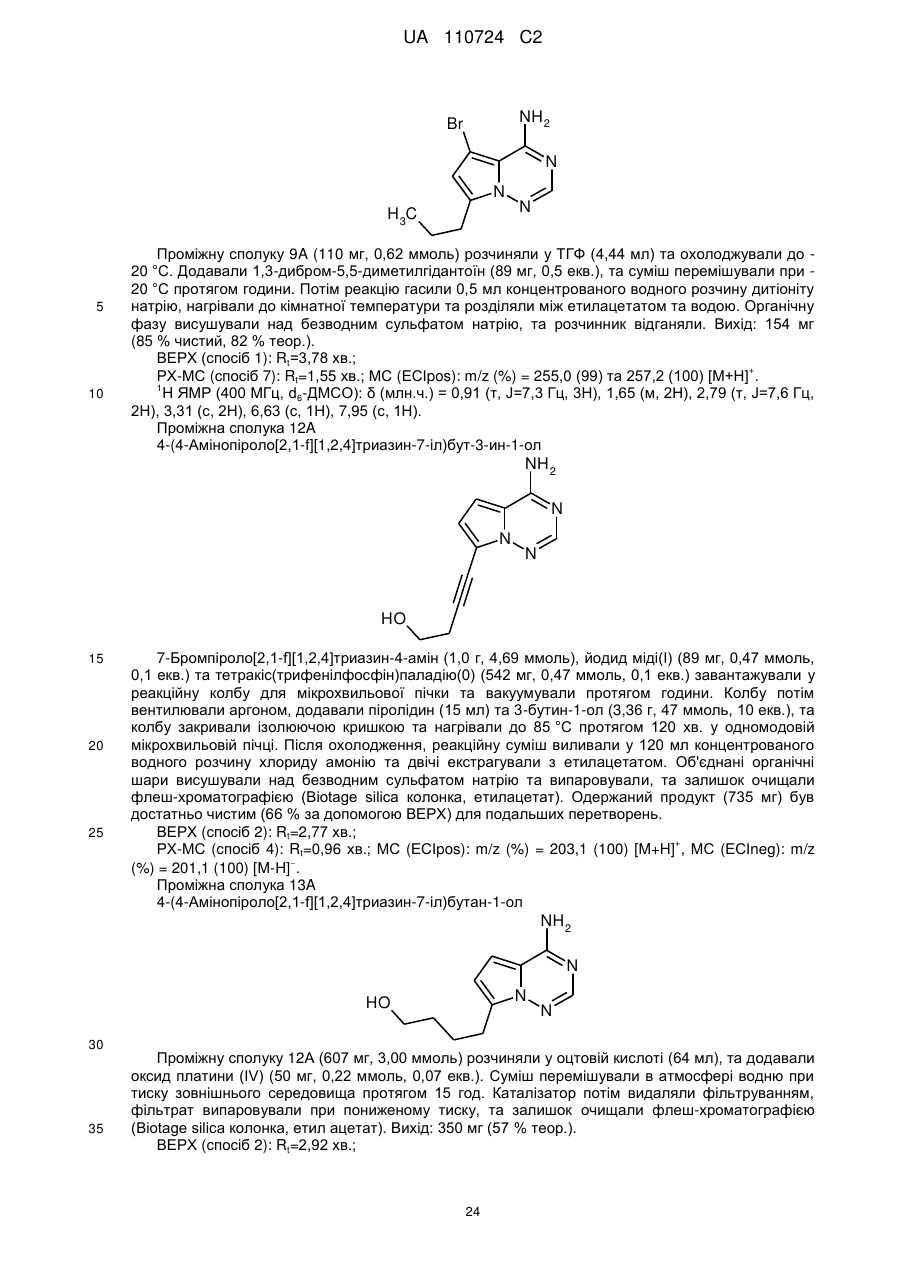
R1 означає водень, фтор, хлор, метил, етил або метокси,
та
Ζ означає (С1-С4)-алкіл або (С3-С6)-циклоалкіл, кожен з яких може бути заміщеним гідрокси,
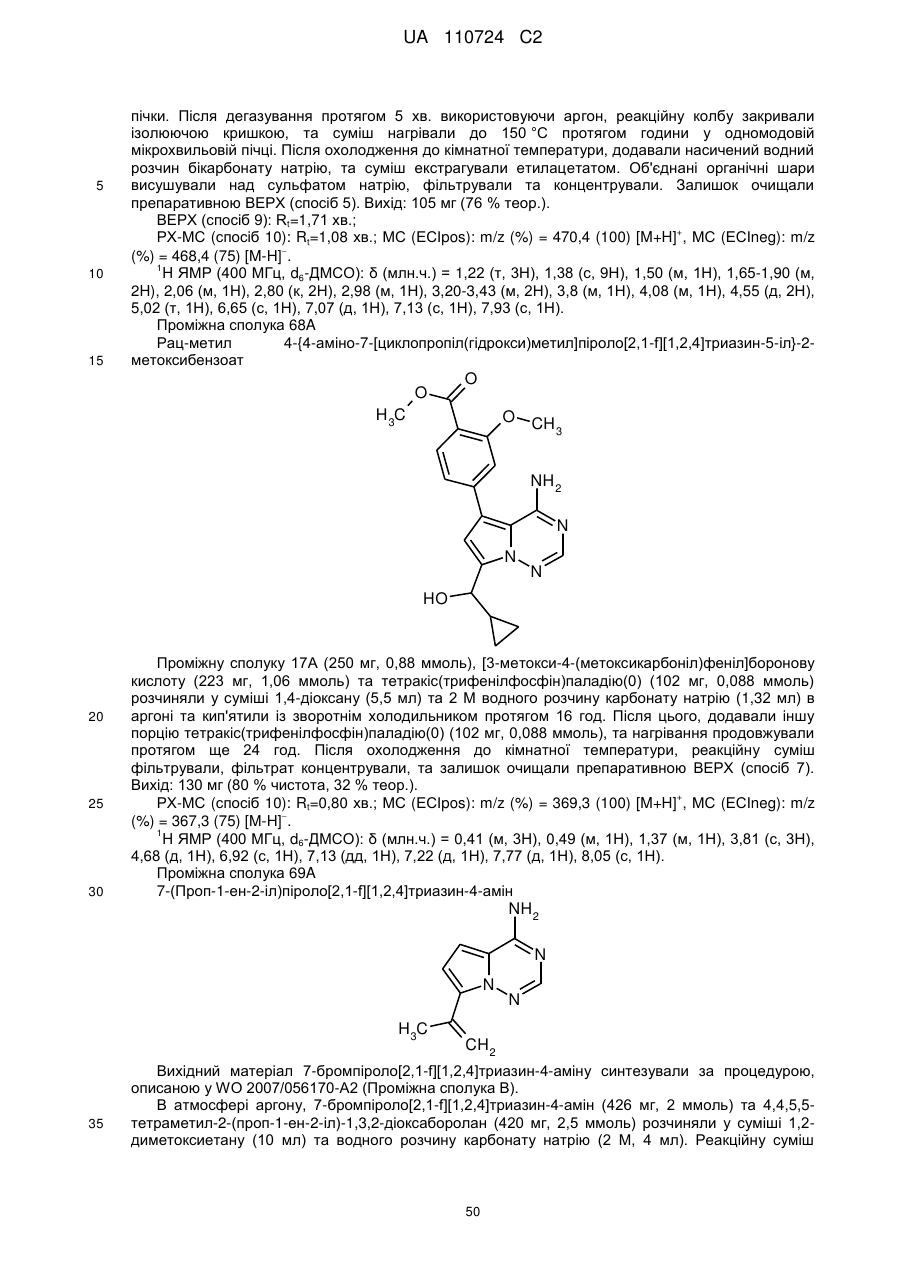
або
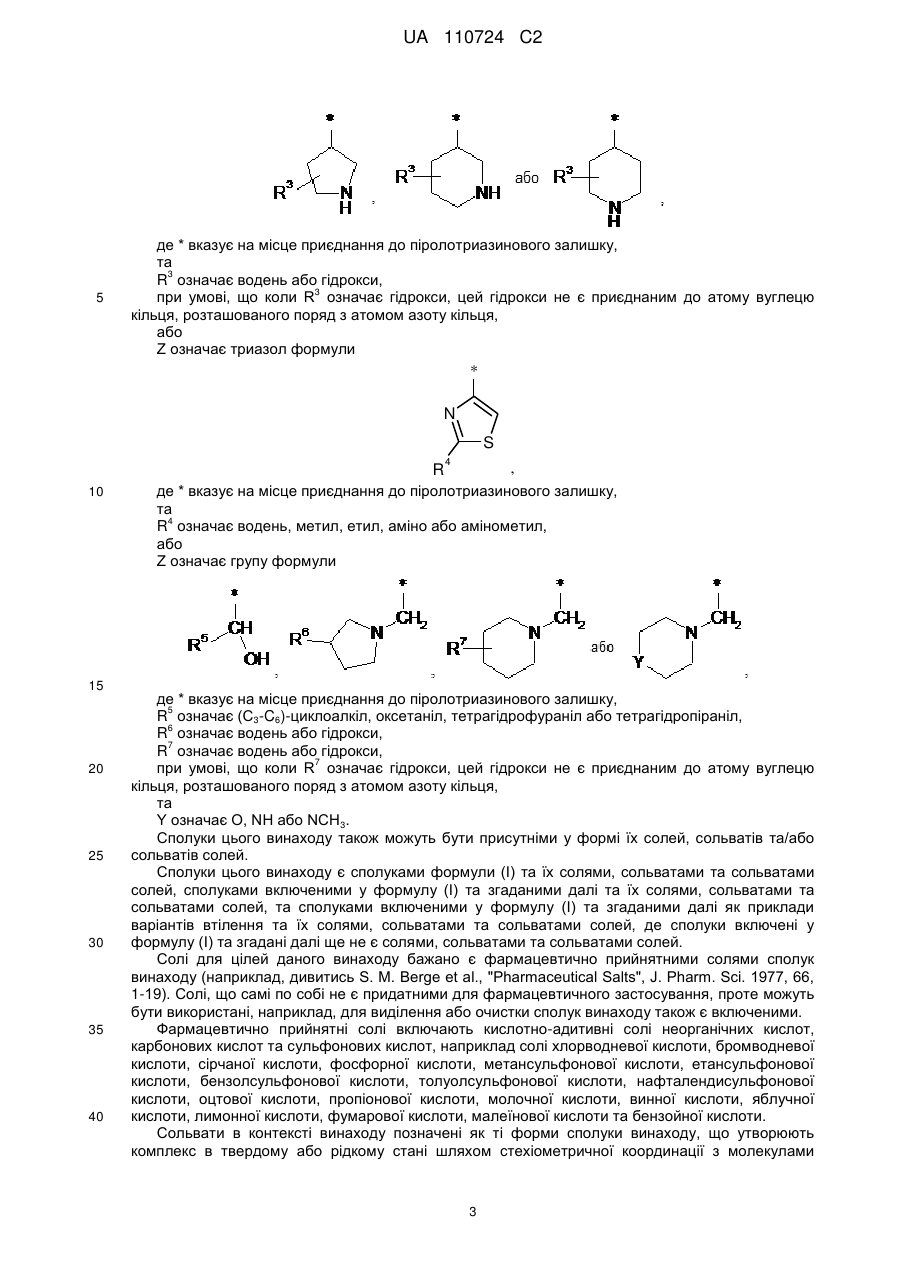
Ζ означає гетероциклічну групу формули
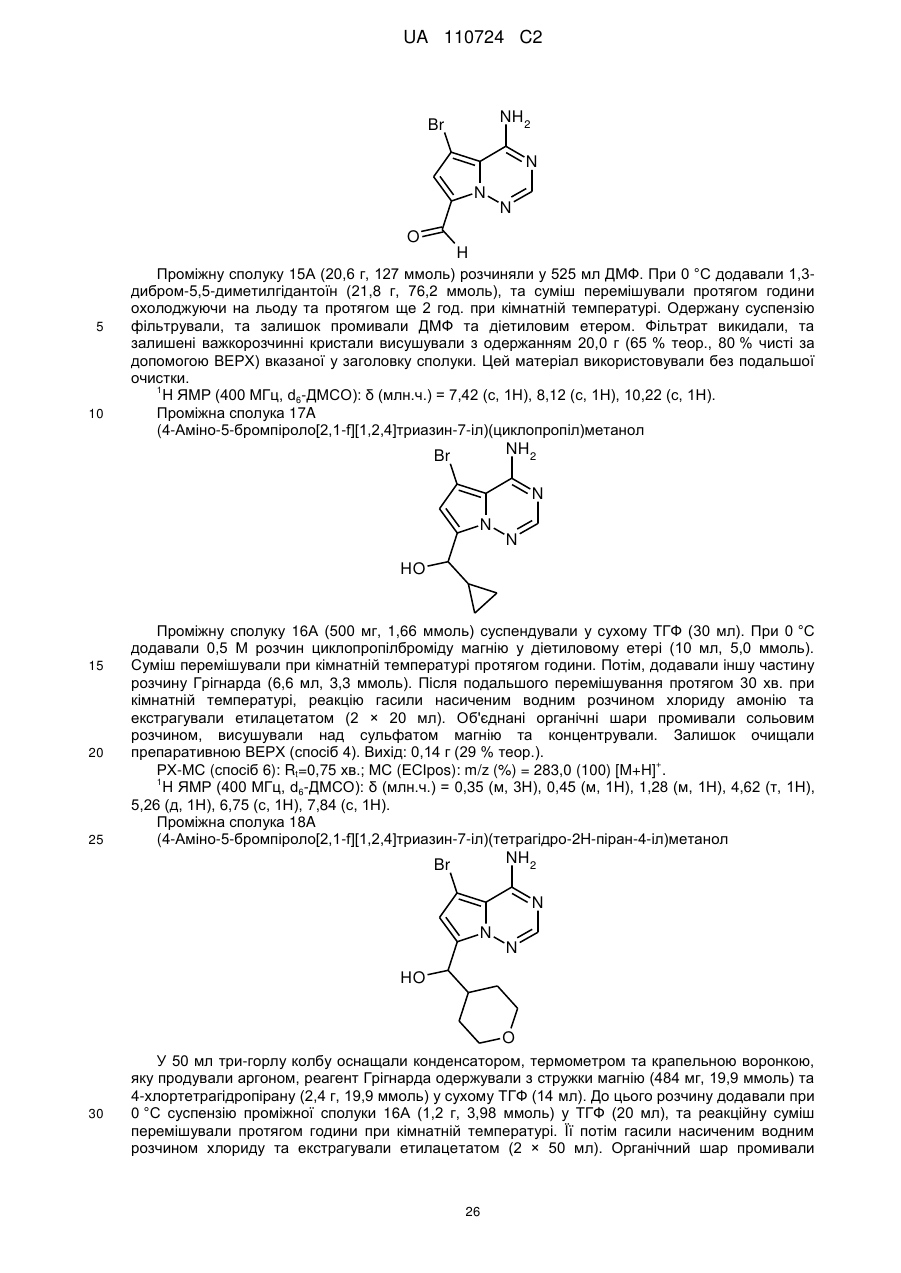
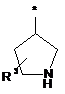 ,
,
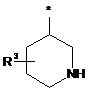
або
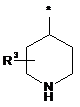 ,
,
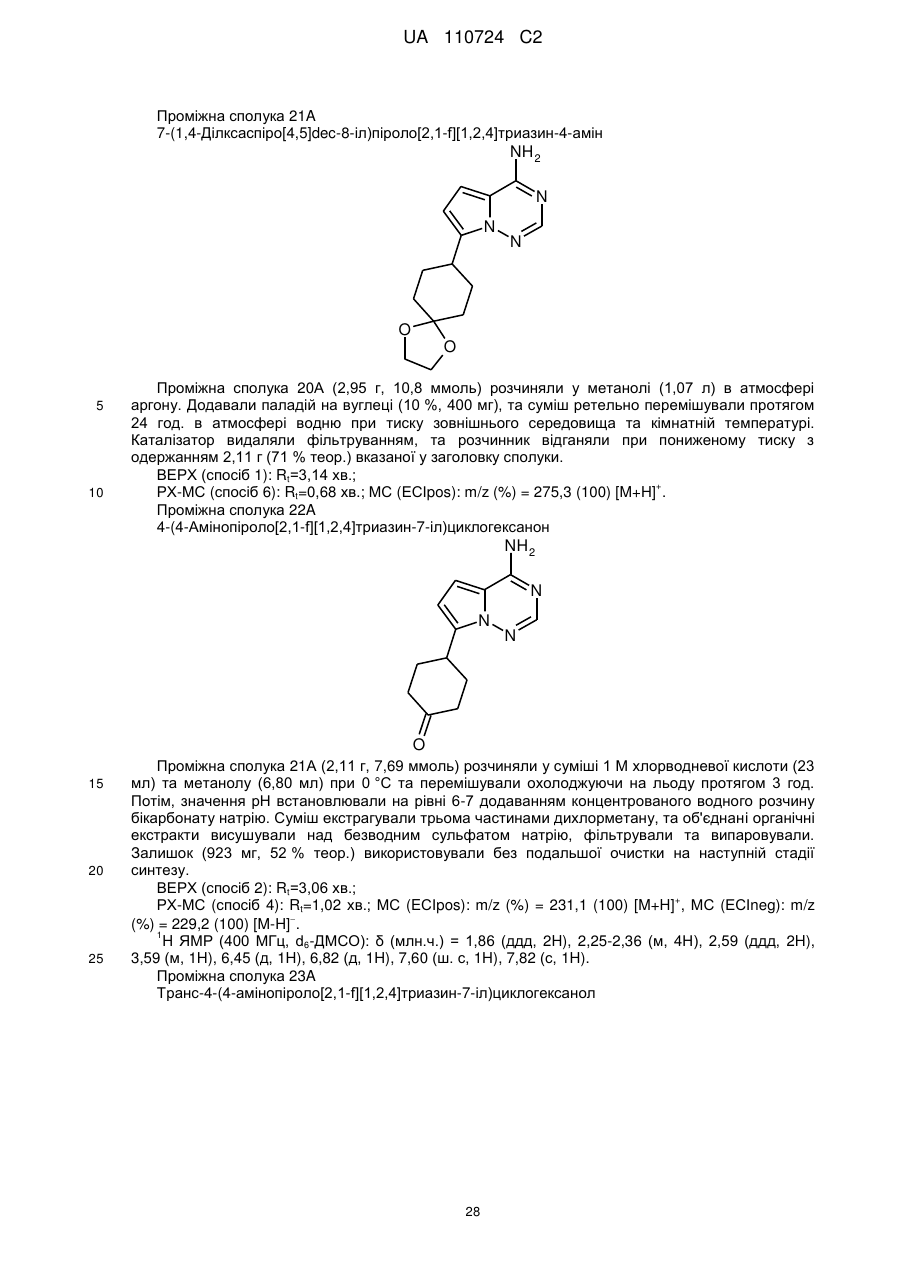
де * вказує на місце приєднання до піролотриазинового залишку,
та
R3 означає водень або гідрокси,
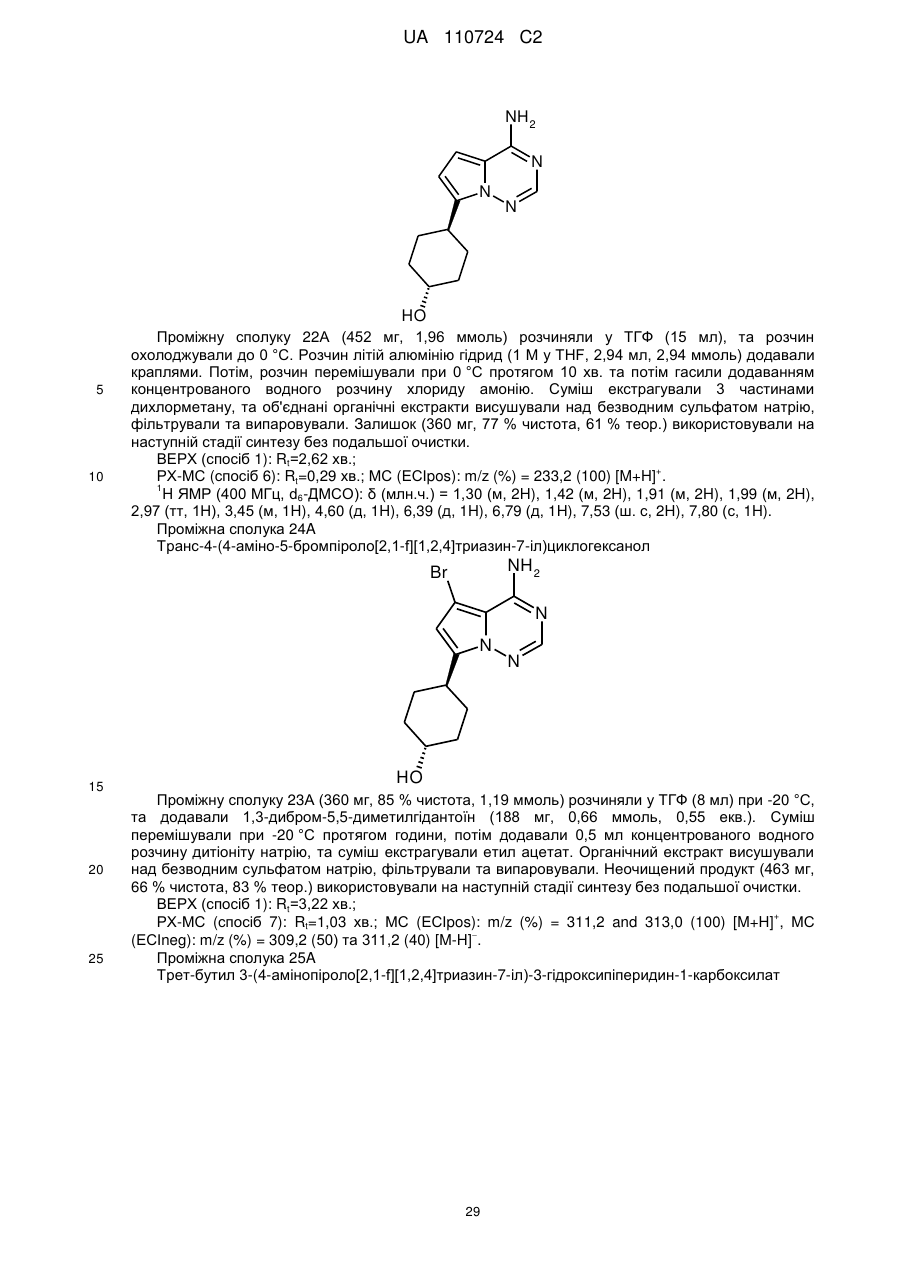
при умові, що, коли R3 означає гідрокси, цей гідрокси не є приєднаним до атома вуглецю кільця, розташованого поряд з атомом азоту кільця,
або
Ζ означає триазол формули
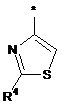 ,
,
де * вказує на місце приєднання до піролотриазинового залишку,
та
R4 означає водень, метил, етил, аміно або амінометил,
або
Ζ означає групу формули
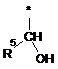 ,
,
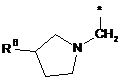 ,
,
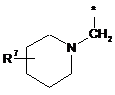
або
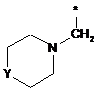 ,
,
де * вказує на місце приєднання до піролотриазинового залишку,
R5 означає (С3-С6)-циклоалкіл, оксетаніл, тетрагідрофураніл або тетрагідропіраніл,
R6 означає водень або гідрокси,
R7 означає водень або гідрокси,
при умові, що, коли R7 означає гідрокси, цей гідрокси не є приєднаним до атома вуглецю кільця, розташованого поряд з атомом азоту кільця,
та
Υ означає О, ΝΗ або NCH3,
або її фармацевтично прийнятна сіль, гідрат та/або сольват.
2. Сполука формули (І) за п. 1, де
А означає C-R2, де
R2 означає водень або фтор,
R1 означає водень, фтор, хлор, метил, етил або метокси,
та
Ζ означає н-пропіл, н-бутил або циклогексил, кожен з яких може бути заміщеним гідрокси,
або
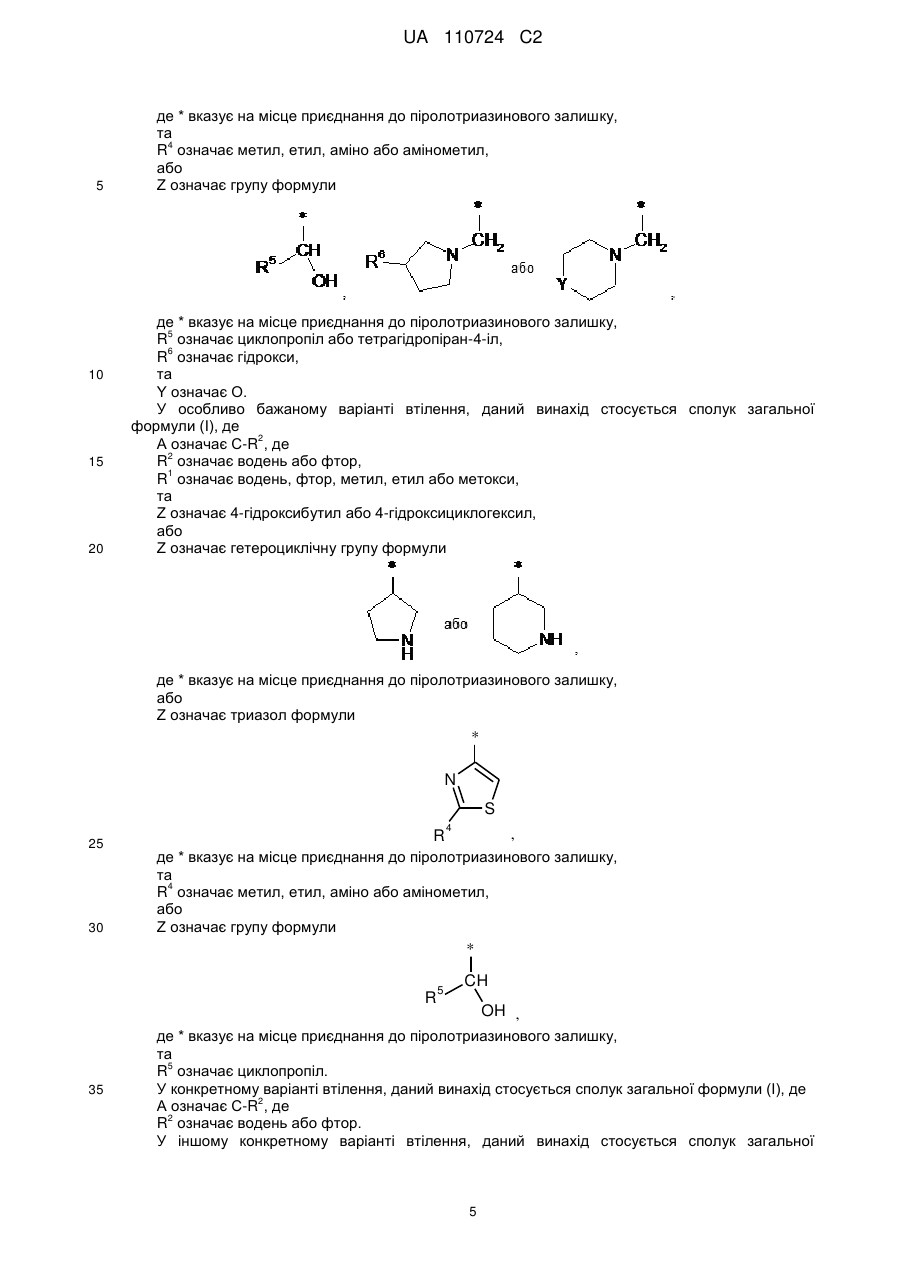
Ζ означає гетероциклічну групу формули
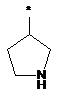 ,
,
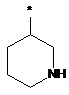
або
 ,
,
де * вказує на місце приєднання до піролотриазинового залишку,
або
Ζ означає тіазол формули
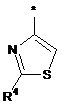 ,
,
де * вказує на місце приєднання до піролотриазинового залишку,
та
R4 означає метил, етил, аміно або амінометил,
або
Ζ означає групу формули
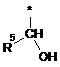 ,
,
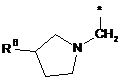
або
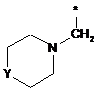 ,
,
де * вказує на місце приєднання до піролотриазинового залишку,
R5 означає циклопропіл або тетрагідропіран-4-іл,
R6 означає гідрокси,
та
Υ означає О,
або її фармацевтично прийнятна сіль, гідрат та/або сольват.
3. Сполука формули (І) за п. 1 або 2, де
А означає C-R2, де
R2 означає водень або фтор,
R1 означає водень, фтор, метил, етил або метокси,
та
Ζ означає 4-гідроксибутил або 4-гідроксициклогексил,
або
Ζ означає гетероциклічну групу формули
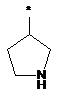
або
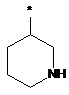 ,
,
де * вказує на місце приєднання до піролотриазинового залишку,
або
Ζ означає тіазол формули
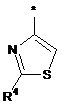 ,
,
де * вказує на місце приєднання до піролотриазинового залишку,
та
R4 означає метил, етил, аміно або амінометил,
або
Ζ означає групу формули
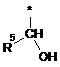 ,
,
де * вказує на місце приєднання до піролотриазинового залишку,
та
R5 означає циклопропіл,
або її фармацевтично прийнятна сіль, гідрат та/або сольват.
Текст
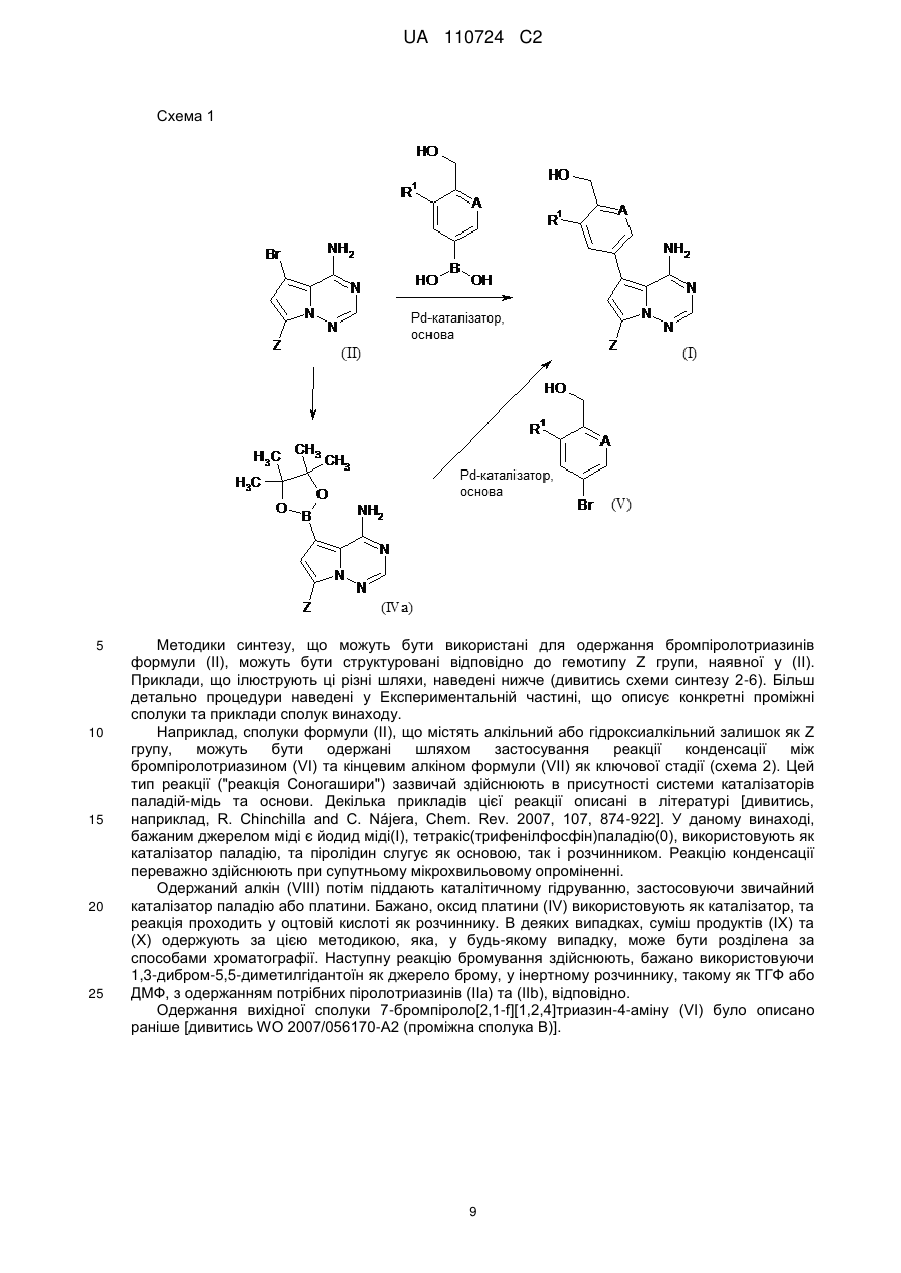
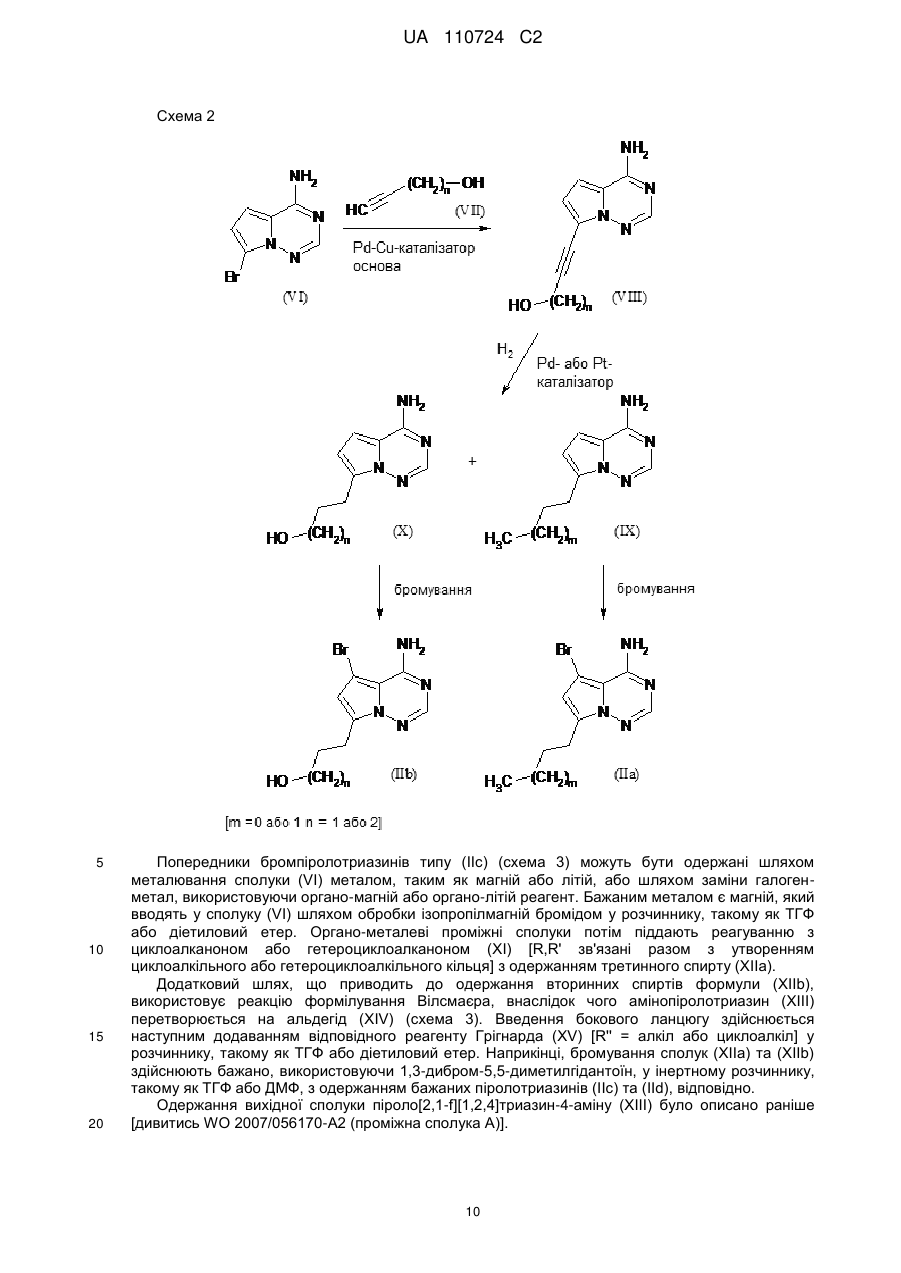
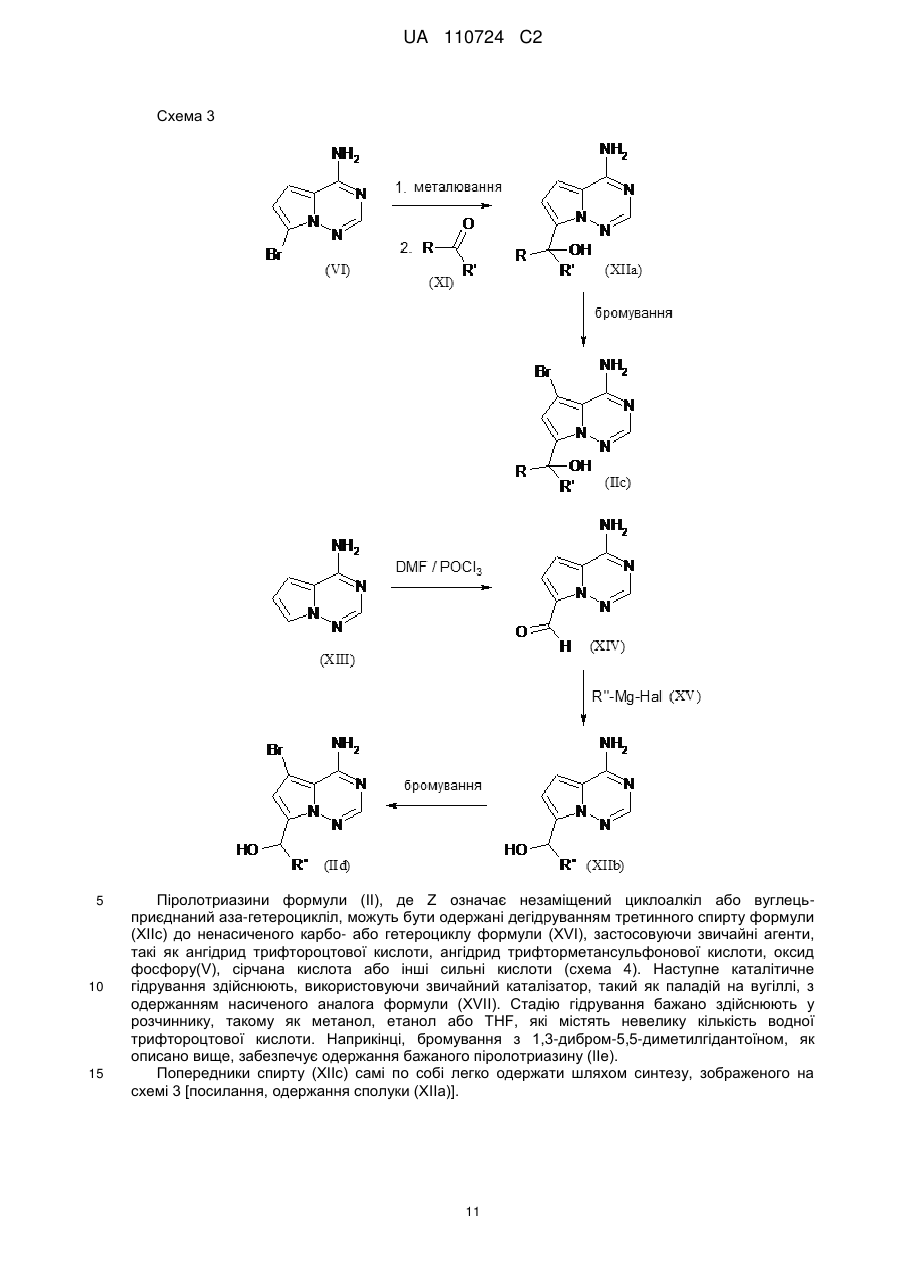
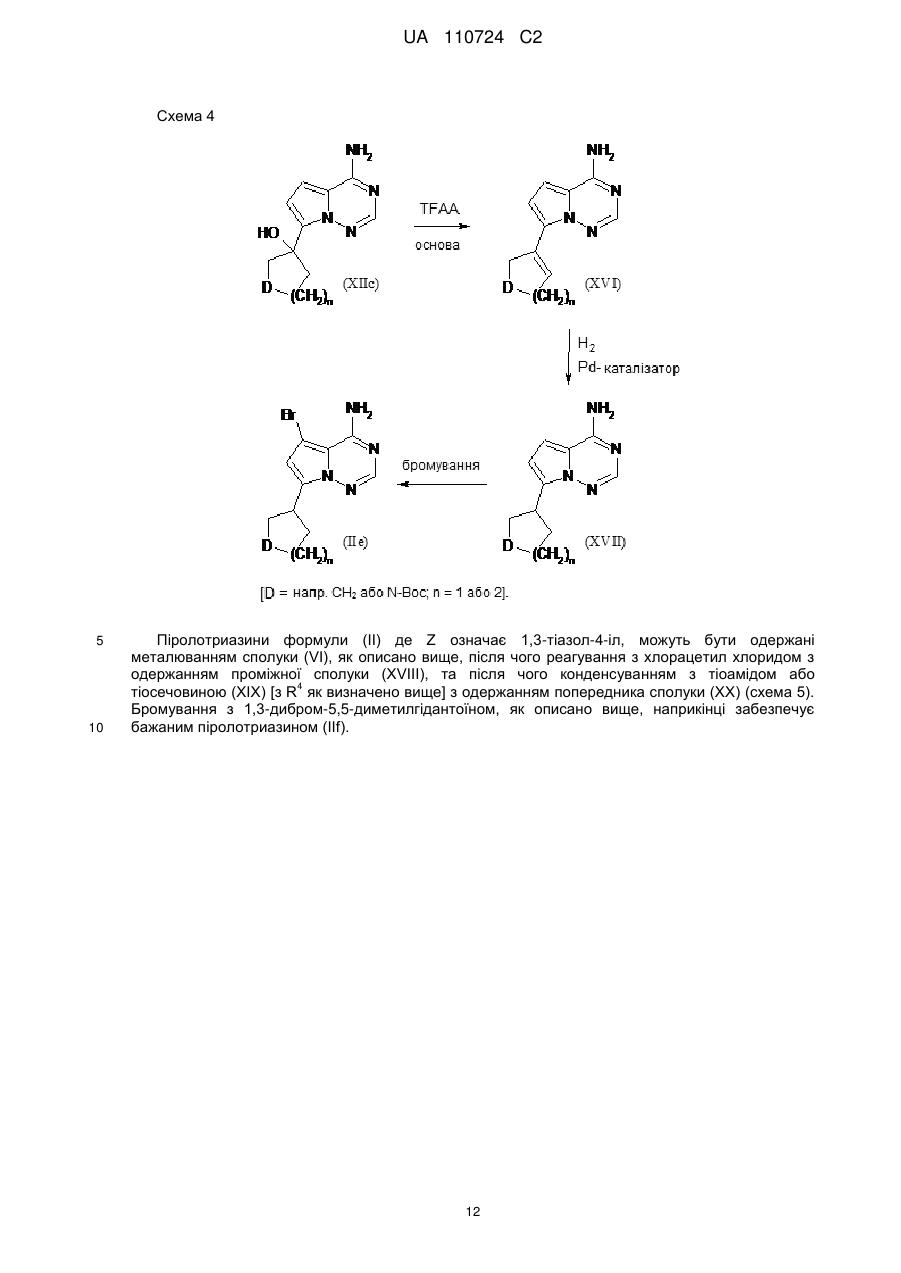
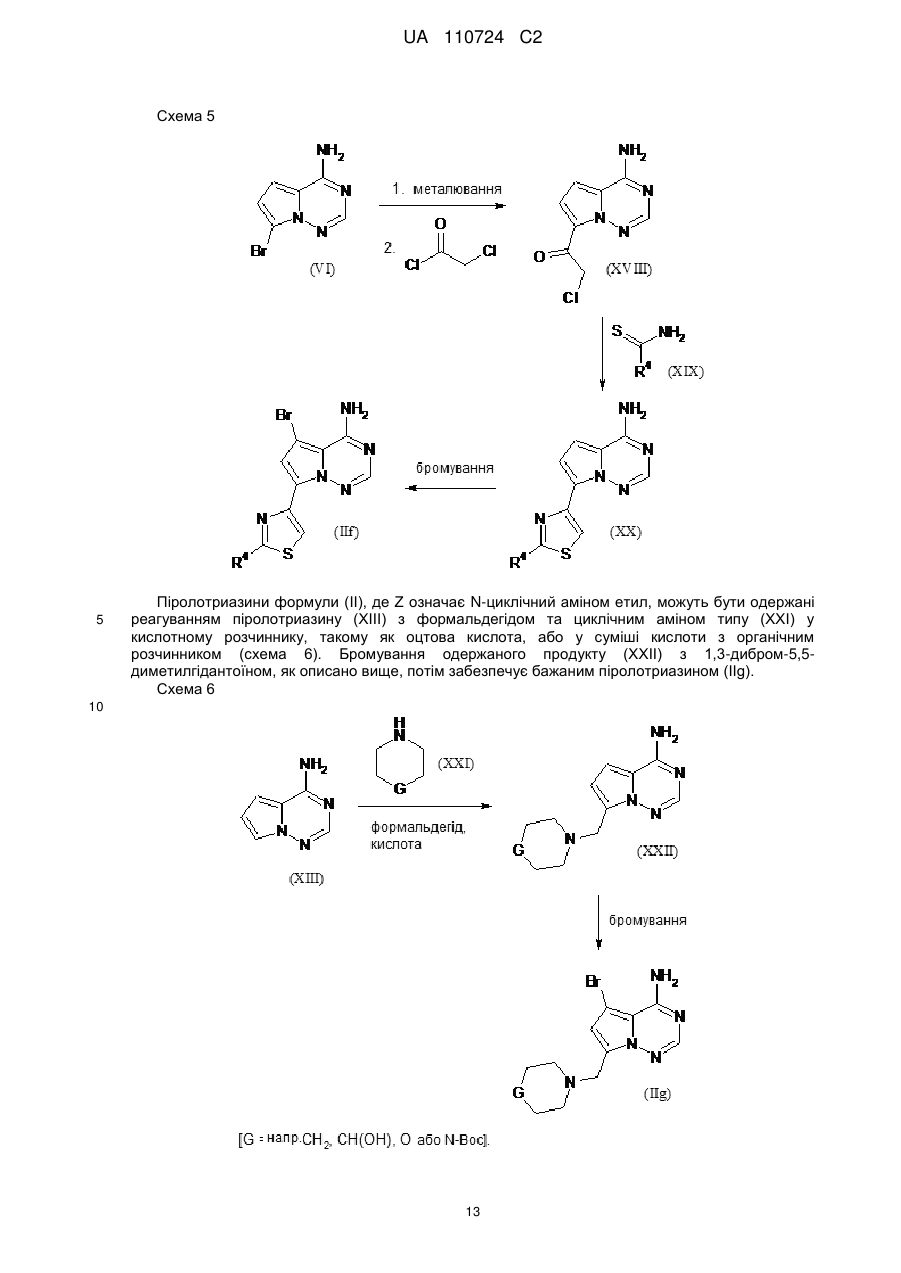
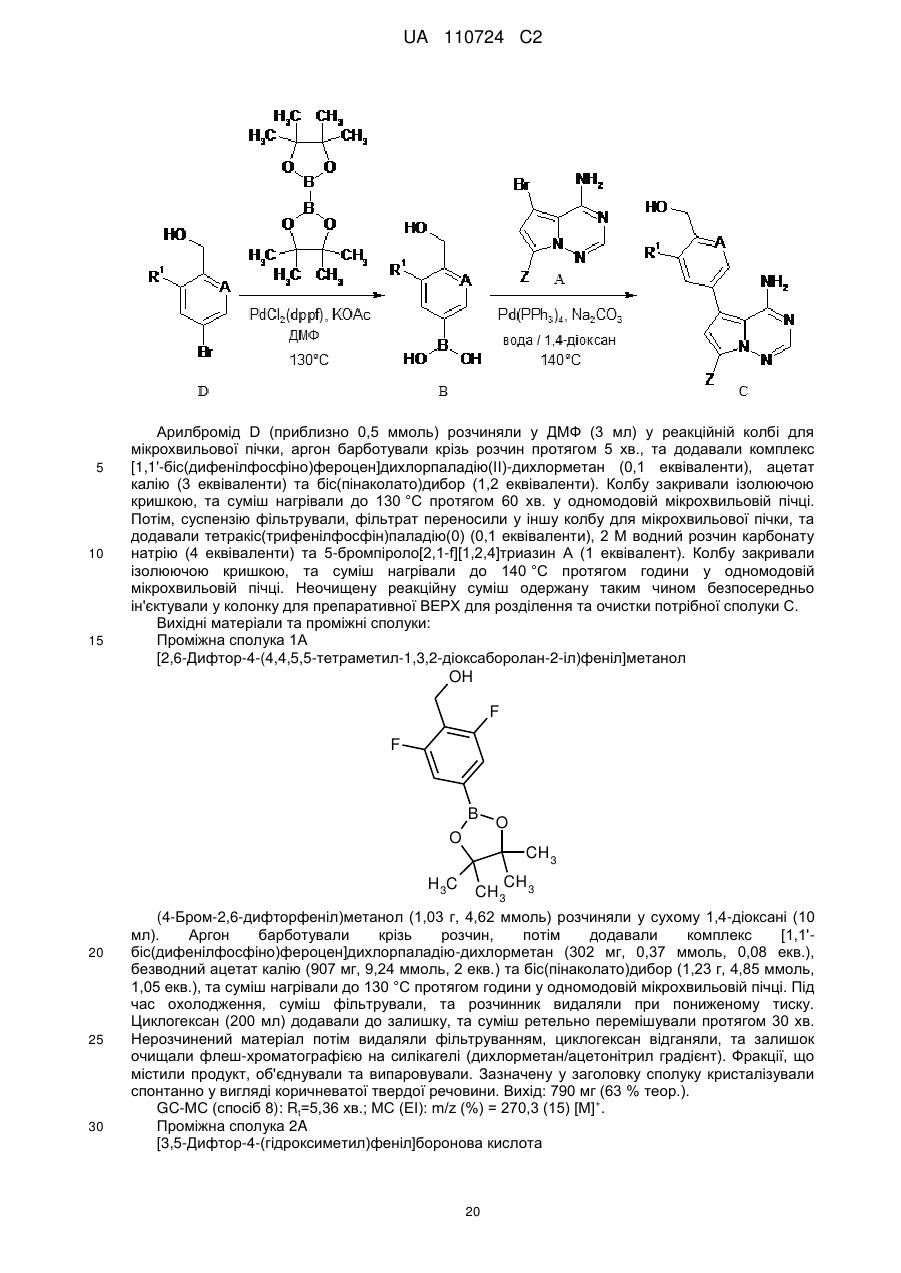
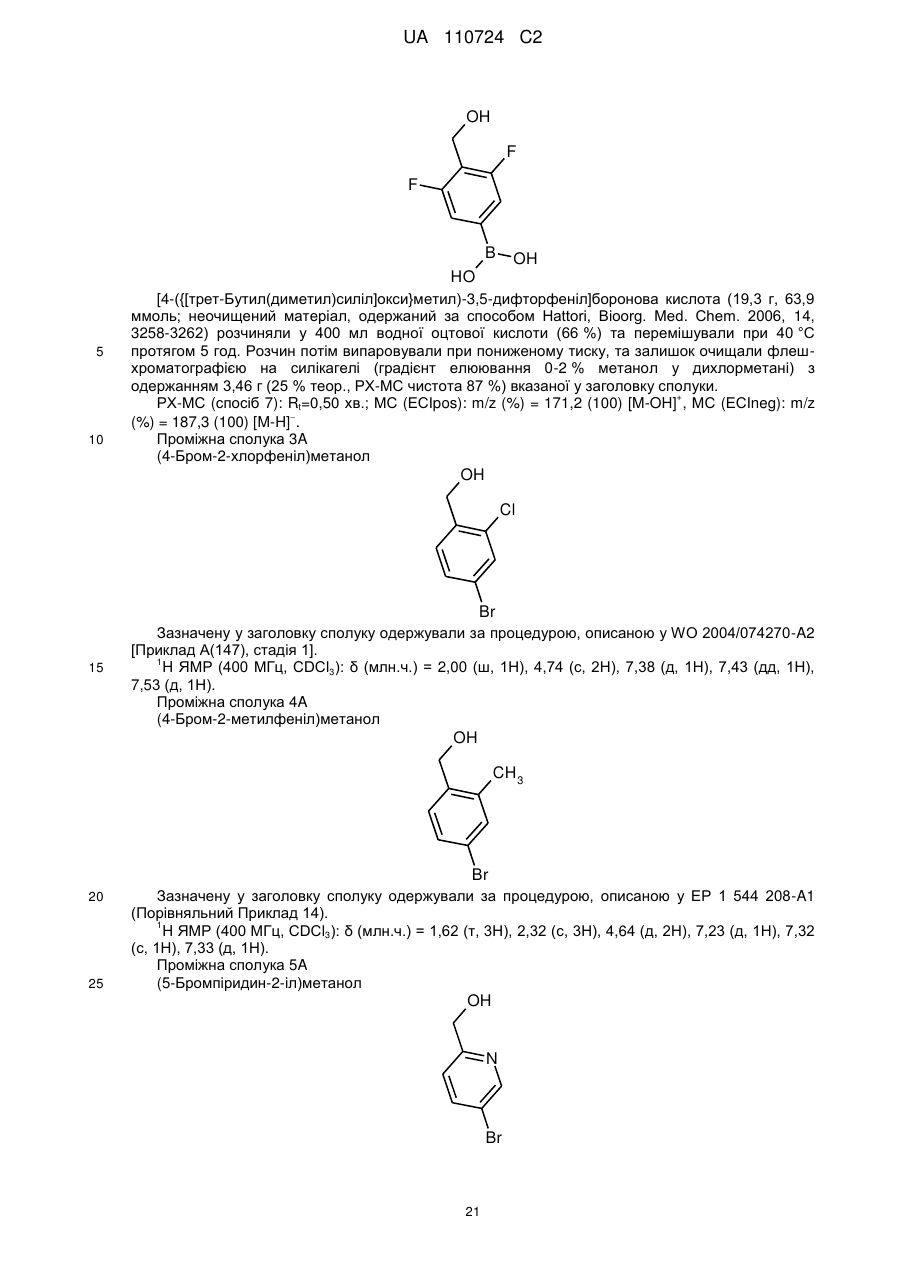
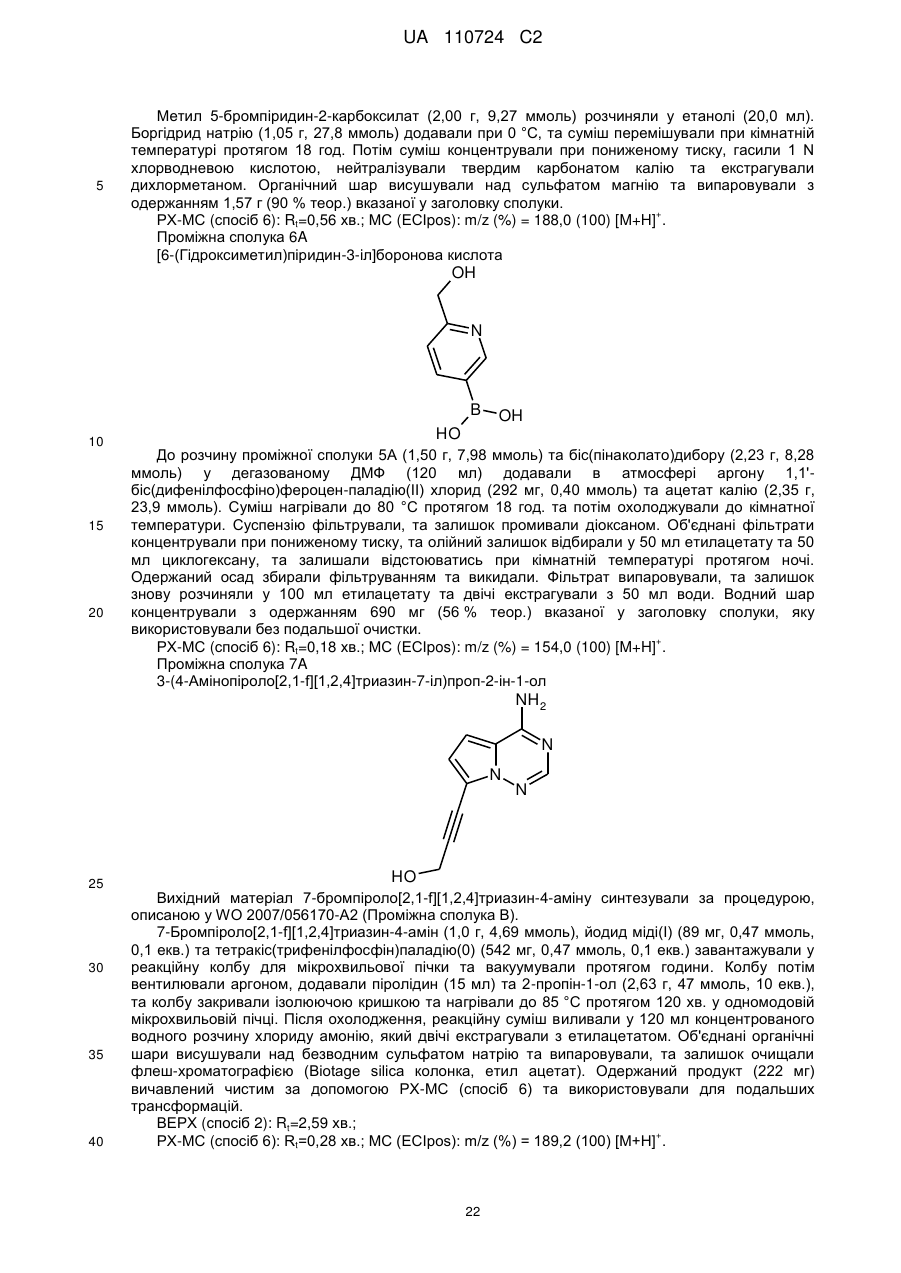
Реферат: Цей винахід стосується нових 5-[(гідроксиметил)арил]-заміщених піроло[2,1-f][1,2,4]триазин-4амінів, способів одержання таких сполук, фармацевтичних композицій, що містять такі сполуки, та застосування таких сполук або композицій для лікування ангіогенез-опосередкованих розладів, зокрема ангіогенез-опосередкованих очних розладів. UA 110724 C2 (12) UA 110724 C2 HO R A 1 NH 2 N N Z N (I), UA 110724 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується нових 5-[(гідроксиметил)арил]-заміщених піроло[2,1-f][1,2,4]триазин4-амінів, способу одержання таких сполук, фармацевтичних композицій, що містять такі сполуки, та застосування таких сполук або композицій для лікування ангіогенезопосередкованих розладів, зокрема, ангіогенез-опосередкованих очних розладів. Термін ангіогенез, який також називають неоваскуляризацією, означає процес формування нових кров'яних судин. Він приймає участь у нормальному розвитку, а також різноманітних патологічних станах, включаючи, наприклад, рак, ревматоїдний артрит, загоєння рани після пошкодження тканини, атеросклероз, псоріаз, та захворювання очей. Різноманітні захворювання очей, які відповідають за більшу частину захворювань зору та сліпоту у розвитих країнах характеризуються, викликаються та/або викликають хороїдальну, ретинальну або радужну неоваскуляризацію або ретинальну едему [Campochiaro (2004), Exp. Opin. Biol. Ther. 4: 1395-1402]. Наприклад, ретинопатія, пов'язана з діабетом, є найважливішою причиною сліпоти при діабеті типу 1, а також зазвичай присутня при діабеті типу 2. Інший очний розлад, що бере участь у неоваскуляризації означає вік-опосередковану макулярну дистрофію (AMD). AMD є найпоширенішою причиною втрати зору у західному світі у тих, кому 50 або старше, та її частота збільшується з віком. AMD класифікують як вологу (неоваскулярну) або суху (ненеоваскулярну). Волога форма захворювання відповідає за найбільш значну втрату зору. Деякі інші менш поширені, проте тим не менш послаблюючі ретинопатії включають хоріоїдальна неоваскулярна мембрана (CNVM), кістозний макулярний набряк (CME, також називають макулярний набряк або макулярна опухлість), епі-ретинальна мембрана (ERM, синдром макулярної складки), та розрив сітківки. У CNVM, аномальні кров'яні судини, що беруть начало з судинної оболонки ока, ростуть крізь шари сітківки. Крихкі нові судини легко руйнуються, що викликає накопичення крові та рідини всередині шарів сітківки. У CME, який може з'явитись внаслідок захворювання, пошкодження або хірургічного втручання, рідина збирається всередині макулярних шарів, викликаючи розпливчастий, перекошений центральний зір. ERM (синдром макулярної складки) є целофано-подібною мембраною, що утворюється поверх жовтої плями, уражуючи центральний зір шляхом викликання розмитості та перекошення. Також сюди відносяться розлади, такі як гіпертонічні та атрофічні зміни пігментного епітелію сітківки (RПE), відшарування сітківки, хоріоїдальна закупорка вен, закупорка вен сітківки, корнеальний ангіогенез після, наприклад, кератиту, трансплантації роговиці або кератопластики, корнеальний ангіогенез внаслідок гіпоксії (наприклад, в результаті надмірного вживання контактних лінз), крилоподібна плева кон'юнктиви, субретинальний набряк, та інтраретинальний набряк. Виявили, що фактор росту ендотелію судин (VEGF) є важливим модулятором ангіогенезу та бере участь у патології різноманітних станів, включаючи AMD та діабетичну ретинопатію. Більш того, для AMD показали, що інтравітреальна ін'єкція інгібітора анти-VEGF, такого як пегабтаніб, ранібізумаб або афліберцепт зменшує хороїдальний ангіогенез та транссудацію [Gragoudas (2004), N. Engl. J. Med. 351: 2805-2816; Rosenfeld (2006), N. Engl. J. Med. 355: 1419-1431; Dixon (2009), Expert Opin. Investig. Drugs 18: 1573-1580]. Сучасним стандартом для лікування AMD є луцентіс (ранібізумаб), анти-VEGF терапія. Однак, лише 1/3 всіх пацієнтів з AMD, яких лікували луцентісом, показали покращення зору [Rosenfeld (2006), N. Engl. J. Med. 355: 1419-1431]. Тому, нові анти-ангіогенні терапевтичні засоби з VEGF-незалежним шляхом дії мають потенціал для покращення сучасного стандарту лікування захворювань, таких як діабетична ретинопатія та AMD. ALK1 (активін-подібна кіназа-1) є рецептором Ser/Thr кінази з TGFβ родини рецепторів, які головним чином експресуються у ендотеліальних клітинах та беруть участи у ангіогенезі. Члени цієї родини здійснюють свою біологічну активність шляхом зв'язування ліганда з гетеромерним рецепторним комплексом типу I та типу II рецепторів серин/треонін кінази TβRI та TβRII та рецепторів допоміжного типу III. TGFβ а також високо афінні ліганди BMP9 та BMP10 можуть активувати ALK1 в рецепторнихкомплексах з BMPRII або ActRII та рецептором ендогліну типу III [Scharpfenecker (2007), J. Cell Sci. 120: 964-972]. Зв'язування BMP9 з ALK1 в капілярних ендотеліальних клітинах активує шлях Smad1/5/8 [David (2007), Blood 109 (5): 1953-1961]. Вважалось, що BMP9 інгібує міграцію та ріст ендотеліальних клітин. Більшість досліджень, однак, виявила, що активацію рецептора ALK1 стимулює міграцію, проліферацію та утворення трубки ендотеліальними клітинами [Goumans (2002), EMBO Journal 21 (7): 1743-1753; Wu (2006), Microvasc. Res. 71: 12-19]. BMP9 та BMP10 активують рецепторні комплекси ALK1. В ендотеліальних клітинах, TGFβ також може активувати ALK1, у той час як у більшості типів клітин TGFβ передає сигнал через 1 UA 110724 C2 5 10 15 20 25 30 35 40 ALK5. Активація ALK5 приводить до фосфорилювання Smad2/3, у той час як активація ALK1 приводить до фосфорилювання Smad1/5. Кожен сигнальний шлях Smad в результаті приводить до регулювання конкретного набору генів-мішеней: Сигнальний шлях Smad2/3 викликає експресію PAI-1 та пригнічення Id-1, у той час як сигнальний шлях Smad1/5 викликає експресію Smad6, Smad7 та Id-1 та пригнічення експресії PAI-1 [Deng (2006), J. Cell Biol. 134: 1563-1571; Ota (2002), J. Cell Physiol. 193: 299-318]. Рецептор ендогліну типу III відіграє роль точного регулятора сигнальних шляхів ALK1 та ALK5, особливо, в ендотеліальних клітинах, шляхом регулювання взаємодії ліганд-рецептор [ten Dijke (2008), Ангіогенез 11: 79-89]. Ендоглін допомагає TGFβ/ALK1-взаємодії, проте пригнічує TGFβ/ALK5-взаємодію [David (2007), Blood 109: 1953-1961]. Мутації в ендогліні та в ALK1 пов'язані з аутосомальним домінантним розладом, що називається спадкова геморагічна телеангіектазія (HHT1 та HHT2, відповідно) з характеристиками ангіогенного розладу, такими як артеріовенозна мальформація та телеангіектазія [Fernandez-Lopez (2006), Clin. Med. & Res. 4: 66-78]. Миші RIP1-Tag2 з тільки +/ однією функціональною копією гена ALK1 (ALK1 ) показали затримку росту пухлини та меншу wt щільність капілярів, порівняно з мишами ALK1 . Подібні спостереження здійснювали з розчинним ALK1-Fc рецепторним конструктом RAP-041, що пригнічував ангіогенез пухлини in vivo та обмежував ріст пухлини [Cunha (2010), J. Exp. Med. 207: 85-100]. Розробка сильнодійних та селективних інгібіторів ALK1 є таким чином дуже бажаним для подальшого виявлення ролі ALK1 у фізіології та патології кров'яних судин, та для одержання потенційних терапевтичних засобів для захворювань, пов'язаних з ангіогенезом та реконструкцією судин. У WO 2007/147647-A1, описані певні 3-арил-заміщені похідні піразоло[1,5-a]піримідину, що є першими дрібно молекулярними інгібіторами кінази ALK1, опублікованій на той час. Вказано, що ці сполуки є придатними для лікування захворювань нерегульованого росту судин, зокрема, твердих пухлин та їх метастазів, а також ангіогенез-залежних захворювань очей, таких як вікопосередкована макулярна дистрофія. Різноманітні похідні піроло[2,1-f][1,2,4]триазин-4-аміну з чіткими профілями інгібування проти діапазону протеїнкіназ описані у, inter alia, WO 00/71129-A1, WO 2005/121147-A1, WO 2007/056170-A2, WO 2007/061882-A2, WO 2007/064883-A2, WO 2007/064931-A2, WO 2007/079164-A2, WO 2008/089105-A2, WO 2009/136966-A1 та WO 2010/126960-A1. Зазвичай, зазначали, що ці сполуки є придатними для лікування проліферативних та/або ангіогенезопосередкованих розладів, таких як рак. Жодна з цих публікацій, однак, не стосується ALK1 як потенційної кінази мішені. Неочікувано, було виявлено, що похідні піроло[2,1-f][1,2,4]триазин-4-аміну, що мають замісник гідроксиметиларил у 5-положенні проявляють значне та селективне інгібування ALK1 кінази, що робить ці сполуки особливо бажаними для лікування ангіогенез-опосередкованих розладів очей. Таким чином, у одному аспекті, даний винахід стосується 5-[(гідроксиметил)арил]-заміщених піроло[2,1-f][1,2,4]триазин-4-амінів загальної формули (I) HO R A 1 NH 2 N N Z 45 N (I), де 2 A означає N або C-R , де 2 R означає водень, фтор або хлор, 1 R означає водень, фтор, хлор, метил, етил або метокси, та Z означає (C1-C4)-алкіл або (C3-C6)-циклоалкіл, кожен з яких може бути заміщеним гідрокси, або Z означає гетероциклічну групу формули 2 UA 110724 C2 5 де * вказує на місце приєднання до піролотриазинового залишку, та 3 R означає водень або гідрокси, 3 при умові, що коли R означає гідрокси, цей гідрокси не є приєднаним до атому вуглецю кільця, розташованого поряд з атомом азоту кільця, або Z означає триазол формули * N S R 10 15 20 25 30 35 40 4 , де * вказує на місце приєднання до піролотриазинового залишку, та 4 R означає водень, метил, етил, аміно або амінометил, або Z означає групу формули де * вказує на місце приєднання до піролотриазинового залишку, 5 R означає (C3-C6)-циклоалкіл, оксетаніл, тетрагідрофураніл або тетрагідропіраніл, 6 R означає водень або гідрокси, 7 R означає водень або гідрокси, 7 при умові, що коли R означає гідрокси, цей гідрокси не є приєднаним до атому вуглецю кільця, розташованого поряд з атомом азоту кільця, та Y означає O, NH або NCH3. Сполуки цього винаходу також можуть бути присутніми у формі їх солей, сольватів та/або сольватів солей. Сполуки цього винаходу є сполуками формули (I) та їх солями, сольватами та сольватами солей, сполуками включеними у формулу (I) та згаданими далі та їх солями, сольватами та сольватами солей, та сполуками включеними у формулу (I) та згаданими далі як приклади варіантів втілення та їх солями, сольватами та сольватами солей, де сполуки включені у формулу (I) та згадані далі ще не є солями, сольватами та сольватами солей. Солі для цілей даного винаходу бажано є фармацевтично прийнятними солями сполук винаходу (наприклад, дивитись S. M. Berge et al., "Pharmaceutical Salts", J. Pharm. Sci. 1977, 66, 1-19). Солі, що самі по собі не є придатними для фармацевтичного застосування, проте можуть бути використані, наприклад, для виділення або очистки сполук винаходу також є включеними. Фармацевтично прийнятні солі включають кислотно-адитивні солі неорганічних кислот, карбонових кислот та сульфонових кислот, наприклад солі хлорводневої кислоти, бромводневої кислоти, сірчаної кислоти, фосфорної кислоти, метансульфонової кислоти, етансульфонової кислоти, бензолсульфонової кислоти, толуолсульфонової кислоти, нафталендисульфонової кислоти, оцтової кислоти, пропіонової кислоти, молочної кислоти, винної кислоти, яблучної кислоти, лимонної кислоти, фумарової кислоти, малеїнової кислоти та бензойної кислоти. Сольвати в контексті винаходу позначені як ті форми сполуки винаходу, що утворюють комплекс в твердому або рідкому стані шляхом стехіометричної координації з молекулами 3 UA 110724 C2 5 10 15 20 25 30 35 40 45 розчинника. Гідрати є конкретною формою сольватів, в яких координація здійснюється з водою. Гідрати є бажаними сольватами в контексті даного винаходу. Сполуки цього винаходу можуть, або за природою асиметричних центрів або за обмереженим обертанням, знаходитись у формі ізомерів (енантіомерів, діастереомерів). Будьякий ізомер може бути присутнім, у якому асиметричний центр знаходиться у (R)-, (S)- або (R,S)-конфігурації. Також бажано, коли два або кілька асиметричних центри наявні у сполуці винаходу, декілька діастереомерів та енантіомерів представлених структур часто є можливими, та бажані варіанти втілення представлені чистими діастереомерами та чистими енантіомерами. Передбачається, що чисті стереоізомери, чисті діастереомери, чисті енантіомери, та їх суміші, входять у рамки винаходу. Геометричні ізомери за природою замісників біля подвійного зв'язку або кільця можуть знаходитись у цис (= Z-) або транс (= E-) формі, та обидві ізомерні форми є включеними у рамки даного винаходу. Всі ізомери, чи виділені, чисті, частково очищені або у рацемічній суміші, сполук цього винаходу є включеними у рамки даного винаходу. Очистку вказаних ізомерів та розділення вказаної рацемічної суміші здійснюють за відомими у галузі способами. Наприклад, діастереомерні суміші можуть бути розділені на окремі ізомери хроматографією або кристалізацією, та рацемати можуть бути розділені на відповідні енантіомери хроматографією на хіральній фазі або розчиненням. Також, всі можливі таутомерні форми вищеописаних сполук є включеними у рамки даного винаходу. Доки не зазначено протилежне, наступні значення наводять для замісників та залишків, використані по всьому опису та формулі: (C1-C4)-алкіл означає з прямим ланцюгом або розгалужений насичений вуглеводневий радикал, що має 1-4 атоми вуглецю. Приклади включають метил, етил, н-пропіл, ізопропіл, нбутил, ізобутил, втор.-бутил, трет-бутил. (C3-C6)-циклоалкіл означає моно циклічний насичений вуглеводневий радикал, що має 3-6 кільцевих атомів вуглецю. Приклади включають циклопропіл, циклобутил, циклопентил, циклогексил. По цьому документу, з метою спрощення, застосуванню однини надають перевагу над множиною, проте зазвичай множинні значення також є включеними, доки не вказано протилежне. Наприклад, вираз "Спосіб лікування захворювання у пацієнта, що включає введення пацієнту ефективної кількості сполуки формули (I)" включає одночасне лікування більш ніж однієї хвороби, а також введення більш ніж однієї сполуки формули (I). У бажаному варіанті втілення, даний винахід стосується сполук загальної формули (I), де 2 A означає C-R , де 2 R означає водень або фтор, 1 R означає водень, фтор, хлор, метил, етил або метокси, та Z означає н-пропіл, н-бутил або циклогексил, кожен з яких може бути заміщеним гідрокси, або Z означає гетероциклічну групу формули де * вказує на місце приєднання до піролотриазинового залишку, або Z означає триазол формули * N S R 4 , 4 UA 110724 C2 5 10 15 20 де * вказує на місце приєднання до піролотриазинового залишку, та 4 R означає метил, етил, аміно або амінометил, або Z означає групу формули де * вказує на місце приєднання до піролотриазинового залишку, 5 R означає циклопропіл або тетрагідропіран-4-іл, 6 R означає гідрокси, та Y означає O. У особливо бажаному варіанті втілення, даний винахід стосується сполук загальної формули (I), де 2 A означає C-R , де 2 R означає водень або фтор, 1 R означає водень, фтор, метил, етил або метокси, та Z означає 4-гідроксибутил або 4-гідроксициклогексил, або Z означає гетероциклічну групу формули де * вказує на місце приєднання до піролотриазинового залишку, або Z означає триазол формули * N S 25 30 R 4 , де * вказує на місце приєднання до піролотриазинового залишку, та 4 R означає метил, етил, аміно або амінометил, або Z означає групу формули * R 35 5 CH OH , де * вказує на місце приєднання до піролотриазинового залишку, та 5 R означає циклопропіл. У конкретному варіанті втілення, даний винахід стосується сполук загальної формули (I), де 2 A означає C-R , де 2 R означає водень або фтор. У іншому конкретному варіанті втілення, даний винахід стосується сполук загальної 5 UA 110724 C2 5 10 формули (I), де 2 A означає C-R , де 2 R означає фтор, та 1 R означає фтор. Визначення залишків конкретно вказані у відповідних комбінаціях або бажаних комбінацій залишків можуть бути замінені у разі потреби визначеннями залишків інших комбінацій, незалежно від певних комбінацій, зазначених для залишків. Комбінації двох або більше вищенаведених бажаних діапазонів є особливо бажаними. У іншому варіанті втілення, даний винахід стосується способу одержання сполуки загальної формули (I), який відрізняється тим, що бромпіролотриазин формули (II) NH2 Br N N N Z 15 (II), де Z має вищенаведене значення, є або [A] конденсованим з арилбороновою кислотою або естером формули (III) HO R 1 A O R B 8 8 R (III), 1 20 O де A та R мають вищенаведені значення, та 8 8 R означає водень або (C1-C4)-алкіл, або обидва залишки R зв'язані разом з утворенням (CH2)2-, -C(CH3)2-C(CH3)2-, -(CH2)3- або -CH2-C(CH3)2-CH2- містка, в присутності придатного каталізатора паладію та основи з одержання потрібної сполуки формули (I) HO R A 1 NH 2 N N Z (I), де A, Z та R мають вищенаведені значення, або [B] спочатку перетвореним на відповідну похідну боронової кислоти або естеру формули (IV) 1 25 N 6 UA 110724 C2 R R 9 9 O O NH2 B N N N Z 5 (IV), де Z має вищенаведене значення, та 9 9 R означає водень або (C1-C4)-алкіл, або обидва залишки R зв'язані разом з утворенням (CH2)2-, -C(CH3)2-C(CH3)2-, -(CH2)3- або -CH2-C(CH3)2-CH2- містка, яку потім конденсують з арилбромідом формули (V) HO R 1 A Br (V), де A та R мають вищенаведені значення, в присутності придатного каталізатора паладію та основи з одержанням бажаної сполуки формули (I) 1 10 HO R A 1 NH 2 N N Z (I), де A, Z та R мають вищенаведені значення, необов'язково після чого, у разі потреби, шляхом (i) розділення сполук формули (I) на їх відповідні енантіомери та/або діастереомери, бажано використовуючи способи хроматографії, та/або (ii) перетворення сполук формули (I) на їх відповідні гідрати, сольвати, солі та/або гідрати або сольвати солей шляхом обробки відповідними розчинниками та/або кислотами. Як зазначено вище, сполуки формули (I) можуть бути синтезовані шляхом конденсації ("конденсація Сузукі") між бромпіролотриазином (II) та арил боронатом або бороновою кислотою (III). Це конденсування зазвичай здійснюють при підвищеній температурі, використовуючи каталізатор паладію, основу або інертний розчинник. Огляд каталізаторів та умов реакції можна знайти в літературі [дивитись, наприклад, S. Kotha et al., Tetrahedron 2002, 58, 9633-9695; T.E. Barder et al., J. Am. Chem. Soc. 2005, 127, 4685-4696]. Бажаним каталізатором в цій реакції є тетракіс(трифенілфосфін)паладію(0). Бажаною основою є карбонат натрію, застосований як водний розчин. Реакцію здійснюють у органічних розчинниках, що є інертними в умовах реакції, таких як 1,4-діоксан, ацетонітрил, N,N-диметилформамід (ДMФ) або диметилсульфоксид (ДMСO), або у воді або у сумішах цих розчинників. Бажано, реакцію здійснюють у суміші 1,4-діоксану та води або ацетонітрилу та води. Реакцію зазвичай здійснюють при температурах від +100 °C до +250 °C, бажано від +120 °C дo+150 °C. Нагрівання бажано здійснюють у одно-модовій мікрохвильовій пічці. Реакції зазвичай перебігають в атмосфері інертного газу, бажано аргону. Зворотня реактивність реакційних партнерів для конденсації Сузукі може іноді бути 1 15 20 25 30 N 7 UA 110724 C2 5 10 15 20 25 30 бажаною. Для цієї мети, бромпіролотриазин (II) спочатку перетворюють на відповідний боронат (IV) та потім крос-конденсують з арил бромідом (V) згідно з одним з вищеописаних способів. Перетворення (II) - (IV) досягають метал-опосередкованою реакцією борилювання. Бажаним способом є паладій-каталізоване "борилювання Міяура" [дивитись, наприклад, J. Takagi et al., J. Am. Chem. Soc. 2002, 124, 8001-8006; T. Ishiyama et al., J. Org. Chem. 1995, 60, 7508-7510; A. L. S. Thompson et al., Synthesis 2005, 547-550]. Процедури, реагенти та розчинники для реакції крос-конденсування (IV) + (V) (I) вибирають з тих, що наведені у попередніх секціях. 8 8 8 Арилборонові кислоти (III) [R =H] та арилборонати (III) [R = алкіл, або обидва R зв'язані разом з утворенням циклічного боронового естеру, наприклад, пінаколінового естеру] є або наявними на ринку, або їх можна одержати з відповідних арил галідів або арил три флатів, використовуючи метал-опосередковану реакцію борилювання (з метою посилання, дивитись попередній розділ). Борилювання та наступну конденсацію Сузукі можна здійснювати у дів окремі стадії, включаючи виділення та очистку проміжної сполуки (III). Альтернативно, борилювання та крос-конденсацію можна здійснювати як одно-стадійну процедуру, використовуючи (III) напряму без виділення та очистки. У випадках, коли залишок первинного або вторинного аміну утворює частину групи Z у сполуці мішені формули (I), зазвичай є бажаним при вищеописаних борилюванні та конденсації використовувати захищену похідну цього аміну, як вихідний піролотриазин (II) замість вільного аміну. Для цієї мети, можна використовувати звичайні тимчасові аміно-захисні групи, такі як ацильні групи (наприклад, ацетил або трифторацетил) або захисні групи карбаматного типу (наприклад, Boc-, Cbz- або Fmoc-група). Бажано, використовують трифторацетил або Boc групу. Аналогічно, гідрокси функція в компонентах конденсації (III) та (V), відповідно, може бути тимчасово заблокована протягом реакції, бажано як похідна силілового етеру, такого як триметилсиліловий або трет-бутилдиметилсиліловий етер. Ці захисні групи можуть потім бути відщеплені протягом водної обробки реакційних сумішей конденсації, або їх видаляють у наступній окремій стадії, використовуючи стандартні способи. Одержання захищених вищеописаних проміжних сполук з відповідних вільних амінів або спиртів формули (II), (III) та (V), відповідно, або з іншого попередника сполуки (дивитись розділ нижче) також легко здійснюють за звичайними процедурами, описаними у літературі [дивитись, наприклад, T.W. Greene and P. Wuts, Protective Groups in Organic Synthesis, Wiley, New York, 1999]. Одержання сполуки винаходу може бути проілюстровано за наступною схемою синтезу: 8 UA 110724 C2 Схема 1 5 10 15 20 25 Методики синтезу, що можуть бути використані для одержання бромпіролотриазинів формули (II), можуть бути структуровані відповідно до гемотипу Z групи, наявної у (II). Приклади, що ілюструють ці різні шляхи, наведені нижче (дивитись схеми синтезу 2-6). Більш детально процедури наведені у Експериментальній частині, що описує конкретні проміжні сполуки та приклади сполук винаходу. Наприклад, сполуки формули (II), що містять алкільний або гідроксиалкільний залишок як Z групу, можуть бути одержані шляхом застосування реакції конденсації між бромпіролотриазином (VI) та кінцевим алкіном формули (VII) як ключової стадії (схема 2). Цей тип реакції ("реакція Соногашири") зазвичай здійснюють в присутності системи каталізаторів паладій-мідь та основи. Декілька прикладів цієї реакції описані в літературі [дивитись, наприклад, R. Chinchilla and C. Nájera, Chem. Rev. 2007, 107, 874-922]. У даному винаході, бажаним джерелом міді є йодид міді(I), тетракіс(трифенілфосфін)паладію(0), використовують як каталізатор паладію, та піролідин слугує як основою, так і розчинником. Реакцію конденсації переважно здійснюють при супутньому мікрохвильовому опроміненні. Одержаний алкін (VIII) потім піддають каталітичному гідруванню, застосовуючи звичайний каталізатор паладію або платини. Бажано, оксид платини (IV) використовують як каталізатор, та реакція проходить у оцтовій кислоті як розчиннику. В деяких випадках, суміш продуктів (IX) та (X) одержують за цією методикою, яка, у будь-якому випадку, може бути розділена за способами хроматографії. Наступну реакцію бромування здійснюють, бажано використовуючи 1,3-дибром-5,5-диметилгідантоїн як джерело брому, у інертному розчиннику, такому як TГФ або ДMФ, з одержанням потрібних піролотриазинів (IIa) та (IIb), відповідно. Одержання вихідної сполуки 7-бромпіроло[2,1-f][1,2,4]триазин-4-аміну (VI) було описано раніше [дивитись WO 2007/056170-A2 (проміжна сполука B)]. 9 UA 110724 C2 Схема 2 5 10 15 20 Попередники бромпіролотриазинів типу (IIc) (схема 3) можуть бути одержані шляхом металювання сполуки (VI) металом, таким як магній або літій, або шляхом заміни галогенметал, використовуючи органо-магній або органо-літій реагент. Бажаним металом є магній, який вводять у сполуку (VI) шляхом обробки ізопропілмагній бромідом у розчиннику, такому як TГФ або дiетиловий етер. Органо-металеві проміжні сполуки потім піддають реагуванню з циклоалканоном або гетерoциклоалканоном (XI) [R,R' зв'язані разом з утворенням циклоалкільного або гетероциклоалкільного кільця] з одержанням третинного спирту (XIIa). Додатковий шлях, що приводить до одержання вторинних спиртів формули (XIIb), використовує реакцію формілування Вілсмаєра, внаслідок чого амінопіролотриазин (XIII) перетворюється на альдегід (XIV) (схема 3). Введення бокового ланцюгу здійснюється наступним додаванням відповідного реагенту Грігнарда (XV) [R'' = алкіл або циклоалкіл] у розчиннику, такому як TГФ або дiетиловий етер. Наприкінці, бромування сполук (XIIa) та (XIIb) здійснюють бажано, використовуючи 1,3-дибром-5,5-диметилгідантоїн, у інертному розчиннику, такому як TГФ або ДMФ, з одержанням бажаних піролотриазинів (IIc) та (IId), відповідно. Одержання вихідної сполуки піроло[2,1-f][1,2,4]триазин-4-аміну (XIII) було описано раніше [дивитись WO 2007/056170-A2 (проміжна сполука A)]. 10 UA 110724 C2 Схема 3 5 10 15 Піролотриазини формули (II), де Z означає незаміщений циклоалкіл або вуглецьприєднаний аза-гетероцикліл, можуть бути одержані дегідруванням третинного спирту формули (XIIc) до ненасиченого карбо- або гетероциклу формули (XVI), застосовуючи звичайні агенти, такі як ангідрид трифтороцтової кислоти, ангідрид трифторметансульфонової кислоти, оксид фосфору(V), сірчана кислота або інші сильні кислоти (схема 4). Наступне каталітичне гідрування здійснюють, використовуючи звичайний каталізатор, такий як паладій на вугіллі, з одержанням насиченого аналога формули (XVII). Стадію гідрування бажано здійснюють у розчиннику, такому як метанол, етанол або THF, які містять невелику кількість водної трифтороцтової кислоти. Наприкінці, бромування з 1,3-дибром-5,5-диметилгідантоїном, як описано вище, забезпечує одержання бажаного піролотриазину (IIe). Попередники спирту (XIIc) самі по собі легко одержати шляхом синтезу, зображеного на схемі 3 [посилання, одержання сполуки (XIIa)]. 11 UA 110724 C2 Схема 4 5 10 Піролотриазини формули (II) де Z означає 1,3-тіазол-4-іл, можуть бути одержані металюванням сполуки (VI), як описано вище, після чого реагування з хлорацетил хлоридом з одержанням проміжної сполуки (XVIII), та після чого конденсуванням з тіоамідом або 4 тіосечовиною (XIX) [з R як визначено вище] з одержанням попередника сполуки (XX) (схема 5). Бромування з 1,3-дибром-5,5-диметилгідантоїном, як описано вище, наприкінці забезпечує бажаним піролотриазином (IIf). 12 UA 110724 C2 Схема 5 5 Піролотриазини формули (II), де Z означає N-циклічний аміном етил, можуть бути одержані реагуванням піролотриазину (XIII) з формальдегідом та циклічним аміном типу (XXI) у кислотному розчиннику, такому як оцтова кислота, або у суміші кислоти з органічним розчинником (схема 6). Бромування одержаного продукту (XXII) з 1,3-дибром-5,5диметилгідантоїном, як описано вище, потім забезпечує бажаним піролотриазином (IIg). Схема 6 10 13 UA 110724 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки формул (V), (VII), (XI), (XV), (XIX) та (XXI) є або наявними на ринку, відомими з літератури, або можуть бути одержані з наявних вихідних матеріалів шляхом адаптації стандартних способів, описаних в літературі. Сполуки даного винаходу мають цінні фармакологічні властивості та можуть бути використані для профілактики та лікування захворювань у людини та тварин. Сполуки даного винаходу є сильними та селективними інгібіторами ALK1 кінази. Тому, вони можуть бути використані для лікування та/або профілактики ангіогенез-опосередкованих розладів, зокрема, ангіогенез-опосередкованих розладів очей. Для даного винаходу, термін "лікування" включає інгібування, затримку, полегшення, пом'якшення, призупинення, зменшення або викликання регресії захворювання, розладу, стану, їх розвитку та/або прогресу, та/або їх симптомів. Термін "профілактика" включає зменшення ризику набуття, зараження або перебігу захворювання, розладу, стану, їх розвитку та/або прогресу, та/або їх симптомів. Термін профілактика включає профілактику. Лікування або профілактика захворювання, розладу, стану може бути частковим або повним. Ангіогенез-пов'язані очні розлади, що можна лікувати та/або запобігати сполуками даного винаходу включають, проте не обмежуються наступними: вік-опосередкована макулярна дистрофія (AMD), діабетична ретинопатія, зокрема, діабетичний макулярний набряк (DME), інші ретинопатії, такі як хоріоїдальна неоваскуляризація (CNV), хоріоїдальна неоваскулярна мембрана (CNVM), кістозний макулярний набряк (CME), епі-ретинальна мембрана (ERM) та розрив сітківки, гіпертрофічні зміни пігментного епітелію сітківки (RПE), атрофічні зімни пігментного епітелію сітківки, відшарування сітківки, хоріоїдальна закупорка вен, закупорка вен сітківки, корнеальний ангіогенез після, наприклад, кератиту, трансплантації роговиці або кератопластики, корнеальний ангіогенез внаслідок гіпоксії (наприклад, викликаний надмірним вживанням контактних лінз), крилоподібна плева кон'юнктиви, субретинальний набряк та інтраретинальний набряк. В контексті даного винаходу, термін вік-опосередкована макулярна дистрофія (AMD) включає як вологі (або ексудативні, неоваскулярні), так і сухі (або не-ексудативні, ненеоваскулярні) прояви AMD. Сполуки даного винаходу також можуть бути використані для лікування та/або профілактики запальних захворювань, пов'язаних з ангіогенезом, таких як ревматоїдний артрит, псоріаз, контактний дерматит, астма, легенева гіпертензія, розсіяний склероз, та запальних захворювань травного тракту, таких як хвороба Крона. Фіброзні захворювання, такі як фіброз та цироз, також можуть лікуватись та/або їм можна запобігти сполуками даного винаходу. На основі їх активного профілю, сполуки даного винаходу є особливо придатними для лікування та/або профілактики очних розладів, такі як вік-опосередкована макулярна дистрофія (AMD), хоріоїдальна неоваскуляризація (CNV), діабетична ретинопатія, та діабетичний макулярний набряк (DME). Вищезгадані розлади були охарактеризовані у людей, проте також існують із подібною етіологією у інших тварин, включаючи ссавців, та можуть лікуватись цими сполуками даного винаходу. Таким чином, даний винахід також стосується застосування сполук винаходу для лікування та/або профілактики розладів, особливо вищезгаданих розладів. Даний винахід також стосується застосування сполук винаходу для одержання фармацевтичної композиції для лікування та/або профілактики розладів, особливо вищезгаданих розладів. Даний винахід також стосується застосування сполук винаходу у способі лікування та/або профілактики розладів, особливо вищезгаданих розладів. Даний винахід також стосується способу для лікування та/або профілактики розладів, особливо вищезгаданих розладів, шляхом використання ефективної кількості щонайменше однієї сполуки винаходу. Сполуки даного винаходу можуть бути введені як окремий фармацевтичний агент або комбінація одного або кількох терапевтичних агентів, де комбінація не викликає шкідливих побічних ефектів. Така комбінаційні терапія включає введення окремої фармацевтичної дозованої форми, яка містить сполуку формули (I), як визначено вище, та один або кілька додаткових терапевтичних агентів, а також введення сполуки формули (I) та кожного додаткового терапевтичного агента у окремій власній фармацевтичній дозованій формі. Наприклад, сполука формули (I) та терапевтичний агент можуть бути введені пацієнту разом у окремій оральній дозованій композиції, такій як таблетка або капсула, або кожен агент може бути введений у окремій дозованій формі. Коли використовують окремі дозовані форми, сполука формули (I) та один або кілька 14 UA 110724 C2 5 10 15 20 25 30 35 40 45 50 55 60 додаткових терапевтичних агентів можуть бути введені по суті одночасно (тобто, одночасно) або окремо поступово (тобто, послідовно). Зокрема, сполуки даного винаходу можуть бути використані у фіксованій або окремій комбінації з інгібіторами VEGF-опосередкованого ангіогенезу, такими як, наприклад, ACTB-1003, афліберцепт, апатиніб, акситиніб, бевацизумаб, бевасираніб, BMС-690514, бриваніб, цедираніб, CT-322, довітиніб, E7080, форетиніб, KH-902, лініфаніб, MGCD-265, мотезаніб, OTS-102, пазопаніб, пегаптаніб, ранібізумаб, регорафеніб, рубоксистаурин, сорафеніб, SU-14813, сунітиніб, телатиніб, TG-100801, тивозаніб, TSU-68, вандетаніб, варгатеф, ваталаніб та XL-184, або з інгібіторами інших сигнальних шляхів, такими як, наприклад, ACU-4429, дисульфірам, E10030, фенретинід, мекаміламін, PF-04523655, сиролімус, сонепцизумаб, тандоспірон та волоциксимаб. Таким чином, у подальшому варіанті втілення, даний винахід стосується фармацевтичних композицій, що містять щонайменше одну з сполук винаходу та один або кілька додаткових терапевтичних агентів для лікування та/або профілактики розладів, особливо вищезгаданих розладів. Сполуки даного винаходу також можуть використовуватись як такі або в композиціях, в дослідженнях або діагностиці, або як аналітичні порівнювальні стандарти тощо. У іншому аспекті, даний винахід стосується фармацевтичнихкомпозицій, що містять щонайменше одну з сполук винаходу разом з одним або кількома інертними, нетоксичними, фармацевтично прийнятними ексціпієнтами, та їх застосування з вищенаведеною метою. Сполуки винаходу можуть діяти системно та/або локально. З цією метою, їх можна вводити придатним чином, таким як, наприклад, орально, парентерально, легенево, назально, лінгвально, сублінгвально, букально, ректально, дермально, трансдермально, в кон'юнктиву, під кон'юнктиву, інтравітреально, у вухо або місцево. Сполуки винаходу можуть бути введені у формах нанесення, придатних для цих шляхів введення. Придатними для орального введення є форми нанесення, які функціонують згідно попереднього рівня техніки та доставляють сполуки винаходу швидко та/або модифіковано, та що містять сполуки винаходу у кристалічній, аморфній та/або розчиненій формі, такій як, наприклад, таблетки (таблетки з покриттям або без, наприклад, з кишковим покриттям або покриттями, що є нерозчинними або розчиняються із затримкою та контролюють вивільнення сполуки винаходу), таблетки, що швидко розкладаються у ротовій порожнині, або плівки/пластини, плівки/ліофілізати, капсули (наприклад, тверді або м'які желатинові капсули), таблетки з цукровим покриттям, гранули, пелети, порошки, емульсії, суспензії, аерозолі або розчини. Парентеральне введення може здійснюватись без стадії абсорбції (наприклад, внутрішньовенно, інтрартеріально, інтракардіально, інтраспінально або інтралюмбарно) або з включенням абсорбції (наприклад, внутрішньом'язово, підшкірно, внутрішньошкірно, чрезшкірно або інтраперітонеально). Форми застосування, придатні для парентерального введення, включають, серед інших, форми для ін'єкцій та інфузій у формі розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків. Форми, придатні для інших шляхів введення, включають, наприклад, фармацевтичні форми для інгаляції (наприклад, порошкові інгалятори, розпилювачі), назальні краплі, розчини або спреї, таблетки або капсули для лінгвального, сублінгвального або букального введення (наприклад, пастилки, лозенждери), супозиторії, очні або вушні препаративні форми (наприклад, краплі, мазі), вагінальні капсули, водні суспензії (лосьйони, змішувані суміші), ліпофільні суспензії, мазі, крема, молочко, пасти, піни, пилоподібні порошки, та трансдермальні терапевтичні системи (наприклад, пластирі). Сполуки винаходу можуть бути перетворені на перелічені форми застосування відомими чином, шляхом змішування з інертними, нетоксичними, фармацевтично прийнятними ексціпієнтами. Ці ексціпієнти включають, серед інших, носії (наприклад, мікрокристалічна целюлоза, лактоза, манітол), розчинники (наприклад, рідкі поліетилeнгліколі), емульгатори (наприклад, додецилсульфат натрію), поверхнево-активні речовини (наприклад, поліоксисорбітан олеат), дисперсанти (наприклад, полівінілпіролідон), штучні та природні полімери (наприклад, альбумін), стабілізатори (наприклад, антиоксиданти, такі як, наприклад, аскорбінова кислота), барвники (наприклад, неорганічні пігменти, такі як, наприклад, оксиди заліза), та смакові добавки та/або агенти маскування запаху. Зазвичай бажано вводити при парентеральному введенні кількість від приблизно 0,001 дo 1 мг/кг, бажано приблизно 0,01-0,5 мг/кг маси тіла для досягнення ефективних результатів. При оральному введенні, приклад діапазону доз становить приблизно 0,01-100 мг/кг, бажано 15 UA 110724 C2 5 10 15 20 25 30 35 40 приблизно 0,01-20 мг/кг, та більш бажано приблизно 0,1-10 мг/кг маси тіла. Тим не менш, актуальні рівні доз та період дії введених активних інгредієнтів в фармацевтичних композиціях винаходу можуть різнитись так, щоб отримати кількість активного інгредієнта, що є ефективною для досягнення бажаної терапевтичної відповіді для певного пацієнта, композиція та шлях введення, що є нетоксичними для пацієнта. Тому може бути необхідним відхилитись від вказаних кількостей, зокрема, з поправкою на вік, стать, масу тіла, раціон харчування та загальний стан здоров'я пацієнта, шлях введення, індивідуальну відповідь на активний інгредієнт, природу препаративної форми, та час або інтервал протягом якого триває введення. Таким чином, в деяких випадках може бути бажаним використати менше, ніж вищенаведену мінімальну кількість, у той час як в інших випадках вказаний вищий ліміт може бути перевищеним. У випадку введення більшої кількості може бути бажаним поділити її на багато окремих доз розподілених продовж доби. Для лікування та/або профілактики очних розладів, як описано вище, бажаним шляхом введення сполук винаходу є місцево у око або за допомогою очної системи доставки лікарського засобу. Внутрішньо очні ін'єкції є іншим шляхом введення сполуки даного винаходу, придатним для таких цілей. Доставка до ділянок всередині ока здійснюється шляхом ін'єкції, застосовуючи канюлю або інший інвазивний пристрій, розроблений для введення чітко визначеної кількості бажаної композиції у певну ділянку або тканину всередині ока (наприклад, задня камера або сітківка). Внутрішньо очна ін'єкція може вводитись у склоподібне тіло (інтравітреально), під кон'юнктиву (під кон'юнктиву), позаду ока (ретробульбарно), у склеру, або під тенонову капсулу (суб-тенон), та може знаходитись у формі депо. Інші внутрішньо очні шляхи введення та місця ін'єкцій та форми маються на увазі та включені у рамки винаходу. Сполуки винаходу можуть бути формульовані відомим фахівцю у галузі чином, так щоб забезпечити потрібну доставку у задню частину ока, за допомогою звичайного дозування, такого як очні краплі, або використовуючи систему доставки щоб забезпечити контрольоване вивільнення, таке як уповільнене вивільнення сполук винаходу. Бажані очні композиції сполук даного винаходу включають водні розчини, суспензії або гелі цих сполук у формі крапель рідини, рідких промивань, спреїв, мазей або гелей, у домішках з екціпієнтами, придатними для виробництва та застосування таких форм введення. Альтернативно, сполуки даного винаходу можуть бути введені у око за допомогою ліпосом або інших очних систем доставки, відомих у галузі. Відповідні рівні доз можна визначити будь-яким придатним способом, відомим фахівцю у галузі лікування очних хвороб. Бажано, активну сполуку вводять з частотою 1-4 рази на добу для місцевого введення, або не так часто, якщо використовують систему доставки лікарського засобу. Зазвичай, очна композиція для місцевого застосування містить активний інгредієнт в діапазоні концентрацій приблизно 0,001 % - 10 %. Наступні приклади варіантів втілення ілюструють винахід. Винахід не є обмеженим прикладами. Проценти в наступних тестах та прикладах є, доки не вказано протилежне, масовими; частини є масовими. Співвідношення розчинів, розведень та концентрацій, вказаних для розчинів рідина/рідина, всі є об'ємними. A. Приклади Скорочення та акроніми: 45 16 UA 110724 C2 Ac вод. Boc ш. Cbz Celite® конц. ПХІ ДХМ ДMФ ДMСO e.н. EI ent екв. EСI Et EtOAc Fmoc ГХ/MС год. Гал 1 H ЯМР ВЕРХ РХ/MС Me MeOH Хв. MС теор. PdCl2(dppf) Ph Рац. Rf к.т. Rt насич. TБAФ tBu трет TФК TФКA TГФ TШХ 5 10 ацетил водний (розчин) трет-бутоксикарбоніл 1 широкий ( H ЯМР сигнал) бензилоксикарбоніл Зареєстрована торгівельна марка корпорації Celite, бренд діатомової землі концентрований пряма хімічна іонізація (MС) дихлорметан N,N-диметилформамід диметилсульфоксид енантіомерний надлишок іонізація електронним ударом (MС) енантіомер, енантіомерно чистий еквівалент(и) електро-спрей іонізація (MС) етил етилацетат (9H-флуорен-9-ілметокси)карбоніл газова хроматографія-спарена з мас-спектрометрією годин(и) галоген спектроскопія ядерно-магнітного резонансу високоефективна рідинна хроматографія рідинна хроматографія-спарена з мас-спектрометрією метил метанол хвилин(и) мас-спектроскопія теоретичне (хімічний вихід) [1,1'-біс(дифенілфосфіно)фероцен]дихлорпаладію(II) феніл рацемічна, рацемат TШХ фактор утримання кімнатна температура час утримання (ВЕРХ) насичений тетрaбутиламонію фторид трет-бутил третинний трифтороцтова кислота ангідрид трифтороцтової кислоти тетрагідрофуран тонко-шарова хроматографія Способи очистки препаративної ВЕРХ: Спосіб 1: Пристрій: Gilson Abimed ВЕРХ, бінарна насосна система; колонка: ReproSil C18, 250 мм 30 мм; елюент A: вода / 1 % аміак, елюент B: ацетонітрил; градієнт: 0-3 хв. 10 % B, 5,01-31 хв. 95 % B, 31 хв. 95 % B; швидкість потоку: 50 мл/хв.; УФ виявлення: 210 нм. Спосіб 2: Пристрій: Gilson Abimed ВЕРХ, бінарна насосна система; колонка: Kromasil-100A C18, 5 мкм, 250 мм 30 мм; елюент A: вода / 0,05-0,5 % TФК, елюент B: ацетонітрил; градієнт: 0-5 хв. 5 % B, 5,01-10 хв. 10 % B, 10,01-20 хв. 40 % B, 20,01-27 хв. 50 % B, 27,01-40 хв. 60 % B, 40,01-45 хв. 90 % B, 45,01-60 хв. 100 % B; швидкість потоку: 15-60 мл/хв.; УФ виявлення: 210 нм. Спосіб 3: Пристрій: Gilson Abimed ВЕРХ, бінарна насосна система; колонка: Grom-Sil-120 ODS-4HE, 17 UA 110724 C2 5 10 15 20 25 30 35 40 45 50 55 250 мм 30 мм; елюент A: вода, елюент B: ацетонітрил; градієнт: 0-3 хв. 10 % B, 3,01-35 хв. 98 % B, 35,01-40 хв. 98 % B; швидкість потоку: 50 мл/хв.; УФ виявлення: 210 нм. Спосіб 4: Пристрій: Gilson Abimed ВЕРХ, бінарна насосна система; колонка: Grom-Sil-120 ODS-4HE, 250 мм 30 мм; елюент A: вода / 0,5 % аміак, елюент B: ацетонітрил; градієнт: 0-3 хв. 10 % B, 3,01-35 хв. 98 % B, 35,01-40 хв. 98 % B; швидкість потоку: 50 мл/хв.; УФ виявлення: 210 нм. Спосіб 5: Пристрій: Gilson Abimed ВЕРХ, бінарна насосна система; колонка: Chromatorex C18 10 мкм, 250 мм 30 мм; елюент A: вода, елюент B: ацетонітрил; градієнт: 0-3 хв. 10 % B, 5,01-31 хв. 90 % B, 31 хв. 90 % B; швидкість потоку: 50 мл/хв.; УФ виявлення: 210 нм. Спосіб 6: Пристрій: Gilson Abimed ВЕРХ, бінарна насосна система; колонка: Chromatorex C18 10 мкм, 250 мм 30 мм; елюент A: вода / 0,5 % TФК, елюент B: ацетонітрил; градієнт: 0-3 хв. 10 % B, 5,01-31 хв. 90 % B, 31 хв. 90 % B; швидкість потоку: 50 мл/хв.; УФ виявлення: 210 нм. Спосіб 7: Пристрій: Gilson Abimed ВЕРХ, бінарна насосна система; колонка: ReproSil C18 10 мкм, 250 мм 40 мм; елюент A: вода, елюент B: ацетонітрил; градієнт: 0-3 хв. 10 % B, 5,01-31 хв. 95 % B, 31 хв. 95 % B; швидкість потоку: 50 мл/хв.; УФ виявлення: 210 нм. Спосіб 8: Пристрій: Gilson Abimed ВЕРХ, бінарна насосна система; колонка: ReproSil C18 10 мкм, 250 мм 30 мм; елюент A: вода, елюент B: ацетонітрил; градієнт: 0-3 хв. 10 % B, 5,01-31 хв. 95 % B, 31 хв. 95 % B; швидкість потоку: 50 мл/хв.; УФ виявлення: 210 нм. Спосіб 9: Пристрій: Gilson Abimed ВЕРХ, бінарна насосна система; колонка: Waters Sunfire C18 5 мкм, 250 мм 20 мм; елюент A: вода, елюент B: ацетонітрил; градієнт: 0 хв. 20 % B, 15 хв. 60 % B, 15,01-19 хв. 20 % B; швидкість потоку: 25 мл/хв.; УФ виявлення: 210 нм. Способи аналітичної ВЕРХ, РХ/MС та ГХ/MС: Спосіб 1 (ВЕРХ): Інструмент: Agilent 1100 з виявленням DAD; колонка: Agilent Zorbax Eclipse XDB-C8 4,6, 150 мм 5 мм; елюент A: 0,01 % TФК у воді, елюент B: 0,01 % TФК у ацетонітрилі; градієнт: 0-1 хв. 10 % B, 4-5 хв. 90 % B, 5,5 хв. 10 % B; швидкість потоку: 2,0 мл/хв.; температура: 30 °C; УФ виявлення: 210 нм. Спосіб 2 (ВЕРХ): Інструмент: HP 1100 з виявленням DAD; колонка: Kromasil 100 RP-18, 60 мм 2,1 мм, 3,5 мкм; елюент A: 5 мл (пер)хлорної кислоти (70 %) / л води, елюент B: ацетонітрил; градієнт: 0 хв. 2 % B, 0,5 хв. 2 % B, 4,5 хв. 90 % B, 6,5 хв. 90 % B, 6,7 хв. 2 % B, 7,5 хв. 2 % B; швидкість потоку: 0,75 мл/хв.; температура: 30 °C; УФ виявлення: 210 нм. Спосіб 3 (ВЕРХ): Інструмент: HP 1100 з виявленням DAD; колонка: Kromasil 100 RP-18, 60 мм 2,1 мм, 3,5 мкм; елюент A: 5 мл (пер)хлорної кислоти (70 %) / л води, елюент B: ацетонітрил; градієнт: 0 хв. 2 % B, 0,5 хв. 2 % B, 4,5 хв. 90 % B, 9 хв. 90 % B, 9,2 хв. 2 % B, 10 хв. 2 % B; швидкість потоку: 0,75 мл/хв.; температура: 30 °C; УФ виявлення: 210 нм. Спосіб 4 (РХ/MС): Інструмент: Micromass Platform LCZ з ВЕРХ Agilent 1100 Series; колонка: Thermo Hypersil GOLD 3µ, 20 мм 4 мм; елюент A: 1 л води + 0,5 мл 50 % мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50 % мурашиної кислоти; градієнт: 0,0 хв. 100 % A 0,2 хв. 100 % A 2,9 хв. 30 % A 3,1 хв. 10 % A 5,5 хв. 10 % A; температура: 50 °C; швидкість потоку: 0,8 мл/хв.; УФ виявлення: 210 нм. Спосіб 5 (РХ/MС): Інструмент: Micromass ZQ з ВЕРХ Waters Alliance 2795 / HP 1100; колонка: Phenomenex Synergi 2,5µ MAX-RP 100A Mercury, 20 мм 4 мм; елюент A: 1 л води + 0,5 мл 50 % мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50 % мурашиної кислоти; градієнт: 0,0 хв. 90 % A 2,5 хв. 30 % A 3,0 хв. 5 % A 4,0 хв. 5 % A; швидкість потоку: 2 мл/хв.; температура: 50 °C; УФ виявлення: 210 нм. Спосіб 6 (РХ/MС): Інструмент: Micromass Quattro Premier з Waters UPLC Acquity; колонка: Thermo Hypersil GOLD 1,9µ, 50 мм 1 мм; елюент A: 1 л води + 0,5 мл 50 % мурашиної кислоти, елюент B: 1 л ацетонітрил + 0,5 мл 50 % мурашиної кислоти; градієнт: 0,0 хв. 90 % A 0,1 хв. 90 % A 1,5 хв. 10 % A 2,2 хв. 10 % A; температура: 50 °C; швидкість потоку: 0,33 мл/хв.; УФ виявлення: 18 UA 110724 C2 5 10 15 20 210 нм. Спосіб 7 (РХ/MС): Інструмент: Micromass ZQ з ВЕРХ Waters Alliance 2795; колонка: Phenomenex Synergi 2,5µ MAX-RP 100A Mercury, 20 мм 4 мм; елюент A: 1 л води + 0,5 мл 50 % мурашиної кислоти, елюент B: 1 л ацетонітрил + 0,5 мл 50 % мурашиної кислоти; градієнт: 0,0 хв. 90 % A 0,1 хв. 90 % A 3,0 хв. 5 % A 4,0 хв. 5 % A 4,01 хв. 90 % A; швидкість потоку: 2 мл/хв.; температура: 50 °C; УФ виявлення: 210 нм. Спосіб 8 (ГХ/MС): Інструмент: Micromass GCT, GC6890; колонка: Restek RTX-35, 15 м 200 мкм 0,33 мкм; постійний потік з гелієм: 0,88 мл/хв.; пічка: 70 °C; впорск: 250 °C; градієнт: 70 °C, 30 °C/хв. 310 °C (тримають протягом 3 хв.). Спосіб 9 (ВЕРХ): Інструмент: Agilent 1100 з виявленням DAD; колонка: Merck Chromolith Speed ROD, 150 мм 5 мм; елюент A: 0,01 % мурашина кислота у воді, елюент B: ацетонітрил; градієнт: 0 хв. 5 % B, 2,5 хв. 95 % B, 3 хв. 95 % B; швидкість потоку: 5,0 мл/хв.; температура: 40 °C; УФ виявлення: 210 нм. Спосіб 10 (РХ/MС): Інструмент: Waters Acquity SQD UPLC System; колонка: Waters Acquity UPLC HSS T3 1,8µ, 50 мм 1 мм; елюент A: 1 л води + 0,25 мл 99 % мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,25 мл 99 % мурашиної кислоти; градієнт: 0,0 хв. 90 % A 1,2 хв. 5 % A 2,0 хв. 5 % A; температура: 50 °C; швидкість потоку: 0,40 мл/хв.; УФ виявлення: 208-400 нм. Загальний спосіб синтезу 1: Конденсація Сузукі похідних 5-бромпіроло[2,1-f][1,2,4]триазину з арилбороновими кислотами або естерами: 25 30 35 5-бромпіроло[2,1-f][1,2,4]триазин A (приблизно 0,5 ммоль), арилборонову кислоту B (1,2 еквіваленти) або відповідний бороновий естер, наприклад, диметил боронат або пінаколато боронат, та тетракіс(трифенілфосфін)паладію(0) (0,1 еквіваленти) розчиняли у суміші 1,4діоксану (приблизно 4,0 мл) та 2 M водного розчину карбонату натрію (1,5 мл) у реакційній колбі для мікрохвильової пічки. Реакційну колбу закривали ізолюючою кришкою, та суміш нагрівали до 140 °C протягом годиниу одномодовій мікрохвильовій пічці. Після охолодження, реакційну суміш фільтрували крізь шар селіту, який промивали 1,4-діоксаном для вимивання всіх органічних речовин. Об'єднаний фільтрат випаровували до сухого залишку при пониженому тиску, та залишок очищали препаративною ВЕРХ з одержанням потрібної сполуки C. Загальний спосіб синтезу 2: Борилювання арилбромидів та наступна конденсація Сузукі з похідними 5-бромпіроло[2,1f][1,2,4]триазину без виділення проміжної арилборонової кислоти або естеру: 40 19 UA 110724 C2 5 10 15 Арилбромід D (приблизно 0,5 ммоль) розчиняли у ДMФ (3 мл) у реакційній колбі для мікрохвильової пічки, аргон барботували крізь розчин протягом 5 хв., та додавали комплекс [1,1'-біс(дифенілфосфіно)фероцен]дихлорпаладію(II)-дихлорметан (0,1 еквіваленти), ацетат калію (3 еквіваленти) та біс(пінаколато)дибор (1,2 еквіваленти). Колбу закривали ізолюючою кришкою, та суміш нагрівали до 130 °C протягом 60 хв. у одномодовій мікрохвильовій пічці. Потім, суспензію фільтрували, фільтрат переносили у іншу колбу для мікрохвильової пічки, та додавали тетракіс(трифенілфосфін)паладію(0) (0,1 еквіваленти), 2 M водний розчин карбонату натрію (4 еквіваленти) та 5-бромпіроло[2,1-f][1,2,4]триазин A (1 еквівалент). Колбу закривали ізолюючою кришкою, та суміш нагрівали до 140 °C протягом години у одномодовій мікрохвильовій пічці. Неочищену реакційну суміш одержану таким чином безпосередньо ін'єктували у колонку для препаративної ВЕРХ для розділення та очистки потрібної сполуки C. Вихідні матеріали та проміжні сполуки: Проміжна сполука 1A [2,6-Дифтор-4-(4,4,5,5-тетрaметил-1,3,2-діоксаборолан-2-іл)феніл]метанол OH F F B O H 3C 20 25 30 O CH 3 CH CH 3 3 (4-Бром-2,6-дифторфеніл)метанол (1,03 г, 4,62 ммоль) розчиняли у сухому 1,4-діоксані (10 мл). Аргон барботували крізь розчин, потім додавали комплекс [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладію-дихлорметан (302 мг, 0,37 ммоль, 0,08 екв.), безводний ацетат калію (907 мг, 9,24 ммоль, 2 екв.) та біс(пінаколато)дибор (1,23 г, 4,85 ммоль, 1,05 екв.), та суміш нагрівали до 130 °C протягом години у одномодовій мікрохвильовій пічці. Під час охолодження, суміш фільтрували, та розчинник видаляли при пониженому тиску. Циклогексан (200 мл) додавали до залишку, та суміш ретельно перемішували протягом 30 хв. Нерозчинений матеріал потім видаляли фільтруванням, циклогексан відганяли, та залишок очищали флеш-хроматографією на силікагелі (дихлорметан/ацетонітрил градієнт). Фракції, що містили продукт, об'єднували та випаровували. Зазначену у заголовку сполуку кристалізували спонтанно у вигляді коричневатої твердої речовини. Вихід: 790 мг (63 % теор.). + GC-MС (спосіб 8): Rt=5,36 хв.; MС (EI): m/z (%) = 270,3 (15) [M] . Проміжна сполука 2A [3,5-Дифтор-4-(гідроксиметил)феніл]боронова кислота 20 UA 110724 C2 OH F F B OH HO 5 10 [4-({[трет-Бутил(диметил)силіл]oкси}метил)-3,5-дифторфеніл]боронова кислота (19,3 г, 63,9 ммоль; неочищений матеріал, одержаний за способом Hattori, Bioorg. Med. Chem. 2006, 14, 3258-3262) розчиняли у 400 мл водної оцтової кислоти (66 %) та перемішували при 40 °C протягом 5 год. Розчин потім випаровували при пониженому тиску, та залишок очищали флешхроматографією на силікагелі (градієнт елюювання 0-2 % метанол у дихлорметані) з одержанням 3,46 г (25 % теор., РХ-MС чистота 87 %) вказаної у заголовку сполуки. + РХ-MС (спосіб 7): Rt=0,50 хв.; MС (EСIpos): m/z (%) = 171,2 (100) [M-OH] , MС (EСIneg): m/z (%) = 187,3 (100) [M-H] . Проміжна сполука 3A (4-Бром-2-хлорфеніл)метанол OH Cl Br 15 Зазначену у заголовку сполуку одержували за процедурою, описаною у WO 2004/074270-A2 [Приклад A(147), стадія 1]. 1 H ЯМР (400 MГц, CDCl3): δ (млн.ч.) = 2,00 (ш, 1H), 4,74 (с, 2H), 7,38 (д, 1H), 7,43 (дд, 1H), 7,53 (д, 1H). Проміжна сполука 4A (4-Бром-2-метилфеніл)метанол OH CH 3 Br 20 25 Зазначену у заголовку сполуку одержували за процедурою, описаною у EP 1 544 208-A1 (Порівняльний Приклад 14). 1 H ЯМР (400 MГц, CDCl3): δ (млн.ч.) = 1,62 (т, 3H), 2,32 (с, 3H), 4,64 (д, 2H), 7,23 (д, 1H), 7,32 (с, 1H), 7,33 (д, 1H). Проміжна сполука 5A (5-Бромпіридин-2-іл)метанол OH N Br 21 UA 110724 C2 5 Mетил 5-бромпіридин-2-карбоксилат (2,00 г, 9,27 ммоль) розчиняли у етанолі (20,0 мл). Боргідрид натрію (1,05 г, 27,8 ммоль) додавали при 0 °C, та суміш перемішували при кімнатній температурі протягом 18 год. Потім суміш концентрували при пониженому тиску, гасили 1 N хлорводневою кислотою, нейтралізували твердим карбонатом калію та екстрагували дихлорметаном. Органічний шар висушували над сульфатом магнію та випаровували з одержанням 1,57 г (90 % теор.) вказаної у заголовку сполуки. + РХ-MС (спосіб 6): Rt=0,56 хв.; MС (EСIpos): m/z (%) = 188,0 (100) [M+H] . Проміжна сполука 6A [6-(Гідроксиметил)піридин-3-іл]боронова кислота OH N B 10 15 20 OH HO До розчину проміжної сполуки 5A (1,50 г, 7,98 ммоль) та біс(пінаколато)дибору (2,23 г, 8,28 ммоль) у дегазованому ДMФ (120 мл) додавали в атмосфері аргону 1,1'біс(дифенілфосфіно)фероцен-паладію(II) хлорид (292 мг, 0,40 ммоль) та ацетат калію (2,35 г, 23,9 ммоль). Суміш нагрівали до 80 °C протягом 18 год. та потім охолоджували дo кімнатної температури. Суспензію фільтрували, та залишок промивали діоксаном. Об'єднані фільтрати концентрували при пониженому тиску, та олійний залишок відбирали у 50 мл етилацетату та 50 мл циклогексану, та залишали відстоюватись при кімнатній температурі протягом ночі. Одержаний осад збирали фільтруванням та викидали. Фільтрат випаровували, та залишок знову розчиняли у 100 мл етилацетату та двічі екстрагували з 50 мл води. Водний шар концентрували з одержанням 690 мг (56 % теор.) вказаної у заголовку сполуки, яку використовували без подальшої очистки. + РХ-MС (спосіб 6): Rt=0,18 хв.; MС (EСIpos): m/z (%) = 154,0 (100) [M+H] . Проміжна сполука 7A 3-(4-Амінопіроло[2,1-f][1,2,4]триазин-7-іл)проп-2-ін-1-oл NH 2 N N 25 30 35 40 N HO Вихідний матеріал 7-бромпіроло[2,1-f][1,2,4]триазин-4-аміну синтезували за процедурою, описаною у WO 2007/056170-A2 (Проміжна сполука B). 7-Бромпіроло[2,1-f][1,2,4]триазин-4-амін (1,0 г, 4,69 ммоль), йодид міді(I) (89 мг, 0,47 ммоль, 0,1 екв.) та тетракіс(трифенілфосфін)паладію(0) (542 мг, 0,47 ммоль, 0,1 екв.) завантажували у реакційну колбу для мікрохвильової пічки та вакуумували протягом години. Колбу потім вентилювали аргоном, додавали піролідин (15 мл) та 2-пропін-1-oл (2,63 г, 47 ммоль, 10 екв.), та колбу закривали ізолюючою кришкою та нагрівали до 85 °C протягом 120 хв. у одномодовій мікрохвильовій пічці. Після охолодження, реакційну суміш виливали у 120 мл концентрованого водного розчину хлориду амонію, який двічі екстрагували з етилацетатом. Об'єднані органічні шари висушували над безводним сульфатом натрію та випаровували, та залишок очищали флеш-хроматографією (Biotage silica колонка, етил ацетат). Одержаний продукт (222 мг) вичавлений чистим за допомогою РХ-MС (спосіб 6) та використовували для подальших трансформацій. ВЕРХ (спосіб 2): Rt=2,59 хв.; + РХ-MС (спосіб 6): Rt=0,28 хв.; MС (EСIpos): m/z (%) = 189,2 (100) [M+H] . 22 UA 110724 C2 Проміжна сполука 8A та Проміжна сполука 9A 3-(4-Амінопіроло[2,1-f][1,2,4]триазин-7-іл)пропан-1-oл та 7-Пропілпіроло[2,1-f][1,2,4]триазин4-амін 5 10 15 20 25 Проміжну сполуку 7A (444 мг, 2,36 ммоль) розчиняли у оцтовій кислоті (18 мл) в атмосфері аргону. Додавали оксид платини (IV) (40 мг, 0,18 ммоль, 0,08 екв.), та суміш ретельно перемішували протягом 3 год. при кімнатній температурі в атмосфері водню при тиску зовнішнього середовища. Каталізатор потім видаляли фільтруванням, розчинник відганяли, та залишок піддавали флеш-хроматографії (Biotage silica колонка, циклогексан/етилацетат градієнт). Проміжні сполуки 8A (185 мг, 41 % теор.) та 9A (170 мг, 41 % теор.) одержували у двох чітких хроматографічних фракціях: Проміжна сполука 8A: ВЕРХ (спосіб 2): Rt=2,68 хв.; + РХ-MС (спосіб 4): Rt=0,83 хв.; MС (EСIpos): m/z (%) = 193,1 (100) [M+H] , MС (EСIneg): m/z (%) = 191,1 (100) [M-H] . 1 H ЯМР (400 MГц, d6-ДMСO): δ (млн.ч.) = 1,80 (м, 2H), 2,86 (т, J=7,7 Гц, 2H), 3,45 (м, 2H), 4,49 (т, J=5,1 Гц, 1H), 6,41 (д, J=4,2 Гц, 1H), 6,69 (д, J=4,2 Гц, 1H), 7,50 (ш. с, 2H), 7,78 (с, 1H). Проміжна сполука 9A: ВЕРХ (спосіб 1): Rt=3,22 хв.; + РХ-MС (спосіб 4): Rt=1,23 хв.; MС (EСIpos): m/z (%) = 177,1 (100) [M+H] , MС (EСIneg): m/z (%) = 175,2 (30) [M-H] . Проміжна сполука 10A 3-(4-Аміно-5-бромпіроло[2,1-f][1,2,4]триазин-7-іл)пропан-1-oл NH 2 Br N N HO 30 35 N Проміжну сполуку 8A (105 мг, 0,55 ммоль) розчиняли у TГФ (8,75 мл) та охолоджували до 20 °C. Додавали 1,3-дибром-5,5-диметилгідантоїн (78,1 мг, 0,5 екв.), та суміш перемішували при -20 °C протягом години. Потім реакцію гасили 0,5 мл концентрованого водного розчину дитіоніту натрію, нагрівали дo кімнатної температури та розділяли між етил ацетатом та водою. Органічну фазу висушували над безводним сульфатом натрію, та розчинник відганяли. Вихід: 145 мг (98 % теор.). ВЕРХ (спосіб 1): Rt=2,96 хв.; ВЕРХ (спосіб 2): Rt=2,95 хв.; + РХ-MС (спосіб 5): Rt=1,03 хв.; MС (EСIpos): m/z (%) = 271,0 (100) та 273,0 (100) [M+H] , MС (EСIneg): m/z (%) = 269,0 (99) та 271,0 (100) [M-H]. 1 H ЯМР (400 MГц, d6-ДMСO): δ (млн.ч.) = 1,75 (м, 2H), 2,83 (т, J=8,1 Гц, 2H), 3,43 (м, 2H), 4,50 (т, J=5,4 Гц, 1H), 6,62 (с, 1H), 7,81 (с, 1H). Проміжна сполука 11A 5-Бром-7-пропілпіроло[2,1-f][1,2,4]триазин-4-амін 23 UA 110724 C2 NH2 Br N N H3C 5 10 N Проміжну сполуку 9A (110 мг, 0,62 ммоль) розчиняли у TГФ (4,44 мл) та охолоджували до 20 °C. Додавали 1,3-дибром-5,5-диметилгідантоїн (89 мг, 0,5 екв.), та суміш перемішували при 20 °C протягом години. Потім реакцію гасили 0,5 мл концентрованого водного розчину дитіоніту натрію, нагрівали дo кімнатної температури та розділяли між етилацетатом та водою. Органічну фазу висушували над безводним сульфатом натрію, та розчинник відганяли. Вихід: 154 мг (85 % чистий, 82 % теор.). ВЕРХ (спосіб 1): Rt=3,78 хв.; + РХ-MС (спосіб 7): Rt=1,55 хв.; MС (EСIpos): m/z (%) = 255,0 (99) та 257,2 (100) [M+H] . 1 H ЯМР (400 MГц, d6-ДMСO): δ (млн.ч.) = 0,91 (т, J=7,3 Гц, 3H), 1,65 (м, 2H), 2,79 (т, J=7,6 Гц, 2H), 3,31 (с, 2H), 6,63 (с, 1H), 7,95 (с, 1H). Проміжна сполука 12A 4-(4-Амінопіроло[2,1-f][1,2,4]триазин-7-іл)бут-3-ин-1-oл NH 2 N N N HO 15 20 25 7-Бромпіроло[2,1-f][1,2,4]триазин-4-амін (1,0 г, 4,69 ммоль), йодид міді(I) (89 мг, 0,47 ммоль, 0,1 екв.) та тетракіс(трифенілфосфін)паладію(0) (542 мг, 0,47 ммоль, 0,1 екв.) завантажували у реакційну колбу для мікрохвильової пічки та вакуумували протягом години. Колбу потім вентилювали аргоном, додавали піролідин (15 мл) та 3-бутин-1-oл (3,36 г, 47 ммоль, 10 екв.), та колбу закривали ізолюючою кришкою та нагрівали до 85 °C протягом 120 хв. у одномодовій мікрохвильовій пічці. Після охолодження, реакційну суміш виливали у 120 мл концентрованого водного розчину хлориду амонію та двічі екстрагували з етилацетатом. Об'єднані органічні шари висушували над безводним сульфатом натрію та випаровували, та залишок очищали флеш-хроматографією (Biotage silica колонка, етилацетат). Одержаний продукт (735 мг) був достатньо чистим (66 % за допомогою ВЕРХ) для подальших перетворень. ВЕРХ (спосіб 2): Rt=2,77 хв.; + РХ-MС (спосіб 4): Rt=0,96 хв.; MС (EСIpos): m/z (%) = 203,1 (100) [M+H] , MС (EСIneg): m/z (%) = 201,1 (100) [M-H] . Проміжна сполука 13A 4-(4-Амінопіроло[2,1-f][1,2,4]триазин-7-іл)бутан-1-oл NH2 N N HO 30 35 N Проміжну сполуку 12A (607 мг, 3,00 ммоль) розчиняли у оцтовій кислоті (64 мл), та додавали оксид платини (IV) (50 мг, 0,22 ммоль, 0,07 екв.). Суміш перемішували в атмосфері водню при тиску зовнішнього середовища протягом 15 год. Каталізатор потім видаляли фільтруванням, фільтрат випаровували при пониженому тиску, та залишок очищали флеш-хроматографією (Biotage silica колонка, етил ацетат). Вихід: 350 мг (57 % теор.). ВЕРХ (спосіб 2): Rt=2,92 хв.; 24 UA 110724 C2 + РХ-MС (спосіб 4): Rt=0,94 хв.; MС (EСIpos): m/z (%) = 207,1 (100) [M+H] , MС (EСIneg): m/z (%) = 205,3 (100) [M-H]. Проміжна сполука 14A 4-(4-Аміно-5-бромпіроло[2,1-f][1,2,4]триазин-7-іл)бутан-1-oл NH2 Br N N HO 5 10 15 N Проміжну сполуку 13A (330 мг, 1,60 ммоль) розчиняли у TГФ (26 мл) при -20 °C, та додавали 1,3-дибром-5,5-диметилгідантоїн (229 мг, 0,80 ммоль). Суміш перемішували при -20 °C протягом години. Потім реакцію гасили концентрованим водним розчином сульфіту натрію (0,5 мл). Етилацетат додавали, відділяли водний шар, та органічний шар висушували над сульфатом натрію та випаровували. Неочищений продукт потім очищали препаративною ВЕРХ (спосіб 2) з одержанням 175 мг (84 % теор.) вказаної у заголовку сполуки. ВЕРХ (спосіб 1): Rt=3,13 хв.; + РХ-MС (спосіб 5): Rt=1,23 хв.; MС (EСIpos): m/z (%) = 285,0 (98) та 287,0 (100) [M+H] , MС (EСIneg): m/z (%) = 283,0 (100) та 285,0 (98) [M-H] . 1 H-ЯМР (400 MГц, d6-ДMСO): δ (млн.ч.) = 1,39-1,48 (м, 2H), 1,60-1,69 (м, 2H), 3,31 (т, J=7,3 Гц, 2H), 3,40 (м, 2H), 4,46 (ш. с, 1H), 6,61 (с, 1H), 7,82 (с, 1H). Проміжна сполука 15A 4-Амінопіроло[2,1-f][1,2,4]триазин-7-карбальдегід NH2 N N N O H 20 25 30 35 Вихідний матеріал піроло[2,1-f][1,2,4]триазин-4-аміну синтезували за процедурою, описаною у WO 2007/056170-A2 (Проміжна сполука A). Піроло[2,1-f][1,2,4]триазин-4-амін (20,5 г, 152 ммоль) розчиняли у 150 мл ДMФ. Охолоджуючи на льоду, фосфорилхлорид (31,3 мл, 336 ммоль) краплями додавали з такою швидкістю, що внутрішня температура не перевищувала 30 °C. Потім суміш нагрівали протягом 2 діб при 50 °C. Після охолодження, додавали іншу частину фосфорилхлориду (14,2 мл, 152 ммоль), та перемішування продовжували протягом ще 24 год. при 50 °C. Після охолодження, реакційну суміш повільно виливали у суміш 2,0 л насиченого водного розчину бікарбонату натрію та 2,0 л етилацетату. Твердий бікарбонат натрію додавали до припинення виділення газу. Шари розділяли, водний шар екстрагували 0,5 л етилацетату, та об'єднані органічні фази висушували над сульфатом натрію та концентрували. Залишок суспендували у 100 мл дiізопропілового етеру, перемішували при кімнатній температурі протягом 10 хв. та потім фільтрували. Висушений залишок перемішували у 6 N хлорводневій кислоті (500 мл) протягом години при 50 °C та потім виливали у суміш лід/вода (1000 мл). Суміш обережно нейтралізували твердим бікарбонатом натрію, перемішували протягом 30 хв. при кімнатній температурі та потім знову фільтрували. Залишок промивали водою та лігроїном з одержанням 20,6 г (83 % теор.) білих кристалів, які використовували на наступній стадії без подальшої очистки. Проміжна сполука 16A 4-Аміно-5-бромпіроло[2,1-f][1,2,4]триазин-7-карбальдегід 25 UA 110724 C2 NH2 Br N N N O H 5 10 Проміжну сполуку 15A (20,6 г, 127 ммоль) розчиняли у 525 мл ДMФ. При 0 °C додавали 1,3дибром-5,5-диметилгідантоїн (21,8 г, 76,2 ммоль), та суміш перемішували протягом години охолоджуючи на льоду та протягом ще 2 год. при кімнатній температурі. Одержану суспензію фільтрували, та залишок промивали ДMФ та діетиловим етером. Фільтрат викидали, та залишені важкорозчинні кристали висушували з одержанням 20,0 г (65 % теор., 80 % чисті за допомогою ВЕРХ) вказаної у заголовку сполуки. Цей матеріал використовували без подальшої очистки. 1 H ЯМР (400 MГц, d6-ДMСO): δ (млн.ч.) = 7,42 (с, 1H), 8,12 (с, 1H), 10,22 (с, 1H). Проміжна сполука 17A (4-Аміно-5-бромпіроло[2,1-f][1,2,4]триазин-7-іл)(циклопропіл)метанол NH2 Br N N N HO 15 20 25 Проміжну сполуку 16A (500 мг, 1,66 ммоль) суспендували у сухому TГФ (30 мл). При 0 °C додавали 0,5 M розчин циклопропілброміду магнію у дiетиловому етері (10 мл, 5,0 ммоль). Суміш перемішували при кімнатній температурі протягом години. Потім, додавали іншу частину розчину Грігнарда (6,6 мл, 3,3 ммоль). Після подальшого перемішування протягом 30 хв. при кімнатній температурі, реакцію гасили насиченим водним розчином хлориду амонію та екстрагували етилацетатом (2 × 20 мл). Об'єднані органічні шари промивали сольовим розчином, висушували над сульфатом магнію та концентрували. Залишок очищали препаративною ВЕРХ (спосіб 4). Вихід: 0,14 г (29 % теор.). + РХ-MС (спосіб 6): Rt=0,75 хв.; MС (EСIpos): m/z (%) = 283,0 (100) [M+H] . 1 H ЯМР (400 MГц, d6-ДMСO): δ (млн.ч.) = 0,35 (м, 3H), 0,45 (м, 1H), 1,28 (м, 1H), 4,62 (т, 1H), 5,26 (д, 1H), 6,75 (с, 1H), 7,84 (с, 1H). Проміжна сполука 18A (4-Аміно-5-бромпіроло[2,1-f][1,2,4]триазин-7-іл)(тетрагідро-2H-піран-4-іл)метанол NH2 Br N N N HO O 30 У 50 мл три-горлу колбу оснащали конденсатором, термометром та крапельною воронкою, яку продували аргоном, реагент Грігнарда одержували з стружки магнію (484 мг, 19,9 ммоль) та 4-хлортетрагідропірану (2,4 г, 19,9 ммоль) у сухому TГФ (14 мл). Дo цього розчину додавали при 0 °C суспензію проміжної сполуки 16A (1,2 г, 3,98 ммоль) у TГФ (20 мл), та реакційну суміш перемішували протягом години при кімнатній температурі. Її потім гасили насиченим водним розчином хлориду та екстрагували етилацетатом (2 × 50 мл). Органічний шар промивали 26 UA 110724 C2 5 сольовим розчином, висушували над сульфатом магнію та концентрували. Залишок очищали препаративною ВЕРХ (спосіб 3). Вихід: 0,5 г (38 % теор.). + РХ-MС (спосіб 6): Rt=0,66 хв.; MС (EСIpos): m/z (%) = 327,0 (100) [M+H] , MС (EСIneg): m/z (%) = 325,1 (100) [M-H] . Проміжна сполука 19A 8-(4-Амінопіроло[2,1-f][1,2,4]триазин-7-іл)-1,4-діоксаспіро[4,5]декан-8-oл NH 2 N N HO N O O 10 15 20 25 Вихідний матеріал 7-бромпіроло[2,1-f][1,2,4]триазин-4-аміну синтезували за процедурою, описаною у WO 2007/056170-A2 (Проміжна сполука B). 7-Бромпіроло[2,1-f][1,2,4]триазин-4-амін (9,20 г, 35,41 ммоль) розчиняли у TГФ (105 мл) в аргоні при кімнатній температурі. Додавали хлортриметилсилан (9,08 мл, 7,77 г, 70,82 ммоль, 2 екв.), та суміш перемішували при кімнатній температурі протягом 3 год. її поті охолоджували до 0 °C, та додавали 2-пропіл магнію хлорид (74 мл 2,0 M розчину у THF, 149 ммоль, 4,2 екв.). Суміш перемішували протягом наступних 3 год. нагріваючи дo кімнатної температури. Потім, додавали 1,4-діоксаспіро[4,5]декан-8-oн (8,38 г, 53,12 ммоль, 1,5 екв.), та перемішування продовжували протягом ще 16 год. Реакцію гасили сумішшю 1:1 концентрованого водного розчину хлориду амонію та льоду до досягнення значення pH 6-7. Суміш екстрагували двома порціями етилацетату, та об'єднані органічні екстракти висушували над безводним карбонатом натрію та концентрували до сухого залишку. Зазначену у заголовку сполуку кристалізували з дiетилового етеру. Вихід: 6,05 г (58 % теор.). ВЕРХ (спосіб 1): Rt=2,89 хв.; + РХ-MС (спосіб 6): Rt=0,38 хв.; MС (EСIpos): m/z (%) = 291,2 (100) [M+H] , MС (EСIneg): m/z (%) = 289,4 (100) [M-H] . Проміжна сполука 20A 7-(1,4-Ділксаспіро[4,5]дец-7-ен-8-іл)піроло[2,1-f][1,2,4]триазин-4-амін NH 2 N N N O O 30 35 Проміжна сполука 19A (2,81 г, 60 % чистота, 5,82 ммоль) розчиняли у піридині (18 мл) при 0 °C. Трифтороцтовий ангідрид (2,46 мл, 3,66 г, 17,45 ммоль, 3 екв.) повільно додавали, та реакційну суміш перемішували при зовнішній температурі протягом 16 год. Розчинник відганяли, та залишок розділяли між водою та етилацетатом. Органічний екстракт висушували над сульфатом натрію та випаровували. Осад розтирали з дiетиловим етером при 0 °C з одержанням 2,95 г (92 % чистий за допомогою ВЕРХ, 99 % теор.) вказаної у заголовку сполуки. ВЕРХ (спосіб 1): Rt=4,55 хв.; + РХ-MС (спосіб 5): Rt=2,28 хв.; MС (EСIpos): m/z (%) = 369,1 (100) [M+H] , MС (EСIneg): m/z (%) = 367,1 (100) [M-H] . 27 UA 110724 C2 Проміжна сполука 21A 7-(1,4-Ділксаспіро[4,5]dec-8-іл)піроло[2,1-f][1,2,4]триазин-4-амін NH 2 N N N O O 5 10 Проміжна сполука 20A (2,95 г, 10,8 ммоль) розчиняли у метанолі (1,07 л) в атмосфері аргону. Додавали паладій на вуглеці (10 %, 400 мг), та суміш ретельно перемішували протягом 24 год. в атмосфері водню при тиску зовнішнього середовища та кімнатній температурі. Каталізатор видаляли фільтруванням, та розчинник відганяли при пониженому тиску з одержанням 2,11 г (71 % теор.) вказаної у заголовку сполуки. ВЕРХ (спосіб 1): Rt=3,14 хв.; + РХ-MС (спосіб 6): Rt=0,68 хв.; MС (EСIpos): m/z (%) = 275,3 (100) [M+H] . Проміжна сполука 22A 4-(4-Амінопіроло[2,1-f][1,2,4]триазин-7-іл)циклогексанон NH 2 N N N O 15 20 25 Проміжна сполука 21A (2,11 г, 7,69 ммоль) розчиняли у суміші 1 M хлорводневої кислоти (23 мл) та метанолу (6,80 мл) при 0 °C та перемішували охолоджуючи на льоду протягом 3 год. Потім, значення pH встановлювали на рівні 6-7 додаванням концентрованого водного розчину бікарбонату натрію. Суміш екстрагували трьома частинами дихлорметану, та об'єднані органічні екстракти висушували над безводним сульфатом натрію, фільтрували та випаровували. Залишок (923 мг, 52 % теор.) використовували без подальшої очистки на наступній стадії синтезу. ВЕРХ (спосіб 2): Rt=3,06 хв.; + РХ-MС (спосіб 4): Rt=1,02 хв.; MС (EСIpos): m/z (%) = 231,1 (100) [M+H] , MС (EСIneg): m/z (%) = 229,2 (100) [M-H] . 1 H ЯМР (400 MГц, d6-ДMСO): δ (млн.ч.) = 1,86 (ддд, 2H), 2,25-2,36 (м, 4H), 2,59 (ддд, 2H), 3,59 (м, 1H), 6,45 (д, 1H), 6,82 (д, 1H), 7,60 (ш. с, 1H), 7,82 (с, 1H). Проміжна сполука 23A Транс-4-(4-амінопіроло[2,1-f][1,2,4]триазин-7-іл)циклогексанол 28
ДивитисяДодаткова інформація
Назва патенту англійськоюHydroxymethylaryl-substituted pyrrolotriazines as alk1 inhibitors
Автори англійськоюKlar, Jurgen, Voehringer, Verena, Telser, Joachim, Lobell, Mario, Sussmeier, Frank, Li, Volkhart Min-Jian, Bottger, Michael, Golz, Stefan, Lang, Dieter, Schlemmer, Karl-Heinz, Schlange, Thomas, Schall, Andreas, Fu, Wenlang
Автори російськоюКлар Юрген, Фьорингер Верена, Тельзер Йоахим, Лобелль Марио, Зюсмаер Франк, Ли Фолькхарт Мин-Джян, Бёттгер Михаель, Гольц Штефан, Ланг Дитер, Шлеммэр Карл-Хайнц, Шланге Томас, Шалль Андреас, Фу Венланг
МПК / Мітки
МПК: C07D 487/04, A61P 27/00, A61K 31/53
Мітки: гідроксиметиларилзаміщені, піролотриазини, інгібітори
Код посилання
<a href="https://ua.patents.su/86-110724-gidroksimetilarilzamishheni-pirolotriazini-yak-ingibitori-alk1.html" target="_blank" rel="follow" title="База патентів України">Гідроксиметиларилзаміщені піролотриазини як інгібітори alk1</a>
Попередній патент: Спосіб та пристрій для відновлення лактиду з полілактиду або гліколіду з полігліколіду
Наступний патент: Причіп з маніфольдом з декількома шарнірними компоновками відводів
Випадковий патент: Спосіб оцінки парціального тиску кисню у артеріальній крові у хворих із черепно-мозковою травмою